
g proteínu. Alfaoktokog (ľudský koagulačný faktor VIII (rDNA)) je čistený proteín s 2332 aminokyselinami. Je produkovaný rekombinantnou DNA technológiou v bunkách ovárií čínskeho škrečka (Chinese
hamster ovary, CHO). Pripravený bez prídavku akýchkoľvek (exogénnych) ľudských alebo zvieracích proteínov v procese bunkovej kultivácie, purifikácie alebo konečnej úpravy.
Pomocné látky so známym účinkom:
0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Prášok a rozpúšťadlo na injekčný roztok. Prášok: biely až sivobiely drobivý prášok.
Rozpúšťadlo: číry a bezfarebný roztok.
4. KLINICKÉ ÚDAJE
4.1. TERAPEUTICKÉ INDIKÁCIE
Liečba a profylaxia krvácania u pacientov s hemofíliou A (vrodený nedostatok faktora VIII). Liek
ADVATE je indikovaný vo všetkých vekových skupinách.
4.2. Dávkovanie a spôsob podávania
Liečba sa má začať pod dohľadom lekára skúseného v liečbe hemofílie a so zabezpečenou okamžitou resuscitáciou v prípade anafylaxie.
Dávkovanie
Dávka a dĺžka substitučnej terapie závisí od závažnosti nedostatku faktora VIII, od miesta a rozsahu krvácania a od klinického stavu pacienta.
Počet jednotiek faktora VIII sa vyjadruje v medzinárodných jednotkách (International Units, IU), ktoré sa vzťahujú na štandard WHO pre lieky s faktorom VIII. Aktivita faktora VIII v plazme sa vyjadruje buď percentuálne (v relácii k normálnej ľudskej plazme) alebo v IU (podľa medzinárodného štandardu pre faktor VIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora VIII zodpovedá množstvu faktora VIII v jednom ml normálnej ľudskej plazmy.
Liečba on demand (podľa potreby)
Výpočet požadovanej dávky faktora VIII sa zakladá na empirickom zistení, že 1 IU faktora VIII na kg telesnej hmotnosti zvýši aktivitu plazmatického faktora VIII o 2 IU/dl. Potrebná dávka sa stanoví
použitím nasledovného vzorca:
Požadované jednotky (IU) = telesná hmotnosť (kg) x požadovaný vzostup faktora VIII (%) x 0,5
V prípade nasledujúcich krvácavých príhod aktivita faktora VIII nemá počas zodpovedajúceho obdobia klesnúť pod danú hladinu aktivity v plazme (v % normálu alebo IU/dl). Ako návod na dávkovanie pri krvácaní alebo pri chirurgických zákrokoch možno použiť nasledovnú tabuľku 1:
Tabuľka 1 Návod na dávkovanie pri krvácaní a chirurgických zákrokoch
Stupeň krvácania/Typ chirurgického zákroku
Krvácanie
Začínajúca hemartróza, krvácanie do svalu alebo krvácanie v ústnej dutine.
Rozsiahlejšia hemartróza, krvácanie do svalu alebo hematóm.
Život ohrozujúce krvácania.
Chirurgický zákrok
Malý
Vrátane extrakcie zuba.
Veľký
Požadovaná hladina faktora VIII
(% alebo IU/dl)
20 – 40
30 – 60
60 – 100
30 – 60
80 – 100
(pred a po operácii)
Frekvencia dávok (hodiny)/ dĺžka trvania terapie (dni)
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým krvácavá príhoda, súdiac podľa bolesti, nepominie alebo kým nedôjde
k zahojeniu.
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších
ako 6 rokov) počas 3 – 4 dní alebo dlhšie až dovtedy, kým bolesť nepominie alebo kým sa neobnoví funkčnosť.
Opakujte injekcie každých 8 až 24 hodín
(6 až 12 hodín u pacientov mladších
ako 6 rokov), až dovtedy, kým nepominie stav ohrozenia života.
Každých 24 hodín (12 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým nedôjde
k zahojeniu.
Opakujte injekcie každých 8 až 24 hodín
(6 až 24 hodín u pacientov mladších
ako 6 rokov), do adekvátneho zahojenia rán, potom pokračujte v terapii najmenej ďalších 7 dní na udržanie aktivity
faktora VIII od 30 % do 60 % (IU/dl).

Dávka a frekvencia podávania sa majú v jednotlivých prípadoch prispôsobiť klinickej odpovedi.
Za určitých okolností (napr. prítomnosť nízkeho titra inhibítora) môžu byť potrebné vyššie dávky ako dávky vypočítané podľa vzorca.
V priebehu liečby sa odporúča primerané stanovovanie hladín plazmatického faktora VIII ako návod na určovanie podávanej dávky a frekvencie opakovaných injekcií. Predovšetkým v prípade veľkých chirurgických zákrokov je nevyhnutné presné sledovanie substitučnej terapie skúškami aktivity plazmatického faktora VIII. Reakcie jednotlivých pacientov na faktor VIII sa môžu
in vivo odlišovať a dosiahnuť odlišné hladiny obnovenia faktora VIII a preukázať rôzne polčasy.
Profylaxia
Na dlhodobú profylaxiu krvácania u pacientov s ťažkou hemofíliou A sú zvyčajné dávky 20 až 40 IU
faktora VIII na kg telesnej hmotnosti v intervaloch od 2 do 3 dní.
Pediatrická populácia
Dávkovanie pre liečbu on demand sa u pediatrických pacientov (0 až 18 rokov veku) nelíši od dospelých pacientov. U pacientov mladších ako 6 rokov sa na profylaktickú terapiu odporúča dávkovanie 20 až 50 IU faktora VIII na kg telesnej hmotnosti 3 až 4-krát do týždňa.
Spôsob podávania
ADVATE sa má podávať intravenóznou cestou. V prípade, že liek nepodáva zdravotnícky pracovník je nutné jeho náležité zaškolenie.
Rýchlosť podávania sa má ustáliť podľa toho, ako to pacientovi najviac vyhovuje a smie dosiahnuť
maximálne 10 ml/min.
Po rekonštitúcii je roztok číry, bezfarebný, bez cudzorodých častíc s pH medzi 6,7 až 7,3. Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3. Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na proteíny myši alebo škrečka.
4.4. Osobitné upozornenia a opatrenia pri používaní
Precitlivenosť
U ADVATE boli hlásené reakcie z precitlivenosti alergického typu vrátane anafylaxie a prejavili sa závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Liek obsahuje stopy proteínov myši a škrečka. Pacienti majú byť upozornení, že ak sa vyskytnú
príznaky precitlivenosti, odporúča sa používanie lieku okamžite prerušiť a kontaktovať svojho lekára. Pacienti majú byť informovaní o prvotných príznakoch reakcií z precitlivenosti zahŕňajúcich vyrážky, generalizovanú žihľavku, pocit tiesne na hrudníku, pískavé dýchanie, hypotenzia a anafylaxiu.
V prípade šoku má byť zavedená štandardná lekárska liečba šoku.
Inhibítory
Známou komplikáciou liečby jedincov s hemofíliou A je vznik protilátok (inhibítorov) neutralizujúcich faktor VIII. Tieto inhibítory sú zvyčajne imunoglobulíny IgG pôsobiace proti prokoagulačnej aktivite faktora VIII, ktoré sú kvantifikované v Bethesdových jednotkách (BU) na ml
plazmy použitím modifikovanej skúšky. U pacientov, u ktorých sa objavia inhibítory faktora VIII, sa
klinický stav môže prejavovať ako nedostatočná klinická odpoveď. V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu. Riziko vzniku inhibítorov koreluje s rozsahom expozície faktoru VIII, toto riziko býva najvyššie počas prvých 20 dní expozície, a tiež s inými genetickými faktormi a faktormi prostredia. V zriedkavých prípadoch môžu inhibítory vzniknúť po prvých 100 dňoch expozície.
Boli pozorované prípady opakovaného vzniku inhibítorov (nízky titer) po prechode z jedného lieku s faktorom VIII na iný u predtým liečených pacientov s viac ako 100 dňami expozície, ktorí majú
v anamnéze vznik inhibítorov. Odporúča sa preto, aby všetci pacienti po prechode z jedného lieku na iný boli pozorne sledovaní na vznik inhibítorov.
Vo všeobecnosti všetci pacienti s koagulačným faktorom VIII majú byť pomocou náležitých klinických pozorovaní a laboratórnych vyšetrení pozorne sledovaní na vznik inhibítorov. Ak sa očakávané hladiny aktivity faktora VIII v plazme nedosiahnu, alebo ak krvácanie nie je kontrolované vhodnou dávkou, má sa vykonať testovanie prítomnosti inhibítorov faktora VIII. U pacientov
s vysokými hladinami inhibítora, substitučná terapia faktorom VIII nemusí byť účinná a treba zvážiť
iné možnosti liečby. Liečba takých pacientov má byť riadená lekármi so skúsenosťami so starostlivosťou o pacientov s hemofíliou a inhibítormi faktora VIII.
Komplikácie liečby súvisiace s katétrom
Ak je potrebný centrálny venózny katéter (CVK), musí sa zvážiť riziko komplikácií súvisiacich s CVK
vrátane lokálnych infekcií, bakterémie a trombózy v mieste zavedenia katétra.
Aspekty týkajúce sa pomocného základu
Po príprave tento liek obsahuje 0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke. Má sa to vziať
do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
Dôrazne odporúčame, aby sa pri každom podávaní lieku ADVATE pacientovi, zapísali názov a číslo šarže lieku, a tak sa uchovalo prepojenie medzi pacientom a šaržou lieku.
Pediatrická populácia:
Uvedené upozornenia a opatrenia pri používaní sa týkajú detí aj dospelých.
4.5. Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s ADVATE.
4.6. Fertilita, gravidita a laktácia
Neuskutočnili sa reprodukčné štúdie s faktorom VIII na zvieratách. Vzhľadom k zriedkavému výskytu hemofílie A u žien, nie sú k dispozícii údaje týkajúce sa použitia faktora VIII počas gravidity
a laktácie. Z tohto dôvodu má byť faktor VIII používaný počas gravidity a dojčenia iba v nevyhnutných prípadoch.
4.7. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
ADVATE nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8. Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Klinické štúdie s ADVATE zahŕňali 418 účastníkov vystavených najmenej raz lieku ADVATE
hlásiacich celkovo 93 nežiaducich liekových reakcií (adverse drug reactions, ADR). ADR, ktoré
sa vyskytli s najväčšou frekvenciou, boli vznik neutralizačných protilátok faktora VIII (inhibítorov), bolesť hlavy, a horúčka.
Reakcie precitlivenosti alebo alergické reakcie (ako angioedém, pálenie a pichanie v mieste infúzie, zimnica, začervenanie kože, generalizovaná žihľavka, bolesť hlavy, vyrážky, hypotenzia, letargia, nauzea, nepokoj, tachykardia, pocit tiesne na hrudníku, mravčenie, vracanie, pískavé dýchanie)
boli pozorované zriedkavo, a v niektorých prípadoch sa z nich môže vyvinúť závažná anafylaxia
(vrátane šoku).
Môže byť pozorovaný vznik protilátok proti proteínu myši alebo škrečka so súvisiacimi reakciami precitlivenosti.
U pacientov s hemofíliou A môžu vznikať neutralizačné protilátky (inhibítory) faktora VIII. Ak dôjde k vzniku takých inhibítorov, klinický stav sa môže prejavovať ako nedostatočná klinická odpoveď.
V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu.
Tabuľ
kové zhrnutie nežiaducich reakcií
Nasledujúca tabuľka 2 uvádza frekvenciu nežiaducich liekových reakcií v klinických štúdiách
a v spontánne hlásených prípadoch. Táto tabuľka je podľa klasifikácie orgánových systémov MEDRA (SOC a preferovaných termínov).
Nežiaduce reakcie sú uvedené podľa nasledujúceho pravidla: veľmi časté (≥ 1/10), časté (≥ 1/100 až
< 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 2 Frekvencia nežiaducich liekových reakcií (ADR) v klinických štúdiách a spontánne hlásených prípadoch
MedDRA štandardná trieda orgánových systémov
Infekcie a nákazy
Poruchy krvi a lymfatického systému
Poruchy imunitného systému
Poruchy nervového systému
Nežiaduca reakcia Frekvenciaa
Chrípka Menej časté Laryngitída Menej časté Inhibícia faktora VIIIc Časté Lymfangitída Menej časté Anafylaktická reakcia Nie je známe Precitlivenosťc Nie je známe Bolesť hlavy Časté
Závrat Menej časté Porucha pamäte Menej časté Synkopa Menej časté Tremor Menej časté Migréna Menej časté Porucha chuti Menej časté
Poruchy oka Zápal oka Menej časté
Poruchy srdca a srdcovej činnosti Palpitácie Menej časté

Poruchy ciev
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Úrazy, otravy a komplikácie liečebného postupu
Hematóm Menej časté Návaly tepla Menej časté Bledosť Menej časté Dyspnoe Menej časté
Hnačka Menej časté Bolesť v hornej časti brucha Menej časté Nevoľnosť Menej časté Vracanie Menej časté Svrbenie Menej časté Vyrážka Menej časté Hyperhidróza Menej časté Žihľavka Menej časté Pyrexia Časté Periférny edém Menej časté Bolesť na hrudi Menej časté Hrudný dyskomfort Menej časté Zimnica Menej časté Nezvyčajný pocit Menej časté Hemátóm v mieste punkcie cievy Menej časté Únava Nie je známe Reakcia v mieste injekcie Nie je známe Nevoľnosť Nie je známe Zvýšený počet monocytov Menej časté
Znížená hladina koagulačného faktora VIIIb Menej časté
Znížený hematokrit Menej časté Abnormálne výsledky laboratórnych testov Menej časté Postprocedurálna komplikácia Menej časté Postprocedurálne krvácanie Menej časté Reakcia v mieste podania Menej časté
a) Vypočítané na základe celkového počtu pacientov, ktorí dostávali ADVATE (418). b) U jedného pacienta sa počas kontinuálnej infúzie ADVATE po operácii (pooperačné
dni 10 - 14) vyskytli neočakávane znížené hladiny koagulačného faktora VIII. Hemostáza bola počas tohto obdobia stále udržiavaná a ako hladina faktora VIII, tak aj hodnoty klírensu sa vrátili na dostatočné hodnoty do 15. pooperačného dňa. Skúšky inhibítora faktora VIII uskutočnené po ukončení kontinuálnej infúzie a v závere štúdie boli negatívne.
c) Nežiaduce reakcie vysvetlené v časti nižšie.
Opis vybratých nežiaducich reakciíVznik inhibítorovBol hlásený vznik inhibítorov u predtým liečených pacientov (PTP) a u predtým neliečených pacientov (PUP). Bližšie údaje nájdete v časti 5.1 (Farmakologické vlastnosti) a 4.4 (Osobitné upozornenia a opatrenia pri používaní).
Nežiaduce reakcie špecifické pre pozostatky z výrobného procesuZ 229 liečených pacientov, ktorí boli hodnotení na protilátky proti proteínu buniek ovárií čínskeho škrečka (CHO), sa u 3 dokázal štatisticky významný vzostupný trend v titroch, u 4 sa ukázali pretrvávajúce vrcholy alebo prechodné výkyvy a jeden pacient mal oboje, ale nemal žiadne klinické príznaky. Z 229 liečených pacientov, ktorí boli hodnotení na protilátky proti myším IgG, sa
u 10 dokázal štatisticky významný vzostupný trend v titroch, u 2 sa ukázali pretrvávajúce vrcholy
alebo prechodné výkyvy a jeden pacient mal oboje. Štyria z týchto pacientov hlásili jednotlivé prípady urtikárie, pruritu, vyrážky a mierne zvýšeného počtu eozinofilov v rámci opakovaných expozícií lieku v štúdii.
PrecitlivenosťReakcie alergického typu vrátane anafylaxie, ktoré sa prejavili závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Pediatrická populáciaV klinických štúdiách neboli uvedené žiadne vekovo špecifické rozdiely v nežiaducich reakciách iné ako vznik inhibítorov u predtým neliečených detských pacientov (PUP) a komplikácie súvisiace
s katétrom.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9. PredávkovanieNeboli hlásené žiadne prípady predávkovania rekombinantným koagulačným faktorom VIII.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1. Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antihemoragiká: krvný koagulačný faktor VIII. ATC kód: B02BD02. Komplex faktora VIII/von Willebrandovho faktora sa skladá z dvoch molekúl (faktor VIII
a von Willebrandov faktor) s odlišnými fyziologickými funkciami. ADVATE obsahuje rekombinantný
koagulačný faktor VIII (alfaoktokog), glykoproteín ktorý je biologicky rovnocenný s glykoproteínu faktora VIII obsiahnutom v ľudskej plazme.
Alfaoktokog je glykoproteín skladajúci sa z 2332 aminokyselín s molekulárnou hmotnosťou
približne 280 kD. Alfaoktokog sa pri podávaní infúziou hemofilickému pacientovi viaže na endogénny
von Willebrandov faktor v pacientovom krvnom obehu. Aktivovaný faktor VIII pôsobí ako kofaktor pre aktivovaný faktor IX, urýchľujúci konverziu faktora X na aktivovaný faktor X. Aktivovaný faktor X premieňa protrombín na trombín. Trombín potom premieňa fibrinogén na fibrín a môže
sa vytvoriť krvná zrazenina. Hemofília A je dedičná porucha zrážania krvi viazaná na pohlavie, spôsobená zníženými hladinami aktivity faktora VIII a má za následok profúzne krvácanie do kĺbov, svalov alebo vnútorných orgánov, ktoré vzniká buď spontánne, alebo ako dôsledok úrazu alebo chirurgického zákroku. Plazmatické hladiny faktora VIII sa substitučnou liečbou zvyšujú,
čo umožňuje dočasnú úpravu nedostatku faktora VIII a úpravu sklonu ku krvácaniu.
Vznik inhibítorov
Imunogenicita ADVATE sa hodnotila u predtým liečených pacientov. Počas klinických štúdií
s ADVATE u 233 pediatrických (pediatrickí pacienti vo veku 0 až 16 rokov) a dospelých pacientov (starší ako 16 rokov), ktorým bola diagnostikovaná ťažká hemofília A (faktor VIII ≤ 1 %) a ktorí boli predtým vystavení koncentrátom faktora VIII po dobu ≥ 150 dní pre dospelých a staršie deti, a
po dobu ≥ 50 dní pre deti mladšie ako 6 rokov, sa po 26 dňoch expozície ADVATE vyvinul nízky titer inhibítora (2,4 BU v modifikovanej Bethesdovej skúške) u jedného pacienta. Nasledujúce testy na inhibítor vykonané u tohto pacienta po vyradení zo štúdie boli negatívne. V rámci všetkých štúdií bol medián expozície lieku ADVATE 97,0 expozičných dní na účastníka (rozsah 1 až 709) pre predtým liečených pacientov. Celkový výskyt vzniku inhibítorov faktora VIII (nízky alebo vysoký) bol 0,4 %
(1 z 233).
V ukončenej nekontrolovanej štúdii 060103, 16 zo 45 (35,6 %) predtým neliečených pacientov
s ťažkou hemofíliou A (faktor VIII < 1 %) a najmenej s 25 dňami expozície faktoru VIII vznikli inhibítory faktora VIII u: 7 (15,6 %) účastníkov vznikli inhibítory s vysokým titrom a u 9 (20 %) účastníkov vznikli inhibítory s nízkym titrom, 1 z nich bol tiež klasifikovaný ako prechodný inhibítor. Rizikové faktory súvisiace so vznikom inhibítorov v tejto štúdii zahŕňali iné ako kaukazské etnikum, familiárny výskyt inhibítorov a intenzívnu liečbu vysokou dávkou počas prvých 20 dní expozície.
U 20 účastníkov, ktorí nemali žiadny z týcho rizikových faktorov, nevznikli žiadne inhibítory.
Boli sústredené údaje o vyvolaní imunitnej tolerancie (ITI) u pacientov s inhibítormi. V rámci čiastkovej štúdie PNP 060103 bola zdokumentovaná liečba ITI u 11 predtým neliečených pacientov (PUP). Bola vypracovaná retrospektívna hodnotiaca schéma pre 30 pacientov s ITI (štúdia 060703)
a prebieha zhromažďovanie údajov do registra.
V štúdii 060201 boli porovnávané dve dlhodobé profylaktické liečebné schémy u 53 predtým liečených osôb: farmakokinetický riadený dávkovací režim prispôsobený individuálnym účastníkom (v rozsahu 20 až 80 IU faktora VIII na kg telesnej hmotnosti v intervaloch 72 ± 6 hodín, n=23)
so štandardným profylaktickým dávkovacím režimom (20 až 40 IU/kg každých 48 ± 6 hodín, n=30). Farmakokinetický riadený dávkovací režim (podľa osobitného vzorca) bol zacielený na udržanie minimálnych hladín (tzv. trough level) faktora VIII ≥ 1 % v intervale medzi dávkovaním 72 hodín. Údaje z tejto štúdie ukazujú, že tieto dva profylaktické dávkovacie režimy sú porovnateľné, čo sa týka redukcie miery krvácania.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom ADVATE vo všetkých podskupinách pediatrickej populácie s hemofíliou A (vrodený deficit faktora VIII) pri „indukcii imunitnej tolerancie (ITI) u pacientov s hemofíliou A (vrodený deficit
faktora VIII), u ktorých vznikli inhibítory faktora VIII“ a „liečbe a profylaxii krvácania u pacientov s hemofíliou A (vrodený deficit faktora VIII)“. (Informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2. Farmakokinetické vlastnosti
Všetky farmakokinetické štúdie s ADVATE boli vykonávané u predtým liečených pacientov s ťažkou až stredne ťažkou hemofíliou A (východiskový faktor VIII ≤ 2%). Analýza vzoriek plazmy bola vykonávaná v centrálnom laboratóriu použitím jednostupňovej skúšky zrážavosti.
Celkovo 195 pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %) poskytlo farmakokinetické (FK) parametre, ktoré boli začlenené do FK analytického súboru „per-protocol“. Kategórie týchto analýz pre dojčatá (1 mesiac do < 2 rokov veku), deti (2 až < 5 rokov veku), staršie deti (5 až < 12 rokov veku), mladistvých (12 až < 18 rokov veku) a dospelých (18 rokov veku a starší) boli použité na sumarizáciu FK parametrov, kde vek bol definovaný ako vek v dobe FK infúzie.
Tabuľka 3 Súhrn farmakokinetických parametrov ADVATE podľa vekovej skupiny pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %)
Parameter (priemer
± štandardná odchýlka)
Dojčatá
(n=5)
Deti
(n=30)
Staršie deti
(n=18)
Mladiství
(n=33)
Dospelí
(n=109)
Celková AUC (IU*h/dl)
Upravené progresívne obnovenie hladiny Cmax (IU/dl na IU/kg)a
1362,1 ± 311,8 1180,0 ± 432,7 1506,6 ± 530,0 1317,1 ± 438,6 1538,5 ± 519,1
2,2 ± 0,6 1,8 ± 0,4 2,0 ± 0,5 2,1 ± 0,6 2,2 ± 0,6
Polčas (h) 9,0 ± 1,5 9,6 ± 1,7 11,8 ± 3,8 12,1 ± 3,2 12,9 ± 4,3
Maximálna plazmatická koncentrácia po infúzii (IU/dl)
Priemerný rezidenčný
čas (h)
Distribučný objem v ustálenom stave (dl/kg)
110,5 ± 30,2 90,8 ± 19,1 100,5 ± 25,6 107,6 ± 27,6 111,3 ± 27,1
11,0 ± 2,8 12,0 ± 2,7 15,1 ± 4,7 15,0 ± 5,0 16,2 ± 6,1
0,4 ± 0,1 0,5 ± 0,1 0,5 ± 0,2 0,6 ± 0,2 0,5 ± 0,2
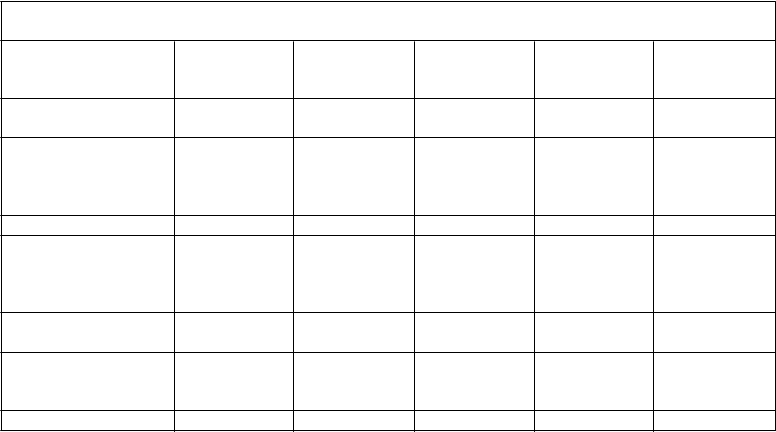
Klírens (ml/kg*h) 3,9 ± 0,9 4,8 ± 1,5 3,8 ± 1,5 4,1 ± 1,0 3,6 ± 1,2 a Vypočítané ako (Cmax – faktor VIII na začiatku liečby) delené dávkou v IU/kg, kde Cmax je maximálny nameraný faktor VIII po infúzii.
Bezpečnosť a hemostatická účinnosť lieku ADVATE v pediatrickej populácii sú podobné ako tieto parametre u dospelých pacientov. Upravené obnovenie a konečný polčas (t½) boli približne o 20% nižšie u mladších detí (mladších ako 6 rokov) ako u dospelých, čo je v súlade so známym vyšším objemom plazmy na kilogram telesnej hmotnosti u mladších pacientov.
Aktuálne nie sú k dispozícii farmakokinetické údaje o ADVATE u predtým neliečených pacientov.
5.3. Predklinické údaje o bezpečnostiPredklinické údaje získané na základe farmakologických štúdií bezpečnosti, akútnej toxikológie, toxicity po opakovanom podaní, lokálnej toxicity a genotoxicity neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1. Zoznam pomocných látokPrášok Manitol Chlorid sodný Histidín Trehalóza
Chlorid vápenatý Trometamol Polysorbát 80
Glutatión (redukovaný)
Rozpúšťadlo
Sterilizovaná voda na injekciu
6.2. Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi alebo rozpúšťadlami.
6.3. Čas použiteľnosti
2 roky.
Po rekonštitúcii: z mikrobiologického hľadiska sa má liek použiť okamžite. Avšak chemická a fyzikálna stabilita počas používania bola pri teplote 25 °C preukázaná na 3 hodiny.
V rámci času použiteľnosti sa liek môže uchovávať pri izbovej teplote (až do 25 °C) počas jedného obdobia nepresahujúceho 6 mesiacov. Na balenie lieku zaznamenajte dátum konca 6-mesačného uchovávania pri izbovej teplote. Liek sa nesmie vrátiť späť do chladničky.
6.4. Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke pri teplote (2 °C – 8 °C). Neuchovávajte v mrazničke.
ADVATE s pomôckou BAXJECT II: Injekčnú liekovku s liekom uchovávajte vo vonkajšom obale na ochranu pred svetlom.
ADVATE v systéme BAXJECT III: Uzavretý blister uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5. Druh obalu a obsah balenia
Injekčná liekovka s práškom a 5 ml injekčná liekovka s rozpúšťadlom sú vyrobené zo skla typu
I a uzatvorené chlorobutylovými gumenými zátkami. Liek sa dodáva v jednej z nasledujúcich foriem:
- ADVATE s pomôckou BAXJECT II: Každé balenie obsahuje injekčnú liekovku
s práškom, 5 ml injekčnú liekovku s rozpúšťadlom a pomôcku na rekonštitúciu (BAXJECT II).
- ADVATE v systéme BAXJECT III: Každé balenie obsahuje systém BAXJECT v uzavretom blistri (injekčná liekovka s práškom a 5 ml injekčná liekovka s rozpúšťadlom sú zabudované v systéme na rekonštitúciu).
6.6. Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
ADVATE sa podáva intravenózne po rekonštitúcii lieku.
Pripravený roztok sa má skontrolovať vizuálne, či neobsahuje cudzorodé častice a či nemá zmenenú farbu.
Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc. Nepoužívajte zakalené roztoky alebo roztoky s usadeninami.
- Na podávanie je potrebné použiť injekčnú striekačku s konektorom luer-lock.
- Použite do troch hodín po príprave.
- Po príprave liek neuchovávajte v chladničke.
- Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Príprava roztoku s pomôckou BAXJECT II
- Na rekonštitúciu použite len pribalenú sterilizovanú vodu na injekciu a pomôcku na rekonštitúciu.
- Nepoužívajte, ak je pomôcka BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
- Má byť použitá aseptická technika
1. Ak je liek ešte uchovávaný v chladničke, vyberte injekčnú liekovku s práškom ADVATE
a injekčnú liekovku s rozpúšťadlom z chladničky a zohrejte ich na izbovú teplotu
(medzi 15 °C - 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Odstráňte uzáver z injekčnej liekovky s práškom a uzáver z injekčnej liekovky s rozpúšťadlom
4. Očistite zátky tampónmi napustenými alkoholom. Injekčné liekovky umiestnite na rovný čistý povrch.
5. Otvorte balenie pomôcky BaxJect II odtrhnutím papierového viečka bez toho, aby ste sa dotkli vnútrajška (Obr. a). Nevyberajte pomôcku z balenia. Nepoužívajte, ak je pomôcka
BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
6. Otočte balenie nahor a prepichnite zátku rozpúšťadla čírym plastovým bodcom. Uchopte balenie za jeho okraj a stiahnite balenie z BAXJECTu II (Obr. b). Neodstraňujte modré viečko
z pomôcky BAXJECT II.
7. Na rekonštitúciu sa má použiť len pribalená sterilizovaná voda na injekciu a pomôcka na rekonštitúciu. S BAXJECTom II pripevneným na injekčnú liekovku s rozpúšťadlom obráťte systém tak, aby bola injekčná liekovka s rozpúšťadlom navrchu. Bielym plastovým bodcom prepichnite zátku prášku ADVATE. Vákuum nasaje rozpúšťadlo do injekčnej liekovky
s práškom ADVATE (Obr. c).

8. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc.
Obr. a Obr. b Obr. cPríprava roztoku so systémom BAXJECT III- Ak viečko úplne neutesňuje blister, výrobok nepoužívajte.
1. Ak je liek ešte uchovávaný v chladničke, vyberte uzavretý blister (obsahuje injekčnú liekovku s práškom a injekčnú liekovku s rozpúšťadlom zabudované v systéme na rekonštitúciu) z chladničky a zohrejte ich na izbovú teplotu (medzi 15 °C a 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Otvorte balenie ADVATE odlepením viečka. Vyberte systém BAXJECT III z blistra.
4. Položte liek ADVATE na rovný povrch s injekčnou liekovkou s rozpúšťadlom nahor (Obr. 1).
Injekčná liekovka s rozpúšťadlom má modrý prúžok. Neodstraňujte modré viečko, až kým nedostanete pokyn v ďalšom kroku.
5. Jednou rukou pridržte liek ADVATE v systéme BAXJECT III, druhou rukou pevne pritlačte na injekčnú liekovku s rozpúšťadlom, kým systém úplne nezaklapne a rozpúšťadlo nezačne prúdiť do injekčnej liekovky ADVATE (Obr. 2). Systém nenakláňajte, kým sa prenos nedokončí.
6. Overte, že prenos rozpúšťadla je úplný. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc.
Obr. 1 Obr. 2 Obr. 3 Podávanie
PodávaniePoužite aseptickú techniku
Lieky podávané parenterálne sa pred podaním musia skontrolovať, či neobsahujú pevné čiastočky, vždy keď to roztok a obal umožní. Použitý smie byť len číry a bezfarebný roztok.
1. Odstráňte modré viečko z BAXJECTu II/BAXJECTu III.
Nenasajte vzduch do injekčnej striekačky. Pripojte injekčnú striekačku k BAXJECTu II/BAXJECTu III.
2. Prevráťte systém (injekčná liekovka s pripraveným roztokom má byť hore). Natiahnite pripravený roztok do injekčnej striekačky pomalým vytiahnutím piestu smerom dozadu.
3. Odpojte injekčnú striekačku.
4. Pripojte krídelkovú ihlu na injekčnú striekačku. Injektujte intravenózne. Roztok sa má podávať pomaly, rýchlosťou ktorá pacientovi najviac vyhovuje a nepresahuje 10 ml za minútu. Pulzová frekvencia sa má zmerať pred podaním ADVATE a počas jeho podávania. Ak dôjde
k významnému vzostupu, zníženie rýchlosti podávania alebo dočasné prerušenie podávania zvyčajne postačí na to, aby príznaky rýchlo vymizli (pozri časti 4.4 a 4.8).
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBaxter AG Industriestrasse 67
A-1221 Viedeň
Rakúsko
8. REGISTRAČNÉ ČÍSLOEU/1/03/271/002
EU/1/03/271/012
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 2. marec 2004
Dátum posledného predĺženia registrácie: 2. marec 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
ADVATE 1000 IU prášok a rozpúšťadlo na injekčný roztok.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá injekčná liekovka obsahuje 1000 IU* ľudského koagulačného faktora VIII (rDNA), alfaoktokogu**. Po rekonštitúcii ADVATE obsahuje približne 200 IU ľudského koagulačného faktora VIII (rDNA), alfaoktokogu/ml.
Účinnosť (medzinárodné jednotky, IU) sa stanovuje pomocou chromogénneho testu Európskeho liekopisu. Špecifická aktivita lieku ADVATE je približne 4000 – 10 000 IU/mg proteínu. Alfaoktokog (ľudský koagulačný faktor VIII (rDNA)) je čistený proteín s 2332 aminokyselinami. Je produkovaný rekombinantnou DNA technológiou v bunkách ovárií čínskeho škrečka (Chinese
hamster ovary, CHO). Pripravený bez prídavku akýchkoľvek (exogénnych) ľudských alebo zvieracích proteínov v procese bunkovej kultivácie, purifikácie alebo konečnej úpravy.
Pomocné látky so známym účinkom:
0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Prášok a rozpúšťadlo na injekčný roztok. Prášok: biely až sivobiely drobivý prášok.
Rozpúšťadlo: číry a bezfarebný roztok.
4. KLINICKÉ ÚDAJE
4.1. TERAPEUTICKÉ INDIKÁCIE
Liečba a profylaxia krvácania u pacientov s hemofíliou A (vrodený nedostatok faktora VIII). Liek
ADVATE je indikovaný vo všetkých vekových skupinách.
4.2. Dávkovanie a spôsob podávania
Liečba sa má začať pod dohľadom lekára skúseného v liečbe hemofílie a so zabezpečenou okamžitou resuscitáciou v prípade anafylaxie.
Dávkovanie
Dávka a dĺžka substitučnej terapie závisí od závažnosti nedostatku faktora VIII, od miesta a rozsahu krvácania a od klinického stavu pacienta.
Počet jednotiek faktora VIII sa vyjadruje v medzinárodných jednotkách (International Units, IU), ktoré sa vzťahujú na štandard WHO pre lieky s faktorom VIII. Aktivita faktora VIII v plazme sa vyjadruje buď percentuálne (v relácii k normálnej ľudskej plazme) alebo v IU (podľa medzinárodného štandardu pre faktor VIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora VIII zodpovedá množstvu faktora VIII v jednom ml normálnej ľudskej plazmy.
Liečba on demand (podľa potreby)
Výpočet požadovanej dávky faktora VIII sa zakladá na empirickom zistení, že 1 IU faktora VIII na kg telesnej hmotnosti zvýši aktivitu plazmatického faktora VIII o 2 IU/dl. Potrebná dávka sa stanoví
použitím nasledovného vzorca:
Požadované jednotky (IU) = telesná hmotnosť (kg) x požadovaný vzostup faktora VIII (%) x 0,5
V prípade nasledujúcich krvácavých príhod aktivita faktora VIII nemá počas zodpovedajúceho obdobia klesnúť pod danú hladinu aktivity v plazme (v % normálu alebo IU/dl). Ako návod na dávkovanie pri krvácaní alebo pri chirurgických zákrokoch možno použiť nasledovnú tabuľku 1:
Tabuľka 1 Návod na dávkovanie pri krvácaní a chirurgických zákrokoch
Stupeň krvácania/Typ chirurgického zákroku
Krvácanie
Začínajúca hemartróza, krvácanie do svalu alebo krvácanie v ústnej dutine.
Rozsiahlejšia hemartróza, krvácanie do svalu alebo hematóm.
Život ohrozujúce krvácania.
Chirurgický zákrok
Malý
Vrátane extrakcie zuba.
Veľký
Požadovaná hladina faktora VIII
(% alebo IU/dl)
20 – 40
30 – 60
60 – 100
30 – 60
80 – 100
(pred a po operácii)
Frekvencia dávok (hodiny)/ dĺžka trvania terapie (dni)
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým krvácavá príhoda, súdiac podľa bolesti, nepominie alebo kým nedôjde
k zahojeniu.
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších
ako 6 rokov) počas 3 – 4 dní alebo dlhšie až dovtedy, kým bolesť nepominie alebo kým sa neobnoví funkčnosť.
Opakujte injekcie každých 8 až 24 hodín
(6 až 12 hodín u pacientov mladších
ako 6 rokov), až dovtedy, kým nepominie stav ohrozenia života.
Každých 24 hodín (12 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým nedôjde
k zahojeniu.
Opakujte injekcie každých 8 až 24 hodín
(6 až 24 hodín u pacientov mladších
ako 6 rokov), do adekvátneho zahojenia rán, potom pokračujte v terapii najmenej ďalších 7 dní na udržanie aktivity
faktora VIII od 30 % do 60 % (IU/dl).

Dávka a frekvencia podávania sa majú v jednotlivých prípadoch prispôsobiť klinickej odpovedi.
Za určitých okolností (napr. prítomnosť nízkeho titra inhibítora) môžu byť potrebné vyššie dávky ako dávky vypočítané podľa vzorca.
V priebehu liečby sa odporúča primerané stanovovanie hladín plazmatického faktora VIII ako návod na určovanie podávanej dávky a frekvencie opakovaných injekcií. Predovšetkým v prípade veľkých chirurgických zákrokov je nevyhnutné presné sledovanie substitučnej terapie skúškami aktivity plazmatického faktora VIII. Reakcie jednotlivých pacientov na faktor VIII sa môžu
in vivo odlišovať a dosiahnuť odlišné hladiny obnovenia faktora VIII a preukázať rôzne polčasy.
Profylaxia
Na dlhodobú profylaxiu krvácania u pacientov s ťažkou hemofíliou A sú zvyčajné dávky 20 až 40 IU
faktora VIII na kg telesnej hmotnosti v intervaloch od 2 do 3 dní.
Pediatrická populácia
Dávkovanie pre liečbu on demand sa u pediatrických pacientov (0 až 18 rokov veku) nelíši od dospelých pacientov. U pacientov mladších ako 6 rokov sa na profylaktickú terapiu odporúča dávkovanie 20 až 50 IU faktora VIII na kg telesnej hmotnosti 3 až 4-krát do týždňa.
Spôsob podávania
ADVATE sa má podávať intravenóznou cestou. V prípade, že liek nepodáva zdravotnícky pracovník je nutné jeho náležité zaškolenie.
Rýchlosť podávania sa má ustáliť podľa toho, ako to pacientovi najviac vyhovuje a smie dosiahnuť
maximálne 10 ml/min.
Po rekonštitúcii je roztok číry, bezfarebný, bez cudzorodých častíc s pH medzi 6,7 až 7,3. Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3. Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na proteíny myši alebo škrečka.
4.4. Osobitné upozornenia a opatrenia pri používaní
Precitlivenosť
U ADVATE boli hlásené reakcie z precitlivenosti alergického typu vrátane anafylaxie a prejavili sa závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Liek obsahuje stopy proteínov myši a škrečka. Pacienti majú byť upozornení, že ak sa vyskytnú
príznaky precitlivenosti, odporúča sa používanie lieku okamžite prerušiť a kontaktovať svojho lekára. Pacienti majú byť informovaní o prvotných príznakoch reakcií z precitlivenosti zahŕňajúcich vyrážky, generalizovanú žihľavku, pocit tiesne na hrudníku, pískavé dýchanie, hypotenzia a anafylaxiu.
V prípade šoku má byť zavedená štandardná lekárska liečba šoku.
Inhibítory
Známou komplikáciou liečby jedincov s hemofíliou A je vznik protilátok (inhibítorov) neutralizujúcich faktor VIII. Tieto inhibítory sú zvyčajne imunoglobulíny IgG pôsobiace proti prokoagulačnej aktivite faktora VIII, ktoré sú kvantifikované v Bethesdových jednotkách (BU) na ml
plazmy použitím modifikovanej skúšky. U pacientov, u ktorých sa objavia inhibítory faktora VIII, sa
klinický stav môže prejavovať ako nedostatočná klinická odpoveď. V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu. Riziko vzniku inhibítorov koreluje s rozsahom expozície faktoru VIII, toto riziko býva najvyššie počas prvých 20 dní expozície, a tiež s inými genetickými faktormi a faktormi prostredia. V zriedkavých prípadoch môžu inhibítory vzniknúť po prvých 100 dňoch expozície.
Boli pozorované prípady opakovaného vzniku inhibítorov (nízky titer) po prechode z jedného lieku s faktorom VIII na iný u predtým liečených pacientov s viac ako 100 dňami expozície, ktorí majú
v anamnéze vznik inhibítorov. Odporúča sa preto, aby všetci pacienti po prechode z jedného lieku na iný boli pozorne sledovaní na vznik inhibítorov.
Vo všeobecnosti všetci pacienti s koagulačným faktorom VIII majú byť pomocou náležitých klinických pozorovaní a laboratórnych vyšetrení pozorne sledovaní na vznik inhibítorov. Ak sa očakávané hladiny aktivity faktora VIII v plazme nedosiahnu, alebo ak krvácanie nie je kontrolované vhodnou dávkou, má sa vykonať testovanie prítomnosti inhibítorov faktora VIII. U pacientov
s vysokými hladinami inhibítora, substitučná terapia faktorom VIII nemusí byť účinná a treba zvážiť
iné možnosti liečby. Liečba takých pacientov má byť riadená lekármi so skúsenosťami so starostlivosťou o pacientov s hemofíliou a inhibítormi faktora VIII.
Komplikácie liečby súvisiace s katétrom
Ak je potrebný centrálny venózny katéter (CVK), musí sa zvážiť riziko komplikácií súvisiacich s CVK
vrátane lokálnych infekcií, bakterémie a trombózy v mieste zavedenia katétra.
Aspekty týkajúce sa pomocného základu
Po príprave tento liek obsahuje 0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke. Má sa to vziať
do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
Dôrazne odporúčame, aby sa pri každom podávaní lieku ADVATE pacientovi, zapísali názov a číslo šarže lieku, a tak sa uchovalo prepojenie medzi pacientom a šaržou lieku.
Pediatrická populácia:
Uvedené upozornenia a opatrenia pri používaní sa týkajú detí aj dospelých.
4.5. Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s ADVATE.
4.6. Fertilita, gravidita a laktácia
Neuskutočnili sa reprodukčné štúdie s faktorom VIII na zvieratách. Vzhľadom k zriedkavému výskytu hemofílie A u žien, nie sú k dispozícii údaje týkajúce sa použitia faktora VIII počas gravidity
a laktácie. Z tohto dôvodu má byť faktor VIII používaný počas gravidity a dojčenia iba v nevyhnutných prípadoch.
4.7. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
ADVATE nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8. Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Klinické štúdie s ADVATE zahŕňali 418 účastníkov vystavených najmenej raz lieku ADVATE
hlásiacich celkovo 93 nežiaducich liekových reakcií (adverse drug reactions, ADR). ADR, ktoré
sa vyskytli s najväčšou frekvenciou, boli vznik neutralizačných protilátok faktora VIII (inhibítorov), bolesť hlavy, a horúčka.
Reakcie precitlivenosti alebo alergické reakcie (ako angioedém, pálenie a pichanie v mieste infúzie, zimnica, začervenanie kože, generalizovaná žihľavka, bolesť hlavy, vyrážky, hypotenzia, letargia, nauzea, nepokoj, tachykardia, pocit tiesne na hrudníku, mravčenie, vracanie, pískavé dýchanie)
boli pozorované zriedkavo, a v niektorých prípadoch sa z nich môže vyvinúť závažná anafylaxia
(vrátane šoku).
Môže byť pozorovaný vznik protilátok proti proteínu myši alebo škrečka so súvisiacimi reakciami precitlivenosti.
U pacientov s hemofíliou A môžu vznikať neutralizačné protilátky (inhibítory) faktora VIII. Ak dôjde k vzniku takých inhibítorov, klinický stav sa môže prejavovať ako nedostatočná klinická odpoveď.
V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu.
Tabuľ
kové zhrnutie nežiaducich reakcií
Nasledujúca tabuľka 2 uvádza frekvenciu nežiaducich liekových reakcií v klinických štúdiách
a v spontánne hlásených prípadoch. Táto tabuľka je podľa klasifikácie orgánových systémov MEDRA (SOC a preferovaných termínov).
Nežiaduce reakcie sú uvedené podľa nasledujúceho pravidla: veľmi časté (≥ 1/10), časté (≥ 1/100 až
< 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 2 Frekvencia nežiaducich liekových reakcií (ADR) v klinických štúdiách a spontánne hlásených prípadoch
MedDRA štandardná trieda orgánových systémov
Infekcie a nákazy
Poruchy krvi a lymfatického systému
Poruchy imunitného systému
Poruchy nervového systému
Nežiaduca reakcia Frekvenciaa
Chrípka Menej časté Laryngitída Menej časté Inhibícia faktora VIIIc Časté Lymfangitída Menej časté Anafylaktická reakcia Nie je známe Precitlivenosťc Nie je známe Bolesť hlavy Časté
Závrat Menej časté Porucha pamäte Menej časté Synkopa Menej časté Tremor Menej časté Migréna Menej časté Porucha chuti Menej časté
Poruchy oka Zápal oka Menej časté
Poruchy srdca a srdcovej činnosti Palpitácie Menej časté

Poruchy ciev
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Úrazy, otravy a komplikácie liečebného postupu
Hematóm Menej časté Návaly tepla Menej časté Bledosť Menej časté Dyspnoe Menej časté
Hnačka Menej časté Bolesť v hornej časti brucha Menej časté Nevoľnosť Menej časté Vracanie Menej časté Svrbenie Menej časté Vyrážka Menej časté Hyperhidróza Menej časté Žihľavka Menej časté Pyrexia Časté Periférny edém Menej časté Bolesť na hrudi Menej časté Hrudný dyskomfort Menej časté Zimnica Menej časté Nezvyčajný pocit Menej časté Hemátóm v mieste punkcie cievy Menej časté Únava Nie je známe Reakcia v mieste injekcie Nie je známe Nevoľnosť Nie je známe Zvýšený počet monocytov Menej časté
Znížená hladina koagulačného faktora VIIIb Menej časté
Znížený hematokrit Menej časté Abnormálne výsledky laboratórnych testov Menej časté Postprocedurálna komplikácia Menej časté Postprocedurálne krvácanie Menej časté Reakcia v mieste podania Menej časté
a) Vypočítané na základe celkového počtu pacientov, ktorí dostávali ADVATE (418). b) U jedného pacienta sa počas kontinuálnej infúzie ADVATE po operácii (pooperačné
dni 10 - 14) vyskytli neočakávane znížené hladiny koagulačného faktora VIII. Hemostáza bola počas tohto obdobia stále udržiavaná a ako hladina faktora VIII, tak aj hodnoty klírensu sa vrátili na dostatočné hodnoty do 15. pooperačného dňa. Skúšky inhibítora faktora VIII uskutočnené po ukončení kontinuálnej infúzie a v závere štúdie boli negatívne.
c) Nežiaduce reakcie vysvetlené v časti nižšie.
Opis vybratých nežiaducich reakciíVznik inhibítorovBol hlásený vznik inhibítorov u predtým liečených pacientov (PTP) a u predtým neliečených pacientov (PUP). Bližšie údaje nájdete v časti 5.1 (Farmakologické vlastnosti) a 4.4 (Osobitné upozornenia a opatrenia pri používaní).
Nežiaduce reakcie špecifické pre pozostatky z výrobného procesuZ 229 liečených pacientov, ktorí boli hodnotení na protilátky proti proteínu buniek ovárií čínskeho škrečka (CHO), sa u 3 dokázal štatisticky významný vzostupný trend v titroch, u 4 sa ukázali pretrvávajúce vrcholy alebo prechodné výkyvy a jeden pacient mal oboje, ale nemal žiadne klinické príznaky. Z 229 liečených pacientov, ktorí boli hodnotení na protilátky proti myším IgG, sa
u 10 dokázal štatisticky významný vzostupný trend v titroch, u 2 sa ukázali pretrvávajúce vrcholy
alebo prechodné výkyvy a jeden pacient mal oboje. Štyria z týchto pacientov hlásili jednotlivé prípady urtikárie, pruritu, vyrážky a mierne zvýšeného počtu eozinofilov v rámci opakovaných expozícií lieku v štúdii.
PrecitlivenosťReakcie alergického typu vrátane anafylaxie, ktoré sa prejavili závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Pediatrická populáciaV klinických štúdiách neboli uvedené žiadne vekovo špecifické rozdiely v nežiaducich reakciách iné ako vznik inhibítorov u predtým neliečených detských pacientov (PUP) a komplikácie súvisiace
s katétrom.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9. PredávkovanieNeboli hlásené žiadne prípady predávkovania rekombinantným koagulačným faktorom VIII.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1. Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antihemoragiká: krvný koagulačný faktor VIII. ATC kód: B02BD02. Komplex faktora VIII/von Willebrandovho faktora sa skladá z dvoch molekúl (faktor VIII
a von Willebrandov faktor) s odlišnými fyziologickými funkciami. ADVATE obsahuje rekombinantný
koagulačný faktor VIII (alfaoktokog), glykoproteín ktorý je biologicky rovnocenný s glykoproteínu faktora VIII obsiahnutom v ľudskej plazme.
Alfaoktokog je glykoproteín skladajúci sa z 2332 aminokyselín s molekulárnou hmotnosťou
približne 280 kD. Alfaoktokog sa pri podávaní infúziou hemofilickému pacientovi viaže na endogénny
von Willebrandov faktor v pacientovom krvnom obehu. Aktivovaný faktor VIII pôsobí ako kofaktor pre aktivovaný faktor IX, urýchľujúci konverziu faktora X na aktivovaný faktor X. Aktivovaný faktor X premieňa protrombín na trombín. Trombín potom premieňa fibrinogén na fibrín a môže
sa vytvoriť krvná zrazenina. Hemofília A je dedičná porucha zrážania krvi viazaná na pohlavie, spôsobená zníženými hladinami aktivity faktora VIII a má za následok profúzne krvácanie do kĺbov, svalov alebo vnútorných orgánov, ktoré vzniká buď spontánne, alebo ako dôsledok úrazu alebo chirurgického zákroku. Plazmatické hladiny faktora VIII sa substitučnou liečbou zvyšujú,
čo umožňuje dočasnú úpravu nedostatku faktora VIII a úpravu sklonu ku krvácaniu.
Vznik inhibítorov
Imunogenicita ADVATE sa hodnotila u predtým liečených pacientov. Počas klinických štúdií
s ADVATE u 233 pediatrických (pediatrickí pacienti vo veku 0 až 16 rokov) a dospelých pacientov (starší ako 16 rokov), ktorým bola diagnostikovaná ťažká hemofília A (faktor VIII ≤ 1 %) a ktorí boli predtým vystavení koncentrátom faktora VIII po dobu ≥ 150 dní pre dospelých a staršie deti, a
po dobu ≥ 50 dní pre deti mladšie ako 6 rokov, sa po 26 dňoch expozície ADVATE vyvinul nízky titer inhibítora (2,4 BU v modifikovanej Bethesdovej skúške) u jedného pacienta. Nasledujúce testy na inhibítor vykonané u tohto pacienta po vyradení zo štúdie boli negatívne. V rámci všetkých štúdií bol medián expozície lieku ADVATE 97,0 expozičných dní na účastníka (rozsah 1 až 709) pre predtým liečených pacientov. Celkový výskyt vzniku inhibítorov faktora VIII (nízky alebo vysoký) bol 0,4 %
(1 z 233).
V ukončenej nekontrolovanej štúdii 060103, 16 zo 45 (35,6 %) predtým neliečených pacientov
s ťažkou hemofíliou A (faktor VIII < 1 %) a najmenej s 25 dňami expozície faktoru VIII vznikli inhibítory faktora VIII u: 7 (15,6 %) účastníkov vznikli inhibítory s vysokým titrom a u 9 (20 %) účastníkov vznikli inhibítory s nízkym titrom, 1 z nich bol tiež klasifikovaný ako prechodný inhibítor. Rizikové faktory súvisiace so vznikom inhibítorov v tejto štúdii zahŕňali iné ako kaukazské etnikum, familiárny výskyt inhibítorov a intenzívnu liečbu vysokou dávkou počas prvých 20 dní expozície.
U 20 účastníkov, ktorí nemali žiadny z týcho rizikových faktorov, nevznikli žiadne inhibítory.
Boli sústredené údaje o vyvolaní imunitnej tolerancie (ITI) u pacientov s inhibítormi. V rámci čiastkovej štúdie PNP 060103 bola zdokumentovaná liečba ITI u 11 predtým neliečených pacientov (PUP). Bola vypracovaná retrospektívna hodnotiaca schéma pre 30 pacientov s ITI (štúdia 060703)
a prebieha zhromažďovanie údajov do registra.
V štúdii 060201 boli porovnávané dve dlhodobé profylaktické liečebné schémy u 53 predtým liečených osôb: farmakokinetický riadený dávkovací režim prispôsobený individuálnym účastníkom (v rozsahu 20 až 80 IU faktora VIII na kg telesnej hmotnosti v intervaloch 72 ± 6 hodín, n=23)
so štandardným profylaktickým dávkovacím režimom (20 až 40 IU/kg každých 48 ± 6 hodín, n=30). Farmakokinetický riadený dávkovací režim (podľa osobitného vzorca) bol zacielený na udržanie minimálnych hladín (tzv. trough level) faktora VIII ≥ 1 % v intervale medzi dávkovaním 72 hodín. Údaje z tejto štúdie ukazujú, že tieto dva profylaktické dávkovacie režimy sú porovnateľné, čo sa týka redukcie miery krvácania.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom ADVATE vo všetkých podskupinách pediatrickej populácie s hemofíliou A (vrodený deficit faktora VIII) pri „indukcii imunitnej tolerancie (ITI) u pacientov s hemofíliou A (vrodený deficit
faktora VIII), u ktorých vznikli inhibítory faktora VIII“ a „liečbe a profylaxii krvácania u pacientov s hemofíliou A (vrodený deficit faktora VIII)“. (Informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2. Farmakokinetické vlastnosti
Všetky farmakokinetické štúdie s ADVATE boli vykonávané u predtým liečených pacientov s ťažkou až stredne ťažkou hemofíliou A (východiskový faktor VIII ≤ 2%). Analýza vzoriek plazmy bola vykonávaná v centrálnom laboratóriu použitím jednostupňovej skúšky zrážavosti.
Celkovo 195 pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %) poskytlo farmakokinetické (FK) parametre, ktoré boli začlenené do FK analytického súboru „per-protocol“. Kategórie týchto analýz pre dojčatá (1 mesiac do < 2 rokov veku), deti (2 až < 5 rokov veku), staršie deti (5 až < 12 rokov veku), mladistvých (12 až < 18 rokov veku) a dospelých (18 rokov veku a starší) boli použité na sumarizáciu FK parametrov, kde vek bol definovaný ako vek v dobe FK infúzie.
Tabuľka 3 Súhrn farmakokinetických parametrov ADVATE podľa vekovej skupiny pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %)
Parameter (priemer
± štandardná odchýlka)
Dojčatá
(n=5)
Deti
(n=30)
Staršie deti
(n=18)
Mladiství
(n=33)
Dospelí
(n=109)
Celková AUC (IU*h/dl) Upravené progresívne obnovenie hladiny Cmax (IU/dl na IU/kg)a
1362,1 ± 311,8 1180,0 ± 432,7 1506,6 ± 530,0 1317,1 ± 438,6 1538,5 ± 519,1
2,2 ± 0,6 1,8 ± 0,4 2,0 ± 0,5 2,1 ± 0,6 2,2 ± 0,6
Polčas (h) 9,0 ± 1,5 9,6 ± 1,7 11,8 ± 3,8 12,1 ± 3,2 12,9 ± 4,3
Maximálna plazmatická koncentrácia po infúzii (IU/dl) Priemerný rezidenčný čas (h)
Distribučný objem v ustálenom stave (dl/kg)
110,5 ± 30,2 90,8 ± 19,1 100,5 ± 25,6 107,6 ± 27,6 111,3 ± 27,1
11,0 ± 2,8 12,0 ± 2,7 15,1 ± 4,7 15,0 ± 5,0 16,2 ± 6,1
0,4 ± 0,1 0,5 ± 0,1 0,5 ± 0,2 0,6 ± 0,2 0,5 ± 0,2
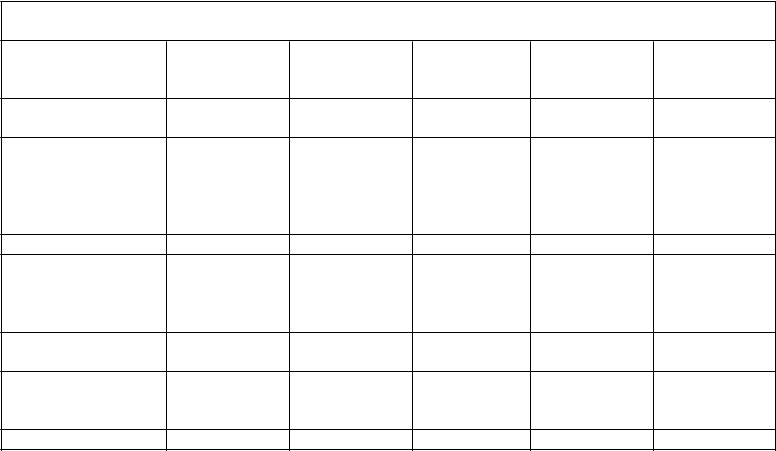
Klírens (ml/kg*h) 3,9 ± 0,9 4,8 ± 1,5 3,8 ± 1,5 4,1 ± 1,0 3,6 ± 1,2 a Vypočítané ako (Cmax – faktor VIII na začiatku liečby) delené dávkou v IU/kg, kde Cmax je maximálny nameraný faktor VIII po infúzii.
Bezpečnosť a hemostatická účinnosť lieku ADVATE v pediatrickej populácii sú podobné ako tieto parametre u dospelých pacientov. Upravené obnovenie a konečný polčas (t½) boli približne o 20% nižšie u mladších detí (mladších ako 6 rokov) ako u dospelých, čo je v súlade so známym vyšším objemom plazmy na kilogram telesnej hmotnosti u mladších pacientov.
Aktuálne nie sú k dispozícii farmakokinetické údaje o ADVATE u predtým neliečených pacientov.
5.3. Predklinické údaje o bezpečnostiPredklinické údaje získané na základe farmakologických štúdií bezpečnosti, akútnej toxikológie, toxicity po opakovanom podaní, lokálnej toxicity a genotoxicity neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1. Zoznam pomocných látokPrášok Manitol Chlorid sodný Histidín Trehalóza
Chlorid vápenatý Trometamol Polysorbát 80
Glutatión (redukovaný)
Rozpúšťadlo
Sterilizovaná voda na injekciu
6.2. Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi alebo rozpúšťadlami.
6.3. Čas použiteľnosti
2 roky.
Po rekonštitúcii: z mikrobiologického hľadiska sa má liek použiť okamžite. Avšak chemická a fyzikálna stabilita počas používania bola pri teplote 25 °C preukázaná na 3 hodiny.
V rámci času použiteľnosti sa liek môže uchovávať pri izbovej teplote (až do 25 °C) počas jedného obdobia nepresahujúceho 6 mesiacov. Na balenie lieku zaznamenajte dátum konca 6-mesačného uchovávania pri izbovej teplote. Liek sa nesmie vrátiť späť do chladničky.
6.4. Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke pri teplote (2 °C – 8 °C). Neuchovávajte v mrazničke.
ADVATE s pomôckou BAXJECT II: Injekčnú liekovku s liekom uchovávajte vo vonkajšom obale na ochranu pred svetlom.
ADVATE v systéme BAXJECT III: Uzavretý blister uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5. Druh obalu a obsah balenia
Injekčná liekovka s práškom a 5 ml injekčná liekovka s rozpúšťadlom sú vyrobené zo skla typu
I a uzatvorené chlorobutylovými gumenými zátkami. Liek sa dodáva v jednej z nasledujúcich foriem:
- ADVATE s pomôckou BAXJECT II: Každé balenie obsahuje injekčnú liekovku
s práškom, 5 ml injekčnú liekovku s rozpúšťadlom a pomôcku na rekonštitúciu (BAXJECT II).
- ADVATE v systéme BAXJECT III: Každé balenie obsahuje systém BAXJECT v uzavretom blistri (injekčná liekovka s práškom a 5 ml injekčná liekovka s rozpúšťadlom sú zabudované v systéme na rekonštitúciu).
6.6. Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
ADVATE sa podáva intravenózne po rekonštitúcii lieku.
Pripravený roztok sa má skontrolovať vizuálne, či neobsahuje cudzorodé častice a či nemá zmenenú farbu.
Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc. Nepoužívajte zakalené roztoky alebo roztoky s usadeninami.
- Na podávanie je potrebné použiť injekčnú striekačku s konektorom luer-lock.
- Použite do troch hodín po príprave.
- Po príprave liek neuchovávajte v chladničke.
- Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Príprava roztoku s pomôckou BAXJECT II
- Na rekonštitúciu použite len pribalenú sterilizovanú vodu na injekciu a pomôcku na rekonštitúciu.
- Nepoužívajte, ak je pomôcka BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
- Má byť použitá aseptická technika
1. Ak je liek ešte uchovávaný v chladničke, vyberte injekčnú liekovku s práškom ADVATE
a injekčnú liekovku s rozpúšťadlom z chladničky a zohrejte ich na izbovú teplotu
(medzi 15 °C - 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Odstráňte uzáver z injekčnej liekovky s práškom a uzáver z injekčnej liekovky s rozpúšťadlom
4. Očistite zátky tampónmi napustenými alkoholom. Injekčné liekovky umiestnite na rovný čistý povrch.
5. Otvorte balenie pomôcky BaxJect II odtrhnutím papierového viečka bez toho, aby ste sa dotkli vnútrajška (Obr. a). Nevyberajte pomôcku z balenia. Nepoužívajte, ak je pomôcka
BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
6. Otočte balenie nahor a prepichnite zátku rozpúšťadla čírym plastovým bodcom. Uchopte balenie za jeho okraj a stiahnite balenie z BAXJECTu II (Obr. b). Neodstraňujte modré viečko
z pomôcky BAXJECT II.
7. Na rekonštitúciu sa má použiť len pribalená sterilizovaná voda na injekciu a pomôcka na rekonštitúciu. S BAXJECTom II pripevneným na injekčnú liekovku s rozpúšťadlom obráťte systém tak, aby bola injekčná liekovka s rozpúšťadlom navrchu. Bielym plastovým bodcom prepichnite zátku prášku ADVATE. Vákuum nasaje rozpúšťadlo do injekčnej liekovky
s práškom ADVATE (Obr. c).

8. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc.
Obr. a Obr. b Obr. cPríprava roztoku so systémom BAXJECT III- Ak viečko úplne neutesňuje blister, výrobok nepoužívajte.
1. Ak je liek ešte uchovávaný v chladničke, vyberte uzavretý blister (obsahuje injekčnú liekovku s práškom a injekčnú liekovku s rozpúšťadlom zabudované v systéme na rekonštitúciu) z chladničky a zohrejte ich na izbovú teplotu (medzi 15 °C a 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Otvorte balenie ADVATE odlepením viečka. Vyberte systém BAXJECT III z blistra.
4. Položte liek ADVATE na rovný povrch s injekčnou liekovkou s rozpúšťadlom nahor (Obr. 1).
Injekčná liekovka s rozpúšťadlom má modrý prúžok. Neodstraňujte modré viečko, až kým nedostanete pokyn v ďalšom kroku.
5. Jednou rukou pridržte liek ADVATE v systéme BAXJECT III, druhou rukou pevne pritlačte na injekčnú liekovku s rozpúšťadlom, kým systém úplne nezaklapne a rozpúšťadlo nezačne prúdiť do injekčnej liekovky ADVATE (Obr. 2). Systém nenakláňajte, kým sa prenos nedokončí.
6. Overte, že prenos rozpúšťadla je úplný. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc.
Obr. 1 Obr. 2 Obr. 3 Podávanie
PodávaniePoužite aseptickú techniku
Lieky podávané parenterálne sa pred podaním musia skontrolovať, či neobsahujú pevné čiastočky, vždy keď to roztok a obal umožní. Použitý smie byť len číry a bezfarebný roztok.
1. Odstráňte modré viečko z BAXJECTu II/BAXJECTu III.
Nenasajte vzduch do injekčnej striekačky. Pripojte injekčnú striekačku k BAXJECTu II/BAXJECTu III.
2. Prevráťte systém (injekčná liekovka s pripraveným roztokom má byť hore). Natiahnite pripravený roztok do injekčnej striekačky pomalým vytiahnutím piestu smerom dozadu.
3. Odpojte injekčnú striekačku.
4. Pripojte krídelkovú ihlu na injekčnú striekačku. Injektujte intravenózne. Roztok sa má podávať pomaly, rýchlosťou ktorá pacientovi najviac vyhovuje a nepresahuje 10 ml za minútu. Pulzová frekvencia sa má zmerať pred podaním ADVATE a počas jeho podávania. Ak dôjde
k významnému vzostupu, zníženie rýchlosti podávania alebo dočasné prerušenie podávania zvyčajne postačí na to, aby príznaky rýchlo vymizli (pozri časti 4.4 a 4.8).
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBaxter AG Industriestrasse 67
A-1221 Viedeň
Rakúsko
8. REGISTRAČNÉ ČÍSLOEU/1/03/271/003
EU/1/03/271/013
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 2. marec 2004
Dátum posledného predĺženia registrácie: 2. marec 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
ADVATE 1500 IU prášok a rozpúšťadlo na injekčný roztok.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá injekčná liekovka obsahuje 1500 IU* ľudského koagulačného faktora VIII (rDNA), alfaoktokogu**. Po rekonštitúcii ADVATE obsahuje približne 300 IU ľudského koagulačného faktora VIII (rDNA), alfaoktokogu/ml.
Účinnosť (medzinárodné jednotky, IU) sa stanovuje pomocou chromogénneho testu Európskeho liekopisu. Špecifická aktivita lieku ADVATE je približne 4000 – 10 000 IU/mg proteínu. Alfaoktokog (ľudský koagulačný faktor VIII (rDNA)) je čistený proteín s 2332 aminokyselinami. Je produkovaný rekombinantnou DNA technológiou v bunkách ovárií čínskeho škrečka (Chinese
hamster ovary, CHO). Pripravený bez prídavku akýchkoľvek (exogénnych) ľudských alebo zvieracích proteínov v procese bunkovej kultivácie, purifikácie alebo konečnej úpravy.
Pomocné látky so známym účinkom:
0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Prášok a rozpúšťadlo na injekčný roztok. Prášok: biely až sivobiely drobivý prášok.
Rozpúšťadlo: číry a bezfarebný roztok.
4. KLINICKÉ ÚDAJE
4.1. TERAPEUTICKÉ INDIKÁCIE
Liečba a profylaxia krvácania u pacientov s hemofíliou A (vrodený nedostatok faktora VIII). Liek
ADVATE je indikovaný vo všetkých vekových skupinách.
4.2. Dávkovanie a spôsob podávania
Liečba sa má začať pod dohľadom lekára skúseného v liečbe hemofílie a so zabezpečenou okamžitou resuscitáciou v prípade anafylaxie.
Dávkovanie
Dávka a dĺžka substitučnej terapie závisí od závažnosti nedostatku faktora VIII, od miesta a rozsahu krvácania a od klinického stavu pacienta.
Počet jednotiek faktora VIII sa vyjadruje v medzinárodných jednotkách (International Units, IU), ktoré sa vzťahujú na štandard WHO pre lieky s faktorom VIII. Aktivita faktora VIII v plazme sa vyjadruje buď percentuálne (v relácii k normálnej ľudskej plazme) alebo v IU (podľa medzinárodného štandardu pre faktor VIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora VIII zodpovedá množstvu faktora VIII v jednom ml normálnej ľudskej plazmy.
Liečba on demand (podľa potreby)
Výpočet požadovanej dávky faktora VIII sa zakladá na empirickom zistení, že 1 IU faktora VIII na kg telesnej hmotnosti zvýši aktivitu plazmatického faktora VIII o 2 IU/dl. Potrebná dávka sa stanoví
použitím nasledovného vzorca:
Požadované jednotky (IU) = telesná hmotnosť (kg) x požadovaný vzostup faktora VIII (%) x 0,5
V prípade nasledujúcich krvácavých príhod aktivita faktora VIII nemá počas zodpovedajúceho obdobia klesnúť pod danú hladinu aktivity v plazme (v % normálu alebo IU/dl). Ako návod na dávkovanie pri krvácaní alebo pri chirurgických zákrokoch možno použiť nasledovnú tabuľku 1:
Tabuľka 1 Návod na dávkovanie pri krvácaní a chirurgických zákrokoch
Stupeň krvácania/Typ chirurgického zákroku
Krvácanie
Začínajúca hemartróza, krvácanie do svalu alebo krvácanie v ústnej dutine.
Rozsiahlejšia hemartróza, krvácanie do svalu alebo hematóm.
Život ohrozujúce krvácania.
Chirurgický zákrok
Malý
Vrátane extrakcie zuba.
Veľký
Požadovaná hladina faktora VIII
(% alebo IU/dl)
20 – 40
30 – 60
60 – 100
30 – 60
80 – 100
(pred a po operácii)
Frekvencia dávok (hodiny)/ dĺžka trvania terapie (dni)
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým krvácavá príhoda, súdiac podľa bolesti, nepominie alebo kým nedôjde
k zahojeniu.
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších
ako 6 rokov) počas 3 – 4 dní alebo dlhšie až dovtedy, kým bolesť nepominie alebo kým sa neobnoví funkčnosť.
Opakujte injekcie každých 8 až 24 hodín
(6 až 12 hodín u pacientov mladších
ako 6 rokov), až dovtedy, kým nepominie stav ohrozenia života.
Každých 24 hodín (12 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým nedôjde
k zahojeniu.
Opakujte injekcie každých 8 až 24 hodín
(6 až 24 hodín u pacientov mladších
ako 6 rokov), do adekvátneho zahojenia rán, potom pokračujte v terapii najmenej ďalších 7 dní na udržanie aktivity
faktora VIII od 30 % do 60 % (IU/dl).

Dávka a frekvencia podávania sa majú v jednotlivých prípadoch prispôsobiť klinickej odpovedi.
Za určitých okolností (napr. prítomnosť nízkeho titra inhibítora) môžu byť potrebné vyššie dávky ako dávky vypočítané podľa vzorca.
V priebehu liečby sa odporúča primerané stanovovanie hladín plazmatického faktora VIII ako návod na určovanie podávanej dávky a frekvencie opakovaných injekcií. Predovšetkým v prípade veľkých chirurgických zákrokov je nevyhnutné presné sledovanie substitučnej terapie skúškami aktivity plazmatického faktora VIII. Reakcie jednotlivých pacientov na faktor VIII sa môžu
in vivo odlišovať a dosiahnuť odlišné hladiny obnovenia faktora VIII a preukázať rôzne polčasy.
Profylaxia
Na dlhodobú profylaxiu krvácania u pacientov s ťažkou hemofíliou A sú zvyčajné dávky 20 až 40 IU
faktora VIII na kg telesnej hmotnosti v intervaloch od 2 do 3 dní.
Pediatrická populácia
Dávkovanie pre liečbu on demand sa u pediatrických pacientov (0 až 18 rokov veku) nelíši od dospelých pacientov. U pacientov mladších ako 6 rokov sa na profylaktickú terapiu odporúča dávkovanie 20 až 50 IU faktora VIII na kg telesnej hmotnosti 3 až 4-krát do týždňa.
Spôsob podávania
ADVATE sa má podávať intravenóznou cestou. V prípade, že liek nepodáva zdravotnícky pracovník je nutné jeho náležité zaškolenie.
Rýchlosť podávania sa má ustáliť podľa toho, ako to pacientovi najviac vyhovuje a smie dosiahnuť
maximálne 10 ml/min.
Po rekonštitúcii je roztok číry, bezfarebný, bez cudzorodých častíc s pH medzi 6,7 až 7,3. Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3. Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na proteíny myši alebo škrečka.
4.4. Osobitné upozornenia a opatrenia pri používaní
Precitlivenosť
U ADVATE boli hlásené reakcie z precitlivenosti alergického typu vrátane anafylaxie a prejavili sa závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Liek obsahuje stopy proteínov myši a škrečka. Pacienti majú byť upozornení, že ak sa vyskytnú
príznaky precitlivenosti, odporúča sa používanie lieku okamžite prerušiť a kontaktovať svojho lekára. Pacienti majú byť informovaní o prvotných príznakoch reakcií z precitlivenosti zahŕňajúcich vyrážky, generalizovanú žihľavku, pocit tiesne na hrudníku, pískavé dýchanie, hypotenzia a anafylaxiu.
V prípade šoku má byť zavedená štandardná lekárska liečba šoku.
Inhibítory
Známou komplikáciou liečby jedincov s hemofíliou A je vznik protilátok (inhibítorov) neutralizujúcich faktor VIII. Tieto inhibítory sú zvyčajne imunoglobulíny IgG pôsobiace proti prokoagulačnej aktivite faktora VIII, ktoré sú kvantifikované v Bethesdových jednotkách (BU) na ml
plazmy použitím modifikovanej skúšky. U pacientov, u ktorých sa objavia inhibítory faktora VIII, sa
klinický stav môže prejavovať ako nedostatočná klinická odpoveď. V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu. Riziko vzniku inhibítorov koreluje s rozsahom expozície faktoru VIII, toto riziko býva najvyššie počas prvých 20 dní expozície, a tiež s inými genetickými faktormi a faktormi prostredia. V zriedkavých prípadoch môžu inhibítory vzniknúť po prvých 100 dňoch expozície.
Boli pozorované prípady opakovaného vzniku inhibítorov (nízky titer) po prechode z jedného lieku s faktorom VIII na iný u predtým liečených pacientov s viac ako 100 dňami expozície, ktorí majú
v anamnéze vznik inhibítorov. Odporúča sa preto, aby všetci pacienti po prechode z jedného lieku na iný boli pozorne sledovaní na vznik inhibítorov.
Vo všeobecnosti všetci pacienti s koagulačným faktorom VIII majú byť pomocou náležitých klinických pozorovaní a laboratórnych vyšetrení pozorne sledovaní na vznik inhibítorov. Ak sa očakávané hladiny aktivity faktora VIII v plazme nedosiahnu, alebo ak krvácanie nie je kontrolované vhodnou dávkou, má sa vykonať testovanie prítomnosti inhibítorov faktora VIII. U pacientov
s vysokými hladinami inhibítora, substitučná terapia faktorom VIII nemusí byť účinná a treba zvážiť
iné možnosti liečby. Liečba takých pacientov má byť riadená lekármi so skúsenosťami so starostlivosťou o pacientov s hemofíliou a inhibítormi faktora VIII.
Komplikácie liečby súvisiace s katétrom
Ak je potrebný centrálny venózny katéter (CVK), musí sa zvážiť riziko komplikácií súvisiacich s CVK
vrátane lokálnych infekcií, bakterémie a trombózy v mieste zavedenia katétra.
Aspekty týkajúce sa pomocného základu
Po príprave tento liek obsahuje 0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke. Má sa to vziať
do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
Dôrazne odporúčame, aby sa pri každom podávaní lieku ADVATE pacientovi, zapísali názov a číslo šarže lieku, a tak sa uchovalo prepojenie medzi pacientom a šaržou lieku.
Pediatrická populácia:
Uvedené upozornenia a opatrenia pri používaní sa týkajú detí aj dospelých.
4.5. Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s ADVATE.
4.6. Fertilita, gravidita a laktácia
Neuskutočnili sa reprodukčné štúdie s faktorom VIII na zvieratách. Vzhľadom k zriedkavému výskytu hemofílie A u žien, nie sú k dispozícii údaje týkajúce sa použitia faktora VIII počas gravidity
a laktácie. Z tohto dôvodu má byť faktor VIII používaný počas gravidity a dojčenia iba v nevyhnutných prípadoch.
4.7. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
ADVATE nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8. Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Klinické štúdie s ADVATE zahŕňali 418 účastníkov vystavených najmenej raz lieku ADVATE
hlásiacich celkovo 93 nežiaducich liekových reakcií (adverse drug reactions, ADR). ADR, ktoré
sa vyskytli s najväčšou frekvenciou, boli vznik neutralizačných protilátok faktora VIII (inhibítorov), bolesť hlavy, a horúčka.
Reakcie precitlivenosti alebo alergické reakcie (ako angioedém, pálenie a pichanie v mieste infúzie, zimnica, začervenanie kože, generalizovaná žihľavka, bolesť hlavy, vyrážky, hypotenzia, letargia, nauzea, nepokoj, tachykardia, pocit tiesne na hrudníku, mravčenie, vracanie, pískavé dýchanie)
boli pozorované zriedkavo, a v niektorých prípadoch sa z nich môže vyvinúť závažná anafylaxia
(vrátane šoku).
Môže byť pozorovaný vznik protilátok proti proteínu myši alebo škrečka so súvisiacimi reakciami precitlivenosti.
U pacientov s hemofíliou A môžu vznikať neutralizačné protilátky (inhibítory) faktora VIII. Ak dôjde k vzniku takých inhibítorov, klinický stav sa môže prejavovať ako nedostatočná klinická odpoveď.
V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu.
Tabuľ
kové zhrnutie nežiaducich reakcií
Nasledujúca tabuľka 2 uvádza frekvenciu nežiaducich liekových reakcií v klinických štúdiách
a v spontánne hlásených prípadoch. Táto tabuľka je podľa klasifikácie orgánových systémov MEDRA (SOC a preferovaných termínov).
Nežiaduce reakcie sú uvedené podľa nasledujúceho pravidla: veľmi časté (≥ 1/10), časté (≥ 1/100 až
< 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 2 Frekvencia nežiaducich liekových reakcií (ADR) v klinických štúdiách a spontánne hlásených prípadoch
MedDRA štandardná trieda orgánových systémov
Infekcie a nákazy
Poruchy krvi a lymfatického systému
Poruchy imunitného systému
Poruchy nervového systému
Nežiaduca reakcia Frekvenciaa
Chrípka Menej časté Laryngitída Menej časté Inhibícia faktora VIIIc Časté Lymfangitída Menej časté Anafylaktická reakcia Nie je známe Precitlivenosťc Nie je známe Bolesť hlavy Časté
Závrat Menej časté Porucha pamäte Menej časté Synkopa Menej časté Tremor Menej časté Migréna Menej časté Porucha chuti Menej časté
Poruchy oka Zápal oka Menej časté
Poruchy srdca a srdcovej činnosti Palpitácie Menej časté

Poruchy ciev
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Úrazy, otravy a komplikácie liečebného postupu
Hematóm Menej časté Návaly tepla Menej časté Bledosť Menej časté Dyspnoe Menej časté
Hnačka Menej časté Bolesť v hornej časti brucha Menej časté Nevoľnosť Menej časté Vracanie Menej časté Svrbenie Menej časté Vyrážka Menej časté Hyperhidróza Menej časté Žihľavka Menej časté Pyrexia Časté Periférny edém Menej časté Bolesť na hrudi Menej časté Hrudný dyskomfort Menej časté Zimnica Menej časté Nezvyčajný pocit Menej časté Hemátóm v mieste punkcie cievy Menej časté Únava Nie je známe Reakcia v mieste injekcie Nie je známe Nevoľnosť Nie je známe Zvýšený počet monocytov Menej časté
Znížená hladina koagulačného faktora VIIIb Menej časté
Znížený hematokrit Menej časté Abnormálne výsledky laboratórnych testov Menej časté Postprocedurálna komplikácia Menej časté Postprocedurálne krvácanie Menej časté Reakcia v mieste podania Menej časté
a) Vypočítané na základe celkového počtu pacientov, ktorí dostávali ADVATE (418). b) U jedného pacienta sa počas kontinuálnej infúzie ADVATE po operácii (pooperačné
dni 10 - 14) vyskytli neočakávane znížené hladiny koagulačného faktora VIII. Hemostáza bola počas tohto obdobia stále udržiavaná a ako hladina faktora VIII, tak aj hodnoty klírensu sa vrátili na dostatočné hodnoty do 15. pooperačného dňa. Skúšky inhibítora faktora VIII uskutočnené po ukončení kontinuálnej infúzie a v závere štúdie boli negatívne.
c) Nežiaduce reakcie vysvetlené v časti nižšie.
Opis vybratých nežiaducich reakciíVznik inhibítorovBol hlásený vznik inhibítorov u predtým liečených pacientov (PTP) a u predtým neliečených pacientov (PUP). Bližšie údaje nájdete v časti 5.1 (Farmakologické vlastnosti) a 4.4 (Osobitné upozornenia a opatrenia pri používaní).
Nežiaduce reakcie špecifické pre pozostatky z výrobného procesuZ 229 liečených pacientov, ktorí boli hodnotení na protilátky proti proteínu buniek ovárií čínskeho škrečka (CHO), sa u 3 dokázal štatisticky významný vzostupný trend v titroch, u 4 sa ukázali pretrvávajúce vrcholy alebo prechodné výkyvy a jeden pacient mal oboje, ale nemal žiadne klinické príznaky. Z 229 liečených pacientov, ktorí boli hodnotení na protilátky proti myším IgG, sa
u 10 dokázal štatisticky významný vzostupný trend v titroch, u 2 sa ukázali pretrvávajúce vrcholy
alebo prechodné výkyvy a jeden pacient mal oboje. Štyria z týchto pacientov hlásili jednotlivé prípady urtikárie, pruritu, vyrážky a mierne zvýšeného počtu eozinofilov v rámci opakovaných expozícií lieku v štúdii.
PrecitlivenosťReakcie alergického typu vrátane anafylaxie, ktoré sa prejavili závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Pediatrická populáciaV klinických štúdiách neboli uvedené žiadne vekovo špecifické rozdiely v nežiaducich reakciách iné ako vznik inhibítorov u predtým neliečených detských pacientov (PUP) a komplikácie súvisiace
s katétrom.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9. PredávkovanieNeboli hlásené žiadne prípady predávkovania rekombinantným koagulačným faktorom VIII.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1. Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antihemoragiká: krvný koagulačný faktor VIII. ATC kód: B02BD02. Komplex faktora VIII/von Willebrandovho faktora sa skladá z dvoch molekúl (faktor VIII
a von Willebrandov faktor) s odlišnými fyziologickými funkciami. ADVATE obsahuje rekombinantný
koagulačný faktor VIII (alfaoktokog), glykoproteín ktorý je biologicky rovnocenný s glykoproteínu faktora VIII obsiahnutom v ľudskej plazme.
Alfaoktokog je glykoproteín skladajúci sa z 2332 aminokyselín s molekulárnou hmotnosťou
približne 280 kD. Alfaoktokog sa pri podávaní infúziou hemofilickému pacientovi viaže na endogénny von Willebrandov faktor v pacientovom krvnom obehu. Aktivovaný faktor VIII pôsobí ako kofaktor pre aktivovaný faktor IX, urýchľujúci konverziu faktora X na aktivovaný faktor X. Aktivovaný
faktor X premieňa protrombín na trombín. Trombín potom premieňa fibrinogén na fibrín a môže sa vytvoriť krvná zrazenina. Hemofília A je dedičná porucha zrážania krvi viazaná na pohlavie, spôsobená zníženými hladinami aktivity faktora VIII a má za následok profúzne krvácanie do kĺbov, svalov alebo vnútorných orgánov, ktoré vzniká buď spontánne, alebo ako dôsledok úrazu alebo chirurgického zákroku. Plazmatické hladiny faktora VIII sa substitučnou liečbou zvyšujú,
čo umožňuje dočasnú úpravu nedostatku faktora VIII a úpravu sklonu ku krvácaniu.
Vznik inhibítorov
Imunogenicita ADVATE sa hodnotila u predtým liečených pacientov. Počas klinických štúdií
s ADVATE u 233 pediatrických (pediatrickí pacienti vo veku 0 až 16 rokov) a dospelých pacientov (starší ako 16 rokov), ktorým bola diagnostikovaná ťažká hemofília A (faktor VIII ≤ 1 %) a ktorí boli predtým vystavení koncentrátom faktora VIII po dobu ≥ 150 dní pre dospelých a staršie deti, a
po dobu ≥ 50 dní pre deti mladšie ako 6 rokov, sa po 26 dňoch expozície ADVATE vyvinul nízky titer inhibítora (2,4 BU v modifikovanej Bethesdovej skúške) u jedného pacienta. Nasledujúce testy na inhibítor vykonané u tohto pacienta po vyradení zo štúdie boli negatívne. V rámci všetkých štúdií bol medián expozície lieku ADVATE 97,0 expozičných dní na účastníka (rozsah 1 až 709) pre predtým liečených pacientov. Celkový výskyt vzniku inhibítorov faktora VIII (nízky alebo vysoký) bol 0,4 %
(1 z 233).
V ukončenej nekontrolovanej štúdii 060103, 16 zo 45 (35,6 %) predtým neliečených pacientov
s ťažkou hemofíliou A (faktor VIII < 1 %) a najmenej s 25 dňami expozície faktoru VIII vznikli inhibítory faktora VIII u: 7 (15,6 %) účastníkov vznikli inhibítory s vysokým titrom a u 9 (20 %) účastníkov vznikli inhibítory s nízkym titrom, 1 z nich bol tiež klasifikovaný ako prechodný inhibítor. Rizikové faktory súvisiace so vznikom inhibítorov v tejto štúdii zahŕňali iné ako kaukazské etnikum, familiárny výskyt inhibítorov a intenzívnu liečbu vysokou dávkou počas prvých 20 dní expozície.
U 20 účastníkov, ktorí nemali žiadny z týcho rizikových faktorov, nevznikli žiadne inhibítory.
Boli sústredené údaje o vyvolaní imunitnej tolerancie (ITI) u pacientov s inhibítormi. V rámci čiastkovej štúdie PNP 060103 bola zdokumentovaná liečba ITI u 11 predtým neliečených pacientov (PUP). Bola vypracovaná retrospektívna hodnotiaca schéma pre 30 pacientov s ITI (štúdia 060703)
a prebieha zhromažďovanie údajov do registra.
V štúdii 060201 boli porovnávané dve dlhodobé profylaktické liečebné schémy u 53 predtým liečených osôb: farmakokinetický riadený dávkovací režim prispôsobený individuálnym účastníkom (v rozsahu 20 až 80 IU faktora VIII na kg telesnej hmotnosti v intervaloch 72 ± 6 hodín, n=23)
so štandardným profylaktickým dávkovacím režimom (20 až 40 IU/kg každých 48 ± 6 hodín, n=30). Farmakokinetický riadený dávkovací režim (podľa osobitného vzorca) bol zacielený na udržanie minimálnych hladín (tzv. trough level) faktora VIII ≥ 1 % v intervale medzi dávkovaním 72 hodín. Údaje z tejto štúdie ukazujú, že tieto dva profylaktické dávkovacie režimy sú porovnateľné, čo sa týka redukcie miery krvácania.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom ADVATE vo všetkých podskupinách pediatrickej populácie s hemofíliou A (vrodený deficit faktora VIII) pri „indukcii imunitnej tolerancie (ITI) u pacientov s hemofíliou A (vrodený deficit
faktora VIII), u ktorých vznikli inhibítory faktora VIII“ a „liečbe a profylaxii krvácania u pacientov s hemofíliou A (vrodený deficit faktora VIII)“. (Informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2. Farmakokinetické vlastnosti
Všetky farmakokinetické štúdie s ADVATE boli vykonávané u predtým liečených pacientov s ťažkou až stredne ťažkou hemofíliou A (východiskový faktor VIII ≤ 2%). Analýza vzoriek plazmy bola vykonávaná v centrálnom laboratóriu použitím jednostupňovej skúšky zrážavosti.
Celkovo 195 pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %) poskytlo farmakokinetické (FK) parametre, ktoré boli začlenené do FK analytického súboru „per-protocol“. Kategórie týchto analýz pre dojčatá (1 mesiac do < 2 rokov veku), deti (2 až < 5 rokov veku), staršie deti (5 až < 12 rokov veku), mladistvých (12 až < 18 rokov veku) a dospelých (18 rokov veku a starší) boli použité na sumarizáciu FK parametrov, kde vek bol definovaný ako vek v dobe FK infúzie.
Tabuľka 3 Súhrn farmakokinetických parametrov ADVATE podľa vekovej skupiny pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %)
Parameter (priemer
± štandardná odchýlka)
Dojčatá
(n=5)
Deti
(n=30)
Staršie deti
(n=18)
Mladiství
(n=33)
Dospelí
(n=109)
Celková AUC (IU*h/dl) Upravené progresívne obnovenie hladiny Cmax (IU/dl na IU/kg)a
1362,1 ± 311,8 1180,0 ± 432,7 1506,6 ± 530,0 1317,1 ± 438,6 1538,5 ± 519,1
2,2 ± 0,6 1,8 ± 0,4 2,0 ± 0,5 2,1 ± 0,6 2,2 ± 0,6
Polčas (h) 9,0 ± 1,5 9,6 ± 1,7 11,8 ± 3,8 12,1 ± 3,2 12,9 ± 4,3
Maximálna plazmatická koncentrácia po infúzii (IU/dl) Priemerný rezidenčný čas (h)
Distribučný objem v ustálenom stave (dl/kg)
110,5 ± 30,2 90,8 ± 19,1 100,5 ± 25,6 107,6 ± 27,6 111,3 ± 27,1
11,0 ± 2,8 12,0 ± 2,7 15,1 ± 4,7 15,0 ± 5,0 16,2 ± 6,1
0,4 ± 0,1 0,5 ± 0,1 0,5 ± 0,2 0,6 ± 0,2 0,5 ± 0,2
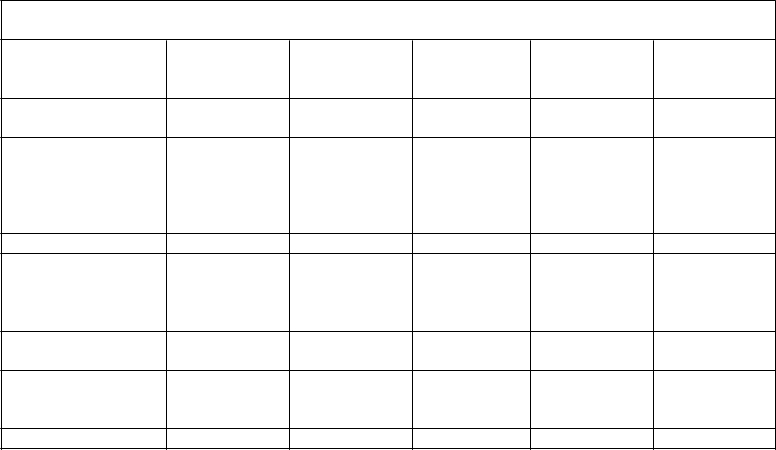
Klírens (ml/kg*h) 3,9 ± 0,9 4,8 ± 1,5 3,8 ± 1,5 4,1 ± 1,0 3,6 ± 1,2 a Vypočítané ako (Cmax – faktor VIII na začiatku liečby) delené dávkou v IU/kg, kde Cmax je maximálny nameraný faktor VIII po infúzii.
Bezpečnosť a hemostatická účinnosť lieku ADVATE v pediatrickej populácii sú podobné ako tieto parametre u dospelých pacientov. Upravené obnovenie a konečný polčas (t½) boli približne o 20% nižšie u mladších detí (mladších ako 6 rokov) ako u dospelých, čo je v súlade so známym vyšším objemom plazmy na kilogram telesnej hmotnosti u mladších pacientov.
Aktuálne nie sú k dispozícii farmakokinetické údaje o ADVATE u predtým neliečených pacientov.
5.3. Predklinické údaje o bezpečnostiPredklinické údaje získané na základe farmakologických štúdií bezpečnosti, akútnej toxikológie, toxicity po opakovanom podaní, lokálnej toxicity a genotoxicity neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1. Zoznam pomocných látokPrášok Manitol Chlorid sodný Histidín Trehalóza
Chlorid vápenatý Trometamol Polysorbát 80
Glutatión (redukovaný) Rozpúšťadlo
Sterilizovaná voda na injekciu
6.2. Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi alebo rozpúšťadlami.
6.3. Čas použiteľnosti
2 roky.
Po rekonštitúcii: z mikrobiologického hľadiska sa má liek použiť okamžite. Avšak chemická a fyzikálna stabilita počas používania bola pri teplote 25 °C preukázaná na 3 hodiny.
V rámci času použiteľnosti sa liek môže uchovávať pri izbovej teplote (až do 25 °C) počas jedného obdobia nepresahujúceho 6 mesiacov. Na balenie lieku zaznamenajte dátum konca 6-mesačného uchovávania pri izbovej teplote. Liek sa nesmie vrátiť späť do chladničky.
6.4. Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke pri teplote (2 °C – 8 °C). Neuchovávajte v mrazničke.
ADVATE s pomôckou BAXJECT II: Injekčnú liekovku s liekom uchovávajte vo vonkajšom obale na ochranu pred svetlom.
ADVATE v systéme BAXJECT III: Uzavretý blister uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5. Druh obalu a obsah balenia
Injekčná liekovka s práškom a 5 ml injekčná liekovka s rozpúšťadlom sú vyrobené zo skla typu
I a uzatvorené chlorobutylovými gumenými zátkami. Liek sa dodáva v jednej z nasledujúcich foriem:
- ADVATE s pomôckou BAXJECT II: Každé balenie obsahuje injekčnú liekovku
s práškom, 5 ml injekčnú liekovku s rozpúšťadlom a pomôcku na rekonštitúciu (BAXJECT II).
- ADVATE v systéme BAXJECT III: Každé balenie obsahuje systém BAXJECT v uzavretom blistri (injekčná liekovka s práškom a 5 ml injekčná liekovka s rozpúšťadlom sú zabudované v systéme na rekonštitúciu).
6.6. Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
ADVATE sa podáva intravenózne po rekonštitúcii lieku.
Pripravený roztok sa má skontrolovať vizuálne, či neobsahuje cudzorodé častice a či nemá zmenenú farbu.
Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc. Nepoužívajte zakalené roztoky alebo roztoky s usadeninami.
- Na podávanie je potrebné použiť injekčnú striekačku s konektorom luer-lock.
- Použite do troch hodín po príprave.
- Po príprave liek neuchovávajte v chladničke.
- Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Príprava roztoku s pomôckou BAXJECT II
- Na rekonštitúciu použite len pribalenú sterilizovanú vodu na injekciu a pomôcku na rekonštitúciu.
- Nepoužívajte, ak je pomôcka BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
- Má byť použitá aseptická technika
1. Ak je liek ešte uchovávaný v chladničke, vyberte injekčnú liekovku s práškom ADVATE
a injekčnú liekovku s rozpúšťadlom z chladničky a zohrejte ich na izbovú teplotu
(medzi 15 °C - 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Odstráňte uzáver z injekčnej liekovky s práškom a uzáver z injekčnej liekovky s rozpúšťadlom
4. Očistite zátky tampónmi napustenými alkoholom. Injekčné liekovky umiestnite na rovný čistý povrch.
5. Otvorte balenie pomôcky BaxJect II odtrhnutím papierového viečka bez toho, aby ste sa dotkli vnútrajška (Obr. a). Nevyberajte pomôcku z balenia. Nepoužívajte, ak je pomôcka
BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
6. Otočte balenie nahor a prepichnite zátku rozpúšťadla čírym plastovým bodcom. Uchopte balenie za jeho okraj a stiahnite balenie z BAXJECTu II (Obr. b). Neodstraňujte modré viečko
z pomôcky BAXJECT II.
7. Na rekonštitúciu sa má použiť len pribalená sterilizovaná voda na injekciu a pomôcka na rekonštitúciu. S BAXJECTom II pripevneným na injekčnú liekovku s rozpúšťadlom obráťte systém tak, aby bola injekčná liekovka s rozpúšťadlom navrchu. Bielym plastovým bodcom prepichnite zátku prášku ADVATE. Vákuum nasaje rozpúšťadlo do injekčnej liekovky
s práškom ADVATE (Obr. c).

8. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc.
Obr. a Obr. b Obr. cPríprava roztoku so systémom BAXJECT III- Ak viečko úplne neutesňuje blister, výrobok nepoužívajte.
1. Ak je liek ešte uchovávaný v chladničke, vyberte uzavretý blister (obsahuje injekčnú liekovku s práškom a injekčnú liekovku s rozpúšťadlom zabudované v systéme na rekonštitúciu) z chladničky a zohrejte ich na izbovú teplotu (medzi 15 °C a 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Otvorte balenie ADVATE odlepením viečka. Vyberte systém BAXJECT III z blistra.
4. Položte liek ADVATE na rovný povrch s injekčnou liekovkou s rozpúšťadlom nahor (Obr. 1).
Injekčná liekovka s rozpúšťadlom má modrý prúžok. Neodstraňujte modré viečko, až kým nedostanete pokyn v ďalšom kroku.
5. Jednou rukou pridržte liek ADVATE v systéme BAXJECT III, druhou rukou pevne pritlačte na injekčnú liekovku s rozpúšťadlom, kým systém úplne nezaklapne a rozpúšťadlo nezačne prúdiť do injekčnej liekovky ADVATE (Obr. 2). Systém nenakláňajte, kým sa prenos nedokončí.
6. Overte, že prenos rozpúšťadla je úplný. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc.
Obr. 1 Obr. 2 Obr. 3 Podávanie
PodávaniePoužite aseptickú techniku
Lieky podávané parenterálne sa pred podaním musia skontrolovať, či neobsahujú pevné čiastočky, vždy keď to roztok a obal umožní. Použitý smie byť len číry a bezfarebný roztok.
1. Odstráňte modré viečko z BAXJECTu II/BAXJECTu III.
Nenasajte vzduch do injekčnej striekačky. Pripojte injekčnú striekačku k BAXJECTu II/BAXJECTu III.
2. Prevráťte systém (injekčná liekovka s pripraveným roztokom má byť hore). Natiahnite pripravený roztok do injekčnej striekačky pomalým vytiahnutím piestu smerom dozadu.
3. Odpojte injekčnú striekačku.
4. Pripojte krídelkovú ihlu na injekčnú striekačku. Injektujte intravenózne. Roztok sa má podávať pomaly, rýchlosťou ktorá pacientovi najviac vyhovuje a nepresahuje 10 ml za minútu. Pulzová frekvencia sa má zmerať pred podaním ADVATE a počas jeho podávania. Ak dôjde
k významnému vzostupu, zníženie rýchlosti podávania alebo dočasné prerušenie podávania zvyčajne postačí na to, aby príznaky rýchlo vymizli (pozri časti 4.4 a 4.8).
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBaxter AG Industriestrasse 67
A-1221 Viedeň
Rakúsko
8. REGISTRAČNÉ ČÍSLOEU/1/03/271/004
EU/1/03/271/014
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 2. marec 2004
Dátum posledného predĺženia registrácie: 2. marec 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
ADVATE 2000 IU prášok a rozpúšťadlo na injekčný roztok.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá injekčná liekovka obsahuje 2000 IU* ľudského koagulačného faktora VIII (rDNA), alfaoktokogu**. Po rekonštitúcii ADVATE obsahuje približne 400 IU ľudského koagulačného faktora VIII (rDNA), alfaoktokogu/ml.
Účinnosť (medzinárodné jednotky, IU) sa stanovuje pomocou chromogénneho testu Európskeho liekopisu. Špecifická aktivita lieku ADVATE je približne 4000 – 10 000 IU/mg proteínu. Alfaoktokog (ľudský koagulačný faktor VIII (rDNA)) je čistený proteín s 2332 aminokyselinami. Je produkovaný rekombinantnou DNA technológiou v bunkách ovárií čínskeho škrečka (Chinese
hamster ovary, CHO). Pripravený bez prídavku akýchkoľvek (exogénnych) ľudských alebo zvieracích proteínov v procese bunkovej kultivácie, purifikácie alebo konečnej úpravy.
Pomocné látky so známym účinkom:
0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Prášok a rozpúšťadlo na injekčný roztok. Prášok: biely až sivobiely drobivý prášok.
Rozpúšťadlo: číry a bezfarebný roztok.
4. KLINICKÉ ÚDAJE
4.1. TERAPEUTICKÉ INDIKÁCIE
Liečba a profylaxia krvácania u pacientov s hemofíliou A (vrodený nedostatok faktora VIII). Liek
ADVATE je indikovaný vo všetkých vekových skupinách.
4.2. Dávkovanie a spôsob podávania
Liečba sa má začať pod dohľadom lekára skúseného v liečbe hemofílie a so zabezpečenou okamžitou resuscitáciou v prípade anafylaxie.
Dávkovanie
Dávka a dĺžka substitučnej terapie závisí od závažnosti nedostatku faktora VIII, od miesta a rozsahu krvácania a od klinického stavu pacienta.
Počet jednotiek faktora VIII sa vyjadruje v medzinárodných jednotkách (International Units, IU), ktoré sa vzťahujú na štandard WHO pre lieky s faktorom VIII. Aktivita faktora VIII v plazme sa vyjadruje buď percentuálne (v relácii k normálnej ľudskej plazme) alebo v IU (podľa medzinárodného štandardu pre faktor VIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora VIII zodpovedá množstvu faktora VIII v jednom ml normálnej ľudskej plazmy.
Liečba on demand (podľa potreby)
Výpočet požadovanej dávky faktora VIII sa zakladá na empirickom zistení, že 1 IU faktora VIII na kg telesnej hmotnosti zvýši aktivitu plazmatického faktora VIII o 2 IU/dl. Potrebná dávka sa stanoví
použitím nasledovného vzorca:
Požadované jednotky (IU) = telesná hmotnosť (kg) x požadovaný vzostup faktora VIII (%) x 0,5
V prípade nasledujúcich krvácavých príhod aktivita faktora VIII nemá počas zodpovedajúceho obdobia klesnúť pod danú hladinu aktivity v plazme (v % normálu alebo IU/dl). Ako návod na dávkovanie pri krvácaní alebo pri chirurgických zákrokoch možno použiť nasledovnú tabuľku 1:
Tabuľka 1 Návod na dávkovanie pri krvácaní a chirurgických zákrokoch
Stupeň krvácania/Typ chirurgického zákroku
Krvácanie
Začínajúca hemartróza, krvácanie do svalu alebo krvácanie v ústnej dutine.
Rozsiahlejšia hemartróza, krvácanie do svalu alebo hematóm.
Život ohrozujúce krvácania.
Chirurgický zákrok
Malý
Vrátane extrakcie zuba.
Veľký
Požadovaná hladina faktora VIII
(% alebo IU/dl)
20 – 40
30 – 60
60 – 100
30 – 60
80 – 100
(pred a po operácii)
Frekvencia dávok (hodiny)/ dĺžka trvania terapie (dni)
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým krvácavá príhoda, súdiac podľa bolesti, nepominie alebo kým nedôjde
k zahojeniu.
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších
ako 6 rokov) počas 3 – 4 dní alebo dlhšie až dovtedy, kým bolesť nepominie alebo kým sa neobnoví funkčnosť.
Opakujte injekcie každých 8 až 24 hodín
(6 až 12 hodín u pacientov mladších
ako 6 rokov), až dovtedy, kým nepominie stav ohrozenia života.
Každých 24 hodín (12 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým nedôjde
k zahojeniu.
Opakujte injekcie každých 8 až 24 hodín
(6 až 24 hodín u pacientov mladších
ako 6 rokov), do adekvátneho zahojenia rán, potom pokračujte v terapii najmenej ďalších 7 dní na udržanie aktivity
faktora VIII od 30 % do 60 % (IU/dl).

Dávka a frekvencia podávania sa majú v jednotlivých prípadoch prispôsobiť klinickej odpovedi.
Za určitých okolností (napr. prítomnosť nízkeho titra inhibítora) môžu byť potrebné vyššie dávky ako dávky vypočítané podľa vzorca.
V priebehu liečby sa odporúča primerané stanovovanie hladín plazmatického faktora VIII ako návod na určovanie podávanej dávky a frekvencie opakovaných injekcií. Predovšetkým v prípade veľkých chirurgických zákrokov je nevyhnutné presné sledovanie substitučnej terapie skúškami aktivity plazmatického faktora VIII. Reakcie jednotlivých pacientov na faktor VIII sa môžu
in vivo odlišovať a dosiahnuť odlišné hladiny obnovenia faktora VIII a preukázať rôzne polčasy.
Profylaxia
Na dlhodobú profylaxiu krvácania u pacientov s ťažkou hemofíliou A sú zvyčajné dávky 20 až 40 IU
faktora VIII na kg telesnej hmotnosti v intervaloch od 2 do 3 dní.
Pediatrická populácia
Dávkovanie pre liečbu on demand sa u pediatrických pacientov (0 až 18 rokov veku) nelíši od dospelých pacientov. U pacientov mladších ako 6 rokov sa na profylaktickú terapiu odporúča dávkovanie 20 až 50 IU faktora VIII na kg telesnej hmotnosti 3 až 4-krát do týždňa.
Spôsob podávania
ADVATE sa má podávať intravenóznou cestou. V prípade, že liek nepodáva zdravotnícky pracovník je nutné jeho náležité zaškolenie.
Rýchlosť podávania sa má ustáliť podľa toho, ako to pacientovi najviac vyhovuje a smie dosiahnuť
maximálne 10 ml/min.
Po rekonštitúcii je roztok číry, bezfarebný, bez cudzorodých častíc s pH medzi 6,7 až 7,3. Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3. Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na proteíny myši alebo škrečka.
4.4. Osobitné upozornenia a opatrenia pri používaní
Precitlivenosť
U ADVATE boli hlásené reakcie z precitlivenosti alergického typu vrátane anafylaxie a prejavili sa závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Liek obsahuje stopy proteínov myši a škrečka. Pacienti majú byť upozornení, že ak sa vyskytnú
príznaky precitlivenosti, odporúča sa používanie lieku okamžite prerušiť a kontaktovať svojho lekára. Pacienti majú byť informovaní o prvotných príznakoch reakcií z precitlivenosti zahŕňajúcich vyrážky, generalizovanú žihľavku, pocit tiesne na hrudníku, pískavé dýchanie, hypotenzia a anafylaxiu.
V prípade šoku má byť zavedená štandardná lekárska liečba šoku.
Inhibítory
Známou komplikáciou liečby jedincov s hemofíliou A je vznik protilátok (inhibítorov) neutralizujúcich faktor VIII. Tieto inhibítory sú zvyčajne imunoglobulíny IgG pôsobiace proti prokoagulačnej aktivite faktora VIII, ktoré sú kvantifikované v Bethesdových jednotkách (BU) na ml
plazmy použitím modifikovanej skúšky. U pacientov, u ktorých sa objavia inhibítory faktora VIII, sa
klinický stav môže prejavovať ako nedostatočná klinická odpoveď. V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu. Riziko vzniku inhibítorov koreluje s rozsahom expozície faktoru VIII, toto riziko býva najvyššie počas prvých 20 dní expozície, a tiež s inými genetickými faktormi a faktormi prostredia. V zriedkavých prípadoch môžu inhibítory vzniknúť po prvých 100 dňoch expozície.
Boli pozorované prípady opakovaného vzniku inhibítorov (nízky titer) po prechode z jedného lieku s faktorom VIII na iný u predtým liečených pacientov s viac ako 100 dňami expozície, ktorí majú
v anamnéze vznik inhibítorov. Odporúča sa preto, aby všetci pacienti po prechode z jedného lieku na iný boli pozorne sledovaní na vznik inhibítorov.
Vo všeobecnosti všetci pacienti s koagulačným faktorom VIII majú byť pomocou náležitých klinických pozorovaní a laboratórnych vyšetrení pozorne sledovaní na vznik inhibítorov. Ak sa očakávané hladiny aktivity faktora VIII v plazme nedosiahnu, alebo ak krvácanie nie je kontrolované vhodnou dávkou, má sa vykonať testovanie prítomnosti inhibítorov faktora VIII. U pacientov
s vysokými hladinami inhibítora, substitučná terapia faktorom VIII nemusí byť účinná a treba zvážiť
iné možnosti liečby. Liečba takých pacientov má byť riadená lekármi so skúsenosťami so starostlivosťou o pacientov s hemofíliou a inhibítormi faktora VIII.
Komplikácie liečby súvisiace s katétrom
Ak je potrebný centrálny venózny katéter (CVK), musí sa zvážiť riziko komplikácií súvisiacich s CVK
vrátane lokálnych infekcií, bakterémie a trombózy v mieste zavedenia katétra.
Aspekty týkajúce sa pomocného základu
Po príprave tento liek obsahuje 0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke. Má sa to vziať
do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
Dôrazne odporúčame, aby sa pri každom podávaní lieku ADVATE pacientovi, zapísali názov a číslo šarže lieku, a tak sa uchovalo prepojenie medzi pacientom a šaržou lieku.
Pediatrická populácia:
Uvedené upozornenia a opatrenia pri používaní sa týkajú detí aj dospelých.
4.5. Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s ADVATE.
4.6. Fertilita, gravidita a laktácia
Neuskutočnili sa reprodukčné štúdie s faktorom VIII na zvieratách. Vzhľadom k zriedkavému výskytu hemofílie A u žien, nie sú k dispozícii údaje týkajúce sa použitia faktora VIII počas gravidity
a laktácie. Z tohto dôvodu má byť faktor VIII používaný počas gravidity a dojčenia iba v nevyhnutných prípadoch.
4.7. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
ADVATE nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8. Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Klinické štúdie s ADVATE zahŕňali 418 účastníkov vystavených najmenej raz lieku ADVATE
hlásiacich celkovo 93 nežiaducich liekových reakcií (adverse drug reactions, ADR). ADR, ktoré
sa vyskytli s najväčšou frekvenciou, boli vznik neutralizačných protilátok faktora VIII (inhibítorov), bolesť hlavy, a horúčka.
Reakcie precitlivenosti alebo alergické reakcie (ako angioedém, pálenie a pichanie v mieste infúzie, zimnica, začervenanie kože, generalizovaná žihľavka, bolesť hlavy, vyrážky, hypotenzia, letargia, nauzea, nepokoj, tachykardia, pocit tiesne na hrudníku, mravčenie, vracanie, pískavé dýchanie)
boli pozorované zriedkavo, a v niektorých prípadoch sa z nich môže vyvinúť závažná anafylaxia
(vrátane šoku).
Môže byť pozorovaný vznik protilátok proti proteínu myši alebo škrečka so súvisiacimi reakciami precitlivenosti.
U pacientov s hemofíliou A môžu vznikať neutralizačné protilátky (inhibítory) faktora VIII. Ak dôjde k vzniku takých inhibítorov, klinický stav sa môže prejavovať ako nedostatočná klinická odpoveď.
V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu.
Tabuľ
kové zhrnutie nežiaducich reakcií
Nasledujúca tabuľka 2 uvádza frekvenciu nežiaducich liekových reakcií v klinických štúdiách
a v spontánne hlásených prípadoch. Táto tabuľka je podľa klasifikácie orgánových systémov MEDRA (SOC a preferovaných termínov).
Nežiaduce reakcie sú uvedené podľa nasledujúceho pravidla: veľmi časté (≥ 1/10), časté (≥ 1/100 až
< 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 2 Frekvencia nežiaducich liekových reakcií (ADR) v klinických štúdiách a spontánne hlásených
prípadoch
MedDRA štandardná trieda a
orgánových systémov Nežiaduca reakcia Frekvencia
Infekcie a nákazy
Poruchy krvi a lymfatického systému
Poruchy imunitného systému
Poruchy nervového systému
Chrípka Menej časté Laryngitída Menej časté Inhibícia faktora VIIIc Časté Lymfangitída Menej časté Anafylaktická reakcia Nie je známe Precitlivenosťc Nie je známe Bolesť hlavy Časté
Závrat Menej časté Porucha pamäte Menej časté Synkopa Menej časté Tremor Menej časté Migréna Menej časté Porucha chuti Menej časté
Poruchy oka Zápal oka Menej časté
Poruchy srdca a srdcovej činnosti Palpitácie Menej časté

Poruchy ciev
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Úrazy, otravy a komplikácie liečebného postupu
Hematóm Menej časté Návaly tepla Menej časté Bledosť Menej časté Dyspnoe Menej časté
Hnačka Menej časté Bolesť v hornej časti brucha Menej časté Nevoľnosť Menej časté Vracanie Menej časté Svrbenie Menej časté Vyrážka Menej časté Hyperhidróza Menej časté Žihľavka Menej časté Pyrexia Časté Periférny edém Menej časté Bolesť na hrudi Menej časté Hrudný dyskomfort Menej časté Zimnica Menej časté Nezvyčajný pocit Menej časté Hemátóm v mieste punkcie cievy Menej časté Únava Nie je známe Reakcia v mieste injekcie Nie je známe Nevoľnosť Nie je známe Zvýšený počet monocytov Menej časté
Znížená hladina koagulačného faktora VIIIb Menej časté
Znížený hematokrit Menej časté Abnormálne výsledky laboratórnych testov Menej časté Postprocedurálna komplikácia Menej časté Postprocedurálne krvácanie Menej časté Reakcia v mieste podania Menej časté
a) Vypočítané na základe celkového počtu pacientov, ktorí dostávali ADVATE (418). b) U jedného pacienta sa počas kontinuálnej infúzie ADVATE po operácii (pooperačné
dni 10 - 14) vyskytli neočakávane znížené hladiny koagulačného faktora VIII. Hemostáza bola počas tohto obdobia stále udržiavaná a ako hladina faktora VIII, tak aj hodnoty klírensu sa vrátili na dostatočné hodnoty do 15. pooperačného dňa. Skúšky inhibítora faktora VIII uskutočnené po ukončení kontinuálnej infúzie a v závere štúdie boli negatívne.
c) Nežiaduce reakcie vysvetlené v časti nižšie.
Opis vybratých nežiaducich reakciíVznik inhibítorovBol hlásený vznik inhibítorov u predtým liečených pacientov (PTP) a u predtým neliečených pacientov (PUP). Bližšie údaje nájdete v časti 5.1 (Farmakologické vlastnosti) a 4.4 (Osobitné upozornenia a opatrenia pri používaní).
Nežiaduce reakcie špecifické pre pozostatky z výrobného procesuZ 229 liečených pacientov, ktorí boli hodnotení na protilátky proti proteínu buniek ovárií čínskeho škrečka (CHO), sa u 3 dokázal štatisticky významný vzostupný trend v titroch, u 4 sa ukázali pretrvávajúce vrcholy alebo prechodné výkyvy a jeden pacient mal oboje, ale nemal žiadne klinické príznaky. Z 229 liečených pacientov, ktorí boli hodnotení na protilátky proti myším IgG, sa
u 10 dokázal štatisticky významný vzostupný trend v titroch, u 2 sa ukázali pretrvávajúce vrcholy
alebo prechodné výkyvy a jeden pacient mal oboje. Štyria z týchto pacientov hlásili jednotlivé prípady urtikárie, pruritu, vyrážky a mierne zvýšeného počtu eozinofilov v rámci opakovaných expozícií lieku v štúdii.
PrecitlivenosťReakcie alergického typu vrátane anafylaxie, ktoré sa prejavili závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Pediatrická populáciaV klinických štúdiách neboli uvedené žiadne vekovo špecifické rozdiely v nežiaducich reakciách iné ako vznik inhibítorov u predtým neliečených detských pacientov (PUP) a komplikácie súvisiace
s katétrom.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9. PredávkovanieNeboli hlásené žiadne prípady predávkovania rekombinantným koagulačným faktorom VIII.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1. Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antihemoragiká: krvný koagulačný faktor VIII. ATC kód: B02BD02. Komplex faktora VIII/von Willebrandovho faktora sa skladá z dvoch molekúl (faktor VIII
a von Willebrandov faktor) s odlišnými fyziologickými funkciami. ADVATE obsahuje rekombinantný
koagulačný faktor VIII (alfaoktokog), glykoproteín ktorý je biologicky rovnocenný s glykoproteínu faktora VIII obsiahnutom v ľudskej plazme.
Alfaoktokog je glykoproteín skladajúci sa z 2332 aminokyselín s molekulárnou hmotnosťou
približne 280 kD. Alfaoktokog sa pri podávaní infúziou hemofilickému pacientovi viaže na endogénny von Willebrandov faktor v pacientovom krvnom obehu. Aktivovaný faktor VIII pôsobí ako kofaktor pre aktivovaný faktor IX, urýchľujúci konverziu faktora X na aktivovaný faktor X. Aktivovaný
faktor X premieňa protrombín na trombín. Trombín potom premieňa fibrinogén na fibrín a môže sa vytvoriť krvná zrazenina. Hemofília A je dedičná porucha zrážania krvi viazaná na pohlavie, spôsobená zníženými hladinami aktivity faktora VIII a má za následok profúzne krvácanie do kĺbov, svalov alebo vnútorných orgánov, ktoré vzniká buď spontánne, alebo ako dôsledok úrazu alebo chirurgického zákroku. Plazmatické hladiny faktora VIII sa substitučnou liečbou zvyšujú,
čo umožňuje dočasnú úpravu nedostatku faktora VIII a úpravu sklonu ku krvácaniu.
Vznik inhibítorov
Imunogenicita ADVATE sa hodnotila u predtým liečených pacientov. Počas klinických štúdií
s ADVATE u 233 pediatrických (pediatrickí pacienti vo veku 0 až 16 rokov) a dospelých pacientov (starší ako 16 rokov), ktorým bola diagnostikovaná ťažká hemofília A (faktor VIII ≤ 1 %) a ktorí boli predtým vystavení koncentrátom faktora VIII po dobu ≥ 150 dní pre dospelých a staršie deti, a
po dobu ≥ 50 dní pre deti mladšie ako 6 rokov, sa po 26 dňoch expozície ADVATE vyvinul nízky titer inhibítora (2,4 BU v modifikovanej Bethesdovej skúške) u jedného pacienta. Nasledujúce testy na inhibítor vykonané u tohto pacienta po vyradení zo štúdie boli negatívne. V rámci všetkých štúdií bol medián expozície lieku ADVATE 97,0 expozičných dní na účastníka (rozsah 1 až 709) pre predtým liečených pacientov. Celkový výskyt vzniku inhibítorov faktora VIII (nízky alebo vysoký) bol 0,4 %
(1 z 233).
V ukončenej nekontrolovanej štúdii 060103, 16 zo 45 (35,6 %) predtým neliečených pacientov
s ťažkou hemofíliou A (faktor VIII < 1 %) a najmenej s 25 dňami expozície faktoru VIII vznikli inhibítory faktora VIII u: 7 (15,6 %) účastníkov vznikli inhibítory s vysokým titrom a u 9 (20 %) účastníkov vznikli inhibítory s nízkym titrom, 1 z nich bol tiež klasifikovaný ako prechodný inhibítor. Rizikové faktory súvisiace so vznikom inhibítorov v tejto štúdii zahŕňali iné ako kaukazské etnikum, familiárny výskyt inhibítorov a intenzívnu liečbu vysokou dávkou počas prvých 20 dní expozície.
U 20 účastníkov, ktorí nemali žiadny z týcho rizikových faktorov, nevznikli žiadne inhibítory.
Boli sústredené údaje o vyvolaní imunitnej tolerancie (ITI) u pacientov s inhibítormi. V rámci čiastkovej štúdie PNP 060103 bola zdokumentovaná liečba ITI u 11 predtým neliečených pacientov (PUP). Bola vypracovaná retrospektívna hodnotiaca schéma pre 30 pacientov s ITI (štúdia 060703)
a prebieha zhromažďovanie údajov do registra.
V štúdii 060201 boli porovnávané dve dlhodobé profylaktické liečebné schémy u 53 predtým liečených osôb: farmakokinetický riadený dávkovací režim prispôsobený individuálnym účastníkom (v rozsahu 20 až 80 IU faktora VIII na kg telesnej hmotnosti v intervaloch 72 ± 6 hodín, n=23)
so štandardným profylaktickým dávkovacím režimom (20 až 40 IU/kg každých 48 ± 6 hodín, n=30). Farmakokinetický riadený dávkovací režim (podľa osobitného vzorca) bol zacielený na udržanie minimálnych hladín (tzv. trough level) faktora VIII ≥ 1 % v intervale medzi dávkovaním 72 hodín. Údaje z tejto štúdie ukazujú, že tieto dva profylaktické dávkovacie režimy sú porovnateľné, čo sa týka redukcie miery krvácania.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom ADVATE vo všetkých podskupinách pediatrickej populácie s hemofíliou A (vrodený deficit faktora VIII) pri „indukcii imunitnej tolerancie (ITI) u pacientov s hemofíliou A (vrodený deficit
faktora VIII), u ktorých vznikli inhibítory faktora VIII“ a „liečbe a profylaxii krvácania u pacientov s hemofíliou A (vrodený deficit faktora VIII)“. (Informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2. Farmakokinetické vlastnosti
Všetky farmakokinetické štúdie s ADVATE boli vykonávané u predtým liečených pacientov s ťažkou až stredne ťažkou hemofíliou A (východiskový faktor VIII ≤ 2%). Analýza vzoriek plazmy bola vykonávaná v centrálnom laboratóriu použitím jednostupňovej skúšky zrážavosti.
Celkovo 195 pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %) poskytlo farmakokinetické (FK) parametre, ktoré boli začlenené do FK analytického súboru „per-protocol“. Kategórie týchto analýz pre dojčatá (1 mesiac do < 2 rokov veku), deti (2 až < 5 rokov veku), staršie deti (5 až < 12 rokov veku), mladistvých (12 až < 18 rokov veku) a dospelých (18 rokov veku a starší) boli použité na sumarizáciu FK parametrov, kde vek bol definovaný ako vek v dobe FK infúzie.
Tabuľka 3 Súhrn farmakokinetických parametrov ADVATE podľa vekovej skupiny pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %)
Parameter (priemer
± štandardná odchýlka)
Dojčatá
(n=5)
Deti
(n=30)
Staršie deti
(n=18)
Mladiství
(n=33)
Dospelí
(n=109)
Celková AUC (IU*h/dl) Upravené progresívne obnovenie hladiny Cmax (IU/dl na IU/kg)a
1362,1 ± 311,8 1180,0 ± 432,7 1506,6 ± 530,0 1317,1 ± 438,6 1538,5 ± 519,1
2,2 ± 0,6 1,8 ± 0,4 2,0 ± 0,5 2,1 ± 0,6 2,2 ± 0,6
Polčas (h) 9,0 ± 1,5 9,6 ± 1,7 11,8 ± 3,8 12,1 ± 3,2 12,9 ± 4,3
Maximálna plazmatická koncentrácia po infúzii (IU/dl) Priemerný rezidenčný čas (h)
Distribučný objem v ustálenom stave (dl/kg)
110,5 ± 30,2 90,8 ± 19,1 100,5 ± 25,6 107,6 ± 27,6 111,3 ± 27,1
11,0 ± 2,8 12,0 ± 2,7 15,1 ± 4,7 15,0 ± 5,0 16,2 ± 6,1
0,4 ± 0,1 0,5 ± 0,1 0,5 ± 0,2 0,6 ± 0,2 0,5 ± 0,2

Klírens (ml/kg*h) 3,9 ± 0,9 4,8 ± 1,5 3,8 ± 1,5 4,1 ± 1,0 3,6 ± 1,2 a Vypočítané ako (Cmax – faktor VIII na začiatku liečby) delené dávkou v IU/kg, kde Cmax je maximálny nameraný faktor VIII po infúzii.
Bezpečnosť a hemostatická účinnosť lieku ADVATE v pediatrickej populácii sú podobné ako tieto parametre u dospelých pacientov. Upravené obnovenie a konečný polčas (t½) boli približne o 20% nižšie u mladších detí (mladších ako 6 rokov) ako u dospelých, čo je v súlade so známym vyšším objemom plazmy na kilogram telesnej hmotnosti u mladších pacientov.
Aktuálne nie sú k dispozícii farmakokinetické údaje o ADVATE u predtým neliečených pacientov.
5.3. Predklinické údaje o bezpečnostiPredklinické údaje získané na základe farmakologických štúdií bezpečnosti, akútnej toxikológie, toxicity po opakovanom podaní, lokálnej toxicity a genotoxicity neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1. Zoznam pomocných látokPrášok Manitol Chlorid sodný Histidín Trehalóza
Chlorid vápenatý Trometamol Polysorbát 80
Glutatión (redukovaný) Rozpúšťadlo
Sterilizovaná voda na injekciu
6.2. Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi alebo rozpúšťadlami.
6.3. Čas použiteľnosti
2 roky.
Po rekonštitúcii: z mikrobiologického hľadiska sa má liek použiť okamžite. Avšak chemická a fyzikálna stabilita počas používania bola pri teplote 25 °C preukázaná na 3 hodiny.
V rámci času použiteľnosti sa liek môže uchovávať pri izbovej teplote (až do 25 °C) počas jedného obdobia nepresahujúceho 6 mesiacov. Na balenie lieku zaznamenajte dátum konca 6-mesačného uchovávania pri izbovej teplote. Liek sa nesmie vrátiť späť do chladničky.
6.4. Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke pri teplote (2 °C – 8 °C). Neuchovávajte v mrazničke.
ADVATE s pomôckou BAXJECT II: Injekčnú liekovku s liekom uchovávajte vo vonkajšom obale na ochranu pred svetlom.
ADVATE v systéme BAXJECT III: Uzavretý blister uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5. Druh obalu a obsah balenia
Injekčná liekovka s práškom a 5 ml injekčná liekovka s rozpúšťadlom sú vyrobené zo skla typu
I a uzatvorené chlorobutylovými gumenými zátkami. Liek sa dodáva v jednej z nasledujúcich foriem:
- ADVATE s pomôckou BAXJECT II: Každé balenie obsahuje injekčnú liekovku
s práškom, 5 ml injekčnú liekovku s rozpúšťadlom a pomôcku na rekonštitúciu (BAXJECT II).
- ADVATE v systéme BAXJECT III: Každé balenie obsahuje systém BAXJECT v uzavretom blistri (injekčná liekovka s práškom a 5 ml injekčná liekovka s rozpúšťadlom sú zabudované v systéme na rekonštitúciu).
6.6. Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
ADVATE sa podáva intravenózne po rekonštitúcii lieku.
Pripravený roztok sa má skontrolovať vizuálne, či neobsahuje cudzorodé častice a či nemá zmenenú farbu.
Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc. Nepoužívajte zakalené roztoky alebo roztoky s usadeninami.
- Na podávanie je potrebné použiť injekčnú striekačku s konektorom luer-lock.
- Použite do troch hodín po príprave.
- Po príprave liek neuchovávajte v chladničke.
- Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Príprava roztoku s pomôckou BAXJECT II
- Na rekonštitúciu použite len pribalenú sterilizovanú vodu na injekciu a pomôcku na rekonštitúciu.
- Nepoužívajte, ak je pomôcka BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
- Má byť použitá aseptická technika
1. Ak je liek ešte uchovávaný v chladničke, vyberte injekčnú liekovku s práškom ADVATE
a injekčnú liekovku s rozpúšťadlom z chladničky a zohrejte ich na izbovú teplotu
(medzi 15 °C - 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Odstráňte uzáver z injekčnej liekovky s práškom a uzáver z injekčnej liekovky s rozpúšťadlom
4. Očistite zátky tampónmi napustenými alkoholom. Injekčné liekovky umiestnite na rovný čistý povrch.
5. Otvorte balenie pomôcky BaxJect II odtrhnutím papierového viečka bez toho, aby ste sa dotkli vnútrajška (Obr. a). Nevyberajte pomôcku z balenia. Nepoužívajte, ak je pomôcka
BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
6. Otočte balenie nahor a prepichnite zátku rozpúšťadla čírym plastovým bodcom. Uchopte balenie za jeho okraj a stiahnite balenie z BAXJECTu II (Obr. b). Neodstraňujte modré viečko
z pomôcky BAXJECT II.
7. Na rekonštitúciu sa má použiť len pribalená sterilizovaná voda na injekciu a pomôcka na rekonštitúciu. S BAXJECTom II pripevneným na injekčnú liekovku s rozpúšťadlom obráťte systém tak, aby bola injekčná liekovka s rozpúšťadlom navrchu. Bielym plastovým bodcom prepichnite zátku prášku ADVATE. Vákuum nasaje rozpúšťadlo do injekčnej liekovky
s práškom ADVATE (Obr. c).

8. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc.
Obr. a Obr. b Obr. cPríprava roztoku so systémom BAXJECT III- Ak viečko úplne neutesňuje blister, výrobok nepoužívajte.
1. Ak je liek ešte uchovávaný v chladničke, vyberte uzavretý blister (obsahuje injekčnú liekovku s práškom a injekčnú liekovku s rozpúšťadlom zabudované v systéme na rekonštitúciu) z chladničky a zohrejte ich na izbovú teplotu (medzi 15 °C a 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Otvorte balenie ADVATE odlepením viečka. Vyberte systém BAXJECT III z blistra.
4. Položte liek ADVATE na rovný povrch s injekčnou liekovkou s rozpúšťadlom nahor (Obr. 1).
Injekčná liekovka s rozpúšťadlom má modrý prúžok. Neodstraňujte modré viečko, až kým nedostanete pokyn v ďalšom kroku.
5. Jednou rukou pridržte liek ADVATE v systéme BAXJECT III, druhou rukou pevne pritlačte na injekčnú liekovku s rozpúšťadlom, kým systém úplne nezaklapne a rozpúšťadlo nezačne prúdiť do injekčnej liekovky ADVATE (Obr. 2). Systém nenakláňajte, kým sa prenos nedokončí.
6. Overte, že prenos rozpúšťadla je úplný. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc.
Obr. 1 Obr. 2 Obr. 3 Podávanie
PodávaniePoužite aseptickú techniku
Lieky podávané parenterálne sa pred podaním musia skontrolovať, či neobsahujú pevné čiastočky, vždy keď to roztok a obal umožní. Použitý smie byť len číry a bezfarebný roztok.
1. Odstráňte modré viečko z BAXJECTu II/BAXJECTu III.
Nenasajte vzduch do injekčnej striekačky. Pripojte injekčnú striekačku k BAXJECTu II/BAXJECTu III.
2. Prevráťte systém (injekčná liekovka s pripraveným roztokom má byť hore). Natiahnite pripravený roztok do injekčnej striekačky pomalým vytiahnutím piestu smerom dozadu.
3. Odpojte injekčnú striekačku.
4. Pripojte krídelkovú ihlu na injekčnú striekačku. Injektujte intravenózne. Roztok sa má podávať pomaly, rýchlosťou ktorá pacientovi najviac vyhovuje a nepresahuje 10 ml za minútu. Pulzová frekvencia sa má zmerať pred podaním ADVATE a počas jeho podávania. Ak dôjde
k významnému vzostupu, zníženie rýchlosti podávania alebo dočasné prerušenie podávania zvyčajne postačí na to, aby príznaky rýchlo vymizli (pozri časti 4.4 a 4.8).
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBaxter AG Industriestrasse 67
A-1221 Viedeň
Rakúsko
8. REGISTRAČNÉ ČÍSLOEU/1/03/271/005
EU/1/03/271/015
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 2. marec 2004
Dátum posledného predĺženia registrácie: 2. marec 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
ADVATE 3000 IU prášok a rozpúšťadlo na injekčný roztok.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá injekčná liekovka obsahuje 3000 IU* ľudského koagulačného faktora VIII (rDNA), alfaoktokogu**. Po rekonštitúcii ADVATE obsahuje približne 600 IU ľudského koagulačného faktora VIII (rDNA), alfaoktokogu/ml.
Účinnosť (medzinárodné jednotky, IU) sa stanovuje pomocou chromogénneho testu Európskeho liekopisu. Špecifická aktivita lieku ADVATE je približne 4000 – 10 000 IU/mg proteínu. Alfaoktokog (ľudský koagulačný faktor VIII (rDNA)) je čistený proteín s 2332 aminokyselinami. Je produkovaný rekombinantnou DNA technológiou v bunkách ovárií čínskeho škrečka (Chinese
hamster ovary, CHO). Pripravený bez prídavku akýchkoľvek (exogénnych) ľudských alebo zvieracích proteínov v procese bunkovej kultivácie, purifikácie alebo konečnej úpravy.
Pomocné látky so známym účinkom:
0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Prášok a rozpúšťadlo na injekčný roztok. Prášok: biely až sivobiely drobivý prášok.
Rozpúšťadlo: číry a bezfarebný roztok.
4. KLINICKÉ ÚDAJE
4.1. TERAPEUTICKÉ INDIKÁCIE
Liečba a profylaxia krvácania u pacientov s hemofíliou A (vrodený nedostatok faktora VIII). Liek
ADVATE je indikovaný vo všetkých vekových skupinách.
4.2. Dávkovanie a spôsob podávania
Liečba sa má začať pod dohľadom lekára skúseného v liečbe hemofílie a so zabezpečenou okamžitou resuscitáciou v prípade anafylaxie.
Dávkovanie
Dávka a dĺžka substitučnej terapie závisí od závažnosti nedostatku faktora VIII, od miesta a rozsahu krvácania a od klinického stavu pacienta.
Počet jednotiek faktora VIII sa vyjadruje v medzinárodných jednotkách (International Units, IU), ktoré sa vzťahujú na štandard WHO pre lieky s faktorom VIII. Aktivita faktora VIII v plazme sa vyjadruje buď percentuálne (v relácii k normálnej ľudskej plazme) alebo v IU (podľa medzinárodného štandardu pre faktor VIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora VIII zodpovedá množstvu faktora VIII v jednom ml normálnej ľudskej plazmy.
Liečba on demand (podľa potreby)
Výpočet požadovanej dávky faktora VIII sa zakladá na empirickom zistení, že 1 IU faktora VIII na kg telesnej hmotnosti zvýši aktivitu plazmatického faktora VIII o 2 IU/dl. Potrebná dávka sa stanoví
použitím nasledovného vzorca:
Požadované jednotky (IU) = telesná hmotnosť (kg) x požadovaný vzostup faktora VIII (%) x 0,5
V prípade nasledujúcich krvácavých príhod aktivita faktora VIII nemá počas zodpovedajúceho obdobia klesnúť pod danú hladinu aktivity v plazme (v % normálu alebo IU/dl). Ako návod na dávkovanie pri krvácaní alebo pri chirurgických zákrokoch možno použiť nasledovnú tabuľku 1:
Tabuľka 1 Návod na dávkovanie pri krvácaní a chirurgických zákrokoch
Stupeň krvácania/Typ chirurgického zákroku Krvácanie
Začínajúca hemartróza, krvácanie do svalu alebo krvácanie v ústnej dutine.
Rozsiahlejšia hemartróza, krvácanie do svalu alebo hematóm.
Život ohrozujúce krvácania.
Chirurgický zákrok
Malý
Vrátane extrakcie zuba.
Veľký
Požadovaná hladina
faktora VIII (% alebo IU/dl)
20 – 40
30 – 60
60 – 100
30 – 60
80 – 100
(pred a po operácii)
Frekvencia dávok (hodiny)/ dĺžka trvania terapie (dni)
Opakujte injekcie
každých 12 až 24 hodín (8 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým krvácavá
príhoda, súdiac podľa bolesti, nepominie alebo kým nedôjde k zahojeniu.
Opakujte injekcie
každých 12 až 24 hodín (8 až 24 hodín u pacientov mladších ako 6 rokov) počas 3 – 4 dní alebo dlhšie až dovtedy, kým bolesť nepominie alebo kým sa neobnoví funkčnosť.
Opakujte injekcie
každých 8 až 24 hodín (6 až 12 hodín u pacientov mladších ako 6 rokov), až dovtedy, kým nepominie stav ohrozenia života.
Každých 24 hodín (12 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým nedôjde
k zahojeniu.
Opakujte injekcie
každých 8 až 24 hodín (6 až 24 hodín
u pacientov mladších ako 6 rokov), do adekvátneho zahojenia rán, potom pokračujte v terapii najmenej
ďalších 7 dní na udržanie aktivity faktora VIII od 30 % do 60 % (IU/dl).
Dávka a frekvencia podávania sa majú v jednotlivých prípadoch prispôsobiť klinickej odpovedi.
Za určitých okolností (napr. prítomnosť nízkeho titra inhibítora) môžu byť potrebné vyššie dávky ako dávky vypočítané podľa vzorca.
V priebehu liečby sa odporúča primerané stanovovanie hladín plazmatického faktora VIII ako návod na určovanie podávanej dávky a frekvencie opakovaných injekcií. Predovšetkým v prípade veľkých chirurgických zákrokov je nevyhnutné presné sledovanie substitučnej terapie skúškami aktivity plazmatického faktora VIII. Reakcie jednotlivých pacientov na faktor VIII sa môžu in vivo odlišovať a dosiahnuť odlišné hladiny obnovenia faktora VIII a preukázať rôzne polčasy.
Profylaxia
Na dlhodobú profylaxiu krvácania u pacientov s ťažkou hemofíliou A sú zvyčajné dávky 20 až 40 IU
faktora VIII na kg telesnej hmotnosti v intervaloch od 2 do 3 dní.
Pediatrická populácia
Dávkovanie pre liečbu on demand sa u pediatrických pacientov (0 až 18 rokov veku) nelíši od dospelých pacientov. U pacientov mladších ako 6 rokov sa na profylaktickú terapiu odporúča dávkovanie 20 až 50 IU faktora VIII na kg telesnej hmotnosti 3 až 4-krát do týždňa.
Spôsob podávania
ADVATE sa má podávať intravenóznou cestou. V prípade, že liek nepodáva zdravotnícky pracovník je nutné jeho náležité zaškolenie.
Rýchlosť podávania sa má ustáliť podľa toho, ako to pacientovi najviac vyhovuje a smie dosiahnuť
maximálne 10 ml/min.
Po rekonštitúcii je roztok číry, bezfarebný, bez cudzorodých častíc s pH medzi 6,7 až 7,3. Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3. Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na proteíny myši alebo škrečka.
4.4. Osobitné upozornenia a opatrenia pri používaní
Precitlivenosť
U ADVATE boli hlásené reakcie z precitlivenosti alergického typu vrátane anafylaxie a prejavili sa závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Liek obsahuje stopy proteínov myši a škrečka. Pacienti majú byť upozornení, že ak sa vyskytnú
príznaky precitlivenosti, odporúča sa používanie lieku okamžite prerušiť a kontaktovať svojho lekára. Pacienti majú byť informovaní o prvotných príznakoch reakcií z precitlivenosti zahŕňajúcich vyrážky, generalizovanú žihľavku, pocit tiesne na hrudníku, pískavé dýchanie, hypotenzia a anafylaxiu.
V prípade šoku má byť zavedená štandardná lekárska liečba šoku.
Inhibítory
Známou komplikáciou liečby jedincov s hemofíliou A je vznik protilátok (inhibítorov) neutralizujúcich faktor VIII. Tieto inhibítory sú zvyčajne imunoglobulíny IgG pôsobiace proti prokoagulačnej aktivite faktora VIII, ktoré sú kvantifikované v Bethesdových jednotkách (BU) na ml
plazmy použitím modifikovanej skúšky. U pacientov, u ktorých sa objavia inhibítory faktora VIII, sa
klinický stav môže prejavovať ako nedostatočná klinická odpoveď. V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu. Riziko vzniku inhibítorov koreluje s rozsahom expozície faktoru VIII, toto riziko býva najvyššie počas prvých 20 dní expozície, a tiež s inými genetickými faktormi a faktormi prostredia. V zriedkavých prípadoch môžu inhibítory vzniknúť po prvých 100 dňoch expozície.
Boli pozorované prípady opakovaného vzniku inhibítorov (nízky titer) po prechode z jedného lieku s faktorom VIII na iný u predtým liečených pacientov s viac ako 100 dňami expozície, ktorí majú
v anamnéze vznik inhibítorov. Odporúča sa preto, aby všetci pacienti po prechode z jedného lieku na iný boli pozorne sledovaní na vznik inhibítorov.
Vo všeobecnosti všetci pacienti s koagulačným faktorom VIII majú byť pomocou náležitých klinických pozorovaní a laboratórnych vyšetrení pozorne sledovaní na vznik inhibítorov. Ak sa očakávané hladiny aktivity faktora VIII v plazme nedosiahnu, alebo ak krvácanie nie je kontrolované vhodnou dávkou, má sa vykonať testovanie prítomnosti inhibítorov faktora VIII. U pacientov
s vysokými hladinami inhibítora, substitučná terapia faktorom VIII nemusí byť účinná a treba zvážiť iné možnosti liečby. Liečba takých pacientov má byť riadená lekármi so skúsenosťami so starostlivosťou o pacientov s hemofíliou a inhibítormi faktora VIII.
Komplikácie liečby súvisiace s katétrom
Ak je potrebný centrálny venózny katéter (CVK), musí sa zvážiť riziko komplikácií súvisiacich s CVK
vrátane lokálnych infekcií, bakterémie a trombózy v mieste zavedenia katétra.
Aspekty týkajúce sa pomocného základu
Po príprave tento liek obsahuje 0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke. Má sa to vziať
do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
Dôrazne odporúčame, aby sa pri každom podávaní lieku ADVATE pacientovi, zapísali názov a číslo šarže lieku, a tak sa uchovalo prepojenie medzi pacientom a šaržou lieku.
Pediatrická populácia:
Uvedené upozornenia a opatrenia pri používaní sa týkajú detí aj dospelých.
4.5. Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s ADVATE.
4.6. Fertilita, gravidita a laktácia
Neuskutočnili sa reprodukčné štúdie s faktorom VIII na zvieratách. Vzhľadom k zriedkavému výskytu hemofílie A u žien, nie sú k dispozícii údaje týkajúce sa použitia faktora VIII počas gravidity a laktácie. Z tohto dôvodu má byť faktor VIII používaný počas gravidity a dojčenia iba v nevyhnutných prípadoch.
4.7. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
ADVATE nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8. Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Klinické štúdie s ADVATE zahŕňali 418 účastníkov vystavených najmenej raz lieku ADVATE
hlásiacich celkovo 93 nežiaducich liekových reakcií (adverse drug reactions, ADR). ADR, ktoré
sa vyskytli s najväčšou frekvenciou, boli vznik neutralizačných protilátok faktora VIII (inhibítorov), bolesť hlavy, a horúčka.
Reakcie precitlivenosti alebo alergické reakcie (ako angioedém, pálenie a pichanie v mieste infúzie, zimnica, začervenanie kože, generalizovaná žihľavka, bolesť hlavy, vyrážky, hypotenzia, letargia, nauzea, nepokoj, tachykardia, pocit tiesne na hrudníku, mravčenie, vracanie, pískavé dýchanie)
boli pozorované zriedkavo, a v niektorých prípadoch sa z nich môže vyvinúť závažná anafylaxia
(vrátane šoku).
Môže byť pozorovaný vznik protilátok proti proteínu myši alebo škrečka so súvisiacimi reakciami precitlivenosti.
U pacientov s hemofíliou A môžu vznikať neutralizačné protilátky (inhibítory) faktora VIII. Ak dôjde k vzniku takých inhibítorov, klinický stav sa môže prejavovať ako nedostatočná klinická odpoveď.
V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu.
Tabuľkové zhrnutie nežiaducich reakcií
Nasledujúca tabuľka 2 uvádza frekvenciu nežiaducich liekových reakcií v klinických štúdiách
a v spontánne hlásených prípadoch. Táto tabuľka je podľa klasifikácie orgánových systémov MEDRA (SOC a preferovaných termínov).
Nežiaduce reakcie sú uvedené podľa nasledujúceho pravidla: veľmi časté (≥ 1/10), časté (≥ 1/100 až
< 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 2 Frekvencia nežiaducich liekových reakcií (ADR) v klinických štúdiách a spontánne hlásených prípadoch
MedDRA štandardná trieda orgánových systémov
Infekcie a nákazy
Poruchy krvi a lymfatického systému
Poruchy imunitného systému
Poruchy nervového systému
Nežiaduca reakcia Frekvenciaa
Chrípka Menej časté Laryngitída Menej časté Inhibícia faktora VIIIc Časté Lymfangitída Menej časté Anafylaktická reakcia Nie je známe Precitlivenosťc Nie je známe Bolesť hlavy Časté
Závrat Menej časté Porucha pamäte Menej časté Synkopa Menej časté Tremor Menej časté Migréna Menej časté Porucha chuti Menej časté
Poruchy oka Zápal oka Menej časté
Poruchy srdca a srdcovej činnosti Palpitácie Menej časté
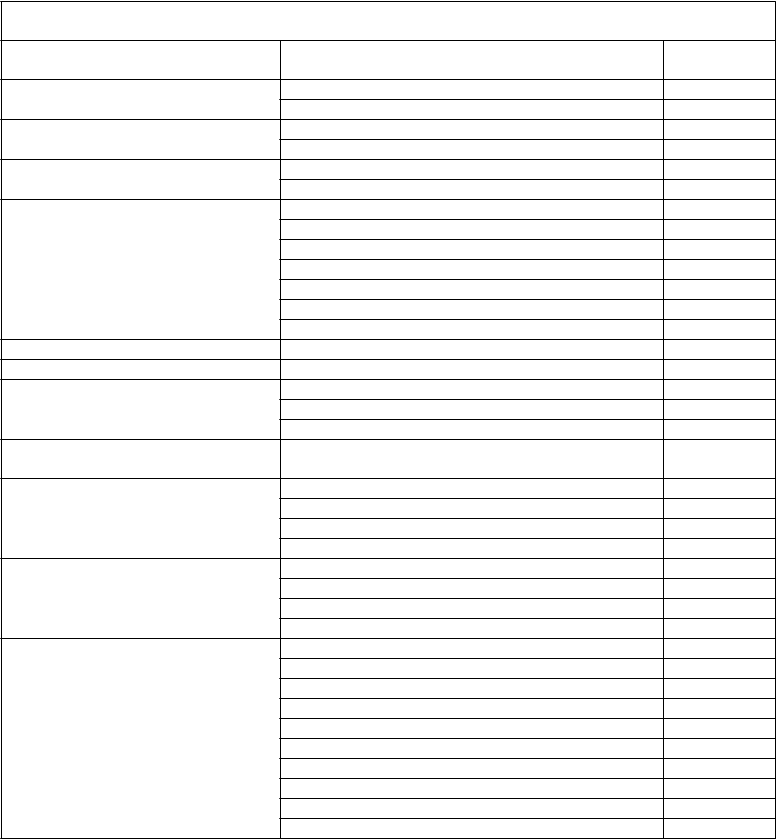
Poruchy ciev
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Celkové poruchy a reakcie v mieste podania
Hematóm Menej časté Návaly tepla Menej časté Bledosť Menej časté Dyspnoe Menej časté
Hnačka Menej časté Bolesť v hornej časti brucha Menej časté Nevoľnosť Menej časté Vracanie Menej časté Svrbenie Menej časté Vyrážka Menej časté Hyperhidróza Menej časté Žihľavka Menej časté Pyrexia Časté Periférny edém Menej časté Bolesť na hrudi Menej časté Hrudný dyskomfort Menej časté Zimnica Menej časté Nezvyčajný pocit Menej časté Hemátóm v mieste punkcie cievy Menej časté Únava Nie je známe Reakcia v mieste injekcie Nie je známe Nevoľnosť Nie je známe
Tabuľka 2 Frekvencia nežiaducich liekových reakcií (ADR) v klinických štúdiách a spontánne hlásených prípadoch
MedDRA štandardná trieda orgánových systémov
Laboratórne a funkčné vyšetrenia
Úrazy, otravy a komplikácie liečebného postupu
Nežiaduca reakcia Frekvenciaa
Zvýšený počet monocytov Menej časté Znížená hladina koagulačného faktora VIIIb Menej časté Znížený hematokrit Menej časté Abnormálne výsledky laboratórnych testov Menej časté Postprocedurálna komplikácia Menej časté Postprocedurálne krvácanie Menej časté Reakcia v mieste podania Menej časté

a) Vypočítané na základe celkového počtu pacientov, ktorí dostávali ADVATE (418).
b) U jedného pacienta sa počas kontinuálnej infúzie ADVATE po operácii (pooperačné
dni 10 - 14) vyskytli neočakávane znížené hladiny koagulačného faktora VIII. Hemostáza bola počas tohto obdobia stále udržiavaná a ako hladina faktora VIII, tak aj hodnoty klírensu sa vrátili na dostatočné hodnoty do 15. pooperačného dňa. Skúšky inhibítora faktora VIII uskutočnené po ukončení kontinuálnej infúzie a v závere štúdie boli negatívne.
c) Nežiaduce reakcie vysvetlené v časti nižšie.
Opis vybratých nežiaducich reakciíVznik inhibítorovBol hlásený vznik inhibítorov u predtým liečených pacientov (PTP) a u predtým neliečených pacientov (PUP). Bližšie údaje nájdete v časti 5.1 (Farmakologické vlastnosti) a 4.4 (Osobitné upozornenia a opatrenia pri používaní).
Nežiaduce reakcie špecifické pre pozostatky z výrobného procesuZ 229 liečených pacientov, ktorí boli hodnotení na protilátky proti proteínu buniek ovárií čínskeho škrečka (CHO), sa u 3 dokázal štatisticky významný vzostupný trend v titroch, u 4 sa ukázali
pretrvávajúce vrcholy alebo prechodné výkyvy a jeden pacient mal oboje, ale nemal žiadne klinické príznaky. Z 229 liečených pacientov, ktorí boli hodnotení na protilátky proti myším IgG, sa
u 10 dokázal štatisticky významný vzostupný trend v titroch, u 2 sa ukázali pretrvávajúce vrcholy alebo prechodné výkyvy a jeden pacient mal oboje. Štyria z týchto pacientov hlásili jednotlivé prípady
urtikárie, pruritu, vyrážky a mierne zvýšeného počtu eozinofilov v rámci opakovaných expozícií lieku
v štúdii.
PrecitlivenosťReakcie alergického typu vrátane anafylaxie, ktoré sa prejavili závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Pediatrická populáciaV klinických štúdiách neboli uvedené žiadne vekovo špecifické rozdiely v nežiaducich reakciách iné ako vznik inhibítorov u predtým neliečených detských pacientov (PUP) a komplikácie súvisiace
s katétrom.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9. PredávkovanieNeboli hlásené žiadne prípady predávkovania rekombinantným koagulačným faktorom VIII.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1. Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antihemoragiká: krvný koagulačný faktor VIII. ATC kód: B02BD02. Komplex faktora VIII/von Willebrandovho faktora sa skladá z dvoch molekúl (faktor VIII
a von Willebrandov faktor) s odlišnými fyziologickými funkciami. ADVATE obsahuje rekombinantný
koagulačný faktor VIII (alfaoktokog), glykoproteín ktorý je biologicky rovnocenný s glykoproteínu faktora VIII obsiahnutom v ľudskej plazme.
Alfaoktokog je glykoproteín skladajúci sa z 2332 aminokyselín s molekulárnou hmotnosťou
približne 280 kD. Alfaoktokog sa pri podávaní infúziou hemofilickému pacientovi viaže na endogénny von Willebrandov faktor v pacientovom krvnom obehu. Aktivovaný faktor VIII pôsobí ako kofaktor pre aktivovaný faktor IX, urýchľujúci konverziu faktora X na aktivovaný faktor X. Aktivovaný
faktor X premieňa protrombín na trombín. Trombín potom premieňa fibrinogén na fibrín a môže sa vytvoriť krvná zrazenina. Hemofília A je dedičná porucha zrážania krvi viazaná na pohlavie, spôsobená zníženými hladinami aktivity faktora VIII a má za následok profúzne krvácanie do kĺbov, svalov alebo vnútorných orgánov, ktoré vzniká buď spontánne, alebo ako dôsledok úrazu alebo chirurgického zákroku. Plazmatické hladiny faktora VIII sa substitučnou liečbou zvyšujú,
čo umožňuje dočasnú úpravu nedostatku faktora VIII a úpravu sklonu ku krvácaniu.
Vznik inhibítorov
Imunogenicita ADVATE sa hodnotila u predtým liečených pacientov. Počas klinických štúdií
s ADVATE u 233 pediatrických (pediatrickí pacienti vo veku 0 až 16 rokov) a dospelých pacientov (starší ako 16 rokov), ktorým bola diagnostikovaná ťažká hemofília A (faktor VIII ≤ 1 %) a ktorí boli predtým vystavení koncentrátom faktora VIII po dobu ≥ 150 dní pre dospelých a staršie deti, a
po dobu ≥ 50 dní pre deti mladšie ako 6 rokov, sa po 26 dňoch expozície ADVATE vyvinul nízky titer inhibítora (2,4 BU v modifikovanej Bethesdovej skúške) u jedného pacienta. Nasledujúce testy na inhibítor vykonané u tohto pacienta po vyradení zo štúdie boli negatívne. V rámci všetkých štúdií bol medián expozície lieku ADVATE 97,0 expozičných dní na účastníka (rozsah 1 až 709) pre predtým liečených pacientov. Celkový výskyt vzniku inhibítorov faktora VIII (nízky alebo vysoký) bol 0,4 %
(1 z 233).
V ukončenej nekontrolovanej štúdii 060103, 16 zo 45 (35,6 %) predtým neliečených pacientov
s ťažkou hemofíliou A (faktor VIII < 1 %) a najmenej s 25 dňami expozície faktoru VIII vznikli inhibítory faktora VIII u: 7 (15,6 %) účastníkov vznikli inhibítory s vysokým titrom a u 9 (20 %) účastníkov vznikli inhibítory s nízkym titrom, 1 z nich bol tiež klasifikovaný ako prechodný inhibítor. Rizikové faktory súvisiace so vznikom inhibítorov v tejto štúdii zahŕňali iné ako kaukazské etnikum, familiárny výskyt inhibítorov a intenzívnu liečbu vysokou dávkou počas prvých 20 dní expozície.
U 20 účastníkov, ktorí nemali žiadny z týcho rizikových faktorov, nevznikli žiadne inhibítory.
Boli sústredené údaje o vyvolaní imunitnej tolerancie (ITI) u pacientov s inhibítormi. V rámci čiastkovej štúdie PNP 060103 bola zdokumentovaná liečba ITI u 11 predtým neliečených pacientov (PUP). Bola vypracovaná retrospektívna hodnotiaca schéma pre 30 pacientov s ITI (štúdia 060703)
a prebieha zhromažďovanie údajov do registra.
V štúdii 060201 boli porovnávané dve dlhodobé profylaktické liečebné schémy u 53 predtým liečených osôb: farmakokinetický riadený dávkovací režim prispôsobený individuálnym účastníkom (v rozsahu 20 až 80 IU faktora VIII na kg telesnej hmotnosti v intervaloch 72 ± 6 hodín, n=23)
so štandardným profylaktickým dávkovacím režimom (20 až 40 IU/kg každých 48 ± 6 hodín, n=30). Farmakokinetický riadený dávkovací režim (podľa osobitného vzorca) bol zacielený na udržanie minimálnych hladín (tzv. trough level) faktora VIII ≥ 1 % v intervale medzi dávkovaním 72 hodín. Údaje z tejto štúdie ukazujú, že tieto dva profylaktické dávkovacie režimy sú porovnateľné, čo sa týka redukcie miery krvácania.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom ADVATE vo všetkých podskupinách pediatrickej populácie s hemofíliou A (vrodený deficit faktora VIII) pri „indukcii imunitnej tolerancie (ITI) u pacientov s hemofíliou A (vrodený deficit
faktora VIII), u ktorých vznikli inhibítory faktora VIII“ a „liečbe a profylaxii krvácania u pacientov s hemofíliou A (vrodený deficit faktora VIII)“. (Informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2. Farmakokinetické vlastnosti
Všetky farmakokinetické štúdie s ADVATE boli vykonávané u predtým liečených pacientov s ťažkou až stredne ťažkou hemofíliou A (východiskový faktor VIII ≤ 2%). Analýza vzoriek plazmy bola vykonávaná v centrálnom laboratóriu použitím jednostupňovej skúšky zrážavosti.
Celkovo 195 pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %) poskytlo farmakokinetické (FK) parametre, ktoré boli začlenené do FK analytického súboru „per-protocol“. Kategórie týchto analýz pre dojčatá (1 mesiac do < 2 rokov veku), deti (2 až < 5 rokov veku), staršie deti (5 až < 12 rokov veku), mladistvých (12 až < 18 rokov veku) a dospelých (18 rokov veku a starší) boli použité na sumarizáciu FK parametrov, kde vek bol definovaný ako vek v dobe FK infúzie.
Tabuľka 3 Súhrn farmakokinetických parametrov ADVATE podľa vekovej skupiny pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %)
Parameter (priemer
± štandardná odchýlka)
Dojčatá
(n=5)
Deti
(n=30)
Staršie deti
(n=18)
Mladiství
(n=33)
Dospelí
(n=109)
Celková AUC (IU*h/dl) Upravené progresívne obnovenie hladiny Cmax (IU/dl na IU/kg)a
1362,1 ± 311,8 1180,0 ± 432,7 1506,6 ± 530,0 1317,1 ± 438,6 1538,5 ± 519,1
2,2 ± 0,6 1,8 ± 0,4 2,0 ± 0,5 2,1 ± 0,6 2,2 ± 0,6
Polčas (h) 9,0 ± 1,5 9,6 ± 1,7 11,8 ± 3,8 12,1 ± 3,2 12,9 ± 4,3
Maximálna plazmatická koncentrácia po infúzii (IU/dl) Priemerný rezidenčný čas (h)
Distribučný objem v ustálenom stave (dl/kg)
110,5 ± 30,2 90,8 ± 19,1 100,5 ± 25,6 107,6 ± 27,6 111,3 ± 27,1
11,0 ± 2,8 12,0 ± 2,7 15,1 ± 4,7 15,0 ± 5,0 16,2 ± 6,1
0,4 ± 0,1 0,5 ± 0,1 0,5 ± 0,2 0,6 ± 0,2 0,5 ± 0,2

Klírens (ml/kg*h) 3,9 ± 0,9 4,8 ± 1,5 3,8 ± 1,5 4,1 ± 1,0 3,6 ± 1,2 a Vypočítané ako (Cmax – faktor VIII na začiatku liečby) delené dávkou v IU/kg, kde Cmax je maximálny nameraný faktor VIII po infúzii.
Bezpečnosť a hemostatická účinnosť lieku ADVATE v pediatrickej populácii sú podobné ako tieto parametre u dospelých pacientov. Upravené obnovenie a konečný polčas (t½) boli približne o 20% nižšie u mladších detí (mladších ako 6 rokov) ako u dospelých, čo je v súlade so známym vyšším objemom plazmy na kilogram telesnej hmotnosti u mladších pacientov.
Aktuálne nie sú k dispozícii farmakokinetické údaje o ADVATE u predtým neliečených pacientov.
5.3. Predklinické údaje o bezpečnostiPredklinické údaje získané na základe farmakologických štúdií bezpečnosti, akútnej toxikológie, toxicity po opakovanom podaní, lokálnej toxicity a genotoxicity neodhalili žiadne osobitné riziko pre ľudí.
6
. FARMACEUTICKÉ INFORMÁCIE
6.1. Zoznam pomocných látok
Prášok Manitol Chlorid sodný Histidín Trehalóza
Chlorid vápenatý Trometamol Polysorbát 80
Glutatión (redukovaný)
Rozpúšťadlo
Sterilizovaná voda na injekciu
6.2. Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi alebo rozpúšťadlami.
6.3. Čas použiteľnosti
2 roky.
Po rekonštitúcii: z mikrobiologického hľadiska sa má liek použiť okamžite. Avšak chemická a fyzikálna stabilita počas používania bola pri teplote 25 °C preukázaná na 3 hodiny.
V rámci času použiteľnosti sa liek môže uchovávať pri izbovej teplote (až do 25 °C) počas jedného obdobia nepresahujúceho 6 mesiacov. Na balenie lieku zaznamenajte dátum konca 6-mesačného uchovávania pri izbovej teplote. Liek sa nesmie vrátiť späť do chladničky.
6.4. Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke pri teplote (2 °C – 8 °C). Neuchovávajte v mrazničke.
ADVATE s pomôckou BAXJECT II: Injekčnú liekovku s liekom uchovávajte vo vonkajšom obale na ochranu pred svetlom.
ADVATE v systéme BAXJECT III: Uzavretý blister uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5. Druh obalu a obsah balenia
Injekčná liekovka s práškom a 5 ml injekčná liekovka s rozpúšťadlom sú vyrobené zo skla typu
I a uzatvorené chlorobutylovými gumenými zátkami. Liek sa dodáva v jednej z nasledujúcich foriem:
- ADVATE s pomôckou BAXJECT II: Každé balenie obsahuje injekčnú liekovku
s práškom, 5 ml injekčnú liekovku s rozpúšťadlom a pomôcku na rekonštitúciu (BAXJECT II).
- ADVATE v systéme BAXJECT III: Každé balenie obsahuje systém BAXJECT v uzavretom blistri (injekčná liekovka s práškom a 5 ml injekčná liekovka s rozpúšťadlom sú zabudované v systéme na rekonštitúciu).
6.6. Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
ADVATE sa podáva intravenózne po rekonštitúcii lieku.
Pripravený roztok sa má skontrolovať vizuálne, či neobsahuje cudzorodé častice a či nemá zmenenú farbu.
Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc. Nepoužívajte zakalené roztoky alebo roztoky s usadeninami.
- Na podávanie je potrebné použiť injekčnú striekačku s konektorom luer-lock.
- Použite do troch hodín po príprave.
- Po príprave liek neuchovávajte v chladničke.
- Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Príprava roztoku s pomôckou BAXJECT II- Na rekonštitúciu použite len pribalenú sterilizovanú vodu na injekciu a pomôcku na rekonštitúciu.
- Nepoužívajte, ak je pomôcka BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
- Má byť použitá aseptická technika
1. Ak je liek ešte uchovávaný v chladničke, vyberte injekčnú liekovku s práškom ADVATE
a injekčnú liekovku s rozpúšťadlom z chladničky a zohrejte ich na izbovú teplotu
(medzi 15 °C - 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Odstráňte uzáver z injekčnej liekovky s práškom a uzáver z injekčnej liekovky s rozpúšťadlom
4. Očistite zátky tampónmi napustenými alkoholom. Injekčné liekovky umiestnite na rovný čistý povrch.
5. Otvorte balenie pomôcky BaxJect II odtrhnutím papierového viečka bez toho, aby ste sa dotkli vnútrajška (Obr. a). Nevyberajte pomôcku z balenia. Nepoužívajte, ak je pomôcka
BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
6. Otočte balenie nahor a prepichnite zátku rozpúšťadla čírym plastovým bodcom. Uchopte balenie za jeho okraj a stiahnite balenie z BAXJECTu II (Obr. b). Neodstraňujte modré viečko z pomôcky BAXJECT II.
7. Na rekonštitúciu sa má použiť len pribalená sterilizovaná voda na injekciu a pomôcka na rekonštitúciu. S BAXJECTom II pripevneným na injekčnú liekovku s rozpúšťadlom obráťte
systém tak, aby bola injekčná liekovka s rozpúšťadlom navrchu. Bielym plastovým bodcom
prepichnite zátku prášku ADVATE. Vákuum nasaje rozpúšťadlo do injekčnej liekovky s práškom ADVATE (Obr. c).

8. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc.
Obr. a Obr. b Obr. c
Príprava roztoku so systémom BAXJECT III
- Ak viečko úplne neutesňuje blister, výrobok nepoužívajte.
1. Ak je liek ešte uchovávaný v chladničke, vyberte uzavretý blister (obsahuje injekčnú liekovku s práškom a injekčnú liekovku s rozpúšťadlom zabudované v systéme na rekonštitúciu) z chladničky a zohrejte ich na izbovú teplotu (medzi 15 °C a 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Otvorte balenie ADVATE odlepením viečka. Vyberte systém BAXJECT III z blistra.
4. Položte liek ADVATE na rovný povrch s injekčnou liekovkou s rozpúšťadlom nahor (Obr. 1).
Injekčná liekovka s rozpúšťadlom má modrý prúžok. Neodstraňujte modré viečko, až kým nedostanete pokyn v ďalšom kroku.
5. Jednou rukou pridržte liek ADVATE v systéme BAXJECT III, druhou rukou pevne pritlačte na injekčnú liekovku s rozpúšťadlom, kým systém úplne nezaklapne a rozpúšťadlo nezačne prúdiť do injekčnej liekovky ADVATE (Obr. 2). Systém nenakláňajte, kým sa prenos nedokončí.
6. Overte, že prenos rozpúšťadla je úplný. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite
sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc.
Obr. 1 Obr. 2 Obr. 3 Podávanie
PodávaniePoužite aseptickú techniku
Lieky podávané parenterálne sa pred podaním musia skontrolovať, či neobsahujú pevné čiastočky, vždy keď to roztok a obal umožní. Použitý smie byť len číry a bezfarebný roztok.
1. Odstráňte modré viečko z BAXJECTu II/BAXJECTu III.
Nenasajte vzduch do injekčnej striekačky. Pripojte injekčnú striekačku k BAXJECTu II/BAXJECTu III.
2. Prevráťte systém (injekčná liekovka s pripraveným roztokom má byť hore). Natiahnite pripravený roztok do injekčnej striekačky pomalým vytiahnutím piestu smerom dozadu.
3. Odpojte injekčnú striekačku.
4. Pripojte krídelkovú ihlu na injekčnú striekačku. Injektujte intravenózne. Roztok sa má podávať pomaly, rýchlosťou ktorá pacientovi najviac vyhovuje a nepresahuje 10 ml za minútu. Pulzová frekvencia sa má zmerať pred podaním ADVATE a počas jeho podávania. Ak dôjde
k významnému vzostupu, zníženie rýchlosti podávania alebo dočasné prerušenie podávania zvyčajne postačí na to, aby príznaky rýchlo vymizli (pozri časti 4.4 a 4.8).
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBaxter AG Industriestrasse 67
A-1221 Viedeň
Rakúsko
8. REGISTRAČNÉ ČÍSLO
EU/1/03/271/006
EU/1/03/271/016
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 2. marec 2004
Dátum posledného predĺženia registrácie: 2. marec 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
ADVATE 250 IU prášok a rozpúšťadlo na injekčný roztok.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá injekčná liekovka obsahuje 250 IU* ľudského koagulačného faktora VIII (rDNA), alfaoktokogu**. Po rekonštitúcii ADVATE obsahuje približne 125 IU ľudského koagulačného faktora VIII (rDNA), alfaoktokogu/ml.
Účinnosť (medzinárodné jednotky, IU) sa stanovuje pomocou chromogénneho testu Európskeho liekopisu. Špecifická aktivita lieku ADVATE je približne 4000 – 10 000 IU/mg proteínu. Alfaoktokog (ľudský koagulačný faktor VIII (rDNA)) je čistený proteín s 2332 aminokyselinami. Je produkovaný rekombinantnou DNA technológiou v bunkách ovárií čínskeho škrečka (Chinese
hamster ovary, CHO). Pripravený bez prídavku akýchkoľvek (exogénnych) ľudských alebo zvieracích proteínov v procese bunkovej kultivácie, purifikácie alebo konečnej úpravy.
Pomocné látky so známym účinkom:
0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Prášok a rozpúšťadlo na injekčný roztok. Prášok: biely až sivobiely drobivý prášok.
Rozpúšťadlo: číry a bezfarebný roztok.
4. KLINICKÉ ÚDAJE
4.1. TERAPEUTICKÉ INDIKÁCIE
Liečba a profylaxia krvácania u pacientov s hemofíliou A (vrodený nedostatok faktora VIII). Liek
ADVATE je indikovaný vo všetkých vekových skupinách.
4.2. Dávkovanie a spôsob podávania
Liečba sa má začať pod dohľadom lekára skúseného v liečbe hemofílie a so zabezpečenou okamžitou resuscitáciou v prípade anafylaxie.
Dávkovanie
Dávka a dĺžka substitučnej terapie závisí od závažnosti nedostatku faktora VIII, od miesta a rozsahu krvácania a od klinického stavu pacienta.
Počet jednotiek faktora VIII sa vyjadruje v medzinárodných jednotkách (International Units, IU), ktoré sa vzťahujú na štandard WHO pre lieky s faktorom VIII. Aktivita faktora VIII v plazme sa vyjadruje buď percentuálne (v relácii k normálnej ľudskej plazme) alebo v IU (podľa medzinárodného štandardu pre faktor VIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora VIII zodpovedá množstvu faktora VIII v jednom ml normálnej ľudskej plazmy.
Liečba on demand (podľa potreby)
Výpočet požadovanej dávky faktora VIII sa zakladá na empirickom zistení, že 1 IU faktora VIII na kg telesnej hmotnosti zvýši aktivitu plazmatického faktora VIII o 2 IU/dl. Potrebná dávka sa stanoví
použitím nasledovného vzorca:
Požadované jednotky (IU) = telesná hmotnosť (kg) x požadovaný vzostup faktora VIII (%) x 0,5
V prípade nasledujúcich krvácavých príhod aktivita faktora VIII nemá počas zodpovedajúceho obdobia klesnúť pod danú hladinu aktivity v plazme (v % normálu alebo IU/dl). Ako návod na dávkovanie pri krvácaní alebo pri chirurgických zákrokoch možno použiť nasledovnú tabuľku 1:
Tabuľka 1 Návod na dávkovanie pri krvácaní a chirurgických zákrokoch
Stupeň krvácania/Typ chirurgického zákroku
Krvácanie
Začínajúca hemartróza, krvácanie do svalu alebo krvácanie v ústnej dutine.
Rozsiahlejšia hemartróza, krvácanie do svalu alebo hematóm.
Život ohrozujúce krvácania.
Chirurgický zákrok
Malý
Vrátane extrakcie zuba.
Veľký
Požadovaná hladina faktora VIII
(% alebo IU/dl)
20 – 40
30 – 60
60 – 100
30 – 60
80 – 100
(pred a po operácii)
Frekvencia dávok (hodiny)/ dĺžka trvania terapie (dni)
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým krvácavá príhoda, súdiac podľa bolesti, nepominie alebo kým nedôjde
k zahojeniu.
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších
ako 6 rokov) počas 3 – 4 dní alebo dlhšie až dovtedy, kým bolesť nepominie alebo kým sa neobnoví funkčnosť.
Opakujte injekcie každých 8 až 24 hodín
(6 až 12 hodín u pacientov mladších
ako 6 rokov), až dovtedy, kým nepominie stav ohrozenia života.
Každých 24 hodín (12 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým nedôjde
k zahojeniu.
Opakujte injekcie každých 8 až 24 hodín
(6 až 24 hodín u pacientov mladších
ako 6 rokov), do adekvátneho zahojenia rán, potom pokračujte v terapii najmenej ďalších 7 dní na udržanie aktivity
faktora VIII od 30 % do 60 % (IU/dl).

Dávka a frekvencia podávania sa majú v jednotlivých prípadoch prispôsobiť klinickej odpovedi.
Za určitých okolností (napr. prítomnosť nízkeho titra inhibítora) môžu byť potrebné vyššie dávky ako dávky vypočítané podľa vzorca.
V priebehu liečby sa odporúča primerané stanovovanie hladín plazmatického faktora VIII ako návod na určovanie podávanej dávky a frekvencie opakovaných injekcií. Predovšetkým v prípade veľkých chirurgických zákrokov je nevyhnutné presné sledovanie substitučnej terapie skúškami aktivity plazmatického faktora VIII. Reakcie jednotlivých pacientov na faktor VIII sa môžu
in vivo odlišovať a dosiahnuť odlišné hladiny obnovenia faktora VIII a preukázať rôzne polčasy.
Profylaxia
Na dlhodobú profylaxiu krvácania u pacientov s ťažkou hemofíliou A sú zvyčajné dávky 20 až 40 IU
faktora VIII na kg telesnej hmotnosti v intervaloch od 2 do 3 dní.
Pediatrická populácia
Dávkovanie pre liečbu on demand sa u pediatrických pacientov (0 až 18 rokov veku) nelíši od dospelých pacientov. U pacientov mladších ako 6 rokov sa na profylaktickú terapiu odporúča dávkovanie 20 až 50 IU faktora VIII na kg telesnej hmotnosti 3 až 4-krát do týždňa.
Použitie 2 ml obchodnej formy nebolo dokumentované pre deti mladšie ako 2 roky.
Spôsob podávania
ADVATE sa má podávať intravenóznou cestou. V prípade, že liek nepodáva zdravotnícky pracovník je nutné jeho náležité zaškolenie.
Rýchlosť podávania sa má ustáliť podľa toho, ako to pacientovi najviac vyhovuje a smie dosiahnuť
maximálne 10 ml/min.
Po rekonštitúcii je roztok číry, bezfarebný, bez cudzorodých častíc s pH medzi 6,7 až 7,3. Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3. Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na proteíny myši alebo škrečka.
4.4. Osobitné upozornenia a opatrenia pri používaní
Precitlivenosť
U ADVATE boli hlásené reakcie z precitlivenosti alergického typu vrátane anafylaxie a prejavili sa závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Liek obsahuje stopy proteínov myši a škrečka. Pacienti majú byť upozornení, že ak sa vyskytnú príznaky precitlivenosti, odporúča sa používanie lieku okamžite prerušiť a kontaktovať svojho lekára. Pacienti majú byť informovaní o prvotných príznakoch reakcií z precitlivenosti zahŕňajúcich vyrážky, generalizovanú žihľavku, pocit tiesne na hrudníku, pískavé dýchanie, hypotenzia a anafylaxiu.
V prípade šoku má byť zavedená štandardná lekárska liečba šoku.
Kvôli poklesu injekčného objemu pre liek ADVATE rozpusteného v 2 ml sterilizovanej vody na injekcie, ak sa vyskytnú reakcie z precitlivenosti, je menej času na reakciu zastavením injekcie.
Počas injekcie lieku ADVATE rozpusteného v 2 ml sterilizovanej vody na injekcie sa preto odporúča opatrnosť, najmä u detí.
Inhibítory
Známou komplikáciou liečby jedincov s hemofíliou A je vznik protilátok (inhibítorov) neutralizujúcich faktor VIII. Tieto inhibítory sú zvyčajne imunoglobulíny IgG pôsobiace proti prokoagulačnej aktivite faktora VIII, ktoré sú kvantifikované v Bethesdových jednotkách (BU) na ml
plazmy použitím modifikovanej skúšky. U pacientov, u ktorých sa objavia inhibítory faktora VIII, sa
klinický stav môže prejavovať ako nedostatočná klinická odpoveď. V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu. Riziko vzniku inhibítorov koreluje s rozsahom expozície faktoru VIII, toto riziko býva najvyššie počas prvých 20 dní expozície, a tiež s inými genetickými faktormi a faktormi prostredia. V zriedkavých prípadoch môžu inhibítory vzniknúť po prvých 100 dňoch expozície.
Boli pozorované prípady opakovaného vzniku inhibítorov (nízky titer) po prechode z jedného lieku s faktorom VIII na iný u predtým liečených pacientov s viac ako 100 dňami expozície, ktorí majú
v anamnéze vznik inhibítorov. Odporúča sa preto, aby všetci pacienti po prechode z jedného lieku na iný boli pozorne sledovaní na vznik inhibítorov.
Vo všeobecnosti všetci pacienti s koagulačným faktorom VIII majú byť pomocou náležitých klinických pozorovaní a laboratórnych vyšetrení pozorne sledovaní na vznik inhibítorov. Ak sa očakávané hladiny aktivity faktora VIII v plazme nedosiahnu, alebo ak krvácanie nie je kontrolované vhodnou dávkou, má sa vykonať testovanie prítomnosti inhibítorov faktora VIII. U pacientov
s vysokými hladinami inhibítora, substitučná terapia faktorom VIII nemusí byť účinná a treba zvážiť
iné možnosti liečby. Liečba takých pacientov má byť riadená lekármi so skúsenosťami so starostlivosťou o pacientov s hemofíliou a inhibítormi faktora VIII.
Nesprávna aplikácia lieku ADVATE
Nesprávna aplikácia (intraarteriálna alebo paravenózna) lieku ADVATE, rozpusteného v 2 ml sterilizovanej vody na injekcie, môže spôsobiť mierne krátkodobé reakcie v mieste podania, ako sú podliatina a erytém.
Komplikácie liečby súvisiace s katétrom
Ak je potrebný centrálny venózny katéter (CVK), musí sa zvážiť riziko komplikácií súvisiacich s CVK
vrátane lokálnych infekcií, bakterémie a trombózy v mieste zavedenia katétra.
Aspekty týkajúce sa pomocného základu
Po príprave tento liek obsahuje 0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke. Má sa to vziať
do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
Dôrazne odporúčame, aby sa pri každom podávaní lieku ADVATE pacientovi, zapísali názov a číslo šarže lieku, a tak sa uchovalo prepojenie medzi pacientom a šaržou lieku.
Pediatrická populácia:
Uvedené upozornenia a opatrenia pri používaní sa týkajú detí aj dospelých.
4.5. Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s ADVATE.
4.6. Fertilita, gravidita a laktácia
Neuskutočnili sa reprodukčné štúdie s faktorom VIII na zvieratách. Vzhľadom k zriedkavému výskytu hemofílie A u žien, nie sú k dispozícii údaje týkajúce sa použitia faktora VIII počas gravidity a laktácie. Z tohto dôvodu má byť faktor VIII používaný počas gravidity a dojčenia iba v nevyhnutných prípadoch.
4.7. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
ADVATE nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8. Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Klinické štúdie s ADVATE zahŕňali 418 účastníkov vystavených najmenej raz lieku ADVATE
hlásiacich celkovo 93 nežiaducich liekových reakcií (adverse drug reactions, ADR). ADR, ktoré
sa vyskytli s najväčšou frekvenciou, boli vznik neutralizačných protilátok faktora VIII (inhibítorov), bolesť hlavy, a horúčka.
Reakcie precitlivenosti alebo alergické reakcie (ako angioedém, pálenie a pichanie v mieste infúzie, zimnica, začervenanie kože, generalizovaná žihľavka, bolesť hlavy, vyrážky, hypotenzia, letargia, nauzea, nepokoj, tachykardia, pocit tiesne na hrudníku, mravčenie, vracanie, pískavé dýchanie)
boli pozorované zriedkavo, a v niektorých prípadoch sa z nich môže vyvinúť závažná anafylaxia
(vrátane šoku).
Môže byť pozorovaný vznik protilátok proti proteínu myši alebo škrečka so súvisiacimi reakciami precitlivenosti.
U pacientov s hemofíliou A môžu vznikať neutralizačné protilátky (inhibítory) faktora VIII. Ak dôjde k vzniku takých inhibítorov, klinický stav sa môže prejavovať ako nedostatočná klinická odpoveď.
V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu.
Tabuľkové zhrnutie nežiaducich reakcií
Nasledujúca tabuľka 2 uvádza frekvenciu nežiaducich liekových reakcií v klinických štúdiách
a v spontánne hlásených prípadoch. Táto tabuľka je podľa klasifikácie orgánových systémov MEDRA (SOC a preferovaných termínov).
Nežiaduce reakcie sú uvedené podľa nasledujúceho pravidla: veľmi časté (≥ 1/10), časté (≥ 1/100 až
< 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 2 Frekvencia nežiaducich liekových reakcií (ADR) v klinických štúdiách a spontánne hlásených prípadoch
MedDRA štandardná trieda orgánových systémov
Infekcie a nákazy
Poruchy krvi a lymfatického systému
Poruchy imunitného systému
Poruchy nervového systému
Nežiaduca reakcia Frekvenciaa
Chrípka Menej časté Laryngitída Menej časté Inhibícia faktora VIIIc Časté Lymfangitída Menej časté Anafylaktická reakcia Nie je známe Precitlivenosťc Nie je známe Bolesť hlavy Časté
Závrat Menej časté Porucha pamäte Menej časté Synkopa Menej časté Tremor Menej časté Migréna Menej časté Porucha chuti Menej časté
Poruchy oka Zápal oka Menej časté
Poruchy srdca a srdcovej činnosti Palpitácie Menej časté
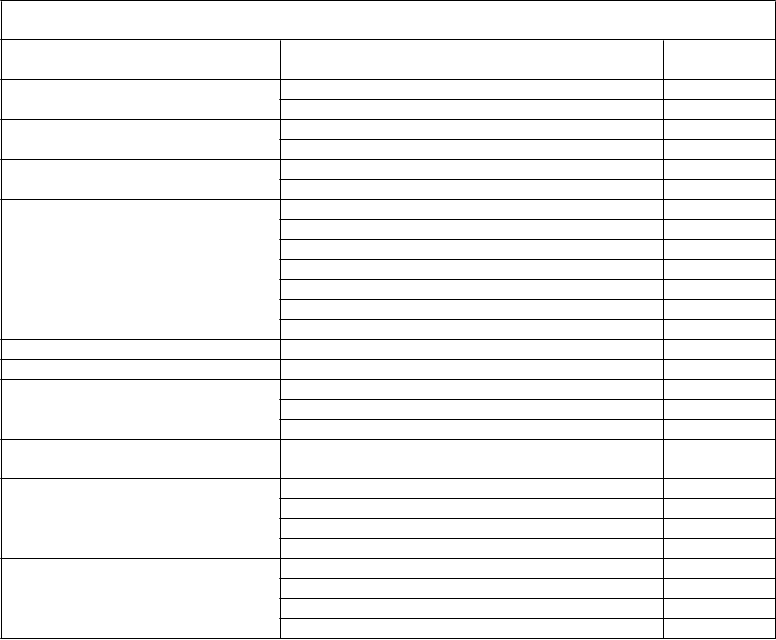
Poruchy ciev
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Hematóm Menej časté Návaly tepla Menej časté Bledosť Menej časté Dyspnoe Menej časté
Hnačka Menej časté Bolesť v hornej časti brucha Menej časté Nevoľnosť Menej časté Vracanie Menej časté Svrbenie Menej časté Vyrážka Menej časté Hyperhidróza Menej časté Žihľavka Menej časté
Tabuľka 2 Frekvencia nežiaducich liekových reakcií (ADR) v klinických štúdiách a spontánne hlásených prípadoch
MedDRA štandardná trieda orgánových systémov
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Úrazy, otravy a komplikácie liečebného postupu
Nežiaduca reakcia Frekvenciaa
Pyrexia Časté Periférny edém Menej časté Bolesť na hrudi Menej časté Hrudný dyskomfort Menej časté Zimnica Menej časté Nezvyčajný pocit Menej časté Hemátóm v mieste punkcie cievy Menej časté Únava Nie je známe Reakcia v mieste injekcie Nie je známe Nevoľnosť Nie je známe Zvýšený počet monocytov Menej časté Znížená hladina koagulačného faktora VIIIb Menej časté Znížený hematokrit Menej časté Abnormálne výsledky laboratórnych testov Menej časté Postprocedurálna komplikácia Menej časté Postprocedurálne krvácanie Menej časté Reakcia v mieste podania Menej časté

a) Vypočítané na základe celkového počtu pacientov, ktorí dostávali ADVATE (418).
b) U jedného pacienta sa počas kontinuálnej infúzie ADVATE po operácii (pooperačné
dni 10 - 14) vyskytli neočakávane znížené hladiny koagulačného faktora VIII. Hemostáza bola počas tohto obdobia stále udržiavaná a ako hladina faktora VIII, tak aj hodnoty klírensu sa vrátili na dostatočné hodnoty do 15. pooperačného dňa. Skúšky inhibítora faktora VIII uskutočnené po ukončení kontinuálnej infúzie a v závere štúdie boli negatívne.
c) Nežiaduce reakcie vysvetlené v časti nižšie.
Opis vybratých nežiaducich reakciíVznik inhibítorovBol hlásený vznik inhibítorov u predtým liečených pacientov (PTP) a u predtým neliečených pacientov (PUP). Bližšie údaje nájdete v časti 5.1 (Farmakologické vlastnosti) a 4.4 (Osobitné upozornenia a opatrenia pri používaní).
Nežiaduce reakcie špecifické pre pozostatky z výrobného procesuZ 229 liečených pacientov, ktorí boli hodnotení na protilátky proti proteínu buniek ovárií čínskeho škrečka (CHO), sa u 3 dokázal štatisticky významný vzostupný trend v titroch, u 4 sa ukázali pretrvávajúce vrcholy alebo prechodné výkyvy a jeden pacient mal oboje, ale nemal žiadne klinické príznaky. Z 229 liečených pacientov, ktorí boli hodnotení na protilátky proti myším IgG, sa
u 10 dokázal štatisticky významný vzostupný trend v titroch, u 2 sa ukázali pretrvávajúce vrcholy alebo prechodné výkyvy a jeden pacient mal oboje. Štyria z týchto pacientov hlásili jednotlivé prípady
urtikárie, pruritu, vyrážky a mierne zvýšeného počtu eozinofilov v rámci opakovaných expozícií lieku v štúdii.
PrecitlivenosťReakcie alergického typu vrátane anafylaxie, ktoré sa prejavili závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Pediatrická populáciaV klinických štúdiách neboli uvedené žiadne vekovo špecifické rozdiely v nežiaducich reakciách iné ako vznik inhibítorov u predtým neliečených detských pacientov (PUP) a komplikácie súvisiace
s katétrom.
Hlásenie podozrení na nežiaduce reakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9. PredávkovanieNeboli hlásené žiadne prípady predávkovania rekombinantným koagulačným faktorom VIII.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1. Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antihemoragiká: krvný koagulačný faktor VIII. ATC kód: B02BD02. Komplex faktora VIII/von Willebrandovho faktora sa skladá z dvoch molekúl (faktor VIII
a von Willebrandov faktor) s odlišnými fyziologickými funkciami. ADVATE obsahuje rekombinantný
koagulačný faktor VIII (alfaoktokog), glykoproteín ktorý je biologicky rovnocenný s glykoproteínu faktora VIII obsiahnutom v ľudskej plazme.
Alfaoktokog je glykoproteín skladajúci sa z 2332 aminokyselín s molekulárnou hmotnosťou
približne 280 kD. Alfaoktokog sa pri podávaní infúziou hemofilickému pacientovi viaže na endogénny von Willebrandov faktor v pacientovom krvnom obehu. Aktivovaný faktor VIII pôsobí ako kofaktor pre aktivovaný faktor IX, urýchľujúci konverziu faktora X na aktivovaný faktor X. Aktivovaný
faktor X premieňa protrombín na trombín. Trombín potom premieňa fibrinogén na fibrín a môže sa vytvoriť krvná zrazenina. Hemofília A je dedičná porucha zrážania krvi viazaná na pohlavie, spôsobená zníženými hladinami aktivity faktora VIII a má za následok profúzne krvácanie do kĺbov, svalov alebo vnútorných orgánov, ktoré vzniká buď spontánne, alebo ako dôsledok úrazu alebo chirurgického zákroku. Plazmatické hladiny faktora VIII sa substitučnou liečbou zvyšujú,
čo umožňuje dočasnú úpravu nedostatku faktora VIII a úpravu sklonu ku krvácaniu.
Vznik inhibítorovImunogenicita ADVATE sa hodnotila u predtým liečených pacientov. Počas klinických štúdií
s ADVATE u 233 pediatrických (pediatrickí pacienti vo veku 0 až 16 rokov) a dospelých pacientov (starší ako 16 rokov), ktorým bola diagnostikovaná ťažká hemofília A (faktor VIII ≤ 1 %) a ktorí boli predtým vystavení koncentrátom faktora VIII po dobu ≥ 150 dní pre dospelých a staršie deti, a
po dobu ≥ 50 dní pre deti mladšie ako 6 rokov, sa po 26 dňoch expozície ADVATE vyvinul nízky titer inhibítora (2,4 BU v modifikovanej Bethesdovej skúške) u jedného pacienta. Nasledujúce testy na inhibítor vykonané u tohto pacienta po vyradení zo štúdie boli negatívne. V rámci všetkých štúdií bol medián expozície lieku ADVATE 97,0 expozičných dní na účastníka (rozsah 1 až 709) pre predtým liečených pacientov. Celkový výskyt vzniku inhibítorov faktora VIII (nízky alebo vysoký) bol 0,4 %
(1 z 233).
V ukončenej nekontrolovanej štúdii 060103, 16 zo 45 (35,6 %) predtým neliečených pacientov
s ťažkou hemofíliou A (faktor VIII < 1 %) a najmenej s 25 dňami expozície faktoru VIII vznikli inhibítory faktora VIII u: 7 (15,6 %) účastníkov vznikli inhibítory s vysokým titrom a u 9 (20 %) účastníkov vznikli inhibítory s nízkym titrom, 1 z nich bol tiež klasifikovaný ako prechodný inhibítor. Rizikové faktory súvisiace so vznikom inhibítorov v tejto štúdii zahŕňali iné ako kaukazské etnikum, familiárny výskyt inhibítorov a intenzívnu liečbu vysokou dávkou počas prvých 20 dní expozície.
U 20 účastníkov, ktorí nemali žiadny z týcho rizikových faktorov, nevznikli žiadne inhibítory.
Boli sústredené údaje o vyvolaní imunitnej tolerancie (ITI) u pacientov s inhibítormi. V rámci čiastkovej štúdie PNP 060103 bola zdokumentovaná liečba ITI u 11 predtým neliečených pacientov (PUP). Bola vypracovaná retrospektívna hodnotiaca schéma pre 30 pacientov s ITI (štúdia 060703)
a prebieha zhromažďovanie údajov do registra.
V štúdii 060201 boli porovnávané dve dlhodobé profylaktické liečebné schémy u 53 predtým liečených osôb: farmakokinetický riadený dávkovací režim prispôsobený individuálnym účastníkom (v rozsahu 20 až 80 IU faktora VIII na kg telesnej hmotnosti v intervaloch 72 ± 6 hodín, n=23)
so štandardným profylaktickým dávkovacím režimom (20 až 40 IU/kg každých 48 ± 6 hodín, n=30). Farmakokinetický riadený dávkovací režim (podľa osobitného vzorca) bol zacielený na udržanie minimálnych hladín (tzv. trough level) faktora VIII ≥ 1 % v intervale medzi dávkovaním 72 hodín. Údaje z tejto štúdie ukazujú, že tieto dva profylaktické dávkovacie režimy sú porovnateľné, čo sa týka redukcie miery krvácania.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom ADVATE vo všetkých podskupinách pediatrickej populácie s hemofíliou A (vrodený deficit faktora VIII) pri „indukcii imunitnej tolerancie (ITI) u pacientov s hemofíliou A (vrodený deficit
faktora VIII), u ktorých vznikli inhibítory faktora VIII“ a „liečbe a profylaxii krvácania u pacientov s hemofíliou A (vrodený deficit faktora VIII)“. (Informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2. Farmakokinetické vlastnosti
Všetky farmakokinetické štúdie s ADVATE boli vykonávané u predtým liečených pacientov s ťažkou až stredne ťažkou hemofíliou A (východiskový faktor VIII ≤ 2%). Analýza vzoriek plazmy bola vykonávaná v centrálnom laboratóriu použitím jednostupňovej skúšky zrážavosti.
Celkovo 195 pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %) poskytlo farmakokinetické (FK) parametre, ktoré boli začlenené do FK analytického súboru „per-protocol“. Kategórie týchto analýz pre dojčatá (1 mesiac do < 2 rokov veku), deti (2 až < 5 rokov veku), staršie deti (5 až < 12 rokov veku), mladistvých (12 až < 18 rokov veku) a dospelých (18 rokov veku a starší) boli použité na sumarizáciu FK parametrov, kde vek bol definovaný ako vek v dobe FK infúzie.
Tabuľka 3 Súhrn farmakokinetických parametrov ADVATE podľa vekovej skupiny pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %)
Parameter (priemer
± štandardná odchýlka)
Dojčatá
(n=5)
Deti
(n=30)
Staršie deti
(n=18)
Mladiství
(n=33)
Dospelí
(n=109)
Celková AUC (IU*h/dl) Upravené progresívne obnovenie hladiny Cmax (IU/dl na IU/kg)a
1362,1 ± 311,8 1180,0 ± 432,7 1506,6 ± 530,0 1317,1 ± 438,6 1538,5 ± 519,1
2,2 ± 0,6 1,8 ± 0,4 2,0 ± 0,5 2,1 ± 0,6 2,2 ± 0,6
Polčas (h) 9,0 ± 1,5 9,6 ± 1,7 11,8 ± 3,8 12,1 ± 3,2 12,9 ± 4,3
Maximálna plazmatická koncentrácia po infúzii (IU/dl) Priemerný rezidenčný čas (h)
Distribučný objem v ustálenom stave (dl/kg)
110,5 ± 30,2 90,8 ± 19,1 100,5 ± 25,6 107,6 ± 27,6 111,3 ± 27,1
11,0 ± 2,8 12,0 ± 2,7 15,1 ± 4,7 15,0 ± 5,0 16,2 ± 6,1
0,4 ± 0,1 0,5 ± 0,1 0,5 ± 0,2 0,6 ± 0,2 0,5 ± 0,2
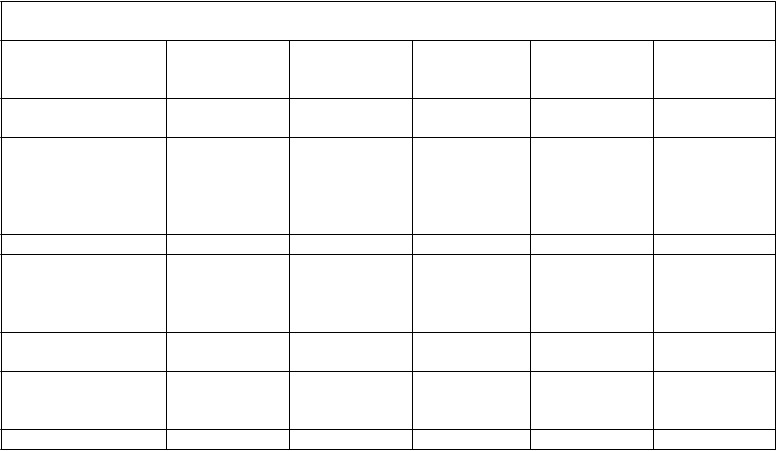
Klírens (ml/kg*h) 3,9 ± 0,9 4,8 ± 1,5 3,8 ± 1,5 4,1 ± 1,0 3,6 ± 1,2 a Vypočítané ako (Cmax – faktor VIII na začiatku liečby) delené dávkou v IU/kg, kde Cmax je maximálny nameraný faktor VIII po infúzii.
Bezpečnosť a hemostatická účinnosť lieku ADVATE v pediatrickej populácii sú podobné ako tieto parametre u dospelých pacientov. Upravené obnovenie a konečný polčas (t½) boli približne o 20% nižšie u mladších detí (mladších ako 6 rokov) ako u dospelých, čo je v súlade so známym vyšším objemom plazmy na kilogram telesnej hmotnosti u mladších pacientov.
Aktuálne nie sú k dispozícii farmakokinetické údaje o ADVATE u predtým neliečených pacientov.
5.3. Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe farmakologických štúdií bezpečnosti, akútnej toxikológie, toxicity po opakovanom podaní, lokálnej toxicity a genotoxicity neodhalili žiadne osobitné riziko pre ľudí.
Štúdia lokálnej tolerancie u králikov ukázala, že liek ADVATE, rozpustený v 2 ml sterilizovanej vody na injekcie, je po intravenóznom podaní dobre tolerovaný. Slabé prechodné začervenanie v mieste podania bolo pozorované po intraarteriálnej aplikácii a po paravenóznom podaní. Nedala sa však pozorovať žiadna korelácia nežiaducich histopatologických zmien, čo hovorí o prechodných vlastnostiach tohto zistenia.
6. FARMACEUTICKÉ INFORMÁCIE
6.1. Zoznam pomocných látok
Prášok Manitol Chlorid sodný Histidín Trehalóza
Chlorid vápenatý Trometamol Polysorbát 80
Glutatión (redukovaný)
Rozpúšťadlo
Sterilizovaná voda na injekciu
6.2. Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi alebo rozpúšťadlami.
6.3. Čas použiteľnosti
2 roky.
Po rekonštitúcii: z mikrobiologického hľadiska sa má liek použiť okamžite. Avšak chemická a fyzikálna stabilita počas používania bola pri teplote 25 °C preukázaná na 3 hodiny.
V rámci času použiteľnosti sa liek môže uchovávať pri izbovej teplote (až do 25 °C) počas jedného obdobia nepresahujúceho 6 mesiacov. Na balenie lieku zaznamenajte dátum konca 6-mesačného uchovávania pri izbovej teplote. Liek sa nesmie vrátiť späť do chladničky.
6.4. Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke pri teplote (2 °C – 8 °C). Neuchovávajte v mrazničke.
ADVATE s pomôckou BAXJECT II: Injekčnú liekovku s liekom uchovávajte vo vonkajšom obale na ochranu pred svetlom.
ADVATE v systéme BAXJECT III: Uzavretý blister uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5. Druh obalu a obsah balenia
Injekčná liekovka s práškom a 2 ml injekčná liekovka s rozpúšťadlom sú vyrobené zo skla typu
I a uzatvorené chlorobutylovými gumenými zátkami. Liek sa dodáva v jednej z nasledujúcich foriem:
- ADVATE s pomôckou BAXJECT II: Každé balenie obsahuje injekčnú liekovku
s práškom, 2 ml injekčnú liekovku s rozpúšťadlom a pomôcku na rekonštitúciu (BAXJECT II).
- ADVATE v systéme BAXJECT III: Každé balenie obsahuje systém BAXJECT v uzavretom blistri (injekčná liekovka s práškom a 2 ml injekčná liekovka s rozpúšťadlom sú zabudované v systéme na rekonštitúciu).
6.6. Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
ADVATE sa podáva intravenózne po rekonštitúcii lieku.
Pripravený roztok sa má skontrolovať vizuálne, či neobsahuje cudzorodé častice a či nemá zmenenú farbu.
Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc. Nepoužívajte zakalené roztoky alebo roztoky s usadeninami.
- Na podávanie je potrebné použiť injekčnú striekačku s konektorom luer-lock.
- Použite do troch hodín po príprave.
- Po príprave liek neuchovávajte v chladničke.
- Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Príprava roztoku s pomôckou BAXJECT II
- Na rekonštitúciu použite len pribalenú sterilizovanú vodu na injekciu a pomôcku na rekonštitúciu.
- Nepoužívajte, ak je pomôcka BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
- Má byť použitá aseptická technika
1. Ak je liek ešte uchovávaný v chladničke, vyberte injekčnú liekovku s práškom ADVATE
a injekčnú liekovku s rozpúšťadlom z chladničky a zohrejte ich na izbovú teplotu
(medzi 15 °C - 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Odstráňte uzáver z injekčnej liekovky s práškom a uzáver z injekčnej liekovky s rozpúšťadlom
4. Očistite zátky tampónmi napustenými alkoholom. Injekčné liekovky umiestnite na rovný čistý povrch.
5. Otvorte balenie pomôcky BaxJect II odtrhnutím papierového viečka bez toho, aby ste sa dotkli vnútrajška (Obr. a). Nevyberajte pomôcku z balenia. Nepoužívajte, ak je pomôcka
BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
6. Otočte balenie nahor a prepichnite zátku rozpúšťadla čírym plastovým bodcom. Uchopte balenie za jeho okraj a stiahnite balenie z BAXJECTu II (Obr. b). Neodstraňujte modré viečko z pomôcky BAXJECT II.
7. Na rekonštitúciu sa má použiť len pribalená sterilizovaná voda na injekciu a pomôcka na rekonštitúciu. S BAXJECTom II pripevneným na injekčnú liekovku s rozpúšťadlom obráťte
systém tak, aby bola injekčná liekovka s rozpúšťadlom navrchu. Bielym plastovým bodcom prepichnite zátku prášku ADVATE. Vákuum nasaje rozpúšťadlo do injekčnej liekovky
s práškom ADVATE (Obr. c).
8. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc.
Obr. a Obr. b Obr. c
 Príprava roztoku so systémom BAXJECT III
Príprava roztoku so systémom BAXJECT III
- Ak viečko úplne neutesňuje blister, výrobok nepoužívajte.
1. Ak je liek ešte uchovávaný v chladničke, vyberte uzavretý blister (obsahuje injekčnú liekovku s práškom a injekčnú liekovku s rozpúšťadlom zabudované v systéme na rekonštitúciu) z chladničky a zohrejte ich na izbovú teplotu (medzi 15 °C a 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Otvorte balenie ADVATE odlepením viečka. Vyberte systém BAXJECT III z blistra.
4. Položte liek ADVATE na rovný povrch s injekčnou liekovkou s rozpúšťadlom nahor (Obr. 1).
Injekčná liekovka s rozpúšťadlom má modrý prúžok. Neodstraňujte modré viečko, až kým nedostanete pokyn v ďalšom kroku.
5. Jednou rukou pridržte liek ADVATE v systéme BAXJECT III, druhou rukou pevne pritlačte na injekčnú liekovku s rozpúšťadlom, kým systém úplne nezaklapne a rozpúšťadlo nezačne prúdiť do injekčnej liekovky ADVATE (Obr. 2). Systém nenakláňajte, kým sa prenos nedokončí.
6. Overte, že prenos rozpúšťadla je úplný. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter
pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok
číry, bezfarebný a bez cudzorodých častíc.
Obr. 1 Obr. 2 Obr. 3 Podávanie
PodávaniePoužite aseptickú techniku
Lieky podávané parenterálne sa pred podaním musia skontrolovať, či neobsahujú pevné čiastočky, vždy keď to roztok a obal umožní. Použitý smie byť len číry a bezfarebný roztok.
1. Odstráňte modré viečko z BAXJECTu II/BAXJECTu III.
Nenasajte vzduch do injekčnej striekačky. Pripojte injekčnú striekačku k BAXJECTu II/BAXJECTu III.
2. Prevráťte systém (injekčná liekovka s pripraveným roztokom má byť hore). Natiahnite pripravený roztok do injekčnej striekačky pomalým vytiahnutím piestu smerom dozadu.
3. Odpojte injekčnú striekačku.
4. Pripojte krídelkovú ihlu na injekčnú striekačku. Injektujte intravenózne. Roztok sa má podávať pomaly, rýchlosťou ktorá pacientovi najviac vyhovuje a nepresahuje 10 ml za minútu. Pulzová frekvencia sa má zmerať pred podaním ADVATE a počas jeho podávania. Ak dôjde
k významnému vzostupu, zníženie rýchlosti podávania alebo dočasné prerušenie podávania zvyčajne postačí na to, aby príznaky rýchlo vymizli (pozri časti 4.4 a 4.8).
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBaxter AG Industriestrasse 67
A-1221 Viedeň
Rakúsko
8. REGISTRAČNÉ ČÍSLOEU/1/03/271/007
EU/1/03/271/017
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 2. marec 2004
Dátum posledného predĺženia registrácie: 2. marec 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
ADVATE 500 IU prášok a rozpúšťadlo na injekčný roztok.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá injekčná liekovka obsahuje 500 IU* ľudského koagulačného faktora VIII (rDNA), alfaoktokogu**. Po rekonštitúcii ADVATE obsahuje približne 250 IU ľudského koagulačného faktora VIII (rDNA), alfaoktokogu/ml.
Účinnosť (medzinárodné jednotky, IU) sa stanovuje pomocou chromogénneho testu Európskeho liekopisu. Špecifická aktivita lieku ADVATE je približne 4000 – 10 000 IU/mg proteínu. Alfaoktokog (ľudský koagulačný faktor VIII (rDNA)) je čistený proteín s 2332 aminokyselinami. Je produkovaný rekombinantnou DNA technológiou v bunkách ovárií čínskeho škrečka (Chinese
hamster ovary, CHO). Pripravený bez prídavku akýchkoľvek (exogénnych) ľudských alebo zvieracích proteínov v procese bunkovej kultivácie, purifikácie alebo konečnej úpravy.
Pomocné látky so známym účinkom:
0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Prášok a rozpúšťadlo na injekčný roztok. Prášok: biely až sivobiely drobivý prášok.
Rozpúšťadlo: číry a bezfarebný roztok.
4. KLINICKÉ ÚDAJE
4.1. TERAPEUTICKÉ INDIKÁCIE
Liečba a profylaxia krvácania u pacientov s hemofíliou A (vrodený nedostatok faktora VIII). Liek
ADVATE je indikovaný vo všetkých vekových skupinách.
4.2. Dávkovanie a spôsob podávania
Liečba sa má začať pod dohľadom lekára skúseného v liečbe hemofílie a so zabezpečenou okamžitou resuscitáciou v prípade anafylaxie.
Dávkovanie
Dávka a dĺžka substitučnej terapie závisí od závažnosti nedostatku faktora VIII, od miesta a rozsahu krvácania a od klinického stavu pacienta.
Počet jednotiek faktora VIII sa vyjadruje v medzinárodných jednotkách (International Units, IU), ktoré sa vzťahujú na štandard WHO pre lieky s faktorom VIII. Aktivita faktora VIII v plazme sa vyjadruje buď percentuálne (v relácii k normálnej ľudskej plazme) alebo v IU (podľa medzinárodného štandardu pre faktor VIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora VIII zodpovedá množstvu faktora VIII v jednom ml normálnej ľudskej plazmy.
Liečba on demand (podľa potreby)
Výpočet požadovanej dávky faktora VIII sa zakladá na empirickom zistení, že 1 IU faktora VIII na kg telesnej hmotnosti zvýši aktivitu plazmatického faktora VIII o 2 IU/dl. Potrebná dávka sa stanoví'
použitím nasledovného vzorca:
Požadované jednotky (IU) = telesná hmotnosť (kg) x požadovaný vzostup faktora VIII (%) x 0,5
V prípade nasledujúcich krvácavých príhod aktivita faktora VIII nemá počas zodpovedajúceho obdobia klesnúť pod danú hladinu aktivity v plazme (v % normálu alebo IU/dl). Ako návod na dávkovanie pri krvácaní alebo pri chirurgických zákrokoch možno použiť nasledovnú tabuľku 1:
Tabuľka 1 Návod na dávkovanie pri krvácaní a chirurgických zákrokoch
Stupeň krvácania/Typ chirurgického zákroku
Krvácanie
Začínajúca hemartróza, krvácanie do svalu alebo krvácanie v ústnej dutine.
Rozsiahlejšia hemartróza, krvácanie do svalu alebo hematóm.
Život ohrozujúce krvácania.
Chirurgický zákrok
Malý
Vrátane extrakcie zuba.
Veľký
Požadovaná hladina faktora VIII
(% alebo IU/dl)
20 – 40
30 – 60
60 – 100
30 – 60
80 – 100
(pred a po operácii)
Frekvencia dávok (hodiny)/ dĺžka trvania terapie (dni)
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým krvácavá príhoda, súdiac podľa bolesti, nepominie alebo kým nedôjde
k zahojeniu.
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších
ako 6 rokov) počas 3 – 4 dní alebo dlhšie až dovtedy, kým bolesť nepominie alebo kým sa neobnoví funkčnosť.
Opakujte injekcie každých 8 až 24 hodín
(6 až 12 hodín u pacientov mladších
ako 6 rokov), až dovtedy, kým nepominie stav ohrozenia života.
Každých 24 hodín (12 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým nedôjde
k zahojeniu.
Opakujte injekcie každých 8 až 24 hodín
(6 až 24 hodín u pacientov mladších
ako 6 rokov), do adekvátneho zahojenia rán, potom pokračujte v terapii najmenej ďalších 7 dní na udržanie aktivity
faktora VIII od 30 % do 60 % (IU/dl).

Dávka a frekvencia podávania sa majú v jednotlivých prípadoch prispôsobiť klinickej odpovedi.
Za určitých okolností (napr. prítomnosť nízkeho titra inhibítora) môžu byť potrebné vyššie dávky ako dávky vypočítané podľa vzorca.
V priebehu liečby sa odporúča primerané stanovovanie hladín plazmatického faktora VIII ako návod na určovanie podávanej dávky a frekvencie opakovaných injekcií. Predovšetkým v prípade veľkých chirurgických zákrokov je nevyhnutné presné sledovanie substitučnej terapie skúškami aktivity plazmatického faktora VIII. Reakcie jednotlivých pacientov na faktor VIII sa môžu
in vivo odlišovať a dosiahnuť odlišné hladiny obnovenia faktora VIII a preukázať rôzne polčasy.
Profylaxia
Na dlhodobú profylaxiu krvácania u pacientov s ťažkou hemofíliou A sú zvyčajné dávky 20 až 40 IU
faktora VIII na kg telesnej hmotnosti v intervaloch od 2 do 3 dní.
Pediatrická populácia
Dávkovanie pre liečbu on demand sa u pediatrických pacientov (0 až 18 rokov veku) nelíši od dospelých pacientov. U pacientov mladších ako 6 rokov sa na profylaktickú terapiu odporúča dávkovanie 20 až 50 IU faktora VIII na kg telesnej hmotnosti 3 až 4-krát do týždňa.
Použitie 2 ml obchodnej formy nebolo dokumentované pre deti mladšie ako 2 roky.
Spôsob podávania
ADVATE sa má podávať intravenóznou cestou. V prípade, že liek nepodáva zdravotnícky pracovník je nutné jeho náležité zaškolenie.
Rýchlosť podávania sa má ustáliť podľa toho, ako to pacientovi najviac vyhovuje a smie dosiahnuť
maximálne 10 ml/min.
Po rekonštitúcii je roztok číry, bezfarebný, bez cudzorodých častíc s pH medzi 6,7 až 7,3. Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3. Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na proteíny myši alebo škrečka.
4.4. Osobitné upozornenia a opatrenia pri používaní
Precitlivenosť
U ADVATE boli hlásené reakcie z precitlivenosti alergického typu vrátane anafylaxie a prejavili sa závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Liek obsahuje stopy proteínov myši a škrečka. Pacienti majú byť upozornení, že ak sa vyskytnú príznaky precitlivenosti, odporúča sa používanie lieku okamžite prerušiť a kontaktovať svojho lekára. Pacienti majú byť informovaní o prvotných príznakoch reakcií z precitlivenosti zahŕňajúcich vyrážky, generalizovanú žihľavku, pocit tiesne na hrudníku, pískavé dýchanie, hypotenzia a anafylaxiu.
V prípade šoku má byť zavedená štandardná lekárska liečba šoku.
Kvôli poklesu injekčného objemu pre liek ADVATE rozpusteného v 2 ml sterilizovanej vody na injekcie, ak sa vyskytnú reakcie z precitlivenosti, je menej času na reakciu zastavením injekcie.
Počas injekcie lieku ADVATE rozpusteného v 2 ml sterilizovanej vody na injekcie sa preto odporúča opatrnosť, najmä u detí.
Inhibítory
Známou komplikáciou liečby jedincov s hemofíliou A je vznik protilátok (inhibítorov) neutralizujúcich faktor VIII. Tieto inhibítory sú zvyčajne imunoglobulíny IgG pôsobiace proti prokoagulačnej aktivite faktora VIII, ktoré sú kvantifikované v Bethesdových jednotkách (BU) na ml
plazmy použitím modifikovanej skúšky. U pacientov, u ktorých sa objavia inhibítory faktora VIII, sa
klinický stav môže prejavovať ako nedostatočná klinická odpoveď. V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu. Riziko vzniku inhibítorov koreluje s rozsahom expozície faktoru VIII, toto riziko býva najvyššie počas prvých 20 dní expozície, a tiež s inými genetickými faktormi a faktormi prostredia. V zriedkavých prípadoch môžu inhibítory vzniknúť po prvých 100 dňoch expozície.
Boli pozorované prípady opakovaného vzniku inhibítorov (nízky titer) po prechode z jedného lieku s faktorom VIII na iný u predtým liečených pacientov s viac ako 100 dňami expozície, ktorí majú
v anamnéze vznik inhibítorov. Odporúča sa preto, aby všetci pacienti po prechode z jedného lieku na iný boli pozorne sledovaní na vznik inhibítorov.
Vo všeobecnosti všetci pacienti s koagulačným faktorom VIII majú byť pomocou náležitých klinických pozorovaní a laboratórnych vyšetrení pozorne sledovaní na vznik inhibítorov. Ak sa očakávané hladiny aktivity faktora VIII v plazme nedosiahnu, alebo ak krvácanie nie je kontrolované vhodnou dávkou, má sa vykonať testovanie prítomnosti inhibítorov faktora VIII. U pacientov
s vysokými hladinami inhibítora, substitučná terapia faktorom VIII nemusí byť účinná a treba zvážiť
iné možnosti liečby. Liečba takých pacientov má byť riadená lekármi so skúsenosťami so starostlivosťou o pacientov s hemofíliou a inhibítormi faktora VIII.
Nesprávna aplikácia lieku ADVATE
Nesprávna aplikácia (intraarteriálna alebo paravenózna) lieku ADVATE, rozpusteného v 2 ml sterilizovanej vody na injekcie, môže spôsobiť mierne krátkodobé reakcie v mieste podania, ako sú podliatina a erytém.
Komplikácie liečby súvisiace s katétrom
Ak je potrebný centrálny venózny katéter (CVK), musí sa zvážiť riziko komplikácií súvisiacich s CVK
vrátane lokálnych infekcií, bakterémie a trombózy v mieste zavedenia katétra.
Aspekty týkajúce sa pomocného základu
Po príprave tento liek obsahuje 0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke. Má sa to vziať
do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
Dôrazne odporúčame, aby sa pri každom podávaní lieku ADVATE pacientovi, zapísali názov a číslo šarže lieku, a tak sa uchovalo prepojenie medzi pacientom a šaržou lieku.
Pediatrická populácia:
Uvedené upozornenia a opatrenia pri používaní sa týkajú detí aj dospelých.
4.5. Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s ADVATE.
4.6. Fertilita, gravidita a laktácia
Neuskutočnili sa reprodukčné štúdie s faktorom VIII na zvieratách. Vzhľadom k zriedkavému výskytu hemofílie A u žien, nie sú k dispozícii údaje týkajúce sa použitia faktora VIII počas gravidity
a laktácie. Z tohto dôvodu má byť faktor VIII používaný počas gravidity a dojčenia iba v nevyhnutných prípadoch.
4.7. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
ADVATE nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8. Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Klinické štúdie s ADVATE zahŕňali 418 účastníkov vystavených najmenej raz lieku ADVATE
hlásiacich celkovo 93 nežiaducich liekových reakcií (adverse drug reactions, ADR). ADR, ktoré
sa vyskytli s najväčšou frekvenciou, boli vznik neutralizačných protilátok faktora VIII (inhibítorov), bolesť hlavy, a horúčka.
Reakcie precitlivenosti alebo alergické reakcie (ako angioedém, pálenie a pichanie v mieste infúzie, zimnica, začervenanie kože, generalizovaná žihľavka, bolesť hlavy, vyrážky, hypotenzia, letargia, nauzea, nepokoj, tachykardia, pocit tiesne na hrudníku, mravčenie, vracanie, pískavé dýchanie)
boli pozorované zriedkavo, a v niektorých prípadoch sa z nich môže vyvinúť závažná anafylaxia
(vrátane šoku).
Môže byť pozorovaný vznik protilátok proti proteínu myši alebo škrečka so súvisiacimi reakciami precitlivenosti.
U pacientov s hemofíliou A môžu vznikať neutralizačné protilátky (inhibítory) faktora VIII. Ak dôjde k vzniku takých inhibítorov, klinický stav sa môže prejavovať ako nedostatočná klinická odpoveď.
V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu.
Tabuľkové zhrnutie nežiaducich reakcií
Nasledujúca tabuľka 2 uvádza frekvenciu nežiaducich liekových reakcií v klinických štúdiách
a v spontánne hlásených prípadoch. Táto tabuľka je podľa klasifikácie orgánových systémov MEDRA (SOC a preferovaných termínov).
Nežiaduce reakcie sú uvedené podľa nasledujúceho pravidla: veľmi časté (≥ 1/10), časté (≥ 1/100 až
< 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 2 Frekvencia nežiaducich liekových reakcií (ADR) v klinických štúdiách a spontánne hlásených prípadoch
MedDRA štandardná trieda orgánových systémov
Infekcie a nákazy
Poruchy krvi a lymfatického systému
Poruchy imunitného systému
Poruchy nervového systému
Nežiaduca reakcia Frekvenciaa
Chrípka Menej časté Laryngitída Menej časté Inhibícia faktora VIIIc Časté Lymfangitída Menej časté Anafylaktická reakcia Nie je známe Precitlivenosťc Nie je známe Bolesť hlavy Časté
Závrat Menej časté Porucha pamäte Menej časté Synkopa Menej časté Tremor Menej časté Migréna Menej časté Porucha chuti Menej časté
Poruchy oka Zápal oka Menej časté
Poruchy srdca a srdcovej činnosti Palpitácie Menej časté

Poruchy ciev
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Hematóm Menej časté Návaly tepla Menej časté Bledosť Menej časté Dyspnoe Menej časté
Hnačka Menej časté Bolesť v hornej časti brucha Menej časté Nevoľnosť Menej časté Vracanie Menej časté Svrbenie Menej časté Vyrážka Menej časté Hyperhidróza Menej časté Žihľavka Menej časté
Tabuľka 2 Frekvencia nežiaducich liekových reakcií (ADR) v klinických štúdiách a spontánne hlásených prípadoch
MedDRA štandardná trieda orgánových systémov
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Úrazy, otravy a komplikácie liečebného postupu
Nežiaduca reakcia Frekvenciaa
Pyrexia Časté Periférny edém Menej časté Bolesť na hrudi Menej časté Hrudný dyskomfort Menej časté Zimnica Menej časté Nezvyčajný pocit Menej časté Hemátóm v mieste punkcie cievy Menej časté Únava Nie je známe Reakcia v mieste injekcie Nie je známe Nevoľnosť Nie je známe Zvýšený počet monocytov Menej časté Znížená hladina koagulačného faktora VIIIb Menej časté Znížený hematokrit Menej časté Abnormálne výsledky laboratórnych testov Menej časté Postprocedurálna komplikácia Menej časté Postprocedurálne krvácanie Menej časté Reakcia v mieste podania Menej časté

a) Vypočítané na základe celkového počtu pacientov, ktorí dostávali ADVATE (418).
b) U jedného pacienta sa počas kontinuálnej infúzie ADVATE po operácii (pooperačné
dni 10 - 14) vyskytli neočakávane znížené hladiny koagulačného faktora VIII. Hemostáza bola počas tohto obdobia stále udržiavaná a ako hladina faktora VIII, tak aj hodnoty klírensu sa vrátili na dostatočné hodnoty do 15. pooperačného dňa. Skúšky inhibítora faktora VIII uskutočnené po ukončení kontinuálnej infúzie a v závere štúdie boli negatívne.
c) Nežiaduce reakcie vysvetlené v časti nižšie.
Opis vybratých nežiaducich reakciíVznik inhibítorovBol hlásený vznik inhibítorov u predtým liečených pacientov (PTP) a u predtým neliečených pacientov (PUP). Bližšie údaje nájdete v časti 5.1 (Farmakologické vlastnosti) a 4.4 (Osobitné upozornenia a opatrenia pri používaní).
Nežiaduce reakcie špecifické pre pozostatky z výrobného procesuZ 229 liečených pacientov, ktorí boli hodnotení na protilátky proti proteínu buniek ovárií čínskeho škrečka (CHO), sa u 3 dokázal štatisticky významný vzostupný trend v titroch, u 4 sa ukázali pretrvávajúce vrcholy alebo prechodné výkyvy a jeden pacient mal oboje, ale nemal žiadne klinické príznaky. Z 229 liečených pacientov, ktorí boli hodnotení na protilátky proti myším IgG, sa
u 10 dokázal štatisticky významný vzostupný trend v titroch, u 2 sa ukázali pretrvávajúce vrcholy alebo prechodné výkyvy a jeden pacient mal oboje. Štyria z týchto pacientov hlásili jednotlivé prípady
urtikárie, pruritu, vyrážky a mierne zvýšeného počtu eozinofilov v rámci opakovaných expozícií lieku v štúdii.
PrecitlivenosťReakcie alergického typu vrátane anafylaxie, ktoré sa prejavili závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Pediatrická populáciaV klinických štúdiách neboli uvedené žiadne vekovo špecifické rozdiely v nežiaducich reakciách iné ako vznik inhibítorov u predtým neliečených detských pacientov (PUP) a komplikácie súvisiace
s katétrom.
Hlásenie podozrení na nežiaduce reakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9. PredávkovanieNeboli hlásené žiadne prípady predávkovania rekombinantným koagulačným faktorom VIII.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1. Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antihemoragiká: krvný koagulačný faktor VIII. ATC kód: B02BD02. Komplex faktora VIII/von Willebrandovho faktora sa skladá z dvoch molekúl (faktor VIII
a von Willebrandov faktor) s odlišnými fyziologickými funkciami. ADVATE obsahuje rekombinantný
koagulačný faktor VIII (alfaoktokog), glykoproteín ktorý je biologicky rovnocenný s glykoproteínu faktora VIII obsiahnutom v ľudskej plazme.
Alfaoktokog je glykoproteín skladajúci sa z 2332 aminokyselín s molekulárnou hmotnosťou
približne 280 kD. Alfaoktokog sa pri podávaní infúziou hemofilickému pacientovi viaže na endogénny von Willebrandov faktor v pacientovom krvnom obehu. Aktivovaný faktor VIII pôsobí ako kofaktor pre aktivovaný faktor IX, urýchľujúci konverziu faktora X na aktivovaný faktor X. Aktivovaný
faktor X premieňa protrombín na trombín. Trombín potom premieňa fibrinogén na fibrín a môže sa vytvoriť krvná zrazenina. Hemofília A je dedičná porucha zrážania krvi viazaná na pohlavie, spôsobená zníženými hladinami aktivity faktora VIII a má za následok profúzne krvácanie do kĺbov, svalov alebo vnútorných orgánov, ktoré vzniká buď spontánne, alebo ako dôsledok úrazu alebo chirurgického zákroku. Plazmatické hladiny faktora VIII sa substitučnou liečbou zvyšujú,
čo umožňuje dočasnú úpravu nedostatku faktora VIII a úpravu sklonu ku krvácaniu.
Vznik inhibítorovImunogenicita ADVATE sa hodnotila u predtým liečených pacientov. Počas klinických štúdií
s ADVATE u 233 pediatrických (pediatrickí pacienti vo veku 0 až 16 rokov) a dospelých pacientov (starší ako 16 rokov), ktorým bola diagnostikovaná ťažká hemofília A (faktor VIII ≤ 1 %) a ktorí boli predtým vystavení koncentrátom faktora VIII po dobu ≥ 150 dní pre dospelých a staršie deti, a
po dobu ≥ 50 dní pre deti mladšie ako 6 rokov, sa po 26 dňoch expozície ADVATE vyvinul nízky titer inhibítora (2,4 BU v modifikovanej Bethesdovej skúške) u jedného pacienta. Nasledujúce testy na inhibítor vykonané u tohto pacienta po vyradení zo štúdie boli negatívne. V rámci všetkých štúdií bol medián expozície lieku ADVATE 97,0 expozičných dní na účastníka (rozsah 1 až 709) pre predtým liečených pacientov. Celkový výskyt vzniku inhibítorov faktora VIII (nízky alebo vysoký) bol 0,4 %
(1 z 233).
V ukončenej nekontrolovanej štúdii 060103, 16 zo 45 (35,6 %) predtým neliečených pacientov
s ťažkou hemofíliou A (faktor VIII < 1 %) a najmenej s 25 dňami expozície faktoru VIII vznikli inhibítory faktora VIII u: 7 (15,6 %) účastníkov vznikli inhibítory s vysokým titrom a u 9 (20 %) účastníkov vznikli inhibítory s nízkym titrom, 1 z nich bol tiež klasifikovaný ako prechodný inhibítor. Rizikové faktory súvisiace so vznikom inhibítorov v tejto štúdii zahŕňali iné ako kaukazské etnikum, familiárny výskyt inhibítorov a intenzívnu liečbu vysokou dávkou počas prvých 20 dní expozície.
U 20 účastníkov, ktorí nemali žiadny z týcho rizikových faktorov, nevznikli žiadne inhibítory.
Boli sústredené údaje o vyvolaní imunitnej tolerancie (ITI) u pacientov s inhibítormi. V rámci čiastkovej štúdie PNP 060103 bola zdokumentovaná liečba ITI u 11 predtým neliečených pacientov (PUP). Bola vypracovaná retrospektívna hodnotiaca schéma pre 30 pacientov s ITI (štúdia 060703)
a prebieha zhromažďovanie údajov do registra.
V štúdii 060201 boli porovnávané dve dlhodobé profylaktické liečebné schémy u 53 predtým liečených osôb: farmakokinetický riadený dávkovací režim prispôsobený individuálnym účastníkom (v rozsahu 20 až 80 IU faktora VIII na kg telesnej hmotnosti v intervaloch 72 ± 6 hodín, n=23)
so štandardným profylaktickým dávkovacím režimom (20 až 40 IU/kg každých 48 ± 6 hodín, n=30). Farmakokinetický riadený dávkovací režim (podľa osobitného vzorca) bol zacielený na udržanie minimálnych hladín (tzv. trough level) faktora VIII ≥ 1 % v intervale medzi dávkovaním 72 hodín. Údaje z tejto štúdie ukazujú, že tieto dva profylaktické dávkovacie režimy sú porovnateľné, čo sa týka redukcie miery krvácania.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom ADVATE vo všetkých podskupinách pediatrickej populácie s hemofíliou A (vrodený deficit faktora VIII) pri „indukcii imunitnej tolerancie (ITI) u pacientov s hemofíliou A (vrodený deficit
faktora VIII), u ktorých vznikli inhibítory faktora VIII“ a „liečbe a profylaxii krvácania u pacientov s hemofíliou A (vrodený deficit faktora VIII)“. (Informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2. Farmakokinetické vlastnosti
Všetky farmakokinetické štúdie s ADVATE boli vykonávané u predtým liečených pacientov s ťažkou až stredne ťažkou hemofíliou A (východiskový faktor VIII ≤ 2%). Analýza vzoriek plazmy bola vykonávaná v centrálnom laboratóriu použitím jednostupňovej skúšky zrážavosti.
Celkovo 195 pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %) poskytlo farmakokinetické (FK) parametre, ktoré boli začlenené do FK analytického súboru „per-protocol“. Kategórie týchto analýz pre dojčatá (1 mesiac do < 2 rokov veku), deti (2 až < 5 rokov veku), staršie deti (5 až < 12 rokov veku), mladistvých (12 až < 18 rokov veku) a dospelých (18 rokov veku a starší) boli použité na sumarizáciu FK parametrov, kde vek bol definovaný ako vek v dobe FK infúzie.
Tabuľka 3 Súhrn farmakokinetických parametrov ADVATE podľa vekovej skupiny pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %)
Parameter (priemer
± štandardná odchýlka)
Dojčatá
(n=5)
Deti
(n=30)
Staršie deti
(n=18)
Mladiství
(n=33)
Dospelí
(n=109)
Celková AUC (IU*h/dl) Upravené progresívne obnovenie hladiny Cmax (IU/dl na IU/kg)a
1362,1 ± 311,8 1180,0 ± 432,7 1506,6 ± 530,0 1317,1 ± 438,6 1538,5 ± 519,1
2,2 ± 0,6 1,8 ± 0,4 2,0 ± 0,5 2,1 ± 0,6 2,2 ± 0,6
Polčas (h) 9,0 ± 1,5 9,6 ± 1,7 11,8 ± 3,8 12,1 ± 3,2 12,9 ± 4,3
Maximálna plazmatická koncentrácia po infúzii (IU/dl) Priemerný rezidenčný čas (h)
Distribučný objem v ustálenom stave (dl/kg)
110,5 ± 30,2 90,8 ± 19,1 100,5 ± 25,6 107,6 ± 27,6 111,3 ± 27,1
11,0 ± 2,8 12,0 ± 2,7 15,1 ± 4,7 15,0 ± 5,0 16,2 ± 6,1
0,4 ± 0,1 0,5 ± 0,1 0,5 ± 0,2 0,6 ± 0,2 0,5 ± 0,2

Klírens (ml/kg*h) 3,9 ± 0,9 4,8 ± 1,5 3,8 ± 1,5 4,1 ± 1,0 3,6 ± 1,2 a Vypočítané ako (Cmax – faktor VIII na začiatku liečby) delené dávkou v IU/kg, kde Cmax je maximálny nameraný faktor VIII po infúzii.
Bezpečnosť a hemostatická účinnosť lieku ADVATE v pediatrickej populácii sú podobné ako tieto parametre u dospelých pacientov. Upravené obnovenie a konečný polčas (t½) boli približne o 20% nižšie u mladších detí (mladších ako 6 rokov) ako u dospelých, čo je v súlade so známym vyšším objemom plazmy na kilogram telesnej hmotnosti u mladších pacientov.
Aktuálne nie sú k dispozícii farmakokinetické údaje o ADVATE u predtým neliečených pacientov.
5.3. Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe farmakologických štúdií bezpečnosti, akútnej toxikológie, toxicity po opakovanom podaní, lokálnej toxicity a genotoxicity neodhalili žiadne osobitné riziko pre ľudí.
Štúdia lokálnej tolerancie u králikov ukázala, že liek ADVATE, rozpustený v 2 ml sterilizovanej vody na injekcie, je po intravenóznom podaní dobre tolerovaný. Slabé prechodné začervenanie v mieste podania bolo pozorované po intraarteriálnej aplikácii a po paravenóznom podaní. Nedala sa však pozorovať žiadna korelácia nežiaducich histopatologických zmien, čo hovorí o prechodných vlastnostiach tohto zistenia.
6. FARMACEUTICKÉ INFORMÁCIE
6.1. Zoznam pomocných látok
Prášok Manitol Chlorid sodný Histidín Trehalóza
Chlorid vápenatý Trometamol Polysorbát 80
Glutatión (redukovaný)
Rozpúšťadlo
Sterilizovaná voda na injekciu
6.2. Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi alebo rozpúšťadlami.
6.3. Čas použiteľnosti
2 roky.
Po rekonštitúcii: z mikrobiologického hľadiska sa má liek použiť okamžite. Avšak chemická a fyzikálna stabilita počas používania bola pri teplote 25 °C preukázaná na 3 hodiny.
V rámci času použiteľnosti sa liek môže uchovávať pri izbovej teplote (až do 25 °C) počas jedného obdobia nepresahujúceho 6 mesiacov. Na balenie lieku zaznamenajte dátum konca 6-mesačného uchovávania pri izbovej teplote. Liek sa nesmie vrátiť späť do chladničky.
6.4. Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke pri teplote (2 °C – 8 °C). Neuchovávajte v mrazničke.
ADVATE s pomôckou BAXJECT II: Injekčnú liekovku s liekom uchovávajte vo vonkajšom obale na ochranu pred svetlom.
ADVATE v systéme BAXJECT III: Uzavretý blister uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5. Druh obalu a obsah balenia
Injekčná liekovka s práškom a 2 ml injekčná liekovka s rozpúšťadlom sú vyrobené zo skla typu
I a uzatvorené chlorobutylovými gumenými zátkami. Liek sa dodáva v jednej z nasledujúcich foriem:
- ADVATE s pomôckou BAXJECT II: Každé balenie obsahuje injekčnú liekovku
s práškom, 2 ml injekčnú liekovku s rozpúšťadlom a pomôcku na rekonštitúciu (BAXJECT II).
- ADVATE v systéme BAXJECT III: Každé balenie obsahuje systém BAXJECT v uzavretom blistri (injekčná liekovka s práškom a 2 ml injekčná liekovka s rozpúšťadlom sú zabudované v systéme na rekonštitúciu).
6.6. Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
ADVATE sa podáva intravenózne po rekonštitúcii lieku.
Pripravený roztok sa má skontrolovať vizuálne, či neobsahuje cudzorodé častice a či nemá zmenenú farbu.
Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc. Nepoužívajte zakalené roztoky alebo roztoky s usadeninami.
- Na podávanie je potrebné použiť injekčnú striekačku s konektorom luer-lock.
- Použite do troch hodín po príprave.
- Po príprave liek neuchovávajte v chladničke.
- Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Príprava roztoku s pomôckou BAXJECT II
- Na rekonštitúciu použite len pribalenú sterilizovanú vodu na injekciu a pomôcku na rekonštitúciu.
- Nepoužívajte, ak je pomôcka BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
- Má byť použitá aseptická technika
1. Ak je liek ešte uchovávaný v chladničke, vyberte injekčnú liekovku s práškom ADVATE
a injekčnú liekovku s rozpúšťadlom z chladničky a zohrejte ich na izbovú teplotu
(medzi 15 °C - 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Odstráňte uzáver z injekčnej liekovky s práškom a uzáver z injekčnej liekovky s rozpúšťadlom
4. Očistite zátky tampónmi napustenými alkoholom. Injekčné liekovky umiestnite na rovný čistý povrch.
5. Otvorte balenie pomôcky BaxJect II odtrhnutím papierového viečka bez toho, aby ste sa dotkli vnútrajška (Obr. a). Nevyberajte pomôcku z balenia. Nepoužívajte, ak je pomôcka
BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
6. Otočte balenie nahor a prepichnite zátku rozpúšťadla čírym plastovým bodcom. Uchopte balenie za jeho okraj a stiahnite balenie z BAXJECTu II (Obr. b). Neodstraňujte modré viečko z pomôcky BAXJECT II.
7. Na rekonštitúciu sa má použiť len pribalená sterilizovaná voda na injekciu a pomôcka na rekonštitúciu. S BAXJECTom II pripevneným na injekčnú liekovku s rozpúšťadlom obráťte
systém tak, aby bola injekčná liekovka s rozpúšťadlom navrchu. Bielym plastovým bodcom prepichnite zátku prášku ADVATE. Vákuum nasaje rozpúšťadlo do injekčnej liekovky
s práškom ADVATE (Obr. c).
8. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc.
Obr. a Obr. b Obr. c
 Príprava roztoku so systémom BAXJECT III
Príprava roztoku so systémom BAXJECT III
- Ak viečko úplne neutesňuje blister, výrobok nepoužívajte.
1. Ak je liek ešte uchovávaný v chladničke, vyberte uzavretý blister (obsahuje injekčnú liekovku s práškom a injekčnú liekovku s rozpúšťadlom zabudované v systéme na rekonštitúciu) z chladničky a zohrejte ich na izbovú teplotu (medzi 15 °C a 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Otvorte balenie ADVATE odlepením viečka. Vyberte systém BAXJECT III z blistra.
4. Položte liek ADVATE na rovný povrch s injekčnou liekovkou s rozpúšťadlom nahor (Obr. 1).
Injekčná liekovka s rozpúšťadlom má modrý prúžok. Neodstraňujte modré viečko, až kým nedostanete pokyn v ďalšom kroku.
5. Jednou rukou pridržte liek ADVATE v systéme BAXJECT III, druhou rukou pevne pritlačte na injekčnú liekovku s rozpúšťadlom, kým systém úplne nezaklapne a rozpúšťadlo nezačne prúdiť do injekčnej liekovky ADVATE (Obr. 2). Systém nenakláňajte, kým sa prenos nedokončí.
6. Overte, že prenos rozpúšťadla je úplný. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter
pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok
číry, bezfarebný a bez cudzorodých častíc.
Obr. 1 Obr. 2 Obr. 3 Podávanie
PodávaniePoužite aseptickú techniku
Lieky podávané parenterálne sa pred podaním musia skontrolovať, či neobsahujú pevné čiastočky, vždy keď to roztok a obal umožní. Použitý smie byť len číry a bezfarebný roztok.
1. Odstráňte modré viečko z BAXJECTu II/BAXJECTu III.
Nenasajte vzduch do injekčnej striekačky. Pripojte injekčnú striekačku k BAXJECTu II/BAXJECTu III.
2. Prevráťte systém (injekčná liekovka s pripraveným roztokom má byť hore). Natiahnite pripravený roztok do injekčnej striekačky pomalým vytiahnutím piestu smerom dozadu.
3. Odpojte injekčnú striekačku.
4. Pripojte krídelkovú ihlu na injekčnú striekačku. Injektujte intravenózne. Roztok sa má podávať pomaly, rýchlosťou ktorá pacientovi najviac vyhovuje a nepresahuje 10 ml za minútu. Pulzová frekvencia sa má zmerať pred podaním ADVATE a počas jeho podávania. Ak dôjde
k významnému vzostupu, zníženie rýchlosti podávania alebo dočasné prerušenie podávania zvyčajne postačí na to, aby príznaky rýchlo vymizli (pozri časti 4.4 a 4.8).
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBaxter AG Industriestrasse 67
A-1221 Viedeň
Rakúsko
8. REGISTRAČNÉ ČÍSLOEU/1/03/271/008
EU/1/03/271/018
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 2. marec 2004
Dátum posledného predĺženia registrácie: 2. marec 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
ADVATE 1000 IU prášok a rozpúšťadlo na injekčný roztok.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá injekčná liekovka obsahuje 1000 IU* ľudského koagulačného faktora VIII (rDNA), alfaoktokogu**. Po rekonštitúcii ADVATE obsahuje približne 500 IU ľudského koagulačného faktora VIII (rDNA), alfaoktokogu/ml.
Účinnosť (medzinárodné jednotky, IU) sa stanovuje pomocou chromogénneho testu Európskeho liekopisu. Špecifická aktivita lieku ADVATE je približne 4000 – 10 000 IU/mg proteínu. Alfaoktokog (ľudský koagulačný faktor VIII (rDNA)) je čistený proteín s 2332 aminokyselinami. Je produkovaný rekombinantnou DNA technológiou v bunkách ovárií čínskeho škrečka (Chinese
hamster ovary, CHO). Pripravený bez prídavku akýchkoľvek (exogénnych) ľudských alebo zvieracích proteínov v procese bunkovej kultivácie, purifikácie alebo konečnej úpravy.
Pomocné látky so známym účinkom:
0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Prášok a rozpúšťadlo na injekčný roztok. Prášok: biely až sivobiely drobivý prášok.
Rozpúšťadlo: číry a bezfarebný roztok.
4. KLINICKÉ ÚDAJE
4.1. TERAPEUTICKÉ INDIKÁCIE
Liečba a profylaxia krvácania u pacientov s hemofíliou A (vrodený nedostatok faktora VIII). Liek
ADVATE je indikovaný vo všetkých vekových skupinách.
4.2. Dávkovanie a spôsob podávania
Liečba sa má začať pod dohľadom lekára skúseného v liečbe hemofílie a so zabezpečenou okamžitou resuscitáciou v prípade anafylaxie.
Dávkovanie
Dávka a dĺžka substitučnej terapie závisí od závažnosti nedostatku faktora VIII, od miesta a rozsahu krvácania a od klinického stavu pacienta.
Počet jednotiek faktora VIII sa vyjadruje v medzinárodných jednotkách (International Units, IU), ktoré sa vzťahujú na štandard WHO pre lieky s faktorom VIII. Aktivita faktora VIII v plazme sa vyjadruje buď percentuálne (v relácii k normálnej ľudskej plazme) alebo v IU (podľa medzinárodného štandardu pre faktor VIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora VIII zodpovedá množstvu faktora VIII v jednom ml normálnej ľudskej plazmy.
Liečba on demand (podľa potreby)
Výpočet požadovanej dávky faktora VIII sa zakladá na empirickom zistení, že 1 IU faktora VIII na kg telesnej hmotnosti zvýši aktivitu plazmatického faktora VIII o 2 IU/dl. Potrebná dávka sa stanoví
použitím nasledovného vzorca:
Požadované jednotky (IU) = telesná hmotnosť (kg) x požadovaný vzostup faktora VIII (%) x 0,5
V prípade nasledujúcich krvácavých príhod aktivita faktora VIII nemá počas zodpovedajúceho obdobia klesnúť pod danú hladinu aktivity v plazme (v % normálu alebo IU/dl). Ako návod na dávkovanie pri krvácaní alebo pri chirurgických zákrokoch možno použiť nasledovnú tabuľku 1:
Tabuľka 1 Návod na dávkovanie pri krvácaní a chirurgických zákrokoch
Stupeň krvácania/Typ chirurgického zákroku
Krvácanie
Začínajúca hemartróza, krvácanie do svalu alebo krvácanie v ústnej dutine.
Rozsiahlejšia hemartróza, krvácanie do svalu alebo hematóm.
Život ohrozujúce krvácania.
Chirurgický zákrok
Malý
Vrátane extrakcie zuba.
Veľký
Požadovaná hladina faktora VIII
(% alebo IU/dl)
20 – 40
30 – 60
60 – 100
30 – 60
80 – 100
(pred a po operácii)
Frekvencia dávok (hodiny)/ dĺžka trvania terapie (dni)
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým krvácavá príhoda, súdiac podľa bolesti, nepominie alebo kým nedôjde
k zahojeniu.
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších
ako 6 rokov) počas 3 – 4 dní alebo dlhšie až dovtedy, kým bolesť nepominie alebo kým sa neobnoví funkčnosť.
Opakujte injekcie každých 8 až 24 hodín
(6 až 12 hodín u pacientov mladších
ako 6 rokov), až dovtedy, kým nepominie stav ohrozenia života.
Každých 24 hodín (12 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým nedôjde
k zahojeniu.
Opakujte injekcie každých 8 až 24 hodín
(6 až 24 hodín u pacientov mladších
ako 6 rokov), do adekvátneho zahojenia rán, potom pokračujte v terapii najmenej ďalších 7 dní na udržanie aktivity
faktora VIII od 30 % do 60 % (IU/dl).

Dávka a frekvencia podávania sa majú v jednotlivých prípadoch prispôsobiť klinickej odpovedi.
Za určitých okolností (napr. prítomnosť nízkeho titra inhibítora) môžu byť potrebné vyššie dávky ako dávky vypočítané podľa vzorca.
V priebehu liečby sa odporúča primerané stanovovanie hladín plazmatického faktora VIII ako návod na určovanie podávanej dávky a frekvencie opakovaných injekcií. Predovšetkým v prípade veľkých chirurgických zákrokov je nevyhnutné presné sledovanie substitučnej terapie skúškami aktivity plazmatického faktora VIII. Reakcie jednotlivých pacientov na faktor VIII sa môžu
in vivo odlišovať a dosiahnuť odlišné hladiny obnovenia faktora VIII a preukázať rôzne polčasy.
Profylaxia
Na dlhodobú profylaxiu krvácania u pacientov s ťažkou hemofíliou A sú zvyčajné dávky 20 až 40 IU
faktora VIII na kg telesnej hmotnosti v intervaloch od 2 do 3 dní.
Pediatrická populácia
Dávkovanie pre liečbu on demand sa u pediatrických pacientov (0 až 18 rokov veku) nelíši od dospelých pacientov. U pacientov mladších ako 6 rokov sa na profylaktickú terapiu odporúča dávkovanie 20 až 50 IU faktora VIII na kg telesnej hmotnosti 3 až 4-krát do týždňa.
Použitie 2 ml obchodnej formy nebolo dokumentované pre deti mladšie ako 2 roky.
Spôsob podávania
ADVATE sa má podávať intravenóznou cestou. V prípade, že liek nepodáva zdravotnícky pracovník je nutné jeho náležité zaškolenie.
Rýchlosť podávania sa má ustáliť podľa toho, ako to pacientovi najviac vyhovuje a smie dosiahnuť
maximálne 10 ml/min.
Po rekonštitúcii je roztok číry, bezfarebný, bez cudzorodých častíc s pH medzi 6,7 až 7,3. Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3. Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na proteíny myši alebo škrečka.
4.4. Osobitné upozornenia a opatrenia pri používaní
Precitlivenosť
U ADVATE boli hlásené reakcie z precitlivenosti alergického typu vrátane anafylaxie a prejavili sa závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Liek obsahuje stopy proteínov myši a škrečka. Pacienti majú byť upozornení, že ak sa vyskytnú príznaky precitlivenosti, odporúča sa používanie lieku okamžite prerušiť a kontaktovať svojho lekára. Pacienti majú byť informovaní o prvotných príznakoch reakcií z precitlivenosti zahŕňajúcich vyrážky, generalizovanú žihľavku, pocit tiesne na hrudníku, pískavé dýchanie, hypotenzia a anafylaxiu.
V prípade šoku má byť zavedená štandardná lekárska liečba šoku.
Kvôli poklesu injekčného objemu pre liek ADVATE rozpusteného v 2 ml sterilizovanej vody na injekcie, ak sa vyskytnú reakcie z precitlivenosti, je menej času na reakciu zastavením injekcie.
Počas injekcie lieku ADVATE rozpusteného v 2 ml sterilizovanej vody na injekcie sa preto odporúča opatrnosť, najmä u detí.
Inhibítory
Známou komplikáciou liečby jedincov s hemofíliou A je vznik protilátok (inhibítorov) neutralizujúcich faktor VIII. Tieto inhibítory sú zvyčajne imunoglobulíny IgG pôsobiace proti prokoagulačnej aktivite faktora VIII, ktoré sú kvantifikované v Bethesdových jednotkách (BU) na ml
plazmy použitím modifikovanej skúšky. U pacientov, u ktorých sa objavia inhibítory faktora VIII, sa
klinický stav môže prejavovať ako nedostatočná klinická odpoveď. V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu. Riziko vzniku inhibítorov koreluje s rozsahom expozície faktoru VIII, toto riziko býva najvyššie počas prvých 20 dní expozície, a tiež s inými genetickými faktormi a faktormi prostredia. V zriedkavých prípadoch môžu inhibítory vzniknúť po prvých 100 dňoch expozície.
Boli pozorované prípady opakovaného vzniku inhibítorov (nízky titer) po prechode z jedného lieku s faktorom VIII na iný u predtým liečených pacientov s viac ako 100 dňami expozície, ktorí majú
v anamnéze vznik inhibítorov. Odporúča sa preto, aby všetci pacienti po prechode z jedného lieku na iný boli pozorne sledovaní na vznik inhibítorov.
Vo všeobecnosti všetci pacienti s koagulačným faktorom VIII majú byť pomocou náležitých klinických pozorovaní a laboratórnych vyšetrení pozorne sledovaní na vznik inhibítorov. Ak sa očakávané hladiny aktivity faktora VIII v plazme nedosiahnu, alebo ak krvácanie nie je kontrolované vhodnou dávkou, má sa vykonať testovanie prítomnosti inhibítorov faktora VIII. U pacientov
s vysokými hladinami inhibítora, substitučná terapia faktorom VIII nemusí byť účinná a treba zvážiť
iné možnosti liečby. Liečba takých pacientov má byť riadená lekármi so skúsenosťami so starostlivosťou o pacientov s hemofíliou a inhibítormi faktora VIII.
Nesprávna aplikácia lieku ADVATE
Nesprávna aplikácia (intraarteriálna alebo paravenózna) lieku ADVATE, rozpusteného v 2 ml sterilizovanej vody na injekcie, môže spôsobiť mierne krátkodobé reakcie v mieste podania, ako sú podliatina a erytém.
Komplikácie liečby súvisiace s katétrom
Ak je potrebný centrálny venózny katéter (CVK), musí sa zvážiť riziko komplikácií súvisiacich s CVK
vrátane lokálnych infekcií, bakterémie a trombózy v mieste zavedenia katétra.
Aspekty týkajúce sa pomocného základu
Po príprave tento liek obsahuje 0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke. Má sa to vziať
do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
Dôrazne odporúčame, aby sa pri každom podávaní lieku ADVATE pacientovi, zapísali názov a číslo šarže lieku, a tak sa uchovalo prepojenie medzi pacientom a šaržou lieku.
Pediatrická populácia:
Uvedené upozornenia a opatrenia pri používaní sa týkajú detí aj dospelých.
4.5. Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s ADVATE.
4.6. Fertilita, gravidita a laktácia
Neuskutočnili sa reprodukčné štúdie s faktorom VIII na zvieratách. Vzhľadom k zriedkavému výskytu hemofílie A u žien, nie sú k dispozícii údaje týkajúce sa použitia faktora VIII počas gravidity
a laktácie. Z tohto dôvodu má byť faktor VIII používaný počas gravidity a dojčenia iba v nevyhnutných prípadoch.
4.7. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
ADVATE nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8. Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Klinické štúdie s ADVATE zahŕňali 418 účastníkov vystavených najmenej raz lieku ADVATE
hlásiacich celkovo 93 nežiaducich liekových reakcií (adverse drug reactions, ADR). ADR, ktoré
sa vyskytli s najväčšou frekvenciou, boli vznik neutralizačných protilátok faktora VIII (inhibítorov), bolesť hlavy, a horúčka.
Reakcie precitlivenosti alebo alergické reakcie (ako angioedém, pálenie a pichanie v mieste infúzie, zimnica, začervenanie kože, generalizovaná žihľavka, bolesť hlavy, vyrážky, hypotenzia, letargia, nauzea, nepokoj, tachykardia, pocit tiesne na hrudníku, mravčenie, vracanie, pískavé dýchanie)
boli pozorované zriedkavo, a v niektorých prípadoch sa z nich môže vyvinúť závažná anafylaxia
(vrátane šoku).
Môže byť pozorovaný vznik protilátok proti proteínu myši alebo škrečka so súvisiacimi reakciami precitlivenosti.
U pacientov s hemofíliou A môžu vznikať neutralizačné protilátky (inhibítory) faktora VIII. Ak dôjde k vzniku takých inhibítorov, klinický stav sa môže prejavovať ako nedostatočná klinická odpoveď.
V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu.
Tabuľkové zhrnutie nežiaducich reakcií
Nasledujúca tabuľka 2 uvádza frekvenciu nežiaducich liekových reakcií v klinických štúdiách
a v spontánne hlásených prípadoch. Táto tabuľka je podľa klasifikácie orgánových systémov MEDRA (SOC a preferovaných termínov).
Nežiaduce reakcie sú uvedené podľa nasledujúceho pravidla: veľmi časté (≥ 1/10), časté (≥ 1/100 až
< 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 2 Frekvencia nežiaducich liekových reakcií (ADR) v klinických štúdiách a spontánne hlásených prípadoch
MedDRA štandardná trieda orgánových systémov
Infekcie a nákazy
Poruchy krvi a lymfatického systému
Poruchy imunitného systému
Poruchy nervového systému
Nežiaduca reakcia Frekvenciaa
Chrípka Menej časté Laryngitída Menej časté Inhibícia faktora VIIIc Časté Lymfangitída Menej časté Anafylaktická reakcia Nie je známe Precitlivenosťc Nie je známe Bolesť hlavy Časté
Závrat Menej časté Porucha pamäte Menej časté Synkopa Menej časté Tremor Menej časté Migréna Menej časté Porucha chuti Menej časté
Poruchy oka Zápal oka Menej časté
Poruchy srdca a srdcovej činnosti Palpitácie Menej časté

Poruchy ciev
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Hematóm Menej časté Návaly tepla Menej časté Bledosť Menej časté Dyspnoe Menej časté
Hnačka Menej časté Bolesť v hornej časti brucha Menej časté Nevoľnosť Menej časté Vracanie Menej časté Svrbenie Menej časté Vyrážka Menej časté Hyperhidróza Menej časté Žihľavka Menej časté
Tabuľka 2 Frekvencia nežiaducich liekových reakcií (ADR) v klinických štúdiách a spontánne hlásených prípadoch
MedDRA štandardná trieda orgánových systémov
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Úrazy, otravy a komplikácie liečebného postupu
Nežiaduca reakcia Frekvenciaa
Pyrexia Časté Periférny edém Menej časté Bolesť na hrudi Menej časté Hrudný dyskomfort Menej časté Zimnica Menej časté Nezvyčajný pocit Menej časté Hemátóm v mieste punkcie cievy Menej časté Únava Nie je známe Reakcia v mieste injekcie Nie je známe Nevoľnosť Nie je známe Zvýšený počet monocytov Menej časté Znížená hladina koagulačného faktora VIIIb Menej časté Znížený hematokrit Menej časté Abnormálne výsledky laboratórnych testov Menej časté Postprocedurálna komplikácia Menej časté Postprocedurálne krvácanie Menej časté Reakcia v mieste podania Menej časté

a) Vypočítané na základe celkového počtu pacientov, ktorí dostávali ADVATE (418).
b) U jedného pacienta sa počas kontinuálnej infúzie ADVATE po operácii (pooperačné
dni 10 - 14) vyskytli neočakávane znížené hladiny koagulačného faktora VIII. Hemostáza bola počas tohto obdobia stále udržiavaná a ako hladina faktora VIII, tak aj hodnoty klírensu sa vrátili na dostatočné hodnoty do 15. pooperačného dňa. Skúšky inhibítora faktora VIII uskutočnené po ukončení kontinuálnej infúzie a v závere štúdie boli negatívne.
c) Nežiaduce reakcie vysvetlené v časti nižšie.
Opis vybratých nežiaducich reakciíVznik inhibítorovBol hlásený vznik inhibítorov u predtým liečených pacientov (PTP) a u predtým neliečených pacientov (PUP). Bližšie údaje nájdete v časti 5.1 (Farmakologické vlastnosti) a 4.4 (Osobitné upozornenia a opatrenia pri používaní).
Nežiaduce reakcie špecifické pre pozostatky z výrobného procesuZ 229 liečených pacientov, ktorí boli hodnotení na protilátky proti proteínu buniek ovárií čínskeho škrečka (CHO), sa u 3 dokázal štatisticky významný vzostupný trend v titroch, u 4 sa ukázali pretrvávajúce vrcholy alebo prechodné výkyvy a jeden pacient mal oboje, ale nemal žiadne klinické príznaky. Z 229 liečených pacientov, ktorí boli hodnotení na protilátky proti myším IgG, sa
u 10 dokázal štatisticky významný vzostupný trend v titroch, u 2 sa ukázali pretrvávajúce vrcholy alebo prechodné výkyvy a jeden pacient mal oboje. Štyria z týchto pacientov hlásili jednotlivé prípady
urtikárie, pruritu, vyrážky a mierne zvýšeného počtu eozinofilov v rámci opakovaných expozícií lieku v štúdii.
PrecitlivenosťReakcie alergického typu vrátane anafylaxie, ktoré sa prejavili závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Pediatrická populáciaV klinických štúdiách neboli uvedené žiadne vekovo špecifické rozdiely v nežiaducich reakciách iné ako vznik inhibítorov u predtým neliečených detských pacientov (PUP) a komplikácie súvisiace
s katétrom.
Hlásenie podozrení na nežiaduce reakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9. PredávkovanieNeboli hlásené žiadne prípady predávkovania rekombinantným koagulačným faktorom VIII.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1. Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antihemoragiká: krvný koagulačný faktor VIII. ATC kód: B02BD02. Komplex faktora VIII/von Willebrandovho faktora sa skladá z dvoch molekúl (faktor VIII
a von Willebrandov faktor) s odlišnými fyziologickými funkciami. ADVATE obsahuje rekombinantný
koagulačný faktor VIII (alfaoktokog), glykoproteín ktorý je biologicky rovnocenný s glykoproteínu faktora VIII obsiahnutom v ľudskej plazme.
Alfaoktokog je glykoproteín skladajúci sa z 2332 aminokyselín s molekulárnou hmotnosťou
približne 280 kD. Alfaoktokog sa pri podávaní infúziou hemofilickému pacientovi viaže na endogénny von Willebrandov faktor v pacientovom krvnom obehu. Aktivovaný faktor VIII pôsobí ako kofaktor pre aktivovaný faktor IX, urýchľujúci konverziu faktora X na aktivovaný faktor X. Aktivovaný
faktor X premieňa protrombín na trombín. Trombín potom premieňa fibrinogén na fibrín a môže sa vytvoriť krvná zrazenina. Hemofília A je dedičná porucha zrážania krvi viazaná na pohlavie, spôsobená zníženými hladinami aktivity faktora VIII a má za následok profúzne krvácanie do kĺbov, svalov alebo vnútorných orgánov, ktoré vzniká buď spontánne, alebo ako dôsledok úrazu alebo chirurgického zákroku. Plazmatické hladiny faktora VIII sa substitučnou liečbou zvyšujú,
čo umožňuje dočasnú úpravu nedostatku faktora VIII a úpravu sklonu ku krvácaniu.
Vznik inhibítorovImunogenicita ADVATE sa hodnotila u predtým liečených pacientov. Počas klinických štúdií
s ADVATE u 233 pediatrických (pediatrickí pacienti vo veku 0 až 16 rokov) a dospelých pacientov (starší ako 16 rokov), ktorým bola diagnostikovaná ťažká hemofília A (faktor VIII ≤ 1 %) a ktorí boli predtým vystavení koncentrátom faktora VIII po dobu ≥ 150 dní pre dospelých a staršie deti, a
po dobu ≥ 50 dní pre deti mladšie ako 6 rokov, sa po 26 dňoch expozície ADVATE vyvinul nízky titer inhibítora (2,4 BU v modifikovanej Bethesdovej skúške) u jedného pacienta. Nasledujúce testy na inhibítor vykonané u tohto pacienta po vyradení zo štúdie boli negatívne. V rámci všetkých štúdií bol medián expozície lieku ADVATE 97,0 expozičných dní na účastníka (rozsah 1 až 709) pre predtým liečených pacientov. Celkový výskyt vzniku inhibítorov faktora VIII (nízky alebo vysoký) bol 0,4 %
(1 z 233).
V ukončenej nekontrolovanej štúdii 060103, 16 zo 45 (35,6 %) predtým neliečených pacientov
s ťažkou hemofíliou A (faktor VIII < 1 %) a najmenej s 25 dňami expozície faktoru VIII vznikli inhibítory faktora VIII u: 7 (15,6 %) účastníkov vznikli inhibítory s vysokým titrom a u 9 (20 %) účastníkov vznikli inhibítory s nízkym titrom, 1 z nich bol tiež klasifikovaný ako prechodný inhibítor. Rizikové faktory súvisiace so vznikom inhibítorov v tejto štúdii zahŕňali iné ako kaukazské etnikum, familiárny výskyt inhibítorov a intenzívnu liečbu vysokou dávkou počas prvých 20 dní expozície.
U 20 účastníkov, ktorí nemali žiadny z týcho rizikových faktorov, nevznikli žiadne inhibítory.
Boli sústredené údaje o vyvolaní imunitnej tolerancie (ITI) u pacientov s inhibítormi. V rámci čiastkovej štúdie PNP 060103 bola zdokumentovaná liečba ITI u 11 predtým neliečených pacientov (PUP). Bola vypracovaná retrospektívna hodnotiaca schéma pre 30 pacientov s ITI (štúdia 060703)
a prebieha zhromažďovanie údajov do registra.
V štúdii 060201 boli porovnávané dve dlhodobé profylaktické liečebné schémy u 53 predtým liečených osôb: farmakokinetický riadený dávkovací režim prispôsobený individuálnym účastníkom (v rozsahu 20 až 80 IU faktora VIII na kg telesnej hmotnosti v intervaloch 72 ± 6 hodín, n=23)
so štandardným profylaktickým dávkovacím režimom (20 až 40 IU/kg každých 48 ± 6 hodín, n=30). Farmakokinetický riadený dávkovací režim (podľa osobitného vzorca) bol zacielený na udržanie minimálnych hladín (tzv. trough level) faktora VIII ≥ 1 % v intervale medzi dávkovaním 72 hodín. Údaje z tejto štúdie ukazujú, že tieto dva profylaktické dávkovacie režimy sú porovnateľné, čo sa týka redukcie miery krvácania.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom ADVATE vo všetkých podskupinách pediatrickej populácie s hemofíliou A (vrodený deficit faktora VIII) pri „indukcii imunitnej tolerancie (ITI) u pacientov s hemofíliou A (vrodený deficit
faktora VIII), u ktorých vznikli inhibítory faktora VIII“ a „liečbe a profylaxii krvácania u pacientov s hemofíliou A (vrodený deficit faktora VIII)“. (Informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2. Farmakokinetické vlastnosti
Všetky farmakokinetické štúdie s ADVATE boli vykonávané u predtým liečených pacientov s ťažkou až stredne ťažkou hemofíliou A (východiskový faktor VIII ≤ 2%). Analýza vzoriek plazmy bola vykonávaná v centrálnom laboratóriu použitím jednostupňovej skúšky zrážavosti.
Celkovo 195 pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %) poskytlo farmakokinetické (FK) parametre, ktoré boli začlenené do FK analytického súboru „per-protocol“. Kategórie týchto analýz pre dojčatá (1 mesiac do < 2 rokov veku), deti (2 až < 5 rokov veku), staršie deti (5 až < 12 rokov veku), mladistvých (12 až < 18 rokov veku) a dospelých (18 rokov veku a starší) boli použité na sumarizáciu FK parametrov, kde vek bol definovaný ako vek v dobe FK infúzie.
Tabuľka 3 Súhrn farmakokinetických parametrov ADVATE podľa vekovej skupiny pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %)
Parameter (priemer
± štandardná odchýlka)
Dojčatá
(n=5)
Deti
(n=30)
Staršie deti
(n=18)
Mladiství
(n=33)
Dospelí
(n=109)
Celková AUC (IU*h/dl) Upravené progresívne obnovenie hladiny Cmax (IU/dl na IU/kg)a
1362,1 ± 311,8 1180,0 ± 432,7 1506,6 ± 530,0 1317,1 ± 438,6 1538,5 ± 519,1
2,2 ± 0,6 1,8 ± 0,4 2,0 ± 0,5 2,1 ± 0,6 2,2 ± 0,6
Polčas (h) 9,0 ± 1,5 9,6 ± 1,7 11,8 ± 3,8 12,1 ± 3,2 12,9 ± 4,3
Maximálna plazmatická koncentrácia po infúzii (IU/dl) Priemerný rezidenčný čas (h)
Distribučný objem v ustálenom stave (dl/kg)
110,5 ± 30,2 90,8 ± 19,1 100,5 ± 25,6 107,6 ± 27,6 111,3 ± 27,1
11,0 ± 2,8 12,0 ± 2,7 15,1 ± 4,7 15,0 ± 5,0 16,2 ± 6,1
0,4 ± 0,1 0,5 ± 0,1 0,5 ± 0,2 0,6 ± 0,2 0,5 ± 0,2

Klírens (ml/kg*h) 3,9 ± 0,9 4,8 ± 1,5 3,8 ± 1,5 4,1 ± 1,0 3,6 ± 1,2 a Vypočítané ako (Cmax – faktor VIII na začiatku liečby) delené dávkou v IU/kg, kde Cmax je maximálny nameraný faktor VIII po infúzii.
Bezpečnosť a hemostatická účinnosť lieku ADVATE v pediatrickej populácii sú podobné ako tieto parametre u dospelých pacientov. Upravené obnovenie a konečný polčas (t½) boli približne o 20% nižšie u mladších detí (mladších ako 6 rokov) ako u dospelých, čo je v súlade so známym vyšším objemom plazmy na kilogram telesnej hmotnosti u mladších pacientov.
Aktuálne nie sú k dispozícii farmakokinetické údaje o ADVATE u predtým neliečených pacientov.
5.3. Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe farmakologických štúdií bezpečnosti, akútnej toxikológie, toxicity po opakovanom podaní, lokálnej toxicity a genotoxicity neodhalili žiadne osobitné riziko pre ľudí.
Štúdia lokálnej tolerancie u králikov ukázala, že liek ADVATE, rozpustený v 2 ml sterilizovanej vody na injekcie, je po intravenóznom podaní dobre tolerovaný. Slabé prechodné začervenanie v mieste podania bolo pozorované po intraarteriálnej aplikácii a po paravenóznom podaní. Nedala sa však pozorovať žiadna korelácia nežiaducich histopatologických zmien, čo hovorí o prechodných vlastnostiach tohto zistenia.
6. FARMACEUTICKÉ INFORMÁCIE
6.1. Zoznam pomocných látok
Prášok Manitol Chlorid sodný Histidín Trehalóza
Chlorid vápenatý Trometamol Polysorbát 80
Glutatión (redukovaný)
Rozpúšťadlo
Sterilizovaná voda na injekciu
6.2. Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi alebo rozpúšťadlami.
6.3. Čas použiteľnosti
2 roky.
Po rekonštitúcii: z mikrobiologického hľadiska sa má liek použiť okamžite. Avšak chemická a fyzikálna stabilita počas používania bola pri teplote 25 °C preukázaná na 3 hodiny.
V rámci času použiteľnosti sa liek môže uchovávať pri izbovej teplote (až do 25 °C) počas jedného obdobia nepresahujúceho 6 mesiacov. Na balenie lieku zaznamenajte dátum konca 6-mesačného uchovávania pri izbovej teplote. Liek sa nesmie vrátiť späť do chladničky.
6.4. Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke pri teplote (2 °C – 8 °C). Neuchovávajte v mrazničke.
ADVATE s pomôckou BAXJECT II: Injekčnú liekovku s liekom uchovávajte vo vonkajšom obale na ochranu pred svetlom.
ADVATE v systéme BAXJECT III: Uzavretý blister uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5. Druh obalu a obsah balenia
Injekčná liekovka s práškom a 2 ml injekčná liekovka s rozpúšťadlom sú vyrobené zo skla typu
I a uzatvorené chlorobutylovými gumenými zátkami. Liek sa dodáva v jednej z nasledujúcich foriem:
- ADVATE s pomôckou BAXJECT II: Každé balenie obsahuje injekčnú liekovku
s práškom, 2 ml injekčnú liekovku s rozpúšťadloma pomôcku na rekonštitúciu (BAXJECT II).
- ADVATE v systéme BAXJECT III: Každé balenie obsahuje systém BAXJECT v uzavretom blistri (injekčná liekovka s práškom a 2 ml injekčná liekovka s rozpúšťadlom sú zabudované v systéme na rekonštitúciu).
6.6. Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
ADVATE sa podáva intravenózne po rekonštitúcii lieku v pribalenej sterilizovanej vode. Pripravený roztok sa má skontrolovať vizuálne, či neobsahuje cudzorodé častice a či nemá zmenenú farbu.
Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc. Nepoužívajte zakalené roztoky alebo roztoky s usadeninami.
- Na podávanie je potrebné použiť injekčnú striekačku s konektorom luer-lock.
- Použite do troch hodín po príprave.
- Po príprave liek neuchovávajte v chladničke.
- Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Príprava roztoku s pomôckou BAXJECT II
- Na rekonštitúciu použite len pribalenú sterilizovanú vodu na injekciu a pomôcku na rekonštitúciu.
- Nepoužívajte, ak je pomôcka BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
- Má byť použitá aseptická technika
1. Ak je liek ešte uchovávaný v chladničke, vyberte injekčnú liekovku s práškom ADVATE
a injekčnú liekovku s rozpúšťadlom z chladničky a zohrejte ich na izbovú teplotu
(medzi 15 °C - 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Odstráňte uzáver z injekčnej liekovky s práškom a uzáver z injekčnej liekovky s rozpúšťadlom
4. Očistite zátky tampónmi napustenými alkoholom. Injekčné liekovky umiestnite na rovný čistý povrch.
5. Otvorte balenie pomôcky BaxJect II odtrhnutím papierového viečka bez toho, aby ste sa dotkli vnútrajška (Obr. a). Nevyberajte pomôcku z balenia. Nepoužívajte, ak je pomôcka
BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
6. Otočte balenie nahor a prepichnite zátku rozpúšťadla čírym plastovým bodcom. Uchopte balenie za jeho okraj a stiahnite balenie z BAXJECTu II (Obr. b). Neodstraňujte modré viečko z pomôcky BAXJECT II.
7. Na rekonštitúciu sa má použiť len pribalená sterilizovaná voda na injekciu a pomôcka na
rekonštitúciu. S BAXJECTom II pripevneným na injekčnú liekovku s rozpúšťadlom obráťte systém tak, aby bola injekčná liekovka s rozpúšťadlom navrchu. Bielym plastovým bodcom prepichnite zátku prášku ADVATE. Vákuum nasaje rozpúšťadlo do injekčnej liekovky
s práškom ADVATE (Obr. c).
8. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter pomôcky. Liek sa rozpúšťa rýchlo
(zvyčajne za menej ako 1 minútu). Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc.
Obr. a Obr. b Obr. c
 Príprava roztoku so systémom BAXJECT III
Príprava roztoku so systémom BAXJECT III
- Ak viečko úplne neutesňuje blister, výrobok nepoužívajte.
1. Ak je liek ešte uchovávaný v chladničke, vyberte uzavretý blister (obsahuje injekčnú liekovku s práškom a injekčnú liekovku s rozpúšťadlom zabudované v systéme na rekonštitúciu) z chladničky a zohrejte ich na izbovú teplotu (medzi 15 °C a 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Otvorte balenie ADVATE odlepením viečka. Vyberte systém BAXJECT III z blistra.
4. Položte liek ADVATE na rovný povrch s injekčnou liekovkou s rozpúšťadlom nahor (Obr. 1).
Injekčná liekovka s rozpúšťadlom má modrý prúžok. Neodstraňujte modré viečko, až kým nedostanete pokyn v ďalšom kroku.
5. Jednou rukou pridržte liek ADVATE v systéme BAXJECT III, druhou rukou pevne pritlačte na injekčnú liekovku s rozpúšťadlom, kým systém úplne nezaklapne a rozpúšťadlo nezačne prúdiť do injekčnej liekovky ADVATE (Obr. 2). Systém nenakláňajte, kým sa prenos nedokončí.
6. Overte, že prenos rozpúšťadla je úplný. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter
pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok
číry, bezfarebný a bez cudzorodých častíc.
Obr. 1 Obr. 2 Obr. 3 Podávanie
PodávaniePoužite aseptickú techniku
Lieky podávané parenterálne sa pred podaním musia skontrolovať, či neobsahujú pevné čiastočky, vždy keď to roztok a obal umožní. Použitý smie byť len číry a bezfarebný roztok.
1. Odstráňte modré viečko z BAXJECTu II/BAXJECTu III.
Nenasajte vzduch do injekčnej striekačky. Pripojte injekčnú striekačku k BAXJECTu II/BAXJECTu III.
2. Prevráťte systém (injekčná liekovka s pripraveným roztokom má byť hore). Natiahnite pripravený roztok do injekčnej striekačky pomalým vytiahnutím piestu smerom dozadu.
3. Odpojte injekčnú striekačku.
4. Pripojte krídelkovú ihlu na injekčnú striekačku. Injektujte intravenózne. Roztok sa má podávať pomaly, rýchlosťou ktorá pacientovi najviac vyhovuje a nepresahuje 10 ml za minútu. Pulzová frekvencia sa má zmerať pred podaním ADVATE a počas jeho podávania. Ak dôjde
k významnému vzostupu, zníženie rýchlosti podávania alebo dočasné prerušenie podávania zvyčajne postačí na to, aby príznaky rýchlo vymizli (pozri časti 4.4 a 4.8).
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBaxter AG Industriestrasse 67
A-1221 Viedeň
Rakúsko
8. REGISTRAČNÉ ČÍSLOEU/1/03/271/009
EU/1/03/271/019
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 2. marec 2004
Dátum posledného predĺženia registrácie: 2. marec 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
ADVATE 1500 IU prášok a rozpúšťadlo na injekčný roztok.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá injekčná liekovka obsahuje 1500 IU* ľudského koagulačného faktora VIII (rDNA), alfaoktokogu**. Po rekonštitúcii ADVATE obsahuje približne 750 IU ľudského koagulačného faktora VIII (rDNA), alfaoktokogu/ml.
Účinnosť (medzinárodné jednotky, IU) sa stanovuje pomocou chromogénneho testu Európskeho liekopisu. Špecifická aktivita lieku ADVATE je približne 4000 – 10 000 IU/mg proteínu. Alfaoktokog (ľudský koagulačný faktor VIII (rDNA)) je čistený proteín s 2332 aminokyselinami. Je produkovaný rekombinantnou DNA technológiou v bunkách ovárií čínskeho škrečka (Chinese
hamster ovary, CHO). Pripravený bez prídavku akýchkoľvek (exogénnych) ľudských alebo zvieracích proteínov v procese bunkovej kultivácie, purifikácie alebo konečnej úpravy.
Pomocné látky so známym účinkom:
0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Prášok a rozpúšťadlo na injekčný roztok. Prášok: biely až sivobiely drobivý prášok.
Rozpúšťadlo: číry a bezfarebný roztok.
4. KLINICKÉ ÚDAJE
4.1. TERAPEUTICKÉ INDIKÁCIE
Liečba a profylaxia krvácania u pacientov s hemofíliou A (vrodený nedostatok faktora VIII). Liek
ADVATE je indikovaný vo všetkých vekových skupinách.
4.2. Dávkovanie a spôsob podávania
Liečba sa má začať pod dohľadom lekára skúseného v liečbe hemofílie a so zabezpečenou okamžitou resuscitáciou v prípade anafylaxie.
Dávkovanie
Dávka a dĺžka substitučnej terapie závisí od závažnosti nedostatku faktora VIII, od miesta a rozsahu krvácania a od klinického stavu pacienta.
Počet jednotiek faktora VIII sa vyjadruje v medzinárodných jednotkách (International Units, IU), ktoré sa vzťahujú na štandard WHO pre lieky s faktorom VIII. Aktivita faktora VIII v plazme sa vyjadruje buď percentuálne (v relácii k normálnej ľudskej plazme) alebo v IU (podľa medzinárodného štandardu pre faktor VIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora VIII zodpovedá množstvu faktora VIII v jednom ml normálnej ľudskej plazmy.
Liečba on demand (podľa potreby)
Výpočet požadovanej dávky faktora VIII sa zakladá na empirickom zistení, že 1 IU faktora VIII na kg telesnej hmotnosti zvýši aktivitu plazmatického faktora VIII o 2 IU/dl. Potrebná dávka sa stanoví
použitím nasledovného vzorca:
Požadované jednotky (IU) = telesná hmotnosť (kg) x požadovaný vzostup faktora VIII (%) x 0,5
V prípade nasledujúcich krvácavých príhod aktivita faktora VIII nemá počas zodpovedajúceho obdobia klesnúť pod danú hladinu aktivity v plazme (v % normálu alebo IU/dl). Ako návod na dávkovanie pri krvácaní alebo pri chirurgických zákrokoch možno použiť nasledovnú tabuľku 1:
Tabuľka 1 Návod na dávkovanie pri krvácaní a chirurgických zákrokoch
Stupeň krvácania/Typ chirurgického zákroku
Krvácanie
Začínajúca hemartróza, krvácanie do svalu alebo krvácanie v ústnej dutine.
Rozsiahlejšia hemartróza, krvácanie do svalu alebo hematóm.
Život ohrozujúce krvácania.
Chirurgický zákrok
Malý
Vrátane extrakcie zuba.
Veľký
Požadovaná hladina faktora VIII
(% alebo IU/dl)
20 – 40
30 – 60
60 – 100
30 – 60
80 – 100
(pred a po operácii)
Frekvencia dávok (hodiny)/ dĺžka trvania terapie (dni)
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým krvácavá príhoda, súdiac podľa bolesti, nepominie alebo kým nedôjde
k zahojeniu.
Opakujte injekcie každých 12 až 24 hodín
(8 až 24 hodín u pacientov mladších
ako 6 rokov) počas 3 – 4 dní alebo dlhšie až dovtedy, kým bolesť nepominie alebo kým sa neobnoví funkčnosť.
Opakujte injekcie každých 8 až 24 hodín
(6 až 12 hodín u pacientov mladších
ako 6 rokov), až dovtedy, kým nepominie stav ohrozenia života.
Každých 24 hodín (12 až 24 hodín u pacientov mladších ako 6 rokov) najmenej 1 deň, kým nedôjde
k zahojeniu.
Opakujte injekcie každých 8 až 24 hodín
(6 až 24 hodín u pacientov mladších
ako 6 rokov), do adekvátneho zahojenia rán, potom pokračujte v terapii najmenej ďalších 7 dní na udržanie aktivity
faktora VIII od 30 % do 60 % (IU/dl).

Dávka a frekvencia podávania sa majú v jednotlivých prípadoch prispôsobiť klinickej odpovedi.
Za určitých okolností (napr. prítomnosť nízkeho titra inhibítora) môžu byť potrebné vyššie dávky ako dávky vypočítané podľa vzorca.
V priebehu liečby sa odporúča primerané stanovovanie hladín plazmatického faktora VIII ako návod na určovanie podávanej dávky a frekvencie opakovaných injekcií. Predovšetkým v prípade veľkých chirurgických zákrokov je nevyhnutné presné sledovanie substitučnej terapie skúškami aktivity plazmatického faktora VIII. Reakcie jednotlivých pacientov na faktor VIII sa môžu
in vivo odlišovať a dosiahnuť odlišné hladiny obnovenia faktora VIII a preukázať rôzne polčasy.
Profylaxia
Na dlhodobú profylaxiu krvácania u pacientov s ťažkou hemofíliou A sú zvyčajné dávky 20 až 40 IU
faktora VIII na kg telesnej hmotnosti v intervaloch od 2 do 3 dní.
Pediatrická populácia
Dávkovanie pre liečbu on demand sa u pediatrických pacientov (0 až 18 rokov veku) nelíši od dospelých pacientov. U pacientov mladších ako 6 rokov sa na profylaktickú terapiu odporúča dávkovanie 20 až 50 IU faktora VIII na kg telesnej hmotnosti 3 až 4-krát do týždňa.
Použitie 2 ml obchodnej formy nebolo dokumentované pre deti mladšie ako 2 roky.
Spôsob podávania
ADVATE sa má podávať intravenóznou cestou. V prípade, že liek nepodáva zdravotnícky pracovník je nutné jeho náležité zaškolenie.
Rýchlosť podávania sa má ustáliť podľa toho, ako to pacientovi najviac vyhovuje a smie dosiahnuť
maximálne 10 ml/min.
Po rekonštitúcii je roztok číry, bezfarebný, bez cudzorodých častíc s pH medzi 6,7 až 7,3. Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3. Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na proteíny myši alebo škrečka.
4.4. Osobitné upozornenia a opatrenia pri používaní
Precitlivenosť
U ADVATE boli hlásené reakcie z precitlivenosti alergického typu vrátane anafylaxie a prejavili sa závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Liek obsahuje stopy proteínov myši a škrečka. Pacienti majú byť upozornení, že ak sa vyskytnú príznaky precitlivenosti, odporúča sa používanie lieku okamžite prerušiť a kontaktovať svojho lekára. Pacienti majú byť informovaní o prvotných príznakoch reakcií z precitlivenosti zahŕňajúcich vyrážky, generalizovanú žihľavku, pocit tiesne na hrudníku, pískavé dýchanie, hypotenzia a anafylaxiu.
V prípade šoku má byť zavedená štandardná lekárska liečba šoku.
Kvôli poklesu injekčného objemu pre liek ADVATE rozpusteného v 2 ml sterilizovanej vody na injekcie, ak sa vyskytnú reakcie z precitlivenosti, je menej času na reakciu zastavením injekcie.
Počas injekcie lieku ADVATE rozpusteného v 2 ml sterilizovanej vody na injekcie sa preto odporúča opatrnosť, najmä u detí.
Inhibítory
Známou komplikáciou liečby jedincov s hemofíliou A je vznik protilátok (inhibítorov) neutralizujúcich faktor VIII. Tieto inhibítory sú zvyčajne imunoglobulíny IgG pôsobiace proti prokoagulačnej aktivite faktora VIII, ktoré sú kvantifikované v Bethesdových jednotkách (BU) na ml
plazmy použitím modifikovanej skúšky. U pacientov, u ktorých sa objavia inhibítory faktora VIII, sa
klinický stav môže prejavovať ako nedostatočná klinická odpoveď. V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu. Riziko vzniku inhibítorov koreluje s rozsahom expozície faktoru VIII, toto riziko býva najvyššie počas prvých 20 dní expozície, a tiež s inými genetickými faktormi a faktormi prostredia. V zriedkavých prípadoch môžu inhibítory vzniknúť po prvých 100 dňoch expozície.
Boli pozorované prípady opakovaného vzniku inhibítorov (nízky titer) po prechode z jedného lieku s faktorom VIII na iný u predtým liečených pacientov s viac ako 100 dňami expozície, ktorí majú
v anamnéze vznik inhibítorov. Odporúča sa preto, aby všetci pacienti po prechode z jedného lieku na iný boli pozorne sledovaní na vznik inhibítorov.
Vo všeobecnosti všetci pacienti s koagulačným faktorom VIII majú byť pomocou náležitých klinických pozorovaní a laboratórnych vyšetrení pozorne sledovaní na vznik inhibítorov. Ak sa očakávané hladiny aktivity faktora VIII v plazme nedosiahnu, alebo ak krvácanie nie je kontrolované vhodnou dávkou, má sa vykonať testovanie prítomnosti inhibítorov faktora VIII. U pacientov
s vysokými hladinami inhibítora, substitučná terapia faktorom VIII nemusí byť účinná a treba zvážiť
iné možnosti liečby. Liečba takých pacientov má byť riadená lekármi so skúsenosťami so starostlivosťou o pacientov s hemofíliou a inhibítormi faktora VIII.
Nesprávna aplikácia lieku ADVATE
Nesprávna aplikácia (intraarteriálna alebo paravenózna) lieku ADVATE, rozpusteného v 2 ml sterilizovanej vody na injekcie, môže spôsobiť mierne krátkodobé reakcie v mieste podania, ako sú podliatina a erytém.
Komplikácie liečby súvisiace s katétrom
Ak je potrebný centrálny venózny katéter (CVK), musí sa zvážiť riziko komplikácií súvisiacich s CVK
vrátane lokálnych infekcií, bakterémie a trombózy v mieste zavedenia katétra.
Aspekty týkajúce sa pomocného základu
Po príprave tento liek obsahuje 0,45 mmol sodíka (10 mg) v jednej injekčnej liekovke. Má sa to vziať
do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
Dôrazne odporúčame, aby sa pri každom podávaní lieku ADVATE pacientovi, zapísali názov a číslo šarže lieku, a tak sa uchovalo prepojenie medzi pacientom a šaržou lieku.
Pediatrická populácia:
Uvedené upozornenia a opatrenia pri používaní sa týkajú detí aj dospelých.
4.5. Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s ADVATE.
4.6. Fertilita, gravidita a laktácia
Neuskutočnili sa reprodukčné štúdie s faktorom VIII na zvieratách. Vzhľadom k zriedkavému výskytu hemofílie A u žien, nie sú k dispozícii údaje týkajúce sa použitia faktora VIII počas gravidity
a laktácie. Z tohto dôvodu má byť faktor VIII používaný počas gravidity a dojčenia iba v nevyhnutných prípadoch.
4.7. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
ADVATE nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8. Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Klinické štúdie s ADVATE zahŕňali 418 účastníkov vystavených najmenej raz lieku ADVATE
hlásiacich celkovo 93 nežiaducich liekových reakcií (adverse drug reactions, ADR). ADR, ktoré
sa vyskytli s najväčšou frekvenciou, boli vznik neutralizačných protilátok faktora VIII (inhibítorov), bolesť hlavy, a horúčka.
Reakcie precitlivenosti alebo alergické reakcie (ako angioedém, pálenie a pichanie v mieste infúzie, zimnica, začervenanie kože, generalizovaná žihľavka, bolesť hlavy, vyrážky, hypotenzia, letargia, nauzea, nepokoj, tachykardia, pocit tiesne na hrudníku, mravčenie, vracanie, pískavé dýchanie)
boli pozorované zriedkavo, a v niektorých prípadoch sa z nich môže vyvinúť závažná anafylaxia
(vrátane šoku).
Môže byť pozorovaný vznik protilátok proti proteínu myši alebo škrečka so súvisiacimi reakciami precitlivenosti.
U pacientov s hemofíliou A môžu vznikať neutralizačné protilátky (inhibítory) faktora VIII. Ak dôjde k vzniku takých inhibítorov, klinický stav sa môže prejavovať ako nedostatočná klinická odpoveď.
V takých prípadoch sa odporúča obrátiť sa na špecializované centrum pre hemofíliu.
Tabuľkové zhrnutie nežiaducich reakcií
Nasledujúca tabuľka 2 uvádza frekvenciu nežiaducich liekových reakcií v klinických štúdiách
a v spontánne hlásených prípadoch. Táto tabuľka je podľa klasifikácie orgánových systémov MEDRA (SOC a preferovaných termínov).
Nežiaduce reakcie sú uvedené podľa nasledujúceho pravidla: veľmi časté (≥ 1/10), časté (≥ 1/100 až
< 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 2 Frekvencia nežiaducich liekových reakcií (ADR) v klinických štúdiách a spontánne hlásených prípadoch
MedDRA štandardná trieda orgánových systémov
Infekcie a nákazy
Poruchy krvi a lymfatického systému
Poruchy imunitného systému
Poruchy nervového systému
Nežiaduca reakcia Frekvenciaa
Chrípka Menej časté Laryngitída Menej časté Inhibícia faktora VIIIc Časté Lymfangitída Menej časté Anafylaktická reakcia Nie je známe Precitlivenosťc Nie je známe Bolesť hlavy Časté
Závrat Menej časté Porucha pamäte Menej časté Synkopa Menej časté Tremor Menej časté Migréna Menej časté Porucha chuti Menej časté
Poruchy oka Zápal oka Menej časté
Poruchy srdca a srdcovej činnosti Palpitácie Menej časté

Poruchy ciev
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Hematóm Menej časté Návaly tepla Menej časté Bledosť Menej časté Dyspnoe Menej časté
Hnačka Menej časté Bolesť v hornej časti brucha Menej časté Nevoľnosť Menej časté Vracanie Menej časté Svrbenie Menej časté Vyrážka Menej časté Hyperhidróza Menej časté Žihľavka Menej časté
Tabuľka 2 Frekvencia nežiaducich liekových reakcií (ADR) v klinických štúdiách a spontánne hlásených prípadoch
MedDRA štandardná trieda orgánových systémov
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Úrazy, otravy a komplikácie liečebného postupu
Nežiaduca reakcia Frekvenciaa
Pyrexia Časté Periférny edém Menej časté Bolesť na hrudi Menej časté Hrudný dyskomfort Menej časté Zimnica Menej časté Nezvyčajný pocit Menej časté Hemátóm v mieste punkcie cievy Menej časté Únava Nie je známe Reakcia v mieste injekcie Nie je známe Nevoľnosť Nie je známe Zvýšený počet monocytov Menej časté Znížená hladina koagulačného faktora VIIIb Menej časté Znížený hematokrit Menej časté Abnormálne výsledky laboratórnych testov Menej časté Postprocedurálna komplikácia Menej časté Postprocedurálne krvácanie Menej časté Reakcia v mieste podania Menej časté

a) Vypočítané na základe celkového počtu pacientov, ktorí dostávali ADVATE (418).
b) U jedného pacienta sa počas kontinuálnej infúzie ADVATE po operácii (pooperačné
dni 10 - 14) vyskytli neočakávane znížené hladiny koagulačného faktora VIII. Hemostáza bola počas tohto obdobia stále udržiavaná a ako hladina faktora VIII, tak aj hodnoty klírensu sa vrátili na dostatočné hodnoty do 15. pooperačného dňa. Skúšky inhibítora faktora VIII uskutočnené po ukončení kontinuálnej infúzie a v závere štúdie boli negatívne.
c) Nežiaduce reakcie vysvetlené v časti nižšie.
Opis vybratých nežiaducich reakciíVznik inhibítorovBol hlásený vznik inhibítorov u predtým liečených pacientov (PTP) a u predtým neliečených pacientov (PUP). Bližšie údaje nájdete v časti 5.1 (Farmakologické vlastnosti) a 4.4 (Osobitné upozornenia a opatrenia pri používaní).
Nežiaduce reakcie špecifické pre pozostatky z výrobného procesuZ 229 liečených pacientov, ktorí boli hodnotení na protilátky proti proteínu buniek ovárií čínskeho škrečka (CHO), sa u 3 dokázal štatisticky významný vzostupný trend v titroch, u 4 sa ukázali pretrvávajúce vrcholy alebo prechodné výkyvy a jeden pacient mal oboje, ale nemal žiadne klinické príznaky. Z 229 liečených pacientov, ktorí boli hodnotení na protilátky proti myším IgG, sa
u 10 dokázal štatisticky významný vzostupný trend v titroch, u 2 sa ukázali pretrvávajúce vrcholy alebo prechodné výkyvy a jeden pacient mal oboje. Štyria z týchto pacientov hlásili jednotlivé prípady
urtikárie, pruritu, vyrážky a mierne zvýšeného počtu eozinofilov v rámci opakovaných expozícií lieku v štúdii.
PrecitlivenosťReakcie alergického typu vrátane anafylaxie, ktoré sa prejavili závratom, zmenou citlivosti, vyrážkou, začervenaním pokožky, opuchom tváre, urtikáriou a svrbením.
Pediatrická populáciaV klinických štúdiách neboli uvedené žiadne vekovo špecifické rozdiely v nežiaducich reakciách iné ako vznik inhibítorov u predtým neliečených detských pacientov (PUP) a komplikácie súvisiace
s katétrom.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9. PredávkovanieNeboli hlásené žiadne prípady predávkovania rekombinantným koagulačným faktorom VIII.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1. Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antihemoragiká: krvný koagulačný faktor VIII. ATC kód: B02BD02. Komplex faktora VIII/von Willebrandovho faktora sa skladá z dvoch molekúl (faktor VIII
a von Willebrandov faktor) s odlišnými fyziologickými funkciami. ADVATE obsahuje rekombinantný koagulačný faktor VIII (alfaoktokog), glykoproteín ktorý je biologicky rovnocenný s glykoproteínu faktora VIII obsiahnutom v ľudskej plazme.
Alfaoktokog je glykoproteín skladajúci sa z 2332 aminokyselín s molekulárnou hmotnosťou
približne 280 kD. Alfaoktokog sa pri podávaní infúziou hemofilickému pacientovi viaže na endogénny von Willebrandov faktor v pacientovom krvnom obehu. Aktivovaný faktor VIII pôsobí ako kofaktor pre aktivovaný faktor IX, urýchľujúci konverziu faktora X na aktivovaný faktor X. Aktivovaný
faktor X premieňa protrombín na trombín. Trombín potom premieňa fibrinogén na fibrín a môže sa vytvoriť krvná zrazenina. Hemofília A je dedičná porucha zrážania krvi viazaná na pohlavie, spôsobená zníženými hladinami aktivity faktora VIII a má za následok profúzne krvácanie do kĺbov, svalov alebo vnútorných orgánov, ktoré vzniká buď spontánne, alebo ako dôsledok úrazu alebo chirurgického zákroku. Plazmatické hladiny faktora VIII sa substitučnou liečbou zvyšujú,
čo umožňuje dočasnú úpravu nedostatku faktora VIII a úpravu sklonu ku krvácaniu.
Vznik inhibítorovImunogenicita ADVATE sa hodnotila u predtým liečených pacientov. Počas klinických štúdií
s ADVATE u 233 pediatrických (pediatrickí pacienti vo veku 0 až 16 rokov) a dospelých pacientov (starší ako 16 rokov), ktorým bola diagnostikovaná ťažká hemofília A (faktor VIII ≤ 1 %) a ktorí boli predtým vystavení koncentrátom faktora VIII po dobu ≥ 150 dní pre dospelých a staršie deti, a
po dobu ≥ 50 dní pre deti mladšie ako 6 rokov, sa po 26 dňoch expozície ADVATE vyvinul nízky titer inhibítora (2,4 BU v modifikovanej Bethesdovej skúške) u jedného pacienta. Nasledujúce testy na inhibítor vykonané u tohto pacienta po vyradení zo štúdie boli negatívne. V rámci všetkých štúdií bol medián expozície lieku ADVATE 97,0 expozičných dní na účastníka (rozsah 1 až 709) pre predtým liečených pacientov. Celkový výskyt vzniku inhibítorov faktora VIII (nízky alebo vysoký) bol 0,4 %
(1 z 233).
V ukončenej nekontrolovanej štúdii 060103, 16 zo 45 (35,6 %) predtým neliečených pacientov
s ťažkou hemofíliou A (faktor VIII < 1 %) a najmenej s 25 dňami expozície faktoru VIII vznikli inhibítory faktora VIII u: 7 (15,6 %) účastníkov vznikli inhibítory s vysokým titrom a u 9 (20 %) účastníkov vznikli inhibítory s nízkym titrom, 1 z nich bol tiež klasifikovaný ako prechodný inhibítor. Rizikové faktory súvisiace so vznikom inhibítorov v tejto štúdii zahŕňali iné ako kaukazské etnikum, familiárny výskyt inhibítorov a intenzívnu liečbu vysokou dávkou počas prvých 20 dní expozície.
U 20 účastníkov, ktorí nemali žiadny z týcho rizikových faktorov, nevznikli žiadne inhibítory.
Boli sústredené údaje o vyvolaní imunitnej tolerancie (ITI) u pacientov s inhibítormi. V rámci čiastkovej štúdie PNP 060103 bola zdokumentovaná liečba ITI u 11 predtým neliečených pacientov (PUP). Bola vypracovaná retrospektívna hodnotiaca schéma pre 30 pacientov s ITI (štúdia 060703)
a prebieha zhromažďovanie údajov do registra.
V štúdii 060201 boli porovnávané dve dlhodobé profylaktické liečebné schémy u 53 predtým liečených osôb: farmakokinetický riadený dávkovací režim prispôsobený individuálnym účastníkom (v rozsahu 20 až 80 IU faktora VIII na kg telesnej hmotnosti v intervaloch 72 ± 6 hodín, n=23)
so štandardným profylaktickým dávkovacím režimom (20 až 40 IU/kg každých 48 ± 6 hodín, n=30). Farmakokinetický riadený dávkovací režim (podľa osobitného vzorca) bol zacielený na udržanie minimálnych hladín (tzv. trough level) faktora VIII ≥ 1 % v intervale medzi dávkovaním 72 hodín. Údaje z tejto štúdie ukazujú, že tieto dva profylaktické dávkovacie režimy sú porovnateľné, čo sa týka redukcie miery krvácania.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom ADVATE vo všetkých podskupinách pediatrickej populácie s hemofíliou A (vrodený deficit faktora VIII) pri „indukcii imunitnej tolerancie (ITI) u pacientov s hemofíliou A (vrodený deficit
faktora VIII), u ktorých vznikli inhibítory faktora VIII“ a „liečbe a profylaxii krvácania u pacientov s hemofíliou A (vrodený deficit faktora VIII)“. (Informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2. Farmakokinetické vlastnosti
Všetky farmakokinetické štúdie s ADVATE boli vykonávané u predtým liečených pacientov s ťažkou až stredne ťažkou hemofíliou A (východiskový faktor VIII ≤ 2%). Analýza vzoriek plazmy bola vykonávaná v centrálnom laboratóriu použitím jednostupňovej skúšky zrážavosti.
Celkovo 195 pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %) poskytlo farmakokinetické (FK) parametre, ktoré boli začlenené do FK analytického súboru „per-protocol“. Kategórie týchto analýz pre dojčatá (1 mesiac do < 2 rokov veku), deti (2 až < 5 rokov veku), staršie deti (5 až < 12 rokov veku), mladistvých (12 až < 18 rokov veku) a dospelých (18 rokov veku a starší) boli použité na sumarizáciu FK parametrov, kde vek bol definovaný ako vek v dobe FK infúzie.
Tabuľka 3 Súhrn farmakokinetických parametrov ADVATE podľa vekovej skupiny pacientov s ťažkou hemofíliou A (faktor VIII na začiatku liečby < 1 %)
Parameter (priemer
± štandardná odchýlka)
Dojčatá
(n=5)
Deti
(n=30)
Staršie deti
(n=18)
Mladiství
(n=33)
Dospelí
(n=109)
Celková AUC (IU*h/dl) Upravené progresívne obnovenie hladiny Cmax (IU/dl na IU/kg)a
1362,1 ± 311,8 1180,0 ± 432,7 1506,6 ± 530,0 1317,1 ± 438,6 1538,5 ± 519,1
2,2 ± 0,6 1,8 ± 0,4 2,0 ± 0,5 2,1 ± 0,6 2,2 ± 0,6
Polčas (h) 9,0 ± 1,5 9,6 ± 1,7 11,8 ± 3,8 12,1 ± 3,2 12,9 ± 4,3
Maximálna plazmatická koncentrácia po infúzii (IU/dl) Priemerný rezidenčný čas (h)
Distribučný objem v ustálenom stave (dl/kg)
110,5 ± 30,2 90,8 ± 19,1 100,5 ± 25,6 107,6 ± 27,6 111,3 ± 27,1
11,0 ± 2,8 12,0 ± 2,7 15,1 ± 4,7 15,0 ± 5,0 16,2 ± 6,1
0,4 ± 0,1 0,5 ± 0,1 0,5 ± 0,2 0,6 ± 0,2 0,5 ± 0,2

Klírens (ml/kg*h) 3,9 ± 0,9 4,8 ± 1,5 3,8 ± 1,5 4,1 ± 1,0 3,6 ± 1,2 a Vypočítané ako (Cmax – faktor VIII na začiatku liečby) delené dávkou v IU/kg, kde Cmax je maximálny nameraný faktor VIII po infúzii.
Bezpečnosť a hemostatická účinnosť lieku ADVATE v pediatrickej populácii sú podobné ako tieto parametre u dospelých pacientov. Upravené obnovenie a konečný polčas (t½) boli približne o 20% nižšie u mladších detí (mladších ako 6 rokov) ako u dospelých, čo je v súlade so známym vyšším objemom plazmy na kilogram telesnej hmotnosti u mladších pacientov.
Aktuálne nie sú k dispozícii farmakokinetické údaje o ADVATE u predtým neliečených pacientov.
5.3. Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe farmakologických štúdií bezpečnosti, akútnej toxikológie, toxicity po opakovanom podaní, lokálnej toxicity a genotoxicity neodhalili žiadne osobitné riziko pre ľudí.
Štúdia lokálnej tolerancie u králikov ukázala, že liek ADVATE, rozpustený v 2 ml sterilizovanej vody na injekcie, je po intravenóznom podaní dobre tolerovaný. Slabé prechodné začervenanie v mieste podania bolo pozorované po intraarteriálnej aplikácii a po paravenóznom podaní. Nedala sa však pozorovať žiadna korelácia nežiaducich histopatologických zmien, čo hovorí o prechodných vlastnostiach tohto zistenia.
6. FARMACEUTICKÉ INFORMÁCIE
6.1. Zoznam pomocných látok
Prášok Manitol Chlorid sodný Histidín Trehalóza
Chlorid vápenatý Trometamol Polysorbát 80
Glutatión (redukovaný)
Rozpúšťadlo
Sterilizovaná voda na injekciu
6.2. Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi alebo rozpúšťadlami.
6.3. Čas použiteľnosti
2 roky.
Po rekonštitúcii: z mikrobiologického hľadiska sa má liek použiť okamžite. Avšak chemická a fyzikálna stabilita počas používania bola pri teplote 25 °C preukázaná na 3 hodiny.
V rámci času použiteľnosti sa liek môže uchovávať pri izbovej teplote (až do 25 °C) počas jedného obdobia nepresahujúceho 6 mesiacov. Na balenie lieku zaznamenajte dátum konca 6-mesačného uchovávania pri izbovej teplote. Liek sa nesmie vrátiť späť do chladničky.
6.4. Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke pri teplote (2 °C – 8 °C). Neuchovávajte v mrazničke.
ADVATE s pomôckou BAXJECT II: Injekčnú liekovku s liekom uchovávajte vo vonkajšom obale na ochranu pred svetlom.
ADVATE v systéme BAXJECT III: Uzavretý blister uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5. Druh obalu a obsah balenia
Injekčná liekovka s práškom a 2 ml injekčná liekovka s rozpúšťadlom sú vyrobené zo skla typu
I a uzatvorené chlorobutylovými gumenými zátkami. Liek sa dodáva v jednej z nasledujúcich foriem:
- ADVATE s pomôckou BAXJECT II: Každé balenie obsahuje injekčnú liekovku
s práškom, 2 ml injekčnú liekovku s rozpúšťadlom a pomôcku na rekonštitúciu (BAXJECT II).
- ADVATE v systéme BAXJECT III: Každé balenie obsahuje systém BAXJECT v uzavretom blistri (injekčná liekovka s práškom a 2 ml injekčná liekovka s rozpúšťadlom sú zabudované v systéme na rekonštitúciu).
6.6. Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
ADVATE sa podáva intravenózne po rekonštitúcii lieku.
Pripravený roztok sa má skontrolovať vizuálne, či neobsahuje cudzorodé častice a či nemá zmenenú farbu.
Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc. Nepoužívajte zakalené roztoky alebo roztoky s usadeninami.
- Na podávanie je potrebné použiť injekčnú striekačku s konektorom luer-lock.
- Použite do troch hodín po príprave.
- Po príprave liek neuchovávajte v chladničke.
- Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Príprava roztoku s pomôckou BAXJECT II
- Na rekonštitúciu použite len pribalenú sterilizovanú vodu na injekciu a pomôcku na rekonštitúciu.
- Nepoužívajte, ak je pomôcka BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
- Má byť použitá aseptická technika
1. Ak je liek ešte uchovávaný v chladničke, vyberte injekčnú liekovku s práškom ADVATE
a injekčnú liekovku s rozpúšťadlom z chladničky a zohrejte ich na izbovú teplotu
(medzi 15 °C - 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Odstráňte uzáver z injekčnej liekovky s práškom a uzáver z injekčnej liekovky s rozpúšťadlom
4. Očistite zátky tampónmi napustenými alkoholom. Injekčné liekovky umiestnite na rovný čistý povrch.
5. Otvorte balenie pomôcky BaxJect II odtrhnutím papierového viečka bez toho, aby ste sa dotkli vnútrajška (Obr. a). Nevyberajte pomôcku z balenia. Nepoužívajte, ak je pomôcka
BAXJECT II, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
6. Otočte balenie nahor a prepichnite zátku rozpúšťadla čírym plastovým bodcom. Uchopte balenie za jeho okraj a stiahnite balenie z BAXJECTu II (Obr. b). Neodstraňujte modré viečko z pomôcky BAXJECT II.
7. Na rekonštitúciu sa má použiť len pribalená sterilizovaná voda na injekciu a pomôcka na rekonštitúciu. S BAXJECTom II pripevneným na injekčnú liekovku s rozpúšťadlom obráťte
systém tak, aby bola injekčná liekovka s rozpúšťadlom navrchu. Bielym plastovým bodcom prepichnite zátku prášku ADVATE. Vákuum nasaje rozpúšťadlo do injekčnej liekovky
s práškom ADVATE (Obr. c).
8. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok číry, bezfarebný a bez cudzorodých častíc.
Obr. a Obr. b Obr. c
 Príprava roztoku so systémom BAXJECT III
Príprava roztoku so systémom BAXJECT III
- Ak viečko úplne neutesňuje blister, výrobok nepoužívajte.
1. Ak je liek ešte uchovávaný v chladničke, vyberte uzavretý blister (obsahuje injekčnú liekovku s práškom a injekčnú liekovku s rozpúšťadlom zabudované v systéme na rekonštitúciu) z chladničky a zohrejte ich na izbovú teplotu (medzi 15 °C a 25 °C).
2. Dôkladne si umyte ruky s použitím mydla a teplej vody.
3. Otvorte balenie ADVATE odlepením viečka. Vyberte systém BAXJECT III z blistra.
4. Položte liek ADVATE na rovný povrch s injekčnou liekovkou s rozpúšťadlom nahor (Obr. 1).
Injekčná liekovka s rozpúšťadlom má modrý prúžok. Neodstraňujte modré viečko, až kým nedostanete pokyn v ďalšom kroku.
5. Jednou rukou pridržte liek ADVATE v systéme BAXJECT III, druhou rukou pevne pritlačte na injekčnú liekovku s rozpúšťadlom, kým systém úplne nezaklapne a rozpúšťadlo nezačne prúdiť do injekčnej liekovky ADVATE (Obr. 2). Systém nenakláňajte, kým sa prenos nedokončí.
6. Overte, že prenos rozpúšťadla je úplný. Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že prášok ADVATE je úplne rozpustený, inak neprejde všetok pripravený roztok cez filter
pomôcky. Liek sa rozpúšťa rýchlo (zvyčajne za menej ako 1 minútu). Po príprave má byť roztok
číry, bezfarebný a bez cudzorodých častíc.
Obr. 1 Obr. 2 Obr. 3 Podávanie
PodávaniePoužite aseptickú techniku
Lieky podávané parenterálne sa pred podaním musia skontrolovať, či neobsahujú pevné čiastočky, vždy keď to roztok a obal umožní. Použitý smie byť len číry a bezfarebný roztok.
1. Odstráňte modré viečko z BAXJECTu II/BAXJECTu III.
Nenasajte vzduch do injekčnej striekačky. Pripojte injekčnú striekačku k BAXJECTu II/BAXJECTu III.
2. Prevráťte systém (injekčná liekovka s pripraveným roztokom má byť hore). Natiahnite pripravený roztok do injekčnej striekačky pomalým vytiahnutím piestu smerom dozadu.
3. Odpojte injekčnú striekačku.
4. Pripojte krídelkovú ihlu na injekčnú striekačku. Injektujte intravenózne. Roztok sa má podávať pomaly, rýchlosťou ktorá pacientovi najviac vyhovuje a nepresahuje 10 ml za minútu. Pulzová frekvencia sa má zmerať pred podaním ADVATE a počas jeho podávania. Ak dôjde
k významnému vzostupu, zníženie rýchlosti podávania alebo dočasné prerušenie podávania zvyčajne postačí na to, aby príznaky rýchlo vymizli (pozri časti 4.4 a 4.8).
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBaxter AG Industriestrasse 67
A-1221 Viedeň
Rakúsko
8. REGISTRAČNÉ ČÍSLOEU/1/03/271/010
EU/1/03/271/020
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 2. marec 2004
Dátum posledného predĺženia registrácie: 2. marec 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.