hypersenzitívne reakcie vrátane liekovej reakcie
s eozinofíliou a systémovými symptómami (Drug Reaction with Eosinophilia and Systemic Symptoms, DRESS) boli v niektorých prípadoch spojené s horúčkou, hematologickými zmenami
a postihnutím obličiek alebo pečene.
Pacienti majú byť poučení o prejavoch a symptómoch a majú byť dôsledne monitorovaní pre výskyt symptómov alergických/hypersenzitívnych reakcií (pozri časť 4.8).
Liečba febuxostátom má byť ihneď ukončená pri výskyte závažných alergických/hypersenzitívnych reakcií, vrátane Stevensovho-Johnsonovho syndrómu, pretože skoré ukončenie liečby je spojené
s lepšou prognózou. Ak sa u pacienta vyvinuli alergické/hypersenzitívne reakcie, vrátane Stevensovho-Johnsonovho syndrómu a akútnej anafylaktickej reakcie/šoku, liečba febuxostátom sa
u týchto pacientov nesmie znovu začať.
Akútne záchvaty dny (vzplanutie dny) Liečba febuxostátom sa nesmie začať, pokiaľ úplne neodznie akútny dnavý záchvat. Po začatí liečby sa môžu vyskytnúť dnavé záchvaty, a to kvôli zmene koncentrácie kyseliny močovej v sére vyplývajúcej z mobilizácie urátov uložených v tkanivách (pozri časti 4.8 a 5.1). Pri začatí liečby febuxostátom sa odporúča profylaxia pred záchvatom najmenej 6 mesiacov pomocou NSAID alebo kolchicínu (pozri časť 4.2).
Ak sa dnavý záchvat vyskytne počas liečby febuxostátom, liečba sa nesmie prerušiť. Dnavý záchvat je potrebné zvládnuť primerane pre príslušného pacienta. Nepretržité podávanie febuxostátu znižuje frekvenciu a intenzitu dnavých záchvatov.
Ukladanie xantínu U pacientov, u ktorých je významne zvýšená rýchlosť tvorby urátov (napr. malígne ochorenie a jeho liečba, Leschov-Nyhanov syndróm), sa môže absolútna koncentrácia xantínu v moči v ojedinelých prípadoch zvýšiť natoľko, že sa môže ukladať v močovom trakte. Keďže nie sú žiadne skúsenosti
s užívaním febuxostátu, u týchto pacientov sa jeho užívanie neodporúča.
Merkaptopurín/azatioprín Použitie febuxostátu sa neodporúča u pacientov, ktorí sú súčasne liečení merkaptopurínom alebo azatioprínom. Ak nie je možné sa tejto kombinácii vyhnúť, pacienti musia byť starostlivo monitorovaní. Odporúča sa redukcia dávky merkaptopurínu alebo azatioprínu s cieľom vyhnúť sa možným hematologickým účinkom (pozri časť 4.5).
Príjemcovia orgánových transplantátov Doteraz nie sú žiadne skúsenosti u pacientov po transplantácii orgánov, preto sa užívanie febuxostátu u týchto pacientov neodporúča (pozri časť 5.1).
Teofylín Súčasné podanie jednej dávky 80 mg febuxostátu a jednej dávky 400 mg teofylínu zdravým dobrovoľníkom neukázalo žiadnu farmakokinetickú interakciu (pozri časť 4.5). Febuxostát 80 mg sa môže používať u pacientov, ktorí sú súčasne liečení teofylínom bez rizika zvýšenia plazmatických hladín teofylínu. Pre febuxostát 120 mg nie sú dostupné údaje.
Poruchy pečene Počas kombinovanej tretej fázy klinických štúdií boli u pacientov liečených febuxostátom pozorované mierne odchýlky v testoch funkcie pečene (5,0%). Pred začatím liečby febuxostátom a potom
v pravidelných intervaloch sa odporúča vyšetriť funkciu pečene na základe klinického hodnotenia (pozri časť 5.1).
Poruchy štítnej žľazy V otvorených rozšírených dlhodobých štúdiách boli u pacientov s dlhodobou liečbou febuxostátom (5,5%) pozorované zvýšené hodnoty TSH (>5,5 μIU/ml). Pri použití febuxostátu u pacientov so zmenenou funkciou štítnej žľazy sa vyžaduje opatrnosť (pozri časť 5.1).
Laktóza Tablety Abuxaru obsahujú laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
4.5 Liekové a iné interakcie Merkaptopurín/azatioprín Na základe mechanizmu účinku febuxostátu na inhibíciu xantínoxidázy (XO) sa súčasné používanie neodporúča. Inhibícia XO febuxostátom môže zvýšiť plazmatickú koncentráciu týchto liekov a viesť
k ich toxicite (pozri časť 4.4). Štúdie interakcií febuxostátu s liekmi, ktoré sú metabolizované XO, neboli uskutočnené.
Liekové interakčné štúdie febuxostátu s cytotoxickou chemoterapiou neboli vykonané. Nie sú
k dispozícii žiadne údaje týkajúce sa bezpečnosti febuxostátu počas cytotoxickej terapie.
Rosiglitazón/CYP2C8 substráty Febuxostát sa javil ako slabý inhibítor CYP2C8
in vitro. V štúdii so zdravými dobrovoľníkmi súčasné podanie perorálnej dávky 120 mg febuxostátu QD s jednou dávkou 4 mg perorálne podaného rosiglitazónu nemalo účinok na farmakokinetiku rosiglitazónu a jeho metabolitu N-demetyl rosiglitazónu, čo poukazuje na to, že febuxostát nie je CYP2C8 enzýmový inhibítor
in vivo. Súčasné podanie febuxostátu s rosiglitazónom alebo inými substrátmi CYP2C8 nevyžaduje úpravu dávky pre tieto liečivá.
Teofylín Interakčná štúdia febuxostátu so zdravými dobrovoľníkmi sledovala, či inhibícia xantínoxidázy môže spôsobiť zvýšenie koncentrácie teofylínu v cirkulácii, ako bolo pozorované pri použití iných inhibítorov xantínoxidázy. Výsledky štúdie ukázali, že súčasné podanie 80 mg febuxostátu QD
s teofylínom 400 mg v jednej dávke nemá účinok na farmakokinetiku alebo bezpečnosť teofylínu. Preto nie je potrebná osobitná opatrnosť pri súčasnom podávaní teofylínu a febuxostátu. Pre febuxostát 120 mg nie sú dostupné údaje.
Naproxén a iné látky inhibujúce glukuronidáciu Metabolizmus febuxostátu závisí na uridín-glukuronyltransferáze (UGT). Lieky inhibujúce glukuronidáciu, ako napríklad NSAIDs a probenecid, by teoreticky mohli ovplyvniť elimináciu febuxostátu. U zdravých osôb bolo súčasné užívanie febuxostátu a naproxénu 250 mg dvakrát denne spojené so zvýšenou expozíciou febuxostátu (C
max 28%, AUC 41% a t
1/2 26%). V klinických štúdiách nebolo užívanie naproxénu ani iných NSAIDs/Cox-2 inhibítorov spojené so žiadnym signifikantným zvýšením nežiaducich účinkov.
Febuxostát možno podávať spolu s naproxénom, pričom nie je potrebná žiadna úprava dávky febuxostátu alebo naproxénu.
Látky indukujúce glukuronidáciu Silné lieky indukujúce enzýmy UGT by mohli viesť k zvýšenému metabolizmu a zníženej účinnosti febuxostátu. Monitorovanie kyseliny močovej v sére sa preto odporúča 1-2 týždne po začatí liečby silným liekom indukujúcim glukuronidáciu. Naopak, skončenie liečby indukujúcim liekom by mohlo viesť k zvýšeným koncentráciám febuxostátu v plazme.
Kolchicín/indometacín/hydrochlorotiazid/warfarín Febuxostát možno podávať súčasne s kolchicínom alebo indometacínom bez potreby upraviť dávku febuxostátu alebo súčasne podávaného liečiva.
Pri podávaní febuxostátu s hydrochlorotiazidom nie je potrebná žiadna úprava dávky pre febuxostát.
Pri podávaní febuxostátu s warfarínom nie je potrebná žiadna úprava dávky pre warfarín. Podávanie febuxostátu (80 mg alebo 120 mg jedenkrát denne) s warfarínom nemá žiadny vplyv na farmakokinetiku warfarínu u zdravých jedincov. INR a pôsobenie faktora VII tiež neboli ovplyvnené so súčasným podávaním febuxostátu.
Dezipramín/ substráty CYP2D6 Pri pokusoch
in vitro sa ukázalo, že febuxostát je slabým inhibítorom CYP2D6
. V štúdii so zdravými subjektmi spôsobilo 120 mg febuxostátu QD priemerne 22% nárast AUC dezipramínu, CYP2D6 substrátu, čo naznačuje možný slabý inhibičný účinok febuxostátu na enzým CYP2D6
in vivo. Preto sa nepredpokladá, že súčasné podávanie febuxostátu s inými substrátmi CYP2D6 bude vyžadovať upravenie dávky pre tieto liečivá.
Antacidá Ukázalo sa, že pri súčasnom užití antacíd s obsahom hydroxidu horečnatého a hydroxidu hlinitého sa oneskorí absorpcia febuxostátu (približne o 1 hodinu) a o 32% sa zníži hodnota C
max, ale nebola pozorovaná žiadna významná zmena AUC. Febuxostát možno preto užívať bez ohľadu na užívanie antacíd.
4.6 Fertilita, gravidita a laktácia GraviditaÚdaje o veľmi obmedzenom počte gravidných žien užívajúcich febuxostát nepreukázali žiadne nežiaduce účinky na graviditu alebo na zdravie plodu/novorodenca. Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky na graviditu, embryonálny/fetálny vývin alebo pôrod (pozri časť 5.3). Nie je známe potenciálne riziko u ľudí. Febuxostát sa nemá používať počas gravidity.
Dojčenie Nie je známe, či sa febuxostát vylučuje do ľudského materského mlieka. Štúdie na zvieratách preukázali vylučovanie tohto liečiva do mlieka a zhoršený vývin dojčených mláďat. Nemožno vylúčiť riziko pre dojča. Febuxostát sa nemá používať počas dojčenia.
Fertilita Štúdie reprodukcie na zvieratách pri dávke do 48 mg/kg/deň nepreukázali žiadne nežiaduce účinky na fertilitu závislé od dávky (pozri časť 5.3). Vplyv febuxostátu na fertilitu u ľudí nie je známy.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje Pri užívaní febuxostátu boli hlásené ospanlivosť, závraty, parestézia a rozmazané videnie. Pacienti by mali dbať na opatrnosť predtým, ako budú viesť vozidlo, obsluhovať stroje alebo sa podieľať na nebezpečných aktivitách, pokiaľ nie sú pevne presvedčení, že Abuxar neovplyvňuje nežiaduco ich výkonnosť.
4.8 Nežiaduce účinky Súhrn bezpečnostného profilu Najčastejšie hlásené nežiaduce účinky v klinických štúdiách (4 072 subjektov liečených aspoň dávkou od 10 mg do 300 mg) a počas postmarketingových skúseností sú vzplanutia dny, poruchy funkcie pečene, hnačka, nauzea, bolesť hlavy, vyrážka a edém. Tieto nežiaduce účinky boli väčšinou mierne alebo stredne závažné. Zriedkavé závažné hypersenzitívne reakcie na febuxostát, z ktorých niektoré boli spojené so systémovými príznakmi, sa vyskytli počas postmarketingových skúseností.
Prehľadný zoznam nežiaducich účinkov Nižšie sú uvedené časté ( ≥ 1/100 až <1/10), menej časté ( ≥ 1/1 000 až <1/100) a zriedkavé
( ≥1/10 000 až <1/1 000) nežiaduce reakcie, ktoré sa vyskytovali u pacientov liečených febuxostátom.
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
Tabuľka 1: Nežiaduce reakcie v dlhodobých rozšírených štúdiách kombinovanej fázy 3 a počas postmarketingových skúsenostíTrieda orgánových systémov
| Frekvencia
| Preferovaný výraz
|
Poruchy krvi a lymfatického systému
| Zriedkavé
| Pancytopénia, trombocytopénia
|
Poruchy imunitného systému
| Zriedkavé
| Anafylaktická reakcia*, hypersenzitivita na liek*
|
Poruchy endokrinného systému
| Menej časté
| Zvýšenie hladiny hormónu stimulujúceho štítnu žľazu v krvi
|
Poruchy oka
| Zriedkavé
| Rozmazané videnie
|
Poruchy metabolizmu a výživy
| Časté ***
| Vzplanutie dny
|
Menej časté
| Diabetes mellitus, hyperlipidémia, znížená chuť do jedla, zvýšenie hmotnosti
|
Zriedkavé
| Zníženie hmotnosti, zvýšená chuť do jedla, anorexia
|
Psychické poruchy
| Menej časté
| Znížené libido, nespavosť
|
Zriedkavé
| Nervozita
|
Poruchy nervového systému
| Časté
| Bolesť hlavy
|
Menej časté
| Závraty, parestézia, hemiparéza, ospanlivosť, zmenená chuť, hypestézia, hyposmia
|
Poruchy ucha a labyrintu
| Zriedkavé
| Tinnitus
|
Poruchy srdca a srdcovej činnosti
| Menej časté
| Fibrilácia predsiení, palpitácie (búšenie srdca), abnormálne EKG
|
Poruchy ciev
| Menej časté
| Hypertenzia, začervenenie, návaly tepla
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| Menej časté
| Dyspnoe, bronchitída, infekcia horných dýchacích ciest, kašeľ
|
Poruchy gastrointestinálneho traktu
| Časté
| Hnačka**, nevoľnosť
|
Menej časté
| Bolesti brucha, distenzia brucha, gastroezofageálny reflux, vracanie, suchosť v ústach, dyspepsia, zápcha, častá stolica, nadúvanie, gastrointestinálne ťažkosti
|
Zriedkavé
| Pankreatitída, vredy v ústach
|
Poruchy pečene a žlčových ciest
| Časté
| Abnormálna funkcia pečene**
|
Menej časté
| Žlčové kamene
|
Zriedkavé
| Hepatitída, žltačka*, poškodenie pečene *
|
Poruchy kože a podkožného tkaniva
| Časté
| Vyrážka (vrátane rôznych druhov vyrážky hlásených s nižšou frekvenciou, pozri nižšie)
|
| Menej časté
| Dermatitída, urtikária, pruritus, poruchy sfarbenia kože, kožné lézie, petechie, makulózna vyrážka, makulopapulózna vyrážka, papulózna vyrážka
|
Zriedkavé
| Toxická epidermálna nekrolýza*, Stevensov-Johnsonov syndróm*, angioedém*, lieková reakcia
s eozinofíliou a systémovými symptómami*, generalizovaná vyrážka (závažná)*, erytém, exfoliatívna vyrážka, folikulárna vyrážka, vezikulárna vyrážka, pustulárna vyrážka, svrbivá vyrážka*, erytematózna vyrážka, morbiliformná vyrážka, alopécia, hyperhidróza
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
| Menej časté
| Artralgia, artritída, myalgia, bolesti svalov a kĺbov, svalová slabosť, svalové spazmy, napätie svalov, burzitída
|
Zriedkavé
| Rabdomyolýza*, stuhnutosť kĺbov, muskuloskeletálna stuhnutosť
|
Poruchy obličiek a močovej sústavy
| Menej časté
| Renálne zlyhanie, nefrolitiáza, hematúria, polakizúria, proteinúria
|
| Zriedkavé
| Tubulointersticiálna nefritída*, nutkanie na močenie
|
Poruchy reprodukčného systému a prsníkov
| Menej časté
| Erektilná dysfunkcia
|
Celkové poruchy a reakcie
v mieste podania
| Časté
| Edém
|
Menej časté
| Únava, bolesť na hrudi, dyskomfort na hrudi
|
Zriedkavé
| Smäd
|
Laboratórne
a funkčné vyšetrenia
| Menej časté
| Zvýšenie amylázy v krvi, zníženie počtu trombocytov, zníženie počtu bielych krviniek, zníženie počtu lymfocytov, zvýšenie kreatínu v krvi, zvýšenie kreatinínu v krvi, pokles hemoglobínu, zvýšenie močoviny v krvi, zvýšenie triglyceridov v krvi, zvýšenie cholesterolu v krvi, zníženie hematokritu, zvýšenie laktátovej dehydrogenázy v krvi, zvýšenie draslíka v krvi
|
Zriedkavé
| Zvýšenie glukózy v krvi, predĺženie aktivovaného parciálneho tromboplastínového času, zníženie počtu červených krviniek v krvi, zvýšenie alkalickej fosfatázy v krvi, zvýšenie kreatínfosfokinázy v krvi*
|
* Nežiaduce reakcie pochádzajúce z postmarketingových skúseností.
** Liečba akútnej neinfekčnej hnačky a výsledky testov pečeňovej funkcie mimo normy
v kombinovanej štúdii fázy 3 sú častejšie u pacientov, ktorí sú súčasne liečení kolchicínom.
*** Pozri časť 5.1 pre výskyt vzplanutia dny v randomizovaných kontrolovaných štúdiách samostatnej fázy 3.
Opis vybraných nežiaducich reakcií Zriedkavé závažné hypersenzitívne reakcie na febuxostát, vrátane Stevensovho-Johnsonovho syndrómu, toxickej epidermálnej nekrolýzy a anafylaktickej reakcie/šoku, sa vyskytli počas postmarketingových skúseností. Stevensov-Johnsonov syndróm a toxická epidermálna nekrolýza sú charakterizované progresívnymi kožnými vyrážkami spojenými s pľuzgiermi alebo léziami na slizniciach a podráždením očí. Hypersenzitívne reakcie na febuxostát môžu byť spojené
s nasledujúcimi symptómami: kožné reakcie charakterizované infiltrovanými makulopapulóznymi erupciami, generalizovanými alebo exfoliatívnymi vyrážkami, ale aj kožnými léziami, edémom tváre, horúčkou, hematologickými abnormalitami ako je trombocytopénia a eozinofília a zasiahnutím jedného alebo viacerých orgánov (pečene a obličky, vrátane tubulointersticiálnej nefritídy)
(pozri časť 4.4).
Vzplanutia dny boli často pozorované krátko po začatí liečby a počas prvých mesiacov. Potom sa frekvencia vzplanutia dny znížila v závislosti od času. Odporúča sa profylaxia pred vzplanutím dny (pozri časti 4.2 a 4.4).
Hlásenie podozrení na nežiaduce reakcie Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národný systém hlásenia uvedený v
Prílohe V.
4.9 Predávkovanie Liečba pacientov s prejavmi predávkovania je podporná a symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: Antiuratiká (liečba dny), liečivá potlačujúce tvorbu kyseliny močovej.
ATC kód: M04AA03
Mechanizmus účinku Kyselina močová je u človeka koncový produkt metabolizmu purínov a vytvára sa v stupňoch hypoxantín → xantín → kyselina močová. Obidva stupne v uvedenom mechanizme sú katalyzované xantínoxidázou (XO). Febuxostát je derivát 2-aryltiazolu, ktorý dosahuje terapeutický účinok zníženia kyseliny močovej v sére selektívnou inhibíciou XO. Febuxostát je potentný nepurínový selektívny inhibítor XO (NP-SIXO), ktorého hodnota Ki
in vitro je menej ako jeden nanomol. Ukázalo sa, že febuxostát účinne inhibuje oxidované aj redukované formy XO. V terapeutických koncentráciách febuxostát neinhibuje iné enzýmy, ktoré sa zúčastňujú na metabolizme purínu alebo pyrimidínu, konkrétne guaníndeaminázu, hypoxantínguanínfosforibozyltransferázu, orotát fosforibozyltransferázu, orotidín monofosfát dekarboxylázu alebo purínnukleozidfosforylázu.
Klinická účinnosť a bezpečnosť Účinnosť febuxostátu bola preukázaná v troch pivotných štúdiách fázy 3 (dve pivotné štúdie APEX
a FACT a v pridanej štúdii CONFIRMS popísaných nižšie), ktoré boli uskutočnené u 4101 pacientov
s hyperurikémiou a dnou. V každej pivotnej štúdii fázy 3 preukázal febuxostát vynikajúcu schopnosť znížiť a udržať koncentrácie kyseliny močovej v sére porovnateľnú s alopurinolom. Primárny parameter účinnosti v APEX a FACT štúdiách predstavoval podiel pacientov, u ktorých boli koncentrácie kyseliny močovej v sére za posledné 3 mesiace < 6,0 mg/dl (357 μmol/l). V pridanej štúdii CONFIRMS vo fáze 3, ktorej výsledky boli prvýkrát dostupné po registrácii febuxostátu, primárnym parametrom účinnosti bola časť pacientov, ktorých hladina urátov v sére bola < 6,0 mg/dl na poslednom vyšetrení. Do týchto štúdií neboli zahrnutí pacienti s orgánovými transplantáciami (pozri časť 4.2).
Štúdia APEX: Štúdia účinnosti febuxostátu kontrolovaná na základe alopurinolu a placeba (APEX) bola randomizovaná, dvojito zaslepená, multicentrická štúdia fázy 3 v trvaní 28 týždňov. Randomizovaných bolo tisícsedemdesiatdva pacientov (1072): placebo (n=134), febuxostát 80 mg QD (n=267), febuxostát 120 mg QD (n=269), febuxostát 240 mg QD (n=134) alebo alopurinol (300 mg QD [n=258] u pacientov s východiskovou hodnotou kreatinínu v sére ≤ 1,5 mg/dl alebo 100 mg QD [n=10] u pacientov s východiskovou hodnotou kreatinínu v sére >1,5 mg/dl a ≤ 2,0 mg/dl). 240 mg febuxostátu (dvojnásobne vyššia dávka ako je najvyššia odporúčaná dávka) bolo použitých ako dávka na vyhodnotenie bezpečnosti.
Štúdia APEX ukázala štatisticky významnú superioritu obidvoch liekov febuxostát 80 mg QD
a febuxostát 120 mg QD
oproti tradične používaným dávkam alopurinolu 300 mg (n = 258) /100 mg (n = 10) v liečbe pri znižovaní kyseliny močovej pod úroveň 6 mg/dl (357 μmol/l) (pozri tabuľku 2
a obrázok 1).
Štúdia FACT: Štúdia kontrolovaná febuxostátom a alopurinolom (FACT) bola randomizovaná, dvojito zaslepená, multicentrická štúdia fázy 3 v trvaní 52 týždňov. Sedemstošesťdesiat pacientov (760) bolo randomizovaných: febuxostát 80 mg QD (n=256), febuxostát 120 mg QD (n=251) alebo alopurinol 300 mg QD (n=253).
Štúdia FACT ukázala štatisticky významnú superioritu obidvoch liekov febuxostát 80 mg a febuxostát 120 mg QD
oproti tradične používaným dávkam alopurinolu 300 mg v liečbe pri znižovaní kyseliny močovej a udržovaní jej hodnoty pod 6 mg/dl (357 μmol/l).
V tabuľke 2 sú výsledky primárneho parametra účinnosti:
Tabuľka 2Percento pacientov s koncentráciami kyseliny močovej v sére < 6,0 mg/dl (357 μmol/l) Posledné tri mesačné návštevy Štúdia
| Febuxostát
80 mg QD
| Febuxostát
120 mg QD
| Alopurinol 300 /
100 mg QD1
|
APEX
(28 týždňov)
| 48% *
(n=262)
| 65% *, #
(n=269)
| 22%
(n=268)
|
FACT
(52 týždňov)
| 53%*
(n=255)
| 62%*
(n=250)
| 21%
(n=251)
|
Kombinované
výsledky
| 51%*
(n=517)
| 63%*, #
(n=519)
| 22%
(n=519)
|
1 výsledky od subjektov, ktorým bolo podávané buď 100 mg QD (n=10: pacienti so sérovým kreatinínom >1,5 a ≤ 2,0 mg/dl) alebo 300 mg QD (n=509), boli kvôli analýzam zoskupené.
* p < 0,001 oproti alopurinolu, # p < 0,001 oproti 80 mg
|
Schopnosť febuxostátu znížiť koncentrácie kyseliny močovej v sére bola rýchla a pretrvávala. Zníženie koncentrácie kyseliny močovej v sére na < 6,0 mg/dl (357 μmol/l) bolo zaznamenané počas návštevy v 2. týždni a udržiavalo sa na rovnakej úrovni počas celej liečby. Priemerné koncentrácie kyseliny močovej v sére v čase pre každú skupinu podstupujúcu liečbu z dvoch pivotných štúdií fázy 3 sú znázornené na obrázku 1.
Obrázok 1 Priemerné koncentrácie kyseliny močovej v sére v kombinovaných pivotných štúdiách fázy 3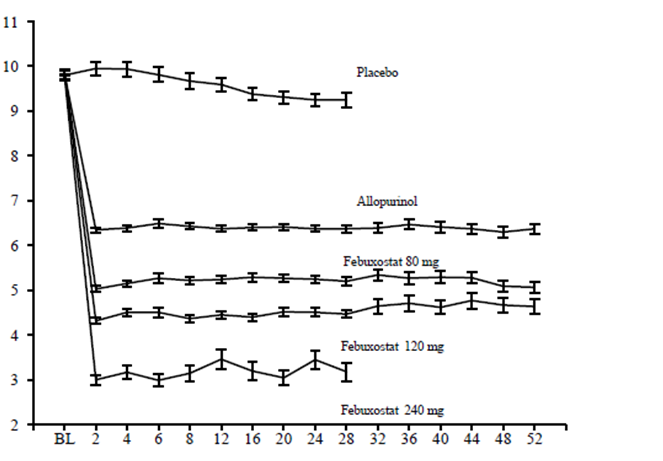

Týždeň
BL = baseline SEM = standard error of the mean
Poznámka: 509 pacientom bolo podávané 300 mg QD alopurinolu; 10 pacientom so sérovým kreatinínom >1,5 a < 2,0 mg/dl bolo podávaných 100 mg QD. (10 pacientov z 268 v štúdii APEX).
Na vyhodnotenie bezpečnosti febuxostátu sa použilo 240 mg febuxostátu, čo je dvojnásobne vyššia dávka ako je najvyššia odporúčaná dávka.
CONFIRMS štúdia: CONFIRMS štúdia bola randomizovaná kontrolovaná 26-týždňová štúdia vo fáze 3, ktorá hodnotila bezpečnosť a účinnosť febuxostátu 40 mg a 80 mg v porovnaní s alopurinolom 300 mg alebo 200 mg u pacientov s dnou a hyperurikémiou. 2269 pacientov bolo náhodne rozdelených: febuxostát 40 mg QD (n=757), febuxostát 80 mg QD (n=756) alebo alopurinol 300/200 mg QD (n=756). Najmenej 65 % pacientov malo mierne až stredne ťažké poškodenie obličiek
(s klírensom kreatinínu 30-89 ml/min). Profylaxia pred opätovným vzplanutím dny bola povinná po dobu 26 týždňov.
Počet pacientov s hladinou urátov < 6,0 mg/dl (357 μmol/l) v sére počas posledného vyšetrenia bol 45% pre pacientov užívajúcich febuxostát 40 mg, 67% pre febuxostát 80 mg a 42 % pre alopurinol 300/200 mg.
Primárny cieľový parameter v podskupine pacientov s poškodením obličiek Štúdia APEX hodnotila účinnosť u 40 pacientov s poškodením obličiek (t.j. základný sérový kreatinín > 1,5 mg/dl a ≤ 2,0 mg/dl). U subjektov s poškodením obličiek, ktorí boli náhodne vybratí na užívanie alopurinolu, bola dávka ukončená na 100 mg QD. Febuxostát dosiahol primárny cieľový parameter účinnosti u 44% (80 mg QD), 45% (120 mg QD) a 60% (240 mg QD) pacientov v porovnaní s 0%
v skupine užívajúcej 100 mg QD alopurinolu a skupine užívajúcej placebo.
Medzi percentuálnym poklesom kyseliny močovej v sére u zdravých subjektov bez ohľadu na ich funkciu obličiek neboli žiadne klinicky významné rozdiely (58% v skupine s normálnou funkciou obličiek a 55% v skupine so závažným poškodením obličiek). '
Analýza pacientov s dnou a poškodením obličiek bola prospektívne definovaná v CONFIRMS štúdii
a ukázala, že febuxostát bol podstatne viac účinný v znižovaní hladiny urátov (< 6,0 mg/dl) v sére
v porovnaní s alopurinolom 300/200 mg u pacientov, ktorí mali dnu s mierne až stredne ťažkým poškodením obličiek (65% sledovaných pacientov).
Primárny cieľový parameter v podskupine pacientov s koncentráciou kyseliny močovej v sére (sUA)
≥ 10 mg/dl Približne u 40% pacientov (kombinované štúdie APEX a FACT) bola východisková koncentrácia kyseliny močovej v sére ≥ 10 mg/dl. V tejto podskupine febuxostát dosiahol primárny cieľový parameter účinnosti (sUA (< 6,0 mg/dl počas posledných troch návštev) u 41% (80 mg QD), 48% (120 mg QD) a 66% (240 mg QD) pacientov v porovnaní s 9% v skupine užívajúcej 300 mg/100 mg QD alopurinolu a 0 % v skupine užívajúcej placebo.
V CONFIRMS štúdii, pomer pacientov dosahujúcich primárny koncový bod účinnosti (sUA < 6,0 mg/dl počas posledného vyšetrenia) v skupine pacientov so základnou hladinou urátov v sére ≥ 10,0 mg/dl liečených febuxostátom 40 mg QD bol 27 % (66/249), febuxostátom 80 mg QD 49 % (125/254) a s alopurinolom 300 mg/200 mg QD 31% (72/230).
Klinické výsledky: percento pacientov, ktorí vyžadovali liečbu kvôli vzplanutiu dnavého záchvatu. APEX štúdia: Počas 8-týždňového obdobia profylaxie väčšia časť subjektov (36%) v skupine liečenej febuxostátom 120 mg vyžadovala liečbu vzplanutia dny porovnateľnú s febuxostátom 80 mg (28%), alopurinolom 300 mg (23%) a placebom (20%). Výskyt záchvatov sa zvýšil po období profylaxie
a postupne v priebehu času klesal. 46 -55% subjektov dostalo liečbu na dnavé záchvaty od 8. do 28. týždňa. Vzplanutie dny počas posledných 4 týždňov štúdie (24.-28. týždeň) sa pozorovalo u 15% (febuxostát 80, 120 mg), 14% (alopurinol 300 mg) a 20% (placebo) subjektov.
FACT štúdia: Počas 8-týždňového obdobia profylaxie väčšia časť subjektov (36%) v skupine liečenej febuxostátom 120 mg vyžadovala liečbu dnavých záchvatov porovnateľnú s febuxostátom 80 mg (22%) a alopurinolom 300 mg (21%). Po 8-týždňovom období profylaxie incidencia vzplanutia sa zvýšila a postupne v priebehu času klesla (64% a 70% subjektov prijalo liečbu dnavých záchvatov od 8. do 52. týždňa). Vzplanutie dny počas posledných 4 týždňov štúdie (49.-52. týždeň) sa pozorovalo
u 6-8% (febuxostát 80, 120 mg) a 11% (alopurinol 300 mg) subjektov.
Percento pacientov, ktorí vyžadovali liečbu kvôli vzplanutiu dnavého záchvatu (štúdia APEX
a FACT) bolo číselne nižšie v skupinách, ktoré dosiahli priemernú koncentráciu urátov v sére oproti východiskovej hodnote < 6,0 mg/dl, < 5,0 mg/dl alebo < 4,0 mg/dl v porovnaní so skupinou, ktorá dosiahla priemernú koncentráciu urátov v sére oproti východiskovej hodnote ≥ 6,0 mg/dl počas posledných 32 týždňov obdobia liečby (intervaly 20. týždeň – 24. týždeň až 49. – 52. týždeň).
Počas CONFIRMS štúdie percentuálny podiel pacientov, ktorí prijali liečbu dnavého vzplanutia
(v prvý deň počas 6 mesiacov) v skupine liečených febuxostátom 80 mg bol 31% a v skupine liečenej alopurinolom bolo 25%. Neboli pozorované žiadne rozdiely v pomere pacientov dostávajúcich liečbu na vzplanutie dny medzi skupinami liečenými febuxostátom 80 mg a 40 mg.
Dlhodobé otvorené rozšírené štúdie EXCEL štúdia (C02-021): Excel štúdia bola trojročná otvorená multicentrická randomizovaná štúdia fázy 3 alopurinolom kontrolovaná bezpečnostná rozšírená štúdia u pacientov, ktorí dokončili pivotné štúdie fázy 3 (APEX a FACT). Bolo zaradených všetkých 1086 pacientov: febuxostát 80 mg QD (n=649), febuxostát 120 mg QD (n=292) a alopurinol 300/100 mg QD (n=145). Okolo 69% pacientov nevyžadovalo žiadnu zmenu liečby vedúcu k dosiahnutiu stabilnej liečby. Pacienti, ktorí mali trikrát po sebe hladiny sUA > 6,0 mg/dl, boli vyradení.
Hladiny urátov v sére boli v priebehu času udržované (t.j. 91% pacientov so začiatočnou dávkou febuxostátu 80 mg a 93 % pacientov s dávkou febuxostátu 120 mg mali sUA < 6 mg/dl v 36. mesiaci).
Údaje získané počas troch rokov ukázali, že sa znížil výskyt dnavých záchvatov a menej než 4% pacientov vyžadovalo liečbu záchvatu (t.j. viac než 96% pacientov nevyžadovalo liečbu záchvatu)
v 16. až 24. mesiaci a v 30. až 36. mesiaci.
46% pacientov s konečnou stabilnou liečbou febuxostátom 80 mg a 38% pacientov s febuxostátom 120 mg QD malo úplné rozpustenie primárnych hmatateľných tofov od začiatku po poslednú návštevu.
FOCUS štúdia (TMX-01-005) bola päťročná otvorená multicentrická bezpečnostná rozšírená štúdia fázy 2 s pacientami, ktorí ukončili 4-týždňové dvojito zaslepené podávanie febuxostátu v štúdii
TMX-00-004.
Zaradených bolo 116 pacientov, ktorí spočiatku dostávali febuxostát 80 mg QD. 62% pacientov nevyžadovalo žiadnu úpravu dávkovania pre udržanie sUA < 6 mg/dl a 38% pacientov vyžadovalo úpravu dávkovania s cieľom dosiahnuť stabilnú konečnú dávku.
Pomer pacientov s hladinou urátov v sére < 6,0 mg/dl (357 μmol/l) počas poslednej návštevy bol väčší ako 80% (81-100%) pre každú dávku febuxostátu.
Počas klinických štúdií fázy 3 boli pozorované mierne abnormality v testoch funkcie pečene
u pacientov liečených febuxostátom (5,0%). Frekvencie výskytu týchto odchýlok boli podobné ako pri liečbe alopurinolom (4,2%) (pozri časť 4.4). Zvýšené hodnoty TSH (>5,5 μIU/ml) boli pozorované
u pacientov liečených febuxostátom dlhodobo (5,5%) a pacientov liečených alopurinolom (5,8%)
v dlhodobých otvorených rozšírených štúdiách (pozri časť 4.4).
5.2 Farmakokinetické vlastnosti U zdravých subjektov sa maximálne koncentrácie febuxostátu v plazme (C
max) a plocha pod krivkou koncentrácie febuxostátu v plazme v priebehu času (AUC) zvýšili úmerne k dávke podľa toho, či boli podávané jednotlivé alebo viaceré dávky 10 mg až 120 mg. Pri dávkach medzi 120 mg a 300 mg je pozorované vyššie ako dávke úmerné zvýšenie AUC febuxostátu. Pri podávaní dávok
10 mg až 240 mg každých 24 hodín nedochádza k žiadnemu významnejšiemu nárastu. Febuxostát má zjavný priemerný polčas eliminácie (t
1/2) približne 5 až 8 hodín.
Farmakokinetické/ farmakodynamické analýzy jednotlivých skupín boli vykonané u 211 pacientov
s hyperurikémiou a dnou, ktorí boli liečení febuxostátom v množstve 40-240 mg QD. Vo všeobecnosti sú farmakokinetické parametre febuxostátu určené týmito analýzami v súlade s parametrami získanými u zdravých subjektov, čo znamená, že zdravé subjekty sú reprezentatívnou vzorkou na hodnotenie farmakokinetických, resp. farmakodynamických vlastností u pacientov s dnou.
Absorpcia Febuxostát sa absorbuje rýchlo (t
max 1,0-1,5 h) a dobre (minimálne 84%).
Po jednej dávke alebo viacerých perorálnych 80 mg a 120 mg dávkach podávaných raz za deň má C
max hodnotu približne 2,8-3,2 μg/ml v prípade 80 mg dávok a 5,0-5,3 μg/ml v prípade 120 mg dávok. Absolútna biologická dostupnosť febuxostátu vo forme tabliet nebola stanovená.
Po viacerých perorálnych 80 mg dávkach podávaných raz denne alebo 120 mg dávke s jedlom obsahujúcim vysoký podiel tukov bol odmeraný 49% a 38% pokles C
max a 18% a 16% pokles AUC, v uvedenom poradí.
V príslušných testoch však nebola pozorovaná žiadna klinicky významná zmena v percentuálnom poklese kyseliny močovej v sére (viacero 80 mg dávok). Febuxostát je preto možné užívať bez ohľadu na jedlo.
Distribúcia Zdanlivý rovnovážny objem distribúcie (Vss/F) febuxostátu je po podaní perorálnych dávok 10 - 300 mg od 29 do 75 l. Febuxostát sa viaže na proteíny v plazme približne v 99,2 %, (primárne na albumín), konštantne v celom rozsahu koncentrácie dosiahnutého dávkami 80 a 120 mg. Väzba aktívnych metabolitov na proteíny v plazme má rozsah približne od 82% do 91%.
Biotransformácia Febuxostát sa metabolizuje do značnej miery konjugáciou
prostredníctvom enzýmového systému uridíndifosfát-glukuronyltransferázy (UDPGT) a oxidáciou
prostredníctvom cytochrómu P450 (CYP). Boli identifikované štyri farmakologicky aktívne hydroxylové metabolity, z ktorých sa tri vyskytujú
v ľudskej plazme. Štúdie
in vitro s ľudskými pečeňovými mikrozómami ukázali, že tieto oxidačné metabolity boli vytvorené primárne pomocou CYP1A1, CYP1A2, CYP2C8 alebo CYP2C9
a febuxostát- glukuronid bol vytvorený najmä pomocou UGT 1A1, 1A8 a 1A9.
Eliminácia Febuxostát sa eliminuje prostredníctvom pečene aj prostredníctvom obličiek. Po podaní perorálnej dávky 80 mg febuxostátu označeného 14C bolo približne 49% dávky znova získaných v moči ako nezmenený febuxostát (3%), acylglukuronid liečiva (30%), jeho známe oxidačné metabolity a ich konjugáty (13%) a iné neznáme metabolity (3%). Okrem vylučovania obličkami bolo približne 45% dávky znova získaných v stolici ako nezmenený febuxostát (12%), acylglukuronid liečiva (1%), jeho známe oxidačné metabolity a ich konjugáty (25%) a iné neznáme metabolity (7%).
Poškodenie obličiek Po viacerých dávkach 80 mg febuxostátu u pacientov s miernym, stredne závažným alebo závažným poškodením obličiek sa hodnota C
max febuxostátu vzhľadom na subjekty s normálnou funkciou obličiek nezmenila. Priemerná celková AUC febuxostátu sa zvýšila približne 1,8-násobne od 7,5 µg.h/ml v skupine s normálnou funkciou obličiek po 13,2 µg.h/ml v skupine so závažnou renálnou dysfunkciou. Hodnoty C
max a AUC aktívnych metabolitov sa zvýšili 2-násobne pre C
max a 4-násobne pre AUC. U pacientov s miernym alebo stredným poškodením obličiek však nie je potrebná žiadna úprava dávky.
Poškodenie pečene Po viacerých 80 mg dávkach febuxostátu u pacientov s miernym poškodením pečene (Childova-Pughova trieda A) alebo stredne závažným poškodením pečene (Childova-Pughova trieda B) sa hodnoty C
max a AUC febuxostátu a jeho metabolitov významne nezmenili v porovnaní so subjektmi
s normálnou funkciou pečene. Neboli uskutočnené štúdie u pacientov so závažným poškodením pečene (Childova-Pughova trieda C).
Vek Neboli pozorované žiadne významné zmeny AUC febuxostátu alebo jeho metabolitov po viacerých perorálnych dávkach febuxostátu u starších ľudí v porovnaní s mladšími zdravými subjektmi.
Pohlavie Po viacerých perorálnych dávkach febuxostátu boli hodnoty C
max o 24% vyššie u žien ako u mužov
a hodnoty AUC boli o 12% vyššie u žien ako u mužov. Hodnoty C
max a AUC upravené podľa hmotnosti boli však podobné medzi oboma pohlaviami. Nie je potrebná žiadna úprava dávky na základe pohlavia.
5.3 Predklinické údaje o bezpečnosti Účinky v predklinických štúdiách sa všeobecne pozorovali pri expozíciách vyšších než je maximálna expozícia u ľudí.
Karcinogenéza, mutagenéza, poruchy plodnosti U samčích potkanov bol štatisticky významný nárast tumorov močového mechúra (papilóm z prechodných buniek a karcinóm) zistený iba v spojení s množstvom xantínu v skupine s vysokou dávkou pri dávke približne 11- krát vyššej, ako je podávaná u ľudí. Nebol pozorovaný signifikantný nárast žiadneho iného typu tumoru u samcov a samíc myší alebo potkanov. Tieto nálezy sa pokladajú za dôsledok purínového metabolizmu a zloženia moču špecifického pre príslušný druh a nemajú žiadny význam pre klinické použitie.
Štandardná skupina testov na genotoxicitu neodhalila žiadne biologicky významné genotoxické účinky pre febuxostát.
Zistilo sa, že febuxostát podávaný v perorálnych dávkach maximálne 48 mg/kg za deň, nemal žiadne účinky na plodnosť a reprodukciu u samcov a samíc potkanov.
Neboli zistené žiadne dôkazy o poškodenej plodnosti, teratogénnych účinkoch alebo poškodení plodu spôsobených febuxostátom. Pri použití dávok približne 4,3-krát vyšších ako sú expozície používané
u ľudí sa zistila maternálna toxicita spojená s vysokými dávkami, ktorá bola sprevádzaná znížením indexu odstavenia a spomaleným vývinom mláďat u potkanov. Štúdie teratogenicity uskutočnené
u brezivých samíc potkanov pri použití dávok približne 4,3-krát vyšších ako expozície u ľudí
a u brezivých samíc králikov 13-krát vyšších ako expozície u ľudí, neodhalili žiadne teratogénne účinky.
6. FARMACEUTICKÉ INFORMÁCIE 6.1 Zoznam pomocných látok Jadro tablety monohydrát laktózy
mikrokryštalická celulóza
stearan horečnatý
hydroxypropylcelulóza
sodná soľ kroskarmelózy
laktóza, bezvodá
koloidný oxid kremičitý bezvodý
laurylsíran sodný
Obal tablety polyvinylalkohol (E1203)
oxid titaničitý (E171)
makrogol 3350 (E1521)
mastenec (E553b)
žltý oxid železitý (E172)
6.2 Inkompatibility Neaplikovateľné.
6.3 Čas použiteľnosti 30 mesiacov
6.4 Špeciálne upozornenia na uchovávanie Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaPVC/PE/PVDC/Alu blister alebo PVC/PCTFE/Alu blister
Abuxar 120 mg filmom obalené tablety je dostupný v balení s obsahom 28 filmom obalených tabliet.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBelupo lijekovi i kozmetika d.d.
Ulica Danica 5, 48 000 Koprivnica, Chorvátska republika
8. REGISTRAČNÉ ČÍSLO29/0200/17-S
9. DÁTUM PRVEJ REGISTRÁCIE Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUJúl 2017