
Alopécia
Akné
Ružovka Ekzém Indurácia kože
|
Vyrážka
Fotosenzitívna reakcia
Hyperhidróza
|
|
Č
asté
|
Menej časté
|
N
eznáme
|
P
oruchy
kostrovej a svalovej sústavy a spojivového tkaniva
|
Muskuloskeletál
na stuhnutosť
|
Rigidita svalov
Svalové spazmy Svalové zášklby Napätie svalov Myalgia
Bolesti končatín
Artralgia
Bolesť chrbta
Zníženie rozsahu pohybu
kĺbov Stuhnutie šije Trizmus
|
Rabdomyolýza
|
P
oruchy
obličiek a močových ciest
|
|
Nefrolitiáza
Glykozúria
|
Zadržiavanie moču,
Močová inkontinencia
|
Stavy v gravidite, v
šestonedelí a perinatálnom
období
|
|
|
Neonatálny
abstinenčný syndróm
(pozri časť 4.6)
|
P
oruchy
reprodukčnéh o systému a prsníkov
|
Poruchy erekcie
|
Galaktorea
Gynekomastia Citlivosť prsníkov Vulvovaginálna suchosť
|
Priapizmus
|
C
elkové poruchy a
reakcie v mieste
podania
|
Bolesť v mieste
vpichu injekcie
Indurácia v mieste vpichu injekcie Únava
|
Pyrexia
Asténia
Poruchy chôdze Dyskomfort na hrudníku Reakcia v mieste vpichu injekcie
Erytém v mieste vpichu injekcie
Opuch v mieste vpichu
injekcie
Dyskomfort v mieste vpichu injekcie
Pruritus v mieste vpichu
injekcie
Smäd
Lenivosť
|
Porucha regulácie
teploty (napr. hypotermia, pyrexia)
Bolesť v hrudníku
Periférny edém
|
L
aboratórne
a funkčné
vyšetrenia
|
Zvýšenie
hladiny kreatínfosfokiná
zy v krvi
|
Zvýšenie glukózy v krvi
Pokles glukózy v krvi
Zvýšenie glykozylovaného hemoglobínu
Nárast obvodu pásu
Pokles cholesterolu v krvi
Pokles triglyceridov v krvi
|
Kolísanie glukózy v
krvi
|
O
pis vybraných nežiaducich reakcií
Reakcie v mieste vpichu injekcie
Počas dvojito zaslepených kontrolovaných fáz dvoch skúšaní boli pozorované reakcie v mieste vpichu injekcie. Väčšinou boli mierne až stredne závažné a časom ustúpili. Bolesť v mieste vpichu injekcie (výskyt 5,1 %) priemerne nastupuje na 2. deň po podaní injekcie a v priemere trvá 4 dni.
LeukopéniaNeutropénia bola hlásená v klinickom programe s liekom ABILIFY MAINTENA a väčšinou začína
okolo 16. dňa po prvej injekcii a trvá priemerne 18 dní.
Extrapyramídové symptómy (EPS)V skúšaniach u stabilných pacientov trpiacich schizofréniou bola liečba liekom ABILIFY MAINTENA spojená s vyššou frekvenciou výskytu príznakov EPS (18,4 %) ako pri liečbe perorálnym aripiprazolom. Akatízia bola najčastejšie pozorovaným príznakom (8,2 %) a väčšinou začína okolo 10. dňa po prvej injekcii a trvá priemerne 56 dní.
Jedinci s akatíziou väčšinou dostávali v rámci liečby anticholinergné lieky, hlavne benzatropín mesilát a trihexyfenidyl. Menej často boli podané liečivá ako propranolol a benzodiazepíny (klonazepam a diazepam) na liečbu akatízie.
Vo výskyte nasledoval parkinsonizmus (6,9 % ABILIFY MAINTENA, 4,15 % perorálny aripiprazol vo forme 10 – 30 mg tabliet a 3,0 % placebo).
DystóniaSkupinový účinok: príznaky dystónie, predĺžené abnormálne sťahy skupín svalov, sa môžu vyskytnúť u citlivých jednotlivcov počas prvých dní liečby. Dystonické symptómy zahŕňajú spazmus krčných svalov, niekedy rozvíjajúci sa do uzavretia hrdla, ťažkosti s prehĺtaním, ťažkosti s dýchaním a/alebo vystúpením jazyka. Zatiaľ čo tieto príznaky sa môžu vyskytnúť pri nízkych dávkach, vyskytujú sa častejšie a sú závažnejšie s vysokým potenciálom pri vyšších dávkach antipsychotík prvej generácie. Zvýšené riziko akútnej dystónie je pozorované u mužov a mladších vekových skupín.
Telesná hmotnosťPočas dvojito zaslepenej aktívne kontrolovanej fázy 38-týždňovej štúdie bol výskyt prírastku telesnej

hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 9,5 % pre skupinu , ktorej bol podávaný liek ABILIFY MAINTENA, a 11,7 % pre skupinu užívajúcu perorálne podávaný aripiprazol vo forme tabliet 10 – 30 mg. Výskyt poklesu telesnej hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 10,2 % pre skupinu užívajúcu liek ABILIFY MAINTENA a 4,5 % pre skupinu užívajúcu perorálne podávaný aripiprazol vo forme tabliet 10 – 30 mg.

Počas dvojito zaslepenej placebom kontrolovanej fázy 52-týždňového skúšania bol výskyt prírastku telesnej hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 6,4 % pre skupinu, ktorej bol podávaný liek ABILIFY MAINTENA, a 5,2 % pre skupinu užívajúcu placebo. Výskyt poklesu
telesnej hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 6,4 % pre skupinu, ktorej bol

podávaný liek ABILIFY MAINTENA, a 6,7 % pre skupinu užívajúcu placebo. Počas dvojito
zaslepenej liečby bola priemerná zmena telesnej hmotnosti z východiskovej hodnoty po poslednú
návštevu -0,2 kg pre liek ABILIFY MAINTENA a -0,4 kg pre placebo (P = 0,812).
ProlaktínPočas dvojito zaslepenej aktívne kontrolovanej fázy 38-týždňového skúšania sa vyskytol priemerný pokles hladiny prolaktínu z východiskovej hodnoty po poslednú návštevu pre skupinu, ktorej bol
podávaný liek ABILIFY MAINTENA (–0,33 ng/ml) v porovnaní s priemerným nárastom pre skupinu
užívajúcu perorálne podávaný aripiprazol vo forme tabliet 10 – 30 mg (0,79 ng/ml, p < 0,01). Výskyt u pacientov, ktorým bol podávaný liek ABILIFY MAINTENA s hladinami prolaktínu > 1-násobok hornej hranice normálneho rozsahu (ULN), bol pri akomkoľvek hodnotení 5,4 % v porovnaní s 3,5 % u pacientov užívajúcich perorálny aripiprazol vo forme tabliet 10 – 30 mg. U mužov bol výskyt vo všeobecnosti vyšší ako u žien v každej liečenej skupine.
Počas dvojito zaslepenej kontrolovanej fázy 52-týždňového skúšania sa vyskytol priemerný pokles hladiny prolaktínu z východiskovej hodnoty po poslednú návštevu pre skupinu, ktorej bol podávaný liek ABILIFY MAINTENA (–0,38 ng/ml), v porovnaní s priemerným nárastom pre skupinu, ktorej bolo podávané placebo (1,67 ng/ml). Výskyt u pacientov užívajúcich liek ABILIFY MAINTENA s hladinami prolaktínu > 1-násobok hornej hranice normálneho rozsahu (ULN) bol 1,9 % v porovnaní so 7,1 % u pacientov, ktorej bolo podávané placebo.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovaniePočas klinických štúdií s liekom ABILIFY MAINTENA neboli hlásené žiadne prípady predávkovania spojené s nežiaducimi reakciami. Je nutná opatrnosť, aby nedošlo k náhodnému vstreknutiu tohto lieku do cievy. Po každom potvrdenom alebo potenciálne náhodnom predávkovaní/neúmyselnom intravenóznom podaní je potrebné dôkladné sledovanie pacienta a ak sa vyskytnú potenciálne lekársky závažné znaky alebo príznaky, vyžaduje sa monitorovanie vrátane nepretržitého monitorovania EKG. Lekársky dohľad a monitorovanie majú pokračovať dovtedy, kým sa pacient nezotaví.
Simulácia náhleho uvoľnenia dávky preukázala, že predpokladané priemerné koncentrácie aripiprazolu dosiahnu najvyššiu hodnotu 4 500 ng/ml alebo približne 9-násobok horného terapeutického rozsahu. V prípade náhleho uvoľnenia dávky sa predpokladá, že koncentrácie aripiprazolu rýchlo poklesnú na hornú hranicu terapeutického okna približne po 3 dňoch. Na 7. deň priemerné koncentrácie aripiprazolu naďalej klesajú na úroveň koncentrácie po intramuskulárnej depotnej dávke bez náhleho uvoľnenia dávky. Predávkovanie je menej pravdepodobné pri parenterálnom podávaní ako pri perorálnom užívaní, a preto sú nižšie uvedené referenčné informácie pre predávkovanie perorálnym aripiprazolom.
Znaky a príznakyPočas klinických skúšaní a postmarketingového obdobia sa náhodné alebo úmyselné akútne predávkovanie samotným aripiprazolom vyskytlo u dospelých pacientov s hlásenými odhadovanými dávkami až do 1 260 mg (41-násobok najvyššej odporúčanej dennej dávky aripiprazolu) bez fatálnych následkov. Potenciálne medicínsky dôležité sledované znaky a príznaky zahŕňali letargiu, zvýšenie krvného tlaku, somnolenciu, tachykardiu, nauzeu, vracanie a hnačku. Ďalej sa získali aj správy náhodného predávkovania samotným perorálnym aripiprazolom (do 195 mg) u detí bez smrteľných prejavov. Medzi potenciálne medicínsky závažné znaky a príznaky patrila ospalosť, prechodná strata vedomia a extrapyramidové symptómy.
Liečba predávkovaniaLiečba predávkovania sa má zamerať na podpornú liečbu, udržiavanie voľných dýchacích ciest, okysličenie a ventiláciu, a na liečbu príznakov. Musí sa zvážiť možnosť pôsobenia ďalších liekov. Preto sa má okamžite začať monitorovanie kardiovaskulárneho systému vrátane priebežného elektrokardiografického monitorovania na odhalenie možných arytmií. Po akomkoľvek potvrdenom alebo podozrivom predávkovaní aripiprazolom má byť pacient dôkladne sledovaný lekárom a monitorovaný dovtedy, kým sa nezotaví.
HemodialýzaAj napriek tomu, že neexistujú žiadne informácie o účinku hemodialýzy v liečbe predávkovania, nie je pravdepodobné, že by hemodialýza bola užitočná v liečbe predávkovania, pretože sa aripiprazol vo veľkej miere viaže na plazmatické proteíny.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: psycholeptiká, ďalšie antipsychotiká, ATC kód: N05AX12
Mechanizmus účinkuPredpokladá sa, že účinnosť aripiprazolu pri schizofrénii sprostredkuje kombinácia čiastočného
agonizmu receptorov dopamínu D2a serotonínu 5-HT1A a antagonizmus receptorov serotonínu 5- HT2A. Aripiprazol vyvolal na zvieracích modeloch antagonistické vlastnosti dopaminergnej
hyperaktivity a agonistické vlastnosti dopaminergnej hypoaktivity. Aripiprazol vyvoláva vysokú
afinitu in vitro k receptorom dopamínu D2a D3, serotonínu 5-HT1A a 5HT2A a má miernu afinitu k receptorom dopamínu D4, serotonínu 5-HT2C a 5-HT7, alfa1-adrenergným receptorom a receptorom histamínu H1. Aripiprazol vyvolal aj miernu afinitu k miestam spätného vychytávania serotonínu a žiadnu významnú afinitu k cholinergným muskarínovým receptorom. Interakcia s receptormi iného podtypu ako dopamínových a serotonínových receptorov môže vysvetľovať niektoré z ďalších klinických účinkov aripiprazolu.
Perorálne dávky aripiprazolu v rozsahu od 0,5 do 30 mg podávané jedenkrát denne zdravým jedincom po dobu 2 týždňov vyvolali dávkovo závislú redukciu väzby 11C-raklopridu, ligandu D2/D3 receptora na caudatus a putamen zistenú pozitrónovou emisnou tomografiou.
Ďalšie informácie o klinickýchskúšaniach:Udržiavacia liečba schizofrénie u dospelých pacientovÚčinnosť lieku ABILIFY MAINTENA v udržiavacej liečbe pacientov trpiacich schizofréniou bola
stanovená v dvoch randomizovaných dvojito zaslepených skúšaniach.
Pivotné 38-týždňové, randomizované, dvojito zaslepené, aktívne kontrolované skúšanie bolo navrhnuté na stanovenie účinnosti, bezpečnosti a znášanlivosti tohto lieku podávaného vo forme injekcie raz mesačne v porovnaní s dávkou perorálneho aripiprazolu vo forme tabliet 10 – 30 mg raz denne ako udržiavacej terapie u dospelých pacientov trpiacich schizofréniou. Skúšanie pozostávalo zo skríningovej fázy a z 3 liečebných fáz: fázy konverzie, fázy perorálnej stabilizácie a dvojito zaslepenej aktívne kontrolovanej fázy.
Šesťstošesťdesiatdva pacientov prijatých do 38-týždňovej dvojito zaslepenej, aktívne kontrolovanej fázy bolo náhodne rozdelených v pomere 2 : 2 : 1 do dvojito zaslepenej liečby do jednej z 3 liečebných skupín: 1) ABILIFY MAINTENA 2) stabilizačná dávka perorálneho aripiprazolu 10 –
30 mg alebo 3) aripiprazol s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg. Aripiprazol s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg bol zahrnutý v skupine s nízkou dávkou aripiprazolu na účely testovania citlivosti analýzy pre non-inferiórny dizajn.
Výsledky analýzy primárneho výsledku účinnosti (odhadovaný podiel pacientov zažívajúcich príznaky
blížiaceho sa relapsu koncom 26. týždňa dvojito zaslepenej aktívne kontrolovanej fázy) preukázali, že
liek ABILIFY MAINTENA 400 mg/300 mg sa neodlišuje od perorálnych tabliet aripiprazolu 10 –
30 mg.
Odhadovaná frekvencia relapsu koncom 26. týždňa bola 7,12 % v skupine užívajúcej liek ABILIFY MAINTENA a 7,76 % v skupine užívajúcej perorálne tablety aripiprazolu 10 – 30 mg, t. j. rozdiel –
0,64 %. 95 % CI (–5,26, 3,99) pre rozdiel v odhadovanom podiele pacientov, u ktorých sa vyskytli príznaky blížiaceho sa relapsu koncom 26. týždňa, vylučuje vopred definovaný non-inferiórny okraj,
11,5 %. Liek ABILIFY MAINTENA sa preto neodlišuje od perorálnych tabliet aripiprazolu 10 –
30 mg.

Odhadovaný podiel pacientov, u ktorých sa vyskytli príznaky blížiaceho sa relapsu koncom 26. týždňa v skupine užívajúcej liek ABILIFY MAINTENA, bol 7,12 %, čo bolo štatisticky výrazne menej ako v skupine s aripiprazolom s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg (21,80 %,
p = 0,0006). Potvrdila sa preto nadradenosť lieku ABILIFY MAINTENA nad aripiprazolom s
Kaplan-Meierove krivky obdobia od randomizácie do príznakov blížiaceho sa relapsu v 38. týždni dvojito zaslepenej liečebnej fázy pre skupiny, ktorej bol podávaný liek ABILIFY MAINTENA, perorálny aripiprazol 10 – 30 mg a aripiprazol s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg sú zobrazené na obrázku 1.
 Obrázok 1 Kaplan-Meierov graf hranice lieku merajúci čas do zhoršenia psychotickýchpríznakov/príznakov blížiaceho sa relapsu
Obrázok 1 Kaplan-Meierov graf hranice lieku merajúci čas do zhoršenia psychotickýchpríznakov/príznakov blížiaceho sa relapsu




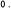
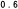
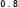







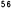


































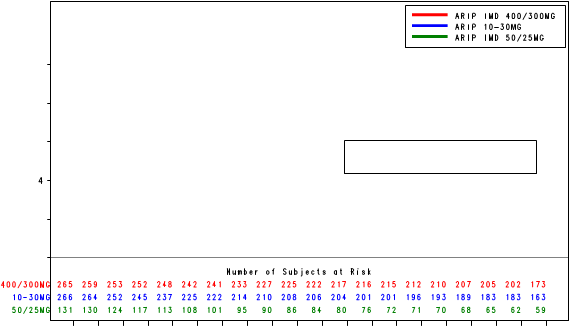

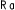

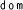
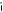




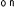
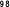

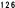

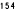
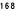




ARIP IMD 50 mg/25 mg
POZNÁMKA: ARIP IMD 400/300 mg = ABILIFY MAINTENA ARIP 10-30 mg = perorálny aripiprazol, ARIP IMD 50/25 mg =

s dlhotrvajúcim účinkom, injekčný
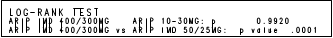
Non-inferioritu lieku ABILIFY MAINTENA v porovnaní s perorálnym aripiprazolom 10 – 30 mg podporujú výsledky analýzy stupnice pozitívneho a negatívneho syndrómu pre schizofréniu (PANSS).
Tabuľka 1 Celkové skóre PANSS – Zmena z východiskovej hodnoty po 38. týždeň-LOCF:Randomizovaná vzorka na stanovenie účinnosti a,bCelkové skóre PANSS – Zmena z východiskovej hodnoty po 38. týždeň-LOCF: Randomizovaná vzorka na stanovenie účinnosti a,b
|
| ABILIFY
MAINTENA
400 mg/300 mg
(n = 263)
| Perorálny
aripiprazol
10 – 30 mg/deň
(n = 266)
| Aripiprazol s dlhotrvajúcim
účinkom, injekčný roztok 50
mg/25 mg
(n = 131)
|
Stredná východisková
hodnota (SD)
| 57,9 (12,94)
| 56,6 (12,65)
| 56,1 (12,59)
|
Stredná zmena
(SD)
| –1,8 (10,49)
| 0,7 (11,60)
| 3,2 (14,45)
|
P-hodnota
| Neaplikovateľné
| 0,0272
| 0,0002
|
a: Negatívne zmeny skóre indikujú zlepšenie.
b: Zahrnutí boli iba pacienti s východiskovou hodnotou a s minimálne jednou hodnotou po východiskovej hodnote. P-hodnoty boli odvodené z porovnania pre zmenu východiskovej hodnoty v rámci analýzy kovariančného modelu s liečbou v čase a východiskovou hodnotou ako kovarianciou.
Druhé skúšanie bolo 52-týždňové randomizované dvojito zaslepené skúšanie stiahnutia lieku vykonané v Spojených štátoch u dospelých pacientov s aktuálnou diagnózou schizofrénie. Toto skúšanie pozostávalo zo skríningovej fázy a zo 4 liečebných fáz: konverzie, perorálnej stabilizácie, stabilizácie s liekom ABILIFY MAINTENA a dvojito zaslepenej placebom kontrolovanej fázy.
Pacienti spĺňajúci požiadavky na perorálnu stabilizáciu vo fáze perorálnej stabilizácie boli pridelení na
podávanie lieku ABILIFY MAINTENA jednostranne zaslepenou metódou a začali stabilizačnú fázu s liekom ABILIFY MAINTENA trvajúcu minimálne 12 týždňov a maximálne 36 týždňov. Pacienti prijatí do dvojito zaslepenej, placebom kontrolovanej fázy boli náhodne rozdelení v pomere 2 : 1 do dvojito zaslepenej liečby liekom ABILIFY MAINTENA alebo placebom.
Finálna analýza účinnosti obsahovala 403 randomizovaných pacientov a 80 zhoršení psychotických príznakov/príznakov blížiaceho sa relapsu. V skupine s placebom sa u 39,6 % pacientov prejavil blížiaci sa relaps, zatiaľčo v skupine s liekom ABILIFY MAINTENA sa blížiaci relaps vyskytol u 10
% pacientov. Pacienti v skupine s placebom mali preto 5,03-násobne vyššie riziko výskytu príznakov blížiaceho sa relapsu.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom ABILIFY MAINTENA vo všetkých podskupinách pediatrickej populácie pre schizofréniu (pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Absorpcia aripiprazolu do systémového obehu je po podaní lieku ABILIFY MAINTENA pomalá a
predĺžená z dôvodu nízkej rozpustnosti častíc aripiprazolu.
Priemerný polčas absorpcie lieku ABILIFY MAINTENA je 28 dní. Absorpcia aripiprazolu
z intramuskulárnej depotnej formulácie úplne zodpovedala intramuskulárnej štandardnej formulácii (s okamžitým uvoľňovaním). Hodnoty cmax po úprave dávky pre depotnú formuláciu boli približne 5 % cmax pri intramuskulárnej štandardnej formulácii.
Po podaní viacerých intramuskulárnych dávok sa koncentrácie aripiprazolu v plazme postupne zvýšia
a v stabilizovanom stave dosiahnu maximálnu plazmatickú koncentrácie pri mediáne Tmax 5 – 7 dní. Menej ako úmerne s dávkou sa zvyšuje koncentrácia aripiprazolu a dehydro-aripiprazolu a AUC parametre sú pozorované po injekcii lieku ABILIFY MAINTENA 300 mg až 400 mg podanej každý mesiac.
Distribúcia
Na základe výsledkov zo skúšaní s perorálne podávaným aripiprazolom sa aripiprazol distribuuje široko do celého tela so zjavným objemom distribúcie 4,9 l/kg, čo navodzuje rozsiahlu
extravaskulárnu distribúciu. Pri terapeutických koncentráciách sa aripiprazol a dehydro-aripiprazol vo viac ako 99 % viažu na sérové proteíny, pričom sa primárne viažu na albumín.
Biotransformácia
Aripiprazol sa v rozsiahlej miere metabolizuje v pečeni hlavne tromi biotransformačnými cestami:
dehydrogenáciou, hydroxyláciou a N-dealkyláciou. Na základe in-vitro štúdií sú enzýmy CYP3A4 a CYP2D6 zodpovedné za dehydrogenáciu a hydroxyláciu aripiprazolu a N-dealkylácia je katalyzovaná enzýmom CYP3A4. Aripiprazol tvorí hlavný podiel lieku v systémovom obehu. Po podaní viacnásobnej dávky lieku ABILIFY MAINTENA dehydro-aripiprazol, aktívny metabolit, predstavuje približne 29,1-32,5 % AUC aripiprazolu v plazme.
Eliminácia
Po podaní viacnásobnej dávky 400 mg alebo 300 mg lieku ABILIFY MAINTENA je stredný polčas terminálnej eliminácie aripiprazolu 46,5 dní alebo 29,9 dní, pravdepodobne z dôvodu kinetických vlastností obmedzených rýchlosťou absorpcie. Po jednotlivej perorálnej dávke aripiprazolu označeného [14C] bolo približne 27 % podanej rádioaktívnej látky zistenej v moči a približne 60 % v stolici. Menej ako 1 % nezmeneného aripiprazolu sa vylúčilo močom a približne 18 % sa vylúčilo v nezmenenej forme stolicou.
Farmakokinetika u špeciálnych skupín pacientov
Pacienti so známou zníženou metabolickou aktivitou CYP2D6
Na základe hodnotenia farmakokinetických vlastností ABILIFY MAINTENA u populácie bol celkový telesný klírens aripiprazolu 3,71 l/h u pacientov so známou nadmernou metabolickou aktivitou CYP2D6 a približne 1,88 l/h (približne o 50 % nižší) u pacientov so známou zníženou metabolickou aktivitou CYP2D6 (pre odporúčanie dávky pozri časť 4.2).
Staršie osoby
Po perorálnom podaní aripiprazolu sa nepreukázali žiadne rozdiely vo farmakokinetických vlastnostiach aripiprazolu medzi zdravými staršími osobami a mladšími dospelými osobami. Podobne
pri analýze farmakokinetických vlastností ABILIFY MAINTENA u populácie pacientov trpiacich
schizofréniou sa nevyskytol žiadny stanoviteľný účinok veku.
Pohlavie
Po perorálnom podaní aripiprazolu sa nepreukázali žiadne rozdiely vo farmakokinetických vlastnostiach aripiprazolu medzi zdravými mužmi a ženami. Podobne pri analýze farmakokinetických
vlastností lieku ABILIFY MAINTENA u populácie počas klinických štúdii u pacientov trpiacich
schizofréniou sa nevyskytol žiadny klinicky významný účinok pohlavia.
Fajčenie
Hodnotenie farmakokinetických vlastností populácie s perorálnym aripiprazolom nepreukázalo výskyt
žiadnych klinicky relevantných účinkov fajčenia na farmakokinetické vlastnosti aripiprazolu.
Rasa
Hodnotenie farmakokinetických vlastností populácie nepreukázalo výskyt žiadnych rozdielov spojených s rasou na farmakokinetické vlastnosti aripiprazolu.
Poruchafunkcieobličiek
V štúdii jednej dávky perorálne podávaného aripiprazolu boli farmakokinetické vlastnosti aripiprazolu a dehydro-aripiprazolu podobné u pacientov so závažnou poruchou funkcie obličiek ako u mladých
zdravých jedincov.
Poruchafunkciepečene
Štúdia jednej dávky perorálne podávaného aripiprazolu osobám s rôznymi stupňami cirhózy pečene
(Child-Pughove triedy A, B a C) neodhalila výrazný účinok poškodenej funkcie pečene na farmakokinetické vlastnosti aripiprazolu a dehydro-aripiprazolu, avšak štúdia zahŕňala iba 3 pacientov s cirhózou pečene triedy C, čo nie je dostatočné na odvodenie záverov o ich metabolickej kapacite.
5.3 Predklinické údaje o bezpečnosti
Toxikologický profil aripiprazolu podávaného testovaným zvieratám vo forme intramuskulárnej injekcie je všeobecne podobný profilu po perorálnom podaní pri porovnateľných plazmatických hladinách. Pri intramuskulárnej injekcii sa však v mieste vpichu objavila zápalová reakcia a pozostávala z granulomatózneho zápalu, ložísk (uložené liečivo), celulárnych infiltrátov, edému (opuch) a u opíc z fibrózy. Tieto účinky postupne vymizli spolu s ukončením dávkovania.
Predklinické údaje o bezpečnosti perorálne podávaného aripiprazolu získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
Perorálny aripiprazol
Pri perorálnom aripiprazole boli toxikologicky významné účinky pozorované iba pri dávkach alebo expozíciách, ktoré dostatočne presahovali maximálnu dávku u ľudí alebo expozíciu, čo naznačilo, že
tieto účinky boli obmedzené alebo nemali význam pre klinickú prax. Zahŕňa to: adrenokortikálnu
toxicitu u potkanov závislú na dávke po 104 týždňoch perorálneho podávania približne 3- až 10- násobku priemernej hodnoty AUC v stabilizovanom stave pri maximálnej odporúčanej dávke u ľudí a zväčšené adrenokortikálne karcinómy a kombinované adrenokortikálne adenómy/karcinómy u samíc potkanov pri približne 10-násobku priemernej hodnoty AUC v stabilizovanom stave pri maximálnej
odporúčanej dávke u ľudí. Najvyššia netumorogénna expozícia u samíc potkanov bola približne 7-
násobok expozície u ľudí pri odporúčanej dávke.
Doplňujúcim nálezom bola cholelitiáza ako následok precipitácie sulfátových konjugátov hydroximetabolitov aripiprazolu v žlči opíc po opakovanom perorálnom dávkovaní 25 až
125 mg/kg/deň alebo približne 16 až 81-násobok maximálnej odporúčanej dávky u ľudí na základe
mg/m2.
Koncentrácie sulfátových konjugátov hydroxy-aripiprazolu v ľudskej žlči v najvyššej navrhovanej
dávke 30 mg denne však netvorili viac ako 6 % koncentrácie v žlči stanovenej u opíc v 39. týždni štúdie a sú výrazne nižšie (6 %) ako hranice ich in-vitro rozpustnosti.
V štúdiách opakovanej dávky u mladých potkanov a psov bol profil toxicity aripiprazolu porovnateľný s profilom pozorovaným u dospelých zvierat a nevyskytol sa dôkaz neurotoxicity alebo nežiaducich účinkov na vývoj.
Na základe kompletného rozsahu štandardných testov genotoxicity sa aripiprazol nepokladá za
genotoxický. Aripiprazol v reprodukčných štúdiách toxicity nepoškodil fertilitu.
Toxicita vo vývoji vrátane oneskorenej osifikácie plodu závislej na dávke a možných teratogénnych
účinkov, bola pozorovaná u potkanov pri dávkach spôsobujúcich subterapeutické expozície (na základe AUC) a u králikov pri dávkach spôsobujúcich expozície približne 3- a 11-násobne vyššie ako priemerná hodnota AUC v stabilizovanom stave pri maximálnej odporúčanej klinickej dávke. Zistilo sa, že dávky podobné tým, ktoré vyvolali vývojovú toxicitu boli toxické aj pre matku.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok
Karmelóza sodná
Manitol
Monohydrát dihydrogénfosforečnanu sodného
Hydroxid sodný
Disperzné prostredie
Voda na injekciu
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
Po rekonštitúcii
Chemická a fyzikálna stabilita v stave pripravenom na použitie bola stanovená na 4 hodiny pri teplote do 25 °C. Z mikrobiologického hľadiska, pokiaľ spôsob otvárania/rekonštitúcie nevylučuje riziko
mikrobiálnej kontaminácie, produkt sa má okamžite použiť. Pokiaľ sa nepoužije okamžite, čas a
podmienky stability v stave pripravenom na použitie sú zodpovednosťou používateľa. Pred vstreknutím injekčnú liekovku minimálne 60 sekúnd riadne pretrepávajte, aby sa obsah rozpustil.
Rekonštituovanú suspenziu neuchovávajte v striekačke.
6.4 Špeciálne upozornenia na uchovávanie
Neuchovávajte v mrazničke.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
300 mg prášok:
Injekčná liekovka zo skla typu I s laminovanou gumovou zátkou a zapečatená odtrhávacím hliníkovým viečkom.
Disperzné prostredie:
2 ml injekčná liekovka zo skla typu I s laminovanou gumovou zátkou a zapečatená odtrhávacím hliníkovým viečkom.
Samostatné balenie
Každé samostatné balenie obsahuje jednu injekčnú liekovku s práškom, 2 ml injekčnú liekovku s disperzným prostredím, jednu 3 ml striekačku typu Luer lock s vopred nasadenou 38 mm (1,5 palca) hypodermickou bezpečnostnou ihlou veľkosti 21 G s ochrannou pomôckou na ihlu, jednu 3 ml jednorazovú striekačku s hrotom typu Luer lock, jeden adaptér na injekčnú liekovku, jednu 38 mm (1,5 palca) hypodermickú bezpečnostnú ihlu veľkosti 21 G s ochrannou pomôckou na ihlu a jednu
50 mm (2 palce) hypodermickú bezpečnostnú ihlu veľkosti 21 G s ochrannou pomôckou na ihlu
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
1. krok: Príprava pred rekonštitúciou prášku.
(a) Rozložte si jednotlivé komponenty a skontrolujte, či sú v balení:
- injekčná liekovka s práškom,
- injekčná liekovka s 2 ml disperzného prostredia,
- jedna 3 ml striekačka typu Luer lock s vopred nasadenou 38 mm (1,5 palca) hypodermickou
bezpečnostnou ihlou veľkosti 21 G s ochrannou pomôckou na ihlu,
- jedna 3 ml jednorazová striekačka s hrotom typu Luer lock,
- jeden adaptér na injekčnú liekovku,
- jedna 38 mm (1,5 palca) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu,
- jedna 50 mm (2 palca) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu.
(b) Prášok rozpustite pomocou disperzného prostredia dodávaného v obale.
(c) Zvoľte potrebné množstvo disperzného prostredia na rekonštitúciu.
300 mg injekčná liekovka: pridajte 1,5 ml disperzného prostredia na rekonštitúciu prášku
Dôležité: injekčná liekovka s disperzným prostredím obsahuje nadbytočné možstvo.
2. krok: Rekonštitúcia prášku
(a) Odstráňte viečka z injekčnej liekovky s disperzným prostredím a s práškom a vrchné časti utrite
sterilným alkoholovým tampónom.
(b) Pomocou striekačky s vopred nasadenou ihlou natiahnite vopred stanovený objem disperzného
prostredia z injekčnej liekovky s disperzným prostredím do striekačky (pozri obrázok 1). Malé množstvo zvyškového disperzného prostredia zostane po natiahnutí v injekčnej liekovke. Všetko nadbytočné množstvo zlikvidujte.
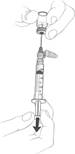
Obrázok 1
(c) Disperzné prostredie pomaly vstreknite do injekčnej liekovky s práškom (pozri obrázok 2).
Obrázok 2
(d) Natiahnite vzduch, aby ste vyrovnali tlak v liekovke jemným spätným potiahnutím piestu.
Následne ihlu odstráňte z liekovky. Metódou jednej ruky nasaďte ochrannú pomôcku na ihlu (pozri obrázok 3). Jemne potlačte puzdro proti plochému povrchu, pokiaľ ihla pevne nezapadne do ochranného puzdra na ihlu. Vizuálne overte, či ihla úplne zapadla do ochranného puzdra na ihlu a zlikvidujte ju.
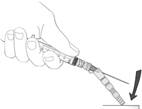
Obrázok 3
(e)
Injekčnúliekovkuriadne pretrepávajte podobu30sekúnd,kýmsuspenzianebudevyzeraťhomogénne(pozri obrázok 4).
Obrázok 4
(f) Pred podaním vizuálne skontrolujte, či rekonštituovaná suspenzia neobsahuje cudzie častice alebo či nezmenila farbu. Rekonštituovaný liek je biela až sivobiela tekutá suspenzia. Nepoužívajte, ak rekonštituovaná suspenzia obsahuje cudzie častice alebo zmenila farbu.
(g) Ak sa injekcia nepodá okamžite po rekonštitúcii, injekčnú liekovku uchovávajte pri teplote do
25 °C maximálne 4 hodiny a pred vstreknutím injekčnú liekovku minimálne 60 sekúnd riadne
pretrepávajte, aby sa obsah rozpustil.
(h) Rekonštituovanú suspenziu neuchovávajte v striekačke.
3. krok: Príprava pred podaním injekcie
(a) Odstráňte kryt, adaptér však nevyberajte z obalu (pozri obrázok 5).
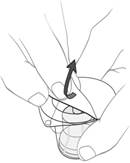
Obrázok 5
(b) Pomocou obalu na adaptér manipulujte s adaptérom na injekčnú liekovku a pripojte vopred
zabalenú striekačku typu Luer lock na adaptér na injekčnú liekovku (pozri obrázok 6).
Obrázok 6
(c) Pomocou striekačky typu Luer lock odstráňte adaptér na injekčnú liekovku z obalu a zlikvidujte
obal na adaptér (pozri obrázok 7).
Nikdy sa nedotýkajte hrotu adaptéra. Obrázok 7 (d) Určite odporúčaný objem na podanie injekcie.
Rekonštituovaný objem suspenzie ABILIFY MAINTENA určený na vstreknutie300 mg injekčná liekovka
|
Dávka
| Objem určený na
vstreknutie
|
---
| ---
|
300 mg
| 1,5 ml
|
200 mg
| 1,0 ml
|
160 mg
| 0,8 ml
|
(e) Vrchnú časť injekčnej liekovky s rekonštituovanou suspenziou utrite sterilným alkoholovým
tampónom.
(f) Umiestnite a podržte injekčnú liekovku s rekonštituovanou suspenziou na tvrdom povrchu.
Pripojte súpravu adaptéra a striekačky na injekčnú liekovku pridržaním vonkajšej časti adaptéra a pevným pritlačením hrotu adaptéra cez gumenú zátku, pokým adaptér nezapadne do správnej
polohy (pozri obrázok 8).
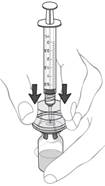
Obrázok 8
(g) Pomaly natiahnite odporúčaný objem z injekčnej liekovky do striekačky typu Luer lock, aby ste umožnili vstreknutie (pozri obrázok 9).
Malé množstvonadbytočnéholieku zostanevinjekčnejliekovke.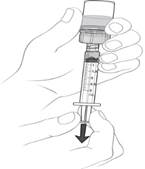
4. krok: Postup podania injekcie:
Obrázok 9
(a) Odpojte striekačku typu Luer lock obsahujúcu odporúčaný objem rekonštituovanej suspenzie
ABILIFY MAINTENA z injekčnej liekovky.
(b) Zvoľte jednu z nasledujúcich hypodermických bezpečnostných ihiel podľa telesnej hmotnosti pacienta a pripojte ihlu ku striekačke typu Luer lock obsahujúcu suspenziu na injekciu.
Stlačením a otočením v smere hodinových ručičiek overte, či ihla pevne drží v ochrannej
pomôcke na ihlu a následne odstráňte kryt z ihly (obrázok 10).
• 38 mm (1,5 palca) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu pre neobéznych pacientov.
• 50 mm (2 palce) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu pre obéznych pacientov.
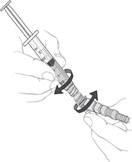
Obrázok 10
(c) Pomaly vstreknite odporúčaný objem ako jednu intramuskulárnu injekciu do sedacieho svalu.
Miesto vpichu injekcie nemasírujte. Je potrebná opatrnosť, aby nedošlo k náhodnému
vstreknutiu do cievy. Nevstrekujte do oblasti s príznakmi zápalu, poškodeniami pokožky, s
hrčami alebo s modrinami.
5. krok: Postup po podaní injekcie:(a) Nasaďte ochrannú pomôcku na ihlu tak, ako je opísané v 2. kroku (d). Po podaní injekcie
injekčné liekovky, adaptér, ihly a striekačku zlikvidujte.
Injekčné liekovky s práškom a s disperzným prostredím sú len na jednorazové použitie.
(b) Nezabudnite, že miesta vpichu injekcie je potrebné striedať medzi dvoma sedacími svalmi.
(c) Sledujte znaky a príznaky náhodného intravenózneho podania.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIOtsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Veľká Británia
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/13/882/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: {DD mesiac RRRR}
10. DÁTUM REVÍZIE TEXTU{DD mesiac RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
ABILIFY MAINTENA 400 mg prášok a disperzné prostredie na injekčnú suspenziu s predĺženým uvoľňovaním
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá injekčná liekovka obsahuje 400 mg aripiprazolu.
Po rekonštitúcii každý ml suspenzie obsahuje 200 mg aripiprazolu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Prášok a disperzné prostredie na injekčnú suspenziu s predĺženým uvoľňovaním
Prášok: biely až sivobiely
Disperzné prostredie: číry roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
ABILIFY MAINTENA je indikovaná na udržiavaciu liečbu schizofrénie u dospelých pacientov
stabilizovaných perorálnym podávaním aripiprazolu .
4.2 Dávkovanie a spôsob podávania
Dávkovanie
U pacientov, ktorí nikdy neužívali aripiprazol, sa má overiť pred začatím liečby liekom ABILIFY
MAINTENA znášanlivosť perorálne podávaného aripiprazolu.
Odporúčaná úvodná a udržiavacia dávka lieku ABILIFY MAINTENA je 400 mg.
Titrácia dávky tohto lieku nie je potrebná. Má sa podávať raz mesačne ako jedna injekcia (nie skôr ako
26 dní po predchádzajúcej injekcii).
Po prvej injekcii sa má pokračovať v liečbe perorálnym aripiprazolom 10 mg až 20 mg 14 po sebe
nasledujúcich dní na zachovanie terapeutickej koncentrácie aripiprazolu počas začatí liečby.
Ak sa pri dávkovaní 400 mg objavia nežiaduce účinky, má sa zvážiť zníženie dávky na 300 mg raz
mesačne.
Vynechané dávky
V
ynechané dávky
|
A
k došlo k vynechaniu 2. alebo
3. dávky a od poslednej injekcie uplynuli:
|
O
patrenie
|
> 4 týždne a < 5 týždňov
|
Injekcia sa má podať čo najskôr a následne obnoviť
mesačný plán podávania injekcií.
|
> 5 týždňov
|
Má sa podať ďalšia injekcia a súčasne obnoviť
užívanie perorálneho aripiprazolu po dobu 14 dní,
následne obnoviť mesačný plán podávania injekcií.
|
A
k došlo k vynechaniu 4.
.
alebo nasledovných dávok (t. j. po
dosiahnutí stabilizovaného stavu)
a od poslednej injekcie uplynuli:
|
O
patrenie
|
> 4 týždne a < 6 týždňov
|
Injekcia sa má podať čo najskôr a následne obnoviť
mesačný plán podávania injekcií.
|
> 6 týždňov
|
Má sa podať ďalšia injekcia a súčasne obnoviť
užívanie perorálneho aripiprazolu po dobu 14 dní,
následne obnoviť mesačný plán podávania injekcií.
|
Špeciálne populácie
Starší pacienti
Bezpečnosť a účinnosť lieku ABILIFY MAINTENA pri liečbe schizofrénie u pacientov vo veku
65 rokov a starších nebola stanovená (pozri časť 4.4).
Porucha funkcie obličiekU pacientov s poruchou funkcie obličiek nie je potrebná úprava dávkovania (pozri časť 5.2).
Porucha funkcie pečeneU pacientov s miernou alebo stredne závažnou poruchou funkcie pečene nie je potrebná úprava dávkovania. U pacientov s ťažkou poruchou funkcie pečene dostupné údaje nie sú dostatočné na stanovenie odporúčania. U týchto pacientov vyžadujúcich opatrnosť pri dávkovaní sa má uprednostniť perorálne podávanie (pozri časť 5.2).
Pacienti so známou zníženou metabolickou aktivitou CYP2D6U pacientov, u ktorých je známa znížená metabolická aktivita CYP2D6, má byť úvodná a udržiavacia
dávka 300 mg. Pri súbežnom používaní so silnými inhibítormi CYP3A4 sa má dávka znížiť na 200 mg
(pozri časť 4.5).
Úprava dávkovania pri interakciáchÚprava dávky je potrebná u pacientov, ktorí súbežne užívajú silné inhibítory CYP3A4 alebo silné inhibítory CYP2D6 dlhšie ako 14 dní. Ak sa skončí užívanie inhibítoru CYP3A4 alebo inhibítoru
CYP2D6, môže byť potrebné zvýšiť dávkovanie na predchádzajúcu dávku (pozri časť 4.5). V prípade
výskytu nežiaducich reakcií aj po úprave dávkovania lieku ABILIFY MAINTENA je potrebné
opätovne zvážiť potrebu súbežného podávania inhibítora CYP2D6 alebo CYP3A4.
Súbežnému používaniu induktorov CYP3A4 s liekom ABILIFY MAINTENA dlhšie ako 14 dní sa má vyvarovať, pretože hladiny aripiprazolu v krvi sú znížené a môžu sa nachádzať pod hladinou účinnosti (pozri časť 4.5).
Ú
prava dávky lieku ABILIFY MAINTENA u pacientov, ktorí súbežne užívajú silné inhibítory
CY
P
2D6, silné inhibítory CYP3A4 a/alebo induktory CYP3A4 dlhšie ako 14 dní
|
U
pravená dávka
|
P
acienti užívajúci 400 mg lieku ABILIFY MAINTENA
|
Silné inhibítory CYP2D6 alebo CYP3A4
|
300 mg
|
Silné inhibítory CYP2D6 a CYP3A4
|
200 mg
|
Induktor CYP3A4
|
Vyvarujte sa použitiu
|
P
acienti užívajúci 300 mg lieku ABILIFY MAINTENA
|
Silné inhibítory CYP2D6 alebo CYP3A4
|
200 mg
|
Silné inhibítory CYP2D6 a CYP3A4
|
160 mg
|
Induktor CYP3A4
|
Vyvarujte sa použitiu
|
Pediatrická populácia
Bezpečnosť a účinnosť lieku ABILIFY MAINTENA u detí a dospievajúcich vo veku 0 – 17 rokov nebola stanovená. K dispozícii nie sú žiadne údaje.
Spôsob podávaniaLiek ABILIFY MAINTENA je určený len na intramuskulárne použitie a nesmie sa podávať
intravenózne ani subkutánne. Má ho podať iba zdravotnícky profesionál. Suspenzia sa má podať
okamžite po rekonštitúcii možno ju však uchovávať pri teplote do 25 °C maximálne 4 hodiny v injekčnej liekovke. Suspenzia sa má vstreknúť pomaly ako jednorazová injekcia (dávky sa nesmú rozdeliť) do sedacieho svalu. Je potrebné dávať pozor, aby nedošlo k náhodnému vstreknutiu do cievy. Miesto vpichu injekcie sa má striedať medzi dvoma sedacími svalmi.
Odporúčaná ihla na podanie je hypodermická bezpečnostná ihla veľkosti 38 mm (1,5 palca), 21 G. U obéznych pacientov (index telesnej hmotnosti > 28 kg/m2) sa má použiť hypodermická bezpečnostná ihla veľkosti 50 mm (2 palce), 21 G (pozri časť 6.6).
Injekčné liekovky na prášok a disperzné prostredie sú určené len na jednorazové použitie.
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníPočas liečby antipsychotikami sa môže zlepšenie klinického stavu pacienta prejaviť po niekoľkých dňoch až niekoľkých týždňoch. Počas celého tohto obdobia majú byť pacienti starostlivo monitorovaní.
SamovraždaPri psychických ochoreniach je výskyt samovražedného správania sprievodným javom a v niektorých
prípadoch bolo hlásené krátko po začatí alebo zmene antipsychotickej liečby, vrátane liečby aripiprazolom (pozri časť 4.8). Dôkladné sledovanie vysoko rizikových pacientov má byť súčasťou antipsychotickej liečby.
Kardiovaskulárne poruchyLiek ABILIFY MAINTENA sa má opatrne používať u pacientov so známou kardiovaskulárnou chorobou (anamnéza infarktu myokardu alebo ischemickej choroby srdca, srdcového zlyhania alebo odchýlok vedenia), s cerebrovaskulárnym ochorením, so stavmi, ktoré spôsobujú u pacientov hypotenziu (dehydratácia, hypovolémia a antihypertenzivna liečba) alebo hypertenziou, vrátane akcelerovanej alebo malígnej.
Boli hlásené prípady žilovej trombembólie pri užívaní antipsychotík. Pretože pacienti liečení antipsychotikami často získajú rizikové faktory pre žilovú trombembóliu, všetky možné rizikové faktory pre žilovú trombembóliu majú byť určené pred a počas liečby liekom ABILIFY MAINTENA a majú sa vykonať preventívne opatrenia. (pozri časť 4.8).
PredĺženieintervaluQT
V klinických štúdiách liečby perorálnym aripiprazolom bol výskyt predĺženia QT intervalu porovnateľný ako u placeba. Aripiprazol sa má používať opatrne u pacientov s predĺžením QT
intervalu v rodinnej anamnéze (pozri časť 4.8).
Tardívna dyskinéza
V jednoročných alebo v kratších klinických štúdiách boli počas liečby aripiprazolom hlásené
zriedkavé prípady akútnej dyskinézy. Hneď ako sa u pacienta užívajúceho liek ABILIFY MAINTENA objavia znaky a príznaky tardívnej dyskinézy, má sa zvážiť zníženie dávky alebo prerušenie liečby (pozri časť 4.8). Tieto príznaky sa môžu postupom času zhoršovať, alebo môžu vzniknúť dokonca aj
po prerušení liečby.
Neuroleptický malígny syndróm (NMS)
NMS je potenciálne fatálny komplex symptómov súvisiaci s podávaním antipsychotík. V klinických skúšaniach boli počas liečby aripiprazolom hlásené zriedkavé prípady NMS. Klinickými prejavmi
NMS sú hyperpyrexia, svalová stuhnutosť, zmenený duševný stav a dokázateľná nestabilita
autonómneho nervového systému (nepravidelný pulz alebo krvný tlak, tachykardia, diaforéza a
srdcová arytmia). Medzi ďalšie znaky môžu patriť zvýšená hladina kreatínfosfokinázy, myoglobinúria
(rabdomyolýza) a akútne renálne zlyhanie.
Vyskytla sa však aj zvýšená hladina kreatínfosfokinázy a rabdomyolýzy, ktorá nemusí byť nevyhnutne spojená s NMS. Ak u pacientov vyvinú znaky a príznaky svedčiace o NMS, alebo budú mať nevysvetliteľnú vysokú horúčku bez ďalších klinických prejavov NMS, užívanie všetkých antipsychotík vrátane aripiprazolu sa musí ukončiť (pozri časť 4.8).
Záchvat
V klinických štúdiách boli počas liečby aripiprazolom hlásené menej časté prípady záchvatov. Aripiprazol sa preto má podávať opatrne u pacientov, ktorí majú epilepsiu v anamnéze, alebo ktorí majú stavy súvisiace so záchvatmi (pozri časť 4.8).
Starší pacienti s psychózou súvisiacou s demenciou
Zvýšená mortalita
V troch placebom kontrolovaných štúdiách perorálneho aripiprazolu u starších pacientov trpiacich psychózami spojenými s Alzheimerovou chorobou (n = 938, priemerný vek: 82,4 rokov, rozsah: 56 –
99 rokov) bolo u pacientov liečených aripiprazolom, v porovnaní s placebom, zvýšené riziko úmrtia.
Frekvencia úmrtí u pacientov liečených perorálnym aripiprazolom bola 3,5 % v porovnaní s 1,7 %
pacientov v skupine s placebom. Príčiny úmrtí boli síce rôzne, väčšina z nich však bola kardiovaskulárneho (napr. zlyhanie srdca, náhla smrť) alebo infekčného (napr. pneumónia) charakteru (pozri časť 4.8).
Cerebrovaskulárne nežiaduce reakcie
Pri rovnakých štúdiách perorálneho aripiprazolu boli u pacientov hlásené cerebrovaskulárne nežiaduce
reakcie (napr. mŕtvica, prechodný ischemický záchvat), vrátane fatálnych prípadov (priemerný vek:
84 rokov, rozsah: 78-88 rokov). Celkovo boli u 1,3 % z pacientov liečených perorálnym aripiprazolom
hlásené cerebrovaskulárne nežiaduce reakcie v porovnaní s 0,6 % pacientov liečených v rámci týchto štúdií placebom. Tento rozdiel nebol štatisticky významný. V jednej z týchto štúdií, v štúdií s fixnou dávkou, sa však vyskytol výrazný vzťah medzi dávkou a cerebrovaskulárnymi nežiaducimi reakciami u pacientov liečených aripiprazolom (pozri časť 4.8).
Liek ABILIFY MAINTENA nie je určený na liečbu pacientov s psychózou spojenou s demenciou.
H
y
perglykémia a diabetes mellitus
U pacientov, liečených atypickými antipsychotikami zahŕňajúcimi aripiprazol, bola hlásená hyperglykémia, ktorá bola v niektorých prípadoch mimoriadna a spojená s ketoacidózou alebo hyperosmolárnou kómou alebo smrťou. Medzi rizikové faktory, ktoré môžu u pacientov viesť k vážnym komplikáciam, patrí obezita a rodinná anamnéza diabetu. V klinických skúšaniach aripiprazolu neboli významné rozdiely v stupni výskytu s hyperglykémiou súvisiacimi nežiaduci reakciami (zahŕňajúcimi diabetes) alebo v abnormálnych laboratórnych hodnotách glykémie v porovnaní s placebom. Presné odhady rizika výskytu nežiaducich reakcií spojených s hyperglykémiou u pacientov liečených aripiprazolom a inými atypickými antipsychotikami nie sú dostupné, aby sa umožnili priame porovnania. Pacienti liečení ktorýmkoľvek antipsychotikom vrátame aripiprazolu majú byť sledovaní kvôli znakom a príznakom hyperglykémie (napr. polydipsia, polyúria, polyfágia a slabosť) a pacienti s diabetes mellitus alebo s rizikovými faktormi pre diabetes mellitus majú byť pravidelne sledovaní kvôli zhoršeniu glykémie (pozri časť 4.8).
Hypersenzitivita
Pri aripiprazole sa môžu vyskytnúť hypersenzitívne reakcie charakterizované alergickými príznakmi.
Prírastok telesnej hmotnosti
K prírastku telesnej hmotnosti často dochádza u schizofrenických pacientov z dôvodu používania antipsychotík, u ktorých je známe, že spôsobujú prírastok telesnej hmotnosti, z dôvodu sprievodných ochorení, zlého životného štýlu a môže viesť k závažným komplikáciám. Prírastok telesnej hmotnosti bol hlásený postmarketingovo u pacientov, ktorým bol predpísaný perorálny aripiprazol. Zvyčajne je pozorovaný u pacientov s významnými rizikovými faktormi, ako je anamnéza diabetu, porucha štítnej žľazy alebo adenóm hypofýzy. V klinických štúdiách aripiprazolu sa nepreukázalo, že by spôsoboval klinicky významný prírastok telesnej hmotnosti (pozri časť 4.8).
Dysfágia
Ezofageálna dysmotilita a aspirácia súvisia s používaním antipsychotík vrátane aripiprazolu.
Aripiprazol sa má používať opatrne u pacientov s rizikom aspiračnej pneumónie.
Patologickéhráčstvo
Postmarketingové hlásenia patologického hráčstva boli hlásené u pacientov, ktorým bol predpísaný perorálny aripiprazol, bez ohľadu na to, či majú títo pacienti patologické hráčstvo v predošlej
anamnéze. Pacienti s patologickým hráčstvom v predošlej anamnéze môžu mať zvýšené riziko a majú
byť starostlivo monitorovaní (pozri časť 4.8).
4.5 Liekové a iné interakcie
S liekom ABILIFY MAINTENA sa neuskutočnili žiadne špecifické interakčné štúdie. Informácie
uvedené nižšie boli získané zo štúdií s perorálnym aripiprazolom.
Z dôvodu jeho antagonizmu voči α1-adrenergnému receptoru má aripiprazol potenciál zlepšovať účinok určitých liekov proti hypertenzii.
Zohľadňujúc primárne účinky aripiprazolu na CNS je potrebná opatrnosť pri podávaní aripiprazolu v kombinácií s alkoholom alebo inými liekmi na CNS , pretože môže dôjsť k prekrývajúcim sa nežiaducim reakciám, ako napríklad sedácia (pozri časť 4.8).
Aripiprazol sa má opatrne používať, ak sa podáva súbežne s liekmi, u ktorých je známe, že zapríčiňujú
QT predĺženie alebo elektrolytovú nerovnováhu
Možnýúčinokinýchliekovovplyvniť ABILIFY MAINTENA
Aripiprazol je metabolizovaný mnohopočetnými cestami zahŕňajúcimi enzýmy CYP2D6 a CYP3A4,
ale nie enzýmy CYP1A. Preto nie je potrebná žiadna úprava dávkovania u fajčiarov.
Chinidín a ďalšie silné inhibítory CYP2D6
V klinickom skúšaní perorálneho aripiprazolu u zdravých jedincov silný inhibítor CYP2D6 (chinidín)
aripiprazolu, aktívneho metabolitu, sa znížila o 32 % a jeho Cmax o 47 %. U ďalších silných inhibítorov
CYP2D6, ako napríklad fluoxetínu a paroxetínu, sa môžu očakávať podobné účinky a je preto
potrebné podobné zníženie dávky (pozri časť 4.2).
Ketokonazol a ďalšie silné inhibítory CYP3A4
V klinickom skúšaní perorálneho aripiprazolu u zdravých jedincov silný inhibítor CYP3A4 (ketokonazol) zvýšil hodnotu AUC aripiprazolu o 63 % a hodnotu Cmax o 37 %. Hodnota AUC dehydro-aripiprazolu sa zvýšila o 77 % a jeho hodnota Cmax o 43 %. U pacientov so zníženou metabolickou aktivitou CYP2D6 môže súbežné používanie silných inhibítorov CYP3A4 spôsobiť vyššie koncentrácie aripiprazolu v plazme v porovnaní s pacientmi s nadmernou metabolickou aktivitou CYP2D6 (pozri časť 4.2).
Pri zvažovaní súbežného podávania ketokonazolu alebo ďalších silných inhibítorov CYP3A4 s aripiprazolom majú potenciálne prínosy prevážiť možné riziká pre pacienta. U ďalších silných inhibítorov CYP3A4, ako napríklad itrakonazol a inhibítory HIV proteázy sa môžu očakávať podobné účinky a preto je potrebné podobné zníženie dávky (pozri časť 4.2).
Po ukončení užívania inhibítora CYP2D6 alebo CYP3A4 sa má dávka lieku ABILIFY MAINTENA zvýšiť na dávku pred začatím súbežnej liečby. Ak sa spolu s týmto liekom súbežne používajú slabé inhibítory CYP3A4 (napr. diltiazem) alebo CYP2D6 (napr. escitalopram), je možné očakávať mierny nárast koncentrácií aripiprazolu v plazme.
Karbamazepín a ďalšie induktory CYP3A4
Po súbežnom podávaní karbamazepínu, silného induktora CYP3A4 a perorálneho aripiprazolu pacientom trpiacich schizofréniou alebo schizoaktívnym ochorením boli geometrické priemery
hodnoty Cmax pre aripiprazol o 68 % nižšie a hodnoty AUC pre aripiprazol o 73 % nižšie v porovnaní s perorálnym podávaním samotného aripiprazolu (30 mg). Podobne u dehydro-aripiprazolu boli geometrické priemery hodnoty Cmax po súbežnom podaní karbamazepínu nižšie o 69 % a hodnoty
AUC o 71 % nižšie ako tie po samostatnej liečbe perorálnym aripiprazolom.
Súbežné podávanie lieku ABILIFY MAINTENA a ďalších induktorov CYP3A4 (ako napríklad rifampicínu, rifabutínu, fenytoínu, fenobarbitalu, primidonu, efavirenzu, nevirapínu a ľubovníka bodkovaného) môže mať podobné účinky. Súbežnému používaniu induktorov CYP3A4 s liekom ABILIFY MAINTENA by sa malo vyvarovať, pretože hladiny aripiprazolu v krvi sú znížené a môžu sa nachádzať pod účinnou hranicou.
Valproát a lítium
Pri súbežnom podávaní valproátu alebo lítia s aripiprazolom nedošlo k žiadnej klinicky významnej zmene v koncentrácii aripiprazolu, a preto nie je potrebná žiadna úprava dávky pri podávaní valproátu
alebo lítia spolu s liekom ABILIFY MAINTENA.
Potenciál lieku ABILIFY MAINTENA ovplyvniť iné lieky
V klinických štúdiách perorálne dávky 10 – 30 mg/deň aripiprazolu nemali výrazný vplyv na
metabolizmus substrátov CYP2D6 (pomer dextrometorfanu/3-metoxymorfinanu), 2C9 (warfarín),
2C19 (omeprazol) a 3A4 (dextrometorfan). Aripiprazol a dehydro-aripiprazol okrem toho nepreukázali potenciál pre zmenu metabolizmu sprostredkovaného CYP1A2 in vitro. ABILIFY MAINTENA preto pravdepodobne nespôsobí klinicky významné liekové interakcie sprostredkované týmito enzýmami.
Pri súbežnom podávaní aripiprazolu a lamotrigínu, dextrometorfanu, warfarínu, omeprazolu, escitalopramu alebo venlafaxínu nedošlo k žiadnej klinicky významnej zmene v koncentráciách týchto liekov. Pri súbežnom podávaní týchto liekov s liekom ABILIFY MAINTENA preto nie je potrebná žiadna úprava dávkovania
Serotonínový syndróm
Prípady serotonínového syndrómu boli hlásené u pacientov užívajúcich aripiprazol a možné znaky a
príznaky tohto stavu sa môžu vyskytnúť hlavne v prípadoch súbežného používania s inými serotonergnými liekmi, ako napríklad SSRI/SNRI alebo s liekmi, u ktorých je známe, že zvyšujú koncentrácie aripiprazolu (pozri časť 4.8).
4.6 Fertilita, gravidita a laktácia
G
r
avidita
Nie sú k dispozícii dostatočné a dobre kontrolované štúdie aripiprazolu u gravidných žien. Boli
hlásené vrodené anomálie, no príčinná súvislosť s aripirazolom nebola stanovená. Štúdie na zvieratách nemohli vylúčiť možnosť vývojovej toxicity (pozri časť 5.3). Pacientky majú byť poučené, aby svojmu lekárovi oznámili, ak otehotnejú alebo ak plánujú otehotnieť počas liečby liekom ABILIFY MAINTENA. Vzhľadom na nedostatočné informácie o bezpečnosti u ľudí a obavám vyvolaných reprodukčnými štúdiami na zvieratách sa tento liek nemá podávať počas gravidity, pokiaľ očakávaný prínos liečby zreteľne neprevýši potenciálne riziko pre plod.
Lekári si musia byť vedomí dlhotrvajúcich vlastností lieku ABILIFY MAINTENA.
Novorodenci vystavení antipsychotikám (vrátane aripiprazolu) v treťom trimestri tehotenstva sú vystavení riziku výskytu nežiaducich reakcií vrátane extrapyramídových a/alebo abstinenčných príznakov, ktoré sa môžu líšiť závažnosťou a trvaním po pôrode. Boli hlásené prípady agitovanosti, hypertónie, hypotónie, trasu, ospalosti, dýchacích ťažkostí alebo porúch kŕmenia. V dôsledku toho majú byť novorodenci starostlivo sledovaní.(pozri časť 4.8).
Laktácia
Aripiprazol sa vylučuje do materského mlieka. Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu liekom ABILIFY MAINTENA sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Na základe údajov zo štúdií reprodukčnej toxicity aripiprazol nemal negatívny vplyv na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek ABILIFY MAINTENA má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje z dôvodu možného účinku na nervový systém a zrak, ako je napríklad sedácia, somnolencia, synkopa, rozmazané videnie (pozri časť 4.8). Pacientom sa má odporučiť, aby neviedli vozidlá ani neobsluhovali stroje, pokiaľ nie je známa ich individuálna citlivosť na tento liek.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie pozorované nežiaduce účinky lieku (ADR) hlásené u ≥ 5 % pacientov v dvoch dvojito
zaslepených kontrolovaných klinických skúšaniach s liekom ABILIFY MAINTENA boli prírastok telesnej hmotnosti (9,0 %), akatízia (7,9 %), insomnia (5,8 %) a bolesť v mieste vpichu injekcie
(5,1 %).
Tabuľkový zoznam nežiaducich reakcií
Výskyt nežiaducich účinkov lieku (ADR) spojených s liečbou aripiprazolom je uvedený v tabuľke
nižšie. Tabuľka vychádza z nežiaducich udalostí hlásených počas klinických skúšaní a/alebo po
uvedení na trh.
Všetky nežiaduce účinky lieku sú zoradené podľa triedy orgánových systémov a frekvencie: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až
< 1/1 000), veľmi zriedkavé ((< 1/10 000) a neznáme (z dostupných údajov). Pri každej frekvencii
výskytu sú nežiaduce reakcie zoradené podľa klesajúcej závažnosti.
Frekvenciu výskytu nežiaducich reakcií hlásených po uvedení na trh nie je možné určiť, pretože pochádzajú zo spontánnych hlásení. Frekvencia výskytu týchto nežiaducich udalostí je následne klasifikovaná ako „neznáma“.
| Časté
| Menej časté
| Neznáme
|
Poruchy krvi a
lymfatického systému
|
| Neutropénia
Anémia
Trombocytopénia
Pokles počtu neutrofilov
Pokles počtu bielych
krviniek
| Leukopénia
|
Poruchy
imunitného systému
|
| Hypersenzitivita
| Alergická reakcia
(napr. anafylaktická reakcia, angioedém vrátane napuchnutého jazyka, edému jazyka, edému tváre, vyrážky alebo urtikárie)
|
Poruchy endokrinného
systému
|
| Pokles hladiny prolaktínu v
krvi
| Diabetická
hyperosmolárna kóma
Diabetická ketoacidóza
|
Poruchy metabolizmu a výživy
| Nárast telesnej
hmotnosti
Diabetes mellitus
Zníženie
telesnej hmotnosti
| Hyperglykémia
Hypercholesterolémia
Hyperinzulinémia
Hyperlipidémia Hypertriglyceridémia Porucha chuti do jedla
| Anorexia
Hyponatriémia
|
Psychické poruchy
| Agitovanosť
Úzkosť
Nepokoj
Insomnia
| Samovražedné predstavy
Psychické poruchy
Halucinácie Klamné predstavy Hypersexualita Panické reakcie Depresia Afektívna labilita Apatia
Dysfória Poruchy spánku Bruxizmus Znížené libido Zmena nálady
| Dokončená
samovražda
Pokus o samovraždu Patologické hráčstvo Nervozita
|
Poruchy nervového
systému
| Extrapyramídov
á porucha
Akatízia Tremor Dyskinéza Sedácia Somnolencia Závrat
Bolesť hlavy
| Dystónia
Tardívna dyskinéza
Parkinsonizmus Porucha pohybu Psychomotorická hyperaktivita
Syndróm nepokojných nôh
Rigidita (fenomén ozubeného kolesa)
Hypertónia
Bradykinéza
| Malígny neuroleptický
syndróm
Záchvat typu grand mal, serotonínový syndróm
Poruchy reči
|
|
Č
asté
|
Menej časté
|
N
eznáme
|
|
|
Slintanie
Porucha chuti
Porucha čuchu
|
|
P
oruchy oka
|
|
Okulogyrická kríza
Rozmazané videnie
Bolesť oka
|
|
P
oruchy srdca a
srdcovej
činnosti
|
|
Ventrikulárne extrasystoly
Bradykardia
Tachykardia
Pokles amplitúdy T-vlny na elektrokardiograme
Elektrokardiogram mimo
normy
Inverzia T-vlny na elektrokardiograme
|
Náhla nevysvetliteľná
smrť
Zástava srdca Torsades de pointes Ventrikulárne arytmie, Predĺženie intervalu QT
|
P
oruchy ciev
|
|
Hypertenzia
Ortostatická hypotenzia
Zvýšenie krvného tlaku
|
Synkopa
Venózna tromboembólia
(vrátane pľúcnej
embólie a trombózy hlbokých žíl)
|
P
oruchy
dýchacej sústavy, hrudníka a mediastína
|
|
Kašeľ
|
Orofaryngeálny
spazmus Laryngospazmus Aspiračná pneumónia
|
P
oruchy gastrointestin álneho traktu
|
Sucho v ústach
|
Gastroezofágová refluxná
choroba
Dyspepsia
Vracanie Hnačka Nauzea
Bolesť v hornej časti brušnej
dutiny
Abdominálne ťažkosti
Zápcha
Častá stolica
Hypersekrécia slín
|
Pankreatitída
Dysfágia
|
P
oruchy pečene a žlčových ciest
|
|
Testy funkcie pečene mimo
normy
Zvýšenie hladiny
pečeňových enzýmov Zvýšenie hladiny alanínaminotransferázy Zvýšenie hladiny gamaglutamyltransferázy Zvýšenie hladiny bilirubínu v krvi
Zvýšenie hladiny aspartátaminotransferázy
|
Zlyhanie pečene
Žltačka
Hepatitída
Zvýšenie hladiny alkalickej fosfatázy
|
P
oruchy kože a podkožného
t
kaniva
|
|
Alopécia
Akné
Ružovka Ekzém Indurácia kože
|
Vyrážka
Fotosenzitívna reakcia
Hyperhidróza
|
|
Č
asté
|
Menej časté
|
N
eznáme
|
P
oruchy
kostrovej a svalovej sústavy a spojivového tkaniva
|
Muskuloskeletál
na stuhnutosť
|
Rigidita svalov
Svalové spazmy Svalové zášklby Napätie svalov Myalgia
Bolesti končatín
Artralgia
Bolesť chrbta
Zníženie rozsahu pohybu
kĺbov Stuhnutie šije Trizmus
|
Rabdomyolýza
|
P
oruchy
obličiek a močových ciest
|
|
Nefrolitiáza
Glykozúria
|
Zadržiavanie moču,
Močová inkontinencia
|
Stavy v gravidite, v
šestonedelí a perinatálnom
období
|
|
|
Neonatálny
abstinenčný syndróm
(pozri časť 4.6)
|
P
oruchy
reprodukčnéh o systému a prsníkov
|
Poruchy erekcie
|
Galaktorea
Gynekomastia Citlivosť prsníkov Vulvovaginálna suchosť
|
Priapizmus
|
C
elkové poruchy a
reakcie v mieste
podania
|
Bolesť v mieste
vpichu injekcie
Indurácia v mieste vpichu injekcie
Únava
|
Pyrexia
Asténia
Poruchy chôdze Dyskomfort na hrudníku Reakcia v mieste vpichu injekcie
Erytém v mieste vpichu injekcie
Opuch v mieste vpichu
injekcie
Dyskomfort v mieste vpichu injekcie
Pruritus v mieste vpichu
injekcie
Smäd
Lenivosť
|
Porucha regulácie
teploty (napr. hypotermia, pyrexia)
Bolesť v hrudníku
Periférny edém
|
L
aboratórne
a funkčné
vyšetrenia
|
Zvýšenie
hladiny kreatínfosfokiná
zy v krvi
|
Zvýšenie glukózy v krvi
Pokles glukózy v krvi
Zvýšenie glykozylovaného hemoglobínu
Nárast obvodu pásu
Pokles cholesterolu v krvi
Pokles triglyceridov v krvi
|
Kolísanie glukózy v
krvi
|
O
pis vybraných nežiaducich reakcií
Reakcie v mieste vpichu injekcie
Počas dvojito zaslepených kontrolovaných fáz dvoch skúšaní boli pozorované reakcie v mieste vpichu injekcie. Väčšinou boli mierne až stredne závažné a časom ustúpili. Bolesť v mieste vpichu injekcie (výskyt 5,1 %) priemerne nastupuje na 2. deň po podaní injekcie a v priemere trvá 4 dni.
LeukopéniaNeutropénia bola hlásená v klinickom programe s liekom ABILIFY MAINTENA a väčšinou začína
okolo 16. dňa po prvej injekcii a trvá priemerne 18 dní.
Extrapyramídové symptómy (EPS)V skúšaniach u stabilných pacientov trpiacich schizofréniou bola liečba liekom ABILIFY MAINTENA spojená s vyššou frekvenciou výskytu príznakov EPS (18,4 %) ako pri liečbe perorálnym aripiprazolom. Akatízia bola najčastejšie pozorovaným príznakom (8,2 %) a väčšinou začína okolo 10. dňa po prvej injekcii a trvá priemerne 56 dní.
Jedinci s akatíziou väčšinou dostávali v rámci liečby anticholinergné lieky, hlavne benzatropín mesilát a trihexyfenidyl. Menej často boli podané liečivá ako propranolol a benzodiazepíny (klonazepam a diazepam) na liečbu akatízie.
Vo výskyte nasledoval parkinsonizmus (6,9 % ABILIFY MAINTENA, 4,15 % perorálny aripiprazol vo forme 10 – 30 mg tabliet a 3,0 % placebo).
DystóniaSkupinový účinok: príznaky dystónie, predĺžené abnormálne sťahy skupín svalov, sa môžu vyskytnúť u citlivých jednotlivcov počas prvých dní liečby. Dystonické symptómy zahŕňajú spazmus krčných svalov, niekedy rozvíjajúci sa do uzavretia hrdla, ťažkosti s prehĺtaním, ťažkosti s dýchaním a/alebo vystúpením jazyka. Zatiaľ čo tieto príznaky sa môžu vyskytnúť pri nízkych dávkach, vyskytujú sa častejšie a sú závažnejšie s vysokým potenciálom pri vyšších dávkach antipsychotík prvej generácie. Zvýšené riziko akútnej dystónie je pozorované u mužov a mladších vekových skupín.
Telesná hmotnosťPočas dvojito zaslepenej aktívne kontrolovanej fázy 38-týždňovej štúdie bol výskyt prírastku telesnej

hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 9,5 % pre skupinu , ktorej bol podávaný liek ABILIFY MAINTENA, a 11,7 % pre skupinu užívajúcu perorálne podávaný aripiprazol vo forme tabliet 10 – 30 mg. Výskyt poklesu telesnej hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 10,2 % pre skupinu užívajúcu liek ABILIFY MAINTENA a 4,5 % pre skupinu užívajúcu perorálne podávaný aripiprazol vo forme tabliet 10 – 30 mg.

Počas dvojito zaslepenej placebom kontrolovanej fázy 52-týždňového skúšania bol výskyt prírastku telesnej hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 6,4 % pre skupinu, ktorej bol podávaný liek ABILIFY MAINTENA, a 5,2 % pre skupinu užívajúcu placebo. Výskyt poklesu
telesnej hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 6,4 % pre skupinu, ktorej bol

podávaný liek ABILIFY MAINTENA, a 6,7 % pre skupinu užívajúcu placebo. Počas dvojito zaslepenej liečby bola priemerná zmena telesnej hmotnosti z východiskovej hodnoty po poslednú
návštevu -0,2 kg pre liek ABILIFY MAINTENA a -0,4 kg pre placebo (P = 0,812).
ProlaktínPočas dvojito zaslepenej aktívne kontrolovanej fázy 38-týždňového skúšania sa vyskytol priemerný
pokles hladiny prolaktínu z východiskovej hodnoty po poslednú návštevu pre skupinu, ktorej bol podávaný liek ABILIFY MAINTENA (–0,33 ng/ml) v porovnaní s priemerným nárastom pre skupinu užívajúcu perorálne podávaný aripiprazol vo forme tabliet 10 – 30 mg (0,79 ng/ml, p < 0,01). Výskyt
u pacientov, ktorým bol podávaný liek ABILIFY MAINTENA s hladinami prolaktínu > 1-násobok
hornej hranice normálneho rozsahu (ULN), bol pri akomkoľvek hodnotení 5,4 % v porovnaní s 3,5 %
u pacientov užívajúcich perorálny aripiprazol vo forme tabliet 10 – 30 mg. U mužov bol výskyt vo
všeobecnosti vyšší ako u žien v každej liečenej skupine.
Počas dvojito zaslepenej kontrolovanej fázy 52-týždňového skúšania sa vyskytol priemerný pokles hladiny prolaktínu z východiskovej hodnoty po poslednú návštevu pre skupinu, ktorej bol podávaný liek ABILIFY MAINTENA (–0,38 ng/ml), v porovnaní s priemerným nárastom pre skupinu, ktorej bolo podávané placebo (1,67 ng/ml). Výskyt u pacientov užívajúcich liek ABILIFY MAINTENA s hladinami prolaktínu > 1-násobok hornej hranice normálneho rozsahu (ULN) bol 1,9 % v porovnaní so 7,1 % u pacientov, ktorej bolo podávané placebo.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovaniePočas klinických štúdií s liekom ABILIFY MAINTENA neboli hlásené žiadne prípady predávkovania spojené s nežiaducimi reakciami. Je nutná opatrnosť, aby nedošlo k náhodnému vstreknutiu tohto lieku do cievy. Po každom potvrdenom alebo potenciálne náhodnom predávkovaní/neúmyselnom intravenóznom podaní je potrebné dôkladné sledovanie pacienta a ak sa vyskytnú potenciálne lekársky závažné znaky alebo príznaky, vyžaduje sa monitorovanie vrátane nepretržitého monitorovania EKG. Lekársky dohľad a monitorovanie majú pokračovať dovtedy, kým sa pacient nezotaví.
Simulácia náhleho uvoľnenia dávky preukázala, že predpokladané priemerné koncentrácie aripiprazolu dosiahnu najvyššiu hodnotu 4 500 ng/ml alebo približne 9-násobok horného terapeutického rozsahu. V prípade náhleho uvoľnenia dávky sa predpokladá, že koncentrácie aripiprazolu rýchlo poklesnú na hornú hranicu terapeutického okna približne po 3 dňoch. Na 7. deň priemerné koncentrácie aripiprazolu naďalej klesajú na úroveň koncentrácie po intramuskulárnej depotnej dávke bez náhleho uvoľnenia dávky. Predávkovanie je menej pravdepodobné pri parenterálnom podávaní ako pri perorálnom užívaní, a preto sú nižšie uvedené referenčné informácie pre predávkovanie perorálnym aripiprazolom.
Znaky a príznakyPočas klinických skúšaní a postmarketingového obdobia sa náhodné alebo úmyselné akútne predávkovanie samotným aripiprazolom vyskytlo u dospelých pacientov s hlásenými odhadovanými dávkami až do 1 260 mg (41-násobok najvyššej odporúčanej dennej dávky aripiprazolu) bez fatálnych následkov. Potenciálne medicínsky dôležité sledované znaky a príznaky zahŕňali letargiu, zvýšenie krvného tlaku, somnolenciu, tachykardiu, nauzeu, vracanie a hnačku. Ďalej sa získali aj správy náhodného predávkovania samotným perorálnym aripiprazolom (do 195 mg) u detí bez smrteľných prejavov. Medzi potenciálne medicínsky závažné znaky a príznaky patrila ospalosť, prechodná strata vedomia a extrapyramidové symptómy.
Liečba predávkovaniaLiečba predávkovania sa má zamerať na podpornú liečbu, udržiavanie voľných dýchacích ciest, okysličenie a ventiláciu, a na liečbu príznakov. Musí sa zvážiť možnosť pôsobenia ďalších liekov. Preto sa má okamžite začať monitorovanie kardiovaskulárneho systému vrátane priebežného elektrokardiografického monitorovania na odhalenie možných arytmií. Po akomkoľvek potvrdenom alebo podozrivom predávkovaní aripiprazolom má byť pacient dôkladne sledovaný lekárom a monitorovaný dovtedy, kým sa nezotaví.
HemodialýzaAj napriek tomu, že neexistujú žiadne informácie o účinku hemodialýzy v liečbe predávkovania, nie je pravdepodobné, že by hemodialýza bola užitočná v liečbe predávkovania, pretože sa aripiprazol vo veľkej miere viaže na plazmatické proteíny.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: psycholeptiká, ďalšie antipsychotiká, ATC kód: N05AX12
Mechanizmus účinkuPredpokladá sa, že účinnosť aripiprazolu pri schizofrénii sprostredkuje kombinácia čiastočného
agonizmu receptorov dopamínu D2a serotonínu 5-HT1A a antagonizmus receptorov serotonínu 5- HT2A. Aripiprazol vyvolal na zvieracích modeloch antagonistické vlastnosti dopaminergnej
hyperaktivity a agonistické vlastnosti dopaminergnej hypoaktivity. Aripiprazol vyvoláva vysokú
afinitu in vitro k receptorom dopamínu D2a D3, serotonínu 5-HT1A a 5HT2A a má miernu afinitu k receptorom dopamínu D4, serotonínu 5-HT2C a 5-HT7, alfa1-adrenergným receptorom a receptorom histamínu H1. Aripiprazol vyvolal aj miernu afinitu k miestam spätného vychytávania serotonínu a žiadnu významnú afinitu k cholinergným muskarínovým receptorom. Interakcia s receptormi iného podtypu ako dopamínových a serotonínových receptorov môže vysvetľovať niektoré z ďalších klinických účinkov aripiprazolu.
Perorálne dávky aripiprazolu v rozsahu od 0,5 do 30 mg podávané jedenkrát denne zdravým jedincom po dobu 2 týždňov vyvolali dávkovo závislú redukciu väzby 11C-raklopridu, ligandu D2/D3 receptora na caudatus a putamen zistenú pozitrónovou emisnou tomografiou.
Ďalšie informácie o klinickýchskúšaniach:Udržiavacia liečba schizofrénie u dospelých pacientovÚčinnosť lieku ABILIFY MAINTENA v udržiavacej liečbe pacientov trpiacich schizofréniou bola
stanovená v dvoch randomizovaných dvojito zaslepených skúšaniach.
Pivotné 38-týždňové, randomizované, dvojito zaslepené, aktívne kontrolované skúšanie bolo navrhnuté na stanovenie účinnosti, bezpečnosti a znášanlivosti tohto lieku podávaného vo forme injekcie raz mesačne v porovnaní s dávkou perorálneho aripiprazolu vo forme tabliet 10 – 30 mg raz denne ako udržiavacej terapie u dospelých pacientov trpiacich schizofréniou. Skúšanie pozostávalo zo skríningovej fázy a z 3 liečebných fáz: fázy konverzie, fázy perorálnej stabilizácie a dvojito zaslepenej aktívne kontrolovanej fázy.
Šesťstošesťdesiatdva pacientov prijatých do 38-týždňovej dvojito zaslepenej, aktívne kontrolovanej fázy bolo náhodne rozdelených v pomere 2 : 2 : 1 do dvojito zaslepenej liečby do jednej z 3 liečebných skupín: 1) ABILIFY MAINTENA 2) stabilizačná dávka perorálneho aripiprazolu 10 –
30 mg alebo 3) aripiprazol s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg. Aripiprazol s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg bol zahrnutý v skupine s nízkou dávkou aripiprazolu na účely testovania citlivosti analýzy pre non-inferiórny dizajn.
Výsledky analýzy primárneho výsledku účinnosti (odhadovaný podiel pacientov zažívajúcich príznaky
blížiaceho sa relapsu koncom 26. týždňa dvojito zaslepenej aktívne kontrolovanej fázy) preukázali, že
liek ABILIFY MAINTENA 400 mg/300 mg sa neodlišuje od perorálnych tabliet aripiprazolu 10 –
30 mg.
Odhadovaná frekvencia relapsu koncom 26. týždňa bola 7,12 % v skupine užívajúcej liek ABILIFY MAINTENA a 7,76 % v skupine užívajúcej perorálne tablety aripiprazolu 10 – 30 mg, t. j. rozdiel –
0,64 %. 95 % CI (–5,26, 3,99) pre rozdiel v odhadovanom podiele pacientov, u ktorých sa vyskytli príznaky blížiaceho sa relapsu koncom 26. týždňa, vylučuje vopred definovaný non-inferiórny okraj,
11,5 %. Liek ABILIFY MAINTENA sa preto neodlišuje od perorálnych tabliet aripiprazolu 10 –
30 mg.

Odhadovaný podiel pacientov, u ktorých sa vyskytli príznaky blížiaceho sa relapsu koncom 26. týždňa v skupine užívajúcej liek ABILIFY MAINTENA, bol 7,12 %, čo bolo štatisticky výrazne menej ako v skupine s aripiprazolom s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg (21,80 %,
p = 0,0006). Potvrdila sa preto nadradenosť lieku ABILIFY MAINTENA nad aripiprazolom s
Kaplan-Meierove krivky obdobia od randomizácie do príznakov blížiaceho sa relapsu v 38. týždni dvojito zaslepenej liečebnej fázy pre skupiny, ktorej bol podávaný liek ABILIFY MAINTENA, perorálny aripiprazol 10 – 30 mg a aripiprazol s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg sú zobrazené na obrázku 1.
 Obrázok 1 Kaplan-Meierov graf hranice lieku merajúci čas do zhoršenia psychotickýchpríznakov/príznakov blížiaceho sa relapsu
Obrázok 1 Kaplan-Meierov graf hranice lieku merajúci čas do zhoršenia psychotickýchpríznakov/príznakov blížiaceho sa relapsu




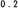
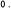
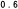
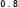
























































ARIP IMD 50 mg/25 mg
POZNÁMKA: ARIP IMD 400/300 mg = ABILIFY MAINTENA ARIP 10-30 mg = perorálny aripiprazol, ARIP IMD 50/25 mg =

s dlhotrvajúcim účinkom, injekčný
Non-inferioritu lieku ABILIFY MAINTENA v porovnaní s perorálnym aripiprazolom 10 – 30 mg podporujú výsledky analýzy stupnice pozitívneho a negatívneho syndrómu pre schizofréniu (PANSS).
Tabuľka 1 Celkové skóre PANSS – Zmena z východiskovej hodnoty po 38. týždeň-LOCF:Randomizovaná vzorka na stanovenie účinnosti a,bCelkové skóre PANSS – Zmena z východiskovej hodnoty po 38. týždeň-LOCF: Randomizovaná vzorka na stanovenie účinnosti a,b
|
| ABILIFY
MAINTENA
400 mg/300 mg
(n = 263)
| Perorálny
aripiprazol
10 – 30 mg/deň
(n = 266)
| Aripiprazol s dlhotrvajúcim
účinkom, injekčný roztok 50
mg/25 mg
(n = 131)
|
Stredná východisková
hodnota (SD)
| 57,9 (12,94)
| 56,6 (12,65)
| 56,1 (12,59)
|
Stredná zmena
(SD)
| –1,8 (10,49)
| 0,7 (11,60)
| 3,2 (14,45)
|
P-hodnota
| Neaplikovateľné
| 0,0272
| 0,0002
|
a: Negatívne zmeny skóre indikujú zlepšenie.
b: Zahrnutí boli iba pacienti s východiskovou hodnotou a s minimálne jednou hodnotou po východiskovej hodnote. P-hodnoty boli odvodené z porovnania pre zmenu východiskovej hodnoty v rámci analýzy kovariančného modelu s liečbou v čase a východiskovou hodnotou ako kovarianciou.
Druhé skúšanie bolo 52-týždňové randomizované dvojito zaslepené skúšanie stiahnutia lieku vykonané v Spojených štátoch u dospelých pacientov s aktuálnou diagnózou schizofrénie. Toto skúšanie pozostávalo zo skríningovej fázy a zo 4 liečebných fáz: konverzie, perorálnej stabilizácie, stabilizácie s liekom ABILIFY MAINTENA a dvojito zaslepenej placebom kontrolovanej fázy.
Pacienti spĺňajúci požiadavky na perorálnu stabilizáciu vo fáze perorálnej stabilizácie boli pridelení na
podávanie lieku ABILIFY MAINTENA jednostranne zaslepenou metódou a začali stabilizačnú fázu s liekom ABILIFY MAINTENA trvajúcu minimálne 12 týždňov a maximálne 36 týždňov. Pacienti prijatí do dvojito zaslepenej, placebom kontrolovanej fázy boli náhodne rozdelení v pomere 2 : 1 do dvojito zaslepenej liečby liekom ABILIFY MAINTENA alebo placebom.
Finálna analýza účinnosti obsahovala 403 randomizovaných pacientov a 80 zhoršení psychotických príznakov/príznakov blížiaceho sa relapsu. V skupine s placebom sa u 39,6 % pacientov prejavil blížiaci sa relaps, zatiaľčo v skupine s liekom ABILIFY MAINTENA sa blížiaci relaps vyskytol u 10
% pacientov. Pacienti v skupine s placebom mali preto 5,03-násobne vyššie riziko výskytu príznakov blížiaceho sa relapsu.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom ABILIFY MAINTENA vo všetkých podskupinách pediatrickej populácie pre schizofréniu (pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Absorpcia aripiprazolu do systémového obehu je po podaní lieku ABILIFY MAINTENA pomalá a
predĺžená z dôvodu nízkej rozpustnosti častíc aripiprazolu.
Priemerný polčas absorpcie lieku ABILIFY MAINTENA je 28 dní. Absorpcia aripiprazolu
z intramuskulárnej depotnej formulácie úplne zodpovedala intramuskulárnej štandardnej formulácii (s okamžitým uvoľňovaním). Hodnoty cmax po úprave dávky pre depotnú formuláciu boli približne 5 % cmax pri intramuskulárnej štandardnej formulácii.
Po podaní viacerých intramuskulárnych dávok sa koncentrácie aripiprazolu v plazme postupne zvýšia
a v stabilizovanom stave dosiahnu maximálnu plazmatickú koncentrácie pri mediáne Tmax 5 – 7 dní. Menej ako úmerne s dávkou sa zvyšuje koncentrácia aripiprazolu a dehydro-aripiprazolu a AUC parametre sú pozorované po injekcii lieku ABILIFY MAINTENA 300 mg až 400 mg podanej každý mesiac.
Distribúcia
Na základe výsledkov zo skúšaní s perorálne podávaným aripiprazolom sa aripiprazol distribuuje široko do celého tela so zjavným objemom distribúcie 4,9 l/kg, čo navodzuje rozsiahlu
extravaskulárnu distribúciu. Pri terapeutických koncentráciách sa aripiprazol a dehydro-aripiprazol vo viac ako 99 % viažu na sérové proteíny, pričom sa primárne viažu na albumín.
Biotransformácia
Aripiprazol sa v rozsiahlej miere metabolizuje v pečeni hlavne tromi biotransformačnými cestami:
dehydrogenáciou, hydroxyláciou a N-dealkyláciou. Na základe in-vitro štúdií sú enzýmy CYP3A4 a CYP2D6 zodpovedné za dehydrogenáciu a hydroxyláciu aripiprazolu a N-dealkylácia je katalyzovaná enzýmom CYP3A4. Aripiprazol tvorí hlavný podiel lieku v systémovom obehu. Po podaní viacnásobnej dávky lieku ABILIFY MAINTENA dehydro-aripiprazol, aktívny metabolit, predstavuje približne 29,1-32,5 % AUC aripiprazolu v plazme.
Eliminácia
Po podaní viacnásobnej dávky 400 mg alebo 300 mg lieku ABILIFY MAINTENA je stredný polčas terminálnej eliminácie aripiprazolu 46,5 dní alebo 29,9 dní, pravdepodobne z dôvodu kinetických vlastností obmedzených rýchlosťou absorpcie. Po jednotlivej perorálnej dávke aripiprazolu označeného [14C] bolo približne 27 % podanej rádioaktívnej látky zistenej v moči a približne 60 % v stolici. Menej ako 1 % nezmeneného aripiprazolu sa vylúčilo močom a približne 18 % sa vylúčilo v nezmenenej forme stolicou.
Farmakokinetika u špeciálnych skupín pacientov
Pacienti so známou zníženou metabolickou aktivitou CYP2D6
Na základe hodnotenia farmakokinetických vlastností ABILIFY MAINTENA u populácie bol celkový telesný klírens aripiprazolu 3,71 l/h u pacientov so známou nadmernou metabolickou aktivitou CYP2D6 a približne 1,88 l/h (približne o 50 % nižší) u pacientov so známou zníženou metabolickou aktivitou CYP2D6 (pre odporúčanie dávky pozri časť 4.2).
Staršie osoby
Po perorálnom podaní aripiprazolu sa nepreukázali žiadne rozdiely vo farmakokinetických vlastnostiach aripiprazolu medzi zdravými staršími osobami a mladšími dospelými osobami. Podobne
pri analýze farmakokinetických vlastností ABILIFY MAINTENA u populácie pacientov trpiacich
schizofréniou sa nevyskytol žiadny stanoviteľný účinok veku.
Pohlavie
Po perorálnom podaní aripiprazolu sa nepreukázali žiadne rozdiely vo farmakokinetických vlastnostiach aripiprazolu medzi zdravými mužmi a ženami. Podobne pri analýze farmakokinetických
vlastností lieku ABILIFY MAINTENA u populácie počas klinických štúdii u pacientov trpiacich
schizofréniou sa nevyskytol žiadny klinicky významný účinok pohlavia.
Fajčenie
Hodnotenie farmakokinetických vlastností populácie s perorálnym aripiprazolom nepreukázalo výskyt
žiadnych klinicky relevantných účinkov fajčenia na farmakokinetické vlastnosti aripiprazolu.
Rasa
Hodnotenie farmakokinetických vlastností populácie nepreukázalo výskyt žiadnych rozdielov spojených s rasou na farmakokinetické vlastnosti aripiprazolu.
Poruchafunkcieobličiek
V štúdii jednej dávky perorálne podávaného aripiprazolu boli farmakokinetické vlastnosti aripiprazolu a dehydro-aripiprazolu podobné u pacientov so závažnou poruchou funkcie obličiek ako u mladých
zdravých jedincov.
Poruchafunkciepečene
Štúdia jednej dávky perorálne podávaného aripiprazolu osobám s rôznymi stupňami cirhózy pečene
(Child-Pughove triedy A, B a C) neodhalila výrazný účinok poškodenej funkcie pečene na farmakokinetické vlastnosti aripiprazolu a dehydro-aripiprazolu, avšak štúdia zahŕňala iba 3 pacientov s cirhózou pečene triedy C, čo nie je dostatočné na odvodenie záverov o ich metabolickej kapacite.
5.3 Predklinické údaje o bezpečnosti
Toxikologický profil aripiprazolu podávaného testovaným zvieratám vo forme intramuskulárnej injekcie je všeobecne podobný profilu po perorálnom podaní pri porovnateľných plazmatických hladinách. Pri intramuskulárnej injekcii sa však v mieste vpichu objavila zápalová reakcia a pozostávala z granulomatózneho zápalu, ložísk (uložené liečivo), celulárnych infiltrátov, edému (opuch) a u opíc z fibrózy. Tieto účinky postupne vymizli spolu s ukončením dávkovania.
Predklinické údaje o bezpečnosti perorálne podávaného aripiprazolu získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
Perorálny aripiprazol
Pri perorálnom aripiprazole boli toxikologicky významné účinky pozorované iba pri dávkach alebo expozíciách, ktoré dostatočne presahovali maximálnu dávku u ľudí alebo expozíciu, čo naznačilo, že
tieto účinky boli obmedzené alebo nemali význam pre klinickú prax. Zahŕňa to: adrenokortikálnu
toxicitu u potkanov závislú na dávke po 104 týždňoch perorálneho podávania približne 3- až 10- násobku priemernej hodnoty AUC v stabilizovanom stave pri maximálnej odporúčanej dávke u ľudí a zväčšené adrenokortikálne karcinómy a kombinované adrenokortikálne adenómy/karcinómy u samíc potkanov pri približne 10-násobku priemernej hodnoty AUC v stabilizovanom stave pri maximálnej
odporúčanej dávke u ľudí. Najvyššia netumorogénna expozícia u samíc potkanov bola približne 7-
násobok expozície u ľudí pri odporúčanej dávke.
Doplňujúcim nálezom bola cholelitiáza ako následok precipitácie sulfátových konjugátov hydroximetabolitov aripiprazolu v žlči opíc po opakovanom perorálnom dávkovaní 25 až
125 mg/kg/deň alebo približne 16 až 81-násobok maximálnej odporúčanej dávky u ľudí na základe
mg/m2.
Koncentrácie sulfátových konjugátov hydroxy-aripiprazolu v ľudskej žlči v najvyššej navrhovanej
dávke 30 mg denne však netvorili viac ako 6 % koncentrácie v žlči stanovenej u opíc v 39. týždni štúdie a sú výrazne nižšie (6 %) ako hranice ich in-vitro rozpustnosti.
V štúdiách opakovanej dávky u mladých potkanov a psov bol profil toxicity aripiprazolu porovnateľný s profilom pozorovaným u dospelých zvierat a nevyskytol sa dôkaz neurotoxicity alebo nežiaducich účinkov na vývoj.
Na základe kompletného rozsahu štandardných testov genotoxicity sa aripiprazol nepokladá za
genotoxický. Aripiprazol v reprodukčných štúdiách toxicity nepoškodil fertilitu.
Toxicita vo vývoji vrátane oneskorenej osifikácie plodu závislej na dávke a možných teratogénnych
účinkov, bola pozorovaná u potkanov pri dávkach spôsobujúcich subterapeutické expozície (na základe AUC) a u králikov pri dávkach spôsobujúcich expozície približne 3- a 11-násobne vyššie ako priemerná hodnota AUC v stabilizovanom stave pri maximálnej odporúčanej klinickej dávke. Zistilo sa, že dávky podobné tým, ktoré vyvolali vývojovú toxicitu boli toxické aj pre matku.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok
Karmelóza sodná
Manitol
Monohydrát dihydrogénfosforečnanu sodného
Hydroxid sodný
Disperzné prostredie
Voda na injekciu
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
Po rekonštitúcii
Chemická a fyzikálna stabilita v stave pripravenom na použitie bola stanovená na 4 hodiny pri teplote do 25 °C. Z mikrobiologického hľadiska, pokiaľ spôsob otvárania/rekonštitúcie nevylučuje riziko
mikrobiálnej kontaminácie, produkt sa má okamžite použiť. Pokiaľ sa nepoužije okamžite, čas a
podmienky stability v stave pripravenom na použitie sú zodpovednosťou používateľa. Pred vstreknutím injekčnú liekovku minimálne 60 sekúnd riadne pretrepávajte, aby sa obsah rozpustil.
Rekonštituovanú suspenziu neuchovávajte v striekačke.
6.4 Špeciálne upozornenia na uchovávanie
Neuchovávajte v mrazničke.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
400 mg prášok:
Injekčná liekovka zo skla typu I s laminovanou gumovou zátkou a zapečatená odtrhávacím hliníkovým viečkom.
Disperzné prostredie:
2 ml injekčná liekovka zo skla typu I s laminovanou gumovou zátkou a zapečatená odtrhávacím hliníkovým viečkom.
Samostatné balenie
Každé samostatné balenie obsahuje jednu injekčnú liekovku s práškom, 2 ml injekčnú liekovku s disperzným prostredím, jednu 3 ml striekačku typu Luer lock s vopred nasadenou 38 mm (1,5 palca) hypodermickou bezpečnostnou ihlou veľkosti 21 G s ochrannou pomôckou na ihlu, jednu 3 ml jednorazovú striekačku s hrotom typu Luer lock, jeden adaptér na injekčnú liekovku, jednu 38 mm (1,5 palca) hypodermickú bezpečnostnú ihlu veľkosti 21 G s ochrannou pomôckou na ihlu a jednu
50 mm (2 palce) hypodermickú bezpečnostnú ihlu veľkosti 21 G s ochrannou pomôckou na ihlu
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
1. krok: Príprava pred rekonštitúciou prášku.
(a) Rozložte si jednotlivé komponenty a skontrolujte, či sú v balení:
- injekčná liekovka s práškom,
- injekčná liekovka s 2 ml disperzného prostredia,
- jedna 3 ml striekačka typu Luer lock s vopred nasadenou 38 mm (1,5 palca) hypodermickou
bezpečnostnou ihlou veľkosti 21 G s ochrannou pomôckou na ihlu,
- jedna 3 ml jednorazová striekačka s hrotom typu Luer lock,
- jeden adaptér na injekčnú liekovku,
- jedna 38 mm (1,5 palca) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu,
- jedna 50 mm (2 palca) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu.
(b) Prášok rozpustite pomocou disperzného prostredia dodávaného v obale.
(c) Zvoľte potrebné množstvo disperzného prostredia na rekonštitúciu.
400 mg injekčná liekovka: pridajte 1,9 ml disperzného prostredia na rekonštitúciu prášku
Dôležité: injekčná liekovka s disperzným prostredím obsahuje nadbytočné možstvo.
2. krok: Rekonštitúcia prášku
(a) Odstráňte viečka z injekčnej liekovky s disperzným prostredím a s práškom a vrchné časti utrite
sterilným alkoholovým tampónom.
(b) Pomocou striekačky s vopred nasadenou ihlou natiahnite vopred stanovený objem disperzného
prostredia z injekčnej liekovky s disperzným prostredím do striekačky (pozri obrázok 1). Malé množstvo zvyškového disperzného prostredia zostane po natiahnutí v injekčnej liekovke. Všetko nadbytočné množstvo zlikvidujte.

Obrázok 1
(c) Disperzné prostredie pomaly vstreknite do injekčnej liekovky s práškom (pozri obrázok 2).
Obrázok 2
(d) Natiahnite vzduch, aby ste vyrovnali tlak v liekovke jemným spätným potiahnutím piestu.
Následne ihlu odstráňte z liekovky. Metódou jednej ruky nasaďte ochrannú pomôcku na ihlu (pozri obrázok 3). Jemne potlačte puzdro proti plochému povrchu, pokiaľ ihla pevne nezapadne do ochranného puzdra na ihlu. Vizuálne overte, či ihla úplne zapadla do ochranného puzdra na ihlu a zlikvidujte ju.
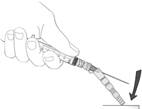
Obrázok 3
(e)
Injekčnúliekovkuriadne pretrepávajte podobu30sekúnd,kýmsuspenzianebudevyzeraťhomogénne(pozri obrázok 4).
Obrázok 4
(f) Pred podaním vizuálne skontrolujte, či rekonštituovaná suspenzia neobsahuje cudzie častice alebo či nezmenila farbu. Rekonštituovaný liek je biela až sivobiela tekutá suspenzia. Nepoužívajte, ak rekonštituovaná suspenzia obsahuje cudzie častice alebo zmenila farbu.
(g) Ak sa injekcia nepodá okamžite po rekonštitúcii, injekčnú liekovku uchovávajte pri teplote do
25 °C maximálne 4 hodiny a pred vstreknutím injekčnú liekovku minimálne 60 sekúnd riadne
pretrepávajte, aby sa obsah rozpustil.
(h) Rekonštituovanú suspenziu neuchovávajte v striekačke.
3. krok: Príprava pred podaním injekcie
(a) Odstráňte kryt, adaptér však nevyberajte z obalu (pozri obrázok 5).
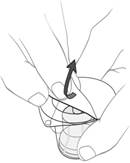
Obrázok 5
(b) Pomocou obalu na adaptér manipulujte s adaptérom na injekčnú liekovku a pripojte vopred
zabalenú striekačku typu Luer lock na adaptér na injekčnú liekovku (pozri obrázok 6).
Obrázok 6
(c) Pomocou striekačky typu Luer lock odstráňte adaptér na injekčnú liekovku z obalu a zlikvidujte
obal na adaptér (pozri obrázok 7).
Nikdy sa nedotýkajte hrotu adaptéra. Obrázok 7 (d) Určite odporúčaný objem na podanie injekcie.
Rekonštituovaný objem suspenzie ABILIFY MAINTENA určený na vstreknutie400 mg injekčná liekovka
|
Dávka
| Objem určený na
vstreknutie
|
400 mg
| 2,0 ml
|
300 mg
| 1,5 ml
|
200 mg
| 1,0 ml
|
160 mg
| 0,8 ml
|
(e) Vrchnú časť injekčnej liekovky s rekonštituovanou suspenziou utrite sterilným alkoholovým
tampónom.
(f) Umiestnite a podržte injekčnú liekovku s rekonštituovanou suspenziou na tvrdom povrchu.
Pripojte súpravu adaptéra a striekačky na injekčnú liekovku pridržaním vonkajšej časti adaptéra a pevným pritlačením hrotu adaptéra cez gumenú zátku, pokým adaptér nezapadne do správnej
polohy (pozri obrázok 8).

Obrázok 8
(g) Pomaly natiahnite odporúčaný objem z injekčnej liekovky do striekačky typu Luer lock, aby ste umožnili vstreknutie (pozri obrázok 9).
Malé množstvonadbytočnéholieku zostanevinjekčnejliekovke.
4. krok: Postup podania injekcie:
Obrázok 9
(a) Odpojte striekačku typu Luer lock obsahujúcu odporúčaný objem rekonštituovanej suspenzie
ABILIFY MAINTENA z injekčnej liekovky.
(b) Zvoľte jednu z nasledujúcich hypodermických bezpečnostných ihiel podľa telesnej hmotnosti pacienta a pripojte ihlu ku striekačke typu Luer lock obsahujúcu suspenziu na injekciu.
Stlačením a otočením v smere hodinových ručičiek overte, či ihla pevne drží v ochrannej
pomôcke na ihlu a následne odstráňte kryt z ihly (obrázok 10).
• 38 mm (1,5 palca) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu pre neobéznych pacientov.
• 50 mm (2 palce) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu pre obéznych pacientov.

Obrázok 10
(c) Pomaly vstreknite odporúčaný objem ako jednu intramuskulárnu injekciu do sedacieho svalu.
Miesto vpichu injekcie nemasírujte. Je potrebná opatrnosť, aby nedošlo k náhodnému
vstreknutiu do cievy. Nevstrekujte do oblasti s príznakmi zápalu, poškodeniami pokožky, s
hrčami alebo s modrinami.
5. krok: Postup po podaní injekcie:(a) Nasaďte ochrannú pomôcku na ihlu tak, ako je opísané v 2. kroku (d). Po podaní injekcie
injekčné liekovky, adaptér, ihly a striekačku zlikvidujte.
Injekčné liekovky s práškom a s disperzným prostredím sú len na jednorazové použitie.
(b) Nezabudnite, že miesta vpichu injekcie je potrebné striedať medzi dvoma sedacími svalmi.
(c) Sledujte znaky a príznaky náhodného intravenózneho podania.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIOtsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Veľká Británia
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/13/882/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: {DD mesiac RRRR}
10. DÁTUM REVÍZIE TEXTU{DD mesiac RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
ABILIFY MAINTENA 300 mg prášok a disperzné prostredie na injekčnú suspenziu s predĺženým uvoľňovaním
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá injekčná liekovka obsahuje 300 mg aripiprazolu.
Po rekonštitúcii každý ml suspenzie obsahuje 200 mg aripiprazolu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Prášok a disperzné prostredie na injekčnú suspenziu s predĺženým uvoľňovaním
Prášok: biely až sivobiely
Disperzné prostredie: číry roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
ABILIFY MAINTENA je indikovaná na udržiavaciu liečbu schizofrénie u dospelých pacientov
stabilizovaných perorálnym podávaním aripiprazolu .
4.2 Dávkovanie a spôsob podávania
Dávkovanie
U pacientov, ktorí nikdy neužívali aripiprazol, sa má overiť pred začatím liečby liekom ABILIFY
MAINTENA znášanlivosť perorálne podávaného aripiprazolu.
Odporúčaná úvodná a udržiavacia dávka lieku ABILIFY MAINTENA je 400 mg.
Titrácia dávky tohto lieku nie je potrebná. Má sa podávať raz mesačne ako jedna injekcia (nie skôr ako
26 dní po predchádzajúcej injekcii).
Po prvej injekcii sa má pokračovať v liečbe perorálnym aripiprazolom 10 mg až 20 mg 14 po sebe
nasledujúcich dní na zachovanie terapeutickej koncentrácie aripiprazolu počas začatí liečby.
Ak sa pri dávkovaní 400 mg objavia nežiaduce účinky, má sa zvážiť zníženie dávky na 300 mg raz
mesačne.
Vynechané dávky
V
ynechané dávky
|
A
k došlo k vynechaniu 2. alebo
3. dávky a od poslednej injekcie uplynuli:
|
O
patrenie
|
> 4 týždne a < 5 týždňov
|
Injekcia sa má podať čo najskôr a následne obnoviť
mesačný plán podávania injekcií.
|
> 5 týždňov
|
Má sa podať ďalšia injekcia a súčasne obnoviť
užívanie perorálneho aripiprazolu po dobu 14 dní,
následne obnoviť mesačný plán podávania injekcií.
|
A
k došlo k vynechaniu 4.
.
alebo nasledovných dávok (t. j. po
dosiahnutí stabilizovaného stavu)
a od poslednej injekcie uplynuli:
|
O
patrenie
|
> 4 týždne a < 6 týždňov
|
Injekcia sa má podať čo najskôr a následne obnoviť
mesačný plán podávania injekcií.
|
> 6 týždňov
|
Má sa podať ďalšia injekcia a súčasne obnoviť
užívanie perorálneho aripiprazolu po dobu 14 dní,
následne obnoviť mesačný plán podávania injekcií.
|
Špeciálne populácie
Starší pacienti
Bezpečnosť a účinnosť lieku ABILIFY MAINTENA pri liečbe schizofrénie u pacientov vo veku
65 rokov a starších nebola stanovená (pozri časť 4.4).
Porucha funkcie obličiekU pacientov s poruchou funkcie obličiek nie je potrebná úprava dávkovania (pozri časť 5.2).
Porucha funkcie pečeneU pacientov s miernou alebo stredne závažnou poruchou funkcie pečene nie je potrebná úprava dávkovania. U pacientov s ťažkou poruchou funkcie pečene dostupné údaje nie sú dostatočné na stanovenie odporúčania. U týchto pacientov vyžadujúcich opatrnosť pri dávkovaní sa má uprednostniť perorálne podávanie (pozri časť 5.2).
Pacienti so známou zníženou metabolickou aktivitou CYP2D6U pacientov, u ktorých je známa znížená metabolická aktivita CYP2D6, má byť úvodná a udržiavacia
dávka 300 mg. Pri súbežnom používaní so silnými inhibítormi CYP3A4 sa má dávka znížiť na 200 mg
(pozri časť 4.5).
Úprava dávkovania pri interakciáchÚprava dávky je potrebná u pacientov, ktorí súbežne užívajú silné inhibítory CYP3A4 alebo silné inhibítory CYP2D6 dlhšie ako 14 dní. Ak sa skončí užívanie inhibítoru CYP3A4 alebo inhibítoru
CYP2D6, môže byť potrebné zvýšiť dávkovanie na predchádzajúcu dávku (pozri časť 4.5). V prípade
výskytu nežiaducich reakcií aj po úprave dávkovania lieku ABILIFY MAINTENA je potrebné
opätovne zvážiť potrebu súbežného podávania inhibítora CYP2D6 alebo CYP3A4.
Súbežnému používaniu induktorov CYP3A4 s liekom ABILIFY MAINTENA dlhšie ako 14 dní sa má vyvarovať, pretože hladiny aripiprazolu v krvi sú znížené a môžu sa nachádzať pod hladinou účinnosti (pozri časť 4.5).
Ú
prava dávky lieku ABILIFY MAINTENA u pacientov, ktorí súbežne užívajú silné inhibítory
CY
P
2D6, silné inhibítory CYP3A4 a/alebo induktory CYP3A4 dlhšie ako 14 dní
|
U
pravená dávka
|
P
acienti užívajúci 400 mg lieku ABILIFY MAINTENA
|
Silné inhibítory CYP2D6 alebo CYP3A4
|
300 mg
|
Silné inhibítory CYP2D6 a CYP3A4
|
200 mg
|
Induktor CYP3A4
|
Vyvarujte sa použitiu
|
P
acienti užívajúci 300 mg lieku ABILIFY MAINTENA
|
Silné inhibítory CYP2D6 alebo CYP3A4
|
200 mg
|
Silné inhibítory CYP2D6 a CYP3A4
|
160 mg
|
Induktor CYP3A4
|
Vyvarujte sa použitiu
|
Pediatrická populácia
Bezpečnosť a účinnosť lieku ABILIFY MAINTENA u detí a dospievajúcich vo veku 0 – 17 rokov nebola stanovená. K dispozícii nie sú žiadne údaje.
Spôsob podávaniaLiek ABILIFY MAINTENA je určený len na intramuskulárne použitie a nesmie sa podávať
intravenózne ani subkutánne. Má ho podať iba zdravotnícky profesionál. Suspenzia sa má podať
okamžite po rekonštitúcii možno ju však uchovávať pri teplote do 25 °C maximálne 4 hodiny v injekčnej liekovke. Suspenzia sa má vstreknúť pomaly ako jednorazová injekcia (dávky sa nesmú rozdeliť) do sedacieho svalu. Je potrebné dávať pozor, aby nedošlo k náhodnému vstreknutiu do cievy. Miesto vpichu injekcie sa má striedať medzi dvoma sedacími svalmi.
Odporúčaná ihla na podanie je hypodermická bezpečnostná ihla veľkosti 38 mm (1,5 palca), 21 G. U obéznych pacientov (index telesnej hmotnosti > 28 kg/m2) sa má použiť hypodermická bezpečnostná ihla veľkosti 50 mm (2 palce), 21 G (pozri časť 6.6).
Injekčné liekovky na prášok a disperzné prostredie sú určené len na jednorazové použitie.
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníPočas liečby antipsychotikami sa môže zlepšenie klinického stavu pacienta prejaviť po niekoľkých dňoch až niekoľkých týždňoch. Počas celého tohto obdobia majú byť pacienti starostlivo monitorovaní.
SamovraždaPri psychických ochoreniach je výskyt samovražedného správania sprievodným javom a v niektorých
prípadoch bolo hlásené krátko po začatí alebo zmene antipsychotickej liečby, vrátane liečby aripiprazolom (pozri časť 4.8). Dôkladné sledovanie vysoko rizikových pacientov má byť súčasťou antipsychotickej liečby.
Kardiovaskulárne poruchyLiek ABILIFY MAINTENA sa má opatrne používať u pacientov so známou kardiovaskulárnou chorobou (anamnéza infarktu myokardu alebo ischemickej choroby srdca, srdcového zlyhania alebo odchýlok vedenia), s cerebrovaskulárnym ochorením, so stavmi, ktoré spôsobujú u pacientov hypotenziu (dehydratácia, hypovolémia a antihypertenzivna liečba) alebo hypertenziou, vrátane akcelerovanej alebo malígnej.
Boli hlásené prípady žilovej trombembólie pri užívaní antipsychotík. Pretože pacienti liečení antipsychotikami často získajú rizikové faktory pre žilovú trombembóliu, všetky možné rizikové faktory pre žilovú trombembóliu majú byť určené pred a počas liečby liekom ABILIFY MAINTENA a majú sa vykonať preventívne opatrenia. (pozri časť 4.8).
PredĺženieintervaluQT
V klinických štúdiách liečby perorálnym aripiprazolom bol výskyt predĺženia QT intervalu porovnateľný ako u placeba. Aripiprazol sa má používať opatrne u pacientov s predĺžením QT
intervalu v rodinnej anamnéze (pozri časť 4.8).
Tardívna dyskinéza
V jednoročných alebo v kratších klinických štúdiách boli počas liečby aripiprazolom hlásené
zriedkavé prípady akútnej dyskinézy. Hneď ako sa u pacienta užívajúceho liek ABILIFY MAINTENA objavia znaky a príznaky tardívnej dyskinézy, má sa zvážiť zníženie dávky alebo prerušenie liečby (pozri časť 4.8). Tieto príznaky sa môžu postupom času zhoršovať, alebo môžu vzniknúť dokonca aj
po prerušení liečby.
Neuroleptický malígny syndróm (NMS)
NMS je potenciálne fatálny komplex symptómov súvisiaci s podávaním antipsychotík. V klinických skúšaniach boli počas liečby aripiprazolom hlásené zriedkavé prípady NMS. Klinickými prejavmi
NMS sú hyperpyrexia, svalová stuhnutosť, zmenený duševný stav a dokázateľná nestabilita
autonómneho nervového systému (nepravidelný pulz alebo krvný tlak, tachykardia, diaforéza a
srdcová arytmia). Medzi ďalšie znaky môžu patriť zvýšená hladina kreatínfosfokinázy, myoglobinúria
(rabdomyolýza) a akútne renálne zlyhanie.
Vyskytla sa však aj zvýšená hladina kreatínfosfokinázy a rabdomyolýzy, ktorá nemusí byť nevyhnutne spojená s NMS. Ak u pacientov vyvinú znaky a príznaky svedčiace o NMS, alebo budú mať nevysvetliteľnú vysokú horúčku bez ďalších klinických prejavov NMS, užívanie všetkých antipsychotík vrátane aripiprazolu sa musí ukončiť (pozri časť 4.8).
Záchvat
V klinických štúdiách boli počas liečby aripiprazolom hlásené menej časté prípady záchvatov. Aripiprazol sa preto má podávať opatrne u pacientov, ktorí majú epilepsiu v anamnéze, alebo ktorí majú stavy súvisiace so záchvatmi (pozri časť 4.8).
Starší pacienti s psychózou súvisiacou s demenciou
Zvýšená mortalita
V troch placebom kontrolovaných štúdiách perorálneho aripiprazolu u starších pacientov trpiacich psychózami spojenými s Alzheimerovou chorobou (n = 938, priemerný vek: 82,4 rokov, rozsah: 56 –
99 rokov) bolo u pacientov liečených aripiprazolom, v porovnaní s placebom, zvýšené riziko úmrtia.
Frekvencia úmrtí u pacientov liečených perorálnym aripiprazolom bola 3,5 % v porovnaní s 1,7 %
pacientov v skupine s placebom. Príčiny úmrtí boli síce rôzne, väčšina z nich však bola kardiovaskulárneho (napr. zlyhanie srdca, náhla smrť) alebo infekčného (napr. pneumónia) charakteru (pozri časť 4.8).
Cerebrovaskulárne nežiaduce reakcie
Pri rovnakých štúdiách perorálneho aripiprazolu boli u pacientov hlásené cerebrovaskulárne nežiaduce
reakcie (napr. mŕtvica, prechodný ischemický záchvat), vrátane fatálnych prípadov (priemerný vek:
84 rokov, rozsah: 78-88 rokov). Celkovo boli u 1,3 % z pacientov liečených perorálnym aripiprazolom
hlásené cerebrovaskulárne nežiaduce reakcie v porovnaní s 0,6 % pacientov liečených v rámci týchto štúdií placebom. Tento rozdiel nebol štatisticky významný. V jednej z týchto štúdií, v štúdií s fixnou dávkou, sa však vyskytol výrazný vzťah medzi dávkou a cerebrovaskulárnymi nežiaducimi reakciami u pacientov liečených aripiprazolom (pozri časť 4.8).
Liek ABILIFY MAINTENA nie je určený na liečbu pacientov s psychózou spojenou s demenciou.
H
y
perglykémia a diabetes mellitus
U pacientov, liečených atypickými antipsychotikami zahŕňajúcimi aripiprazol, bola hlásená hyperglykémia, ktorá bola v niektorých prípadoch mimoriadna a spojená s ketoacidózou alebo hyperosmolárnou kómou alebo smrťou. Medzi rizikové faktory, ktoré môžu u pacientov viesť k vážnym komplikáciam, patrí obezita a rodinná anamnéza diabetu. V klinických skúšaniach aripiprazolu neboli významné rozdiely v stupni výskytu s hyperglykémiou súvisiacimi nežiaduci reakciami (zahŕňajúcimi diabetes) alebo v abnormálnych laboratórnych hodnotách glykémie v porovnaní s placebom. Presné odhady rizika výskytu nežiaducich reakcií spojených s hyperglykémiou u pacientov liečených aripiprazolom a inými atypickými antipsychotikami nie sú dostupné, aby sa umožnili priame porovnania. Pacienti liečení ktorýmkoľvek antipsychotikom vrátame aripiprazolu majú byť sledovaní kvôli znakom a príznakom hyperglykémie (napr. polydipsia, polyúria, polyfágia a slabosť) a pacienti s diabetes mellitus alebo s rizikovými faktormi pre diabetes mellitus majú byť pravidelne sledovaní kvôli zhoršeniu glykémie (pozri časť 4.8).
Hypersenzitivita
Pri aripiprazole sa môžu vyskytnúť hypersenzitívne reakcie charakterizované alergickými príznakmi.
Prírastok telesnej hmotnosti
K prírastku telesnej hmotnosti často dochádza u schizofrenických pacientov z dôvodu používania antipsychotík, u ktorých je známe, že spôsobujú prírastok telesnej hmotnosti, z dôvodu sprievodných ochorení, zlého životného štýlu a môže viesť k závažným komplikáciám. Prírastok telesnej hmotnosti bol hlásený postmarketingovo u pacientov, ktorým bol predpísaný perorálny aripiprazol. Zvyčajne je pozorovaný u pacientov s významnými rizikovými faktormi, ako je anamnéza diabetu, porucha štítnej žľazy alebo adenóm hypofýzy. V klinických štúdiách aripiprazolu sa nepreukázalo, že by spôsoboval klinicky významný prírastok telesnej hmotnosti (pozri časť 4.8).
Dysfágia
Ezofageálna dysmotilita a aspirácia súvisia s používaním antipsychotík vrátane aripiprazolu.
Aripiprazol sa má používať opatrne u pacientov s rizikom aspiračnej pneumónie.
Patologickéhráčstvo
Postmarketingové hlásenia patologického hráčstva boli hlásené u pacientov, ktorým bol predpísaný perorálny aripiprazol, bez ohľadu na to, či majú títo pacienti patologické hráčstvo v predošlej
anamnéze. Pacienti s patologickým hráčstvom v predošlej anamnéze môžu mať zvýšené riziko a majú
byť starostlivo monitorovaní (pozri časť 4.8).
4.5 Liekové a iné interakcie
S liekom ABILIFY MAINTENA sa neuskutočnili žiadne špecifické interakčné štúdie. Informácie
uvedené nižšie boli získané zo štúdií s perorálnym aripiprazolom.
Z dôvodu jeho antagonizmu voči α1-adrenergnému receptoru má aripiprazol potenciál zlepšovať účinok určitých liekov proti hypertenzii.
Zohľadňujúc primárne účinky aripiprazolu na CNS je potrebná opatrnosť pri podávaní aripiprazolu v kombinácií s alkoholom alebo inými liekmi na CNS , pretože môže dôjsť k prekrývajúcim sa nežiaducim reakciám, ako napríklad sedácia (pozri časť 4.8).
Aripiprazol sa má opatrne používať, ak sa podáva súbežne s liekmi, u ktorých je známe, že zapríčiňujú
QT predĺženie alebo elektrolytovú nerovnováhu
Možnýúčinokinýchliekovovplyvniť ABILIFY MAINTENA
Aripiprazol je metabolizovaný mnohopočetnými cestami zahŕňajúcimi enzýmy CYP2D6 a CYP3A4,
ale nie enzýmy CYP1A. Preto nie je potrebná žiadna úprava dávkovania u fajčiarov.
Chinidín a ďalšie silné inhibítory CYP2D6
V klinickom skúšaní perorálneho aripiprazolu u zdravých jedincov silný inhibítor CYP2D6 (chinidín)
aripiprazolu, aktívneho metabolitu, sa znížila o 32 % a jeho Cmax o 47 %. U ďalších silných inhibítorov
CYP2D6, ako napríklad fluoxetínu a paroxetínu, sa môžu očakávať podobné účinky a je preto
potrebné podobné zníženie dávky (pozri časť 4.2).
Ketokonazol a ďalšie silné inhibítory CYP3A4
V klinickom skúšaní perorálneho aripiprazolu u zdravých jedincov silný inhibítor CYP3A4 (ketokonazol) zvýšil hodnotu AUC aripiprazolu o 63 % a hodnotu Cmax o 37 %. Hodnota AUC dehydro-aripiprazolu sa zvýšila o 77 % a jeho hodnota Cmax o 43 %. U pacientov so zníženou metabolickou aktivitou CYP2D6 môže súbežné používanie silných inhibítorov CYP3A4 spôsobiť vyššie koncentrácie aripiprazolu v plazme v porovnaní s pacientmi s nadmernou metabolickou aktivitou CYP2D6 (pozri časť 4.2).
Pri zvažovaní súbežného podávania ketokonazolu alebo ďalších silných inhibítorov CYP3A4 s aripiprazolom majú potenciálne prínosy prevážiť možné riziká pre pacienta. U ďalších silných inhibítorov CYP3A4, ako napríklad itrakonazol a inhibítory HIV proteázy sa môžu očakávať podobné účinky a preto je potrebné podobné zníženie dávky (pozri časť 4.2).
Po ukončení užívania inhibítora CYP2D6 alebo CYP3A4 sa má dávka lieku ABILIFY MAINTENA zvýšiť na dávku pred začatím súbežnej liečby. Ak sa spolu s týmto liekom súbežne používajú slabé inhibítory CYP3A4 (napr. diltiazem) alebo CYP2D6 (napr. escitalopram), je možné očakávať mierny nárast koncentrácií aripiprazolu v plazme.
Karbamazepín a ďalšie induktory CYP3A4
Po súbežnom podávaní karbamazepínu, silného induktora CYP3A4 a perorálneho aripiprazolu pacientom trpiacich schizofréniou alebo schizoaktívnym ochorením boli geometrické priemery
hodnoty Cmax pre aripiprazol o 68 % nižšie a hodnoty AUC pre aripiprazol o 73 % nižšie v porovnaní s perorálnym podávaním samotného aripiprazolu (30 mg). Podobne u dehydro-aripiprazolu boli geometrické priemery hodnoty Cmax po súbežnom podaní karbamazepínu nižšie o 69 % a hodnoty
AUC o 71 % nižšie ako tie po samostatnej liečbe perorálnym aripiprazolom.
Súbežné podávanie lieku ABILIFY MAINTENA a ďalších induktorov CYP3A4 (ako napríklad rifampicínu, rifabutínu, fenytoínu, fenobarbitalu, primidonu, efavirenzu, nevirapínu a ľubovníka bodkovaného) môže mať podobné účinky. Súbežnému používaniu induktorov CYP3A4 s liekom ABILIFY MAINTENA by sa malo vyvarovať, pretože hladiny aripiprazolu v krvi sú znížené a môžu sa nachádzať pod účinnou hranicou.
Valproát a lítium
Pri súbežnom podávaní valproátu alebo lítia s aripiprazolom nedošlo k žiadnej klinicky významnej zmene v koncentrácii aripiprazolu, a preto nie je potrebná žiadna úprava dávky pri podávaní valproátu
alebo lítia spolu s liekom ABILIFY MAINTENA.
Potenciál lieku ABILIFY MAINTENA ovplyvniť iné lieky
V klinických štúdiách perorálne dávky 10 – 30 mg/deň aripiprazolu nemali výrazný vplyv na
metabolizmus substrátov CYP2D6 (pomer dextrometorfanu/3-metoxymorfinanu), 2C9 (warfarín),
2C19 (omeprazol) a 3A4 (dextrometorfan). Aripiprazol a dehydro-aripiprazol okrem toho nepreukázali potenciál pre zmenu metabolizmu sprostredkovaného CYP1A2 in vitro. ABILIFY MAINTENA preto pravdepodobne nespôsobí klinicky významné liekové interakcie sprostredkované týmito enzýmami.
Pri súbežnom podávaní aripiprazolu a lamotrigínu, dextrometorfanu, warfarínu, omeprazolu, escitalopramu alebo venlafaxínu nedošlo k žiadnej klinicky významnej zmene v koncentráciách týchto liekov. Pri súbežnom podávaní týchto liekov s liekom ABILIFY MAINTENA preto nie je potrebná žiadna úprava dávkovania
Serotonínový syndróm
Prípady serotonínového syndrómu boli hlásené u pacientov užívajúcich aripiprazol a možné znaky a
príznaky tohto stavu sa môžu vyskytnúť hlavne v prípadoch súbežného používania s inými serotonergnými liekmi, ako napríklad SSRI/SNRI alebo s liekmi, u ktorých je známe, že zvyšujú koncentrácie aripiprazolu (pozri časť 4.8).
4.6 Fertilita, gravidita a laktácia
G
r
avidita
Nie sú k dispozícii dostatočné a dobre kontrolované štúdie aripiprazolu u gravidných žien. Boli
hlásené vrodené anomálie, no príčinná súvislosť s aripirazolom nebola stanovená. Štúdie na zvieratách nemohli vylúčiť možnosť vývojovej toxicity (pozri časť 5.3). Pacientky majú byť poučené, aby svojmu lekárovi oznámili, ak otehotnejú alebo ak plánujú otehotnieť počas liečby liekom ABILIFY MAINTENA. Vzhľadom na nedostatočné informácie o bezpečnosti u ľudí a obavám vyvolaných reprodukčnými štúdiami na zvieratách sa tento liek nemá podávať počas gravidity, pokiaľ očakávaný prínos liečby zreteľne neprevýši potenciálne riziko pre plod.
Lekári si musia byť vedomí dlhotrvajúcich vlastností lieku ABILIFY MAINTENA.
Novorodenci vystavení antipsychotikám (vrátane aripiprazolu) v treťom trimestri tehotenstva sú vystavení riziku výskytu nežiaducich reakcií vrátane extrapyramídových a/alebo abstinenčných príznakov, ktoré sa môžu líšiť závažnosťou a trvaním po pôrode. Boli hlásené prípady agitovanosti, hypertónie, hypotónie, trasu, ospalosti, dýchacích ťažkostí alebo porúch kŕmenia. V dôsledku toho majú byť novorodenci starostlivo sledovaní.(pozri časť 4.8).
Laktácia
Aripiprazol sa vylučuje do materského mlieka. Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu liekom ABILIFY MAINTENA sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Na základe údajov zo štúdií reprodukčnej toxicity aripiprazol nemal negatívny vplyv na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek ABILIFY MAINTENA má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje z dôvodu možného účinku na nervový systém a zrak, ako je napríklad sedácia, somnolencia, synkopa, rozmazané videnie (pozri časť 4.8). Pacientom sa má odporučiť, aby neviedli vozidlá ani neobsluhovali stroje, pokiaľ nie je známa ich individuálna citlivosť na tento liek.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie pozorované nežiaduce účinky lieku (ADR) hlásené u ≥ 5 % pacientov v dvoch dvojito
zaslepených kontrolovaných klinických skúšaniach s liekom ABILIFY MAINTENA boli prírastok telesnej hmotnosti (9,0 %), akatízia (7,9 %), insomnia (5,8 %) a bolesť v mieste vpichu injekcie
(5,1 %).
Tabuľkový zoznamnežiaducichreakcií
Výskyt nežiaducich účinkov lieku (ADR) spojených s liečbou aripiprazolom je uvedený v tabuľke
nižšie. Tabuľka vychádza z nežiaducich udalostí hlásených počas klinických skúšaní a/alebo po
uvedení na trh.
Všetky nežiaduce účinky lieku sú zoradené podľa triedy orgánových systémov a frekvencie: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až
< 1/1 000), veľmi zriedkavé ((< 1/10 000) a neznáme (z dostupných údajov). Pri každej frekvencii
výskytu sú nežiaduce reakcie zoradené podľa klesajúcej závažnosti.
Frekvenciu výskytu nežiaducich reakcií hlásených po uvedení na trh nie je možné určiť, pretože pochádzajú zo spontánnych hlásení. Frekvencia výskytu týchto nežiaducich udalostí je následne klasifikovaná ako „neznáma“.
| Časté
| Menej časté
| Neznáme
|
Poruchy krvi a
lymfatického systému
|
| Neutropénia
Anémia
Trombocytopénia
Pokles počtu neutrofilov
Pokles počtu bielych
krviniek
| Leukopénia
|
Poruchy
imunitného systému
|
| Hypersenzitivita
| Alergická reakcia
(napr. anafylaktická reakcia, angioedém vrátane napuchnutého jazyka, edému jazyka, edému tváre, vyrážky alebo urtikárie)
|
Poruchy endokrinného
systému
|
| Pokles hladiny prolaktínu v
krvi
| Diabetická
hyperosmolárna kóma
Diabetická ketoacidóza
|
Poruchy metabolizmu a výživy
| Nárast telesnej
hmotnosti
Diabetes mellitus
Zníženie
telesnej hmotnosti
| Hyperglykémia
Hypercholesterolémia
Hyperinzulinémia
Hyperlipidémia Hypertriglyceridémia Porucha chuti do jedla
| Anorexia
Hyponatriémia
|
Psychické poruchy
| Agitovanosť
Úzkosť
Nepokoj
Insomnia
| Samovražedné predstavy
Psychické poruchy
Halucinácie Klamné predstavy Hypersexualita Panické reakcie Depresia Afektívna labilita Apatia
Dysfória Poruchy spánku Bruxizmus Znížené libido Zmena nálady
| Dokončená
samovražda
Pokus o samovraždu Patologické hráčstvo Nervozita
|
Poruchy nervového
systému
| Extrapyramídov
á porucha
Akatízia Tremor Dyskinéza Sedácia Somnolencia Závrat
Bolesť hlavy
| Dystónia
Tardívna dyskinéza
Parkinsonizmus Porucha pohybu Psychomotorická hyperaktivita
Syndróm nepokojných nôh
Rigidita (fenomén ozubeného kolesa)
Hypertónia
Bradykinéza
| Malígny neuroleptický
syndróm
Záchvat typu grand mal, serotonínový syndróm
Poruchy reči
|
|
Č
asté
|
Menej časté
|
N
eznáme
|
|
|
Slintanie
Porucha chuti
Porucha čuchu
|
|
P
oruchy oka
|
|
Okulogyrická kríza
Rozmazané videnie
Bolesť oka
|
|
P
oruchy srdca a
srdcovej
činnosti
|
|
Ventrikulárne extrasystoly
Bradykardia
Tachykardia
Pokles amplitúdy T-vlny na elektrokardiograme
Elektrokardiogram mimo
normy
Inverzia T-vlny na elektrokardiograme
|
Náhla nevysvetliteľná
smrť
Zástava srdca Torsades de pointes Ventrikulárne arytmie, Predĺženie intervalu QT
|
P
oruchy ciev
|
|
Hypertenzia
Ortostatická hypotenzia
Zvýšenie krvného tlaku
|
Synkopa
Venózna tromboembólia
(vrátane pľúcnej
embólie a trombózy hlbokých žíl)
|
P
oruchy
dýchacej sústavy, hrudníka a mediastína
|
|
Kašeľ
|
Orofaryngeálny
spazmus Laryngospazmus Aspiračná pneumónia
|
P
oruchy gastrointestin álneho traktu
|
Sucho v ústach
|
Gastroezofágová refluxná
choroba
Dyspepsia
Vracanie Hnačka Nauzea
Bolesť v hornej časti brušnej
dutiny
Abdominálne ťažkosti
Zápcha
Častá stolica
Hypersekrécia slín
|
Pankreatitída
Dysfágia
|
P
oruchy pečene a žlčových ciest
|
|
Testy funkcie pečene mimo
normy
Zvýšenie hladiny
pečeňových enzýmov Zvýšenie hladiny alanínaminotransferázy Zvýšenie hladiny gamaglutamyltransferázy Zvýšenie hladiny bilirubínu v krvi
Zvýšenie hladiny aspartátaminotransferázy
|
Zlyhanie pečene
Žltačka
Hepatitída
Zvýšenie hladiny alkalickej fosfatázy
|
P
oruchy kože a podkožného
t
kaniva
|
|
Alopécia
Akné
Ružovka Ekzém Indurácia kože
|
Vyrážka
Fotosenzitívna reakcia
Hyperhidróza
|
|
Č
asté
|
Menej časté
|
N
eznáme
|
P
oruchy
kostrovej a svalovej sústavy a spojivového tkaniva
|
Muskuloskeletál
na stuhnutosť
|
Rigidita svalov
Svalové spazmy Svalové zášklby Napätie svalov Myalgia
Bolesti končatín
Artralgia
Bolesť chrbta
Zníženie rozsahu pohybu
kĺbov Stuhnutie šije Trizmus
|
Rabdomyolýza
|
P
oruchy
obličiek a močových ciest
|
|
Nefrolitiáza
Glykozúria
|
Zadržiavanie moču,
Močová inkontinencia
|
Stavy v gravidite, v
šestonedelí a perinatálnom
období
|
|
|
Neonatálny
abstinenčný syndróm
(pozri časť 4.6)
|
P
oruchy
reprodukčnéh o systému a prsníkov
|
Poruchy erekcie
|
Galaktorea
Gynekomastia Citlivosť prsníkov Vulvovaginálna suchosť
|
Priapizmus
|
C
elkové poruchy a
reakcie v mieste
podania
|
Bolesť v mieste
vpichu injekcie
Indurácia v mieste vpichu injekcie Únava
|
Pyrexia
Asténia
Poruchy chôdze Dyskomfort na hrudníku Reakcia v mieste vpichu injekcie
Erytém v mieste vpichu injekcie
Opuch v mieste vpichu
injekcie
Dyskomfort v mieste vpichu injekcie
Pruritus v mieste vpichu
injekcie
Smäd
Lenivosť
|
Porucha regulácie
teploty (napr. hypotermia, pyrexia)
Bolesť v hrudníku
Periférny edém
|
L
aboratórne
a funkčné
vyšetrenia
|
Zvýšenie
hladiny kreatínfosfokiná
zy v krvi
|
Zvýšenie glukózy v krvi
Pokles glukózy v krvi
Zvýšenie glykozylovaného hemoglobínu
Nárast obvodu pásu
Pokles cholesterolu v krvi
Pokles triglyceridov v krvi
|
Kolísanie glukózy v
krvi
|
O
pis vybraných nežiaducich reakcií
Reakcie v mieste vpichu injekcie
Počas dvojito zaslepených kontrolovaných fáz dvoch skúšaní boli pozorované reakcie v mieste vpichu injekcie. Väčšinou boli mierne až stredne závažné a časom ustúpili. Bolesť v mieste vpichu injekcie (výskyt 5,1 %) priemerne nastupuje na 2. deň po podaní injekcie a v priemere trvá 4 dni.
LeukopéniaNeutropénia bola hlásená v klinickom programe s liekom ABILIFY MAINTENA a väčšinou začína
okolo 16. dňa po prvej injekcii a trvá priemerne 18 dní.
Extrapyramídové symptómy (EPS)V skúšaniach u stabilných pacientov trpiacich schizofréniou bola liečba liekom ABILIFY MAINTENA spojená s vyššou frekvenciou výskytu príznakov EPS (18,4 %) ako pri liečbe perorálnym aripiprazolom. Akatízia bola najčastejšie pozorovaným príznakom (8,2 %) a väčšinou začína okolo 10. dňa po prvej injekcii a trvá priemerne 56 dní.
Jedinci s akatíziou väčšinou dostávali v rámci liečby anticholinergné lieky, hlavne benzatropín mesilát a trihexyfenidyl. Menej často boli podané liečivá ako propranolol a benzodiazepíny (klonazepam a diazepam) na liečbu akatízie.
Vo výskyte nasledoval parkinsonizmus (6,9 % ABILIFY MAINTENA, 4,15 % perorálny aripiprazol vo forme 10 – 30 mg tabliet a 3,0 % placebo).
DystóniaSkupinový účinok: príznaky dystónie, predĺžené abnormálne sťahy skupín svalov, sa môžu vyskytnúť u citlivých jednotlivcov počas prvých dní liečby. Dystonické symptómy zahŕňajú spazmus krčných svalov, niekedy rozvíjajúci sa do uzavretia hrdla, ťažkosti s prehĺtaním, ťažkosti s dýchaním a/alebo vystúpením jazyka. Zatiaľ čo tieto príznaky sa môžu vyskytnúť pri nízkych dávkach, vyskytujú sa častejšie a sú závažnejšie s vysokým potenciálom pri vyšších dávkach antipsychotík prvej generácie. Zvýšené riziko akútnej dystónie je pozorované u mužov a mladších vekových skupín.
Telesná hmotnosťPočas dvojito zaslepenej aktívne kontrolovanej fázy 38-týždňovej štúdie bol výskyt prírastku telesnej

hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 9,5 % pre skupinu , ktorej bol podávaný liek ABILIFY MAINTENA, a 11,7 % pre skupinu užívajúcu perorálne podávaný aripiprazol vo forme tabliet 10 – 30 mg. Výskyt poklesu telesnej hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 10,2 % pre skupinu užívajúcu liek ABILIFY MAINTENA a 4,5 % pre skupinu užívajúcu perorálne podávaný aripiprazol vo forme tabliet 10 – 30 mg.

Počas dvojito zaslepenej placebom kontrolovanej fázy 52-týždňového skúšania bol výskyt prírastku telesnej hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 6,4 % pre skupinu, ktorej bol podávaný liek ABILIFY MAINTENA, a 5,2 % pre skupinu užívajúcu placebo. Výskyt poklesu
telesnej hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 6,4 % pre skupinu, ktorej bol

podávaný liek ABILIFY MAINTENA, a 6,7 % pre skupinu užívajúcu placebo. Počas dvojito zaslepenej liečby bola priemerná zmena telesnej hmotnosti z východiskovej hodnoty po poslednú
návštevu -0,2 kg pre liek ABILIFY MAINTENA a -0,4 kg pre placebo (P = 0,812).
ProlaktínPočas dvojito zaslepenej aktívne kontrolovanej fázy 38-týždňového skúšania sa vyskytol priemerný
pokles hladiny prolaktínu z východiskovej hodnoty po poslednú návštevu pre skupinu, ktorej bol podávaný liek ABILIFY MAINTENA (–0,33 ng/ml) v porovnaní s priemerným nárastom pre skupinu užívajúcu perorálne podávaný aripiprazol vo forme tabliet 10 – 30 mg (0,79 ng/ml, p < 0,01). Výskyt
u pacientov, ktorým bol podávaný liek ABILIFY MAINTENA s hladinami prolaktínu > 1-násobok
hornej hranice normálneho rozsahu (ULN), bol pri akomkoľvek hodnotení 5,4 % v porovnaní s 3,5 %
u pacientov užívajúcich perorálny aripiprazol vo forme tabliet 10 – 30 mg. U mužov bol výskyt vo všeobecnosti vyšší ako u žien v každej liečenej skupine.
Počas dvojito zaslepenej kontrolovanej fázy 52-týždňového skúšania sa vyskytol priemerný pokles hladiny prolaktínu z východiskovej hodnoty po poslednú návštevu pre skupinu, ktorej bol podávaný liek ABILIFY MAINTENA (–0,38 ng/ml), v porovnaní s priemerným nárastom pre skupinu, ktorej bolo podávané placebo (1,67 ng/ml). Výskyt u pacientov užívajúcich liek ABILIFY MAINTENA s hladinami prolaktínu > 1-násobok hornej hranice normálneho rozsahu (ULN) bol 1,9 % v porovnaní so 7,1 % u pacientov, ktorej bolo podávané placebo.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovaniePočas klinických štúdií s liekom ABILIFY MAINTENA neboli hlásené žiadne prípady predávkovania spojené s nežiaducimi reakciami. Je nutná opatrnosť, aby nedošlo k náhodnému vstreknutiu tohto lieku do cievy. Po každom potvrdenom alebo potenciálne náhodnom predávkovaní/neúmyselnom intravenóznom podaní je potrebné dôkladné sledovanie pacienta a ak sa vyskytnú potenciálne lekársky závažné znaky alebo príznaky, vyžaduje sa monitorovanie vrátane nepretržitého monitorovania EKG. Lekársky dohľad a monitorovanie majú pokračovať dovtedy, kým sa pacient nezotaví.
Simulácia náhleho uvoľnenia dávky preukázala, že predpokladané priemerné koncentrácie aripiprazolu dosiahnu najvyššiu hodnotu 4 500 ng/ml alebo približne 9-násobok horného terapeutického rozsahu. V prípade náhleho uvoľnenia dávky sa predpokladá, že koncentrácie aripiprazolu rýchlo poklesnú na hornú hranicu terapeutického okna približne po 3 dňoch. Na 7. deň priemerné koncentrácie aripiprazolu naďalej klesajú na úroveň koncentrácie po intramuskulárnej depotnej dávke bez náhleho uvoľnenia dávky. Predávkovanie je menej pravdepodobné pri parenterálnom podávaní ako pri perorálnom užívaní, a preto sú nižšie uvedené referenčné informácie pre predávkovanie perorálnym aripiprazolom.
Znaky a príznakyPočas klinických skúšaní a postmarketingového obdobia sa náhodné alebo úmyselné akútne predávkovanie samotným aripiprazolom vyskytlo u dospelých pacientov s hlásenými odhadovanými dávkami až do 1 260 mg (41-násobok najvyššej odporúčanej dennej dávky aripiprazolu) bez fatálnych následkov. Potenciálne medicínsky dôležité sledované znaky a príznaky zahŕňali letargiu, zvýšenie krvného tlaku, somnolenciu, tachykardiu, nauzeu, vracanie a hnačku. Ďalej sa získali aj správy náhodného predávkovania samotným perorálnym aripiprazolom (do 195 mg) u detí bez smrteľných prejavov. Medzi potenciálne medicínsky závažné znaky a príznaky patrila ospalosť, prechodná strata vedomia a extrapyramidové symptómy.
Liečba predávkovaniaLiečba predávkovania sa má zamerať na podpornú liečbu, udržiavanie voľných dýchacích ciest, okysličenie a ventiláciu, a na liečbu príznakov. Musí sa zvážiť možnosť pôsobenia ďalších liekov. Preto sa má okamžite začať monitorovanie kardiovaskulárneho systému vrátane priebežného elektrokardiografického monitorovania na odhalenie možných arytmií. Po akomkoľvek potvrdenom alebo podozrivom predávkovaní aripiprazolom má byť pacient dôkladne sledovaný lekárom a monitorovaný dovtedy, kým sa nezotaví.
HemodialýzaAj napriek tomu, že neexistujú žiadne informácie o účinku hemodialýzy v liečbe predávkovania, nie je pravdepodobné, že by hemodialýza bola užitočná v liečbe predávkovania, pretože sa aripiprazol vo veľkej miere viaže na plazmatické proteíny.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: psycholeptiká, ďalšie antipsychotiká, ATC kód: N05AX12
Mechanizmus účinkuPredpokladá sa, že účinnosť aripiprazolu pri schizofrénii sprostredkuje kombinácia čiastočného
agonizmu receptorov dopamínu D2a serotonínu 5-HT1A a antagonizmus receptorov serotonínu 5- HT2A. Aripiprazol vyvolal na zvieracích modeloch antagonistické vlastnosti dopaminergnej
hyperaktivity a agonistické vlastnosti dopaminergnej hypoaktivity. Aripiprazol vyvoláva vysokú
afinitu in vitro k receptorom dopamínu D2a D3, serotonínu 5-HT1A a 5HT2A a má miernu afinitu k receptorom dopamínu D4, serotonínu 5-HT2C a 5-HT7, alfa1-adrenergným receptorom a receptorom histamínu H1. Aripiprazol vyvolal aj miernu afinitu k miestam spätného vychytávania serotonínu a žiadnu významnú afinitu k cholinergným muskarínovým receptorom. Interakcia s receptormi iného podtypu ako dopamínových a serotonínových receptorov môže vysvetľovať niektoré z ďalších klinických účinkov aripiprazolu.
Perorálne dávky aripiprazolu v rozsahu od 0,5 do 30 mg podávané jedenkrát denne zdravým jedincom po dobu 2 týždňov vyvolali dávkovo závislú redukciu väzby 11C-raklopridu, ligandu D2/D3 receptora na caudatus a putamen zistenú pozitrónovou emisnou tomografiou.
Ďalšie informácie o klinickýchskúšaniach:Udržiavacia liečba schizofrénie u dospelých pacientovÚčinnosť lieku ABILIFY MAINTENA v udržiavacej liečbe pacientov trpiacich schizofréniou bola
stanovená v dvoch randomizovaných dvojito zaslepených skúšaniach.
Pivotné 38-týždňové, randomizované, dvojito zaslepené, aktívne kontrolované skúšanie bolo navrhnuté na stanovenie účinnosti, bezpečnosti a znášanlivosti tohto lieku podávaného vo forme injekcie raz mesačne v porovnaní s dávkou perorálneho aripiprazolu vo forme tabliet 10 – 30 mg raz denne ako udržiavacej terapie u dospelých pacientov trpiacich schizofréniou. Skúšanie pozostávalo zo skríningovej fázy a z 3 liečebných fáz: fázy konverzie, fázy perorálnej stabilizácie a dvojito zaslepenej aktívne kontrolovanej fázy.
Šesťstošesťdesiatdva pacientov prijatých do 38-týždňovej dvojito zaslepenej, aktívne kontrolovanej fázy bolo náhodne rozdelených v pomere 2 : 2 : 1 do dvojito zaslepenej liečby do jednej z 3 liečebných skupín: 1) ABILIFY MAINTENA 2) stabilizačná dávka perorálneho aripiprazolu 10 –
30 mg alebo 3) aripiprazol s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg. Aripiprazol s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg bol zahrnutý v skupine s nízkou dávkou aripiprazolu na účely testovania citlivosti analýzy pre non-inferiórny dizajn.
Výsledky analýzy primárneho výsledku účinnosti (odhadovaný podiel pacientov zažívajúcich príznaky
blížiaceho sa relapsu koncom 26. týždňa dvojito zaslepenej aktívne kontrolovanej fázy) preukázali, že
liek ABILIFY MAINTENA 400 mg/300 mg sa neodlišuje od perorálnych tabliet aripiprazolu 10 –
30 mg.
Odhadovaná frekvencia relapsu koncom 26. týždňa bola 7,12 % v skupine užívajúcej liek ABILIFY MAINTENA a 7,76 % v skupine užívajúcej perorálne tablety aripiprazolu 10 – 30 mg, t. j. rozdiel –
0,64 %. 95 % CI (–5,26, 3,99) pre rozdiel v odhadovanom podiele pacientov, u ktorých sa vyskytli príznaky blížiaceho sa relapsu koncom 26. týždňa, vylučuje vopred definovaný non-inferiórny okraj,
11,5 %. Liek ABILIFY MAINTENA sa preto neodlišuje od perorálnych tabliet aripiprazolu 10 –
30 mg.

Odhadovaný podiel pacientov, u ktorých sa vyskytli príznaky blížiaceho sa relapsu koncom 26. týždňa v skupine užívajúcej liek ABILIFY MAINTENA, bol 7,12 %, čo bolo štatisticky výrazne menej ako v skupine s aripiprazolom s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg (21,80 %,
p = 0,0006). Potvrdila sa preto nadradenosť lieku ABILIFY MAINTENA nad aripiprazolom s
Kaplan-Meierove krivky obdobia od randomizácie do príznakov blížiaceho sa relapsu v 38. týždni dvojito zaslepenej liečebnej fázy pre skupiny, ktorej bol podávaný liek ABILIFY MAINTENA, perorálny aripiprazol 10 – 30 mg a aripiprazol s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg sú zobrazené na obrázku 1.
 Obrázok 1 Kaplan-Meierov graf hranice lieku merajúci čas do zhoršenia psychotickýchpríznakov/príznakov blížiaceho sa relapsu
Obrázok 1 Kaplan-Meierov graf hranice lieku merajúci čas do zhoršenia psychotickýchpríznakov/príznakov blížiaceho sa relapsu




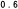
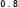







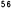

















































ARIP IMD 50 mg/25 mg
POZNÁMKA: ARIP IMD 400/300 mg = ABILIFY MAINTENA ARIP 10-30 mg = perorálny aripiprazol, ARIP IMD 50/25 mg =

s dlhotrvajúcim účinkom, injekčný
Non-inferioritu lieku ABILIFY MAINTENA v porovnaní s perorálnym aripiprazolom 10 – 30 mg podporujú výsledky analýzy stupnice pozitívneho a negatívneho syndrómu pre schizofréniu (PANSS).
Tabuľka 1 Celkové skóre PANSS – Zmena z východiskovej hodnoty po 38. týždeň-LOCF:Randomizovaná vzorka na stanovenie účinnosti a,bCelkové skóre PANSS – Zmena z východiskovej hodnoty po 38. týždeň-LOCF: Randomizovaná vzorka na stanovenie účinnosti a,b
|
| ABILIFY
MAINTENA
400 mg/300 mg
(n = 263)
| Perorálny
aripiprazol
10 – 30 mg/deň
(n = 266)
| Aripiprazol s dlhotrvajúcim
účinkom, injekčný roztok 50
mg/25 mg
(n = 131)
|
Stredná východisková
hodnota (SD)
| 57,9 (12,94)
| 56,6 (12,65)
| 56,1 (12,59)
|
Stredná zmena
(SD)
| –1,8 (10,49)
| 0,7 (11,60)
| 3,2 (14,45)
|
P-hodnota
| Neaplikovateľné
| 0,0272
| 0,0002
|
a: Negatívne zmeny skóre indikujú zlepšenie.
b: Zahrnutí boli iba pacienti s východiskovou hodnotou a s minimálne jednou hodnotou po východiskovej hodnote. P-hodnoty boli odvodené z porovnania pre zmenu východiskovej hodnoty v rámci analýzy kovariančného modelu s liečbou v čase a východiskovou hodnotou ako kovarianciou.
Druhé skúšanie bolo 52-týždňové randomizované dvojito zaslepené skúšanie stiahnutia lieku vykonané v Spojených štátoch u dospelých pacientov s aktuálnou diagnózou schizofrénie. Toto skúšanie pozostávalo zo skríningovej fázy a zo 4 liečebných fáz: konverzie, perorálnej stabilizácie, stabilizácie s liekom ABILIFY MAINTENA a dvojito zaslepenej placebom kontrolovanej fázy.
Pacienti spĺňajúci požiadavky na perorálnu stabilizáciu vo fáze perorálnej stabilizácie boli pridelení na
podávanie lieku ABILIFY MAINTENA jednostranne zaslepenou metódou a začali stabilizačnú fázu s liekom ABILIFY MAINTENA trvajúcu minimálne 12 týždňov a maximálne 36 týždňov. Pacienti prijatí do dvojito zaslepenej, placebom kontrolovanej fázy boli náhodne rozdelení v pomere 2 : 1 do dvojito zaslepenej liečby liekom ABILIFY MAINTENA alebo placebom.
Finálna analýza účinnosti obsahovala 403 randomizovaných pacientov a 80 zhoršení psychotických príznakov/príznakov blížiaceho sa relapsu. V skupine s placebom sa u 39,6 % pacientov prejavil blížiaci sa relaps, zatiaľčo v skupine s liekom ABILIFY MAINTENA sa blížiaci relaps vyskytol u 10
% pacientov. Pacienti v skupine s placebom mali preto 5,03-násobne vyššie riziko výskytu príznakov blížiaceho sa relapsu.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom ABILIFY MAINTENA vo všetkých podskupinách pediatrickej populácie pre schizofréniu (pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Absorpcia aripiprazolu do systémového obehu je po podaní lieku ABILIFY MAINTENA pomalá a
predĺžená z dôvodu nízkej rozpustnosti častíc aripiprazolu.
Priemerný polčas absorpcie lieku ABILIFY MAINTENA je 28 dní. Absorpcia aripiprazolu
z intramuskulárnej depotnej formulácie úplne zodpovedala intramuskulárnej štandardnej formulácii (s okamžitým uvoľňovaním). Hodnoty cmax po úprave dávky pre depotnú formuláciu boli približne 5 % cmax pri intramuskulárnej štandardnej formulácii.
Po podaní viacerých intramuskulárnych dávok sa koncentrácie aripiprazolu v plazme postupne zvýšia
a v stabilizovanom stave dosiahnu maximálnu plazmatickú koncentrácie pri mediáne Tmax 5 – 7 dní. Menej ako úmerne s dávkou sa zvyšuje koncentrácia aripiprazolu a dehydro-aripiprazolu a AUC parametre sú pozorované po injekcii lieku ABILIFY MAINTENA 300 mg až 400 mg podanej každý mesiac.
Distribúcia
Na základe výsledkov zo skúšaní s perorálne podávaným aripiprazolom sa aripiprazol distribuuje široko do celého tela so zjavným objemom distribúcie 4,9 l/kg, čo navodzuje rozsiahlu
extravaskulárnu distribúciu. Pri terapeutických koncentráciách sa aripiprazol a dehydro-aripiprazol vo viac ako 99 % viažu na sérové proteíny, pričom sa primárne viažu na albumín.
Biotransformácia
Aripiprazol sa v rozsiahlej miere metabolizuje v pečeni hlavne tromi biotransformačnými cestami:
dehydrogenáciou, hydroxyláciou a N-dealkyláciou. Na základe in-vitro štúdií sú enzýmy CYP3A4 a CYP2D6 zodpovedné za dehydrogenáciu a hydroxyláciu aripiprazolu a N-dealkylácia je katalyzovaná enzýmom CYP3A4. Aripiprazol tvorí hlavný podiel lieku v systémovom obehu. Po podaní viacnásobnej dávky lieku ABILIFY MAINTENA dehydro-aripiprazol, aktívny metabolit, predstavuje približne 29,1-32,5 % AUC aripiprazolu v plazme.
Eliminácia
Po podaní viacnásobnej dávky 400 mg alebo 300 mg lieku ABILIFY MAINTENA je stredný polčas terminálnej eliminácie aripiprazolu 46,5 dní alebo 29,9 dní, pravdepodobne z dôvodu kinetických vlastností obmedzených rýchlosťou absorpcie. Po jednotlivej perorálnej dávke aripiprazolu označeného [14C] bolo približne 27 % podanej rádioaktívnej látky zistenej v moči a približne 60 % v stolici. Menej ako 1 % nezmeneného aripiprazolu sa vylúčilo močom a približne 18 % sa vylúčilo v nezmenenej forme stolicou.
Farmakokinetika u špeciálnych skupín pacientov
Pacienti so známou zníženou metabolickou aktivitou CYP2D6
Na základe hodnotenia farmakokinetických vlastností ABILIFY MAINTENA u populácie bol celkový telesný klírens aripiprazolu 3,71 l/h u pacientov so známou nadmernou metabolickou aktivitou CYP2D6 a približne 1,88 l/h (približne o 50 % nižší) u pacientov so známou zníženou metabolickou aktivitou CYP2D6 (pre odporúčanie dávky pozri časť 4.2).
Staršie osoby
Po perorálnom podaní aripiprazolu sa nepreukázali žiadne rozdiely vo farmakokinetických vlastnostiach aripiprazolu medzi zdravými staršími osobami a mladšími dospelými osobami. Podobne
pri analýze farmakokinetických vlastností ABILIFY MAINTENA u populácie pacientov trpiacich
schizofréniou sa nevyskytol žiadny stanoviteľný účinok veku.
Pohlavie
Po perorálnom podaní aripiprazolu sa nepreukázali žiadne rozdiely vo farmakokinetických vlastnostiach aripiprazolu medzi zdravými mužmi a ženami. Podobne pri analýze farmakokinetických
vlastností lieku ABILIFY MAINTENA u populácie počas klinických štúdii u pacientov trpiacich
schizofréniou sa nevyskytol žiadny klinicky významný účinok pohlavia.
Fajčenie
Hodnotenie farmakokinetických vlastností populácie s perorálnym aripiprazolom nepreukázalo výskyt
žiadnych klinicky relevantných účinkov fajčenia na farmakokinetické vlastnosti aripiprazolu.
Rasa
Hodnotenie farmakokinetických vlastností populácie nepreukázalo výskyt žiadnych rozdielov spojených s rasou na farmakokinetické vlastnosti aripiprazolu.'
Poruchafunkcieobličiek
V štúdii jednej dávky perorálne podávaného aripiprazolu boli farmakokinetické vlastnosti aripiprazolu a dehydro-aripiprazolu podobné u pacientov so závažnou poruchou funkcie obličiek ako u mladých
zdravých jedincov.
Poruchafunkciepečene
Štúdia jednej dávky perorálne podávaného aripiprazolu osobám s rôznymi stupňami cirhózy pečene
(Child-Pughove triedy A, B a C) neodhalila výrazný účinok poškodenej funkcie pečene na farmakokinetické vlastnosti aripiprazolu a dehydro-aripiprazolu, avšak štúdia zahŕňala iba 3 pacientov s cirhózou pečene triedy C, čo nie je dostatočné na odvodenie záverov o ich metabolickej kapacite.
5.3 Predklinické údaje o bezpečnosti
Toxikologický profil aripiprazolu podávaného testovaným zvieratám vo forme intramuskulárnej injekcie je všeobecne podobný profilu po perorálnom podaní pri porovnateľných plazmatických hladinách. Pri intramuskulárnej injekcii sa však v mieste vpichu objavila zápalová reakcia a pozostávala z granulomatózneho zápalu, ložísk (uložené liečivo), celulárnych infiltrátov, edému (opuch) a u opíc z fibrózy. Tieto účinky postupne vymizli spolu s ukončením dávkovania.
Predklinické údaje o bezpečnosti perorálne podávaného aripiprazolu získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
Perorálny aripiprazol
Pri perorálnom aripiprazole boli toxikologicky významné účinky pozorované iba pri dávkach alebo expozíciách, ktoré dostatočne presahovali maximálnu dávku u ľudí alebo expozíciu, čo naznačilo, že
tieto účinky boli obmedzené alebo nemali význam pre klinickú prax. Zahŕňa to: adrenokortikálnu
toxicitu u potkanov závislú na dávke po 104 týždňoch perorálneho podávania približne 3- až 10- násobku priemernej hodnoty AUC v stabilizovanom stave pri maximálnej odporúčanej dávke u ľudí a zväčšené adrenokortikálne karcinómy a kombinované adrenokortikálne adenómy/karcinómy u samíc potkanov pri približne 10-násobku priemernej hodnoty AUC v stabilizovanom stave pri maximálnej
odporúčanej dávke u ľudí. Najvyššia netumorogénna expozícia u samíc potkanov bola približne 7-
násobok expozície u ľudí pri odporúčanej dávke.
Doplňujúcim nálezom bola cholelitiáza ako následok precipitácie sulfátových konjugátov hydroximetabolitov aripiprazolu v žlči opíc po opakovanom perorálnom dávkovaní 25 až
125 mg/kg/deň alebo približne 16 až 81-násobok maximálnej odporúčanej dávky u ľudí na základe
mg/m2.
Koncentrácie sulfátových konjugátov hydroxy-aripiprazolu v ľudskej žlči v najvyššej navrhovanej
dávke 30 mg denne však netvorili viac ako 6 % koncentrácie v žlči stanovenej u opíc v 39. týždni štúdie a sú výrazne nižšie (6 %) ako hranice ich in-vitro rozpustnosti.
V štúdiách opakovanej dávky u mladých potkanov a psov bol profil toxicity aripiprazolu porovnateľný s profilom pozorovaným u dospelých zvierat a nevyskytol sa dôkaz neurotoxicity alebo nežiaducich účinkov na vývoj.
Na základe kompletného rozsahu štandardných testov genotoxicity sa aripiprazol nepokladá za
genotoxický. Aripiprazol v reprodukčných štúdiách toxicity nepoškodil fertilitu.
Toxicita vo vývoji vrátane oneskorenej osifikácie plodu závislej na dávke a možných teratogénnych
účinkov, bola pozorovaná u potkanov pri dávkach spôsobujúcich subterapeutické expozície (na základe AUC) a u králikov pri dávkach spôsobujúcich expozície približne 3- a 11-násobne vyššie ako priemerná hodnota AUC v stabilizovanom stave pri maximálnej odporúčanej klinickej dávke. Zistilo sa, že dávky podobné tým, ktoré vyvolali vývojovú toxicitu boli toxické aj pre matku.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok
Karmelóza sodná
Manitol
Monohydrát dihydrogénfosforečnanu sodného
Hydroxid sodný
Disperzné prostredie
Voda na injekciu
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
Po rekonštitúcii
Chemická a fyzikálna stabilita v stave pripravenom na použitie bola stanovená na 4 hodiny pri teplote do 25 °C. Z mikrobiologického hľadiska, pokiaľ spôsob otvárania/rekonštitúcie nevylučuje riziko
mikrobiálnej kontaminácie, produkt sa má okamžite použiť. Pokiaľ sa nepoužije okamžite, čas a
podmienky stability v stave pripravenom na použitie sú zodpovednosťou používateľa. Pred vstreknutím injekčnú liekovku minimálne 60 sekúnd riadne pretrepávajte, aby sa obsah rozpustil.
Rekonštituovanú suspenziu neuchovávajte v striekačke.
6.4 Špeciálne upozornenia na uchovávanie
Neuchovávajte v mrazničke.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
300 mg prášok:
Injekčná liekovka zo skla typu I s laminovanou gumovou zátkou a zapečatená odtrhávacím hliníkovým viečkom.
Disperzné prostredie:
2 ml injekčná liekovka zo skla typu I s laminovanou gumovou zátkou a zapečatená odtrhávacím hliníkovým viečkom.
Viacnásobné balenie
Hromadné balenie 3 samostatných balení.
Každé samostatné balenie obsahuje jednu injekčnú liekovku s práškom, 2 ml injekčnú liekovku s disperzným prostredím, jednu 3 ml striekačku typu Luer lock s vopred nasadenou 38 mm (1,5 palca) hypodermickou bezpečnostnou ihlou veľkosti 21 G s ochrannou pomôckou na ihlu, jednu 3 ml jednorazovú striekačku s hrotom typu Luer lock, jeden adaptér na injekčnú liekovku, jednu 38 mm (1,5 palca) hypodermickú bezpečnostnú ihlu veľkosti 21 G s ochrannou pomôckou na ihlu a jednu
50 mm (2 palce) hypodermickú bezpečnostnú ihlu veľkosti 21 G s ochrannou pomôckou na ihlu
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
1. krok: Príprava pred rekonštitúciou prášku.
(a) Rozložte si jednotlivé komponenty a skontrolujte, či sú v balení:
- injekčná liekovka s práškom,
- injekčná liekovka s 2 ml disperzného prostredia,
- jedna 3 ml striekačka typu Luer lock s vopred nasadenou 38 mm (1,5 palca) hypodermickou
bezpečnostnou ihlou veľkosti 21 G s ochrannou pomôckou na ihlu,
- jedna 3 ml jednorazová striekačka s hrotom typu Luer lock,
- jeden adaptér na injekčnú liekovku,
- jedna 38 mm (1,5 palca) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu,
- jedna 50 mm (2 palca) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu.
(b) Prášok rozpustite pomocou disperzného prostredia dodávaného v obale.
(c) Zvoľte potrebné množstvo disperzného prostredia na rekonštitúciu.
300 mg injekčná liekovka: pridajte 1,5 ml disperzného prostredia na rekonštitúciu prášku
Dôležité: injekčná liekovka s disperzným prostredím obsahuje nadbytočné možstvo.
2. krok: Rekonštitúcia prášku
(a) Odstráňte viečka z injekčnej liekovky s disperzným prostredím a s práškom a vrchné časti utrite
sterilným alkoholovým tampónom.
(b) Pomocou striekačky s vopred nasadenou ihlou natiahnite vopred stanovený objem disperzného
prostredia z injekčnej liekovky s disperzným prostredím do striekačky (pozri obrázok 1). Malé množstvo zvyškového disperzného prostredia zostane po natiahnutí v injekčnej liekovke. Všetko nadbytočné množstvo zlikvidujte.

Obrázok 1
(c) Disperzné prostredie pomaly vstreknite do injekčnej liekovky s práškom (pozri obrázok 2).
Obrázok 2
(d) Natiahnite vzduch, aby ste vyrovnali tlak v liekovke jemným spätným potiahnutím piestu.
Následne ihlu odstráňte z liekovky. Metódou jednej ruky nasaďte ochrannú pomôcku na ihlu (pozri obrázok 3). Jemne potlačte puzdro proti plochému povrchu, pokiaľ ihla pevne nezapadne do ochranného puzdra na ihlu. Vizuálne overte, či ihla úplne zapadla do ochranného puzdra na ihlu a zlikvidujte ju.

Obrázok 3
(e)
Injekčnúliekovkuriadne pretrepávajte podobu30sekúnd,kýmsuspenzianebudevyzeraťhomogénne(pozri obrázok 4).
Obrázok 4
(f) Pred podaním vizuálne skontrolujte, či rekonštituovaná suspenzia neobsahuje cudzie častice alebo či nezmenila farbu. Rekonštituovaný liek je biela až sivobiela tekutá suspenzia. Nepoužívajte, ak rekonštituovaná suspenzia obsahuje cudzie častice alebo zmenila farbu.
(g) Ak sa injekcia nepodá okamžite po rekonštitúcii, injekčnú liekovku uchovávajte pri teplote do
25 °C maximálne 4 hodiny a pred vstreknutím injekčnú liekovku minimálne 60 sekúnd riadne
pretrepávajte, aby sa obsah rozpustil.
(h) Rekonštituovanú suspenziu neuchovávajte v striekačke.
3. krok: Príprava pred podaním injekcie
(a) Odstráňte kryt, adaptér však nevyberajte z obalu (pozri obrázok 5).

Obrázok 5
(b) Pomocou obalu na adaptér manipulujte s adaptérom na injekčnú liekovku a pripojte vopred
zabalenú striekačku typu Luer lock na adaptér na injekčnú liekovku (pozri obrázok 6).
Obrázok 6
(c) Pomocou striekačky typu Luer lock odstráňte adaptér na injekčnú liekovku z obalu a zlikvidujte
obal na adaptér (pozri obrázok 7).
Nikdy sa nedotýkajte hrotu adaptéra. Obrázok 7 (d) Určite odporúčaný objem na podanie injekcie.
Rekonštituovaný objem suspenzie ABILIFY MAINTENA určený na vstreknutie300 mg injekčná liekovka
|
Dávka
| Objem určený na
vstreknutie
|
---
| ---
|
300 mg
| 1,5 ml
|
200 mg
| 1,0 ml
|
160 mg
| 0,8 ml
|
(e) Vrchnú časť injekčnej liekovky s rekonštituovanou suspenziou utrite sterilným alkoholovým
tampónom.
(f) Umiestnite a podržte injekčnú liekovku s rekonštituovanou suspenziou na tvrdom povrchu.
Pripojte súpravu adaptéra a striekačky na injekčnú liekovku pridržaním vonkajšej časti adaptéra a pevným pritlačením hrotu adaptéra cez gumenú zátku, pokým adaptér nezapadne do správnej
polohy (pozri obrázok 8).

Obrázok 8
(g) Pomaly natiahnite odporúčaný objem z injekčnej liekovky do striekačky typu Luer lock, aby ste umožnili vstreknutie (pozri obrázok 9).
Malémnožstvonadbytočného lieku zostanevinjekčnejliekovke.
4. krok: Postup podania injekcie:
Obrázok 9
(a) Odpojte striekačku typu Luer lock obsahujúcu odporúčaný objem rekonštituovanej suspenzie
ABILIFY MAINTENA z injekčnej liekovky.
(b) Zvoľte jednu z nasledujúcich hypodermických bezpečnostných ihiel podľa telesnej hmotnosti pacienta a pripojte ihlu ku striekačke typu Luer lock obsahujúcu suspenziu na injekciu.
Stlačením a otočením v smere hodinových ručičiek overte, či ihla pevne drží v ochrannej
pomôcke na ihlu a následne odstráňte kryt z ihly (obrázok 10).
• 38 mm (1,5 palca) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu pre neobéznych pacientov.
• 50 mm (2 palce) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu pre obéznych pacientov.

Obrázok 10
(c) Pomaly vstreknite odporúčaný objem ako jednu intramuskulárnu injekciu do sedacieho svalu.
Miesto vpichu injekcie nemasírujte. Je potrebná opatrnosť, aby nedošlo k náhodnému
vstreknutiu do cievy. Nevstrekujte do oblasti s príznakmi zápalu, poškodeniami pokožky, s
hrčami alebo s modrinami.
5. krok: Postup po podaní injekcie:(a) Nasaďte ochrannú pomôcku na ihlu tak, ako je opísané v 2. kroku (d). Po podaní injekcie
injekčné liekovky, adaptér, ihly a striekačku zlikvidujte.
Injekčné liekovky s práškom a s disperzným prostredím sú len na jednorazové použitie.
(b) Nezabudnite, že miesta vpichu injekcie je potrebné striedať medzi dvoma sedacími svalmi.
(c) Sledujte znaky a príznaky náhodného intravenózneho podania.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIOtsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Veľká Británia
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/13/882/003
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: {DD mesiac RRRR}
10. DÁTUM REVÍZIE TEXTU{DD mesiac RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
ABILIFY MAINTENA 400 mg prášok a disperzné prostredie na injekčnú suspenziu s predĺženým uvoľňovaním
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá injekčná liekovka obsahuje 400 mg aripiprazolu.
Po rekonštitúcii každý ml suspenzie obsahuje 200 mg aripiprazolu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Prášok a disperzné prostredie na injekčnú suspenziu s predĺženým uvoľňovaním
Prášok: biely až sivobiely
Disperzné prostredie: číry roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
ABILIFY MAINTENA je indikovaná na udržiavaciu liečbu schizofrénie u dospelých pacientov
stabilizovaných perorálnym podávaním aripiprazolu .
4.2 Dávkovanie a spôsob podávania
Dávkovanie
U pacientov, ktorí nikdy neužívali aripiprazol, sa má overiť pred začatím liečby liekom ABILIFY
MAINTENA znášanlivosť perorálne podávaného aripiprazolu.
Odporúčaná úvodná a udržiavacia dávka lieku ABILIFY MAINTENA je 400 mg.
Titrácia dávky tohto lieku nie je potrebná. Má sa podávať raz mesačne ako jedna injekcia (nie skôr ako
26 dní po predchádzajúcej injekcii).
Po prvej injekcii sa má pokračovať v liečbe perorálnym aripiprazolom 10 mg až 20 mg 14 po sebe nasledujúcich dní na zachovanie terapeutickej koncentrácie aripiprazolu počas začatí liečby.
Ak sa pri dávkovaní 400 mg objavia nežiaduce účinky, má sa zvážiť zníženie dávky na 300 mg raz
mesačne.
Vynechané dávky
V
ynechané dávky
|
A
k došlo k vynechaniu 2. alebo
3. dávky a od poslednej injekcie uplynuli:
|
O
patrenie
|
> 4 týždne a < 5 týždňov
|
Injekcia sa má podať čo najskôr a následne obnoviť
mesačný plán podávania injekcií.
|
> 5 týždňov
|
Má sa podať ďalšia injekcia a súčasne obnoviť
užívanie perorálneho aripiprazolu po dobu 14 dní,
následne obnoviť mesačný plán podávania injekcií.
|
A
k došlo k vynechaniu 4.
.
alebo nasledovných dávok (t. j. po
dosiahnutí stabilizovaného stavu)
a od poslednej injekcie uplynuli:
|
O
patrenie
|
> 4 týždne a < 6 týždňov
|
Injekcia sa má podať čo najskôr a následne obnoviť
mesačný plán podávania injekcií.
|
> 6 týždňov
|
Má sa podať ďalšia injekcia a súčasne obnoviť
užívanie perorálneho aripiprazolu po dobu 14 dní,
následne obnoviť mesačný plán podávania injekcií.
|
Špeciálne populácie
Starší pacienti
Bezpečnosť a účinnosť lieku ABILIFY MAINTENA pri liečbe schizofrénie u pacientov vo veku
65 rokov a starších nebola stanovená (pozri časť 4.4).
Porucha funkcie obličiekU pacientov s poruchou funkcie obličiek nie je potrebná úprava dávkovania (pozri časť 5.2).
Porucha funkcie pečeneU pacientov s miernou alebo stredne závažnou poruchou funkcie pečene nie je potrebná úprava dávkovania. U pacientov s ťažkou poruchou funkcie pečene dostupné údaje nie sú dostatočné na stanovenie odporúčania. U týchto pacientov vyžadujúcich opatrnosť pri dávkovaní sa má uprednostniť perorálne podávanie (pozri časť 5.2).
Pacienti so známou zníženou metabolickou aktivitou CYP2D6U pacientov, u ktorých je známa znížená metabolická aktivita CYP2D6, má byť úvodná a udržiavacia
dávka 300 mg. Pri súbežnom používaní so silnými inhibítormi CYP3A4 sa má dávka znížiť na 200 mg
(pozri časť 4.5).
Úprava dávkovania pri interakciáchÚprava dávky je potrebná u pacientov, ktorí súbežne užívajú silné inhibítory CYP3A4 alebo silné inhibítory CYP2D6 dlhšie ako 14 dní. Ak sa skončí užívanie inhibítoru CYP3A4 alebo inhibítoru
CYP2D6, môže byť potrebné zvýšiť dávkovanie na predchádzajúcu dávku (pozri časť 4.5). V prípade
výskytu nežiaducich reakcií aj po úprave dávkovania lieku ABILIFY MAINTENA je potrebné
opätovne zvážiť potrebu súbežného podávania inhibítora CYP2D6 alebo CYP3A4.
Súbežnému používaniu induktorov CYP3A4 s liekom ABILIFY MAINTENA dlhšie ako 14 dní sa má vyvarovať, pretože hladiny aripiprazolu v krvi sú znížené a môžu sa nachádzať pod hladinou účinnosti (pozri časť 4.5).
Ú
prava dávky lieku ABILIFY MAINTENA u pacientov, ktorí súbežne užívajú silné inhibítory
CY
P
2D6, silné inhibítory CYP3A4 a/alebo induktory CYP3A4 dlhšie ako 14 dní
|
U
pravená dávka
|
P
acienti užívajúci 400 mg lieku ABILIFY MAINTENA
|
Silné inhibítory CYP2D6 alebo CYP3A4
|
300 mg
|
Silné inhibítory CYP2D6 a CYP3A4
|
200 mg
|
Induktor CYP3A4
|
Vyvarujte sa použitiu
|
P
acienti užívajúci 300 mg lieku ABILIFY MAINTENA
|
Silné inhibítory CYP2D6 alebo CYP3A4
|
200 mg
|
Silné inhibítory CYP2D6 a CYP3A4
|
160 mg
|
Induktor CYP3A4
|
Vyvarujte sa použitiu
|
Pediatrická populácia
Bezpečnosť a účinnosť lieku ABILIFY MAINTENA u detí a dospievajúcich vo veku 0 – 17 rokov nebola stanovená. K dispozícii nie sú žiadne údaje.
Spôsob podávaniaLiek ABILIFY MAINTENA je určený len na intramuskulárne použitie a nesmie sa podávať
intravenózne ani subkutánne. Má ho podať iba zdravotnícky profesionál. Suspenzia sa má podať
okamžite po rekonštitúcii možno ju však uchovávať pri teplote do 25 °C maximálne 4 hodiny v injekčnej liekovke. Suspenzia sa má vstreknúť pomaly ako jednorazová injekcia (dávky sa nesmú rozdeliť) do sedacieho svalu. Je potrebné dávať pozor, aby nedošlo k náhodnému vstreknutiu do cievy. Miesto vpichu injekcie sa má striedať medzi dvoma sedacími svalmi.
Odporúčaná ihla na podanie je hypodermická bezpečnostná ihla veľkosti 38 mm (1,5 palca), 21 G. U obéznych pacientov (index telesnej hmotnosti > 28 kg/m2) sa má použiť hypodermická bezpečnostná ihla veľkosti 50 mm (2 palce), 21 G (pozri časť 6.6).
Injekčné liekovky na prášok a disperzné prostredie sú určené len na jednorazové použitie.
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníPočas liečby antipsychotikami sa môže zlepšenie klinického stavu pacienta prejaviť po niekoľkých dňoch až niekoľkých týždňoch. Počas celého tohto obdobia majú byť pacienti starostlivo monitorovaní.
SamovraždaPri psychických ochoreniach je výskyt samovražedného správania sprievodným javom a v niektorých prípadoch bolo hlásené krátko po začatí alebo zmene antipsychotickej liečby, vrátane liečby
aripiprazolom (pozri časť 4.8). Dôkladné sledovanie vysoko rizikových pacientov má byť súčasťou
antipsychotickej liečby.
Kardiovaskulárne poruchyLiek ABILIFY MAINTENA sa má opatrne používať u pacientov so známou kardiovaskulárnou chorobou (anamnéza infarktu myokardu alebo ischemickej choroby srdca, srdcového zlyhania alebo odchýlok vedenia), s cerebrovaskulárnym ochorením, so stavmi, ktoré spôsobujú u pacientov hypotenziu (dehydratácia, hypovolémia a antihypertenzivna liečba) alebo hypertenziou, vrátane akcelerovanej alebo malígnej.
Boli hlásené prípady žilovej trombembólie pri užívaní antipsychotík. Pretože pacienti liečení antipsychotikami často získajú rizikové faktory pre žilovú trombembóliu, všetky možné rizikové faktory pre žilovú trombembóliu majú byť určené pred a počas liečby liekom ABILIFY MAINTENA a majú sa vykonať preventívne opatrenia. (pozri časť 4.8).
PredĺženieintervaluQT
V klinických štúdiách liečby perorálnym aripiprazolom bol výskyt predĺženia QT intervalu
porovnateľný ako u placeba. Aripiprazol sa má používať opatrne u pacientov s predĺžením QT
intervalu v rodinnej anamnéze (pozri časť 4.8).
Tardívna dyskinéza
V jednoročných alebo v kratších klinických štúdiách boli počas liečby aripiprazolom hlásené
zriedkavé prípady akútnej dyskinézy. Hneď ako sa u pacienta užívajúceho liek ABILIFY MAINTENA objavia znaky a príznaky tardívnej dyskinézy, má sa zvážiť zníženie dávky alebo prerušenie liečby (pozri časť 4.8). Tieto príznaky sa môžu postupom času zhoršovať, alebo môžu vzniknúť dokonca aj
po prerušení liečby.
Neuroleptický malígny syndróm (NMS)
NMS je potenciálne fatálny komplex symptómov súvisiaci s podávaním antipsychotík. V klinických skúšaniach boli počas liečby aripiprazolom hlásené zriedkavé prípady NMS. Klinickými prejavmi
NMS sú hyperpyrexia, svalová stuhnutosť, zmenený duševný stav a dokázateľná nestabilita
autonómneho nervového systému (nepravidelný pulz alebo krvný tlak, tachykardia, diaforéza a
srdcová arytmia). Medzi ďalšie znaky môžu patriť zvýšená hladina kreatínfosfokinázy, myoglobinúria
(rabdomyolýza) a akútne renálne zlyhanie.
Vyskytla sa však aj zvýšená hladina kreatínfosfokinázy a rabdomyolýzy, ktorá nemusí byť nevyhnutne spojená s NMS. Ak u pacientov vyvinú znaky a príznaky svedčiace o NMS, alebo budú mať nevysvetliteľnú vysokú horúčku bez ďalších klinických prejavov NMS, užívanie všetkých antipsychotík vrátane aripiprazolu sa musí ukončiť (pozri časť 4.8).
Záchvat
V klinických štúdiách boli počas liečby aripiprazolom hlásené menej časté prípady záchvatov. Aripiprazol sa preto má podávať opatrne u pacientov, ktorí majú epilepsiu v anamnéze, alebo ktorí majú stavy súvisiace so záchvatmi (pozri časť 4.8).
Starší pacienti s psychózou súvisiacou s demenciou
Zvýšená mortalita
V troch placebom kontrolovaných štúdiách perorálneho aripiprazolu u starších pacientov trpiacich psychózami spojenými s Alzheimerovou chorobou (n = 938, priemerný vek: 82,4 rokov, rozsah: 56 –
99 rokov) bolo u pacientov liečených aripiprazolom, v porovnaní s placebom, zvýšené riziko úmrtia.
Frekvencia úmrtí u pacientov liečených perorálnym aripiprazolom bola 3,5 % v porovnaní s 1,7 %
pacientov v skupine s placebom. Príčiny úmrtí boli síce rôzne, väčšina z nich však bola kardiovaskulárneho (napr. zlyhanie srdca, náhla smrť) alebo infekčného (napr. pneumónia) charakteru (pozri časť 4.8).
Cerebrovaskulárne nežiaduce reakcie
Pri rovnakých štúdiách perorálneho aripiprazolu boli u pacientov hlásené cerebrovaskulárne nežiaduce
reakcie (napr. mŕtvica, prechodný ischemický záchvat), vrátane fatálnych prípadov (priemerný vek:
84 rokov, rozsah: 78-88 rokov). Celkovo boli u 1,3 % z pacientov liečených perorálnym aripiprazolom
hlásené cerebrovaskulárne nežiaduce reakcie v porovnaní s 0,6 % pacientov liečených v rámci týchto štúdií placebom. Tento rozdiel nebol štatisticky významný. V jednej z týchto štúdií, v štúdií s fixnou dávkou, sa však vyskytol výrazný vzťah medzi dávkou a cerebrovaskulárnymi nežiaducimi reakciami u pacientov liečených aripiprazolom (pozri časť 4.8).
Liek ABILIFY MAINTENA nie je určený na liečbu pacientov s psychózou spojenou s demenciou.
H
y
perglykémia a diabetes mellitus
U pacientov, liečených atypickými antipsychotikami zahŕňajúcimi aripiprazol, bola hlásená hyperglykémia, ktorá bola v niektorých prípadoch mimoriadna a spojená s ketoacidózou alebo hyperosmolárnou kómou alebo smrťou. Medzi rizikové faktory, ktoré môžu u pacientov viesť k vážnym komplikáciam, patrí obezita a rodinná anamnéza diabetu. V klinických skúšaniach aripiprazolu neboli významné rozdiely v stupni výskytu s hyperglykémiou súvisiacimi nežiaduci reakciami (zahŕňajúcimi diabetes) alebo v abnormálnych laboratórnych hodnotách glykémie v porovnaní s placebom. Presné odhady rizika výskytu nežiaducich reakcií spojených s hyperglykémiou u pacientov liečených aripiprazolom a inými atypickými antipsychotikami nie sú dostupné, aby sa umožnili priame porovnania. Pacienti liečení ktorýmkoľvek antipsychotikom vrátame aripiprazolu majú byť sledovaní kvôli znakom a príznakom hyperglykémie (napr. polydipsia, polyúria, polyfágia a slabosť) a pacienti s diabetes mellitus alebo s rizikovými faktormi pre diabetes mellitus majú byť pravidelne sledovaní kvôli zhoršeniu glykémie (pozri časť 4.8).
Hypersenzitivita
Pri aripiprazole sa môžu vyskytnúť hypersenzitívne reakcie charakterizované alergickými príznakmi.
Prírastok telesnej hmotnosti
K prírastku telesnej hmotnosti často dochádza u schizofrenických pacientov z dôvodu používania antipsychotík, u ktorých je známe, že spôsobujú prírastok telesnej hmotnosti, z dôvodu sprievodných ochorení, zlého životného štýlu a môže viesť k závažným komplikáciám. Prírastok telesnej hmotnosti bol hlásený postmarketingovo u pacientov, ktorým bol predpísaný perorálny aripiprazol. Zvyčajne je pozorovaný u pacientov s významnými rizikovými faktormi, ako je anamnéza diabetu, porucha štítnej žľazy alebo adenóm hypofýzy. V klinických štúdiách aripiprazolu sa nepreukázalo, že by spôsoboval klinicky významný prírastok telesnej hmotnosti (pozri časť 4.8).
Dysfágia
Ezofageálna dysmotilita a aspirácia súvisia s používaním antipsychotík vrátane aripiprazolu.
Aripiprazol sa má používať opatrne u pacientov s rizikom aspiračnej pneumónie.
Patologickéhráčstvo
Postmarketingové hlásenia patologického hráčstva boli hlásené u pacientov, ktorým bol predpísaný perorálny aripiprazol, bez ohľadu na to, či majú títo pacienti patologické hráčstvo v predošlej
anamnéze. Pacienti s patologickým hráčstvom v predošlej anamnéze môžu mať zvýšené riziko a majú
byť starostlivo monitorovaní (pozri časť 4.8).
4.5 Liekové a iné interakcie
S liekom ABILIFY MAINTENA sa neuskutočnili žiadne špecifické interakčné štúdie. Informácie uvedené nižšie boli získané zo štúdií s perorálnym aripiprazolom.
Z dôvodu jeho antagonizmu voči α1-adrenergnému receptoru má aripiprazol potenciál zlepšovať účinok určitých liekov proti hypertenzii.
Zohľadňujúc primárne účinky aripiprazolu na CNS je potrebná opatrnosť pri podávaní aripiprazolu v kombinácií s alkoholom alebo inými liekmi na CNS , pretože môže dôjsť k prekrývajúcim sa nežiaducim reakciám, ako napríklad sedácia (pozri časť 4.8).
Aripiprazol sa má opatrne používať, ak sa podáva súbežne s liekmi, u ktorých je známe, že zapríčiňujú
QT predĺženie alebo elektrolytovú nerovnováhu
Možnýúčinokiných liekov ovplyvniť ABILIFY MAINTENA
Aripiprazol je metabolizovaný mnohopočetnými cestami zahŕňajúcimi enzýmy CYP2D6 a CYP3A4, ale nie enzýmy CYP1A. Preto nie je potrebná žiadna úprava dávkovania u fajčiarov.
Chinidín a ďalšie silné inhibítory CYP2D6
V klinickom skúšaní perorálneho aripiprazolu u zdravých jedincov silný inhibítor CYP2D6 (chinidín)
aripiprazolu, aktívneho metabolitu, sa znížila o 32 % a jeho Cmax o 47 %. U ďalších silných inhibítorov
CYP2D6, ako napríklad fluoxetínu a paroxetínu, sa môžu očakávať podobné účinky a je preto
potrebné podobné zníženie dávky (pozri časť 4.2).
Ketokonazol a ďalšie silné inhibítory CYP3A4
V klinickom skúšaní perorálneho aripiprazolu u zdravých jedincov silný inhibítor CYP3A4 (ketokonazol) zvýšil hodnotu AUC aripiprazolu o 63 % a hodnotu Cmax o 37 %. Hodnota AUC dehydro-aripiprazolu sa zvýšila o 77 % a jeho hodnota Cmax o 43 %. U pacientov so zníženou metabolickou aktivitou CYP2D6 môže súbežné používanie silných inhibítorov CYP3A4 spôsobiť vyššie koncentrácie aripiprazolu v plazme v porovnaní s pacientmi s nadmernou metabolickou aktivitou CYP2D6 (pozri časť 4.2).
Pri zvažovaní súbežného podávania ketokonazolu alebo ďalších silných inhibítorov CYP3A4 s aripiprazolom majú potenciálne prínosy prevážiť možné riziká pre pacienta. U ďalších silných inhibítorov CYP3A4, ako napríklad itrakonazol a inhibítory HIV proteázy sa môžu očakávať podobné účinky a preto je potrebné podobné zníženie dávky (pozri časť 4.2).
Po ukončení užívania inhibítora CYP2D6 alebo CYP3A4 sa má dávka lieku ABILIFY MAINTENA zvýšiť na dávku pred začatím súbežnej liečby. Ak sa spolu s týmto liekom súbežne používajú slabé inhibítory CYP3A4 (napr. diltiazem) alebo CYP2D6 (napr. escitalopram), je možné očakávať mierny nárast koncentrácií aripiprazolu v plazme.
Karbamazepín a ďalšie induktory CYP3A4
Po súbežnom podávaní karbamazepínu, silného induktora CYP3A4 a perorálneho aripiprazolu pacientom trpiacich schizofréniou alebo schizoaktívnym ochorením boli geometrické priemery
hodnoty Cmax pre aripiprazol o 68 % nižšie a hodnoty AUC pre aripiprazol o 73 % nižšie v porovnaní s perorálnym podávaním samotného aripiprazolu (30 mg). Podobne u dehydro-aripiprazolu boli geometrické priemery hodnoty Cmax po súbežnom podaní karbamazepínu nižšie o 69 % a hodnoty
AUC o 71 % nižšie ako tie po samostatnej liečbe perorálnym aripiprazolom.
Súbežné podávanie lieku ABILIFY MAINTENA a ďalších induktorov CYP3A4 (ako napríklad rifampicínu, rifabutínu, fenytoínu, fenobarbitalu, primidonu, efavirenzu, nevirapínu a ľubovníka bodkovaného) môže mať podobné účinky. Súbežnému používaniu induktorov CYP3A4 s liekom ABILIFY MAINTENA by sa malo vyvarovať, pretože hladiny aripiprazolu v krvi sú znížené a môžu sa nachádzať pod účinnou hranicou.
Valproát a lítium
Pri súbežnom podávaní valproátu alebo lítia s aripiprazolom nedošlo k žiadnej klinicky významnej zmene v koncentrácii aripiprazolu, a preto nie je potrebná žiadna úprava dávky pri podávaní valproátu
alebo lítia spolu s liekom ABILIFY MAINTENA.
Potenciál lieku ABILIFY MAINTENA ovplyvniť iné lieky
V klinických štúdiách perorálne dávky 10 – 30 mg/deň aripiprazolu nemali výrazný vplyv na
metabolizmus substrátov CYP2D6 (pomer dextrometorfanu/3-metoxymorfinanu), 2C9 (warfarín),
2C19 (omeprazol) a 3A4 (dextrometorfan). Aripiprazol a dehydro-aripiprazol okrem toho nepreukázali potenciál pre zmenu metabolizmu sprostredkovaného CYP1A2 in vitro. ABILIFY MAINTENA preto pravdepodobne nespôsobí klinicky významné liekové interakcie sprostredkované týmito enzýmami.
Pri súbežnom podávaní aripiprazolu a lamotrigínu, dextrometorfanu, warfarínu, omeprazolu, escitalopramu alebo venlafaxínu nedošlo k žiadnej klinicky významnej zmene v koncentráciách týchto liekov. Pri súbežnom podávaní týchto liekov s liekom ABILIFY MAINTENA preto nie je potrebná žiadna úprava dávkovania
Serotonínový syndróm
Prípady serotonínového syndrómu boli hlásené u pacientov užívajúcich aripiprazol a možné znaky a príznaky tohto stavu sa môžu vyskytnúť hlavne v prípadoch súbežného používania s inými
serotonergnými liekmi, ako napríklad SSRI/SNRI alebo s liekmi, u ktorých je známe, že zvyšujú
koncentrácie aripiprazolu (pozri časť 4.8).
4.6 Fertilita, gravidita a laktácia
G
r
avidita
Nie sú k dispozícii dostatočné a dobre kontrolované štúdie aripiprazolu u gravidných žien. Boli
hlásené vrodené anomálie, no príčinná súvislosť s aripirazolom nebola stanovená. Štúdie na zvieratách nemohli vylúčiť možnosť vývojovej toxicity (pozri časť 5.3). Pacientky majú byť poučené, aby svojmu lekárovi oznámili, ak otehotnejú alebo ak plánujú otehotnieť počas liečby liekom ABILIFY MAINTENA. Vzhľadom na nedostatočné informácie o bezpečnosti u ľudí a obavám vyvolaných reprodukčnými štúdiami na zvieratách sa tento liek nemá podávať počas gravidity, pokiaľ očakávaný prínos liečby zreteľne neprevýši potenciálne riziko pre plod.
Lekári si musia byť vedomí dlhotrvajúcich vlastností lieku ABILIFY MAINTENA.
Novorodenci vystavení antipsychotikám (vrátane aripiprazolu) v treťom trimestri tehotenstva sú vystavení riziku výskytu nežiaducich reakcií vrátane extrapyramídových a/alebo abstinenčných príznakov, ktoré sa môžu líšiť závažnosťou a trvaním po pôrode. Boli hlásené prípady agitovanosti, hypertónie, hypotónie, trasu, ospalosti, dýchacích ťažkostí alebo porúch kŕmenia. V dôsledku toho majú byť novorodenci starostlivo sledovaní.(pozri časť 4.8).
Laktácia
Aripiprazol sa vylučuje do materského mlieka. Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu liekom ABILIFY MAINTENA sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Na základe údajov zo štúdií reprodukčnej toxicity aripiprazol nemal negatívny vplyv na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek ABILIFY MAINTENA má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje z dôvodu možného účinku na nervový systém a zrak, ako je napríklad sedácia, somnolencia, synkopa, rozmazané videnie (pozri časť 4.8). Pacientom sa má odporučiť, aby neviedli vozidlá ani neobsluhovali stroje, pokiaľ nie je známa ich individuálna citlivosť na tento liek.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie pozorované nežiaduce účinky lieku (ADR) hlásené u ≥ 5 % pacientov v dvoch dvojito
zaslepených kontrolovaných klinických skúšaniach s liekom ABILIFY MAINTENA boli prírastok telesnej hmotnosti (9,0 %), akatízia (7,9 %), insomnia (5,8 %) a bolesť v mieste vpichu injekcie
(5,1 %).
Tabuľkový zoznamnežiaducichreakcií
Výskyt nežiaducich účinkov lieku (ADR) spojených s liečbou aripiprazolom je uvedený v tabuľke
nižšie. Tabuľka vychádza z nežiaducich udalostí hlásených počas klinických skúšaní a/alebo po uvedení na trh.
Všetky nežiaduce účinky lieku sú zoradené podľa triedy orgánových systémov a frekvencie: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až
< 1/1 000), veľmi zriedkavé ((< 1/10 000) a neznáme (z dostupných údajov). Pri každej frekvencii
výskytu sú nežiaduce reakcie zoradené podľa klesajúcej závažnosti.
Frekvenciu výskytu nežiaducich reakcií hlásených po uvedení na trh nie je možné určiť, pretože pochádzajú zo spontánnych hlásení. Frekvencia výskytu týchto nežiaducich udalostí je následne klasifikovaná ako „neznáma“.
| Časté
| Menej časté
| Neznáme
|
Poruchy krvi a
lymfatického systému
|
| Neutropénia
Anémia
Trombocytopénia
Pokles počtu neutrofilov
Pokles počtu bielych
krviniek
| Leukopénia
|
Poruchy
imunitného systému
|
| Hypersenzitivita
| Alergická reakcia
(napr. anafylaktická reakcia, angioedém vrátane napuchnutého jazyka, edému jazyka, edému tváre, vyrážky alebo urtikárie)
|
Poruchy endokrinného
systému
|
| Pokles hladiny prolaktínu v
krvi
| Diabetická
hyperosmolárna kóma
Diabetická ketoacidóza
|
Poruchy metabolizmu a výživy
| Nárast telesnej
hmotnosti
Diabetes mellitus
Zníženie
telesnej hmotnosti
| Hyperglykémia
Hypercholesterolémia
Hyperinzulinémia
Hyperlipidémia Hypertriglyceridémia Porucha chuti do jedla
| Anorexia
Hyponatriémia
|
Psychické poruchy
| Agitovanosť
Úzkosť
Nepokoj
Insomnia
| Samovražedné predstavy
Psychické poruchy
Halucinácie Klamné predstavy Hypersexualita Panické reakcie Depresia Afektívna labilita Apatia
Dysfória Poruchy spánku Bruxizmus Znížené libido Zmena nálady
| Dokončená
samovražda
Pokus o samovraždu Patologické hráčstvo Nervozita
|
Poruchy nervového
systému
| Extrapyramídov
á porucha
Akatízia Tremor Dyskinéza Sedácia Somnolencia Závrat
Bolesť hlavy
| Dystónia
Tardívna dyskinéza
Parkinsonizmus Porucha pohybu Psychomotorická hyperaktivita
Syndróm nepokojných nôh
Rigidita (fenomén ozubeného kolesa)
Hypertónia
Bradykinéza
| Malígny neuroleptický
syndróm
Záchvat typu grand mal, serotonínový syndróm
Poruchy reči
|
|
Č
asté
|
Menej časté
|
N
eznáme
|
|
|
Slintanie
Porucha chuti
Porucha čuchu
|
|
P
oruchy oka
|
|
Okulogyrická kríza
Rozmazané videnie
Bolesť oka
|
|
P
oruchy srdca a
srdcovej
činnosti
|
|
Ventrikulárne extrasystoly
Bradykardia
Tachykardia
Pokles amplitúdy T-vlny na elektrokardiograme
Elektrokardiogram mimo
normy
Inverzia T-vlny na elektrokardiograme
|
Náhla nevysvetliteľná
smrť
Zástava srdca Torsades de pointes Ventrikulárne arytmie, Predĺženie intervalu QT
|
P
oruchy ciev
|
|
Hypertenzia
Ortostatická hypotenzia
Zvýšenie krvného tlaku
|
Synkopa
Venózna tromboembólia
(vrátane pľúcnej
embólie a trombózy hlbokých žíl)
|
P
oruchy
dýchacej sústavy, hrudníka a mediastína
|
|
Kašeľ
|
Orofaryngeálny
spazmus Laryngospazmus Aspiračná pneumónia
|
P
oruchy gastrointestin álneho traktu
|
Sucho v ústach
|
Gastroezofágová refluxná
choroba
Dyspepsia
Vracanie Hnačka Nauzea
Bolesť v hornej časti brušnej
dutiny
Abdominálne ťažkosti
Zápcha
Častá stolica
Hypersekrécia slín
|
Pankreatitída
Dysfágia
|
P
oruchy pečene a žlčových ciest
|
|
Testy funkcie pečene mimo
normy
Zvýšenie hladiny
pečeňových enzýmov Zvýšenie hladiny alanínaminotransferázy Zvýšenie hladiny gamaglutamyltransferázy Zvýšenie hladiny bilirubínu v krvi
Zvýšenie hladiny aspartátaminotransferázy
|
Zlyhanie pečene
Žltačka
Hepatitída
Zvýšenie hladiny alkalickej fosfatázy
|
P
oruchy kože a podkožného
t
kaniva
|
|
Alopécia
Akné
Ružovka Ekzém Indurácia kože
|
Vyrážka
Fotosenzitívna reakcia
Hyperhidróza
|
|
Č
asté
|
Menej časté
|
N
eznáme
|
P
oruchy
kostrovej a svalovej sústavy a spojivového tkaniva
|
Muskuloskeletál
na stuhnutosť
|
Rigidita svalov
Svalové spazmy Svalové zášklby Napätie svalov Myalgia
Bolesti končatín
Artralgia
Bolesť chrbta
Zníženie rozsahu pohybu
kĺbov Stuhnutie šije Trizmus
|
Rabdomyolýza
|
P
oruchy
obličiek a močových ciest
|
|
Nefrolitiáza
Glykozúria
|
Zadržiavanie moču,
Močová inkontinencia
|
Stavy v gravidite, v
šestonedelí a perinatálnom
období
|
|
|
Neonatálny
abstinenčný syndróm
(pozri časť 4.6)
|
P
oruchy
reprodukčnéh o systému a prsníkov
|
Poruchy erekcie
|
Galaktorea
Gynekomastia Citlivosť prsníkov Vulvovaginálna suchosť
|
Priapizmus
|
C
elkové poruchy a
reakcie v mieste
podania
|
Bolesť v mieste
vpichu injekcie
Indurácia v mieste vpichu injekcie Únava
|
Pyrexia
Asténia
Poruchy chôdze Dyskomfort na hrudníku Reakcia v mieste vpichu injekcie
Erytém v mieste vpichu injekcie
Opuch v mieste vpichu
injekcie
Dyskomfort v mieste vpichu injekcie
Pruritus v mieste vpichu
injekcie
Smäd
Lenivosť
|
Porucha regulácie
teploty (napr. hypotermia, pyrexia)
Bolesť v hrudníku
Periférny edém
|
L
aboratórne
a funkčné
vyšetrenia
|
Zvýšenie
hladiny kreatínfosfokiná
zy v krvi
|
Zvýšenie glukózy v krvi
Pokles glukózy v krvi
Zvýšenie glykozylovaného hemoglobínu
Nárast obvodu pásu
Pokles cholesterolu v krvi
Pokles triglyceridov v krvi
|
Kolísanie glukózy v
krvi
|
O
pis vybraných nežiaducich reakcií
Reakcie v mieste vpichu injekcie
Počas dvojito zaslepených kontrolovaných fáz dvoch skúšaní boli pozorované reakcie v mieste vpichu injekcie. Väčšinou boli mierne až stredne závažné a časom ustúpili. Bolesť v mieste vpichu injekcie (výskyt 5,1 %) priemerne nastupuje na 2. deň po podaní injekcie a v priemere trvá 4 dni.
LeukopéniaNeutropénia bola hlásená v klinickom programe s liekom ABILIFY MAINTENA a väčšinou začína
okolo 16. dňa po prvej injekcii a trvá priemerne 18 dní.
Extrapyramídové symptómy (EPS)V skúšaniach u stabilných pacientov trpiacich schizofréniou bola liečba liekom ABILIFY MAINTENA spojená s vyššou frekvenciou výskytu príznakov EPS (18,4 %) ako pri liečbe perorálnym aripiprazolom. Akatízia bola najčastejšie pozorovaným príznakom (8,2 %) a väčšinou začína okolo 10. dňa po prvej injekcii a trvá priemerne 56 dní.
Jedinci s akatíziou väčšinou dostávali v rámci liečby anticholinergné lieky, hlavne benzatropín mesilát a trihexyfenidyl. Menej často boli podané liečivá ako propranolol a benzodiazepíny (klonazepam a diazepam) na liečbu akatízie.
Vo výskyte nasledoval parkinsonizmus (6,9 % ABILIFY MAINTENA, 4,15 % perorálny aripiprazol vo forme 10 – 30 mg tabliet a 3,0 % placebo).
DystóniaSkupinový účinok: príznaky dystónie, predĺžené abnormálne sťahy skupín svalov, sa môžu vyskytnúť u citlivých jednotlivcov počas prvých dní liečby. Dystonické symptómy zahŕňajú spazmus krčných svalov, niekedy rozvíjajúci sa do uzavretia hrdla, ťažkosti s prehĺtaním, ťažkosti s dýchaním a/alebo vystúpením jazyka. Zatiaľ čo tieto príznaky sa môžu vyskytnúť pri nízkych dávkach, vyskytujú sa častejšie a sú závažnejšie s vysokým potenciálom pri vyšších dávkach antipsychotík prvej generácie. Zvýšené riziko akútnej dystónie je pozorované u mužov a mladších vekových skupín.
Telesná hmotnosťPočas dvojito zaslepenej aktívne kontrolovanej fázy 38-týždňovej štúdie bol výskyt prírastku telesnej

hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 9,5 % pre skupinu , ktorej bol podávaný liek ABILIFY MAINTENA, a 11,7 % pre skupinu užívajúcu perorálne podávaný aripiprazol vo forme tabliet 10 – 30 mg. Výskyt poklesu telesnej hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 10,2 % pre skupinu užívajúcu liek ABILIFY MAINTENA a 4,5 % pre skupinu užívajúcu perorálne podávaný aripiprazol vo forme tabliet 10 – 30 mg.

Počas dvojito zaslepenej placebom kontrolovanej fázy 52-týždňového skúšania bol výskyt prírastku telesnej hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 6,4 % pre skupinu, ktorej bol podávaný liek ABILIFY MAINTENA, a 5,2 % pre skupinu užívajúcu placebo. Výskyt poklesu
telesnej hmotnosti ≥ 7 % z východiskovej hodnoty po poslednú návštevu 6,4 % pre skupinu, ktorej bol

podávaný liek ABILIFY MAINTENA, a 6,7 % pre skupinu užívajúcu placebo. Počas dvojito zaslepenej liečby bola priemerná zmena telesnej hmotnosti z východiskovej hodnoty po poslednú
návštevu -0,2 kg pre liek ABILIFY MAINTENA a -0,4 kg pre placebo (P = 0,812).
ProlaktínPočas dvojito zaslepenej aktívne kontrolovanej fázy 38-týždňového skúšania sa vyskytol priemerný pokles hladiny prolaktínu z východiskovej hodnoty po poslednú návštevu pre skupinu, ktorej bol
podávaný liek ABILIFY MAINTENA (–0,33 ng/ml) v porovnaní s priemerným nárastom pre skupinu
užívajúcu perorálne podávaný aripiprazol vo forme tabliet 10 – 30 mg (0,79 ng/ml, p < 0,01). Výskyt u pacientov, ktorým bol podávaný liek ABILIFY MAINTENA s hladinami prolaktínu > 1-násobok hornej hranice normálneho rozsahu (ULN), bol pri akomkoľvek hodnotení 5,4 % v porovnaní s 3,5 % u pacientov užívajúcich perorálny aripiprazol vo forme tabliet 10 – 30 mg. U mužov bol výskyt vo všeobecnosti vyšší ako u žien v každej liečenej skupine.
Počas dvojito zaslepenej kontrolovanej fázy 52-týždňového skúšania sa vyskytol priemerný pokles hladiny prolaktínu z východiskovej hodnoty po poslednú návštevu pre skupinu, ktorej bol podávaný liek ABILIFY MAINTENA (–0,38 ng/ml), v porovnaní s priemerným nárastom pre skupinu, ktorej bolo podávané placebo (1,67 ng/ml). Výskyt u pacientov užívajúcich liek ABILIFY MAINTENA s hladinami prolaktínu > 1-násobok hornej hranice normálneho rozsahu (ULN) bol 1,9 % v porovnaní so 7,1 % u pacientov, ktorej bolo podávané placebo.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovaniePočas klinických štúdií s liekom ABILIFY MAINTENA neboli hlásené žiadne prípady predávkovania spojené s nežiaducimi reakciami. Je nutná opatrnosť, aby nedošlo k náhodnému vstreknutiu tohto lieku do cievy. Po každom potvrdenom alebo potenciálne náhodnom predávkovaní/neúmyselnom intravenóznom podaní je potrebné dôkladné sledovanie pacienta a ak sa vyskytnú potenciálne lekársky závažné znaky alebo príznaky, vyžaduje sa monitorovanie vrátane nepretržitého monitorovania EKG. Lekársky dohľad a monitorovanie majú pokračovať dovtedy, kým sa pacient nezotaví.
Simulácia náhleho uvoľnenia dávky preukázala, že predpokladané priemerné koncentrácie aripiprazolu dosiahnu najvyššiu hodnotu 4 500 ng/ml alebo približne 9-násobok horného terapeutického rozsahu. V prípade náhleho uvoľnenia dávky sa predpokladá, že koncentrácie aripiprazolu rýchlo poklesnú na hornú hranicu terapeutického okna približne po 3 dňoch. Na 7. deň priemerné koncentrácie aripiprazolu naďalej klesajú na úroveň koncentrácie po intramuskulárnej depotnej dávke bez náhleho uvoľnenia dávky. Predávkovanie je menej pravdepodobné pri parenterálnom podávaní ako pri perorálnom užívaní, a preto sú nižšie uvedené referenčné informácie pre predávkovanie perorálnym aripiprazolom.
Znaky a príznakyPočas klinických skúšaní a postmarketingového obdobia sa náhodné alebo úmyselné akútne predávkovanie samotným aripiprazolom vyskytlo u dospelých pacientov s hlásenými odhadovanými dávkami až do 1 260 mg (41-násobok najvyššej odporúčanej dennej dávky aripiprazolu) bez fatálnych následkov. Potenciálne medicínsky dôležité sledované znaky a príznaky zahŕňali letargiu, zvýšenie krvného tlaku, somnolenciu, tachykardiu, nauzeu, vracanie a hnačku. Ďalej sa získali aj správy náhodného predávkovania samotným perorálnym aripiprazolom (do 195 mg) u detí bez smrteľných prejavov. Medzi potenciálne medicínsky závažné znaky a príznaky patrila ospalosť, prechodná strata vedomia a extrapyramidové symptómy.
Liečba predávkovaniaLiečba predávkovania sa má zamerať na podpornú liečbu, udržiavanie voľných dýchacích ciest, okysličenie a ventiláciu, a na liečbu príznakov. Musí sa zvážiť možnosť pôsobenia ďalších liekov. Preto sa má okamžite začať monitorovanie kardiovaskulárneho systému vrátane priebežného elektrokardiografického monitorovania na odhalenie možných arytmií. Po akomkoľvek potvrdenom alebo podozrivom predávkovaní aripiprazolom má byť pacient dôkladne sledovaný lekárom a monitorovaný dovtedy, kým sa nezotaví.
HemodialýzaAj napriek tomu, že neexistujú žiadne informácie o účinku hemodialýzy v liečbe predávkovania, nie je pravdepodobné, že by hemodialýza bola užitočná v liečbe predávkovania, pretože sa aripiprazol vo veľkej miere viaže na plazmatické proteíny.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: psycholeptiká, ďalšie antipsychotiká, ATC kód: N05AX12
Mechanizmus účinkuPredpokladá sa, že účinnosť aripiprazolu pri schizofrénii sprostredkuje kombinácia čiastočného
agonizmu receptorov dopamínu D2a serotonínu 5-HT1A a antagonizmus receptorov serotonínu 5- HT2A. Aripiprazol vyvolal na zvieracích modeloch antagonistické vlastnosti dopaminergnej
hyperaktivity a agonistické vlastnosti dopaminergnej hypoaktivity. Aripiprazol vyvoláva vysokú
afinitu in vitro k receptorom dopamínu D2a D3, serotonínu 5-HT1A a 5HT2A a má miernu afinitu k receptorom dopamínu D4, serotonínu 5-HT2C a 5-HT7, alfa1-adrenergným receptorom a receptorom histamínu H1. Aripiprazol vyvolal aj miernu afinitu k miestam spätného vychytávania serotonínu a žiadnu významnú afinitu k cholinergným muskarínovým receptorom. Interakcia s receptormi iného podtypu ako dopamínových a serotonínových receptorov môže vysvetľovať niektoré z ďalších klinických účinkov aripiprazolu.
Perorálne dávky aripiprazolu v rozsahu od 0,5 do 30 mg podávané jedenkrát denne zdravým jedincom po dobu 2 týždňov vyvolali dávkovo závislú redukciu väzby 11C-raklopridu, ligandu D2/D3 receptora na caudatus a putamen zistenú pozitrónovou emisnou tomografiou.
Ďalšie informácie o klinickýchskúšaniach:Udržiavacia liečba schizofrénie u dospelých pacientovÚčinnosť lieku ABILIFY MAINTENA v udržiavacej liečbe pacientov trpiacich schizofréniou bola
stanovená v dvoch randomizovaných dvojito zaslepených skúšaniach.
Pivotné 38-týždňové, randomizované, dvojito zaslepené, aktívne kontrolované skúšanie bolo navrhnuté na stanovenie účinnosti, bezpečnosti a znášanlivosti tohto lieku podávaného vo forme injekcie raz mesačne v porovnaní s dávkou perorálneho aripiprazolu vo forme tabliet 10 – 30 mg raz denne ako udržiavacej terapie u dospelých pacientov trpiacich schizofréniou. Skúšanie pozostávalo zo skríningovej fázy a z 3 liečebných fáz: fázy konverzie, fázy perorálnej stabilizácie a dvojito zaslepenej aktívne kontrolovanej fázy.
Šesťstošesťdesiatdva pacientov prijatých do 38-týždňovej dvojito zaslepenej, aktívne kontrolovanej fázy bolo náhodne rozdelených v pomere 2 : 2 : 1 do dvojito zaslepenej liečby do jednej z 3 liečebných skupín: 1) ABILIFY MAINTENA 2) stabilizačná dávka perorálneho aripiprazolu 10 –
30 mg alebo 3) aripiprazol s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg. Aripiprazol s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg bol zahrnutý v skupine s nízkou dávkou aripiprazolu na účely testovania citlivosti analýzy pre non-inferiórny dizajn.
Výsledky analýzy primárneho výsledku účinnosti (odhadovaný podiel pacientov zažívajúcich príznaky
blížiaceho sa relapsu koncom 26. týždňa dvojito zaslepenej aktívne kontrolovanej fázy) preukázali, že
liek ABILIFY MAINTENA 400 mg/300 mg sa neodlišuje od perorálnych tabliet aripiprazolu 10 –
30 mg.
Odhadovaná frekvencia relapsu koncom 26. týždňa bola 7,12 % v skupine užívajúcej liek ABILIFY MAINTENA a 7,76 % v skupine užívajúcej perorálne tablety aripiprazolu 10 – 30 mg, t. j. rozdiel –
0,64 %. 95 % CI (–5,26, 3,99) pre rozdiel v odhadovanom podiele pacientov, u ktorých sa vyskytli príznaky blížiaceho sa relapsu koncom 26. týždňa, vylučuje vopred definovaný non-inferiórny okraj,
11,5 %. Liek ABILIFY MAINTENA sa preto neodlišuje od perorálnych tabliet aripiprazolu 10 –
30 mg.

Odhadovaný podiel pacientov, u ktorých sa vyskytli príznaky blížiaceho sa relapsu koncom 26. týždňa v skupine užívajúcej liek ABILIFY MAINTENA, bol 7,12 %, čo bolo štatisticky výrazne menej ako v skupine s aripiprazolom s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg (21,80 %,
p = 0,0006). Potvrdila sa preto nadradenosť lieku ABILIFY MAINTENA nad aripiprazolom s
Kaplan-Meierove krivky obdobia od randomizácie do príznakov blížiaceho sa relapsu v 38. týždni dvojito zaslepenej liečebnej fázy pre skupiny, ktorej bol podávaný liek ABILIFY MAINTENA, perorálny aripiprazol 10 – 30 mg a aripiprazol s dlhotrvajúcim účinkom, injekčný roztok 50 mg/25 mg sú zobrazené na obrázku 1.
 Obrázok 1 Kaplan-Meierov graf hranice lieku merajúci čas do zhoršenia psychotickýchpríznakov/príznakov blížiaceho sa relapsu
Obrázok 1 Kaplan-Meierov graf hranice lieku merajúci čas do zhoršenia psychotickýchpríznakov/príznakov blížiaceho sa relapsu




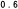
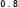
























































ARIP IMD 50 mg/25 mg
POZNÁMKA: ARIP IMD 400/300 mg = ABILIFY MAINTENA ARIP 10-30 mg = perorálny aripiprazol, ARIP IMD 50/25 mg =

s dlhotrvajúcim účinkom, injekčný
Non-inferioritu lieku ABILIFY MAINTENA v porovnaní s perorálnym aripiprazolom 10 – 30 mg podporujú výsledky analýzy stupnice pozitívneho a negatívneho syndrómu pre schizofréniu (PANSS).
Tabuľka 1 Celkové skóre PANSS – Zmena z východiskovej hodnoty po 38. týždeň-LOCF: Randomizovaná vzorka na stanovenie účinnosti a,bCelkové skóre PANSS – Zmena z východiskovej hodnoty po 38. týždeň-LOCF: Randomizovaná vzorka na stanovenie účinnosti a,b
|
| ABILIFY
MAINTENA
400 mg/300 mg
(n = 263)
| Perorálny
aripiprazol
10 – 30 mg/deň
(n = 266)
| Aripiprazol s dlhotrvajúcim
účinkom, injekčný roztok 50
mg/25 mg
(n = 131)
|
Stredná východisková
hodnota (SD)
| 57,9 (12,94)
| 56,6 (12,65)
| 56,1 (12,59)
|
Stredná zmena
(SD)
| –1,8 (10,49)
| 0,7 (11,60)
| 3,2 (14,45)
|
P-hodnota
| Neaplikovateľné
| 0,0272
| 0,0002
|
a: Negatívne zmeny skóre indikujú zlepšenie.
b: Zahrnutí boli iba pacienti s východiskovou hodnotou a s minimálne jednou hodnotou po východiskovej hodnote. P-hodnoty boli odvodené z porovnania pre zmenu východiskovej hodnoty v rámci analýzy kovariančného modelu s liečbou v čase a východiskovou hodnotou ako kovarianciou.
Druhé skúšanie bolo 52-týždňové randomizované dvojito zaslepené skúšanie stiahnutia lieku vykonané v Spojených štátoch u dospelých pacientov s aktuálnou diagnózou schizofrénie. Toto skúšanie pozostávalo zo skríningovej fázy a zo 4 liečebných fáz: konverzie, perorálnej stabilizácie, stabilizácie s liekom ABILIFY MAINTENA a dvojito zaslepenej placebom kontrolovanej fázy.
Pacienti spĺňajúci požiadavky na perorálnu stabilizáciu vo fáze perorálnej stabilizácie boli pridelení na podávanie lieku ABILIFY MAINTENA jednostranne zaslepenou metódou a začali stabilizačnú fázu
s liekom ABILIFY MAINTENA trvajúcu minimálne 12 týždňov a maximálne 36 týždňov. Pacienti
prijatí do dvojito zaslepenej, placebom kontrolovanej fázy boli náhodne rozdelení v pomere 2 : 1 do
dvojito zaslepenej liečby liekom ABILIFY MAINTENA alebo placebom.
Finálna analýza účinnosti obsahovala 403 randomizovaných pacientov a 80 zhoršení psychotických príznakov/príznakov blížiaceho sa relapsu. V skupine s placebom sa u 39,6 % pacientov prejavil blížiaci sa relaps, zatiaľčo v skupine s liekom ABILIFY MAINTENA sa blížiaci relaps vyskytol u 10
% pacientov. Pacienti v skupine s placebom mali preto 5,03-násobne vyššie riziko výskytu príznakov blížiaceho sa relapsu.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom ABILIFY MAINTENA vo všetkých podskupinách pediatrickej populácie pre schizofréniu (pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Absorpcia aripiprazolu do systémového obehu je po podaní lieku ABILIFY MAINTENA pomalá a
predĺžená z dôvodu nízkej rozpustnosti častíc aripiprazolu.
Priemerný polčas absorpcie lieku ABILIFY MAINTENA je 28 dní. Absorpcia aripiprazolu
z intramuskulárnej depotnej formulácie úplne zodpovedala intramuskulárnej štandardnej formulácii (s okamžitým uvoľňovaním). Hodnoty cmax po úprave dávky pre depotnú formuláciu boli približne 5 % cmax pri intramuskulárnej štandardnej formulácii.
Po podaní viacerých intramuskulárnych dávok sa koncentrácie aripiprazolu v plazme postupne zvýšia
a v stabilizovanom stave dosiahnu maximálnu plazmatickú koncentrácie pri mediáne Tmax 5 – 7 dní. Menej ako úmerne s dávkou sa zvyšuje koncentrácia aripiprazolu a dehydro-aripiprazolu a AUC parametre sú pozorované po injekcii lieku ABILIFY MAINTENA 300 mg až 400 mg podanej každý mesiac.
Distribúcia
Na základe výsledkov zo skúšaní s perorálne podávaným aripiprazolom sa aripiprazol distribuuje široko do celého tela so zjavným objemom distribúcie 4,9 l/kg, čo navodzuje rozsiahlu
extravaskulárnu distribúciu. Pri terapeutických koncentráciách sa aripiprazol a dehydro-aripiprazol vo viac ako 99 % viažu na sérové proteíny, pričom sa primárne viažu na albumín.
Biotransformácia
Aripiprazol sa v rozsiahlej miere metabolizuje v pečeni hlavne tromi biotransformačnými cestami:
dehydrogenáciou, hydroxyláciou a N-dealkyláciou. Na základe in-vitro štúdií sú enzýmy CYP3A4 a CYP2D6 zodpovedné za dehydrogenáciu a hydroxyláciu aripiprazolu a N-dealkylácia je katalyzovaná enzýmom CYP3A4. Aripiprazol tvorí hlavný podiel lieku v systémovom obehu. Po podaní viacnásobnej dávky lieku ABILIFY MAINTENA dehydro-aripiprazol, aktívny metabolit, predstavuje približne 29,1-32,5 % AUC aripiprazolu v plazme.
Eliminácia
Po podaní viacnásobnej dávky 400 mg alebo 300 mg lieku ABILIFY MAINTENA je stredný polčas terminálnej eliminácie aripiprazolu 46,5 dní alebo 29,9 dní, pravdepodobne z dôvodu kinetických vlastností obmedzených rýchlosťou absorpcie. Po jednotlivej perorálnej dávke aripiprazolu označeného [14C] bolo približne 27 % podanej rádioaktívnej látky zistenej v moči a približne 60 % v stolici. Menej ako 1 % nezmeneného aripiprazolu sa vylúčilo močom a približne 18 % sa vylúčilo v nezmenenej forme stolicou.
Farmakokinetika u špeciálnych skupín pacientov
Pacienti so známou zníženou metabolickou aktivitou CYP2D6
Na základe hodnotenia farmakokinetických vlastností ABILIFY MAINTENA u populácie bol celkový telesný klírens aripiprazolu 3,71 l/h u pacientov so známou nadmernou metabolickou aktivitou CYP2D6 a približne 1,88 l/h (približne o 50 % nižší) u pacientov so známou zníženou metabolickou aktivitou CYP2D6 (pre odporúčanie dávky pozri časť 4.2).
Staršie osoby
Po perorálnom podaní aripiprazolu sa nepreukázali žiadne rozdiely vo farmakokinetických vlastnostiach aripiprazolu medzi zdravými staršími osobami a mladšími dospelými osobami. Podobne
pri analýze farmakokinetických vlastností ABILIFY MAINTENA u populácie pacientov trpiacich
schizofréniou sa nevyskytol žiadny stanoviteľný účinok veku.
Pohlavie
Po perorálnom podaní aripiprazolu sa nepreukázali žiadne rozdiely vo farmakokinetických vlastnostiach aripiprazolu medzi zdravými mužmi a ženami. Podobne pri analýze farmakokinetických
vlastností lieku ABILIFY MAINTENA u populácie počas klinických štúdii u pacientov trpiacich
schizofréniou sa nevyskytol žiadny klinicky významný účinok pohlavia.
Fajčenie
Hodnotenie farmakokinetických vlastností populácie s perorálnym aripiprazolom nepreukázalo výskyt
žiadnych klinicky relevantných účinkov fajčenia na farmakokinetické vlastnosti aripiprazolu.
Rasa
Hodnotenie farmakokinetických vlastností populácie nepreukázalo výskyt žiadnych rozdielov spojených s rasou na farmakokinetické vlastnosti aripiprazolu.
Poruchafunkcieobličiek
V štúdii jednej dávky perorálne podávaného aripiprazolu boli farmakokinetické vlastnosti aripiprazolu a dehydro-aripiprazolu podobné u pacientov so závažnou poruchou funkcie obličiek ako u mladých
zdravých jedincov.
Poruchafunkciepečene
Štúdia jednej dávky perorálne podávaného aripiprazolu osobám s rôznymi stupňami cirhózy pečene
(Child-Pughove triedy A, B a C) neodhalila výrazný účinok poškodenej funkcie pečene na farmakokinetické vlastnosti aripiprazolu a dehydro-aripiprazolu, avšak štúdia zahŕňala iba 3 pacientov s cirhózou pečene triedy C, čo nie je dostatočné na odvodenie záverov o ich metabolickej kapacite.
5.3 Predklinické údaje o bezpečnosti
Toxikologický profil aripiprazolu podávaného testovaným zvieratám vo forme intramuskulárnej injekcie je všeobecne podobný profilu po perorálnom podaní pri porovnateľných plazmatických hladinách. Pri intramuskulárnej injekcii sa však v mieste vpichu objavila zápalová reakcia a pozostávala z granulomatózneho zápalu, ložísk (uložené liečivo), celulárnych infiltrátov, edému (opuch) a u opíc z fibrózy. Tieto účinky postupne vymizli spolu s ukončením dávkovania.
Predklinické údaje o bezpečnosti perorálne podávaného aripiprazolu získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
Perorálny aripiprazol
Pri perorálnom aripiprazole boli toxikologicky významné účinky pozorované iba pri dávkach alebo expozíciách, ktoré dostatočne presahovali maximálnu dávku u ľudí alebo expozíciu, čo naznačilo, že
tieto účinky boli obmedzené alebo nemali význam pre klinickú prax. Zahŕňa to: adrenokortikálnu
toxicitu u potkanov závislú na dávke po 104 týždňoch perorálneho podávania približne 3- až 10- násobku priemernej hodnoty AUC v stabilizovanom stave pri maximálnej odporúčanej dávke u ľudí a zväčšené adrenokortikálne karcinómy a kombinované adrenokortikálne adenómy/karcinómy u samíc potkanov pri približne 10-násobku priemernej hodnoty AUC v stabilizovanom stave pri maximálnej
odporúčanej dávke u ľudí. Najvyššia netumorogénna expozícia u samíc potkanov bola približne 7- násobok expozície u ľudí pri odporúčanej dávke.
Doplňujúcim nálezom bola cholelitiáza ako následok precipitácie sulfátových konjugátov hydroximetabolitov aripiprazolu v žlči opíc po opakovanom perorálnom dávkovaní 25 až
125 mg/kg/deň alebo približne 16 až 81-násobok maximálnej odporúčanej dávky u ľudí na základe
mg/m2.
Koncentrácie sulfátových konjugátov hydroxy-aripiprazolu v ľudskej žlči v najvyššej navrhovanej
dávke 30 mg denne však netvorili viac ako 6 % koncentrácie v žlči stanovenej u opíc v 39. týždni štúdie a sú výrazne nižšie (6 %) ako hranice ich in-vitro rozpustnosti.
V štúdiách opakovanej dávky u mladých potkanov a psov bol profil toxicity aripiprazolu porovnateľný s profilom pozorovaným u dospelých zvierat a nevyskytol sa dôkaz neurotoxicity alebo nežiaducich účinkov na vývoj.
Na základe kompletného rozsahu štandardných testov genotoxicity sa aripiprazol nepokladá za
genotoxický. Aripiprazol v reprodukčných štúdiách toxicity nepoškodil fertilitu.
Toxicita vo vývoji vrátane oneskorenej osifikácie plodu závislej na dávke a možných teratogénnych
účinkov, bola pozorovaná u potkanov pri dávkach spôsobujúcich subterapeutické expozície (na základe AUC) a u králikov pri dávkach spôsobujúcich expozície približne 3- a 11-násobne vyššie ako priemerná hodnota AUC v stabilizovanom stave pri maximálnej odporúčanej klinickej dávke. Zistilo sa, že dávky podobné tým, ktoré vyvolali vývojovú toxicitu boli toxické aj pre matku.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok
Karmelóza sodná
Manitol
Monohydrát dihydrogénfosforečnanu sodného
Hydroxid sodný
Disperzné prostredie
Voda na injekciu
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
Po rekonštitúcii
Chemická a fyzikálna stabilita v stave pripravenom na použitie bola stanovená na 4 hodiny pri teplote do 25 °C. Z mikrobiologického hľadiska, pokiaľ spôsob otvárania/rekonštitúcie nevylučuje riziko
mikrobiálnej kontaminácie, produkt sa má okamžite použiť. Pokiaľ sa nepoužije okamžite, čas a
podmienky stability v stave pripravenom na použitie sú zodpovednosťou používateľa. Pred vstreknutím injekčnú liekovku minimálne 60 sekúnd riadne pretrepávajte, aby sa obsah rozpustil.
Rekonštituovanú suspenziu neuchovávajte v striekačke.
6.4 Špeciálne upozornenia na uchovávanie
Neuchovávajte v mrazničke.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
400 mg prášok:
Injekčná liekovka zo skla typu I s laminovanou gumovou zátkou a zapečatená odtrhávacím hliníkovým viečkom.
Disperzné prostredie:
2 ml injekčná liekovka zo skla typu I s laminovanou gumovou zátkou a zapečatená odtrhávacím hliníkovým viečkom.
Viacnásobné balenie
Hromadné balenie 3 samostatných balení.
Každé samostatné balenie obsahuje jednu injekčnú liekovku s práškom, 2 ml injekčnú liekovku s disperzným prostredím, jednu 3 ml striekačku typu Luer lock s vopred nasadenou 38 mm (1,5 palca) hypodermickou bezpečnostnou ihlou veľkosti 21 G s ochrannou pomôckou na ihlu, jednu 3 ml jednorazovú striekačku s hrotom typu Luer lock, jeden adaptér na injekčnú liekovku, jednu 38 mm (1,5 palca) hypodermickú bezpečnostnú ihlu veľkosti 21 G s ochrannou pomôckou na ihlu a jednu
50 mm (2 palce) hypodermickú bezpečnostnú ihlu veľkosti 21 G s ochrannou pomôckou na ihlu
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
1. krok: Príprava pred rekonštitúciou prášku.
(a) Rozložte si jednotlivé komponenty a skontrolujte, či sú v balení:
- injekčná liekovka s práškom,
- injekčná liekovka s 2 ml disperzného prostredia,
- jedna 3 ml striekačka typu Luer lock s vopred nasadenou 38 mm (1,5 palca) hypodermickou
bezpečnostnou ihlou veľkosti 21 G s ochrannou pomôckou na ihlu,
- jedna 3 ml jednorazová striekačka s hrotom typu Luer lock,
- jeden adaptér na injekčnú liekovku,
- jedna 38 mm (1,5 palca) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu,
- jedna 50 mm (2 palca) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu.
(b) Prášok rozpustite pomocou disperzného prostredia dodávaného v obale.
(c) Zvoľte potrebné množstvo disperzného prostredia na rekonštitúciu.
400 mg injekčná liekovka: pridajte 1,9 ml disperzného prostredia na rekonštitúciu prášku
Dôležité: injekčná liekovka s disperzným prostredím obsahuje nadbytočné možstvo.
2. krok: Rekonštitúcia prášku
(a) Odstráňte viečka z injekčnej liekovky s disperzným prostredím a s práškom a vrchné časti utrite
sterilným alkoholovým tampónom.
(b) Pomocou striekačky s vopred nasadenou ihlou natiahnite vopred stanovený objem disperzného
prostredia z injekčnej liekovky s disperzným prostredím do striekačky (pozri obrázok 1). Malé množstvo zvyškového disperzného prostredia zostane po natiahnutí v injekčnej liekovke. Všetko nadbytočné množstvo zlikvidujte.

Obrázok 1
(c) Disperzné prostredie pomaly vstreknite do injekčnej liekovky s práškom (pozri obrázok 2).
Obrázok 2
(d) Natiahnite vzduch, aby ste vyrovnali tlak v liekovke jemným spätným potiahnutím piestu.
Následne ihlu odstráňte z liekovky. Metódou jednej ruky nasaďte ochrannú pomôcku na ihlu (pozri obrázok 3). Jemne potlačte puzdro proti plochému povrchu, pokiaľ ihla pevne nezapadne do ochranného puzdra na ihlu. Vizuálne overte, či ihla úplne zapadla do ochranného puzdra na ihlu a zlikvidujte ju.

Obrázok 3
(e)
Injekčnúliekovkuriadne pretrepávajte podobu30sekúnd,kýmsuspenzianebudevyzeraťhomogénne(pozri obrázok 4).
Obrázok 4
(f) Pred podaním vizuálne skontrolujte, či rekonštituovaná suspenzia neobsahuje cudzie častice alebo či nezmenila farbu. Rekonštituovaný liek je biela až sivobiela tekutá suspenzia. Nepoužívajte, ak rekonštituovaná suspenzia obsahuje cudzie častice alebo zmenila farbu.
(g) Ak sa injekcia nepodá okamžite po rekonštitúcii, injekčnú liekovku uchovávajte pri teplote do
25 °C maximálne 4 hodiny a pred vstreknutím injekčnú liekovku minimálne 60 sekúnd riadne
pretrepávajte, aby sa obsah rozpustil.
(h) Rekonštituovanú suspenziu neuchovávajte v striekačke.
3. krok: Príprava pred podaním injekcie
(a) Odstráňte kryt, adaptér však nevyberajte z obalu (pozri obrázok 5).

Obrázok 5
(b) Pomocou obalu na adaptér manipulujte s adaptérom na injekčnú liekovku a pripojte vopred
zabalenú striekačku typu Luer lock na adaptér na injekčnú liekovku (pozri obrázok 6).
Obrázok 6
(c) Pomocou striekačky typu Luer lock odstráňte adaptér na injekčnú liekovku z obalu a zlikvidujte
obal na adaptér (pozri obrázok 7).
Nikdy sa nedotýkajte hrotu adaptéra. Obrázok 7 (d) Určite odporúčaný objem na podanie injekcie.
Rekonštituovaný objem suspenzie ABILIFY MAINTENA určený na vstreknutie400 mg injekčná liekovka
|
Dávka
| Objem určený na
vstreknutie
|
400 mg
| 2,0 ml
|
300 mg
| 1,5 ml
|
200 mg
| 1,0 ml
|
160 mg
| 0,8 ml
|
(e) Vrchnú časť injekčnej liekovky s rekonštituovanou suspenziou utrite sterilným alkoholovým
tampónom.
(f) Umiestnite a podržte injekčnú liekovku s rekonštituovanou suspenziou na tvrdom povrchu.
Pripojte súpravu adaptéra a striekačky na injekčnú liekovku pridržaním vonkajšej časti adaptéra
a pevným pritlačením hrotu adaptéra cez gumenú zátku, pokým adaptér nezapadne do správnej
polohy (pozri obrázok 8).

Obrázok 8
(g) Pomaly natiahnite odporúčaný objem z injekčnej liekovky do striekačky typu Luer lock, aby ste umožnili vstreknutie (pozri obrázok 9).
Malémnožstvonadbytočnéholieku zostanevinjekčnejliekovke.
4. krok: Postup podania injekcie:
Obrázok 9
(a) Odpojte striekačku typu Luer lock obsahujúcu odporúčaný objem rekonštituovanej suspenzie
ABILIFY MAINTENA z injekčnej liekovky.
(b) Zvoľte jednu z nasledujúcich hypodermických bezpečnostných ihiel podľa telesnej hmotnosti pacienta a pripojte ihlu ku striekačke typu Luer lock obsahujúcu suspenziu na injekciu.
Stlačením a otočením v smere hodinových ručičiek overte, či ihla pevne drží v ochrannej
pomôcke na ihlu a následne odstráňte kryt z ihly (obrázok 10).
• 38 mm (1,5 palca) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu pre neobéznych pacientov.
• 50 mm (2 palce) hypodermická bezpečnostná ihla veľkosti 21 G s ochrannou pomôckou na ihlu pre obéznych pacientov.

Obrázok 10
(c) Pomaly vstreknite odporúčaný objem ako jednu intramuskulárnu injekciu do sedacieho svalu.
Miesto vpichu injekcie nemasírujte. Je potrebná opatrnosť, aby nedošlo k náhodnému
vstreknutiu do cievy. Nevstrekujte do oblasti s príznakmi zápalu, poškodeniami pokožky, s
hrčami alebo s modrinami.
5. krok: Postup po podaní injekcie:(a) Nasaďte ochrannú pomôcku na ihlu tak, ako je opísané v 2. kroku (d). Po podaní injekcie
injekčné liekovky, adaptér, ihly a striekačku zlikvidujte.
Injekčné liekovky s práškom a s disperzným prostredím sú len na jednorazové použitie.
(b) Nezabudnite, že miesta vpichu injekcie je potrebné striedať medzi dvoma sedacími svalmi.
(c) Sledujte znaky a príznaky náhodného intravenózneho podania.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIOtsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Veľká Británia
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/13/882/004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: {DD mesiac RRRR}
10. DÁTUM REVÍZIE TEXTU{DD mesiac RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.