
sových faktorov),
- neobvyklá, zvýšená alebo predĺžená fyzická aktivita,
- interkurentné ochorenie (napr. vracanie, hnačka),
- neprimeraný príjem potravy,
- vynechanie jedla,
- konzumácia alkoholu,
- určité nekompenzované poruchy endokrinného systému (napr. pri hypotyreóze a pri nedostatočnej činnosti adenohypofýzy alebo kôry nadobličiek),
- súbežná liečba niektorými inými liekmi.
Injekčná technika
Pacienti musia byť poučení o tom, aby miesto podania injekcie neustále menili, čím sa zníži riziko
vzniku lipodystrofie a kožnej amyloidózy. Na miestach s týmito reakciami existuje potenciálne riziko oneskorenej absorpcie inzulínu a zhoršenej kontroly glykémie po podaní inzulínových injekcií.
V prípade náhlej zmeny miesta podania injekcie na nepostihnutú oblasť bol hlásený vznik
hypoglykémie. Po zmene miesta podania injekcie sa odporúča monitorovanie hladiny glukózy v krvi
a je možné zvážiť úpravu dávky antidiabetík.
Interkurentné ochorenie
Interkurentné ochorenie si vyžaduje intenzívnejšie sledovanie metabolizmu. V mnohých prípadoch sa
indikujú močové testy na ketóny a často sa musí upraviť dávku inzulínu. Nároky na inzulín sú často zvýšené. Pacienti s diabetom mellitus 1. typu musia udržiavať pravidelný prísun aspoň malého
množstva sacharidov, aj keď sú schopní jesť len málo alebo vôbec nie, prípadne vracajú a pod. a nikdy nesmú inzulín úplne vynechať.
Inzulínové protilátky
Podávanie inzulínu môže spôsobiť tvorbu inzulínových protilátok. V ojedinelých prípadoch si môže
prítomnosť inzulínových protilátok vyžadovať úpravu dávky inzulínu, aby sa korigovala tendencia
k hyper- alebo hypoglykémii (pozri časť 5.1).
Perá, ktorésamajúpoužívaťsnáplňami ABASAGLAR
Náplne sa majú používať iba v kombinácii s inzulínovými perami na opakované použitie od
spoločnosti Lilly a nemajú sa používať so žiadnymi inými perami na opakované použitie, pretože sa
s inými perami nezisťovala presnosť dávkovania.
O
m
yly pri použití lieku
Boli hlásené omyly pri použití lieku, kedy boli namiesto inzulínu glargínu náhodne použité iné
inzulíny, najmä krátkodobo účinkujúce. Pred každou injekciou je nutné vždy skontrolovať označenie
na inzulíne, aby sa zabránilo zámene ABASAGLARU za iné inzulíny.
Kombinácia ABASAGLARU s pioglitazónom
Pri súčasnom použití pioglitazónu s inzulínom boli hlásené prípady srdcového zlyhania, predovšetkým
u pacientov s rizikovými faktormi pre rozvoj srdcového zlyhania. Preto je potrebné súčasné použitie pioglitazónu a ABASAGLARU starostlivo zvážiť. V prípade, že sa kombinácia použije,
u pacientov sa musia sledovať znaky a príznaky srdcového zlyhania, prírastku telesnej hmotnosti
a edému. V prípade akéhokoľvek výskytu zhoršenia srdcových príznakov sa musí liečba pioglitazónom ihneď prerušiť.
Obsah sodíka
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t.j. v podstate zanedbateľné
množstvo sodíka.
4.5 Liekové a iné interakcie
Celý rad látok ovplyvňuje glukózový metabolizmus a môže si vyžiadať úpravu dávky inzulínu glargínu.
Medzi látky, ktoré môžu zosilňovať účinok znižujúci hladinu cukru v krvi a zvyšujú náchylnosť na hypoglykémiu, patria: perorálne antidiabetiká, inhibítory enzýmu konvertujúceho angiotenzín (ACE), disopyramid, fibráty, fluoxetín, inhibítory monoaminooxidázy (IMAO), pentoxifylín, propoxyfén, salicyláty, analógy somatostatínu a sulfónamidové antibiotiká.
Medzi látky, ktoré môžu zoslabovať účinok znižujúci hladinu cukru v krvi, patria: kortikosteroidy, danazol, diazoxid, diuretiká, glukagón, izoniazid, estrogény a progestagény, fenotiazínové deriváty, somatropín, sympatomimetiká (napr. epinefrín [adrenalín], salbutamol, terbutalín), tyroidné hormóny, atypické antipsychotické lieky (napr. klozapín a olanzapín) a inhibítory proteázy.
Betablokátory, klonidín, soli lítia alebo alkohol môžu buď zosilňovať alebo zoslabovať účinok inzulínu znižujúci hladinu cukru v krvi. Pentamidín môže spôsobiť hypoglykémiu, po ktorej môže niekedy nasledovať hyperglykémia.
Pod vplyvom sympatolytík, ako sú betablokátory, klonidín, guanetidín a rezerpín, sa naviac môžu oslabiť alebo chýbať príznaky adrenergickej kontraregulácie.
4.6 Fertilita, gravidita a laktácia
Gravidita
Z kontrolovaných klinických štúdii nie sú k dispozícii žiadne klinické údaje o gravidných ženách
vystavených účinku inzulínu glargínu. Údaje o veľkom počte gravidných žien (závery z počtu viac ako 1000 gravidít) vystavených účinku inzulínu glargínu nepreukázali žiadne špecifické nežiaduce účinky inzulínu glargínu na graviditu a nepreukázali žiadne špecifické malformácie ani toxicitu inzulínu glargínu pre plod/novorodenca.
Údaje získané u zvierat nepreukázali reprodukčnú toxicitu.
Ak je to klinicky potrebné, môže sa zvážiť použitie ABASAGLARU počas gravidity.
Pre pacientky s predtým existujúcou alebo gestačnou cukrovkou je dôležité udržiavanie dobrej metabolickej kontroly počas gravidity, aby sa zabránilo nepriaznivým následkom súvisiacim s hyperglykémiou. Nároky na inzulín môžu počas prvého trimestra poklesnúť a v druhom a treťom trimestri všeobecne stúpajú. Okamžite po pôrode nároky na inzulín rapídne klesnú (zvýšené riziko hypoglykémie). Nevyhnutné je starostlivé sledovanie glykémie.
DojčenieNie je známe, či sa inzulín-glargín vylučuje do materského mlieka. Nepredpokladajú sa žiadne
metabolické účinky požitého inzulínu glargínu na dojčeného novorodenca/dieťa, keďže inzulín-glargín ako peptid sa spracováva na aminokyseliny v ľudskom tráviacom trakte.
Dojčiacim matkám možno bude treba upraviť dávky inzulínu a diétu.
FertilitaŠtúdie na zvieratách nepreukázali priame škodlivé účinky na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNásledkom hypoglykémie alebo hyperglykémie, alebo napríklad ako dôsledok zhoršenia zraku, sa môže zhoršiť pacientova schopnosť sústrediť sa a reagovať. To môže predstavovať riziko
v situáciách, kedy sú tieto schopnosti zvlášť dôležité (napr. vedenie vozidiel alebo obsluha strojov).
Pacientom majú byť odporučené také opatrenia, aby sa počas vedenia vozidiel vyhli hypoglykémii. To je obzvlášť dôležité pre tých, ktorí majú oslabené alebo chýbajúce varovné príznaky hypoglykémie, alebo majú časté hypoglykemické príhody. Za týchto okolností sa musí zvážiť, či je vhodné viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinkyZhrnutie bezpečnostného profiluHypoglykémia (veľmi časté) je vo všeobecnosti najčastejšou nežiaducou reakciou inzulínovej liečby,
ktorá sa môže vyskytnúť, ak je dávka inzulínu privysoká vzhľadom na potrebu inzulínu (pozri časť
4.4).
Zoznam nežiaducich reakcií v tabuľkovomformáteZ klinických štúdií vyplynuli nasledujúce nežiaduce reakcie, ktoré sú zoradené podľa tried orgánových
systémov MedDRA a v poradí podľa klesajúceho výskytu (veľmi časté: ≥ 1/10; časté: ≥ 1/100 až <
1/10; menej časté: ≥ 1/1 000 až < 1/100; zriedkavé: ≥ 1/10 000 až < 1/1 000; veľmi zriedkavé:
< 1/10 000 a neznáme (z dostupných údajov)).
MedDRA triedy orgánových systémov
|
Veľmi časté
|
Časté
|
Menej časté
|
Zried kavé
| Veľmi
zriedka vé
|
Neznáme
| Poruchy imunitného systému
|
| Alergické reakcie
|
|
|
| X
|
|
| Poruchy metabolizmu a výživy
|
| Hypoglykémia
| X
|
|
|
|
|
| Poruchy nervového systému
|
| Dysgeúzia
|
|
|
|
| X
|
|
|
|
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
MedDRA triedy orgánových systémov
|
V
eľmi časté
|
Č
asté
|
Menej časté
|
Z
ried kavé
|
V
eľmi zriedka vé
|
N
eznáme
|
Poruchy zraku
|
|
Zhoršené videnie
|
|
|
|
X
|
|
|
Retinopatia
|
|
|
|
X
|
|
|
P
oruchy kože a podkožného tkaniva
|
|
Lipohypertrofia
|
|
X
|
|
|
|
|
Lipoatrofia
|
|
|
X
|
|
|
|
Kožná amyloidóza
|
|
|
|
|
|
X
|
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
|
Myalgia
|
|
|
|
|
X
|
|
C
elkové poruchy a reakcie v mieste podania
|
|
Reakcie v mieste
podania injekcie
|
|
X
|
|
|
|
|
Edém
|
|
|
|
X
|
|
|
O
pis
vybraných
nežiaducich
reakcií
Poruchy metabolizmu a výživy
Ťažké ataky hypoglykémie, najmä ak sú rekurentné, môžu spôsobiť neurologické poškodenie.
Dlhotrvajúce alebo ťažké hypoglykemické príhody môžu ohroziť život. Znakom a príznakom neuroglykopénie predchádzajú u mnohých pacientov znaky adrenergickej kontraregulácie. Všeobecne
čím väčší a rýchlejší je pokles hladiny glukózy v krvi, tým výraznejší je fenomén kontraregulácie a jej
príznakov.
Poruchy imunitného systémuBezprostredné alergické reakcie na inzulín sú zriedkavé. Takéto reakcie na inzulín (vrátane inzulínu
glargínu) alebo na pomocné látky môžu byť spojené napríklad s generalizovanými kožnými reakciami, angioedémom, bronchospazmom, hypotenziou a šokom a môžu ohroziť život.
Poruchy okaVýrazné zmeny glykemickej kontroly môžu dočasne zhoršiť zrak tým, že sa prechodne zmení
zdurenie a refrakčný index šošovky.
Dlhodobo zlepšená glykemická kontrola zmenšuje riziko progresie diabetickej retinopatie.
Avšak zintenzívnenie inzulínovej liečby s náhlym zlepšením glykemickej kontroly môže sprevádzať dočasné zhoršenie diabetickej retinopatie. U pacientov s proliferatívnou retinopatiou, najmä ak sa
neliečia fotokoaguláciou, môžu ťažké hypoglykemické príhody vyústiť do prechodnej amaurózy.
Poruchy kože a podkožnéhotkanivaLipodystrofia a kožná amyloidóza sa môžu vyskytnúť v mieste podania injekcie a spomaľujú lokálnu
absorpciu inzulínu. Priebežné striedanie miesta injekcie v rámci určitej injekčnej oblasti môže pomôcť znížiť alebo zabrániť takýmto reakciám (pozri časť 4.4).
Celkové poruchy a reakcie v mieste podaniaK reakciám v mieste podania injekcie patrí sčervenanie kože, bolesť, svrbenie, žihľavka, opuch alebo
zápal. Väčšina miernych reakcií na inzulín v mieste injekcie obvykle vymizne za niekoľko dní až týždňov.
Inzulín môže zriedkavo spôsobiť retenciu sodíka a opuch, najmä ak sa pôvodne slabá metabolická kontrola zlepšila intenzifikovanou inzulínovou liečbou.
Pediatrická populáciaVo všeobecnosti bezpečnostný profil u detí a dospievajúcich (vo veku ≤ 18 rokov) je podobný
bezpečnostnému profilu u dospelých. Správy o nežiaducich reakciách z postmarketingového sledovania zahŕňali u detí a dospievajúcich (vo veku ≤ 18 rokov) pomerne častejšie reakcie v mieste
vpichu (bolesť v mieste vpichu, reakcie v mieste vpichu) a kožné reakcie (vyrážka, urtikária) ako u
dospelých (vek > 18 rokov). Klinické štúdie s údajmi o bezpečnosti pre deti mladšie ako 2 roky nie sú k dispozícii.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 PredávkovaniePríznakyPredávkovanie inzulínom môže viesť k ťažkej a niekedy dlhotrvajúcej a život ohrozujúcej
hypoglykémii.
LiečbaMierne hypoglykemické príhody sa obvykle liečia perorálnymi sacharidmi. Môže byť potrebná úprava
dávky lieku, jedálneho lístka alebo telesnej aktivity.
Závažnejšie príhody spojené s kómou, kŕčmi alebo neurologickým poškodením možno liečiť intramuskulárnym alebo subkutánnym podaním glukagónu alebo intravenóznym podaním koncentrovanej glukózy. Keďže hypoglykémia sa po zdanlivom klinickom zotavení môže vrátiť, pacient musí udržiavať príjem sacharidov a je nutné pacienta pozorovať.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antidiabetiká, inzulíny a analógy na injekciu, pôsobiace dlhodobo. ATC kód: A10A E04.
ABASAGLAR je biologicky podobný liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.
MechanizmusúčinkuInzulín-glargín je ľudský inzulínový analóg vyvinutý tak, aby mal nízku rozpustnosť v neutrálnom pH.
Je úplne rozpustný v injekčnom roztoku ABASAGLARU s kyslým pH (pH 4). Po injekcii do podkožného tkaniva sa kyslý roztok neutralizuje, následkom čoho sa tvoria mikroprecipitáty, z ktorých sa priebežne uvoľňuje v malých množstvách inzulín-glargín, čím sa zaisťuje hladký a predvídateľný profil priebehu koncentrácie v závislosti od času bez vrcholov s predĺženým trvaním účinku.
Inzulín-glargín sa metabolizuje na 2 aktívne metabolity M1 a M2 (pozri časť 5.2).
Väzba na inzulínový receptor
I
n vitro štúdie uvádzajú, že afinita inzulínu glargínu a jeho metabolitov M1 a M2 k ľudskému
inzulínovému receptoru sa podobá ľudskému inzulínu.
Väzba na receptor IGF-1: Afinita inzulínu glargínu k ľudskému IGF-1 receptoru je približne 5 až 8- násobne vyššia ako ľudského inzulínu (ale približne 70 až 80-násobne nižšia ako u IGF-1), zatiaľ čo M1 a M2 sa viaže na IGF-1 receptor s mierne nižšou afinitou v porovnaní s ľudským inzulínom.
Celková terapeutická koncentrácia inzulínu (inzulínu glargínu a jeho metabolitov) zistená u pacientov
s diabetom 1. typu bola výrazne nižšia ako by bolo potrebné pre maximálne polovičné obsadenie IGF-
1 receptora a následnú aktiváciu mitogénno-proliferatívnej cesty iniciovanej IGF-1 receptorom. Fyziologické koncentrácie endogénneho IGF-1 môžu aktivovať mitogénno-proliferatívnu cestu, avšak
terapeutické koncentrácie zistené pri inzulínovej liečbe vrátane liečby ABASAGLAROM sú podstatne nižšie ako farmakologické koncentrácie potrebné na aktiváciu cesty IGF-1.
Farmakodynamické účinkyPrimárny účinok inzulínov, vrátane inzulínu glargínu, je regulácia glukózového metabolizmu. Inzulín
a jeho analógy znižujú hladinu glukózy v krvi stimuláciou periférneho vychytávania glukózy, najmä kostrovým svalstvom a tukom a inhibíciou tvorby glukózy v pečeni. Inzulín inhibuje lipolýzu
v adipocytoch, inhibuje proteolýzu a zvyšuje syntézu proteínov.
V klinických farmakologických štúdiách sa ukázalo, že intravenózny inzulín-glargín a ľudský inzulín sú pri rovnakých dávkach rovnocenné. Telesná aktivita a iné premenné môžu ovplyvňovať časový priebeh účinku inzulínu glargínu rovnako ako pri všetkých inzulínoch.
V euglykemických uzatvorených štúdiách so zdravými dobrovoľníkmi alebo pacientmi s diabetom
1. typu, bol nástup účinku subkutánneho inzulínu glargínu pomalší ako u ľudského NPH inzulínu, jeho profil účinku bol hladký, bez vrcholov a s predĺženým trvaním účinku.
Nasledujúci graf zobrazuje výsledky štúdie u pacientov:
 Graf č. 1: Profil účinku u pacientov s diabetom typu I inzulín-glargín------ NPH inzulínUkončeniepozorovania
Graf č. 1: Profil účinku u pacientov s diabetom typu I inzulín-glargín------ NPH inzulínUkončeniepozorovania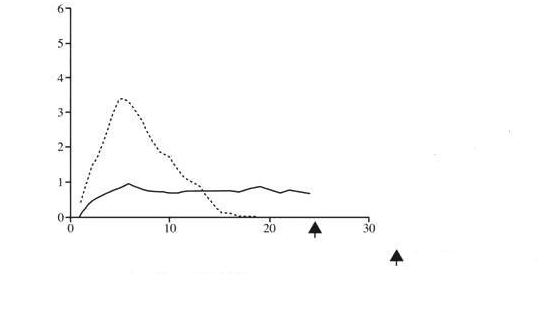 Čas (hod.) po s.c. injekcii
Čas (hod.) po s.c. injekcii∗ udáva sa ako množstvo infúziou podanej glukózy na udržanie konštantných plazmatických
hladín glukózy (priemerné hodinové hodnoty).
Dlhšie trvanie účinku podkožne podaného inzulínu glargínu priamo súvisí s jeho nižšou absorpčnou
rýchlosťou a umožňuje podávanie raz denne. Časový priebeh účinku inzulínu a inzulínových
analógov, akým je inzulín-glargín, sa môže značne líšiť u rôznych jedincov alebo u toho istého
jedinca.
Príznaky hypoglykémie alebo hormonálnych odpovedí kontraregulácie boli v klinickej štúdii podobné po intravenóznom podaní inzulínu glargínu a ľudského inzulínu u zdravých dobrovoľníkov aj
u pacientov s diabetom 1. typu.
Klinická bezpečnosť a účinnosť
V klinických štúdiách sa pozorovali protilátky, ktoré krížovo reagujú s ľudským inzulínom
a inzulínom-glargínom, s rovnakou frekvenciou v skupine liečenej NPH-inzulínom a inzulínom-
glargínom.
Účinky inzulínu glargínu (podávaného jedenkrát denne) na diabetickú retinopatiu sa vyhodnocovali v otvorenej 5 -ročnej štúdii kontrolovanej NPH (NPH podávaný dvakrát denne) u 1024 pacientov s diabetom 2. typu, u ktorých bola zistená progresia retinopatie o 3 stupne a viac na základe vyhodnocovania snímky očného pozadia podľa škály Early Treatment Diabetic Retinopathy Study (ETDRS). Pri porovnaní inzulínu glargínu s NPH inzulínom sa nepozoroval žiadny významný rozdiel v progresii diabetickej retinopatie.
Klinické skúšanie ORIGIN (Outcome Reduction with Initial Glargine INtervention) bolo multicentrické, randomizované klinické skúšanie s 2x2 faktoriálnym dizajnom, v ktorom bolo zahrnutých12 537 pacientov s vysokým kardiovaskulárnym (CV) rizikom, s hraničnou glykémiou nalačno (IFG), s poruchou glukózovej tolerancie (IGT) (12% subjektov) alebo s diabetom 2. typu liečených ≤1 antidiabetickým perorálnym liekom (88% subjektov). Pacienti boli randomizovaní (1:1) do skupiny s liečbou inzulínom-glargínom (n = 6 264), titrovaným tak, aby sa dosiahla koncentrácia FPG ≤95 mg/dl (5,3 mmol/l) alebo do skupiny so štandardnou liečbou (n = 6 273).
Prvý kompozitný ukazovateľ týkajúci sa účinnosti bol čas do prvého výskytu úmrtia z CV príčin, nefatálneho infarktu myokardu (MI) alebo nefatálnej mozgovej príhody a druhý kompozitný ukazovateľ týkajúci sa účinnosti bol čas do prvého výskytu ktorejkoľvek udalosti zahrnutej v prvom kompozitnom ukazovateli alebo čas do revaskularizačného výkonu, (koronárne tepny, karotídy alebo periférne cievy,) alebo do hospitalizácie z dôvodu zlyhania srdca.
Sekundárne cieľové ukazovatele zahŕňali mortalitu z akejkoľvek príčiny a kompozitné mikrovaskulárne ukazovatele.
Inzulín-glargín nezhoršoval relatívne riziko CV ochorenia a CV mortality v porovnaní so štandardnou liečbou. V prvých dvoch kompozitných ukazovateľoch neboli zistené žiadne rozdiely medzi
inzulínom-glargínom a štandardnou liečbou v akejkoľvek čiastkovej zložke zahŕňajúcej primárne
ukazovatele; pre úmrtie z akejkoľvek príčiny alebo pre kompozitné mikrovaskulárne ukazovatele.
Priemerná dávka inzulínu glargínu bola na konci štúdie 0,42 jednotiek/kg. Na začiatku mali účastníci
medián hodnoty HbA1c 6,4 %. Medián hodnoty HbA1c sa počas liečby pohyboval v rozmedzí 5,9-
6,4 % v skupine s inzulínom-glargínom a 6,2 až 6,6 % v skupine so štandardnou liečbou počas následného sledovania (follow-up).Výskyt ťažkej hypoglykémie (počet postihnutých účastníkov na
100 liečených osôb počas 1 roka) bol 1,05 v skupine s inzulínom-glargínom a 0,30 v skupine so štandardnou liečbou a výskyt potvrdenej nezávažnej hypoglykémie bol 7,71 v skupine s inzulínom- glargínom a 2,44 v skupine so štandardnou liečbou. Počas celého trvania tejto 6-ročnej štúdie sa nevyskytla hypoglykémia u 42% účastníkov v skupine s inzulínom-glargínom.
Pri poslednej návšteve lekára v rámci štúdie bol zistený priemerný nárast telesnej hmotnosti
z východiskovej hodnoty o 1,4 kg v skupine s inzulínom-glargínom a priemerný pokles o 0,8 kg v skupine so štandardnou liečbou.
Pediatrická populácia
V randomizovanej, kontrolovanej klinickej štúdii boli pediatrickí pacienti (vo veku od 6 do 15 rokov)
s diabetom 1. typu (n=349) liečení po dobu 28 týždňov v inzulínovom režime bazál-bolus, kde bol použitý regulárny ľudský inzulín pred každým jedlom. Inzulín-glargín sa podával jedenkrát denne pred spaním a NPH ľudský inzulín sa podával jedenkrát alebo dvakrát denne. V obidvoch liečených skupinách sa pozorovali podobné účinky na glykovaný hemoglobín a výskyt symptomatickej hypoglykémie, avšak hladina plazmatickej glukózy nalačno klesla z východiskovej hodnoty viac
v skupine s inzulínom-glargínom ako v skupine s NPH. V skupine s inzulínom-glargínom bol taktiež menej častý výskyt ťažkej hypoglykémie. Stoštyridsaťtri pacientov liečených inzulínom-glargínom
v tejto štúdii pokračovalo v liečbe inzulínom-glargínom v nekontrolovanom predĺžení štúdie, pričom sledovanie trvalo priemerne 2 roky. Počas tejto predĺženej liečby inzulínom-glargínom sa nezaznamenali žiadne nové signály týkajúce sa bezpečnosti.
Taktiež sa uskutočnila „crossover“ štúdia (so skríženým dizajnom) porovnávajúca liečbu inzulínom- glargínom plus inzulínom lispro s liečbou inzulínom NPH plus regulárny ľudský inzulín (každá liečba sa podávala 16 týždňov v náhodnom poradí) u 26 dospievajúcich vo veku 12 až 18 rokov s diabetom
1. typu. Rovnako ako vo vyššie uvedenej pediatrickej štúdii pokles hladiny plazmatickej glukózy nalačno z východiskovej hodnoty bol väčší v skupine s inzulínom-glargínom ako v skupine s NPH.
Zmeny HbA1c z východiskovej hodnoty boli v obidvoch liečených skupinách podobné; hodnoty hladiny glukózy v krvi zaznamenané počas noci boli významne vyššie v skupine inzulínom-glargínom
/ lispro ako v skupine NPH/ regulárny ľudský inzulín, s priemernou najnižšou hodnotou (nadir) 5,4
mmol/l oproti 4,1 mmol/l. Tomu zodpovedal výskyt nočnej hypoglykémie, ktorý bol 32 % v skupine
s inzulínom-glargínom / lisprom oproti 52 % v skupine NPH/regulárny ľudský inzulín.
Bola vykonaná štúdia trvajúca 24 týždňov s paralelnými skupinami u 125 detí vo veku od 2 do 6 rokov s diabetom 1. typu porovnávajúca inzulín-glargín podávaný raz denne ráno s NPH inzulínom podávaným raz alebo dvakrát denne ako bazálny inzulín. Obidve skupiny dostávali bolusový inzulín pred jedlom. Primárny cieľ preukázať non-inferioritu inzulínu glargínu v porovnaní s NPH inzulínom vo všetkých hypoglykémiách nebol dosiahnutý a pri inzulíne glargíne bol trend narastania hypoglykemických príhod [inzulín-glargín: NPH pomer výskytu (95% CI) = 1,18 (0,97-1,44)].
Hodnota glykovaného hemoglobínu a variabilita glukózy bola porovnateľná v obidvoch liečebných skupinách. V tejto štúdii sa nepozorovali žiadne nové bezpečnostné signály.
5.2 Farmakokinetické vlastnosti
Absorpcia
U zdravých jedincov a diabetikov ukázali sérové koncentrácie inzulínu pomalšiu a oveľa dlhšiu
absorpciu a po subkutánnej injekcii inzulínu glargínu v porovnaní s ľudským NPH inzulínom chýbal
vrchol. Koncentrácie teda zodpovedali časovému profilu farmakodynamického účinku inzulínu glargínu. Vyššie uvedený graf č. 1 ukazuje profily farmakodynamického účinku inzulínu glargínu a NPH inzulínu.
Inzulín-glargín podaný raz denne dosiahne hladinu rovnovážneho stavu za 2-4 dni po prvej dávke. Biotransformácia
Po podaní subkutánnej injekcie diabetickým pacientom sa inzulín-glargín rýchlo metabolizuje v
uhlíkovom zakončení beta reťazca za vzniku dvoch aktívnych metabolitov M1 (21A-Gly-inzulín)
a M2 (21A-Gly-des-30B-Thr-inzulín). Hlavná cirkulujúca zlúčenina v plazme je metabolit M1. Expozícia M1 sa zvyšuje s podanou dávkou inzulínu glargínu.
Farmakokinetické a farmakodynamické výsledky uvádzajú, že účinok inzulínu glargínu podaného subkutánnou injekciou je v zásade založený na expozícii M1. Inzulín-glargín a metabolit M2 neboli
u veľkej väčšiny prípadov zistiteľné a ak sa zistili, ich koncentrácia nebola závislá od podanej dávky
inzulínu glargínu.
E
l
i
mi
n
ácia
Pri intravenóznom podaní je polčas eliminácie inzulínu glargínu a ľudského inzulínu porovnateľný.
Osobitné skupiny pacientov
V klinických štúdiách sa v jednotlivých podskupinách rozdelených podľa veku a rodu nezistili žiadne
rozdiely v bezpečnosti a účinnosti pri liečbe inzulínom-glargínom v porovnaní s celkovou študovanou
populáciou.
Pediatrická populácia
V jednej klinickej štúdii sa posudzovala farmakokinetika u detí vo veku od 2 do menej ako 6 rokov
s diabetom 1. typu (pozri časť 5.1). Merali sa najnižšie plazmatické hladiny inzulínu glargínu a jeho
hlavných metabolitov M1 a M2 u detí liečených inzulínom-glargínom. Merania preukázali, že plazmatické koncentrácie boli podobné ako u dospelých a pri dlhodobom podávaní sa nezistil žiadny dôkaz akumulácie inzulínu glargínu ani jeho metabolitov.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podaní, genotoxicity, karcinogénneho potenciálu a reprodukčnej toxicity neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
oxid zinočnatý metakrezol glycerol
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
voda na injekcie
6.2 Inkompatibility
Tento liek sa nesmie miešať so žiadnymi inými liekmi.
6.3 Čas použiteľnosti
2 roky.
Čas použiteľnosti po prvompoužití
Liek sa môže uchovávať maximálne 28 dní pri teplote neprevyšujúcej 30 °C tak, aby nebol vystavený
priamemu teplu ani priamemu svetlu. Používané perá sa nesmú uchovávať v chladničke.
Po každom podaní injekcie nasaďte vrchnák opäť na pero, aby ste ho chránili pred svetlom.
6.4 Špeciálne upozornenia na uchovávanie
Pred použitím
Uchovávajte v chladničke (2 °C – 8 °C).
Neuchovávajte v mrazničke.
Neuchovávajte ABASAGLAR v blízkosti mraziaceho výparníka ani zmrazených chladiacich vložiek.
Náplň uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Počas použitia
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
3 ml roztoku v náplni (z bezfarebného skla typu 1) s dávkovacím tlačidlom (z halobutylovej gumy)
a okrúhlou zátkou (guma z polyizoprénového laminátu a halobutylu) s hliníkovým tesniacim krytom. Balenia sú po 5 a 10 náplní. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
ABASAGLAR sa nesmie miešať so žiadnym iným inzulínom ani inými liekmi a nesmie sa ani riediť. Miešanie alebo riedenie môže zmeniť jeho časový profil účinku a miešanie môže spôsobiť precipitáciu.
Inzulínové pero
Náplne ABASAGLARU sa majú používať iba v spojení s inzulínovým perom na opakované použitie
od spoločnosti Lilly (pozri časť 4.4).
Pero sa má používať podľa odporúčaní v návode na použitie dodaného spolu s touto pomôckou.
Je potrebné starostlivo dodržiavať pokyny z návodu na použitie pera pri zakladaní náplne do pera, pripevňovaní ihly a podávaní inzulínovej injekcie.
Ak je inzulínové pero poškodené alebo správne nefunguje (ako následok mechanickej poruchy), treba ho zlikvidovať a použiť nové inzulínové pero.
Náplň
Pred použitím skontrolujte náplň. Môže sa použiť len ak je roztok číry, bezfarebný, bez viditeľných
tuhých častíc a len ak má konzistenciu podobnú vode. Keďže ABASAGLAR je roztok, nevyžaduje pred použitím resuspenzáciu. Pred podaním injekcie sa vzduchové bubliny musia z náplne odstrániť
(pozri návod na použitie pera).
Aby sa zabránilo možným prenosným ochoreniam, musí každé pero používať len jeden pacient.
Prázdne náplne nesmú byť opätovne použité a musia byť náležite zlikvidované. Pred každou injekciou je nutné vždy skontrolovať označenie na inzulíne, aby sa zabránilo zámene inzulínu glargínu za iné inzulíny (pozri časť 4.4).
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Holandsko
8. REGISTRAČNÉ ČÍSLA
EU/1/14/944/003
EU/1/14/944/009
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 09. septembra 2014
Dátum posledného predĺženia: 25. júla 2019
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu
1. NÁZOV LIEKU
ABASAGLAR 100 jednotiek/ml KwikPen injekčný roztok v naplnenom pere.
ABASAGLAR 100 jednotiek/ml Tempo Pen injekčný roztok v naplnenom pere.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Jeden ml obsahuje 100 jednotiek inzulínu-glargínu* (zodpovedá 3,64 mg).
Každé pero obsahuje 3 ml injekčného roztoku, čo zodpovedá 300 jednotkám.
*vyrábaného rekombinantnou DNA technológiou v Escherichia coli.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA Injekčný roztok (injekcia). Číry, bezfarebný roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba diabetes mellitus u dospelých, dospievajúcich a detí vo veku 2 rokov a starších.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
ABASAGLAR obsahuje inzulín-glargín, analóg inzulínu a má predĺžené trvanie účinku.
ABASAGLAR sa má podávať raz denne, kedykoľvek počas dňa, ale každý deň v tom istom čase. Dávkovacia schéma (dávka a čas podania) sa musí prispôsobiť individuálne. Pacientom s diabetom
mellitus 2. typu sa môže podávať ABASAGLAR spolu s perorálnymi antidiabetikami.
Účinnosť tohto lieku je daná v jednotkách. Tieto jednotky sú špecifické len pre inzulín-glargín a nie sú rovnaké ako IU alebo jednotky, ktoré sa používajú na vyjadrenie účinnosti iných inzulínových analógov (pozri časť 5.1).
Osobitné skupiny pacientov
Populácia starších pacientov (≥65 rokov)
U starších pacientov môže progresívne zhoršovanie renálnej funkcie viesť k stálemu poklesu nárokov na inzulín.
Zhoršená renálna funkcia
U pacientov so zhoršenou renálnou funkciou môžu byť nároky na inzulín znížené z dôvodu zníženého inzulínového metabolizmu.
Zhoršená funkcia pečene
U pacientov so zhoršenou funkciou pečene môžu byť nároky na inzulín znížené z dôvodu zníženej kapacity pre glukoneogenézu a zníženého inzulínového metabolizmu.
Pediatrická populácia
Dospievajúci a deti 2-ročné a staršie
Bezpečnosť a účinnosť inzulínu glargínu bola stanovená u dospievajúcich a detí vo veku 2 rokov
a starších (pozri časť 5.1). Dávkovacia schéma (dávka a čas podania) sa má stanoviť individuálne.
Deti vo veku do 2 rokov
Bezpečnosť a účinnosť inzulínu glargínu nebola stanovená. K dispozícii nie sú žiadne údaje.
Zmena liečbyz iných inzulínov na ABASAGLAR
Zmena liečebného režimu zo strednodobo alebo dlhodobo pôsobiaceho inzulínu na režim
s ABASAGLAROM, si môže vyžiadať zmenu dávky bazálneho inzulínu a úpravu sprievodnej antidiabetickej liečby (dávok a času podania prídavných bežných inzulínov alebo rýchlo pôsobiacich
analógov inzulínu alebo dávok perorálnych antidiabetík).
Zmena liečbyz NPH inzulínu dvakrát denne na ABASAGLAR
Pacienti, ktorí menia režim bazálneho inzulínu z NPH dvakrát denne na režim s ABASAGLAROM
jedenkrát denne, musia v prvých týždňoch liečby znížiť dennú dávku bazálneho inzulínu o 20-30 %, aby sa zmenšilo riziko nočnej alebo skorej rannej hypoglykémie.
Zmena liečbyz inzulínu glargínu 300 jednotiek/ml na ABASAGLAR
ABASAGLAR a Toujeo (inzulín-glargín 300 jednotiek/ml) nie sú bioekvivalentné a nie sú priamo
zameniteľné. Na zníženie rizika hypoglykémie majú pacienti meniaci režim bazálneho inzulínu z inzulínu glargínu 300 jednotiek/ml raz denne na ABASAGLAR raz denne znížiť svoju dávku
o približne 20 %.
Toto zníženie dávky počas prvých týždňov sa má aspoň čiastočne kompenzovať zvýšením prandiálneho inzulínu, po uplynutí tohto času sa režim má individuálne upraviť.
Pri zmene liečby a v prvých týždňoch po ňom sa odporúča starostlivé sledovanie metabolizmu.
So zlepšením metabolickej kontroly a následným zvýšením citlivosti na inzulín môže byť potrebná ďalšia úprava dávky. Úpravu dávky si môže vyžiadať napríklad aj zmena pacientovej hmotnosti a/alebo životného štýlu, zmena času podania dávky inzulínu alebo iné okolnosti, ktoré zvyšujú náchylnosť na hypoglykémiu alebo na hyperglykémiu (pozri časť 4.4).
Pacienti, ktorí užívajú vysoké dávky inzulínu z dôvodu zvýšenej hladiny protilátok proti ľudskému inzulínu, môžu pri ABASAGLARE zaznamenať zlepšenú inzulínovú odpoveď.
Spôsob podávania
ABASAGLAR sa podáva subkutánne.
ABASAGLAR sa nemá podávať intravenózne. Predĺžený účinok ABASAGLARU závisí od jeho podania do subkutánneho tkaniva. Intravenózne podanie dávky, ktorá sa obvykle podáva subkutánne, by mohlo spôsobiť ťažkú hypoglykémiu.
Po podaní ABASAGLARU do brušnej steny, deltového svalu alebo do stehna nie sú klinicky významné rozdiely v hladinách glukózy alebo inzulínu v sére.
Miesta vpichu sa majú meniť rotačným spôsobom tak, aby sa rovnaké miesto nepoužilo viac ako približne jedenkrát za mesiac, a tým sa znížilo riziko lipodystrofie a kožnej amyloidózy (pozri časti
4.4 a 4.8).
ABASAGLAR sa nesmie miešať so žiadnym iným inzulínom ani riediť. Miešanie alebo riedenie môže zmeniť jeho časový profil účinku a miešanie môže spôsobiť precipitáciu.
Podrobnejšie o zaobchádzaní s liekom, pozri časť 6.6.
Pred použitím injekčného roztoku ABASAGLARU v naplnenom pere si musíte dôkladne prečítať návod na použitie zahrnutý v Písomnej informácii pre používateľa (pozri časť 6.6).
KwikPen
Pero KwikPen je registrované v dvoch variantoch. Prvým sa môže podať v jednej injekcii
1 - 60 jednotiek v kroku po 1 jednotke a druhým sa môže podať v jednej injekcii 1 - 80 jednotiek v kroku po 1 jednotke. Požadovaná dávka sa nastavuje po celých jednotkách. Počet jednotiek sa zobrazí v dávkovacom okienku pera.
Tempo Pen
Perom Tempo Pen sa môže podať v jednej injekcii 1 - 80 jednotiek v kroku po 1 jednotke. Požadovaná
dávka sa nastavuje po celých jednotkách. Počet jednotiek sa zobrazí v dávkovacom okienku pera.
Tempo Pen sa môže používať s voliteľným prenosovým modulom Tempo Smart Button (pozri časť
6.6).
Tak ako pri ostatných inzulínových injekciách, pri používaní Tempo Penu, modulu Tempo Smart Button a mobilnej aplikácie, má byť pacient poučený, aby si skontroloval hladinu cukru v krvi vtedy, keď zvažuje alebo sa rozhoduje, či si má podať ďalšiu injekciu v prípade, ak si nie je istý, koľko inzulínu si už podal.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Sledovateľnosť
Aby sa zlepšila dosledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov a číslo
šarže podaného lieku.
Diabetická ketoacidóza
ABASAGLAR nie je inzulínom voľby na liečbu diabetickej ketoacidózy. Namiesto toho sa v takýchto
prípadoch odporúča intravenózne podať bežný inzulín.
Potreba inzulínu aúpravadávky
V prípade nedostatočnej glukózovej kontroly alebo náchylnosti na hyperglykemické alebo
hypoglykemické príhody sa musí ešte pred zvážením úpravy dávok prehodnotiť ako pacient dodržiava predpísaný liečebný režim, injekčné miesta, správnu techniku podania injekcií a iné významné
faktory.
Prestavenie pacienta na iný typ alebo druh inzulínu sa musí robiť pod prísnym lekárskym dohľadom . Zmena sily, druhu (iný výrobca), typu (bežný, NPH, lente, s dlhotrvajúcim účinkom, atď.), pôvodu
(zvierací, ľudský, analóg ľudského inzulínu) a/alebo výrobného postupu môže mať za následok to, že je potrebné zmeniť dávku.
Hypoglykémia
Čas výskytu hypoglykémie závisí od profilu účinku použitých inzulínov a preto sa môže zmeniť pri
zmene liečebného režimu. V dôsledku dlhšie pretrvávajúcej suplementácie bazálneho inzulínu pri liečbe inzulínom-glargínom, možno očakávať menej nočnej hypoglykémie, ale viac skorej rannej
hypoglykémie.
Vyžaduje sa mimoriadna opatrnosť a intenzívne monitorovanie hladiny glukózy v krvi sa odporúča u pacientov, pre ktorých môžu byť hypoglykemické príhody obzvlášť klinicky významné, ako sú napríklad pacienti so signifikantnou stenózou koronárnych artérií alebo krvných ciev zásobujúcich mozog (riziko srdcových alebo mozgových hypoglykemických komplikácií), ako aj pacienti s proliferatívnou retinopatiou, najmä ak sa neliečia fotokoaguláciou (riziko prechodnej amaurózy po hypoglykémii).
Pacienti majú byť upozornení na okolnosti, keď sa varovné príznaky hypoglykémie zmenšujú.
Varovné príznaky hypoglykémie sa môžu meniť, môžu byť menej výrazné alebo u určitých rizikových skupín môžu chýbať. Patria sem pacienti:
- s nápadne zlepšenou glykemickou kontrolou,
- s pozvoľným nástupom hypoglykémie,
- staršieho veku,
- po prechode zo zvieracieho na ľudský inzulín,
- s autonómnou neuropatiou v súčasnosti,
- s dlhodobou anamnézou cukrovky,
- s psychiatrickým ochorením,
- dostávajúci sprievodnú liečbu niektorými inými liekmi (pozri časť 4.5).
Tieto okolnosti môžu spôsobiť ťažkú hypoglykémiu (a možnú stratu vedomia) skôr, ako si pacient hypoglykémiu uvedomí.
Predĺžený účinok subkutánne podaného inzulínu glargínu môže oneskoriť zotavenie sa po hypoglykémii.
Ak sa zistia normálne alebo znížené hodnoty glykovaného hemoglobínu, musí sa vziať do úvahy možnosť rekurentných nerozpoznaných (najmä nočných) príhod hypoglykémie.
Nevyhnutným predpokladom pre zníženie rizika hypoglykémie je to, aby pacient dodržiaval režim dávok a diétny režim, správne podávanie inzulínu a znalosť príznakov hypoglykémie. Faktory, ktoré zvyšujú náchylnosť na hypoglykémiu, si vyžadujú obzvlášť podrobné sledovanie a môžu si vyžiadať aj úpravu dávok. K nim patria:
- zmena injekčného miesta,
- zlepšená vnímavosť na inzulín (napr. odstránením stresových faktorov),
- neobvyklá, zvýšená alebo predĺžená fyzická aktivita,
- interkurentné ochorenie (napr. vracanie, hnačka),
- neprimeraný príjem potravy,
- vynechanie jedla,
- konzumácia alkoholu,
- určité nekompenzované poruchy endokrinného systému (napr. pri hypotyreóze a pri nedostatočnej činnosti adenohypofýzy alebo kôry nadobličiek),
- súbežná liečba niektorými inými liekmi.
Injekčná technika
Pacienti musia byť poučení o tom, aby miesto podania injekcie neustále menili, čím sa zníži riziko
vzniku lipodystrofie a kožnej amyloidózy. Na miestach s týmito reakciami existuje potenciálne riziko
oneskorenej absorpcie inzulínu a zhoršenej kontroly glykémie po podaní inzulínových injekcií. V prípade náhlej zmeny miesta podania injekcie na nepostihnutú oblasť bol hlásený vznik hypoglykémie. Po zmene miesta podania injekcie sa odporúča monitorovanie hladiny glukózy v krvi a je možné zvážiť úpravu dávky antidiabetík.
Interkurentné ochorenie
Interkurentné ochorenie si vyžaduje intenzívnejšie sledovanie metabolizmu. V mnohých prípadoch sa
indikujú močové testy na ketóny a často sa musí upraviť dávku inzulínu. Nároky na inzulín sú často zvýšené. Pacienti s diabetom mellitus 1. typu musia udržiavať pravidelný prísun aspoň malého množstva sacharidov, aj keď sú schopní jesť len málo alebo vôbec nie, prípadne vracajú a pod. a nikdy nesmú inzulín úplne vynechať.
Inzulínové protilátky
Podávanie inzulínu môže spôsobiť tvorbu inzulínových protilátok. V ojedinelých prípadoch si môže
prítomnosť inzulínových protilátok vyžadovať úpravu dávky inzulínu, aby sa korigovala tendencia
k hyper- alebo hypoglykémii (pozri časť 5.1).
Zabránenie chybám v liečbe
Boli hlásené omyly pri použití lieku, kedy boli namiesto inzulínu glargínu náhodne použité iné
inzulíny, najmä krátkodobo účinkujúce. Pred každou injekciou je nutné vždy skontrolovať označenie
na inzulíne, aby sa zabránilo zámene ABASAGLARU v naplnenom pere za iné inzulíny.
Kombinácia ABASAGLARU s pioglitazónom
Pri súčasnom použití pioglitazónu s inzulínom boli hlásené prípady srdcového zlyhania, predovšetkým
u pacientov s rizikovými faktormi pre rozvoj srdcového zlyhania. Preto je potrebné súčasné použitie pioglitazónu a ABASAGLARU starostlivo zvážiť. V prípade, že sa kombinácia použije,
u pacientov sa musia sledovať znaky a príznaky srdcového zlyhania, prírastku telesnej hmotnosti
a edému. V prípade akéhokoľvek výskytu zhoršenia srdcových príznakov sa musí liečba pioglitazónom ihneď prerušiť.
Tempo Pen
Tempo Pen obsahuje magnet (pozri časť 6.5), ktorý môže narúšať funkcie implantovateľných
elektronických zdravotníckych pomôcok, ako napríklad kardiostimulátora. Magnetické pole má dosah
približne do vzdialenosti 1,5 cm.
Obsah sodíka
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t.j. v podstate bez sodíka.
4.5 Liekové a iné interakcie
Celý rad látok ovplyvňuje glukózový metabolizmus a môže si vyžiadať úpravu dávky inzulínu glargínu.
Medzi látky, ktoré môžu zosilňovať účinok znižujúci hladinu cukru v krvi a zvyšujú náchylnosť na hypoglykémiu, patria: perorálne antidiabetiká, inhibítory enzýmu konvertujúceho angiotenzín (ACE), disopyramid, fibráty, fluoxetín, inhibítory monoaminooxidázy (IMAO), pentoxifylín, propoxyfén, salicyláty, analógy somatostatínu a sulfónamidové antibiotiká.
Medzi látky, ktoré môžu zoslabovať účinok znižujúci hladinu cukru v krvi, patria: kortikosteroidy, danazol, diazoxid, diuretiká, glukagón, izoniazid, estrogény a progestagény, fenotiazínové deriváty,
somatotropín, sympatomimetiká (napr. epinefrín [adrenalín], salbutamol, terbutalín), tyroidné hormóny, atypické antipsychotické lieky (napr. klozapín a olanzapín) a inhibítory proteázy.
Betablokátory, klonidín, soli lítia alebo alkohol môžu buď zosilňovať alebo zoslabovať účinok inzulínu znižujúci hladinu cukru v krvi. Pentamidín môže spôsobiť hypoglykémiu, po ktorej môže niekedy nasledovať hyperglykémia.
Pod vplyvom sympatolytík, ako sú betablokátory, klonidín, guanetidín a rezerpín, sa naviac môžu oslabiť alebo chýbať príznaky adrenergickej kontraregulácie.
4.6 Fertilita, gravidita a laktácia
Gravidita
Z kontrolovaných klinických štúdii nie sú k dispozícii žiadne klinické údaje o gravidných ženách
vystavených účinku inzulínu glargínu. Údaje o veľkom počte gravidných žien (závery z počtu viac ako 1000 gravidít) vystavených účinku inzulínu glargínu nepreukázali žiadne špecifické nežiaduce účinky inzulínu glargínu na graviditu a nepreukázali žiadne špecifické malformácie ani toxicitu inzulínu glargínu pre plod/novorodenca.
Údaje získané u zvierat nepreukázali reprodukčnú toxicitu.
Ak je to klinicky potrebné, môže sa zvážiť použitie ABASAGLARU počas gravidity.
Pre pacientky s predtým existujúcou alebo gestačnou cukrovkou je dôležité udržiavanie dobrej metabolickej kontroly počas gravidity, aby sa zabránilo nepriaznivým následkom súvisiacim
s hyperglykémiou. Nároky na inzulín môžu počas prvého trimestra poklesnúť a
v druhom a treťom trimestri všeobecne stúpajú. Okamžite po pôrode nároky na inzulín rapídne klesnú
(zvýšené riziko hypoglykémie). Nevyhnutné je starostlivé sledovanie glykémie.
Dojčenie
Nie je známe, či sa inzulín-glargín vylučuje do materského mlieka. Nepredpokladajú sa žiadne
metabolické účinky požitého inzulínu glargínu na dojčeného novorodenca/dieťa, keďže inzulín-glargín ako peptid sa spracováva na aminokyseliny v ľudskom tráviacom trakte.
Dojčiacim matkám možno bude treba upraviť dávky inzulínu a diétu. Fertilita
Štúdie na zvieratách nepreukázali priame škodlivé účinky na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Následkom hypoglykémie alebo hyperglykémie, alebo napríklad ako dôsledok zhoršenia zraku, sa môže zhoršiť pacientova schopnosť sústrediť sa a reagovať. To môže predstavovať riziko
v situáciách, kedy sú tieto schopnosti zvlášť dôležité (napr. vedenie vozidiel alebo obsluha strojov).
Pacientom majú byť odporučené také opatrenia, aby sa počas vedenia vozidiel vyhli hypoglykémii. To je obzvlášť dôležité pre tých, ktorí majú oslabené alebo chýbajúce varovné príznaky hypoglykémie, alebo majú časté hypoglykemické príhody. Za týchto okolností sa musí zvážiť, či je vhodné viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Z
hrnutie bezpečnostného profiluHypoglykémia (veľmi časté) je vo všeobecnosti najčastejšou nežiaducou reakciou inzulínovej liečby,
ktorá sa môže vyskytnúť, ak je dávka inzulínu privysoká vzhľadom na potrebu inzulínu (pozri časť
4.4).
Zoznam nežiaducich reakcií v tabuľkovomformáteZ klinických štúdií vyplynuli nasledujúce nežiaduce reakcie, ktoré sú zoradené podľa tried orgánových
systémov MedDRA a v poradí podľa klesajúceho výskytu (veľmi časté: ≥ 1/10; časté: ≥ 1/100 až <
1/10; menej časté: ≥ 1/1 000 až < 1/100; zriedkavé: ≥ 1/10 000 až < 1/1 000; veľmi zriedkavé:'
< 1/10 000 a neznáme (z dostupných údajov)).
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
MedDRA triedy orgánových systémov
|
Veľmi časté
|
Časté
|
Menej časté
|
Zriedka vé
| Veľmi
zriedka vé
|
Neznám e
|
Poruchy imunitného systému
|
|
Alergické reakcie
|
|
|
| X
|
|
|
Poruchy metabolizmu a výživy
|
|
Hypoglykémia
| X
|
|
|
|
|
|
Poruchy nervového systému
|
|
Dysgeúzia
|
|
|
|
| X
|
|
Poruchy zraku
|
|
Zhoršené videnie
|
|
|
| X
|
|
|
Retinopatia
|
|
|
| X
|
|
|
Poruchy kože a podkožného tkaniva
|
|
Lipohypertrofia
|
| X
|
|
|
|
|
Lipoatrofia
|
|
| X
|
|
|
|
Kožná amyloidóza
|
|
|
|
|
| X
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
|
Myalgia
|
|
|
|
| X
|
|
Celkové poruchy a reakcie v mieste podania
|
|
Reakcie v mieste podania injekcie
|
|
X
|
|
|
|
|
Edém
|
|
|
| X
|
|
|
OpisvybranýchnežiaducichreakciíPoruchy metabolizmu a výživyŤažké ataky hypoglykémie, najmä ak sú rekurentné, môžu spôsobiť neurologické poškodenie.
Dlhotrvajúce alebo ťažké hypoglykemické príhody môžu ohroziť život. Znakom a príznakom neuroglykopénie predchádzajú u mnohých pacientov znaky adrenergickej kontraregulácie. Všeobecne čím väčší a rýchlejší je pokles hladiny glukózy v krvi, tým výraznejší je fenomén kontraregulácie a jej príznakov.
Poruchy imunitného systému
Bezprostredné alergické reakcie na inzulín sú zriedkavé. Takéto reakcie na inzulín (vrátane inzulínu
glargínu) alebo na pomocné látky môžu byť spojené napríklad s generalizovanými kožnými reakciami, angioedémom, bronchospazmom, hypotenziou a šokom a môžu ohroziť život.
Poruchy okaVýrazné zmeny glykemickej kontroly môžu dočasne zhoršiť zrak tým, že sa prechodne zmení
zdurenie a refrakčný index šošovky.
Dlhodobo zlepšená glykemická kontrola zmenšuje riziko progresie diabetickej retinopatie.
Avšak zintenzívnenie inzulínovej liečby s náhlym zlepšením glykemickej kontroly môže sprevádzať dočasné zhoršenie diabetickej retinopatie. U pacientov s proliferatívnou retinopatiou, najmä ak sa
neliečia fotokoaguláciou, môžu ťažké hypoglykemické príhody vyústiť do prechodnej amaurózy.
Poruchy kože a podkožnéhotkanivaLipodystrofia a kožná amyloidóza sa môžu vyskytnúť v mieste podania injekcie a spomaľujú lokálnu
absorpciu inzulínu. Priebežné striedanie miesta injekcie v rámci určitej injekčnej oblasti môže pomôcť znížiť alebo zabrániť takýmto reakciám (pozri časť 4.4).
Celkové poruchy a reakcie v mieste podaniaK reakciám v mieste podania injekcie patrí sčervenanie kože, bolesť, svrbenie, žihľavka, opuch alebo
zápal. Väčšina miernych reakcií na inzulín v mieste injekcie obvykle vymizne za niekoľko dní až týždňov.
Inzulín môže zriedkavo spôsobiť retenciu sodíka a opuch, najmä ak sa pôvodne slabá metabolická kontrola zlepšila intenzifikovanou inzulínovou liečbou.
Pediatrická populáciaVo všeobecnosti bezpečnostný profil u detí a dospievajúcich (vo veku ≤ 18 rokov) je podobný
bezpečnostnému profilu u dospelých. Správy o nežiaducich reakciách z postmarketingového sledovania zahŕňali u detí a dospievajúcich (vo veku ≤ 18 rokov) pomerne častejšie reakcie v mieste
vpichu (bolesť v mieste vpichu, reakcie v mieste vpichu) a kožné reakcie (vyrážka, urtikária) ako
u dospelých (vek > 18 rokov). Klinické štúdie s údajmi o bezpečnosti pre deti mladšie ako 2 roky nie sú k dispozícii.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 PredávkovaniePríznakyPredávkovanie inzulínom môže viesť k ťažkej a niekedy dlhotrvajúcej a život ohrozujúcej
hypoglykémii.
LiečbaMierne hypoglykemické príhody sa obvykle liečia perorálnymi sacharidmi. Môže byť potrebná úprava
dávky lieku, jedálneho lístka alebo telesnej aktivity.
Závažnejšie príhody spojené s kómou, kŕčmi alebo neurologickým poškodením možno liečiť intramuskulárnym alebo subkutánnym podaním glukagónu alebo intravenóznym podaním koncentrovanej glukózy. Keďže hypoglykémia sa po zdanlivom klinickom zotavení môže vrátiť, pacient musí udržiavať príjem sacharidov a je nutné pacienta pozorovať.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antidiabetiká, inzulíny a analógy na injekciu, pôsobiace dlhodobo. ATC kód: A10A E04.
ABASAGLAR je biologicky podobný liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.
MechanizmusúčinkuInzulín-glargín je ľudský inzulínový analóg vyvinutý tak, aby mal nízku rozpustnosť v neutrálnom pH.
Je úplne rozpustný v injekčnom roztoku ABASAGLARU s kyslým pH (pH 4). Po injekcii do podkožného tkaniva sa kyslý roztok neutralizuje, následkom čoho sa tvoria mikroprecipitáty, z ktorých sa priebežne uvoľňuje v malých množstvách inzulín-glargín, čím sa zaisťuje hladký a predvídateľný profil priebehu koncentrácie v závislosti od času bez vrcholov s predĺženým trvaním účinku.
Inzulín-glargín sa metabolizuje na 2 aktívne metabolity M1 a M2 (pozri časť 5.2).
Väzba na inzulínový receptorIn vitro štúdie uvádzajú, že afinita inzulínu glargínu a jeho metabolitov M1 a M2 k ľudskému
inzulínovému receptoru sa podobá ľudskému inzulínu.
Väzba na receptor IGF-1: afinita inzulínu glargínu k ľudskému IGF-1 receptoru je približne 5 až 8- násobne vyššia ako ľudského inzulínu (ale približne 70 až 80-násobne nižšia ako u IGF-1), zatiaľ čo M1 a M2 sa viaže na IGF-1 receptor s mierne nižšou afinitou v porovnaní s ľudským inzulínom.
Celková terapeutická koncentrácia inzulínu (inzulínu glargínu a jeho metabolitov) zistená u pacientov s diabetom 1. typu bola výrazne nižšia ako by bolo potrebné pre maximálne polovičné obsadenie IGF-
1 receptora a následnú aktiváciu mitogénno-proliferatívnej cesty iniciovanej IGF-1 receptorom. Fyziologické koncentrácie endogénneho IGF-1 môžu aktivovať mitogénno-proliferatívnu cestu, avšak
terapeutické koncentrácie zistené pri inzulínovej liečbe vrátane liečby ABASAGLAROM sú podstatne nižšie ako farmakologické koncentrácie potrebné na aktiváciu cesty IGF-1.
Farmakodynamické účinkyPrimárny účinok inzulínov, vrátane inzulínu glargínu, je regulácia glukózového metabolizmu. Inzulín
a jeho analógy znižujú hladinu glukózy v krvi stimuláciou periférneho vychytávania glukózy, najmä kostrovým svalstvom a tukom a inhibíciou tvorby glukózy v pečeni. Inzulín inhibuje lipolýzu
v adipocytoch, inhibuje proteolýzu a zvyšuje syntézu proteínov.
V klinických farmakologických štúdiách sa ukázalo, že intravenózny inzulín-glargín a ľudský inzulín sú pri rovnakých dávkach rovnocenné. Telesná aktivita a iné premenné môžu ovplyvňovať časový priebeh účinku inzulínu glargínu rovnako ako pri všetkých inzulínoch.
V euglykemických uzatvorených štúdiách so zdravými dobrovoľníkmi alebo pacientmi s diabetom
1. typu, bol nástup účinku subkutánneho inzulínu glargínu pomalší ako u ľudského NPH inzulínu, jeho profil účinku bol hladký, bez vrcholov a s predĺženým trvaním účinku.
Nasledujúci graf zobrazuje výsledky štúdie u pacientov:
 Graf č. 1: Profil účinku u pacientov s diabetom typu I inzulín-glargín------ NPH inzulínUkončeniepozorovania
Graf č. 1: Profil účinku u pacientov s diabetom typu I inzulín-glargín------ NPH inzulínUkončeniepozorovania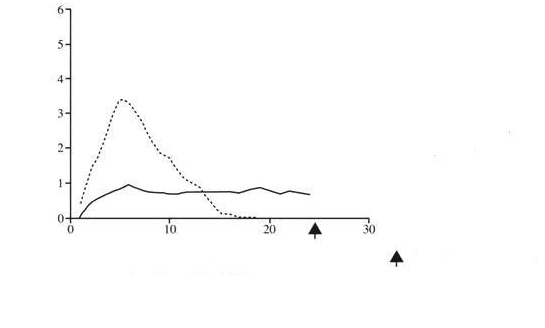 Čas (hod.) po s.c. injekcii
Čas (hod.) po s.c. injekcii∗ udáva sa ako množstvo infúziou podanej glukózy na udržanie konštantných plazmatických
hladín glukózy (priemerné hodinové hodnoty).
Dlhšie trvanie účinku podkožne podaného inzulínu glargínu priamo súvisí s jeho nižšou absorpčnou
rýchlosťou a umožňuje podávanie raz denne. Časový priebeh účinku inzulínu a inzulínových analógov, akým je inzulín-glargín, sa môže značne líšiť u rôznych jedincov alebo u toho istého jedinca.
Príznaky hypoglykémie alebo hormonálnych odpovedí kontraregulácie boli v klinickej štúdii podobné po intravenóznom podaní inzulínu glargínu a ľudského inzulínu u zdravých dobrovoľníkov aj
u pacientov s diabetom 1. typu.
Klinická bezpečnosť a účinnosťV klinických štúdiách sa pozorovali protilátky, ktoré krížovo reagujú s ľudským inzulínom
a inzulínom-glargínom, s rovnakou frekvenciou v skupine liečenej NPH-inzulínom a inzulínom-
glargínom.
Účinky inzulínu glargínu (podávaného jedenkrát denne) na diabetickú retinopatiu sa vyhodnocovali v otvorenej 5-ročnej štúdii kontrolovanej NPH (NPH podávaný dvakrát denne) u 1024 pacientov s diabetom 2. typu, u ktorých bola zistená progresia retinopatie o 3 stupne a viac na základe vyhodnocovania snímky očného pozadia podľa škály Early Treatment Diabetic Retinopathy Study (ETDRS). Pri porovnaní inzulínu glargínu s NPH inzulínom sa nepozoroval žiadny významný rozdiel v progresii diabetickej retinopatie.
Klinické skúšanie ORIGIN (Outcome Reduction with Initial Glargine INtervention) bolo multicentrické, randomizované klinické skúšanie s 2x2 faktoriálnym dizajnom, v ktorom bolo zahrnutých 12 537 pacientov s vysokým kardiovaskulárnym (CV) rizikom, s hraničnou glykémiou nalačno (IFG), s poruchou glukózovej tolerancie (IGT) (12% subjektov) alebo s diabetom 2. typu liečených ≤1 antidiabetickým perorálnym liekom (88% subjektov). Pacienti boli randomizovaní (1:1) do skupiny s liečbou inzulínom-glargínom (n = 6 264), titrovaným tak, aby sa dosiahla koncentrácia FPG ≤95 mg/dl (5,3 mmol/l) alebo do skupiny so štandardnou liečbou (n = 6 273).
Prvý kompozitný ukazovateľ týkajúci sa účinnosti bol čas do prvého výskytu úmrtia z CV príčin, nefatálneho infarktu myokardu (MI) alebo nefatálnej mozgovej príhody a druhý kompozitný
ukazovateľ týkajúci sa účinnosti bol čas do prvého výskytu ktorejkoľvek udalosti zahrnutej v prvom kompozitnom ukazovateli alebo čas do revaskularizačného výkonu, (koronárne tepny, karotídy alebo periférne cievy,) alebo do hospitalizácie z dôvodu zlyhania srdca.
Sekundárne cieľové ukazovatele zahŕňali mortalitu z akejkoľvej príčiny a kompozitné mikrovaskulárne ukazovatele.
Inzulín-glargín nezhoršoval relatívne riziko CV ochorenia a CV mortality v porovnaní so štandardnou liečbou. V prvých dvoch kompozitných ukazovateľoch neboli zistené žiadne rozdiely medzi inzulínom glargín a štandardnou liečbou v akejkoľvek čiastkovej zložke zahŕňajúcej primárne ukazovatele; pre úmrtie z akejkoľvek príčiny alebo pre kompozitné mikrovaskulárne ukazovatele.
Priemerná dávka inzulínu glargín bola na konci štúdie 0,42 jednotiek/kg. Na začiatku mali účastníci
medián hodnoty HbA1c 6,4 %. Medián hodnoty HbA1c sa počas liečby pohyboval v rozmedzí 5,9-6,4
% v skupine s inzulínom glargín a 6,2 až 6,6 % v skupine so štandardnou liečbou počas následného sledovania (follow-up).
Výskyt ťažkej hypoglykémie (počet postihnutých účastníkov na 100 liečených osôb počas 1 roka) bol
1,05 v skupine s inzulínom-glargínom a 0,30 v skupine so štandardnou liečbou a výskyt potvrdenej nezávažnej hypoglykémie bol 7,71 v skupine s inzulínom-glargínom a 2,44 v skupine so štandardnou liečbou. Počas celého trvania tejto 6-ročnej štúdie sa nevyskytla hypoglykémia u 42% účastníkov
v skupine s inzulínom-glargínom.
Pri poslednej návšteve lekára v rámci štúdie bol zistený priemerný nárast telesnej hmotnosti
z východiskovej hodnoty o 1,4 kg v skupine s inzulínom-glargínom a priemerný pokles o 0,8 kg v skupine so štandardnou liečbou.
Pediatrická populácia
V randomizovanej, kontrolovanej klinickej štúdii boli pediatrickí pacienti (vo veku od 6 do 15 rokov)
s diabetom 1. typu (n=349) liečení po dobu 28 týždňov v inzulínovom režime bazál-bolus, kde bol použitý regulárny ľudský inzulín pred každým jedlom. Inzulín-glargín sa podával jedenkrát denne
pred spaním a NPH ľudský inzulín sa podával jedenkrát alebo dvakrát denne. V obidvoch liečených
skupinách sa pozorovali podobné účinky na glykovaný hemoglobín a výskyt symptomatickej hypoglykémie, avšak hladina plazmatickej glukózy nalačno klesla z východiskovej hodnoty viac v skupine s inzulínom-glargínom ako v skupine s NPH. V skupine s inzulínom-glargínom bol taktiež menej častý výskyt ťažkej hypoglykémie. Stoštyridsaťtri pacientov liečených inzulínom-glargínom v tejto štúdii pokračovalo v liečbe inzulínom-glargínom v nekontrolovanom predĺžení štúdie, pričom sledovanie trvalo priemerne 2 roky. Počas tejto predĺženej liečby inzulínom-glargínom sa nezaznamenali žiadne nové signály týkajúce sa bezpečnosti.
Taktiež sa uskutočnila „crossover“ štúdia (so skríženým dizajnom) porovnávajúca liečbu inzulínom- glargínom plus inzulínom lispro s liečbou inzulínom NPH plus regulárny ľudský inzulín (každá liečba sa podávala 16 týždňov v náhodnom poradí) u 26 dospievajúcich vo veku 12 až 18 rokov s diabetom
1. typu. Rovnako ako vo vyššie uvedenej pediatrickej štúdii pokles hladiny plazmatickej glukózy nalačno z východiskovej hodnoty bol väčší v skupine s inzulínom-glargínom ako v skupine s NPH.
Zmeny HbA1c z východiskovej hodnoty boli v obidvoch liečených skupinách podobné; hodnoty hladiny glukózy v krvi zaznamenané počas noci boli významne vyššie v skupine inzulínom-glargínom
/ lispro ako v skupine NPH/bežný ľudský inzulín, s priemernou najnižšou hodnotou (nadir) 5,4 mmol/l oproti 4,1 mmol/l. Tomu zodpovedal výskyt nočnej hypoglykémie, ktorý bol 32 % v skupine
s inzulínom-glargínom / lisprom oproti 52 % v skupine NPH/regulárny ľudský inzulín.
Bola vykonaná štúdia trvajúca 24 týždňov s paralelnými skupinami u 125 detí vo veku od 2 do 6 rokov s diabetom 1. typu porovnávajúca inzulín-glargín podávaný raz denne ráno s NPH inzulínom podávaným raz alebo dvakrát denne ako bazálny inzulín. Obidve skupiny dostávali bolusový inzulín pred jedlom. Primárny cieľ preukázať non-inferioritu inzulínu glargínu v porovnaní s NPH inzulínom vo všetkých hypoglykémiách nebol dosiahnutý a pri inzulíne glargíne bol trend narastania
hypoglykemických príhod [inzulín-glargín: NPH pomer výskytu (95% CI) = 1,18 (0,97-1,44)]. Hodnota glykovaného hemoglobínu a variabilita glukózy bola porovnateľná v obidvoch liečebných skupinách. V tejto štúdii sa nepozorovali žiadne nové bezpečnostné signály.
5.2 Farmakokinetické vlastnosti
Absorpcia
U zdravých jedincov a diabetikov ukázali sérové koncentrácie inzulínu pomalšiu a oveľa dlhšiu
absorpciu a po subkutánnej injekcii inzulínu glargínu v porovnaní s ľudským NPH inzulínom chýbal
vrchol. Koncentrácie teda zodpovedali časovému profilu farmakodynamického účinku inzulínu glargínu. Vyššie uvedený graf č. 1 ukazuje profily farmakodynamického účinku inzulínu glargínu a NPH inzulínu.
Inzulín-glargín podaný raz denne dosiahne hladinu rovnovážneho stavu za 2-4 dni po prvej dávke.
Biotransformácia
Po podaní subkutánnej injekcie diabetickým pacientom sa inzulín-glargín rýchlo metabolizuje v
uhlíkovom zakončení beta reťazca za vzniku dvoch aktívnych metabolitov M1 (21A-Gly-inzulín)
a M2 (21A-Gly-des-30B-Thr-inzulín). Hlavná cirkulujúca zlúčenina v plazme je metabolit M1. Expozícia M1 sa zvyšuje s podanou dávkou inzulínu glargínu.
Farmakokinetické a farmakodynamické výsledky uvádzajú, že účinok inzulínu glargínu podaného subkutánnou injekciou je v zásade založený na expozícii M1. Inzulín-glargín a metabolit M2 neboli
u veľkej väčšiny prípadov zistiteľné a ak sa zistili, ich koncentrácia nebola závislá od podanej dávky inzulínu glargínu.
Eliminácia
Pri intravenóznom podaní je polčas eliminácie inzulínu glargínu a ľudského inzulínu porovnateľný.
Osobitné skupiny pacientov
V klinických štúdiách sa v jednotlivých podskupinách rozdelených podľa veku a rodu nezistili žiadne
rozdiely v bezpečnosti a účinnosti pri liečbe inzulínom-glargínom v porovnaní s celkovou študovanou
populáciou.
Pediatrická populácia
V jednej klinickej štúdii sa posudzovala farmakokinetika u detí vo veku od 2 do menej ako 6 rokov
s diabetom 1. typu (pozri časť 5.1). Merali sa najnižšie plazmatické hladiny inzulínu glargínu a jeho
hlavných metabolitov M1 a M2 u detí liečených inzulínom-glargínom. Merania preukázali, že plazmatické koncentrácie boli podobné ako u dospelých a pri dlhodobom podávaní sa nezistil žiadny dôkaz akumulácie inzulínu glargínu ani jeho metabolitov.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podaní, genotoxicity, karcinogénneho potenciálu a reprodukčnej toxicity neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
oxid zinočnatý metakrezol glycerol
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
voda na injekcie
6.2 Inkompatibility
Tento liek sa nesmie miešať so žiadnymi inými liekmi.
6.3 Čas použiteľnosti
2 roky.
Čas použiteľnosti po prvompoužití
Liek sa môže uchovávať maximálne 28 dní pri teplote neprevyšujúcej 30 °C tak, aby nebol vystavený
priamemu teplu ani priamemu svetlu. Používané perá sa nesmú uchovávať v chladničke.
Po každom podaní injekcie nasaďte vrchnák opäť na pero, aby ste ho chránili pred svetlom.
6.4 Špeciálne upozornenia na uchovávanie
Pred použitím
Uchovávajte v chladničke (2 °C - 8 °C).
Neuchovávajte v mrazničke.
Neuchovávajte ABASAGLAR v blízkosti mraziaceho výparníka ani zmrazených chladiacich vložiek.
Naplnené perá uchovávajte vo vonkajšom obale na ochranu pred svetlom. Počaspoužitia
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
KwikPen
3 ml roztoku v náplni (z bezfarebného skla typu 1) s dávkovacím tlačidlom (z halobutylovej gumy)
a okrúhlou zátkou (guma z polyizoprénového laminátu a halobutylu) s hliníkovým tesniacim krytom. Náplň je uzavretá v jednorazovom pere.
Balenie po 5 naplnených pier a multibalenie obsahujúce 10 (2 balenia po 5) naplnených pier.
Tempo Pen
3 ml roztoku v náplni (z bezfarebného skla typu 1) s dávkovacím tlačidlom (z halobutylovej gumy)
a okrúhlou zátkou (guma z polyizoprénového laminátu a halobutylu) s hliníkovým tesniacim krytom.
Náplň je uzavretá v jednorazovom pere. Tempo Pen obsahuje magnet (pozri časť 4.4). Balenie po 5 naplnených pier a multibalenie obsahujúce 10 (2 balenia po 5) naplnených pier. Na trh nemusia byť uvedené všetky veľkosti balenia.
Ihly nie sú súčasťou balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
ABASAGLAR sa nesmie miešať so žiadnym iným inzulínom a nesmie sa ani riediť. Miešanie alebo riedenie môže zmeniť jeho čas/profil účinku a miešanie môže spôsobiť precipitáciu.
Pred použitím skontrolujte náplň. Môže sa použiť len ak je roztok číry, bezfarebný, bez viditeľných tuhých častí a len ak má konzistenciu podobnú vode. Keďže ABASAGLAR je roztok, nevyžaduje pred použitím resuspenzáciu.
ABASAGLAR sa nesmie miešať so žiadnym iným inzulínom a nesmie sa ani riediť. Miešanie alebo riedenie môže zmeniť jeho čas/profil účinku a miešanie môže spôsobiť precipitáciu.
Prázdne perá sa nesmú opätovne použiť a musia sa náležite zlikvidovať.
Aby sa zabránilo možným prenosným ochoreniam, musí každé pero používať len jeden pacient. Pred každou injekciou je nutné vždy skontrolovať označenie na inzulíne, aby sa zabránilo zámene
inzulínu glargínu za iné inzulíny (pozri časť 4.4).
Pacient musí byť upozornený, aby si pred použitím pera s injekčným roztokom ABASAGLARU
v naplnenom pere pozorne prečítal návod na používanie, ktorý je súčasťou písomnej informácie pre používateľa.
Tempo Pen
Pero Tempo Pen je navrhnuté pre použitie s modulom Tempo Smart Button. Tento Tempo Smart
Button je voliteľným prvkom, ktorý sa dá pripojiť k dávkovaciemu tlačidlu Tempo Penu a pomáha prenášať informácie o dávke Abasaglaru z Tempo Penu do kompatibilnej mobilnej aplikácie. Pero Tempo Pen sa môže používať s pripojeným modulom Tempo Smart Button alebo bez neho. Ďalšie informácie ako prenášať údaje do mobilnej aplikácie nájdete v pokynoch dodaných s modulom Tempo Smart Button a pokynoch dodaných s mobilnou aplikáciou.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Holandsko
8. REGISTRAČNÉ ČÍSLA
EU/1/14/944/007
EU/1/14/944/008
EU/1/14/944/012
EU/1/14/944/013
EU/1/14/944/014
EU/1/14/944/015
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 09. septembra 2014
Dátum posledného predĺženia: 25. júla 2019
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu