
é) sa neodporúča (pozri časť 5.2).
Opatrenia pred začatím liečby
Pred začatím liečby venujte pozornosť typu závislosti od opioidov (t. j. dlhodobo alebo krátkodobo pôsobiace opioidy), dobe od posledného užitia opioidu a stupňa závislosti od opioidov. Aby sa
predišlo urýchleniu vzniku abstinenčných príznakov, indukcia buprenorfínom/naloxónom sa má začať
vtedy, keď sú prítomné objektívne a jasné abstinenčné príznaky(na základe skóre signalizujúceho mierny až stredný abstinenčný syndróm podľa schválenej klinickej stupnice závislosti od opioidov (Clinical Opioid Withdrawal Scale; COWS)).
· U pacientov závislých od heroínu alebo krátkodobo pôsobiacich opioidov sa prvá dávka buprenorfínu/naloxónu má podať vtedy, keď sa objavia prejavy abstinenčného syndrómu, ale
nie skôr ako 6 hodín po poslednom užití dávky opioidu.
· U pacientov užívajúcich metadón je potrebné pred začiatkom terapie buprenorfínom/naloxónom znížiť dávku metadónu na maximálne 30 mg/denne. Pri začatí podávania
buprenorfínu/naloxónu treba vziať do úvahy dlhý biologický polčas metadónu. Prvá dávka buprenorfínu/naloxónu sa má podať až vtedy, keď sa objavia prejavy abstinenčného syndrómu, ale nie skôr ako 24 hodín po poslednom užití dávky metadónu. Buprenorfín môže vyvolať abstinenčné príznaky u pacientov závislých od metadónu.
Pred začatím liečby sa odporúčajú východiskové testy zamerané na fungovanie pečene a dokumentácia o stave vírusovej hepatitídy. Pacientom s pozitívnym výsledkom testu na vírusovú hepatitídu, užívajúcim súbežne iné lieky (pozri časť 4.5) a/alebo pacientom, ktorí už majú dysfunkciu pečene, hrozí riziko urýchlenia poškodenia pečene. Odporúča sa pravidelné monitorovanie fungovania pečene (pozri časť 4.4).
Dávkovanie
Začatie liečby
V záujme zabezpečenia riadneho sublingválneho umiestnenia dávky sa pri začatí liečby odporúča každodenný dohľad nad dávkovaním a sledovanie reakcie pacienta na liečbu, čo umožní usmerniť efektívne titrovanie dávky podľa klinického účinku.
Indukcia
Odporúčaná začiatočná dávka u dospelých a dospievajúcich nad 15 rokov je dávka 1,4 mg/0,36 mg alebo 2,9 mg/0,71 mg Zubsolvu denne. V závislosti od individuálnej potreby pacienta možno v prvý deň podať ďalšiu tabletu Zubsolvu 1,4 mg/0,36 mg alebo 2,9 mg/0,71 mg.
Úprava dávkovania a udržiavacia liečba
Po indukcii liečby v prvý deň je potrebné pacienta v priebehu niekoľkých najbližších dní postupne stabilizovať na udržiavaciu dávku úpravou dávky podľa individuálneho klinického účinku. Pacienti musia byť monitorovaní počas titrácie dávky. Pri krokoch po 1,4 – 5,7 mg buprenorfínu sa táto titrácia riadi podľa opakovaných posúdení klinického a psychologického stavu pacienta a nemá prekročiť maximálnu jednotlivú dennú dávku 17,2 mg buprenorfínu (podávanú napr. ako 11,4 + 5,7 mg,
2 x 8,6 mg alebo 3 x 5,7 mg).
Sila 0,7 mg/0,18 mg sa má používať na doladenie dávky u pacientov hlavne počas ukončovania liečby alebo pri problémoch so znášanlivosťou počas titrácie.
Ak je to možné, lekári by pri predpisovaní mali uprednostňovať režim jednej tablety jedenkrát denne, aby sa minimalizovalo riziko zneužitia.Dávkovanie menej ako raz denne
Po uspokojivej stabilizácii sa frekvencia dávkovania môže znížiť na podávanie každý druhý deň,
pričom dávka je dvojnásobkom individuálne titrovanej dennej dávky. U niektorých pacientov môže byť po uspokojivej stabilizácii frekvencia podávania znížená na 3-krát týždenne (napríklad v
pondelok, stredu a piatok). Dávka v pondelok a v stredu má byť dvojnásobkom individuálne titrovanej dennej dávky a piatková dávka má byť trojnásobkom individuálne titrovanej dennej dávky bez
podania dávky v ostatných dňoch). Dávka podaná v ktorýkoľvek deň však nemá prekročiť množstvo
17,2 mg buprenorfínu. Pre pacientov vyžadujúcich titrovanú dennú dávku > 5,7 mg buprenorfínu/deň nemusí byť tento režim vhodný.
Medicínsky navodená abstinencia
Ak pacient súhlasí, po uspokojivej stabilizácii možno dávku postupne znížiť na nižšiu udržiavaciu dávku, v niektorých priaznivých prípadoch možno liečbu aj ukončiť. Dostupnosť tabliet v šiestich rôznych silách pomáha pri titrácii a znižovaní dávky. Pacientov treba po medicínsky navodenej abstinencii monitorovať z dôvodu možnej recidívy.
Osobitné populácie
Starší pacienti
Bezpečnosť a účinnosť buprenorfínu/naloxónu u starších pacientov vo veku nad 65 rokov neboli stanovené. Nie je možné uviesť odporúčania na dávkovanie.
Porucha funkcie pečene
Pred začatím liečby sa odporúča vykonať východiskové pečeňové testy a zdokumentovať stav vírusovej hepatitídy. Pacientom, ktorí sú pozitívni na vírusovú hepatitídu, súbežne užívajú iné lieky (pozri časť 4.5) alebo už majú poruchu funkcie pečene, hrozí rýchlejšie poškodenie pečene. Odporúča sa pravidelné sledovanie pečeňových funkcií (pozri časť 4.4).
Obidve liečivá v lieku Zubsolv, buprenorfín a naloxón, sa rozsiahlo metabolizujú v pečeni a u pacientov so stredne ťažkým a ťažkým poškodením pečene boli zaznamenané zvýšené plazmatické hladiny buprenorfínu a naloxónu. Pacienti majú byť sledovaní na prejavy a symptómy vysadenia opioidov, toxicity alebo predávkovania spôsobenéhozvýšenou hladinou naloxónu alebo buprenorfínu.
Keďže farmakokinetika buprenorfínu/naloxónu môže byť u pacientov s poruchou funkcie pečene zmenená, u pacientov s miernou až stredne ťažkou poruchou funkcie pečene sa odporúčajú nižšie začiatočné dávky a opatrná titrácia dávky (pozri časť 5.2). Buprenorfín/naloxón je kontraindikovaný pacientom s ťažkým poškodením pečene (pozri časť 4.3 a 5.2).
Porucha funkcie obličiek
U pacientov s poruchou funkcie obličiek nie je nutná úprava dávky buprenorfínu/naloxónu. Opatrnosťsa odporúča pri dávkovaní u pacientov s ťažkou poruchou funkcie obličiek (klírens kreatinínu < 30 ml/min) (pozri časti 4.4 a 5.2).
Pediatrická populácia
Bezpečnosť a účinnosť buprenorfínu/naloxónu u detí vo veku do 15 rokov neboli stanovené. K
dispozícii nie sú žiadne údaje.
Spôsob podávania
Lekári musia varovať pacientov, že sublingválna cesta je jedinou účinnou a bezpečnou cestou podania
tohto lieku (pozri časť 4.4). Tableta sa umiestni pod jazyk, kým sa úplne nerozpustí. Pacienti nesmú prehĺtať alebo konzumovať potraviny alebo nápoje, kým sa tableta úplne nerozpustí.
Zubsolv sa zvyčajne rozpadne do 40 sekúnd, pacient však môže pocítiť úplné rozpustenie tablety v ústach až po 5 – 10 minútach.
Ak je potrebné užiť viacero tabliet, môžu sa užiť všetky naraz alebo v dvoch rozdelených dávkach;
pričom druhá dávka sa užíva ihneď po rozpustení prvej dávky.
4.3 Kontraindikácie
Precitlivenosť na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Ťažká respiračná nedostatočnosť.
Ťažké poškodenie funkcie pečene.
Akútny alkoholizmus alebo delírium tremens.
Súbežné podávanie antagonistov opioidov (naltrexón, nalmefén) na liečbu závislosti od alkoholu alebo opioidov.
4.4 Osobitné upozornenia a opatrenia pri používaní
Nesprávne užívanie, zneužívanie a nevhodné užívanie
Buprenorfín môže byť nesprávne užívaný alebo zneužívaný podobne ako ostatné opioidy, legálne
alebo nelegálne. Niektoré riziká nesprávneho užívania a zneužívania zahŕňajú predávkovanie, šírenie vírusových alebo lokalizovaných a systémových infekcií krvnou cestou, útlm dýchania a poškodenie pečene. Nesprávne užívanie buprenorfínu inou osobou ako určeným pacientom predstavuje ďalšie
riziko nových narkomanov, ktorí užívajú buprenorfín ako primárny zneužívaný liek a môže k tomu dôjsť, ak je liek distribuovaný na nezákonné použitie priamo určeným pacientom, alebo ak liek nie je chránený proti krádeži.
Liečba buprenorfínom/naloxónom v dávkach pod úrovňou optimálneho množstva môže viesť k zneužitiu lieku pacientom a následnému predávkovaniu alebo ukončeniu liečby. Pacient, ktorý užíva nižšie dávky buprenorfínu/naloxónu, môže naďalej reagovať na nekontrolované abstinenčné príznaky samoliečbou opioidmi, alkoholom alebo inými sedatívami – hypnotikami, napríklad benzodiazepínmi.
S cieľom minimalizovať riziko nesprávneho použitia, zneužitia a nevhodného použitia musia lekári prijať vhodné opatrenia pri predpisovaní a výdaji buprenorfínu, napríklad nepredpisovať viacero náhradných balení na začiatku liečby a vykonávať kontroly pacienta s klinickým sledovaním podľa jeho potrieb.
Kombinácia buprenorfínu s naloxónom v Zubsolve má odradiť od nesprávneho užívania a zneužívania buprenorfínu. Predpokladá sa, že intravenózne alebo intranazálne zneužívanie Zubsolvu bude menej pravdepodobné ako samotného buprenorfínu, pretože naloxón v Zubsolve môže vyvolať abstinenčné príznaky u osôb závislých od heroínu, metadónu alebo iných opioidných agonistov.
Útlm dýchania
Je opísaných množstvo prípadov úmrtí v dôsledku útlmu dýchania, najmä pri podaní buprenorfínu v
kombinácii s benzodiazepínmi (pozri časť 4.5), alebo ak sa buprenorfín nepoužíval tak, ako je predpísané. Úmrtia boli hlásené aj v súvislosti so súbežným užitím buprenorfínu s ďalším látkami s tlmiacim účinkom na CNS, ako je alkohol alebo iné opioidy.
Ak je buprenorfin podávaný osobám bez závislosti na opioidoch, ktoré nemajú vytvorenú toleranciu na účinky opioidov, môže potenciálne dôjsť k fatálnemu útlmu dýchania.-
U pacientov s astmou alebo respiračnou nedostatočnosťou (napr. chronickou obštrukčnou chorobou pľúc, cor pulmonale, zníženou respiračnou rezervou, hypoxiou, hyperkapniou, už existujúcim útlmom dýchania alebo kyfoskoliózou [zakrivením chrbtice vedúcim k potenciálnej dýchavičnosti]) sa musí tento liek používať s opatrnosťou.
Buprenorfín/naloxón môže v prípade neúmyselného alebo úmyselného požitia spôsobiť vážny a potenciálne smrteľný útlm dýchania u detí a osôb bez závislosti. Pacienti musia byť upozornení, aby blister skladovali na bezpečnom mieste, nikdy ho neotvárali predčasne, uchovávali ho mimo dohľadu a dosahu detí a iných členov domácnosti a neužívali liek pred deťmi. V prípade neúmyselného požitia alebo podozrenia na požitie ihneď kontaktujte rýchlu lekársku pomoc.
Útlm CNS
Buprenorfín/naloxón môže spôsobiť ospalosť, zvlášť pri užívaní spolu s alkoholom alebo s liekmi s
tlmiacim účinkom na CNS (ako sú trankvilizéry, sedatíva a hypnotiká) (pozri časť 4.5).
Závislosť
Buprenorfín je parciálny agonista μ (mí)-opioidného receptora a chronické podávanie vyvoláva
závislosť opioidného typu. Štúdie na zvieratách ako aj klinické skúsenosti preukázali, že buprenorfín môže vyvolať závislosť, ale na nižšej úrovni ako úplný agonista, napr. morfín.
Náhle prerušenie liečby sa neodporúča, pretože následkom môže byť abstinenčný syndróm, ktorý môže mať oneskorený nástup.
Hepatitída a hepatické udalosti
V klinických štúdiách aj v správach o nežiaducich účinkoch po uvedení na trh boli u osôb závislých od
opioidov hlásené prípady akútneho poškodenia pečene. Spektrum abnormalít siaha od prechodných asymptomatických zvýšení pečeňových transamináz až po prípady zlyhania pečene, pečeňovej nekrózy, hepatorenálneho syndrómu, hepatálnej encefalopatie a smrti. V mnohých prípadoch môže zohrať príčinnú alebo pomocnú úlohu prítomnosť už existujúceho mitochondriálneho poškodenia (genetické ochorenie, pečeňovéenzýmy mimo normy, infekcia vírusmi hepatitídy typu B alebo hepatitídy typu C, nadmerná konzumácia alkoholu, anorexia, súbežné užívanie iných potenciálne hepatotoxických liekov) a pokračujúce injekčné užívanie drog. Tieto faktory sa musia vziať do úvahy
pred predpísaním buprenorfínu/naloxónu a počas liečby. V prípade podozrenia na hepatickú udalosť sa vyžaduje ďalšie biologické a etiologické zhodnotenie. V závislosti od týchto nálezov sa môže užívanie lieku opatrne prerušiť tak, aby sa predišlo abstinenčným príznakom a aby sa zabránilo návratu k užívaniu drog. Pokiaľ sa v liečbe pokračuje, je potrebné pozorne sledovať činnosť pečene.
Urýchlenie abstinenčného syndrómu po opioidoch
Pri začatí liečby buprenorfínom/naloxónom si musí lekár uvedomiť parciálny agonistický profil
buprenorfínu, ktorý môže urýchliť abstinenčné príznaky u pacientov závislých od opioidov, najmä ak sa podá skôr ako 6 hodín od poslednej dávky heroínu alebo iného krátkodobo pôsobiaceho opioidu, alebo ak sa podá skôr ako 24 hodín od poslednej dávky metadónu. Aby sa zabránilo urýchleniu vzniku abstinenčných príznakov, indukcia má byť uskutočnená buprenorfínom/naloxónom, ak sú prítomné objektívne abstinenčné príznaky (pozri časť 4.2). Počas prechodu z buprenorfínu alebo metadónu na buprenorfín/naloxón musia byť pacienti pozorne sledovaní, pretože boli hlásené abstinenčné príznaky.
Abstinenčné príznaky môžu súvisieť aj s nižším ako optimálnym dávkovaním. Poruchafunkciepečene
Vplyv poškodenia pečene na farmakokinetiku buprenorfínu a naloxónu bol vyhodnocovaný v štúdii po
uvedení lieku na trh. Keďže buprenorfín a naloxón sa rozsiahlo metabolizujú v pečeni, u pacientov so stredne ťažkým a ťažkým poškodením pečene boli po podaní jednej dávky zaznamenané zvýšené plazmatické koncentrácie buprenorfínu a naloxónu. Pacienti majú byť sledovaní, či nevykazujú prejavy a symptómy vysadenia opioidov, toxicity alebo predávkovania spôsobeného zvýšenou hladinou naloxónu a/alebo buprenorfínu. Sublingválne tablety Zubsolv sa musia používať s opatrnosťou u pacientov so stredne ťažkým poškodením pečene (pozri časť 4.2 a 5.2). Použitie buprenorfínu/naloxónu je kontraindikované pacientom so závažnou nedostatočnosťou pečene (pozri časť 4.3).
Porucha funkcie obličiek
Vylučovanie obličkami môže trvať dlhšie, pretože 30 % podanej dávky sa vylučuje renálnou cestou. U
pacientov s poruchou funkcie obličiek sa akumulujú metabolity buprenorfínu. Pri dávkovaní u pacientov s ťažkou poruchou funkcie obličiek sa odporúča opatrnosť (klírens kreatinínu < 30 ml/min) (pozri časti 4.2 a 5.2).
Použitie u dospievajúcich (vek 15 – < 18 rokov)
Vzhľadom na nedostatok údajov u dospievajúcich (vo veku 15 – < 18 rokov) musia byť pacienti v
tejto vekovej kategórii počas liečby pozorne sledovaní. Zameniteľnosťliekovobsahujúcichbuprenorfín
Dávka v mg môže byť pri každom lieku obsahujúcom buprenorfín iná a lieky nie sú priamo zameniteľné. Pacienti musia byť preto monitorovaní, ak u nich dochádza k zmene lieku obsahujúceho buprenorfín, keďže v niektorých jednotlivých prípadoch môžu byť významné rozdiely v biologickej dostupnosti (pozri časť 5.2). Preto môže byť potrebná úprava dávkovania.
Inhibítory CYP 3A
Lieky, ktoré inhibujú enzým CYP3A4, môžu zvýšiť koncentrácie buprenorfínu. Môže byť potrebné
zníženie dávky buprenorfínu/naloxónu. Pacientom, ktorí už sú liečení inhibítormi CYP3A4, je potrebné starostlivo titrovať dávku buprenorfínu/naloxónu, pretože týmto pacientom môže byť postačujúca aj znížená dávka (pozri časť 4.5).
Všeobecné upozornenia týkajúce sa podávania opioidov
Opioidy môžu vyvolať ortostatickú hypotenziu u ambulantne liečených pacientov. .
Opioidy môžu zvýšiť tlak mozgovomiechového moku a spôsobiť tak záchvaty, u pacientov s poranením hlavy, vnútrolebkovými léziami alebo inými stavmi, ktoré zvyšujú tlak mozgovomiechového moku alebo s anamnézou záchvatov je preto nutné používať opioidy s opatrnosťou.
U pacientov s hypotenziou, hypertrofiou prostaty alebo s uretrálnou stenózou sa pri používaní opioidov vyžaduje opatrnosť.
Opioidmi vyvolaná mióza, zmeny v úrovni vedomia alebo zmeny vo vnímaní bolesti ako symptómu ochorenia môžu narušiť vyhodnotenie stavu pacienta alebo prekryť diagnózu alebo klinický priebeh sprievodného ochorenia.
Opatrnosť pri používaní opioidov sa vyžaduje u pacientov s myxedémom, hypotyreózou alebo adrenokortikálnou nedostatočnosťou (napr. Addisonovou chorobou).
Preukázalo sa, že opioidy zvyšujú tlak v žlčovode a je nutné ich používať s opatrnosťou u pacientov s dysfunkciou žlčových ciest.
Pri podávaní opioidov starším alebo chorobou oslabeným pacientom treba postupovať opatrne. Na základe skúseností s morfínom (pozri časť 4.5) môže súbežné užívanie inhibítorov
monoaminooxidázy (IMAO) zosilniť účinky opioidov.
4.5 Liekové a iné interakcie
Zubsolv sa nesmie používať spoločne s týmito látkami:
· naltrexón a nalmefén sú antagonisty opioidov, ktoré dokážu zablokovať farmakologické účinky buprenorfínu. Počas liečby buprenorfínom/naloxónom je súbežné podávanie kontraindikované vzhľadom na potenciálne nebezpečnú interakciu, ktorá môže vyvolať náhly nástup dlhodobých a intenzívnych abstinenčných príznakov v spojitosti s opioidmi (pozri časť 4.3).
Zubsolv sa nemá používať spoločne s týmito látkami:
· alkoholickými nápojmi alebo liekmi obsahujúcimi alkohol, pretože alkohol zvyšuje sedatívny účinok buprenorfínu (pozri časť 4.7).
Zubsolv sa má používať s opatrnosťou pri súbežnom podávaní týchto liekov:
· benzodiazepíny: Táto kombinácia môže viesť k smrti v dôsledku útlmu dýchania centrálneho pôvodu. Dávkovanie sa preto musí obmedziť a tejto kombinácii treba zamedziť, ak existuje riziko zneužitia. Pacientov treba upozorniť, že počas užívania tohto lieku je samoliečba benzodiazepínmi bez predpisu mimoriadne nebezpečná a musia byť upozornení, aby benzodiazepíny užívali súbežne s týmto liekom len podľa pokynov svojho lekára (pozri časť
4.4),
· ďalšie lieky tlmiace centrálnu nervovú sústavu, ostatné opioidné deriváty (napr. metadón, analgetiká a antitusiká), niektoré antidepresíva, sedatívne antagonisty H1-receptorov, barbituráty, anxiolytiká iné ako benzodiazepíny, neuroleptiká, klonidín a príbuzné látky: tieto kombinácie zvyšujú útlm centrálnej nervovej sústavy. Zníženie úrovne pozornosti môže byť nebezpečné pri vedení vozidiel a obsluhovaní strojov,
· úplný opioidný agonista: pri podaní úplného opioidného agonistu pacientom užívajúcim buprenorfín/naloxón môže byť náročné dosiahnuť dostatočnú analgéziu. Vzhľadom na to existuje možnosť predávkovania úplným agonistom, najmä pri pokusoch o prekonanie účinkov parciálneho agonistu buprenorfínu, alebo poklese hladiny buprenorfínu v plazme,
· inhibítory CYP3A4: výsledkom interakčnej štúdie buprenorfínu s ketokonazolom (silným inhibítorom CYP3A4) bolo zvýšenie hodnôt Cmax a AUC (plochy pod krivkou) buprenorfínu (približne o 50 % a70 % v uvedenom poradí) a v menšej miere aj norbuprenorfínu. Pacienti užívajúci Zubsolv musia byť starostlivo monitorovaní a pri kombinácii so silnými inhibítormi CYP3A4 (napr. inhibítormi proteázy, ako sú ritonavir, nelfinavir alebo indinavir, alebo azolovými antimykotikami, ako sú ketokonazol, itrakonazol, alebo makrolidovými antibiotikami) môžu vyžadovať zníženie dávky,
· induktory CYP3A4: súbežné užívanie induktorov CYP3A4 s buprenorfínom môže znížiť koncentrácie buprenorfínu v plazme a potenciálne vyústiť k suboptimálnej liečbe závislosti od opioidov buprenorfínom. V prípade súbežného podávania induktorov (napr. fenobarbitalu, karbamazepínu, fenytoínu, rifampicínu) sa odporúča dôkladne monitorovať pacientov užívajúcich buprenorfín/naloxón. Dávku buprenorfínu či induktora CYP3A4 možno bude potrebné príslušne prispôsobiť.
· na základe skúseností s morfínom môže súbežné užívanie inhibítorov monoaminooxidázy
(IMAO) zosilniť účinky opioidov.
4.6 Fertilita, gravidita a laktácia
Gravidita
Dostatočné údaje o použití buprenorfínu/naloxónu u tehotných žien nie sú k dispozícii. Štúdie na
zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Potenciálne riziko pre ľudí je neznáme.
Ku koncu tehotenstva môže buprenorfín vyvolať útlm dýchania u novorodenca, a to dokonca aj po krátkej dobe podávania. Dlhodobé podávanie buprenorfínu počas posledných troch mesiacov gravidity môže spôsobiť abstinenčný syndróm u novorodenca (napr. hypertónia, novorodenecký tremor, novorodenecká agitácia, myoklonus alebo kŕče). K syndrómu dochádza zvyčajne oneskorene,
niekoľko hodín až niekoľko dní po pôrode.
Vzhľadom na dlhý biologický polčas buprenorfínu sa má na konci tehotenstva zvážiť niekoľkodňové pozorovanie novorodenca, aby sa zabránilo riziku respiračného útlmu alebo abstinenčného syndrómu u novorodenca.
Okrem toho je nutné, aby používanie buprenorfínu/naloxónu počas tehotenstva posúdil lekár. Buprenorfín/naloxón sa majú používať počas gravidity len v prípade, že potenciálnyprínos preváži nad potenciálnym rizikom pre plod.
Dojčenie
Zistilo sa, že buprenorfín inhibuje laktáciu u potkanov. Buprenorfín a jeho metabolity sa vylučujú do
materského mlieka. Nie je známe, či naloxón alebo jeho metabolity prechádzajú do materského mlieka. Počas liečby Zubsolvom je preto potrebné prerušiť dojčenie.
Fertilita
Štúdie na zvieratách preukázali zníženie fertility u samíc pri vysokých dávkach (pri systémovej expozícii > 2,4-krát vyššej ako expozícia u človeka pri maximálnej odporúčanej dávke 17,2 mg buprenorfínu na základe AUC) (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeBuprenorfín/naloxón má malý až mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje, ak je podaný pacientom závislým od opioidov. Tento liek môže spôsobiť ospalosť, závraty alebo poruchy myslenia, a to najmä počas indukcie liečby a zmene dávkovania. Ak sa užíva spolu s alkoholom alebo liekmi s tlmiacim účinkom na centrálnu nervovú sústavu, je pravdepodobné, že účinok bude ešte výraznejší (pozri časti 4.4 a 4.5).
Pacienti musia byť upozornení na nebezpečenstvo pri vedení vozidiel alebo obsluhe nebezpečných strojov pre prípad, že buprenorfín/naloxón môže ovplyvniť ich schopnosti vykonávať tieto činnosti.
4.8 Nežiaduce účinkySúhrn bezpečnostného profiluNajčastejšie hlásené nežiaduce reakcie súvisiace s liečbou počas pivotných klinických štúdií boli
zápcha a príznaky obyčajne spojené s abstinenčným stavom (t. j. nespavosť, bolesť hlavy, nevoľnosť, nadmerné potenie a bolesť). Niektoré hlásenia o záchvatoch, vracaní, hnačke, zvýšených hodnotách pečeňových testov sa považujú za závažné.
Súhrn nežiaducich reakcií v tabuľkeV tabuľke 1 sú zhrnuté nežiaduce reakcie hlásené z pivotných klinických štúdií, v ktorých 342 zo
472 pacientov (72,5 %) hlásilo nežiaduce reakcie, a nežiaduce reakcie hlásené v postmarketingových štúdiách.
Frekvencia nasledujúcich možných vedľajších účinkov je definovaná podľa tejto konvencie : veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥/10 000 až <1/1 000), veľmi zriedkavé (< 1/10 000) a neznáme (z dostupných údajov).
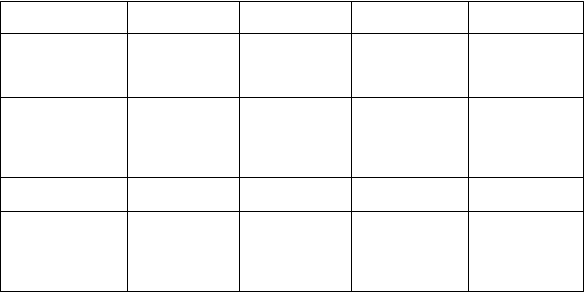 Tabuľka č. 1: S liečbou súvisiace nežiaduce reakcie hlásené v klinických skúšaniach a v štúdiách po uvedení buprenorfínu/naloxónu na trh
Tabuľka č. 1: S liečbou súvisiace nežiaduce reakcie hlásené v klinických skúšaniach a v štúdiách po uvedení buprenorfínu/naloxónu na trh
Trieda orgánových systémov
Veľmi časté Časté Menej časté Neznáme
Infekcie a nákazy Chrípka Infekcia Zápal hltanu Nádcha
Poruchy krvi a lymfatického systému
Poruchy imunitného systému
Poruchy metabolizmu a výživy
Infekcia močových ciest Infekcia pošvy
Anémia Leukocytóza Leukopénia Lymfadenopatia Trombocytopénia
Precitlivenosť Anafylaktický šok
Znížená chuť do jedla Hyperglykémia Hyperlipidémia Hypoglykémia
Psychické poruchy Nespavosť Úzkosť Depresia Zníženie libida Nervozita Porucha myslenia
Nezvyčajné sny
Agitácia Apatia Depersonalizácia Drogová závislosť Eufória
Hostilita
Halucinácie
Poruchy nervového systému
Bolesť hlavy Migréna Závraty Hypertónia Parestézia Ospalosť
Amnézia Hyperkinéza Záchvat Poruchy reči Tremor
Pečeňová encefalopatia Synkopa
Poruchy oka Tupozrakosť
Porucha slzenia
Poruchy ucha a labyrintu Poruchy srdca a srdcovej činnosti
Zápal spojoviek
Mióza
Angína pektoris Bradykardia Infarkt myokardu Palpitácie Tachykardia
Vertigo
Poruchy ciev Hypertenzia
Vazodilatácia
Hypotenzia Ortostatická hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Kašeľ Astma Dýchavičnosť Zívanie
Bronchospazmus
Útlm dýchania
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Zápcha
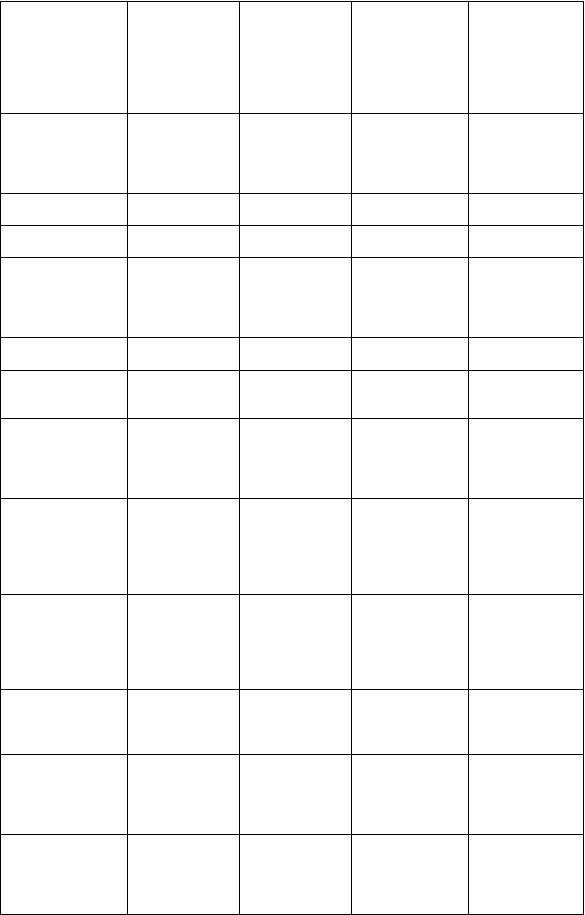
Nevoľnosť
Bolesť brucha Hnačka Dyspepsia Nadúvanie Vracanie
Vredy v ústach Zmena zafarbenia jazyka
Hepatitída
Akútna hepatitída
Žltačka
Nekróza pečene Hepatorenálny syndróm
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Hyperhidróza Svrbenie Vyrážka Žihľavka
Bolesti chrbta Bolesti kĺbov Svalové kŕče Bolesť svalov
Akné Alopécia Exfoliatívna dermatitída Suchá koža Hrčky na koži Artritída
Angioedém
Poruchy obličiek a močových ciest
Zmeny moču Albuminúria Dyzúria Hematúria Nefrolitiáza Retencia moču
Poruchy reprodukčného systému a prsníkov
Erektilná dysfunkcia
Amenorea Poruchy ejakulácie Menorágia Metrorágia
Celkové poruchy a reakcie v mieste podania
Drogové abstinenčné príznaky
Asténia
Bolesť na hrudi Zimnica Horúčka Celkový pocit choroby
Bolesť
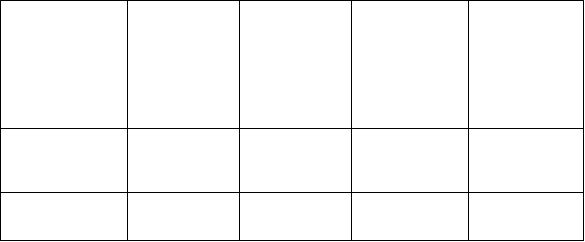
Periférny edém
Hypotermia Abstinenčný syndróm u novorodenca
Laboratórne
a funkčné vyšetrenia
Test funkcie pečene mimo normy
Pokles hmotnosti
Zvýšenie krvného kreatinínu
Zvýšené hodnoty transamináz
Úrazy, otravy a komplikácie liečebného postupu
Poranenie Prehriatie
Popis
vybraných
nežiaducich
reakcií
V prípade zneužitia lieku vnútrožilovým podaním sú niektoré nežiaduce reakcie priraďované práve
zneužitiu ako samotnému lieku. Patria k nim lokálne reakcie, niekedy septické (absces, celulitída), potenciálne závažná akútna hepatitída a iné akútne infekcie, ako napr. pneumónia, endokarditída (pozri časť 4.4).
U pacientov s drogovou závislosťou môže prvé podanie buprenorfínu spôsobiť abstinenčné príznaky podobné príznakom spojeným s naloxónom (pozri časti 4.2 a 4.4).
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 Predávkovanie
Symptómy
Útlm dýchania v dôsledku útlmu centrálnej nervovej sústavy je hlavným symptómom vyžadujúcim si
zásah v prípade predávkovania, pretože môže viesť k zástave dýchania a smrti. Medzi prejavy predávkovania môže patriť tiež ospalosť, tupozrakosť, mióza, hypotenzia, nevoľnosť, vracanie a/alebo poruchy reči.
Liečba
Je potrebné uplatniť všeobecné podporné opatrenia vrátane starostlivého monitorovania respiračnej
funkcie a funkcie srdca u pacienta. Treba aplikovať symptomatickú liečbu útlmu dýchania a štandardné opatrenia intenzívnej starostlivosti. Musia sa zabezpečiť voľné dýchacie cesty pacienta a asistované alebo kontrolované dýchanie. Pacient sa má presunúť do prostredia, v ktorom je k dispozícii kompletné resuscitačné vybavenie.
Ak pacient vracia, je potrebné zabezpečiť, aby nedošlo k vdýchnutiu zvratkov.
Odporúča sa použitie antagonistu opioidov (napr. naloxónu) aj keď môže mať iba mierny vplyv na zvrátenie respiračných symptómov spôsobených buprenorfínom v porovnaní s jeho účinkami na opioidy s úplným agonistickým účinkom.
Pri použití naloxónu treba pri stanovení dĺžky liečby a nutného lekárskeho dohľadu vziať do úvahy dlhé trvanie účinkov buprenorfínu, aby sa predišlo účinkom predávkovania. Naloxón môže byť eliminovaný rýchlejšie ako buprenorfín, čo môže spôsobiť návrat k už kontrolovaným symptómom predávkovania buprenorfínom, takže môže byť potrebné kontinuálne podávanie naloxónu infúziou. Ak infúziu nemožno použiť, môže byť potrebné zopakovať dávkovanie naloxónu. Začiatočné dávky naloxónu sa môžu pohybovať v rozmedzí až do 2 mg a opakovať sa každé 2 – 3 minúty. Rýchlosť prebiehajúcich intravenóznych infúzií sa má titrovať podľa pacientovej reakcie. Ak napriek podaniu naloxónu v celkovej dávke 10 mg nedochádza k reakcii, je potrebné opätovne prehodnotiť diagnózu otravy súvisiacej s opioidmi.'
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Iné liečivá na centrálnu nervovú sústavu, liečivá na terapiu závislostí, ATC kód: N07BC51.
Mechanizmus účinku
Buprenorfín je opioidný parciálny agonista/antagonista, ktorý sa viaže na opioidné receptory v mozgu
μ a κ (kappa). Jeho aktivita v opioidnej udržiavacej liečbe sa vysvetľuje pomalým reverzibilným uvoľňovaním jeho väzby na μ-opioidné receptory, ktoré počas dlhej doby môžu minimalizovať potrebu drog u závislých pacientov.
V priebehu klinických farmakologických štúdií bol u osôb závislých od opioidov pozorovaný efekt stropu opioidných agonistov.
Naloxón je antagonistom μ-opioidných receptorov. Pri perorálnom alebo sublingválnom podaní v obvyklých dávkach u pacientov s abstinenčnými príznakmi po opioidoch vykazuje naloxón malý alebo žiaden farmakologický účinok z dôvodu takmer kompletného metabolizmu pri prvom prechode pečeňou. Ak sa však podá intravenózne pacientom závislým od opioidov, prítomnosť naloxónu v Zubsolve vyvoláva výrazný antagonistický účinok voči opioidom, čím odrádza od zneužitia intravenóznym podaním.
Klinická účinnosť
Údaje o účinnosti a bezpečnosti pre buprenorfín/naloxón sú primárne odvodené z ročnej klinickej
štúdie, ktorá zahŕňala 4-týždňové randomizované dvojito zaslepené porovnanie buprenorfínu/naloxónu a buprenorfínu a placeba, s následnou 48-týždňovou štúdiou bezpečnosti buprenorfínu/naloxónu. V tejto štúdii bol 326 účastníkom závislým od heroínu náhodne pridelený buď buprenorfín/naloxón 16 mg denne, buprenorfín 16 mg denne alebo placebo. U subjektov randomizovaných na ktorúkoľvek aktívnu liečbu sa dávkovanie začalo s 8 mg buprenorfínu v 1. deň, v 2. deň nasledovalo 16 mg (dve 8 mg dávky) buprenorfínu. V 3. deň sa účastníkom randomizovaným na dávku buprenorfínu/naloxónu začala podávať kombinovaná tableta. Účastníci navštevovali kliniku denne (v pondelok až piatok) z dôvodu posúdenia dávkovania a účinnosti. Na víkendy sa poskytovali dávky na domáce použitie. Primárna porovnávacia štúdia mala zhodnotiť účinnosť buprenorfínu a buprenorfín/naloxónu individuálne oproti placebu. Percento vzoriek moču odobratých trikrát týždenne, ktoré boli negatívne na opioidy neužívané v štúdii, bolo štatisticky vyššie pri buprenorfíne/naloxóne v porovnaní s placebom (p < 0,0001) a pri buprenorfíne v porovnaní s placebom (p < 0,0001).
V dvojito zaslepenej, (double-dummy) štúdii paralelných skupín, ktorá porovnáva alkoholový roztok buprenorfínu s úplne agonistickou aktívnou kontrolou, bolo 162 účastníkov randomizovaných do skupiny pre podávanie alkoholového sublingválneho roztoku buprenorfínu v dávke 8 mg/deň (dávka, ktorá je zhruba porovnateľná s dávkou 12 mg/deň buprenorfínu/naloxónu), alebo dvoch relatívne nízkych dávok aktívnej kontroly, z ktorých jedna bola dostatočne nízka, aby slúžila ako alternatíva k placebu, a to počas 3- až 10-dennej fázy indukcie, 16-týždňovej udržiavacej fázy a 7- týždňovej
detoxikačnej fázy. Buprenorfín bol titrovaný na udržiavaciu dávku do 3. dňa; dávky aktívnej kontroly boli titrované postupnejšie. Na základe udržania v liečbe a percenta vzoriek moču odobratých trikrát týždenne, ktoré boli negatívne na opioidy neužívané v štúdii, bol buprenorfín účinnejší ako nízka
dávka kontroly pri udržaní jedincov závislých od heroínu v liečbe a pri znížení ich užívania opioidov v priebehu liečby. Účinnosť buprenorfínu v dávke 8 mg denne bola podobná ako pri stredne aktívnej kontrolnej dávke, ale ekvivalencia nebola preukázaná.
5.2 Farmakokinetické vlastnosti
Zubsolv sa rozpustí obvykle do 40 sekúnd, ale môže trvať 5 až 10 minút, kým pacient pocíti, že tableta v ústach celá zmizla.
Sublingválne tablety Zubsolv majú vyššiu biologickú dostupnosť ako bežné sublingválne tablety. Dávka jednotlivých liekov v mg sa teda môže líšiť. Zubsolv nie je možné zameniť s inými liekmi obsahujúcimi buprenorfín.
V porovnávacích štúdiách biologickej dostupnosti vykazoval Zubsolv 11,4/2,9 mg rovnakú expozíciu buprenorfínu ako 16/4 mg (2 x 8/2 mg) buprenorfínu/naloxónu podávaných ako bežné sublingválne tablety, ale Zubsolv 2 x 1,4/0,36 mg vykazoval o 20 % nižšiu expozíciu buprenorfínu ako 2 x 2/0,5 mg buprenorfínu/naloxónu podávaných ako bežné sublingválne tablety. Expozícia naloxónu z lieku Zubsolv nebola vyššia pri žiadnej testovanej úrovni dávkovania.
Buprenorfín
Absorpcia
Buprenorfín pri perorálnom podaní podlieha prvému metabolizmu s N-dealkyláciou a glukurokonjugáciou v tenkom čreve a pečeni. Použitie tohto lieku perorálnou cestou je preto nevhodné.
Existujú malé odchýlky v parametroch expozície podľa úmernosti dávky buprenorfínu, ako aj odchýlky od prísnej kompozičnej úmernosti pre tri formy s nižšou silou (2,9/0,71, 1,4/0,36
a 0,7/0,18 mg) v porovnaní s tromi liekovými formami s vyššími dávkami. Násobky troch nižších síl
Zubsolvu nemajú nahrádzať ľubovoľnú z troch vyšších síl lieku Zubsolv.
Maximálne plazmatické koncentrácie sa dosiahnu približne 90 minút po sublingválnom podaní.Plazmatické koncentrácie buprenorfínu sa zvyšovali so sublingválnou dávkou buprenorfínu/naloxónu. Spolu so zvýšením dávky sa zvyšovali aj hodnoty Cmax a AUC buprenorfínu, aj keď zvýšenie bolo nižšie ako úmerné dávke.
Distribúcia
Po absorpcii prechádza buprenorfín rýchlou distribučnou fázou (polčas distribúcie 2 až 5 hodín).
Biotransformácia a eliminácia
Buprenorfín sa metabolizuje 14-N-dealkyláciou a glukurokonjugáciou materskej molekuly a dealkylovaného metabolitu. Klinické údaje potvrdzujú, že CYP3A4 je zodpovedný za N-dealkyláciu buprenorfínu. N-dealkylbuprenorfín je μ-opioidný agonista so slabou vnútornou aktivitou.
Eliminácia buprenorfínu má bi- alebo triexponenciálny charakter s priemerným plazmatickým polčasom 32 hodín.
Buprenorfín sa eliminuje hlavne stolicou, žlčovým vylučovaním glukurokonjugovaných metabolitov
(70 %), zvyšok sa eliminuje močom.
Naloxón
Absorpciaadistribúcia
Po intravenóznom podaní sa naloxón rýchlo distribuuje (polčas distribúcie je ~ 4 minúty). Po perorálnom podaní je naloxón v plazme ťažko merateľný. Po podaní buprenorfínu/naloxónu pod jazyk sú plazmatické koncentrácie naloxónu nízke a rýchlo klesajú.
BiotransformáciaNaloxón sa metabolizuje v pečeni, hlavne konjugáciou s glukuronidom a vylučuje sa močom. Naloxón má priemerný plazmatický eliminačný polčas 1,2 hodiny.
Osobitné populácieStarší pacientiFarmakokinetické údaje u starších pacientov nie sú k dispozícii.
Porucha funkcie obličiekEliminácia obličkami má relatívne malú úlohu (~ 30 %) v celkovom klírense buprenorfínu/naloxónu. Úprava dávkovania na základe funkcie obličiek sa nevyžaduje, ale odporúča sa opatrnosť pri dávkovaní u pacientov s ťažkým poškodením obličiek (pozri časť 4.4).
Porucha funkcie pečeneVplyv poškodenia pečene na farmakokinetiku buprenorfínu a naloxónu bol vyhodnocovaný v štúdii po uvedení lieku na trh.
V tabuľke 3 sú zhrnuté výsledky z klinického skúšania, v ktorom sa stanovila expozícia po jednorazovej dávke sublingválnej tablety buprenorfínu/naloxónu u zdravých jedincov a u jedincov s poškodením pečene.
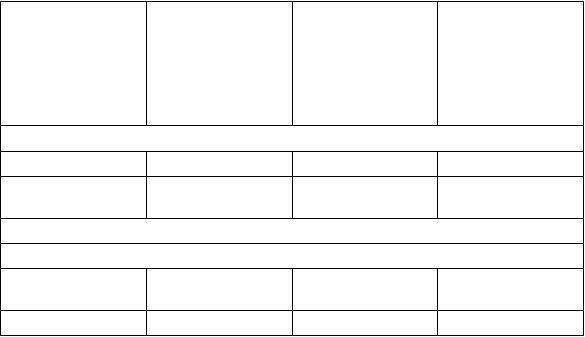 Tabuľka 3: Vplyv poruch& funkcie pečene na farmakokinetické parametre buprenorfínu a naloxónu po podaní (zmena oproti zdravým jedincom)
Tabuľka 3: Vplyv poruch& funkcie pečene na farmakokinetické parametre buprenorfínu a naloxónu po podaní (zmena oproti zdravým jedincom)
Farmakokinetický parameter
M
ierna porucha funkcie pečene
(Childova-Pughova
trieda A)
(n = 9)
Stredne ťažká porucha funkcie pečene
(Childova-Pughova
t
r
i
e
d
a B)
(n = 8)
Ťažká porucha funkcie pečene
(Childova-Pughova
trieda C)
(n = 8)
Buprenorfín
Cmax 1,2-násobný nárast 1,1-násobný nárast 1,7-násobný nárast
AUCposl. Podobná ako kontrolné hodnoty
1,6-násobný nárast 2,8-násobný nárast
Naloxón
Cmax Podobná ako kontrolné hodnoty
2,7-násobný nárast 11,3-násobný nárast
AUCposl. 0,2-násobný nárast 3,2-násobný nárast 14,0-násobný nárast
Celkovo možno konštatovať, že expozícia buprenorfínu v plazme sa zvýšila približne 3-násobne u
pacientov s ťažkou poruchou funkcie pečene, kým expozícia naloxónu v plazme sa u pacientov s ťažkou poruchou funkcie pečene zvýšila 14-násobne.
5.3 Predklinické údaje o bezpečnosti
Kombinácia buprenorfínu a naloxónu bola hodnotená v štúdiách akútnej toxicity a toxicity po opakovanom podaní (až 90 dní u potkanov) na zvieratách. Synergické zvýšenie toxicity nebolo pozorované. Nežiaduce účinky vychádzali zo známej farmakologickej aktivity opioidných agonistov alebo antagonistov.
Kombinácia buprenorfíniumchloridua naloxóniumchloridu (4:1) nebola mutagénna v teste bakteriálnej mutácie (Amesov test) a nebola klastogénna v cytogenetickom teste in vitro na ľudských lymfocytoch ani v intravenóznom mikronukleárnom teste u potkanov.
Reprodukčné štúdie po perorálnom podaní buprenorfínu:naloxónu (v pomere 1 : 1) naznačili, že u potkanov sa objavila embryonálna letalita v prítomnosti maternálnej toxicity pri všetkých dávkach. Najnižšia skúmaná dávka predstavovala expozíciu v násobkoch 1x pre buprenorfín a 5x pre naloxón pri maximálnej terapeutickej dávke u človeka vypočítanej podľa mg/m². U králikov sa nepozorovala vývinová toxicita pri dávkach toxických pre matku. Okrem toho u potkanov ani králikov nebola pozorovaná žiadna teratogenita. S buprenorfínom/naloxónom nebola vykonaná peripostnatálna štúdia, ale perorálne podávanie buprenorfínu matke vo vysokých dávkach počas tehotenstva a dojčenia malo za následok ťažký pôrod (pravdepodobne v dôsledku sedatívneho účinku buprenorfínu), vysokú novorodeneckú úmrtnosť a mierne oneskorenie vo vývine niektorých neurologických funkcií (povrchová lateralizácia doprava a ľakavé reakcie) u novorodených potkanov.
Podávanie buprenorfínu v strave potkanom v dávkach 500 ppm alebo vyšších vyvolalo zníženie fertility preukázané znížením miery počatia u samíc. Dávka 100 ppm v strave (odhadovaná expozícia približne 2,4-násobku buprenorfínu ľudskej dávky 17,2 mg buprenorfínu/naloxónu na základe AUC, plazmatických koncentrácií naloxónu boli u potkanov pod limitom detekcie) nemá nepriaznivý účinok na fertilitu samíc.
Štúdia karcinogenity buprenorfínu/naloxónu bola vykonaná na potkanoch v dávke 7, 30 a
120 mg/kg/deň s predpokladanou expozíciou v 3- až 75-násobkoch, a to na základe dennej sublingválnej dávky u človeka 11,4 mg buprenorfínu ekvivalentnej Zubsolvu vypočítanej podľa mg/m². Vo všetkých dávkovacích skupinách sa pozorovalo štatisticky významné zvýšenie incidencie benígnych testikulárnych intersticiálnych (z Leydigových buniek) adenómov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol
Kyselina citrónová, bezvodá Citronan sodný Mikrokryštalická celulóza Kroskarmelóza, sodná soľ Sukralóza
Levomentol
Oxid kremičitý, koloidný bezvodý
Stearylfumaran sodný
6.2 Inkompatibility
Neaplikovateľné
6.3 Čas použiteľnosti
0,7 mg/0,18 mg
2 roky
1,4 mg/0,36 mg
4 roky
2,9 mg/0,71 mg
30 mesiacov
5,7 mg/1,4 mg
4 roky
8,6 mg/2,1 mg
3 roky
11,4 mg/2,9 mg
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale pri teplote do 25 °C na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
Detské bezpečnostné blistrové karty vyrobené z PVC/OPA/Al/PVC // Al/PET/papiera. Veľkosť balenia po 7 (1 x 7) tabliet.
Veľkosť balenia po 28 (4 x 7) tabliet.
Veľkosť balenia po 30 (3 x 10) tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Mundipharma Corporation (Ireland) Limited
Millbank House
Arkle Road
Sandyford Industrial Estate
Dublin 18
Írsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
EU/1/17/1233/001
EU/1/17/1233/002
EU/1/17/1233/003
EU/1/17/1233/004
EU/1/17/1233/005
EU/1/17/1233/006
EU/1/17/1233/007
EU/1/17/1233/008
EU/1/17/1233/009
EU/1/17/1233/010
EU/1/17/1233/011
EU/1/17/1233/012
EU/1/17/1233/013
EU/1/17/1233/014
EU/1/17/1233/015
EU/1/17/1233/016
EU/1/17/1233/017
EU/1/17/1233/018
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 10 november 2017
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.