
b>
(pozri časť 4.5)
1 mg/kg/deň (jedenkrát denne)
Zvyšujte
v týždňových intervaloch
v prírastkoch o 1 mg/kg
6 až 8 mg/kg/deň
(jedenkrát denne)
300 – 500 mg/deň
(jedenkrát denne)
- bez induktorov
1. + 2. týždeň 3. týždeň a viac
CYP3A4
Poznámka:
1 mg/kg/deň (jedenkrát denne)
Zvyšujte
v dvojtýždňových intervaloch
v prírastkoch o 1 mg/kg
6 až 8 mg/kg/deň
(jedenkrát denne)
300 – 500 mg/deň
(jedenkrát denne)

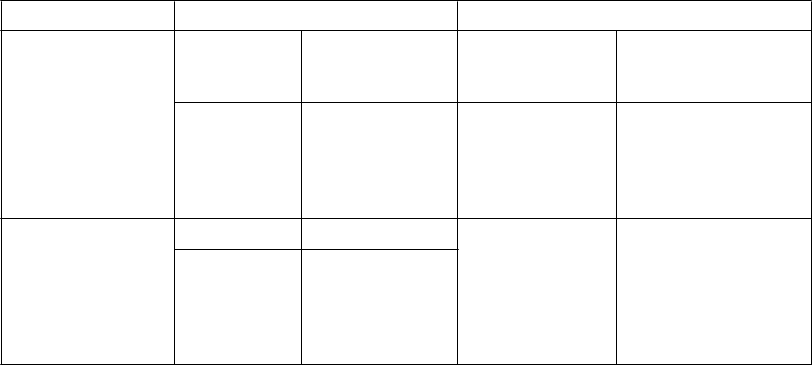
a. Aby sa zaistilo udržanie terapeutickej dávky, je nutné sledovať telesnú hmotnosť dieťaťa a pri výskyte zmien telesnej hmotnosti vyššej ako 55 kg dávku prehodnotiť. Režim dávkovania je 6-
8 mg/kg/deň až do maximálnej dávky 500 mg/deň.
Bezpečnosť a účinnosť zonisamidu u detí mladších ako 6 rokov alebo s telesnou hmotnosťou nižšou ako 20 kg neboli stanovené.
K dispozícii sú obmedzené údaje z klinických štúdií s pacientmi s telesnou hmotnosťou nižšou ako
20 kg. Preto sa deti vo veku 6 rokov a staršie s telesnou hmotnosťou nižšou ako 20 kg majú liečiť s opatrnosťou.
Ukončenie liečbyAk sa má liečba zonisamidom ukončiť, musí to byť postupne (pozri časť 4.4). V klinických štúdiách pediatrických pacientov, titrácia smerom k nižším dávkam sa dosiahla znížením dávky v týždňových intervaloch v prírastkoch o 2 mg/kg (v súlade s harmonogramom v tabuľke 3).
Tabuľka 3. Pediatrická populácia (vo veku 6 rokov a viac) – schéma odporúčanej titrácie k nižším dávkamTelesná hmotnosť Zníženie v týždňových intervaloch v prírastkoch20 – 28 kg 25 až 50 mg/deň*
29 – 41 kg 50 až 75 mg/deň*
42 – 55 kg 100 mg/deň*
> 55 kg 100 mg/deň* Poznámka:
* Všetky dávky sú jedenkrát denne.
 Starší
Starší
Na začiatku liečby starších pacientov sa musí postupovať s opatrnosťou, keďže sú k dispozícii len obmedzené údaje o použití zonisamidu u týchto pacientov. Lekári predpisujúci zonisamid musia vziať do úvahy jeho bezpečnostný profil (pozri časť 4.8).
Porucha funkcie obličiekPri liečení pacientov s poruchou funkcie obličiek sa musí postupovať s opatrnosťou, keďže sú
k dispozícii len obmedzené údaje o použití u týchto pacientov a môže byť potrebná pomalšia titrácia Zonisamidu Mylan. Keďže zonisamid a jeho metabolity sa vylučujú renálnou cestou, musí sa jeho podávanie prerušiť u pacientov, u ktorých nastane akútne zlyhanie obličiek alebo kde sa pozoruje klinicky významné trvalé zvyšovanie hladiny kreatinínu v sére.
Hodnoty renálneho klírensu po podaní jednej dávky zonisamidu pozitívne korelujú s hodnotami klírensu kreatinínu u jedincov s poruchou funkcie obličiek. Hodnota AUC zonisamidu v plazme sa zvýšila o 35 % u jedincov s hodnotami klírensu kreatinínu < 20 ml/min.
Porucha funkcie pečenePoužitie u pacientov s poruchou funkcie pečene sa neskúmalo. Preto sa použitie u pacientov s ťažkou poruchou funkcie pečene neodporúča. Pri liečení pacientov s miernou až stredne závažnou poruchou funkcie pečene sa musí postupovať s opatrnosťou a môže byť potrebná pomalšia titrácia Zonisamidu Mylan.
Spôsob podávaniaZonisamid Mylan tvrdé kapsuly sú na perorálne použitie.
Vplyv stravyZonisamid Mylan možno užiť s jedlom alebo bez jedla (pozri časť 5.2).
4.3 KontraindikáciePrecitlivenosť na liečivo, na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na sulfónamidy.
4.4 Osobitné upozornenia a opatrenia pri používaníNevysvetliteľná vyrážkaV súvislosti s liečbou zonisamidom sa objavujú závažné vyrážky vrátane prípadov Stevensovho-Johnsonovho syndrómu.U pacientov, u ktorých vzniknú inak nevysvetliteľné vyrážky, sa musí zvážiť prerušenie užívania
zonisamidu. Všetci pacienti, u ktorých vzniknú vyrážky počas užívania zonisamidu, musia byť pod dôkladným dohľadom a zvláštna pozornosť sa musí venovať pacientom súčasne užívajúcich antiepileptiká, ktoré môžu samostatne vyvolať vznik kožných vyrážok.
Záchvaty z ukončenia liečbyV súlade so súčasnou klinickou praxou musí byť ukončenie liečby zonisamidom u pacientov
s epilepsiou dosiahnuté postupným znižovaním dávky, aby sa obmedzila možnosť vzniku záchvatov pri ukončení užívania lieku. Neexistujú dostatočné údaje o ukončení liečby súčasne podávaných
antiepileptík s cieľom dosiahnuť monoterapiu zonisamidom v situácii, keď sa dosiahla kontrola záchvatov po pridávaní zonisamidu. Preto sa ukončenie liečby súčasne podávaných antiepileptík musí vykonať s opatrnosťou.
Sulfónamidové reakcie
Zonisamid je derivát benzizoxazolu, ktorý obsahuje sulfónamidovú funkčnú skupinu. Závažné,
imunitou podmienené nežiaduce účinky, ktoré sú spojené s liekmi s obsahom sulfónamidovej funkčnej skupiny zahŕňajú vyrážky, alergickú reakciu a závažnejšie hematologické poruchy, vrátane aplastickej anémie, ktorá veľmi zriedkavo môže byť smrteľná. Boli hlásené prípady agranulocytózy, trombocytopénie, leukopénie, aplastickej anémie, pancytopénie a leukocytózy. K dispozícii nie sú dostatočné informácie na stanovenie vzťahu, ak nejaký existuje, medzi dávkou a trvaním liečby
a týmito udalosťami.
Samovražedné myšlienky a správanie
U pacientov liečených antiepileptikami v niekoľkých indikáciách boli hlásené samovražedné
myšlienky a správanie. Meta-analýza randomizovaných, placebom kontrolovaných štúdií
s antiepileptikami preukázala tiež mierne zvýšené riziko samovražedných myšlienok a správania. Mechanizmus tohto rizika nie je známy a dostupné údaje nevylučujú možnosť zvýšeného rizika pre zonisamid.
Preto musia byť pacienti sledovaní vzhľadom na prejavy samovražedných myšlienok a správania
a musí sa zvážiť vhodná liečba. Pacientom (a ich opatrovateľom) sa má odporučiť, aby v prípade, že sa u nich objavia príznaky samovražedných myšlienok alebo správania, okamžite vyhľadali lekársku pomoc.
Obličkové kamene
U niektorých pacientov, najmä u tých s predispozíciou k nefrolitiáze, môže byť zvýšené riziko tvorby
obličkových kameňov a s tým spojených prejavov a príznakov, ako sú obličková kolika, bolesť obličiek alebo bolesť v boku. Nefrolitiáza môže viesť k chronickému poškodeniu obličiek. Rizikové faktory nefrolitiázy zahŕňajú predchádzajúcu tvorbu kameňov, rodinnú anamnézu nefrolitiázy
a hyperkalciúrie. Žiadny z týchto rizikových faktorov nemôže s istotou predurčovať tvorbu kameňov
počas liečby zonisamidom. Okrem toho môžu mať zvýšené riziko pacienti užívajúci inú liečbu súvisiacu s nefrolitiázou. Zvýšený príjem tekutín a vylučovanie moču môžu pomôcť znížiť riziko tvorby kameňov, obzvlášť u pacientov s predispozičnými rizikovými faktormi.
Metabolická acidóza
S liečbou zonisamidom sa spája hyperchloremická metabolická non-anion gap acidóza (tzn. zníženie
hladiny sérových bikarbonátov pod normálne referenčné rozpätie pri absencii chronickej respiračnej alkalózy). Táto metabolická acidóza je spôsobená úbytkom bikarbonátov obličkami v dôsledku inhibičného účinku zonisamidu na karboanhydrázu. Takáto nerovnováha elektrolytov bola pozorovaná pri užívaní zonisamidu v placebom kontrolovaných klinických štúdiách a v post-marketingovom období. Metabolická acidóza vyvolaná zonisamidom sa zvyčajne vyskytuje v priebehu začiatočnej liečby, hoci sa môže objaviť kedykoľvek v priebehu liečby. Pokles hladiny bikarbonátov je zvyčajne mierny až stredný (priemerný pokles je asi 3,5 mEq/l pri denných dávkach 300 mg u dospelých), zriedkavo sa u pacientov môže objaviť aj vyšší úbytok. Podmienky alebo terapie, ktoré predstavujú predispozíciu na vznik acidózy (ako sú ochorenia obličiek, závažné respiračné poruchy, status epilepticus, chirurgické zákroky, ketogénna diéta alebo lieky) môžu prispievať k účinku zonisamidu
na znižovanie hladiny bikarbonátov.
Riziko metabolickej acidózy spôsobenej zonisamidom sa ukazuje byť častejšie a závažnejšie
u mladších pacientov. U pacientov liečených zonisamidom, u ktorých sú prítomné okolnosti, ktoré môžu zvýšiť riziko acidózy alebo u ktorých existuje zvýšené riziko nežiaducich následkov
metabolickej acidózy a u pacientov s príznakmi, ktoré poukazujú na metabolickú acidózu, je potrebné urobiť zodpovedajúce vyšetrenia a monitorovať hladinu sérového bikarbonátu. Pokiaľ dôjde
k rozvinutiu metabolickej acidózy a jej pretrvávaniu, je potrebné uvážiť zníženie dávky alebo
prerušenie liečby zonisamidom (postupným znižovaním dávky), nakoľko sa môže vyvinúť osteopénia. Pokiaľ sa u pacienta napriek pretrvávajúcej metabolickej acidóze rozhodne o pokračovaní v liečbe zonisamidom, je potrebné uvažovať o alkalizujúcej liečbe.
Zonisamid sa musí používať s opatrnosťou u pacientov, ktorí sú zároveň liečení inhibítormi karboanhydrázy, ako je topiramát alebo acetazolamid, keďže nie sú k dispozícii dostatočné údaje na vylúčenie farmakodynamickej interakcie (pozri časť 4.4 Pediatrická populácia a časť 4.5).
Úpal
Prípady zníženého potenia a zvýšenej telesnej teploty boli hlásené hlavne u pediatrických pacientov
(celé varovanie pozri časť 4.4 Pediatrická populácia). Je nutné postupovať opatrne u dospelých v prípade, keď sa zonisamid predpisuje súčasne s inými liekmi, ktoré u pacientov vyvolávajú predispozíciu na poruchy spojené so zvýšenou teplotou; tieto zahŕňajú inhibítory karboanhydrázy a lieky s anticholinergickou aktivitou (pozri tiež časť 4.4 Pediatrická populácia).
Pankreatitída
U pacientov užívajúcich zonisamid, u ktorých sa vyvinú klinické prejavy a príznaky pankreatitídy, sa
odporúčajú sledovať hladiny pankreatickej lipázy a amylázy. Ak je pankreatitída evidentná, v prípade absencie inej zrejmej príčiny, odporúča sa zvážiť ukončenie liečby zonisamidom a začať príslušnú liečbu.
Rabdomyolýza
U pacientov užívajúcich zonisamid, u ktorých sa vyvinie ťažká svalová bolesť a/alebo slabosť buď
v prítomnosti alebo absencii horúčky, sa odporúča, aby sa stanovili markery svalového poškodenia, vrátane hladín sérovej kreatinínfosfokinázy a aldolázy. Ak sú v prípade absencie inej zrejmej príčiny, ako trauma alebo epileptické záchvaty grand mal, zvýšené hladiny, odporúča sa zvážiť vysadenie zonisamidu a začať príslušnú liečbu.
Ženy vo fertilnom veku
Ženy vo fertilnom veku musia počas liečby zonisamidom a jeden mesiac po jej ukončení používať
vhodnú antikoncepciu (pozri časť 4.6). Lekári, liečiaci pacientov zonisamidom, sa musia pokúsiť zabezpečiť použitie vhodnej antikoncepcie a musia uplatniť klinický úsudok pri hodnotení toho, či je perorálna antikoncepcia (OC) alebo či sú dávky jednotlivých zložiek OC adekvátne pre individuálny klinický stav pacientky.
Telesná hmotnosť
Zonisamid môže spôsobovať stratu telesnej hmotnosti. Ak pacient stráca hmotnosť alebo má podváhu
počas tejto liečby, je možné zvážiť doplnkovú výživu alebo zvýšený príjem potravy. Ak sa objaví značná nežiaduca strata hmotnosti, musí sa zvážiť ukončenie liečby zonisamidom. Strata telesnej hmotnosti je oveľa závažnejšia u detí (pozri časť 4.4 Pediatrická populácia).
Pediatrická populácia
Vyššie uvedené upozornenia a opatrenia platia aj pre dospievajúcich a pediatrických pacientov. Nižšie
uvedené upozornenia a opatrenia sú dôležitejšie pre pediatrických a dospievajúcich pacientov.
 Úpal a dehydratácia
Prevencia voči prehriatiu a dehydratácii u detí
Úpal a dehydratácia
Prevencia voči prehriatiu a dehydratácii u detí
Zonisamid môže spôsobiť znížené potenie u detí a prehriatie a ak dieťa nie je liečené, môže to viesť
k poškodeniu mozgu alebo k smrti. Deti sú najviac ohrozené najmä počas horúceho počasia.
Ak dieťa užíva zonisamid:
· Dieťa musí zostať v pohode a to najmä počas horúceho počasia.
· Dieťa sa musí vyhnúť veľkej fyzickej záťaži, najmä počas horúceho počasia.
· Dieťa musí piť veľké množstvo studenej vody.
· Dieťa nesmie užívať akýkoľvek z týchto liekov:
inhibítory karboanhydrázy (ako je topiramát a acetazolamid) a anticholinergné látky (ako sú klomipramín, hydroxyzín, difenhydramín, haloperidol, imipramín a oxybutynín).
DIEŤA POTREBUJE OKAMŽITÚ LEKÁRSKU POZORNOSŤ, AK SA VYSKYTNE ČOKOĽVEK Z NASLEDOVNÉHO:Pokožka je veľmi horúca, málo sa potí alebo vôbec, alebo je dieťa zmätené alebo má svalové kŕče,
alebo sa tlkot srdca alebo dýchanie dieťaťa zrýchli.
· Zoberte dieťa na chladné, tienisté miesto.
· Udržiavajte pokožku dieťaťa chladnú pomocou vody.
· Dajte dieťaťu na pitie studenú vodu.
Prípady zníženého potenia a zvýšenej telesnej teploty boli hlásené hlavne u pediatrických pacientov.
V niektorých prípadoch bol diagnostikovaný úpal vyžadujúci liečbu v nemocnici. Bol hlásený úpal vyžadujúci liečbu v nemocnici a s následkom smrti. Väčšina hlásení sa objavila v obdobiach teplého
počasia. Lekári majú prebrať s pacientmi a ich opatrovateľmi potenciálnu závažnosť úpalu, situácie,
v ktorých sa môže vyskytnúť, ako aj konanie v prípade akýchkoľvek prejavov a príznakov. Pacienti alebo ich opatrovatelia musia byť upozornení na to, aby dbali na udržiavanie hydratácie a predchádzali vystaveniu nadmerne vysokým teplotám a namáhavému fyzickému cvičeniu v závislosti od ich stavu. Lekári majú upozorniť pediatrických pacientov a ich rodičov/opatrovateľov na pokyny uvedené
v písomnej informácii pre používateľa o prevencii úpalu a prehriatia u detí. V prípade prejavov alebo príznakov dehydratácie, oligohydrózy alebo zvýšenej telesnej teploty je potrebné zvážiť vysadenie
zonisamidu.
Zonisamid sa nesmie používať u pediatrických pacientov súčasne liečených s inými liekmi, ktoré
u pacientov vyvolávajú predispozíciu na poruchy spojené s pôsobením tepla; tieto zahŕňajú inhibítory karboanhydrázy a lieky s anticholinergickou aktivitou.
Telesná hmotnosťStrata hmotnosti vedúca k zhoršeniu celkového stavu a zlyhaniu užívania antiepileptickej liečby bola spojená s fatálnymi následkami (pozri časť 4.8). Zonisamid sa neodporúča u pediatrických pacientov,
ktorí majú podváhu (definícia na základe kategórii BMI upravených podľa veku stanovených WHO)
alebo majú zníženú chuť do jedla.
Výskyt zníženia telesnej hmotnosti je zhodný vo všetkých vekových skupinách (pozri časť 4.8), avšak vzhľadom na potenciálnu závažnosť straty hmotnosti u detí, je potrebné monitorovať hmotnosť v tejto populácii. Ak pacient nepriberá na hmotnosti v súlade s rastovými grafmi, je potrebné zvážiť doplnkovú výživu alebo zvýšený príjem stravy, v inom prípade sa má liečba zonisamidom ukončiť.
K dispozícii sú obmedzené údaje z klinických štúdií u pacientov s telesnou hmotnosťou nižšou ako
20 kg. Preto deti vo veku 6 rokov a viac a s telesnou hmotnosťou nižšou ako 20 kg majú byť liečené s opatrnosťou. Dlhodobý účinok úbytku hmotnosti v pediatrickej populácii na rast a vývoj nie je
známy.
Metabolická acidóza
Zdá sa, že riziko metabolickej acidózy indukovanej zonisamidom je častejšie a závažnejšie u detských a dospievajúcich pacientov. V tejto populácii je potrebné urobiť zodpovedajúce vyšetrenia
a monitorovať hladinu sérového bikarbonátu (celé upozornenie pozri časť 4.4 – Metabolická acidóza, výskyt nízkej hladiny bikarbonátov pozri časť 4.8). Dlhodobý účinok nízkych hladín bikarbonátov na rast a vývoj nie je známy.
Zonisamid sa nemá používať u pediatrických pacientov súčasne s inými inhibítormi karboanhydrázy, ako je topiramát a acetazolamid (pozri časť 4.5).
Obličkové kamene
Vyskytli sa obličkové kamene u pediatrických pacientov (celé upozornenie pozri časť 4.4 Obličkové kamene). Niektorí pacienti, najmä s predispozíciou na nefrolitiázu, môžu mať zvýšené riziko tvorby
obličkových kameňov a pridružených prejavov a príznakov, ako sú obličkové koliky, bolesť obličiek alebo slabín. Nefrolitiáza môže viesť k chronickému poškodeniu obličiek. Rizikové faktory nefrolitiázy zahŕňajú skoršiu tvorbu kameňov, rodinnú anamnézu nefrolitiázy a hyperkalciúrie. Žiaden
z týchto rizikových faktorov nemôže spoľahlivo predpovedať tvorbu kameňov počas liečby zonisamidom.
Zvýšený príjem tekutín a vylučovanie moču môže pomôcť k zníženiu rizika tvorby kameňov, najmä u pacientov s predispozíciou rizikových faktorov. Na základe rozhodnutia lekára sa musí vykonať
ultrazvukové vyšetrenie obličiek. V prípade detekcie obličkových kameňov sa liečba zonisamidom musí ukončiť.
Pečeňová dysfunkcia
Zvýšené hladiny hepatobiliárnych parametrov, ako je alanínaminotransferáza (ALT), aspartátaminotransferáza (AST), gamaglutamyltransferáza (GMT) a bilirubín sa objavili u detských
a dospievajúcich pacientov, u pozorovaných hodnôt nad hornou hranicou normálu nebola zistená žiadna súvislosť. Predsa len, ak je podozrenie na pečeňovú príhodu, má sa zhodnotiť funkcia pečene
a zvážiť ukončenie liečby zonisamidom.
Kognitívne funkcie
Kognitívna porucha bola u pacientov postihnutých epilepsiou spojená so základnou patológiou a/alebo s podávaním antiepileptickej liečby. V placebom kontrolovanej štúdii so zonisamidom vedenej
u detských a dospievajúcich pacientov bol podiel pacientov s kognitívnou poruchou číselne vyšší v skupine so zonisamidom v porovnaní so skupinou s placebom.
4.5 Liekové a iné interakcie
Vplyv zonisamidu na enzýmy cytochrómu P450
In vitro štúdie s ľudskými pečeňovými mikrozómami pri hladinách zonisamidu približne
dvojnásobných alebo vyšších ako klinicky zodpovedajúce voľné sérové koncentrácie, nevykazujú žiadnu alebo len nízku (< 25 %) inhibíciu izoenzýmov 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 alebo 3A4 cytochrómu P450. Preto sa neočakáva, že zonisamid bude ovplyvňovať farmakokinetiku iných liekov prostredníctvom mechanizmov sprostredkovaných cytochrómom P450 tak, ako to bolo dokázané pre karbamazepín, fenytoín, etinylestradiol a dezipramín in vivo.
Schopnosť zonisamidu ovplyvniť iné lieky
Antiepileptiká
U pacientov s epilepsiou neviedlo dávkovanie zonisamidu v rovnovážnom stave ku klinicky
významným farmakokinetickým účinkom na karbamazepín, lamotrigín, fenytoín alebo valproát sodný.
Perorálna antikoncepcia
V klinických štúdiách so zdravými jedincami neovplyvnilo dávkovanie zonisamidu v rovnovážnom stave sérové koncentrácie etinylestradiolu alebo noretisterónu v kombinovanej perorálnej
antikoncepcii.
Inhibítory karboanhydrázy
Zonisamid sa má používať s opatrnosťou u dospelých pacientov liečených súbežne inhibítormi karboanhydrázy, ako je topiramát a acetazolamid, keďže nie sú k dispozícii dostatočné údaje na
vylúčenie možných farmakodynamických interakcií (pozri časť 4.4).
Zonisamid sa nemá používať u pediatrických pacientov súčasne s inými inhibítormi karboanhydrázy, ako je topiramát a acetazolamid (pozri časť 4.4 Pediatrická populácia).
P-gp substrát
In vitro štúdia ukázala, že zonisamid je slabý inhibítor P-gp (MDR1) s IC50 hodnotou 267 mol/l
a existuje teoretická možnosť, že zonisamid ovplyvňuje farmakokinetiku látok, ktoré sú substrátmi P-
gp. U pacientov užívajúcich lieky, ktoré sú substrátmi P-gp (napr. digoxín, chinidín) sa pri začatí alebo ukončení liečby zonisamidom alebo zmene dávky zonisamidu odporúča postupovať opatrne.
Potenciálne liekové interakcie ovplyvňujúce zonisamid.
V klinických štúdiách nemalo súčasné podávanie lamotrigínu žiadne zjavné účinky na
farmakokinetiku zonisamidu. Kombinácia zonisamidu s inými liekmi, ktorá môže viesť ku vzniku urolitiázy, môže zvýšiť riziko vzniku obličkových kameňov, preto sa má vyhnúť súčasnému používaniu takýchto liekov.
Zonisamid sa sčasti metabolizuje CYP3A4 (redukčné odbúravanie) a tiež N-acetyltransferázami
a konjugáciou s kyselinou glukurónovou; preto látky so schopnosťou indukovať alebo inhibovať tieto enzýmy môžu ovplyvňovať farmakokinetiku zonisamidu:
- Indukcia enzýmov: Expozícia zonisamidu je nižšia u pacientov s epilepsiou, ktorí užívajú induktory CYP3A4, ako sú fenytoín, karbamazepín a fenobarbital. Nie je pravdepodobné, že tieto účinky majú klinický význam, ak sa zonisamid pridá k existujúcej liečbe; avšak, zmeny
v koncentráciách zonisamidu sa môžu objaviť, ak sa zároveň ukončí, upraví dávka alebo začne liečba s CYP3A4-indukujúcich antiepileptikých alebo iných liekov a môže byť potrebná
úprava dávok zonisamidu. Rifampicín je silným induktorom CYP3A4. Ak je súčasné
používanie nevyhnutné, pacient musí byť dôkladne sledovaný a dávka zonisamidu a iných
CYP3A4 substrátov podľa potreby upravená.
- Inhibícia CYP3A4: Podľa klinických údajov nevykazujú známe špecifické a nešpecifické inhibítory CYP3A4 klinicky zodpovedajúci účinok na farmakokinetické parametre expozície zonisamidu. Dávkovanie buď ketokonazolu (400 mg/deň) alebo cimetidínu (1200 mg/deň) nemalo v rovnovážnom stave žiadne klinické účinky na farmakokinetiku zonisamidu po
podaní jednej dávky zdravým jedincom. Preto nemusí byť pri súčasnom podávaní so známymi inhibítormi CYP3A4 úprava dávkovania zonisamidu potrebná.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Ženy v reprodukčnom veku
Ženy v reprodukčnom veku musia používať vhodnú antikoncepciu počas liečby zonisamidom a až do jedného mesiaca po skončení liečby.
Gravidita
Nie sú k dispozícii dostatočné údaje o použití zonisamidu u gravidných žien. Štúdie na zvieratách
preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko u ľudí.
Zonisamid smie byť užívaný počas gravidity iba v nevyhnutných prípadoch, podľa posúdenia lekára a len, ak možno potenciálnym prospechom ospravedlniť riziko pre plod. Musí sa opätovne zvážiť
potreba antiepileptickej liečby u pacientiek, ktoré plánujú otehotnieť. Ak sa zonisamid predpíše, odporúča sa pozorné sledovanie.
Ženám, ktoré môžu otehotnieť, musí byť poskytnutá odborná rada, aby sa zvážila optimálna liečba počas gravidity. Ženy v plodnom veku musia byť poučené lekárom špecialistom o možných účinkoch zonisamidu na plod a pred začatím liečby sa musí s pacientkou prediskutovať riziko vo vzťahu
k prospechu liečby. Riziko poruchy pri narodení sa zvyšuje 2 až 3 krát pre potomkov matiek, ktoré sú liečené antiepileptikami. Najčastejšie hlásenými poruchami sú zajačí pysk, kardiovaskulárne
malformácie a poruchy neurálnej trubice. Viacnásobná antiepileptická liečba môže súvisieť s vyšším rizikom vrodených malformácií ako v prípade monoterapie.
Antiepileptická liečba nesmie byť náhle prerušená, keďže to môže viesť k vypuknutiu záchvatov, čo môže mať vážne následky pre oboch, matku i dieťa.
Dojčenie
Zonisamid sa vylučuje do ľudského mlieka; koncentrácia v materskom mlieku je podobná koncentrácii
v plazme matky. Musí byť urobené rozhodnutie, či sa preruší dojčenie alebo sa ukončí/preruší liečba zonisamidom. Kvôli dlhému retenčnému času zonisamidu v tele sa dojčenie nesmie obnoviť do jedného mesiaca po ukončení liečby zonisamidom.
Fertilita
K dispozícii nie sú žiadne údaje o účinkoch zonisamidu na fertilitu u ľudí. Štúdie na zvieratách
preukázali zmeny na parametroch fertility (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neboli vykonané žiadne štúdie o účinku na schopnosť viesť vozidlá a obsluhovať stroje. Berúc však do úvahy, že niektorí pacienti môžu pocítiť ospalosť alebo ťažkosti s koncentráciou, obzvlášť na začiatku liečby alebo po zvýšení dávky, musia byť pacienti poučení, aby počas vykonávania aktivít vyžadujúcich si vysoký stupeň bdelosti, napr. vedenie vozidiel alebo obsluha strojov, postupovali opatrne.
4.8 Nežiaduce účinky
Zonisamid bol v klinických štúdiách podaný viac ako 1 200 pacientom, viac ako 400 z nich užívalo zonisamid najmenej 1 rok. Okrem toho existujú od roku 1989 bohaté post-marketingové skúsenosti so zonisamidom v Japonsku a od roku 2000 v USA.
Má sa zobrať na vedomie, že zonisamid je derivátom benzizoxazolu, ktorý obsahuje sulfónamidovú skupinu. Závažné nežiaduce reakcie súvisiace s imunitným systémom, ktoré sa dávajú do súvislosti s liekmi obsahujúcimi sulfónamidovú skupinu zahŕňajú vyrážku, alergickú reakciu a závažné
hematologické poruchy vrátane aplastickej anémie, ktorá veľmi zriedkavo môže byť smrteľná (pozri
časť 4.4).
Najčastejšie nežiaduce reakcie v kontrolovaných štúdiách prídavnej liečby boli somnolencia, závraty a anorexia. Najčastejšie nežiaduce reakcie v randomizovanej, kontrolovanej štúdii s monoterapiou porovnávajúcej zonisamid s karbamazepínom v liekovej forme s predĺženým uvoľňovaním boli znížená hladina bikarbonátu, znížená chuť do jedla a znížená hmotnosť. Incidencia výrazne abnormálne nízkej sérovej hladiny bikarbonátu (zníženie na menej ako 17 mEq/l a o viac ako 5 mEq/l) bola 3,8 %. Incidencia výrazného zníženia hmotnosti o 20 % alebo viac bola 0,7 %.
Súhrn nežiaducich reakcií uvedených v tabuľke
Nežiaduce reakcie súvisiace so zonisamidom získané z klinických štúdií a post-markentingového
sledovania sú usporiadané v nižšie uvedenej tabuľke. Frekvencie výskytu sú zoradené podľa nasledujúcej schémy:
veľmi časté ≥ 1/10
časté ≥ 1/100 až < 1/10 menej časté ≥ 1/1 000 až < 1/100 zriedkavé ≥ 1/10 000 až < 1/1 000 veľmi zriedkavé < 1/10 000
neznáme nie je možné odhadnúť z dostupných údajov
Tabuľka4 Nežiaducereakciesúvisiacesozonisamidomzískanézklinickýchštúdiísprídavnouliečbouapost-markentingovéhosledovania
Trieda orgánových systémov (názvoslovie MedDRA)
Veľmi časté Časté Menej časté Veľmi zriedkavé
Infekcie a nákazy Pneumónia Infekcia močových ciest
Poruchy krvi
a lymfatického systému
Poruchy imunitného systému
Poruchy metabolizmu a výživy
Ekchymóza Agranulocytóza Aplastická anémia Leukocytóza Leukopénia Lymfadenopatia Pancytopénia Trombocytopénia
Precitlivenosť Liekom vyvolaný hypersenzitívny syndróm Lieková vyrážka
s eozinofíliou a systémové
prejavy
Anorexia Hypokaliémia Metabolická acidóza
Renálna tubulárna acidóza
Psychické poruchy Vzrušenie
Dráždivosť
Citová labilita
Úzkosť
Hnev
Agresivita
Halucinácie
Stav zmätenosti Nespavosť
Samovražedná
Poruchy nervového systému
Depresia
Ataxia Závraty Zhoršenie pamäti Somnolencia
Psychotické poruchy
Bradyfrénia Porucha pozornosti Nystagmus Parestézie Porucha reči Tremor
predstavivosť
Pokus
o samovraždu
Kŕče Amnézia
Kóma
Grand mal záchvaty Myastenický syndróm Neuroleptický malígny syndróm
Epileptický stav
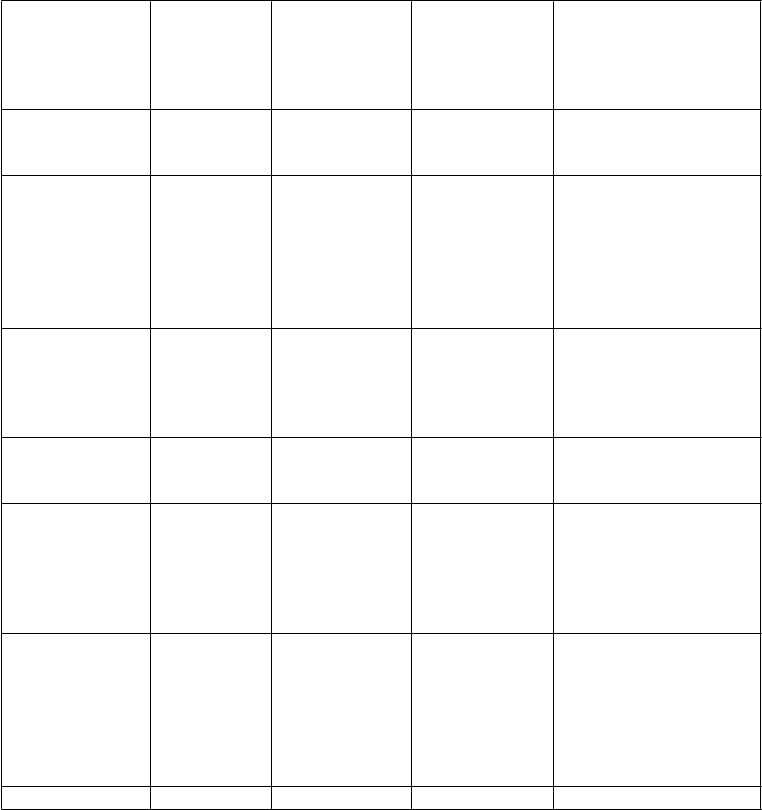 Poruchy oka
Poruchy oka Diplopia
Trieda orgánových systémov (názvoslovie MedDRA) Poruchy dýchacej sústavy, hrudníka a mediastína
Veľmi časté Časté Menej časté Veľmi zriedkavé
Dyspnoe
Aspiračná pneumónia Poruchy dýchacej sústavy Hypersenzitívna pneumonitída
Poruchy gastrointestinálne ho traktu
Abdominálna bolesť
Zápcha
Hnačka Dyspepsia Nutkanie na vracanie
Vracanie Pankreatitída
Poruchy pečene a žlčových ciest Poruchy kože
a podkožného
tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Vyrážky Svrbenie Alopécia
Cholecystitída
Cholelitiáza
Hepatocelulárne poškodenie Anhydróza Multiformný erytém Stevensov-Johnsonov syndróm
Toxická epidermálna
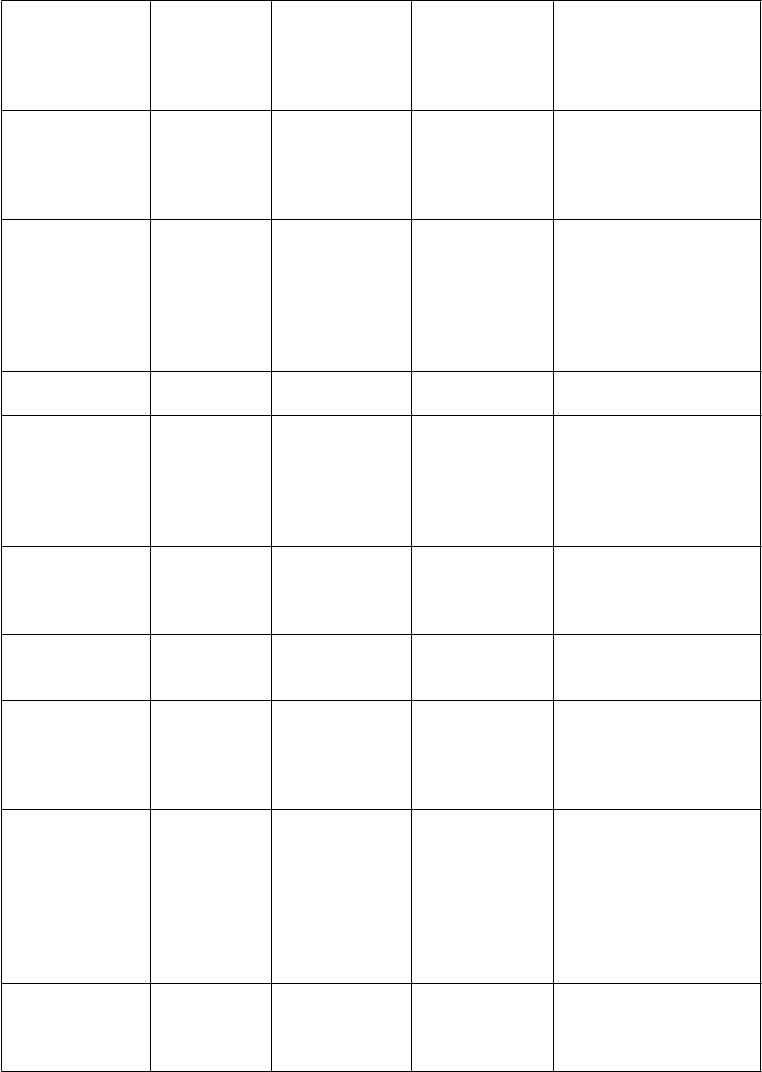
nekrolýza
Rabdomyolýza
Poruchy obličiek
a močovej sústavy
Nefrolitiáza Močový kamienok Hydronefróza Obličkové zlyhanie Anomália moču
Celkové poruchy a reakcie v mieste podania
Abnormálne
Únava Ochorenie podobné chrípke Pyrexia
Periférny edém
Znížená hladina Znížená telesná
Zvýšená hladina
laboratórne a funkčné vyšetrenia
Úrazy, otravy a komplikácie liečebného postupu
bikarbonátu
hmotnosť
kreatinínfosfokinázy v krvi Zvýšená hladina kreatinínu v krvi
Zvýšená hladina močoviny v krvi
Abnormálne pečeňové funkčné testy
Úpal
Okrem toho sa pozorovali jednotlivé prípady náhlej nevysvetlenej smrti u pacientov s epilepsiou
(Sudden Unexplained Death in Epilepsy Patients (SUDEP)) užívajúcich zonisamid.
Tabuľka
5 Nežiaduce
reakcie
v
randomizovanej,
kontrolovanej
štúdii
s
monoterapiou porovnávajúcej zonisamid s karbamazepínom v liekovej forme s predĺženým uvoľňovaním Trieda orgánových systémov Veľmi časté Časté Menej časté (názvoslovie MedDRA†)
Infekcie a nákazy Infekcia močových ciest
Pneumónia
Poruchy krvi a lymfatického systému
Poruchy metabolizmu a výživy
Leukopénia
Trombocytopénia
Znížená chuť do jedla Hypokaliémia
Psychické poruchy Agitácia Depresia Nespavosť Zmeny nálady Úzkosť
Poruchy nervového systému Ataxia
Závrat
Porucha pamäti Somnolencia Bradyfrénia Porucha pozornosti Parestézie
Poruchy oka Diplopia
Poruchy dýchacej sústavy, hrudníka a mediastína
Stav zmätenosti Akútna psychóza Agresivita Myšlienky na samovraždu Halucinácie Nystagmus Porucha reči Tremor
Kŕče
Respiračná porucha
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Zápcha Hnačka Dyspepsia Nevoľnosť Vracanie
Abdominálna bolesť
Akútna cholecystitída
Poruchy kože a podkožného tkaniva
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
† MedDRA verzia 13.1
Znížená hladina bikarbonátu
Vyrážka Pruritus
Ekchymóza
Únava Pyrexia Podráždenosť Znížená telesná hmotnosť Zvýšená hladina
kreatinínfosfokinázy
v krvi
Zvýšená hladina alanínaminotransferázy Zvýšená hladina aspartátaminotransferázy
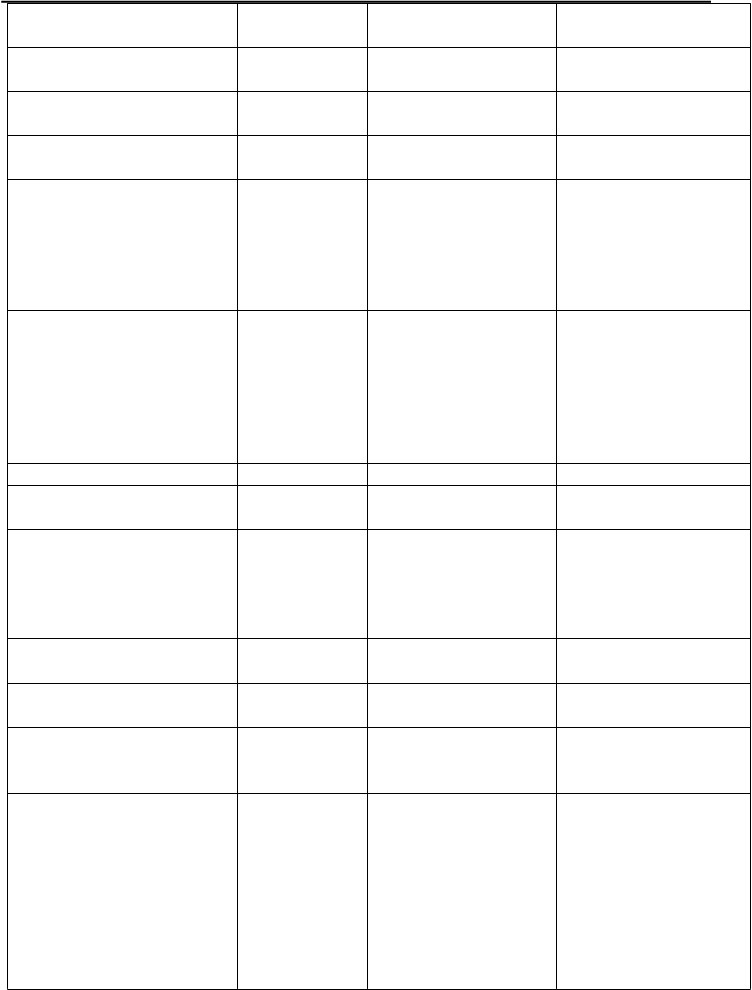 Dodatočné informácie pre osobitné populácie
Starší
Dodatočné informácie pre osobitné populácie
Starší
Združená analýza údajov o bezpečnosti u 95 starších osôb preukázala relatívne vyššiu frekvenciu hlásenia periférneho edému a pruritu v porovnaní s dospelou populáciou.
Zhodnotenie postmarketingových údajov nasvedčuje, že u pacientov vo veku 65 rokov a starších sa nasledujúce prípady vyskytujú častejšie ako vo všeobecnej populácii: Stevensov-Johnsonov syndróm (SJS) a liekmi vyvolaný syndróm precitlivenosti (DIHS – Drug Induced Hypersensitivity syndrome).
Pediatrická populáciaProfil nežiaducich účinkov zonisamidu u detských pacientov vo veku 6 až 17 rokov v placebom kontrolovaných klinických štúdiách bol konzistentný s tým u dospelých. Medzi 465 pacientmi
v pediatrickej databáze bezpečnosti (vrátane ďalších 67 pacientov z následnej fázy kontrolovanej
klinickej štúdie) bolo 7 úmrtí (1,5 %; 14,6/1000 osoba-roky): 2 prípady epileptických stavov, z ktorých jeden súvisel so závažnou stratou telesnej hmotnosti (10 % v rámci 3 mesiacov)
u podvyživených pacientov a s následným zlyhaním užívania liekov; 1 prípad poranenia
hlavy/hematómu a 4 úmrtia pacientov s už existujúcimi funkčnými neurologickými defektmi
z rôznych príčin (2 prípady pneumóniou vyvolanej sepsy/zlyhanie orgánu, 1 SUDEP a 1 zranenie hlavy). Celkovo 70,4 % pediatrických pacientov, ktorí dostávali ZNS v kontrolovanej štúdii alebo v jej otvorenom predĺžení mali aspoň jedno vyšetrenie naliehavej liečby bikarbonátom pod 22 mmol/l. Dĺžka trvania vyšetrení nízkym bikarbonátom bola tiež dlhá (medián 188 dní).
Združená analýza údajov o bezpečnosti u 420 pediatrických pacientov (183 pacientov vo veku 6 až
11 rokov a 273 pacientov vo veku 12 až 16 rokov s priemernou dĺžkou trvania expozície približne
12 mesiacov) preukázala relatívne vyššiu frekvenciu pneumónie, dehydratácie, zníženého potenia, abnormálnych hodnôt pečeňových testov, zápalu stredného ucha, faryngitídy, sinusitídy a infekcie horných dýchacích ciest, kašľa, epistaxy a rinitídy, bolesti brucha, vracania, vyrážky a ekzému
a horúčky v porovnaní s populáciou dospelých (najmä u pacientov vo veku menej ako 12 rokov)
a nízky výskyt amnézie, zvýšenia kreatinínu, lymfadenopatie a trombocytopénie. Výskyt zníženia telesnej hmotnosti o 10 % alebo viac bol 10,7 % (pozri časť 4.4). V niektorých prípadoch poklesu telesnej hmotnosti došlo k oneskoreniu prechodu do ďalšieho štádia podľa Tannera a kostnej maturácie.'
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieSymptómyObjavili sa prípady náhodného a zámerného predávkovania u dospelých a pediatrických pacientov.
V niektorých prípadoch bolo predávkovanie bezpríznakové, obzvlášť tam, kde bolo bezprostredne vyvolané vracanie alebo bol prevedený výplach. V iných prípadoch bolo predávkovanie nasledované príznakmi ako somnolencia, nutkanie na vracanie, gastritída, nystagmus, myoklonus, kóma, bradykardia, znížená funkcia obličiek, hypotenzia a útlm dýchania. Veľmi vysoká koncentrácia zonisamidu 100,1 μg/ml v plazme bola zaznamenaná približne 31 hodín potom, ako pacient užil nadmernú dávku zonisamidu a klonazepamu; pacient sa stal komatóznym a mal útlm dýchania, ale
o päť dní bol opäť pri vedomí bez ďalších následkov.
LiečbaNie sú k dispozícii žiadne antidotá pre prípad predávkovania zonisamidom. Po podozrení na nedávne
predávkovanie sa môže indikovať vyprázdnenie žalúdka výplachom žalúdka alebo indukciou vracania za zvyčajných opatrení na ochranu dýchacích ciest. Indikuje sa všeobecná podporná starostlivosť vrátane častého sledovania vitálnych funkcií a dôkladného pozorovania. Zonisamid má dlhý eliminačný polčas, preto môžu jeho účinky pretrvávať. Hoci hemodialýza nebola formálne študovaná ako liečba pri predávkovaní, znižuje koncentrácie zonisamidu v plazme pacientov so zníženou funkciou obličiek a možno ju považovať za liečbu predávkovania, ak je to klinicky indikované.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiepileptiká, iné antiepileptiká, ATC kód: N03AX15
Zonisamid je derivát benzizoxazolu. Je to antiepileptický liek so slabou karboanhydrázovou aktivitou
in vitro. Nie je chemicky príbuzný s inými antiepileptikami.
Mechanizmus účinku
Mechanizmus účinku zonisamidu nie je ešte plne objasnený, ale zdá sa, že pôsobí na napätie citlivé
sodíkové a vápnikové kanály, a tak narúša synchronizovanú neuronálnu aktivitu, redukuje šírenie epileptických výbojov a ruší následnú epileptickú aktivitu. Zonisamid má tiež modulačnú aktivitu na neuronálnu inhibíciu sprostredkovanú GABA.
Farmakodynamické účinky
Antikonvulzívna aktivita zonisamidu bola hodnotená na rôznych modeloch u niekoľkých druhov
s vyvolanými alebo prirodzenými záchvatmi a zdá sa, že zonisamid pôsobí v týchto modeloch ako široko spektrálne antiepileptikum. Zonisamid zabraňuje maximálnym elektrošokovým záchvatom
a obmedzuje šírenie záchvatov, vrátane šírenia záchvatov z kôry do podkôrových štruktúr a potláča
epileptogénnu ložiskovú aktivitu. Na rozdiel od fenyltoínu a karbamazepínu však zonisamid pôsobí prednostne na záchvaty pochádzajúce z kôry.
Klinická účinnosť a bezpečnosť
Monoterapia parciálnych záchvatov so sekundárnou generalizáciou alebo bez nej
Účinnosť zonisamidu v monoterapii bola preukázaná v dvojito zaslepenom, paralelnom neinferiórnom porovnaní s karbamazepínom v liekovej forme s predĺženým uvoľňovaním u 583 dospelých jedincov
s novodiagnostikovanými parciálnymi záchvatmi so sekundárnou generalizáciou tonicko-klonických záchvatov alebo bez nej. Jedinci boli randomizovaní na užívanie liečby karbamazepínom
a zonisamidom v trvaní až do 24 mesiacov v závislosti od odpovede. Jedinci boli titrovaní po
začiatočnú cieľovú dávku 600 mg karbamazepínu alebo 300 mg zonisamidu. Jedinci, u ktorých sa objavil záchvat, boli titrovaní do nasledujúcej cieľovej dávky, t.j. 800 mg karbamazepínu alebo
400 mg zonisamidu. Jedinci, u ktorých sa objavil ďalší záchvat, boli titrovaní do maximálnej cieľovej dávky 1 200 mg karbamazepínu alebo 500 mg zonisamidu. Jedinci, ktorí nemali záchvaty počas 26 týždňov pri cieľovej dávkovej hladine, pokračovali s touto dávkou ďalších 26 týždňov. Hlavné
výsledky tejto štúdie sú uvedené v tejto tabuľke:
Tabuľka
6 Výsledky
účinnosti
pre
štúdiu
310
s
monoterapiou
Zonisamid Karbamazepín
n (ITT populácia) 281 300
Šesť mesiacov bez záchvatov Diff IS
95 %
PP-populácia* 79,4 % 83,7 % -4,5 % -12,2 % ; 3,1 %
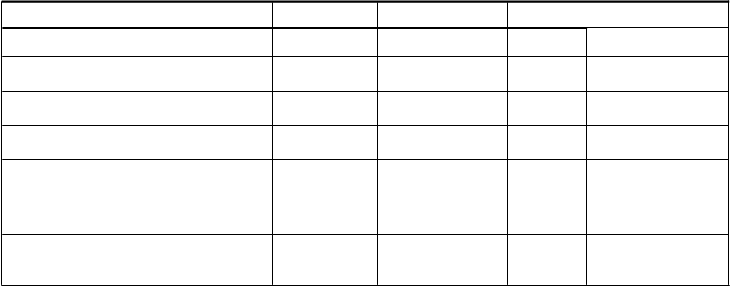
ITT-populácia 69,4 % 74,7 % -6,1 % -13,6 % ; 1,4 %
< 4 záchvaty počas 3- mesačného východiskového obdobia
> 4 záchvaty počas 3- mesačného východiskového
71,7 % 75,7 % -4,0 % -11,7 % ; 3,7 %
52,9 % 68,9 % -15,9 % -37,5 % ; 5,6 %
obdobia
Dvanásť mesiacov bez záchvatov
PP-populácia 67,6 % 74,7 % -7,9 % - 17,2 % ; 1,5 % ITT-populácia 55,9 % 62,3 % -7,7 % - 16,1 % ; 0,7 %
< 4 záchvaty počas 3- mesačného východiskového obdobia
> 4 záchvaty počas 3- mesačného východiskového

obdobia
57,4 % 64,7 % -7,2 % -15,7 % ; 1,3 %
44,1 % 48,9 % -4,8 % -26,9 % ; 17,4 %
Podtyp záchvatov (PP populácia
6 mesiacov bez záchvatu)
Všetky parciálne 76,4 % 86,0 % -9,6 % -19,2 % ; 0,0 % Simplexné parciálne 72,3 % 75,0 % -2,7 % -20,0 % ; 14,7 %
Komplexné parciálne 76,9 % 93,0 % -16,1 % -26,3 % ; -5,9 %
Všetky generalizované tonicko- klonické
78,9 % 81,6 % -2,8 -11,5 % ; 6,0 %
Sekundárne tonicko-klonické 77,4 % 80,0 % -2,6 % -12,4 % ; 7,1 %
Generalizované tonicko-klonické 85,7 % 92,0 % -6,3 % -23,1 % ; 10,5 %
PP = populácia podľa protokolu; ITT = populácia so zámerom liečiť
*primárny koncový ukazovateľ
Prídavná liečba pri liečbe parciálnych záchvatov so sekundárnou generalizáciou alebo bez nej u dospelých
U dospelých bola účinnosť zonisamidu preukázaná v 4 dvojito zaslepených, placebom kontrolovaných štúdiách s trvaním do 24 týždňov a dávkovaním buď jeden alebo dvakrát denne. Tieto štúdie dokazujú, že stredná hodnota znižovania frekvencie parciálnych záchvatov súvisí s dávkou zonisamidu
s ustálenou účinnosťou pri dávkach 300-500 mg za deň.
Pediatrická populácia
Prídavná liečba pri liečbe parciálnych záchvatov so sekundárnou generalizáciou alebo bez nej
u dospievajúcich a pediatrických pacientov (vo veku 6 rokov a viac).
U pediatrických pacientov (vo veku 6 rokov a viac) bola účinnosť zonisamidu preukázaná v dvojito zaslepenej, placebom kontrolovanej štúdii, ktorá zahŕňala 207 osôb a mala trvanie liečby do
24 týždňov. 50 % alebo väčšie zníženie frekvencie záchvatov z pôvodných hodnôt bolo pozorované
počas 12-týždňového obdobia stabilnej dávky u 50 % zonisamidom liečených osôb a u 31 % pacientov s placebom.
Špecifické bezpečnostné problémy, ktoré sa vyskytli v pediatrických štúdiách, boli: znížená chuť do jedla a strata hmotnosti, znížené hladiny bikarbonátov, zvýšené riziko obličkových kameňov
a dehydratácia. Všetky tieto účinky a hlavne strata hmotnosti môžu mať škodlivé účinky na rast
a vývoj a môžu viesť k celkovému zhoršeniu zdravia. Celkovo existujú len obmedzené údaje o účinkoch na dlhodobý rast a vývoj.
5.2 Farmakokinetické vlastnosti
Absorpcia
Zonisamid sa po perorálnom podaní absorbuje takmer úplne, zvyčajne dosahuje najvyššie
koncentrácie v sére alebo plazme do 2 až 5 hodín po podaní dávky. "First-pass" metabolizmus sa považuje za zanedbateľný. Absolútna biologická dostupnosť sa odhaduje na približne 100 %. Perorálna biologická dostupnosť nie je ovplyvnená potravou, aj keď sa dosiahnutie najvyššej koncentrácie v plazme alebo sére môže oneskoriť.
Hodnoty AUC a Cmax zonisamidu vzrástli po podaní jednorazovej dávky takmer lineárne v rozpätí dávok 100-800 mg a po podaní viacerých dávok v rozpätí dávok 100-400 mg raz za deň. Nárast za ustáleného stavu bol mierne vyšší ako sa na základe dávky očakával, pravdepodobne kvôli saturovateľnej väzbe zonisamidu na erytrocyty. Ustálený stav sa dosiahol počas 13 dní. Nepatrne vyššia akumulácia ako sa očakávalo nastala pri jednorazovej dávke.
Distribúcia
Zonisamid sa zo 40 - 50 % viaže na proteíny ľudskej plazmy a in vitro štúdie ukazujú, že táto väzba
nie je ovplyvnená prítomnosťou rôznych antiepileptických liekov (napr. fenytoín, fenobarbital, karbamazepín a valproát sodný). Zdanlivý distribučný objem je približne 1,1-1,7 l/kg u dospelých, čo naznačuje, že zonisamid sa značne distribuuje do tkanív. Pomer erytrocyty/plazma je asi 15 pri nízkych koncentráciách a asi 3 pri vyšších koncentráciách.
Biotransformácia
Zonisamid sa metabolizuje CYP3A4 hlavne redukčným odbúravaním benzizoxazolového kruhu
pôvodného liečiva za tvorby 2-sulfamoylacetylfenolu (SMAF) a tiež N-acetyláciou. Pôvodné liečivo a SMAF môžu dodatočne podliehať glukuronidácii. Metabolity, ktorých prítomnosť nebolo možné
v plazme zistiť, nemajú antikonvulzívnu aktivitu. Neexistujú dôkazy o tom, že zonisamid indukuje
svoj vlastný metabolizmus.
Eliminácia
Zdanlivý klírens zonisamidu v ustálenom stave po perorálnom podaní je asi 0,70 l/hod a terminálny
eliminačný polčas je asi 60 hodín v neprítomnosti induktorov CYP3A4. Eliminačný polčas nezávisel
na dávke a nebol ovplyvnený opakovaným podávaním. Fluktuácia hodnôt koncentrácií v sére a plazme je počas dávkovacieho intervalu nízka (< 30 %). Hlavnou cestou vylučovania metabolitov zonisamidu
a nezmeneného liečiva je moč. Renálny klírens nezmeneného zonisamidu je pomerne nízky (približne
3,5 ml/min); asi 15 - 30 % dávky sa vylučuje v nezmenenej forme.
Linearita/nelinearita
Expozícia zonisamidu sa zvyšuje s časom, kým sa približne o 8 týždňov nedosiahne rovnovážny stav.
Pri porovnaní rovnakých hladín dávok sa zdá, že jedinci s vyššou celkovou telesnou hmotnosťou dosahujú v rovnovážnom stave nižšie koncentrácie v sére, ale tento efekt sa zdá byť pomerne mierny. Vek (≥ 12 rokov) a pohlavie nemajú po úprave vplyvov na telesnú hmotnosť žiadne zjavné účinky na expozíciu zonisamidu u pacientov s epilepsiou počas dávkovania v rovnovážnom stave. Úprava dávky nie je potrebná so žiadnym z antiepileptík (AED), vrátane induktorov CYP3A4.
Farmakokinetický/farmakodynamický vzťah
Zonisamid znižuje 28-dňové priemerné frekvencie záchvatov a zníženie je proporcionálne (log-
lineárne) s priemernou koncentráciou zonisamidu.
Osobitné skupiny pacientov
Porucha funkcie obličiek
Pozitívne korelovali hodnoty renálneho klírensu zonisamidu s klírensom kreatinínu. Hodnota AUC zonisamidu v plazme sa zvýšila o 35% u jedincov s klírensom kreatinínu < 20 ml/min (pozri tiež časť 4.2).
Porucha funkcie pečene
Farmakokinetika zonisamidu u pacientov s poruchou funkcie pečene nebola dostatočne študovaná.
Starší
Vo farmakokinetike neboli medzi mladými (vo veku 21-40 rokov) a staršími osobami (65-75 rokov)
pozorované klinicky významné rozdiely.
Deti a dospievajúci (5-18 rokov)
Obmedzené údaje naznačujú, že farmakokinetika u detí a dospievajúcich dávkovaných na ustálený stav s 1, 7 a 12 mg/kg denne v rozdelených dávkach, je po úprave na telesnú hmotnosť podobná farmakokinetike pozorovanej u dospelých.
5.3 Predklinické údaje o bezpečnosti
Výsledky, ktoré neboli pozorované v klinických štúdiách, ale boli pozorované u psov pri hladinách expozície podobných klinickému použitiu, boli zmeny pečene (zväčšenie, zmena farby na tmavohnedú, mierne zväčšenie hepatocytov s koncentrickými lamelárnymi telieskami v cytoplazme a cytoplazmatická vakuolizácia) súvisiace so zvýšeným metabolizmom.
Zonisamid nebol genotoxický a nemá žiadny karcinogénny potenciál.
Zonisamid spôsoboval vývojové anomálie u myší, potkanov a psov a bol embryoletálny pre opice, keď sa podával v období organogenézy pri dávkovaní zonisamidu a plazmatických hladinách u matky podobných alebo nižších ako sú terapeutické hladiny u ľudí.
V štúdii perorálnej toxicity opakovanej dávky u mladých potkanov, pri hladinách expozície, ktoré boli podobné ako u pediatrických pacientov pri maximálnej odporúčanej dávke, bolo pozorované zníženie telesnej hmotnosti a zmeny v parametroch renálnej histopatológie a klinickej patológie a zmeny správania. Zmeny v parametroch renálnej histopatológie a klinickej patológie boli považované za súvisiace s inhibíciou karboanhydrázy zonisamidom. Účinky pri tejto hladine dávky boli reverzibilné počas obdobia rekonvalescencie. Pri vyššej hladine dávky (2 – 3-násobná systémová expozícia
v porovnaní s terapeutickou expozíciou) boli účinky na renálnu histopatológiu závažnejšie a iba čiastočne reverzibilné. Väčšina nežiaducich účinkov pozorovaných u mladých potkanov boli podobné
tým, ktoré boli pozorované v štúdiách toxicity opakovanej dávky zonisamidu u dospelých potkanov,
ale renálne tubulárne hyalínové kvapôčky a prechodná hyperplázia boli pozorované len v štúdii
u mladých potkanov. Pri tejto vyššej hladine dávky, mladé potkany preukázali pokles rastu, učenia a vývojových parametrov. Tieto účinky boli považované za pravdepodobne súvisiace so znížením
telesnej hmotnosti a s prehnanými farmakologickými účinkami zonisamidu v maximálne tolerovanej dávke.
U potkanov bolo pozorované zníženie počtu corpora lutea (žltých teliesok) pri hladinách expozície ekvivalentných maximálnej terapeutickej dávke u ľudí; nepravidelné cykly a znížený počet živých plodov boli pozorované pri hladinách expozície trikrát vyšších.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Zonisamid Mylan 25 mg a 100 mg tvrdé kapsuly
O
bsah kapsuly
mikrokryštalická celulóza
nátriumlaurylsulfát hydrogenovaný rastlinný olej
Obal kapsuly
oxid titaničitý (E 171)
želatína
Atrament:
šelak
čierny oxid železitý (E 172)
hydroxid draselný
Zonisamid Mylan 50 mg tvrdé kapsuly
Obsah kapsuly
mikrokryštalická celulóza
nátriumlaurylsulfát hydrogenovaný rastlinný olej
Obal kapsuly
oxid titaničitý (E 171)
želatína
Atrament:
šelak
červený oxid železitý (E 172)
6.2 Inkompatibility
Neaplikovateľné
6.3 Čas použiteľnosti
30 mesiacov
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Zonisamid
Mylan
25 mg a 50 mg tvrdé kapsuly
PVC-PVdC/Alu blistre v papierových škatuľkách obsahujúcich 14, 28 a 56 kapsúl.
PVC-PVdC/Alu blistre s perforáciou, umožňujúci oddelenie jednotlivej dávky v papierových škatuľkách obsahujúcich 14 x 1 kapsulu.
Zonisamid Mylan 100 mg tvrdé kapsuly
PVC-PVdC/Alu blistre v papierových škatuľkách obsahujúcich 28, 56a 196 kapsúl.
PVC-PVdC/Alu blistre s perforáciou, umožňujúci oddelenie jednotlivej dávky v papierových škatuľkách obsahujúcich 56 x 1 kapsulu.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Mylan S.A.S.
117 Allée des Parcs
69800 Saint Priest
Francúzsko
8. REGISTRAČNÉ ČÍSLA
EU/1/16/1093/001
EU/1/16/1093/002
EU/1/16/1093/003
EU/1/16/1093/004
EU/1/16/1093/005
EU/1/16/1093/006
EU/1/16/1093/007
EU/1/16/1093/008
EU/1/16/1093/009
EU/1/16/1093/010
EU/1/16/1093/011
EU/1/16/1093/012
EU/1/16/1093/013
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: {DD month YYYY}
10. DÁTUM REVÍZIE TEXTU
{MM/YYYY}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.