
cing="0" cellpadding="0">
|
Zriedkavé:
|
Angioneurotický edém
|
Psychické poruchy
|
|
Menej časté:
|
Úzkosť, poruchy spánku
|
|
Zriedkavé:
|
Zmätenosť
|
Poruchy nervového systému
|
|
Časté:
|
Bolesť hlavy
|
|
Menej časté:
|
Závraty, parestézia, poruchy chuti, hypestézia, hyperestézia, tremor, somnolencia
|
Poruchy oka
|
|
Časté:
|
Konjunktivitída
|
|
Menej časté:
|
Neostré videnie, skleritída a zápal orbity
|
|
Veľmi
zriedkavé:
|
Uveitída, episkleritída
|
Poruchy srdca a srdcovej činnosti
|
|
Menej časté:
|
Hypertenzia, hypotenzia, fibrilácia predsiení, hypotenzia spôsobujúca synkopu alebo obehový kolaps
|
|
Zriedkavé:
|
Bradykardia
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
|
Menej časté:
|
Dyspnoea, kašeľ, bronchokonstrikcia
|
|
Zriedkavé:
|
Intersticiálna choroba pľúc
|
Poruchy gastrointestinálneho traktu
|
|
Časté:
|
Nauzea, vracanie, anorexia
|
|
Menej časté:
|
Hnačka, zápcha, bolesť brucha, dyspepsia, stomatitída, suchosť v ústach
|
Poruchy kože a podkožného tkaniva
|
|
Menej časté:
|
Pruritus, vyrážka (vrátane erytematóznej a makulérnej vyrážky), zvýšené potenie
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
|
Časté:
|
Bolesť kostí, myalgia, artralgia, generalizovaná bolesť
|
|
Menej časté:
|
Svalové kŕče, osteonekróza čeľuste
|
Poruchy obličiek a močových ciest
|
|
Časté:
|
Zhoršenie funkcie obličiek
|
|
Menej časté:
|
Akútne zlyhanie obličiek, hematúria, proteinúria
|
C
elkové poruchy a reakcie v mieste podania
|
|
Časté:
|
Horúčka, syndróm podobný chrípke (vrátane únavy, zimnice, celkového
pocitu nevoľnosti a návalov tepla)
|
|
Menej časté:
|
Asténia, periférny edém, reakcie v mieste podania (vrátane bolesti, podráždenia, poruchu a indurácie), bolesť na hrudi, zvýšenie hmotnosti, anafylaktická reakcia/šok, urtikária
|
Laboratórne a funkčné vyšetrenia
|
|
Veľmi časté:
|
Hypofosfatémia
|
|
Časté:
|
Zvýšenie kreatinínu a močoviny v krvi, hypokalciémia
|
|
Menej časté:
|
Hypomagneziémia, hypokaliémia
|
|
Zriedkavé:
|
Hyperkaliémia, hypernatriémia
|
O
pis vybraných nežiaducich účinkov
Poškodenie
f
unkcie
pečene
Kyselina zoledrónová sa dávala do súvislosti s hláseniami o dysfunkcii obličiek. V súhrnnej analýze
údajov o bezpečnosti z registračných klinických skúšaní kyseliny zoledrónovej na prevenciu príhod súvisiacich so skeletom u pacientov s pokročilými malignitami s postihnutím kostí bola nasledovná
frekvencia porúch funkcie obličiek ako nežiaducich udalostí, pri ktorých bolo podozrenie na súvislosť
s kyselinou zoledrónovou (nežiaduce reakcie): mnohopočetný myelóm (3,2 %), karcinóm prostaty
(3,1 %), karcinóm prsníka (4,3 %), nádory pľúc a iné solídne nádory (3,2 %). Medzi faktory, ktoré môžu zvýšiť možnosť zhoršenia funkcie obličiek, patrí dehydratácia, už prítomné poškodenie funkcie obličiek, viaceré cykly podávania kyseliny zoledrónovej alebo iných bisfosfonátov, ako aj súbežné použitie nefrotoxických liekov alebo podanie infúzie za kratší čas, než sa v súčasnosti odporúča. Zhoršenie funkcie obličiek progredujúce do zlyhania obličiek a dialýzy sa zaznamenalo u pacientov po úvodnej dávke alebo po jedinej dávke 4 mg kyseliny zoledrónovej (pozri časť 4.4).
Osteonekróza čeľustePrevažne u pacientov s rakovinou liečených liekmi inhibujúcimi resorpciu kosti, ako je kyselina
zoledrónová, sa zaznamenali prípady osteonekrózy (primárne čeľuste). Mnohí z týchto pacientov mali príznaky lokálnej infekcie vrátane osteomyelitídy a väčšina hlásení sa týka pacientov s rakovinou po extrakcii zubov alebo iných dentálnych chirurgických zákrokoch. Osteonekróza čeľuste má viaceré zdokumentované rizikové faktory vrátane diagnózy rakoviny, súčasne podanej liečby (napr. chemoterapie, rádioterapie, kortikosteroidov) a sprievodných ochorení (napr. anémie, koagulopatií, infekcie, ochorenia ústnej dutiny). Hoci sa nestanovila príčinná súvislosť, odporúča sa vyvarovať sa dentálnych chirurgických zákrokov, pretože sa môže predĺžiť obdobie zotavenia (pozri časť 4.4).
Fibrilácia predsieníV jednom randomizovanom, dvojito zaslepenom, kontrolovanom klinickom skúšaní trvajúcom 3 roky,
v ktorom sa vyhodnotila účinnosť a bezpečnosť 5 mg kyseliny zoledrónovej podávanej raz ročne oproti placebu v liečbe postmenopauzálnej osteoporózy (PMO), bola celková incidencia fibrilácie
predsiení 2,5 % (96 z 3 862) u pacientok, ktoré dostávali 5 mg kyseliny zoledrónovej, a 1,9 % (75
z 3 852) u pacientok, ktoré dostávali placebo. Výskyt fibrilácie predsiení ako závažnej nežiaducej udalosti bol 1,3 % (51 z 3 862) u pacientok, ktoré dostávali 5 mg kyseliny zoledrónovej, a 0,6 % (22
z 3 852) u pacientok, ktoré dostávali placebo. Nerovnováha pozorovaná v tomto klinickom skúšaní sa
nepozorovala v iných skúšaniach s kyselinou zoledrónovou, vrátane skúšaní kyseliny zoledrónovej
4 mg každé 3 – 4 týždne u onkologických pacientov. Mechanizmus, ktorý spôsobil zvýšenú incidenciu fibrilácie predsiení v tomto jedinom klinickom skúšaní, nie je známy.
Reakcia akútnej fázyTúto nežiaducu reakciu na liek tvorí zoskupenie symptómov, ku ktorým patrí horúčka, bolesť svalov,
bolesť hlavy, bolesť končatín, nauzea, vracanie, hnačka a bolesť kĺbov. Čas ich nástupu je ≤ 3 dni po infúzii kyseliny zoledrónovej a táto reakcia sa tiež označuje ako symptómy „podobné chrípke“ alebo
„po podaní“.
Atypické zlomeniny stehennej kosti
Po uvedení lieku na trh boli hlásené nasledovné reakcie (frekvencia zriedkavé):
Atypické subtrochanterické a diafyzárne zlomeniny stehennej kosti (skupinová nežiaduca reakcia na bisfosfonáty).
4.9 Predávkovanie
Klinické skúsenosti s akútnym predávkovaním kyselinou zoledrónovou sú obmedzené. Zaznamenali sa aj omylom podané dávky až do 48 mg kyseliny zoledrónovej. Pacientov, ktorí dostali vyššie ako odporúčané dávky (pozri časť 4.2), je potrebné starostlivo sledovať, pretože sa pozorovalo poškodenie funkcie obličiek (vrátane zlyhania obličiek) a poruchy sérových elektrolytov (vrátane vápnika, fosforu a horčíka). Ak vznikne hypokalciémia, majú sa podať infúzie glukonanu vápenatého, ak je to klinicky indikované.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Liečivá na liečbu chorôb kostí, bisfosfonáty, ATC kód: M05BA08
Kyselina zoledrónová patrí do skupiny bisfosfonátov a pôsobí primárne na kosti. Je to inhibítor resorpcie kostí, spôsobenej osteoklastami.
Selektívny účinok bisfosfonátov na kosti podmieňuje ich vysoká afinita k mineralizovanej kosti, ale presný mechanizmus na úrovni molekúl, ktorý vedie k inhibícii aktivity osteoklastov, zatiaľ nie je jasný. V dlhodobých štúdiách na zvieratách kyselina zoledrónová tlmí resorpciu kosti bez nepriaznivého ovplyvnenia tvorby, mineralizácie alebo mechanických vlastností kosti.
Kyselina zoledrónová je nielen účinným inhibítorom resorpcie kostí, ale má aj viaceré protinádorové vlastnosti, ktoré môžu prispievať k jej celkovej účinnosti pri liečbe metastatického ochorenia kostí. V predklinických skúšaniach sa ukázali nasledujúce vlastnosti:
- In vivo: Inhibícia resorpcie kostí osteoklastami, ktorá mení mikroprostredie kostnej drene a robí ho
menej priaznivým pre rast nádorových buniek, antiangiogenetický účinok a analgetický účinok.
- In vitro: Inhibícia proliferácie osteoblastov, priamy cytostatický a proapoptotický účinok na nádorové bunky, synergický cytostatický účinok s inými protinádorovými liečivami, antiadhezívny a antiinvazívny účinok.
Výsledky klinických skúšaní pri prevencii príhod súvisiacich so skeletom u pacientov s postihnutím
kostí pri pokročilých malignitách
Prvé randomizované, dvojito zaslepené klinické skúšanie kontrolované placebom porovnávalo 4 mg
kyseliny zoledrónovej s placebom pri prevencii príhod súvisiacich so skeletom (SRE) u pacientov s karcinómom prostaty. Kyselina zoledrónová v dávke 4 mg významne znížila podiel pacientov, u
ktorých sa vyskytla aspoň jedna SRE, predĺžila medián času do prvej SRE o > 5 mesiacov a znížila
výskyt príhod pripadajúcich na pacienta za rok - mieru morbidity skeletu. Analýza viacpočetných príhod ukázala zníženie rizika vzniku SRE v skupine 4 mg kyseliny zoledrónovej o 36 % v porovnaní s placebom. Pacienti, ktorí dostávali 4 mg kyseliny zoledrónovej, hlásili menšie stupňovanie bolesti
ako pacienti, ktorí dostávali placebo, pričom rozdiel dosiahol štatistickú významnosť v 3., 9., 21., a 24. mesiaci. Menej pacientov liečených 4 mg kyseliny zoledrónovej utrpelo patologické zlomeniny.
Účinky liečby boli menej výrazné u pacientov s blastickými léziami. Výsledky účinnosti sú uvedené v
Tabuľke 2.
V druhom klinickom skúšaní, do ktorého boli zahrnuté solídne nádory okrem karcinómu prsníka alebo prostaty, kyselina zoledrónová v dávke 4 mg významne znížila podiel pacientov s SRE, predĺžila
medián času do prvej SRE o> 2 mesiace a znížila mieru morbidity skeletu. Analýza viacpočetných príhod ukázala zníženie rizika vzniku SRE v skupine 4 mg kyseliny zoledrónovej o 30,7 % v porovnaní s placebom. Výsledky účinnosti sú uvedené v Tabuľke 3.
Tabuľka 2: Výsledky účinnosti (pacienti s karcinómom prostaty liečení hormónmi)
|
| AkákoľvekSRE (+TIH)
| Zlomeniny*
| Rádioterapia kostí
|
| Kyselina zoledrónová
4 mg
| Placebo
| Kyselina zoledrónová
4 mg
| Placebo
| Kyselina zoledrónová
4 mg
| Placebo
|
N
| 214
| 208
| 214
| 208
| 214
| 208
|
Podiel pacientov s SRE (%)
| 38
| 49
| 17
| 25
| 26
| 33
|
Hodnota p
| 0,028
| 0,052
| 0,119
|
Medián času
do SRE (dni)
| 488
| 321
| NR
| NR
| NR
| 640
|
Hodnota p
| 0,009
| 0,020
| 0,055
|
Miera morbidity skeletu
| 0,77
| 1,47
| 0,20
| 0,45
| 0,42
| 0,89
|
Hodnota p
| 0,005
| 0,023
| 0,060
|
Zníženie
rizika utrpenia
viacpočetných príhod** (%)
| 36
| -
| NA
| NA
| NA
| NA
|
Hodnota p
| 0,002
| NA
| NA
|
* Zahŕňa zlomeniny stavcov a iné zlomeniny
** Zohľadňuje všetky príhody súvisiace so skeletom, celkový počet ako aj čas do každej príhody počas klinického skúšania
NR Nedosiahnuté
NA Neaplikovateľné
Tabuľka 3: Výsledky účinnosti (solídne nádory okrem karcinómu prsníka alebo prostaty)
|
| AkákoľvekSRE (+TIH)
| Zlomeniny*
| Rádioterapia kostí
|
| Kyselina zoledrónová
4 mg
| Placebo
| Kyselina zoledrónová
4 mg
| Placebo
| Kyselina zoledrónová
4 mg
| Placebo
|
N
| 257
| 250
| 257
| 250
| 257
| 250
|
Podiel pacientov s SRE (%)
| 39
| 48
| 16
| 22
| 29
| 34
|
Hodnota p
| 0,039
| 0,064
| 0,173
|
Medián času
do SRE (dni)
| 236
| 155
| NR
| NR
| 424
| 307
|
Hodnota p
| 0,009
| 0,020
| 0,079
|
Miera morbidity skeletu
|
1,74
|
2,71
|
0,39
|
0,63
|
1,24
|
1,89
|
Hodnota p
|
0,012
|
0,066
|
0,099
|
Zníženie rizika utrenia viacpočetných príhod** (%)
|
30,7
|
-
|
NA
|
NA
|
NA
|
NA
|
Hodnota p
|
0,003
|
NA
|
NA
|
* Zahŕňa zlomeniny stavcov a iné zlomeniny
** Zohľadňuje všetky príhody súvisiace so skeletom, celkový počet ako aj čas do každej príhody počas klinického skúšania
NR Nedosiahnuté
NA Neaplikovateľné
V treťom randomizovanom, dvojito zaslepenom klinickom skúšaní fázy III sa porovnávala kyselina zoledrónová 4 mg a pamidronát 90 mg každé 3 až 4 týždne u pacientov s mnohopočetným myelómom alebo karcinómom prsníka a aspoň jednou léziou kosti. Výsledky ukázali, že kyselina zoledrónová v dávke 4 mg vykazuje porovnateľnú účinnosť s 90 mg pamidronátu pri prevencii SRE. Analýza viacpočetných príhod ukázala významné zníženie rizika vzniku SRE o 16 % u pacientov liečených
4 mg kyseliny zoledrónovej v porovnaní s pacientmi, ktorí dostávali pamidronát. Výsledky účinnosti sú uvedené v Tabuľke 4.
Tabuľka 4: Výsledky bezpečnosti (pacienti s mnohopočetným myelómom a karcinómom prsníka)
|
| Akákoľvek(+TIH)
| Zlomeniny*
| Rádioterapia kostí
|
| Kyselina zoledrónová
4 mg
| Pam 90 mg
| Kyseliny zoledrónová
4 mg
| Pam 90 mg
| Kyselina zoledrónová
4 mg
| Pam 90 mg
|
N
| 561
| 555
| 561
| 555
| 561
| 555
|
Podiel pacientov s SRE (%)
| 48
| 52
| 37
| 39
| 19
| 24
|
Hodnota p
| 0,198
| 0,653
| 0,037
|
Medián času
do SRE (dni)
| 376
| 356
| NR
| 714
| NR
| NR
|
Hodnota p
| 0,151
| 0,672
| 0,026
|
Miera morbidity skeletu
| 1,04
| 1,39
| 0,53
| 0,60
| 0,47
| 0,71
|
Hodnota p
| 0,084
| 0,614
| 0,015
|
Zníženie
rizika utrpenia
viacpočetných
príhod** (%)
| 16
| -
| NA
| NA
| NA
| NA
|
Hodnota p
| 0,030
| NA
| NA
|
* Zahŕňa zlomeniny stavcov a iné zlomeniny
** Zohľadňuje všetky príhody súvisiace so skeletom, celkový počet ako aj čas do každej príhody počas klinického skúšania
NR Nedosiahnuté
NA Neaplikovateľné
Kyselina zoledrónová v dávke 4 mg sa skúmala aj v dvojito zaslepenom, randomizovanom klinickom skúšaní kontrolovanom placebom u 228 pacientok s preukázanými metastázami do kostí pri karcinóme prsníka, v ktorom sa vyhodnotil účinok 4 mg kyseliny zoledrónovej na pomer výskytu príhod súvisiacich so skeletom (SRE), vypočítaný ako celkový počet SRE príhod (okrem hyperkalciémie a po úprave vzhľadom na predchádzajúcu zlomeninu), delený obdobím celkového rizika. Pacientky dostávali buď 4 mg kyseliny zoledrónovej, alebo placebo každé štyri týždne počas jedného roka. Pacientky boli rovnomerne rozdelené do skupín liečby kyselinou zoledrónovou a placebom.
Výskyt SRE (príhody/osoba za rok) bol 0,628 pri kyseline zoledrónovej a 1,096 pri placebe. Podiel pacientok s aspoň jednou SRE (okrem hyperkalciémie) bol 29,8 % v skupine liečenej kyselinou zoledrónovou oproti 49,6 % v skupine placeba (p = 0,003). Medián času do vzniku prvej SRE sa v skupine liečby kyselinou zoledrónovou na konci klinického skúšania nedosiahol a v porovnaní s placebom bol významne dlhší (p = 0,007). V porovnaní s placebom kyselina zoledrónová v dávke
4 mg znížila riziko SRE o 41 % v analýze viacpočetných príhod (pomer rizika = 0,59, p = 0,019).
V skupine liečenej kyselinou zoledrónovou sa v porovnaní s placebom pozorovalo štatisticky významné zlepšenie pri hodnotení bolesti (pri použití Brief Pain Inventory, BPI) po 4 týždňoch a v každom neskoršom čase počas klinického skúšania (Obrázok 1). Hodnotenie bolesti pri kyseline zoledrónovej bolo trvale pod východiskovou hodnotou a zmiernenie bolesti sprevádzala tendencia k poklesu analgetického skóre.
Obrázok 1: Priemerné zmeny skóre podľa BPI oproti východiskovej hodnote. Vyznačené sú štatisticky významné rozdiely (*p < 0,05) pri porovnaní spôsobov liečby (4 mg kyseliny zoledrónovej oproti placebu)Placebo
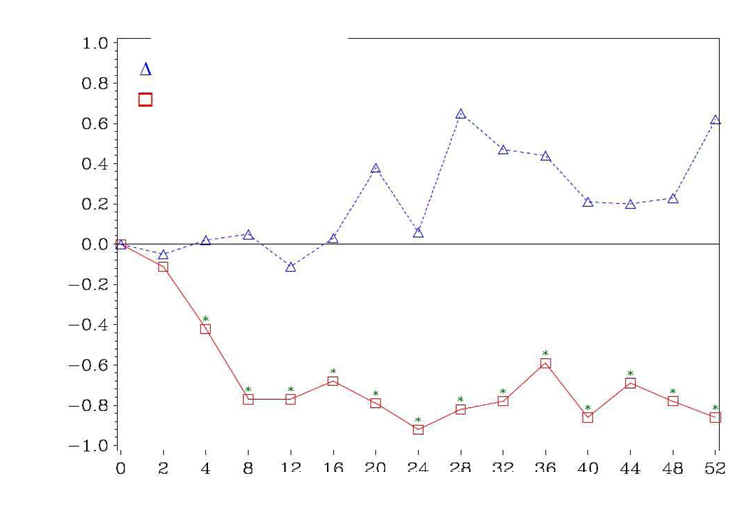

Kyselina zoledrónová
Trvanie klinického skúšania (týždne)
V
ý
sledky klinických skúšanípriliečbeTIHKlinické skúšania pri hyperkalciémii vyvolanej nádorom (TIH) ukázali, že pre účinok kyseliny
zoledrónovej je charakteristický pokles vápnika v sére a vylučovania vápnika močom. Vo fáze I sa v klinických skúšaniach na zistenie dávky u pacientov s miernou až stredne závažnou hyperkalciémiou vyvolanou nádorom (TIH) skúšali účinné dávky v rozmedzí približne 1,2 – 2,5 mg.
Na stanovenie účinkov 4 mg kyseliny zoledrónovej v porovnaní s 90 mg pamidronátu sa vo vopred plánovej analýze zlúčili výsledky dvoch pilotných multicentrických skúšaní s pacientmi s TIH. Normalizácia korigovaného vápnika v sére bola rýchlejšia na 4. deň pri 8 mg kyseliny zoledrónovej a na 7. deň pri 4 mg a 8 mg kyseliny zoledrónovej. Pozorovala sa nasledujúca odpoveď na liečbu:
Tabuľka 5: Podiel pacientov s úplnou odpoveďou na liečbu podľa dní v zlúčených klinických
skúšaniach TIH
|
| 4. deň
| 7. deň
| 10. deň
|
Kyseliny zoledrónová
4 mg (N = 86)
| 45,3 % (p = 0,104)
| 82,6 % (p = 0,005)*
| 88,4 % (p = 0,002)*
|
Kyselina zoledrónová
8 mg (N = 90)
| 55,6 % (p = 0.021)*
| 83,3 % (p = 0,010)*
| 86,7 % (p = 0,015)*
|
Pamidronát 90 mg
(N = 99)
| 33,3 %
| 63,6 %
| 69,7 %
|
*hodnoty p v porovnaní s pamidronátom.
|
Medián času do dosiahnutia normokalciémie bol 4 dni. Medián času do relapsu (opätovné zvýšenie
sérového vápnika korigovaného podľa albumínu na ≥ 2,9 mmol/l) bol 30 až 40 dní u pacientov liečených kyselinou zoledrónovou oproti 17 dňom u pacientov liečených 90 mg pamidronátu (hodnoty p: 0,001 pre 4 mg a 0,007 pre 8 mg kyseliny zoledrónovej). Medzi oboma dávkami kyseliny zoledrónovej neboli štatisticky významné rozdiely.
V klinických skúšaniach bolo 69 pacientov s relapsom alebo bez odpovede na začiatočnú liečbu (kyselina zoledrónová 4 mg, 8 mg alebo pamidronát 90 mg) opäť liečených 8 mg kyseliny zoledrónovej. Podiel takýchto pacientov, u ktorých sa dosiahla odpoveď, bol asi 52 %. Pretože títo pacienti boli liečení len dávkou 8 mg, nie sú údaje, ktoré umožňujú porovnanie s dávkou 4 mg kyseliny zoledrónovej.
V klinických skúšaniach s pacientmi s hyperkalciémiou vyvolanou nádorom (TIH) bol celkový profil bezpečnosti u všetkých troch skupín liečby (kyselina zoledrónová 4 mg a 8 mg a pamidronát 90 mg) podobný čo do typu a závažnosti.
Deti a dospievajúciVýsledkyklinickýchskúšanívliečbezávažnejosteogenesisimperfectaudetí a dospievajúcich vo vekuod 1 do 17 rokovÚčinky intravenózne podávanej kyseliny zoledrónovej v liečbe detí a dospievajúcich (vo veku od 1 do
17 rokov) so závažnou osteogenesis imperfecta (typy I, III a IV) sa porovnali s intravenózne podávaným pamidronátom v jednej medzinárodnej, multicentrickej, randomizovanej, otvorenej štúdii
so 74 a 76 pacientmi v uvedených skupinách liečby. Liečba v štúdii trvala 12 mesiacov a predchádzalo
jej 4- až 9-týţdňové obdobie skríningu, v ktorom sa počas najmenej 2 týždňov užívali doplnky vitamínu D a elementárneho vápnika. V klinickom programe pacienti vo veku od 1 do < 3 roky dostávali 0,025 mg/kg kyseliny zoledrónovej (až do najvyššej jednorazovej dávky 0,35 mg) každé
3 mesiace a pacienti vo veku od 3 do 17 rokov dostávali 0,05 mg/kg kyseliny zoledrónovej (až do najvyššej jednorazovej dávky 0,83 mg) každé 3 mesiace. Štúdia s extenziou sa vykonala na
preskúmanie dlhodobej celkovej bezpečnosti a bezpečnosti pre obličky pri podávaní kyseliny zoledrónovej raz za rok alebo dvakrát za rok počas 12 mesiacov liečby v extenzii u detí, ktoré v základnej štúdii ukončili jeden rok liečby buď kyselinou zoledrónovou, alebo pamidronátom.
Primárnym koncovým ukazovateľom v tejto štúdii bola percentuálna zmena minerálnej denzity kostí (BMD) v lumbálnej chrbtici po 12 mesiacoch liečby oproti východiskovým hodnotám. Odhadované účinky liečby na BMD boli podobné, ale usporiadanie klinického skúšania nepostačovalo na preukázanie noninferiority účinnosti kyseliny zoledrónovej. Najmä účinnosť na incidenciu zlomenín alebo bolesť sa jednoznačne nepreukázala. Zlomeniny dlhých kostí dolných končatín boli hlásené ako nežiaduce udalosti u približne 24 % (femur) a 14 % (tíbia) pacientov so závažnou osteogenesis imperfecta liečených kyselinou zoledrónovou oproti 12 % a 5 % pacientov liečených pamidronátom, bez ohľadu na typ ochorenia a kauzalitu, ale celková incidencia zlomenín bola porovnateľná u pacientov liečených kyselinou zoledrónovou a pamidronátom: 43 % (32/74) oproti 41 % (31/76). Interpretáciu rizika zlomenín komplikuje skutočnosť, že zlomeniny sú ako súčasť priebehu ochorenia častou udalosťou u pacientov so závažnou osteogenesis imperfecta.
Typ nežiaducich reakcií, ktoré sa pozorovali u tejto populácie, bol podobný, ako sa predtým zaznamenal u dospelých s pokročilými malignitami s postihnutím kosti (pozri časť 4.8). Nežiaduce reakcie usporiadané podľa frekvencie sú uvedené v Tabuľke 6. Použila sa nasledujúca obvyklá klasifikácia: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až <1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov).
Tabuľka 6: Nežiaduce reakcie pozorované u detí a dospievajúcich so závažnou osteogenesis imperfecta1
| Poruchy nervového systému
|
| Časté:
| Bolesť hlavy
| Poruchy srdca a srdcovej činnosti
|
| Časté:
| Tachykardia
| Poruchy dýchacej sústavy, hrudníka a mediastína
|
| Časté:
| Nazofaryngitída
| Poruchy gastrointestinálneho traktu
|
| Veľmi časté:
| Vracanie, nauzea
|
| Časté:
| Bolesť brucha
| Poruchy kostrovej a svalovej sústavy a spojivového tkanica
|
| Časté:
| Bolesť končatín, artralgia, bolesť svalov a kostí
| Celkové poruchy a reakcie v mieste podania
|
| Veľmi časté:
| Pyrexia, únava
|
| Časté:
| Reakcia akútnej fázy, bolesť
| Laboratórne a funkčné vyšetrenia
|
| Veľmi časté:
| Hypokalciémia
|
| Časté:
| Hypofosfatémia
|
|
|
1 Nežiaduce udalosti vyskytujúce sa s frekvenciou < 5 % boli medicínsky vyhodnotené a ukázalo sa,
že tieto prípady zodpovedajú overenému profilu bezpečnosti kyseliny zoledrónovej (pozri časť 4.8).
U detí a dospievajúcich so závažnou osteogenesis imperfecta sa zdá, že kyselina zoledrónová je v porovnaní s pamidronátom spojená s výraznejším rizikom reakcie akútnej fázy, hypokalciémie a nevysvetlenej tachykardie, ale tieto rozdiely sa znižovali pri následných infúziách.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií pre referenčný liek obsahujúci kyselinu zoledrónovú vo všetkých vekových podskupinách detí a dospievajúcich v liečbe hyperkalciémie vyvolanej nádorom a v prevencii príhod súvisiacich so skeletom u pacientov s postihnutím kostí pri pokročilých malignitách (pre informáciu o použití u detí a dospievajúcich, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Pri jednorazových a opakovaných infúziách trvajúcich 5 a 15 minút, ktorými sa podalo 2, 4, 8 a 16 mg kyseliny zoledrónovej 64 pacientom s metastázami v kostiach, sa zistili nasledujúce farmakokinetické údaje, ktoré nezáviseli od dávky.
Po začatí infúzie kyseliny zoledrónovej sa plazmatické koncentrácie kyseliny zoledrónovej rýchlo zvýšili a dosiahli maximum na konci podania infúzie, po ktorom nasledoval rýchly pokles na ˂ 10 % maxima po 4 hodinách a ˂ 1 % maxima po 24 hodinách, s následným dlhým obdobím veľmi nízkych koncentrácií nepresahujúcich 0,1 % maxima pred druhou infúziou kyseliny zoledrónovej na 28. deň.
Intravenózne podaná kyselina zoledrónová sa eliminuje trojfázovým procesom: rýchle dvojfázové vymiznutie zo systémového obehu s polčasmi t1/2α 0,24 a t1/2β 1,87 hodiny, po ktorých nasleduje dlhá eliminačná fáza s konečným polčasom eliminácie t1/2γ 146 hodín. Po opakovanom podávaní každých
28 dní nedošlo k akumulácii kyseliny zoledrónovej v plazme. Kyselina zoledrónová sa nemetabolizuje
a vylučuje sa nezmenená obličkami. Počas prvých 24 hodín sa v moči nájde 39 ± 16 % podanej dávky,
zatiaľ čo zvyšok sa v zásade viaže na tkanivo kostí. Z kostného tkaniva sa veľmi pomaly uvoľňuje späť do systémového obehu a vylučuje sa obličkami. Celkový telesný klírens je 5,04 ± 2,5 l/hod, a to
nezávisle od dávky a bez ovplyvnenia pohlavím, vekom, rasou a telesnou hmotnosťou. Predĺženie
infúzie z 5 na 15 minút znížilo koncentráciu kyseliny zoledrónovej na konci infúzie o 30 %, ale
neovplyvnilo plochu pod krivkou koncentrácie oproti času.
Tak ako aj pri iných bisfosfonátoch, variabilita farmakokinetických parametrov kyseliny zoledrónovej medzi pacientmi bola vysoká.
Nie sú dostupné farmakokinetické údaje o kyseline zoledrónovej u pacientov s hyperkalciémiou alebo u pacientov s insuficienciou pečene. Kyselina zoledrónová neinhibuje ľudské enzýmy P450 in vitro, nevykazuje biotransformáciu a v štúdiách na zvieratách sa v stolici našli < 3 podanej dávky, čo naznačuje, že funkcia pečene nezohráva významnú úlohu vo farmakokinetike kyseliny zoledrónovej.
Pri určení vzťahu medzi obličkovým klírensom kyseliny zoledrónovej a klírensom kreatinínu predstavoval obličkový klírens 75 ± 33 % klírensu kreatinínu, ktorého priemerná hodnota bola
84 ± 29 ml/min (rozmedzie 22 – 143 ml/min) u 64 sledovaných pacientov s karcinómami. Analýza v tejto skupine ukázala, že u pacienta s klírensom kreatinínu 20 ml/min (závažné poškodenie funkcie obličiek) alebo 50 ml/min (stredne závažné poškodenie) bude zodpovedajúci predpokladaný klírens
kyseliny zoledrónovej 37 % alebo 72 % hodnoty pacienta, ktorý má klírens kreatinínu 84 ml/min. Sú dostupné len obmedzené farmakokinetické údaje o pacientoch so závažnou insuficienciou obličiek (klírens kreatinínu ˂ 30 ml/min).
Kyselina zoledrónová nemá afinitu ku krvinkám a jej väzba na bielkoviny plazmy je nízka (približne
56 %) a nezávisí od koncentrácie kyseliny zoledrónovej.
Osobitné skupiny pacientov
Deti a dospievajúci
Obmedzené farmakokinetické údaje u detí so závažnou osteogenesis imperfecta naznačujú, že farmakokinetika kyseliny zoledrónovej u detí vo veku 3 až 17 rokov je podobná ako u dospelých pri podobnej hladine dávok mg/kg. Vek, telesná hmotnosť, pohlavie a klírens kreatinínu zrejme nemajú žiadny vplyv na systémovú expozíciu kyseline zoledrónovej.
5.3 Predklinické údaje o bezpečnosti
Akútna toxicita
Najvyššia neletálna jednorazová intravenózna dávka bola 10 mg/kg telesnej hmotnosti u myší a
0,6 mg/kg u potkanov.
Subchronická a chronická toxicita
Kyselina zoledrónová sa dobre znášala, keď sa podávala subkutánne potkanom a intravenózne psom v
dávkach do 0,02 mg/kg denne počas 4 týždňov. Podávanie 0,001 mg/kg/deň subkutánne potkanom a
0,005 mg/kg intravenózne psom raz za 2 – 3 dni počas až 52 týždňov sa tiež dobre znášalo.
Najčastejším nálezom v štúdiách pri opakovanom podávaní bolo zväčšenie primárnej trabekulárnej časti kosti v metafýzach dlhých kostí u rastúcich zvierat pri takmer všetkých dávkach, čo bol nález v súlade s farmakologickou antiresorpčnou účinnosťou látky.
Bezpečné rozmedzie dávok vzhľadom na účinky na obličky bolo úzke v štúdiách pri dlhodobom opakovanom parenterálnom podávaní zvieratám, ale kumulatívne hladiny bez nežiaducich príhod v štúdiách pri jednorazovom podaní (1,6 mg/kg) a pri opakovanom podávaní až do jedného mesiaca (0,06 – 0,6 mg/kg/deň) nenaznačili účinky na obličky pri dávkach ekvivalentných alebo prevyšujúcich najvyššiu plánovanú terapeutickú dávku u ľudí. Dlhodobejšie opakované podávanie v dávkach, ktoré zahrnulo aj najvyššiu plánovanú terapeutickú dávku kyseliny zoledrónovej u ľudí, vyvolalo toxické účinky v iných orgánoch vrátane gastrointestinálneho traktu, pečene, sleziny a pľúc, ako aj v mieste podania intravenóznej injekcie.
Reprodukčná toxicita
Kyselina zoledrónová bola teratogénna u potkanov v subkutánnych dávkach ≥ 0,2 mg/kg. Hoci sa u
králikov nepozorovala žiadna teratogenita alebo fetotoxicita, zistila sa toxicita pre matky. Dystokia sa pozorovala pri najnižšej skúšanej dávke u potkanov (0,01 mg/kg telesnej hmotnosti).
Mutagenita a karcinogénny potenciál
Kyselina zoledrónová nebola mutagénna vo vykonaných testoch mutagenity a testy na karcinogenitu
neposkytli žiadne dôkazy o karcinogénnom potenciále.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol Citrát sodný Voda na injekciu
6.2 Inkompatibility
Aby sa zabránilo prípadným inkompatibilitám, Zoledronic Acid Hospira sa má zriediť s injekčným
roztokom chloridu sodného 9 mg/ml (0,9 %) alebo 5 % m/V roztokom glukózy.
Tento liek sa nesmie miešať s infúznymi roztokmi obsahujúcimi vápnik alebo iné dvojmocné katióny, napr. Ringerovým roztokom s laktátom, a má sa podať vo forme jednorazového intravenózneho roztoku osobitnou infúznou súpravou.
6.3 Čas použiteľnosti
2 roky
Po zriedení: Z mikrobiologického hľadiska sa má zriedený infúzny roztok použiť okamžite. Ak sa nepoužije okamžite, používateľ zodpovedá za čas a podmienky uchovávania pred použitím, čo normálne nemá byť dlhšie ako 24 hodín pri 2 °C – 8 °C. Schladený roztok má potom pred podaním dosiahnuť izbovú teplotu.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
Podmienky na uchovávanie po riedení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Injekčná liekovka s objemom 6 ml z číreho skla triedy I alebo injekčná liekovka s objemom 5 ml
z pastu s fluóropolymérovou zátkou potiahnutou halobutylovým vrchnákom a hliníkovým uzáverom s vyklápacím viečkom.
Zoledronic Acid Hospira sa dodáva v baleniach obsahujúcich 1 injekčnú liekovku.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pred podaním sa musí 5,0 ml koncentrátu z jednej injekčnej liekovky alebo odobraté množstvo koncentrátu riediť v 100 ml infúzneho roztoku, ktorý neobsahuje vápnik (injekčný roztok chloridu sodného 9 mg/ml (0,9 %) alebo 5 % m/V roztok glukózy).
Ďalšie informácie o manipulácii so Zoledronic Acid Hospira, vrátane pokynov na prípravu znížených dávok, sú uvedené v časti 4.2.
Počas prípravy infúzie sa musia dodržiavať aseptické postupy. Len na jednorazové použitie. Má sa použiť len číry, nesfarbený roztok bez cudzorodých častíc.
Zdravotníckym pracovníkom sa odporúča, aby nelikvidovali nepoužitú Zoledronic Acid Hospira odpadovou vodou alebo domovým odpadom.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Hospira UK Limited
Queensway
Royal Leamington Spa Warwickshire CV31 3RW Spojené kráľovstvo
8. REGISTRAČNÉ ČÍSLO
9. DÁTUM PRVEJ REGISTÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Zoledronic Acid Hospira 4 mg/100 ml infúzny roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Jeden vak s objemom 100 ml obsahuje 4 mg kyseliny zoledrónovej (vo forme monohydrátu). Jeden ml roztoku obsahuje 0,04 mg kyseliny zoledrónovej (vo forme monohydrátu).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Infúzny roztok
Číry a bezfarebný roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
- Prevencia príhod súvisiacich so skeletom (patologické zlomeniny, kompresia miechy, rádioterapia alebo chirurgický zákrok na kosti, alebo hyperkalciémia vyvolaná nádorom) u dospelých pacientov s postihnutím kostí pri pokročilých malignitách.
- Liečba dospelých pacientov s hyperkalciémiou vyvolanou nádorom (TIH).
4.2 Dávkovanie a spôsob podania
Kyselinu zoledrónovú môžu predpisovať a podávať pacientom len zdravotnícki pracovníci, ktorí majú
skúsenosti s intravenóznym podávaním bisfosfonátov.
Dávkovanie
Prevenciapríhodsúvisiacichsoskeletomupacientovspostihnutímkostípripokročilýchmalignitách
Dospelí a starší pacienti
Odporúčaná dávka pri prevencii príhod súvisiacich so skeletom u pacientov s postihnutím kostí pri pokročilých malignitách je 4 mg kyseliny zoledrónovej každé 3 až 4 týždne.
Pacientom sa má perorálne podávať aj doplnok 500 mg vápnika a 400 IU vitamínu D denne.
Pri rozhodovaní o liečbe na prevenciu príhod súvisiacich so skeletom u pacientov s metastázami v kostiach sa má vziať do úvahy, že účinok liečby sa prejaví za 2 – 3 mesiace.
Liečba TIH
Dospelí a starší pacienti
Odporúčaná dávka pri hyperkalciémii (vápnik v sére korigovaný podľa albumínu ≥ 12,0 mg/dl alebo
3,0 mmol/l) je jednorazová dávka 4 mg kyseliny zoledrónovej.
Poškodenie funkcie obličiek
TIH:
O liečbe kyselinou zoledrónovou u pacientov s TIH, ktorí majú aj závažné poškodenie funkcie obličiek, sa má uvažovať len po vyhodnotení rizík a prínosov liečby. Z klinických skúšaní boli vylúčení pacienti s kreatinínom v sére > 400 μmol/l alebo > 4,5 mg/dl. Nie je potrebné upraviť dávku u pacientov s TIH s kreatinínom v sére < 400 μmol/l alebo < 4,5 mg/dl (pozri časť 4.4).
Prevencia príhod súvisiacich so skeletom u pacientov s postihnutím kostí pri pokročilých malignitách:Pri začatí liečby kyselinou zoledrónovou u pacientov s mnohopočetným myelómom alebo metastatickými léziami kostí pri solídnych nádoroch sa majú stanoviť kreatinín v sére a klírens kreatinínu (CLcr). CLcr sa vypočíta zo sérového kreatinínu pomocou Cockcroftovho-Gaultovho vzorca. Použitie kyseliny zoledrónovej sa neodporúča u pacientov, ktorí majú pred začatím liečby závažné poškodenie funkcie obličiek, definované u tejto skupiny pacientov ako CLcr < 30 ml/min. Z klinických skúšaní kyseliny zoledrónovej boli vylúčení pacienti s kreatinínom v sére > 265 μmol/l alebo > 3,0 mg/dl.
Pacientom s normálnou funkciou obličiek (definovanou ako CLcr > 60 ml/min) možno podávať infúzny roztok kyseliny zoledrónovej 4 mg/100 ml priamo bez ďalšej prípravy. U pacientov s metastázami v kostiach, ktorí majú pred začatím liečby mierne až stredne závažné poškodenie funkcie obličiek, definované u tejto skupiny pacientov ako CLcr 30 – 60 ml/min, sa odporúčajú znížené dávky Zoledronic Acid Hospira (pozri aj časť 4.4).
Východiskový klírens kreatinínu (ml/min)
| Odporúčaná dávky Zoledronic Acid Hospira*
|
> 60
| 4,0 mg kyseliny zoledrónovej
|
50–60
| 3,5 mg* kyseliny zoledrónovej
|
40–49
| 3,3 mg* kyseliny zoledrónovej
|
30–39
| 3,0 mg* kyseliny zoledrónovej
|
* Dávky sa vypočítali za predpokladu cieľovej AUC 0,66 (mg•hod/l) (CLcr = 75 ml/min). Očakáva sa,
že zníženými dávkami sa u pacientov s poškodením funkcie obličiek dosiahne rovnaká AUC, aká sa
pozoruje u pacientov s klírensom kreatinínu 75 ml/min.
Po začatí liečby sa má stanoviť kreatinín v sére pred každou dávkou Zoledronic Acid Hospira a liečba sa má ukončiť, ak sa zhoršila funkcia obličiek. V klinických skúšaniach sa zhoršenie funkcie obličiek definovalo ako:
- Zvýšenie o 0,5 mg/dl alebo 44 μmol/l u pacientov s normálnou východiskovou hodnotou kreatinínu v sére (< 1,4 mg/dl alebo < 124 μmol/l);
- Zvýšenie o 1,0 mg/dl alebo 88 μmol/l u pacientov s abnormálnou východiskovou hodnotou
kreatinínu (> 1,4 mg/dl alebo > 124 μmol/l).
V klinických skúšaniach sa pokračovalo v liečbe kyselinou zoledrónovou, len ak sa hladina kreatinínu vrátila do rozmedzia 10 % nad východiskovou hodnotou (pozri časť 4.4). V liečbe Zoledronic Acid Hospira sa má pokračovať s rovnakou dávkou, aká sa podávala pred prerušením liečby.
Deti a dospievajúciBezpečnosť a účinnosť kyseliny zoledrónovej u detí vo veku 1 rok až 17 rokov neboli doteraz stanovené. V súčasnosti sú dostupné údaje opísané v časti 5.1, ale neumožňujú uviesť odporúčania k dávkovaniu.
Spôsob podaniaIntravenózne použitie.
Zoledronic Acid Hospira sa má podať vo forme jednorazovej intravenóznej infúzie trvajúcej nie menej
ako 15 minút.
Pre pacientov s normálnou funkciou obličiek, definovanou ako CLcr > 60 ml/min, sa infúzny roztok kyseliny zoledrónovej 4 mg/100 ml nesmie ďalej riediť.
U pacientov s miernym až stredne závažným poškodením funkcie obličiek sa odporúčajú znížené
dávky Zoledronic Acid Hospira (pozri časť „Dávkovanie” vyššie a časť 5.2).
Pokyny na prípravu znížených dávok pre pacientov s východiskovou hodnotou CLcr ≤ 60 ml/min pozri nižšie v Tabuľke 1. Pred podaním odoberte určený objem roztoku Zoledronic Acid Hospira z vaku.
Tabuľka 1: Príprava znížených dávok infúzneho roztoku Zoledronic Acid Hospira 4 mg/100 m
Východisková hodnota klírensu kreatinínu (ml/min)
| Odoberte nasledujúce množstvo infúzneho roztoku Zoledronic Acid Hospira
4 mg/100 ml (ml)
| Upravená dávka (mg kyseliny zoledrónovej)
|
50-60
| 12,0
| 3,5
|
40-49
| 18,0
| 3,3
|
30-39
| 25,0
| 3,0
|
Zoledronic Acid Hospira sa nesmie miešať s inými infúznymi roztokmi a má sa podať vo forme
jednorazového intravenózneho roztoku osobitnou infúznou súpravou.
Pacienti musia byť trvale dostatočne hydratovaní pred podaním Zoledronic Acid Hospira a po ňom.
4.3 Kontraindikácie- Precitlivenosť na liečivo, iné bisfosfonáty alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Dojčenie (pozri časť 4.6).
4.4 Osobitné upozornenia a opatrenia pri používaníVšeobecnéPred podaním kyseliny zoledrónovej je nutné pacientov vyšetriť, aby sa overilo, či sú dostatočne
hydratovaní.
U pacientov s rizikom zlyhania srdca je nutné vyvarovať sa nadbytočnej hydratácie.
Po začatí liečby kyselinou zoledrónovou sa majú starostlivo sledovať bežné metabolické parametre súvisiace s hyperkalciémiou, ako sú hladiny vápnika, fosfátu a horčíka v sére. Ak vznikne hypokalciémia, hypofosfatémia alebo hypomagneziémia, môže byť potrebná krátkodobá suplementárna liečba. Neliečení pacienti s hyperkalciémiou mávajú spravidla určitý stupeň poruchy funkcie obličiek, preto sa má zvážiť starostlivé sledovanie funkcie obličiek.
Boli hlásené prípady závažnej hypokalciémie vyžadujúce hospitalizáciu. V niektorých prípadoch sa
môže vyskytnúť život ohrozujúca hypokalciémia.
Iné lieky obsahujúce kyselinu zoledrónovú ako liečivo sú dostupné na liečbu osteoporózy alebo Pagetovej choroby kostí. Pacienti, ktorí sa liečia Zoledronic Acid Hospira, sa nemajú súčasne liečiť takýmito liekmi alebo akýmkoľvek iným bisfosfonátom, pretože kombinované účinky týchto látok nie sú známe.
Insuficienciaobličiek Stav pacientov s TIH a preukázaným zhoršením funkcie obličiek je nutné patrične zhodnotiť a zvážiť, či je prípadný prínos liečby kyselinou zoledrónovou väčší ako jej možné riziko.
Pri rozhodovaní o tom, či preventívne liečiť pacientov s metastázami v kostiach proti príhodám
súvisiacim so skeletom, treba vziať do úvahy, že účinok liečby nastupuje za 2 – 3 mesiace.
V súvislosti s kyselinou zoledrónovou sa zaznamenali poruchy funkcie obličiek. Medzi faktory, ktoré môžu zvýšiť možnosť zhoršenia funkcie obličiek, patrí dehydratácia, už existujúce poškodenie funkcie obličiek, viaceré liečebné cykly kyseliny zoledrónovej a iných bisfosfonátov, ako aj použitie iných nefrotoxických liekov. Hoci sa podaním kyseliny zoledrónovej v dávke 4 mg počas 15 minút toto riziko zníži, zhoršenie funkcie obličiek sa napriek tomu môže vyskytnúť. Zhoršenie funkcie obličiek, progresia do zlyhania obličiek a dialýzy boli hlásené u pacientov po začiatočnej dávke alebo jednorazovej dávke 4 mg kyseliny zoledrónovej. K zvýšeniu kreatinínu v sére dochádza aj u
niektorých pacientov pri chronickom podávaní kyseliny zoledrónovej v odporúčaných dávkach na prevenciu príhod súvisiacich so skeletom, aj keď zriedkavejšie.
Hladiny kreatinínu v sére pacientov sa majú stanoviť pred každou dávkou kyseliny zoledrónovej. Pri začatí liečby pacientov s metastázami v kostiach s miernym až stredne závažným poškodením funkcie obličiek sa odporúčajú nižšie dávky kyseliny zoledrónovej. Pacientom, u ktorých sa dokáže zhoršenie funkcie obličiek počas liečby, sa kyseliny zoledrónová nemá podať. Kyseliny zoledrónová sa má znovu podať len vtedy, keď sa ich kreatinín v sére vráti do rozmedzia 10 % nad východiskovou hodnotou. Liečba kyselinou zoledrónovou sa má znovu začať s rovnakou dávkou, aká sa podávala pred prerušením liečby.
Vzhľadom na prípadný účinok kyseliny zoledrónovej na funkciu obličiek, nedostatok klinických údajov o bezpečnosti u pacientov so závažným poškodením funkcie obličiek na začiatku liečby (v klinických skúšaniach definované ako kreatinín v sére ≥ 400 µmol/l alebo ≥ 4,5 mg/dl u pacientov s TIH a ≥ 265 µmol/l alebo ≥ 3,0 mg/dl u pacientov s rakovinou a metastázami v kostiach) a len obmedzené farmakokinetické údaje u pacientov so závažným poškodením funkcie obličiek na začiatku
liečby (klírens kreatinínu ˂ 30 ml/min), použitie kyseliny zoledrónovej u pacientov so závažným
poškodením funkcie obličiek sa neodporúča.
Insuficiencia pečene
Pretože sú dostupné len obmedzené klinické údaje o pacientoch so závažnou insuficienciou pečene,
nemožno dať žiadne osobitné odporúčania pre túto skupinu pacientov.
Osteonekróza čeľuste
Osteonekróza čeľuste (ONJ) sa zaznamenala u pacientov, prevažne u tých s rakovinou, ktorí dostávali
lieky inhibujúce resorpciu kosti, ako je kyselina zoledrónová. Mnohí z týchto pacientov dostávali aj
chemoterapiu a kortikosteroidy. Väčšina hlásených prípadov súvisela s dentálnymi zákrokmi, ako je extrakcia zuba. Mnohí mali príznaky lokálnej infekcie vrátane osteomyelitídy.
Nasledujúce rizikové faktory sa majú zvážiť pri vyhodnocovaní rizika vývinu ONJ u jednotlivých
pacientov:
- Účinok bisfosfonátov (vyššie riziko pri vysoko účinných zlúčeninách), cesta podania (vyššie
riziko pri parenterálnom podaní) a kumulatívna dávka
- Rakovina, chemoterapia, rádioterapia, kortikosteroidy, fajčenie
- Porucha zubov v minulosti, nedostatočná hygiena ústnej dutiny, periodontálna porucha, invazívne dentálne zákroky a zle prispôsobené protézy
Prehliadka chrupu s náležitými preventívnymi dentálnymi zákrokmi sa má uvážiť pred liečbou
bisfosfonátmi u pacientov so sprievodnými rizikovými faktormi.
Ak je to možné, títo pacienti sa majú počas liečby vyvarovať invazívnych dentálnych zákrokov. Dentálny chirurgický zákrok môže zhoršiť stav pacientov, u ktorých počas liečby vznikne osteonekróza čeľuste. Nie sú dostupné údaje, ktoré by ukázali, či prerušenie liečby bisfosfonátom
znižuje riziko osteonekrózy čeľuste u pacientov, ktorí potrebujú dentálne zákroky. Klinický úsudok ošetrujúceho lekára založený na vyhodnotení individuálneho pomeru prínosu a rizika má byť určujúci pri plánovaní liečby každého pacienta.
Bolesť svalovakostí
Po uvedení na trh bola hlásená silná bolesť kostí, kĺbov a/alebo svalov, príležitostne znemožňujúca
pohyblivosť u pacientov používajúcich kyselinu zoledrónovú. Takéto hlásenia však neboli časté. Čas
do nástupu symptómov sa rôznil od jedného dňa do niekoľkých mesiacov od začatia liečby. U väčšiny pacientov sa symptómy zmiernili po skončení liečby. Podsúbor pacientov mal recidívu symptómov, keď sa im znovu podala kyselina zoledrónová alebo iný bisfosfonát.
Atypické zlomeniny stehennej kosti
Pri liečbe bisfosfonátmi boli hlásené atypické subtrochanterické a diafyzárne zlomeniny stehennej
kosti, predovšetkým u pacientov, ktorí sa dlhodobo liečili na osteoporózu. Tieto priečne alebo krátke šikmé zlomeniny môžu vzniknúť kdekoľvek pozdĺž stehennej kosti, tesne pod malým trochanterom až po suprakondylickú časť. K týmto zlomeninám dochádza po minimálnej alebo žiadnej traume a u niektorých pacientov sa niekoľko týždňov až mesiacov pred vznikom úplnej zlomeniny stehennej kosti vyskytne bolesť v stehne alebo slabine, pri zobrazovacom vyšetrení často spojená s charakteristikami únavovej zlomeniny. Zlomeniny sú často bilaterálne, preto sa má u pacientov liečených bisfosfonátmi, ktorí utrpeli zlomeninu stehennej kosti, vyšetriť aj kontralaterálna stehenná kosť. Hlásené bolo tiež nedostatočné hojenie týchto zlomenín. U pacientov s podozrením na atypickú zlomeninu stehennej kosti sa má na základe individuálneho zhodnotenia prínosu a rizika pre pacienta zvážiť prerušenie liečby bisfosfonátmi.
Počas liečby bisfosfonátmi treba pacientov poučiť, aby hlásili akúkoľvek bolesť v stehne, bedre alebo slabine a každého pacienta s takýmito príznakmi je potrebné vyšetriť na prítomnosť neúplnej zlomeniny stehennej kosti.
Tento liek obsahuje menej ako 16 mmol sodíka (alebo 360 mg) na dávku. Je to potrebné vziať do
úvahy u pacientov s kontrolovaným príjmom sodíka.
4.5 Liekové a iné interakcie
V klinických skúšaniach sa kyselina zoledrónová podávala súčasne s bežne používanými protinádorovými liekmi, diuretikami, antibiotikami a analgetikami bez toho, aby sa vyskytli klinicky zjavné interakcie. Kyselina zoledrónová sa in vitro neviaže vo významnej miere na bielkoviny plazmy a neinhibuje ľudské enzýmy P450 (pozri časť 5.2), neuskutočnili sa žiadne formálne klinické interakčné štúdie.
Opatrnosť sa odporúča pri súčasnom podávaní bisfosfonátov s aminoglykozidmi, pretože obidve skupiny liečiv môžu mať aditívny účinok, čo má za následok nižšiu hladinu vápnika v sére na dlhšiu dobu, ako sa požaduje.
Pri použití kyseliny zoledrónovej súčasne s inými potenciálne nefrotoxickými liekmi je nutná opatrnosť. Počas liečby sa musí venovať pozornosť aj možnému vzniku hypomagneziémie.
U pacientov s mnohopočetným myelómom sa môže zvýšiť riziko poruchy funkcie obličiek pri
intravenóznom podaní kyseliny zoledrónovej v kombinácii s talidomidom.
Hlásenia o ONJ pochádzali od pacientov, ktorí dostávali kyselinu zoledrónovú a súbežne lieky s
antiangiogénnym účinkom.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití kyseliny zoledrónovej u gravidných žien. Štúdie reprodukčnej toxicity kyseliny zoledrónovej na zvieratách preukázali reprodukčnú toxicitu (pozri časť
5.3). Nie je známe potenciálne riziko u ľudí. Kyselina zoledrónová sa nemá používať počas gravidity.
LaktáciaNie je známe, či sa kyselina zoledrónová vylučuje do ľudského mlieka. Kyselina zoledrónová je
kontraindikovaná u dojčiacich žien (pozri časť 4.3).
FertilitaMožné nežiaduce účinky kyseliny zoledrónovej na fertilitu generácie rodičov a F1 sa vyhodnotili u potkanov. Výsledkom boli vystupňované farmakologické účinky, pri ktorých sa predpokladá súvislosť
s inhibíciou metabolizácie kostrového vápnika vyvolanou touto látkou, ktorá spôsobila hypokalciémiu
v období pôrodu, čo je skupinový účinok bisfosfonátov, dystokiu a predčasné ukončenie štúdie. Tieto výsledky tak znemožnili stanovenie definitívneho účinku kyseliny zoledrónovej na fertilitu ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNežiaduce reakcie, ako sú závraty a somnolencia, môžu mať vplyv na schopnosť viesť vozidlá a obsluhovať stroje, preto je potrebná opatrnosť, keď sa kyselina zoledrónová použije v čase vedenia vozidla a obsluhy strojov.
4.8 Nežiaduce účinkySúhrn profilubezpečnostiDo troch dní od podania kyseliny zoledrónovej bola často hlásená reakcia akútnej fázy so
symptómami, ktoré zahŕňali bolesť kostí, horúčku, únavu, bolesť kĺbov, bolesť svalov a zimnicu; tieto symptómy obvykle ustúpia počas niekoľkých dní (pozri opis vybraných nežiaducich reakcií).
Významné identifikované riziká pri kyseline zoledrónovej v schválených indikáciách sú nasledovné: Poškodenie funkcie obličiek, osteonekróza čeľuste, reakcia akútnej fázy, hypokalciémia, nežiaduce udalosti súvisiace s očami, fibrilácia predsiení, anafylaxia. Frekvencia každého z týchto identifikovaných rizík je uvedená v Tabuľke 2.
Zoznam nežiaducich reakcií v tabuľkeNasledujúce nežiaduce reakcie uvedené v Tabuľke 2 sa súhrnne zaznamenali po prevažne chronickej
liečbe 4 mg kyseliny zoledrónovej v klinických skúšaniach a v hláseniach po uvedení lieku na trh:
Tabuľka 2Nežiaduce reakcie sú zoradené podľa frekvencie, najčastejšie ako prvé, pričom frekvencia je určená nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
Poruchy krvi a lymfatického systému
|
| Časté:
| Anémia
|
| Menej časté:
| Trombocytopénia, leukopénia
|
| Zriedkavé:
| Pancytopénia
|
Poruchy imunitného systému
|
| Menej časté:
| Reakcie z precitlivenosti
|
|
Zriedkavé:
|
Angioneurotický edém
|
Psychické poruchy
|
|
Menej časté:
|
Úzkosť, poruchy spánku
|
|
Zriedkavé:
|
Zmätenosť
|
Poruchy nervového systému
|
|
Časté:
|
Bolesť hlavy
|
|
Menej časté:
|
Závraty, parestézia, poruchy chuti, hypestézia, hyperstézia, tremor, somnolencia
|
Poruchy oka
|
|
Časté:
|
Konjunktivitída
|
|
Menej časté:
|
Neostré videnie, skleritída a zápal orbity
|
|
Veľmi
zriedkavé:
|
Uveitída, episkleritída
|
Poruchy srdca a srdcovej činnosti
|
|
Menej časté:
|
Hypertenzia, hypotenzia, fibrilácia predsiení, hypotenzia spôsobujúca synkopu alebo obehový kolaps
|
|
Zriedkavé:
|
Bradykardia
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
|
Menej časté:
|
Dyspnoea, kašeľ, bronchokonstrikcia
|
|
Zriedkavé:
|
Intersticiálna choroba pľúc
|
Poruchy gastrointestinálneho traktu
|
|
Časté:
|
Nauzea, vracanie, anorexia
|
|
Menej časté:
|
Hnačka, zápcha, bolesť brucha, dyspepsia, stomatitída, suchosť v ústach
|
Poruchy kože a podkožného tkanica
|
|
Menej časté:
|
Pruritus, vyrážka (vrátane erytematóznej a makulárnej vyrážky), zvýšené potenie
|
Poruchy kostrovej a svalovej sústavy a spojivového tkanica
|
|
Časté:
|
Bolesť kostí, myalgia, artralgia, generalizovaná bolesť
|
|
Menej časté:
|
Svalové kŕče, osteonekróza čeľuste
|
Poruchy obličiek a močových ciest
|
|
Časté:
|
Zhoršenie funkcie obličiek
|
|
Menej časté:
|
Akútne zlyhanie obličiek, hematúria, proteinúria
|
C
elkové poruchy a reakcie v mieste podania
|
|
Časté:
|
Horúčka, syndróm podobný chrípke (vrátane únavy, zimnice, celkového pocitu nevoľnosti a návalov tepla)
|
|
Menej časté:
|
Asténia, periférny edém, reakcie v mieste podania injekcie (vrátane bolesti, podráždenia, opuchu a indurácie), bolesť na hrudi, zvýšenie hmotnosti, anafylaktická reakcia/šok, urtikária
|
Laboratórne a funkčné vyšetrenia
|
|
Veľmi časté:
|
Hypofosfatémia
|
|
Časté:
|
Zvýšenie kreatinínu a močoviny v krvi, hypokalciémia
|
|
Menej časté:
|
Hypomagneziémia, hypokaliémia
|
|
Zriedkavé:
|
Hyperkaliémia, hypernatriémia
|
O
pis vybraných nežiaducich reakcií
Poškodenie
f
unkcie
obličiek
Kyselina zoledrónová sa dávala do súvislosti s hláseniami o dysfunkcii obličiek. V súhrnnej analýze
údajov o bezpečnosti z registračných klinických skúšaní kyseliny zoledrónovej na prevenciu príhod súvisiacich so skeletom u pacientov s pokročilými malignitami s postihnutím kostí bola nasledovná
frekvencia porúch funkcie obličiek ako nežiaducich udalostí, pri ktorých bolo podozrenie na súvislosť
s kyselinou zoledrónovou (nežiaduce reakcie): mnohopočetný myelóm (3,2 %), karcinóm prostaty
(3,1 %), karcinóm prsníka (4,3 %), nádory pľúc a iné solídne nádory (3,2 %). Medzi faktory, ktoré môžu zvýšiť možnosť zhoršenia funkcie obličiek, patrí dehydratácia, už prítomné poškodenie funkcie obličiek, viaceré cykly podávania kyseliny zoledrónovej alebo iných bisfosfonátov, ako aj súbežné použitie nefrotoxických liekov alebo podanie infúzie za kratší čas, než sa v súčasnosti odporúča. Zhoršenie funkcie obličiek progredujúce do zlyhania obličiek a dialýzy sa zaznamenalo u pacientov po úvodnej dávke alebo po jedinej dávke 4 mg kyseliny zoledrónovej (pozri časť 4.4).
Osteonekróza čeľustePrevažne u pacientov s rakovinou liečených liekmi inhibujúcimi resorpciu kosti, ako je kyselina
zoledrónová, sa zaznamenali prípady osteonekrózy (primárne čeľuste). Mnohí z týchto pacientov mali príznaky lokálnej infekcie vrátane osteomyelitídy a väčšina hlásení sa týka pacientov s rakovinou po extrakcii zubov alebo iných dentálnych chirurgických zákrokoch. Osteonekróza čeľuste má viaceré zdokumentované rizikové faktory vrátane diagnózy rakoviny, súčasne podanej liečby (napr. chemoterapie, rádioterapie, kortikosteroidov) a sprievodných ochorení (napr. anémie, koagulopatií, infekcie, ochorenia ústnej dutiny). Hoci sa nestanovila príčinná súvislosť, odporúča sa vyvarovať sa dentálnych chirurgických zákrokov, pretože sa môže predĺžiť obdobie zotavenia (pozri časť 4.4).
Fibrilácia predsieníV jednom randomizovanom, dvojito zaslepenom, kontrolovanom klinickom skúšaní trvajúcom 3 roky,
v ktorom sa vyhodnotila účinnosť a bezpečnosť 5 mg kyseliny zoledrónovej podávanej raz ročne oproti placebu v liečbe postmenopauzálnej osteoporózy (PMO), bola celková incidencia fibrilácie
predsiení 2,5 % (96 z 3 862) u pacientok, ktoré dostávali 5 mg kyseliny zoledrónovej a 1,9 % (75
z 3 852) u pacientok, ktoré dostávali placebo. Výskyt fibrilácie predsiení ako závažnej nežiaducej udalosti bol 1,3 % (51 z 3 862) u pacientok, ktoré dostávali 5 mg kyseliny zoledrónovej a 0,6 % (22
z 3 852) u pacientok, ktoré dostávali placebo. Nerovnováha pozorovaná v tomto klinickom skúšaní sa
nepozorovala v iných skúšaniach s kyselinou zoledrónovou, vrátane skúšania kyseliny zoledrónovej
4 mg každé 3 – 4 týždne u onkologických pacientov. Mechanizmus, ktorý spôsobil zvýšenú incidenciu fibrilácie predsiení v tomto jedinom klinickom skúšaní, nie je známy.
Reakcia akútnej fázyTúto nežiaducu reakciu na liek tvorí zoskupenie symptómov, ku ktorým patrí horúčka, bolesť svalov,
bolesť hlavy, bolesť končatín, nauzea, vracanie, hnačka a bolesť kĺbov. Čas ich nástupu je ≤ 3 dni po infúzii kyseliny zoledrónovej a táto reakcia sa tiež označuje ako symptómy „podobné chrípke“ alebo
„po podaní“.
Atypické zlomeniny stehennej kosti
Po uvedení lieku na trh boli hlásené nasledovné reakcie (frekvencia zriedkavé):
Atypické subtrochanterické a diafyzárne zlomeniny stehennej kosti (skupinová nežiaduca reakcia na bisfosfonáty).
4.9 Predávkovanie
Klinické skúsenosti s akútnym predávkovaním kyseliny zoledrónovej sú obmedzené. Zaznamenali sa aj omylom podané dávky až do 48 mg kyseliny zoledrónovej. Pacientov, ktorí dostali vyššie ako odporúčané dávky (pozri časť 4.2), je potrebné starostlivo sledovať, pretože sa pozorovalo poškodenie funkcie obličiek (vrátane zlyhania obličiek) a poruchy sérových elektrolytov (vrátane vápnika, fosforu a horčíka). Ak vznikne hypokalciémia, majú sa podať infúzie glukonanu vápenatého, ak je to klinicky indikované.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Liečivá na liečbu chorôb kostí, bisfosfonáty, ATC kód: M05BA08
Kyselina zoledrónová patrí do skupiny bisfosfonátov a pôsobí primárne na kosti. Je to inhibítor resorpcie kostí, spôsobenej osteoklastami.
Selektívny účinok bisfosfonátov na kosti podmieňuje ich vysoká afinita k mineralizovanej kosti, ale presný mechanizmus na úrovni molekúl, ktorý vedie k inhibícii aktivity osteoklastov, zatiaľ nie je jasný. V dlhodobých štúdiách na zvieratách kyselina zoledrónová tlmí resorpciu kosti bez nepriaznivého ovplyvnenia tvorby, mineralizácie alebo mechanických vlastností kosti.
Kyselina zoledrónová je nielen účinným inhibítorom resorpcie kostí, ale má aj viaceré protinádorové vlastnosti, ktoré by mohli prispievať k jej celkovej účinnosti pri liečbe metastatického ochorenia kostí. V predklinických skúšaniach sa ukázali nasledujúce vlastnosti:
- In vivo: inhibícia resorpcie kostí osteoklastami, ktorá mení mikroprostredie kostnej drene a robí ho
menej priaznivým pre rast nádorových buniek, antiangiogenetický účinok a analgetický účinok.
- In vitro: inhibícia proliferácie osteoblastov, priamy cytostatický a proapoptotický účinok na nádorové bunky, synergický cytostatický účinok s inými protinádorovými liečivami, antiadhezívny a antiinvazívny účinok.
Výsledky klinických skúšaní pri prevencii príhod súvisiacich so skeletom u pacientov s postihnutím
kostí pri pokročilých malignitách
Prvá randomizovaná, dvojito zaslepená štúdia kontrolovaná placebom porovnávala 4 mg kyseliny
zoledrónovej s placebom pri prevencii príhod súvisiacich so skeletom (SRE) u pacientov s rakovinou prostaty. Kyselina zoledrónová v dávke 4 mg významne znížila podiel pacientov, u ktorých sa
vyskytla aspoň jedna SRE, predĺžila medián času do prvej SRE o > 5 mesiacov a znížila výskyt príhod
pripadajúcich na pacienta za rok - mieru morbidity skeletu. Analýza viacpočetných príhod ukázala zníženie rizika vzniku SRE v skupine 4 mg kyseliny zoledrónovej o 36 % v porovnaní s placebom. Pacienti, ktorí dostávali 4 mg kyseliny zoledrónovej, hlásili menšie stupňovanie bolesti ako pacienti, ktorí dostávali placebo, pričom rozdiel dosiahol štatistickú významnosť v 3., 9., 21., a 24. mesiaci. Menej pacientov liečených 4 mg kyseliny zoledrónovej utrpelo patologické zlomeniny. Účinky liečby boli menej výrazné u pacientov s blastickými léziami. Výsledky účinnosti sú uvedené v Tabuľke 3.
V druhej štúdii, do ktorej boli zahrnuté solídne nádory okrem rakoviny prsníka alebo prostaty, kyselina zoledrónová v dávke 4 mg významne znížila podiel pacientov s SRE, predĺžila medián času do prvej SRE o > 2 mesiace a znížila mieru morbidity skeletu. Analýza viacpočetných príhod ukázala
zníženie rizika vzniku SRE v skupine 4 mg kyseliny zoledrónovej o 30,7 % v porovnaní s placebom.
Výsledky účinnosti sú uvedené v Tabuľke 4.
Tabuľka 3: Výsledky účinnosti (pacienti s karcinómom prostaty liečení hormónmi)
|
| AkákoľvekSRE (+TIH)
| Zlomeniny*
| Rádioterapia kostí
|
| Kyselina zoledrónová
4 mg
| Placebo
| Kyselina zoledrónová
4 mg
| Placebo
| Kyselina zoledrónová
4 mg
| Placebo
|
N
| 214
| 208
| 214
| 208
| 214
| 208
|
Podiel pacientov s SRE (%)
| 38
| 49
| 17
| 25
| 26
| 33
|
Hodnota p
| 0,028
| 0,052
| 0,119
|
Medián času
do SRE (dni)
| 488
| 321
| NR
| NR
| NR
| 640
|
Hodnota p
| 0,009
| 0,020
| 0,055
|
Miera morbidity skeletu
| 0,77
| 1,47
| 0,20
| 0,45
| 0,42
| 0,89
|
Hodnota p
| 0,005
| 0,023
| 0,060
|
Zníženie
rizika utrpenia viacpočetných príhod** (%)
| 36
| -
| NA
| NA
| NA
| NA
|
Hodnota p
| 0,002
| NA
| NA
|
* Zahŕňa zlomeniny stavcov a iné zlomeniny
** Zohľadňuje všetky príhody súvisiace so skeletom, celkový počet ako aj čas do každej príhody počas klinického skúšania
NR Nedosiahnuté
NA Neaplikovateľné
Tabuľka 4: Výsledky účinnosti (solídne tumory okrem karcinómu prsníka alebo prostaty)
|
| AkákoľvekSRE (+TIH)
| Zlomeniny*
| Rádioterapia kostí
|
| Kyseliny zoledrónová
4 mg
| Placebo
| Kyseliny zoledrónová
4 mg
| Placebo
| Kyselina zoledrónová
4 mg
| Placebo
|
N
| 257
| 250
| 257
| 250
| 257
| 250
|
Podiel pacientov s SRE (%)
| 39
| 48
| 16
| 22
| 29
| 34
|
Hodnota p
| 0,039
| 0,064
| 0,173
|
Medián času
do SRE (dni)
| 236
| 155
| NR
| NR
| 424
| 307
|
Hodnota p
| 0,009
| 0,020
| 0,079
|
Miera morbidity skeletu
|
1,74
|
2,71
|
0,39
|
0,63
|
1,24
|
1,89
|
Hodnota p
|
0,012
|
0,066
|
0,099
|
Zníženie
rizika utrpenia
viacpočetných
príhod** (%)
|
30,7
|
-
|
NA
|
NA
|
NA
|
NA
|
Hodnota p
|
0,003
|
NA
|
NA
|
* Zahŕňa zlomeniny stavcov a iné zlomeniny
** Zohľadňuje všetky príhody súvisiace so skeletom, celkový počet ako aj čas do každej príhody počas klinického skúšania
NR Nedosiahnuté
NA Neaplikovateľné
V treťom randomizovanom, dvojito zaslepenom klinickom skúšaní fázy III sa porovnávala kyselina zoledrónová 4 mg a pamidronát 90 mg každé 3 až 4 týždne u pacientov s mnohopočetným myelómom alebo rakovinou prsníka a aspoň jednou léziou kosti. Výsledky ukázali, že kyselina zoledrónová v dávke 4 mg vykazuje porovnateľnú účinnosť s 90 mg pamidronátu pri prevencii SRE. Analýza viacpočetných príhod ukázala významné zníženie rizika vzniku SRE o 16 % u pacientov liečených
4 mg kyseliny zoledrónovej v porovnaní s pacientmi, ktorí dostávali pamidronát. Výsledky účinnosti sú uvedené v Tabuľke 5.
Tabuľka 5: Výsledky účinnosti (pacienti s mnohopočetným myelómom a karcinómom prsníka)
|
| AkákoľvekSRE (+TIH)
| Zlomeniny*
| Rádioterapia kostí
|
| Kyselina zoledrónová
4 mg
| Pam 90 mg
| Kyselina zoledrónová
4 mg
| Pam 90 mg
| Kyselina zoledrónová
4 mg
| Pam 90 mg
|
N
| 561
| 555
| 561
| 555
| 561
| 555
|
Podiel pacientov s SRE (%)
| 48
| 52
| 37
| 39
| 19
| 24
|
Hodnota p
| 0,198
| 0,653
| 0,037
|
Medián času
do SRE (dni)
| 376
| 356
| NR
| 714
| NR
| NR
|
Hodnota p
| 0,151
| 0,672
| 0,026
|
Miera morbidity skeletu
| 1,04
| 1,39
| 0,53
| 0,60
| 0,47
| 0,71
|
Hodnota p
| 0,084
| 0,614
| 0,015
|
Zníženie
rizika utrpenia
viacpočetných
príhod** (%)
| 16
| -
| NA
| NA
| NA
| NA
|
Hodnota p
| 0,030
| NA
| NA
|
* Zahŕňa zlomeniny stavcov a iné zlomeniny
** Zohľadňuje všetky príhody súvisiace so skeletom, celkový počet ako aj čas do každej príhody
počas klinického skúšania
NR Nedosiahnuté
NA Neaplikovateľné
Kyselina zoledrónová v dávke 4 mg sa skúmala aj v dvojito zaslepenom, randomizovanom klinickom skúšaní kontrolovanom placebom u 228 pacientok s preukázanými metastázami do kostí pri karcinóme prsníka, v ktorom sa vyhodnotil účinok 4 mg kyseliny zoledrónovej na pomer výskytu príhod súvisiacich so skeletom (SRE), vypočítaný ako celkový počet SRE príhod (okrem hyperkalciémie a po úprave vzhľadom na predchádzajúcu zlomeninu), delený obdobím celkového rizika. Pacientky dostávali buď 4 mg kyseliny zoledrónovej, alebo placebo každé štyri týždne počas jedného roka. Pacientky boli rovnomerne rozdelené do skupín liečby kyselinou zoledrónovou a placebom.
Výskyt SRE (príhody/osoba za rok) bol 0,628 pri kyseline zoledrónovej a 1,096 pri placebe. Podiel pacientok s aspoň jednou SRE (okrem hyperkalciémie) bol 29,8 % v skupine liečenej kyselinou zoledrónovou oproti 49,6 % v skupine placeba (p = 0,003). Medián času do vzniku prvej SRE sa v skupine liečby kyselinou zoledrónovou na konci klinického skúšania nedosiahol a v porovnaní s placebom bol významne dlhší (p = 0,007). V porovnaní s placebom kyselina zoledrónová v dávke
4 mg znížila riziko SRE o 41 % v analýze viacpočetných príhod (pomer rizika = 0,59, p = 0,019).
V skupine liečenej kyselinou zoledrónovou sa v porovnaní s placebom pozorovalo štatisticky významné zlepšenie pri hodnotení bolesti (pri použití Brief Pain Inventory, BPI) po 4 týždňoch a v každom neskoršom čase počas klinického skúšania (Obrázok 1). Hodnotenie bolesti pri kyseline zoledrónovej bolo trvale pod východiskovou hodnotou a zmiernenie bolesti sprevádzala tendencia k poklesu analgetického skóre.
Obrázok 1:Priemerné zmeny skóre podľa BPI oproti východiskovej hodnote. Vyznačené sú štatisticky významné rozdiely (*p < 0,05) pri porovnaní spôsobov liečby (4 mg kyseliny zoledrónovej oproti placebu)Placebo

Kyselina zoledrónová
 Trvanie štúdie (týždne)
Trvanie štúdie (týždne)
V
ý
sledky klinických skúšanípriliečbeTIHKlinické skúšania pri hyperkalciémii vyvolanej nádorom (TIH) ukázali, že pre účinok kyseliny
zoledrónovej je charakteristický pokles vápnika v sére a vylučovania vápnika močom. Vo fáze I sa v klinických skúšaniach na zistenie dávky u pacientov s miernou až stredne závažnou hyperkalciémiou vyvolanou nádorom (TIH) skúšali účinné dávky v rozmedzí približne 1,2 – 2,5 mg.
Na stanovenie účinkov 4 mg kyseliny zoledrónovej v porovnaní s 90 mg pamidronátu sa vo vopred plánovej analýze zlúčili výsledky dvoch pilotných multicentrických skúšaní s pacientmi s TIH. Normalizácia korigovaného vápnika v sére bola rýchlejšia na 4. deň pri 8 mg kyseliny zoledrónovej a na 7. deň pri 4 mg a 8 mg kyseliny zoledrónovej. Pozorovala sa nasledujúca odpoveď na liečbu.
Tabuľka 6: Podiel pacientov s úplnou odpoveďou na liečbu podľa dní v zlúčených klinických
štúdiách TIH
|
| 4. deň
| 7. deň
| 10. deň
|
Kyselina zoledrónová
4 mg (N = 86)
| 45,3 % (p = 0,.104)
| 82,6 % (p = 0,005)*
| 88,4 % (p = 0.002)*
|
Kyselina zoledrónová
8 mg (N = 90)
| 55,6 % (p = 0,021)*
| 83,3 % (p = 0,010)*
| 86,7 % (p = 0,015)*
|
Pamidronát 90 mg
(N = 99)
| 33,3 %
| 63,6 %
| 69,7 %
|
* Hodnoty p v porovnaní s pamidronátom.
|
Medián času do dosiahnutia normokalciémie bol 4 dni. Medián času do relapsu (opätovné stúpnutie
sérového vápnika korigovaného podľa albumínu na ≥ 2,9 mmol/l) bol 30 až 40 dní u pacientov liečených kyselinou zoledrónovou oproti 17 dňom u pacientov liečených 90 mg pamidronátu (hodnoty p: 0,001 pre 4 mg a 0,007 pre 8 mg kyseliny zoledrónovej). Medzi oboma dávkami kyseliny zoledrónovej neboli štatisticky významné rozdiely.
V klinických skúšaniach bolo 69 pacientov s relapsom alebo bez odpovede na začiatočnú liečbu (kyselina zoledrónová 4 mg, 8 mg alebo pamidronát 90 mg) opäť liečených 8 mg kyseliny zoledrónovej. Podiel takýchto pacientov, u ktorých sa dosiahla odpoveď, bol asi 52 %. Pretože títo pacienti boli liečení len dávkou 8 mg, nie sú údaje, ktoré by umožnili porovnanie s dávkou 4 mg kyseliny zoledrónovej.
V klinických skúšaniach s pacientmi s hyperkalciémiou vyvolanou nádorom (TIH) bol celkový profil bezpečnosti u všetkých troch skupín liečby (kyselina zoledrónová 4 mg a 8 mg a pamidronát 90 mg) podobný čo do typu a závažnosti.
Deti a dospievajúciVýsledkyklinickýchskúšanívliečbezávažnejosteogenesisimperfectaudetí a dospievajúcich vo vekuod 1 do 17 rokovÚčinky intravenózne podávanej kyseliny zoledrónovej v liečbe detí a dospievajúcich (vo veku od 1 do
17 rokov) so závažnou osteogenesis imperfecta (typy I, III a IV) sa porovnali s intravenózne podávaným pamidronátom v jednej medzinárodnej, multicentrickej, randomizovanej, otvorenej štúdii
so 74 a 76 pacientmi v uvedených skupinách liečby. Liečba v štúdii trvala 12 mesiacov a predchádzalo
jej 4- až 9-týždňové obdobie skríningu, v ktorom sa počas najmenej 2 týždňov užívali doplnky vitamínu D a elementárneho vápnika. V klinickom programe pacienti vo veku od 1 do < 3 roky dostávali 0,025 mg/kg kyseliny zoledrónovej (až do najvyššej jednorazovej dávky 0,35 mg) každé 3 mesiace a pacienti vo veku od 3 do 17 rokov dostávali 0,05 mg/kg kyseliny zoledrónovej (až do najvyššej jednorazovej dávky 0,83 mg) každé 3 mesiace. Štúdia s extenziou sa vykonala na
preskúmanie dlhodobej celkovej bezpečnosti a bezpečnosti pre obličky pri podávaní kyseliny zoledrónovej raz za rok alebo dvakrát za rok počas 12 mesiacov liečby v extenzii u detí, ktoré v základnej štúdii ukončili jeden rok liečby buď kyselinou zoledrónovou, alebo pamidronátom.
Primárnym koncovým ukazovateľom v tejto štúdii bola percentuálna zmena minerálnej denzity kostí (BMD) v lumbálnej chrbtici po 12 mesiacoch liečby oproti východiskovým hodnotám. Odhadované účinky liečby na BMD boli podobné, ale usporiadanie klinického skúšania nepostačovalo na preukázanie noninferiority účinnosti kyseliny zoledrónovej. Najmä účinnosť na incidenciu zlomenín alebo bolesť sa jednoznačne nepreukázala. Zlomeniny dlhých kostí dolných končatín boli hlásené ako nežiaduce udalosti u približne 24 % (femur) a 14 % (tíbia) pacientov so závažnou osteogenesis imperfecta liečených kyselinou zoledrónovou oproti 12 % a 5 % pacientov liečených pamidronátom, bez ohľadu na typ ochorenia a kauzalitu, ale celková incidencia zlomenín bola porovnateľná u pacientov liečených kyselinou zoledrónovou a pamidronátom: 43 % (32/74) oproti 41 % (31/76). Interpretáciu rizika zlomenín komplikuje skutočnosť, že zlomeniny sú ako súčasť priebehu ochorenia častou udalosťou u pacientov so závažnou osteogenesis imperfecta.
Typ nežiaducich reakcií, ktoré sa pozorovali u tejto populácie, bol podobný, ako sa predtým zaznamenal u dospelých s pokročilými malignitami s postihnutím kosti (pozri časť 4.8). Nežiaduce reakcie usporiadané podľa frekvencie sú uvedené v Tabuľke 7. Použila sa nasledujúca obvyklá klasifikácia: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
Tabuľka 7: Nežiaduce reakcie pozorované u detí so závažnou osteogenesis imperfecta1
| Poruchy nervového systému
|
| Časté:
| Bolesť hlavy
| Poruchy srdca a srdcovej činnosti
|
| Časté:
| Tachykardia
| Poruchy dýchacej sústavy, hrudníka a mediastína
|
| Časté:
| Nazofaryngititída
| Poruchy gastrointestinálneho traktu
|
| Veľmi časté:
| Vracanie, nauzea
|
| Časté:
| Bolesť brucha
| Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
| Časté:
| Bolesť končatín, artralgia, muskuloskeletálna bolesť
| Celkové poruchy a reakcie v mieste podania
|
| Veľmi časté:
| Pyrexia, únava
|
| Časté:
| Reakcia akútnej fázy, bolesť
| Laboratórne a funkčné vyšetrenia
|
| Veľmi časté:
| Hypokalciémia
|
| Časté:
| Hypofosfatémia
|
|
|
1 Nežiaduce udalosti vyskytujúce sa s frekvenciou < 5 % boli medicínsky vyhodnotené a ukázalo sa,
že tieto prípady zodpovedajú overenému profilu bezpečnosti kyseliny zoledrónovej (pozri časť 4.8).
U detí a dospievajúcich so závažnou osteogenesis imperfecta sa zdá, že kyselina zoledrónová je v porovnaní s pamidronátom spojená s výraznejším rizikom reakcie akútnej fázy, hypokalciémie a nevysvetlenej tachykardie, ale tieto rozdiely sa znižovali pri následných infúziách.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií pre referenčný
liek obsahujúci kyselinu zoledrónovú s ohľadom na všetky vekové podskupiny detí a dospievajúcich v liečbe hyperkalciémie vyvolanej nádorom a v prevencii príhod súvisiacich so skeletom u pacientov s
postihnutím kostí pri pokročilých malignitách (pozri časť 4.2 pre informáciu o použití u detí a
dospievajúcich).
5.2 Farmakokinetické vlastnosti
Pri jednorazových a opakovaných infúziách trvajúcich 5 a 15 minút, ktorými sa podalo 2, 4, 8 a 16 mg kyseliny zoledrónovej 64 pacientom s metastázami v kostiach, sa zistili nasledujúce farmakokinetické údaje, ktoré nezáviseli od dávky.
Po začatí infúzie kyseliny zoledrónovej sa plazmatické koncentrácie kyseliny zoledrónovej rýchlo zvýšili a dosiahli maximum na konci podania infúzie, po ktorom nasledoval rýchly pokles na ˂ 10 % maxima po 4 hodinách a ˂ 1 % maxima po 24 hodinách, s následným dlhým obdobím veľmi nízkych koncentrácií nepresahujúcich 0,1 % maxima pred druhou infúziou kyseliny zoledrónovej na 28. deň.
Intravenózne podaná kyselina zoledrónová sa eliminuje trojfázovým procesom: rýchle dvojfázové vymiznutie zo systémového obehu s polčasmi t1/2α 0,24 a t1/2β 1,87 hodiny, po ktorých nasleduje dlhá eliminačná fáza s konečným polčasom eliminácie t1/2γ 146 hodín. Po opakovanom podávaní každých
28 dní nedošlo k akumulácii kyseliny zoledrónovej v plazme. Kyselina zoledrónová sa nemetabolizuje
a vylučuje sa nezmenená obličkami. Počas prvých 24 hodín sa v moči nájde 39 ± 16 % podanej dávky,
zatiaľ čo zvyšok sa v zásade viaže na tkanivo kostí. Z kostného tkaniva sa veľmi pomaly uvoľňuje späť do systémového obehu a vylučuje sa obličkami. Celkový telesný klírens je 5,04 ± 2,5 l/hod, a to nezávisle od dávky a bez ovplyvnenia pohlavím, vekom, rasou a telesnou hmotnosťou. Predĺženie infúzie z 5 na 15 minút znížilo koncentráciu kyseliny zoledrónovej na konci infúzie o 30 %, ale neovplyvnilo plochu pod krivkou koncentrácie oproti času.
Tak ako aj pri iných bisfosfonátoch, variabilita farmakokinetických parametrov kyseliny zoledrónovej medzi pacientmi bola vysoká.
Nie sú dostupné farmakokinetické údaje o kyseline zoledrónovej u pacientov s hyperkalciémiou alebo u pacientov s insuficienciou pečene. Kyselina zoledrónová neinhibuje ľudské enzýmy P450 in vitro, nevykazuje biotransformáciu a v štúdiách na zvieratách sa v stolici našli < 3 % podanej dávky, čo naznačuje, že funkcia pečene nezohráva významnú úlohu vo farmakokinetike kyseliny zoledrónovej.
Pri určení vzťahu medzi obličkovým klírensom kyseliny zoledrónovej a klírensom kreatinínu predstavoval obličkový klírens 75 ± 33 % klírensu kreatinínu, ktorého priemerná hodnota bola
84 ± 29 ml/min (rozmedzie 22 – 143 ml/min) u 64 sledovaných pacientov s karcinómami. Analýza v
tejto skupine ukázala, že u pacienta s klírensom kreatinínu 20 ml/min (závažné poškodenie funkcie obličiek) alebo 50 ml/min (stredne závažné poškodenie) bude zodpovedajúci predpokladaný klírens kyseliny zoledrónovej 37 % alebo 72 % hodnoty pacienta, ktorý má klírens kreatinínu 84 ml/min. Sú dostupné len obmedzené farmakokinetické údaje o pacientoch so závažnou insuficienciou obličiek
(klírens kreatinínu ˂ 30 ml/min).
Kyselina zoledrónová nemá afinitu ku krvinkám a jej väzba na bielkoviny plazmy je nízka (približne
56 %) a nezávisí od koncentrácie kyseliny zoledrónovej.
Osobitné skupiny populácie
Deti a dospievajúci
Obmedzené farmakokinetické údaje u detí so závažnou osteogenesis imperfecta naznačujú, že
farmakokinetika kyseliny zoledrónovej u detí vo veku 3 až 17 rokov je podobná ako u dospelých pri podobnej hladine dávok mg/kg. Vek, telesná hmotnosť, pohlavie a klírens kreatinínu zrejme nemajú žiadny vplyv na systémovú expozíciu kyseline zoledrónovej.
5.3 Predklinické údaje o bezpečnosti
A
k
útna toxicita
Najvyššia neletálna jednorazová intravenózna dávka bola 10 mg/kg telesnej hmotnosti u myší a
0,6 mg/kg u potkanov.
Subchronická a chronická toxicita
Kyselina zoledrónová sa dobre znášala, keď sa podávala subkutánne potkanom a intravenózne psom v
dávkach do 0,02 mg/kg denne počas 4 týždňov. Podávanie 0,001 mg/kg/deň subkutánne potkanom a
0,005 mg/kg intravenózne psom raz za 2 – 3 dni počas až 52 týždňov sa tiež dobre znášalo.
Najčastejším nálezom v štúdiách pri opakovanom podávaní bolo zväčšenie primárnej trabekulárnej časti kosti v metafýzach dlhých kostí u rastúcich zvierat pri takmer všetkých dávkach, čo bol nález v súlade s farmakologickou antiresorpčnou účinnosťou látky.
Bezpečné rozmedzie dávok vzhľadom na účinky na obličky bolo úzke v štúdiách pri dlhodobom opakovanom parenterálnom podávaní zvieratám, ale kumulatívne hladiny bez nežiaducich príhod v štúdiách pri jednorazovom podaní (1,6 mg/kg) a pri opakovanom podávaní až do jedného mesiaca (0,06 – 0,6 mg/kg/deň) nenaznačili účinky na obličky pri dávkach ekvivalentných alebo prevyšujúcich najvyššiu plánovanú terapeutickú dávku u ľudí. Dlhodobejšie opakované podávanie v dávkach, ktoré zahrnulo aj najvyššiu plánovanú terapeutickú dávku kyseliny zoledrónovej u ľudí, vyvolalo toxické účinky v iných orgánoch vrátane gastrointestinálneho traktu, pečene, sleziny a pľúc, ako aj v mieste podania intravenóznej injekcie.
Reprodukčná toxicita
Kyselina zoledrónová bola teratogénna u potkanov v subkutánnych dávkach ≥ 0,2 mg/kg. Hoci sa u
králikov nepozorovala žiadna teratogenita alebo fetotoxicita, zistila sa toxicita pre matky. Dystokia sa pozorovala pri najnižšej skúšanej dávke u potkanov (0,01 mg/kg telesnej hmotnosti).
Mutagenicita a karcinogénny potenciál
Kyselina zoledrónová nebola mutagénna vo vykonaných testoch mutagenity a testy na karcinogenitu
neposkytli žiadne dôkazy o karcinogénnom potenciále.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol Citrát sodný Chlorid sodný Voda a injekciu
6.2 Inkompatibility
Tento liek nesmie prísť do styku s akýmikoľvek roztokmi obsahujúcimi vápnik a nesmie sa miešať alebo intravenózne podať s akýmkoľvek iným liekom tou istou infúznou súpravou.
6.3 Čas použiteľnosti
Neotvorený vak: 2 roky.
Po prvom otvorení: Z mikrobiologického hľadiska sa má liek použiť okamžite. Ak sa nepoužije okamžite, používateľ zodpovedá za čas a podmienky uchovávania pred použitím, čo normálne nemá byť dlhšie ako 24 hodín pri 2 °C – 8 °C. Schladený roztok má potom pred podaním dosiahnuť izbovú teplotu.
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
Podmienky na uchovávanie lieku po prvom otvorení, pozri časť 6.3.
6.5 Druh obalu a obsah baleniaPolypropylénové vaky s objemom 100 ml s polypropylénovým skrutkovacím portom s uzáverom s polyestér/polypropylénovým obalom
Veľkosť balenia
Zoledronic Acid Hospira sa dodáva v baleniach s 1 vakom.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomPočas prípravy infúzie sa musia dodržiavať aseptické postupy. Len na jednorazové použitie
Má sa použiť len číry, nesfarbený roztok bez cudzorodých častíc.
Zdravotníckym pracovníkom sa odporúča, aby nelikvidovali nepoužitú Zoledronic Acid Hospira
domovým odpadom.
Nepoužitý liek alebo odpad vzniknutý z lieku sa má vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIHospira UK Limited
Queensway
Royal Leamington Spa Warwickshire CV31 3RW Spojené kráľovstvo
8. REGISTRAČNÉ ČÍSLO9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10 DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu
1. NÁZOV LIEKU
Zoledronic Acid Hospira 5 mg/100 ml infúzny roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Jeden vak so 100 ml roztoku obsahuje 5 mg kyseliny zoledrónovej (vo forme monohydrátu). Jeden ml roztoku obsahuje 0,05 mg kyseliny zoledrónovej (vo forme monohydrátu).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Infúzny roztok
Číry a bezfarebný roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba osteoporózy
• u postmenopauzálnych žien
• u mužov
pri zvýšenom riziku zlomenín vrátane tých s nedávnou zlomeninou krčka stehnovej kosti následkom
minimálnej traumy.
Liečba osteoporózy spojenej s dlhodobou systémovou liečbou glukokortikoidmi
• u postmenopauzálnych žien
• u mužov
u ktorých je zvýšené riziko zlomenín.
Liečba Pagetovej choroby kostí u dospelých.
4.2 Dávkovania a spôsob podania
Dávkovanie
Odporúčaná dávka na liečbu postmenopauzálnej osteoporózy, osteoporózy u mužov a na liečbu
osteoporózy spojenej s dlhodobou systémovou liečbou glukokortikoidmi je jednorazová intravenózna
infúzia 5 mg kyseliny zoledrónovej podávaná raz ročne.'
Optimálna dĺžka liečby osteoporózy bisfosfonátmi sa nestanovila.
Potreba pokračovať v liečbe sa má u jednotlivých pacientov pravidelne prehodnocovať na základe
prínosov a možných rizík Zoledronic Acid Hospira, najmä po 5 alebo viacerých rokoch používania.
U pacientov s nedávnou zlomeninou krčka stehnovej kosti následkom minimálnej traumy sa odporúča podať infúziu kyseliny zoledrónovej dva alebo viac týždňov po ošetrení zlomeniny krčka stehnovej kosti (pozri časť 5.1).
Na liečbu Pagetovej choroby kyselinu zoledrónovú majú predpisovať len lekári, ktorí majú skúsenosti s liečbou Pagetovej choroby kostí. Odporúčaná dávka je jednorazová intravenózna infúzia 5 mg kyseliny zoledrónovej.
Opakovanie liečby Pagetovej choroby: Po úvodnej liečbe kyselinou zoledrónovou sa pri Pagetovej chorobe pozoruje u pacientov s odpoveďou na liečbu obdobie dlhšej remisie. Opakovanie liečby pozostáva z ďalšej intravenóznej infúzie 5 mg kyseliny zoledrónovej s intervalom jedného roka alebo dlhším po úvodnej liečbe u pacientov, u ktorých dôjde k relapsu. Dostupné sú obmedzené údaje o opakovaní liečby Pagetovej choroby kostí (pozri časť 5.1).
Pacienti musia byť dostatočne hydratovaní pred podaním kyseliny zoledrónovej. Toto je zvlášť dôležité u starších osôb a u pacientov, ktorí dostávajú diuretickú liečbu.
V súvislosti s podaním kyseliny zoledrónovej sa odporúča dostatočný príjem vápnika a vitamínu D. Okrem toho sa u pacientov s Pagetovou chorobou naliehavo odporúča zabezpečiť dostatočnú suplementáciu vápnika, zodpovedajúcu najmenej 500 mg elementárneho vápnika dvakrát denne, počas najmenej 10 dní po podaní kyseliny zoledrónovej (pozri časť 4.4).
U pacientov s nedávnou zlomeninou krčka stehnovej kosti následkom minimálnej traumy sa odporúča podať perorálne alebo intramuskulárne saturačnú dávku 50 000 až 125 000 IU vitamínu D pred prvou infúziou kyselinou zoledrónovou.
Výskyt symptómov po podaní dávky, ktoré sa vyskytujú počas prvých troch dní po podaní kyseliny zoledrónovej, možno znížiť podaním paracetamolu alebo ibuprofénu krátko po podaní kyseliny zoledrónovej.
Pacientispoškodenímfunkcieobličiek
Kyseliny zoledrónová je kontraindikovaná u pacientov s klírensom kreatinínu < 35 ml/min (pozri časti
4.3 a 4.4).
Úprava dávky nie je potrebná u pacientov s klírensom kreatinínu ≥ 35 ml/min.
Pacienti s poškodenímfunkciepečene
Úprava dávky sa nevyžaduje (pozri časť 5.2).
Starší pacienti (≥65 rokov)
Úprava dávky nie je potrebná, pretože biologická dostupnosť, distribúcia a eliminácia boli podobné u
starších pacientov a u mladších osôb.
Deti a dospievajúci
Bezpečnosť a účinnosť kyseliny zoledrónovej u detí a dospievajúcich vo veku menej ako 18 rokov
neboli stanovené.
Spôsob podania
Intravenózne podanie.
Zoledronic Acid Hospira (5 mg v 100 ml infúzneho roztoku pripraveného na použitie) sa podáva cez infúznu súpravu s odvzdušnením konštantnou rýchlosťou. Infúzia nesmie trvať menej ako 15 minút. Informácie o infúzii Zoledronic Acid Hospira, pozri časť 6.6.
4.3 Kontraindikácie
- Precitlivenosť na liečivo, na akékoľvek bisfosfonáty alebo na ktorúkoľvek z pomocných látok
uvedených v časti 6.1.
- Pacienti s hypokalciémiou (pozri časť 4.4).
- Závažné poškodenie funkcie obličiek s klírensom kreatinínu < 35 ml/min (pozri časť 4.4).
- Gravidita a laktácia (pozri časť 4.6).
4.4 Osobitné upozornenia a opatrenia pri používaní
Použitie Zoledronic Acid Hospira u pacientov so závažným poškodením funkcie obličiek (klírens
kreatinínu < 35 ml/min) je kontraindikované pre zvýšené riziko zlyhania obličiek u tejto skupiny.
Po podaní kyseliny zoledrónovej sa pozorovalo poškodenie funkcie obličiek (pozri časť 4.8), najmä u pacientov s už prítomnou dysfunkciou obličiek alebo inými rizikami vrátane pokročilého veku, súbežného podania nefrotoxických liekov, súbežnej diuretickej liečby (pozri časť 4.5) alebo dehydratácie, ku ktorej došlo po podaní kyseliny zoledrónovej. Zlyhanie obličiek vyžadujúce dialýzu alebo končiace sa smrťou sa zriedka vyskytlo u pacientov so základným poškodením funkcie obličiek alebo s ktorýmkoľvek z rizikových faktorov opísaných vyššie.
Je potrebné vziať do úvahy nasledujúce bezpečnostné opatrenia, aby sa minimalizovalo riziko nežiaducich reakcií týkajúcich sa obličiek:
• Klírens kreatinínu sa má stanoviť pred každou dávkou kyseliny zoledrónovej.
• Prechodné zvýšenie kreatinínu v sére môže byť väčšie u pacientov so základným poškodením funkcie obličiek.
• Monitorovanie kreatinínu v sére sa má zvážiť u rizikových pacientov.
• Kyseliny zoledrónová sa má používať opatrne pri súbežnom použití s inými liekmi, ktoré môžu ovplyvniť funkciu obličiek (pozri časť 4.5).
• Pacientov, najmä starších pacientov a tých, ktorí dostávajú diuretickú liečbu, je potrebné pred podaním kyseliny zoledrónovej primerane hydratovať.
• Jednorazová dávka kyseliny zoledrónovej nemá byť väčšia ako 5 mg a podanie infúzie má trvať
najmenej 15 minút (pozri časť 4.2).
Prítomná hypokalciémia sa musí liečiť dostatočným príjmom vápnika a vitamínu D pred začatím liečby kyselinou zoledrónovou (pozri časť 4.3). Iné poruchy metabolizmu minerálnych látok sa tiež musia účinne liečiť (napr. znížená tvorba parathormónu, intestinálna malabsorpcia vápnika). Lekári majú zvážiť klinické sledovanie týchto pacientov.
Pre Pagetovu chorobu kostí je charakteristický zvýšený kostný obrat. V dôsledku rýchleho nástupu účinku kyseliny zoledrónovej na kostný obrat sa môže vyvinúť prechodná hypokalciémia, niekedy symptomatická, ktorá zvyčajne dosahuje maximum počas prvých 10 dní po infúzii kyseliny zoledrónovej (pozri časť 4.8).
V súvislosti s podaním kyseliny zoledrónovej sa odporúča dostatočný príjem vápnika a vitamínu D. Okrem toho sa u pacientov s Pagetovou chorobou naliehavo odporúča zabezpečiť dostatočnú suplementáciu vápnika, zodpovedajúcu najmenej 500 mg elementárneho vápnika dvakrát denne, počas najmenej 10 dní po podaní kyseliny zoledrónovej (pozri časť 4.2). Pacientov je potrebné informovať o symptómoch hypokalciémie a primerane klinicky sledovať počas rizikového obdobia. U pacientov s Pagetovou chorobou sa pred infúziou kyseliny zoledrónovej odporúča stanoviť vápnik v sére.
U pacientov liečených bisfosfonátmi vrátane kyseliny zoledrónovej bola zriedkavo hlásená silná
bolesť kostí, kĺbov a/alebo svalov, príležitostne znemožňujúca pohyblivosť (pozri časť 4.8).
Iné lieky obsahujúce kyselinu zoledrónovú ako liečivo sú dostupné na liečbu onkologických indikácií. Pacienti, ktorí sa liečia Zoledronic Acid Hospira, sa nemajú súčasne liečiť takýmito liekmi alebo akýmkoľvek iným bisfosfonátom, pretože kombinované účinky týchto látok nie sú známe.
Osteonekróza čeľuste (ONJ)
Osteonekróza čeľuste sa zaznamenala prevažne u pacientov s malignitami, ktorí dostávali režimy liečby zahŕňajúce bisfosfonáty vrátane kyseliny zoledrónovej. Mnohí z týchto pacientov dostávali aj chemoterapiu a kortikosteroidy. Väčšina hlásených prípadov súvisela s dentálnymi zákrokmi, ako je extrakcia zuba. Mnohí mali príznaky lokálnej infekcie vrátane osteomyelitídy. Prehliadka chrupu s náležitými preventívnymi dentálnymi zákrokmi sa má uvážiť pred liečbou bisfosfonátmi u pacientov
so sprievodnými rizikovými faktormi (napr. malignitou, chemoterapiou, kortikosteroidmi, nedostatočnou hygienou ústnej dutiny). Ak je to možné, títo pacienti sa majú počas liečby vyvarovať invazívnych dentálnych zákrokov. Dentálny chirurgický zákrok môže zhoršiť stav pacientov, u ktorých počas liečby bisfosfonátom vznikne osteonekróza čeľuste. Nie sú dostupné údaje, ktoré by ukázali, či prerušenie liečby bisfosfonátom znižuje riziko osteonekrózy čeľuste u pacientov, ktorí potrebujú dentálne zákroky. Klinický úsudok ošetrujúceho lekára založený na vyhodnotení individuálneho pomeru prospešnosti a rizika má byť určujúci pri plánovaní liečby každého pacienta.
Atypické zlomeniny stehennej kosti
Pri liečbe bisfosfonátmi boli hlásené atypické subtrochanterické a diafyzárne zlomeniny stehennej kosti, predovšetkým u pacientov, ktorí sa dlhodobo liečili na osteoporózu. Tieto priečne alebo krátke šikmé zlomeniny môžu vzniknúť kdekoľvek pozdĺž stehennej kosti, tesne pod malým trochanterom až po suprakondylickú časť. K týmto zlomeninám dochádza po minimálnej alebo žiadnej traume a u niektorých pacientov sa niekoľko týždňov až mesiacov pred vznikom úplnej zlomeniny stehennej kosti vyskytne bolesť v stehne alebo slabine, pri zobrazovacom vyšetrení často spojená s charakteristikami únavovej zlomeniny. Zlomeniny sú často bilaterálne, preto sa má u pacientov liečených bisfosfonátmi, ktorí utrpeli zlomeninu stehennej kosti, vyšetriť aj kontralaterálna stehenná kosť. Hlásené bolo tiež nedostatočné hojenie týchto zlomenín. U pacientov s podozrením na atypickú zlomeninu stehennej kosti sa má na základe individuálneho zhodnotenia prínosu a rizika pre pacienta zvážiť prerušenie liečby bisfosfonátmi.
Počas liečby bisfosfonátmi treba pacientov poučiť, aby hlásili akúkoľvek bolesť v stehne, bedre alebo slabine a každého pacienta s takýmito príznakmi je potrebné vyšetriť na prítomnosť neúplnej zlomeniny stehennej kosti.
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na dávku, t.j. v podstate bez sodíka.
4.5 Liekové a iné interakcie
Štúdie interakcií s inými liekmi sa nevykonali. Kyselina zoledrónová sa systémovo nemetabolizuje a neovplyvňuje ľudské enzýmy cytochrómu P450 in vitro (pozri časť 5.2). Kyselina zoledrónová sa neviaže vo veľkej miere na bielkoviny plazmy (viaže sa približne 43 – 55 %), a preto sú nepravdepodobné interakcie následkom vytesnenia liečiv s vysokou väzbou na bielkoviny.
Kyselina zoledrónová sa eliminuje vylučovaním obličkami. Opatrnosť je potrebná, keď sa kyselina zoledrónová podáva spolu s liekmi, ktoré môžu významne ovplyvniť funkciu obličiek (napr. aminoglykozidy alebo diuretiká, ktoré môžu spôsobiť dehydratáciu) (pozri časť 4.4).
U pacientov s poškodením funkcie obličiek sa môže zvýšiť systémová expozícia súbežne podávaným liekom, ktoré sa vylučujú primárne obličkami.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití kyseliny zoledrónovej u gravidných žien. Štúdie s
kyselinou zoledrónovou na zvieratách preukázali toxické účinky na reprodukciu vrátane malformácií
(pozri časť 5.3). Nie je známe potenciálne riziko u ľudí.
Laktácia
Nie je známe, či sa kyselina zoledrónová vylučuje do ľudského mlieka. Kyselina zoledrónová je
kontraindikovaná počas gravidity a u dojčiacich žien (pozri časť 4.3).
Ženyvreprodukčnomveku
Použitie kyseliny zoledrónovej sa neodporúča u žien v reprodukčnom veku.
FertilitaMožné nežiaduce účinky kyseliny zoledrónovej na fertilitu parentálnej generácie a F1 sa hodnotili u
potkanov. Prejavili sa vystupňované farmakologické účinky, pri ktorých sa predpokladá súvislosť s inhibíciou mobilizácie kostrového vápnika vyvolanou touto látkou, ktorá viedla k hypokalciémii v období okolo pôrodu, čo je účinok bisfosfonátov ako skupiny, dystokii a predčasnému ukončeniu štúdie. Tieto výsledky tak znemožnili určenie jednoznačného účinku kyseliny zoledrónovej na fertilitu u ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNežiaduce reakcie, napr. závraty, môžu ovplyvniť schopnosť viesť vozidlá a obsluhovať stroje, hoci klinické štúdie tohto účinku sa s kyselinou zoledrónovou nevykonali.
4.8 Nežiaduce účinkyCelkový percentuálny podiel pacientov, u ktorých sa vyskytli nežiaduce reakcie, bol 44,7 % po prvej,
16,7 % po druhej a 10,2 % po tretej infúzii. Incidencia jednotlivých nežiaducich reakcií po prvej
infúzii bola: horúčka (17,1 %), myalgia (7,8 %), symptómy podobné chrípke (6,7 %), artralgia (4,8 %) a bolesť hlavy (5,1 %). Incidencia týchto reakcií sa výrazne znižovala pri ďalších každoročných dávkach kyseliny zoledrónovej. Väčšina týchto reakcií sa vyskytla počas prvých troch dní po podaní kyseliny zoledrónovej. Väčšina týchto reakcií bola mierna až stredne závažná a zmizla do troch dní od ich nástupu. Percentuálny podiel pacientov, u ktorých sa vyskytli nežiaduce reakcie, bol nižší v menšom klinickom skúšaní (19,5 % po prvej, 10,4 % po druhej a 10,7 % po tretej infúzii), v ktorom sa použila profylaxia proti nežiaducim reakciám, ako je opísaná nižšie.
Výskyt nežiaducich reakcií, ktoré sa vyskytujú počas prvých troch dní po podaní kyseliny zoledrónovej, možno podľa potreby znížiť podaním paracetamolu alebo ibuprofénu krátko po podaní kyseliny zoledrónovej (pozri časť 4.2).
V klinickom skúšaní HORIZON – Pivotal Fracture Trial [PFT] (pozri časť 5.1) celková incidencia fibrilácie predsiení bola 2,5 % (96 z 3 862) u pacientok, ktoré dostávali kyselinu zoledrónovú a 1,9 % (75 z 3 852) u pacientok, ktoré dostávali placebo. Výskyt fibrilácie predsiení ako závažnej nežiaducej udalosti bol zvýšený u pacientok, ktoré dostávali kyselinu zoledrónovú (1,3 %) (51 z 3 862) v porovnaní s pacientkami, ktoré dostávali placebo (0,6 %) (22 z 3 852). Mechanizmus, ktorý spôsobuje toto zvýšenie incidencie fibrilácie predsiení, nie je známy. V klinických skúšaniach pri osteoporóze (PFT, HORIZON – Recurrent Fracture Trial [RFT]) boli súhrnné incidencie fibrilácie predsiení porovnateľné pri kyseline zoledrónovej (2,6 %) a placebe (2,1 %). Súhrnné incidencie fibrilácie predsiení ako závažnej nežiaducej udalosti boli 1,3 % pri kyseline zoledrónovej a 0,8 % pri placebe.
Nežiaduce reakcie v Tabuľke 1 sú zatriedené podľa orgánových systémov MedDRA a kategórie frekvencií. Kategórie frekvencií sú definované pomocou nasledujúcej konvencie: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000); neznáme (z dostupných údajov). V rámci jednotlivých skupín
frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
Infekcie a nákazy
| Menej časté
| chrípka, nazofaryngitída
| Poruchy krvi a lymfatického systému
| Menej časté
| Anémia
| Poruchy imunitného systému
| Neznáme**
| Reakcie z precitlivenosti vrátane zriedkavých prípadov bronchokonstrikcie, urtikárie a angioedému a veľmi zriedkavé prípady anafylaktickej reakcie/šoku
|
|
|
Tabuľka 1
Poruchy metabolizmu a výživy
|
Ča
st
é
|
Hypokalciémia*
|
|
M
enej časté
|
Anorexia, znížená chuť do jedenia
|
Psychické poruchy
|
M
enej časté
|
Nespavosť
|
Poruchy nervového systému
|
Ča
st
é
|
Bolesť hlavy, závraty
|
|
M
enej časté
|
Letargia, parestézia, somnolencia, tremor, synkopa, dysgeúzia
|
Poruchy oka
|
Ča
st
é
|
Hyperémia očí
|
|
M
enej časté
|
Konjunktivitída, bolesť očí
|
|
Zriedkavé
|
Uveitída, episkleritída, iritída
|
|
N
eznáme**
|
Skleritída a zápal orbity
|
Poruchy ucha a labyrintu
|
M
enej časté
|
Vertigo
|
Poruchy srdca a srdcovej činnosti
|
Ča
st
é
|
Fibrilácia predsiení
|
|
M
enej časté
|
Palpitácie
|
Poruchy ciev
|
M
enej časté
|
Hypertenzia, návaly tepla
|
|
N
eznáme**
|
Hypotenzia (niektorí pacienti mali základné rizikové faktory)
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
M
enej časté
|
Kašeľ, dyspnoe
|
Poruchy gastrointestinálneho traktu
|
Ča
st
é
|
Nauzea, vracanie, hnačka
|
|
M
enej časté
|
Dyspepsia, bolesť v hornej časti brucha, bolesť brucha, gastroezofágový reflux, zápcha, suchosť v ústach, ezofagitída, bolesť zubov, gastritída#
|
Poruchy kože a spojivového tkaniva
|
M
enej časté
|
Vyrážka, hyperhidróza, svrbenie, erytém
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
Ča
st
é
|
Myalgia, artralgia, bolesť kostí, bolesť
chrbta, bolesť končatín
|
|
M
enej časté
|
Bolesť krku, stuhnutosť svalstva a kostry, opuch kĺbov, svalové kŕče, bolesť pliec, bolesť svalov a kostry hrudníka, bolesť svalstva a kostry, stuhnutosť kĺbov, artritída, svalová slabosť
|
|
Zriedkavé
|
Atypické subtrochanterické a diafyzárne zlomeniny stehennej kosti† (skupinová nežiaduca reakcia na bisfosfonáty)
|
|
N
eznáme**
|
Osteonekróza čeľuste (pozri časti 4.4 a 4.8
Skupinové účinky)
|
Poruchy obličiek a močových ciest
|
M
enej časté
|
Zvýšená hladina kreatinínu v krvi, polakizúria, proteinúria
|
|
N
eznáme**
|
Poškodenie funkcie obličiek. Zriedkavé prípady zlyhania obličiek vyžadujúce dialýzu a zriedkavé prípady končiace smrťou sa zaznamenali u pacientov s už
prítomnou dysfunkciou obličiek alebo inými
|
|
|
rizikovými faktormi ako sú pokročilý vek, súbežné podanie nefrotoxických liekov, súbežná diuretická liečba alebo dehydratácia v období po infúzii (pozri časti 4.4 a 4.8
Skupinové účinky)
|
C
elkové poruchy a reakcie v mieste podania
|
Veľmi časté
|
Horúčka
|
Ča
st
é
|
Symptómy podobné chrípke, zimnica, únava, asténia, bolesť, celková nevoľnosť, reakcia v mieste podania infúzie
|
|
M
enej časté
|
Periférny edém, smäd, reakcia akútnej fázy,
nekardiálna bolesť v hrudníku
|
|
N
eznáme**
|
Sekundárna dehydratácia pri symptómoch
po podaní ako sú horúčka, vracanie a hnačka
|
Laboratórne a funkčné vyšetrenia
|
Ča
st
é
|
Zvýšenie C-reaktívneho proteínu
|
|
M
enej časté
|
Zníženie vápnika v krvi
|
# Pozorované u pacientov súbežne užívajúcich glukokortikosteroidy.
* Časté iba pri Pagetovej chorobe.
** Založené na hláseniach po uvedení lieku na trh. Frekvencia sa nedá odhadnúť z dostupných údajov.
† Zistené pri používaní po uvedení lieku na trh.
|
Skupinové
účinky:
Poškodenie funkcie obličiek
Kyselina zoledrónová sa spájala s poškodením funkcie obličiek, ktoré sa prejavilo ako zhoršenie funkcie obličiek (t.j. zvýšenie kreatinínu v sére) a v zriedkavých prípadoch ako akútne zlyhanie obličiek. Poškodenie funkcie obličiek sa pozorovala po podaní kyseliny zoledrónovej najmä u pacientov s už prítomnou dysfunkciou obličiek alebo s ďalšími rizikovými faktormi (napr. pokročilým vekom, u onkologických pacientov s chemoterapiou, pri súčasnom užívaní nefrotoxických liekov, pri súbežnej diuretickej liečbe, pri závažnej dehydratácii), z ktorých väčšina dostávala dávku 4 mg každé
3 – 4 týždne, ale pozorovala sa u pacientov po jedinom podaní.
V klinických skúšaniach pri osteoporóze bola zmena klírensu kreatinínu (stanovený každý rok pred podaním dávky) a incidencia zlyhania a zhoršenia funkcie obličiek porovnateľná počas troch rokov v skupinách liečby kyselinou zoledrónovou aj placebom. Prechodné zvýšenie kreatinínu v sére sa pozorovalo počas 10 dní u 1,8 % pacientok liečených kyselinou zoledrónovou oproti 0,8 % pacientok, ktoré dostali placebo.
HypokalciémiaV klinických skúšaniach pri osteoporóze približne 0,2 % pacientok malo zreteľný pokles hladiny vápnika v sére (menej ako 1,87 mmol/l) po podaní kyseliny zoledrónovej. Nepozorovali sa prípady symptomatickej hypokalciémie.
V klinických skúšaniach pri Pagetovej chorobe sa symptomatická hypokalciémia pozorovala u približne 1 % pacientov a u všetkých sa upravila.
Podľa laboratórnych hodnotení došlo k prechodnému asymptomatickému poklesu hladín vápnika pod rozmedzie normálnych referenčných hodnôt (menej ako 2,10 mmol/l) u 2,3 % pacientok liečených kyselinou zoledrónovou v jednom veľkom klinickom skúšaní v porovnaní s 21 % pacientov liečených kyselinou zoledrónovou v klinických skúšaniach pri Pagetovej chorobe. Frekvencia hypokalciémie bola oveľa nižšia po ďalších infúziách.
Všetky pacientky v klinickom skúšaní pri postmenopauzálnej osteoporóze, pacienti v klinickom skúšaní prevencie klinických zlomenín po zlomenine krčka stehnovej kosti a v klinických skúšaniach pri Pagetovej chorobe dostávali dostatočnú suplementáciu vitamínu D a vápnika (pozri aj časť 4.2). V klinickom skúšaní prevencie klinických zlomenín po nedávnej zlomenine krčka stehnovej kosti sa hladiny vitamínu D bežne nestanovovali, ale väčšina pacientov dostala saturačnú dávku vitamínu D pred podaním kyseliny zoledrónovej (pozri časť 4.2).
Miestne reakcie
V jednom veľkom klinickom skúšaní boli hlásené po podaní kyseliny zoledrónovej miestne reakcie v
mieste podania infúzie (0,7 %), napr. sčervenenie, opuch a/alebo bolesť.
Osteonekróza čeľuste
Prevažne u pacientov s malignitami liečených bisfosfonátmi vrátane kyseliny zoledrónovej sa menej často zaznamenali prípady osteonekrózy (najmä čeľuste). Mnohí z týchto pacientov mali príznaky lokálnej infekcie vrátane osteomyelitídy a väčšina hlásení sa týka pacientov s malignitami po extrakcii zubov alebo iných dentálnych chirurgických zákrokoch. Osteonekróza čeľuste má viaceré dobre zdokumentované rizikové faktory vrátane diagnózy malignity, súčasne podanej liečby (napr. chemoterapie, rádioterapie, kortikosteroidov) a sprievodných ochorení (napr. anémie, koagulopatií, infekcie, už prítomného ochorenia zubov). Hoci sa nestanovila príčinná súvislosť, je vhodné
vyvarovať sa dentálnych chirurgických zákrokov, pretože sa môže predĺžiť obdobie zotavenia (pozri časť 4.4). V jednom veľkom klinickom skúšaní so 7 736 pacientkami bola osteonekróza čeľuste
hlásená u jednej pacientky liečenej kyselinou zoledrónovou a u jednej pacientky, ktorá dostávala
placebo. V obidvoch prípadoch sa stav upravil.
4.9 Predávkovanie
Klinické skúsenosti s akútnym predávkovaním sú obmedzené. Pacientov, ktorí dostali vyššie ako odporúčané dávky, je potrebné starostlivo sledovať. V prípade predávkovania, ktoré má za následok klinicky významnú hypokalciémiu, možno dosiahnuť zvrat perorálnou suplementáciou vápnika a/alebo intravenóznou infúziou glukonanu vápenatého.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Liečivá na liečbu ochorení kostí, bisfosfonáty, ATC kód: M05BA08
Spôsob účinku
Kyselina zoledrónová patrí do skupiny bisfosfonátov obsahujúcich dusík a účinkuje primárne na kosti.
Je to inhibítor resorpcie kostí sprostredkovanej osteoklastami.
Farmakodynamické účinky
Selektívny účinok bisfosfonátov na kosť je založený na ich vysokej afinite k mineralizovanej kosti.
Hlavným molekulárnym cieľom kyseliny zoledrónovej v osteoklaste je enzým farnezylpyrofosfátsyntáza. Dlhé trvanie účinku kyseliny zoledrónovej možno pripísať jej vysokej väzbovej afinite k aktívnemu miestu farnezylpyrofosfátsyntázy (FPP) a jej silnej väzbovej afinite ku kostnému minerálu.
Liečba kyselinou zoledrónovou prudko znížila rýchlosť kostného obratu zo zvýšenej postmenopauzálnej hladiny na dolnú hranicu markerov resorpcie pozorovanú na 7. deň a markerov
tvorby kosti v 12. týždni. Potom sa kostné markery ustálili v predmenopauzálnom rozmedzí hodnôt.
Pri opakovanom každoročnom podávaní nedošlo k progresívnemu zníženiu markerov kostného obratu.
Klinická účinnosť vliečbepostmenopauzálnejosteoporózy(PFT)Účinnosť a bezpečnosť kyselinou zoledrónovou 5 mg raz ročne počas 3 po sebe nasledujúcich rokov
sa preukázali u postmenopauzálnych žien (7 736 žien vo veku 65 – 89 rokov), ktoré mali buď: T-skóre
minerálnej denzity kostí (BMD) krčka stehnovej kosti ≤ –1,5 a najmenej dve malé alebo jednu stredne závažnú existujúcu zlomeninu stavca; alebo T-skóre BMD krčka stehnovej kosti ≤ –2,5, s preukázanou
existujúcou zlomeninou stavca alebo bez nej. 85 % pacientok nedostalo predtým žiadny bisfosfonát.
Ženy, u ktorých sa hodnotila incidencia zlomenín stavcov, nedostávali súbežnú liečbu osteoporózy, ktorá bola povolená u žien, ktoré sa zúčastnili na vyhodnotení zlomenín krčka stehnovej kosti a všetkých klinických zlomenín. Súbežná liečba osteoporózy pozostávala z kalcitonínu, raloxifénu, tamoxifénu, hormonálnej substitučnej liečby a tibolónu, ale vylúčené boli iné bisfosfonáty. Všetky ženy dostávali denne suplementy s 1 000 až 1 500 mg elementárneho vápnika a 400 až 1 200 IU vitamínu D denne.
Účinok na morfometrické zlomeniny stavcovKyselina zoledrónová významne znížila incidenciu jednej alebo viacerých nových zlomenín stavcov
počas troch rokov, a to už po prvom roku (pozri Tabuľku 2).
Tabuľka 2 Zhrnutie účinnosti pri zlomeninách stavcov po 12, 24 a 36 mesiacoch
|
Výsledok
| Kyseliny zoledrónová (%)
| Placebo (%)
| Absolútne zníženie incidencie zlomenín
% (IS)
| Relatívne zníženie incidencie zlomenín
% (IS)
|
Najmenej jedna nová zlomenina stavca
(0 – 1 rok)
| 1,5
| 3,7
| 2,2 (1,4; 3,1)
| 60 (43, 72)**
|
Najmenej jedna nová zlomenina stavca
(0 – 2 roky)
| 2,2
| 7,7
| 5,5 (4,4; 6,6)
| 71 (62, 78)**
|
Najmenej jedna nová zlomenina stavca
(0 – 3 roky)
| 3,3
| 10,9
| 7,6 (6,3; 9,0)
| 70 (62, 76)**
|
** p < 0,0001
|
U pacientov vo veku 75 rokov a starších liečených kyselinou zoledrónovou sa znížilo riziko zlomenín
stavcov o 60 % v porovnaní s pacientmi, ktorí dostávali placebo (p < 0,0001).
Účinok na zlomeniny krčka stehnovej kostiPri kyseline zoledrónovej sa preukázal účinok pretrvávajúci počas 3 rokov, ktorý viedol k zníženiu rizika zlomenín krčka stehnovej kosti o 41 % (95 % IS, 17 % až 58 %). Výskyt zlomenín krčka stehnovej kosti bol 1,44 % u pacientok liečených kyselinou zoledrónovou v porovnaní s 2,49 % u pacientok, ktoré dostávali placebo. Riziko sa znížilo o 51 % u pacientok, ktoré v minulosti nedostávali bisfosfonáty, a o 42 % u žien, ktoré mali povolenú súbežnú liečbu osteoporózy.
Účinok na všetky klinické zlomeninyVšetky klinické zlomeniny boli dokázané rádiograficky a/alebo klinicky. Zhrnutie výsledkov sa
uvádza v Tabuľke 3.
Ta
b
uľka 3 Porovnania incidencie kľúčových klinických ukazovateľov zlomenín medzi druhmi liečby počas 3 rokov
|
Výsledok
|
Kyselina zoledrónová (N = 3 875) výskyt udalostí (%)
|
Placebo
(N = 3 861) výskyt udalostí
(%)
|
Absolútne zníženie výskytu zlomenín % (IS)
|
Relatívne zníženie rizika incidencie zlomenín % (IS)
|
Akákoľvek klinická
zlomenina (1)
|
8,4
|
12,8
|
4,4 (3,0; 5,8)
|
33 (23, 42)**
|
Klinická zlomenina stavca
(2)
|
0,5
|
2,6
|
2,1 (1,5; 2,7)
|
77 (63, 86)**
|
Zlomenina inej kosti ako stavca (1)
|
8,0
|
10,7
|
2,7 (1,4; 4,0)
|
25 (13, 36)*
|
* hodnota p < 0,001, ** hodnota p < 0,0001 (1) Okrem zlomenín prstov a kostí tváre
(2) Vrátane klinických zlomenín hrudníka a klinických zlomenín lumbálnych stavcov
|
Ú
činok na minerálnu denzitu kostí (BMD)
Kyselina zoledrónová významne zvýšila BMD v lumbálnej chrbtici, bedrovom kĺbe a distálnej vretennej kosti v porovnaní s liečbou placebom vo všetkých sledovaných časoch (6, 12, 24 a 36 mesiacov). V porovnaní s placebom liečba kyselinou zoledrónovou za 3 roky viedla k zvýšeniu BMD v lumbálnej chrbtici o 6,7 %, v celom bedrovom kĺbe o 6,0 %, v krčku stehnovej kosti o 5,1 % a v distálnej vretennej kosti o 3,2 %.
Histológia kostíBiopsie kosti z bedrového hrebeňa sa získali 1 rok po podaní tretej ročnej dávky od 152 postmenopauzálnych pacientok s osteoporózou, ktoré dostávali kyselinu zoledrónovú (N = 82) alebo placebo (N = 70). Histomorfometrická analýza ukázala zníženie kostného obratu o 63 %. U pacientok liečených kyselinou zoledrónovou sa nezistila osteomalácia, fibróza kostnej drene ani tvorba vláknitej kosti. Značenie tetracyklínom bolo detekovateľné vo všetkých 82 biopsiách získaných od pacientok liečených kyselinou zoledrónovou, okrem jednej. Analýza pomocou mikropočítačovej tomografie (μCT) ukázala zvýšený objem trabekulárnej kosti a zachovanie stavby trabekulárnej kosti u pacientok liečených kyselinou zoledrónovou v porovnaní s placebom.
Markery kostného obratuV pravidelných intervaloch počas klinického skúšania sa hodnotila alkalická fosfatáza špecifická pre kosť (BSAP), N-koncový propeptid kolagénu typu I v sére (P1NP) a beta-C-telopeptidy v sére (b- CTx) v podsúboroch s počtom od 517 do 1 246 pacientok. Liečba kyselinou zoledrónovou v dávke
5 mg raz ročne významne znížila BSAP o 30 % oproti východiskovej hodnote po 12 mesiacoch a pokles pretrval na 28 % pod východiskovou hodnotou po 36 mesiacoch. P1NP sa významne znížil o
61 % oproti východiskovej hodnote po 12 mesiacoch a pokles pretrval na 52 % pod východiskovou hodnotou po 36 mesiacoch. B-CTx sa významne znížili o 61 % oproti východiskovej hodnote po 12 mesiacoch a pokles pretrval na 55 % pod východiskovou hodnotou po 36 mesiacoch. Počas celého
tohto obdobia markery kostného obratu na konci každého roka boli v predmenopauzálnom rozmedzí.
Opakované podávanie neviedlo k ďalšiemu zníženiu markerov kostného obratu.
Účinok na telesnú výšku
V trojročnom klinickom skúšaní sa pri osteoporóze každoročne merala výška v stoji pomocou výškomeru. V skupine kyseliny zoledrónovej bola strata telesnej výšky približne o 2,5 mm menšia v porovnaní s placebom (95 % IS: 1,6 mm; 3,5 mm) [p < 0,0001].
Počet dní nespôsobilostiKyselina zoledrónová významne znížila priemerný počet dní obmedzenej aktivity o 17,9 dní a pokoja na lôžku pre bolesť chrbta o 11,3 dní v porovnaní s placebom a významne znížila priemerný počet dní obmedzenej aktivity o 2,9 dní a pokoja na lôžku pre zlomeniny o 0,5 dňa v porovnaní s placebom (všetky p < 0,01).
Klinickáúčinnosťvliečbeosteoporózyupacientovsozvýšenýmrizikomzlomenínponedávnejzlomeninekrčkastehnovejkosti(RFT)Incidencia klinických zlomenín vrátane zlomenín stavcov, zlomenín iných kostí ako stavcov a
zlomenín krčka stehnovej kosti sa vyhodnotila u 2 127 mužov a žien vo veku 50 – 95 rokov (priemerný vek 74,5 rokov) s nedávnou (počas uplynulých 90 dní) zlomeninou krčka stehnovej kosti následkom minimálnej traumy, ktorí boli sledovaní v priemere 2 roky počas podávania skúšaného lieku. Približne 42 % pacientov malo T-skóre BMD krčka stehnovej kosti nižšie ako -2,5 a približne
45 % pacientov malo T-skóre BMD krčka stehnovej kosti vyššie ako -2,5. Kyselina zoledrónová sa podávala raz za rok, kým najmenej 211 pacientov z populácie v štúdii potvrdilo klinické zlomeniny.
Hladiny vitamínu D sa bežne nestanovovali, ale väčšina pacientov dostala 2 týždne pred infúziou
saturačnú dávku vitamínu D (50 000 až 125 000 IU perorálne alebo intramuskulárne). Všetci účastníci
dostávali suplementáciu 1 000 až 1 500 mg elementárneho vápnika a 800 až 1 200 IU vitamínu D denne. 95 % pacientov dostalo infúziu dva alebo viac týždňov po ošetrení zlomeniny krčka stehnovej kosti a medián času podania infúzie bol približne šesť týždňov po ošetrení zlomeniny krčka stehnovej kosti. Primárna premenná účinnosti bola incidencia klinických zlomenín počas trvania štúdie.
Účinok na všetky klinické zlomeninyIncidencie kľúčových klinických ukazovateľov zlomenín uvádza Tabuľka 4.
Tabuľka 4 Porovnanie incidencie kľúčových klinických ukazovateľov zlomenín medzi druhmi liečby
|
Výsledok
| Kyselina zoledrónová (N = 1 065) výskyt udalostí (%)
| Placebo
(N = 1 062) výskyt udalostí
(%)
| Absolútne zníženie výskytu zlomenín % (IS)
| Relatívne zníženie rizika incidencie zlomenín % (IS)
|
Akákoľvek klinická
zlomenina (1)
| 8,6
| 13,9
| 5,3 (2,3; 8,3)
| 35 (16, 50)**
|
Klinická zlomenina stavca
(2)
| 1,7
| 3,8
| 2,1 (0,5; 3,7)
| 46 (8, 68)*
|
Zlomenina inej kosti ako stavca (1)
| 7,6
| 10,7
| 3,1 (0,3; 5,9)
| 27 (2, 45)*
|
* hodnota p < 0,05; ** hodnota p < 0,01 (1) Okrem zlomenín prstov a kostí tváre
(2) Vrátane klinických zlomenín hrudníka a klinických zlomenín lumbálnych stavcov
|
Štúdia nebola navrhnutá na stanovenie významných rozdielov v počte zlomenín krčka stehnovej kosti,
ale pozorovala sa tendencia k zníženiu nových zlomenín krčka stehnovej kosti.
Mortalita zo všetkých príčin bola 10 % (101 pacientov) v skupine liečenej kyselinou zoledrónovou v porovnaní s 13 % (141 pacientov) v skupine placeba. Zodpovedá to zníženiu rizika mortality zo všetkých príčin o 28 % (p = 0,01).
Incidencia spomaleného hojenia zlomeniny krčka stehnovej kosti bola porovnateľná pri kyseline zoledrónovej (34 [3,2 %]) a placebe (29 [2,7 %]).
Účinok na minerálnu denzitu kosti (BMD)
V štúdii HORIZON-RFT liečba kyselinou zoledrónovou významne zvýšila BMD celého bedrového kĺbu a krčka stehnovej kosti oproti liečbe placebom v každom čase. Liečba kyselinou zoledrónovou viedla v porovnaní s placebom počas 24 mesiacov k zvýšeniu BMD o 5,4 % v celom bedrovom kĺbe a o 4,3 % v krčku stehnovej kosti.
Klinická účinnosť umužov
V štúdii HORIZON-RFT bolo do štúdie randomizovaných 508 mužov a u 185 pacientov sa stanovila
BMD po 24 mesiacoch. V porovnaní s účinkami pozorovanými u postmenopauzálnych žien v štúdii
HORIZON-PFT sa po 24 mesiacoch u pacientov liečených kyselinou zoledrónovou pozorovalo podobné významné zvýšenie BMD v celom bedrovom kĺbe o 3,6 %. Klinické skúšanie nebolo určené na preukázanie poklesu klinických zlomenín u mužov; incidencia klinických zlomenín bola 7,5 % u mužov liečených kyselinou zoledrónovou oproti 8,7 % pri placebe.
V ďalšej štúdii u mužov (štúdia CZOL446M2308) bola infúzia kyseliny zoledrónovej raz za rok
noninferiórna alendronátu raz týždenne vzhľadom na percentuálnu zmenu BMD v lumbálnej chrbtici v
24. mesiaci oproti východiskovej hodnote.
Klinická účinnosť priosteoporózespojenejsdlhodobousystémovouliečbouglukokortikoidmi
Účinnosť a bezpečnosť kyseliny zoledrónovej v liečbe a prevencii osteoporózy spojenej s dlhodobou
systémovou liečbou glukokortikoidmi sa hodnotila v randomizovanej, multicentrickej, dvojito zaslepenej, stratifikovanej štúdii kontrolovanej účinným liekom u 833 mužov a žien vo veku 18 – 85 rokov (priemerný vek u mužov 56,4 rokov; u žien 53,5 rokov), ktorí dostávali perorálne > 7,5 mg/deň prednizónu (alebo ekvivalent). Pacienti boli stratifikovaní podľa dĺžky používania glukokortikoidov pred randomizáciou (≤ 3 mesiace oproti > 3 mesiace). Klinické skúšanie trvalo jeden rok. Pacienti boli randomizovaní buď na podanie jednorazovej infúzie kyseliny zoledrónovej 5 mg, alebo na perorálnu liečbu risedronátom 5 mg denne počas jedného roka. Všetci účastníci dostávali denne suplementy
1 000 mg elementárneho vápnika a 400 až 1 000 IU vitamínu D. Účinnosť sa preukázala, ak sa noninferiorita oproti risedronátu následne prejavila v percentuálnej zmene BMD v lumbálnej chrbtici po 12 mesiacoch oproti východiskovým hodnotám v subpopuláciách prevencie aj liečby. Väčšina pacientov naďalej dostávala glukokortikoidy počas jedného roka trvania klinického skúšania.
Účinok na minerálnu denzitu kostí (BMD)
Zvýšenie BMD bolo významne väčšie v skupine liečenej kyselinou zoledrónovou v lumbálnej chrbtici a v krčku stehnovej kosti po 12 mesiacoch v porovnaní s risedronátom (všetky p < 0,03). V subpopulácii pacientov, ktorí dostávali glukokortikoidy pred randomizáciou dlhšie ako 3 mesiace, kyselina zoledrónová zvýšila BMD lumbálnej chrbtice o 4,06 % oproti 2,71 % pri risedronáte (priemerný rozdiel: 1,36 %; p < 0,001). V subpopulácii pacientov, ktorí dostávali glukokortikoidy pred randomizáciou 3 mesiace alebo kratšie, kyselina zoledrónová zvýšila BMD lumbálnej chrbtice o
2,60 % oproti 0,64 % pri risedronáte (priemerný rozdiel: 1,96 %; p < 0,001). Štúdia nebola zameraná na preukázanie poklesu počtu klinických zlomenín v porovnaní s risedronátom. Incidencia zlomenín bola 8 u pacientov liečených kyselinou zoledrónovou oproti 7 u pacientov liečených risedronátom
(p = 0,8055).
Klinická účinnosťvliečbePagetovejchorobykostí
Kyselina zoledrónová sa sledovala u pacientov a pacientok vo veku nad 30 rokov s primárne miernou až stredne závažnou Pagetovou chorobou kostí (v čase zaradenia do klinického skúšania bol medián ich hladiny alkalickej fosfatázy v sére 2,6 – 3,0-násobkom hornej hranice vekovo špecifického normálneho referenčného rozmedzia), potvrdenou rádiografickými dôkazmi.
Účinnosť jednej infúzie 5 mg kyseliny zoledrónovej v porovnaní s dennými dávkami 30 mg
risedronátu počas 2 mesiacov sa preukázala v dvoch porovnávacích klinických skúšaniach trvajúcich 6
mesiacov. Po 6 mesiacoch sa pri kyseline zoledrónovej preukázala odpoveď na liečbu 96 % (169/176)
a podiel normalizácie sérovej alkalickej fosfatázy (SAP) 89 % (156/176) v porovnaní so 74 % (127/171) a 58 % (99/171) pri risedronáte (všetky p < 0,001).
Pri spojení výsledkov sa pozoroval podobný pokles skóre intenzity bolesti a rušenia bolesťou po 6
mesiacoch oproti východiskovým hodnotám pri kyseline zoledrónovej a risedronáte.
Pacienti s odpoveďou na liečbu na konci základnej štúdie trvajúcej 6 mesiacov boli vhodní pre zaradenie do dlhšieho obdobia následného sledovania. Zo 153 pacientov liečených kyselinou zoledrónovou a 115 pacientov liečených risedronátom, ktorí sa zúčastnili predĺženej observačnej štúdie trvajúcej v priemere 3,8 rokov od podania, bol podiel pacientov, ktorí ukončili predĺžené observačné obdobie pre nutnosť opakovania liečby (klinické posúdenie), vyšší pri risedronáte (48 pacientov, alebo 41,7 %) v porovnaní s kyselinou zoledrónovou (11 pacientov, alebo 7,2 %). Priemerný čas do ukončenia predĺženého observačného obdobia pre nutnosť opakovania liečby Pagetovej choroby od úvodnej dávky bol dlhší pri kyseline zoledrónovej (7,7 rokov) ako pri risedronáte (5,1 rokov).
Šiesti pacienti, u ktorých sa dosiahla terapeutická odpoveď 6 mesiacov po podaní kyseliny zoledrónovej a neskôr u nich došlo k relapsu choroby počas dlhšieho obdobia následného sledovania, boli opakovane liečení kyselinou zoledrónovou po priemernom čase 6,5 rokov od úvodnej liečby do opakovania liečby. Piati zo 6 pacientov mali SAP v rozmedzí normálnych hodnôt po 6 mesiacoch (posledné pozorovanie prenesené, LOCF).
Histológia kosti sa vyhodnotila u 7 pacientov s Pagetovou chorobou 6 mesiacov po liečbe 5 mg kyseliny zoledrónovej. Výsledky biopsie kosti ukázali kosť normálnej kvality bez dôkazu zhoršenej prestavby kosti a bez dôkazu porúch mineralizácie. Tieto výsledky boli v súlade s normalizáciou kostného obratu dokázanou biochemickými markermi.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií pre referenčný liek obsahujúci kyselinu zoledrónovú s ohľadom na všetky vekové podskupiny detí a dospievajúcich pri Pagetovej chorobe kostí, osteoporóze u postmenopauzálnych žien pri zvýšenom riziku zlomenín, osteoporóze u mužov pri zvýšenom riziku zlomenín a na prevenciu klinických zlomenín po zlomenine krčka stehnovej kosti u mužov a žien (pozri časť 4.2 pre informáciu o použití u detí a dospievajúcich).
5.2 Farmakokinetické vlastnosti
Pri jednorazových a opakovaných infúziách trvajúcich 5 a 15 minút, ktorými sa podalo 2, 4, 8 a 16 mg kyseliny zoledrónovej 64 pacientom, sa zistili nasledujúce farmakokinetické údaje, ktoré nezáviseli od dávky.
Po začatí infúzie kyseliny zoledrónovej sa plazmatické koncentrácie liečiva rýchlo zvýšili a dosiahli
maximum na konci podania infúzie, po ktorom nasledoval rýchly pokles na ˂ 10 % maxima po
4 hodinách a ˂ 1 % maxima po 24 hodinách, s následným dlhým obdobím veľmi nízkych koncentrácií
nepresahujúcich 0,1 % maximálnych hladín.
Intravenózne podaná kyselina zoledrónová sa eliminuje trojfázovým procesom: rýchle dvojfázové vymiznutie zo systémového obehu s polčasmi t½α 0,24 a t½β 1,87 hodiny, po ktorých nasleduje dlhá eliminačná fáza s konečným polčasom eliminácie t½γ 146 hodín. Po opakovanom podávaní každých 28 dní nedošlo k akumulácii liečiva v plazme. Fázy včasnej distribúcie ( α a β s hodnotami t½ uvedenými vyššie) pravdepodobne predstavujú rýchle vychytávanie do kosti a vylučovanie obličkami.
Kyselina zoledrónová sa nemetabolizuje a vylučuje sa nezmenená obličkami. Počas prvých 24 hodín sa v moči nájde 39 ± 16 % podanej dávky, zatiaľ čo zvyšok sa v zásade viaže na tkanivo kostí. Toto vychytávanie do kosti je spoločné pre všetky bisfosfonáty a pravdepodobne je dôsledkom štruktúrnej analógie s pyrofosfátom. Tak ako aj pri iných bisfosfonátoch je retenčný čas kyseliny zoledrónovej v kostiach veľmi dlhý. Z kostného tkaniva sa veľmi pomaly uvoľňuje späť do systémového obehu a vylučuje sa obličkami. Celkový telesný klírens je 5,04 ± 2,5 l/hod, a to nezávisle od dávky a bez ovplyvnenia pohlavím, vekom, rasou a telesnou hmotnosťou. Ukázalo sa, že odchýlky plazmatického klírensu kyseliny zoledrónovej medzi jedincami sú 36 % a u jedincov 34 %. Predĺženie infúzie z 5 na
15 minút znížilo koncentráciu kyseliny zoledrónovej na konci infúzie o 30 %, ale neovplyvnilo plochu
pod krivkou koncentrácie v plazme oproti času.
Štúdie interakcií kyseliny zoledrónovej s inými liekmi sa nevykonali. Pretože kyselina zoledrónová sa u ľudí nemetabolizuje a zistilo sa, že látka má malú alebo žiadnu schopnosť účinkovať ako priamy a/alebo ireverzibilný inhibítor enzýmov P450 závislý od metabolizmu, nie je pravdepodobné, že kyselina zoledrónová zníži metabolický klírens látok metabolizovaných prostredníctvom enzýmových systémov cytochrómu P450. Kyselina zoledrónová sa neviaže vo veľkej miere na bielkoviny plazmy (viaže sa približne 43 – 55 %) a väzba nezávisí od koncentrácie. Preto sú nepravdepodobné interakcie následkom vytesnenia liečiv s vysokou väzbou na bielkoviny.
Osobitné skupiny pacientov (pozri časť 4.2)
Porucha funkcie obličiek
Určil sa vzťah medzi obličkovým klírensom kyseliny zoledrónovej a klírensom kreatinínu, pričom obličkový klírens predstavoval 75 ± 33 % klírensu kreatinínu, ktorého priemerná hodnota u 64 sledovaných pacientov bola 84 ± 29 ml/min (rozmedzie 22 ± 143 ml/min). Malé pozorované zvýšenia AUC(0-24hod), približne o 30 % až 40 % pri miernom až stredne závažnom poškodení funkcie obličiek v porovnaní s pacientom s normálnou funkciou obličiek, a skutočnosť, že pri opakovanom podávaní nedochádza k akumulácii liečiva bez ohľadu na funkciu obličiek, naznačujú, že úpravy dávky kyseliny zoledrónovej pri miernom (Clcr = 50 – 80 ml/min) a stredne závažnom poškodení funkcie obličiek po hodnotu klírensu kreatinínu 35 ml/min nie sú potrebné. Použitie kyseliny zoledrónovej u pacientov so závažnou poruchou funkcie obličiek (klírens kreatinínu < 35 ml/min) je kontraindikované pre zvýšené riziko zlyhania obličiek u tejto skupiny.
5.3 Predklinické údaje o bezpečnosti
Akútna toxicita
Najvyššia neletálna jednorazová intravenózna dávka bola 10 mg/kg telesnej hmotnosti u myší a
0,6 mg/kg u potkanov. V štúdiách jednorazovej dávky v infúzii podanej počas 15 minút psy dobre znášali bez účinkov na obličky 1,0 mg/kg (6-násobok odporúčanej terapeutickej expozície u ľudí založenej na AUC).
Subchronická a chronická toxicita
V štúdiách intravenóznych infúzií sa stanovila znášanlivosť kyseliny zoledrónovej v obličkách
potkanov, ktorým sa podalo 0,6 mg/kg ako 15 minút trvajúca infúzia v 3-dňových intervaloch celkovo šesťkrát (do kumulatívnej dávky, ktorá zodpovedala hladinám AUC predstavujúcim asi 6-násobok terapeutickej expozície u ľudí), zatiaľ čo päť infúzií 0,25 mg/kg trvajúcich 15 minút podaných v intervaloch 2 – 3 týždňov (kumulatívna dávka, ktorá zodpovedala 7-násobku terapeutickej expozície u ľudí) dobre znášali psy. V štúdiách podania ako intravenózny bolus sa dobre znášané dávky znižovali
s predlžujúcim sa trvaním štúdie: počas 4 týždňov dobre znášali potkany 0,2 a psy 0,02 mg/kg denne, ale pri podávaní počas 52 týždňov potkany len 0,01 mg/kg a psy 0,005 mg/kg.
Dlhodobejšie opakované podávanie pri kumulatívnych expozíciách dostatočne prevyšujúcich maximum plánované pre expozíciu u ľudí vyvolalo toxické účinky v iných orgánoch, vrátane
gastrointestinálneho traktu a pečene, a v mieste intravenózneho podania. Klinická významnosť týchto nálezov nie je známa. Najčastejší nález v štúdiách opakovaného podávania predstavovalo zväčšovanie primárnej spongiózy v metafýzach dlhých kostí u rastúcich zvierat pri takmer všetkých dávkach, čo je nález, ktorý je v súlade s farmakologickou antiresorpčnou aktivitou zlúčeniny.
Reprodukčná toxicita
Teratologické štúdie sa vykonali na dvoch živočíšnych druhoch, v oboch prípadoch pri subkutánnom
podaní. Teratogenita sa pozorovala u potkanov pri dávkach ≥ 0,2 mg/kg a prejavila sa vonkajšími, vnútornými a kostrovými malformáciami. Dystokia sa pozorovala pri najnižšej dávke (0,01 mg/kg telesnej hmotnosti) skúšanej u potkanov. Žiadne teratogénne účinky alebo účinky na embryo/fétus sa nepozorovali u králikov, hoci toxicita pre matky bola výrazná pri 0,1 mg/kg následkom znížených hladín vápnika v sére.
Mutagenita a karcinogénny potenciál
Kyselina zoledrónová nebola mutagénna vo vykonaných testoch mutagenity a testy na karcinogenitu
neposkytli žiadne dôkazy o karcinogénnom potenciále.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol Citrát sodný Voda na injekciu
6.2 Inkompatibility
Tento liek nesmie prísť do styku so žiadnymi roztokmi obsahujúcimi vápnik. Zoledronic Acid Hospira
sa nesmie miešať alebo podať intravenózne so žiadnymi inými liekmi.
6.3 Čas použiteľnosti
Neotvorený vak: 2 roky
Po otvorení: 24 hodín pri 2 °C – 8 °C
Z mikrobiologického hľadiska sa má liek použiť okamžite. Ak sa nepoužije okamžite, používateľ zodpovedá za čas do použitia a podmienky pred použitím, čo normálne nemá byť dlhšie ako 24 hodín pri 2 °C – 8 °C.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie. Podmienky na uchovávanie lieku
po otvorení, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Polypropylénové vaky s objemom 100 ml s polypropylénovým skrutkovacím portom s uzáverom s polyestér/polypropylénovým obalom
Zoledronic Acid Hospira sa dodáva v baleniach obsahujúcich 1 vak.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Len na jednorazové použitie.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne. Má sa použiť len číry, nesfarbený roztok bez cudzorodých častíc.
Ak je roztok schladený, nechajte ho pred podaním zohriať na izbovú teplotu. Počas prípravy infúzie sa musia dodržiavať aseptické postupy.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIHospira UK Limited
Queensway
Royal Leamington Spa Warwickshire CV31 3RW Spojené kráľovstvo
8. REGISTRAČNÉ ČÍSLO9 DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10 DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu