
ť ako jednorazový intravenózny roztok osobitnou infúznou súpravou.
Pacienti musia byť trvale dostatočne hydratovaní pred podaním Zoledronic acid Actavis a po ňom.
4.3 Kontraindikácie
· Precitlivenosť na liečivo, iné bisfosfonáty alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
· Dojčenie (pozri časť 4.6)
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
Pred podaním Zoledronic acid Actavis je nutné pacientov vyšetriť, aby sa overilo, či sú dostatočne hydratovaní.
U pacientov s rizikom zlyhania srdca je nutné vyvarovať sa nadbytočnej hydratácie.
Po začatí liečby Zoledronic acid Actavis sa majú starostlivo sledovať bežné metabolické parametre súvisiace s hyperkalciémiou, ako sú hladiny vápnika, fosfátu a horčíka v sére. Ak vznikne hypokalciémia, hypofosfatémia alebo hypomagneziémia, môže byť potrebná krátkodobá suplementárna liečba. Neliečení pacienti s hyperkalciémiou mávajú spravidla určitý stupeň poruchy funkcie obličiek, preto sa má zvážiť starostlivé sledovanie funkcie obličiek.
Iné lieky obsahujúce kyselinu zoledrónovú ako liečivo sú dostupné v indikáciách osteoporózy a liečbe Pagetovej choroby kostí. Pacienti, ktorí sa liečia Zoledronic acid Actavis, sa nemajú súčasne liečiť takýmito liekmi alebo akýmkoľvek iným bisfosfonátom, pretože kombinované účinky týchto látok nie sú známe.
Insuficiencia obličiek
Stav pacientov s TIH a preukázaným zhoršením funkcie obličiek je nutné patrične zhodnotiť a zvážiť,
či prípadná prospešnosť liečby Zoledronic acid Actavis je väčšia ako jej možné riziko.
Pri rozhodovaní o tom, či pacientom s metastázami v kostiach podať preventívnu liečbu proti príhodám súvisiacim so skeletom, treba vziať do úvahy, že účinok liečby nastupuje za 2–3 mesiace.
Kyselina zoledrónová, používaná ako je uvedené v častiach 4.1 a 4.2, súvisela s hláseniami poruchy funkcie obličiek. Medzi faktory, ktoré môžu zvýšiť možnosť zhoršenia funkcie obličiek, patrí dehydratácia, už existujúce poškodenie funkcie obličiek, viaceré liečebné cykly kyselinou zoledrónovou a iných bisfosfonátov, ako aj použitie iných nefrotoxických liekov. Hoci sa podaním kyseliny zoledrónovej v dávke 4 mg počas 15 minút toto riziko zníži, zhoršenie funkcie obličiek sa napriek tomu môže vyskytnúť. Zhoršenie funkcie obličiek, progresia do zlyhania obličiek a dialýzy boli hlásené u pacientov po začiatočnej dávke alebo jednorazovej dávke 4 mg kyseliny zoledrónovej. K zvýšeniu kreatinínu v sére dochádza aj u niektorých pacientov pri chronickom podávaní kyseliny zoledrónovej v odporúčaných dávkach na prevenciu príhod súvisiacich so skeletom, aj keď zriedkavejšie.
Hladiny kreatinínu v sére pacientov sa majú stanoviť pred každou dávkou Zoledronic acid Actavis. Pri začatí liečby pacientov s metastázami v kostiach s miernym až stredne ťažkým poškodením funkcie obličiek sa odporúčajú nižšie dávky kyseliny zoledrónovej. Pacientom, u ktorých sa dokáže zhoršenie
funkcie obličiek počas liečby, sa Zoledronic acid Actavis nemá podať. Zoledronic acid Actavis sa má znovu podať len vtedy, keď sa ich kreatinín v sére vráti do rozmedzia 10% nad východiskovou hodnotou. Liečba Zoledronic acid Actavis sa má znovu začať s rovnakou dávkou, aká sa podávala pred prerušením liečby.
Vzhľadom na prípadný účinok kyseliny zoledrónovej na funkciu obličiek, nedostatok klinických údajov o bezpečnosti u pacientov s ťažkým poškodením funkcie obličiek na začiatku liečby
(v klinických skúšaniach definované ako kreatinín v sére ³ 400 mmol/l alebo ³ 4,5 mg/dl u pacientov s TIH a ³ 265 mmol/l alebo ³ 3,0 mg/dl u pacientov s rakovinou a metastázami v kostiach) a len obmedzené farmakokinetické údaje u pacientov s ťažkým poškodením funkcie obličiek na začiatku liečby (klírens kreatinínu < 30 ml/min), použitie Zoledronic acid Actavis u pacientov s ťažkým poškodením funkcie obličiek sa neodporúča.
Insuficiencia pečene
Pretože sú dostupné len obmedzené klinické údaje o pacientoch so závažnou insuficienciou pečene, nemožno dať žiadne osobitné odporúčania pre túto skupinu pacientov.
Osteonekróza čeľuste
Osteonekróza čeľuste (ONJ, osteonecrosis of the jaw) sa zaznamenala u pacientov, prevažne u tých s rakovinou, ktorí dostávali lieky inhibujúce resorpciu kosti, ako je kyselina zoledrónová. Mnohí
z týchto pacientov dostávali aj chemoterapiu a kortikosteroidy. Väčšina hlásených prípadov súvisela s dentálnymi zákrokmi, ako je extrakcia zuba. Mnohí mali príznaky lokálnej infekcie vrátane osteomyelitídy.
Pri hodnotení rizika vzniku ONJ u individuálneho pacienta sa majú vziať do úvahy nasledujúce rizikové faktory:
- Účinnosť bisfosfonátu (vyššie riziko pri vysoko účinných látkach), cesta podania (vyššie riziko pri parenterálnom podaní) a kumulatívna dávka
- Rakovina, chemoterapia (pozri časť 4.5), rádioterapia, kortikosteroidy, fajčenie
- Choroba zubov v anamnéze, nedostatočná hygiena ústnej dutiny, choroba periodontu, invazívne dentálne zákroky a nesprávne priliehajúce zubné protézy
Prehliadka chrupu s náležitými preventívnymi dentálnymi zákrokmi sa má uvážiť pred liečbou bisfosfonátmi u pacientov so sprievodnými rizikovými faktormi.
Ak je to možné, títo pacienti sa majú počas liečby vyvarovať invazívnych dentálnych zákrokov. Dentálny chirurgický zákrok môže zhoršiť stav pacientov, u ktorých počas liečby vznikne osteonekróza čeľuste. Nie sú dostupné údaje, ktoré by ukázali, či prerušenie liečby bisfosfonátom znižuje riziko osteonekrózy čeľuste u pacientov, ktorí potrebujú dentálne zákroky. Klinický úsudok ošetrujúceho lekára založený na vyhodnotení individuálneho pomeru prospešnosti a rizika má byť určujúci pri plánovaní liečby každého pacienta.
Bolesťsvalov a kostí
Po uvedení na trh bola hlásená silná bolesť kostí, kĺbov a/alebo svalov, príležitostne znemožňujúca pohyblivosť u pacientov používajúcich kyselinu zoledrónovú. Takéto hlásenia však neboli časté. Čas do nástupu symptómov sa rôznil od jedného dňa do niekoľkých mesiacov od začatia liečby. U väčšiny pacientov sa symptómy zmiernili po skončení liečby. Podsúbor pacientov mal recidívu symptómov, keď sa im znovu podala kyselina zoledrónová alebo iný bisfosfonát.
Atypické zlomeniny stehennej kosti
Pri liečbe bisfosfonátmi boli hlásené atypické subtrochanterické a diafyzárne zlomeniny stehennej kosti, predovšetkým u pacientov, ktorí sa dlhodobo liečili na osteoporózu. Tieto priečne alebo krátke šikmé zlomeniny môžu vzniknúť kdekoľvek pozdĺž stehennej kosti, tesne pod malým trochanterom až po suprakondylickú časť. K týmto zlomeninám dochádza po minimálnej alebo žiadnej traume
a u niektorých pacientov sa niekoľko týždňov až mesiacov pred vznikom úplnej zlomeniny stehennej kosti vyskytne bolesť v stehne alebo slabine, pri zobrazovacom vyšetrení často spojená
s charakteristikami únavovej zlomeniny. Zlomeniny sú často bilaterálne, preto sa má u pacientov
liečených bisfosfonátmi, ktorí utrpeli zlomeninu stehennej kosti, vyšetriť aj kontralaterálna stehenná kosť. Hlásené bolo tiež nedostatočné hojenie týchto zlomenín. U pacientov s podozrením na atypickú zlomeninu stehennej kosti sa má na základe individuálneho zhodnotenia prínosu a rizika pre pacienta zvážiť prerušenie liečby bisfosfonátmi.
Počas liečby bisfosfonátmi treba pacientov poučiť, aby hlásili akúkoľvek bolesť v stehne, bedre alebo slabine a každého pacienta s takýmito príznakmi je potrebné vyšetriť na prítomnosť neúplnej zlomeniny stehennej kosti.
Hypokalciémia
U pacientov liečených Zoledronic acid Actavis sa zaznamenala hypokalciémia. Popri prípadoch závažnej hypokalciémie sa sekundárne zaznamenali srdcové arytmie a neurologické nežiaduce udalosti (vrátane záchvatov, strnulosti a tetanie). Zaznamenali sa prípady závažnej hypokalciémie vyžadujúcej hospitalizáciu. V niektorých prípadoch sa môže vyskytnúť hypokalciémia ohrozujúca život (pozri časť 4.8).
Zoledronic acid Actavis obsahuje sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t.j. je v podstate „bez sodíka“.
4.5 Liekové a iné interakcie
V klinických skúšaniach sa kyselina zoledrónová, používaná ako je uvedené v častiach 4.1 a 4.2, podávala súčasne s bežne používanými protinádorovými liekmi, diuretikami, antibiotikami a analgetikami bez toho, aby sa vyskytli klinicky zjavné interakcie. Kyselina zoledrónová sa in vitro neviaže vo významnej miere na bielkoviny plazmy a neinhibuje ľudské enzýmy P450 (pozri časť 5.2), neuskutočnili sa žiadne formálne klinické interakčné štúdie.
Opatrnosť sa odporúča pri súčasnom podávaní bisfosfonátov s aminoglykozidmi, pretože obidve skupiny liečiv môžu mať aditívny účinok, čo má za následok nižšiu hladinu vápnika v sére na dlhšiu dobu, ako sa požaduje.
Pri použití Zoledronic acid Actavis súčasne s inými potenciálne nefrotoxickými liekmi je nutná opatrnosť. Počas liečby sa musí venovať pozornosť aj možnému vzniku hypomagneziémie.
U pacientov s mnohopočetným myelómom sa môže zvýšiť riziko poruchy funkcie obličiek pri intravenóznom podaní Zoledronic acid Actavis v kombinácii s talidomidom.
Opatrnosť sa odporúča pri podávaní Zoledronic acid Actavis súbežne s liekmi s antiangiogénnym účinkom z dôvodu hlásení o zvýšenej incidencii ONJ u pacientov liečených súbežne týmito liekmi.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití kyseliny zoledrónovej u gravidných žien. Štúdie reprodukčnej toxicity kyseliny zoledrónovej na zvieratách preukázali reprodukčnú toxicitu (pozri časť
5.3). Nie je známe potenciálne riziko u ľudí. Zoledronic acid Actavis sa nemá používať počas gravidity.
Laktácia
Nie je známe, či sa kyselina zoledrónová vylučuje do ľudského mlieka. Zoledronic acid Actavis je kontraindikovaná u dojčiacich žien (pozri časť 4.3).
Fertilita
Možné nežiaduce účinky kyseliny zoledrónovej na fertilitu generácie rodičov a F1 sa vyhodnotili u potkanov. Výsledkom boli vystupňované farmakologické účinky, pri ktorých sa predpokladá súvislosť s inhibíciou metabolizácie kostrového vápnika vyvolanou touto látkou, ktorá spôsobila hypokalciémiu v období pôrodu, čo je skupinový účinok bisfosfonátov, dystokiu a predčasné
ukončenie štúdie. Tieto výsledky tak znemožnili stanovenie definitívneho účinku kyseliny zoledrónovej na fertilitu ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNežiaduce reakcie, ako sú závraty a somnolencia, môžu mať vplyv na schopnosť viesť vozidlá a obsluhovať stroje, preto je potrebná opatrnosť, keď sa Zoledronic acid Actavis použije v čase vedenia vozidla a obsluhy strojov.
4.8 Nežiaduce účinkySúhrn profilu bezpečnostiDo troch dní od podania kyseliny zoledrónovej, ako je uvedené v častiach 4.1 a 4.1, bola často hlásená reakcia akútnej fázy so symptómami, ktoré zahŕňali bolesť kostí, horúčku, únavu, bolesť kĺbov, bolesť svalov, zimnicu a artritídu s následným opuchom kĺbov; tieto symptómy obvykle ustúpia počas niekoľkých dní (pozri opis vybraných nežiaducich reakcií).
Významné identifikované riziká pri kyseline zoledrónovej v schválených indikáciách sú nasledovné: poškodenie funkcie obličiek, osteonekróza čeľuste, reakcia akútnej fázy, hypokalciémia, nežiaduce udalosti súvisiace s očami, fibrilácia predsiení, anafylaxia. Frekvencia každého z týchto identifikovaných rizík je uvedená v Tabuľke 1.
Tabuľkový zoznam nežiaducich reakciíNasledujúce nežiaduce reakcie uvedené v Tabuľke 1 sa súhrnne zaznamenali po prevažne chronickej liečbe 4 mg kyseliny zoledrónovej v klinických skúšaniach a v hláseniach po uvedení lieku na trh:
Tabuľka 1Nežiaduce reakcie sú zoradené podľa frekvencie, najčastejšie ako prvé, pričom frekvencia je určená nasledovne: veľmi časté (³1/10), časté (³1/100 až <1/10), menej časté (³1/1 000 až <1/100), zriedkavé (³1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov).
Poruchy krvi a lymfatického systému
Časté: Anémia
Menej časté: Trombocytopénia, leukopénia
Zriedkavé: Pancytopénia
|
Poruchy imunitného systému
Menej časté: Reakcie z precitlivenosti
Zriedkavé: Angioneurotický edém
|
Psychické poruchy
Menej časté: Úzkosť, poruchy spánku
Zriedkavé: Zmätenosť
|
Poruchy nervového systému
Časté: Bolesť hlavy
Menej časté: Závraty, parestézie, poruchy chuti, hypestézie, hyperestézie, tremor, somnolencia
Veľmi zriedkavé: Záchvaty, strnulosť a tetania (sekundárne pri hypokalciémii)
|
Poruchy oka
Časté: Konjunktivitída
Menej časté: Neostré videnie, skleritída a zápal orbity
Veľmi zriedkavé: Uveitída, episkleritída
|
Poruchy srdca a srdcovej činnosti
Menej časté: Hypertenzia, hypotenzia, fibrilácia predsiení, hypotenzia spôsobujúca synkopu alebo obehový kolaps
Zriedkavé: Bradykardia
|
Veľmi zriedkavé: Srdcová arytmia (sekundárne pri hypokalciémii)
|
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté: Dyspnoe, kašeľ, bronchokonstrikcia
Zriedkavé: Intersticiálna choroba pľúc
|
Poruchy gastrointestinálneho traktu
Časté: Nauzea, vracanie, anorexia
Menej časté: Hnačka, zápcha, bolesť brucha, dyspepsia, stomatitída, suchosť v ústach
|
Poruchy kože a podkožného tkaniva
Menej časté: Svrbenie, exantém (vrátane erytematózneho a makulárneho exantému), zvýšené potenie
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté: Bolesť kostí, bolesť svalov, bolesť kĺbov, generalizovaná bolesť
Menej časté: Svalové kŕče, osteonekróza čeľuste*
|
Poruchy obličiek a močových ciest
Časté: Zhoršenie funkcie obličiek
Menej časté: Akútne zlyhanie obličiek, hematúria, proteinúria
|
Celkové poruchy a reakcie v mieste podania
Časté: Horúčka, syndróm podobný chrípke (zahŕňajúci únavu, zimnicu, celkový pocit nevoľnosti a návaly tepla)
Menej časté: Asténia, periférny edém, reakcie v mieste podania (zahŕňajúce bolesť, podráždenie,
opuch a induráciu), bolesť na hrudi, zvýšenie hmotnosti, anafylaktická reakcia/šok, urtikária
Zriedkavé: Artritída a opuch kĺbov ako symptómy reakcie akútnej fázy
|
Laboratórne a funkčné vyšetrenia
Veľmi časté: Hypofosfatémia
Časté: Zvýšenie kreatinínu a močoviny v krvi, hypokalciémia
Menej časté: Hypomagneziémia, hypokaliémia
Zriedkavé: Hyperkaliémia, hypernatriémia
|
Opis vybraných nežiaducich reakcií
Poškodenie funkcie obličiek
Kyselina zoledrónová, používaná ako je uvedené v častiach 4.1 a4.2, sa dávala do súvislosti
s hláseniami o dysfunkcii obličiek. V súhrnnej analýze údajov o bezpečnosti kyseliny zoledrónovej v registrovaných skúšaniach prevencie skeletálnych príhod u pacientov s pokročilými malignitami vrátane kostí, bola frekvencia suspektných nežiaducich príhod renálneho poškodenia vo vzťahu ku kyseline zoledrónovej (nežiaduce reakcie) nasledovná: viacnásobný myelóm (3,2%), karcinóm prostaty (3,1%), karcinóm prsníka (4,3%), nádory pľúc a iné solidné nádory (3,2%). Medzi faktory, ktoré môžu zvýšiť možnosť zhoršenia funkcie obličiek, patrí dehydratácia, už prítomné poškodenie funkcie obličiek, viaceré cykly kyseliny zoledrónovej alebo iných bisfosfonátov, ako aj súbežné použitie nefrotoxických liekov alebo podanie infúzie za kratší čas, než sa v súčasnosti odporúča.
Zhoršenie funkcie obličiek progredujúce do zlyhania obličiek a dialýzy sa zaznamenalo u pacientov po úvodnej dávke alebo po jedinej dávke 4 mg kyseliny zoledrónovej (pozri časť 4.4).
Osteonekróza čeľustePrevažne u pacientov s rakovinou liečených liekmi inhibujúcimi resorpciu kosti, ako je kyselina zoledrónová, sa zaznamenali prípady osteonekrózy (primárne čeľuste). Mnohí z týchto pacientov mali príznaky lokálnej infekcie vrátane osteomyelitídy a väčšina hlásení sa týka pacientov s rakovinou po
extrakcii zubov alebo iných dentálnych chirurgických zákrokoch. Osteonekróza čeľuste má viaceré
zdokumentované rizikové faktory vrátane diagnózy rakoviny, súčasne podanej liečby (napr. chemoterapie, rádioterapie, kortikosteroidov) a sprievodných ochorení (napr. anémie, koagulopatií, infekcie, ochorenia ústnej dutiny). Hoci sa nestanovila príčinná súvislosť, odporúča sa vyvarovať sa dentálnych chirurgických zákrokov, pretože sa môže predĺžiť obdobie zotavenia (pozri časť 4.4).
Fibrilácia predsiení
V jednom randomizovanom, dvojito slepom, kontrolovanom klinickom skúšaní trvajúcom 3 roky, v ktorom sa vyhodnotila účinnosť a bezpečnosť 5 mg kyseliny zoledrónovej podávanej raz ročne oproti placebu v liečbe postmenopauzálnej osteoporózy (PMO), bola celková incidencia fibrilácie predsiení
2,5% (96 z 3 862) u pacientok, ktoré dostávali 5 mg kyseliny zoledrónovej, a 1,9% (75 z 3 852)
u pacientok, ktoré dostávali placebo. Výskyt fibrilácie predsiení ako závažnej nežiaducej udalosti bol
1,3% (51 z 3 862) u pacientok, ktoré dostávali 5 mg kyseliny zoledrónovej, a 0,6% (22 z 3 852) u pacientok, ktoré dostávali placebo. Nerovnováha pozorovaná v tomto klinickom skúšaní sa nepozorovala v iných skúšaniach s kyselinou zoledrónovou, vrátane skúšaní kyseliny zoledrónovej
4 mg každé 3-4 týždne u onkologických pacientov. Mechanizmus, ktorý spôsobil zvýšenú incidenciu fibrilácie predsiení v tomto jedinom klinickom skúšaní, nie je známy.
Reakcia akútnej fázy
Túto nežiaducu reakciu na liek tvorí zoskupenie symptómov, ku ktorým patrí horúčka, bolesť svalov, bolesť hlavy, bolesť končatín, nauzea, vracanie, hnačka, bolesť kĺbov a artritída s následným opuchom
kĺbov. Čas ich nástupu je ≤ 3 dni po infúziikyseliny zoledrónovej a táto reakcia sa tiež označuje ako symptómy „podobné chrípke“ alebo „po podaní“.
Atypické zlomeniny stehennej kosti
Po uvedení lieku na trh boli hlásené nasledovné reakcie (frekvencia zriedkavé):
Atypické subtrochanterické a diafyzárne zlomeniny stehennej kosti (skupinová nežiaduca reakcia na bisfosfonáty).
Nežiaduce reakcie na liek spojené s hypokalciémiou
Hypokalciémia je závažné riziko identifikované pri používaní Zoledronic acid Actavis v rámci schválených indikácií. Na základe zhodnotenia prípadov z klinických skúšaní po uvedení lieku na trh
existuje dostatok dôkazov na preukázanie súvislosti medzi liečbou Zoledronic acid Actavis, hlásenými prípadmi hypokalciémie a sekundárnym vznikom srdcovej arytmie. Navyše existuje dôkaz o súvislosti medzi hypokalciémiou a sekundárnymi neurologickými udalosťami hlásenými v týchto prípadoch vrátane záchvatov, strnulosti a tetanie (pozri časť 4.4).
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v Prílohe V.
4.9 Predávkovanie
Klinické skúsenosti s akútnym predávkovaním kyselinou zoledrónovou sú obmedzené. Zaznamenali sa aj omylom podané dávky až do 48 mg kyseliny zoledrónovej. Pacientov, ktorí dostali vyššie ako odporúčané dávky (pozri časť 4.2), je potrebné starostlivo sledovať, pretože sa pozorovalo poškodenie funkcie obličiek (vrátane zlyhania obličiek) a poruchy sérových elektrolytov (vrátane vápnika, fosforu a horčíka). Ak vznikne hypokalciémia, majú sa podať infúzie glukonanu vápenatého, ak je to klinicky indikované.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Liečivá na liečbu chorôb kostí, bisfosfonáty, ATC kód: M05BA08
Kyselina zoledrónová patrí do skupiny bisfosfonátov a pôsobí primárne na kosti. Je to inhibítor resorpcie kostí, spôsobenej osteoklastami.
Selektívny účinok bisfosfonátov na kosti podmieňuje ich vysoká afinita k mineralizovanej kosti, ale presný mechanizmus na úrovni molekúl, ktorý vedie k inhibícii aktivity osteoklastov, zatiaľ nie je jasný. V dlhodobých štúdiách na zvieratách kyselina zoledrónová tlmí resorpciu kosti bez nepriaznivého ovplyvnenia tvorby, mineralizácie alebo mechanických vlastností kosti.
Kyselina zoledrónová je nielen účinným inhibítorom resorpcie kostí, ale má aj viaceré protinádorové vlastnosti, ktoré by mohli prispievať k jej celkovej účinnosti pri liečbe metastatického ochorenia kostí. V predklinických skúšaniach sa ukázali nasledujúce vlastnosti:
-
In vivo: inhibícia resorpcie kostí osteoklastami, ktorá mení mikroprostredie kostnej drene a robí ho menej priaznivým pre rast nádorových buniek, antiangiogenetický účinok a analgetický účinok.
-
In vitro: inhibícia proliferácie osteoblastov, priamy cytostatický a proapoptotický účinok na nádorové bunky, synergický cytostatický účinok s inými protinádorovými liečivami, antiadhezívny a antiinvazívny účinok.
Výsledky klinických skúšaní pri prevencii príhod súvisiacich so skeletom u pacientov s postihnutímkostí pri pokročilých malignitáchPrvé randomizované, dvojito slepé klinické skúšanie kontrolované placebom porovnávalo 4 mg kyseliny zoledrónovej s placebom pri prevencii príhod súvisiacich so skeletom (SRE) u pacientov s rakovinou prostaty. Kyselina zoledrónová v dávke 4 mg významne znížila podiel pacientov, u ktorých
sa vyskytla aspoň jedna SRE, predĺžila medián času do prvej SRE o > 5 mesiacov a znížila výskyt príhod pripadajúcich na pacienta za rok - mieru morbidity skeletu. Analýza viacpočetných príhod
ukázala zníženie rizika vzniku SRE v skupine 4 mg kyseliny zoledrónovej o 36% v porovnaní s placebom. Pacienti, ktorí dostávali 4 mg kyseliny zoledrónovej, hlásili menšie stupňovanie bolesti ako pacienti, ktorí dostávali placebo, pričom rozdiel dosiahol štatistickú významnosť v 3., 9., 21., a
24. mesiaci. Menej pacientov liečených 4 mg kyseliny zoledrónovej utrpelo patologické zlomeniny. Účinky liečby boli menej výrazné u pacientov s blastickými léziami. Výsledky účinnosti sú uvedené
v Tabuľke 2.
V druhom klinickom skúšaní, do ktorého boli zahrnuté solídne nádory okrem rakoviny prsníka alebo prostaty, kyselina zoledrónová v dávke 4 mg významne znížila podiel pacientov s SRE, predĺžila medián času do prvej SRE o > 2 mesiace a znížila mieru morbidity skeletu. Analýza viacpočetných príhod ukázala zníženie rizika vzniku SRE v skupine 4 mg kyseliny zoledrónovej o 30,7% v porovnaní s placebom. Výsledky účinnosti sú uvedené v Tabuľke 3.
Tabuľka 2: Výsledky účinnosti (pacienti s rakovinou prostaty liečení hormónmi)
| Akákoľvek SRE (+ TIH)
| Zlomeniny*
| Rádioterapia kostí
|
| kyselina
zoledrónová
4 mg
| Placebo
| kyselina
zoledrónová
4 mg
| Placebo
| kyselina
zoledrónová
4 mg
| Placebo
|
N
| 214
| 208
| 214
| 208
| 214
| 208
|
Podiel pacientov s
SRE (%)
| 38
| 49
| 17
| 25
| 26
| 33
|
Hodnota p
| 0,028
| 0,052
| 0,119
|
Medián času do
SRE (dni)
| 488
| 321
| NR
| NR
| NR
| 640
|
Hodnota p
|
0,009
|
0,020
|
0,055
|
Miera morbidity
skeletu
|
0,77
|
1,47
|
0,20
|
0,45
|
0,42
|
0,89
|
Hodnota p
|
0,005
|
0,023
|
0,060
|
Zníženie rizika utrpieť viacpočetné
príhody** (%)
|
36
|
-
|
NA
|
NA
|
NA
|
NA
|
Hodnota p
|
0,002
|
NA
|
NA
|
* Zahŕňa zlomeniny stavcov a iné zlomeniny
** Zohľadňuje všetky príhody súvisiace so skeletom, celkový počet ako aj čas do každej príhody počas klinického skúšania
NR Nedosiahol sa
NA Nemožno použiť
Tabuľka 3: Výsledky účinnosti (solídne nádory okrem rakoviny prsníka alebo prostaty)
| Akákoľvek SRE (+ TIH)
| Zlomeniny*
| Rádioterapia kostí
|
| kyselina
zoledrónová
4 mg
| Placebo
| kyselina
zoledrónová
4 mg
| Placebo
| kyselina
zoledrónová
4 mg
| Placebo
|
N
| 257
| 250
| 257
| 250
| 257
| 250
|
Podiel pacientov s
SRE (%)
| 39
| 48
| 16
| 22
| 29
| 34
|
Hodnota p
| 0,039
| 0,064
| 0,173
|
Medián času do
SRE (dni)
| 236
| 155
| NR
| NR
| 424
| 307
|
Hodnota p
| 0,009
| 0,020
| 0,079
|
Miera morbidity
skeletu
| 1,74
| 2,71
| 0,39
| 0,63
| 1,24
| 1,89
|
Hodnota p
| 0,012
| 0,066
| 0,099
|
Zníženie rizika
utrpieť viacpočetné príhody** (%)
| 30,7
| -
| NA
| NA
| NA
| NA
|
Hodnota p
| 0,003
| NA
| NA
|
* Zahŕňa zlomeniny stavcov a iné zlomeniny
** Zohľadňuje všetky príhody súvisiace so skeletom, celkový počet ako aj čas do každej príhody počas klinického skúšania
NR Nedosiahol sa
NA Nemožno použiť
V treťom randomizovanom, dvojito slepom klinickom skúšaní fázy III sa porovnávala kyselina zoledrónová 4 mg a pamidronát 90 mg každé 3 až 4 týždne u pacientov s mnohopočetným myelómom alebo rakovinou prsníka a aspoň jednou léziou kosti. Výsledky ukázali, že kyselina zoledrónová
v dávke 4 mg vykazuje porovnateľnú účinnosť s 90 mg pamidronátu pri prevencii SRE. Analýza viacpočetných príhod ukázala významné zníženie rizika vzniku SRE o 16% u pacientov liečených
4 mg kyseliny zoledrónovej v porovnaní s pacientmi, ktorí dostávali pamidronát. Výsledky účinnosti sú uvedené v Tabuľke 4.
Tabuľka 4: Výsledky účinnosti (pacienti s mnohopočetným myelómom a rakovinou prsníka)
| Akákoľvek SRE (+ TIH)
| Zlomeniny*
| Rádioterapia kostí
|
| kyselina zoledrónová
4 mg
| Pam
90 mg
| kyselina zoledrónová
4 mg
| Pam
90 mg
| kyselina zoledrónová
4 mg
| Pam
90 mg
|
| | | | | | |
N
|
561
|
555
|
561
|
555
|
561
|
555
|
Podiel pacientov s
SRE (%)
|
48
|
52
|
37
|
39
|
19
|
24
|
Hodnota p
|
0,198
|
0,653
|
0,037
|
Medián času do SRE (dni)
|
376
|
356
|
NR
|
714
|
NR
|
NR
|
Hodnota p
|
0,151
|
0,672
|
0,026
|
Miera morbidity skeletu
|
1,04
|
1,39
|
0,53
|
0,60
|
0,47
|
0,71
|
Hodnota p
|
0,084
|
0,614
|
0,015
|
Zníženie rizika utrpieť viacpočetné
príhody** (%)
|
16
|
-
|
NA
|
NA
|
NA
|
NA
|
Hodnota p
|
0,030
|
NA
|
NA
|
* Zahŕňa zlomeniny stavcov a iné zlomeniny
** Zohľadňuje všetky príhody súvisiace so skeletom, celkový počet ako aj čas do každej príhody počas klinického skúšania
NR Nedosiahol sa
NA Nemožno použiť
Kyselina zoledrónová v dávke 4 mg sa skúmala aj v dvojito slepom, randomizovanom klinickom skúšaní kontrolovanom placebom u 228 pacientok s preukázanými metastázami do kostí pri rakovine prsníka, v ktorom sa vyhodnotil účinok 4 mg kyseliny zoledrónovej na pomer výskytu príhod súvisiacich so skeletom (SRE), vypočítaný ako celkový počet SRE príhod (okrem hyperkalciémie a po úprave vzhľadom na predchádzajúcu zlomeninu), delený obdobím celkového rizika. Pacientky dostávali buď 4 mg kyseliny zoledrónovej, alebo placebo každé štyri týždne počas jedného roka. Pacientky boli rovnomerne rozdelené do skupín liečby kyselinou zoledrónovou a placebom.
Výskyt SRE (príhody/osoba za rok) bol 0,628 pri kyseline zoledrónovej a 1,096 pri placebe. Podiel pacientok s aspoň jednou SRE (okrem hyperkalciémie) bol 29,8% v skupine liečenej kyselinou zoledrónovou oproti 49,6% v skupine placeba (p=0,003). Medián času do vzniku prvej SRE sa
v ramene liečby kyselinou zoledrónovou na konci klinického skúšania nedosiahol a v porovnaní
s placebom bol významne dlhší (p=0,007). V porovnaní s placebom kyselina zoledrónová v dávke
4 mg znížila riziko SRE o 41% v analýze viacpočetných príhod (pomer rizika=0,59, p=0,019).
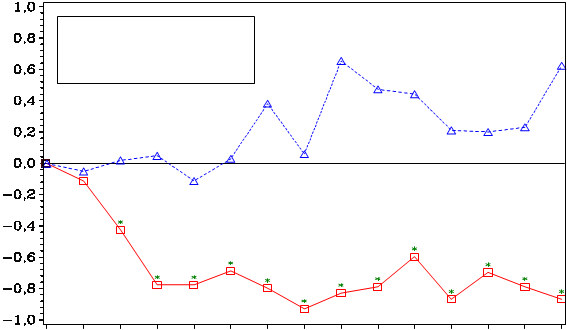
V skupine liečenej kyselinou zoledrónovou sa v porovnaní s placebom pozorovalo štatisticky významné zlepšenie pri hodnotení bolesti (pri použití Brief Pain Inventory, BPI) po 4 týždňoch
a v každom neskoršom čase počas klinického skúšania (Obrázok 1). Hodnotenie bolesti pri kyseline zoledrónovej bolo trvale pod východiskovou hodnotou a zmiernenie bolesti sprevádzala tendencia
k poklesu analgetického skóre.
'
 Obrázok 1:Priemerné zmeny skóre podľa BPI oproti východiskovej hodnote. Vyznačené sú štatisticky významné rozdiely (*p<0,05) pri porovnaní spôsobov liečby (4 mg kyseliny zoledrónovej oproti placebu)
Obrázok 1:Priemerné zmeny skóre podľa BPI oproti východiskovej hodnote. Vyznačené sú štatisticky významné rozdiely (*p<0,05) pri porovnaní spôsobov liečby (4 mg kyseliny zoledrónovej oproti placebu)
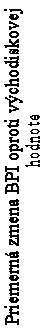 ∆
∆ Placebo


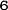


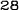
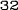
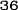

¨ Kyselina zoledrónová
Trvanie klinického skúšania (týždne)
Výsledky klinických skúšaní pri liečbe TIHKlinické skúšania pri hyperkalciémii vyvolanej nádorom (TIH) ukázali, že pre účinok kyseliny zoledrónovej je charakteristický pokles vápnika v sére a vylučovania vápnika močom. Vo fáze I sa v klinických skúšaniach na zistenie dávky u pacientov s miernou až stredne ťažkou hyperkalciémiou vyvolanou nádorom (TIH) skúšali účinné dávky v rozmedzí približne 1,2–2,5 mg.
Na stanovenie účinkov 4 mg kyseliny zoledrónovej v porovnaní s 90 mg pamidronátu sa vo vopred plánovej analýze zlúčili výsledky dvoch pilotných multicentrických skúšaní s pacientmi s TIH. Normalizácia korigovaného vápnika v sére bola rýchlejšia na 4. deň pri 8 mg kyseliny zoledrónovej a na 7. deň pri 4 mg a 8 mg kyseliny zoledrónovej. Pozorovala sa nasledujúca odpoveď na liečbu.
Tabuľka 5: Podiel pacientov s úplnou odpoveďou na liečbu podľa dní v zlúčených klinických skúšaniach TIH
| 4. deň
| 7. deň
| 10. deň
|
Kyselina zoledrónová 4 mg
(N=86)
| 45,3% (p=0,104)
| 82,6% (p=0,005)*
| 88,4% (p=0,002)*
|
Kyselina zoledrónová 8 mg
(N=90)
| 55,6% (p=0,021)*
| 83,3% (p=0,010)*
| 86,7% (p=0,015)*
|
Pamidronát 90 mg (N=99)
| 33,3%
| 63,6%
| 69,7%
|
*Hodnoty p v porovnaní s pamidronátom
|
Medián času do dosiahnutia normokalciémie bol 4 dni. Medián času do relapsu (opätovné stúpnutie
sérového vápnika korigovaného podľa albumínu na ³ 2,9 mmol/l) bol 30 až 40 dní u pacientov liečených kyselinou zoledrónovou oproti 17 dňom u pacientov liečených 90 mg pamidronátu
(hodnoty p: 0,001 pre 4 mg a 0,007 pre 8 mg kyseliny zoledrónovej). Medzi oboma dávkami kyseliny zoledrónovej neboli štatisticky významné rozdiely.
V klinických skúšaniach bolo 69 pacientov s relapsom alebo bez odpovede na začiatočnú liečbu (kyselina zoledrónová 4 mg, 8 mg alebo pamidronát 90 mg) opäť liečených 8 mg kyseliny zoledrónovej. Podiel takýchto pacientov, u ktorých sa dosiahla odpoveď, bol asi 52%. Pretože títo
pacienti boli liečení len dávkou 8 mg, nie sú údaje, ktoré by umožnili porovnanie s dávkou 4 mg kyseliny zoledrónovej.
V klinických skúšaniach s pacientmi s hyperkalciémiou vyvolanou nádorom (TIH) bol celkový profil bezpečnosti u všetkých troch skupín liečby (kyselina zoledrónová 4 mg a 8 mg a pamidronát 90 mg) podobný čo do typu a závažnosti.
Pediatrická populáciaVýsledky klinických skúšaní v liečbe závažnej osteogenesis imperfecta u pediatrických pacientov voveku od 1 do 17 rokovÚčinky intravenózne podávanej kyseliny zoledrónovej v liečbe pediatrických pacientov (vo veku od 1
do 17 rokov) so závažnou osteogenesis imperfecta (typy I, III a IV) sa porovnali s intravenózne podávaným pamidronátom v jednej medzinárodnej, multicentrickej, randomizovanej, otvorenej štúdii so 74 a 76 pacientmi v uvedených skupinách liečby. Liečba v štúdii trvala 12 mesiacov a predchádzalo jej 4- až 9-týždňové obdobie skríningu, v ktorom sa počas najmenej 2 týždňov užívali doplnky vitamínu D a elementárneho vápnika. V klinickom programe pacienti vo veku od 1 do < 3 roky dostávali 0,025 mg/kg kyseliny zoledrónovej (až do najvyššej jednorazovej dávky 0,35 mg) každé
3 mesiace a pacienti vo veku od 3 do 17 rokov dostávali 0,05 mg/kg kyseliny zoledrónovej (až do najvyššej jednorazovej dávky 0,83 mg) každé 3 mesiace. Štúdia s extenziou sa vykonala na preskúmanie dlhodobej celkovej bezpečnosti a bezpečnosti pre obličky pri podávaní kyseliny zoledrónovej raz za rok alebo dvakrát za rok počas 12 mesiacov liečby v extenzii u detí, ktoré
v základnej štúdii ukončili jeden rok liečby buď kyselinou zoledrónovou, alebo pamidronátom.
Primárnym koncovým ukazovateľom v tejto štúdii bola percentuálna zmena minerálnej denzity kostí (BMD) v lumbálnej chrbtici po 12 mesiacoch liečby oproti východiskovým hodnotám. Odhadované účinky liečby na BMD boli podobné, ale usporiadanie klinického skúšania nepostačovalo na preukázanie noninferiority účinnosti kyseliny zoledrónovej. Najmä účinnosť na incidenciu zlomenín alebo bolesť sa jednoznačne nepreukázala. Zlomeniny dlhých kostí dolných končatín boli hlásené ako nežiaduce udalosti u približne 24% (femur) a 14% (tíbia) pacientov so závažnou osteogenesis imperfecta liečených kyselinou zoledrónovou oproti 12% a 5% pacientov liečených pamidronátom, bez ohľadu na typ ochorenia a kauzalitu, ale celková incidencia zlomenín bola porovnateľná
u pacientov liečených kyselinou zoledrónovou a pamidronátom: 43% (32/74) oproti 41% (31/76). Interpretáciu rizika zlomenín komplikuje skutočnosť, že zlomeniny sú ako súčasť priebehu ochorenia častou udalosťou u pacientov so závažnou osteogenesis imperfecta.
Typ nežiaducich reakcií, ktoré sa pozorovali u tejto populácie, bol podobný, ako sa predtým zaznamenal u dospelých s pokročilými malignitami s postihnutím kosti (pozri časť 4.8). Nežiaduce reakcie usporiadané podľa frekvencie sú uvedené v Tabuľke 6. Použila sa nasledujúca obvyklá klasifikácia: veľmi časté (³1/10), časté (³1/100 až <1/10), menej časté (³1/1 000 až <1/100), zriedkavé (³1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov).
Tabuľka 6: Nežiaduce reakcie pozorované u pediatrických pacientov so závažnou osteogenesis imperfecta1
Poruchy nervového systému
Časté: Bolesť hlavy
|
Poruchy srdca a srdcovej činnosti
Časté: Tachykardia
|
Poruchy dýchacej sústavy, hrudníka a mediastína
Časté: Nazofaryngitída
|
Poruchy gastrointestinálneho traktu
Veľmi časté: Vracanie, nauzea
Časté: Bolesť brucha
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté: Bolesť končatín, bolesť kĺbov, bolesť svalov a kostí
|
Celkové poruchy a reakcie v mieste podania
|

Veľmi časté: Pyrexia, únava
Časté: Reakcia akútnej fázy, bolesť
Laboratórne a funkčné vyšetreniaVeľmi časté: Hypokalciémia
Časté: Hypofosfatémia
1 Nežiaduce udalosti vyskytujúce sa s frekvenciou < 5% boli medicínsky vyhodnotené a ukázalo sa, že tieto prípady zodpovedajú overenému profilu bezpečnosti kyseliny zoledrónovej, ako je uvedené
v častiach 4.1 a 4.2 (pozri časť 4.8).
U pediatrických pacientov so závažnou osteogenesis imperfecta sa zdá, že kyselina zoledrónová je v porovnaní s pamidronátom spojená s výraznejším rizikom reakcie akútnej fázy, hypokalciémie
a nevysvetlenej tachykardie, ale tieto rozdiely sa znižovali pri následných infúziách.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s referenčným liekom obsahujúcim kyselinu zoledrónovú vo všetkých vekových podskupinách pediatrickej populácie v liečbe hyperkalciémie vyvolanej nádorom a v prevencii príhod súvisiacich so skeletom u pacientov
s postihnutím kostí pri pokročilých malignitách (informácie o použití v pediatrickej populácii, pozri
časť 4.2).
5.2 Farmakokinetické vlastnostiPri jednorazových a opakovaných infúziách trvajúcich 5 a 15 minút, ktorými sa podalo 2, 4, 8 a 16 mg kyseliny zoledrónovej 64 pacientom s metastázami v kostiach, sa zistili nasledujúce farmakokinetické údaje, ktoré nezáviseli od dávky.
Po začatí infúzie kyseliny zoledrónovej sa plazmatické koncentrácie kyseliny zoledrónovej rýchlo zvýšili a dosiahli maximum na konci podania infúzie, po ktorom nasledoval rýchly pokles na < 10% maxima po 4 hodinách a < 1% maxima po 24 hodinách, s následným dlhým obdobím veľmi nízkych koncentrácií nepresahujúcich 0,1% maxima pred druhou infúziou kyseliny zoledrónovej na 28. deň.
Intravenózne podaná kyselina zoledrónová sa eliminuje trojfázovým procesom: rýchle dvojfázové vymiznutie zo systémového obehu s polčasmi t1/2a 0,24 a t1/2b 1,87 hodiny, po ktorých nasleduje dlhá eliminačná fáza s konečným polčasom eliminácie t1/2g 146 hodín. Po opakovanom podávaní každých
28 dní nedošlo k akumulácii kyseliny zoledrónovej v plazme. Kyselina zoledrónová sa nemetabolizuje
a vylučuje sa nezmenená obličkami. Počas prvých 24 hodín sa v moči nájde 39 ± 16% podanej dávky, zatiaľ čo zvyšok sa v zásade viaže na tkanivo kostí.
Z kostného tkaniva sa veľmi pomaly uvoľňuje späť do systémového obehu a vylučuje sa obličkami. Celkový telesný klírens je 5,04 ± 2,5 l/hod, a to nezávisle od dávky a bez ovplyvnenia pohlavím, vekom, rasou a telesnou hmotnosťou. Predĺženie infúzie z 5 na 15 minút znížilo koncentráciu kyseliny zoledrónovej na konci infúzie o 30%, ale neovplyvnilo plochu pod krivkou koncentrácie oproti času.
Tak ako aj pri iných bisfosfonátoch, variabilita farmakokinetických parametrov kyseliny zoledrónovej medzi pacientmi bola vysoká.
Nie sú dostupné farmakokinetické údaje o kyseline zoledrónovej u pacientov s hyperkalciémiou alebo u pacientov s insuficienciou pečene. Kyselina zoledrónová neinhibuje ľudské enzýmy P450
in vitro, nevykazuje biotransformáciu a v štúdiách na zvieratách sa v stolici našli < 3% podanej dávky, čo naznačuje, že funkcia pečene nezohráva významnú úlohu vo farmakokinetike kyseliny zoledrónovej.
Pri určení vzťahu medzi obličkovým klírensom kyseliny zoledrónovej a klírensom kreatinínu predstavoval obličkový klírens 75 ± 33% klírensu kreatinínu, ktorého priemerná hodnota bola
84 ± 29 ml/min (rozmedzie 22–143 ml/min) u 64 sledovaných pacientov s karcinómami. Analýza v tejto skupine ukázala, že u pacienta s klírensom kreatinínu 20 ml/min (ťažké poškodenie funkcie obličiek) alebo 50 ml/min (stredne ťažké poškodenie) bude zodpovedajúci predpokladaný klírens
kyseliny zoledrónovej 37% alebo 72% hodnoty pacienta, ktorý má klírens kreatinínu 84 ml/min. Sú
dostupné len obmedzené farmakokinetické údaje o pacientoch s ťažkou insuficienciou obličiek
(klírens kreatinínu < 30 ml/min).
Kyselina zoledrónová nemá afinitu ku krvinkám a jej väzba na bielkoviny plazmy je nízka (približne
56%) a nezávisí od koncentrácie kyseliny zoledrónovej.
Osobitné skupiny pacientov
Pediatrickí pacienti
Obmedzené farmakokinetické údaje u detí so závažnou osteogenesis imperfecta naznačujú, že farmakokinetika kyseliny zoledrónovej u detí vo veku 3 až 17 rokov je podobná ako u dospelých pri podobnej hladine dávok mg/kg. Vek, telesná hmotnosť, pohlavie a klírens kreatinínu zrejme nemajú žiadny vplyv na systémovú expozíciu kyseline zoledrónovej.
5.3 Predklinické údaje o bezpečnosti
Akútna toxicita
Najvyššia neletálna jednorazová intravenózna dávka bola 10 mg/kg telesnej hmotnosti u myší a
0,6 mg/kg u potkanov.
Subchronická a chronická toxicita
Kyselina zoledrónová sa dobre znášala, keď sa podávala subkutánne potkanom a intravenózne psom v dávkach do 0,02 mg/kg denne počas 4 týždňov. Podávanie 0,001 mg/kg/deň subkutánne potkanom a
0,005 mg/kg intravenózne psom raz za 2–3 dni počas až 52 týždňov sa tiež dobre znášalo.
Najčastejším nálezom v štúdiách pri opakovanom podávaní bolo zväčšenie primárnej trabekulárnej časti kosti v metafýzach dlhých kostí u rastúcich zvierat pri takmer všetkých dávkach, čo bol nález v súlade s farmakologickou antiresorpčnou účinnosťou látky.
Bezpečné rozmedzie dávok vzhľadom na účinky na obličky bolo úzke v štúdiách pri dlhodobom opakovanom parenterálnom podávaní zvieratám, ale kumulatívne hladiny bez nežiaducich príhod (NOAELs, no adverse event levels) v štúdiách pri jednorazovom podaní (1,6 mg/kg) a pri opakovanom podávaní až do jedného mesiaca (0,06–0,6 mg/kg/deň) nenaznačili účinky na obličky pri dávkach ekvivalentných alebo prevyšujúcich najvyššiu plánovanú terapeutickú dávku u ľudí. Dlhodobejšie opakované podávanie v dávkach, ktoré zahrnulo aj najvyššiu plánovanú terapeutickú dávku kyseliny zoledrónovej u ľudí, vyvolalo toxické účinky v iných orgánoch vrátane gastrointestinálneho traktu, pečene, sleziny a pľúc, ako aj v mieste podania intravenóznej injekcie.
Reprodukčná toxicita
Kyselina zoledrónová bola teratogénna u potkanov v subkutánnych dávkach ³ 0,2 mg/kg. Hoci sa u králikov nepozorovala žiadna teratogenita alebo fetotoxicita, zistila sa toxicita pre matky. Dystokia sa pozorovala pri najnižšej skúšanej dávke u potkanov (0,01 mg/kg telesnej hmotnosti).
Mutagenita a karcinogenita
Kyselina zoledrónová nebola mutagénna vo vykonaných testoch mutagenity a testy na karcinogenitu neposkytli žiadne dôkazy o karcinogénnom potenciále.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol Citrónan sodný Voda na injekciu
6.2 Inkompatibility
Aby sa zabránilo prípadným inkompatibilitám, Zoledronic acid Actavis 4 mg/5 ml infúzny koncentrát sa má zriediť 0,9% m/V roztokom chloridu sodného alebo 5% m/V roztokom glukózy.
Tento liek sa nesmie miešať s infúznymi roztokmi obsahujúcimi vápnik alebo iné dvojmocné katióny, napr. Ringerovým roztokom s laktátom, a má sa podať ako jednorazový intravenózny roztok osobitnou infúznou súpravou.
6.3 Čas použiteľnosti
3 roky.
Po zriedení: chemická a fyzikálna stabilita pred použitím bola demonštrovaná po dobu 24 hodín pri teplote 2 °C - 8 °C a pri teplote 25 ° po zriedení v 100 ml 0,9 % w/V roztoku chloridu sodného alebo
v 100 ml 5 % w/V roztoku glukózy. Z mikrobiologického hľadiska sa má nariedený infúzny roztok po zriedení použiť okamžite. Ak sa nepoužije okamžite, používateľ zodpovedá za čas a podmienky uchovávania pred použitím, čo normálne nemá byť dlhšie ako 24 hodín pri 2 °C – 8 °C. Ak sa uchováva v chladničke, potom musí roztok pred podaním dosiahnuť izbovú teplotu.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
Podmienky na uchovávanie Zoledronic acid Actavis po zriedení, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
5 ml koncentrátu v plastovej injekčnej liekovke z číreho, bezfarebného oleofinového polyméru, ktorá je uzavretá zátkou z bromobutylovej gumy pokrytou vrstvou fluoropolyméru a hliníkovým uzáverom s plastovým strhávacím (flip-off) krytom.
Zoledronic acid Actavis 4 mg/5 ml infúzny koncentrát sa dodáva v baleniach obsahujúcich 1, 4 alebo
10 injekčných liekoviek.
Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pred podaním sa 5,0 ml koncentrátu z jednej injekčnej liekovky alebo objem koncentrátu odobratý podľa potreby musí ďalej zriediť 100 ml infúzneho roztoku, ktorý neobsahuje vápnik (0,9% m/V roztok chloridu sodného alebo 5% m/V roztok glukózy).
Ďalšie informácie o manipulácii so Zoledronic acid Actavis vrátane pokynov na prípravu znížených dávok sú uvedené v časti 4.2.
Počas prípravy infúzie sa musia dodržiavať aseptické postupy. Len na jednorazové použitie. Má sa použiť len číry, nesfarbený roztok bez cudzorodých častíc.
Zdravotníckym pracovníkom sa odporúča, aby nelikvidovali nepoužitý Zoledronic acid Actavis domovou stokovou sieťou.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Actavis Group PTC ehf.
Reykjavíkurvegur 76-78
220 Hafnarfjörður
Island
8. REGISTRAČNÉ ČÍSLA
EU/1/12/759/001
EU/1/12/759/002
EU/1/12/759/003
9. DÁTUM PRVEJ REGISTRÁCIE / PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 20.04.2012
10. DÁTUM REVÍZIE TEXTU