
iu AUC omeprazolu (substrát CYP2C19). Podobne mohla byť indukovaná aj UDP1A1.
V klinickom skúšaní u pacientov s metastázujúcim karcinómom prostaty rezistentným na kastráciu nemal Xtandi (160 mg jedenkrát denne) klinicky významný účinok na farmakokinetiku intravenózne podávaného docetaxelu (75 mg/m2 infúziou každé 3 týždne). Hodnota AUC docetaxelu sa znížila
o 12 % [geometrický priemer (GMR) = 0,882 (90 % IS: 0,767; 1,02)] zatiaľ čo hodnota Cmax sa znížila o 4 % [GMR = 0,963 (90 % IS: 0,834; 1,11)].
Očakávané sú interakcie s niektorými liekmi, ktoré sú eliminované cez metabolizmus alebo aktívny transport. Ak je ich terapeutický účinok pre pacienta veľmi dôležitý a nie sú možné jednoduché zmeny dávkovania na základe sledovania účinnosti alebo plazmatických koncentrácií, takéto lieky sa nemajú používať alebo sa majú používať s opatrnosťou. Riziko poškodenia pečene po podaní paracetamolu sa očakáva, že bude vyššie u pacientov, ktorí sú súčasne liečení induktormi enzýmov.
Skupiny liekov, ktoré môžu byť ovplyvnené (avšak nie sú obmedzené iba na tieto skupiny), zahŕňajú:
• analgetiká (napr. fentanyl, tramadol),
• antibiotiká (napr. klaritromycín, doxycyklín),
• protinádorové lieky (napr. kabazitaxel),
• antikoagulanciá (napr. acenokumarol, warfarín),
• antiepileptiká (napr. karbamazepín, klonazepam, fenytoín, primidon, kyselina valproová),
• antipsychotiká (napr. haloperidol),
• betablokátory (napr. bisoprolol, propranolol),
• blokátory kalciového kanála (napr. diltiazem, felodipín, nikardipín, nifedipín, verapamil),
• srdcové glykozidy (napr. digoxín),
• kortikosteroidy (napr. dexametazón, prednizolón),
• HIV antivirotiká (napr. indinavir, ritonavir),
• hypnotiká (napr. diazepam, midazolam, zolpidem),
• statíny metabolizované CYP3A4 (napr. atorvastatín, simvastatín),
• hormóny štítnej žľazy (napr. levotyroxín).
Celkové indukčné schopnosti enzalutamidu sa nemusia prejaviť skôr ako približne 1 mesiac od začatia liečby, kedy sa dosiahnu stabilné plazmatické koncentrácie enzalutamidu, hoci niektoré indukčné účinky sa môžu prejaviť aj skôr. U pacientov užívajúcich lieky, ktoré sú substrátmi CYP2B6, CYP3A4, CYP2C9, CYP2C19 alebo UGT1A1 sa má zhodnotiť možná strata farmakologických účinkov (alebo zosilnenie účinkov v prípadoch, kedy sa tvoria aktívne metabolity) počas prvého mesiaca liečby enzalutamidom a ak je to potrebné, má sa zvážiť úprava dávkovania. Vzhľadom
na dlhý polčas enzalutamidu (5,8 dní, pozri časť 5.2) môžu po prerušení užívania enzalutamidu jeho
účinky na enzýmy pretrvávať mesiac alebo aj dlhšie. Pri ukončení liečby enzalutamidom môže byť potrebné postupné znižovanie dávky súčasne podávaného lieku.
Substráty CYP1A2 a CYP2C8
Enzalutamid (160 mg jedenkrát denne) nespôsobil klinicky významnú zmenu AUC alebo Cmax kofeínu
(substrát CYP1A2) alebo pioglitazónu (substrát CYP2C8). Hodnota AUC pioglitazónu sa zvýšila o 20 %, kým Cmax sa znížila o 18 %. Hodnota AUC kofeínu sa znížila o 11 % a Cmax sa znížila
o 4 %.Pri súčasnom podávaní substrátu CYP1A2 alebo CYP2C8 s liekom Xtandi nie je potrebná žiadna úprava dávkovania.
Substráty P-gp
In vitro údaje ukazujú, že enzalutamid môže byť inhibítorom efluxového transportéra P-gp. Účinok
enzalutamidu na substráty P-gp nebol hodnotený in vivo; avšak v podmienkach klinického použitia môže byť enzalutamid induktorom P-gp cez aktiváciu pregnánového nukleárneho receptora (PXR). Lieky s úzkym terapeutickým indexom, ktoré sú substrátmi P-gp (napr. kolchicín, dabigatran etexilát, digoxín) sa majú pri súčasnom podávaní s liekom Xtandi užívať opatrne a pre zachovanie optimálnych plazmatických koncentrácií môže byť potrebná úprava dávkovania.
Substráty BCRP, MRP2, OAT3 a OCT1
Na základe in vitro údajov nemožno vylúčiť inhibíciu BCRP a MRP2 (v čreve), rovnako ako aj inhibíciu transportéra organického aniónu 3 (OAT3) a transportéra organického katiónu 1 (OCT1)
(systémovo). Teoreticky je možná indukcia aj týchto transportérov, ale výsledný efekt je v súčasnosti
neznámy.
Lieky, ktoré predlžujú QT interval
Kvôli súvislosti androgén–deprivačnej liečby s predĺžením QT intervalu sa má dôkladne zvážiť súbežné používanie Xtandi s liekmi, o ktorých je známe, že predlžujú QT interval a liečba liekmi, ktoré môžu vyvolať Torsade de pointes, ako antiarytmiká triedy I A (napr. chinidín, disopyramid),
triedy III (napr. amiodarón, sotalol, dofetilid, ibutilid), metadon, moxifloxacín, antipsychotiká a ďalšie
(pozri časť 4.4.).
Vplyv jedla na expozíciu enzalutamidu
Jedlo nemá žiadny klinicky významný vplyv na rozsah účinku enzalutamidu. V klinických skúšaniach
bol liek Xtandi podávaný bez ohľadu na príjem potravy.
4.6 Fertilita, gravidita a laktácia
Ženy vo fertilnom veku
Nie sú k dispozícii údaje o použití Xtandi počas gravidity a tento liek nie je určený na užívanie u žien vo fertilnom veku. Tento liek môže spôsobiť poškodenie plodu alebo aj prípadný potrat, ak ho užívajú ženy, ktoré sú tehotné (pozri časť 5.3).
A
ntikoncepcia u mužov a žien
Nie je známe, či sú enzalutamid alebo jeho metabolity prítomné v sperme. Počas liečby enzalutamidom a 3 mesiace po nej je potrebné pri pohlavnom styku pacienta s gravidnou ženou používať kondóm. Ak má pacient pohlavný styk so ženou vo fertilnom veku, musí počas liečby a 3 mesiace po nej používať kondóm a ďalšiu formu antikoncepcie. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3).
Gravidita
Enzalutamid nie je určený na použitie u žien. Enzalutamid je kontraindikovaný u žien, ktoré sú alebo môžu byť gravidné (pozri časti 4.3 a 5.3).
Dojčenie
Enzalutamid nie je určený na použitie u žien. Nie je známe, či je enzalutamid prítomný v ľudskom
mlieku. Enzalutamid a/alebo jeho metabolity sa vylučujú do mlieka potkanov (pozri časť 5.3).
Fertilita
Štúdie na zvieratách ukázali, že enzalutamid ovplyvnil reprodukčný systém u samcov potkanov a psov
(pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Enzalutamid môže mať mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje, pretože boli hlásené psychiatrické a neurologické príhody, vrátane epileptického záchvatu (pozri časť 4.8). Pacienti s anamnézou záchvatov alebo s inými predisponujúcimi faktormi (pozri časť 4.4) majú byť poučení
o riziku pri vedení vozidla alebo obsluhe strojov. Nevykonali sa žiadne štúdie preukazujúce účinky
enzalutamidu na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnprofilubezpečnosti
Najčastejšie nežiaduce reakcie sú asténia/únava, návaly tepla, bolesť hlavy a hypertenzia. Medzi ďalšie významné nežiaduce reakcie patria pády, nepatologické zlomeniny, poruchy kognitívnych funkcií a neutropénia.
Epileptický záchvat sa vyskytol u 0,5 % pacientov liečených enzalutamidom, 0,1 % pacientov užívajúcich placebo a 0,3 % pacientov liečených bikalutamidom. Boli hlásené zriedkavé prípady syndrómu reverzibilnej posteriórnej encefalopatie (PRES) u pacientov liečených enzalutamidom (pozri časť 4.4).
Prehľadnežiaducichreakcií zoradenýchvtabuľke
Nežiaduce reakcie pozorované počas klinických skúšaní sú zoradené podľa frekvencie výskytu. Kategórie frekvencie výskytu nežiaducich účinkov sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v klesajúcom poradí závažnosti.
 T
abuľka 1: Nežiaduce reakcie zistené v kontrolovaných klinických skúšaniach a po uvedení lieku na trh
T
abuľka 1: Nežiaduce reakcie zistené v kontrolovaných klinických skúšaniach a po uvedení lieku na trh
T
rieda orgánových systémov podľa databázy MedDRA
Poruchy krvi a lymfatického systému
Frekvencia
menej časté: leukopénia, neutropénia neznáme*: trombocytopénia
Poruchy imunitného systému neznáme*: opuch jazyka, opuch pery, opuch hltana
Celkové poruchy veľmi časté: asténia/únava
Psychické poruchy časté: úzkosť
menej časté: zrakové halucinácie
Poruchy nervového systému veľmi časté: bolesť hlavy
časté: zhoršenie pamäti, amnézia, poruchy pozornosti, syndróm nepokojných nôh
menej časté: poruchy kognitívnych funkcií, epileptický
záchvat
neznáme*: syndróm reverzibilnej posteriórnej encefalopatie
Poruchy srdca a srdcovej
činnosti
Poruchy reprodukčného
systému a prsníkov
neznáme*: predĺženie QT intervalu (pozri časti 4.4 a 4.5)
časté: gynekomastia
Poruchy ciev veľmi časté: návaly tepla, hypertenzia
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Úrazy, otravy a komplikácie
liečebného postupu
neznáme *: nauzea, vracanie, hnačka
časté: suchá koža, svrbenie neznáme*: vyrážka
časté: zlomeniny**
neznáme*: myalgia, svalové spazmy, svalová slabosť, bolesť
chrbta
časté: pády
*Spontánne hlásenia z praxe po uvedení lieku na trh
**Zahŕňa všetky zlomeniny s výnimkou patologických zlomenín
Popis vybraných nežiaducich reakcií
Epileptický záchvat
V kontrolovanom klinickom skúšaní sa vyskytol epileptický záchvat u 10 pacientov (0,5 %)
z 2 051 pacientov liečených dennou dávkou 160 mg enzalutamidu, zatiaľ čo epileptický záchvat sa vyskytol u jedného pacienta (< 0,1 %) dostávajúceho placebo a jedného pacienta (0,3 %) dostávajúceho bikalutamid. Dávka sa zdá byť dôležitým prediktorom rizika záchvatu, čo vyplýva
z predklinických údajov a údajov zo štúdie s eskaláciou dávky. Pacienti s predchádzajúcim
epileptickým záchvatom alebo rizikovými faktormi záchvatu boli vylúčení z kontrolovaných klinických skúšaní .
V klinickom skúšaní AFFIRM sa epileptické záchvaty vyskytli u siedmich pacientov (0,9 %)
z 800 pacientov po chemoterapii liečených dennou dávkou 160 mg enzalutamidu, u pacientov užívajúcich placebo sa nevyskytli žiadne epileptické záchvaty. U niektorých z týchto pacientov sa vyskytovali faktory potenciálne prispievajúce k vzniku záchvatu, ktoré u nich mohli nezávisle toto riziko zvyšovať. V klinickom skúšaní PREVAIL sa epileptický záchvat vyskytol u jedného (0,1 %) z 871 pacientov liečených dennou dávkou 160 mg enzalutamidu, ktorí predtým nepodstúpili chemoterapiu, a vyskytol sa u jedného pacienta (0,1 %) užívajúceho placebo. V klinickom skúšaní kontrolovanom bikalutamidom, mali epileptický záchvat 3 pacienti (0,8 %) liečení enzalutamidom
z 380 pacientov predtým neliečených chemoterapiou a 1 pacient (0,3 %) z 387, ktorý dostával bikalutamid.
V klinickom skúšaní s jednou skupinou na posúdenie výskytu záchvatov u pacientov s predisponujúci faktormi záchvatov (z ktorých 1,6% malo záchvaty v anamnéze) sa u 8 z 366 (2,2%) pacientov liečených enzalutamidom vyskytli záchvaty. Medián trvania liečby bol 9,3 mesiaca.
Mechanizmus, akým enzalutamid môže znižovať prah pre vznik záchvatu nie je známy, ale mohol by
súvisieť s údajmi z
in vitro štúdií, ktoré ukázali, že enzalutamid a jeho aktívny metabolit sa viažu na aktivitu GABA-chloridového kanála a môžu ju inhibovať.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovaniePre enzalutamid neexistuje antidotum. V prípade predávkovania sa má liečba enzalutamidom prerušiť
a začať so všeobecnými podpornými opatreniami, pričom treba brať do úvahy jeho polčas 5,8 dňa.
U pacientov môže byť po predávkovaní zvýšené riziko vzniku epileptických záchvatov.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antiandrogény, antagonisty hormónov a príbuzné liečivá, ATC kód: L02BB04
MechanizmusúčinkuJe známe, že karcinóm prostaty je citlivý na androgény a odpovedá na inhibíciu signalizácie androgénneho receptora. Napriek nízkym alebo dokonca nedetekovateľným hladinám sérového androgénu, signalizácia androgénneho receptora ďalej podporuje progresiu ochorenia. Na stimuláciu rastu nádorových buniek cez androgénny receptor je potrebný transport do jadra a väzba na DNA. Enzalutamid je účinný inhibítor signalizácie androgénneho receptora, ktorý blokuje niekoľko krokov v signálnej dráhe androgénneho receptora.
Enzalutamid kompetitívne inhibuje väzbu androgénov na androgénne receptory, inhibuje translokáciu aktivovaných receptorov do jadra a inhibuje spojenie aktivovaného androgénneho receptora s DNA
dokonca aj v prostredí nadmernej expresie androgénneho receptora a u buniek karcinómu prostaty rezistentných na antiandrogény. Liečba enzalutamidom spomaľuje rast buniek karcinómu prostaty
a môže indukovať zánik nádorových buniek a regresiu nádoru. V predklinických štúdiách enzalutamid nepreukázal aktivitu agonistu androgénneho receptora.
FarmakodynamickéúčinkyV klinickom skúšaní fázy 3 (AFIRM) u pacientov so zlyhaním predchádzajúcej chemoterapie docetaxelom došlo k najmenej 50 % poklesu východiskových hladín PSA u 54 % pacientov liečených
enzalutamidom oproti 1,5 % pacientov, ktorí dostávali placebo.
V inom klinickom skúšaní fázy 3 (PREVIAL) u chemo-naivných pacientov, pacienti liečení enzalutamidom preukázali významne vyššiu celkovú mieru odpovede PSA (definovanú ako ≥ 50% zníženie oproti východiskovej hodnote), v porovnaní s pacientmi užívajúcimi placebo, 78,0 % oproti
3,5 % (rozdiel = 74,5 %, p < 0,0001).
V klinickom skúšaní fázy 2 (TERRAIN) u chemo-naivných pacientov, pacienti dostávajúci enzalutamid preukázali významne vyššiu celkovú mieru odpovede PSA (definovanú ako ≥ 50 %
zníženie oproti východiskovej hodnote), v porovnaní s pacientmi dostávajúcimi bikalutamid, 82,1 %
oproti 20,9 % (rozdiel = 61,2 %, p < 0,0001).
V skúšaní v jednej skupine (9785-CL-0410) pacientov, ktorí boli predtým liečení aspoň 24 týždňov
abiraterónom (plus prednizón), 22,4 % malo ≥ 50 % pokles PSA oproti východiskovej hodnote.
Podľa predchádzajúcej chemoterapie v anamnéze bol výsledný pomer pacientov s ≥ 50 % poklesom
PSA 22,1 % v skupine bez predchádzajúcej chemoterapie a 23,2 % s predchádzajúcou chemoterapiou.
Klinickáúčinnosťabezpečnosť
Účinnosť enzalutamidu bola stanovená v dvoch randomizovaných placebom kontrolovaných multicentrických klinických skúšaniach fázy 3 [CRPC2 (AFFIRM), MDV3100-03 (PREVAIL)]
u pacientov s progresívnym metastázujúcim karcinómom prostaty, u ktorých zlyhala androgénna
deprivačná terapia [analóg hormónu uvoľňujúceho luteinizačný hormón (LHRH) alebo po obojstrannej orchiektómii]. Do klinického skúšania PREVAIL boli zahrnutí pacienti, ktorí predtým
nepodstúpili chemoterapiu, zatiaľ čo do klinického skúšania AFFIRM boli zahrnutí pacienti, ktorí
predtým dostávali docetaxel. Všetci pacienti pokračovali v liečbe analógom LHRH alebo predtým
podstúpili obojstrannú orchiektómiu. V skupine s aktívnou liečbou bol Xtandi podávaný perorálne
v dávke 160 mg denne. V oboch klinických skúšaniach užívali pacienti v kontrolnej skupine placebo a pacienti v skúšaní mohli, ale nemuseli užívať prednizón (maximálna povolená denná dávka bola
10 mg prednizónu alebo jej ekvivalent).
Zmeny sérových koncentrácií PSA samy o sebe, nie vždy predpovedajú klinický prínos. Preto sa
v oboch klinických skúšaniach pacientom odporúčalo pokračovať v skúšanej liečbe až do dosiahnutia kritérií na ukončenie liečby, ktoré sú pre každé skúšanie uvedené nižšie.
Klinické skúšanie MDV3100-03 (PREVAIL) (pacienti bez predchádzajúcej chemoterapie)
Celkom 1 717 asymptomatických alebo mierne symptomatických pacientov, ktorí predtým nepodstúpili chemoterapiu, bolo randomizovaných v pomere 1:1 na perorálne užívanie enzalutamidu v dávke 160 mg jedenkrát denne (N = 872) alebo placeba jedenkrát denne (N = 845). Na klinickom skúšaní bola povolená účasť pacientov s viscerálnym ochorením, pacientov s ľahkým až stredne ťažkým srdcovým zlyhávaním (triedy 1 alebo 2 podľa NYHA) v anamnéze a pacientov užívajúcich lieky znižujúce prah pre vznik epileptických záchvatov. Pacienti s výskytom epileptických záchvatov v anamnéze alebo pacienti s ochorením, ktoré by u nich mohlo zvýšiť náchylnosť na epileptické záchvaty a pacienti so stredne ťažkou až ťažkou bolesťou spôsobenou karcinómom prostaty boli
zo skúšania vylúčení. Skúšaná liečba pokračovala až do progresie ochorenia (rádiologický dôkaz progresie, výskyt kostnej príhody alebo klinická progresia) a začiatku buď cytotoxickej chemoterapie alebo liečby iným skúmaným liekom alebo do neakceptovateľnej toxicity.
Demografické údaje pacientov a základné charakteristiky ochorenia boli rovnovážne rozložené medzi liečebnými skupinami. Medián veku bol 71 rokov (rozsah 42-93) a rasová príslušnosť bola 77 % belošská, 10 % ázijská, 2 % černošská a 11 % iná alebo neznáma rasa. Šesťdesiatosem percent (68 %) pacientov malo skóre výkonnostného stavu ECOG 0 a 32 % pacientov malo výkonnostný stav
ECOG 1. Východiskové hodnotenie bolesti bolo u 67 % pacientov 0-1 (asymptomatickí pacienti)
a u 32 % pacientov 2-3 (mierne symptomatickí pacienti), podľa krátkeho inventáru bolesti (Brief Pain
Inventory Short Form) (najsilnejšia bolesť za posledných 24 hodín na stupnici od 1 do 10). Približne
45 % pacientov malo merateľné ochorenie mäkkých tkanív pri vstupe do klinického skúšania a 12 %
pacientov malo viscerálne (pľúcne a/alebo pečeňové) metastázy.
Spoločné primárne ciele účinnosti boli celkové prežívanie a prežívanie bez rádiologickej progresie (radiographic progression-free survival, rPFS). Okrem primárnych spoločných cieľov bol prínos tiež hodnotený pomocou času do začatia cytotoxickej chemoterapie, najlepšej celkovej odpovede mäkkých tkanív, času do prvého výskytu kostnej príhody, odpovede PSA (≥ 50% zníženie oproti východiskovej hodnote), času do progresie PSA a času do zhoršenia celkového skóre FACT-P.
Rádiologická progresia bola hodnotená pomocou skúmaní sekvenčného zobrazovania podľa kritérií
PCWG2 (Prostate Cancer Clinical Trials Working Group 2) (pre kostné lézie) a/alebo podľa kritérií
RECIST v 1.1 (Response Evaluation Criteria in Solid Tumors) (pre mäkké tkanivá). V analýze rPFS
bolo použité centrálne schválené hodnotenie rádiologickej progresie.
Vo vopred špecifikovanej predbežnej analýze celkového prežívania, keď bolo zaznamenaných
540 úmrtí, sa pri liečbe enzalutamidom preukázalo štatisticky významné zlepšenie celkového
prežívania v porovnaní s užívaním placeba, s 29,4 % znížením rizika úmrtia [HR = 0,706, (95 % CI:
0,596; 0,837), p < 0,0001]. Aktualizovaná analýza prežívania bola vykonaná, keď bolo
zaznamenaných 784 úmrtí. Výsledky z tejto analýzy boli v súlade s výsledkami predbežnej analýzy
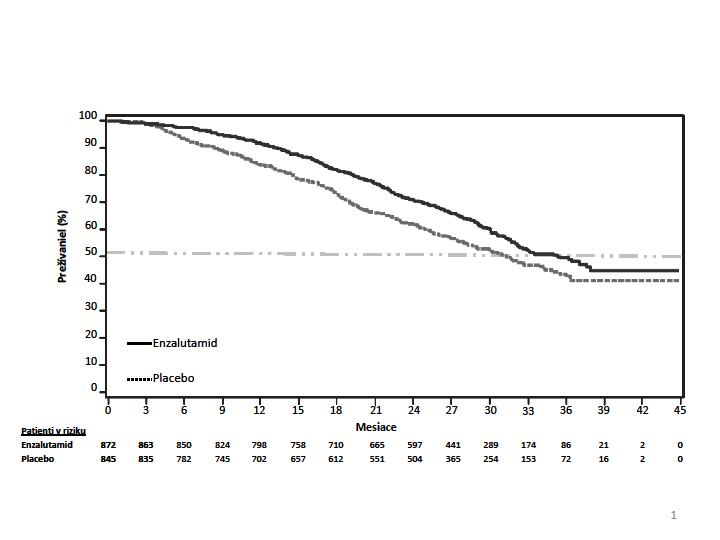
(Tabuľka 2, Obrázok 1). V aktualizovanej analýze 52 % pacientov liečených enzalutamidom a 81 % pacientov užívajúcich placebo dostalo následnú liečbu na metastázujúci karcinóm prostaty rezistentný na kastráciu (CRPC), ktorá môže predĺžiť celkové prežívanie.
Tabuľka 2: Celkové prežívanie pacientov liečených buď enzalutamidom alebo užívajúcich
placebo v skúšaní PREVAIL (Intent-to-Treat analýza)
Vopred špecifikovaná predbežná analýza
Enzalutamid
(N = 872)
Placebo
(N = 845)
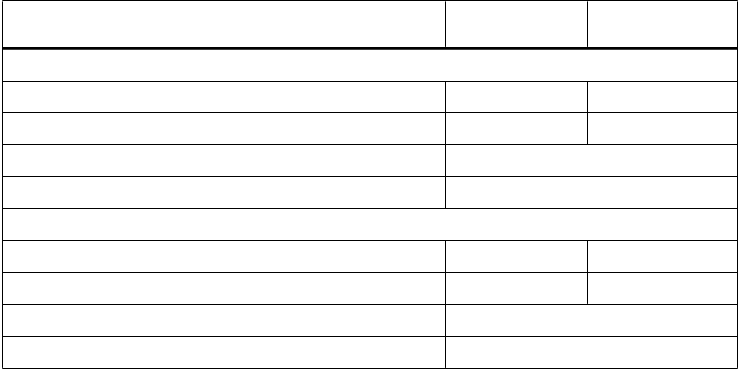
Počet úmrtí (%) 241 (27,6 %) 299 (35,4 %) Medián prežívania, mesiace (95 % CI) 32,4 (30,1; NR) 30.2 (28,0; NR) P-hodnotaa < 0,0001
Pomer rizík (95 % CI) b 0,71 (0,60; 0,84) Aktualizovaná analýza prežívania
Počet úmrtí (%) 368 (42,2 %) 416 (49,2 %)
Medián prežívania, mesiace (95 % CI) 35,3 (32,2; NR) 31,3 (28,8, 34,2) P-hodnotaa 0,0002
Pomer rizík (95 % CI) b 0,77 (0,67; 0,88)
a P-hodnota p odvodená z nestratifikovaného log-rank testu
b Pomer rizík odvodený z nestratifikovaného modelu proporčných rizík. Pomer rizík < 1 v prospech enzalutamidu. NR, nedosiahnuté.
O
brázok 1: Kaplanove-Meierove krivky celkového prežívania na základe aktualizovanej analýzy prežívania v klinickom skúšaní PREVAIL (Intent-to-Treat analýza)
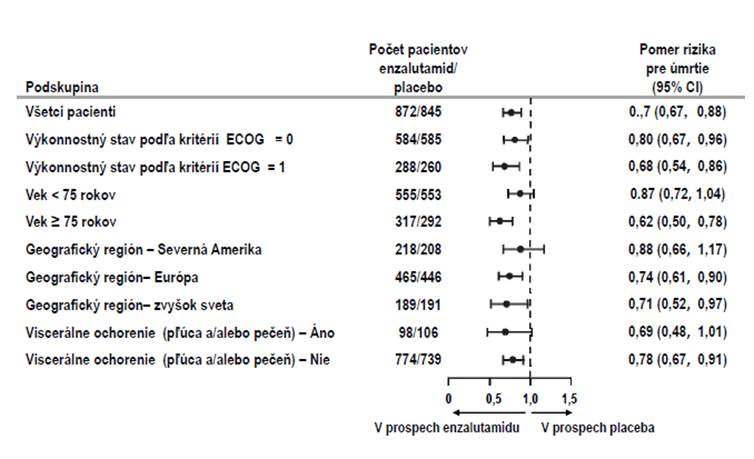
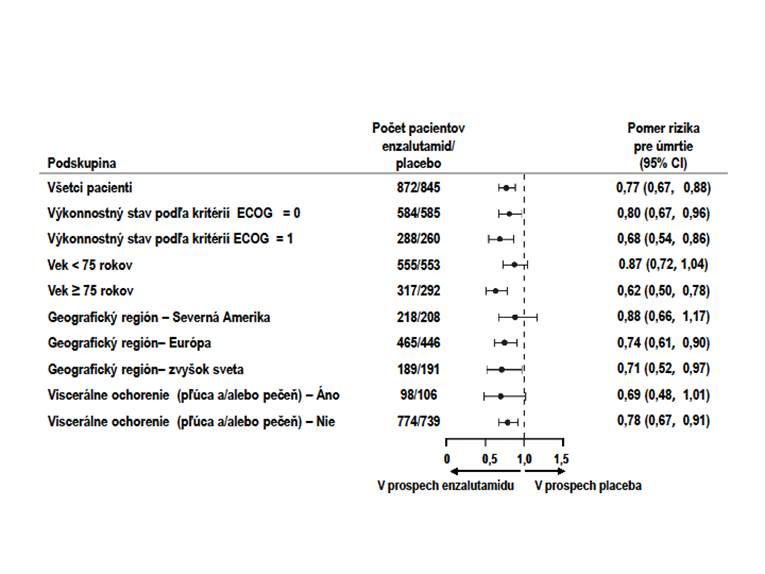
 O
brázok 2: Aktualizovaná analýza celkového prežívania podľa podskupín: Pomer rizík a 95 %
i
nterval spoľahlivosti v klinickom skúšaní PREVAIL (Intent-to-Treat analýza)
O
brázok 2: Aktualizovaná analýza celkového prežívania podľa podskupín: Pomer rizík a 95 %
i
nterval spoľahlivosti v klinickom skúšaní PREVAIL (Intent-to-Treat analýza)
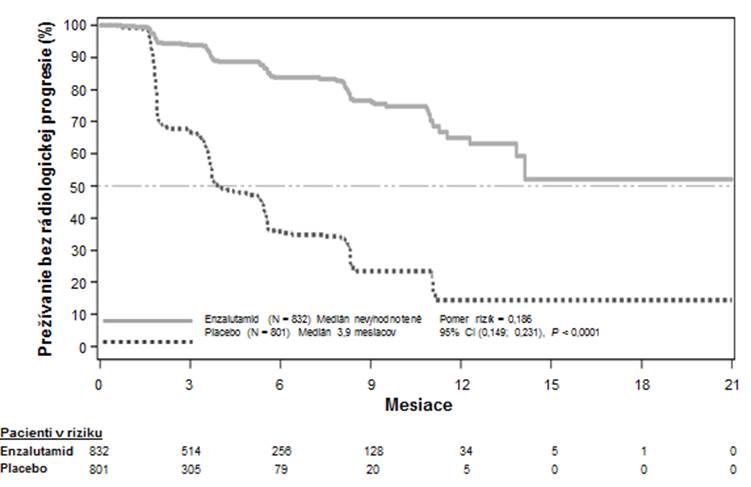
Vo vopred špecifikovanej analýze rPFS bolo preukázané štatisticky významné zlepšenie medzi
liečebnými skupinami s 81,4 % znížením rizika rádiologickej progresie alebo úmrtia [HR = 0,186
(95 % CI: 0,149; 0.231), p < 0,0001]. U 118 (14 %) pacientov liečených enzalutamidom a 321 (40 %)
pacientov užívajúcich placebo sa vyskytla príhoda. Medián hodnoty rPFS nebol dosiahnutý (95 % CI:
13,8; nedosiahnuté) v skupine liečenej enzalutamidom a bol 3,9 mesiacov (95 % CI: 3,7; 5,4)
v skupine užívajúcej placebo (Obrázok 3). Konzistentný prínos v rPFS sa pozoroval vo všetkých vopred špecifikovaných podskupinách pacientov (napr. vek, východiskový výkonnostný stav ECOG,
východiskové hladiny PSA a LDH, Gleasonovo skóre pri diagnóze a viscerálne ochorenie pri
skríningu). Vopred špecifikovaná analýza sledovania rPFS založená na hodnotení rádiologickej progresie skúšajúcim preukázala štatisticky významné zlepšenie medzi liečebnými skupinami s 69,3 % znížením rizika rádiologickej progresie alebo úmrtia [HR = 0.307 (95 % CI: 0,267; 0,353), p < 0,0001]. Medián hodnoty rPFS bol 19,7 mesiacov v skupine s enzalutamidom a 5,4 mesiacov v skupine
s placebom.
Obrázok 3: Kaplanove-Meierove krivky prežívania bez rádiologickej progresie v klinickom skúšaní PREVAIL (Intent-to-Treat analýza)V čase primárnej analýzy bolo randomizovaných 1 633 pacientov.
Okrem primárnych spoločných cieľov bolo preukázané štatisticky významné zlepšenie aj nasledujúcich prospektívne definovaných cieľov.
Medián času do začatia cytotoxickej chemoterapie bol 28,0 mesiacov pre pacientov liečených
enzalutamidom a 10,8 mesiacov pre pacientov užívajúcich placebo (HR = 0,350, 95 % CI: [0,303;
0,403], p < 0,0001).
Podiel pacientov liečených enzalutamidom s merateľným ochorením na začiatku liečby, u ktorých sa zaznamenala objektívna odpoveď mäkkých tkanív, bol 58,8 % (95 % CI: 53,8; 63,7) v porovnaní
s 5,0 % (95 % CI: 3,0; 7,7) u pacientov, ktorí užívali placebo. Absolútny rozdiel v objektívnej odpovedi mäkkých tkanív medzi skupinami s enzalutamidom a placebom bol 53,9 % (95 % CI:
48,5 %, 59,1 %, p < 0,0001). Kompletné odpovede sa hlásili u 19,7 % pacientov liečených
enzalutamidom v porovnaní s 1,0 % pacientov, ktorí užívali placebo, a čiastočné odpovede boli hlásené u 39,1 % pacientov liečených enzalutamidom oproti 3,9 % pacientov užívajúcich placebo.
Enzalutamid výrazne znížil riziko výskytu prvej skeletálnej udalosti o 28 % [HR = 0,718 (95 % CI:
0,610; 0,844) p-hodnota < 0,0001]. Skeletálna udalosť bola definovaná ako potreba rádioterapie kostí alebo chirurgického výkonu na kostiach z dôvodu karcinómu prostaty, patologická fraktúra kostí,
kompresia miechy alebo zmena protinádorovej liečby z dôvodu bolesti kostí. Analýza zahŕňala
578 skeletálnych udalostí, z toho v 389 prípadoch (66,3 %) išlo o rádioterapiu kostí, v 79 prípadoch
(13,5 %) o kompresiu miechy, v 70 prípadoch (11,9 %) udalostí tvorili patologické kostné fraktúry,
v 45 prípadoch (7,6 %) došlo k zmene protinádorovej liečby pre bolesti kostí a v 22 prípadoch (3,7 %)
bol potrebný chirurgický zásah do kostí.
Pacienti liečení enzalutamidom preukázali významne vyššiu celkovú mieru odpovede PSA (definovanú ako ≥ 50% zníženie oproti východiskovej hodnote), v porovnaní s pacientmi užívajúcimi placebo, 78,0 % oproti 3,5 % (rozdiel = 74,5 %, p < 0,0001).
Medián času do progresie PSA podľa kritérií PCWG2 bol 11,2 mesiacov u pacientov liečených enzalutamidom a 2,8 mesiacov u pacientov užívajúcich placebo [HR = 0,169, (95 % CI: 0,147; 0,195), p < 0,0001].
Liečba enzalutamidom znížila riziko zhoršenia FACT-P skóre o 37,5 % v porovnaní s placebom
(p < 0,001). Medián času do zhoršenia FACT-P bol 11,3 mesiacov v skupine s enzalutamidom a 5,6 mesiacov v skupine s placebom.
785-CL-0222 (TERRAIN) skúšanie (pacienti, ktorí predtým neboli liečení chemoterapiou)
Do skúšania TERRAIN bolo zaradených 375 pacientov predtým neliečených chemoterapiou a ani antiandrogénnou liečbou, ktorí boli randomizovaní buď na enzalutamid v dávke 160 mg jedenkrát denne (N = 184) alebo bikalutamid v dávke 50 mg jedenkrát denne (N = 191). Medián PFS bol 15,7 mesiaca u pacientov liečených enzalutamidom oproti 5,8 mesiaca u pacientov užívajúcich bikalutamid
[HR = 0,44 (95% CI: 0,34, 0,57), p <0,0001]. Prežívanie bez progresie bolo definované ako objektívny dôkaz progresie ochorenia podľa nezávislého centrálneho röntgenologického hodnotenia, skeletárna
príhoda, iniciácia novej protinádorovej liečby alebo smrť z akejkoľvek príčiny podľa toho, čo nastalo
skôr.
Konzistentný prínos v PFS sa pozoroval vo všetkých vopred špecifikovaných podskupinách pacientov.
Klinické skúšanie CRPC2 (AFFIRM) (pacienti, ktorí boli predtým liečení chemoterapiou)
Účinnosť a bezpečnosť enzalutamidu u pacientov s metastázujúcim karcinómom prostaty rezistentným na kastráciu, ktorí dostávali docetaxel a užívali analóg LHRH alebo podstúpili orchiektómiu, boli hodnotené v randomizovanom, placebom kontrolovanom multicentrickom klinickom skúšaní fázy 3. Celkovo bolo randomizovaných 1 199 pacientov v pomere 2:1 na perorálne užívanie enzalutamidu
v dávke 160 mg jedenkrát denne (n = 800) alebo na placebo jedenkrát denne (n = 399). Pacienti mohli,
ale nemuseli užívať prednizón (maximálna povolená denná dávka bola 10 mg prednizónu alebo jej ekvivalent). Pacienti randomizovaní do niektorej zo skupín pokračovali v liečbe až do vzniku progresie ochorenia (definovaného ako rádiologicky potvrdená progresia alebo výskyt kostnej príhody) a začiatku novej systémovej protinádorovej liečby, pri neakceptovateľnej toxicite alebo nutnosti prerušenia liečby.
Nasledujúce demografické údaje pacientov a základné charakteristiky ochorenia boli rovnovážne rozložené medzi liečebnými skupinami. Medián veku bol 69 rokov (rozsah 41-92) a rasová príslušnosť bola 93 % belošská, 4 % černošská, 1 % ázijská a 2 % iná. ECOG skóre výkonnostného stavu bolo 0-1 u 91,5 % pacientov a 2 u 8,5 % pacientov; 28 % malo priemerné skóre bolesti (Brief Pain Inventory Score) ≥ 4 (priemer najhoršej pacientmi uvádzanej bolesti počas predchádzajúcich 24 hodín
vypočítaný za obdobie siedmich dní pred randomizáciou). Väčšina (91 %) pacientov mala metastázy do kostí a 23 % pacientov malo viscerálne pľúcne a/alebo pečeňové postihnutie. Pri vstupe
do skúšania malo 41 % randomizovaných pacientov len progresiu PSA, kým 59 % pacientov malo rádiologickú progresiu. Na začiatku bolo päťdesiatjeden percent (51 %) pacientov liečených
bisfosfonátmi.
Z klinického skúšania AFFIRM boli vylúčení pacienti s ochoreniami, ktoré ich predisponovali
k vzniku epileptických záchvatov (pozri časť 4.8) a užívajúci lieky, ktoré znižujú prah citlivosti pre vznik epileptického záchvatu, ako aj pacienti s klinicky významným kardiovaskulárnym

ochorením ako nekontrolovaná hypertenzia, infarkt myokardu v nedávnej anamnéze alebo nestabilná angína, zlyhanie srdca triedy III alebo IV podľa Newyorskej srdcovej asociácie (ak nebola ejekčná frakcia ≥ 45 %), klinicky signifikantné ventrikulárne arytmie alebo atrioventrikulárnu blokádu (bez permanentného kardiostimulátora).
Protokolom vopred špecifikovaná predbežná analýza po 520 úmrtiach ukázala štatisticky významnú superioritu v celkovom prežívaní u pacientov liečených enzalutamidom oproti placebu (Tabuľka 3
a Obrázky 4 a 5).
Tabuľka 3: Celkové prežívanie pacientov liečených buď enzalutamidom alebo placebomv klinickom skúšaní AFFIRM (Intent –to-Treat analýza)Enzalutamid (n = 800) Placebo (n = 399) Úmrtia (%) 308 (38,5 %) 212 (53,1 %) Medián prežívania (mesiace) (95 % CI) 18,4 (17,3, NR) 13,6 (11,3, 15,8) P-hodnotaa < 0,0001
Pomer rizík (95 % CI)b 0,631 (0,529 - 0,752)
a P-hodnota vychádza z log-rank testu stratifikovaného podľa ECOG skóre výkonnostného stavu (0-1
vs. 2) a priemerného skóre bolesti (< 4 vs. ≥ 4)
b Pomer rizík (Hazard Ratio) vychádza zo stratifikovaného modelu proporčných rizík. Pomer rizík < 1
znamená lepší efekt enzalutamidu
NR, nedosiahnuté
Obrázok 4: Kaplanove-Meierove krivky celkového prežívania v klinickom skúšaní AFFIRM (ITT analýza)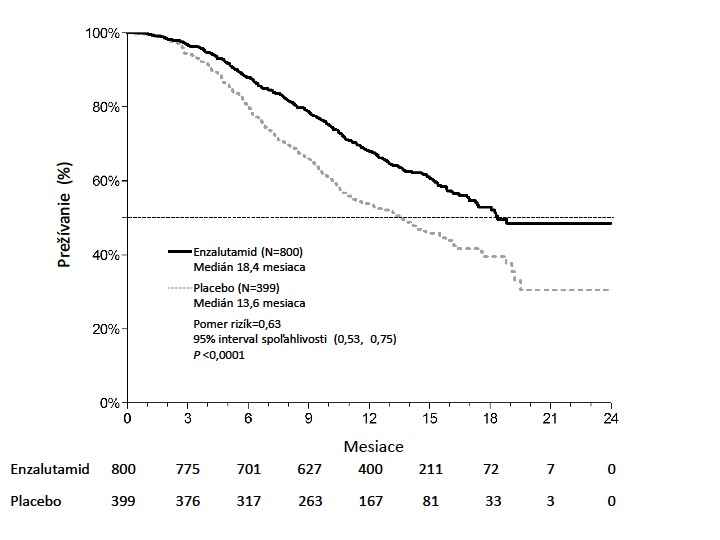
O
brázok 5: Celkové prežívanie podľa podskupín v klinickom skúšaní AFFIRM – Pomer rizík a 95 % interval spoľahlivosti
ECOG: Východná spolupracujúca onkologická skupina; BPI-SF: krátka forma dotazníka bolesti; PSA: prostatický špecifický antigén
Okrem pozorovaného zlepšenia celkového prežívania aj hlavné sekundárne ciele (progresia PSA, prežívanie bez rádiologickej progresie a čas do prvej kostnej príhody) preferovali enzalutamid a boli štatisticky významné po úprave pre viacnásobné testovanie.
Prežívanie bez rádiologickej progresie hodnotené skúšajúcim podľa kritérií RECIST v 1.1 pre mäkké tkanivá a podľa výskytu 2 alebo viacerých kostných lézií na snímku kostí bolo 8,3 mesiaca
pre pacientov liečených enzalutamidom a 2,9 mesiaca pre pacientov, ktorí užívali placebo
(HR = 0,404; 95 % CI: [0,350 – 0,466]; p < 0,0001). Analýza zahŕňala 216 úmrtí bez potvrdenej progresie a 645 potvrdených príhod progresie, z ktorých v 303 prípadoch (47 %) išlo o progresiu
do mäkkých tkanív, v 268 prípadoch (42 %) o kostnú progresiu a v 74 prípadoch (11 %) išlo súčasne
o lézie v mäkkých tkanivách aj v kostiach.
Potvrdený 50 % alebo 90 % pokles PSA bol prítomný u 54,0 % a 24,8 % pacientov, ktorí užívali enzalutamid a 1,5 % a 0,9 % pacientov užívajúcich placebo (p < 0,0001). Medián času do progresie PSA bol 8,3 mesiaca pre pacientov liečených enzalutamidom a 3,0 mesiaca pre pacientov užívajúcich placebo (HR = 0,248, 95 % CI: [0,204 – 0,303]; p < 0,0001).
Medián času do prvej skeletálnej udalosti bol 16,7 mesiaca pre pacientov liečených enzalutamidom
a 13,3 mesiaca pre pacientov užívajúcich placebo (HR = 0,688, 95 % CI: [0,566 – 0,835]; p < 0,0001). Skeletálna udalosť bola definovaná ako potreba rádioterapie kostí alebo chirurgického výkonu
na kostiach, patologická fraktúra kostí, kompresia miechy alebo zmena protinádorovej liečby z dôvodu
bolesti kostí. Analýza zahŕňala 448 skeletálnych udalostí, z toho v 227 prípadoch (62 %) išlo
o rádioterapiu kostí, v 95 prípadoch (21 %) o kompresiu miechy, v 47 prípadoch (10 %) udalostí tvorili patologické kostné fraktúry, v 36 prípadoch (8 %) došlo k zmene protinádorovej liečby pre bolesti kostí a v 7 prípadoch (2 %) bol potrebný chirurgický zásah do kostí.
Skúšanie 9785-CL-0410 (enzalutamid po abirateróne u pacientov s metastatickým CRPC)
Išlo o skúšanie u 214 pacientov s progredujúcim metastatickým CRPC v jednej skupine, ktorí
po liečbe abiraterón acetátom a prednizónom, ktorá trvala najmenej 24 týždňov, dostávali enzalutamid (160 mg raz denne). Medián rPFS (prežitie bez rádiologickej progresie, hlavný cieľ skúšania) bol 8,1 mesiaca (95 % CI: 6,1; 8,3). Medián OS nebol dosiahnutý. PSA odpoveď (definovaná ako ≥ 50 % zníženie oproti východiskovej hodnote) bola 22,4 % (95 % CI:17,0; 28,6.).
U 145 pacientov, ktorí predtým dostávali chemoterapiu, bol medián rPFS 7,9 mesiaca (95 % CI: 5,5,
10,8). PSA odpoveď bola 23,2 % (95 % CI: 13,9; 34,9).
U 69 pacientov bez predchádzajúcej chemoterapie bol medián rPFS 8,1 mesiaca (95 % CI: 5,7; 8,3).
PSA odpoveď bola 22,1 % (95 % CI: 15,6; 29,7).
Hoci u niektorých pacientov bola odpoveď na liečbu enzalutamidom po abirateróne obmedzená, dôvod tohto zistenia nie je v súčasnosti známy. Dizajn skúšania nemôže ani identifikovať pacientov,
u ktorých je pravdepodobný prínos, a ani poradie, v ktorom má byť optimálne sekvenčne podávaný
enzalutamid a abiraterón.
Starší pacienti
Z 1 671 pacientov v klinickom skúšaní fázy 3 užívajúcich enzalutamid malo 1 261 (75 %) viac ako
65 rokov a 516 pacientov (31 %) malo viac ako 75 rokov. Neboli pozorované žiadne celkové rozdiely v bezpečnosti alebo účinnosti medzi týmito staršími a mladšími pacientmi.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií pre enzalutamid vo všetkých vekových podskupinách detí a dospievajúcich pri karcinóme prostaty (informácie
o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Enzalutamid je zle rozpustný vo vode. V prípade tohto lieku sa rozpustnosť enzalutamidu zvyšuje pomocou kaprylokaproyl makrogolglyceridov ako emulgátorov/surfaktantov. V predklinických štúdiách absorpcia enzalutamidu stúpla, keď bol rozpustený v kaprylokaproyl makrogolglyceridoch.
Farmakokinetika enzalutamidu bola hodnotená u pacientov s karcinómom prostaty a u zdravých mužov. Priemerný terminálny polčas (t1/2 ) enzalutamidu u pacientov po podaní jednorazovej perorálnej dávky je 5,8 dní (rozsah 2,8 až 10,2 dní) a rovnovážny stav sa dosiahne približne za jeden mesiac. Pri dennom perorálnom podávaní dôjde k nahromadeniu enzalutamidu na úroveň približne
8,3-násobku jednorazovej dávky. Výkyvy v plazmatických koncentráciách počas dňa sú nízke (pomer
najvyššej a najnižšej hodnoty je 1,25). Klírens enzalutamidu sa uskutočňuje primárne cez pečeňový metabolizmus, pričom dochádza k vytvoreniu aktívneho metabolitu, ktorý je rovnako aktívny ako enzalutamid a cirkuluje približne v rovnakej plazmatickej koncentrácii.
Absorpcia
Maximálne plazmatické koncentrácie (Cmax ) enzalutamidu boli u pacientov pozorované za 1 až
2 hodiny po podaní. Na základe balančnej štúdie celkového príjmu a výdaja u ľudí sa odhaduje
absorpcia enzalutamidu po perorálnom podaní na úrovni najmenej 84,2 %. Enzalutamid nie je substrátom efluxových transportérov P-gb alebo BCRP. V rovnovážnom stave sú priemerné hodnoty
Cmax pre enzalutamid 16,6 μg/ml (23 % variačný koeficient [CV]) a 12,7 μg/ml (30 % CV) pre jeho aktívny metabolit.
Jedlo nemá žiadny klinicky významný účinok na mieru absorpcie. V klinických skúšaniach bolo
Xtandi podávané bez ohľadu na príjem potravy.
D
is
t
ri
b
úcia
Priemerný zdanlivý distribučný objem (V/F) enzalutamidu u pacientov po jednorazovej perorálnej dávke je 110 litrov (29 % CV). Distribučný objem enzalutamidu je väčší než objem celkovej telesnej
vody, čo poukazuje na jeho extenzívnu extravaskulárnu distribúciu. Štúdie na hlodavcoch ukazujú, že
enzalutamid a jeho aktívny metabolit môžu prestupovať cez hematoencefalickú bariéru.
Enzalutamid je z 97 % až 98 % viazaný na plazmatické proteíny, primárne albumín. Aktívny metabolit je z 95 % viazaný na plazmatické proteíny. In vitro nedošlo k žiadnemu vytesneniu z väzby na proteín medzi enzalutamidom a inými vysoko viazanými liekmi (warfarín, ibuprofen a kyselina salicylová).
Biotransformácia
Enzalutamid sa metabolizuje extenzívne. V ľudskej plazme sú prítomné dva hlavné metabolity: N- dezmetyl enzalutamid (aktívny) a derivát kyseliny karboxylovej (neaktívny). Enzalutamid sa
metabolizuje prostredníctvom CYP2C8 a v menšom rozsahu prostredníctvom CYP3A4/5 (pozri časť
4.5), obidva enzýmy majú svoju úlohu v tvorbe aktívneho metabolitu. In vitro sa N-dezmetyl enzalutamid metabolizuje na metabolit kyseliny karboxylovej prostredníctvom karboxylesterázy 1, ktorá tiež hrá menšiu úlohu v metabolizme enzalutamidu na metabolit kyseliny karboxylovej.
N-dezmetyl enzalutamid sa in vitro nemetabolizoval prostredníctvom enzýmov CYP.
V podmienkach klinického používania je enzalutamid silným induktorom CYP3A4, stredne silným induktorom CYP2C9 a CYP2C19 a nemá žiadny klinicky relevantný vplyv na CYP2C8 (pozri časť
4.5).
Eliminácia
Priemerný klírens (CL/F) enzalutamidu u pacientov sa pohybuje od 0,520 do 0,564 litra/hodinu.
Po perorálnom podaní 14C-enzalutamidu sa do 77 dní po užití zachytilo 84,6 % rádioaktivity: 71,0 %
sa zachytilo v moči (primárne ako inaktívny metabolit so stopovými množstvami enzalutamidu
a aktívneho metabolitu) a 13,6 % sa zachytilo v stolici (0,39 % dávky ako nezmenený enzalutamid).
In vitro údaje ukazujú, že enzalutamid nie je substrátom pre OATP1B1, OATP1B3 alebo OCT1
a N-dezmetyl enzalutamid nie je substrátom pre P-gp alebo BCRP.
In vitro údaje ukazujú, že enzalutamid a jeho hlavné metabolity neinhibujú nasledujúce transportéry pri klinicky relevantných koncentráciách: OATP1B1, OATP1B3, OCT2 alebo OAT1.
Linearita
Nie sú pozorované žiadne významné odchýlky proporcionality dávky mimo rozsahu dávok 40 až
160 mg. Rovnovážne Cmin hodnoty enzalutamidu a aktívneho metabolitu u jednotlivých pacientov zostávali konštantné počas viac než jedného roka chronickej liečby, čo po dosiahnutí rovnovážneho
stavu preukazuje časovo lineárnu farmakokinetiku.
Porucha funkcieobličiek
Formálne nebolo pre enzalutamid uskutočnené žiadne klinické skúšanie pri poškodení funkcie
obličiek. Pacienti so sérovým kreatinínom > 177 μmol/l (2 mg/dl) boli z klinického skúšania vyradení.
Na základe populačnej farmakokinetickej analýzy nie je potrebná žiadna úprava dávkovania
u pacientov s vypočítanými hodnotami klírensu kreatinínu (CrCL) ≥ 30 ml/min (stanovené vzorcom podľa Cockcrofta a Gaulta). Enzalutamid nebol hodnotený u pacientov s ťažkým poškodením funkcie obličiek (CrCL < 30 ml/min) alebo ochorením obličiek v koncovom štádiu a pri liečbe týchto
pacientov sa odporúča opatrnosť. Je nepravdepodobné, že by bol enzalutamid signifikantne odstránený použitím intermitentnej hemodialýzy alebo kontinuálnou ambulantnou peritoneálnou dialýzou.
Porucha funkciepečene
Porucha funkcie pečene nemala výrazný vplyv na celkovú expozíciu enzalutamidu alebo jeho aktívnemu metabolitu. Avšak u pacientov s ťažkou poruchou funkcie pečene bol biologický polčas
lieku v porovnaní so zdravou kontrolou dvojnásobný (10,4 dňa v porovnaní s 4,7 dňami), čo asi
súviselo so zvýšenou distribúciou v tkanivách.
Farmakokinetika enzalutamidu bola skúmaná u subjektov so vstupným ľahkým (n = 6), stredne ťažkým (n = 8) alebo ťažkým (n = 8) poškodením funkcie pečene (Childova-Pughovej trieda A, B alebo C) a u 22 porovnateľných subjektov v kontrolnej skupine s normálnou funkciou pečene.
Po podaní jednorazovej perorálnej 160 mg dávky enzalutamidu pacientom s ľahkým poškodením funkcie pečene sa AUC enzalutamidu zvýšila o 5 % a Cmax sa zvýšila o 24 % a u pacientov so stredne ťažkým poškodením funkcie pečene sa AUC enzalutamidu zvýšila o 29 % a Cmax sa znížila o 11 %
a AUC enzalutamidu u subjektov s ťažkou poruchou funkcie pečene sa zvýšila o 5 % a Cmax sa znížila o 41 %v porovnaní so zdravými subjektmi v kontrolnej skupine. V prípade súčtu voľného
enzalutamidu a jeho voľného aktívneho metabolitu u pacientov s ľahkým poškodením funkcie pečene sa AUC zvýšila o 14 % a Cmax sa zvýšila o 19 %, u pacientov so stredne ťažkým poškodením funkcie pečene sa AUC zvýšila o 14 % a Cmax sa znížila o 17 % a u subjektov s ťažkou poruchou funkcie pečene sa AUC zvýšila o 34 % a Cmax sa znížila o 27 % v porovnaní so zdravými subjektmi
v kontrolnej skupine.
Rasa
Väčšina pacientov v klinických skúšaniach (> 84 %) patrila k belošskej rase. Na základe farmakokinetických údajov z klinického skúšania u japonských pacientov s karcinómom prostaty nebol nájdený žiaden klinicky významný rozdiel v expozícii medzi Japoncami a belochmi. Nie je k dispozícii dostatočné množstvo údajov na vyhodnotenie možných rozdielov vo farmakokinetike u iných rás.
Starší pacienti
V populačnej farmakokinetickej analýze nebol pozorovaný žiadny klinicky relevantný vplyv veku
na farmakokinetiku enzalutamidu.
5.3 Predklinické údaje o bezpečnosti
Podávanie enzalutamidu gravidným myšiam viedlo k zvýšenému výskytu embryofetálnych úmrtí, vonkajších a kostrových zmien. Neboli uskutočnené štúdie reprodukčnej toxicity enzalutamidu, ale v štúdiách na potkanoch (4 a 26 týždňov) a psoch (4, 13 a 39 týždňov) boli zaznamenané atrofia, aspermia/hypospermia a hypertrofia/hyperplázia v reprodukčnom systéme, čo je v súlade
s farmakologickým účinkom enzalutamidu. V štúdiách na myšiach (4 týždne), potkanoch (4 a 26
týždňov) a psoch (4, 13 a 39 týždňov) boli prítomné zmeny na reprodukčných orgánoch spojené s podávaním enzalutamidu ako zníženie hmotnosti orgánov s atrofiou prostaty a nadsemenníka. Hypertrofia a/alebo hyperplázia Leydigových buniek boli pozorované u myší (4 týždne) a psov
(39 týždňov). Ďalšie zmeny na reprodukčných tkanivách zahŕňali hypertrofiu/hyperpláziu hypofýzy
a atrofiu semenných mechúrikov u potkanov a testikulárnu hypospermiu a degeneráciu semenotvorných tubulov u psov. Rozdiely medzi pohlaviami boli zaznamenané pri prsných žľazách
potkanov (atrofia u samcov a lobulárna hyperplázia u samíc). Zmeny na reprodukčných orgánoch
obidvoch druhov boli v súlade s farmakologickými účinkami enzalutamidu a úplne alebo čiastočne
vymizli po 8-týždňovom období zotavovania. Ani u jedného druhu neboli prítomné žiadne významné zmeny v klinickej patológii alebo histopatológii žiadneho iného orgánového systému, vrátane pečene.
Štúdie na gravidných potkanoch ukázali, že enzalutamid a/alebo jeho metabolity sú prenášané na plody. Po perorálnom podaní rádioaktívne značeného 14C-enzalutamidu potkanom v 14. deň tehotenstva v dávke 30 mg/kg (~1,9 násobok maximálnej dávky indikovanej u ľudí) bola maximálna rádioaktivita v plode dosiahnutá 4 hodiny po podaní a bola nižšia ako rádioaktivita v plazme matky
v pomere tkanivo/plazma 0,27. Rádioaktivita v plode klesla na 0,08 násobok maximálnej koncentrácie za 72 hodín po podaní.
Štúdie na dojčiacich potkanoch ukázali, že enzalutamid a/alebo jeho metabolity sú vylučované do mlieka potkanov. Po perorálnom podaní rádioaktívne značeného 14C-enzalutamidu dojčiacim potkanom v dávke 30 mg/kg (~1,9 násobok maximálnej dávky indikovanej u ľudí) bola maximálna
v plazme matky. Výsledky štúdie tiež ukázali, že enzalutamid a/alebo jeho metabolity prechádzajú cez mlieko do tkanív dojčených potkanov a následne sú eliminované.
Enzalutamid nevyvolával mutácie v teste mikrobiálnej mutagenézy (Ames) a nebol klastogénny ani v in vitro cytogenetickom teste s lymfómovými bunkami myší ani v in vivo mikronukleárnom teste
u myší. Neboli uskutočnené dlhodobé štúdie na zvieratách na stanovenie karcinogénneho potenciálu
enzalutamidu. Enzalutamid nebol in vitro fototoxický.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly
kaprylokaproyl-makrogol-8-glyceridy butylhydroxyanizol (E320)
butylhydroxytoluén (E321)
Obal kapsuly želatína
sorbitol - roztok sorbitolu glycerol
oxid titaničitý (E171)
čistená voda
Potlačováfarba
čierny oxid železa (E172)
polyvinylacetátftalát
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Papierový rozkladací obal s polyvinylchlorid (PVC) / polychlórtrifluóretylén (PCTFE)/ hliníkovým blistrom po 28 mäkkých kapsúl. Každé balenie obsahuje 4 puzdrá (112 mäkkých kapsúl).
6.6 Špeciálne opatrenia na likvidáciu
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Astellas Pharma Europe B.V. Sylviusweg 62
2333 BE Leiden
Holandsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
EU/1/13/846/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21. júna 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.

Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUXtandi 40 mg filmom obalené tablety
Xtandi 80 mg filmom obalené tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEXtandi 40 mg filmom obalené tabletyKaždá filmom obalená tableta obsahuje 40 mg enzalutamidu.
Xtandi 80 mg filmom obalené tabletyKaždá filmom obalená tableta obsahuje 80 mg enzalutamidu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMAFilmom obalená tableta.
Xtandi 40 mg filmom obalené tabletyŽlté okrúhle filmom obalené tablety s vyrazeným označením E 40.
Xtandi 80 mg filmom obalené tabletyŽlté oválne filmom obalené tablety s vyrazeným označením E 80.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieXtandi je indikovaný na:
• liečbu metastázujúceho karcinómu prostaty rezistentného na kastráciu (CRPC) u dospelých mužov, ktorí sú asymptomatickí alebo mierne symptomatickí po zlyhaní androgénnej deprivačnej terapie, u ktorých doposiaľ nebola klinicky indikovaná chemoterapia (pozri časť 5.1).
• liečbu metastázujúceho CRPC u dospelých mužov, u ktorých došlo k progresii ochorenia
počas liečby alebo po liečbe docetaxelom.
4.2 Dávkovanie a spôsob podávaniaDávkovanieOdporúčaná dávka je 160 mg enzalutamidu (štyri 40 mg filmom obalené tablety alebo dve 80 mg filmom obalené tablety) podaná perorálne jedenkrát denne.
Počas liečby pacientov, ktorí nie sú chirurgicky kastrovaní, sa má pokračovať v liekovej kastrácii analógom hormónu uvoľňujúceho luteinizačný hormón (LHRH).
Ak pacient neužije Xtandi v obvyklom čase, predpísanú dávku má užiť podľa možnosti čo najskôr. Ak pacient vynechá dávku počas celého dňa, v liečbe má pokračovať nasledujúci deň užitím obvyklej dennej dávky.
Ak sa u pacienta vyskytne toxicita 3. stupňa alebo vyššia alebo netolerovateľná nežiaduca reakcia, má sa užívanie lieku prerušiť na týždeň alebo dovtedy, kým nedôjde k zlepšeniu príznakov na 2. stupeň alebo nižší, potom sa má v liečbe pokračovať užívaním rovnakej alebo ak je to potrebné redukovanej dávky (120 mg alebo 80 mg).
Súbežné použitie so silnými inhibítormi CYP2C8
Ak je to možné, treba sa vyhnúť súčasnému užívaniu silných inhibítorov CYP2C8. Ak je pacientovi potrebné súbežne podávať silný inhibítor CYP2C8, má sa znížiť dávka enzalutamidu na 80 mg
jedenkrát denne. Ak bolo podávanie silného inhibítora CYP2C8 ukončené, má sa dávka enzalutamidu upraviť na dávku užívanú pred začatím podávania silného inhibítora CYP2C8 (pozri časť 4.5).
Starší ľudia
U starších pacientov nie je potrebná žiadna úprava dávkovania (pozri časti 5.1 a 5.2).
Porucha funkcie pečene
U pacientov s ľahkou, stredne ťažkou alebo ťažkou poruchou funkcie pečene (Childova-Pughovej trieda A, B alebo C) nie je potrebná žiadna úprava dávkovania. Avšak u pacientov s ťažkou poruchou funkcie pečene bol pozorovaný predĺžený biologický polčas enzalutamidu (pozri časti 4.4 a 5.2).
Porucha funkcie obličiek
U pacientov s ľahkou až stredne ťažkou poruchou funkcie obličiek nie je potrebná žiadna úprava dávkovania (pozri časť 5.2). Opatrnosť sa odporúča u pacientov s ťažkou poruchou funkcie obličiek alebo pri ochorení obličiek v koncovom štádiu (pozri časť 4.4).
Pediatrická populácia
Použitie enzalutamidu sa netýka detí a dospievajúcich v indikácii, ktorou je liečba metastázujúceho
CRPC u dospelých mužov.
Spôsob podávania
Xtandi je určený na perorálne použitie. Filmom obalené tablety sa majú prehltnúť celé a zapiť vodou
a môžu sa užívať s jedlom alebo bez jedla.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Ženy, ktoré sú tehotné alebo môžu potenciálne otehotnieť (pozri časť 4.6).
4.4 Osobitné upozornenia a opatrenia pri používaní
Riziko epileptického záchvatu
Opatrnosť je potrebná pri podávaní Xtandi pacientom s anamnézou záchvatov alebo s inými
predisponujúcimi faktormi, ktoré okrem iných, zahŕňajú existujúce poranenia mozgu, mŕtvicu, primárne nádory alebo mozgové metastázy alebo alkoholizmus. Okrem toho sa riziko epileptického záchvatu môže zvýšiť u pacientov, ktorí súbežne používajú lieky znižujúce prah pre vznik záchvatov. Rozhodnutie či pokračovať v liečbe u pacientov, u ktorých došlo k vzniku záchvatov, sa má zvážiť prípad od prípadu.
Syndróm reverzibilnej posteriórnej encefalopatie
Zriedkavo boli hlásené prípady syndrómu reverzibilnej posteriórnej encefalopatie (PRES) u pacientov
liečených Xtandi (pozri časť 4.8). PRES je zriedkavá reverzibilná neurologická porucha, ktorá sa môže prejaviť rýchlo sa rozvíjajúcimi príznakmi vrátane epileptického záchvatu, bolesti hlavy, zmätenosti, slepoty, iných vizuálnych porúch a neurologických porúch s hypertenziou alebo bez nej. Diagnóza PRES si vyžaduje potvrdenie zobrazovacím vyšetrením mozgu, prednostne magnetickou rezonanciou (MRI). U pacientov, u ktorých sa vyskytol PRES sa odporúča prerušenie liečby Xtandi.
Súbežné použitie s ďalšímiliekmi
Enzalutamid je silný enzýmový induktor a môže spôsobiť stratu účinnosti mnohých bežne používaných liekov (pozri príklady v časti 4.5). Preto sa majú pred začiatkom liečby enzalutamidom skontrolovať súbežne používané lieky. Obvykle je potrebné vyhnúť sa súbežnému použitiu enzalutamidu s liekmi, ktoré sú senzitívnymi substrátmi mnohých metabolizujúcich enzýmov alebo transportérov (pozri časť 4.5), ak je ich terapeutický účinok pre pacienta veľmi dôležitý a ak nie je možné urobiť jednoduchú zmenu dávkovania na základe sledovania účinnosti alebo plazmatických koncentrácií.
Treba sa vyhýbať súbežnému podávaniu lieku s warfarínom a antikoagulanciami kumarínového typu. Ak sa Xtandi podáva súbežne s antikoagulanciom metabolizovaným CYP2C9 (ako sú warfarín alebo acenokumarol), je potrebné dodatočné monitorovanie medzinárodného normalizovaného pomeru (INR) (pozri časť 4.5).
Porucha funkcieobličiek
Opatrnosť je potrebná u pacientov s ťažkou poruchou funkcie obličiek, pretože enzalutamid nebol
v tejto skupine pacientov skúmaný.
Ťažkáporuchafunkciepečene
Predĺžený biologický polčas enzalutamidu bol pozorovaný u pacientov s ťažkou poruchou funkcie pečene, čo asi súviselo so zvýšenou distribúciou v tkanivách. Klinický význam tohto pozorovania zostáva neznámy. Predpokladá sa ale predĺžený čas na dosiahnutie rovnovážneho stavu koncentrácií,
a že sa môže predĺžiť čas maximálneho farmakologického účinku, rovnako ako čas nástupu a poklesu
indukcie enzýmov (pozri časť 4.5).
Nedávne kardiovaskulárne poruchy
Klinické skúšania 3. fázy nezahŕňali pacientov s nedávnym infarktom myokardu (počas posledných 6 mesiacov) alebo nestabilnou angínou (počas posledných 3 mesiacov), srdcovým zlyhávaním III. alebo IV. triedy podľa klasifikácie New York Heart Association (NYHA) s výnimkou ejekčnej frakcie ľavej komory (LVEF) ≥ 45 %, bradykardiou alebo nekontrolovanou hypertenziou. To je potrebné vziať do úvahy pri predpisovaní Xtandi týmto pacientom.
Androgén - deprivačnáliečbamôžepredlžovaťQTinterval.
Pred začiatkom liečby Xtandi má lekár zvážiť pomer prínosu a rizika, vrátane rizika Torsade de pointes, u pacientov s rizikovými faktormi na predĺženie QT intervalu v anamnéze a u pacientov súbežne užívajúcich lieky, ktoré môžu predlžovať QT interval (pozri časť 4.5).
Použitie s chemoterapiou
Bezpečnosť a účinnosť súbežného použitia Xtandi s cytotoxickou chemoterapiou nebola stanovená. Súbežné podávanie enzalutamidu nemá klinicky významný účinok na farmakokinetiku intravenózne podávaného docetaxelu (pozri časť 4.5); nemožno však vylúčiť zvýšenie výskytu neutropénie vyvolanej docetaxelom.
Reakcie precitlivenosti
Pri enzalutamide boli pozorované reakcie precitlivenosti prejavujúce sa príznakmi, ako napríklad opuch jazyka, opuch pery a opuch hltana (pozri časť 4.8 ).
4.5 Liekové a iné interakcie
Schopnosť iných liekovovplyvniťexpozícieenzalutamidu
Inhibítory CYP2C8
CYP2C8 zohráva významnú úlohu v eliminácii enzalutamidu a v tvorbe jeho aktívneho metabolitu. Po perorálnom podaní silného inhibítora CYP2C8 gemfibrozilu (600 mg dvakrát denne) zdravým
mužom sa AUC enzalutamidu zvýšila o 362 %, zatiaľ čo sa Cmax enzalutamidu znížila o 18 %.
V prípade súčtu voľného enzalutamidu a jeho voľného aktívneho metabolitu sa AUC zvýšila o 77 %, zatiaľ čo Cmax sa znížila o 19 %. Počas liečby enzalutamidom je potrebné vyhýbať sa použitiu silných inhibítorov CYP2C8 (napr. gemfibrozil) alebo ich treba používať so zvýšenou opatrnosťou. Ak sa
pacientom musí súbežne podať silný inhibítor CYP2C8, má sa znížiť dávka enzalutamidu na 80 mg
jedenkrát denne (pozri časť 4.2).
Inhibítory CYP3A4
CYP3A4 zohráva v metabolizme enzalutamidu druhoradú úlohu. Po perorálnom podaní silného inhibítora CYP3A4 itrakonazolu (200 mg jedenkrát denne) zdravým mužom sa zvýšila AUC
enzalutamidu o 41 %, Cmax zostala nezmenená. V prípade súčtu voľného enzalutamidu a jeho voľného
aktívneho metabolitu sa AUC zvýšila o 27 %, zatiaľ čo Cmax zostala opäť nezmenená. Pri súbežnom používaní Xtandi s inhibítormi CYP3A4 nie je potrebná žiadna úprava dávkovania.
Induktory CYP2C8 a CYP3A4
Po perorálnom podaní stredne silného induktora CYP2C8 a silného induktora CYP3A4 rifampicínu
(600 mg jedenkrát denne) zdravým dobrovoľníkom mužského pohlavia, AUC súčtu enzalutamidu
a aktívneho metabolitu sa znížila o 37 %, zatiaľ čo Cmax zostala nezmenená. Pri súbežnom používaní
Xtandi s induktormi CYP2C8 alebo CYP3A4 nie je potrebná žiadna úprava dávkovania.
Schopnosť enzalutamidu ovplyvniťexpozícieinýchliekov
Indukcia enzýmov
Enzalutamid je silný enzýmový induktor a zvyšuje syntézu mnohých enzýmov a transportérov; preto
sú očakávané interakcie s mnohými bežnými liekmi, ktoré sú substrátmi enzýmov alebo transportérov. Môže dôjsť k značnému zníženiu plazmatických koncentrácií, a tým k strate alebo redukcii klinického účinku. Existuje tiež riziko zvýšenej tvorby aktívnych metabolitov. Enzýmy, ktoré môžu byť indukované zahŕňajú CYP3A v pečeni a čreve, CYP2B6, CYP2C9, CYP2C19 a uridín 5'-difosfo- glukuronyltransferázu (UDP-glukuronid konjugujúce enzýmy). Môže tiež dôjsť k indukcii transportnej bielkoviny P-gp a pravdepodobne aj iných transportérov, napr. viacliekového rezistentného
proteínu 2 (MRP2), proteínu rezistencie rakoviny prsníka (BCRP) a polypeptidu transportujúceho organické anióny 1B1 (OATP1B1).
In vivo štúdie ukázali, že enzalutamid je silný induktor CYP3A4 a stredne silný induktor CYP2C9
a CYP2C19. Súčasné podávanie enzalutamidu (160 mg jedenkrát denne) s jednorazovými perorálnymi dávkami senzitívnych CYP substrátov u pacientov s karcinómom prostaty viedlo k 86 % zníženiu
AUC midazolamu (substrát CYP3A4), 56 % zníženiu AUC S-warfarínu (substrát CYP2C9) a 70 %
zníženiu AUC omeprazolu (substrát CYP2C19). Podobne mohla byť indukovaná aj UDP1A1.
V klinickom skúšaní u pacientov s metastázujúcim karcinómom prostaty rezistentným na kastráciu nemal Xtandi (160 mg jedenkrát denne) klinicky významný účinok na farmakokinetiku intravenózne podávaného docetaxelu (75 mg/m2 infúziou každé 3 týždne). Hodnota AUC docetaxelu sa znížila
o 12 % [geometrický priemer (GMR) = 0,882 (90 % IS: 0,767; 1,02)] zatiaľ čo hodnota Cmax sa znížila o 4 % [GMR = 0,963 (90 % IS: 0,834; 1,11)].
Očakávané sú interakcie s niektorými liekmi, ktoré sú eliminované cez metabolizmus alebo aktívny transport. Ak je ich terapeutický účinok pre pacienta veľmi dôležitý a nie sú možné jednoduché zmeny dávkovania na základe sledovania účinnosti alebo plazmatických koncentrácií, takéto lieky sa nemajú používať alebo sa majú používať s opatrnosťou. Riziko poškodenia pečene po podaní paracetamolu sa očakáva, že bude vyššie u pacientov, ktorí sú súbežne liečení induktormi enzýmov.
Skupiny liekov, ktoré môžu byť ovplyvnené (avšak nie sú obmedzené iba na tieto skupiny), zahŕňajú:
• analgetiká (napr. fentanyl, tramadol),
• antibiotiká (napr. klaritromycín, doxycyklín),
• protinádorové lieky (napr. kabazitaxel),
• antikoagulanciá (napr. acenokumarol, warfarín),
• antiepileptiká (napr. karbamazepín, klonazepam, fenytoín, primidon, kyselina valproová),
• antipsychotiká (napr. haloperidol),
• betablokátory (napr. bisoprolol, propranolol),
• blokátory kalciového kanála (napr. diltiazem, felodipín, nikardipín, nifedipín, verapamil),
• srdcové glykozidy (napr. digoxín),
• kortikosteroidy (napr. dexametazón, prednizolón),
• HIV antivirotiká (napr. indinavir, ritonavir),
• hypnotiká (napr. diazepam, midazolam, zolpidem),
• statíny metabolizované CYP3A4 (napr. atorvastatín, simvastatín),
• hormóny štítnej žľazy (napr. levotyroxín).
Celkové indukčné schopnosti enzalutamidu sa nemusia prejaviť skôr ako približne 1 mesiac od začatia liečby, kedy sa dosiahnu stabilné plazmatické koncentrácie enzalutamidu, hoci niektoré indukčné účinky sa môžu prejaviť aj skôr. U pacientov užívajúcich lieky, ktoré sú substrátmi CYP2B6, CYP3A4, CYP2C9, CYP2C19 alebo UGT1A1 sa má zhodnotiť možná strata farmakologických účinkov (alebo zosilnenie účinkov v prípadoch, kedy sa tvoria aktívne metabolity) počas prvého mesiaca liečby enzalutamidom a ak je to potrebné, má sa zvážiť úprava dávkovania. Vzhľadom
na dlhý polčas enzalutamidu (5,8 dní, pozri časť 5.2) môžu po prerušení užívania enzalutamidu jeho
účinky na enzýmy pretrvávať mesiac alebo aj dlhšie. Pri ukončení liečby enzalutamidom môže byť potrebné postupné znižovanie dávky súčasne podávaného lieku.
Substráty CYP1A2 a CYP2C8
Enzalutamid (160 mg jedenkrát denne) nespôsobil klinicky významnú zmenu AUC alebo Cmax kofeínu
(substrát CYP1A2) alebo pioglitazónu (substrát CYP2C8). Hodnota AUC pioglitazónu sa zvýšila o 20 %, kým Cmax sa znížila o 18 %. Hodnota AUC kofeínu sa znížila o 11 % a Cmax sa znížila
o 4 %.Pri súbežnom podávaní substrátu CYP1A2 alebo CYP2C8 s liekom Xtandi nie je potrebná žiadna úprava dávkovania.
Substráty P-gp
In vitro údaje ukazujú, že enzalutamid môže byť inhibítorom efluxového transportéra P-gp. Účinok
enzalutamidu na substráty P-gp nebol hodnotený in vivo; avšak v podmienkach klinického použitia môže byť enzalutamid induktorom P-gp cez aktiváciu pregnánového nukleárneho receptora (PXR). Lieky s úzkym terapeutickým indexom, ktoré sú substrátmi P-gp (napr. kolchicín, dabigatran etexilát, digoxín) sa majú pri súčasnom podávaní s liekom Xtandi užívať opatrne a pre zachovanie optimálnych plazmatických koncentrácií môže byť potrebná úprava dávkovania.
Substráty BCRP, MRP2, OAT3 a OCT1
Na základe in vitro údajov nemožno vylúčiť inhibíciu BCRP a MRP2 (v čreve), rovnako ako aj inhibíciu transportéra organického aniónu 3 (OAT3) a transportéra organického katiónu 1 (OCT1)
(systémovo). Teoreticky je možná indukcia aj týchto transportérov, ale výsledný efekt je v súčasnosti
neznámy.
Lieky, ktoré predlžujú QT interval
Kvôli súvislosti androgén–deprivačnej liečby s predĺžením QT intervalu sa má dôkladne zvážiť súbežné používanie Xtandi s liekmi, o ktorých je známe, že predlžujú QT interval a liečba liekmi, ktoré môžu vyvolať Torsade de pointes, ako antiarytmiká triedy I A (napr. chinidín, dizopyramid),
triedy III (napr. amiodarón, sotalol, dofetilid, ibutilid), metadon, moxifloxacín, antipsychotiká a ďalšie
(pozri časť 4.4.).
Vplyv jedla na expozíciu enzalutamidu
Jedlo nemá žiadny klinicky významný vplyv na rozsah účinku enzalutamidu. V klinických skúšaniach
bol liek Xtandi podávaný bez ohľadu na príjem potravy.
4.6 Fertilita, gravidita a laktácia
Ženy vo fertilnom veku
Nie sú k dispozícii údaje o použití Xtandi počas gravidity a tento liek nie je určený na užívanie u žien vo fertilnom veku. Tento liek môže spôsobiť poškodenie plodu alebo aj prípadný potrat, ak ho užívajú ženy, ktoré sú gravidné (pozri časť 5.3).
A
ntikoncepcia u mužov a žien
Nie je známe, či sú enzalutamid alebo jeho metabolity prítomné v sperme. Počas liečby enzalutamidom a 3 mesiace po nej je potrebné pri pohlavnom styku pacienta s gravidnou ženou používať kondóm. Ak má pacient pohlavný styk so ženou vo fertilnom veku, musí počas liečby a 3 mesiace po nej používať kondóm a ďalšiu formu antikoncepcie. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3).
Gravidita
Enzalutamid nie je určený na použitie u žien. Enzalutamid je kontraindikovaný u žien, ktoré sú alebo
môžu byť gravidné (pozri časti 4.3 a 5.3).
Dojčenie
Enzalutamid nie je určený na použitie u žien. Nie je známe, či je enzalutamid prítomný v ľudskom
mlieku. Enzalutamid a/alebo jeho metabolity sa vylučujú do mlieka potkanov (pozri časť 5.3).
Fertilita
Štúdie na zvieratách ukázali, že enzalutamid ovplyvnil reprodukčný systém u samcov potkanov a psov
(pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Enzalutamid má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje, pretože boli hlásené
psychiatrické a neurologické príhody, vrátane epileptického záchvatu (pozri časť 4.8). Pacienti
s anamnézou záchvatov alebo s inými predisponujúcimi faktormi (pozri časť 4.4) majú byť poučení o riziku pri vedení vozidla alebo obsluhe strojov. Nevykonali sa žiadne štúdie preukazujúce účinky enzalutamidu na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnprofilubezpečnosti
Najčastejšie nežiaduce reakcie sú asténia/únava, návaly tepla, bolesť hlavy a hypertenzia. Medzi ďalšie významné nežiaduce reakcie patria pády, nepatologické zlomeniny, poruchy kognitívnych funkcií a neutropénia.
Epileptický záchvat sa vyskytol u 0,5 % pacientov liečených enzalutamidom, 0,1 % pacientov užívajúcich placebo a 0,3 % pacientov liečených bikalutamidom. Boli hlásené zriedkavé prípady syndrómu reverzibilnej posteriórnej encefalopatie (PRES) u pacientov liečených enzalutamidom (pozri časť 4.4).
Prehľadnežiaducichreakcií zoradenýchvtabuľke
Nežiaduce reakcie pozorované počas klinických skúšaní sú zoradené podľa frekvencie výskytu. Kategórie frekvencie výskytu nežiaducich účinkov sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v klesajúcom poradí závažnosti.
 T
abuľka 1: Nežiaduce reakcie zistené v kontrolovaných klinických skúšaniach a po uvedení lieku na trh
T
abuľka 1: Nežiaduce reakcie zistené v kontrolovaných klinických skúšaniach a po uvedení lieku na trh
T
rieda orgánových systémov podľa databázy MedDRA
Poruchy krvi a lymfatického systému
Nežiaduca reakcia a frekvencia
Menej časté: leukopénia, neutropénia, neznáme*: trombocytopénia.
Poruchy imunitného systému Neznáme*: opuch jazyka, opuch pery, opuch hltana. Psychické poruchy Časté: úzkosť,
menej časté: zrakové halucinácie.
Poruchy nervového systému Veľmi časté: bolesť hlavy,
časté: zhoršenie pamäti, amnézia, poruchy pozornosti, syndróm nepokojných nôh,
menej časté: poruchy kognitívnych funkcií, epileptický
záchvat,
neznáme*: syndróm reverzibilnej posteriórnej encefalopatie.
Poruchy srdca a srdcovej
činnosti
Neznáme*: predĺženie QT intervalu (pozri časti 4.4 a 4.5).
Poruchy ciev Veľmi časté: návaly tepla, hypertenzia.
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy reprodukčného
systému a prsníkov
Neznáme *: nauzea, vracanie, hnačka.
Časté: suchá koža, svrbenie, neznáme*: vyrážka.
časté: zlomeniny**,
neznáme*: myalgia, svalové spazmy, svalová slabosť, bolesť
chrbta.
Časté: gynekomastia.
Celkové poruchy Veľmi časté: asténia/únava.
Úrazy, otravy a komplikácie
liečebného postupu
Časté: pády.
*Spontánne hlásenia z praxe po uvedení lieku na trh
**Zahŕňa všetky zlomeniny s výnimkou patologických zlomenín
Popis vybraných nežiaducich reakcií
Epileptický záchvat
V kontrolovanom klinickom skúšaní sa vyskytol epileptický záchvat u 10 pacientov (0,5 %)
z 2 051 pacientov liečených dennou dávkou 160 mg enzalutamidu, zatiaľ čo epileptický záchvat sa
vyskytol u jedného pacienta (< 0,1 %) dostávajúceho placebo a jedného pacienta (0,3 %) dostávajúceho bikalutamid. Dávka sa zdá byť dôležitým prediktorom rizika záchvatu, čo vyplýva z predklinických údajov a údajov zo štúdie s eskaláciou dávky. Pacienti s predchádzajúcim epileptickým záchvatom alebo rizikovými faktormi záchvatu boli vylúčení z kontrolovaných klinických skúšaní .
V klinickom skúšaní AFFIRM sa epileptické záchvaty vyskytli u siedmich pacientov (0,9 %)
z 800 pacientov po chemoterapii liečených dennou dávkou 160 mg enzalutamidu, u pacientov užívajúcich placebo sa nevyskytli žiadne epileptické záchvaty. U niektorých z týchto pacientov sa vyskytovali faktory potenciálne prispievajúce k vzniku záchvatu, ktoré u nich mohli nezávisle toto riziko zvyšovať. V klinickom skúšaní PREVAIL sa epileptický záchvat vyskytol u jedného (0,1 %) z 871 pacientov liečených dennou dávkou 160 mg enzalutamidu, ktorí predtým nepodstúpili chemoterapiu, a vyskytol sa u jedného pacienta (0,1 %) užívajúceho placebo. V klinickom skúšaní kontrolovanom bikalutamidom, mali epileptický záchvat 3 pacienti (0,8 %) liečení enzalutamidom
z 380 pacientov predtým neliečených chemoterapiou a 1 pacient (0,3 %) z 387, ktorý dostával bikalutamid.
V klinickom skúšaní s jednou skupinou na posúdenie výskytu záchvatov u pacientov s predisponujúci faktormi záchvatov (z ktorých 1,6% malo záchvaty v anamnéze) sa u 8 z 366 (2,2%) pacientov liečených enzalutamidom vyskytli záchvaty. Medián trvania liečby bol 9,3 mesiaca.
Mechanizmus, akým enzalutamid môže znižovať prah pre vznik záchvatu nie je známy, ale mohol by
súvisieť s údajmi z
in vitro štúdií, ktoré ukázali, že enzalutamid a jeho aktívny metabolit sa viažu na aktivitu GABA-chloridového kanála a môžu ju inhibovať.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na národné centrum hlásenia uvedené v
Prílohe V.'
4.9 PredávkovaniePre enzalutamid neexistuje antidotum. V prípade predávkovania sa má liečba enzalutamidom prerušiť
a začať so všeobecnými podpornými opatreniami, pričom treba brať do úvahy jeho polčas 5,8 dňa.
U pacientov môže byť po predávkovaní zvýšené riziko vzniku epileptických záchvatov.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antiandrogény, antagonisty hormónov a príbuzné liečivá,
ATC kód: L02BB04
MechanizmusúčinkuJe známe, že karcinóm prostaty je citlivý na androgény a odpovedá na inhibíciu signalizácie
androgénneho receptora. Napriek nízkym alebo dokonca nedetekovateľným hladinám sérového androgénu, signalizácia androgénneho receptora ďalej podporuje progresiu ochorenia. Na stimuláciu rastu nádorových buniek cez androgénny receptor je potrebný transport do jadra a väzba na DNA. Enzalutamid je účinný inhibítor signalizácie androgénneho receptora, ktorý blokuje niekoľko krokov v signálnej dráhe androgénneho receptora.
Enzalutamid kompetitívne inhibuje väzbu androgénov na androgénne receptory, inhibuje translokáciu aktivovaných receptorov do jadra a inhibuje spojenie aktivovaného androgénneho receptora s DNA dokonca aj v prostredí nadmernej expresie androgénneho receptora a u buniek karcinómu prostaty rezistentných na antiandrogény. Liečba enzalutamidom spomaľuje rast buniek karcinómu prostaty
a môže indukovať zánik nádorových buniek a regresiu nádoru. V predklinických štúdiách enzalutamid nepreukázal aktivitu agonistu androgénneho receptora.
FarmakodynamickéúčinkyV klinickom skúšaní 3. fázy (AFIRM) u pacientov so zlyhaním predchádzajúcej chemoterapie docetaxelom došlo k najmenej 50 % poklesu východiskových hladín PSA u 54 % pacientov liečených
enzalutamidom oproti 1,5 % pacientov, ktorí dostávali placebo.
V inom klinickom skúšaní 3. fázy (PREVAIL) u chemo-naivných pacientov, pacienti liečení enzalutamidom preukázali významne vyššiu celkovú mieru odpovede PSA (definovanú ako ≥ 50% zníženie oproti východiskovej hodnote), v porovnaní s pacientmi užívajúcimi placebo, 78,0 % oproti
3,5 % (rozdiel = 74,5 %, p < 0,0001).
V klinickom skúšaní 2. fázy (TERRAIN) u chemo-naivných pacientov, pacienti dostávajúci enzalutamid preukázali významne vyššiu celkovú mieru odpovede PSA (definovanú ako ≥ 50 % zníženie oproti východiskovej hodnote), v porovnaní s pacientmi dostávajúcimi bikalutamid, 82,1 % oproti 20,9 % (rozdiel = 61,2 %, p < 0,0001).
V skúšaní v jednej skupine (9785-CL-0410) pacientov, ktorí boli predtým liečení aspoň 24 týždňov
abiraterónom (plus prednizón), 22,4 % malo ≥ 50 % pokles PSA oproti východiskovej hodnote. Podľa predchádzajúcej chemoterapie v anamnéze bol výsledný pomer pacientov s ≥ 50 % poklesom PSA 22,1 % v skupine bez predchádzajúcej chemoterapie a 23,2 % s predchádzajúcou chemoterapiou.
Klinickáúčinnosťabezpečnosť
Účinnosť enzalutamidu bola stanovená v dvoch randomizovaných placebom kontrolovaných multicentrických klinických skúšaniach fázy 3 [CRPC2 (AFFIRM), MDV3100-03 (PREVAIL)] u pacientov s progresívnym metastázujúcim karcinómom prostaty, u ktorých zlyhala androgénna deprivačná terapia [analóg LHRH alebo po obojstrannej orchiektómii]. Do klinického skúšania
PREVAIL boli zahrnutí pacienti, ktorí predtým nepodstúpili chemoterapiu, zatiaľ čo do klinického skúšania AFFIRM boli zahrnutí pacienti, ktorí predtým dostávali docetaxel. Všetci pacienti
pokračovali v liečbe analógom LHRH alebo predtým podstúpili obojstrannú orchiektómiu. V skupine
s aktívnou liečbou bol Xtandi podávaný perorálne v dávke 160 mg denne. V oboch klinických skúšaniach užívali pacienti v kontrolnej skupine placebo a pacienti v skúšaní mohli, ale nemuseli užívať prednizón (maximálna povolená denná dávka bola 10 mg prednizónu alebo jej ekvivalent).
Zmeny sérových koncentrácií PSA samy o sebe, nie vždy predpovedajú klinický prínos. Preto sa
v oboch klinických skúšaniach pacientom odporúčalo pokračovať v skúšanej liečbe až do dosiahnutia kritérií na ukončenie liečby, ktoré sú pre každé skúšanie uvedené nižšie.
Klinické skúšanie MDV3100-03 (PREVAIL) (pacienti bez predchádzajúcej chemoterapie)
Celkom 1 717 asymptomatických alebo mierne symptomatických pacientov, ktorí predtým nepodstúpili chemoterapiu, bolo randomizovaných v pomere 1:1 na perorálne užívanie enzalutamidu v dávke 160 mg jedenkrát denne (N = 872) alebo placeba jedenkrát denne (N = 845). Na klinickom skúšaní bola povolená účasť pacientov s viscerálnym ochorením, pacientov s ľahkým až stredne ťažkým srdcovým zlyhávaním (triedy 1 alebo 2 podľa NYHA) v anamnéze a pacientov užívajúcich lieky znižujúce prah pre vznik epileptických záchvatov. Pacienti s výskytom epileptických záchvatov v anamnéze alebo pacienti s ochorením, ktoré by u nich mohlo zvýšiť náchylnosť na epileptické záchvaty a pacienti so stredne ťažkou až ťažkou bolesťou spôsobenou karcinómom prostaty boli
zo skúšania vylúčení. Skúšaná liečba pokračovala až do progresie ochorenia (rádiologický dôkaz progresie, výskyt kostnej príhody alebo klinická progresia) a začiatku buď cytotoxickej chemoterapie
alebo liečby iným skúmaným liekom alebo do neakceptovateľnej toxicity.
Demografické údaje pacientov a základné charakteristiky ochorenia boli rovnovážne rozložené medzi liečebnými skupinami. Medián veku bol 71 rokov (rozsah 42-93) a rasová príslušnosť bola 77 % belošská, 10 % ázijská, 2 % černošská a 11 % iná alebo neznáma rasa. Šesťdesiatosem percent (68 %) pacientov malo skóre výkonnostného stavu ECOG 0 a 32 % pacientov malo výkonnostný stav
ECOG 1. Východiskové hodnotenie bolesti bolo u 67 % pacientov 0-1 (asymptomatickí pacienti)
a u 32 % pacientov 2-3 (mierne symptomatickí pacienti), podľa krátkeho inventáru bolesti (Brief Pain
Inventory Short Form) (najsilnejšia bolesť za posledných 24 hodín na stupnici od 1 do 10). Približne
45 % pacientov malo merateľné ochorenie mäkkých tkanív pri vstupe do klinického skúšania a 12 %
pacientov malo viscerálne (pľúcne a/alebo pečeňové) metastázy.
Spoločné primárne ciele účinnosti boli celkové prežívanie a prežívanie bez rádiologickej progresie (radiographic progression-free survival, rPFS). Okrem primárnych spoločných cieľov bol prínos tiež hodnotený pomocou času do začatia cytotoxickej chemoterapie, najlepšej celkovej odpovede mäkkých tkanív, času do prvého výskytu kostnej príhody, odpovede PSA (≥ 50% zníženie oproti východiskovej hodnote), času do progresie PSA a času do zhoršenia celkového skóre FACT-P.
Rádiologická progresia bola hodnotená pomocou skúmaní sekvenčného zobrazovania podľa kritérií Prostate Cancer Clinical Trials Working Group 2 (PCWG2) (pre kostné lézie) a/alebo podľa kritérií Response Evaluation Criteria in Solid Tumors (kritériá vyhodnotenia odpovede pri solídnych tumoroch, RECIST v 1.1 ) (pre mäkké tkanivá). V analýze rPFS bolo použité centrálne schválené hodnotenie rádiologickej progresie.
Vo vopred špecifikovanej predbežnej analýze celkového prežívania, keď bolo zaznamenaných
540 úmrtí, sa pri liečbe enzalutamidom preukázalo štatisticky významné zlepšenie celkového
prežívania v porovnaní s užívaním placeba, s 29,4 % znížením rizika úmrtia [pomer rizík
(HR) = 0,706, (95 % CI: 0,596; 0,837), p < 0,0001]. Aktualizovaná analýza prežívania bola vykonaná, keď bolo zaznamenaných 784 úmrtí. Výsledky z tejto analýzy boli v súlade s výsledkami predbežnej analýzy (Tabuľka 2, Obrázok 1). V aktualizovanej analýze 52 % pacientov liečených enzalutamidom
a 81 % pacientov užívajúcich placebo dostalo následnú liečbu na metastázujúci karcinóm prostaty rezistentný na kastráciu (CRPC), ktorá môže predĺžiť celkové prežívanie.
Tabuľka 2: Celkové prežívanie pacientov liečených buď enzalutamidom alebo užívajúcich
placebo v skúšaní PREVAIL (Intent-to-Treat analýza)
Vopred špecifikovaná predbežná analýza
Enzalutamid
(N = 872)
Placebo
(N = 845)

Počet úmrtí (%) 241 (27,6 %) 299 (35,4 %) Medián prežívania, mesiace (95 % CI) 32,4 (30,1; NR) 30.2 (28,0; NR) P-hodnotaa < 0,0001
Pomer rizík (95 % CI) b 0,71 (0,60; 0,84) Aktualizovaná analýza prežívania
Počet úmrtí (%) 368 (42,2 %) 416 (49,2 %)
Medián prežívania, mesiace (95 % CI) 35,3 (32,2; NR) 31,3 (28,8, 34,2) P-hodnotaa 0,0002
Pomer rizík (95 % CI) b 0,77 (0,67; 0,88)
a P-hodnota p odvodená z nestratifikovaného log-rank testu
b Pomer rizík odvodený z nestratifikovaného modelu proporčných rizík. Pomer rizík < 1 v prospech enzalutamidu. NR, nedosiahnuté.
O
brázok 1: Kaplanove-Meierove krivky celkového prežívania na základe aktualizovanej analýzy prežívania v klinickom skúšaní PREVAIL (Intent-to-Treat analýza)

O
brázok 2: Aktualizovaná analýza celkového prežívania podľa podskupín: Pomer rizík a 95 %
i
nterval spoľahlivosti v klinickom skúšaní PREVAIL (Intent-to-Treat analýza)
Vo vopred špecifikovanej analýze rPFS bolo preukázané štatisticky významné zlepšenie medzi
liečebnými skupinami s 81,4 % znížením rizika rádiologickej progresie alebo úmrtia [HR = 0,186
(95 % CI: 0,149; 0.231), p < 0,0001]. U 118 (14 %) pacientov liečených enzalutamidom a 321 (40 %)
pacientov užívajúcich placebo sa vyskytla príhoda. Medián hodnoty rPFS nebol dosiahnutý (95 % CI:
13,8; nedosiahnuté) v skupine liečenej enzalutamidom a bol 3,9 mesiacov (95 % CI: 3,7; 5,4)
v skupine užívajúcej placebo (Obrázok 3). Konzistentný prínos v rPFS sa pozoroval vo všetkých vopred špecifikovaných podskupinách pacientov (napr. vek, východiskový výkonnostný stav ECOG,
východiskové hladiny PSA a LDH, Gleasonovo skóre pri diagnóze a viscerálne ochorenie pri
skríningu). Vopred špecifikovaná analýza sledovania rPFS založená na hodnotení rádiologickej progresie skúšajúcim preukázala štatisticky významné zlepšenie medzi liečebnými skupinami s 69,3 % znížením rizika rádiologickej progresie alebo úmrtia [HR = 0,307 (95 % CI: 0,267; 0,353), p < 0,0001]. Medián hodnoty rPFS bol 19,7 mesiacov v skupine s enzalutamidom a 5,4 mesiacov v skupine
s placebom.
O
brázok 3: Kaplanove-Meierove krivky prežívania bez rádiologickej progresie v klinickom skúšaní PREVAIL (Intent-to-Treat analýza)
V čase primárnej analýzy bolo randomizovaných 1 633 pacientov.
Okrem primárnych spoločných cieľov bolo preukázané štatisticky významné zlepšenie aj
nasledujúcich prospektívne definovaných cieľov.
Medián času do začatia cytotoxickej chemoterapie bol 28,0 mesiacov pre pacientov liečených
enzalutamidom a 10,8 mesiacov pre pacientov užívajúcich placebo (HR = 0,350, 95 % CI: [0,303;
0,403], p < 0,0001).
Podiel pacientov liečených enzalutamidom s merateľným ochorením na začiatku liečby, u ktorých sa
zaznamenala objektívna odpoveď mäkkých tkanív, bol 58,8 % (95 % CI: 53,8; 63,7) v porovnaní s 5,0 % (95 % CI: 3,0; 7,7) u pacientov, ktorí užívali placebo. Absolútny rozdiel v objektívnej odpovedi mäkkých tkanív medzi skupinami s enzalutamidom a placebom bol 53,9 % (95 % CI:
48,5 %, 59,1 %, p < 0,0001). Kompletné odpovede sa hlásili u 19,7 % pacientov liečených
enzalutamidom v porovnaní s 1,0 % pacientov, ktorí užívali placebo, a čiastočné odpovede boli hlásené u 39,1 % pacientov liečených enzalutamidom oproti 3,9 % pacientov užívajúcich placebo.
Enzalutamid výrazne znížil riziko výskytu prvej skeletálnej udalosti o 28 % [HR = 0,718 (95 % CI:
0,610; 0,844) p-hodnota < 0,0001]. Skeletálna udalosť bola definovaná ako potreba rádioterapie kostí
alebo chirurgického výkonu na kostiach z dôvodu karcinómu prostaty, patologická fraktúra kostí,
kompresia miechy alebo zmena protinádorovej liečby z dôvodu bolesti kostí. Analýza zahŕňala
578 skeletálnych udalostí, z toho v 389 prípadoch (66,3 %) išlo o rádioterapiu kostí, v 79 prípadoch
(13,5 %) o kompresiu miechy, v 70 prípadoch (11,9 %) udalostí tvorili patologické kostné fraktúry,
v 45 prípadoch (7,6 %) došlo k zmene protinádorovej liečby pre bolesti kostí a v 22 prípadoch (3,7 %)
bol potrebný chirurgický zásah do kostí.
Pacienti liečení enzalutamidom preukázali významne vyššiu celkovú mieru odpovede PSA (definovanú ako ≥ 50% zníženie oproti východiskovej hodnote), v porovnaní s pacientmi užívajúcimi placebo, 78,0 % oproti 3,5 % (rozdiel = 74,5 %, p < 0,0001).
Medián času do progresie PSA podľa kritérií PCWG2 bol 11,2 mesiacov u pacientov liečených enzalutamidom a 2,8 mesiacov u pacientov užívajúcich placebo [HR = 0,169, (95 % CI: 0,147; 0,195), p < 0,0001].
Liečba enzalutamidom znížila riziko zhoršenia FACT-P skóre o 37,5 % v porovnaní s placebom
(p < 0,001). Medián času do zhoršenia FACT-P bol 11,3 mesiacov v skupine s enzalutamidom a 5,6 mesiacov v skupine s placebom.
785-CL-0222 (TERRAIN) skúšanie (pacienti, ktorí predtým neboli liečení chemoterapiou)
Do skúšania TERRAIN bolo zaradených 375 pacientov predtým neliečených chemoterapiou a ani antiandrogénnou liečbou, ktorí boli randomizovaní buď na enzalutamid v dávke 160 mg jedenkrát denne (N = 184) alebo bikalutamid v dávke 50 mg jedenkrát denne (N = 191). Medián PFS bol 15,7 mesiaca u pacientov liečených enzalutamidom oproti 5,8 mesiaca u pacientov užívajúcich bikalutamid
[HR = 0,44 (95% CI: 0,34, 0,57), p <0,0001]. Prežívanie bez progresie bolo definované ako objektívny dôkaz progresie ochorenia podľa nezávislého centrálneho röntgenologického hodnotenia, skeletárna
príhoda, iniciácia novej protinádorovej liečby alebo smrť z akejkoľvek príčiny podľa toho, čo nastalo
skôr. Konzistentný prínos v PFS sa pozoroval vo všetkých vopred špecifikovaných podskupinách pacientov.
Klinické skúšanie CRPC2 (AFFIRM) (pacienti, ktorí boli predtým liečení chemoterapiou)
Účinnosť a bezpečnosť enzalutamidu u pacientov s metastázujúcim CRPC, ktorí dostávali docetaxel
a užívali analóg LHRH alebo podstúpili orchiektómiu, boli hodnotené v randomizovanom, placebom kontrolovanom multicentrickom klinickom skúšaní 3. fázy. Celkovo bolo randomizovaných
1 199 pacientov v pomere 2:1 na perorálne užívanie enzalutamidu v dávke 160 mg jedenkrát denne
(n = 800) alebo na placebo jedenkrát denne (n = 399). Pacienti mohli, ale nemuseli užívať prednizón
(maximálna povolená denná dávka bola 10 mg prednizónu alebo jej ekvivalent). Pacienti randomizovaní do niektorej zo skupín pokračovali v liečbe až do vzniku progresie ochorenia (definovaného ako rádiologicky potvrdená progresia alebo výskyt kostnej príhody) a začiatku novej systémovej protinádorovej liečby, pri neakceptovateľnej toxicite alebo nutnosti prerušenia liečby.
Nasledujúce demografické údaje pacientov a základné charakteristiky ochorenia boli rovnovážne rozložené medzi liečebnými skupinami. Medián veku bol 69 rokov (rozsah 41-92) a rasová príslušnosť bola 93 % belošská, 4 % černošská, 1 % ázijská a 2 % iná. ECOG skóre výkonnostného stavu bolo 0-1 u 91,5 % pacientov a 2 u 8,5 % pacientov; 28 % malo priemerné skóre bolesti (Brief Pain Inventory Score) ≥ 4 (priemer najhoršej pacientmi uvádzanej bolesti počas predchádzajúcich 24 hodín
vypočítaný za obdobie siedmich dní pred randomizáciou). Väčšina (91 %) pacientov mala metastázy do kostí a 23 % pacientov malo viscerálne pľúcne a/alebo pečeňové postihnutie. Pri vstupe
do skúšania malo 41 % randomizovaných pacientov len progresiu PSA, kým 59 % pacientov malo
rádiologickú progresiu. Na začiatku bolo päťdesiatjeden percent (51 %) pacientov liečených
bisfosfonátmi.
Z klinického skúšania AFFIRM boli vylúčení pacienti s ochoreniami, ktoré ich predisponovali
k vzniku epileptických záchvatov (pozri časť 4.8) a užívajúci lieky, ktoré znižujú prah citlivosti pre vznik epileptického záchvatu, ako aj pacienti s klinicky významným kardiovaskulárnym
ochorením ako nekontrolovaná hypertenzia, infarkt myokardu v nedávnej anamnéze alebo nestabilná
angína, zlyhanie srdca triedy III alebo IV podľa New York Heart Association (ak nebola ejekčná frakcia ≥ 45 %), klinicky signifikantné ventrikulárne arytmie alebo atrioventrikulárnu blokádu (bez permanentného kardiostimulátora).
Protokolom vopred špecifikovaná predbežná analýza po 520 úmrtiach ukázala štatisticky významnú superioritu v celkovom prežívaní u pacientov liečených enzalutamidom oproti placebu (Tabuľka 3
a Obrázky 4 a 5).
 T
abuľka 3: Celkové prežívanie pacientov liečených buď enzalutamidom alebo placebom
v klinickom skúšaní AFFIRM (Intent –to-Treat analýza)
E
nzalutamid (n = 800) Placebo (n = 399)
T
abuľka 3: Celkové prežívanie pacientov liečených buď enzalutamidom alebo placebom
v klinickom skúšaní AFFIRM (Intent –to-Treat analýza)
E
nzalutamid (n = 800) Placebo (n = 399) Úmrtia (%) 308 (38,5 %) 212 (53,1 %) Medián prežívania (mesiace) (95 % CI) 18,4 (17,3, NR) 13,6 (11,3, 15,8) P-hodnotaa < 0,0001
Pomer rizík (95 % CI)b 0,631 (0,529 - 0,752)
a P-hodnota vychádza z log-rank testu stratifikovaného podľa ECOG skóre výkonnostného stavu (0-1
vs. 2) a priemerného skóre bolesti (< 4 vs. ≥ 4)
b Pomer rizík (Hazard Ratio) vychádza zo stratifikovaného modelu proporčných rizík. Pomer rizík < 1
znamená lepší efekt enzalutamidu
NR, nedosiahnuté
Obrázok 4: Kaplanove-Meierove krivky celkového prežívania v klinickom skúšaní AFFIRM (ITT analýza)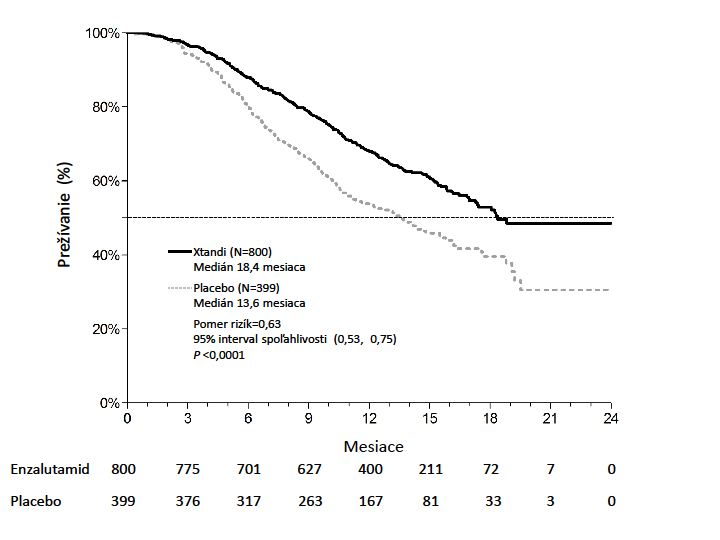
O
brázok 5: Celkové prežívanie podľa podskupín v klinickom skúšaní AFFIRM – Pomer rizík a 95 % interval spoľahlivosti
ECOG: Východná spolupracujúca onkologická skupina; BPI-SF: krátka forma dotazníka bolesti; PSA: prostatický špecifický antigén
Okrem pozorovaného zlepšenia celkového prežívania aj hlavné sekundárne ciele (progresia PSA, prežívanie bez rádiologickej progresie a čas do prvej kostnej príhody) preferovali enzalutamid a boli štatisticky významné po úprave pre viacnásobné testovanie.
Prežívanie bez rádiologickej progresie hodnotené skúšajúcim podľa kritérií RECIST v 1.1 pre mäkké tkanivá a podľa výskytu 2 alebo viacerých kostných lézií na snímku kostí bolo 8,3 mesiaca
pre pacientov liečených enzalutamidom a 2,9 mesiaca pre pacientov, ktorí užívali placebo
(HR = 0,404; 95 % CI: [0,350 – 0,466]; p < 0,0001). Analýza zahŕňala 216 úmrtí bez potvrdenej progresie a 645 potvrdených príhod progresie, z ktorých v 303 prípadoch (47 %) išlo o progresiu
do mäkkých tkanív, v 268 prípadoch (42 %) o kostnú progresiu a v 74 prípadoch (11 %) išlo súčasne
o lézie v mäkkých tkanivách aj v kostiach.
Potvrdený 50 % alebo 90 % pokles PSA bol prítomný u 54,0 % a 24,8 % pacientov, ktorí užívali enzalutamid a 1,5 % a 0,9 % pacientov užívajúcich placebo (p < 0,0001). Medián času do progresie PSA bol 8,3 mesiaca pre pacientov liečených enzalutamidom a 3,0 mesiaca pre pacientov užívajúcich placebo (HR = 0,248, 95 % CI: [0,204 – 0,303]; p < 0,0001).
Medián času do prvej skeletálnej udalosti bol 16,7 mesiaca pre pacientov liečených enzalutamidom
a 13,3 mesiaca pre pacientov užívajúcich placebo (HR = 0,688, 95 % CI: [0,566 – 0,835]; p < 0,0001).
Skeletálna udalosť bola definovaná ako potreba rádioterapie kostí alebo chirurgického výkonu
na kostiach, patologická fraktúra kostí, kompresia miechy alebo zmena protinádorovej liečby z dôvodu
bolesti kostí. Analýza zahŕňala 448 skeletálnych udalostí, z toho v 227 prípadoch (62 %) išlo
o rádioterapiu kostí, v 95 prípadoch (21 %) o kompresiu miechy, v 47 prípadoch (10 %) udalostí tvorili patologické kostné fraktúry, v 36 prípadoch (8 %) došlo k zmene protinádorovej liečby pre bolesti kostí a v 7 prípadoch (2 %) bol potrebný chirurgický zásah do kostí.
Skúšanie 9785-CL-0410 (enzalutamid po abirateróne u pacientov s metastatickým CRPC)
Išlo o skúšanie u 214 pacientov s progredujúcim metastatickým CRPC v jednej skupine, ktorí
po liečbe abiraterón acetátom a prednizónom, ktorá trvala najmenej 24 týždňov, dostávali enzalutamid
(160 mg raz denne). Medián rPFS (prežitie bez rádiologickej progresie, hlavný cieľ skúšania) bol 8,1 mesiaca (95 % CI: 6,1; 8,3). Medián OS nebol dosiahnutý. PSA odpoveď (definovaná ako ≥ 50 % zníženie oproti východiskovej hodnote) bola 22,4 % (95 % CI:17,0; 28,6.).
U 145 pacientov, ktorí predtým dostávali chemoterapiu, bol medián rPFS 7,9 mesiaca (95 % CI: 5,5,
10,8). PSA odpoveď bola 23,2 % (95 % CI: 13,9; 34,9).
U 69 pacientov bez predchádzajúcej chemoterapie bol medián rPFS 8,1 mesiaca (95 % CI: 5,7; 8,3).
PSA odpoveď bola 22,1 % (95 % CI: 15,6; 29,7).
Hoci u niektorých pacientov bola odpoveď na liečbu enzalutamidom po abirateróne obmedzená, dôvod tohto zistenia nie je v súčasnosti známy. Dizajn skúšania nemôže ani identifikovať pacientov, u ktorých je pravdepodobný prínos, a ani poradie, v ktorom má byť optimálne sekvenčne podávaný enzalutamid a abiraterón.
Starší ľudia
Z 1 671 pacientov v klinickom skúšaní fázy 3 užívajúcich enzalutamid malo 1 261 (75 %) viac ako
65 rokov a 516 pacientov (31 %) malo viac ako 75 rokov. Neboli pozorované žiadne celkové rozdiely v bezpečnosti alebo účinnosti medzi týmito staršími a mladšími pacientmi.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií pre enzalutamid vo všetkých vekových podskupinách detí a dospievajúcich pri karcinóme prostaty (informácie
o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Enzalutamid je zle rozpustný vo vode. Rozpustnosť enzalutamidu sa zvyšuje pomocou kaprylokaproyl makrogolglyceridov ako emulgátorov/surfaktantov. V predklinických štúdiách absorpcia enzalutamidu stúpla, keď bol rozpustený v kaprylokaproyl makrogolglyceridoch.
Farmakokinetika enzalutamidu bola hodnotená u pacientov s karcinómom prostaty a u zdravých mužov. Priemerný terminálny polčas (t1/2 ) enzalutamidu u pacientov po podaní jednorazovej perorálnej dávky je 5,8 dní (rozsah 2,8 až 10,2 dní) a rovnovážny stav sa dosiahne približne za jeden mesiac. Pri dennom perorálnom podávaní dôjde k nahromadeniu enzalutamidu na úroveň približne
8,3-násobku jednorazovej dávky. Výkyvy v plazmatických koncentráciách počas dňa sú nízke (pomer najvyššej a najnižšej hodnoty je 1,25). Klírens enzalutamidu sa uskutočňuje primárne cez pečeňový metabolizmus, pričom dochádza k vytvoreniu aktívneho metabolitu, ktorý je rovnako aktívny ako enzalutamid a cirkuluje približne v rovnakej plazmatickej koncentrácii.
Absorpcia
Perorálna absorpcia tabliet enzalutamidu sa hodnotila u zdravých dobrovoľníkov mužského pohlavia
po jednorazovej dávke 160 mg Xtandi filmom obalených tabliet a na účely prognózy farmakokinetického profilu v ustálenom stave sa použili farmakokinetické modelovanie a simulácia. Na základe týchto predikcií, ako aj ďalších podporných údajov je stredný čas do dosiahnutia maximálnych koncentrácií enzalutamidu v plazme (C max ) 2 hodiny (rozpätie 0,5 až 6 hodín) a farmakokinetické profily enzalutamidu a jeho aktívneho metabolitu v ustálenom stave sú v prípade tabliet a mäkkých kapsúl Xtandi podobné. Po perorálnom podaní kapsúl (Xtandi 160 mg denne) pacientom s metastázujúcim CRPC sú priemerné hodnoty Cmax v plazme v ustálenom stave pre enzalutamid 16,6 μg/ml (23 % CV) a pre jeho aktívny metabolit 12,7 μg/ml (30 % CV).
Na základe balančnej štúdie celkového príjmu a výdaja u ľudí sa odhaduje absorpcia enzalutamidu po perorálnom podaní na úrovni najmenej 84,2 %. Enzalutamid nie je substrátom efluxových transportérov P-gp alebo BCRP.
Jedlo nemá žiadny klinicky významný účinok na mieru absorpcie. V klinických skúšaniach bolo
Xtandi podávané bez ohľadu na príjem potravy.
Distribúcia
Priemerný zdanlivý distribučný objem (V/F) enzalutamidu u pacientov po jednorazovej perorálnej dávke je 110 litrov (29 % CV). Distribučný objem enzalutamidu je väčší než objem celkovej telesnej vody, čo poukazuje na jeho extenzívnu extravaskulárnu distribúciu. Štúdie na hlodavcoch ukazujú, že enzalutamid a jeho aktívny metabolit môžu prestupovať cez hematoencefalickú bariéru.
Enzalutamid je z 97 % až 98 % viazaný na plazmatické proteíny, primárne albumín. Aktívny metabolit je z 95 % viazaný na plazmatické proteíny. In vitro nedošlo k žiadnemu vytesneniu z väzby na proteín medzi enzalutamidom a inými vysoko viazanými liekmi (warfarín, ibuprofen a kyselina salicylová).
Biotransformácia
Enzalutamid sa metabolizuje extenzívne. V ľudskej plazme sú prítomné dva hlavné metabolity: N- dezmetyl enzalutamid (aktívny) a derivát kyseliny karboxylovej (neaktívny). Enzalutamid sa metabolizuje prostredníctvom CYP2C8 a v menšom rozsahu prostredníctvom CYP3A4/5 (pozri časť
4.5), obidva enzýmy majú svoju úlohu v tvorbe aktívneho metabolitu. In vitro sa N-dezmetyl enzalutamid metabolizuje na metabolit kyseliny karboxylovej prostredníctvom karboxylesterázy 1,
ktorá tiež hrá menšiu úlohu v metabolizme enzalutamidu na metabolit kyseliny karboxylovej. N-dezmetyl enzalutamid sa in vitro nemetabolizoval prostredníctvom enzýmov CYP.
V podmienkach klinického používania je enzalutamid silným induktorom CYP3A4, stredne silným induktorom CYP2C9 a CYP2C19 a nemá žiadny klinicky relevantný vplyv na CYP2C8 (pozri časť
4.5).
Eliminácia
Priemerný klírens (CL/F) enzalutamidu u pacientov sa pohybuje od 0,520 do 0,564 litra/hodinu.
Po perorálnom podaní 14C-enzalutamidu sa do 77 dní po užití zachytilo 84,6 % rádioaktivity: 71,0 %
sa zachytilo v moči (primárne ako inaktívny metabolit so stopovými množstvami enzalutamidu
a aktívneho metabolitu) a 13,6 % sa zachytilo v stolici (0,39 % dávky ako nezmenený enzalutamid).
In vitro údaje ukazujú, že enzalutamid nie je substrátom pre OATP1B1, OATP1B3 alebo OCT1
a N-dezmetyl enzalutamid nie je substrátom pre P-gp alebo BCRP.
In vitro údaje ukazujú, že enzalutamid a jeho hlavné metabolity neinhibujú nasledujúce transportéry pri klinicky relevantných koncentráciách: OATP1B1, OATP1B3, OCT2 alebo OAT1.
Linearita
Nie sú pozorované žiadne významné odchýlky proporcionality dávky mimo rozsahu dávok 40 až
160 mg. Rovnovážne Cmin hodnoty enzalutamidu a aktívneho metabolitu u jednotlivých pacientov zostávali konštantné počas viac než jedného roka chronickej liečby, čo po dosiahnutí rovnovážneho stavu preukazuje časovo lineárnu farmakokinetiku.
Porucha funkcieobličiek
Formálne nebolo pre enzalutamid uskutočnené žiadne klinické skúšanie pri poruche funkcie obličiek. Pacienti so sérovým kreatinínom > 177 μmol/l (2 mg/dl) boli z klinického skúšania vyradení. Na základe populačnej farmakokinetickej analýzy nie je potrebná žiadna úprava dávkovania u pacientov s vypočítanými hodnotami klírensu kreatinínu (CrCL) ≥ 30 ml/min (stanovené vzorcom podľa Cockcrofta a Gaulta). Enzalutamid nebol hodnotený u pacientov s ťažkým poškodením funkcie obličiek (CrCL < 30 ml/min) alebo ochorením obličiek v koncovom štádiu a pri liečbe týchto
pacientov sa odporúča opatrnosť. Je nepravdepodobné, že by bol enzalutamid signifikantne odstránený použitím intermitentnej hemodialýzy alebo kontinuálnou ambulantnou peritoneálnou dialýzou.
Porucha funkciepečene
Porucha funkcie pečene nemala výrazný vplyv na celkovú expozíciu enzalutamidu alebo jeho aktívnemu metabolitu. Avšak u pacientov s ťažkou poruchou funkcie pečene bol biologický polčas enzalutamidu v porovnaní so zdravou kontrolou dvojnásobný (10,4 dňa v porovnaní s 4,7 dňami), čo asi súviselo so zvýšenou distribúciou v tkanivách.
Farmakokinetika enzalutamidu bola skúmaná u subjektov so vstupným ľahkým (n = 6), stredne ťažkým (n = 8) alebo ťažkým (n = 8) poškodením funkcie pečene (Childova-Pughovej trieda A, B alebo C) a u 22 porovnateľných subjektov v kontrolnej skupine s normálnou funkciou pečene.
Po podaní jednorazovej perorálnej 160 mg dávky enzalutamidu pacientom s ľahkým poškodením funkcie pečene sa AUC enzalutamidu zvýšila o 5 % a Cmax sa zvýšila o 24 % a u pacientov so stredne ťažkým poškodením funkcie pečene sa AUC enzalutamidu zvýšila o 29 % a Cmax sa znížila o 11 %
a AUC enzalutamidu u subjektov s ťažkou poruchou funkcie pečene sa zvýšila o 5 % a Cmax sa znížila o 41 %v porovnaní so zdravými subjektmi v kontrolnej skupine. V prípade súčtu voľného
enzalutamidu a jeho voľného aktívneho metabolitu u pacientov s ľahkým poškodením funkcie pečene sa AUC zvýšila o 14 % a Cmax sa zvýšila o 19 %, u pacientov so stredne ťažkým poškodením funkcie pečene sa AUC zvýšila o 14 % a Cmax sa znížila o 17 % a u subjektov s ťažkou poruchou funkcie pečene sa AUC zvýšila o 34 % a Cmax sa znížila o 27 % v porovnaní so zdravými subjektmi
v kontrolnej skupine.
Rasa
Väčšina pacientov v klinických skúšaniach (> 84 %) patrila k belošskej rase. Na základe farmakokinetických údajov z klinického skúšania u japonských pacientov s karcinómom prostaty
nebol nájdený žiaden klinicky významný rozdiel v expozícii medzi Japoncami a belochmi. Nie je k dispozícii dostatočné množstvo údajov na vyhodnotenie možných rozdielov vo farmakokinetike
u iných rás.
Starší ľudia
V populačnej farmakokinetickej analýze nebol pozorovaný žiadny klinicky relevantný vplyv veku
na farmakokinetiku enzalutamidu.
5.3 Predklinické údaje o bezpečnosti
Podávanie enzalutamidu gravidným myšiam viedlo k zvýšenému výskytu embryofetálnych úmrtí, vonkajších a kostrových zmien. Neboli uskutočnené štúdie reprodukčnej toxicity enzalutamidu, ale v štúdiách na potkanoch (4 a 26 týždňov) a psoch (4, 13 a 39 týždňov) boli zaznamenané atrofia, aspermia/hypospermia a hypertrofia/hyperplázia v reprodukčnom systéme, čo je v súlade
s farmakologickým účinkom enzalutamidu. V štúdiách na myšiach (4 týždne), potkanoch (4 a 26
týždňov) a psoch (4, 13 a 39 týždňov) boli prítomné zmeny na reprodukčných orgánoch spojené s podávaním enzalutamidu ako zníženie hmotnosti orgánov s atrofiou prostaty a nadsemenníka. Hypertrofia a/alebo hyperplázia Leydigových buniek boli pozorované u myší (4 týždne) a psov
(39 týždňov). Ďalšie zmeny na reprodukčných tkanivách zahŕňali hypertrofiu/hyperpláziu hypofýzy
a atrofiu semenných mechúrikov u potkanov a testikulárnu hypospermiu a degeneráciu semenotvorných tubulov u psov. Rozdiely medzi pohlaviami boli zaznamenané pri prsných žľazách
potkanov (atrofia u samcov a lobulárna hyperplázia u samíc). Zmeny na reprodukčných orgánoch
obidvoch druhov boli v súlade s farmakologickými účinkami enzalutamidu a úplne alebo čiastočne vymizli po 8-týždňovom období zotavovania. Ani u jedného druhu neboli prítomné žiadne významné zmeny v klinickej patológii alebo histopatológii žiadneho iného orgánového systému, vrátane pečene.
Štúdie na gravidných potkanoch ukázali, že enzalutamid a/alebo jeho metabolity sú prenášané na plody. Po perorálnom podaní rádioaktívne značeného 14C-enzalutamidu potkanom v 14. deň tehotenstva v dávke 30 mg/kg (~1,9 násobok maximálnej dávky indikovanej u ľudí) bola maximálna rádioaktivita v plode dosiahnutá 4 hodiny po podaní a bola nižšia ako rádioaktivita v plazme matky
v pomere tkanivo/plazma 0,27. Rádioaktivita v plode klesla na 0,08 násobok maximálnej koncentrácie za 72 hodín po podaní.
Štúdie na dojčiacich potkanoch ukázali, že enzalutamid a/alebo jeho metabolity sú vylučované do mlieka potkanov. Po perorálnom podaní rádioaktívne značeného 14C-enzalutamidu dojčiacim potkanom v dávke 30 mg/kg (~1,9 násobok maximálnej dávky indikovanej u ľudí) bola maximálna rádioaktivita v mlieku dosiahnutá 4 hodiny po podaní a bola vyššia až do 3,54 násobku rádioaktivity v plazme matky. Výsledky štúdie tiež ukázali, že enzalutamid a/alebo jeho metabolity prechádzajú cez mlieko do tkanív dojčených potkanov a následne sú eliminované.
Enzalutamid nevyvolával mutácie v teste mikrobiálnej mutagenézy (Ames) a nebol klastogénny ani v in vitro cytogenetickom teste s lymfómovými bunkami myší ani v in vivo mikronukleárnom teste
u myší. Neboli uskutočnené dlhodobé štúdie na zvieratách na stanovenie karcinogénneho potenciálu enzalutamidu. Enzalutamid nebol in vitro fototoxický.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
acetát sukcinát hypromelózy mikrokryštalická celulóza
bezvodý koloidný oxid kremičitý
kroskarmelóza sodná magnéziumstearát
Obal tablety hypromelóza mastenec makrogol (8000)
oxid titaničitý (E171)
žltý oxid železitý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
40 mg filmom obalené tablety
Papierové puzdro obsahujúce PVC/PCTFE/hliníkový blister po 28 filmom obalených tabliet. Každá
škatuľka obsahuje 112 filmom obalených tabliet (4 puzdrá).
80 mg filmom obalené tablety
Papierové puzdro obsahujúce PVC/PCTFE/hliníkový blister po 14 filmom obalených tabliet. Každá
škatuľka obsahuje 56 filmom obalených tabliet (4 puzdrá).
6.6 Špeciálne opatrenia na likvidáciu
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAstellas Pharma Europe B.V. Sylviusweg 62
2333 BE Leiden
Holandsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/13/846/002 (filmom obalená tableta 40 mg) EU/1/13/846/003 (filmom obalená tableta 80 mg)
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21. júna 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.