
bocytopénia, neutropénia,
leukopénia a pancytopénia (pozri časť 4.8).
Preto sa musí vykonať hematologické vyšetrenie pacientov na začiatku liečby a pred každou dávkou Xofiga. Pred prvým podaním Xofiga by mal byť absolútny počet neutrofilov (ANC) ≥1,5 x 109/l, počet trombocytov
≥100 x 109/l a hemoglobín ≥10,0 g/dl. Pred následnými podaniami má byť ANC ≥1,0 x 109/l a počet trombocytov ≥50 x 109/l. V prípade, ak nedôjde k náprave týchto hodnôt do 6 týždňov po poslednom podaní
Xofiga napriek poskytnutiu štandardnej zdravotnej starostlivosti, ďalšia liečba Xofigom má pokračovať iba po dôkladnom vyhodnotení prínosov/rizík.
Pacienti s potvrdenou zníženou rezervou kostnej drene, napríklad po predchádzajúcej cytotoxickej chemoterapii alebo radiačnej liečbe (EBRT) alebo pacienti s karcinómom prostaty s pokročilou difúznou infiltráciou kostí (EOD4; „superscan“), sa majú liečiť s opatrnosťou. U týchto pacientov sa počas klinického skúšania fázy III pozoroval zvýšený výskyt nežiaducich hematologických účinkov, ako je neutropénia
a trombocytopénia, (pozri časť 4.8).
Účinnosť a bezpečnosť cytostatík po liečbe Xofigom sa neskúmala. Dostupné údaje naznačujú, že pacienti liečení chemoterapiou po liečbe Xofigom mali podobný hematologický profil ako pacienti liečení chemoterapiou po placebe (pozri tiež časť 5.1).
Crohnova choroba a ulcerózna kolitída
Bezpečnosť a účinnosť Xofiga u pacientov s Crohnovou chorobou a ulceróznou kolitídou sa neskúmali.
Vzhľadom na exkréciu Xofiga stolicou, môže žiarenie viesť k zhoršeniu akútneho zápalového ochorenia čriev. Xofigo sa má podávať iba po starostlivom zvážení prínosov a rizík u pacientov s akútnym zápalovým ochorením čriev.
Kompresia miechy
U pacientov s neliečenou hroziacou alebo rozvinutou kompresiou miechy sa má pred začatím alebo
pokračovaním liečby Xofigom vykonať štandardná liečba, ako je klinicky indikované.
Zlomeniny kostí
U pacientov so zlomeninami kostí sa má pred začatím alebo pokračovaním liečby Xofigom vykonať
ortopedická stabilizácia zlomenín.
Osteonekróza čeľuste
U pacientov liečených bisfosfonátmi a Xofigom nemožno vylúčiť zvýšené riziko rozvoja osteonekrózy
čeľuste (ONJ). V klinickom skúšaní fázy III sa hlásili prípady ONJ u 0,67 % v skupine pacientov liečených
Xofigom (4/600) v porovnaní s 0,33 % v skupine pacientov s placebom (1/301). Avšak všetci pacienti
s osteonekrózou čeluste boli vystavení tiež predchádzajúcemu alebo súbežnému podávaniu bisfosfonátov
(napr. kyseliny zoledrónovej) a predchádzajúcej chemoterapii (napr. docetaxelom).
Sekundárne malígne neoplazmy
Xofigo prispieva k celkovej dlhodobej kumulatívnej radiačnej expozícii pacienta. Preto môže dlhotrvajúca
kumulatívna expozícia žiareniu súvisieť so zvýšeným rizikom rakoviny a dedičných chýb. Riziko vzniku osteosarkómu, myelodysplastického syndrómu a leukémie sa preto môže zvýšiť. V klinických skúšaniach počas troch rokov neboli hlásené žiadne prípady Xofigom vyvolanej rakoviny.
Pomocné látky so známym účinkom
V závislosti od podaného objemu môže tento liek obsahovať do 2,35 mmol (54 mg) sodíka v jednej dávke.
Toto sa má vziať do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné klinické skúšania.
Keďže nemožno vylúčiť interakcie s vápnikom a fosfátmi, zvážte prerušenie podávania týchto látok a/alebo vitamínu D niekoľko dní pred podaním Xofiga.
Súbežné podávanie chemoterapie s Xofigom môže mať aditívne účinky na útlm kostnej drene (pozri časť
4.4). Bezpečnosť a účinnosť súbežne podávanej chemoterapie a Xofiga neboli stanovené.
4.6 Fertilita, gravidita a laktácia
Antikoncepcia u mužov
Neuskutočnili sa žiadne štúdie zamerané na vplyv Xofiga na reprodukciu u zvierat.
Z dôvodu potenciálnych účinkov na spermatogenézu v súvislosti so žiarením sa má mužom odporučiť
používanie účinných antikoncepčných metód počas liečby Xofigom a po dobu 6 mesiacov po jej ukončení.
Gravidita a laktácia
Xofigo nie je indikované u žien. Xofigo sa nemá používať u žien, ktoré sú alebo môžu byť tehotné alebo
dojčia.
Fertilita
Nie sú k dispozícii žiadne údaje o účinku Xofiga na fertilitu u ľudí.
Na základe štúdií na zvieratách existuje potenciálne riziko, že žiarenie z Xofiga by mohlo mať nežiaduce účinky na fertilitu (pozri časť 5.3). Pacienti mužského pohlavia sa majú pred liečbou poradiť ohľadom konzervácie spermií.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neexistuje žiadny dôkaz a ani sa neočakáva, že by Xofigo malo vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Celkový bezpečnostný profil Xofiga je založený na údajoch získaných od 600 pacientov liečených Xofigom
v klinickom skúšaní fázy III.
Najčastejšie pozorovanými nežiaducimi reakciami (≥10 %) u pacientov dostávajúcich Xofigo boli hnačka, nevoľnosť, vracanie a trombocytopénia.
Najzávažnejšími nežiaducimi reakciami boli trombocytopénia a neutropénia (pozri časť 4.4 a“ Popis vybraných nežiaducich reakcií” ).
Tabuľkový prehľad nežiaducich účinkovNežiaduce reakcie pozorované pri liečbe Xofigom sú uvedené v nižšie uvedenej tabuľke (pozri tabuľku č. 1).
Sú klasifikované podľa tried orgánových systémov. Na popis určitej reakcie a jej synoným a súvisiacich stavov sa použil najvhodnejší výraz podľa databázy MedDRA.
Nežiaduce reakcie z klinických skúšaní sú klasifikované podľa ich frekvencií: Frekvencie sú definované nasledovne: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100).
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
Tabuľka č. 1: Nežiaduce reakcie hlásené v klinických skúšaniach u pacientov liečených XofigomTrieda orgánových systémov
(MedDRA)
|
Veľmi časté
|
Časté
|
Menej časté
|
Poruchy krvi
a lymfatického systému
| trombocytopénia
| neutropénia,
pancytopénia, leukopénia
| lymfopénia
|
Poruchy gastrointestinálneho traktu
| hnačka,
vracanie, nauzea
|
|
|
Celkové poruchy
a reakcie v mieste podania
|
| reakcie v mieste podania
|
|
Popis vybraných nežiaducich účinkovTrombocytopénia a neutropéniaTrombocytopénia (všetky stupne) sa vyskytovala u 11,5 % pacientov liečených Xofigom a u 5,6 % pacientov, ktorí dostávali placebo. Trombocytopénia stupňa 3 a 4 sa pozorovala u 6,3 % pacientov liečených Xofigom a u 2 % pacientov, ktorí dostávali placebo (pozri časť 4.4). Celkovo bola frekvencia výskytu trombocytopénie stupňa 3 a 4 nižšia u pacientov, ktorí predtým neboli liečení docetaxelom (2,8 % pacientov
liečených Xofigom v porovnaní s 0,8 % pacientov, ktorí dostávali placebo) v porovnaní s pacientmi, ktorí
predtým boli liečení docetaxelom (8,9 % pacientov liečených Xofigom v porovnaní s 2,9 % pacientov, ktorí dostávali placebo). U pacientov s EOD4 („superscan“) bola trombocytopénia (všetky stupne) hlásená
u 19,6 % pacientov liečených Xofigom a u 6,7 % pacientov, ktorí dostávali placebo. Trombocytopénia stupňa 3 a 4 bola pozorovaná u 5,9 % pacientov liečených Xofigom a u 6,7 % pacientov, ktorí dostávali placebo (pozri časť 4.4).
Neutropénia (všetky stupne) bola hlásená u 5 % pacientov liečených Xofigom a u 1 % pacientov, ktorí dostávali placebo. Neutropénia stupňa 3 a 4 sa pozorovala u 2,2 % pacientov liečených Xofigom a u 0,7 % pacientov, ktorí dostávali placebo. Celkovo bola frekvencia výskytu neutropénie stupňa 3 a 4 nižšia
u pacientov, ktorí predtým neboli liečení docetaxelom (0,8 % u pacientov liečených Xofigom v porovnaní s
0,8 % u pacientov, ktorí dostávali placebo) v porovnaní s pacientmi, ktorí predtým boli liečení docetaxelom
(3,2 % u pacientov liečených Xofigom oproti 0,6 % u pacientov, ktorí dostávali placebo).
V klinickom skúšaní fázy I sa najnižšie namerané počty neutrofilov a trombocytov vyskytovali po 2 až
3 týždňoch po intravenóznom podaní jednej dávky Xofiga.
Reakcia v mieste podaniaReakcie v mieste podania injekcie stupňa 1 a 2, ako napríklad erytém, bolesť a opuch, sa hlásili u 1,2 %
pacientov liečených Xofigom a u 0 % pacientov, ktorí dostávali placebo.
Sekundárne malignityXofigo prispieva k celkovej dlhodobej kumulatívnej radiačnej expozícii pacienta. Dlhodobá kumulatívna radiačná expozícia sa môže spájať so zvýšeným rizikom vzniku rakoviny a dedičných porúch. Ide najmä o zvýšené riziko vzniku osteosarkómu, myelodysplastického syndrómu a leukémie.
V klinických skúšaniach s následným sledovaním po dobu až troch rokov sa nehlásili žiadne prípady
rakoviny vyvolanej Xofigom.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie

pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v Prílohe V.
4.9 PredávkovaniePočas klinických skúšaní neboli hlásené žiadne prípady náhodného predávkovania Xofigom.
Nie je k dispozícii žiadne špecifické antidotum. V prípade náhodného predávkovania sa majú vykonávať
všeobecné podporné opatrenia vrátane sledovania potenciálnej hematologickej a gastrointestinálnej toxicity.
V klinickom skúšaní fázy I boli vyhodnocované jednorazové dávky Xofiga s obsahom aktivity do 250 kBq na kg telesnej hmotnosti a nepozorovali sa žiadne toxicity obmedzujúce dávku.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: rôzne terapeutické rádiofarmaká, ATC kód: V10XX03
Mechanizmus účinkuXofigo je terapeutické rádiofarmakum vyžarujúce alfa častice.
Jeho aktívna zložka rádium-223 (vo forme chloridu radnatého 223) imituje vápnik a selektívne je cielený na kosti, najmä oblasti kostných metastáz, prostredníctvom tvorby komplexov s kostným minerálom hydroxyapatitom. Vysoký lineárny prenos energie alfa žiaričov (80 keV/mikrometer) vedie k vysokej frekvencii zlomov dvojvláknovej DNA v priľahlých nádorových bunkách s následným silným cytotoxickým účinkom. Ďalšie účinky na mikroprostredie nádoru, vrátane osteoblastov a osteoklastov, tiež prispievajú k účinnosti
in vivo. Dosah alfa častíc z rádia-223 je menší než 100 mikrometrov (menej než 10 bunkových priemerov), čo minimalizuje poškodenie okolitého zdravého tkaniva.
Farmakodynamické účinkyV porovnaní s placebom došlo k signifikantnému rozdielu v prospech Xofiga u všetkých piatich sérových
biomarkerov kostnej prestavby skúmaných v randomizovanom klinickom skúšaní fázy II (markery tvorby kostí: kostná alkalická fosfatáza [ALP], celková ALP a prokolagén I N propeptid [PINP], markery kostnej
rezorpcie: C-terminálny priečne sa viažuci telopeptid kolagénu typu I [S-CTX-I] a priečne sa viažuci C- telopeptid kolagénu typu I [ICTP]).
Klinická účinnosť a bezpečnosť
Klinickú bezpečnosť a účinnosť Xofiga vyhodnocovalo dvojito zaslepené, randomizované, multicentrické
klinické skúšanie fázy III s podaním viacnásobnej dávky (ALSYMPCA, EudraCT 2007-006195-1) u pacientov s kastračne rezistentným karcinómom prostaty so symptomatickými kostnými metastázami. Pacienti s viscerálnymi metastázami a malígnou lymfadenopatiou presahujúcou 3 cm boli vylúčení..
Primárnym ukazovateľom účinnosti bolo celkové prežívanie. Sekundárne ukazovatele zahŕňali dobu do vzniku symptomatických kostných príhod (SSE), progresiu ALP a PSA.
V čase vopred plánovanej priebežnej analýzy (potvrdzujúca analýza) bolo randomizovaných spolu
809 pacientov v pomere 2:1 na intravenózne podávanie Xofiga 50 kBq/kg každé 4 týždne po dobu 6 cyklov (N=541) s najlepším štandardom zdravotnej starostlivosti alebo placeba s najlepším štandardom zdravotnej starostlivosti (N=268). Najlepší štandard zdravotnej starostlivosti zahŕňal napríklad lokálnu externú rádioterapiu, bisfosfonáty, kortikosteroidy, antiandrogény, estrogény, estramustín alebo ketokonazol.
Aktualizovaná popisná analýza bezpečnosti a celkového prežívania bola vykonaná u 921 randomizovaných pacientov pred prekrížením (t. j. ponúknutie liečby Xofigom pacientom, ktorí predtým dostávali placebo).
Demografické a východiskové charakteristiky ochorenia (populácia pre priebežnú analýzu) boli podobné medzi skupinami so Xofigom a placebom a sú uvedené nižšie pre Xofigo:
• priemerný vek pacientov bol 70 rokov (rozsah 49 až 90 rokov).
• 87 % zaradených pacientov malo skóre výkonnostného stavu podľa ECOG v rozmedzí 0-1.
• 41 % dostalo bisfosfonáty.
• 42 % pacientov nedostalo predtým docetaxel, pretože sa považovali za nespôsobilých na podanie docetaxelu alebo ho odmietli.
• 46 % pacientov nemalo žiadnu bolesť alebo malo bolesť úrovne 1 na stupnici WHO (boli asymptomatickí alebo mierne symptomatickí) a 54 % malo bolesť úrovne 2-3 na stupnici WHO.
• 16 % pacientov malo <6 kostných metastáz, 44 % pacientov malo 6 až 20 kostných metastáz,
40 % pacientov malo viac než 20 kostných metastáz alebo superscan.
Počas obdobia liečby 83 % pacientov dostávalo liečbu agonistami hormónu uvoľňujúceho luteinizačný hormón (LHRH) a 26 % pacientov dostávalo súbežne antiandrogénovú liečbu.
Výsledky priebežnej aj aktualizovanej analýzy preukázali, že celkové prežívanie bolo výrazne dlhšie u pacientov liečených Xofigom s najlepším štandardom zdravotnej starostlivosti v porovnaní so skupinou pacientov, ktorí dostávali placebo s najlepším štandardom zdravotnej starostlivosti (pozri tabuľku č. 2 a obrázok č. 2). V skupine s placebom sa pozoroval zvýšený výskyt úmrtí, ktoré nesúviseli s karcinómom prostaty (26/541, 4,8 % v ramene s Xofigom v porovnaní s 23/268, 8,6 % v ramene s placebom).
Tabuľka č. 2: Výsledky prežívania z klinického skúšania fázy III ALSYMPCA
Parameter účinnosti
|
Xofigo
|
Placebo
|
Priebežná analýza
|
N=541
|
N=268
|
Počet úmrtí (%)
|
191 (35,3 %)
|
123 (45,9 %)
|
Medián celkového prežívania (mesiace) (95 % IS)
|
14,0 (12,1-15,8)
|
11,2 (9,0-13,2)
|
Miera rizikab (95 % IS)
|
0,695 (0,552-0,875)
|
Hodnota pa (2-stranná)
|
0,00185
|
Aktualizovaná analýza
|
N=614
|
N=307
|
Počet úmrtí (%)
|
333 (54,2 %)
|
195 (63,5 %)
|
Medián celkového prežívania (mesiace) (95 % IS)
|
14,9 (13,9-16,1)
|
11,3 (10,4-12,8)
|
Miera rizikab (95% IS)
|
0,695 (0,581-0,832)
|
IS = interval spoľahlivosti
a Klinické skúšanie fázy III ALSYMPCA bola zastavená pre účinnosť po vykonaní priebežnej analýzy. Keďže sa aktualizovaná analýza poskytuje iba na opisné účely, hodnota p nie je uvedená.
b Miera rizika (Xofigo verzus placebo) <1 v prospech Xofiga.
 Obrázok č. 2: Kaplan-Meierová krivka celkového prežívania (aktualizovaná analýza)
Obrázok č. 2: Kaplan-Meierová krivka celkového prežívania (aktualizovaná analýza)
L
i
ečba
Č
as (mesiace)
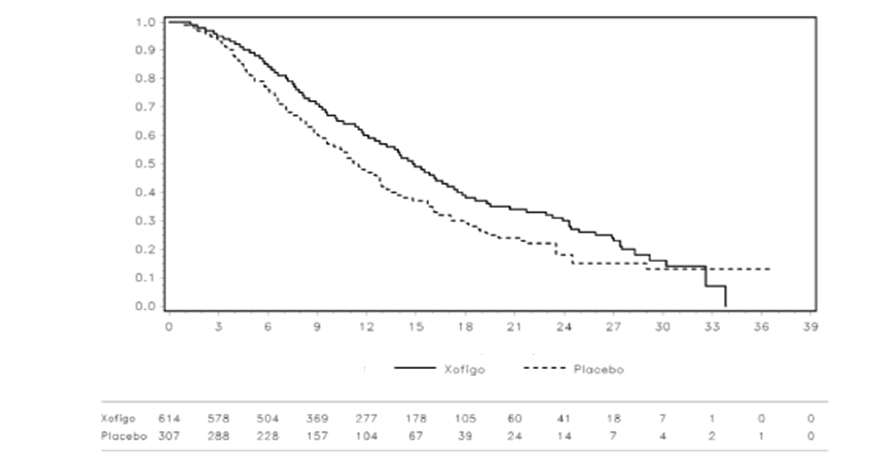 Počet pacientov s rizikom
Počet pacientov s rizikom
Výsledky priebežnej a aktualizovanej analýzy preukázali aj významné zlepšenie vo všetkých hlavných
sekundárnych koncových ukazovateľoch v liečebnej skupine s Xofigom v porovnaní s liečebnou skupinou s placebom (pozri tabuľku 3). Údaje o časoch do vzniku udalostí progresie ALP boli podporené štatisticky významným prínosom vzhľadom na normalizáciu ALP a odpovede ALP v 12. týždni.
Tabuľka č. 3: Sekundárne koncové ukazovatele z klinického skúšania ALSYMPCA fázy III (p analýza)
|
Miera výskytu
[počet (%) pacientov] Xofigo Placebo N=541 N=268
|
Analýza časov do výskytu udalostí (95 % IS)
|
[medián počtu mesiacov] Miera rizika Xofigo Placebo <1 v prospech N=541 N=268 Xofiga
|
Hodnota p (deskriptívna analýza)
|
Symptomatické kostné príhody
(SSE)
|
Z
l
o
ž
en
ý koncový ukazovateľ SSE
|
132 82
(24,4 %) (30,6 %)
|
13,5 8,4 0,610
(12,2-19,6) (7,2 – NE)b (0,461-0,807)
|
0,00046
|
Zložky SSE
|
Externá rádioterapia pre úľavu od bolesti
|
122 72 (22,6 %) (26,9 %)
|
17,0 10,8 0,649
(12,9-NE) (7,9-NE) (0,483-0,871)
|
0,00375
|
Kompresia miechy
|
17 16 (3,1 %) (6,0 %)
|
NE NE 0,443 (0,223-0,877)
|
0,01647
|
Chirurgický zákrok
|
9 5 (1,7 %) (1,9 %)
|
NE NE 0.801 (0,267-2,398)
|
0,69041
|
Z
lomenina kostí
|
20 18 (3,7 %) (6,7 )
|
NE NE 0,450 (0,236-0,856)
|
0,01255
|
Celková progresia ALP
c
|
79 116 (14,6 %) (43,3 %)
|
NE 3,7 0,162
(3,5-4,1) (0,120-0,220)
|
<0,00001
|
Progresia PSA
d
|
288 141 (53,2 %) (52,6 %)
|
3,6 3,4 0,671
(3,5-3,7) (3,3-3,5) (0,546-0,826)
|
0,00015
|
ALP = alkalická fosfatáza, IS = interval spoľahlivosti, NE = nemožno stanoviť, PSA = antigén špecifický pre prostatu, SSE = symptomatické kostné príhody
a Definované ako výskyt ktorejkoľvek z nasledujúcich udalostí: externá rádioterapia na úľavu od bolesti, patologická zlomenina,
kompresia miechy alebo ortopedický chirurgický zákrok súvisiaci s nádorovým ochorením.
b Nemožno stanoviť vzhľadom na nedostatočný počet udalostí po mediáne.
c Definované ako zvýšenie o ≥25 % v porovnaní s východiskovou hodnotou/nadirom.
d Definované ako zvýšenie o ≥25 % a zvýšenie absolútnej hodnoty o ≥2 ng/ml v porovnaní s východiskovou hodnotou/nadirom.
Analýza prežívania v podskupináchAnalýza prežívania v podskupinách preukázala konzistentný prínos pre prežívanie pri liečbe Xofigom, nezávisle od hladiny celkovej alkalickej fosfatázy (ALP), súbežného používania bisfosfonátov a
predchádzajúceho použitia docetaxelu.
Kvalita životaKvalita života súvisiaca so zdravotným stavom (HRQOL) sa hodnotila v klinickom skúšaní ALSYMPCA fázy III použitím špecifických dotazníkov: EQ-5D (všeobecný dotazník) a FACT-P (dotazník pre pacientov s rakovinou prostaty). Obom skupinám sa zhoršila kvalita života. V porovnaní s placebom bol pokles kvality
života pomalší pri liečbe Xofigom počas celého klinického skúšania, čo sa meralo pomocou skóre indexu
prospešnosti EQ-5D (-0,040 vs - 0,109; p=0,001), samostatne hláseného vizuálneho analógového skóre zdravotného stavu (VAS) EQ 5D (-2,661 vs -5,860; p=0,018) a celkového skóre FACT-P (-3,880 vs -7,651; p=0,006), ale nedosiahol publikované minimálne významné rozdiely. Existujú len obmedzené dôkazy o tom, že oddialenie zníženia kvality života HRQOL presahuje obdobie liečby.
Úľava od bolestiVýsledky klinického skúšania fázy III ALSYPMCA, týkajúce sa času do externej rádioterapie (EBRT) na úľavu od bolesti a menšieho počtu pacientov hlásiacich bolesť kostí ako nežiaducu udalosť v skupine so Xofigom preukázali pozitívny účinok na úľavu od bolesti kosti.
Následná liečba cytotoxickými látkamiPočas klinického skúšania ALSYMPCA s randomizáciou v pomere 2:1 dostalo 93 (17 %) pacientov v skupine so Xofigom a 54 (16,8 %) pacientov v skupine s placebom cytotoxickú chemoterapiu v rôznych časoch po poslednej liečbe. V týchto dvoch skupinách neboli zrejmé žiadne rozdiely hematologických laboratórnych hodnôt.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Xofigom vo všetkých
podskupinách pediatrickej populácie s karcinómom prostaty (s výnimkou rabdomyosarkómu) (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Všeobecný úvod
Farmakokinetické údaje, údaje o biologickej distribúcii a dozimetrii boli získané z 3 klinických skúšaní
fázy I. Farmakokinetické údaje sa získali u 25 pacientov pri aktivite v rozsahu od 46 do 250 kBq/kg. Farmakokinetické údaje, údaje o biologickej distribúcii a dozimetrii sa získali u 6 pacientov pri aktivite
100 kBq/kg podanej dvakrát s odstupom 6 týždňov a u 10 pacientov pri aktivite 50, 100 alebo 200 kBq/kg.
Absorpcia
Xofigo sa podáva ako intravenózna injekcia, a preto je 100 % biologicky dostupné.
Distribúcia a vychytávanie v orgánoch
Po intravenóznej injekcii sa rádium-223 rýchlo uvoľňuje z krvi a zabudováva najmä do kostí a kostných
metastáz alebo sa vylučuje do čreva.
Pätnásť minút po injekcii zostáva v krvi približne 20 % z injekčne podanej aktivity. Po 4 hodinách zostávajú v krvi približne 4 % z injekčne podanej aktivity a po 24 hodinách po injekcii dochádza k poklesu na menej než 1 %. Distribučný objem bol vyšší než objem krvi, čo naznačuje distribúciu do periférnych priestorov.
10 minút po injekcii sa pozorovala aktivita v kostiach a v črevách. 4 hodiny po injekcii bola úroveň aktivity v kostiach v rozsahu od 44 % do 77 %.
4 hodiny po injekcii sa nepozorovalo žiadne významné hromadenie v iných orgánoch, ako napríklad v srdci, pečeni, obličkách, močovom mechúre a slezine.
Biotransformácia
Rádium-223 je izotop, ktorý podlieha rádioaktívnemu rozpadu a nie je metabolizovaný.
Eliminácia
Vylučovanie stolicou je hlavnou cestou eliminácie z tela. Približne 5 % sa vylučuje močom a nie je žiadny
dôkaz o vylučovaní pečeňou a žlčovými cestami.
Celotelové merania 7 dní po injekcii (po korekcii na rozpad) preukázali, že z tela bol vylúčený medián 76 % z podanej aktivity. Rýchlosť vylučovania chloridu radnatého 223 z gastrointestinálneho traktu je ovplyvnená vysokou variabilitou rýchlostí prechodu črevami v rámci populácie, s normálnym rozsahom vyprázdňovania čriev od jedenkrát denne po jedenkrát týždenne.
Linearita/nelinearita
Farmakokinetické vlastnosti chloridu radnatého 223 boli lineárne v skúmanom rozsahu aktivity
(46 až 250 kBq/kg).
Pediatrickí pacienti
Bezpečnosť a účinnosť Xofiga sa u detí a dospievajúcich do 18 rokov veku neskúmali.
5.3 Predklinické údaje o bezpečnosti
Systémová toxicita
V štúdiách toxicity po jednorazovom podaní a opakovanom podávaní u potkanov boli hlavnými nálezmi
znížený prírastok telesnej hmotnosti, hematologické zmeny, znížená sérová alkalická fosfatáza a mikroskopické nálezy v kostnej dreni (úbytok hematopoetických buniek, fibróza), slezine (sekundárna extramedulárna hematopoéza) a kostiach (úbytok osteocytov, osteoblastov, osteoklastov, fibrózne-kostné lézie, porucha/rozpad epifyzárnej/rastovej línie). Tieto nálezy súviseli s radiáciou vyvolaným narušením hematopoézy a znížením osteogénézy a pozorovali sa počínajúc od najnižšej aktivity 20 kBq na kg telesnej hmotnosti (0,4-násobok klinicky odporúčanej dávky).
U psov sa pozorovali hematologické zmeny počínajúc najnižšou aktivitou 50 kBq/kg, čo je klinicky odporúčaná dávka. Myelotoxicita obmedzujúca dávku sa pozorovala u psov po jednom podaní dávky
450 kBq chloridu radnatého 223 na kg telesnej hmotnosti (9-násobok klinicky odporúčanej aktivity).
Po opakovanom podaní klinicky odporúčanej aktivity 50 kBq na kg telesnej hmotnosti jedenkrát za 4 týždne počas 6 mesiacov sa u dvoch psov vyvinuli zlomeniny panvy. Vzhľadom k prítomnosti osteolýzy trabekulárnej kosti, nemožno u ošetrených zvierat vylúčiť spontánne zlomeniny v rôznej miere v spojistosti s osteolýzou na iných miestach kostí. Klinický význam týchto nálezov nie je známy.
U psov sa pozorovalo po jednom injekčnom podaní aktivít 150 a 450 kBq na kg telesnej hmotnosti (3-
a 9-násobok klinicky odporúčanej dávky) odlupovanie sietnice, nie však po opakovanom podávaní klinicky odporúčanej aktivity 50 kBq na kg telesnej hmotnosti jedenkrát každé 4 týždne po dobu 6 mesiacov. Presný mechanizmus vyvolania odlupovania sietnice je neznámy, ale údaje z literatúry naznačujú, že rádium sa špecificky vstrebáva v tapetum lucidum očí psov. Keďže ľudia nemajú tapetum lucidum, klinický význam týchto nálezov pre ľudí je nejasný. V klinických skúšaniach nebol hlásený žiadny prípad odlúčenia sietnice.
V orgánoch zúčastňujúcich sa na vylučovaní chloridu radnatého-223 sa nepozorovali žiadne histologické zmeny.
7 až 12 mesiacov po začatí liečby sa u potkanov pri klinicky relevantných dávkach pozorovali osteosarkómy, ktoré sú známym následkom použitia osteotropných rádionuklidov. Osteosarkómy sa nepozorovali v skúšaniach u psov. V klinických skúšaniach so Xofigom nebol hlásený žiadny prípad osteosarkómu. Riziko vzniku osteosarkómov u pacientov s expozíciou rádiu-223 nie je v súčasnosti známe. Prítomnosť zmien vo forme novotvarov iných než osteosarkómov bola hlásená aj v dlhodobejších (12- až 15-mesačných) štúdiách toxicity u potkanov (pozri časť 4.8).
Embryotoxicita/Reprodukčná toxicita
Neuskutočnili sa žiadne klinické skúšania reprodukčnej a vývojovej toxicity. Vo všeobecnosti platí, že
rádionuklidy vyvolávajú reprodukčné a vývojové zmeny.
Po jednorazovom podaní chloridu radnatého 223 s aktivitou ≥2 054 kBq/kg telesnej hmotnosti (≥41-násobok klinicky odporúčanej aktivity) sa pozoroval minimálny počet abnormálnych spermatocytov v niekoľkých semenonosných kanálikoch v semenníkoch samcov potkanov. Semenníky sa inak zdali byť normálne fungujúce a nadsemenníky vykazovali normálny obsah spermatocytov. Po jednorazovom alebo po opakovanom podávaní chloridu radnatého 223 s aktivitou ≥325 kBq/kg telesnej hmotnosti (≥6,5-násobok klinicky odporúčanej aktivity) sa u samíc potkanov pozorovali maternicové polypy (endometriálna stroma).
Keďže sa rádium-223 distribuuje najmä do kosti, potenciálne riziko nežiaducich účinkov v mužských pohlavných žľazách u pacientov s kastračne rezistentnou rakovinou prostaty je veľmi nízke, ale nemožno ho vylúčiť (pozri časť 4.6).
Genotoxicita/Karcinogenita
Neuskutočnili sa žiadne klinické skúšania mutagénneho a karcinogénneho potenciálu Xofiga. Rádionuklidy
sa vo všeobecnosti považujú za genotoxické a karcinogénne.
Farmakologické skúšania bezpečnosti
Nepozorovali sa žiadne významné účinky na systémy životne dôležitých orgánov, t. j. kardiovaskulárny
(pes), respiračný ani centrálny nervový systém (potkan), po podaní jednorazovej aktivity od
450 do 1000 kBq na kg telesnej hmotnosti (9- [pes] až 20-násobok [potkan] klinicky odporúčanej aktivity).
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Voda na injekciu Citran sodný Chlorid sodný
Kyselina chlorovodíková, zriedená
6.2 Inkompatibility
Nevykonali sa klinické skúšania kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
28 dní.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky na uchovávanie.
Uchovávanie Xofiga sa má vykonávať v súlade s národnými predpismi pre rádioaktívne materiály.
6.5 Druh obalu a obsah balenia
Injekčná liekovka z bezfarebného skla typu I uzavretá sivou zátkou z chlorobutylovej gumy a hliníkovým tesniacim viečkom, obsahujúca 6 ml injekčného roztoku.
Injekčná liekovka sa uchováva v olovenej nádobe.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všeobecné pokyny
Rádiofarmaká majú prijímať, používať a podávať len osoby oprávnené na zaobchádzanie s rádiofarmakami
v určenom zdravotníckom zariadení. Príjem, uchovávanie, používanie, preprava a likvidácia podliehajú predpisom a/alebo príslušným povoleniam kompetentných národných inštitúcií.'
S Xofigom sa má zaobchádzať takým spôsobom, ktorý zodpovedá požiadavkám radiačnej bezpečnosti a požiadavkám kvality liekov. Musia sa prijať príslušné aseptické opatrenia.
Ochrana pred radiáciou
Gama žiarenie súvisiace s rozpadom rádia-223 a jeho produktov rozpadu umožňuje meranie radioaktivity
Xofiga a detekciu kontaminácie pomocou štandardných zariadení.
Podávanie rádiofarmák je spojené s rizikami pre iné osoby súvisiacimi s možným ožiarením alebo kontamináciou rozliatym močom, stolicou a zvratkami. Preto sa musia vykonať preventívne opatrenia na radiačnú ochranu v súlade s národnými a miestnymi predpismi. Pri manipulácii s materiálmi, ako je posteľná bielizeň, ktoré prichádzajú do styku s takými telesnými tekutinami je potrebná opatrnosť. Aj keď je
rádium-223 najmä alfa žiarič, s rozpadom rádia-223 a jeho rádioaktívnych dcérskych izotopov je spojené žiarenie gama a beta. Externá radiačná expozícia spojená s manipuláciou s dávkami pre pacientov je značne nižšia v porovnaní s inými rádiofarmakami na terapeutické účely, pretože podaná rádioaktivita bude zvyčajne nižšia než 8 MBq. Avšak z dôvodu zachovania princípu ALARA („As Low As Reasonably Achievable“, čiže „tak nízke, ako možno rozumne dosiahnuť“) sa na minimalizáciu radiačnej expozície odporúča minimalizovať čas strávený v oblasti zdrojov žiarenia, maximalizovať vzdialenosť od zdrojov žiarenia a používať dostatočné tienenie.
Akýkoľvek nepoužitý liek alebo materiál sa má zlikvidovať v súlade s miestnymi predpismi.
S akýmkoľvek materiálom použitým v súvislosti s prípravou alebo podaním Xofiga treba zaobchádzať ako s rádioaktívnym odpadom.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Bayer Pharma AG
13342 Berlín
Nemecko
8. REGISTRAČNÉ ČÍSLO
EU/1/13/873/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
11. DOZIMETRIA
Výpočet absorbovanej dávky žiarenia bol vykonaný na základe klinických údajov o biologickej distribúcii. Výpočty absorbovaných dávok boli vykonané použitím softvéru OLINDA/EXM (Organ Level INternal Dose Assessment/EXponential Modeling; vyhodnotenie/exponenciálne modelovanie úrovne dávok vnútri orgánov) založeného na algoritme medicínskej vnútornej dávky žiarenia (Medical Internal Radiation Dose,
MIRD), ktorý sa bežne používa pre schválené rádionuklidy vyžarujúce beta a gama žiarenie. Pre rádium-223, ktoré je primárne alfa žiaričom, boli vykonané ďalšie predpoklady pre črevá, červenú kostnú dreň
a kostné/osteogénne bunky, aby sa získali najlepšie možné výpočty absorbovanej dávky pre Xofigo po zohľadnení jeho pozorovanej biologickej distribúcie a špecifických charakteristík (pozri tabuľku 4).
Tabuľka 4: Vypočítané absorbované dávky žiarenia v orgánoch
Cieľový orgán
|
Alfa
1
ž
iarenie (Gy/MBq)
|
Beta žiarenie (Gy/MBq)
|
Gama žiarenie (Gy/MBq)
|
Celková dávka (Gy/MBq)
|
Variačný koeficient (%)
|
Nadobličky
|
0,00000
|
0,00002
|
0,00009
|
0,00012
|
56
|
Mozog
|
0,00000
|
0,00002
|
0,00008
|
0,00010
|
80
|
Prsníky
|
0,00000
|
0,00002
|
0,00003
|
0,00005
|
120
|
Stena žlčníka
|
0,00000
|
0,00002
|
0,00021
|
0,00023
|
14
|
Stena LLI2
|
0,00000
|
0,04560
|
0,00085
|
0,04645
|
83
|
Stena tenkého čreva
|
0,00319
|
0,00360
|
0,00047
|
0,00726
|
45
|
Stena žalúdka
|
0,00000
|
0,00002
|
0,00012
|
0,00014
|
22
|
Stena ULI0
|
0,00000
|
0,03150
|
0,00082
|
0,03232
|
50
|
Stena srdca
|
0,00161
|
0,00007
|
0,00005
|
0,00173
|
42
|
Obličky
|
0,00299
|
0,00011
|
0,00011
|
0,00320
|
36
|
Pečeň
|
0,00279
|
0,00010
|
0,00008
|
0,00298
|
36
|
Pľúca
|
0,00000
|
0,00002
|
0,00005
|
0,00007
|
90
|
Sval
|
0,00000
|
0,00002
|
0,00010
|
0,00012
|
41
|
Vaječníky
|
0,00000
|
0,00002
|
0,00046
|
0,00049
|
40
|
Pankreas
|
0,00000
|
0,00002
|
0,00009
|
0,00011
|
43
|
Červená kostná dreň
|
0,13200
|
0,00642
|
0,00020
|
0,13879
|
41
|
Osteogénne bunky
|
1,14000
|
0,01490
|
0,00030
|
1,15206
|
41
|
Koža
|
0,00000
|
0,00002
|
0,00005
|
0,00007
|
79
|
Slezina
|
0,00000
|
0,00002
|
0,00007
|
0,00009
|
54
|
Semenníky
|
0,00000
|
0,00002
|
0,00006
|
0,00008
|
59
|
Týmus
|
0,00000
|
0,00002
|
0,00003
|
0,00006
|
109
|
Štítna žľaza
|
0,00000
|
0,00002
|
0,00005
|
0,00007
|
96
|
Stena močového
mechúra
|
0,00371
|
0,00016
|
0,00016
|
0,00403
|
63
|
Maternica
|
0,00000
|
0,00002
|
0,00023
|
0,00026
|
28
|
Celé telo
|
0,02220
|
0,00081
|
0,00012
|
0,02311
|
16
|
|
|
1 Keďže vo väčšine pozorovaných mäkkých tkanív nedochádzalo k žiadnej absorpcii rádia-223, podiel žiarenia alfa na celkovej orgánovej dávke bol pre tieto orgány stanovený na nulu.
2 LLI: dolná časť hrubého čreva
3 ULI: horná časť hrubého čreva
Hematologické nežiaduce liekové reakcie pozorované v klinických skúšaniach so Xofigom majú oveľa nižšiu frekvenciu výskytu a závažnosť než tie, ktoré možno očakávať z vypočítaných absorbovaných dávok pre červenú kostnú dreň. To môže súvisieť s priestorovou distribúciou alfa žiarenia spôsobujúcou nerovnomernú dávku žiarenia pre červenú kostnú dreň.
12. POKYNY NA PRÍPRAVU RÁDIOFARMÁKTento liek sa má pred použitím vizuálne skontrolovať. Xofigo je číry, bezfarebný roztok, ktorý sa v prípade zmeny sfarbenia, výskytu nečistôt alebo poškodenia obalu nesmie použiť.
Xofigo je roztok pripravený na použitie a nemá sa riediť alebo miešať s inými roztokmi. Každá injekčná liekovka je určená len na jednorazové použitie.
Objem určený na podanie pre konkrétneho pacienta sa má vypočítať na základe:
- telesnej hmotnosti pacienta (kg)
- veľkosti jednotkovej dávky jednotkovej aplikovanej aktivity (50 kBq/kg telesnej hmotnosti)
- objemovej aktivity rádiofarmaka (1 000 kBq/ml) ku referenčnému dátumu. Referenčný dátum je uvedený na injekčnej liekovke a na štítku oloveného obalu.
- hodnoty korekčného faktora (Decay correction factor , DK) na korekciu fyzikálneho rozpadu rádia-223. Tabuľka korekčných faktorov sa poskytuje ako súčasť príručky ku každej injekčnej liekovke (pred písomnou informáciou pre používateľa).
Množstvo rádioaktivity v pripravenom objeme sa musí potvrdiť meraním v správne kalibrovanom merači aktivity (kalibrátore dávok).
Celkový objem na podanie pacientovi sa vypočíta nasledovne:
Objem určený na podanie (ml) =
Telesná hmotnosť(kg) ´aktivita (50kBq/kg tel.hmotnosti) DK faktor ´ 1 000 kBq/ml
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.