
Pred začiatkom liečby XGEVOU sa musí prítomná hypokalciémia upraviť. Hypokalciémia sa môže vyskytnúť kedykoľvek počas liečby XGEVOU. Hladina vápnika sa má monitorovať (i) pred úvodnou
dávkou XGEVY, (ii) v priebehu dvoch týždňov po úvodnej dávke, (iii) pri podozrení na výskyt
príznakov hypokalciémie (pre príznaky pozri časť 4.8). Ďalšie sledovanie hladiny vápnika sa má zvážiť počas liečby u pacientov s rizikovými faktormi pre hypokalciémiu alebo, ak nie je uvedené inak, na základe klinického stavu pacienta.
Pacientom treba odporučiť, aby hlásili príznaky naznačujúce hypokalciémiu. Ak sa počas liečby
XGEVOU vyskytne hypokalciémia, môže byť potrebné ďalšie doplnenie vápnika a ďalšie
monitorovanie.
Po uvedení lieku na trh sa zaznamenala závažná symptomatická hypokalciémia (vrátane fatálnych prípadov) (pozri časť 4.8), pričom väčšina prípadov sa vyskytovala počas prvých týždňov po začatí liečby, môžu sa však vyskytnúť aj neskôr.
Poruchafunkcieobličiek
Pacienti so závažnou poruchou funkcie obličiek (klírens kreatinínu < 30 ml/min) alebo pacienti na
dialýze sú vystavení vyššiemu riziku rozvoja hypokalciémie. Riziko vzniku hypokalciémie
a sprievodných nárastov hladiny parathormónu sa zvyšuje so zvyšujúcim sa stupňom poruchy funkcie obličiek. U týchto pacientov je obzvlášť dôležité pravidelné sledovanie hladiny vápnika.
Osteonekrózačeľuste (Osteonecrosis of the Jaw, ONJ)
U pacientov liečených XGEVOU bola často zaznamenaná ONJ (pozri časť 4.8).
Začiatok liečby/nový liečebný cyklus sa má oddialiť u pacientov s nevyliečenými otvorenými léziami
mäkkého tkaniva v ústach. Pred liečbou XGEVOU sa odporúča stomatologické vyšetrenie
s preventívnou stomatologickou starostlivosťou a individuálne zhodnotenie prínosu a rizika liečby.
Pri posudzovaní rizika rozvoja ONJ pre pacienta sa majú brať do úvahy nasledujúce rizikové faktory:
· účinnosť lieku, ktorý inhibuje kostnú resorpciu (vyššie riziko pri vysoko účinných zložkách), spôsob podávania (vyššie riziko pri parenterálnom podaní) a kumulovaná dávka antiresorpčnej liečby.
· nádorové ochorenie, pridružené ochorenia (napr. anémia, koagulopatie, infekcia), fajčenie.
· súbežná liečba: kortikosteroidy, chemoterapia, inhibítory angiogenézy, rádioterapia hlavy a krku.
· nedostatočná ústna hygiena, periodontálne ochorenie, slabo prichytené zubné náhrady,
ochorenie zubov v anamnéze, invazívne stomatologické zákroky (napr. extrakcie zubov).
Všetkým pacientom treba odporučiť, aby dodržiavali správnu ústnu hygienu, pravidelne chodili na stomatologické prehliadky a okamžite hlásili výskyt všetkých orálnych symptómov počas liečby XGEVOU, ako je pohyblivosť zubov, bolesť alebo opuch, prípadne neliečiace sa bolestivé rany či výtok z úst. Počas liečby sa invazívne stomatologické zákroky majú vykonať až po starostlivom zvážení a bezprostredne po podaní XGEVY sa im treba vyhnúť.
Plán liečby pacientov, u ktorých sa vyvinula ONJ, sa má vytvoriť v úzkej spolupráci medzi ošetrujúcim lekárom a stomatológom alebo dentálnym chirurgom so skúsenosťami s ONJ. Ak je to možné, je potrebné zvážiť dočasné prerušenie liečby XGEVOU až do ústupu ochorenia a zmiernenia prispievajúcich rizikových faktorov.
O
steonekróza
vonkajšieho
zvukovodu
V súvislosti s liečbou denosumabom bola hlásená osteonekróza vonkajšieho zvukovodu. K možným rizikovým faktorom osteonekrózy vonkajšieho zvukovodu patrí používanie steroidov a chemoterapia a/alebo miestne rizikové faktory, ako sú infekcia alebo trauma. Možnosť vzniku osteonekrózy vonkajšieho zvukovodu treba zvážiť u pacientov liečených denosumabom, u ktorých sa prejavia ušné symptómy, vrátane chronických infekcií ucha.
Atypické fraktúry femuru
U pacientov liečených XGEVOU sa zaznamenali atypické fraktúry femuru (pozri časť 4.8). Atypické fraktúry femuru sa môžu vyskytnúť v subtrochanterickej a diafyzálnej oblasti femuru pri malej traume alebo bez traumy. Tieto udalosti sú charakteristické špecifickými röntgenovými nálezmi. Atypické fraktúry femuru sa zaznamenali aj u pacientov s niektorými súbežnými ochoreniami (napr. nedostatok vitamínu D, reumatoidná artritída, hypofosfatázia) a u tých, ktorí používajú niektoré lieky (napr. bisfosfonáty, glukokortikoidy, inhibítory protónovej pumpy). Tieto udalosti sa vyskytovali aj bez antiresorpčnej liečby. Podobné fraktúry zaznamenané v súvislosti s bisfosfonátmi sú často bilaterálne; preto je potrebné u pacientov liečených denosumabom s fraktúrou femuru vyšetriť kontralaterálny femur. U pacientov s podozrením na atypickú fraktúru femuru sa má vysadenie liečby XGEVOU zvážiť na základe individuálneho hodnotenia prínosu a rizika pre pacienta. Počas liečby XGEVOU sa pacientom odporúča, aby hlásili nové alebo nezvyčajné bolesti stehna, bedra alebo slabín. Pacienti s uvedenými príznakmi sa majú vyšetriť na prítomnosť inkompletnej fraktúry femuru.
Pacienti so skeletom v období rastu
XGEVA sa neodporúča u pacientov so skeletom v období rastu (pozri časť 4.2). U pacientov liečených
XGEVOU, so skeletom v období rastu, bola hlásená klinicky významná hyperkalciémia týždne až mesiace po ukončení liečby.
Iné
Pacienti liečení XGEVOU sa nemajú súčasne liečiť inými liekmi obsahujúcimi denosumab (na
indikáciu osteoporóza).
Pacienti liečení XGEVOU sa nemajú súčasne liečiť bisfosfonátmi.
Malignita v prípade obrovskobunkového kostného nádoru alebo progresia do metastatického ochorenia sú zriedkavou udalosťou a známym rizikom u pacientov s obrovskobunkovým kostným nádorom. U pacientov sa majú sledovať rádiologické prejavy malignity, nová rádiolucencia alebo osteolýza. Dostupné klinické údaje nenaznačujú zvýšené riziko malignity u pacientov s GCTB liečených XGEVOU.
Upozornenia na pomocné látky
XGEVA obsahuje sorbitol. Pacienti so zriedkavými dedičnými problémami intolerancie fruktózy nemajú používať XGEVU.
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na 120 mg, t.j. v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
V klinických skúšaniach sa XGEVA podávala v kombinácii so štandardnou protinádorovú liečbou
a u osôb, ktoré boli predtým liečené bisfosfonátmi. Súbežná chemoterapia a/alebo hormonálna liečba alebo predchádzajúca expozícia intravenóznym bisfosfonátom nevyvolali žiadne klinicky významné zmeny v minimálnej sérovej koncentrácii a farmakodynamike denosumabu (močový N-telopeptid korigovaný podľa kreatinínu, uNTx/Cr).
4.6 Fertilita, gravidita a laktácia
G
r
avidita
Nie sú k dispozícii dostatočné údaje o použití XGEVY u gravidných žien. Reprodukčná toxicita sa
preukázala v štúdii pri opiciach rodu Cynomolgus, ktoré dostávali denosumab počas gravidity
v expozíciách AUC 12-násobne vyšších, ako je dávka u ľudí (pozri časť 5.3).
XGEVA sa neodporúča používať u gravidných žien a u žien vo fertilnom veku nepoužívajúcich vysoko účinnú antikoncepciu. Ženám treba odporučiť, aby neotehotneli počas liečby a počas najmenej
5 mesiacov po liečbe XGEVOU. Všetky účinky XGEVY sú pravdepodobne väčšie v priebehu
druhého a tretieho trimestra gravidity, pretože monoklonálne protilátky sú transportované cez placentu lineárne s vývojom gravidity, pričom najväčšie množstvo je transportované v priebehu tretieho trimestra.
Dojčenie
Nie je známe, či sa denosumab vylučuje do materského mlieka. Štúdie s knokautovanými myšami naznačujú, že by chýbajúci RANKL počas gravidity mohol interferovať s vývojom prsnej žľazy, čo má za následok poruchu popôrodnej laktácie (pozri časť 5.3). Rozhodnutie, či prerušiť dojčenie, alebo prerušiť liečbu XGEVOU, sa má urobiť po zvážení prínosu dojčenia pre novorodenca/dojča a prínosu liečby XGEVOU pre ženu.
Fertilita
Nie sú dostupné žiadne údaje o vplyve denosumabu na fertilitu u ľudí. Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky na fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
XGEVA nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn profilubezpečnosti
Celkový profil bezpečnosti je zhodný vo všetkých schválených indikáciách.
Po podaní XGEVY bola často hlásená hypokalciémia, najmä v prvých 2 týždňoch. Hypokalciémia môže byť ťažká a symptomatická (pozri časť 4.8 – Opis vybraných nežiaducich reakcií). Zníženia hodnôt sérového kalcia sa zvyčajne dostatočne zvládli suplementáciou vápnika a vitamínu D. Najčastejšou nežiaducou reakciou pri liečbe XGEVOU je muskuloskeletálna bolesť.
Bezpečnosť XGEVY sa hodnotila:
· u 5 931 pacientov s pokročilým nádorovým ochorením postihujúcim kosti v aktívne kontrolovaných klinických skúšaniach skúmajúcich účinnosť a bezpečnosť XGEVY oproti kyseline zoledrónovej na prevenciu výskytu príhod súvisiacich so skeletom.
· u 523 pacientov s obrovskobunkovým kostným nádorom v klinických skúšaniach s jedným
ramenom skúmajúcich účinnosť a bezpečnosť XGEVY.
Nežiaduce reakcie identifikované v týchto klinických skúšaniach a zo skúseností po uvedení lieku na trh sú uvedené v tabuľke 1.
Zoznamnežiaducichreakciívtabuľke
Na klasifikáciu nežiaducich reakcií vychádzajúcich z miery výskytu v troch klinických štúdiách
fázy III a v dvoch klinických štúdiách fázy II bola použitá nasledujúca konvencia (pozri tabuľku 1):
veľmi časté (³ 1/10), časté (³ 1/100 až < 1/10), menej časté (³ 1/1 000 až < 1/100), zriedkavé
(³ 1/10 000 až < 1/1 000) a veľmi zriedkavé (< 1/10 000). V rámci jednotlivých skupín frekvencií a tried orgánových systémov sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
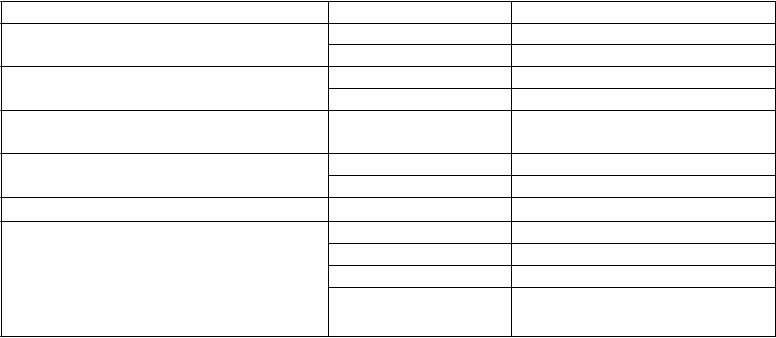
T
abuľka 1: Nežiaduce reakcie zaznamenané u pacientov s pokročilým nádorovým ochorením
postihujúcim kosti alebo s obrovskobunkovým kostným nádorom
T
rieda orgánových systémov MedDRA Trieda frekvencie Nežiaduce reakcie
Poruchy imunitného systému Zriedkavé Precitlivenosť na liečivo1
Zriedkavé Anafylaktická reakcia1
Poruchy metabolizmu a výživy Časté Hypokalciémia1, 2
Časté Hypofosfatémia
Poruchy dýchacej sústavy, hrudníka a mediastína
Veľmi časté Dyspnoe
Poruchy gastrointestinálneho traktu Veľmi časté Hnačka
Časté Extrakcia zuba
Poruchy kože a podkožného tkaniva Časté Hyperhidróza
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
1 Pozri časť Opis vybraných nežiaducich reakcií
2 Pozri časť Iné osobitné populácie
3 Pozri časť 4.4
4 Skupinový účinok
Veľmi časté Muskuloskeletálna bolesť1
Časté Osteonekróza čeľuste1
Zriedkavé Atypické fraktúry femuru1
Neznáme Osteonekróza vonkajšieho
zvukovodu3,4
 O
pis vybraných
nežiaducich
reakcií
H
ypokalciémia
O
pis vybraných
nežiaducich
reakcií
H
ypokalciémia
V troch aktívne kontrolovaných klinických štúdiách fázy III u pacientov s pokročilým nádorovým ochorením postihujúcim kosti sa u 9,6 % pacientov liečených XGEVOU a u 5,0 % pacientov liečených kyselinou zoledrónovou zaznamenala hypokalciémia.
Zníženie sérových hladín vápnika 3. stupňa sa vyskytovalo u 2,5 % pacientov liečených XGEVOU
a u 1,2 % pacientov liečených kyselinou zoledrónovou. Zníženie sérových hladín vápnika 4. stupňa sa vyskytovalo u 0,6 % pacientov liečených XGEVOU a u 0,2 % pacientov liečených kyselinou zoledrónovou (pozri časť 4.4).
V dvoch klinických skúšaniach fázy II s jedným ramenom u pacientov s obrovskobunkovým kostným nádorom bola hypokalciémia hlásená u 5,7 % pacientov. Žiadne nežiaduce udalosti sa nepovažovali za závažné.
Po uvedení lieku na trh sa zaznamenala závažná symptomatická hypokalciémia (vrátane fatálnych prípadov), pričom väčšina prípadov sa vyskytovala počas prvých týždňov po začatí liečby. Príklady klinických prejavov závažnej symptomatickej hypokalciémie zahŕňali predĺženie QT intervalu, tetániu, kŕče a poruchy duševného stavu (vrátane kómy) (pozri časť 4.4). Príznaky hypokalciémie
v klinických skúšaniach zahŕňali parestéziu alebo stuhnutosť svalov, zášklby, spazmy a svalové kŕče.
Osteonekróza čeľuste (ONJ)V klinických štúdiách bol výskyt ONJ vyšší pri dlhšom trvaní expozície; ONJ bola diagnostikovaná aj
po ukončení liečby XGEVOU, pričom väčšina prípadov sa vyskytla do 5 mesiacov po podaní poslednej dávky. Pacienti s predchádzajúcou anamnézou ONJ alebo osteomyelitídy čeľuste, s
aktívnym ochorením zubov alebo čeľuste vyžadujúcim chirurgický zákrok v ústach, s nezahojeným
zubným chirurgickým zákrokom alebo zákrokom v ústach alebo s akýmkoľvek plánovaným invazívnym stomatologickým zákrokom boli vylúčení z klinických skúšaní.
V primárnych fázach liečby troch aktívne kontrolovaných klinických štúdií fázy III u pacientov
s pokročilým nádorovým ochorením postihujúcim kosti sa u 1,8 % pacientov liečených XGEVOU
(medián expozície 12,0 mesiaca; rozmedzie 0,1 – 40,5) a u 1,3 % pacientov liečených kyselinou zoledrónovou potvrdila ONJ. Klinické charakteristiky týchto prípadov boli medzi skupinami podobné. Medzi osobami s potvrdenou ONJ mala väčšina (81 % v oboch liečených skupinách) v anamnéze
extrakciu zuba, slabú ústnu hygienu a/alebo používanie dentálneho aparátu. Väčšina osôb dostávala
alebo predtým dostala chemoterapiu.
Klinické skúšania u pacientov s karcinómom prsníka alebo prostaty zahŕňali rozšírenie liečebnej fázy
XGEVY (medián celkovej expozície 14,9 mesiaca; rozmedzie 0,1 – 67,2). ONJ bola potvrdená u 6,9 % pacientov s karcinómom prsníka a s karcinómom prostaty počas fázy predĺženia liečby.
Celková incidencia potvrdenej ONJ upravená na pacientorok bola počas prvého roka liečby 1,1 %,
v druhom roku 3,7 % a potom 4,6 % ročne. Medián času do ONJ bol 20,6 mesiaca (rozmedzie: 4 - 53).
V dvoch klinických skúšaniach fázy II s jedným ramenom u pacientov s obrovskobunkovým kostným nádorom sa ONJ vyskytovala u 2,3 % (12 z 523) pacientov liečených XGEVOU (medián celkovej expozície 20,3 mesiaca; rozmedzie: 0 – 83,4). Incidencia ONJ upravená na pacientorok bola 0,2 % počas prvého roka liečby a 1,7 % počas druhého roka. Medián času do ONJ bol 19,4 mesiaca (rozmedzie: 11 – 40). Na základe trvania expozície neexistuje dostatok údajov u pacientov s GCTB na vyhodnotenie rizika ONJ po 2 rokoch.
V klinickom skúšaní fázy III u pacientov s nemetastatickým karcinómom prostaty (populácia pacientov, ktorým XGEVA nie je indikovaná) a pri dlhšej expozícii liečbe až do 7 rokov bola incidencia potvrdenej ONJ na pacientorok upravená počas prvého roka liečby 1,1 %, v druhom roku
3,0 % a potom 7,1 % ročne.
Hypersenzitívne reakcie súvisiace s liekom
Po uvedení lieku na trh sa u pacientov liečených XGEVOU zaznamenali príhody precitlivenosti na liečivo vrátane zriedkavých príhod anafylaktických reakcií.
Atypické fraktúry femuru
V programe klinických štúdií sa zriedkavo zaznamenali atypické fraktúry femuru u pacientov
liečených denosumabom (pozri časť 4.4).
Muskuloskeletálna bolesť
Po uvedení lieku na trh sa u pacientov liečených XGEVOU zaznamenala muskuloskeletálna bolesť vrátane závažných prípadov. V klinických skúšaniach bola muskuloskeletálna bolesť veľmi častá
v oboch liečebných skupinách, s denosumabom aj kyselinou zoledrónovou. Muskuloskeletálna bolesť
vedúca k prerušeniu skúmanej liečby bola menej častá.
Pediatrická populácia
XGEVA sa skúmala v nezaslepenom skúšaní, do ktorého bolo zaradených 18 dospievajúcich
s vyvinutým skeletom s obrovskobunkovým kostným nádorom. Na základe týchto obmedzených
údajov sa zdá, že profil nežiaducich účinkov je podobný ako u dospelých.
Iné osobitné populácie
Porucha funkcie obličiek
V klinickej štúdii s pacientmi bez pokročilého karcinómu s ťažkou poruchou funkcie obličiek (klírens
kreatinínu < 30 ml/min) alebo na dialýze existuje vyššie riziko vývoja hypokalciémie pri chýbajúcej suplementácii vápnikom. Riziko vývoja hypokalciémie počas liečby XGEVOU je vyššie so
zvyšujúcim sa stupňom poruchy funkcie obličiek. V klinickej štúdii u pacientov bez pokročilého
karcinómu sa u 19 % pacientov s ťažkou poruchou funkcie obličiek (klírens kreatinínu < 30 ml/min) a u 63 % pacientov na dialýze vyvinula hypokalciémia napriek suplementácii vápnikom. Celková incidencia klinicky významnej hypokalciémie bola 9 %.
Sprievodné zvýšenie parathormónu sa pozorovalo aj u pacientov liečených XGEVOU s ťažkou poruchou funkcie obličiek alebo u pacientov na dialýze. U pacientov s poruchou funkcie obličiek je obzvlášť dôležité monitorovanie hladín vápnika a adekvátny prísun vápnika a vitamínu D (pozri časť 4.4).
H
l
ásenie
podozrení
na
nežiaduce
r
eakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieV klinických štúdiách neexistujú žiadne skúsenosti s predávkovaním. XGEVA bola podávaná
v klinických štúdiách v dávkach až do 180 mg každé 4 týždne a 120 mg týždenne počas 3 týždňov.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Liečivá proti ochoreniam kostí – iné liečivá ovplyvňujúce stavbu a
mineralizáciu kostí, ATC kód: M05BX04
Mechanizmus účinkuRANKL existuje ako transmembránový alebo rozpustný proteín. RANKL je nevyhnutný na tvorbu, funkciu a prežívanie osteoklastov, jediného typu buniek zodpovedného za kostnú resorpciu. Zvýšená aktivita osteoklastov, stimulovaná RANKL, je kľúčovým sprostredkovateľom odbúravania kostí pri metastázujúcom ochorení kostí a mnohopočetnom myelóme. Denosumab je ľudská monoklonálna protilátka (IgG2), ktorej cieľom je RANKL a ktorá sa na neho viaže s vysokou afinitou
a špecifickosťou, pričom zabraňuje interakcii RANKL/RANK, čo vedie k poklesu počtu a funkcie
osteoklastov, čím znižuje kostnú resorpciu a deštrukciu kosti spôsobenú nádorovým ochorením.
Obrovskobunkové kostné nádory sú charakterizované neoplastickými stromálnymi bunkami, ktoré exprimujú RANK ligand, a obrovskými bunkami podobnými osteoklastom, ktoré exprimujú RANK. U pacientov s obrovskobunkovým kostným nádorom sa denosumab viaže na RANK ligand, čo výrazne znižuje alebo eliminuje obrovské bunky podobné osteoklastom. V dôsledku toho je znížená
osteolýza a stróma proliferačného nádoru je nahradená neproliferačnou, diferencovanou novou kosťou
s veľkou hustotou.
FarmakodynamickéúčinkyV klinických štúdiách fázy II u pacientov s pokročilým nádorovým ochorením postihujúcim kosti spôsobilo subkutánne (s.c.) podávanie XGEVY každé 4 týždne alebo každých 12 týždňov rýchle
zníženie markerov kostnej resorpcie (uNTx/Cr, sérový CTx) s mediánom zníženia približne 80 % pre
uNTx/Cr vyskytujúce sa v priebehu 1 týždňa bez ohľadu na predchádzajúcu liečbu bisfosfonátmi
alebo východiskovú uNTx/Cr hladinu. V klinických štúdiách fázy III sa medián zníženia približne o
80 % udržiaval pre uNTx/Cr po 3 mesiacoch liečby u 2 075 pacientov s pokročilým nádorovým ochorením liečených XGEVOU, predtým neliečených i.v. bisfosfonátmi.
ImunogenicitaV klinických štúdiách sa nepozorovali neutralizujúce protilátky voči XGEVE. Pomocou senzitívneho imunologického hodnotenia sa u < 1 % pacientov liečených denosumabom po dobu až 3 rokov zistili pozitívne neneutralizujúce viažuce protilátky bez dôkazu zmenenej farmakokinetiky, toxicity alebo klinickej odpovede.
Klinickáúčinnosťupacientov s kostnými metastázami zo solídnych tumorovÚčinnosť a bezpečnosť XGEVY podávanej subkutánne v dávke 120 mg každé 4 týždne alebo kyseliny
zoledrónovej podávanej i.v. v dávke 4 mg (dávka upravená podľa zníženej funkcie obličiek) každé
4 týždne sa porovnávali v troch randomizovaných, dvojito zaslepených, aktívne kontrolovaných
štúdiách u pacientov s pokročilým nádorovým ochorením postihujúcim kosti neliečených i.v. bisfosfonátmi: u dospelých s karcinómom prsníka (štúdia 1), inými solídnymi tumormi alebo mnohopočetným myelómom (štúdia 2) a hormonálne refraktérnym karcinómom prostaty (štúdia 3).
Pacienti s predchádzajúcou anamnézou ONJ alebo osteomyelitídou čeľuste, aktívnym ochorením zubov alebo čeľuste, ktoré si vyžaduje chirurgický zákrok v ústach, nevyliečeným chirurgickým zákrokom zubov/úst alebo akýmkoľvek plánovaným invazívnym stomatologickým zákrokom neboli vhodní na zaradenie do týchto štúdií. Primárne a sekundárne koncové ukazovatele hodnotili výskyt jednej alebo viacerých príhod súvisiacich so skeletom (skeletal related events – SRE). V štúdiách preukazujúcich superioritu XGEVY oproti kyseline zoledrónovej bola pacientom ponúknutá nezaslepená XGEVA vo vopred špecifikovanej 2-ročnej extenzii liečebnej fázy.
XGEVA znížila riziko rozvoja SRE a rozvoja mnohopočetných SRE (prvých a následných)
u pacientov s kostnými metastázami zo solídnych tumorov (pozri tabuľku 2).
Tabuľka 2: Výsledky účinnosti u pacientov s pokročilým nádorovým ochorením postihujúcim
kosti
Štúdia 1
karcinóm prsníka
XGEVA kyselina zoledrónová
Štúdia 2 iné solídne tumory** alebo
mnohopočetný
myelóm
XGEVA kyselina zoledrónová
Štúdia 3
karcinóm prostaty
XGEVA kyselina zoledrónová
Kombinovaná analýza pri pokročilých nádoroch
XGEVA kyselina zoledrónová
N 1 026 1 020 886 890 950 951 2 862 2 861
Prvá SRE
Medián času
(mesiace)
Rozdiel v mediáne
času (mesiace)
HR (95 % CI)/RRR (%)
Non- inferiorita/Superiorita p-hodnoty
NR 26,4 20,6 16,3 20,7 17,1 27,6 19,4
NA 4,2 3,5 8,2
0,82 (0,71; 0,95)/18 0,84 (0,71; 0,98)/16 0,82 (0,71; 0,95)/18 0,83 (0,76; 0,90)/17
< 0,0001†/0,0101† 0,0007†/0,0619† 0,0002†/0,0085† < 0,0001/< 0,0001
Podiel osôb (%) 30,7 36,5 31,4 36,3 35,9 40,6 32,6 37,8
Prvá a následná SRE*
Priemerný
počet/pacient
Pomer výskytu (95 % CI)/RRR (%) Superiorita p-
hodnoty
0,46 0,60 0,44 0,49 0,52 0,61 0,48 0,57
0,77 (0,66; 0,89)/23 0,90 (0,77; 1,04)/10 0,82 (0,71; 0,94)/18 0,82 (0,75; 0,89)/18
0,0012† 0,1447† 0,0085† < 0,0001
SMR na rok 0,45 0,58 0,86 1,04 0,79 0,83 0,69 0,81
Prvá SRE alebo HCM
Medián času
(mesiace)
HR (95 % CI)/RRR (%)
Superiorita p- hodnota
Prvé ožarovanie kosti
Medián času
(mesiace)
HR (95 % CI)/RRR (%)
Superiorita p- hodnota
NR 25,2 19,0 14,4 20,3 17,1 26,6 19,4
0,82 (0,70; 0,95)/18 0,83 (0,71; 0,97)/17 0,83 (0,72; 0,96)/17 0,83 (0,76; 0,90)/17
0,0074 0,0215 0,0134 < 0,0001
NR NR NR NR NR 28,6 NR 33,2
0,74 (0,59; 0,94)/26 0,78 (0,63; 0,97)/22 0,78 (0,66; 0,94)/22 0,77 (0,69; 0,87)/23
0,0121 0,0256 0,0071 < 0,0001

NR = nedosiahnutý; NA = neaplikovateľné; HCM = hyperkalciémia nádorového ochorenia; SMR = miera skeletálnej morbidity; HR = pomer rizika; RRR = zníženie relatívneho rizika †Upravené p-hodnoty sú uvedené pre štúdie 1, 2 a 3 (koncové ukazovatele prvej SRE a prvej a následnej SRE); *Tvorí časom všetky príhody súvisiace so skeletom; počítajú sa len príhody vyskytujúce sa ≥ 21 dní po predchádzajúcej príhode.
** Vrátane NSCLC, karcinómu renálnych buniek, kolorektálneho karcinómu, malobunkového karcinómu pľúc, karcinómu močového mechúra, karcinómu hlavy a krku, GI/genitourinárneho karcinómu a iných, s výnimkou karcinómu prsníka a prostaty
 Obrázok 1. Kaplanove-Meierove odhady času do prvej SRE v štúdii
Obrázok 1. Kaplanove-Meierove odhady času do prvej SRE v štúdii
ZA – kyselina zoledrónová 4 mg každé 4 týždne

Dmab – dZeAno-sZuomleadbro1n2ic0 Amcgidk4ažmdgé Q44tWýždne
Dmab - Den o s u mab 1 2 0 mg Q4 W
0.8
0.6
0.4
0.2
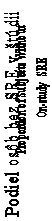
0.0
0 6 12 18 24 30 0 6 12 18 24 30 0 6 12 18 24 30
StudM
ye
Msia
oc
ntš
htúdie
N = Počet randomizovaných osôb
*=N Š= tNautmisbtiecr koyf svubýjze cntas mra nndéompri zee sduperioritu; **= Štatisticky významné pre non-inferioritu
* = St a t i st i c a l l y si gni fi c a nt for supe ri ori t y ; ** = St a t i st i c a l l y si gni fi c a nt for noni nfe ri ori t y
Progra m : / st a t / a m g162/ m e t a / bl a _2009onc / a na l ysi s/ uspi / gra phs/ progra m / g_t i m e t o_sre _upda t e . sa s
PrOougt p
ruets: iga1-
o0c4_
h1o0r0e_nt i
imaeat o
c_s
erlek_u
opvdéa t
pe .
rcegžmíva(D
naitee Ge ne ra t e d: 12NOV2010: 13: 22: 58)
Sourc e Da ta : a 09c se. a sle ff, a 09c se. a slba se
Progresia ochorenia bola podobná medzi XGEVOU a kyselinou zoledrónovou vo všetkých troch
štúdiách a vo vopred špecifikovanej analýze kombinácie všetkých troch štúdií.
Vo všetkých troch štúdiách bolo celkové prežívanie vyvážené medzi XGEVOU a kyselinou zoledrónovou u pacientov s pokročilým nádorovým ochorením postihujúcim kosti: pacienti
s karcinómom prsníka (pomer rizika a 95 % CI bol 0,95 [0,81; 1,11]), pacienti s karcinómom prostaty
(pomer rizika a 95 % CI bol 1,03 [0,91; 1,17]) a pacienti s inými solídnymi tumormi alebo mnohopočetným myelómom (pomer rizika a 95 % CI bol 0,95 [0,83; 1,08]). Post hoc analýza v štúdii
2 (pacienti s inými solídnymi tumormi alebo mnohopočetným myelómom) skúmala celkové
prežívanie s použitím stratifikácie pre 3 typy nádorov (nemalobunkový karcinóm pľúc, mnohopočetný myelóm a iné). Celkové prežívanie bolo dlhšie pre XGEVU v prípade nemalobunkového karcinómu pľúc (pomer rizika [95 % CI] 0,79 [0,65; 0,95]; n = 702) a dlhšie pre kyselinu zoledrónovú v prípade mnohopočetného myelómu (pomer rizika [95 % CI] 2,26 [1,13; 4,50]; n = 180) a podobné medzi XGEVOU a kyselinou zoledrónovou v prípade iných typov nádorov (pomer rizika [95 % CI] 1,08 (0,90; 1,30); n = 894). Táto štúdia nekontrolovala prognostické faktory a antineoplastické liečby.
V kombinovanej vopred špecifikovanej analýze štúdií 1, 2 a 3 bolo celkové prežívanie podobné medzi
XGEVOU a kyselinou zoledrónovou (pomer rizika a 95 % CI 0,99 [0,91; 1,07]).
VplyvnabolesťČas do zlepšenia bolesti (t. j. pokles o ≥ 2 body z východiskového BPI-SF skóre najhoršej bolesti) bol podobný pre denosumab a kyselinu zoledrónovú v každej štúdii a integrovaných analýzach. V post hoc analýze kombinovaného súboru dát sa medián času do zhoršenia bolesti (> 4-bodové skóre najhoršej bolesti) u pacientov s miernou alebo žiadnou bolesťou oneskoril pre XGEVU v porovnaní
s kyselinou zoledrónovou (198 dní oproti 143 dňom) (p = 0,0002).
Klinickáúčinnosťudospelýcha dospievajúcich s vyvinutým skeletom s obrovskobunkovým kostnýmnádoromBezpečnosť a účinnosť XGEVY sa skúmali v dvoch nezaslepených klinických skúšaniach fázy II
s jedným liečebným ramenom (štúdie 4 a 5) zahŕňajúcich 529 pacientov s obrovskobunkovým kostným nádorom, ktorý bol buď neresekovateľný, alebo u ktorého by chirurgická resekcia bola
spojená so závažnou morbiditou.
Do štúdie 4 bolo zaradených 37 dospelých pacientov s histologicky potvrdeným neresekovateľným alebo rekurentným obrovskobunkovým kostným nádorom. Kritériá pre odpoveď zahŕňali elimináciu obrovských buniek na základe histopatológie alebo chýbajúcej progresie pri rádiografii.
Z 35 pacientov zahrnutých do analýzy účinnosti zaznamenalo 85,7 % (95 % CI: 69,7; 95,2) odpoveď na liečbu XGEVOU. Všetkých 20 pacientov (100 %) s histologickým vyšetrením odpovedalo na liečbu. Zo zvyšných 15 pacientov sa u 10 (67 %) rádiografickými meraniami nezistila progresia cieľovej lézie.
Do štúdie 5 bolo zaradených 507 dospelých alebo dospievajúcich s vyvinutým skeletom
s obrovskobunkovým kostným nádorom a dokázaným merateľným aktívnym ochorením.
V skupine 1 (pacienti s chirurgicky neliečiteľným ochorením) nebol dosiahnutý medián času do
progresie ochorenia, 21 z 258 liečených pacientov malo progresiu ochorenia. V skupine 2 (pacienti
s chirurgicky liečiteľným ochorením, ktorých plánovaný chirurgický zákrok bol spojený so závažnou
morbiditou) 209 z 228 hodnotených pacientov liečených XGEVOU nepodstúpilo chirurgický zákrok do 6. mesiaca. Z celkového počtu 225 pacientov, u ktorých bol plánovaný chirurgický zákrok
z dôvodu obrovskobunkového kostného nádoru (s vylúčením iba pľúcnych metastáz), u 109 pacientov'
sa neuskutočnil žiadny chirurgický zákrok a 84 pacientov podstúpilo menej závažný zákrok, ako bol plánovaný na začiatku liečby. Medián času do chirurgického zákroku bol 261 dní.
Po zaradení 305 pacientov do štúdií 4 a 5 sa uskutočnilo retrospektívne nezávislé posúdenie rádiografických dát. Stodeväťdesiat pacientov malo minimálne 1 hodnotiteľnú odpoveď v časovom bode a boli zahrnutí do analýzy (tabuľka 3). Celkovo XGEVA dosiahla objektívne odpovede nádorov u 71,6 % (95 % CI 64,6; 77,9) pacientov (tabuľka 3) posudzovaných niektorou z modalít, pričom väčšina odpovedí bola definovaná znížením aktivity fluorodeoxyglukózy PET alebo zvýšením hustoty meranej CT/HU, len 25,1 % pacientov malo odpoveď podľa RECIST. Medián času do odpovede bol
3,1 mesiaca (95 % CI 2,89; 3,65). Medián trvania odpovede nebolo možné odhadnúť (u štyroch pacientov sa zistili progresie ochorenia po objektívnej odpovedi). U 190 osôb bola hodnotená objektívna odpoveď nádoru, z toho 55 osôb podstúpilo chirurgický zákrok z dôvodu GCTB, z nich 40 osôb podstúpilo kompletnú resekciu.
Tabuľka 3: Objektívna odpoveď na liečbu u pacientov s obrovskobunkovým kostným nádorom
P
očet pacientov s hodnotiteľnou odpoveďou
P
očet pacientov s objektívnou odpoveďou
P
odiel (%) (95 % CI)
1
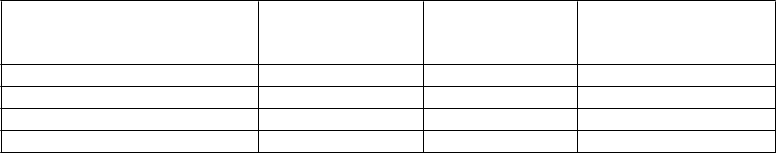
Na základe najlepšej odpovede 190 136 71,6 (64,6; 77,9) RECIST 1.12 187 47 25,1 (19,1; 32,0) EORTC3 26 25 96,2 (80,4; 99,9) Hustota/Veľkosť4 176 134 76,1 (69,1; 82,2)
1 CI = Presný interval spoľahlivosti
2 RECIST 1.1: Upravené kritériá na hodnotenie odpovede u solídnych tumorov na zhodnotenie nádorovej záťaže na základe počítačovej tomografie CT (computed tomography)/zobrazovania magnetickou rezonanciou
(magnetic resonance imaging – MRI)
3 EORTC: Upravené kritériá Európskej organizácie pre výskum a liečbu rakoviny na zhodnotenie metabolickej odpovede pomocou pozitrónovej emisnej tomografie s fluorodeoxyglukózou (FDG-PET)
4 Hustota/Veľkosť: Upravené inverzné Choiove kritériá na zhodnotenie veľkosti nádoru a hustoty pomocou
Hounsfieldových jednotiek na základe CT/MRI
VplyvnabolesťPo zaradení 282 pacientov, v štúdii 5 s kombinovanými skupinami 1 a 2 sa zaznamenal klinicky významný pokles najhoršej bolesti (t. j. pokles o ≥ 2 body oproti východiskovému stavu) u 31,4 % rizikových pacientov (t. j. u tých, ktorí mali na začiatku skóre najhoršej bolesti ≥ 2) v priebehu
1 týždňa liečby a ≥ 50 % v 5. týždni. Tieto zlepšenia bolesti sa udržali vo všetkých nasledujúcich
hodnoteniach. Východiskové podávanie analgetík pred liečbou v skupine 1 a v skupine 2 bolo
odstupňované podľa 7-bodovej stupnice, kde 74,8 % pacientov hlásilo žiadne alebo mierne používanie
analgetík (t. j. analgetické skóre ≤ 2) a 25,2 % pacientov používalo silné opioidy (t. j. analgetické
skóre 3 až 7).
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií pre XGEVU vo
všetkých podskupinách pediatrickej populácie v prevencii príhod súvisiacich so skeletom u pacientov s kostnými metastázami a v podskupinách pediatrickej populácie vo veku do 12 rokov v liečbe obrovskobunkového kostného nádoru (informácie o použití v pediatrickej populácii, pozri časť 4.2).
V štúdii 5 sa XGEVA hodnotila v podskupine 18 dospievajúcich pacientov (vo veku 13 – 17 rokov) s obrovskobunkovým kostným nádorom s vyvinutým skeletom definovaným ako minimálne jedna vyvinutá dlhá kosť (napr. uzavretá epifyzárna rastová platnička humeru) a telesná hmotnosť ≥ 45 kg. Objektívna odpoveď sa pozorovala u štyroch zo šiestich hodnotiteľných dospievajúcich pacientov
v predbežnej analýze štúdie 5. Skúšajúci zistil, že všetkých 18 dospievajúcich pacientov malo najlepšiu alebo lepšiu odpoveď stabilizácie ochorenia (úplná odpoveď u 2 pacientov, čiastočná odpoveď u 8 pacientov a stabilizácia ochorenia u 8 pacientov). Európska agentúra pre lieky udelila výnimku z povinnosti predložiť finálne výsledky tejto štúdie.
5.2 Farmakokinetické vlastnosti
Absorpcia
Po s.c. podaní bola biologická dostupnosť 62 %.
Biotransformácia
Denosumab tvoria výhradne aminokyseliny a sacharidy ako prirodzený imunoglobulín a je
nepravdepodobné, že by bol eliminovaný prostredníctvom metabolických mechanizmov pečene. Predpokladá sa, že jeho metabolizmus a eliminácia sledujú dráhy klírensu imunoglobulínu, čo vedie k degradácii na malé peptidy a jednotlivé aminokyseliny.
Eliminácia
U osôb s pokročilým nádorovým ochorením, ktoré dostávali mnohonásobné dávky 120 mg každé
4 týždne, sa pozorovala približne dvojnásobná kumulácia v sérových koncentráciách denosumabu
a rovnovážny stav sa dosiahol do 6 mesiacov, čo je v súlade s farmakokinetikou nezávislou od času. U osôb s obrovskobunkovým kostným nádorom, ktorí dostávali 120 mg každé 4 týždne s nárazovou dávkou 8. a 15. deň, sa rovnovážne hladiny dosiahli v priebehu prvého mesiaca liečby. Medzi 9.
a 49. týždňom sa medián najnižších hladín líšil o menej ako 9 %. U osôb, ktoré prerušili liečbu 120 mg
každé 4 týždne, bol priemerný polčas 28 dní (rozmedzie 14 až 55 dní).
Farmakokinetická analýza populácie nenaznačuje klinicky významné zmeny v systémovej expozícii denosumabu v rovnovážnom stave vzhľadom na vek (18 až 87 rokov), rasu/etnickú príslušnosť (skúmaní černosi, Hispánci, Ázijčania a belosi), pohlavie alebo typy solídnych tumorov. Zvýšenie telesnej hmotnosti bolo spojené so znížením systémovej expozície a naopak. Zmeny sa nepovažovali za klinicky významné, pretože farmakodynamické účinky na základe markerov kostného obratu sa zhodovali v širokom rozmedzí telesnej hmotnosti.
Linearita/nelinearita
Denosumab vykazoval nelineárnu farmakokinetiku pri dávke mimo širokého dávkovacieho intervalu, ale pri expozícii dávok 60 mg (alebo 1 mg/kg) a vyšších boli zvýšenia približne proporcionálne dávke.
Nelinearita je pravdepodobne spôsobená saturovateľnou eliminačnou cestou cieľového orgánu, ktorá
je významná pri nízkych koncentráciách.
Poruchafunkcieobličiek
V štúdiách s denosumabom (60 mg, n = 55 a 120 mg, n = 32) u pacientov bez pokročilého nádorového ochorenia, ale s rôznym stupňom renálnej funkcie, vrátane pacientov na dialýze, nemá stupeň poruchy funkcie obličiek žiadny vplyv na farmakokinetiku denosumabu; preto úprava dávky z dôvodu poruchy funkcie obličiek nie je potrebná. Pri liečbe XGEVOU nie je potrebné monitorovanie obličiek.
Porucha
funkcie
pečene
U pacientov s poruchou funkcie pečene sa neuskutočnila žiadna špecifická štúdia. Vo všeobecnosti nie sú monoklonálne protilátky eliminované prostredníctvom metabolických mechanizmov pečene. Nepredpokladá sa, že by farmakokinetika denosumabu bola ovplyvnená poruchou funkcie pečene.
Staršípacienti
Medzi geriatrickými pacientmi a mladšími pacientmi sa nepozorovali žiadne celkové rozdiely
v bezpečnosti alebo účinnosti. Kontrolované klinické štúdie XGEVY u pacientov s pokročilým
nádorovým ochorením postihujúcim kosti vo veku viac ako 65 rokov odhalili podobnú účinnosť a bezpečnosť u starších i mladších pacientov. U starších pacientov nie je potrebná žiadna úprava dávky.
Pediatrická populácia
Farmakokinetický profil sa v pediatrickej populácii nestanovil.
5.3 Predklinické údaje o bezpečnosti
Keďže biologická aktivita denosumabu pri zvieratách je špecifická pre nehumánne primáty, hodnotenie geneticky modifikovaných (knokautovaných) myší alebo používanie iných biologických inhibítorov dráhy RANK/RANKL, ako je OPG-Fc a RANK-Fc, boli použité na hodnotenie farmakodynamických vlastností denosumabu na modeloch hlodavcov.
Pri modeloch myší s kostnými metastázami ľudského karcinómu prsníka pozitívneho a negatívneho na receptor estrogénu, karcinómu prostaty a nemalobunkového karcinómu pľúc OPG-Fc znížilo osteolytické, osteoblastické a osteolytické/osteoblastické lézie, oneskorilo tvorbu kostných metastáz
de novo a znížilo rast tumoru v kosti. Pri kombinácii OPG-Fc s hormonálnou liečbou (tamoxifénom)
alebo chemoterapiou (docetaxelom) v týchto modeloch sa zistila aditívna inhibícia rastu tumoru
v kosti pri karcinóme prsníka, prostaty alebo pľúc. Pri myšom modeli indukcie tumoru prsnej žľazy
RANK-Fc znížil hormónmi indukovanú proliferáciu epitelu prsnej žľazy a oneskoril vývoj nádoru.
Štandardné testy na preskúmanie genotoxického potenciálu denosumabu sa nehodnotili, pretože takéto testy nie sú dôležité pre túto molekulu. Vzhľadom na jeho povahu je však nepravdepodobné, že by
mal denosumab nejaký genotoxický potenciál.
V dlhodobých štúdiách na zvieratách sa nehodnotil karcinogénny potenciál denosumabu.
V štúdiách toxicity po jednorazovom a opakovanom podávaní opiciam rodu Cynomolgus dávky denosumabu, ktoré mali za následok systémovú expozíciu 2,7- až 15-krát vyššiu, ako je odporúčaná dávka u ľudí, nemali žiadny vplyv na kardiovaskulárnu fyziológiu, samčiu alebo samičiu reprodukciu ani nespôsobili špecifickú toxicitu cieľového orgánu.
V štúdii s opicami rodu Cynomolgus, ktoré dostávali denosumab počas obdobia zodpovedajúceho prvému trimestru gravidity, dávky denosumabu, ktoré mali za následok systémovú expozíciu 9-krát vyššiu, ako je odporúčaná dávka u ľudí, neindukovali toxicitu u matky ani fetálne poškodenie počas obdobia zodpovedajúceho prvému trimestru, hoci fetálne lymfatické uzliny sa nevyšetrovali.
V ďalšej štúdii s opicami rodu Cynomolgus, ktoré dostávali denosumab počas gravidity v systémových expozíciách 12-násobne vyšších, ako je dávka u ľudí, sa zistil nárast narodených mŕtvych plodov
a postnatálnej mortality; abnormálny rast kostí, čo má za následok zníženú pevnosť kostí, zníženú
hematopoézu a chybné postavenie zubov; chýbajúce periférne lymfatické uzliny; a zníženie
neonatálneho rastu. Nepozoroval sa žiadny nežiaduci vplyv na reprodukciu. Po 6-mesačnom období po pôrode kostné zmeny ustúpili a nezistil sa žiadny vplyv na prerezávanie zubov. Účinky na lymfatické uzliny a chybné postavenie zubov pretrvávali a pri jednom zvierati sa pozorovala minimálna až stredná mineralizácia v mnohých tkanivách (neistá súvislosť s liečbou). Nezistil sa žiadny dôkaz o riziku pre matku pred pôrodom; počas pôrodu sa zriedkavo vyskytovali nežiaduce účinky u matky. Vývoj mliečnej žľazy u matky bol normálny.
V predklinických štúdiách skúmajúcich kvalitu kostí pri opiciach dlhodobo liečených denosumabom boli zníženia kostného obratu spojené so zlepšením pevnosti kostí a normálnou histológiou kostí.
Pri samčekoch geneticky modifikovaných myší exprimujúcich huRANKL („knock-in“ myši), ktoré boli vystavené transkortikálnej fraktúre, denosumab oneskoril odstránenie chrupky a remodeláciu kalusu fraktúry v porovnaní s kontrolou, biomechanická sila však nebola negatívne ovplyvnená.
V predklinických štúdiách s knokautovanými myšami, ktorým chýba RANK alebo RANKL, sa pozorovala chýbajúca laktácia z dôvodu inhibície vývoja prsnej žľazy (vývoj lobulo-alveolárnej žľazy počas gravidity) a tieto myši vykazovali poruchu vývoja lymfatickej uzliny. Neonatálne RANK/RANKL knokautované myši vykazovali zníženú telesnú hmotnosť, znížený rast kostí, zmenené rastové platničky a chýbanie prerezávania zubov. V štúdiách s neonatálnymi potkanmi, ktorým sa podávali inhibítory RANKL, sa tiež pozoroval znížený rast kostí, zmenené rastové
platničky a zhoršené prerezávanie zubov a tieto zmeny boli čiastočne reverzibilné po vysadení dávkovania inhibítora RANKL. Dospievajúce primáty, ktorým sa podávali 2,7- a 15-násobne vyššie dávky denosumabu (dávka 10 a 50 mg/kg), ako je klinická expozícia, mali abnormálne rastové platničky. Preto môže liečba denosumabom poškodiť rast kostí u detí s otvorenými rastovými platničkami a môže inhibovať prerezávanie zubov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
ľadová kyselina octová* hydroxid sodný (na úpravu pH)* sorbitol (E420)
voda na injekciu
*acetátový tlmivý roztok je tvorený zmiešaním kyseliny octovej s hydroxidom sodným
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
3 roky.
XGEVA sa môže uchovávať pri izbovej teplote (do 25 °C) do 30 dní v pôvodnom obale. Po vybratí z chladničky sa musí XGEVA použiť v priebehu 30 dní.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
1,7 ml roztoku v injekčnej liekovke na jednorazové použitie (zo skla typu I) so zátkou (elastomerickou potiahnutou fluoropolymérom) a tesnením (hliníkovým) s odklápacím viečkom.
Balenie po jednom, troch alebo štyroch kusoch.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pred podaním sa má roztok XGEVY vizuálne skontrolovať. Roztok môže obsahovať stopové
množstvá priesvitných až bielych proteínových častíc. Roztok neaplikujte, ak je zakalený alebo zmenil sfarbenie. Príliš netraste. Pred aplikáciou injekcie nechajte injekčnú liekovku dosiahnuť izbovú teplotu (do 25 °C), aby ste zabránili diskomfortu v mieste injekcie, a aplikujte pomaly. Aplikujte celý obsah injekčnej liekovky. Na podávanie denosumabu sa odporúča použiť ihlu 27G. Do injekčnej liekovky neprenikajte opakovane.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAmgen Europe B.V. Minervum 7061
NL-4817 ZK Breda
Holandsko
8. REGISTRAČNÉ ČÍSLAEU/1/11/703/001
EU/1/11/703/002
EU/1/11/703/003
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 13. júl 2011
Dátum posledného predĺženia registrácie: 4. apríla 2016
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.euVEDECKÉ ZÁVERYVzhľadom na hodnotiacu správu Výboru pre hodnotenie rizík liekov (PRAC) o periodicky aktualizovaných správach o bezpečnosti lieku (PSUR) pre denosumab (indikovaný na liečbu príhod súvisiacich so skeletom spojených s kostnými metastázami a na liečbu obrovskobunkového kostného nádoru) dospel Výbor pre humánne lieky (CHMP) k týmto vedeckým záverom:
Pri používaní XGEVY nebola hlásená osteonekróza vonkajšieho zvukovodu (osteonecrosis of external auditory canal, OEAC). OEAC je už hlásená u pacientov liečených denosumabom (Prolia). Mechanizmus, akým vzniká, sa považuje za podobný osteonekróze čeľuste. OEAC je zisteným
rizikom pri bisfosfonátoch už niekoľko rokov, pôvodne sa však považovala za potenciálne riziko denosumabu na základe iba dvoch prípadov, z ktorých druhý bola rádionekróza. OEAC je zahrnutá
v nežiaducich účinkoch (adverse drug reaction, ADR) bisfosfonátov, prípadne sa navrhuje zaradiť ju
ako skupinový účinok do nežiaducich účinkov liekov tak pri indikácii osteoporóza, ako aj rakovina. V záujme konzistencie sa OEAC má zahrnúť aj do nežiaducich účinkov lieku (ADR) XGEVA a má sa uviesť príslušné upozornenie podobné upozorneniu v informáciách o lieku pre bisfosfonáty.
Výbor pre humánne lieky (CHMP) súhlasí s vedeckými závermi PRAC.
Dôvody zmeny podmienok rozhodnutia (rozhodnutí) o registrácii:
Na základe vedeckých záverov pre denosumab (indikovaný na liečbu príhod súvisiacich so skeletom spojených s kostnými metastázami a na liečbu obrovskobunkového kostného nádoru) je CHMP toho názoru, že pomer prínosu a rizika lieku (liekov) obsahujúceho (obsahujúcich) denosumab (indikovaný na liečbu príhod súvisiacich so skeletom spojených s kostnými metastázami a na liečbu obrovskobunkového kostného nádoru) je nezmenený za predpokladu, že budú prijaté navrhované zmeny v informáciách o lieku.
CHMP odporúča zmenu podmienok rozhodnutia o registrácii (rozhodnutí o registrácii).