
Zvláštneskupinypacientov
Pacienti s poškodením funkcie obličiek alebo pečene
Bezpečnosť a účinnosť vozoritidu u pacientov s poruchami funkcie obličiek alebo pečene neboli hodnotené.
Pediatrická populácia
Bezpečnosť a účinnosť lieku Voxzogo u detí do veku 2 roky neboli doteraz stanovené. V súčasnosti dostupné údaje sú opísané v častiach 4.8, 5.1 a 5.2, ale neumožňujú uviesť odporúčania týkajúce sadávkovania.
Spôsob podávania
Liek Voxzogo je určený len na jednorazové subkutánne použitie. Tento liek sa musí podať do 3 hodín po
rekonštitúcii.
Pred podaním injekcie by mal zdravotnícky pracovník:
• zaškoliť opatrovateľov na prípravu a subkutánne podanie injekcie tohto lieku,
• zaškoliť opatrovateľov a pacientov, aby rozpoznali prejavy a príznaky zníženého krvného tlaku,
• informovať opatrovateľov a pacientov čo robiť v prípade symptomatických znížení krvného tlaku.
Pacientov alebo opatrovateľov treba poučiť, aby miesta pre subkutánne podania injekcie striedali. Odporúčanými miestami podania injekcie na tele sú predná stredná časť stehien, dolná časť brucha (okrem oblasti 5 cm okolo pupka), horná časť zadku a zadná strana hornej časti ramien. Rovnaké miesto podania injekcie sa nemá používať dva po sebe nasledujúce dni. Liek Voxzogo sa nemá injekčne podávať v miestach, ktoré sú červené, opuchnuté alebo citlivé.
V čase podania injekcie majú byť pacienti dostatočne hydratovaní. Odporúča sa, aby pacienti približne
30 minút pred podaním injekcie zjedli ľahké jedlo a vypili pohár tekutiny (napr. voda, mlieko, džús atď.). Zmiernia sa tým prejavy a príznaky možného výskytu zníženia krvného tlaku (závraty, únava a/alebo nevoľnosť) (pozri časť 4.4, Účinky na krvný tlak).
Ak je to možné, má sa tento liek podávať každý deň v približne rovnakom čase. Návod na prípravu rekonštituovaného lieku pred podávaním je uvedený v časti 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo (liečivá) alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Sledovateľnosť
Aby sa zlepšila (do)sledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov a číslo šarže
podaného lieku.
Účinky na krvný tlak
Pacienti s významnými kardiovaskulárnymi ochoreniami a pacienti užívajúci lieky proti vysokému tlaku boli
vylúčení z účasti na klinických skúšaniach pred uvedením lieku na trh.
S cieľom znížiť riziko možného zníženia krvného tlaku a súvisiacich príznakov (závraty, únava a/alebo nevoľnosť) majú byť pacienti v čase podanie injekcie dostatočne hydratovaní (pozri časť 4.2 a 4.8).
Sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na objemovú jednotku, t. j. v podstate zanedbateľné
množstvo sodíka.
4
.5 Liekové a iné interakcie
Uskutočnili sa štúdie in vitro inhibície a indukcie cytochrómu P450 (CYP) a in vitro štúdie inhibície transportérov. Výsledky naznačili, že v prípade, že sa liek podáva súbežne s inými liekmi, je málo pravdepodobné, že by vozoritid spôsobil u ľudí vzájomnú liekovú interakciu sprostredkovanú CYP alebo transportérmi.
Neuskutočnili sa žiadne iné interakčné štúdie. Keďže sa jedná o rekombinantný ľudský proteín, vozoritid je
nepravdepodobným kandidátom na vzájomné liekové interakcie.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití vozoritidu u gravidných žien. Štúdie
na zvieratách nepreukázali priame alebo nepriame účinky z hľadiska reprodukčnej toxicity (pozri časť 5.3). Užívanie vozoritidu počas gravidity sa z preventívnych dôvodov neodporúča.
Dojčenie
Dostupné farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie vozoritidu do mlieka
(pozri časť 5.3). Riziko u novorodencov/dojčiat nemôže byť vylúčené. Vozoritid sa nemá používať počas laktácie.
Fertilita
V neklinických štúdiách nebolo pozorované žiadne poškodenie fertility u mužov ani u žien (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek Voxzogo má mierny vplyv na schopnosť viesť vozidlá, bicykle a obsluhovať stroje. Vozoritid môže spôsobiť prechodné zníženia krvného tlaku, ktoré sú zvyčajne mierne, ale synkopa, stav pred synkopou
a závrat, ako aj iné prejavy a príznaky zníženého krvného tlaku boli hlásené ako nežiaduce reakcie lieku
Voxzogo. Je potrebné zvážiť odpoveď pacienta na liečbu a v prípade potreby ho informovať, aby minimálne
60 minút po podaní injekcie neviedol vozidlo, bicykel ani neobsluhoval stroje.
4.8 Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Najčastejšími nežiaducimi reakciami na vozoritid boli reakcie v mieste podania injekcie (85 %), vracanie
(27 %) a znížený krvný tlak (13 %).
Tabuľka so zoznamom nežiaducich reakcií
V tabuľke nižšie sú uvedené nežiaduce reakcie u pacientov liečených vozoritidom.
Nežiaduce reakcie sú uvedené nižšie podľa triedy orgánových systémov a podľa frekvencie. Frekvencie sú definované nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000) a neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
Tabuľka 2: Nežiaduce reakcie u pacientov liečených liekom Voxzogo
Trieda orgánových systémov
| Veľmi časté
| Časté
|
Poruchy nervového systému
|
| Synkopa
|
Stav pred synkopou
|
Závrat
|
Poruchy ciev
| Hypotenziaa
|
|
Poruchy gastrointestinálneho
traktu
| Vracanie
| Nevoľnosť
|
Celkové poruchy
a reakcie v mieste podania
| Reakcia v mieste podania injekcieb
| Únava
|
Laboratórne a funkčné vyšetrenia
|
| Zvýšená alkalická fosfatáza
|
a. Hypotenzia zahŕňa asymptomatické aj symptomatické nežiaduce reakcie.
b. Reakcie v mieste podania injekcie zahŕňajú uprednostňované výrazy: erytém v mieste podania injekcie, reakcia v mieste podania injekcie, opuch v mieste podania injekcie, žihľavka v mieste podania injekcie,
bolesť v mieste podania injekcie, podliatina v mieste podania injekcie, pruritus v mieste podania injekcie,
krvácanie v mieste podania injekcie, zmena zafarbenia v mieste podania injekcie a stvrdnutie v mieste podania injekcie.
Popis vybraných nežiaducich reakciíHypotenziaV štúdii ACH 111-301 13 % pacientov liečených vozoritidom nahlásilo udalosti zníženia krvného tlaku, ktoré boli prechodné a vyriešené bez zásahu. Medián času od podania injekcie do nástupu bol 31 (18 až 120) minút s vyriešením do 31 (5 až 90) minút. Nahlásené udalosti boli zistené prevažne počas obdobia častého sledovania životných funkcií v rámci klinického hodnotenia po podaní dávky počas 52-týždňového obdobia liečby. U 2 % pacientov sa vyskytla symptomatická epizóda s nevoľnosťou a vracaním.
Reakcie v mieste podania injekcieReakcie v mieste podania injekcie boli hlásené u 85 % pacientov liečených vozoritidom v porovnaní s 82 %
pacientov, ktorým bolo podané placebo. Pacienti, ktorí dostali tento liek a u ktorých sa vyskytli reakcie
v mieste podania injekcie, nahlásili medián 76 udalostí počas 52-týždňového obdobia oproti 7,5 udalosti hlásenej pacientmi, ktorí dostali placebo. Najčastejšie reakcie v mieste podania injekcie (vyskytujúce sa minimálne u 10 % pacientov liečených vozoritidom) boli reakcia v mieste podania injekcie (73 %), erytém v mieste podania injekcie (68 %), opuch v mieste podania injekcie (38 %) a žihľavka v mieste podania injekcie (13 %). Závažnosť všetkých reakcií v mieste podania injekcie bola stupeň 1 (mierne), okrem
5 udalostí u 2 pacientov, ktoré boli stupeň 2 (stredne závažné). Nahlásené udalosti stupňa 2 sa vyskytli
u dvoch pacientov, ktorí nahlásili dve udalosti výskytu žihľavky v mieste podania injekcie a jednu udalosť výskytu vezikúl v mieste podania injekcie.
ImunogenitaZo 131 pacientov s achondropláziou, ktorí boli liečení vozoritidom dávkou 15 µg/kg/deň a u ktorých bolo možné zistiť prítomnosť protilátok proti lieku (anti-drug antibodies, ADA) v období do 240 týždňov, sa ADA zistili u 35 % pacientov. Najkratšia doba vytvorenia ADA bola 85 dní. Všetci pacienti s pozitívnym výsledkom na ADA mali negatívny test na neutralizačné protilátky proti vozoritidu. Nebola zistená žiadna korelácia medzi počtom, trvaním alebo závažnosťou závažných reakcií z precitlivenosti alebo reakcií
v mieste podania injekcie a pozitivitou na ADA alebo strednou hodnotou titrov ADA. V 12. mesiaci nebola zistená žiadna súvislosť medzi pozitivitou na ADA alebo strednou hodnotou titrov ADA a zmenou ročnej
rýchlosti rastu (annual growth velocity, AGV) alebo skóre Z výšky od východiskovej hodnoty. Nebol zistený žiadny dopad ADA v sére na merania farmakokinetiky vozoritidu v plazme.
Pediatrická populáciaBezpečnostný profil vozoritidu v klinických štúdiách, ktorých sa zúčastnili deti vo veku 2 až < 5 rokov bol
podobný ako profil pozorovaný u starších detí (pozri časť 5.1).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieV klinických skúšaniach boli dávky vozoritidu skúmané až do 30 μg/kg/deň. Dvaja pacienti dostávali až 3- násobok výšky odporúčanej dávky 15 μg/kg/deň počas 5 týždňov. Neboli pozorované žiadne prejavy, príznaky alebo nežiaduce reakcie súvisiace s dávkou vyššou ako je plánovaná dávka.
V prípade, že pacient užije vyššiu dávku, ako má, musí kontaktovať svojho lekára.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Liečivá na liečbu ochorení kostí, Iné liečivá ovplyvňujúce štruktúru a mineralizáciu kostí, ATC kód: M05BX07
Mechanizmus účinkuVozoritid je modifikovaný natriuretický peptid typu C (CNP). U pacientov s achondropláziou je
endochondrálny rast kostí negatívne regulovaný z dôvodu výskytu funkčnej mutácie receptora 3 rastového faktora fibroblastov
(FGFR3). Väzba vozoritidu na receptor natriuretického peptidu typu B (NPR-B) antagonizuje „downstream“ signalizáciu
FGFR3 inhibovaním extracelulárnych, signálom regulovaných kináz 1 and 2 (ERK1/2) v trase mitogénom aktivovanej proteínovej kinázy (MAPK) na úrovni rýchlo zrýchľujúcej proteínovej serín/treonín kinázy (rapidly accelerating fibrosarcoma, RAF-1) fibrosarkómu. Výsledkom je, že vozoritid, tak ako CNP, pôsobí ako pozitívny regulátor endochondrálneho rastu kostí, keďže podporuje rozmnožovanie a diferenciáciu chondrocytov.
Farmakodynamické účinkyPri liečbe vozoritidom bolo pozorované zvýšenie koncentrácií cyklického guanozinmonofosfátu (cGMP,
biomarker aktivity NPR-B) v moči a markera kolagénu typu X (CXM, biomarker endochronálnej osifikácie)
v sére oproti východiskovej hodnote v závislosti od expozície (AUC a Cmax). Zvýšenie koncentrácií cGMP
v moči v porovnaní s východiskovými hodnotami sa vyskytlo počas prvých štyroch hodín po podaní dávky. Medián koncentrácie CXM v sére sa v porovnaní s východiskovou hodnotou zvýšil do dňa 29 pri dennom podávaní tohto lieku. Tento účinok pokračoval dlhšie ako 24 mesiacov liečby.
Aktivita vozoritidu, podľa merania cGMP v moči bola takmer na hodnote saturácie, zatiaľ čo maximálne zvýšenie aktivity rastových platničiek, indikované CXM, sa dosiahlo pri dávke 15 μg/kg podávanej
subkutánne jedenkrát denne.
Klinická účinnosť a bezpečnosťÚčinnosť a bezpečnosť vozoritidu u pacientov s achondropláziou s mutáciou funkcie
FGFR3 boli hodnotené
v rámci randomizovanej, dvojito zaslepenej, placebom kontrolovanej, 52-týždňovej štúdie (štúdia
ACH 111-301). V štúdii ACH 111-301 boli pacienti randomizovaní na podávanie vozoritidu (n = 60) alebo placeba (n = 61) a dávka vozoritidu bola 15 μg/kg, podávaná subkutánne jedenkrát denne. Pred randomizáciou boli všetci pacienti zaradení do observačnej štúdie (štúdia ACH 111-901) pre pediatrických pacientov s achondropláziou v trvaní minimálne 6 mesiacov, počas ktorej sa zozbierali východiskové hodnoty výšky v stoji a uskutočnili vyšetrenia rastu pred začiatkom liečby. Pacienti, ktorí absolvovali
v predchádzajúcich 18 mesiacoch chirurgický zákrok predlžovania končatiny alebo ktorí mali takýto chirurgický zákrok naplánovaný počas trvania štúdie, boli zo štúdie vylúčení. Štúdia zahŕňala 52-týždňovú, placebom kontrolovanú fázu liečby nasledovanú otvorenou rozširujúcou štúdiou, v ktorej boli všetci pacienti liečení vozoritidom. Primárnym koncovým ukazovateľom účinnosti bola zmena hodnoty AGV od východiskovej hodnoty v 52. týždni v porovnaní s placebom.
Pacienti s achondropláziou boli tiež liečení vozoritidom 15 μg/kg/deň v otvorenej štúdii so zvyšovaním dávky a v dlhodobej rozširujúcej štúdii (štúdia ACH 111-205). Údaje boli zbierané z observačných štúdií u pacientov s cieľom zachytiť prirodzený vývoj achondroplázie. Údaje o výške od neliečených pacientov
s achondropláziou v rovnakej vekovej skupine ako pacienti v klinických štúdiách sa použili ako historické kontrolné údaje s cieľom vyhodnotiť účinok na výšku až po 5 rokoch liečby vozoritidom.
Demografické údaje a východiskové hodnoty pacientov sú uvedené v Tabuľke 3.
Tabuľka 3: Demografické údaje a charakteristiky pacientov v štúdiách ACH 111-301 a ACH 111-205
Parameter
| Štúdia ACH 111-301
| Štúdia
ACH 111-205b
|
Placebo
(N = 61)
| 15 μg/kg/deň Voxzogo (N = 60)
| 15 μg/kg/deň Voxzogo (N = 10)
|
Vek v 1. dni (v rokoch) Priemer (ŠO)
Min., max.
Vek v 1. dni, n (%)a
≥ 5 až < 8 rokov
≥ 8 až < 11 rokov
≥ 11 až < 15 rokov
|
9,06 (2,47)
5,1; 14,9
24 (39,3)
24 (39,3)
13 (21,3)
|
8,35 (2,43)
5,1; 13,1
31 (51,7)
17 (28,3)
12 (20,0)
|
8,54 (1,54)
6,3; 11,1
4 (40,0)
5 (50,0)
1 (10,0)
|
Tannerova stupnica b, n
(%)a
|
|
|
|
I
| 48 (78,7)
| 48 (80,0)
| 10 (100,0)
|
> I
| 13 (21,3)
| 12 (20,0)
|
|
Pohlavie, n (%)a
mužské ženské
|
33 (54,1)
28 (45,9)
|
31 (51,7)
29 (48,3)
|
4 (40,0)
6 (60,0)
|
Hmotnosť (kg)
|
|
|
|
Priemer (ŠO) Min., max.
| 24,62 (9,07)
11,6; 68,9
| 22,88 (7,96)
13,6; 53,0
| 25,13 (5,74)
18,2; 36,4
|
max. – maximum; min. – minimum; ŠO – štandardná odchýlka.
a Percentuálne hodnoty boli vypočítané použitím celkového počtu pacientov v úplnej analyzovanej skupine
(N pre každú liečebnú skupinu) ako menovateľom
b Analýza 10 z 35 pacientov, ktorí dostali iba dávku 15 μg/kg/deň v otvorenej štúdii so zvyšovaním dávky a následne pokračovali do dlhodobej rozširujúcej štúdie ACH 111-205
V štúdii ACH 111-301 boli pozorované zlepšenia hodnôt AGV a výšky Z oproti východiskovej hodnote u pacientov liečených liekom Voxzogo 15 µg/kg/deň v porovnaní s placebom. Výsledky účinnosti sú uvedené v Tabuľke 4.
Tabuľka 4: Výsledky z placebom kontrolovaného klinického skúšania
| Placebo
(N = 61)
| Voxzogo 15 µg/kg denne
(N = 60c)
| Porovnanie
Voxzogo/placebo
|
Východisková hodnota
| Týždeň 52
| Zmena
| Východ isková
hodnota
| Týždeň 52
| Zmena
| Rozdiel zistený metódou LS
v zmenách
(95 % CI)
|
Ročná rýchlosť rastu (cm/rok)
|
Prie mer
± ŠO
| 4,06
± 1,20
| 3,94
± 1,07
| -0,12
± 1,74
| 4,26
± 1,53
| 5,61
± 1,05
| 1,35
± 1,71
| 1,57a
(1,22; 1,93)
(p = < 0,0001)b
|
Výška, skóre Z
|
Prie mer
± ŠO
| -5,14
± 1,07
| -5,14
± 1,09
| 0,00
± 0,28
| -5,13
± 1,11
| -4,89
± 1,09
| 0,24
± 0,32
| 0,28a
(0,17; 0,39)
(p = < 0,0001)b
|
| | | | | | | | |
AGV – ročná rýchlosť rastu; 95 % CI – 95 % interval spoľahlivosti; LS – metóda najmenších štvorcov; ŠO –
štandardná odchýlka.
a Rozdiel je 15 µg/kg Voxzogo mínus placebo.
b Dvojstranná hodnota p.
c Dvaja pacienti v skupine liečenej liekom Voxzogo boli vyradení zo štúdie pred týždňom 52. Hodnoty týchto 2 pacientov boli do tejto analýzy zahrnuté.
Stredná hodnota metódy najmenších štvorcov odhadnutá z modelu ANCOVA (analýza kovariancie)
upravená pre rozdiely od východiskových hodnôt medzi dvomi ramenami, analýza kovariancie.
Prínos zlepšenia hodnoty AGV v prospech lieku Voxzogo bol konzistentný vo všetkých analyzovaných preddefinovaných podskupinách vrátane pohlavia, vekovej skupiny, Tannerovej stupnice, východiskovej hodnoty skóre Z výšky a východiskovej hodnoty AGV. V podskupine pacientov mužského pohlavia
s hodnotou Tannerovej stupnice > I bol bodový odhad účinku liečby v prospech vozoritidu. V tejto
podskupine bolo však iba 8 účastníkov (3, resp. 5 účastníkov v ramenách s vozoritidom, resp. placebom).
Pozorované zvýšenie rastu sa vyskytlo proporcionálne pre chrbticu aj dolné končatiny. Nebol pozorovaný žiadny rozdiel v minerálnej hustote kostí po liečbe liekom Voxzogo v porovnaní s placebom. Počas liečby týmto liekom bolo priemerné zvýšenie veku kosti porovnateľné s priemerným zvýšením chronologického veku, čo ukazuje, že nedošlo k zrýchleniu zrenia kostí.
Na obrázku 1 je znázornený účinok lieku Voxzogo počas dvojročného obdobia v skupine liečenej liekom Voxzogo a účinok v skupine kontrolovanej placebom po denne subkutánne podávaných injekciách lieku Voxzogo po dobu 52 týždňov v rámci otvorenej rozširujúcej štúdie. Zlepšenia hodnôt AGV pretrvávali po dobu trvania pokračujúcej liečby liekom Voxzogo bez známok tachyfylaxie.
Obrázok 1: Priemerný (± ŠO) 12-mesačný interval AGV v časovom priebehu
8,0
7,5
Placebo/15 μg/kg vozoritid 15 μg/kg vozoritid/15 μg/kg vozoritid
7,0
6,5
6,0
5,5
5,0
4,5
4,0
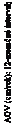
3,5
3,0
2,5
2,0
Placebo/15 μg/kg
15 μg/kg/15 μg/kg
Vých. hodnota v 111-301 Týždeň 52 v 111-301 Týždeň 52 v 111-301
Analýza
Obrázok zahŕňa všetky subjekty prihlásené do kľúčových štúdií, ktorých výška bola posúdená v týždni 52
v rozširujúcej štúdii. Plné čiary znázorňujú liečbu vozoritidom 15 µg/kg; prerušované čiary znázorňujú placebo. Východiskový stav je definovaný ako posledné vyšetrenie pred prvou dávkou aktívneho lieku štúdie (t. j. vozoritid) alebo placeba v 111-301.
12-mesačné hodnoty AGV pri kontrolách nasledujúcich po východiskových posúdeniach sú odvodené z obdobia predchádzajúcich 12 mesiacov. Napríklad, 12-mesačné hodnoty AGV v 52. týždni 111-
302 = [(výška pri kontrole 111-302 v 52. týždni – výška pri kontrole 111-301 v 52. týždni)/(dátum kontroly
111-302 v 52. týždni – dátum kontroly 111-301 v 52. týždni)] x 365,25.
Otvorená rozširujúca štúdiaV dlhodobej rozširujúcej štúdii (štúdia ACH 111-205) bolo 10 pacientov liečených liekom Voxzogo s dávkou 15 µg/kg/deň nepretržite počas obdobia do 5 rokov. Zlepšenie priemernej (ŠO) hodnoty AGV v porovnaní s východiskovou hodnotou v 60 mesiacoch bolo 1,34 (1,31) cm/rok.
Prírastok výšky po 5 rokoch liečby liekom Voxzogo s dávkou 15 µg/kg/deň bol porovnaný s historickými kontrolnými údajmi o veku a pohlaví. 5-ročná prierezová porovnávacia analýza upravená o rozdiely vo
výške proti východiskovej hodnote ukázala štatisticky významnú stredovú hodnotu (95 % CI) rozdielu výšky v prospech lieku Voxzogo (9,08 [5,77; 12,38] cm; p = 0,0002) v porovnaní s neliečenými pacientmi
s achondropláziou.
Pediatrická populácia < 5 rokovPediatrickí pacienti vo veku ≥ 2 až < 5 rokovPoužitie vo vekovej skupine 2 až < 5 rokov je podporené dôkazmi zo štúdií u detí vo veku 5 až 18 rokov
a u detí mladších ako 5 rokov. Profily bezpečnosti a účinnosti boli podobné medzi deťmi vo veku 5 rokov a viac a deťmi vo veku 2 až < 5 rokov. Prebiehajúca štúdia (štúdia ACH 111-206) hodnotí bezpečnosť
a účinnosť vozoritidu u pacientov vo veku 0 až < 5 rokov a do ukončenia zberu údajov (30. jún 2020) bolo do štúdie zaradených 62 pacientov. Priebežné údaje zo štúdie ACH 111-206 ukázali pozitívny účinok na rast u 4 pacientov vo veku ≥ 2 až < 5 rokov liečených dávkou vozoritidu 15 µg/kg/deň po dobu 2 rokov.
K dispozícii nie sú žiadne údaje pre deti mladšie ako 2 roky.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s liekom Voxzogo v jednej
alebo vo viacerých podskupinách pediatrickej populácie s achondropláziou (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Vozoritid je modifikovaný rekombinantný ľudský CNP. 39 aminokyselinový peptidový analógobsahuje
37 aminokyselín s C-koncami sekvencie ľudského CNP53 plus 2 ďalšie aminokyseliny (Pro Gly) na zabezpečenie rezistencie na degradáciu neutrálnou endopeptidázou (NEP). Výsledkom je predĺžený biologický polčas v porovnaní s endogénnym CNP.
Farmakokinetika vozoritidu bola vyhodnotená celkovo u 58 pacientov vo veku 5 až 18 rokov
s achondropláziou, ktorým boli subkutánne podávané injekcie vozoritidu 15 µg/kg jedenkrát denne po dobu 52 týždňov. Farmakokinetika vozoritidu u 18 pacientov vo veku 2 až < 5 rokov bola porovnateľná so staršími deťmi.
Absorpcia
Vozoritid bol absorbovaný s mediánom Tmax 15 minút. Priemerná (± ŠO) vrcholová koncentrácia (Cmax) bola
5 800 (± 3 680) a plocha pod krivkou závislosti koncentrácie na čase od času nula do poslednej merateľnej koncentrácie (AUC0-t) pozorované po 52 týždňoch liečby bola 290 000 (± 235 000) pg-min/ml. Biologická dostupnosť vozoritidu nebola v klinických štúdiách hodnotená.
Distribúcia
Priemerný (± ŠO) zdanlivý distribučný objem po 52 týždňoch liečby bol 2 910 (± 1 660) ml/kg.
Biotransformácia
Očakáva sa, že metabolizmus vozoritidu bude prebiehať prostredníctvom katabolických dráh a degradácie na
malé fragmenty peptidov a aminokyselín.
Eliminácia
Priemerný (± ŠO) zdanlivý distribučný objem po 52 týždňoch liečby bol 79,4 (53,0) ml/min/kg. Priemerný
(± ŠO) biologický polčas bol 27,9 (9,9) minúty.
Interindividuálna variabilita účastníkov (koeficient variácie) v zdanlivom klírense bola 33,6 %. Linearita/nelinearita
Zvýšenie expozície v plazme (AUC a Cmax) s dávkou bolo väčšie ako primerané dávke v rozsahu dávky
2,5 (0,17-násobok odporúčanej dávky) až 30,0 μg/kg/deň (dvojnásobok schválenej dávky).
Zvláštne skupiny pacientov
Vo farmakokinetike vozoritidu neboli pozorované žiadne klinicky významné rozdiely v závislosti na veku
(0,9 až 16 rokov), pohlaví, rase alebo národnosti.
Telesná hmotnosť
Telesná hmotnosť je jediným podstatným kovariantom pre klírens alebo distribučný objem vozoritidu. Zdanlivý klírens a distribučný objem vozoritidu za zvyšovali so zvyšujúcou telesnou hmotnosťou
u pacientov s achondropláziou (9 až 74,5 kg). Navrhované dávkovanie (pozri časť 4.2) berie do úvahy túto odchýlku a odporúča používanie vyššie uvedených dávok (u pacientov s telesnou hmotnosťou 10 – 16 kg)
alebo nižšej (u pacientov s telesnou hmotnosťou viac ako 44 kg) „štandardnej dávky“ 15 μg/kg s cieľom umožniť podobnú úroveň expozície vo všetkých hmotnostných rozsahoch.
Pacienti s poškodením funkcie obličiek a pečene
Bezpečnosť a účinnosť vozoritidu u pacientov s poruchami funkcie obličiek alebo pečene neboli stanovené. Na základe eliminačného mechanizmu sa neočakáva, že by poškodenie funkcie obličiek alebo pečene zmenilo farmakokinetiku vozoritidu.
Štúdie liekových interakcií
In vitro štúdie inhibície a indukcie cytochrómu P450 (CYP) ukázali v klinicky relevantných koncentráciách,
že vozoritid neinhiboval CYP 1A2, 2B6, 2C8, 2C9, 2C19, 2D6 alebo 3A4/5 ani neindukoval CYP 1A2, 2B6 alebo 3A4/5 . Štúdie interakcií in vitro tiež ukázali, že potenciál liekovej interakcie s transportérmi liečiv OAT1, OAT3, OCT 1, OCT 2, OATP1B1, OATP1B3, MATE 1, KATE2-K, BCRP, P-gp a BSEP je pri klinicky relevantných koncentráciách nízky.
5.3 Predklinické údaje o bezpečnosti
Nežiaduce reakcie, ktoré neboli pozorované v klinických štúdiách, ale boli pozorované u zvierat pri expozíciách podobných klinickým a s možným významom pre klinické použitie.
Prechodné zníženia krvného tlaku a zvýšenia pulzu závislé na dávke boli pozorované u zdravých opíc vo viacerých štúdiách v dávkach 28 až 300 μg/kg. Vrcholové účinky boli štandardne pozorované počas prvej hodiny po podaní dávky a vo všeobecnosti boli asymptomatické. U niektorých opíc, ktoré dostali vyššie dávky vozoritidu, boli pozorované krátke sternálne/laterálne záchvaty v polohe v ľahu alebo záchvaty hypoaktivity. Tieto účinky mohli mať súvislosť so zníženým krvným tlakom.
V štúdiách toxicity pri opakovaných dávkach na potkanoch a opiciach boli na bežných zvieratách pozorované nežiaduce účinky, ktoré majú vplyv na držanie tela, tvar kostí, mobilitu a pevnosť kostí. U opíc je hladina NOAEL pre vozoritid na úrovni 25 μg/kg (priemerná hodnota Cmax 1 170 pg/ml; približný ekvivalent odporúčanej dávky pre ľudí s hmotnosťou 20 kg) pri dennom podávaní vo forme subkutánnej injekcie v období 44 týždňov.
Karcinogenita/mutagenita
S vozoritidom sa neuskutočnili štúdie karcinogenity a génotoxicity. Na základe mechanizmu účinku sa
neočakáva, že vozoritid bude tumorogénny.
Porucha fertility
V štúdii fertility a reprodukčnosti u samcov a samíc potkanov na úrovniach dávky do 540 μg/kg/deň nemal
vozoritid žiadny účinok na schopnosť párenia, fertilitu alebo charakteristiku vrhu.
Reprodukčná a vývojovátoxicita
Vozoritid nebol spojený s účinkami na parametre reprodukčnej schopnosti, v maternici alebo vývojové
parametre namerané u potkanov a králikov na skúmanie fertility alebo embryofetálneho vývoja v štúdiách prenatálneho a postnatálneho vývoja.
Vozoritid sa zistil v materskom mlieku u potkanov.
6
. FARMACEUTICKÉ INFORMÁCIE
6
.1 Zoznam pomocných látok
Prášok
kyselina citrónová (E 330)
citrát sodný (E 331) dihydrát trehalózy manitol (E 421) metionín
polysorbát 80 (E 433)
Rozpúšťadlo
voda na injekcie
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Neotvorené injekčné liekovky
2 roky
Rekonštituovaný roztok
Chemická a fyzikálna stabilita bola preukázaná na dobu 3 hodiny pri teplote 25 °C.
Z mikrobiologického hľadiska, pokiaľ spôsob rekonštitúcie nevylučuje riziko mikrobiálnej kontaminácie, sa má roztok použiť okamžite.
Ak sa liek Voxzogo nepoužije okamžite, musí sa podať do 3 hodín po rekonštitúcii (pozri časť 4.2).
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke. Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Liek Voxzogo sa môže uchovávať pri izbovej teplote do 30 °C počas jedného 90 dňového obdobia, ale
nesmie byť prekročený dátum exspirácie. Po uchovávaní lieku Voxzogo pri izbovej teplote nevracajte liek do
chladničky.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Vozoritid 0,4 mg prášok a rozpúšťadlonainjekčnýroztok
Prášok
2 ml injekčná liekovka (sklo) s gumenou zátkou (brómbutyl) a bielym vyklápacím viečkom.
Rozpúšťadlo
Naplnená injekčná striekačka (sklo) s piestom (brómbutyl) a krytom s konektorom Luer-Lock a bezpečnostnou zátkou obsahujúcou 0,5 ml vody na injekcie.
Vozoritid 0,56 mg prášok a rozpúšťadlonainjekčnýroztok
Prášok
2 ml injekčná liekovka (sklo) s gumenou zátkou (brómbutyl) a purpurovým vyklápacím viečkom.
Rozpúšťadlo
Naplnená injekčná striekačka (sklo) s piestami (brómbutyl) a krytom s konektorom Luer-Lock a bezpečnostnou zátkou obsahujúcou 0,7 ml vody na injekcie.
Vozoritid 1,2 mg prášok a rozpúšťadlonainjekčnýroztok
Prášok
2 ml injekčná liekovka (sklo) s gumenou zátkou (brómbutyl) a sivým vyklápacím viečkom.
Rozpúšťadlo
Naplnená injekčná striekačka (sklo) s piestami (brómbutyl) a krytom s konektorom Luer-Lock a bezpečnostnou zátkou obsahujúcou 0,6 ml vody na injekcie.
Každá škatuľa obsahuje:
• 10 injekčných liekoviek lieku Voxzogo
• 10 naplnených injekčných striekačiek s vodou na injekcie
• 10 samostatne balených ihiel na jednorazové použitie (23 G, na rekonštitúciu)
• 10 samostatne balených injekčných striekačiek na jednorazové použitie (30 G, na podávanie)
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Príprava lieku Voxzogo na subkutánnu injekciu
• Zodpovedajúca sila lieku Voxzogo a zodpovedajúca naplnená injekčná striekačka
s rozpúšťadlom (objem na rekonštitúciu) sa majú potvrdiť na základe telesnej hmotnosti pacienta (pozri Tabuľku 1).
• Pred začiatkom prípravy je potrebné si nachystať všetky ďalšie potrebné materiály:.
o alkoholové tampóny,
o gáza alebo obväzy,
o nádoba na likvidáciu ostrých predmetov.
• Injekčná liekovka s liekom Voxzogo a rozpúšťadlo v naplnenej injekčnej striekačke (voda na injekcie) sa pred rekonštitúciou lieku Voxzogo majú vytiahnuť z chladničky, aby dosiahli izbovú teplotu.
• Ihla na rozpúšťadlo sa musí nasadiť na naplnenú injekčnú striekačku s rozpúšťadlom (voda na injekcie).
• Celý objem rozpúšťadla sa musí vstreknúť do injekčnej liekovky.
• Rozpúšťadlo v injekčnej liekovke sa má opatrne rozvíriť dovtedy, kým sa biely prášok úplne nerozpustí. Injekčnou liekovkou sa nemá triasť.
• Príslušný objem dávky rekonštituovaného roztoku sa má pomaly natiahnuť z injekčnej liekovky na jednorazové použitie do injekčnej striekačky.
• Po rekonštitúcii je tento liek číra, bezfarebná až žltá kvapalina. Roztok by sa nemal používať, ak je sfarbený alebo zakalený alebo ak sú prítomné viditeľné častice.
• Po rekonštitúcii sa môže liek Voxzogo uchovávať v injekčnej liekovke pri izbovej teplote
do 25 °C maximálne 3 hodiny. Liek neobsahuje žiadnu konzervačnú látku.
• Na podanie sa musí potrebný objem dávky natiahnuť z injekčnej liekovky pomocou dodanej injekčnej striekačky určenej na podanie lieku (pozri Tabuľku 1).
• Každá injekčná liekovka a naplnená injekčná striekačka je určená len na jednorazové použitie.'
• Má sa použiť iba priložená injekčná striekačka určená na podanie lieku.
LikvidáciaVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Všetky ihly a injekčné striekačky sa musia zlikvidovať v nádobe na likvidáciu ostrých predmetov.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBioMarin International Limited
Shanbally, Ringaskiddy
County Cork, P43 R298
Írsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
https://www.ema.europa.eu.
Pokyny na použitie
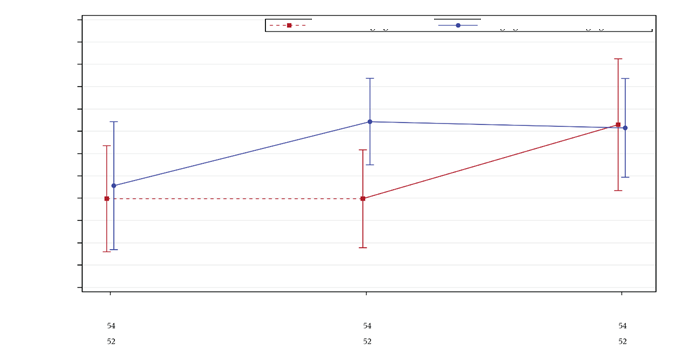
Materiál dodávaný na podanie injekcie lieku Voxzogo (pozri Obrázok A)
Obrázok A
Injekčná liekovka
s liekom Voxzogo
Ihla na prenos rozpúšťadla
(modrá úchytka zaťahuje ihlu naspäť)
Striekačka s rozpúšťadlom(obsahuje vodu na injekcie na rekonštitúciu lieku Voxzogo)
 Striekačka na podanie injekcie
Striekačka na podanie injekcie
 Materiál, ktorý je potrebný, ale nie je súčasťou balenia (pozri Obrázok B)
Ak tento materiál nemáte, obráťte sa na svojho lekárnika.
Obrázok B
Alkoholové tampóny Nádoba na likvidáciu ostrých predmetov Gáza alebo náplasť
Materiál, ktorý je potrebný, ale nie je súčasťou balenia (pozri Obrázok B)
Ak tento materiál nemáte, obráťte sa na svojho lekárnika.
Obrázok B
Alkoholové tampóny Nádoba na likvidáciu ostrých predmetov Gáza alebo náplasť
PRÍPRAVA NA PODANIE INJEKCIE
Skôr ako začnete, sa uistite, že máte k dispozícii čistý pracovný povrch a umyli ste si ruky.
Krok 1: Na čistom rovnom povrchu otvorte viečko injekčnej liekovky a utrite jej vrchnú časť alkoholovým tampónom.
Po utretí alkoholovým tampónom sa
nedotýkajte zátky injekčnej liekovky prstami.
|
|
Krok 2: Jemným ohnutím odstráňte viečko na striekačke s rozpúšťadlom.
|
|
Krok 3: Ihlu na prenos rozpúšťadla naskrutkujte na injekčnú striekačku s rozpúšťadlom, až kým už nebudete môcť ďalej otáčať..
|
|
Krok 4: Potiahnutím odstráňte kryt ihly a zasuňte ihlu do injekčnej liekovky stredom jej zátky. Pomaly zatlačte piest úplne dole a vstreknite celý objem tekutiny.
Dávajte pozor, aby ste modrú úchytku
nezatlačili skôr ako v kroku 5.
|
|
Krok 5: Vytiahnite ihlu z injekčnej liekovky,
potom zatlačte modrú úchytku, aby sa ihla zasunula späť (zatiahla). Ihlu a striekačku vyhoďte do
nádoby na likvidáciu ostrých predmetov.
Pozri krok 19 a „Ako vyhodiť (zlikvidovať) liek
Voxzogo.“
Striekačku, kde bolo rozpúšťadlo, nepoužívajte
na podanie injekcie.
 POZOR: Dávajte pozor, aby ste sa nedotkli POZOR: Dávajte pozor, aby ste sa nedotkli
špičky ihly.
|

|
Krok 6: Rozpúšťadlo v injekčnej liekovke opatrne rozvírte, aby sa prášok úplne rozpustil a roztok bol číry.
Nepretrepávajte.
Uistite sa, že liek je číry až žltý, nie je zakalený a nie sú v ňom prítomné častice.
|
|
Krok 7: Potiahnutím odstráňte kryt ihly z injekčnej striekačky a zasuňte ihlu do injekčnej liekovky stredom zátky injekčnej liekovky.
Dávajte pozor, aby ste neohli ihlu.
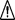 POZOR: Nedávajte kryt späť na ihlu. POZOR: Nedávajte kryt späť na ihlu.
|
|

Krok 8: Opatrne uchopte injekčnú liekovku a striekačku. Prevráťte injekčnú liekovku
s vloženou ihlou. Injekčná liekovka má byť hore.
Dávajte pozor, aby ste neohli ihlu.
|
|
Krok 9: S ihlou stále vsunutou v liekovke pomaly potiahnite piest smerom von tak, aby ste natiahli predpísanú dávku lieku do striekačky.
Informácie o objeme, ktorý sa má natiahnuť, nájdete na štítku s informáciami o dávkovaní.
 POZOR: Natiahnite do striekačky predpísanú dávku. POZOR: Natiahnite do striekačky predpísanú dávku.
|
|
Krok 10: Jemným poklepaním odstráňte veľké vzduchové bubliny v striekačke. Potom pomaly zatlačte bubliny späť do injekčnej liekovky.
|
|
Krok 11: Opakujte kroky 9 a 10, až kým nemáte v striekačke správny objem predpísanej dávky
a v striekačke sa nenachádzajú žiadne veľké
bubliny.
Uistite sa, že dávka v striekačke sa zhoduje
s predpísanou dávkou. Merajte od spodnej časti
piestu, ako je znázornené na obrázku.
 POZOR: Odstráňte všetky veľké POZOR: Odstráňte všetky veľké
bubliny. 1 alebo 2 malé bubliny sú prijateľné.
|
|
Krok 12: Uistite sa, že v striekačke máte predpísanú dávku, potom odstráňte injekčnú liekovku a pripravte sa na podanie dávky.
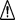 POZOR: Pred odstránením injekčnej liekovky skontrolujte, či sa natiahnuté množstvo lieku zhoduje s predpísanou dávkou. POZOR: Pred odstránením injekčnej liekovky skontrolujte, či sa natiahnuté množstvo lieku zhoduje s predpísanou dávkou.
|
|
VÝBER A PRÍPRAVA MIESTA PODANIA INJEKCIE
Krok 13: Liek Voxzogo sa má injekčne podávať iba do podkožného tuku (subkutánne).
• Nevpichujte injekciu cez oblečenie.
• Nepoužívajte to isté miesto vpichu dva krát po sebe.
• Nepodávajte injekciu na miesto, kde je koža citlivá, červená, stvrdnutá, zjazvená alebo kde je modrina.
|
Na podanie injekcie sa odporúčajú nasledujúce miesta:
• zadná časť hornej časti ramien alebo
• stehná alebo
• brucho (5 centimetrov od pupka) alebo
• zadok.
|
Krok 14: Pretrite miesto vpichu alkoholovým tampónom a nechajte pokožku vyschnúť.
Nedotýkajte sa očisteného miesta vpichu pred podaním injekcie.
|
|
PODANIE INJEKCIE LIEKU VOXZOGO
 Krok 15:
Krok 15: Po pretretí miesta vpichu alkoholovým tampónom vytvorte ryhu (stlačte kožu) okolo vybraného miesta vpichu.
 Krok 16:
Krok 16: Rýchlym pohybom zasuňte celú ihlu do kože pod uhlom 45 stupňov.
Krok 17: Uvoľnite stlačenie kože a pomaly
zatlačte piest úplne dole. Podajte celú dávku.
Krok 18: Pokračujte v zatláčaní piestu, až kým sa
ihla nezasunie do striekačky.
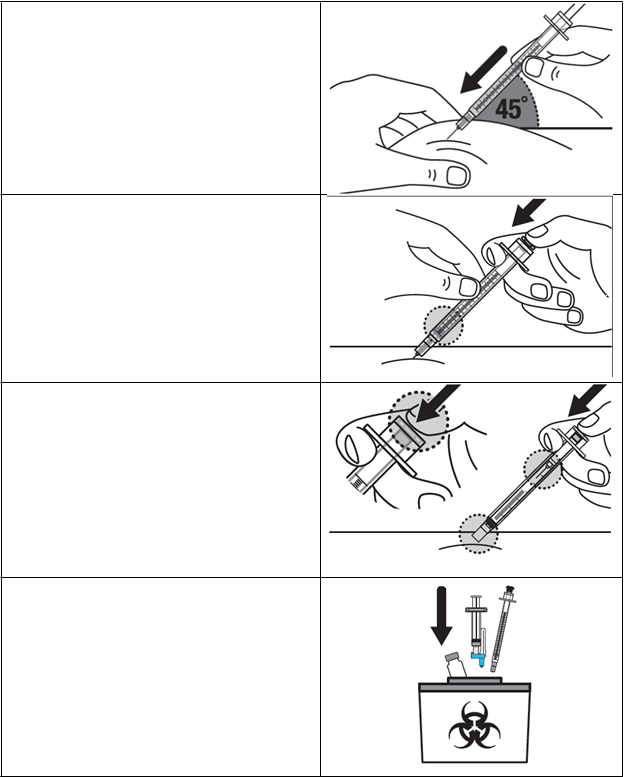
Krok 19: Použitú injekčnú liekovku, striekačky
a ihly odhoďte do nádoby na likvidáciu ostrých predmetov. Viac informácií nájdete v časti „Ako vyhodiť (zlikvidovať) liek Voxzogo“.
Po podaní injekcie lieku Voxzogo• Skontrolujte miesto podania injekcie. Ak sa v mieste podania injekcie objaví malé množstvo krvi, na niekoľko sekúnd jemne zatlačte na miesto gázový tampón alebo prekryte miesto obväzom.
•
Nešúchajte miesto vpichu.
• Sledujte prejavy nízkeho krvného tlaku, ako napr. závrat, únava alebo napínanie na vracanie. Ak sa u vás tieto príznaky vyskytnú, kontaktujte svojho lekára alebo poskytovateľa zdravotnej starostlivosti, potom si ľahnite na chrbát a podložením vankúšov zdvihnite nohy do vyvýšenej polohy.
Ako vyhodiť (zlikvidovať) liek Voxzogo
Použité/exspirované injekčné liekovky, ihly a injekčné striekačky vyhoďte ihneď po použití do nádoby na likvidáciu ostrých predmetov.
Ak nemáte nádobu na likvidáciu ostrých predmetov, môžete použiť nádobu na domový odpad, ktorá spĺňa nasledujúce kritériá:
• je vyrobená z odolného plastu,
• má tesné veko odolné proti prepichnutiu, cez ktoré ostré predmety nemôžu preniknúť von,
• je počas používania stabilná a stojí na mieste,
• je nepriepustná a
• je vhodne označená s cieľom upozorniť na nebezpečný odpad nachádzajúci sa vo vnútri.
Keď bude vaša nádoba na likvidáciu ostrých predmetov takmer plná, budete ju musieť zlikvidovať podľa miestnych predpisov.
Injekčné liekovky, ihly ani striekačky nelikvidujte domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.