
nechať súbežné podanie rFVIII.
V prípade závažných udalostí krvácania alebo závažných operácií vyžadujúcich opakované časté infúzie sa odporúča monitorovanie hladín FVIII:C, aby sa rozhodlo, či je potrebné podávanie rFVIII pri následných infúziách, aby sa predišlo nadmernému vzostupu hladiny FVIII:C.
Liečba epizód krvácania (liečbapodľapotreby)
Začiatok liečby
Prvá dávka lieku VEYVONDI by mala byť 40 až 80 IU/kg telesnej hmotnosti. Je potrebné dosiahnuť substitučné hladiny > 0,6 IU/ml (60%) and FVIII:C > 0,4 IU/ml (40%).Pokyny pre dávkovanie na
liečbu menších a závažných hemorágií nájdete v tabuľke 1.
VEYVONDI sa má podávať na kontrolu krvácania s rekombinantným faktorom VIII, ak sú hladiny FVIII:C <40 % alebo nie sú známe. Dávka rFVIII sa má vypočítať na základe rozdielu medzi východiskovou hladinou FVIII:C pacienta a požadovanou maximálnou hladinou FVIII:C, aby sa dosiahla primeraná hladina FVIII:C v plazme na základe približnej strednej
obnovy 0,02 (IU/ml)/(IU/kg). Podávať sa má celá dávka lieku VEYVONDI a potom do 10 minút rFVIII.
Výpočet dávky:
Dávka lieku VEYVONDI [IU] = dávka [IU/kg] x váha [kg]
Nasledujúce infúzie:
Nasledujúca dávka 40 IUaž 60 IU/kg lieku VEYVONDI by mala byť infúzne podaná
každých 8 až 24 hodín podľa dávkovacích rozmedzí uvedených v tabuľke1 alebo tak dlho, ako je to klinicky potrebné. Pri závažných epizódach krvácania udržiavajte minimálnu hladinu VWF:RCo na
viac ako 50 % tak dlho, pokiaľ to bude potrebné.
Na základe skúseností z klinických štúdií zostanú endogénne hladiny FVIII po substitúcii VWF
normálne alebo takmer normálne, pokiaľ sa pokračuje v podávaní lieku VEYVONDI.
Tabuľka 1
Odporúčania pre dávkovanie na liečbu menej závažných a závažných hemorágií
H
e
m
o
rágia
Úvodná dávka
Nasledujúca dávka
(
I
U VWF:RCo/kg telesnej hmotnosti)
M
enej závažná (napr. krvácanie z nosa, perorálne krvácanie, menorágia)
Závažnáb
(napr. ťažké alebo neustupujúce krvácanie z nosa, menorágia, gastrointestinálne krvácanie, trauma centrálneho nervového systému, hemartróza alebo traumatická hemorágia)
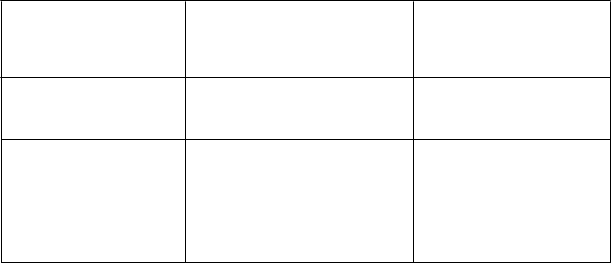
40 až 50 IU/kg
50 až 80 IU/kg
40 až 50 IU/kg
každých 8 až 24 hodín (alebo pokiaľ sa to bude považovať za klinicky potrebné)
40 až 60 IU/kg
každých 8 až 24 hodín po dobu približne 2-3 dní (alebo pokiaľ sa to bude považovať za klinicky potrebné)
aPri podávaní rFVIII si pozrite písomnú informáciu pre rFVIII, kde nájdete pokyny na rekonštitúciu a podávanie. bKrvácanie sa môže považovať za závažné, ak je transfúzia červených krviniek buď potrebná alebo potenciálne indikovaná, alebo ak krvácanie nastane na kritickom anatomickom mieste (napr. intrakraniálna alebo gastrointestinálna hemorágia).
Predchádzaniekrvácania/hemorágiealiečbavprípadeplánovanejoperácie:
Pred chirurgickým zákrokom:
Pacientom s neprimeranými hladinami FVIII by sa 12-24 hodín pred začiatkom plánovanej operácie mala podať dávka 40-60 IU/kg VEYVONDI (predoperačná dávka), aby sa zabezpečili predoperačné
endogénne hladiny VFIII na úrovni najmenej 0,4 IU/ml pre malý chirurgický zákrok
a najmenej0,8 IU/ml pre veľký chirurgický zákrok.
Počas 3 hodín pred začiatkom akéhokoľvek chirurgického zákroku by sa mali vyhodnotiť hladiny FVIII:C, aby sa v prípade plánovanej operácie zabránilo nadmernému krvácaniu. V prípade, že sú hladiny FVIII:C na odporúčaných cieľových hodnotách:
- najmenej 0,4 IU/ml pre malé a perorálne chirurgické zákroky,
- najmenej0,8 IU/ml pre veľké chirurgické zákroky,
počas 1 hodiny pred operáciou by mali pacienti dostať dávku samotného lieku VEYVONDI.
Ak nie sú hladiny FVIII:C na odporúčaných cieľových hodnotách, je nutné okrem vonikogu alfa podať aj dávku lieku obsahujúceho rFVIII na zvýšenie hladiny VWF:RCo a FVIII:C počas 1 hodiny pre operáciou. Odporúčané cieľové hladiny FVIII:C nájdete v tabuľke 2. Dávka závisí od hladiny VWF
a FVIII pacienta, ako aj od typu a závažnosti očakávaného krvácania.
T
a
buľka 2
O
dporúčané cieľové maximálne plazmatické hladiny VWF:RCo a FVIII:C, ktoré je potrebné dosiahnuť pred chirurgickým zákrokom za účelom prevencie nadmerného krvácania počas a po chirurgickom zákroku
T
y
p zákroku
Cieľová maximálna plazmatická hladina VWF:RCo
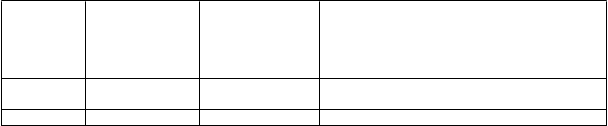 Cieľová maximálna plazmatická hladina FVIII:C
Cieľová maximálna plazmatická hladina FVIII:C a
Výpočet dávky rVWF (má sa podaťdo 1 hodiny pred operáciou) (potrebné IU VWF:RCo)
Menej b c
závažný 0,50 - 0,60 IU/ml 0,40 - 0,50 IU/ml ∆ VWF:RCo x BW (kg)/IR
Závažný 1 IU/ml 0,80 - 1 IU/ml ∆bVWF:RCo x BW (kg)/IR c
a Na dosiahnutie odporúčaných cieľových maximálnych plazmatických hladín FVIII:C môže byť potrebné zvýšené množstvo rFVIII. Dávkovanie musí byť založené na IR.
b ∆ = Cieľová maximálna plazmatická hladina VWF:RCo – východisková plazmatická hladina VWF:RCo
cIR = Prírastková obnova meraná u daného subjektu. Ak IR nie je k dispozícii, použite IR 0,02 IU/ml na IU/kg.
Počas a po chirurgickom zákroku:
Po začatí chirurgického zákroku by sa mali monitorovať plazmatické hladiny VWF:RCo a FVIII:C
a intraoperačný a pooperačný substitučný režim by sa mal individuálne upraviť podľa farmakokinetických výsledkov, intenzity a trvania hemostázy a štandardnej starostlivosti inštitúcie.
Vo všeobecnosti, pre pooperačný substitučný režim by mal byť rozsah frekvencie dávkovania lieku
VEYVONDI od dvakrát denne až po každých 48 hodín. Odporúčané liečebné postupy pre následné udržiavacie dávky sú uvedené v tabuľke č. 3.
Tabuľka 3
Odporúčané cieľové minimálne plazmatické hladiny VWF:RCo a FVIII:C a minimálna dĺžka liečby pre následné udržiavacie dávky na prevenciu nadmerného krvácania po chirurgickom zákroku
T
y
p zákroku
V
W
F
:
R
C
o Cieľová minimálna plazmatická hladina
F
VI
II
:
C Cieľová minimálna
p
l
a
z
m
a
ti
c
k
á hladina
M
i
n
i
m
á
l
n
a
F
re
k
venc
i
a dávkovania
M
e
ne
j
D
o 72 hodín po operácii
P
o 72 hodinách po operácii
D
o 72 hodín po operácii
P
o 72 hodinách po operácii
d
ĺ
ž
k
a liečby
Každých 12-24 hodín/
závaž
n
ý ≥ 0,30 IU/ml - > 0,40 IU/ml - 48 hodín
každý druhý deň
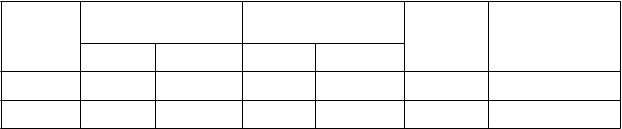 Z
ávažn
ý
Z
ávažn
ý > 0,50 IU/ml > 0,30 IU/ml > 0,50 IU/ml > 0,40 IU/ml 72 hodín Každých 12-24 hodín/
každý druhý deň
PediatrickápopuláciaBezpečnosť a účinnosť lieku VEYVONDI u detí a dospievajúcich vo veku od 0 do 18 rokov nebola
doteraz stanovená. K dispozícii nie sú žiadne údaje.
Spôsob podávaniaVEYVONDI je na intravenózne použitie. Rekonštituovaný liek sa má pred podaním vizuálne
skontrolovať.
Rýchlosť podávania musí byť dostatočne nízka, aby sa zaistilo pohodlie pacienta, maximálne
4 ml/min. Pacienta je potrebné pozorovať pre prípad akýchkoľvek okamžitých reakcií. Ak nastane akákoľvek reakcia, ktorá môže súvisieť s podávaním lieku, ako napríklad tachykardia, rýchlosť infúzie sa musí znížiť alebo zastaviť podľa klinického stavu pacienta.
Ak je nutné súbežné podávanie rVWF a rFVIII, môžu byť predbežne zmiešané v jednej injekčnej striekačke, aby sa dosiahla vhodná dávka. Obsah každej injekčnej liekovky rVWF a rFVIII sa môže
vtiahnuť do jedinej injekčnej striekačky použitím samostatného nepoužitého zariadenia na rekonštitúciu (inkompatibility sú uvedené v časti 6.2).
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Známa alergická reakcia na myšie a škrečie proteíny.
4.4 Osobitné upozornenia a opatrenia pri používaní
U pacientov s aktívnym krvácaním sa odporúča súbežné podanie lieku obsahujúceho FVIII s liekom
VEYVONDI ako liečba prvej línie a v závislosti od hladín aktivity FVIII (pozri časť 4.2).
Sledovateľnosť
Aby bolo možné zlepšiť sledovateľnosť biologických liekov, názov a číslo šarže podaného lieku sa majú jasne zaznamenať.
Reakciezprecitlivenosti
Môžu sa vyskytnúť reakcie z precitlivenosti (vrátane anafylaxie). Pacienti a/alebo ich opatrovatelia by mali byť informovaní o skorých prejavoch reakcií z precitlivenosti, ktoré môžu zahŕňať, ale nie sú
obmedzené na tachykardiu, tlak v hrudníku, dýchavičnosť a/alebo akútnu respiračnú tieseň, hypotenziu, generalizovanú žihľavku, pruritus, rinokonjunktivitídu, angioedém, letargiu, nauzeu,
vracanie, parestéziu, nepokoj a môžu prejsť do anafylaktického šoku. V prípade šoku sa má použiť bežná medicínska liečba šoku.
Pacientov je nutné starostlivo sledovať a starostlivo kontrolovať pre prípad akýchkoľvek príznakov počas infúzie. Ak sa objavia prejavy a príznaky závažných alergických reakcií, okamžite prerušte podávanie lieku VEYVONDI a poskytnite primeranú podpornú starostlivosť.
Pri potenciálnej anafylaktickej reakcii by mala byť k dispozícii adekvátna lekárska starostlivosť a opatrenia, a to najmä u pacientov s anamnézou alergických reakcií.
VEYVONDI obsahuje stopové množstvá myšieho imunoglobulínu G (MuIgG) a škrečích proteínov (množstvo menšie alebo rovnajúce sa 2 ng/IU VEYVONDI). U pacientov liečených týmto liekom sa môžu vyvinúť reakcie z precitlivenosti na tieto proteíny cicavcov iného ako ľudského pôvodu. VEYVONDI obsahuje stopové množstvá rekombinantného koagulačného faktora VIII.
Trombózaaembolizmus
U pacientov so známymi rizikovými faktormi pre trombózu zistenými klinickým alebo laboratórnym vyhodnotením vrátane nízkych hladín ADAMTS13 existuje riziko výskytu trombotických udalostí. Je
preto nutné monitorovať rizikových pacientov, kvôli výskytu včasných prejavov trombózy, a na
základe súčasných odporúčaní a štandardov starostlivosti sa musia dodržiavať profylaktické opatrenia proti tromboembolizmu.
U pacientov, ktorí vyžadujú časté dávky lieku VEYVONDI v kombinácii s rekombinantným faktorom VIII, sa majú sledovať plazmatické hladiny aktivity FVIII:C, aby sa zabránilo pretrvávajúcim nadmerným plazmatickým hladinám FVIII:C, čo môže zvýšiť riziko trombotických udalostí. Ktorýkoľvek liek obsahujúci FVIII podávaný v kombinácii s liekom VEYVONDI by mal byť liek obsahujúci len samotný FVIII. Kombinácia s liekom obsahujúcim FVIII aj VWF predstavuje ďalšie riziko trombotických udalostí.
Neutralizáciaprotilátok(inhibítorov)
U pacientov s von Willebrandovou chorobou, obzvlášť typu 3, sa môžu vytvárať neutralizujúce protilátky (inhibítory) proti von Willebrandovmu faktoru. Ak sa nedosiahne očakávaná plazmatická hladina (VWF:RCo) alebo ak krvácanie nie je vhodnou dávkou kontrolované, musí sa vykonať testovanie na prítomnosť inhibítora von Willebrandovho faktora. U pacientov s vysokými hladinami protilátok proti VWF nemusí byť liečba faktorom VWF účinná a je potrebné zvážiť iné liečebné možnosti.
Liečba pacientov s VWD, ktorí majú protilátky s vysokým stupňom väzby (z dôvodu predchádzajúcej liečby použitím pdVWF), môže vyžadovať vyššiu dávku na prekonanie väzbového účinku protilátok
a takíto pacienti by mohli byť liečení podaním klinicky vhodných vyšších dávok vonikogu alfa na
základe farmakokinetických údajov pre každého jednotlivého pacienta.
Informácieopomocnejlátke,ktoréjepotrebnézvážiť
Tento liek obsahuje 5,2 mg sodíka na každú injekčnú liekovku 650 IU alebo 10,4 mg sodíka na každú injekčnú liekovku 1300 IU. Toto je rovné 2,2 % maximálneho denného príjmu 2 g sodíka dospelého
jedinca na základe odporúčania organizácie WHO za predpokladu, že telesná hmotnosť je 70 kg a dávka je 80 IU/kg telesnej hmotnosti. Je potrebné to vziať do úvahy u pacientov na diéte
s kontrolovaným príjmom sodíka.
4.5 Liekové a iné interakcie
Nie sú známe žiadne interakcie medzi liekmi obsahujúcimi ľudský von Willebrandov faktorom a inými liekmi.
4.6 Fertilita, gravidita a laktácia
S liekom VEYVONDI sa neuskutočnili žiadne reprodukčné štúdie na zvieratách. Gravidita
Skúsenosti týkajúce sa liečby počas gravidity alebo laktácie nie sú k dispozícii. VEYVONDI sa má
podávať gravidným ženám len vtedy, ak je to jasne indikované, berúc do úvahy, že u týchto pacientok je pri podávaní zvýšené riziko hemoragických udalostí.
Dojčenie
Nie je známe, či sa liek VEYVONDI vylučuje do ľudského mlieka. Preto sa má VEYVONDI podávať laktujúcim ženám s nedostatkom von Willebrandovho faktora len vtedy, ak je to jasne indikované. Zdravotnícki pracovníci majú zvážiť potenciálne riziká a len v prípade potreby predpísať
VEYVONDI.
Fertilita
Účinky lieku VEYVONDI na fertilitu neboli stanovené.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
VEYVONDI nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Počas liečby liekom VEYVONDI sa môžu vyskytnúť nasledujúce nežiaduce reakcie:
Precitlivenosť alebo alergické reakcie, tromboembolické udalosti, vytvorenie inhibítorov voči VWF.
Tabuľkovýzoznamnežiaducichreakcií
Kategórie frekvencie výskytu sú definované podľa nasledujúcej konvencie: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
T
rieda
T
a
buľka 4
Z
h
rnutie nežiaducich reakcií hlásených v rámci klinických skúšaní lieku VEYVONDI
pri von Willebrandovej chorobe
Počet a frekvencia podľa
o
rgánových systémov podľa MedDRA (SOC)
Nežiaduce reakcie podľa preferovaného termínu (PT)
Kat
egória
f
rekvencie podľa subjektu
s
ubjektu
a
(
N=80)
n (%)
Poruchy nervového systému
Poruchy srdca
Závrat Časté 3 (3,75) Vertigo Časté 2 (2,50) Poruchy chuti Časté 1 (1,25)
Triaška Časté 1 (1,25)
a srdcovej činnosti Tachykardia Časté 1 (1,25)
Hlboká trombóza žíl Časté 1 (1,25)
Poruchy ciev
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Celkové poruchy
a reakcie v mieste podania
L
a
boratórne a funkčné vyšetrenia
Hypertenzia Časté 1(1,25) Návaly horúčavy Časté 1 (1,25) Vracanie Časté 3 (3,75)
Nevoľnosť Časté 3 (3,75)
Generalizovaný pruritus Časté 2 (2,50) Nepríjemný pocit na hrudi Časté 1 (1,25)
Parestézia v mieste infúzie Časté 1 (1,25) Inverzia vlny T na
elektrokardiograme Časté 1 (1,25)
Zvýšená srdcová frekvencia Časté 1 (1,25)
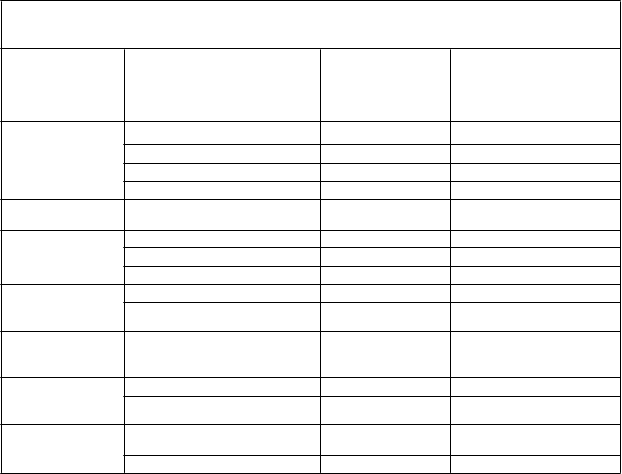 a
Frekvencia podľa subjektu:
a
Frekvencia podľa subjektu: Celkový počet subjektov s nežiaducimi udalosťami (súvisiacimi a nesúvisiacimi) vydelený celkovým počtom subjektov (N) a vynásobený x 100.
OpisvybranýchnežiaducichreakciíV klinických štúdiách bol zaznamenaný jeden prípad klinicky asymptomatickej hlbokej žilovej trombózy (DVT) u subjektu v chirurgickej štúdii, ktorý mal úplnú náhradu bedrového kĺbu.
Okrem toho bol po uvedení lieku na trh spontánne nahlásený jeden prípad hlbokej žilovej trombózy
u staršieho pacienta.
PrecitlivenosťExistuje možnosť vzniku precitlivenosti alebo alergických reakcií (ktoré môžu zahŕňať angioedém, pálenie a pichanie v mieste infúzie, zimnicu, návaly horúčavy, rinokonjunktivitídu, generalizovanú žihľavku, bolesť hlavy, vyrážky, hypotenziu, letargiu, nevoľnosť, nepokoj, tachykardiu, tlak na hrudníku, mravčenie, vracanie, sipot), ktoré môžu v niektorých prípadoch viesť k anafylaxii (vrátane šoku).
U pacientov s von Willebrandovou chorobou, obzvlášť typu 3 sa môžu veľmi zriedkavo vytvárať neutralizujúce protilátky (inhibítory) proti von Willebrandovmu faktoru. Ak sa vyskytnú takéto inhibítory, stav sa môže prejaviť nedostatočnou klinickou odpoveďou. Takéto protilátky sa môžu vyskytnúť v tesnej súvislosti s precitlivenosťou alebo anafylaktickými reakciami. Preto je potrebné pacientov s precitlivenosťou alebo anafylaktickými reakciami testovať a zistiť prítomnosť inhibítora.
Vo všetkých takýchto prípadoch sa odporúča obrátiť sa na špecializované centrum na liečbu hemofílie.
TrombogenicitaU pacientov so známymi klinickými alebo laboratórnymi rizikovými faktormi, vrátane nízkych hladín
ADAMTS13, existuje riziko výskytu trombotických udalostí. Je preto nutné monitorovať rizikových pacientov, kvôli výskytu včasných prejavov trombózy, a na základe súčasných odporúčaní
a štandardov starostlivosti sa musia dodržiavať profylaktické opatrenia proti tromboembolizmu.
I
m
unogenicita
Imunogenicita lieku VEYVONDI bola hodnotená v klinických štúdiách sledovaním vývoja neutralizujúcich protilátok proti VWF a FVIII, ako aj väzbových protilátok proti VWF, Furinu,
proteínu ovariálnych buniek čínskeho škrečka (CHO) a myšiemu IgG. Nebol pozorovaný žiadny vývoj
neutralizujúcich protilátok proti ľudskému VWF alebo neutralizujúcich protilátok proti ľudskému rFVIII, ku ktorému by došlo počas liečby. U jedného z 80 jedincov, ktorí počas klinických štúdií dostávali perioperatívne liek VEYVONDI, u ktorého neboli hlásené žiadne nežiaduce udalosti alebo nedostatočná hemostatická účinnosť, sa po chirurgickom zákroku vyvinuli liečbou spôsobené väzobné protilátky proti VWF. Väzbové protilátky proti nečistotám, ako je rFurin, CHO-proteín alebo myšie IgG neboli po liečbe liekom VEYVONDI pozorované.
NežiaducereakciepouvedeníliekunatrhKeďže sú tieto reakcie nahlasované dobrovoľne z populácie neznámej veľkosti, nie je vždy možné spoľahlivo odhadnúť ich frekvenciu alebo zistiť kauzálny vzťah k vystaveniu lieku.
Najčastejšou nežiaducou reakciou po uvedení lieku na trh nahlásenou v súvislosti s liečbou použitím rVWF/vonikogu alfa je „reakcia súvisiaca s podaním infúzie“ (IRR), ktorá sa klinicky prejavuje nasledujúcimi symptómami: tachykardia, návaly horúčavy, vyrážka, dýchavičnosť a rozmazané
videnie. V 2 spontánne nahlásených prípadoch po uvedení lieku na trh sa symptómy stratili a pacienti sa úplne zotavili v čase od 20 minút do 4 hodín po skončení aplikácie infúzie.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNeboli hlásené žiadne príznaky predávkovania von Willebrandovým faktorom. V prípade závažného predávkovania sa môžu vyskytnúť tromboembolické udalosti.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antihemoragiká: koagulačné faktory, von Willebrandov faktor. ATC
kód: B02BD10
MechanizmusakcieVEYVONDI je rekombinantný ľudský von Willebrandov faktor (rVWF). VEYVONDI sa správa rovnako ako endogénny ľudský von Willebrandov faktor.
Podávanie lieku VEYVONDI umožňuje korekciu hemostatických abnormalít u pacientov, ktorí trpia nedostatkom von Willebrandovho faktora (von Willebrandovou chorobou) na dvoch úrovniach:
- VEYVONDI obnovuje adhéziu krvných doštičiek k vaskulárnemu subendotelu na mieste vaskulárneho poškodenia (pretože sa viaže na vaskulárny subendotelový matrix (napr. kolagén)
a na membrány krvných doštičiek), čo poskytuje primárnu hemostázu, čo sa odráža v skrátenom čase krvácania. Tento účinok nastáva ihneď a je známe, že v značnej miere závisí od úrovne
polymerizácie proteínu.
- VEYVONDI vyvoláva oneskorenú korekciu súvisiaceho nedostatku faktora VIII. Pri intravenóznom podávaní sa VEYVONDI viaže na endogénny faktor VIII (ktorý normálne produkuje pacient) a stabilizáciou tohto faktora zabráni jeho rýchlej degradácii. Z tohto dôvodu je sekundárnym účinkom podávania prvej infúzie lieku VEYVONDI obnovenie hladiny FVIII:C na normálnu hladinu. Po podaní sa v priebehu 6 hodín hladina FVIII:C zvýši nad 40 % a u väčšiny pacientov dosiahne maximum v priebehu 24 hodín, v závislosti od východiskovej hladiny FVIII:C.
VEYVONDI je rVWF, ktorý okrem všetkých multimérov v plazme obsahuje aj extrémne veľké multiméry, pretože počas výrobného procesu nie je vystavený proteolýze prostredníctvom ADAMTS13.
Klinickáúčinnosťabezpečnosť
Klinická bezpečnosť, účinnosť a údaje o farmakokinetike sa hodnotili v 3 dokončených štúdiách
(070701, 071001 a 071101), ktoré zahŕňali pacientov s VWD. Do klinického vývoja lieku
VEYVONDI bolo zapojených celkovo 92 jedinečných subjektov (80 jedinečných subjektov s VWD
v štúdiách 070701, 071001 a 071101 a 12 subjektov s hemofíliou A v štúdii 071104).
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s liekom VEYVONDI vo všetkých podskupinách pediatrickej populácie pri liečbe von Willebrandovej choroby (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Farmakokinetika (PK) lieku VEYVONDI bola stanovená v troch klinických štúdiách stanovením plazmatickej hladiny VWF:RCo, antigénu von Willebrandovho faktora (VWF:Ag) a väzobnej aktivity von Willebrandovho faktora ku kolagénu (VWF:CB). Vo všetkých troch štúdiách boli subjekty hodnotené v stave bez krvácania. Trvalý nárast FVIII:C sa pozoroval do šiestich hodín po
jednorazovej infúzii lieku VEYVONDI.
Tabuľka 5 zhŕňa farmakokinetiku (PK) lieku VEYVONDI po infúziách 50 IU/kg VWF:RCo (PK50) alebo 80 IU/kg VWF:RCo (PK80). Priemerná doba trvania infúzie bola 16,5 minút (SD± 3,51 minút) pri 50 IU/kg (PK50) a 11,8 minút (± 2,86 minút) pri 80 IU/kg VWF:RCo (PK80).
Tabuľka 5
Farmakokinetické hodnotenie VWF:RCof
Parameter Fáza 1 PK
5
0
V
E
Y
V
O
N
D
I s
o
k
t
o
k
og
o
m
al
f
a
g
(
š
t
ú
d
i
a 070701)
Pr
i
e
m
er
n
á hodnota (95 % CI) SD
T
1/2
a 19,3 (14,3; 24,3)
10,99
Clb 0,04 (0,03; 0,05)
0,028
IR pri Cm c 1,7 (1,4; 2,0)
Fáza3 PK50 VEYVONDI (štúdia 071001)Priemerná hodnota (95 % CI) SD22,6 (19,5; 25,7)
5,34
0,02 (0,02; 0,03)
0,005
1,9 (1,6; 2,1)
Fáza3 PK80 VEYVONDI (Štúdia 071001)Priemerná hodnota (95 % CI) SD19,1 (16,7; 21,5)
4,32
0,03 (0,02; 0,03)
0,009
2,0 (1,7; 2,2)
OperáciaPK50 VEYVONDI (štúdia 071101)Priemerná hodnota(95 % CI) SD17,8 (12,9; 22,8)
7,34
0,03 (0,02; 0,04)
0,011
2,0 (1,7; 2,3)
0,62
AUC0-infd 1541,4 (1295,7; 1787,2)
554,31
AUC0-inf/Dávkae 33,4 (27,2; 39,5)
13,87
0,41
2105,4 (1858,6; 2352,3)
427,51
42,1 (37,3; 46,9)
8,31
0,39
2939,0 (2533,2; 3344,8)
732,72'
36,8 (31,8; 41,8)
8,97
0,45
1834,4 (1259,0; 2409,7)
856,45
37,5 (25,3; 49,7)
18,14
a[hodiny], b[dl/kg/hodiny], c[(IU/dl)/(U VWF:RCo/kg)] d[(h*IU/dl)]e[(h*IU/dl)/(U VWF:RCo/kg)] /
f[Boli použité testy na VWF:RCo s rôznou citlivosťou a pracovnými rozsahmi: Fáza 1: automatizovaný test 0,08 až 1,50 IU/ml a citlivý manuálny test 0,01 až 0,08 IU/ml; Fáza 3: automatizovaný test 0,08 – 1,50 IU/ml
g Táto štúdia bola vykonaná s použitím ADVATE, rekombinantného faktora VIII
Prieskumná analýza kombinovaných údajov zo štúdií 070701 a 071001 ukázala štatisticky významnú
(na úrovni 5%) dlhšiu priemernú retenčnú dobu, štatisticky významný (na úrovni 5%) dlhší terminálny polčas a štatisticky významný (na úrovni 5%) väčší AUC0-inf vo vzťahu k VWF: RCo po podaní
lieku VEYVONDI (50 IU/kg VWF:RCo) a podaní kombinácie lieku VEYVONDI a oktokogu alfa
(50 IU/kg VWF: RCo a 38,5 IU/kg rFVIII) v porovnaní s podaním pdVWF a pdFVIII (50 IU/kg pdVWF:RCo a 38,5 IU/kg pdFVIII).
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko preľudí.
Štúdie karcinogenity, zhoršenia fertility a vývoja plodu neboli uskutočnené. V perfúznom modeli ľudskej placenty ex vivo sa preukázalo, že VEYVONDI nepreniká ľudskou placentovou bariérou.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok
Citronan sodný
Glycín
Dihydráttrehalózy Manitol Polysorbát 80
Rozpúšťadlo
Voda na injekcie
6.2 Inkompatibility
Boli vykonané klinické štúdie a štúdie kompatibility podávania vonikogu alfa (ľudský Willebrandov faktor) s oktokogom alfa (ľudským koagulačným faktorom) v tej istej injekčnej striekačke. Vhodnú dávku možno dosiahnuť predbežným zmiešaním rVWF a rFVIII v jednej injekčnej striekačke (pozri časť 4.2 pre spôsob podávania).Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Neotvorenáinjekčnáliekovka
3 roky.
Časpoužiteľnostiporekonštitúcii:
Chemická a fyzikálna stabilita rekonštituovaného roztoku bola preukázaná počas 3 hodín pri teplote 25 °C.
Z mikrobiologického hľadiska sa má liek okamžite použiť. Ak nie je použitý okamžite, za dĺžku
a podmienky uchovávania pred použitím zodpovedá používateľ a obvykle by nemala presahovať 24 hodín pri teplote 2 až 8 °C, pokiaľ rekonštitúcia neprebehla v kontrolovaných a overených aseptických podmienkach.
6.4 Špeciálne upozornenia na uchovávanie
Prášok
Uchovávajte pri teplote neprevyšujúcej 30 °C. Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Porekonštitúcii:
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
 6.5 Druh a obsah balenia
V
EYVONDI
650
I
U
prášok
a
r
ozpúšťadlo
na
injekčný
roztok
6.5 Druh a obsah balenia
V
EYVONDI
650
I
U
prášok
a
r
ozpúšťadlo
na
injekčný
roztok
Každé balenie obsahuje:
- prášok v injekčnej liekovke (zo skla typu I) uzavretej butylovou gumenou zátkou,
- 5 ml rozpúšťadla v injekčnej liekovke (zo skla typu I) uzavretej chlórbutylovou gumenou zátkou,
- jedno zariadenie na rekonštitúciu (Mix2Vial).
VEYVONDI1300IUprášokarozpúšťadlonainjekčnýroztokKaždé balenie obsahuje:
- prášok v injekčnej liekovke (zo skla typu I) uzavretej butylovou gumenou zátkou,
- 10 ml rozpúšťadla v injekčnej liekovke (zo skla typu I) uzavretej brómbutylovou gumenou zátkou,
- jedno zariadenie na rekonštitúciu (Mix2Vial).
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomVšeobecnépokyny- Skontrolujte dátum exspirácie a uistite sa, že teplota prášku VEYVONDI a vody na injekcie
(rozpúšťadlo) pred prípravou je vo výške izbovej teploty. Nepoužívajte po dátume exspirácie, ktorý je uvedený na štítkoch a škatuli.
- Počas postupu rekonštitúcie používajte aseptickú techniku (čistú a s nízkym počtom mikróbov)
a rovnú pracovnú plochu. Umyte si ruky a použite čisté gumené rukavice (použitie rukavíc je voliteľné).
- Rekonštituovaný liek (po zmiešaní prášku s dodanou vodou) použite čo najskôr a do troch hodín. Rekonštituovaný liek môžete uchovávať po dobu do 3 hodín pri izbovej teplote, ktorá
nesmie presiahnuť 25 °C.
- Uistite sa, že teplota injekčnej liekovky s práškom VEYVONDI a sterilizovanej vody na injekcie (rozpúšťadlo) pred prípravou je vo výške izbovej teploty.
- Na podanie tohto lieku používajte plastové injekčné striekačky, pretože bielkoviny v lieku majú tendenciu prilepiť sa na povrch sklenených injekčných striekačiek.
- Vonikog alfa sa nesmie miešať s inými liekmi okrem rFVIII.
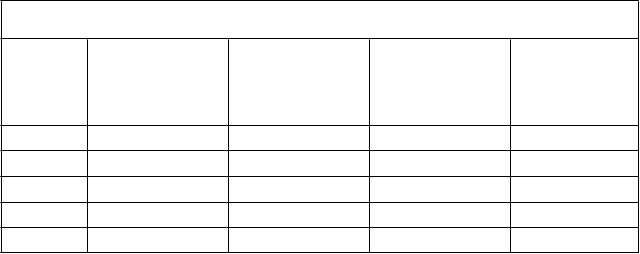
Pokyny na rekonštitúciuapodávanieKroky Zobrazený príklad1 Odstráňte z injekčných liekoviek s práškom VEYVONDI
a rozpúšťadlom uzávery, čím odhalíte stred gumových zátok.
2 Dezinfikujte každú zátku samostatným sterilným alkoholovým
tampónom (alebo iným vhodným sterilným roztokom navrhnutým lekárom alebo centrom na liečbu hemofílie) tak,
že zátku budete po dobu niekoľko sekúnd utierať tampónom.
Zátku nechajte vyschnúť. Položte injekčné liekovky na rovný povrch.
3 Otvorte balenie zariadenia Mix2Vial. Úplne odlúpnite viečko
bez toho, aby ste sa dotkli vnútra balenia. Nevyberajte NA
pomôcku Mix2Vial z balenia.
4 Otočte balenie so zariadením Mix2Vial hore dnom a umiestnite ho nad hornú časť injekčnej liekovky
s rozpúšťadlom. Pevne zasuňte modrý plastový hrot zariadenia
do centra zátky injekčnej liekovky s rozpúšťadlom zatlačením rovno nadol. Uchopte balenie za jeho okraj a zdvihnite ho zo zariadenia Mix2Vial. Pozor, nedotýkajte sa priesvitného plastového hrotu. Na injekčnú liekovku s rozpúšťadlom je teraz pripojené zariadenie Mix2Vial a je pripravená na pripojenie k injekčnej liekovke VEYVONDI.
5 Ak chcete pripojiť injekčnú liekovku s rozpúšťadlom na injekčnú liekovku VEYVONDI, otočte injekčnú liekovku s rozpúšťadlom a umiestnite ju na injekčnú liekovku
obsahujúcu prášok VEYVONDI. Úplne zasuňte priesvitný plastový hrot do zátky injekčnej liekovky s liekom
VEYVONDI pevným zatlačením rovno nadol. Toto by sa malo vykonať hneď, aby kvapalina neobsahovala baktérie. Vákuum vtiahne rozpúšťadlo do injekčnej liekovky s liekom
VEYVONDI. Overte, že prenos celého objemu rozpúšťadla je dokončený. Nepoužívajte, ak stratíte vákuum a rozpúšťadlo
neprechádza do injekčnej liekovky s liekom VEYVONDI.
6 Jemne a nepretržite otáčaním miešajte obsah pripojených injekčných liekoviek alebo nechajte rekonštituovaný liek stáť po dobu 5 minút, potom ho jemne otáčaním pomiešajte, aby sa prášok úplne rozpustil. Nepretrepávajte. Pretrepanie nepriaznivo ovplyvní liek. Po rekonštitúcii neuchovávajte
v chladničke.
7 Odpojte obidve strany Mix2Vial od seba tak, že jednou rukou
podržíte priehľadnú plastovú stranu zariadenia Mix2Vial pripojenú k injekčnej liekovke VEYVONDI a druhou rukou
podržíte modrú plastovú stranu zariadenia Mix2Vial pripojenú
k injekčnej liekovke s rozpúšťadlom. Otočte modrou plastovou stranou proti smeru pohybu hodinových ručičiek
a opatrne od seba injekčné liekovky odtiahnite. Nedotýkajte sa
konca plastového konektora pripojeného k injekčnej liekovke VEYVONDI obsahujúcej rozpustený liek. Položte injekčnú liekovku VEYVONDI na rovný pracovný povrch. Zlikvidujte prázdnu injekčnú liekovku rozpúšťadla.
8 Vytiahnutím piestu nasajete vzduch do prázdnej sterilnej injekčnej striekačky na jedno použitie. Množstvo vzduchu by sa malo rovnať množstvu rekonštituovaného lieku VEYVONDI, ktorý odoberiete z injekčnej liekovky.
9 Injekčnú liekovku s liekom VEYVONDI (obsahujúcou
rekonštituovaný liek) nechajte na plochom pracovnom povrchu, a pripojte injekčnú striekačku k priehľadnému
plastovému konektoru a otočte injekčnú striekačku v smere
hodinových ručičiek.
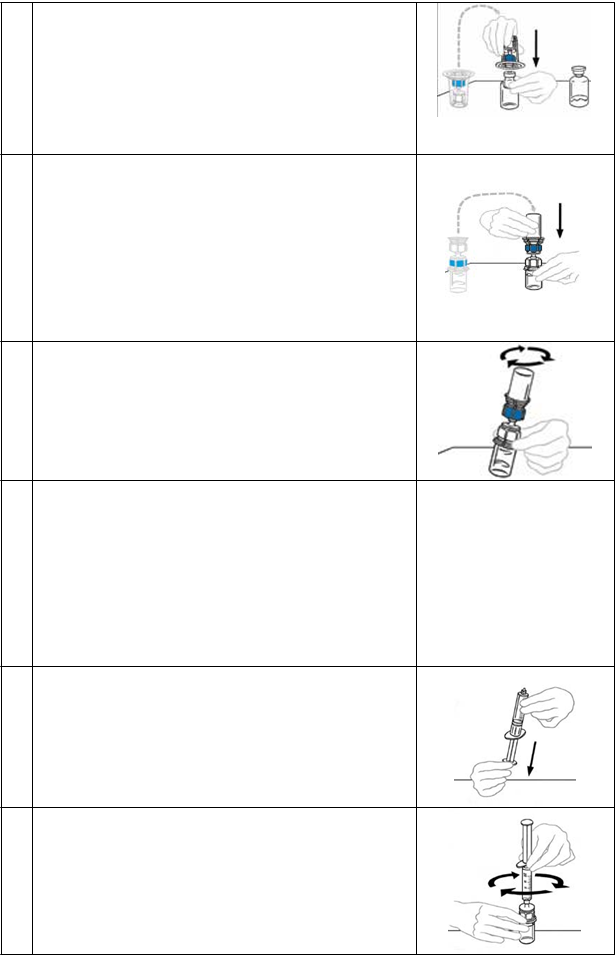
10 Držte injekčnú liekovku jednou rukou a druhou rukou vytlačte všetok vzduch z injekčnej striekačky do injekčnej liekovky.
11 Otočte pripojenú injekčnú striekačku a injekčnú liekovku
VEYVONDI tak, aby bola injekčná liekovka na hornej strane. Uistite sa, že stále stláčate piest injekčnej striekačky.
Pomalým vytiahnutím piestu nasajte VEYVONDI do injekčnej striekačky.
12 Roztok sa nemá presúvať tam a naspäť medzi injekčnou
striekačkou a injekčnou liekovkou. Ak to urobíte, môžete poškodiť liek. Keď je čas na infúziu, odpojte injekčnú
striekačku otočením proti smeru hodinových ručičiek.
Injekčnú striekačku vizuálne skontrolujte, či sa v roztoku nenachádzajú častice. Roztok musí byť číry a bezfarebný.
Ak je vidno vločky alebo častice, roztok nepoužívajte
a upovedomte svojho lekára.
13 · Ak je pre vašu dávku nutná viac ako jedna injekčná
liekovkaVEYVONDI:
· Nechajte injekčnú striekačku pripojenú k injekčnej liekovke, kým nebudete mať pripravenú ďalšiu injekčnú liekovku.
· Pomocou rekonštitúcie podľa vyššie uvedených krokov (2 až 8) pripravte ďalšiu injekčnú liekovku s liekom VEYVONDI pomocou nového zariadenia Mix2Vial pre každú injekčnú liekovku.
14 Do jednej injekčnej striekačky sa dá vtiahnuť obsah dvoch injekčných liekoviek.
POZNÁMKA: Pri vtláčaní vzduchu do druhej injekčnej liekovky VEYVONDI, ktorej obsah sa má preniesť do
injekčnej striekačky, nasmerujte injekčnú liekovku
s pripojenou injekčnou striekačkou tak, aby bola injekčná liekovka navrchu.
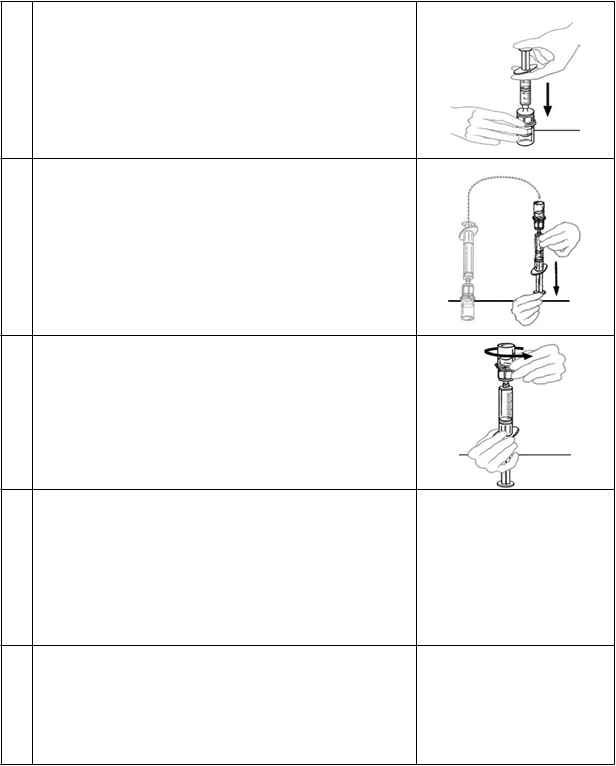
PokynynapodávaniePred podaním pripravený roztok v injekčnej striekačke skontrolujte, či sa v ňom nenachádzajú častice
alebo nezmenil farbu (roztok musí byť číry, bezfarebný a bez častíc). Nie je nezvyčajné, že
porekonštitúciiostanevinjekčnejliekovke lieku zopár vločiek alebo častíc. Filter v zariadení Mix2Vial tieto častice úplne odstraňuje. Filtrácia nemá vplyv na výpočet dávkovania.
Roztokvinjekčnejstriekačkesa nesmie používať v prípade, že je po filtrácii zakalený alebo obsahuje vločky alebo častice.
1. Pripojte infúznu ihlu k injekčnej striekačke obsahujúcej roztok VEYVONDI. Pre pohodlie je preferovaná infúzna sada s krídelkami. Otočte ihlu smerom nahor a odstráňte všetky vzduchové
bubliny jemným poklepaním prstom na injekčnú striekačku. Pomaly a opatrne vytlačte vzduch z injekčnej striekačky a ihly.
2. Nasaďte škrtidlo a starostlivo pripravte miesto na infúziu potieraním kože sterilným
alkoholovým tampónom (alebo iným vhodným sterilným roztokom navrhnutým lekárom alebo centrom na liečbu hemofílie).
3. Vsuňte ihlu do žily a odstráňte škrtidlo. Pomaly podávajte infúziu s liekom VEYVONDI.
Nepodávajte infúziu rýchlejšie než 4 ml za minútu. Odpojte prázdnu injekčnú striekačku. Ak vaša dávka vyžaduje viacero injekčných striekačiek, postupne po sebe po jednom pripájajte
a podávajte ďalšie injekčné striekačky VEYVONDI.
Poznámka:Neodstraňujte krídelkovú ihlu dovtedy, kým nebude infúziou podaný obsah všetkých injekčných striekačiek a nedotýkajte sa portu Luer, ktorý pripája injekčnú striekačku.
Ak bol predpísaný rekombinantný faktor VIII, podajte ho do 10 minút po ukončení infúzie lieku
VEYVONDI.
4. Vytiahnite ihlu zo žily a sterilnú gázu pritlačte na miesto infúzie po dobu niekoľkých minút.
V prípade potreby veľkého objemu lieku VEYVONDI je možné spojiť dve injekčné liekovky VEYVONDI dohromady. Do jednej injekčnej striekačky sa dá vtiahnuť obsah oboch rekonštituovaných liekov VEYVONDI. V týchto prípadoch by sa však pôvodne rekonštituovaný roztok VEYVONDI nemal ďalej riediť.
Roztok sa má pomaly podávať intravenózne (pozri časť 4.2), maximálne 4 ml/min.
Ihlu opätovne nezatvárajte. Pre správnu likvidáciu umiestnite ihlu, injekčnú striekačku a prázdne injekčné liekovky s liekom VEYVONDI a rozpúšťadlom do pevného kontajnera na ostré predmety.
Tieto predmety nevyhadzujte spolu s bežnými odpadkami v domácnosti.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBaxalta Innovations GmbH Industriestraße 67
1221 Viedeň
Rakúsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/18/1298/001
EU/1/18/1298/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.