
o 12 mesiacov, odporúča sa pravidelné vyšetrenie oka (očí), napr. každé 3 až
6 mesiacov.
Liek Verkazia sa neskúmal u pacientov s aktívnou orofaciálnou infekciou zapríčinenou vírusom herpes simplex, s očným herpesom v anamnéze, s infekciou zapríčinenou vírusom varicella-zoster alebo vírusom vakcínie, a preto sa má u týchto pacientov používať s opatrnosťou.
Pomocnálátka
Liek Verkazia obsahuje cetalkóniumchlorid, ktorý môže spôsobiť podráždenie oka.
Trvanie
liečby
Účinnosť a bezpečnosť lieku Verkazia podávaného dlhšie ako 12 mesiacov sa neskúmali. Preto keď sa liek Verkazia používa dlhšie ako 12 mesiacov, odporúča sa pravidelné vyšetrenie oka (očí), napr.
každé 3 až 6 mesiacov.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s liekom Verkazia. Kombináciasinýmiliekmi,ktoréovplyvňujúimunitnýsystém
Súbežné podávanie lieku Verkazia s očnými instiláciami obsahujúcimi kortikosteroidy môže zosilniť
účinky lieku Verkazia na imunitný systém. V klinických štúdiách však 18 pacientov používalo liek Verkazia (4-krát denne) súbežne s očnými instiláciami obsahujúcimi kortikosteroidy, pričom sa nezistilo zvýšenie rizika nežiaducich reakcií súvisiacich s imunitným systémom (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Ženyvofertilnomveku/antikoncepciaužien
Liek Verkazia sa neodporúča používať u žien vo fertilnom veku, ktoré nepoužívajú účinnú antikoncepciu.
Gravidita
Nie sú k dispozícii žiadne údaje o použití lieku Verkazia u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu po systémovom podaní cyklosporínu pri expozíciách považovaných za dostatočne vyššie, ako je maximálna expozícia u ľudí, čo poukazuje na malý význam týchto zistení pre klinické použitie lieku Verkazia.
Liek Verkazia sa neodporúča používať počas gravidity, ak potenciálny prínos pre matku neprevyšuje potenciálne riziko pre plod.
Dojčenie
Cyklosporín sa po perorálnom podaní vylučuje do ľudského mlieka. Nie sú dostatočné informácie o účinkoch cyklosporínu u novorodencov/dojčiat. Pri terapeutických dávkach cyklosporínu v očnej instilácii je však nepravdepodobné, že by sa do materského mlieka dostalo významné množstvo. Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu liekom Verkazia sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú k dispozícii žiadne údaje o účinkoch lieku Verkazia na fertilitu človeka.
U zvierat, ktoré dostávali intravenózny cyklosporín, nebolo hlásené zhoršenie fertility (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek Verkazia má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
Tento liek môže vyvolať dočasne rozmazané videnie alebo iné poruchy zraku, ktoré môžu ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje (pozri časť 4.8). Pacientov je potrebné upozorniť, aby neviedli vozidlá ani neobsluhovali stroje, kým sa im videnie neupraví.
4.8 Nežiaduce účinky
Súhrn
bezpečnostného
profilu
Najčastejšie nežiaduce reakcie v klinických skúšaniach s liekom Verkazia boli bolesť očí (11 %) a svrbenie očí (9 %), ktoré boli zvyčajne prechodné a vyskytli sa počas podávania instilácie.
TabuľkovýzoznamnežiaducichreakciíV klinických štúdiách sa pozorovali nasledujúce nežiaduce reakcie uvedené ďalej. Sú zoradené podľa triedy orgánových systémov a klasifikované podľa nasledujúceho pravidla: veľmi časté (³ 1/10), časté (³ 1/100 až < 1/10), menej časté (³ 1/1 000 až < 1/100), zriedkavé (³ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
Trieda orgánových systémov podľa databázy MedDRA
| Frekvencia podľa databázy MedDRA
| Nežiaduca reakcia
|
Infekcie a nákazy
| Časté
| Infekcia horných dýchacích ciest.
|
Menej časté
| Bakteriálna keratitída, očný herpes zoster.
|
Poruchy nervového systému
| Časté
| Bolesť hlavy.
|
Poruchy oka
| Veľmi časté
| Bolesť oka.
|
Časté
| Svrbenie oka, očná hyperémia, podráždenie oka, nepríjemný pocit v oku, pocit cudzieho telieska v očiach, zvýšené slzenie, rozmazané videnie, erytém očného viečka, edém očného viečka.
|
Menej časté
| Blefaritída, edém spojovky.
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| Časté
| Kašeľ.
|
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
PríloheV.
4.9 PredávkovanieLokálne predávkovanie po podaní do oka nie je pravdepodobné. Ak dôjde k predávkovaniu liekom
Verkazia, liečba má byť symptomatická a podporná.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: oftalmologiká, iné oftalmologiká, ATC kód: S01XA18.
MechanizmusúčinkuafarmakodynamickéúčinkyPo podaní do oka sa cyklosporín pasívne absorbuje T-lymfocytmi, kde sa naviaže na cyklofilín A, čím inaktivuje kalcineurín a zabráni translokácii NF-AT do jadra, a tak zablokuje uvoľňovanie prozápalových cytokínov, ako je IL-2 a aktiváciu T-lymfocytov. Zablokovanie NF-AT narúša tiež proces alergie. Cyklosporín inhibuje uvoľňovanie histamínu zo žírnych buniek a bazofilov znížením produkcie IL-5 a môže znížiť mobilizáciu eozinofilov a účinky na spojovku a rohovku. Je tiež známe, že cyklosporín reguluje uvoľňovanie protizápalových cytokínov smerom nahor. Zo všetkých
dostupných dôkazov vyplýva, že cyklosporín pôsobí špecificky a reverzibilne na lymfocyty a nepotláča krvotvorbu ani nemá žiadny vplyv na funkciu fagocytárnych buniek.
Klinickáúčinnosť
V 12-mesačnom dvojito maskovanom hlavnom klinickom skúšaní kontrolovanom vehikulom (štúdia VEKTIS) bolo 169 pacientov so závažnou VKC a závažnou keratitídou (4. alebo 5. stupeň na upravenej oxfordskej stupnici) randomizovaných do skupín so 4 kvapkami lieku Verkazia (vysoká dávka) alebo 2 kvapkami lieku Verkazia (nízka dávka) a 2 kvapkami vehikula alebo 4 kvapkami vehikula počas prvých 4 mesiacov (1. obdobie). Pacienti randomizovaní do skupiny s vehikulom prešli po 4 až 12 mesiacoch na liek Verkazia (štyrikrát alebo dvakrát denne) (2. obdobie).
Analýzy účinnosti zahŕňali 168 pacientov [127 detí (75,6 %) a 41 dospievajúcich (24,4 %)]. Priemerný vek bol 9,2 roka (SD: 3,3, vekový rozsah: 4-17 rokov). Na skúšaní sa zúčastnilo viac chlapcov [n =
132 (78,6 %)] ako dievčat [n = 36 (21,4 %)].
Primárny cieľový ukazovateľ účinnosti, ktorým bola priemerná zmena skóre zafarbenia rohovky fluoresceínom (Corneal Fluorescein Staining, CFS) upraveného vzhľadom na nepriaznivé okolnosti v porovnaní s východiskovým bodom a v priebehu 1. obdobia, zahŕňal všetkých pacientov (n = 168). Účinnosť sa hodnotila každý mesiac počas obdobia liečby trvajúceho 4 mesiace a porovnávala sa s východiskovým stavom s použitím zloženého kritéria založeného na keratitíde posudzovanej pomocou upravenej oxfordskej stupnice, potreby záchranného lieku (použitie lokálnych steroidov) a výskytu ulcerácie rohovky.
Rozdiel v priemere najmenších štvorcov (LS) v porovnaní s vehikulom bol 0,76 (95 % IS: 0,26; 1,27) pre skupinu s vysokou dávkou a 0,67 (95 % IS: 0,16; 1,18) pre skupinu s nízkou dávkou. Obidva rozdiely boli štatisticky významné s hodnotou p = 0,007 pre skupinu s vysokou dávkou a p = 0,010 pre skupinu s nízkou dávkou.
Klinický význam primárneho cieľového ukazovateľa účinnosti však bolo ťažké zistiť. V tomto kontexte sa výsledky miery pacientov reagujúcich na liečbu považovali za spoľahlivejší cieľový ukazovateľ. Pacient reagujúci na liečbu bol definovaný ako pacient 1) s priemerným skóre CFS počas
4 mesiacov liečby ≤ 50 % východiskovej hodnoty, 2) ktorý neodstúpil zo štúdie z dôvodu pravdepodobne súvisiaceho s liečbou, 3) ktorý nemal skúsenosti s ulceráciou rohovky a 4) ktorý nepoužil záchranný liek za posledné 4 mesiace liečby. V obidvoch skupinách liečených aktívnym liekom sa vyskytoval významne vyšší počet CFS pacientov reagujúcich na liečbu v porovnaní so skupinou liečenou vehikulom (p = 0,005 pre skupinu s vysokou dávkou a p = 0,010 pre skupinu
s nízkou dávkou), pričom v skupine liečenej vysokou dávkou reagovalo na liečbu 55,4 % pacientov,
50,0 % v skupine liečenej nízkou dávkou a 27,6 % v skupine, ktorá dostávala vehikulum. Nadmerná miera, pokiaľ ide o vehikulum, bola 27,8 % pre režim s vysokou dávkou a 22,4 % pre režim s nízkou dávkou.
Záchranný liek (lokálne steroidy) sa použil častejšie v režime s vehikulom než v režime s vysokou dávkou: 32,1 % pacientov v skupine s vysokou dávkou a 31,5 % pacientov v skupine s nízkou dávkou dostalo aspoň jednu kúru záchranného lieku, zatiaľ čo v skupine s vehikulom to bolo
53,4 % pacientov.
Všetky štyri symptómy (fotofóbia, slzenie, svrbenie a výtok zo sliznice) sa v priebehu času zlepšili a rozdiel v 4. mesiaci oproti začiatku v prípade každého symptómu väčšinou prekročil hodnotu 10 mm.
V prípade priemeru symptómov VKC bol rozdiel v priemere LS v porovnaní s vehikulom v skupine s vysokou dávkou štatisticky významný vo všetkých časových bodoch v porovnaní s vehikulom: -
19,4 mm (p < 0,05).
Kvalita života pacientov („Quick“ dotazník) sa zlepšila významne viac v skupine s vysokou dávkou v porovnaní so skupinou s vehikulom. Zlepšenie bolo klinicky významné, čo dokazuje veľkosť účinku v priebehu 4 mesiacov (oblasť symptómov: 0,67 a oblasť každodenných činností: 0,44).
Analýzy v 2. období preukázali stabilitu zlepšení dosiahnutých počas 1. obdobia v prípade obidvoch dávkových režimov.
5.2 Farmakokinetické vlastnosti
Neuskutočnili sa žiadne oficiálne farmakokinetické štúdie s liekom Verkazia u ľudí. Koncentrácia lieku Verkazia v krvi sa merala s použitím špecifického testu vysokotlakovou
kvapalinovou chromatografiou a hmotnostnou spektrometriou. U 166 pacientov vo východiskovom stave v jednej štúdii účinnosti (55 pacientov v skupine s vysokou dávkou, 53 pacientov v skupine s nízkou dávkou a 58 pacientov v skupine s vehikulom) sa plazmatické koncentrácie cyklosporínu merali pred podaním a po 2, 4 a 12 mesiacoch liečby.
V skupine s vysokou dávkou malo po 4 mesiacoch podávania očnej instilácie Verkazia 4-krát denne (n
= 50) 20 pacientov hodnoty nižšie ako dolný limit detekcie (0,050 ng/ml) a 13 pacientov malo hodnoty nižšie ako dolný limit kvantifikácie (0,100 ng/ml). Kvantifikovateľné hodnoty nepresahujúce
0,670 ng/ml sa merali u 14 pacientov a hodnoty sa považovali za zanedbateľné. Cyklosporinémia sa
nemerala u 3 pacientov. Hodnoty v 12. mesiaci (n = 68 pacientov) boli nižšie ako dolný limit detekcie v prípade 38 pacientov a nižšie ako dolný limit kvantifikácie v prípade 10 pacientov. Dvanásť pacientov malo merateľné hodnoty (maximálne 0,291 ng/ml) a všetky hodnoty sa považovali za zanedbateľné. Cyklosporinémia sa nemerala u 8 pacientov.
V skupine s nízkou dávkou malo po 4 mesiacoch podávania očnej instilácie Verkazia 2-krát denne (n
= 47) 34 pacientov hodnoty nižšie ako dolný limit detekcie (0,050 ng/ml) a 7 pacientov malo hodnoty nižšie ako dolný limit kvantifikácie (0,100 ng/ml). Kvantifikovateľné hodnoty nepresahujúce
0,336 ng/ml sa merali u 5 pacientov, pričom tieto hodnoty sa považovali za zanedbateľné. Cyklosporinémia sa nemerala u 1 pacienta. Hodnoty v 12. mesiaci (n = 61 pacientov) boli nižšie ako dolný limit detekcie v prípade 47 pacientov a nižšie ako dolný limit kvantifikácie v prípade
6 pacientov. Päť pacientov malo merateľné hodnoty (maximálne 0,300 ng/ml) a všetky hodnoty sa považovali za zanedbateľné. Cyklosporinémia sa nemerala u 3 pacientov.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, fototoxicity a fotoalergie, genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
Účinky v predklinických štúdiách sa pozorovali iba pri systémovom podaní alebo pri expozíciách považovaných za dostatočne vyššie, ako je maximálna expozícia u ľudí, čo poukazuje na malý význam týchto zistení pre klinické použitie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
triglyceridy so stredne dlhým reťazcom, cetalkóniumchlorid,
glycerol, tyloxapol, poloxamér 188,
hydroxid sodný (na úpravu pH),
voda na injekcie.
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Neuchovávajte v mrazničke. Uchovávajte pri teplote do 25° C.
Jednodávkové obaly udržiavajte vo vrecku na ochranu pred svetlom a zabránenie odparovaniu.
Otvorený jednodávkový obal ihneď po použití zlikvidujte.
6.5 Druh obalu a obsah balenia
0,3 ml jednodávkové obaly z polyetylénu s nízkou hustotou (LDPE) v uzavretom laminátovom hliníkovom vrecku.
Jedno vrecko obsahuje 5 jednodávkových obalov.
Veľkosti balenia: 30, 60, 90 alebo 120 jednodávkových obalov. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Santen Oy
Niittyhaankatu 20
33720 Tampere
Fínsko
8. REGISTRAČNÉ ČÍSLA
EU/1/17/1219/001
EU/1/17/1219/002
EU/1/17/1219/003
EU/1/17/1219/004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 6. júla 2018
10
. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu
1
. NÁZOV LIEKU
Verkazia 1 mg/ml očné emulzné kvapky
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Jeden ml emulzie obsahuje 1 mg cyklosporínu (ciclosporin). Pomocná látka so známym účinkom:
Jeden ml emulzie obsahuje 0,05 mg cetalkóniumchloridu (pozri časť 4.4). Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Očné emulzné kvapky. Mliečne biela emulzia.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba závažnej vernálnej keratokonjunktivitídy (VKC) u detí od 4 rokov a u dospievajúcich.
4.2 Dávkovanie a spôsob podávania
Liečbu liekom Verkazia musí začať oftalmológ alebo zdravotnícky pracovník kvalifikovaný v oblasti oftalmológie.
Dávkovanie
Deti od 4 rokov a dospievajúci
Odporúčaná dávka je jedna kvapka lieku Verkazia 4 krát denne (ráno, na poludnie, popoludní a večer) do postihnutého oka počas sezóny VKC. Ak prejavy a príznaky VKC pretrvávajú po skončení sezóny, liečba sa môže udržiavať v odporúčanej dávke alebo sa môže znížiť na jednu kvapku dvakrát denne, keď sa dosiahne primeraná kontrola prejavov a príznakov. Liečba sa má po odznení príznakov ukončiť a po ich návrate sa má znova začať.
Účinnosť a bezpečnosť lieku Verkazia u detí starších ako 12 mesiacov sa neskúmali (pozri časť 4.4). Ak sa dávka vynechá, liečba má pokračovať nasledujúcou dávkou ako obvykle. Pacientov treba
upozorniť, aby si do postihnutého oka (očí) nekvapkali pri každom podaní viac než jednu kvapku.
Deti mladšie ako 4 roky
Použitie lieku Verkazia sa netýka detí mladších ako 4 roky pri liečbe závažnej vernálnej keratokonjunktivitídy.
Dospelí
Účinok lieku Verkazia u pacientov starších ako 18 rokov sa neskúmal.
Pacienti s poruchou funkcie obličiek alebo pečene
Účinok lieku Verkazia sa neskúmal u pacientov s poruchou funkcie obličiek alebo pečene. V týchto populáciách však nie je potrebná osobitná úprava dávkovania.
Spôsob podávania
Podanie do oka
Opatrenia pred podaním lieku
Pacienti majú byť poučení, aby si najprv umyli ruky. Pred podaním sa má obsah fľaše opatrne pretrepať.
Pacienti majú byť poučení, aby použili nazolakrimálnu oklúziu a aby nechali zatvorené očné viečka počas 2 minút po podaní instilácie na zníženie systémovej absorpcie. To môže viesť k zníženiu systémových nežiaducich účinkov a zvýšeniu lokálneho účinku (pozri časť 4.4).
Ak sa používa viac než jeden lokálny oftalmologický liek, lieky sa musia podávať s odstupom aspoň 15 minút. Liek Verkazia sa má podať ako posledný (pozri časť 4.4).
Pacienti majú byť oboznámení so správnou manipuláciou s viacdávkovým obalom. Pokyny na použitie, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Očné alebo periokulárne malignity alebo premalígne stavy.
Aktívna alebo suspektná očná alebo periokulárna infekcia.
4.4 Osobitné upozornenia a opatrenia pri používaní
Kontaktnéšošovky
Pacienti, ktorí nosia kontaktné šošovky, sa neskúmali. Preto sa neodporúča použitie lieku Verkazia s kontaktnými šošovkami.
Súbežnáliečba
Súbežné podávanie lieku Verkazia s očnou instiláciou obsahujúcou kortikosteroidy môže zosilniť účinok lieku Verkazia na imunitný systém. V klinických štúdiách však 18 pacientov používalo liek Verkazia (4-krát denne) súbežne s očnými instiláciami obsahujúcimi kortikosteroidy, pričom
sa nezistilo zvýšenie rizika nežiaducich reakcií súvisiacich s imunitným systémom. Preto je pri súbežnom podávaní kortikosteroidov s liekom Verkazia potrebná opatrnosť (pozri časť 4.5).
Účinkynaimunitnýsystém
Oftalmologické lieky, ktoré ovplyvňujú imunitný systém vrátane cyklosporínu, môžu ovplyvniť obranné mechanizmy používateľa voči lokálnym infekciám a malignitám. Preto, keď sa liek Verkazia používa dlhšie ako 12 mesiacov, odporúča sa pravidelné vyšetrenie oka (očí), napr.
každé 3 až 6 mesiacov.
Liek Verkazia sa neskúmal u pacientov s aktívnou orofaciálnou infekciou zapríčinenou vírusom herpes simplex, s očným herpesom v anamnéze, s infekciou zapríčinenou vírusom varicella-zoster alebo vírusom vakcínie, a preto sa má u týchto pacientov používať s opatrnosťou.
Pomocnálátka
Liek Verkazia obsahuje cetalkóniumchlorid, ktorý môže spôsobiť podráždenie oka.
Trvanie
liečby
Účinnosť a bezpečnosť lieku Verkazia podávaného dlhšie ako 12 mesiacov sa neskúmali. Preto keď sa liek Verkazia používa dlhšie ako 12 mesiacov, odporúča sa pravidelné vyšetrenie oka (očí), napr.
každé 3 až 6 mesiacov.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s liekom Verkazia. Kombináciasinýmiliekmi,ktoréovplyvňujúimunitnýsystém
Súbežné podávanie lieku Verkazia s očnými instiláciami obsahujúcimi kortikosteroidy môže zosilniť účinky lieku Verkazia na imunitný systém. V klinických štúdiách však 18 pacientov používalo liek Verkazia (4-krát denne) súbežne s očnými instiláciami obsahujúcimi kortikosteroidy, pričom sa nezistilo zvýšenie rizika nežiaducich reakcií súvisiacich s imunitným systémom (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Ženyvofertilnomveku/antikoncepciaužien
Liek Verkazia sa neodporúča používať u žien vo fertilnom veku, ktoré nepoužívajú účinnú antikoncepciu.
Gravidita
Nie sú k dispozícii žiadne údaje o použití lieku Verkazia u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu po systémovom podaní cyklosporínu pri expozíciách považovaných za dostatočne vyššie, ako je maximálna expozícia u ľudí, čo poukazuje na malý význam týchto zistení pre klinické použitie lieku Verkazia.
Liek Verkazia sa neodporúča používať počas gravidity, ak potenciálny prínos pre matku neprevyšuje potenciálne riziko pre plod.
Dojčenie
Cyklosporín sa po perorálnom podaní vylučuje do ľudského mlieka. Nie sú dostatočné informácie o účinkoch cyklosporínu u novorodencov/dojčiat. Pri terapeutických dávkach cyklosporínu v očnej instilácii je však nepravdepodobné, že by sa do materského mlieka dostalo významné množstvo. Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu liekom Verkazia sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú k dispozícii žiadne údaje o účinkoch lieku Verkazia na fertilitu človeka.
U zvierat, ktoré dostávali intravenózny cyklosporín, nebolo hlásené zhoršenie fertility (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek Verkazia má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
Tento liek môže vyvolať dočasne rozmazané videnie alebo iné poruchy zraku, ktoré môžu ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje (pozri časť 4.8). Pacientov je potrebné upozorniť, aby neviedli vozidlá ani neobsluhovali stroje, kým sa im videnie neupraví.
4.8 Nežiaduce účinky
Súhrn
bezpečnostného
profilu
Najčastejšie nežiaduce reakcie v klinických skúšaniach s liekom Verkazia boli bolesť očí (11 %) a svrbenie očí (9 %), ktoré boli zvyčajne prechodné a vyskytli sa počas podávania instilácie.
TabuľkovýzoznamnežiaducichreakciíV klinických štúdiách sa pozorovali nasledujúce nežiaduce reakcie uvedené ďalej. Sú zoradené podľa triedy orgánových systémov a klasifikované podľa nasledujúceho pravidla: veľmi časté (³ 1/10), časté (³ 1/100 až < 1/10), menej časté (³ 1/1 000 až < 1/100), zriedkavé (³ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
Trieda orgánových systémov podľa databázy MedDRA
| Frekvencia podľa databázy MedDRA
| Nežiaduca reakcia
|
Infekcie a nákazy
| Časté
| Infekcia horných dýchacích ciest.
|
Menej časté
| Bakteriálna keratitída, očný herpes zoster.
|
Poruchy nervového systému
| Časté
| Bolesť hlavy.
|
Poruchy oka
| Veľmi časté
| Bolesť oka.
|
Časté
| Svrbenie oka, očná hyperémia, podráždenie oka, nepríjemný pocit v oku, pocit cudzieho telieska v očiach, zvýšené slzenie, rozmazané videnie, erytém očného viečka, edém očného viečka.
|
Menej časté
| Blefaritída, edém spojovky.
|
Poruchy dýchacej sústavy, hrudníka a mediastína'
| Časté
| Kašeľ.
|
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
PríloheV.
4.9 PredávkovanieLokálne predávkovanie po podaní do oka nie je pravdepodobné. Ak dôjde k predávkovaniu liekom
Verkazia, liečba má byť symptomatická a podporná.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: oftalmologiká, iné oftalmologiká, ATC kód: S01XA18.
MechanizmusúčinkuafarmakodynamickéúčinkyPo podaní do oka sa cyklosporín pasívne absorbuje T-lymfocytmi, kde sa naviaže na cyklofilín A, čím inaktivuje kalcineurín a zabráni translokácii NF-AT do jadra, a tak zablokuje uvoľňovanie prozápalových cytokínov, ako je IL-2 a aktiváciu T-lymfocytov. Zablokovanie NF-AT narúša tiež proces alergie. Cyklosporín inhibuje uvoľňovanie histamínu zo žírnych buniek a bazofilov znížením produkcie IL-5 a môže znížiť mobilizáciu eozinofilov a účinky na spojovku a rohovku. Je tiež známe, že cyklosporín reguluje uvoľňovanie protizápalových cytokínov smerom nahor. Zo všetkých
dostupných dôkazov vyplýva, že cyklosporín pôsobí špecificky a reverzibilne na lymfocyty a nepotláča krvotvorbu ani nemá žiadny vplyv na funkciu fagocytárnych buniek.
Klinickáúčinnosť
V 12-mesačnom dvojito maskovanom hlavnom klinickom skúšaní kontrolovanom vehikulom (štúdia VEKTIS) bolo 169 pacientov so závažnou VKC a závažnou keratitídou (4. alebo 5. stupeň na upravenej oxfordskej stupnici) randomizovaných do skupín so 4 kvapkami lieku Verkazia (vysoká dávka) alebo 2 kvapkami lieku Verkazia (nízka dávka) a 2 kvapkami vehikula alebo 4 kvapkami vehikula počas prvých 4 mesiacov (1. obdobie). Pacienti randomizovaní do skupiny s vehikulom prešli po 4 až 12 mesiacoch na liek Verkazia (štyrikrát alebo dvakrát denne) (2. obdobie).
Analýzy účinnosti zahŕňali 168 pacientov [127 detí (75,6 %) a 41 dospievajúcich (24,4 %)]. Priemerný vek bol 9,2 roka (SD: 3,3, vekový rozsah: 4-17 rokov). Na skúšaní sa zúčastnilo viac chlapcov [n
= 132 (78,6 %)] ako dievčat [n = 36 (21,4 %)].
Primárny cieľový ukazovateľ účinnosti, ktorým bola priemerná zmena skóre zafarbenia rohovky fluoresceínom (Corneal Fluorescein Staining, CFS) upraveného vzhľadom na nepriaznivé okolnosti v porovnaní s východiskovým bodom a v priebehu 1. obdobia, zahŕňal všetkých pacientov (n = 168). Účinnosť sa hodnotila každý mesiac počas obdobia liečby trvajúceho 4 mesiace a porovnávala sa s východiskovým stavom s použitím zloženého kritéria založeného na keratitíde posudzovanej pomocou upravenej oxfordskej stupnice, potreby záchranného lieku (použitie lokálnych steroidov) a výskytu ulcerácie rohovky.
Rozdiel v priemere najmenších štvorcov (LS) v porovnaní s vehikulom bol 0,76 (95 % IS: 0,26; 1,27) pre skupinu s vysokou dávkou a 0,67 (95 % IS: 0,16; 1,18) pre skupinu s nízkou dávkou. Obidva rozdiely boli štatisticky významné s hodnotou p = 0,007 pre skupinu s vysokou dávkou a p = 0,010 pre skupinu s nízkou dávkou.
Klinický význam primárneho cieľového ukazovateľa účinnosti však bolo ťažké zistiť. V tomto kontexte sa výsledky miery pacientov reagujúcich na liečbu považovali za spoľahlivejší cieľový ukazovateľ. Pacient reagujúci na liečbu bol definovaný ako pacient 1) s priemerným skóre CFS počas 4 mesiacov liečby ≤ 50 % východiskovej hodnoty, 2) ktorý neodstúpil zo štúdie z dôvodu pravdepodobne súvisiaceho s liečbou, 3) ktorý nemal skúsenosti s ulceráciou rohovky a 4) ktorý nepoužil záchranný liek za posledné 4 mesiace liečby. V obidvoch skupinách liečených aktívnym liekom sa vyskytoval významne vyšší počet CFS pacientov reagujúcich na liečbu v porovnaní so skupinou liečenou vehikulom (p = 0,005 pre skupinu s vysokou dávkou a p = 0,010 pre skupinu
s nízkou dávkou), pričom v skupine liečenej vysokou dávkou reagovalo na
liečbu 55,4 % pacientov, 50,0 % v skupine liečenej nízkou dávkou a 27,6 % v skupine, ktorá dostávala vehikulum. Nadmerná miera, pokiaľ ide o vehikulum, bola 27,8 % pre režim s vysokou dávkou
a 22,4 % pre režim s nízkou dávkou.
Záchranný liek (lokálne steroidy) sa použil častejšie v režime s vehikulom než v režime s vysokou dávkou: 32,1 % pacientov v skupine s vysokou dávkou a 31,5 % pacientov v skupine s nízkou dávkou dostalo aspoň jednu kúru záchranného lieku, zatiaľ čo v skupine s vehikulom to
bolo 53,4 % pacientov.
Všetky štyri symptómy (fotofóbia, slzenie, svrbenie a výtok zo sliznice) sa v priebehu času zlepšili a rozdiel v 4. mesiaci oproti začiatku v prípade každého symptómu väčšinou prekročil hodnotu 10 mm.
V prípade priemeru symptómov VKC bol rozdiel v priemere LS v porovnaní s vehikulom v skupine s vysokou dávkou štatisticky významný vo všetkých časových bodoch v porovnaní s vehikulom: -
19,4 mm (p < 0,05).
Kvalita života pacientov („Quick“ dotazník) sa zlepšila významne viac v skupine s vysokou dávkou v porovnaní so skupinou s vehikulom. Zlepšenie bolo klinicky významné, čo dokazuje veľkosť účinku v priebehu 4 mesiacov (oblasť symptómov: 0,67 a oblasť každodenných činností: 0,44).
Analýzy v 2. období preukázali stabilitu zlepšení dosiahnutých počas 1. obdobia v prípade obidvoch dávkových režimov.
5.2 Farmakokinetické vlastnosti
Neuskutočnili sa žiadne oficiálne farmakokinetické štúdie s liekom Verkazia u ľudí. Koncentrácia lieku Verkazia v krvi sa merala s použitím špecifického testu vysokotlakovou
kvapalinovou chromatografiou a hmotnostnou spektrometriou. U 166 pacientov vo východiskovom stave v jednej štúdii účinnosti (55 pacientov v skupine s vysokou dávkou, 53 pacientov v skupine s nízkou dávkou a 58 pacientov v skupine s vehikulom) sa plazmatické koncentrácie cyklosporínu merali pred podaním a po 2, 4 a 12 mesiacoch liečby.
V skupine s vysokou dávkou malo po 4 mesiacoch podávania očnej instilácie Verkazia 4-krát denne (n
= 50) 20 pacientov hodnoty nižšie ako dolný limit detekcie (0,050 ng/ml) a 13 pacientov malo hodnoty nižšie ako dolný limit kvantifikácie (0,100 ng/ml). Kvantifikovateľné hodnoty
nepresahujúce 0,670 ng/ml sa merali u 14 pacientov a hodnoty sa považovali za zanedbateľné.
Cyklosporinémia sa nemerala u 3 pacientov. Hodnoty v 12. mesiaci (n = 68 pacientov) boli nižšie ako dolný limit detekcie v prípade 38 pacientov a nižšie ako dolný limit kvantifikácie v
prípade 10 pacientov. Dvanásť pacientov malo merateľné hodnoty (maximálne 0,291 ng/ml) a všetky
hodnoty sa považovali za zanedbateľné. Cyklosporinémia sa nemerala u 8 pacientov.
V skupine s nízkou dávkou malo po 4 mesiacoch podávania očnej instilácie Verkazia 2-krát denne (n
= 47) 34 pacientov hodnoty nižšie ako dolný limit detekcie (0,050 ng/ml) a 7 pacientov malo hodnoty nižšie ako dolný limit kvantifikácie (0,100 ng/ml). Kvantifikovateľné hodnoty
nepresahujúce 0,336 ng/ml sa merali u 5 pacientov, pričom tieto hodnoty sa považovali za zanedbateľné. Cyklosporinémia sa nemerala u 1 pacienta. Hodnoty v 12. mesiaci (n = 61 pacientov) boli nižšie ako dolný limit detekcie v prípade 47 pacientov a nižšie ako dolný limit kvantifikácie v prípade 6 pacientov. Päť pacientov malo merateľné hodnoty (maximálne 0,300 ng/ml) a všetky hodnoty sa považovali za zanedbateľné. Cyklosporinémia sa nemerala u 3 pacientov.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, fototoxicity a fotoalergie, genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
Účinky v predklinických štúdiách sa pozorovali iba pri systémovom podaní alebo pri expozíciách považovaných za dostatočne vyššie, ako je maximálna expozícia u ľudí, čo poukazuje na malý význam týchto zistení pre klinické použitie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
triglyceridy so stredne dlhým reťazcom, cetalkóniumchlorid,
glycerol, tyloxapol, poloxamér 188,
hydroxid sodný (na úpravu pH),
voda na injekcie.
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky.
Po prvom otvorení fľaše: 4 týždne.
6.4 Špeciálne upozornenia na uchovávanie
Neuchovávajte v mrazničke. Uchovávajte pri teplote do 25 °C.
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Verkazia sa dodáva sterilná v bielej fľaši z polyetylénu s nízkou hustotou (9 ml náplň v 11 ml obale) a a bielej dýze s poistným systémom.
Balenie obsahujúce 1 fľašu.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Pokyny na použitie
Pred podaním očných kvapiek:
· Umyte si ruky a potom otvorte fľašu.
· Neužívajte tento liek, ak spozorujete, že poistné zapečatenie na hrdle fľaše je porušené pred prvým použitím.
· Pri prvom použití fľaše si pred podaním kvapky do oka nacvičte používanie fľaše pomalým stláčaním a podaním jednej kvapky mimo oka.
· Keď si už budete istý/á, že budete vedieť podávať po jednej kvapke, vyberte si pre vás najvhodnejšiu polohu na podávanie kvapiek (môžete sedieť, ležať na chrbte alebo stáť pred
zrkadlom).
· Po každom otvorením novej fľaše aktivujte fľašu kvapnutím jednej kvapky do odpadu.
Podanie:
1. Obsah fľaše opatrne pretrepte. Držte fľašu tesne pod vrchnákom a otvorte fľašu otočením vrchnáka. Aby nedošlo ku kontaminácii emulzie, špičkou fľaše sa ničoho nedotýkajte.
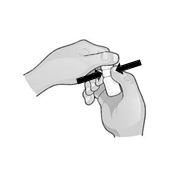
2. Zakloňte hlavu a držte fľašu nad okom.
3. Potiahnite si spodné očné viečko nadol a pozerajte sa nahor. Fľašu jemne stlačte v strede a počkajte, kým vám kvapne do oka kvapka. Upozorňujeme, že kvapka môže kvapnúť až niekoľko sekúnd po stlačení. Nestláčajte príliš silno.
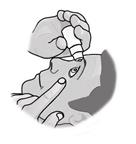
4. Zavrite oko a pritlačte prst do vnútorného očného kútika pri nose približne na dve minúty.
Zabránite tak tomu, aby sa liek dostal do ostatných častí tela.

5. Zopakujte 2. – 4. krok pokynov, aby ste si podali kvapku do druhého oka, ak vám to nariadil lekár. Niekedy je potrebné liečiť iba jedno oko a váš lekár vám povie, či to platí pre vás a ktoré oko potrebuje liečbu.
6. Po každom použití a pred opätovným nasadením vrchnáka sa má fľaša jedenkrát pretrepať smerom nadol bez toho, aby ste sa dotkli špičky kvapkadla, aby sa zo špičky odstránila zvyšková emulzia. Je nevyhnutné na zabezpečenie podania ďalších kvapiek.
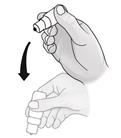
7. Utrite si prebytočnú emulziu na koži v okolí oka..
Na konci 4 týždňov použiteľnosti lieku môže vo fľaši zostať trochu emulzie. V žiadnom prípade nepoužívajte tento zvyšný liek, ktorý zostal vo fľaši po dokončení liečebného cyklu. Nepoužívajte očné kvapky dlhšie ako 4 týždne od prvého otvorenia fľaše.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIISanten Oy
Niittyhaankatu 20
33720 Tampere
Fínsko
8. REGISTRAČNÉ ČÍSLAEU/1/17/1219/005
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 6. júla 2018
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu
.