a počas aspoň 30 minút; 300 mg železa počas aspoň 1½ hodiny; 400 mg železa počas aspoň 2½ hodiny a 500 mg počas aspoň 3½ hodiny. Pre podanie maximálne tolerovanej jednotlivej dávky 7 mg železa / kg telesnej hmotnosti sa musí dodržať čas infúzie aspoň 3½ hodiny, nezávisle od celkovej dávky.
Pred podaním terapeutickej dávky pacientovi, ktorý ešte Venofer nedostal, sa má prvých 20 mg železa u dospelých a u detí s telesnou hmotnosťou vyššou ako 14 kg, a polovica dennej dávky (1,5 mg železa/kg) u detí s telesnou hmotnosťou nižšou ako 14 kg podať ako testovacia dávka infúziou v trvaní viac ako 15 minút. Ak sa neobjavia žiadne nežiaduce účinky, zvyšná časť infúznej dávky sa môže podať odporúčanou rýchlosťou.
Intravenózna injekcia: Venofer môže byť tiež podaný v nezriedenej forme pomalou intravenóznou injekciou (
zvyčajnou) odporúčanou rýchlosťou 1 ml Venoferu (20 mg železa) za minútu [5 ml Venoferu (100 mg železa) za najmenej 5 minút]. V jednej injekcii možno podať maximálne 10 ml Venoferu (200 mg železa).
Pred podaním terapeutickej dávky pacientovi, ktorý ešte Venofer nedostal, sa má 1 ml Venoferu (20 mg železa) u dospelých a u detí s telesnou hmotnosťou vyššou ako 14 kg, a polovica dennej dávky (1,5 mg železa/kg) u detí s telesnou hmotnosťou nižšou ako 14 kg podať ako testovacia dávka injekčne počas 1 až 2 minút. Ak sa neobjavia žiadne nežiaduce účinky počas 15 minút, zvyšná časť injekcie sa môže podať odporúčanou rýchlosťou. Po podaní injekcie sa má rameno pacienta rozpažiť.
Injekcia do dialyzéra: Venofer môže byť podaný priamo do venózneho ramena dialyzéra za rovnakých podmienok ako v prípade intravenóznej injekcie.
4.2.2. Dávkovanie Výpočet dávkovania:Dávkovanie musí byť prispôsobené individuálne na základe celkového deficitu železa a vypočíta sa podľa nasledujúcej rovnice:
Celkový deficit železa [mg] = Telesná hmotnosť [kg] x (cieľová hodnota Hb – aktuálna hodnota Hb) [g/l] x 0,24* +depot železa [mg]
Telesná hmotnosť do 35 kg: cieľová hodnota Hb = 130 g/l resp. depot železa =
15 mg/kg telesnej hmotnosti
Telesná hmotnosť and 35 kg: cieľová hodnota Hb = 150 g/l resp. depot železa =
500 mg
* Faktor 0,24 = 0,0034 x 0,07 x 1000 (Obsah železa v hemoglobíne @ 0,34% / objem krvi @ 7% telesnej hmotnosti / faktor 1000 = premena z g na mg)
Celkový obsah Venoferu, ktorý sa má podať (v ml) =
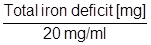
(1 ampulka alebo liekovka Venoferu zodpovedá 5 ml)
| Celkový počet ampuliek alebo liekoviek Venoferu, ktorý sa má podať:
|
Telesná hmotnosť [kg]
| Hb 60 g/l
| Hb 75 g/l
| Hb 90 g/l
| Hb 105 g/l
|
5
| 1,5
| 1,5
| 1,5
| 1
|
10
| 3
| 3
| 2,5
| 2
|
15
| 5
| 4,5
| 3,5
| 3
|
20
| 6,5
| 5,5
| 5
| 4
|
25
| 8
| 7
| 6
| 5,5
|
30
| 9,5
| 8,5
| 7,5
| 6,5
|
35
| 12,5
| 11,5
| 10
| 9
|
40
| 13,5
| 12
| 11
| 9,5
|
45
| 15
| 13
| 11,5
| 10
|
50
| 16
| 14
| 12
| 10,5
|
55
| 17
| 15
| 13
| 11
|
60
| 18
| 16
| 13,5
| 11,5
|
65
| 19
| 16,5
| 14,5
| 12
|
70
| 20
| 17,5
| 15
| 12,5
|
75
| 21
| 18,5
| 16
| 13
|
80
| 22,5
| 19,5
| 16,5
| 13,5
|
85
| 23,5
| 20,5
| 17
| 14
|
90
| 24,5
| 21,5
| 18
| 14,5
|
Ak celková potrebná dávka prevýši maximálnu povolenú jednotlivú dávku, podávanie lieku musí byť rozdelené. Ak sa do 1 až 2 týždňov nepozoruje odpoveď v hematologických parametroch, musí sa opätovne zvážiť správnosť pôvodnej diagnózy.
Výpočet dávkovania za účelom náhrady straty železa spôsobenej stratou krvi a za účelom podpory autológového darcovstva krvi: Požadovaná dávka Venoferu za účelom kompenzácie deficitu železa sa vypočíta podľa nasledujúcich rovníc:
· ak je stratené množstvo krvi známe: Podanie 200 mg i.v. železa (= 10 ml Venoferu) vedie k zvýšeniu hladiny hemoglobínu, čo zodpovedá 1 jednotke krvi (= 400 ml s obsahom 150 g/l Hb).
Železo, ktoré sa má nahradiť [mg] = počet
jednotiek stratenej krvi X 200 alebo
Potrebné množstvo Venoferu (ml) = počet
jednotiek stratenej krvi X 10
· ak je hladina Hb znížená: použite predchádzajúcu rovnicu s tým, že depot železa nemusí byť obnovený.
Železo, ktoré musí byť nahradené [mg] = telesná hmotnosť [kg] x 0,24 x[kg] x 0,24 x (cieľová hodnota Hb – aktuálna Hb) [g/l]
napr.: telesná hmotnosť 60 kg , deficit Hb = 10 g/l Þ železo, ktoré musí byť nahradené @ 150 mg Þ je potrebných 7,5 ml Venoferu
Normálne dávkovanie: Dospelí a deti:5-10 ml Venoferu (100 - 200 mg železa) jeden až tri razy za týždeň v závislosti na hladine hemoglobínu.
Deti:K dispozícii sú obmedzené údaje u detí za podmienok štúdie. Ak existuje klinická potreba, odporúča sa neprekračovať 0,15 ml Venoferu (3 mg železa) na kg telesnej hmotnosti jeden až trikrát za týždeň v závislosti od hladiny hemoglobínu.
Maximálna tolerovaná jednotlivá dávka: Dospelí a deti:Formou injekcie: 10 ml Venoferu (200 mg železa) podaných injekčne počas aspoň 10 minút.
Formou infúzie: Ak si to klinická situácia vyžadovala, boli podané dávky do 500 mg. Maximálna tolerovaná jednotlivá dávka je 7 mg železa / kg telesnej hmotnosti podaná jedenkrát za týždeň, ale nesmie prevyšovať 500 mg železa. Čas podávania a pomer zrieďovania nájdete v časti 4.2.1.
Vyšší výskyt nežiaducich reakcií (hlavne hypotenzie), ktoré môžu byť aj závažnejšie, súvisí s vyššími dávkami. Preto musia byť infúzne časy uvedené v časti 4.2.1 prísne dodržiavané, aj keď pacient nedostane maximálnu tolerovanú jednotlivú dávku.
4.3. KontraindikáciePoužitie Venoferu je kontraindikované v prípadoch:
· anémie, ktorá nie je spôsobená nedostatkom železa,
· preťaženia železom alebo porúch využitia železa,
· známej precitlivenosti na Venofer alebo na niektorú z jeho pomocných látok.
· v prvom trimestri gravidity.
4.4. Osobitné upozornenia a opatrenia pri používaníVenofer sa má podávať len v prípadoch, keď je indikácia potvrdená príslušnými vyšetreniami (napr. sérový feritín alebo hemoglobín (Hb), alebo hematokrit, alebo počet erytrocytov, alebo ukazovateľov červených krviniek – MCV, MCH, MCHC).
Parenterálne podávané prípravky železa môžu spôsobovať alergické alebo anafylaktické reakcie, ktoré môžu byť potenciálne letálne. V prípade miernej alergickej reakcie sa majú podať antihistaminiká; v prípade závažnej anafylaktickej reakcie sa musí okamžite podať adrenalín. K dispozícii musia byť prostriedky kardiopulmonálnej resuscitácie.
Pacientom s anamnézou astmy, ekzému, iných atopických alergií alebo alergických reakcií na iné parenterálne prípravky železa a u pacientov s nízkou väzbovou kapacitou železa a/alebo nedostatkom kyseliny listovej sa musí Venofer podávať s opatrnosťou, keďže sú títo zvlášť vystavení riziku alergickej reakcie. V štúdii s limitovaným počtom pacientov citlivých na dextran železa bolo dokázané, že im možno Venofer podávať bez komplikácií.
Venofer sa musí podávať s opatrnosťou pacientom s poškodením funkcie pečene.
Venofer sa musí použiť s opatrnosťou u pacientov s akútnou alebo chronickou infekciou, ktorí majú zvýšené hodnoty feritínu, keďže môže parenterálne podané železo nepriaznivo ovplyvniť bakteriálnu alebo vírusovú infekciu.
Ak sa injekcia podá príliš rýchlo, môžu sa objaviť epizódy hypotenzie.
Paravenóznemu úniku sa musí zabrániť, pretože únik Venoferu v mieste injekcie môže viesť k nekróze tkaniva a hnedému sfarbeniu kože. V prípade neúmyselného úniku mimo žilu môže pomôcť nasledujúca procedúra: Za účelom zrýchlenia eliminácie železa a zabránenia distribúcie železa čo najviac, ošetrite miesto injekcie topicky heparínom (gél alebo masť). Gél alebo masť nanášajte jemne. Nemasírujte.
4.5. Liekové a iné interakcieAko v prípade všetkých parenterálnych prípravkov, Venofer sa nesmie podať súbežne s perorálnymi prípravkami železa, keďže je absorpcia perorálne podávaného železa znížená. Preto sa perorálna liečba železom musí začať aspoň 5 dní po podaní poslednej injekcie.
4.6. Gravidita a laktáciaÚdaje o obmedzenom počte gravidných žien užívajúcich sacharózu železa nepreukázali žiadne nežiaduce účinky na graviditu alebo na zdravie plodu/novorodenca. V súčasnosti nie sú dostupné žiadne údaje z dobre kontrolovaných štúdií s gravidnými ženami. Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky na graviditu, embryonálny/fetálny vývoj , pôrod alebo postnatálny vývoj.
Vyžaduje sa však vyhodnotenie pomeru riziko/prospech.
Nie je pravdepodobné, že nemetabolizovaná sacharóza železa prestupuje do materského mlieka. Preto by Venofer nemal spôsobovať riziko pre dojčené dieťa.
4.7. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje Nie je pravdepodobné, že Venofer ovplyvňuje schopnosť viesť vozidlá a obsluhovať stroje.
4.8. Nežiaduce účinky Najčastejšie hlásené nežiaduce liekové reakcie (adverse drug reactions, ADRs) v klinických štúdiách s Venoferom boli prechodná zvrátenosť chute, hypotenzia, horúčka a triaška, reakcie v mieste podanie injekcie a nauzea. Tieto sa objavili u 0,5 až 1,5 % pacientov. Nezávažné anafylaktické reakcie sa objavili zriedkavo.
Vo všeobecnosti sú anafylaktické reakcie potenciálne najzávažnejšie nežiaduce reakcie (pozri “Osobitné upozornenia a opatrenia pri používaní” časť 4.4).
V klinických štúdiách boli hlásené nasledujúce nežiaduce liekové reakcie, dočasne súvisiace s podávaním Venoferu, s aspoň možným kauzálnym vzťahom:'
Poruchy nervového systémuČasté (vyskytujúce sa u aspoň 1, ale menej ako 10 pacientov zo 100): prechodná zvrátenosť chute (obzvlášť chuť kovu).
Menej časté (vyskytujúce sa u aspoň 1, ale menej ako 10 pacientov z 1000): bolesť hlavy; závraty.
Zriedkavé (vyskytujúce sa u aspoň 1, ale menej ako 10 pacientov z 10 000): parestézia, synkopa, strata vedomia, pocit pálenia.
Kardiovaskulárne poruchyMenej časté: hypotenzia a kolaps; tachykardia a palpitácie.
Zriedkavé: hypertenzia.
Ochorenia dýchacej sústavy, hrudníka a mediastínaMenej časté: bronchospazmus, dyspnoe
Poruchy a ochorenia gastrointestinálneho traktu Menej časté: nauzea; vracanie; bolesť brucha; hnačka.
Poruchy kože a podkožného tkanivaMenej časté: svrbenie; urtikária; vyrážky, exantém, erytém.
Poruchy kostrovej a svalovej sústavy, spojivového tkaniva a kostí Menej časté: kŕče svalov, myalgia.
Celkové ochorenia a reakcie v mieste podaniaMenej časté: horúčka, triaška, sčervenanie; bolesť a úzkosť na hrudi. Ochorenia a reakcie v mieste podania, ako sú flebitída, pálenie, opuch.
Zriedkavé: artralgia, ; periférny edém; únava, asténia; nevoľnosť, pocit horúčavy, edém.
Poruchy imunitného systémuZriedkavé: anafylaktoidné reakcie
Okrem toho sa v spontánnych hláseniach objavili nasledujúce nežiaduce reakcie:
Jednotlivé prípady: znížená hladina vedomia, pocit závratu, zmätenosť; angioedém; opuch kĺbov, hyperhidróza, bolesť chrbta, bradykardia, chromatúria.
4.9. PredávkovaniePredávkovanie môže spôsobiť akútne preťaženie železom, čo sa môže prejaviť ako hemosideróza. Predávkovanie možno liečiť podpornými metódami a ak je to potrebné, aj chelátom vychytávajúcim železo.
5. FARMAKOLOGICKÉ VLASTNOSTIPolynukleové jadrá železo(III)-hydroxidu sú na povrchu obklopené veľkým množstvom nekovalentne viazaných molekúl sacharózy, tvoriacich komplex s molekulovou hmotnosťou približne 43 kDa. Tento je dostatočne veľký na zabránenie eliminácie obličkami. Výsledný komplex je stabilný a za fyziologických podmienok neuvoľňuje iónové železo. Železo v polynukleovom jadre je viazané v podobnej štruktúre ako v prípade fyziologicky sa vyskytujúceho feritínu.
5.1. Farmakodynamické vlastnostiFarmakoterapeutická skupina: antianemikum
ATC kód: B03AC02
Ferokinetika Venoferu označeného
59Fe a
52Fe bola hodnotená u 6 pacientov s anémiou a chronickým zlyhaním obličiek. Plazmové klírens
52Fe bolo v rozpätí od 60 do 100 minút.
52Fe sa distribuoval do pečene, sleziny a kostnej drene. Po dvoch až štyroch týždňoch po podaní sa maximálna utilizácia
59Fe červenými krvinkami pohybovala v rozmedzí od 68 % do 97 %.
5.2. Farmakokinetické vlastnostiPo intravenóznej injekcii jednej dávky Venoferu s obsahom 100 mg železa zdravým dobrovoľníkom sa maximálne hladiny železa s priemernou hodnotou 538 mmol/l dosiahli 10 min po podaní injekcie. Distribučný objem centrálneho kompartmentu dobre zodpovedal objemu plazmy (približne 3 l).
Železo podané injekčne rýchlo vymizlo z plazmy, terminálny polčas bol približne 6 hod. Distribučný objem v ustálenom stave (steady-state) bol približne 8 l, čo naznačuje nízku distribúciu železa v telesných tekutinách. Vzhľadom na nízku stabilitu sacharózy železa v porovnaní s transferínom sa pozorovala kompetitívna výmena železa do transferínu. To viedlo k prechodu približne 31 mg železa / 24 hod.
Eliminácia železa obličkami v prvých 4 hodinách po podaní injekcie zodpovedá menej ako 5 % celkového telesného klírens. Po 24 hodinách poklesli hladiny železa v plazme na úroveň pred podaním dávky a asi 75 % dávky sacharózy sa vylúčilo.
5.3. Predklinické údaje o bezpečnostiPredklinické údaje na základe obvyklých štúdií toxicity po opakovanom podávaní, genotoxicity a reprodukčnej toxicity neodhalili žiadne osobitné riziko u zvierat.
6. FARMACEUTICKÉ INFORMÁCIE 6.1. Zoznam pomocných látokAqua pro injectione, natrii hydroxidum
6.2. InkompatibilityVenofer sa smie zmiešať len 0,9 % m/V roztokom NaCl. Žiadne iné intravenózne zrieďovacie roztoky a lieky sa nesmú použiť, keďže tu existuje možnosť tvorby zrazenín a/alebo interakcií. Kompatibilita s nádobami z materiálu iného ako sklo, polyetylén a PVC nie je známa.
6.3. Čas použiteľnosti3 roky.
Čas použiteľnosti po prvom otvorení balenia:Z mikrobiologického pohľadu sa produkt musí ihneď použiť.
Čas použiteľnosti po zriedení 0,9 % m/V roztokom chloridu sodného:Chemická a fyzikálna stabilita počas použitia bola dokázaná počas 12 hodín pri teplote miestnosti. Z mikrobiologického pohľadu sa produkt musí ihneď použiť. Ak sa ihneď nepoužije, časy skladovania počas používania a podmienky pred použitím sú zodpovednosťou používateľa a obyčajne nie sú dlhšie ako 3 hodiny pri teplote miestnosti, iba ak sa rozriedenie uskutočnilo v kontrolovaných a validovaných aseptických podmienkach.
6.4. Špeciálne upozornenia na uchovávanieUchovávajte pri teplote neprevyšujúcej 25 °C. Neuchovávajte v mrazničke. Uchovávajte v pôvodnom obale
6.5. Druh obalu a obsah baleniaAmpulky alebo liekovky z bezfarebného skla typu I s odoberateľným objemom 5 ml, plastové lôžko, písomná informácia pre používateľov, papierová škatuľka.
Veľkosť balenia: 5 x 5 ml, 50 x 5 ml a 100 x 5 ml
6.6. Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomAmpulky alebo liekovky musia byť pred použitím vizuálne skontrolované, či v nich nie je prítomný sediment a či nie sú poškodené. Použité môžu byť len ampulky alebo liekovky s homogénnym roztokom a bez sedimentu.
Pozri tiež časť 6.3 čas použiteľnosti.
Všetky nepoužité lieky alebo odpad vzniknutý z liekov majú byť zlikvidované v súlade s miestnymi požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIVifor France SA
7 – 13, Bd Paul Emile Victor
92200 Neuilly-sur-Seine
Francúzsko
8. REGISTRAČNÉ ČÍSLO12/0852/92-S
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE28.12.1992/
10. DÁTUM REVÍZIE TEXTUMáj 2011