kálne používa viac ako jeden očný liek, časový odstup medzi liekmi má byť aspoň 5 minút.
DetiBezpečnosť a účinnosť lieku u detí nebola stanovená. Preto sa UNILAT neodporúča používať u detí.
4.3 Kontraindikácie Precitlivenosť na liečivo (latanoprost) alebo na ktorúkoľvek z pomocných látok.
4.4 Osobitné upozornenia a opatrenia pri používaníUNILAT môže postupne meniť sfarbenie oka zvýšením množstva hnedého pigmentu v dúhovke. Pred začiatkom liečby musia byť pacienti informovaní o možnej trvalej zmene farby oka. Unilaterálna liečba môže viesť k trvalej heterochrómii.
Táto zmena farby oka sa pozorovala prevažne u pacientov, ktorí mali zmiešanú farbu dúhoviek ako je modro-hnedá, šedo-hnedá, zeleno-hnedá alebo žlto-hnedá. K zmene dochádza obvykle počas prvých 8 mesiacov liečby,
zriedkakedy neskôr. V klinických štúdiách sa počas 4 rokov pozoroval tento účinok na základe dôkazov z nadväzujúcich fotografií u 30 % všetkých pacientov. Táto zmena dúhovky bola mierna vo väčšine prípadov a často nebola klinicky pozorovaná. Incidencia u pacientov so zmiešaným sfarbením dúhoviek sa pohybovala od 7 do 85 %, u pacienov so žlto-hnedými dúhovkami bola incidencia vyššia.
U pacientov s homogénne modrými očami neboli pozorované žiadne zmeny a u pacientov s homogénne šedými, zelenými alebo hnedými očami boli zmeny pozorované len zriedka.
K zmene farby dochádza v dôsledku zvýšeného obsahu melanínu v stromálnych melanocytoch dúhovky, a nie kvôli zvýšenému počtu melanocytov. Typická je hnedá pigmentácia okolo zreníc, ktorá sa koncentricky šíri k periférii postihnutých očí, ale celá dúhovka alebo jej časti môžu byť viac hnedé. Po prerušení liečby sa nepozorovalo ďalšie zvýšenie hnedej pigmentácie dúhovky. Doposiaľ sa v klinických skúškach nezistilo spojenie so žiadnymi symptómami alebo patologickými zmenami.
Liečbou nie sú ovplyvnené ani pehy, ani névy na dúhovke. V klinických skúškach nebola pozorovaná akumulácia pigmentu v trabekulárnej sieťovine alebo na inom mieste v prednej komore.
Na základe klinických skúseností sa nepreukázalo, že zvýšená pigmentácia dúhovky má nejaké negatívne klinické následky. S podávaním UNILATu sa môže pokračovať aj v prípade pigmentácie dúhovky. Pacienti však musia byť pravidelne monitorovaní, a ak si to vyžaduje klinický stav, liečba UNILATom sa môže prerušiť.
Skúsenosti s používaním latanoprostu v prípade chronického glaukómu so zatvoreným uhlom, glaukómu s otvoreným uhlom u pseudofakických pacientov a u pacientov s pigmentovaným glaukómom sú limitované. S používaním latanoprostu v prípade zápalového a neovaskulárneho glaukómu, zápalových očných ochorení alebo kongenitálneho glaukómu nie sú skúsenosti. Latanoprost nemážiadny alebo len malý účinok na zrenicu, ale v prípade akútneho záchvatu pri glaukóme so zatvoreným uhlom skúsenosti nie sú. Preto sa odporúča v týchto prípadoch používať UNILAT s opatrnosťou, pokiaľ sa nezíska viac skúseností.
Skúsenosti s používaním latanoprostu v perioperačnom období pri chirurgickom zákroku na odstránenie katarakty sú obmedzené. UNILAT sa musí u týchto pacientov používať s opatrnosťou.
Vyskytli sa hlásenia o makulárnom edéme (pozri časť 4.8) hlavne u afakických pacientov, u pseudofakických pacientov s ruptúrou zadnej časti puzdra šošovky alebo šošovkami v prednej očnej komore, alebo u pacientov so známymi rizikovými faktormi cystoidného makulárneho edému (ako je diabetická retinopatia a oklúzia retinálnej cievy). UNILAT sa musí používať s opatrnosťou u afakických pacientov, u pseudofakických pacientov s ruptúrou zadnej časti puzdra šošovky alebo šošovkami v prednej očnej komore, alebo u pacientov so známymi rizikovými faktormi cystoidného makulárneho edému (pozri časť 4.8).
U pacientov so známou predispozíciou rizikových faktorov na iritídu/uveitídu sa UNILAT musí používať s opatrnosťou.
Skúsenosti u pacientov s astmou sú obmedzené, ale v postmarketingových štúdiách boli hlásené prípady zhoršenia astmy a/alebo dyspnoe. Preto musia byť astmatickí pacienti liečení s opatrnosťou, pokiaľ nebudú k dispozícii dostatočné skúsenosti (pozri časť 4.8).
Pozorovali sa zmeny sfarbenia periorbitálnej pokožky, väčšina hlásení bola u japonských pacientov. Súčasné skúsenosti ukazujú, že zmeny sfarbenia periorbitálnej pokožky nie sú trvalé a v niektorých prípadoch vymiznú počas pokračovania liečby latanoprostom.
Latanoprost môže postupne meniť očné riasy a jemné chĺpky u liečeného oka a okolitých oblastí, pričom tieto zmeny zahŕňajú väčšiu dĺžku, hrúbku, pigmentáciu, počet rias alebo vlasov a nesprávny rast očných rias. Tieto zmeny sú reverzibilné po prerušení liečby.
UNILAT obsahuje benzalkóniumchlorid, ktorý sa používa ako konzervant v oftalmologických liekoch. Bolo hlásené, že benzalkóniumchlorid spôsobil bodovú keratopatiu a/alebo toxickú ulceróznu keratopatiu, môže spôsobiť podráždenie očí a sfarbiť mäkké kontaktné šošovky. Pozorné sledovanie je potrebné pri častom alebo dlhodobom užívaní UNILATu u pacientov so suchými očami, alebo v podmienkach, keď je oslabená rohovka. Kontaktné šošovky môžu absorbovať benzalkóniumchlorid a preto ich vyberte pred podaním UNILATu, ale môžu byť opäť nasadené po 15 minútach (pozri časť 4.2).
4.5 Liekové a iné interakcieKonečné údaje o liekových interakciách nie sú k dispozícii.
Boli hlásené paradoxné zvýšenia vnútroočného tlaku po súbežnom očnom podaní dvoch analógov prostaglandínov. Preto sa použitie dvoch alebo viacerých prostaglandínov, analógov prostaglandínov alebo derivátov prostaglandínov neodporúča.
4.6 Gravidita a laktáciaGraviditaBezpečnosť použitia lieku počas gravidity u ľudí nebola stanovená. Má potenciálne rizikové farmakologické účinky na priebeh gravidity, na plod a novorodenca (pozri časť 5.3). A preto by sa UNILAT nemal používať počas gravidity.
LaktáciaLatanoprost a jeho metabolity môžu prechádzať do materského mlieka, a preto sa UNILAT nesmie používať u dojčiacich žien alebo sa dojčenie musí ukončiť.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeTak ako pri iných očných liekoch, instilácia očných kvapiek môže spôsobiť prechodné neostré videnie.
4.8 Nežiaduce účinkyVäčšina pozorovaných nežiaducich účinkov súvisela s očným systémom. V 5 ročnej otvorenej štúdii bezpečnosti latanoprostu sa u 33 % pacientov vyvinula pigmentácia dúhovky (pozri časť 4.4). Ostatné očné vedľajšie účinky sú zvyčajne prechodné a vznikajú v závislosti od dĺžky podávania.
Nežiaduce účinky sú rozdelené podľa nasledujúcich početností:
veľmi časté (
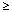
1/10),
časté (
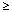
1/100 až < 1/10),
menej časté (
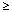
1/1000 až < 1/100),
zriedkavé (
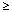
1/10 000 až < 1/1000),
veľmi zriedkavé (< 1/10 000) a neznáme (z dostupných údajov).
Frekvencie hlásených postmarketingových prípadov nie sú známe.
Poruchy okaVeľmi časté: zvýšená pigmentácia dúhovky, mierna až stredne závažná konjunktiválna hyperémia, podráždenie oka (pálenie, pocit piesku v očiach, svrbenie, pichanie a pocit cudzieho telieska v oku); zmeny očných rias a jemných chĺpkov (predĺženie, zhrubnutie, stmavnutie, zvýšenie počtu rias) (prevažná väčšina hlásení u japonskej populácie).
Časté: prechodné bodkovité epitelové erózie, väčšinou bez symptómov, blefaritída, bolesť oka.
Menej časté: edém viečka, suché oči, keratitída; rozmazané videnie, konjunktivitída.
Zriedkavé: iritída, uveitída (väčšina hlásení u pacientov so známou predispozíciou rizikových faktorov); makulárny edém; symptomatický korneálny edém a erózia; periorbitálny edém; zlým smerom rastúce očné riasy spôsobujúce podráždenie oka; dvojitý ciliárny rad pri otvorení Meibomových žľiaz (distichiáza).
Poruchy srdca a srdcovej činnostiVeľmi zriedkavé: zhoršenie angíny pectoris u pacientov s existujúcim ochorením.
Poruchy dýchacej sústavy, hrudníka a mediastinaZriedkavé: astma, zhoršenie astmy a dyspnoe
Poruchy kože a podkožného tkanivaMenej časté: kožná vyrážka
Zriedkavé: lokalizované kožné reakcie na očných viečkach; stmavnutie palbebrálnej kože očných viečok.
Celkové poruchy a reakcie v mieste podaniaVeľmi zriedkavé: bolesť v hrudníku
Dodatočné postmarketingové hlásenia:Poruchy nervového systémubolesť hlavy, závraty
Poruchy srdca a srdcovej činnosti:palpitácie
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva: myalgia; artralgia
4.9 PredávkovanieOkrem podráždenia oka a konjunktiválnej hyperémie nie sú známe žiadne iné očné nežiaduce účinky pri predávkovaní latanoprostom.
V prípade náhodného prehltnutia UNILATu môžu byť užitočné nasledujúce informácie:
jedna fľaša obsahuje 125 mikrogramov latanoprostu. Viac ako 90 % sa metabolizuje počas prvého prechodu pečeňou. Intravenózna infúzia dávky 3 mg/kg u zdravých dobrovoľníkov nevyvolala žiadne symptómy, ale dávka 5,5 ‑ 10 mg/kg spôsobila nauzeu, bolesti brucha, závraty, únavu, návaly horúčavy a potenie. U opíc sa podával latanoprost intravenóznou infúziou v dávkach do 500 mg/kg bez výrazných účinkov na kardiovaskulárny systém.
Intravenózne podanie latanoprostu u opíc bolo spojené s prechodnou bronchokonstrikciou. Avšak u pacientov so stredne ťažkou bronchiálnou astmou latanoprost podaný lokálne do očí v dávke zodpovedajúcej 7‑násobku klinickej dávky latanoprostunevyvolal bronchokonstrikciu.
V prípade predávkovania UNILATom má byť liečba symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antiglaukomatiká a miotiká/prostaglandínové analógy
ATC kód: S01EE01
Liečivo latanoprost, analóg prostaglandínu F
2a, je selektívny agonista prostaglandínového FP receptora, ktorý znižuje vnútroočný tlak zvýšením odtoku komorového moku. Zníženie vnútroočného tlaku u ľudí sa začína asi 3 - 4 hodiny po podaní a maximálny účinok sa dosahuje po 8 - 12 hodinách. Zníženie tlaku pretrváva najmenej počas 24 hodín.
Štúdie u zvierat a u ľudí dokazujú, že hlavným mechanizmom účinku je zvýšenie uveosklerálneho odtoku, hoci u ľudí boli hlásené údaje o miernom zvýšení kapacity odtoku (zníženie odtokovej rezistencie).
Pivotné štúdie dokázali, že latanoprost je účinný v monoterapii. Boli uskutočnené ďalšie klinické skúšky zamerané na použitie v kombinácii. Patria sem aj štúdie, ktoré dokazujú, že latanoprost je účinný v kombinácii s beta-blokátormi (timolol). Krátkodobé štúdie (1 alebo 2 týždne) ukazujú, že účinok latanoprostu je aditívny v kombinácii s adrenergnými agonistami (dipivefrín), perorálnymi inhibítormi karboanhydrázy (acetazolamid) a prinajmenšom čiastočne aditívny s cholinergnými agonistami (pilokarpín).
Klinické skúšky dokázali, že latanoprost nemá významný účinok na produkciu komorového moku. Nepreukázal sa vplyv latanoprostu na hematookulárnu bariéru.
Pri použití klinickej dávky u študovaných opíc latanoprost nemá žiadne alebo len zanedbateľné účinky na vnútroočnú cirkuláciu krvi. Avšak počas lokálnej liečby sa môže vyskytnúť mierna až stredne ťažká konjunktiválna alebo episklerálna hyperémia.
Chronická liečba latanoprostom u opíc, ktoré podstúpili extrakapsulárnu extrakciu šošovky, neovplyvňovala retinálne krvné cievy, čo sa dokázalo fluoresceínovou angiografiou.'
Počas krátkodobej liečby u ľudí latanoprost nevyvolával únik fluoresceínu do zadného segmentu pseudofakických očí.
Zistilo sa, že latanoprost v klinických dávkach nemá signifikantné farmakologické účinky na kardiovaskulárny alebo respiračný systém.
5.2 Farmakokinetické vlastnostiLatanoprost (molekulárna hmotnosť 432,58) je izopropylesterový prekurzor, ktorý je po podaní
per se inaktívny, ale po hydrolýze na kyselinu latanoprostu sa stáva biologicky aktívny.
Prekurzor sa dobre absorbuje cez rohovku a všetko liečivo, ktoré vstupuje do komorového moku sa hydrolyzuje počas prechodu rohovkou.
Štúdie u ľudí ukazujú, že maximálna koncentrácia v komorovom moku sa dosahuje asi o 2 hodiny po lokálnom podaní. Po lokálnom podaní u opíc sa latanoprost primárne distribuuje do predného segmentu, spojoviek a do očných viečok. Len malé množstvo lieku sa dostane do zadného segmentu.
Kyselina latanoprostu sa prakticky v očiach nemetabolizuje. Ukázalo sa, že hlavné miesto metabolizmu je pečeň. Plazmatický polčas u ľudí je 17 minút. Hlavné metabolity, 1,2-dinor- a 1,2,3,4-tetranorové metabolity, nevykazujú žiadnu alebo len slabú biologickú aktivitu v štúdiách na zvieratách a vylučujú sa predovšetkým močom.
5.3 Predklinické údaje o bezpečnostiOčná aj systémová toxicita latanoprostu bola skúmaná u niekoľkých živočíšnych druhov. Vo všeobecnosti je latanoprost dobre tolerovaný a dávka spôsobujúca systémovú toxicitu je 1000-krát vyššia ako bežná klinická dávka. Ukázalo sa, že vysoké dávky latanoprostu, približne 100-násobok klinickej dávky/kg telesnej hmotnosti, podávané intravenózne opiciam bez anestézy, spôsobujú zvýšenie respiračnej frekvencie pravdepodobne v dôsledku krátkotrvajúcej bronchokonstrikcie. V štúdiách na zvieratách sa neukázalo, že by mal latanoprost alergizujúce vlastnosti.
Nepozorovali sa očné toxické účinky pri dávkach do 100 mg/oko/deň u králikov alebo u opíc (klinická dávka je približne 1,5 mg/oko/deň). Avšak ukázalo sa, že latanoprost u opíc indukuje zvýšenú pigmentáciu dúhovky. Mechanizmus zvýšenej pigmentácie sa pripisuje stimulácii produkcie melanínu v melanocytoch dúhovky bez pozorovania proliferatívnych zmien. Zmena farby dúhovky môže byť trvalá.
Štúdie chronickej očnej toxicity dokázali, že podávanie latanoprostu v dávke 6 mg/oko/deň indukovalo zväčšenie očnej štrbiny. Tento účinok je reverzibilný a vyskytuje sa pri dávkach presahujúcich úroveň klinickej dávky. Tento účinok nebol pozorovaný u ľudí.
Ukázalo sa, že latanoprost má negatívne výsledky reverzných mutačných testov u baktérií, génového mutačného testu u lymfómu myší a mikronukleálneho testu u myší. Chromozomálne aberácie boli pozorované v humánnych lymfocytoch
in vitro. Podobné účinky boli pozorované pri prirodzene sa vyskytujúcom prostaglandíne F
2a a ukazuje sa, že ide o tzv „class efect“.
Ďalšie štúdie na mutagenitu s
in vitro/in vivo mimoriadnou DNA syntézou u potkanov boli negatívne a dokazujú, že latanoprost nemá mutagénnu toxicitu. Štúdie na karcinogenitu u myší a potkanov boli negatívne.
V štúdiách u zvierat sa nezistil žiadny účinok latanoprostu na fertilitu samcov alebo samičiek. V štúdii embryotoxicity u potkanov nebola pozorovaná embryotoxicita pri intravenóznych dávkach (5, 50 a 250 mg/kg/deň) latanoprostu. Avšak dávky latanoprostu 5 mg/kg/deň a viac indukovali embryoletálne účinky u králikov.
Dávka 5 mg/kg/deň (približne 100-násobok klinickej dávky) spôsobila preukázanú embryofetálnu toxicitu charakterizovanú zvýšeným výskytom neskorej resorpcie plodu a potratov ako aj nižšej hmotnosti plodu.
Teratogénny potenciál sa nezistil.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokchlorid sodný
roztok benzalkóniumchloridu
monohydrát dihydrogénfosforečnanu sodného, E339a
bezvodý hydrogénfosforečnan disodný, E339b
kyselina chlorovodíková na úpravu pH,
hydroxid sodný na úpravu pH,
voda na injekciu
6.2 InkompatibilityŠtúdie
in vitro ukázali, že ak sa latanoprost kombinuje s očnými instiláciami obsahujúcimi tiomerzal, dochádza ku precipitácii. Pri použití takýchto liekov má byť časový odstup medzi podaním jednotlivých očných instilácií aspoň päť minút.
6.3 Čas použiteľnostiČas použiteľnosti: 18 mesiacov
Čas použiteľnosti po prvom otvorení fľaštičky: 28 dní
6.4 Špeciálne upozornenia na uchovávaniePred prvým otvorením: uchovávajte v chladničke pri teplote (2ºC - 8ºC ). Neuchovávajte v mrazničke. Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Po prvom otvorení: uchovávajte pri teplote neprevyšujúcej 25 °C.
Liek nepoužívajte dlhšie ako 28 dní od prvého otvorenia.
6.5 Druh obalu a obsah balenia Polyetylénová fľaštička s kvapkadlom, polypropylénový uzáver so závitom a bezpečnostným prúžkom z polyetylénu, etiketa. Fľaštičky sa balia do papierových skladačiek spolu s písomnou informáciou pre používateľa lieku.
Jedna fľaštička obsahuje 2,5 ml očnej roztokovej instilácie, čo zodpovedá približne 80 kvapkám roztoku.
Veľkosť balenia: 1 x 2,5 ml,
3 x 2,5 ml
Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomLieky sa nesmú likvidovať odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIUNIMED PHARMA spol. s r.o. Oriešková11, 821 05, BRATISLAVA, Slovenská republika
8. REGISTRAČNÉ <
ČÍSLO> <
ČÍSLA>
64/0542/09-S
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTU