
patriť katarakta, glaukóm alebo zriedkavé ochorenia, ako je napríklad centrálna serózna chorioretinopatia (CSCR), ktoré boli hlásené po použití systémových a lokálnych kortikosteroidov.
4.5 Liekové a iné interakcie
Farmakokinetické interakcie
Vzhľadom na to, že glykopyrónium sa vylučuje prevažne obličkami, k liekovým interakciám by
mohlo dôjsť v prípade liekov ovplyvňujúcich mechanizmy renálneho vylučovania (pozri časť 5.2). Účinok inhibície transportu organických katiónov (s použitím cimetidínu ako skúšobného inhibítora transportérov OCT2 a MATE1) v obličkách preukázal vplyv na dispozíciu inhalovaného glykopyrónia v dôsledku súbežného podania cimetidínu a to malé zvýšenie celkovej systémovej expozície (AUC0-t) pre glykopyrónium o 16 % a mierne zníženie obličkového klírensu o 20 %.
Beklometazón je menej závislý od metabolizmu CYP3A než niektoré iné kortikosteroidy a interakcie zvyčajne nie sú pravdepodobné; možnosť systémových účinkov pri súbežnom použití silných inhibítorov CYP3A (napr. ritonavir, kobicistát) sa však nemôže vylúčiť, a preto sa pri použití takýchto liekov odporúča obozretnosť a príslušné sledovanie.
Farmakodynamické interakcie
Interakcie súvisiace s formoterolom
U pacientov užívajúcich inhalačný formoterol sa treba vyhnúť podávaniu nekardioselektívnych beta-blokátorov (vrátane očných kvapiek). Ak je ich podávanie nevyhnutné, účinok formoterolu sa zníži alebo zruší.
Súbežné podávanie iných beta-adrenergných liekov môže mať potenciálne aditívne účinky, preto ak sú súbežne s formoterolom predpísané aj iné beta-adrenergné lieky, je potrebná opatrnosť.
Pri súbežnej liečbe chinidínom, dizopyramidom, prokaínamidom, antihistaminikami, inhibítormi monoaminooxidázy, tricyklickými antidepresívami a fenotiazínmi môže dôjsť k predĺženiu intervalu QT a zvýšeniu rizika vzniku ventrikulárnych arytmií. Okrem toho L-dopa, L-tyroxín, oxytocín
a alkohol môžu zhoršiť toleranciu srdca voči beta2-sympatomimetikám.
Súbežná liečba inhibítormi monoaminooxidázy vrátane liekov s podobnými vlastnosťami, ako je furazolidon a prokarbazín, môže vyvolať hypertenzné reakcie.
U pacientov, ktorým sa súbežne podáva anestézia halogénovými uhľovodíkmi, je zvýšené riziko vzniku arytmií.
Pri súbežnej liečbe s derivátmi xantínu, so steroidmi alebo s diuretikami sa môže zosilniť možný hypokaliemický účinok beta2-agonistov (pozri časť 4.4). Hypokaliémia môže u pacientov liečených digitalisovými glykozidmi zvýšiť predispozíciu ku vzniku arytmií.
Interakcie súvisiace s glykopyróniom
Dlhodobé súbežné podávanie lieku Trydonis s inými anticholinergnými liekmi sa neskúmalo, a preto sa neodporúča (pozri časť 4.4).
Pomocné látky
Liek Trydonis obsahuje malé množstvo etanolu. U obzvlášť citlivých pacientov užívajúcich disulfiram
alebo metronidazol existuje teoreticky možnosť interakcie.
4.6 Fertilita, gravidita a laktácia
Neexistujú žiadne skúsenosti alebo dôkazy o otázkach bezpečnosti pri používaní hnacieho plynu norflurán (HFA134a) počas gravidity alebo laktácie u ľudí. Štúdie o účinku HFA134a na reprodukčnú funkciu a embryofetálny vývoj však u zvierat neodhalili žiadne klinicky významné nežiaduce účinky.
Gravidita
Nie sú k dispozícii alebo je dostupné iba obmedzené množstvo údajov o použití lieku Trydonis
u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). O glukokortikoidoch je známe, že majú účinky v skorej fáze tehotenstva, zatiaľ čo beta2-sympatomimetiká ako formoterol majú tokolytické účinky. Preto ako preventívne opatrenie je vhodnejšie vyhnúť sa používaniu lieku Trydonis počas gravidity a počas pôrodu.
Liek Trydonis sa má používať počas gravidity len v prípade, že očakávaný prínos pre pacientku prevyšuje potenciálne riziko pre plod. Dojčatá a novorodenci matiek, ktoré užívali vysoké dávky lieku Trydonis, sa májú sledovať pre možný výskyt adrenálnej supresie.
Dojčenie
O použití lieku Trydonis počas dojčenia u ľudí neexistujú žiadne relevantné klinické údaje.
Glukokortikoidy sa vylučujú do ľudského mlieka. Možno predpokladať, že beklometazóndipropionát a jeho metabolity sa tiež vylučujú do materského mlieka.
Nie je známe, či formoterol alebo glykopyrónium (vrátane jeho metabolitov) prechádzajú do ľudského mlieka, ale boli zaznamenané v mlieku dojčiacich zvierat. Anticholinergiká ako glykopyrónium môžu potlačiť laktáciu.
Rozhodnutie, či ukončiť dojčenie alebo či ukončiť/prerušiť liečbu liekom Trydonis sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
S liekom Trydonis neboli vykonané žiadne špecifické štúdie týkajúce sa bezpečnosti vo vzťahu
k ľudskej plodnosti. Štúdie na zvieratách preukázali zhoršenie fertility (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek Trydonis nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať
stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Najčastejšie hlásenými nežiaducimi reakciami na liek Trydonis boli orálna kandidóza (vyskytla sa
u 0,8 % liečených pacientov), ktorá zvyčajne súvisí s inhalačnými kortikosteroidmi, svalové kŕče
(0,4 %), ktoré možno pripísať zložke dlhodobo pôsobiacich beta2-agonistov, sucho v ústach (0,4 %),
čo je typickým anticholinergným účinkom.
Tabuľkový súhrn nežiaducich reakcií
Program klinického vývoja lieku Trydonis sa vykonával u pacientov so stredne závažnou, závažnou
alebo s veľmi závažnou CHOCHP. Celkovo bolo v štúdiách liečených 3 346 pacientov s opakovanými dávkami beklometazóndipropionátu/dihydrát formoteroliumfumarátu/glykopyrónia
87 mikrogramov/5 mikrogramov/9 mikrogramov v cieľovom dávkovacom režime (dve inhalácie dvakrát denne).
Frekvencia výskytu nežiaducich reakcií je definovaná podľa nasledovnej konvencie: veľmi časté
(≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až
< 1/1 000), veľmi zriedkavé (< 1/10 000) a neznáme (z dostupných údajov).
Trieda orgánových systémov podľa databázy MedDRA
|
Nežiaduca reakcia
|
Frekvencia
|
Infekcie a nákazy
|
pneumónia (u CHOCHP pacientov), faryngitída, orálna kandidóza, infekcia močových ciest1, nazofaryngitída1
|
časté
|
influenza1, orálna plesňová infekcia, orofaryngeálna kandidóza, ezofageálna kandidóza1, sinusitída1, rinitída1, gastroenteritída1, vulvovaginálna kandidóza1
|
menej časté
|
infekcia dolných dýchacích ciest (plesňová)
|
zriedkavé
|
Poruchy krvi
a lymfatického systému
|
granulocytopénia1
|
menej časté
|
trombocytopénia1
|
veľmi
zriedkavé
|
Poruchy imunitného systému
|
alergická dermatitída1
|
menej časté
|
reakcie z precitlivenosti vrátane erytému, opuchu pier, tváre, očí a hltana
|
zriedkavé
|
Poruchy endokrinného systému
|
adrenálna supresia1
|
veľmi
zriedkavé
|
Poruchy metabolizmu a výživy
|
hypokaliémia, hyperglykémia
|
menej časté
|
znížená chuť do jedla
|
zriedkavé
|
Psychické poruchy
|
nepokoj1
|
menej časté
|
psychomotorická hyperaktivita1, poruchy spánku1, úzkosť, depresia1, agresivita1, zmeny v správaní (najmä u detí)1
|
neznáme
|
insomnia
|
zriedkavé
|
Poruchy nervového systému
|
bolesť hlavy
|
časté
|
tremor, závrat, dysgeúzia1, hypoestézia1
|
menej časté
|
hypersomnia
|
zriedkavé
|
Poruchy oka
|
rozmazané videnie (pozri tiež časť 4.4)
|
neznáme
|
glaukóm1, katarakta1
|
veľmi
zriedkavé
|
Poruchy ucha a labyrintu
|
zápal Eustachovej trubice1
|
menej časté
|
Poruchy srdca a srdcovej
činnosti
|
fibrilácia predsiení, predĺženie intervalu QT na EKG, tachykardia, tachyarytmia1, palpitácie
|
menej časté
|
angina pectoris (stabilizovaná1 a nestabilizovaná), ventrikulárne extrasystoly1, nodálny rytmus, sínusová bradykardia
|
zriedkavé
|
Poruchy ciev
|
hyperémia1, nával krvi1, hypertenzia
|
menej časté
|
extravazácia krvi
|
zriedkavé
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
dysfónia
|
časté
|
kašeľ, produktívny kašeľ1, podráždenie hrdla, epistaxa1
|
menej časté
|
paradoxný bronchospazmus1, orofaryngeálna bolesť,
faryngeálny erytém, faryngeálny zápal, sucho v hrdle
|
zriedkavé
|
dyspnoe1
|
veľmi
zriedkavé
|
Poruchy gastrointestinálneho traktu
|
hnačka1, sucho v ústach, dysfágia1, nauzea,dyspepsia1, pálenie pier1, zubný kaz1, (aftózna) stomatitída
|
menej časté
|
Poruchy kože
a podkožného tkaniva
|
vyrážka1, urtikária1, pruritus, hyperhidróza1
|
menej časté
|
angioedém1
|
zriedkavé
|
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
|
svalové kŕče, myalgia, bolesť končatín1, muskuloskeletálna bolesť hrudníka1
|
menej časté
|
spomalenie rastu1
|
veľmi
zriedkavé
|
Poruchy obličiek
a močových ciest
|
dyzúria, retencia moču, nefritída1
|
zriedkavé
|
Trieda orgánových systémov podľa databázy MedDRA
|
Nežiaduca reakcia
|
Frekvencia
|
Celkové poruchy a reakcie v mieste podania
|
únava1
|
menej časté
|
asténia
|
zriedkavé
|
periférny edém1
|
veľmi
zriedkavé
|
Laboratórne a funkčné
vyšetrenia
|
zvýšená hladina C-reaktívneho proteínu1, zvýšený počet trombocytov1, zvýšená hladina voľných mastných kyselín1, zvýšená hladina inzulínu v krvi1, zvýšená hladina ketolátok v krvi1, znížená hladina kortizolu1
|
menej časté
|
zvýšený krvný tlak1, znížený krvný tlak1
|
zriedkavé
|
znížená hustota kostí1
|
veľmi
zriedkavé
|
1 Nežiaduce reakcie uvedené v súhrne charakteristických vlastností lieku pre aspoň jednu zo zložiek lieku, ktoré sa však nepozorovali ako nežiaduce reakcie pri klinickom vývoji lieku Trydonis.
V rámci pozorovaných nežiaducich reakcií sa nasledovné nežiaduce reakcie zvyčajne spájajú s nasledovnými zložkami:
BeklometazóndipropionátPneumónia, orálne plesňové infekcie, plesňová infekcia dolných dýchacích ciest , dysfónia, podráždenie hrdla, hyperglykémia, psychické poruchy, znížená hladina kortizolu, rozmazané videnie.
FormoterolHypokaliémia, hyperglykémia, tremor, palpitácie, svalové kŕče, predĺženie intervalu QT na EKG, zvýšený krvný tlak, znížený krvný tlak, fibrilácia predsiení, tachykardia, tachyarytmia, angina pectoris (stabilizovaná a nestabilizovaná), ventrikulárne extrasystoly, nodálny rytmus.
GlykopyróniumGlaukóm, fibrilácia predsiení, tachykardia, palpitácie, sucho v ústach, zubný kaz, dyzúria, retencia
moču, infekcia močových ciest.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
národné
|
centrum
|
hlásenia
|
uvedené
|
|
|
akékoľvek podozrenia na nežiaduce reakcie na
v Prílohe V.
4.9 Predávkovanie
Predávkovanie liekom Trydonis môže vyvolať prejavy a príznaky v dôsledku účinkov jednotlivých zložiek, vrátane prejavov a príznakov pozorovaných pri predávkovaní inými beta2-agonistmi alebo anticholinergikami a totožnými so známymi účinkami skupiny inhalačných kortikosteroidov (pozri časť 4.4). V prípade, že dôjde k predávkovaniu, pacientove príznaky sa majú podporne liečiť a podľa potreby náležite sledovať.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiastmatiká, sympatomimetiká v kombinácii s anticholinergikami vrátane trojkombinácií s kortikosteroidmi, ATC kód: R03AL09.
Mechanizmus účinku a farmakodynamické účinky
Liek Trydonis obsahuje beklometazóndipropionát, formoterol a glykopyrónium vo forme roztoku,
výsledkom čoho je extra jemný aerosól so strednou hodnotou aerodynamického priemeru častíc (mass median aerodynamic diameter, MMAD) približne 1,1 mikrometrov a spoločnou depozíciou troch zložiek. Aerosólové častice lieku Trydonis sú v priemere oveľa menšie ako častice podávané prípravkami, ktoré nie sú označené ako extra jemné. V prípade beklometazóndipropionátu to má za následok silnejší účinok ako v prípade prípravkov s distribúciou častíc, ktoré nie sú extra jemné
(100 mikrogramov extra jemného beklometazóndipropionátu v lieku Trydonis klinicky zodpovedá
250 mikrogramom beklometazóndipropionátu v prípravku s časticami, ktoré nie sú extra jemné).
Beklometazóndipropionát
Beklometazóndipropionát podávaný inhalačne v odporúčaných dávkach má v pľúcach glukokortikoidový protizápalový účinok. Glukokortikoidy sa používajú na potlačenie zápalu pri chronických zápalových ochoreniach dýchacích ciest, ako je CHOCHP. Ich účinok je sprostredkovaný väzbou na glukokortikoidové receptory v cytoplazme, čo vedie k zvýšenej transkripcii génov kódujúcich pre protizápalové proteíny.
Formoterol
Formoterol je selektívny beta2-adrenergný agonista, ktorý u pacientov s reverzibilnou obštrukciou dýchacích ciest vyvoláva relaxáciu hladkých svalov priedušiek. Bronchodilatačný účinok nastupuje rýchlo, do 1 - 3 minút po inhalácii, a po podaní jednej dávky trvá 12 hodín.
Glykopyrónium
Glykopyrónium je dlhodobo pôsobiaci antagonista muskarínových receptorov (anticholinergikum)
s vysokou afinitou, používaný na inhaláciu ako bronchodilatačná liečba pri CHOCHP. Glykopyrónium pôsobí tak, že blokuje bronchokonstrikčný účinok acetylcholínu na bunky hladkého svalstva
dýchacích ciest, čím rozširuje dýchacie cesty. Glykopyróniumbromid je antagonista muskarínových receptorov s vysokou afinitou, pri ktorom bola preukázaná viac než 4-násobná selektivita pre ľudské receptory M3 v porovnaní s ľudskými receptormi M2.
Klinická účinnosť a bezpečnosť
Program klinického vývoja pre CHOCHP fázy III zahŕňal dve 52-týždňové štúdie s aktívnou
kontrolou. Štúdia TRILOGY porovnávala liek Trydonis s fixnou kombináciou beklometazóndipropionátu a formoterolu 100/6 mikrogramov, dve inhalácie dvakrát denne
(1 368 randomizovaných pacientov). Štúdia TRINITY porovnávala liek Trydonis s tiotrópiom
18 mikrogramov inhalačného prášku v tvrdej kapsule, jedna inhalácia jedenkrát denne. Účinky boli okrem toho porovnávané s voľnou trojkombináciou pozostávajúcou z fixnej kombinácie beklometazóndipropionátu a formoterolu 100/6 mikrogramov, dve inhalácie dvakrát denne, a tiotrópia
18 mikrogramov inhalačného prášku v tvrdej kapsule, jedna inhalácia jedenkrát denne
(2 691 randomizovaných pacientov). Obe štúdie sa vykonávali u pacientov s klinickou diagnózou CHOCHP so závažným až veľmi závažným obmedzením prietoku vzduchu (FEV1 menej ako 50 % predpokladanej hodnoty) s príznakmi zhodnotenými ako skóre 10 alebo vyššie v teste na hodnotenie CHOCHP (COPD Assessment Test, CAT) a s najmenej jednou exacerbáciou CHOCHP
v predchádzajúcom roku. Tieto dve štúdie zhŕňali približne 20 % pacientov, ktorí používali nadstavec
AeroChamber Plus.
Okrem toho boli vykonané dve štúdie fázy IIIb na podporu klinickej účinnosti a bezpečnosti lieku Trydonis. TRISTAR bola 26-týždňová otvorená štúdia s aktívnou kontrolou porovnávajúca liek Trydonis s voľnou kombináciou pozostávajúcou z fixnej kombinácie flutikazónu/vilanterolu
92/22 mikrogramov inhalačného prášku, jedna inhalácia jedenkrát denne, a tiotrópia 18 mikrogramov inhalačného prášku v tvrdej kapsule, jedna inhalácia jedenkrát denne (1 157 randomizovaných pacientov). TRIBUTE bola 52-týždňová štúdia s aktívnou kontrolou porovnávajúca liek Trydonis
s fixnou kombináciou indakaterolu/glykopyrónia 85/43 mikrogramov inhalačného prášku v tvrdej kapsule, jedna inhalácia jedenkrát denne (1 532 randomizovaných pacientov). Obe štúdie boli vykonané u podobnej populácie pacientov s CHOCHP ako štúdie TRILOGY a TRINITY.
Zníženie počtu exacerbácií CHOCHP
V porovnaní s fixnou kombináciou beklometazóndipropionátu a formoterolu liek Trydonis znížil mieru výskytu stredne závažných/závažných exacerbácií v priebehu 52 týždňov o 23 % (miera výskytu: 0,41 oproti 0,53 prípadu na pacienta/rok, p = 0,005). V porovnaní s tiotrópiom liek Trydonis znížil mieru výskytu stredne závažných/závažných exacerbácií v priebehu 52 týždňov o 20 % (miera výskytu: 0,46 oproti 0,57 prípadu na pacienta/rok, p = 0,003). V porovnaní s fixnou kombináciou indakaterolu/glykopyrónia znížil liek Trydonis mieru výskytu stredne závažných/závažných exacerbácií počas 52 týždňov o 15 % (miera výskytu: 0,50 oproti 0,59 prípadu na pacienta/rok,
p = 0,043). V porovnaní s tiotrópiom liek Trydonis tiež znížil mieru výskytu závažných exacerbácií (t. j. nepočítajúc stredne závažné exacerbácie) o 32 % (miera výskytu: 0,067 oproti 0,098 prípadu na pacienta/rok, p = 0,017). Pri porovnávaní lieku Trydonis s voľnou trojkombináciou pozostávajúcou
z fixnej kombinácie beklometazóndipropionátu/formoterolu s tiotrópiom (miera výskytu stredne závažných/závažných exacerbácií: 0,46 oproti 0,45 prípadu na pacienta/rok) neboli pozorované žiadne rozdiely.
Okrem toho, v porovnaní s fixnou kombináciou beklometazóndipropionátu a formoterolu ako aj
v porovnaní s tiotrópiom, liek Trydonis značne predĺžil čas do prvej exacerbácie (pomer rizík 0,80
a 0,84, v uvedenom poradí, p = 0,020 a 0,015, v uvedenom poradí), pričom medzi liekom Trydonis
a voľnou trojkombináciou pozostávajúcou z fixnej kombinácie beklometazóndipropionátu/formoterolu s tiotrópiom nebol žiadny rozdiel (pomer rizík 1,06).
Účinky na funkciu pľúc Hodnota FEV
Hodnota FEV1
pred podaním dávkyV porovnaní s fixnou kombináciou beklometazóndipropionátu a formoterolu, liek Trydonis zlepšil po
26 týždňoch liečby hodnotu FEV1 pred podaním dávky o 81 ml a po 52 týždňoch liečby o 63 ml.
V porovnaní s tiotrópiom liek Trydonis zlepšil po 26 týždňoch liečby hodnotu FEV1 pred podaním
dávky o 51 ml a po 52 týždňoch liečby o 61 ml. Tieto zlepšenia boli štatisticky významné (p < 0,001).
V porovnaní s fixnou kombináciou indakaterolu a glykopyrónia, liek Trydonis zlepšil počas
52 týždňov liečby priemernú hodnotu FEV1 pred podaním dávky o 22 ml (p = 0,018). Podobné zlepšenia, aj keď boli štatisticky nevýznamné, sa pozorovali v týždňoch 26 a 52.
Pri porovnaní lieku Trydonis s voľnou trojkombináciou pozostávajúcou z fixnej kombinácie beklometazóndipropionátu/formoterolu s tiotrópiom neboli pozorované žiadne rozdiely (rozdiel 3 ml v hodnote FEV1 pred podaním dávky po 52 týždňoch liečby).
 Hodnota FEV
Hodnota FEV1
2 hodiny po podaní dávkyV porovnaní s fixnou kombináciou beklometazóndipropionátu a formoterolu, liek Trydonis významne
zlepšil po 26 týždňoch liečby hodnotu FEV1 2 hodiny po podaní dávky o 117 ml a po 52 týždňoch liečby o 103 ml (p < 0,001). Tento koncový ukazovateľ sa meral len v štúdii TRILOGY.
Inspiračná kapacita (IC)V porovnaní s tiotrópiom liek Trydonis významne zlepšil po 26 týždňoch liečby hodnotu IC o 39 ml (p = 0,025) a po 52 týždňoch liečby o 60 ml (p = 0,001). Podobné účinky sa pozorovali pri porovnaní lieku Trydonis s voľnou trojkombináciou. Tento koncový ukazovateľ sa meral len v štúdii TRINITY.
Symptomatické výsledkyLiek Trydonis významne zlepšil dyspnoe (merané ako prechodný index dyspnoe (
Transition Dyspnoea Index, TDI) – ústredné skóre) po 26 týždňoch liečby v porovnaní s počiatočným stavom (o 1,71 jednotky, p < 0,001), ale upravený priemerný rozdiel v porovnaní s fixnou kombináciou beklometazóndipropionátu a formoterolu nebol štatisticky významný (0,21 jednotky, p = 0,160).
Analýza pacientov odpovedajúcich na liečbu ukázala, že po 26 týždňoch liečby liekom Trydonis došlo ku klinicky významnému zlepšeniu (ústredné skóre viac ako alebo rovné 1) u značne vyššieho
percenta pacientov ako v prípade fixnej kombinácie beklometazóndipropionátu a formoterolu (57,4 %
oproti 51,8 %, p = 0,027). TDI sa meral len v štúdii TRILOGY.
Postavenie lieku Trydonis bolo tiež štatisticky významnejšie v porovnaní s fixnou kombináciou beklometazóndipropionátu a formoterolu, s tiotrópiom a s fixnou kombináciou indakaterolu
a glykopyrónia, čo sa týka zlepšenia kvality života (hodnotenej pomocou respiračného dotazníka
SaintGeorge Respiratory Questionnaire, SGRQ – celkové skóre). Pri porovnávaní lieku Trydonis s voľnou
trojkombináciou pozostávajúcou z fixnej kombinácie flutikazónu/vilanterolu s tiotrópiom neboli pozorované žiadne rozdiely.
Analýza pacientov odpovedajúcich na liečbu ukázala, že po 26 týždňoch a 52 týždňoch liečby liekom Trydonis došlo ku klinicky významnému zlepšeniu (zníženie oproti počiatočnému stavu o viac ako alebo rovné 4) u značne vyššieho percenta pacientov ako v prípade fixnej kombinácie beklometazóndipropionátu a formoterolu a v prípade tiotrópia.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom Trydonis
vo všetkých podskupinách pediatrickej populácie s CHOCHP (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Trydonis
Systémová expozícia beklometazóndipropionátu, formoterolu a glykopyróniu bola skúmaná vo
farmakokinetickej štúdii vykonávanej u zdravých dobrovoľníkov. Štúdia porovnávala údaje získané po liečbe jednorazovou dávkou liku Trydonis (4 inhalácie 100/6/25 mikrogramov, forma neuvedená na trhu obsahujúca dvojnásobok schválenej sily glykopyrónia) alebo jednou dávkou voľnej kombinácie beklometazóndipropionátu/formoterolu (4 inhalácie 100/6 mikrogramov) a glykopyrónia (4 inhalácie
25 mikrogramov). Maximálna koncentrácia v plazme a systémová expozícia hlavnému aktívnemu metabolitu beklometazóndipropionátu (beklometazón-17-monopropionát) a formoterolu boli podobné po podaní fixnej kombinácie aj voľnej kombinácie. V prípade glykopyrónia bola maximálna koncentrácia v plazme podobná po podaní fixnej kombinácie aj voľnej kombinácie, zatiaľ čo systémová expozícia bola mierne vyššia po podaní lieku Trydonis v porovnaní s voľnou kombináciou. V tejto štúdii sa tiež skúmala potenciálna farmakokinetická interakcia medzi účinnými zložkami lieku Trydonis a to porovnaním farmakokinetických údajov získaných po podaní jednorazovej dávky voľnej kombinácie alebo po jednorazovej dávke jednotlivých zložiek beklometazóndipropionátu/formoterolu alebo glykopyrónia. Aj keď sa nenašli žiadne jasné dôkazy farmakokinetickej interakcie, preukázala voľná kombinácia v porovnaní s jednotlivými zložkami bezprostredne po podaní prechodne mierne vyššie hladiny formoterolu a glykopyrónia. Je potrebné poznamenať, že jednozložkové
glykopyrónium vo forme dávkovacieho inhalátora v tlakovom obale, ktoré sa používalo vo FK
štúdiách, nie je na trhu dostupné.
Porovnanie v rámci všetkých štúdií ukázalo, že farmakokinetické vlastnosti
beklometazón-17-monopropionátu, formoterolu a glykopyrónia sú u pacientov s CHOCHP a zdravých
dobrovoľníkov podobné.
Vplyv nadstavca
Použitie lieku Trydonis u pacientov s CHOCHP s pomocou nadstavca AeroChamber Plus zvýšilo množstvo beklometazón-17-monopropionátu, formoterolu a glykopyrónia podaného do pľúc (maximálna koncentrácia v plazme sa zvýšila o 15 %, 58 % a 60 %, v uvedenom poradí). Celková systémová expozícia (meraná pomocou AUC0-t) bola mierne znížená v prípade
beklometazón-17-monopropionátu (o 37 %) a formoterolu (o 24 %), zatiaľ čo v prípade glykopyrónia
bola zvýšená (o 45 %). Pozri tiež časť 4.4.
Vplyv poruchy funkcie obličiek
Systémová expozícia (AUC0-t) beklometazóndipropionátu, jeho metabolitu
beklometazón-17-monopropionátu a formoterolu nebola miernou až závažnou poruchou funkcie
obličiek ovplyvnená. V prípade glykopyrónia nebola systémová expozícia u pacientov s miernou
a stredne závažnou poruchou funkcie obličiek ovplyvnená. U pacientov so závažnou poruchou funkcie obličiek (rýchlosť glomerulárnej filtrácie pod 30 ml/min/1,73 m2) bolo však následkom značného zníženia množstva glykopyrónia vylúčeného močom (približne 90 % zníženie renálneho klírensu glykopyrónia) pozorované až 2,5-násobné zvýšenie celkovej systémovej expozície. Simulácie vykonané s farmakokinetickým modelom ukázali, že aj pri extrémnych hodnotách kovariátov (telesná
hmotnosť nižšia ako 40 kg a sprievodná rýchlosť glomerulárnej filtrácie pod 27 ml/min/1,73 m²) zostáva expozícia liečivám lieku Trydonis približne v 2,5-násobnom rozsahu v porovnaní s expozíciou u typického pacienta so strednými hodnotami kovariátov.
Beklometazóndipropionát
Beklometazóndipropionát je prekurzor so slabou väzbovou afinitou ku glukokortikoidovým
receptorom, ktorý sa hydrolyzuje prostredníctvom enzýmov esteráz na aktívny metabolit beklometazón-17-monopropionát, ktorý má v porovnaní s prekurzorom beklometazóndipropionátom silnejší lokálny protizápalový účinok.
Absorpcia, distribúcia a biotransformácia
Inhalačný beklometazóndipropionát sa rýchlo absorbuje cez pľúca. Pred absorpciou podlieha rozsiahlej premene na beklometazón-17-monopropionát prostredníctvom enzýmov esteráz, ktoré sa nachádzajú vo väčšine tkanív. Systémová dostupnosť aktívneho metabolitu pochádza z absorpcie pľúcami (36 %) a z gastrointestinálnej absorpcie prehltnutej dávky. Biologická dostupnosť prehltnutého beklometazóndipropionátu je zanedbateľná, avšak predsystémová premena na beklometazón-17-monopropionát vedie k absorpcii 41 % dávky vo forme aktívneho metabolitu. So zvyšujúcou sa inhalovanou dávkou sa približne lineárne zvyšuje aj systémová expozícia. Absolútna biologická dostupnosť po inhalácii je približne 2 % nominálnej dávky nezmeneného beklometazóndipropionátu a 62 % nominálnej dávky beklometazón-17-monopropionátu. Po intravenóznom podaní sa dispozícia beklometazóndipropionátu a jeho aktívneho metabolitu vyznačuje vysokým plazmatickým klírensom (150 a 120 l/h, v uvedenom poradí), malým distribučným objemom v rovnovážnom stave pre beklometazóndipropionát (20 l) a rozsiahlejšou distribúciou aktívneho metabolitu v tkanivách (424 l). Väzba na plazmatické proteíny je stredne vysoká.
Eliminácia
Hlavnou cestou eliminácie beklometazóndipropionátu je vylučovanie stolicou, najmä vo forme polárnych metabolitov. Vylučovanie beklometazóndipropionátu a jeho metabolitov obličkami je zanedbateľné. Konečný polčas eliminácie beklometazóndipropionátu je 0,5 hodiny a konečný polčas eliminácie beklometazón-17-monopropionátu je 2,7 hodiny.
Pacienti s poruchou funkcie pečene
Aj keď sa farmakokinetické vlastnosti beklometazóndipropionátu u pacientov s poruchou funkcie pečene neskúmali, keďže beklometazóndipropionát sa veľmi rýchlo metabolizuje prostredníctvom enzýmov esteráz prítomných v črevnej tekutine, sére, pľúcach a pečeni za vzniku polárnejších produktov – beklometazón-21-monopropionátu, beklometazón-17-monopropionátu a beklometazónu, neočakáva sa, že by porucha funkcie pečene zmenila farmakokinetické vlastnosti a bezpečnostný profil beklometazóndipropionátu.
Formoterol
Absorpcia a distribúcia
Po inhalácii sa formoterol absorbuje z pľúc a gastrointestinálneho traktu. Časť inhalovanej dávky, ktorá sa po podaní dávkovacím inhalátorom prehltne, môže byť v rozmedzí 60 % až 90 %. Najmenej
65 % prehltnutého množstva sa absorbuje z gastrointestinálneho traktu. Maximálne plazmatické koncentrácie dosahuje nezmenené liečivo do 0,5 až 1 hodiny po perorálnom podaní. Väzba formoterolu na plazmatické proteíny je 61 – 64 %, pričom 34 % sa viaže na albumín. V rozsahu koncentrácií dosiahnutých pri liečebných dávkach nedošlo k žiadnemu nasýteniu väzieb. Polčas eliminácie po perorálnom podaní je 2 - 3 hodiny. Absorpcia formoterolu po inhalácii 12 až
96 mikrogramov formoterolu je lineárna.
Biotransformácia
Formoterol sa výrazne metabolizuje, a to hlavne cestou priamej konjugácie na fenolovej hydroxylovej skupine. Konjugát kyseliny glukorónovej je inaktívny. Druhou hlavnou cestou je O-demetylácia, po ktorej nasleduje konjugácia na fenolovej 2'-hydroxylovej skupine. Na O-demetylácii formoterolu sa zúčastňujú izoenzýmy cytochrómu P450 - CYP2D6, CYP2C19 a CYP2C9. Pečeň sa zdá byť
primárnym miestom metabolizmu. Formoterol neinhibuje enzýmy CYP450 pri terapeuticky relevantných koncentráciách.
Eliminácia
Kumulatívne vylučovanie formoterolu močom po jednorazovej inhalácii z inhalátora so suchým práškom sa v rozsahu dávok 12 - 96 mikrogramov zvyšovalo lineárne. V priemere 8 % dávky sa vylúčilo ako nezmenený formoterol a 25 % ako celkový formoterol. Vychádzajúc z meraní plazmatických koncentrácií po inhalácii jednorazovej dávky 120 mikrogramov u 12 zdravých dobrovoľníkov bol priemerný konečný polčas eliminácie stanovený na 10 hodín. (R,R)-enantioméry predstavujú približne 40 % a (S,S)-enantioméry približne 60 % nezmeneného liečiva vylúčeného močom. Relatívny pomer oboch enantiomérov zostával v skúmanom rozsahu dávok konštantný a po opakovanom podávaní dávok sa nezistila žiadna relatívna kumulácia jedného enantioméra oproti druhému. Po perorálnom podaní (40 až 80 mikrogramov) zdravým dobrovoľníkom sa 6 % až 10 % dávky vylúčilo močom ako nezmenené liečivo a až 8 % dávky sa vylúčilo vo forme glukuronidu. Celkovo 67 % z perorálnej dávky formoterolu sa vylúči močom (hlavne vo forme metabolitov)
a zvyšok stolicou. Renálny klírens formoterolu je 150 ml/min.
Pacienti s poruchou funkcie pečene
Aj keď sa farmakokinetické vlastnosti formoterolu u pacientov s poruchou funkcie pečene neskúmali, keďže formoterol sa primárne vylučuje hepatálnym metabolizmom, u pacientov so závažnou poruchou funkcie pečene možno očakávať zvýšenú expozíciu.
Glykopyrónium
Absorpcia a distribúcia
Glykopyrónium má kvartérnu amónnu štruktúru, ktorá obmedzuje jeho prechod cez biologické membrány a spôsobuje pomalú, premenlivú a neúplnú gastrointestinálnu absorpciu. Po inhalácii glykopyrónia bola biologická dostupnosť v pľúcach 10,5 % (s požitím aktívneho uhlia), zatiaľ čo absolútna biologická dostupnosť bola 12,8 % (bez požitia aktívneho uhlia), čo potvrdzuje obmedzenú gastrointestinálnu absorpciu a svedčí o tom, že viac ako 80 % systémovej expozície glykopyróniu pochádza z absorpcie pľúcami. Po opakovanej inhalácii dávok dvakrát denne v rozsahu od 12,5 do
50 mikrogramov pomocou tlakového dávkovacieho inhalátora u pacientov s CHOCHP, glykopyrónium vykazovalo lineárne farmakokinetické vlastnosti s malou systémovou akumuláciou v rovnovážnom stave (stredná miera akumulácie 2,2 - 2,5).
Zdanlivý distribučný objem (Vz) inhalovaného glykopyrónia bol v porovnaní s intravenóznou infúziou zvýšený (6 420 l oproti 323 l), čo odráža pomalšiu elimináciu po inhalácii.
Biotransformácia
Schéma metabolizmu glykopyrónia in vitro (mikrozómy pečene a hepatocyty ľudí, psov, potkanov, myší a králikov) bola podobná u všetkých druhov a hlavnou metabolickou reakciou je hydroxylácia na fenylových alebo cyklopentylových kruhoch. Zistilo sa, že CYP2D6 je jediným enzýmom zodpovedným za metabolizmus glykopyrónia.
Eliminácia
Priemerný polčas eliminácie glykopyrónia u zdravých dobrovoľníkov bol v rovnovážnom stave približne 6 hodín po podaní intravenóznej injekcie, zatiaľ čo po inhalácii u pacientov s CHOCHP bol
v rozmedzí 5 až 12 hodín. Po podaní jednorazovej intravenóznej injekcie glykopyrónia sa 40 % dávky vylúčilo močom do 24 hodín. U pacientov s CHOCHP liečených opakovaným podávaním inhalovaného glykopyrónia dvakrát denne bola časť dávky vylúčená močom v rovnovážnom stave
v rozmedzí 13,0 až 14,5 %. Priemerný renálny klírens bol v celom rozsahu testovaných dávok a po jednorazovej a opakovanej inhalácii podobný (rozsah 281 - 396 ml/min).
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní a reprodukčnej a vývinovej toxicity neodhalili žiadne osobitné riziko pre ľudí.
Farmakologická bezpečnosť
V inhalačnej štúdii na telemetrický sledovaných psoch bol kardiovaskulárny systém hlavným
cieľovým systémom akútnych účinkov lieku Trydonis (zvýšenie srdcovej frekvencie, zníženie krvného tlaku, pri vyšších dávkach zmeny na EKG). Tieto účinky sú pravdepodobne spojené hlavne
s beta2-adrenergnou aktivitou formoterolu a antimuskarínovou aktivitou glykopyrónia. Nezistil sa žiadny dôkaz dodatočných aditívnych účinkov trojkombinácie v porovnaní s jednotlivými zložkami.
Toxicita po opakovanom podávaní
V inhalačných štúdiách po opakovanom podávaním lieku Trydonis potkanom a psom trvajúcich až
13 týždňov boli hlavné pozorované zmeny spojené s účinkami na imunitný systém (pravdepodobne kvôli systémovým kortikosteroidovým účinkom beklometazóndipropionátu a jeho aktívneho metabolitu beklometazón-17-monopropionátu) a na kardiovaskulárny systém (pravdepodobne súvisiace s beta2-adrenergnou aktivitou formoterolu a antimuskarínovou aktivitou glykopyrónia). Toxikologický profil trojkombinácie odzrkadľoval toxikologický profil jednotlivých zložiek bez významného zvýšenia toxicity a bez neočakávaných nálezov.
Reprodukčná a vývinová toxicita
Beklometazóndipropionát/beklometazón-17-monopropionát sa považoval za zodpovedný za účinky reprodukčnej toxicity u potkanov, ako sú zníženie percenta oplodnenia, indexu plodnosti, parametrov skorého embryonálneho vývoja (implantačné straty), oneskorenie osifikácie a zvýšený výskyt viscerálnych variácií, zatiaľ čo tokolytické a antimuskarínové účinky prisudzované beta2-adrenergnej aktivite formoterolu a antimuskarínovej aktivite glykopyyrónia postihovali gravidné samice potkanov v neskorej fáze gravidity a/alebo skorej fáze laktácie, čo viedlo k úmrtiu mláďat.
Genotoxicita
Genotoxicita lieku Trydonis sa nevyhodnocovala, avšak pri konvenčných testovacích systémoch jeho jednotlivé aktívne zložky nepreukazovali genotoxickú aktivitu.
Karcinogenita
Štúdie karcinogenity sa s liekom Trydonis neuskutočnili. V 104-týždňovej inhalačnej štúdii karcinogenity u potkanov a 26-týždňovej perorálnej štúdii karcinogenity u transgénnych myší Tg.rasH2 sa v prípade glykopyróniumbromidu nepreukázal žiadny karcinogénny potenciál
a publikovavané údaje týkajúce sa dlhodobých štúdií vykonané s beklometazóndipropionátom
a formoteroliumfumarátom u potkanov nenaznačujú klinicky významný karcinogénny potenciál.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
bezvodý etanol
kyselina chlorovodíková norflurán (hnací plyn)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
Tlakový obal so 60 dávkami: 21 mesiacov.
Chemická a fyzikálna stabilita používaného roztoku a bola preukázaná 2 mesiace pri teplote 25 °C. Po výdaji lieku sa môže liek uchovávať maximálne 2 mesiace pri teplote do 25 °C. Za odlišný čas
a podmienky uchovávania používaného roztoku zodpovedá používateľ.
Tlakový obal so 120 a 180 dávkami: 22 mesiacov.
Chemická a fyzikálna stabilita používaného roztoku bola preukázaná 4 mesiace pri teplote 25 °C. Po výdaji lieku sa môže liek uchovávať maximálne 4 mesiace pri teplote do 25 °C. Za odlišný čas a podmienky uchovávania používaného roztoku zodpovedá používateľ.
6.4 Špeciálne upozornenia na uchovávanie
Pred výdajom lieku:
Uchovávajte v chladničke (2 °C - 8 °C).
Neuchovávajte v mrazničke.
Nevystavujte teplotám vyšším ako 50 °C. Tlakový obal neprepichujte.
Podmienky na uchovávanie pripraveného roztoku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Tlakový obal (poťahovaný hliníkom) s dávkovacím ventilom. Tlakový obal je vsadený do polypropylénového inhalátora, do ktorého je vstavaný náustok a počítadlo dávok (60 dávok alebo
120 dávok na tlakový obal) alebo indikátor dávok (180 dávok na tlakový obal) a je opatrený polypropylénovým krytom náustka.
Veľkosti balenia: 1 obal obsahujúci 60, 120 alebo 180 dávok a multibalenie s 2 alebo 3 obalmi, každý obsahujúci 120 dávok.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Pre lekárnikov:
Uveďte dátum výdaja lieku pacientovi na obal.
Návod na použitie
Príprava inhalátora na prvé použitie
Pred prvým použitím inhalátora má pacient vystreknúť jeden krát do vzduchu, aby sa zabezpečilo, že inhalátor správne funguje (príprava). Pred prípravou tlakových obalov so 60, 120 alebo 180 dávkami
na prvé použitie má počítadlo/indikátor ukazovať číslo 61, 121 alebo 180. Po príprave na prvé použitie má počítadlo/indikátor ukazovať číslo 60, 120 alebo 180.
Používanie inhalátora
Pri inhalácii z inhalátora majú pacienti stáť alebo sedieť vo vzpriamenej polohe. Má sa postupovať podľa týchto krokov. DÔLEŽITÉ UPOZORNENIE: Kroky 2 až 5 sa nemajú vykonávať príliš rýchlo:
1. Pacienti majú z náustka odstrániť ochranný kryt a skontrolovať, či je náustok čistý, bez prachu a nečistôt alebo iných cudzích častíc.
2. Pacienti majú pomaly a bez námahy zhlboka vydýchnuť, tak, aby vydýchli všetok vzduch z
pľúc.
3. Pacienti majú držať inhalátor vo zvislej polohe tak, aby jeho hlavná časť smerovala nahor
a vložiť si náustok medzi zuby bez zahryznutia. Pacienti majú potom náustok zovrieť perami a mať pod ním vystretý jazyk.
4. Pacienti sa majú zároveň pomaly a zhlboka začať nadychovať ústami, kým sa im pľúca nenaplnia vzduchom (má to trvať približne 4 - 5 sekúnd). Hneď po začatí nádychu, majú pacienti pevne stlačiť vrch tlakového obalu, aby uvoľnil dávku.
5. Pacienti majú potom čo najdlhšie zadržať dych, vybrať inhalátor z úst a pomaly vydýchnuť.
Pacienti nemajú vydýchnuť do inhalátora.
6. Pacienti majú potom skontrolovať počítadlo dávok alebo indikátor dávok, aby sa presvedčili, či
sa náležite posunuli.
Na inhaláciu druhej dávky majú pacienti držať inhalátor vo zvislej polohe približne 30 sekúnd a zopakovať kroky 2 - 6.
Ak sa po inhalácii objaví hmla vychádzajúca z inhalátora alebo zo strán úst, postup sa má od kroku 2
zopakovať.
Po použití majú pacienti uzavrieť inhalátor ochranným krytom náustka a skontrolovať počítadlo dávok alebo indikátor dávok.
Po inhalácii si majú pacienti vypláchnuť alebo vykloktať ústa vodou bez toho, aby ju prehltli alebo si
umyť zuby (pozri časti 4.2 a 4.4).
Kedy je potrebný nový inhalátor
Pacientov treba poučiť, aby si zaobstarali nový inhalátor, keď sa na počítadle dávok alebo indikátore dávok zobrazí číslo 20. Pacienti majú prestať používať inhalátor, keď sa na počítadle alebo indikátore zobrazí číslo 0, pretože množstvo, ktoré zostalo v tlakovom obale, nemusí stačiť na podanie celej dávky.
Dodatočné pokyny pre konkrétne skupiny pacientov
Pre pacientov, ktorí majú slabé ruky, môže byť jednoduchšie držať inhalátor oboma rukami. Ukazováky sa preto majú položiť na vrch tlakového obalu a obidva palce na spodok inhalátora.
Pacienti, pre ktorých je ťažké zosynchronizovať uvoľnenie dávky aerosólu s nádychom, môžu použiť ako pomôcku nadstavec AeroChamber Plus, ktorý má byť správne vyčistený podľa popisu v príslušnej písomnej informácii. Lekár alebo lekárnik ich má poučiť o tom, ako správne používať a starať sa
o inhalátor a nadstavec a kontrolovať ich techniku, aby sa zabezpečilo optimálne dodanie
inhalovaného liečiva do pľúc. To môže pacienti dosiahnuť použitím pomôcky AeroChamber Plus, a to jedným plynulým pomalým a hlbokým nadýchnutím cez nadstavec a bez časového odstupu medzi vystreknutím a inhaláciou. Prípadne sa pacienti môžu podľa pokynov v písomnej informácii po vystreknutí jednoducho (ústami) nadýchnuť a vydýchnuť, a tak prijať liečivo. Pozri časť 4.4
a časť 5.2.
Čistenie
Pre pravidelné čistenie inhalátora majú pacienti raz do týždňa odstrániť z náustka kryt a suchou handričkou utrieť vnútornú aj vonkajšiu časť náustka. Tlakový obal nemajú vyberať z dávkovača a na čistenie náustku nemajú použiť vodu ani iné kvapaliny.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Chiesi Farmaceutici S.p.A. Via Palermo 26/A
43122 Parma
Taliansko
8. REGISTRAČNÉ <ČÍSLO> <ČÍSLA>
EU/1/18/1274/001
EU/1/18/1274/002
EU/1/18/1274/003
EU/1/18/1274/004
EU/1/18/1274/005
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 26. apríla 2018
10. DÁTUM REVÍZIE TEXTU{DD. mesiac RRRR}


Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
internetovej
|
stránke
|
Štátneho
|
ústavu
|
|
|
http://www.ema.europa.eu a na http://www.sukl.sk.
pre kontrolu liečiv
1. NÁZOV LIEKU
Trydonis 88 mikrogramov/5 mikrogramov/9 mikrogramov, inhalačný prášok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá podaná dávka (dávka uvoľnená cez náustok) obsahuje 88 mikrogramov beklometazóndipropionátu, 5 mikrogramov dihydrát formoterólium-fumarátu a 9 mikrogramov glykopyrónia (ako 11 mikrogramov glykopyróniumbromidu).
Každá odmeraná dávka obsahuje 100 mikrogramov beklometazóndipropionátu, 6 mikrogramov dihydrát formoterólium-fumarátu a 10 mikrogramov glykopyrónia (ako 12,5 mikrogramov glykopyróniumbromidu).
Pomocná látka so známym účinkom
Každá inhalácia obsahuje 9,9 mg monohydrátu laktózy. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Inhalačný prášok
Biely až skoro biely prášok v bielom inhalátore (NEXThaler).
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Udržiavacia liečba u dospelých pacientov so stredne závažnou až závažnou chronickou obštrukčnou chorobou pľúc (CHOCHP), ktorí nie sú dostatočne liečení kombináciou inhalačného kortikosteroidu a dlhodobo pôsobiaceho beta2-agonistu alebo kombináciou dlhodobo pôsobiaceho beta2-agonistu
a dlhodobo pôsobiaceho muskarínového antagonistu (účinky na kontrolu príznakov a prevenciu exacerbácií pozri časť 5.1).
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Odporúčanou dávkou sú dve inhalácie dvakrát denne.
Maximálnou dávkou sú dve inhalácie dvakrát denne.
Osobitné skupiny pacientov
Starší pacienti
U starších pacientov (vo veku 65 rokov a starších) nie je potrebná žiadna úprava dávky.
Porucha funkcie obličiek
U pacientov s miernou až stredne závažnou poruchou funkcie obličiek sa liek Trydonis môže používať v odporúčanej dávke. Použitie u pacientov so závažnou poruchou funkcie obličiek alebo v konečnom štádiu ochorenia obličiek vyžadujúcich dialýzu, najmä ak sa spája so značným znížením telesnej hmotnosti, sa má zvážiť len v prípade, že očakávaný prínos preváži potenciálne riziko (pozri časti 4.4
a 5.2).
Porucha funkcie pečene
O použití lieku Trydonis u pacientov so závažnou poruchou funkciou pečene nie sú k dispozícii žiadne relevantné údaje, a preto sa má liek u týchto pacientov používať s opatrnosťou (pozri časti 4.4 a 5.2).
Pediatrická populácia
Použitie lieku Trydonis sa netýka pediatrickej populácie (vo veku menej ako 18 rokov) pre indikáciu
CHOCHP (chronická obštrukčná choroba pľúc).
Spôsob podávania
Na inhalačné použitie.
Inhalátor je aktivovaný dychom. Na zabezpečenie správneho podania lieku je potrebné, aby lekár
alebo iný zdravotnícky pracovník ukázal pacientovi, ako sa inhalátor správne používa a tiež pravidelne kontroloval správnosť pacientovej inhalačnej techniky (pozri „Návod na použitie“ nižšie).
Pacientovi sa má odporučiť, aby si pozorne prečítal písomnú informáciu pre používateľa a postupoval
podľa uvedeného návodu na použitie.
Po inhalácii si majú pacienti vypláchnuť alebo vykloktať ústa vodou bez toho, aby ju prehltli alebo si umyli zuby (pozri časť 4.4).
Návod na použitie
Okienko
počítadla

dávok
Kryt Náustok Vzduchový
ventil
Pri používaní nového inhalátora informujte pacienta
· Ak vrecko nie je uzavreté, alebo je poškodené, alebo ak inhalátor vyzerá byť zlomený alebo poškodený, pacient má vrátiť inhalátor osobe, ktorá mu ho poskytla a zaobstarať si nový.
· Pacient má napísať dátum otvorenia vrecka na štítok na škatuľke.
· Okienko počítadla dávok musí ukazovať „120“. Ak je zobrazené číslo nižšie ako „120“, pacient má vrátiť inhalátor osobe, ktorá mu ho poskytla a zaobstarať si nový.
Používanie inhalátora
Pri vdychovaní z inhalátora majú pacienti stáť alebo sedieť vo vzpriamenej polohe. Je potrebné
dodržiavať nasledujúce kroky:
1. Pacienti majú držať inhalátor vo vzpriamenej polohe, skontrolovať počet dávok (akékoľvek číslo medzi „1“ a „120“ ukazuje, že v inhalátore sú zvyšné dávky) a úplne otvoriť kryt.
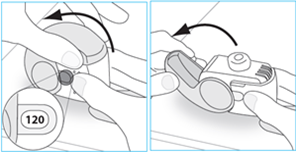
2. Pacienti majú pomaly a tak hlboko, ako im to je príjemné vydýchnuť, aby si vyprázdnili pľúca.
3. Pacienti majú zobrať náustok medzi pery bez toho, aby prikryli vzduchový ventil alebo aby vdychovali do vzduchového ventila.
4. Pacienti sa majú silno a zhlboka nadýchnuť ústami. Pri podaní dávky môžu pocítiť určitú príchuť a počuť či pocítiť kliknutie.
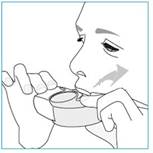
5. Pacienti potom majú vybrať inhalátor z úst, zadržať dych tak dlho, ako im to je príjemné
(5 - 10 sekúnd) a potom pomaly vydýchnuť. Pacienti nemajú vydýchnuť do inhalátora.
6. Po použití majú pacienti vrátiť inhalátor späť do vzpriamenej polohy, úplne uzavrieť kryt a skontrolovať počítadlo dávok, aby sa uistili, že počet klesol o jednu dávku.
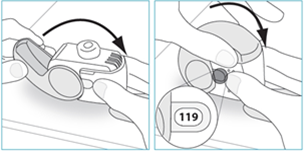
7. Ak sa má užiť ďalšia dávka, pacienti majú zopakovať kroky 1 - 6.
POZNÁMKA: Počet dávok zobrazený v okienku na kryte sa nezníži pri zatvorení krytu, ak pacient dávku cez inhalátor nevdýchol. Pacienta treba poučiť, aby kryt inhalátora otváral, len ak je to potrebné. V prípade, že pacient otvoril inhalátor, ale nevdýchol dávku a kryt sa uzavrie, dávka sa presunie naspäť do nádržky na prášok v inhalátore, nasledujúcu dávku možno bezpečne vdýchnuť.
ČisteniePravidelné čistenie inhalátora zvyčajne nie je potrebné. Pacienti môžu očistiť inhalátor po použití suchou handričkou alebo obrúskom, nie však vodou ani inými tekutinami.
4.3 KontraindikáciePrecitlivenosť na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Liek nie je určený na akútne použitie
Tento liek nie je indikovaný na liečbu akútnych prípadov bronchospazmu ani na liečbu akútnej
exacerbácie ochorenia (t. j. ako záchranná liečbu).
Precitlivenosť
Po podaní boli hlásené okamžité reakcie z precitlivenosti. Ak sa vyskytnú prejavy svedčiace
o alergických reakciách, najmä angioedém (vrátane ťažkostí s dýchaním alebo prehĺtaním, opuchu jazyka, pier a tváre), urtikária alebo kožná vyrážka, liečba sa má okamžite prerušiť a má sa nasadiť alternatívna liečba.
Paradoxný bronchospazmus
Po podaní dávky sa môže vyskytnúť paradoxný bronchospazmus s okamžitým zosilnením sipotu
a dýchavičnosti. To sa má okamžite liečiť rýchlo pôsobiacim inhalačným bronchodilatátorom
(úľavový liek). Liečba sa má okamžite prerušiť, má sa posúdiť stav pacienta a v prípade potreby sa má
nasadiť alternatívna liečba.
Zhoršenie choroby
Neodporúča sa liečbu ukončiť náhle. Ak pacienti pokladajú liečbu za neúčinnú, majú v liečbe
pokračovať a vyhľadať lekársku pomoc. Zvýšené používanie úľavových bronchodilatácií svedčí
o zhoršení základného ochorenia a vyžaduje prehodnotenie liečby. Náhle alebo progresívne zhoršenie príznakov môže byť život ohrozujúce, a preto má pacient neodkladne absolvovať lekárske vyšetrenie.
Kardiovaskulárne účinky
V dôsledku prítomnosti dlhodobo pôsobiacich beta2-agonistov a dlhodobo pôsobiacich
muskarínových antagonistov sa má liek Trydonis používať opatrne u pacientov so srdcovými arytmiami, najmä s atrioventrikulárnou blokádou tretieho stupňa a tachyarytmiami (zrýchlený a/alebo nepravidelný tep srdca vrátane fibrilácie predsiení), idiopatickou subvalvulárnou aortálnou stenózou, hypertrofickou obštrukčnou kardiomyopatiou, závažným ochorením srdca (najmä akútnym infarktom myokardu, ischemickou chorobou srdca, kongestívnym zlyhaním srdca), okluzívnymi vaskulárnymi ochoreniami (najmä artériosklerózou), arteriálnou hypertenziou a aneuryzmou.
Opatrne sa má postupovať aj pri liečbe pacientov so známym predĺžením intervalu QTc alebo
s podozrením na predĺženie intervalu (QTc > 450 milisekúnd u mužov alebo > 470 milisekúnd u žien), buď vrodeným, alebo spôsobeným liekmi. Pacienti, u ktorých sa diagnostikovali popísané kardiovaskulárne ochorenia neboli zaradení do klinických skúšaní s liekom Trydonis.
Ak sa plánuje anestézia s halogénovými anestetikami, má sa zabezpečiť, aby liek Trydonis nebol podaný najmenej 12 hodín pred začiatkom anestézie, pretože existuje riziko srdcových arytmií.
Opatrnosť je potrebná aj pri liečbe u pacientov s tyreotoxikózou, diabetom mellitus, feochromocytómom a neliečenou hypokaliémiou.
Pneumónia u pacientov s CHOCHP
U pacientov s CHOCHP liečených inhalačnými kortikosteroidmi sa pozorovalo zvýšenie výskytu
pneumónie vrátane pneumónie vyžadujúcej hospitalizáciu. Existujú určité dôkazy, že so zvyšujúcou sa dávkou steroidov stúpa riziko pneumónie, to sa však v rámci všetkých štúdií presvedčivo
nepreukázalo.
O rozdieloch v rámci skupiny inhalačných kortikosteroidných liekov vo vzťahu k miere rizika pneumónie neexistujú žiadne presvedčivé dôkazy.
Lekári majú u pacientov s CHOCHP naďalej sledovať možný vznik pneumónie, pretože klinické prejavy týchto infekcií sa prekrývajú s príznakmi exacerbácií CHOCHP.
Medzi rizikové faktory vzniku pneumónie u pacientov s CHOCHP patrí súčasné fajčenie, vyšší vek, nízky index telesnej hmotnosti (BMI) a závažná CHOCHP.
Systémové účinky kortikosteroidov
Systémové účinky sa môžu vyskytnúť pri použití ktoréhokoľvek inhalačného kortikosteroidu, hlavne
ak sa podáva dlhodobo vo vysokých dávkach. Denná dávka lieku Trydonis zodpovedá strednej dávke
inhalačných kortikosteroidov; okrem toho je výskyt týchto účinkov oveľa menej pravdepodobný v porovnaní s perorálne podávanými kortikosteroidmi. K možným systémovým účinkom patria: Cushingov syndróm, cushingoidné príznaky, adrenálna supresia, spomalenie rastu, zníženie minerálnej hustoty kostí a zriedkavejšie sa môžu vyskytnúť rôzne účinky na psychiku alebo správanie vrátane psychomotorickej hyperaktivity, porúch spánku, úzkosti, depresie alebo agresivity (najmä u detí).
Preto je dôležité pacienta pravidelne kontrolovať.
U pacientov s aktívnou alebo latentnou pľúcnou tuberkulózou a u pacientov s plesňovou a vírusovou infekciou dýchacích ciest sa má liek Trydonis podávať opatrne.
Hypokaliémia
Pri liečbe beta2-agonistami môže dôjsť k potenciálne závažnej hypokaliémii. To má vplyv na
vyvolanie nežiaducich kardiovaskulárnych účinkov. U pacientov so závažným ochorením sa odporúča osobitná opatrnosť, pretože tento účinok môže byť zosilnený hypoxiou. Hypokaliémia sa môže tiež zosilniť súbežnou liečbou inými liekmi, ktoré môžu vyvolať hypokaliémiu, ako sú deriváty xantínu, steroidy a diuretiká (pozri časť 4.5).
Opatrnosť sa odporúča aj v prípade, že sa používa niekoľko úľavových bronchodilatancií. V takýchto situáciách sa odporúča sledovať hladiny draslíka v sére.
Hyperglykémia
Inhalácia formoterolu môže spôsobiť zvýšenie hladiny glukózy v krvi. Preto sa má počas liečby
u pacientov s diabetom sledovať hladina glukózy v krvi podľa stanovených postupov.
Anticholinergný účinok
U pacientov s glaukómom s úzkym uhlom, hyperpláziou prostaty alebo retenciou moču sa má
glykopyrónium používať opatrne. Pacientov je potrebné informovať o prejavoch a príznakoch akútneho glaukómu s úzkym uhlom a o tom, aby v prípade výskytu týchto prejavov alebo príznakov ukončili liečbu a okamžite sa obrátili na svojho lekára.
Okrem toho sa kvôli anticholinegnému účinku glykopyrónia neodporúča dlhodobé súbežné podávanie s inými anticholinergnými liekmi (pozri časť 4.5).
Pacienti so závažnou poruchou funkcie obličiek
U pacientov so závažnou poruchou funkcie obličiek, vrátane pacientov v konečnom štádiu ochorenia
obličiek vyžadujúcich dialýzu, najmä ak sa spája so značným znížením telesnej hmotnosti, sa má liek
Trydonis používať len v prípade, že očakávaný prínos preváži potenciálne riziko (pozri časť 5.2). U týchto pacientov sa má sledovať možný výskyt nežiaducich reakcií.
Pacienti so závažnou poruchou funkcie pečene
U pacientov so závažnou poruchou funkcie pečene sa má liek Trydonis používať len v prípade, že
očakávaný prínos preváži potenciálne riziko (pozri časť 5.2). U týchto pacientov sa má sledovať
výskyt možných nežiaducich reakcií.
Prevencia orofaryngeálnych infekcií
Aby sa znížilo riziko orofaryngeálnej kandidózy, pacientov treba upozorniť, aby si po inhalácii
predpísanej dávky vypláchli alebo vykloktali ústa vodou bez toho, aby ju prehltli, alebo si umyli zuby.
Poruchy videnia
Poruchy videnia môžu byť hlásené pri systémovom a lokálnom použití kortikosteroidov. Ak sa
u pacienta objavia symptómy, ako je rozmazané videnie alebo iné poruchy videnia, pacient má byť odporučený k oftalmológovi na posúdenie možných príčin, medzi ktoré môže patriť katarakta, glaukóm alebo zriedkavé ochorenia, ako je napríklad centrálna serózna chorioretinopatia (CSCR), ktoré boli hlásené po použití systémových a lokálnych kortikosteroidov.
Obsah laktózy
Tento liek obsahuje laktózu.
Laktóza obsahuje malé množstvo mliečnych proteínov, ktoré môžu spôsobiť alergické reakcie.
4.5 Liekové a iné interakcie
Farmakokinetické interakcie
Vzhľadom na to, že glykopyrónium sa vylučuje prevažne obličkami, k interakciám by mohlo dôjsť
v prípade liekov ovplyvňujúcich mechanizmy renálneho vylučovania (pozri časť 5.2). Účinok inhibície transportu organických katiónov (s použitím cimetidínu ako skúšobného inhibítora transportérov OCT2 a MATE1) v obličkách preukázal vplyv na dispozíciu inhalovaného glykopyrónia v dôsledku súbežného podania cimetidínu a to malé zvýšenie celkovej systémovej expozície (AUC0-t) pre glykopyrónium o 16 % a mierne zníženie obličkového klírensu o 20 %.
Beklometazón je menej závislý od metabolizmu CYP3A než niektoré iné kortikosteroidy a interakcie zvyčajne nie sú pravdepodobné; možnosť systémových účinkov pri súbežnom použití silných inhibítorov CYP3A (napr. ritonavir, kobicistát) sa však nemôže vylúčiť, a preto sa pri použití takýchto liekov odporúča obozretnosť a príslušné sledovanie.
Farmakodynamické interakcie
Interakcie súvisiace s formoterolom
U pacientov užívajúcich inhalačný formoterol sa treba vyhnúť podávaniu nekardioselektívnych beta-blokátorov (vrátane očných kvapiek). Ak je ich podávanie nevyhnutné, účinok formoterolu sa zníži alebo zruší.
Súbežné podávanie iných beta-adrenergných liekov môže mať potenciálne aditívne účinky, preto ak sú súbežne s formoterolom predpísané aj iné beta-adrenergné lieky, je potrebná opatrnosť.
Pri súbežnej liečbe chinidínom, dizopyramidom, prokaínamidom, antihistaminikami, inhibítormi monoaminooxidázy, tricyklickými antidepresívami a fenotiazínmi môže dôjsť k predĺženiu intervalu QT a zvýšeniu rizika vzniku ventrikulárnych arytmií. Okrem toho L-dopa, L-tyroxín, oxytocín
a alkohol môžu zhoršiť toleranciu srdca voči beta2-sympatomimetikám.
Súbežná liečba inhibítormi monoaminooxidázy vrátane liekov s podobnými vlastnosťami, ako je furazolidon a prokarbazín, môže vyvolať hypertenzné reakcie.
U pacientov, ktorým sa súbežne podáva anestézia halogénovými uhľovodíkmi, je zvýšené riziko vzniku arytmií.
Pri súbežnej liečbe s derivátmi xantínu, so steroidmi alebo s diuretikami sa môže zosilniť možný hypokaliemický účinok beta2-agonistov (pozri časť 4.4). Hypokaliémia môže u pacientov liečených digitalisovými glykozidmi zvýšiť predispozíciu ku vzniku arytmií.
Interakcie súvisiace s glykopyróniom
Dlhodobé súbežné podávanie lieku Trydonis s inými anticholinergnými liekmi sa neskúmalo, a preto sa neodporúča (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je dostupné iba obmedzené množstvo údajov o použití lieku Trydonis
u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). O glukokortikoidoch je známe, že majú účinky v skorej fáze tehotenstva, zatiaľ čo beta2-sympatomimetiká ako formoterol majú tokolytické účinky. Preto ako preventívne opatrenie je vhodnejšie vyhnúť sa používaniu lieku Trydonis počas gravidity a počas pôrodu.
Liek Trydonis sa má používať počas gravidity len v prípade, že očakávaný prínos pre pacientku prevyšuje potenciálne riziko pre plod. Dojčatá a novorodenci matiek, ktoré užívali vysoké dávky, sa majú sledovať pre možný výskyt adrenálnej supresie.
Dojčenie
O použití lieku Trydonis počas dojčenia u ľudí neexistujú žiadne relevantné klinické údaje.
Glukokortikoidy sa vylučujú do ľudského mlieka. Možno predpokladať, že beklometazóndipropionát a jeho metabolity sa tiež vylučujú do materského mlieka.
Nie je známe, či formoterol alebo glykopyrónium (vrátane jeho metabolitov) prechádzajú do ľudského mlieka, ale boli zaznamenané v mlieku dojčiacich zvierat. Anticholinergiká ako glykopyrónium môžu potlačiť laktáciu.
Rozhodnutie, či ukončiť dojčenie alebo či ukončiť/prerušiť liečbu liekom Trydonis sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
S liekom Trydonis neboli vykonané žiadne špecifické štúdie týkajúce sa bezpečnosti vo vzťahu
k ľudskej plodnosti. Štúdie na zvieratách preukázali zhoršenie fertility (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek Trydonis nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať
stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
V 4-týždňovej štúdii bol bezpečnostný profil inhalačného prášku Trydonis podobný bezpečnostnému
profilu pozorovanému pre roztok v tlakovom obale Trydonis.
Najčastejšie hlásenými nežiaducimi reakciami u pacientov s CHOCHP alebo astmou s liekom
Trydonis roztok v tlakovom obale sú v uvedenom poradí: dysfónia (0,3 % a 1,5 %) a orálna kandidóza (0,8 % a 0,3 %), ktoré zvyčajne súvisia s inhalačnými kortikosteroidmi, svalové kŕče (0,4 % a 0,2 %), ktoré možno pripísať zložke dlhodobo pôsobiacich beta2-agonistov, a sucho v ústach (0,4 % a 0,5 %), ktoré je typickým anticholinergným účinkom. Podobne bolo sucho v ústach hlásené u 2 pacientov (0,6
%) používajúcich inhalačný prášok Trydonis. U astmatických pacientov majú nežiaduce reakcie tendenciu vyskytovať sa počas prvých 3 mesiacov po začatí liečby častejšie a pri dlhodobejšom používaní (po 6 mesiacoch liečby) frekvencia ich výskytu klesá.
Tabuľkový zoznam nežiaducich reakciíNežiaduce reakcie súvisiace s beklometazóndipropionátom/formoterolom/glykopyróniom, ktoré sa
vyskytli počas klinických skúšaní a v skúsenostiach po uvedení lieku na trh, ako aj nežiaduce reakcie uvedené pre jednotlivé zložky uvedené na trh sú uvedené nižšie zoradené podľa triedy orgánových systémov a frekvencie.
Frekvencie sú definované nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté
(≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000) a neznáme
(z dostupných údajov).
Trieda orgánových systémov podľa databázy MedDRA
|
Nežiaduca reakcia
|
Frekvencia
|
Infekcie a nákazy
| pneumónia (u CHOCHP pacientov), faryngitída, orálna kandidóza, infekcia močových ciest1, nazofaryngitída1
|
časté
|
influenza1, orálna plesňová infekcia, orofaryngeálna kandidóza, ezofageálna kandidóza, plesňová (oro)faryngitída, sinusitída1, rinitída1, gastroenteritída1, vulvovaginálna kandidóza1'
|
menej časté
|
infekcia dolných dýchacích ciest (plesňová)
| zriedkavé
|
Poruchy krvi
a lymfatického systému
| granulocytopénia1
| menej časté
|
trombocytopénia1
| veľmi zriedkavé
|
Poruchy imunitného systému
| alergická dermatitída1
| menej časté
|
reakcie z precitlivenosti vrátane erytému, opuchu pier, tváre, očí a hltana
|
zriedkavé
|
Poruchy endokrinného systému
|
adrenálna supresia1
|
veľmi zriedkavé
|
Poruchy metabolizmu a výživy
| hypokaliémia, hyperglykémia
| menej časté
|
znížená chuť do jedla
| zriedkavé
|
Psychické poruchy
| nepokoj1
| menej časté
|
psychomotorická hyperaktivita1, poruchy spánku1, úzkosť, depresia1, agresivita1, zmeny v správaní (najmä u detí)1
|
neznáme
|
insomnia
| zriedkavé
|
Poruchy nervového systému
| bolesť hlavy
| časté
|
tremor, závrat, dysgeúzia1, hypoestézia1
| menej časté
|
hypersomnia
| zriedkavé
|
Poruchy oka
| rozmazané videnie1 (pozri tiež časť 4.4)
| neznáme
|
glaukóm1, katarakta1
| veľmi zriedkavé
|
Poruchy ucha a labyrintu
| zápal Eustachovej trubice1
| menej časté
|
Poruchy srdca a srdcovej
činnosti
| fibrilácia predsiení, predĺženie intervalu QT na EKG, tachykardia, tachyarytmia1, palpitácie
|
menej časté
|
angina pectoris (stabilizovaná1 a nestabilizovaná), extrasystoly (ventrikulárne1 a supraventrikulárne), nodálny rytmus, sínusová bradykardia
|
zriedkavé
|
Trieda orgánových systémov podľa databázy MedDRA
|
Nežiaduca reakcia
|
Frekvencia
|
Poruchy ciev
|
hyperémia1, nával krvi1, hypertenzia
|
menej časté
|
extravazácia krvi
|
zriedkavé
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
dysfónia
|
časté
|
astmatická kríza1, kašeľ, produktívny kašeľ1, podráždenie hrdla, epistaxa1, faryngeálny erytém
|
menej časté
|
paradoxný bronchospazmus1, exacerbácia astmy, orofaryngeálna bolesť, faryngeálny zápal, sucho
v hrdle
|
zriedkavé
|
dyspnoe1
|
veľmi zriedkavé
|
Poruchy gastrointestinálneho traktu
|
hnačka1, sucho v ústach, dysfágia1, nauzea, dyspepsia1, pálenie pier1, zubný kaz1, (aftózna) stomatitída
|
menej časté
|
Poruchy kože
a podkožného tkaniva
|
vyrážka1, urtikária, pruritus, hyperhidróza1
|
menej časté
|
angioedém1
|
zriedkavé
|
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
|
svalové kŕče, myalgia, bolesť končatín1, muskuloskeletálna bolesť hrudníka1
|
menej časté
|
spomalenie rastu1
|
veľmi zriedkavé
|
Poruchy obličiek
a močových ciest
|
dyzúria, retencia moču, nefritída1
|
zriedkavé
|
Celkové poruchy a reakcie v mieste podania
|
únava1
|
menej časté
|
asténia
|
zriedkavé
|
periférny edém1
|
veľmi zriedkavé
|
Laboratórne a funkčné
vyšetrenia
|
zvýšená hladina C-reaktívneho proteínu1, zvýšený počet trombocytov1, zvýšená hladina voľných mastných kyselín1, zvýšená hladina inzulínu v krvi1, zvýšená hladina ketolátok v krvi1, znížená hladina kortizolu1
|
menej časté
|
zvýšený krvný tlak1, znížený krvný tlak1
|
zriedkavé
|
znížená hustota kostí1
|
veľmi zriedkavé
|
1 Nežiaduce reakcie uvedené v súhrne charakteristických vlastností lieku pre aspoň jednu zo zložiek lieku, ktoré sa však nepozorovali ako nežiaduce reakcie pri klinickom vývoji lieku Trydonis.
V rámci pozorovaných nežiaducich reakcií sa nasledovné nežiaduce reakcie zvyčajne spájajú s nasledovnými zložkami:
BeklometazóndipropionátPneumónia, orálne plesňové infekcie, plesňová infekcia dolných dýchacích ciest, dysfónia, podráždenie hrdla, hyperglykémia, psychické poruchy, znížená hladina kortizolu, rozmazané videnie.
FormoterolHypokaliémia, hyperglykémia, tremor, palpitácie, svalové kŕče, predĺženie intervalu QT na EKG, zvýšený krvný tlak, znížený krvný tlak, fibrilácia predsiení, tachykardia, tachyarytmia, angina pectoris (stabilizovaná a nestabilizovaná), ventrikulárne extrasystoly, nodálny rytmus.
GlykopyróniumGlaukóm, fibrilácia predsiení, tachykardia, palpitácie, sucho v ústach, zubný kaz, dyzúria, retencia
moču, infekcia močových ciest.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
národné
|
centrum
|
hlásenia
|
uvedené
|
|
|
akékoľvek podozrenia na nežiaduce reakcie na
v Prílohe V.
4.9 Predávkovanie
Predávkovanie liekom Trydonis môže vyvolať prejavy a príznaky v dôsledku účinkov jednotlivých zložiek, vrátane prejavov a príznakov pozorovaných pri predávkovaní inými beta2-agonistmi alebo anticholinergikami a totožnými so známymi účinkami skupiny inhalačných kortikosteroidov (pozri časť 4.4). V prípade, že dôjde k predávkovaniu, pacientove príznaky sa majú podporne liečiť a podľa potreby náležite sledovať.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiastmatiká, sympatomimetiká v kombinácii s anticholinergikami vrátane trojkombinácií s kortikosteroidmi, ATC kód: R03AL09.
Mechanizmus účinku a farmakodynamické účinky
Trydonis obsahuje beklometazóndipropionát, formoterol a glykopyrónium (BDP/FF/G) vo forme
suchého prášku, ktorý počas inhalácie vytvára extra jemný aerosól s extra jemnými časticami so spoločnou depozíciou všetkých troch zložiek. Aerosólové častice lieku Trydonis sú v priemere oveľa menšie ako častice podávané prípravkami, ktoré nie sú označené ako extra jemné. V prípade beklometazóndipropionátu to má za následok silnejší účinok ako v prípade prípravkov s distribúciou častíc, ktoré nie sú extra jemné (100 mikrogramov extra jemného beklometazóndipropionátu v lieku Trydonis klinicky zodpovedá 250 mikrogramom beklometazóndipropionátu v prípravku s časticami, ktoré nie sú extra jemné).
Beklometazóndipropionát
Beklometazóndipropionát podávaný inhalačne v odporúčaných dávkach má v pľúcach glukokortikoidový protizápalový účinok. Glukokortikoidy sa používajú na potlačenie zápalu pri chronických zápalových ochoreniach dýchacích ciest. Ich účinok je sprostredkovaný väzbou na glukokortikoidové receptory v cytoplazme, čo vedie k zvýšenej transkripcii génov kódujúcich pre protizápalové proteíny.
Formoterol
Formoterol je selektívny beta2-adrenergný agonista, ktorý u pacientov s reverzibilnou obštrukciou dýchacích ciest vyvoláva relaxáciu hladkých svalov priedušiek. Bronchodilatačný účinok nastupuje rýchlo, do 1 - 3 minút po inhalácii, a po podaní jednej dávky trvá 12 hodín.
Glykopyrónium
Glykopyrónium je dlhodobo pôsobiaci antagonista muskarínových receptorov (anticholinergikum)
s vysokou afinitou, používaný na inhaláciu ako bronchodilatačná liečba. Glykopyrónium pôsobí tak, že blokuje bronchokonstrikčný účinok acetylcholínu na bunky hladkého svalstva dýchacích ciest, čím rozširuje dýchacie cesty. Glykopyróniumbromid je antagonista muskarínových receptorov s vysokou afinitou, pri ktorom bola preukázaná viac než 4-násobná selektivita pre ľudské receptory M3
v porovnaní s ľudskými receptormi M2.
Klinická účinnosť a bezpečnosť
Inhalačný prášok Trydonis
Program vývoja inhalačného prášku Trydonis sa vykonával s BDP/FF/G 88/5/9 a zahŕňal jednu
4-týždňovú štúdiu porovnateľnosti (non-inferiority). Štúdia TRI-D bolo multicentrické, randomizované, dvojito zaslepené, dvojito zastúpené (tzv. „double-dummy“), aktívne kontrolované, trojito prekrížené (tzv. „cross-over“) skúšanie u pacientov so stabilnou, stredne závažnou až závažnou CHOCHP. Porovnávali sa 3 liečebné obdobia, každé trvajúce 4 týždne, s liečbou inhalačným práškom BDP/FF/G, roztokom v tlakovom obale BDP/FF/G alebo roztokom v tlakovom obale s fixnou
kombináciou dávok beklometazóndipropionátu a formoterolu 100/6 mikrogramov, pričom každá sa podávala ako 2 inhalácie dvakrát denne a liečebné obdobia boli oddelené 2-týždňovým tzv. wash-out obdobím. Koprimárne koncové ukazovatele účinnosti boli zmena hodnoty FEV1 AUC0-12h normalizovanej podľa času a zmena minimálnej hodnoty FEV1 po 24 hodinách v 28. deň oproti východiskovým hodnotám.
Účinky na funkciu pľúc
Randomizovaných bolo 366 pacientov. Porovnateľnosť inhalačného prášku BDP/FF/G s roztokom v tlakovom obale BDP/FF/G sa preukázala pre oba koprimárne koncové ukazovatele, s dolnou hranicou intervalu spoľahlivosti upravených priemerných rozdielov spadajúcou nad hranicu porovnateľnosti -50 ml. Upravené priemerné rozdiely (95 % IS) boli -20 ml (-35, -6) pre hodnotu FEV1 AUC0-12h, a 3 ml (-15, 20) pre minimálnu hodnotu FEV1 po 24 hodinách v 28. deň.
Inhalačný prášok aj roztok v tlakovom obale BDP/FF/G významne zlepšili hodnotu FEV1 AUC0-12h
oproti roztoku v tlakovom obale s fixnou kombináciou dávok beklometazóndipropionátu
a formoterolu o 85 ml (95 % IS: 70, 99) a 105 ml (95 % IS: 90, 120), v uvedenom poradí (pre oba p < 0,001).
Nádychový prietok
Na overenie schopnosti generovať dostatočný nádychový prietok cez inhalátor a jeho možného ovplyvnenia vekom pacienta, ochorením a závažnosťou ochorenia, a dosiahnutie aktivácie a inhalácie u pacientov, sa vykonala otvorená placebo štúdia. Primárnym koncovým ukazovateľom bolo percento pacientov v každej vekovej skupine a skupine ochorenia, ktorí boli schopní aktivovať inhalátor. Na skúšaní sa zúčastnilo 89 pacientov vo vekovom rozsahu 5-84 rokov, vrátane pacientov so stredne závažnou a závažnou astmou (FEV1 > 60 % a ≤ 60 % predpokladanej hodnoty, v uvedenom poradí)
a pacientov so stredne ťažkou a ťažkou CHOCHP (FEV1 ≥ 50% a < 50 % predpokladanej hodnoty,
v uvedenom poradí). Všetci pacienti nezávisle od veku, ochorenia a závažnosti ochorenia boli schopní
vygenerovať dostatočný nádychový prietok na aktivovanie inhalátora. V dodatočnej, otvorenej placebo štúdii boli pacienti s miernou až závažnou CHOCHP nezávisle od ich funkčných obmedzení schopní účinne aktivovať a používať inhalátor.
Roztok v tlakovom obale Trydonis
Program vývoja roztoku v tlakovom obale Trydonis pri CHOCHP sa vykonával s BDP/FF/G
87/5/9 a zahŕňal dve 52-týždňové štúdie s aktívnou kontrolou. Štúdia TRILOGY porovnávala BDP/FF/G s fixnou kombináciou beklometazóndipropionátu a formoterolu 100/6 mikrogramov, dve inhalácie dvakrát denne (1 368 randomizovaných pacientov). Štúdia TRINITY porovnávala BDP/FF/G s tiotrópiom 18 mikrogramov inhalačného prášku v tvrdej kapsule, jedna inhalácia jedenkrát denne. Účinky boli okrem toho porovnávané s voľnou trojkombináciou pozostávajúcou
z fixnej kombinácie beklometazóndipropionátu a formoterolu 100/6 mikrogramov (čo zodpovedá podanej dávke 84,6/5,0 mikrogramu), dve inhalácie dvakrát denne, a tiotrópia 18 mikrogramov inhalačného prášku v tvrdej kapsule, jedna inhalácia jedenkrát denne (2 691 randomizovaných pacientov). Štúdia TRIBUTE porovnávala BDP/FF/G s fixnou kombináciou indakaterolu/glykopyrónia 85/43 mikrogramov inhalačného prášku v tvrdej kapsule, jedna inhalácia jedenkrát denne (1 532 randomizovaných pacientov).
Zníženie počtu exacerbácií CHOCHP
BDP/FF/G znížili mieru výskytu stredne závažných/závažných exacerbácií v priebehu 52 týždňov
o 23 % v porovnaní s fixnou kombináciou beklometazóndipropionátu a formoterolu (miera výskytu:
0,41 oproti 0,53 prípadu na pacienta/rok, p = 0,005) , o 20 % v porovnaní s tiotrópiom (miera výskytu:
0,46 oproti 0,57 prípadu na pacienta/rok, p = 0,003) a o 15 % v porovnaní s fixnou kombináciou indakaterolu/glykopyrónia (miera výskytu: 0,50 oproti 0,59 prípadu na pacienta/rok, p = 0,043). Pri porovnávaní BDP/FF/G s voľnou trojkombináciou pozostávajúcou z fixnej kombinácie beklometazóndipropionátu/formoterolu s tiotrópiom (miera výskytu stredne závažných/závažných exacerbácií: 0,46 oproti 0,45 prípadu na pacienta/rok) neboli pozorované žiadne rozdiely.
Účinky na funkciu pľúc
V porovnaní s fixnou kombináciou beklometazóndipropionátu a formoterolu, BDP/FF/G zlepšili hodnotu FEV1 pred podaním dávky o 71 ml po 28 dňoch, o 81 ml po 26 týždňoch liečby a po
52 týždňoch liečby o 63 ml. V porovnaní s tiotrópiom BDP/FF/G zlepšili po 26 týždňoch liečby
hodnotu FEV1 pred podaním dávky o 51 ml a po 52 týždňoch liečby o 61 ml. Tieto zlepšenia boli štatisticky významné (p < 0,001). V porovnaní s fixnou kombináciou indakaterolu a glykopyrónia, BDP/FF/G zlepšili počas 52 týždňov liečby priemernú hodnotu FEV1 pred podaním dávky o 22 ml
(p = 0,018). Podobné zlepšenia, aj keď boli štatisticky nevýznamné, sa pozorovali v týždňoch 26 a 52. Pri porovnaní BDP/FF/G s voľnou trojkombináciou pozostávajúcou z fixnej kombinácie beklometazóndipropionátu/formoterolu s tiotrópiom neboli pozorované žiadne rozdiely (rozdiel 3 ml
v hodnote FEV1 pred podaním dávky po 52 týždňoch liečby).
Ovplyvnenie symptómov
Postavenie BDP/FF/G bolo štatisticky významnejšie v porovnaní s fixnou kombináciou beklometazóndipropionátu a formoterolu, s tiotrópiom a s fixnou kombináciou indakaterolu
a glykopyrónia, čo sa týka zlepšenia kvality života (hodnotenej pomocou respiračného dotazníka Saint
George Respiratory Questionnaire, SGRQ – celkové skóre).
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom Trydonis
vo všetkých podskupinách pediatrickej populácie s CHOCHP (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Trydonis – fixná kombinácia
Farmakokinetické vlastnosti beklometazóndipropionátu (a jeho aktívneho metabolitu
beklometazón-17-monopropionátu), formoterolu a glykopyróniumbromidu boli skúmané vo farmakokinetickej štúdii vykonávanej u zdravých dobrovoľníkov, ktorá porovnávala inhalačný prášok Trydonis s formou roztoku v tlakovom obale, pričom v oboch prípadoch sa podávali beklometazóndipropionát, formoterólium-fumarát a glykopyróniumbromid v liekovej sile
100/6/12,5 µg/inhalácia (8 inhalácií zodpovedá celkovej dávke 800/48/100 µg). Relatívna celková systémová expozícia sa hodnotila bez použitia blokády aktívnym uhlím pre liečivo absorbované z pľúc aj z gastrointestinálneho traktu, zatiaľ čo relatívna dostupnosť v pľúcach sa skúmala použitím blokády aktívnym uhlím na vylúčenie absorpcie liečiva z gastrointestinálneho traktu.
Beklometazóndipropionát sa rýchlo absorboval s maximálnou plazmatickou koncentráciou 10 min po podaní dávky inhalačného prášku aj roztoku v tlakovom obale Trydonis. Podanie inhalačného prášku viedlo k zvýšenej celkovej systémovej expozícii (1,2-násobne pre Cmax a 2,4-násobne pre AUC0-t)
a dostupnosti v pľúcach (1,3-násobne pre Cmax a 2,5-násobne pre AUC0-t) v porovnaní s roztokom
v tlakovom obale. Beklometazón-17-monopropionát sa tvoril rýchlo s maximálnou plazmatickou
koncentráciou približne 15-30 min po podaní lieku. Podanie inhalačného prášku viedlo k mierne nižšej celkovej systémovej expozícii v porovnaní s roztokom v tlakovom obale (-17 % pre Cmax a -16 % pre AUC0-t), zatiaľ čo dostupnosť v pľúcach bola rovnaká pre AUC0-t, ale mierne nižšia pre Cmax (-13 %). Formoterol sa rýchlo absorboval s maximálnou plazmatickou koncentráciou 10 min po podaní dávky inhalačného prášku aj roztoku v tlakovom obale. Podanie inhalačného prášku viedlo k zvýšenej celkovej systémovej expozícii (1,6-násobne pre Cmax a 1,2-násobne pre AUC0-t) a dostupnosti
v pľúcach (1,8-násobne pre Cmax a 1,9-násobne pre AUC0-t) v porovnaní s roztokom v tlakovom obale. Farmakokinetický profil glykopyróniumbromidu bol charakterizovaný rýchlou absorpciou
s maximálnou plazmatickou koncentráciou 10 min po podaní dávky inhalačného prášku aj roztoku
v tlakovom obale. Výsledná celková systémová expozícia pre inhalačný prášok zodpovedala roztoku v tlakovom obale, bola však 2,2-násobne vyššia pri hodnotení ako maximálna koncentrácia. Dostupnosť v pľúcach bola vyššia pre inhalačný prášok, s 2,9-násobným zvýšením hodnoty Cmax
a 1,2-násobným zvýšením hodnoty AUC0-t.
Vplyv na poruchy funkcie obličiek
Systémová expozícia (AUC0-t) beklometazóndipropionátu, jeho metabolitu
beklometazón-17-monopropionátu a formoterolu nebola miernou až závažnou poruchou funkcie
obličiek ovplyvnená. V prípade glykopyrónia nebola systémová expozícia u pacientov s miernou
a stredne závažnou poruchou funkcie obličiek ovplyvnená. U pacientov so závažnou poruchou funkcie obličiek (rýchlosť glomerulárnej filtrácie pod 30 ml/min/1,73 m2) bolo však následkom značného zníženia množstva glykopyrónia vylúčeného močom (približne 90 % zníženie renálneho klírensu glykopyrónia) pozorované až 2,5-násobné zvýšenie celkovej systémovej expozície. Simulácie vykonané s farmakokinetickým modelom ukázali, že aj pri extrémnych hodnotách kovariátov (telesná hmotnosť nižšia ako 40 kg a sprievodná rýchlosť glomerulárnej filtrácie pod 27 ml/min/1,73 m²) zostáva expozícia liečivám lieku Trydonis približne v 2,5-násobnom rozsahu v porovnaní s expozíciou u typického pacienta so strednými hodnotami kovariátov.
Beklometazóndipropionát
Beklometazóndipropionát je prekurzor so slabou väzbovou afinitou ku glukokortikoidovým
receptorom, ktorý sa hydrolyzuje prostredníctvom enzýmov esteráz na aktívny metabolit beklometazón-17-monopropionát, ktorý má v porovnaní s prekurzorom beklometazóndipropionátom silnejší lokálny protizápalový účinok.
Absorpcia, distribúcia a biotransformácia
Inhalačný beklometazóndipropionát sa rýchlo absorbuje cez pľúca. Pred absorpciou podlieha rozsiahlej premene na beklometazón-17-monopropionát prostredníctvom enzýmov esteráz, ktoré sa nachádzajú vo väčšine tkanív. Systémová dostupnosť aktívneho metabolitu pochádza z absorpcie pľúcami (36 %) a z gastrointestinálnej absorpcie prehltnutej dávky. Biologická dostupnosť prehltnutého beklometazóndipropionátu je zanedbateľná, avšak predsystémová premena na beklometazón-17-monopropionát vedie k absorpcii 41 % dávky vo forme aktívneho metabolitu. So zvyšujúcou sa inhalovanou dávkou sa približne lineárne zvyšuje aj systémová expozícia. Absolútna biologická dostupnosť po inhalácii je približne 2 % nominálnej dávky nezmeneného beklometazóndipropionátu a 62 % nominálnej dávky beklometazón-17-monopropionátu. Po intravenóznom podaní sa dispozícia beklometazóndipropionátu a jeho aktívneho metabolitu vyznačuje vysokým plazmatickým klírensom (150 a 120 l/h, v uvedenom poradí), malým distribučným objemom v rovnovážnom stave pre beklometazóndipropionát (20 l) a rozsiahlejšou distribúciou aktívneho metabolitu v tkanivách (424 l). Väzba na plazmatické proteíny je stredne vysoká.
Eliminácia
Hlavnou cestou eliminácie beklometazóndipropionátu je vylučovanie stolicou, najmä vo forme polárnych metabolitov. Vylučovanie beklometazóndipropionátu a jeho metabolitov obličkami je zanedbateľné. Konečný polčas eliminácie beklometazóndipropionátu je 0,5 hodiny a konečný polčas eliminácie beklometazón-17-monopropionátu je 2,7 hodiny.
Pacienti s poruchou funkcie pečene
Aj keď sa farmakokinetické vlastnosti beklometazóndipropionátu u pacientov s poruchou funkcie pečene neskúmali, keďže beklometazóndipropionát sa veľmi rýchlo metabolizuje prostredníctvom enzýmov esteráz prítomných v črevnej tekutine, sére, pľúcach a pečeni za vzniku polárnejších produktov – beklometazón-21-monopropionátu, beklometazón-17-monopropionátu a beklometazónu, neočakáva sa, že by porucha funkcie pečene zmenila farmakokinetické vlastnosti a bezpečnostný profil beklometazóndipropionátu.
Formoterol
Absorpcia a distribúcia
Po inhalácii sa formoterol absorbuje z pľúc a gastrointestinálneho traktu. Časť inhalovanej dávky, ktorá sa po podaní dávkovacím inhalátorom prehltne, môže byť v rozmedzí 60 % až 90 %. Najmenej
65 % prehltnutého množstva sa absorbuje z gastrointestinálneho traktu. Maximálne plazmatické koncentrácie dosahuje nezmenené liečivo do 0,5 až 1 hodiny po perorálnom podaní. Väzba formoterolu na plazmatické proteíny je 61 – 64 %, pričom 34 % sa viaže na albumín. V rozsahu
koncentrácií dosiahnutých pri liečebných dávkach nedošlo k žiadnemu nasýteniu väzieb. Polčas
eliminácie po perorálnom podaní je 2 - 3 hodiny. Absorpcia formoterolu po inhalácii 12 až
96 mikrogramov formoterolu je lineárna.
Biotransformácia
Formoterol sa výrazne metabolizuje, a to hlavne cestou priamej konjugácie na fenolovej hydroxylovej skupine. Konjugát kyseliny glukorónovej je inaktívny. Druhou hlavnou cestou je O-demetylácia, po ktorej nasleduje konjugácia na fenolovej 2'-hydroxylovej skupine. Na O-demetylácii formoterolu sa zúčastňujú izoenzýmy cytochrómu P450 - CYP2D6, CYP2C19 a CYP2C9. Pečeň sa zdá byť primárnym miestom metabolizmu. Formoterol neinhibuje enzýmy CYP450 pri terapeuticky relevantných koncentráciách.
Eliminácia
Kumulatívne vylučovanie formoterolu močom po jednorazovej inhalácii z inhalátora so suchým práškom sa v rozsahu dávok 12 - 96 mikrogramov zvyšovalo lineárne. V priemere 8 % dávky sa vylúčilo ako nezmenený formoterol a 25 % ako celkový formoterol. Vychádzajúc z meraní plazmatických koncentrácií po inhalácii jednorazovej dávky 120 mikrogramov u 12 zdravých dobrovoľníkov bol priemerný konečný polčas eliminácie stanovený na 10 hodín. (R,R)-enantioméry predstavujú približne 40 % a (S,S)-enantioméry približne 60 % nezmeneného liečiva vylúčeného močom. Relatívny pomer oboch enantiomérov zostával v skúmanom rozsahu dávok konštantný a po opakovanom podávaní dávok sa nezistila žiadna relatívna kumulácia jedného enantioméra oproti druhému. Po perorálnom podaní (40 až 80 mikrogramov) zdravým dobrovoľníkom sa 6 % až 10 % dávky vylúčilo močom ako nezmenené liečivo a až 8 % dávky sa vylúčilo vo forme glukuronidu. Celkovo 67 % z perorálnej dávky formoterolu sa vylúči močom (hlavne vo forme metabolitov)
a zvyšok stolicou. Renálny klírens formoterolu je 150 ml/min.
Pacienti s poruchou funkcie pečene
Aj keď sa farmakokinetické vlastnosti formoterolu u pacientov s poruchou funkcie pečene neskúmali, keďže formoterol sa primárne vylučuje hepatálnym metabolizmom, u pacientov so závažnou poruchou funkcie pečene možno očakávať zvýšenú expozíciu.
Glykopyrónium
Absorpcia a distribúcia
Glykopyrónium má kvartérnu amónnu štruktúru, ktorá obmedzuje jeho prechod cez biologické membrány a spôsobuje pomalú, premenlivú a neúplnú gastrointestinálnu absorpciu. Po inhalácii glykopyrónia bola biologická dostupnosť v pľúcach 10,5 % (s požitím aktívneho uhlia), zatiaľ čo absolútna biologická dostupnosť bola 12,8 % (bez požitia aktívneho uhlia), čo potvrdzuje obmedzenú gastrointestinálnu absorpciu a svedčí o tom, že viac ako 80 % systémovej expozície glykopyróniu pochádza z absorpcie pľúcami. Po opakovanej inhalácii dávok dvakrát denne v rozsahu od 12,5 do
50 mikrogramov pomocou tlakového dávkovacieho inhalátora u pacientov s CHOCHP, glykopyrónium vykazovalo lineárne farmakokinetické vlastnosti s malou systémovou akumuláciou v rovnovážnom stave (stredná miera akumulácie 2,2 - 2,5).
Zdanlivý distribučný objem (Vz) inhalovaného glykopyrónia bol v porovnaní s intravenóznou infúziou zvýšený (6 420 l oproti 323 l), čo odráža pomalšiu elimináciu po inhalácii.
Biotransformácia
Schéma metabolizmu glykopyrónia in vitro (mikrozómy pečene a hepatocyty ľudí, psov, potkanov, myší a králikov) bola podobná u všetkých druhov a hlavnou metabolickou reakciou je hydroxylácia na fenylových alebo cyklopentylových kruhoch. Zistilo sa, že CYP2D6 je jediným enzýmom zodpovedným za metabolizmus glykopyrónia.
Eliminácia
Priemerný polčas eliminácie glykopyrónia u zdravých dobrovoľníkov bol v rovnovážnom stave približne 6 hodín po podaní intravenóznej injekcie, zatiaľ čo po inhalácii u pacientov s CHOCHP bol
v rozmedzí 5 až 12 hodín. Po podaní jednorazovej intravenóznej injekcie glykopyrónia sa 40 % dávky
vylúčilo močom do 24 hodín. U pacientov s CHOCHP liečených opakovaným podávaním
inhalovaného glykopyrónia dvakrát denne bola časť dávky vylúčená močom v rovnovážnom stave v rozmedzí 13,0 až 14,5 %. Priemerný renálny klírens bol v celom rozsahu testovaných dávok a po jednorazovej a opakovanej inhalácii podobný (rozsah 281 - 396 ml/min).
5.3 Predklinické údaje o bezpečnosti
Farmakologická bezpečnosť
V inhalačnej štúdii na telemetrický sledovaných psoch bol kardiovaskulárny systém hlavným
cieľovým systémom akútnych účinkov lieku Trydonis (zvýšenie srdcovej frekvencie, zníženie krvného tlaku, pri vyšších dávkach zmeny na EKG). Tieto účinky sú pravdepodobne spojené hlavne
s beta2-adrenergnou aktivitou formoterolu a antimuskarínovou aktivitou glykopyrónia. Nezistil sa žiadny dôkaz dodatočných aditívnych účinkov trojkombinácie v porovnaní s jednotlivými zložkami.
Toxicita po opakovanom podávaní
V inhalačných štúdiách po opakovanom podávaním lieku Trydonis potkanom a psom trvajúcich až
13 týždňov boli hlavné pozorované zmeny spojené s účinkami na imunitný systém (pravdepodobne kvôli systémovým kortikosteroidovým účinkom beklometazóndipropionátu a jeho aktívneho metabolitu beklometazón-17-monopropionátu) a na kardiovaskulárny systém (pravdepodobne súvisiace s beta2-adrenergnou aktivitou formoterolu a antimuskarínovou aktivitou glykopyrónia). Toxikologický profil trojkombinácie odzrkadľoval toxikologický profil jednotlivých zložiek bez významného zvýšenia toxicity a bez neočakávaných nálezov.
Reprodukčná a vývinová toxicita
Beklometazóndipropionát/beklometazón-17-monopropionát sa považoval za zodpovedný za účinky
reprodukčnej toxicity u potkanov, ako sú zníženie percenta oplodnenia, indexu plodnosti, parametrov skorého embryonálneho vývoja (implantačné straty), oneskorenie osifikácie a zvýšený výskyt viscerálnych variácií, zatiaľ čo tokolytické a antimuskarínové účinky prisudzované beta2-adrenergnej aktivite formoterolu a antimuskarínovej aktivite glykopyrónia postihovali gravidné samice potkanov
v neskorej fáze gravidity a/alebo skorej fáze laktácie, čo viedlo k úmrtiu mláďat.
Genotoxicita
Genotoxicita lieku Trydonis sa nevyhodnocovala, avšak pri konvenčných testovacích systémoch jeho
jednotlivé aktívne zložky nepreukazovali genotoxickú aktivitu.
Karcinogenita
Štúdie karcinogenity sa s liekom Trydonis neuskutočnili. V 104-týždňovej inhalačnej štúdii
karcinogenity u potkanov a 26-týždňovej perorálnej štúdii karcinogenity u transgénnych myší
Tg-rasH2 sa v prípade glykopyróniumbromidu nepreukázal žiadny karcinogénny potenciál
a publikované údaje týkajúce sa dlhodobých štúdií vykonané s beklometazóndipropionátom
a formoterólium-fumarátom u potkanov nenaznačujú klinicky významný karcinogénny potenciál.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
monohydrát laktózy (môže obsahovať mliečne proteíny)
stearát horečnatý
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
21 mesiacov
Po prvom otvorení vrecka sa musí liek použiť do 6 týždňov a uchovávať na suchom mieste.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote neprevyšujúcej 25 °C.
Inhalátor uchovávajte v pôvodnom obale na ochranu pred vlhkosťou a vyberte ho z vrecka len tesne pred prvým použitím.
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah baleniaInhalátor je biely inhalátor so sivým krytom náustku a počítadlom zostávajúcich dávok. Pozostáva z puzdra tvoreného spodnou časťou s okienkom zobrazujúcim počet zostávajúcich dávok
a zabudovaným krytom. Pri otvorení krytu, ktorý tiež poháňa mechanizmus počítania dávok, sa odkryje náustok, cez ktorý sa inhaluje liek.
Spodná časť a náustok sú vyrobené z akrylonitril-butadién-styrénu a kryt je vyrobený z polypropylénu. Inhalátor je zabalený v tepelne zatavenom vrecku z polyamidu/hliníka/polyetylénu (PA/Al/PE) alebo polyetyléntereftalátu/hliníka/polyetylénu (PET/Al/PE).
Veľkosti balenia:
Balenie 1 inhalátora obsahuje 120 inhalácií.
Multibalenie obsahujúce 240 inhalácií (2 inhalátory po 120 inhalácií). Multibalenie obsahujúce 360 inhalácií (3 inhalátory po 120 inhalácií).
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIChiesi Farmaceutici S.p.A. Via Palermo 26/A
43122 Parma
Taliansko
8. REGISTRAČNÉ ČÍSLAEU/1/18/1274/006
EU/1/18/1274/007
EU/1/18/1274/008
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 26. apríla 2018
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu