TRULICITY 0,75 MG INJEKČNÝ ROZTOK NAPLNENÝ V INJEKČNOM PERE sol inj 4x0,75 mg (striek.napl.skl. v pere)

pioglitazónom)
dehydratácia
|
|
| Poruchy gastrointesti- nálneho traktu
| nevoľnosť,
hnačka,
vracanie†,
bolesť brucha
| znížená chuť do
jedla, dyspepsia, zápcha, nadúvanie,
abdominálna distenzia, refluxná
choroba pažeráka, grganie
|
| akútna
pankreatitída
| nemechanická
intestinálna obštrukcia
|
Poruchy pečene
a žlčových ciest
|
|
| cholelitiáza,
cholecystitída
|
|
|
Poruchy kože a podkožného tkaniva
|
|
|
| angioedém#
|
|
Celkové poruchy a reakcie v
mieste podania
|
| únava
| reakcie v
mieste podania
|
|
|
Laboratórne a
funkčné
vyšetrenia
|
| sínusová
tachykardia, atrioventrikulárna blokáda 1. stupňa (AVB)
|
|
|
|
# Z postmarketingových hlásení
* Zdokumentovaná, symptomatická hypoglykémia s hladinou glukózy v krvi ≤ 3,9 mmol/l
† Len pre 1,5 mg dávku. Pre dulaglutid 0,75 mg, frekvencia nežiaducich reakcií patrila do nižšej skupiny incidencie.
Opis vybraných nežiaducich reakciíHypoglykémiaAk sa 0,75 mg a 1,5 mg dulaglutidu použilo ako monoterapia alebo v kombinácii s liečbou
metformínom samotným alebo s metformínom a pioglitazónom, miera výskytu zdokumentovanej symptomatickej hypoglykémie bola 5,9 % až 10,9 % a frekvencia 0,14 – 0,62 epizód/pacienta/rok a
neboli hlásené žiadne epizódy závažnej hypoglykémie.
Miera výskytu zdokumentovanej symptomatickej hypoglykémie, keď sa pridalo 0,75 mg a 1,5 mg dulaglutidu k režimu pozostávajúcemu zo sulfonylurey a metformínu bola 39 % a 40,3 % a frekvencia
1,67 a 1,67 epizód/pacienta/rok. Miera výskytu závažnej hypoglykémie bola 0 % a 0,7 % a frekvencia
0,00 a 0,01 epizód/pacienta/rok pre každú dávku v uvedenom poradí. Miera výskytu zdokumentovanej symptomatickej hypoglykémie pri použití 1,5 mg dulaglutidu so samotnou sulfonylureou bola 11,3 %
a frekvencia 0,90 epizód/pacienta/rok a neboli zistené žiadne závažné epizódy hypoglykémie.
Miera výskytu zdokumentovanej symptomatickej hypoglykémie pri použití 1,5 mg dulaglutidu
v kombinácii s inzulínom glargínom bola 35,3 % a frekvencia 3,38 epizód/pacienta/rok. Miera výskytu závažnej hypoglykémie bola 0,7 % a frekvencia 0,01 epizód/pacienta/rok.
Miera výskytu hypoglykémie, keď sa pridalo 0,75 mg a 1,5 mg dulaglutidu k prandiálnemu inzulínu bola 85,3 % a 80,0 % a frekvencia 35,66 a 31,06 epizód/pacienta/rok. Miera výskytu závažnej hypoglykémie bola 2,4 % a 3,4 % a frekvencia 0,05 a 0,06 epizód/pacienta/rok.
Gastrointestinálne nežiaduce udalosti
Kumulatívne hlásenie gastrointestinálnych udalostí počas až 104 týždňov s dulaglutidom 0,75 mg a 1,5 mg zahŕňalo nevoľnosť (12,9 % a 21,2 %), hnačku (10,7 % a 13,7 %) a vracanie (6,9 % a
11,5 %). Tieto udalosti boli obvykle mierne alebo stredne závažné, bolo hlásené, že dosiahli vrchol
počas prvých 2 týždňov liečby, v priebehu nasledujúcich 4 týždňov ich počet rýchlo klesal a ich miera výskytu potom ostala relatívne nemenná.
Vo farmakologických klinických štúdiách v trvaní najviac 6 týždňov, uskutočnených na pacientoch s diabetom 2. typu, bola väčšina gastrointestinálnych udalostí hlásená počas prvých 2-3 dní od podania počiatočnej dávky a s nasledujúcimi dávkami klesala.
Akútna pankreatitída
Incidencia akútnej pankreatitídy vo fáze II a II klinických štúdií bola 0,07 % pre dulaglutid v porovnaní s 0,14 % pre placebo a 0,19 % pre komparátorov s/bez prídavnej podpornej antidiabetickej liečby.
Enzýmy pankreasu
Dulaglutid sa spája so zvýšenou hladinou pankreatických enzýmov (lipáza a/alebo pankreatická amyláza) v priemere o 11 % až 21 % oproti vstupným hodnotám (pozri časť 4.4). V prípade, že nie sú prítomné iné symptómy akútnej pankreatitídy, zvýšená hladina samotných pankreatických enzýmov nie je predikciou akútnej pankreatitídy.
Zvýšená srdcová frekvencia
Dulaglutid sa spája s nízkym priemerným zvýšením srdcovej frekvencie v hodnotách 2-4 údery za minútu (bpm) a s 1,4 % výskytom sínusovej tachykardie so súčasným nárastom o ≥ 15 bpm oproti
východiskovej hodnote.
AV blokáda 1. stupňa/predĺženie PR intervalu
Dulaglutid sa spája s nízkym priemerným zvýšením PR intervalu o 2-3 msec oproti východiskovej hodnote a s 1,5 % (pri 0,75 mg) a 2,4 % (pri 1,5 mg) výskytom AV blokády 1. stupňa.
Imunogenicita
V klinických štúdiách bola liečba dulaglutidom spojená s 1,6 % incidenciou náhleho zvýšenia dulaglutidových protilátok, čo znamená, že štrukturálne zmeny v GLP 1 a modifikované časti IgG4 dulaglutidovej molekuly, spolu s vysokou homológiou s natívnym GLP 1 a natívnym IgG4, minimalizovali riziko imunitnej reakcie na dulaglutid. Pacienti s dulaglutidovými protilátkami mali vo všeobecnosti nízke titre, a hoci počet pacientov, u ktorých sa vytvorili dulaglutidové protilátky bol nízky, vyhodnotenie študijných dát fázy III neodhalilo žiadny zrejmý vplyv dulaglutidových protilátok na zmeny v HbA1c. U žiadneho z týchto pacientov so systémovou hypersenzitivitou sa nevyvinuli dulaglutidové protilátky.
Hypersenzitivita
U 0,5 % pacientov užívajúcich dulaglutid boli vo fázach II a III klinických štúdií hlásené prípady systémovej hypersenzitivity (napr. urtikária, edém). Počas prítomnosti dulaglutidu na trhu boli hlásené prípady anafylaktických reakcií.
R
eakcie v mieste podania
Nežiaduce udalosti v mieste podania boli hlásené u 1,9 % pacientov používajúcich dulaglutid. Možné nežiaduce udalosti v mieste podania spôsobené imunitnou reakciou organizmu (napr. vyrážka, erytém) boli hlásené u 0,7 % pacientov a boli väčšinou mierne.
Prerušenie liečby ako následok nežiaducich účinkovV klinických štúdiách s dĺžkou 26 týždňov bol výskyt prerušenia liečby ako následku nežiaducich udalostí s 0,75 mg dulaglutidom 2,6 % a s1,5 mg 6,1 % oproti prerušeniu liečby u placeba 3,7 %.
V priebehu trvania celej klinickej štúdie (až 104 týždňov) bol výskyt prerušenia liečby ako následku nežiaducich účinkov s 0,75 mg dulaglutidom 5,1 % a s 1,5 mg 8,4 %. Najčastejšími nežiaducimi
účinkami vedúcimi k prerušeniu liečby boli nevoľnosť (1,0 % a 1,9 %), hnačka (0,5 % a 0,6 %) a vracanie (0,4 % a 0,6 %), ktoré boli obvykle hlásené počas prvých 4-6 týždňov.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieÚčinky predávkovania dulaglutidom v klinických štúdiách zahŕňajú gastrointestinálne poruchy a hypoglykémiu. V prípade predávkovania sa má začať s vhodnou podpornou liečbou podľa toho, aké sú klinické prejavy a príznaky pacienta.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antidiabetiká, antidiabetiká s výnimkou inzulínov; ATC kód: A10BJ05
MechanizmusúčinkuDulaglutid je agonista receptora glukagónu podobného peptidu 1 (GLP-1) s dlhodobým účinkom. Jedna molekula obsahuje 2 identické disulfidovým mostíkom spojené reťazce, z ktorých každý obsahuje modifikovanú ľudskú sekvenciu GLP-1 analógu kovalentne naviazanú na fragment ťažkého reťazca (Fc) modifikovaného ľudského imunoglobulínu G4 (IgG4) prostredníctvom malého peptidového linkera. GLP-1 analógová časť dulaglutidu je približne na 90 % homologická s prirodzeným ľudským GLP-1 (7-37). Prirodzený GLP-1 má polčas rozpadu 1,5-2 minúty ako následok degradácie prostredníctvom DPP-4 a renálneho klírensu. Na rozdiel od prirodzeného GLP-1 je dulaglutid rezistentný voči degradácii prostredníctvom DPP-4 a jeho objemnosť spomaľuje absorpciu
a znižuje renálny klírens. V dôsledku týchto technických vlastností vzniká rozpustná zmes
s predĺženým polčasom 4,7 dňa, čo umožňuje jej subkutánne podávanie raz týždenne. Okrem toho
bola molekula dulaglutidu navrhnutá tak, aby zabránila imunitnej odpovedi závislej od Fcγ receptora a
aby znižovala jeho imunogénny potenciál.
Dulaglutid vykazuje viaceré antihyperglykemické aktivity GLP-1. Pri zvýšenej koncentrácii glukózy dulaglutid zvyšuje intracelulárnu koncentráciu cyklického AMP (cAMP) v pankreatických beta bunkách, čo vedie k uvoľňovaniu inzulínu. Dulaglutid potláča sekréciu glukagónu, o ktorej je známe, že je u pacientov s diabetom 2. typu neprimerane zvýšená. Nižšie koncentrácie glukagónu vedú
k zníženiu vylučovania glukózy pečeňou. Dulaglutid tiež spomaľuje vyprázdňovanie žalúdka.
FarmakodynamickéúčinkyDulaglutid zlepšuje glykemickú kontrolu prostredníctvom dlhodobého účinku zníženia koncentrácie glukózy nalačno, pred jedlom a po jedle u pacientov s diabetom 2. typu, so začiatkom po prvom podaní dulaglutidu a pretrváva počas celého dávkovacieho intervalu raz týždenne.
Farmakodynamická klinická štúdia s dulaglutidom ukázala u pacientov s diabetom 2. typu obnovenie prvej fázy sekrécie inzulínu na úroveň, ktorá prekročila hladinu pozorovanú u zdravých subjektov na liečbe placebom a zlepšenie druhej fázy sekrécie inzulínu ako odpovede na intravenózny bolus glukózy. V tej istej klinickej štúdii sa ukázalo, že jediná 1,5 mg dávka dulaglutidu zvýšila maximálnu sekréciu inzulínu z β-buniek a v porovnaní s placebom zlepšila funkciu β-buniek u subjektov s diabetom 2. typu.
V súlade s farmakokinetickým profilom, dulaglutid má farmakodynamický profil vhodný na
podávanie raz týždenne (pozri časť 5.2).
Klinická účinnosť abezpečnosťGlykemická kontrolaBezpečnosť a účinnosť dulaglutidu boli hodnotené v deviatich randomizovaných, kontrolovaných klinických štúdiách fázy III, ktorých sa zúčastnilo 6 193 pacientov s diabetom 2. typu. Z nich 1 206 bolo vo veku ≥ 65 rokov, z ktorých 119 malo ≥ 75 rokov. Tieto klinické štúdie zahŕňali 3 808 pacientov liečených dulaglutidom, z ktorých 2 250 pacientom bola podávaná Trulicity v dávke 1,5 mg za týždeň a 1 558 pacientom bola podávaná Trulicity v dávke 0,75 mg za týždeň. Vo všetkých klinických štúdiách dulaglutid vyvolával klinicky významné zlepšenie glykemickej kontroly meranej pomocou glykovaného hemoglobínu A1c (HbA1c).
MonoterapiaDulaglutid bol hodnotený v 52- týždňovej klinickej štúdii kontrolovanej metformínom v monoterapii. Trulicity 1,5 mg a 0,75 mg bola lepšia ako metformín (1500-2000 mg/deň) v znižovaní hodnoty
HbA1c oproti východiskovým hodnotám a signifikantne vyššie percento pacientov dosiahlo za
26 týždňov cieľovú hodnotu HbA1c < 7,0 % a ≤ 6,5 % pri používaní Trulicity v porovnaní s metformínom.
Tabuľka 2: Výsledky 52-týždňovej štúdie s aktívne kontrolovanou monoterapiou s dvomi dávkami dulaglutidu v porovnaní s metformínom.
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny tel. hodnota zmena HbA1c FBG hmotnosti HbA1c HbA1c
(%) (%) <7,0% (%) ≤6,5% (%) (mmol/l) (kg)
|
26 týždňov
|
Dulaglutid 1,5 mg
raz týždenne (n=269)
|
7,63
|
-0,78††
|
61,5#
|
46,0##
|
-1,61
|
-2,29
|
Dulaglutid 0,75 mg
raz týždenne (n=270)
|
7,58 -0,71††
|
62,6#
|
40,0#
|
-1,46
|
-1,36#
|
Metformín
1500-2000 mg/deň
(n=268)
|
7,60 -0,56
|
53,6
|
29,8
|
-1,34
|
-2,22
|
52 týždňov
|
Dulaglutid 1,5 mg
raz týždenne (n=269)
|
7,63
|
-0,70††
|
60,0#
|
42,3##
|
-1,56#
|
-1,93
|
Dulaglutid 0,75 mg
raz týždenne (n=270)
|
7,58 -0,55†
|
53,2
|
34,7
|
-1,00
|
-1,09#
|
Metformín
1500-2000 mg/deň
(n=268)
|
7,60
|
-0,51
|
48,3
|
28,3
|
-1,15
|
-2,20
|
† multiplicitne upravená 1-stranná p-hodnota < 0,025 pre nonferioritu †† multiplicitne upravená
1-stranná p-hodnota < 0,025 pre superioritu dulaglutidu nad metformínom, vyhodnotené iba pre
HbA1c
# p < 0,05; ## p < 0, 001 liečebná skupina s dulaglutidom v porovnaní s metformínom
Miera výskytu zdokumentovanej symptomatickej hypoglykémie pri liečbe s 1,5 mg a 0,75 mg Trulicity bola 0,62 a 0,15 a 0,09 epizód/pacienta/rok. Neboli zaznamenané žiadne prípady závažnej hypoglykémie.
K
ombinovaná terapia s metformínom
Bezpečnosť a účinnosť dulaglutidu boli hodnotené v klinickej štúdii kontrolovanej placebom a aktívnou látkou (sitagliptínom 100 mg denne) v trvaní 104 týždňov, všetko v kombinácii s metformínom. Liečba s 1,5 mg a 0,75 mg Trulicity mala za následok výraznejšie zníženie hodnoty HbA1c v porovnaní so sitagliptínom po 52 týždňoch, čo bolo sprevádzané podstatne vyšším percentom pacientov dosahujúcich cieľové hodnoty HbA1c < 7,0 % a ≤ 6,5 %. Tieto účinky pretrvávali až do konca klinickej štúdie (104 týždňov).
Tabuľka 3: Výsledky 104-týždňovej štúdie s placebom a aktívne kontrolovanou monoterapiou s dvomi dávkami dulaglutidu v porovnaní so sitagliptínom.
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny hodnota zmena HbA1c FBG tel. HbA1c HbA1c hmotnosti
(%) (%) <7,0 %(%) ≤6,5 %(%) (mmol/l) (kg)
|
26 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=304)
|
8,12
|
-1,22‡‡,##
|
60,9**,##
|
46,7**,##
|
-2,38**,##
|
-3,18**,##
|
Dulaglutid 0,75 mg raz
týždenne (n=302)
|
8,19
|
-1,01‡‡,##
|
55,2**,##
|
31,0**,##
|
-1,97**,##
|
-2,63**,##
|
Placebo (n= 177)
| 8,10
| 0,03
| 21,0
| 12,5
| -0,49
| -1,47
|
Sitagliptín 100 mg raz
denne (n=315)
|
8,09
|
-0,61
|
37,8
|
21,8
|
-0,97
|
-1,46
|
52 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=304)
|
8,12
|
-1,10††
|
57,6##
|
41,7##
|
-2,38##
|
-3,03##
|
Dulaglutid 0,75 mg raz
týždenne (n=302)
|
8,19
|
-0,87††
|
48,8##
|
29,0##
|
-1,63##
|
-2,60##
|
Sitagliptín 100 mg raz
denne(n=315)
|
8,09
|
-0,39
|
33,0
|
19,2
|
-0,90
|
-1,53
|
104 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=304)
|
8,12
|
-0,99††
|
54,3##
|
39,1##
|
-1,99##
|
-2,88##
|
Dulaglutid 0,75 mg raz
týždenne (n=302)
|
8,19
|
-0,71††
|
44,8##
|
24,2##
|
-1,39##
|
-2,39
|
Sitagliptín 100 mg raz
denne (n=315)
|
8,09
|
-0,32
|
31,1
|
14,1
|
-0,47
|
-1,75
|
†† multiplicitne upravená 1-stranná p-hodnota < 0,025 pre superioritu dulaglutidu v porovnaní so
sitagliptínom, vyhodnotené iba pre HbA1c po 52 a 104 týždňoch
‡‡ multiplicitne upravená 1-stranná p-hodnota < 0,001 pre superioritu dulaglutidu v porovnaní s placebom, vyhodnotené iba pre HbA1c
** p < 0,001 liečebná skupina s dulaglutidom v porovnaní s placebom
## p < 0,001 liečebná skupina s dulaglutidom v porovnaní so sitagliptínom
Miera výskytu zdokumentovanej symptomatickej hypoglykémie pri liečbe s 1,5 mg a 0,75 mg Trulicity bola 0,19 a 0,18 a 0,17 epizód/pacienta/rok. Počas liečby s dulaglutidom neboli pozorované žiadne prípady závažnej hypoglykémie.
Bezpečnosť a účinnosť dulaglutidu boli tiež hodnotené v klinickej štúdii kontrolovanej aktívnou látkou (1,8 mg liraglutidu denne) v trvaní 26 týždňov, oba lieky v kombinácii s metformínom. Liečba s Trulicity 1,5 mg mala v porovnaní s liraglutidom za následok podobné zníženie hodnoty HbA1c a pacienti dosiahli cieľové hodnoty HbA1c < 7,0 % a ≤ 6,5 % v porovnaní s liraglutidom.
Tabuľka 4: Výsledky 26-týždňovej aktívne kontrolovanej štúdie s jednou dávkou dulaglutidu v porovnaní s liraglutidom
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny tel. hodnota zmena HbA1c FBG hmotnosti HbA1c HbA1c
(%) (%) <7,0 %(%) ≤6,5 %(%) (mmol/l) (kg)
|
26 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=299)
|
8,06
|
-1,42‡
|
68,3
|
54,6
|
-1,93
|
-2,90#
|
Liraglutid+ 1,8 mg
denne (n=300)
|
8,05
|
-1,36
|
67,9
|
50,9
|
-1,90
|
-3,61
|
‡ 1-stranná p-hodnota p < 0,001 pre noninferioritu dulaglutidu v porovnaní s liraglutidom,
vyhodnotené iba pre HbA1c.
# p < 0,05 liečebná skupina s dulaglutidom v porovnaní s liraglutidom.
+ Pacienti randomizovaní na liraglutid začali s dávkou 0,6 mg denne. Po 1. týždni boli pacienti pretitrovaní na 1,2 mg denne, a potom po 2. týždni na 1,8 mg denne.
Miera výskytu zdokumentovanej symptomatickej hypoglykémie s dulaglutidom 1,5 mg bola
0,12 epizód/pacienta/rok a pri liraglutide to bolo 0,29 epizód/pacienta/rok. Neboli pozorované žiadne prípady závažnej hypoglykémie.
Kombinovaná terapia s metformínom a sulfonylureouV klinickej štúdii kontrolovanej aktívnou látkou v trvaní 78 týždňov bol dulaglutid porovnávaný s inzulínom glargínom, oba spolu s metformínom a sulfonylureou. Po 52 týždňoch 1,5 mg Trulicity vykazovala výraznejšie zníženie hodnoty HbA1c oproti inzulínu glargínu, ktorý pretvával počas
78 týždňov; zatiaľ čo s 0,75 mg Trulicity zníženie HbA1c nebolo horšie oproti inzulínu glargínu. S 1,5 mg Trulicity dosiahlo podstatne vyššie percento pacientov cieľové hodnoty HbA1c < 7,0 %
alebo ≤ 6,5 % v 52. a 78. týždni v porovnaní s inzulínom glargínom.
Tabuľka 5: Výsledky 78-týždňovej aktívne kontrolovanej štúdie s dvomi dávkami dulaglutidu v porovnaní s inzulínom glargínom
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny tel. hodnota zmena HbA1c FBG hmotnosti HbA1c HbA1c
(%) (%) <7,0 %(%) ≤6,5 %(%) (mmol/l) (kg)
|
52 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=273)
|
8,18
|
-1,08††
|
53,2##
|
27,0##
|
-1,50
|
-1,87##
|
Dulaglutid 0,75 mg
raz týždenne (n=272)
|
8,13
|
-0,76†
|
37,1
|
22,5#
|
-0,87##
|
-1,33##
|
Inzulín glargín+ raz
denne (n=262)
|
8,10
|
-0,63
|
30,9
|
13,5
|
-1,76
|
1,44
|
78 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=273)
|
8,18
|
-0,90††
|
49,0##
|
28,1##
|
-1,10#
|
-1,96##
|
Dulaglutid 0,75 mg
raz týždenne (n=272)
|
8,13
|
-0,62†
|
34,1
|
22,1
|
-0,58##
|
-1,54##
|
Inzulín glargín+ raz
denne (n=262)
|
8,10
|
-0,59
|
30,5
|
16,6
|
-1,58
|
1,28
|
† multiplicitne upravená 1-stranná p-hodnota < 0,025 pre nonferioritu; †† multiplicitne upravená
1-stranná p-hodnota < 0,025 pre superioritu dulaglutidu nad inzulínom glargínom, vyhodnotené iba pre HbA1c
# p < 0,05, ## p < 0,001 liečebná skupina s dulaglutidom v porovnaní s inzulínom glargínom
+ Dávky inzulínu glargínu boli upravené s použitím algoritmu s cieľovou hodnotou plazmovej glukózy nalačno < 5,6 mmol/l
Miera výskytu zdokumentovanej symptomatickej hypoglykémie počas používania 1,5 mg a 0,75 mg
Trulicity a inzulínu glargínu bola 1,67; 1,67 a 3,02 epizód/pacienta/rok, v uvedenom poradí. Boli
zaznamenané dva prípady závažnej hypoglykémie pri Trulicity 1,5 mg a dva prípady závažnej hypoglykémie pri inzulíne glargíne.
Kombinovaná terapia so sulfonylureou
Bezpečnosť a účinnosť dulaglutidu po pridaní k sulfonyluree boli hodnotené v placebom kontrolovanej 24-týždňovej klinickej štúdii. Liečba s Trulicity 1,5 mg v kombinácii s glimepiridom
viedla k štatisticky významnej redukcii HbA1c v porovnaní s placebom a glimepiridom počas
24 týždňov. Po 24 týždňoch dosiahlo cieľové hodnoty < 7,0 % a ≤ 6,5 % HbA1c signifikantne vyššie percento pacientov liečených s Trulicity 1,5 mg v porovnaní s placebom.
Tabuľka 6: Výsledky 24-týždňovej placebom kontrolovanej štúdie s dulaglutidom ako prídavnej
liečby ku glimepiridu.
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny tel. hodnota zmena HbA1c FBG hmotnosti HbA1c HbA1c
(
%) (%) <7,0% (%) ≤6,5% (%) (mmol/l) (kg)
|
2
4 týždňov
|
Dulaglutid 1,5 mg
raz týždenne (n=239)
|
8,39
|
‡‡
|
‡‡
|
**
|
‡‡
|
-0,91
|
Placebo (n=60)
|
8,39
|
-0,11
|
18,9
|
9,4
|
0,16
|
-0,24
|
|
|
-1,38
55,3
40,0
-1,70
‡‡ p < 0,001 pre superioritu dulaglutidu v porovnaní s placebom, s celkovou kontrolovanou chybou
typu I
** p < 0,001 pre dulaglutidové liečebné rameno v porovnaní s placebom
Miera výskytu zdokumentovanej symptomatickej hypoglykémie počas používania Trulicity 1,5 mg
a placeba bola 0,90 a 0,04 prípadov/pacienta/rok v danom poradí. Neboli pozorované žiadne prípady závažnej hypoglykémie pre Trulicity ani placebo.
Kombinovaná liečba inhibítorom SGLT2 s metformínom alebo bez metformínu
Bezpečnosť a účinnosť dulaglutidu po pridaní k liečbe inhibítorom sodík-glukózového kotransportéra
2 (SGLT2i) (96 % s metformínom a 4 % bez metformínu) sa hodnotili v placebom kontrolovanej štúdii v trvaní 24 týždňov. Liečba s Trulicity 0,75 mg alebo Trulicity 1,5 mg v kombinácii s liečbou SGLT2i po 24 týždňoch preukázala štatisticky významné zníženie hodnôt HbA1c v porovnaní s placebom a SGLT2i. Pri užívaní Trulicity 0,75 mg aj 1,5 mg dosiahlo v 24. týždni podstatne vyššie percento pacientov cieľovú hodnotu HbA1c < 7,0 % a ≤ 6,5 % v porovnaní s placebom.
Tabuľka č. 7: Výsledky 24-týždňovej placebom kontrolovanej štúdie s dulaglutidom ako doplnkom k liečbe s SGLT2i
Vstupná Priemerná Pacienti s cieľovým Zmena Zmena hodnota zmena HbA1c FBG telesnej HbA1c HbA1c hmotnosti
(
%) (%)
<
7,0
%^ (%) ≤6,5% (%) (mmol/L) (kg)
|
2
4 týždňov
|
Dulaglutid 0,75 mg
raz týždenne (n=141)
|
8,05
|
-1,19‡‡
|
58,8
|
38,9**
|
-1,44
|
-2,6
|
Dulaglutid 1,5 mg
raz týždenne (n=142)
|
8,04
|
‡‡
|
‡‡
|
**
|
-1,77
|
-3,1
|
Placebo (n=140)
|
8,05
|
-0,51
|
31,2
|
14,6
|
-0,29
|
-2,3
|
|
|
-1,33
67,4
50,8
‡‡ p < 0,001 pre superioritu dulaglutidu oproti placebu, s celkovou kontrolovanou chybou typu I
** p < 0,001 pre skupinu liečenú dulaglutidom v porovnaní s placebom
^ pacienti, ktorí odstúpili z randomizovanej liečby pred 24. týždňom sa považovali za nespĺňajúcich cieľ
Miera výskytu zdokumentovanej symptomatickej hypoglykémie pri užívaní Trulicity 0,75 mg, Trulicity 1,5 mg a placeba bola 0,15; 0,16 a 0,12 epizód/pacienta/rok v uvedenom poradí. Jeden
pacient nahlásil závažnú hypoglykémiu pri užívaní Trulicity 0,75 mg v kombinácii s liečbou SGLT2i
a žiadny pri užívaní Trulicity 1,5 mg alebo placeba.
Kombinovaná terapia s metformínom a pioglitazónomV klinickej štúdii kontrolovanej placebom a aktívnou látkou (exenatidom dvakrát denne), oba
v kombinácii s metformínom a pioglitazónom, 1,5 mg a 0,75 mg Trulicity vykazovala významné zníženie hodnoty HbA1c v porovnaní s placebom a exenatidom. Bolo to sprevádzané podstatne vyšším percentom pacientov, ktorí dosiahli cieľovú hodnotu HbA1c < 7,0 % alebo ≤ 6,5 %.
Tabuľka 8: Výsledky 52-týždňovej aktívne kontrolovanej štúdie s dvomi dávkami dulaglutidu v porovnaní s exenatidom
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny tel. hodnota zmena HbA1c FBG hmotnosti HbA1c HbA1c
(%) (%) <7,0 %(%) ≤6,5 %(%) (mmol/l) (kg)
|
26 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=279)
|
8,10
|
-1,51‡‡,††
|
78,2**,##
|
62,7**,##
|
-2,36**,##
|
-1,30**
|
Dulaglutid 0,75 mg
raz týždenne (n=280)
|
8,05
|
-1,30‡‡/††
|
65,8**/##
|
53,2**/##
|
-1,90**/##
|
0,20 */##
|
Placebo (n=141)
| 8,06
| -0,46
| 42,9
| 24,4
| -0,26
| 1,24
|
Exenatid+ 10 mcg
2x denne (n=276)
|
8,07
|
-0,99
|
52,3
|
38,0
|
-1,35
|
-1,07
|
52 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=279)
|
8,10
|
-1,36††
|
70,8##
|
57,2##
|
-2,04##
|
-1,10
|
Dulaglutid 0,75 mg
raz týždenne (n=280)
|
8,05
|
-1,07††
|
59,1#
|
48,3##
|
-1,58#
|
0,44#
|
Exenatid+ 10 mcg
2x denne (n=276)
|
8,07
|
-0,80
|
49,2
|
34,6
|
-1,03
|
-0,80
|
†† multiplicitne upravená 1-stranná p-hodnota < 0,025 pre superioritu dulaglutidu nad exenatidom,
vyhodnotené iba pre HbA1c
‡‡ multiplicitne upravená 1-stranná p-hodnota < 0,001 pre superioritu dulaglutidu v porovnaní s placebom, vyhodnotené iba pre HbA1c
* p < 0,05,** p < 0,001 liečebná skupina s dulaglutidom v porovnaní s placebom
# p < 0,05,## p < 0,001 liečebná skupina s dulaglutidom v porovnaní s exenatidom
+ Dávka exenatidu bola počas prvých 4 týždňov 5 mcg dvakrát denne a potom 10 mcg dvakrát denne.
Miera výskytu zdokumentovanej symptomatickej hypoglykémie počas používania 1,5 mg a 0,75 mg
Trulicity bola 0,19 a 0,14 a 0,75 epizód/pacienta/rok. Pri dulaglutide neboli pozorované žiadne
prípady závažnej hypoglykémie a pri exenatide dvakrát denne boli zaznamenané dva prípady závažnej hypoglykémie.
Kombinovaná terapia s titrovaným bazálnym inzulínom, s alebo bez metformínuV 28-týždňovej placebom kontrolovanej štúdii sa porovnávala Trulicity 1,5 mg s placebom ako prídavnou liečbou k titrovanému bazálnemu inzulínu glargínu (88 % s a 12 % bez metformínu), aby sa vyhodnotil účinok na glykemickú kontrolu a bezpečnosť. Na optimalizáciu dávky inzulínu glargínu, sa obe skupiny titrovali na cieľovú hladinu sérovej glukózy nalačno <5,6 mmol/l. Stredná východisková hodnota inzulínu glargínu bola 37 jednotiek/deň u pacientov užívajúcich placebo a 41 jednotiek/deň
u pacientov užívajúcich Trulicity 1,5 mg. Počiatočné hodnoty inzulínu glargínu u pacientov s HbA1c
< 8.0 % boli zredukované o 20 %. Na konci 28-týždňovej liečebnej periódy bola dávka
65 jednotiek/deň pre pacientov užívajúcich placebo a 51 jednotiek/deň pre pacientov s Trulicity
1,5 mg. Po 28 týždňoch viedla liečba s Trulicity 1.5 mg raz týždenne ku štatisticky významnej redukcii HbA1c v porovnaní s placebom a významne vyššie percento pacientov dosiahlo cieľové
hodnoty HbA1c < 7,0 % a ≤ 6,5 % (Tabuľka 9).
Tabuľka 9: Výsledky 28-týždňovej štúdie porovnania dulaglutidu a placeba ako prídavnej liečby
k titrovanému inzulínu glargínu.
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny tel. hodnota zmena HbA1c FBG hmotnosti HbA1c HbA1c
(%) (%) <7,0 %(%) ≤6,5 %(%) (mmol/l) (%)
|
28 týždňov
|
Dulaglutid 1,5 mg
raz týždenne
a inzulín glargín
(n=150)
|
8,41
|
-1,44‡‡
|
66,7‡‡
|
50,0**
|
-2,48‡‡
|
-1,91‡‡
|
Placebo raz týždenne
a inzulín glargín
(n=150)
|
8,32
|
-0,67
|
33,3
|
16,7
|
-1,55
|
0,50
|
‡‡ p < 0,001 pre superioritu dulaglutidu v porovnaní s placebom, s celkovou kontrolovanou chybou typu I
** p < 0,001 dulaglutidové rameno v porovnaní s placebom
Miera výskytu zdokumentovanej symptomatickej hypoglykémie počas používania Trulicity 1,5 mg a inzulínu glargín bola 3,38 epizód/pacienta/rok v porovnaní s placebom a inzulínom glargín 4,38 epizód/pacienta/rok. Jeden pacient hlásil závažnú hypoglykémiu pri liečbe s Trulicity 1,5 mg a žiadny pri placebe.
Kombinovaná terapia s prandiálnym inzulínom a s metformínom alebo bez metformínuV tejto klinickej štúdii pacienti, ktorí pred zaradením do štúdie používali 1 alebo 2 injekcie inzulínu denne, ukončili svoj inzulínový režim pred klinickým skúšaním a boli randomizovaní na dulaglutid raz týždenne alebo inzulín glargín raz denne, oba v kombinácii s prandiálnym inzulínom lispro trikrát denne, s metformínom alebo bez metformínu. V 26. týždni bola 1,5 mg a 0,75 mg Trulicity lepšia ako inzulín glargín v znižovaní hladiny HbA1c a tento účinok pretrval až do 52. týždňa. Vyššie percento pacientov tiež dosiahlo cieľové hodnoty HbA1c < 7,0 % alebo ≤ 6,5 % v 26. týždni a hodnoty < 7,0 % v 52. týždni oproti tým, čo používali inzulín glargín.
Tabuľka 10: Výsledky 52-týždňovej aktívne kontrolovanej štúdie s dvomi dávkami dulaglutidu v porovnaní s inzulínom glargínom
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny tel. hodnota zmena HbA1c FBG hmotnosti HbA1c HbA1c
(%) (%) <7,0 %(%) ≤6,5 %(%) (mmol/l) (%)
|
26 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=295)
|
8,46
|
-1,64††
|
67,6#
|
48,0#
|
-0,27##
|
-0,87##
|
Dulaglutid 0,75 mg
raz týždenne (n=293)
|
8,40
|
-1,59††
|
69,0#
|
43,0
|
0,22##
|
0,18##
|
Inzulín glargín+
raz denne (n=296)
|
8,53
|
-1,41
|
56,8
|
37,5
|
-1,58
|
2,33
|
52 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=295)
|
8,46
|
-1,48††
|
58,5#
|
36,7
|
0,08##
|
-0,35##
|
Dulaglutid 0,75 mg
raz týždenne (n=293)
|
8,40
|
-1,42††
|
56,3
|
34,7
|
0,41##
|
0,86##
|
Inzulín glargín+
raz denne (n=296)
|
8,53
|
-1,23
|
49,3
|
30,4
|
-1,01
|
2,89
|
†† multiplicitne upravená 1-stranná p-hodnota < 0,025 pre superioritu dulaglutidu v porovnaní s
inzulínom glargínom, vyhodnotené iba pre HbA1c
# p < 0,05; ## p < 0,001 liečebná skupina s dulaglutidom v porovnaní s inzulínom glargínom
+ Dávky inzulínu glargínu boli upravené s použitím algoritmu s cieľovou hodnotou plazmovej glukózy nalačno < 5,6 mmol/l
Miera výskytu zdokumentovanej symptomatickej hypoglykémie počas používania 1,5 mg a 0,75 mg Trulicity a inzulínu glargínu bola 31,06; 35,66 a 40,95 epizód/pacienta/rok, v uvedenom poradí. Závažná hypoglykémia bola hlásená u desiatich pacientov používajúcich 1,5 mg Trulicity, u siedmich pacientov používajúcich 0,75 mg Trulicity a u pätnástich pacientov používajúcich inzulín glargín.
Glukóza v krvi nalačno
Liečba dulaglutidom mala za následok významné zníženie hladiny glukózy v krvi nalačno oproti
východiskovej hodnote. Najvyšší účinok na hladiny glukózy v krvi nalačno sa vyskytol do 2 týždňov. Zlepšenie hladiny glukózy v krvi nalačno pretrvalo počas najdlhšej klinickej štúdie v trvaní
104 týždňov.
Postprandiálna glukóza
Liečba dulaglutidom mala za následok významné zníženie strednej hladiny postprandiálnej glukózy oproti východiskovým hodnotám (zmeny od východiskových hodnôt po primárny časový
bod -1,95 mmol/l až -4,23 mmol/l).
Funkcia beta-buniek
Klinické štúdie s dulaglutidom ukázali zlepšenie funkcie beta-buniek pri meraní prostredníctvom vyhodnotenia modelu homeostázy (HOMA2-%B). Trvanie účinku na funkciu beta-buniek pretrvalo
počas najdlhšej klinickej štúdie v trvaní 104 týždňov.
Telesná hmotnosť
Trulicity 1,5 mg sa spájala s udržaním poklesu hmotnosti počas trvania klinických štúdií (od
východiskovej hodnoty po finálny časový bod -0,35 kg až -2,90 kg). Zmeny telesnej hmotnosti pri Trulicity 0,75 mg boli v rozmedzí od 0,86 kg do -2,63 kg. Pokles telesnej hmotnosti bol pozorovaný u pacientov, ktorým bol podávaný dulaglutid bez ohľadu na nevoľnosť, hoci pokles mal vyššie numerické hodnoty v skupine s nevoľnosťou.
Pacientom hlásené výsledky
Dulaglutid významne zlepšoval celkovú spokojnosť s liečbou v porovnaní s exenatidom podávaným
dvakrát denne. Okrem toho bola zaznamenaná významne nižšia pozorovaná frekvencia hyperglykémie a hypoglykémie v porovnaní s exenatidom podávaným dvakrát denne.
Krvný tlak
Účinok dulaglutidu na krvný tlak vyhodnotený podľa ambulantného monitorovania krvného tlaku
(ABPM) bol hodnotený v klinickej štúdii, ktorej sa zúčastnilo 755 pacientov s diabetom 2. typu. Pri liečbe dulaglutidom došlo po 16. týždňoch k zníženiu systolického krvného tlaku (SBP) (-2,8 mm Hg rozdiel v porovnaní s placebom). V hodnotách diastolického krvného tlaku (DBP) sa nevyskytli žiadne rozdiely. V poslednom časovom bode klinickej štúdie, po 26 týždňoch, sa u SBP a DBP ukázali rovnaké výsledky.
Kardiovaskulárne hodnotenie
Metaanalýza štúdií fázy II a III
V rámci metaanalýzy registračných štúdií fázy II a III sa celkovo u 51 pacientov (dulaglutid: 26 [N =
3 885]; všetky komparátory: 25 [N = 2 125]) vyskytla aspoň jedna kardiovaskulárna (CV) udalosť (úmrtie v dôsledku CV príčin, nefatálny IM, nefatálna mozgová porážka alebo hospitalizácia kvôli nestabilnej angíne pectoris). Výsledky ukazujú, že sa pri liečbe dulaglutidom v porovnaní s kontrolnou liečbou nevyskytlo zvýšené CV riziko (HR: 0,57; CI: [0,30; 1,10]).
Štúdia hodnotiaca kardiovaskulárne príhody
Dlhodobá kardiovaskulárna štúdia s Trulicity bola placebom kontrolovaná, dvojito zaslepená. Pacienti s diabetom 2. typu boli randomizovaní buď na liečbu Trulicity v dávke 1,5 mg (4 949) alebo
podávanie placeba (4 952), pričom obe skupiny dostávali aj štandardnú liečbu diabetu 2. typu (dávka
vo výške 0,75 mg sa v tejto štúdii nepodávala). Medián času následného sledovania bol 5,4 roka.
Priemerný vek bol 66,2 roka, priemerný BMI bol 32,3 kg/m² a 46,3 % pacientov boli ženy. 3 114 (31,5 %) pacientov malo preukázané kardiovaskulárne ochorenie. Priemerná východisková hladina HbA1c predstavovala 7,2 %. Rameno liečené Trulicity zahŕňalo pacientov vo veku ≥ 65 rokov
(n = 2619) a ≥ 75 rokov (n = 484) a pacientov s miernym (n = 2435), stredne ťažkým (n = 1031) alebo
ťažkým (n = 50) poškodením funkcie obličiek.
Primárnym cieľovým ukazovateľom bol čas od randomizácie do objavenia akejkoľvek závažnej nepriaznivej kardiovaskulárnej udalosti (Major Adverse Cardiovascular Event, MACE) – kardiovaskulárneho úmrtia, nefatálneho infarktu myokardu alebo nefatálnej mozgovej príhody.
V porovnaní s placebom Trulicity dosahovala lepšie výsledky v prevencii MACE (obrázok č. 1). Ako
je znázornené na obrázku č. 2, každá zložka MACE prispievala k zníženiu MACE.
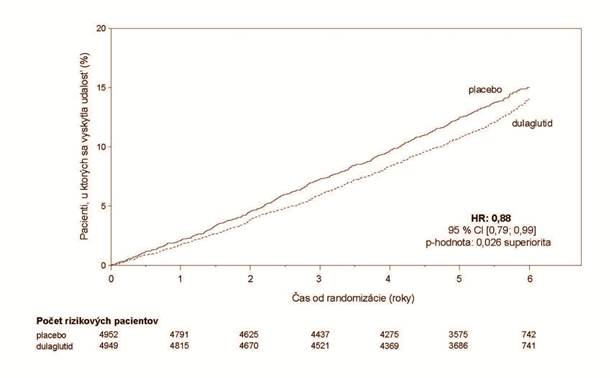
Obrázok č. 1: Kaplanova-Meierova krivka znázorňujúca čas do prvého výskytu kompozitného ukazovateľa: kardiovaskulárneho úmrtia, nefatálneho infarktu myokardu alebo nefatálnej mozgovej
príhody v dlhodobej dulaglutidovej kardiovaskulárnej štúdii
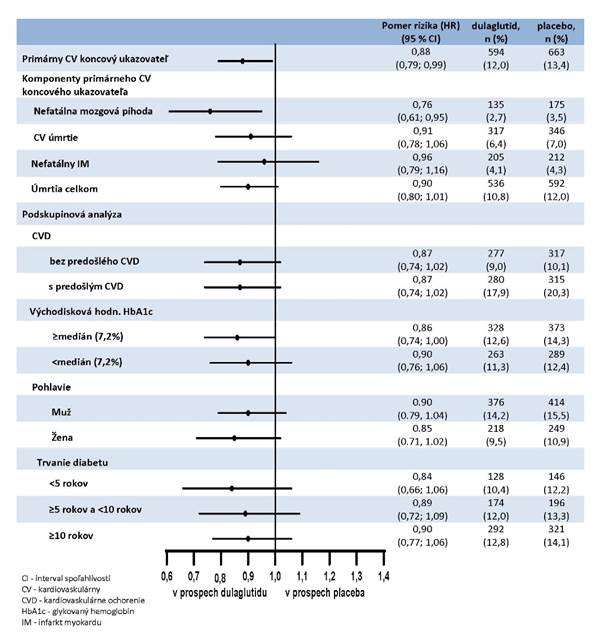
Obrázok č. 2: Grafické znázornenie (Forest plot) analýz jednotlivých druhov kardiovaskulárnych udalostí, úmrtia z akejkoľvek príčiny a konzistentnosti účinku medzi podskupinami pre primárny cieľový ukazovateľ.
Bolo pozorované významné a trvalé zníženie hladín HbA1c medzi východiskovou hodnotou do
60. mesiaca pri porovnaní Trulicity a placeba používanými ako doplnok štandardnej starostlivosti
(-0,29 % verzus 0,22 %; odhadovaný rozdiel liečby (ETD) -0,51 % [-0,57; -0,45]; p < 0,001).
V porovnaní s placebom sa v skupine pacientov liečených Trulicity vyskytlo výrazne menej pacientov, ktorí dostali dodatočnú glykemickú liečbu (Trulicity: 2 086 [42,2 %]; placebo: 2 825 [57,0 %];
p < 0,001).
Osobitné skupiny pacientovPoužitie u pacientov s poruchou funkcie obličiekV 52-týždňovej štúdii sa Trulicity 1,5 mg a 0,75 mg porovnávala s titrovaným inzulínom glargínom,
ako prídavnou liečbou k prandiálnemu inzulínu lispro, na vyhodotenie účinku na glykemickú kontrolu
a bezpečnosť pacientov so stredne závažným až závažným chronickým ochorením obličiek (eGFR
[podľa CKD-EPI] < 60 a ≥ 15 ml/min/1,73 m2). V čase randomizácie pacienti ukončili predštúdijný inzulínový režim. Na začiatku liečby bola celková priemerná eGFR 38 ml/min/1,73 m2, 30 % pacientov malo eGFR < 30 ml/min/1,73 m2.
V 26. týždni nebola 1,5 mg a 0,75 mg Trulicity inferiórna voči inzulínu glargínu v znižovaní HbA1c
a tento účinok pretrvával 52 týždňov. Podobné percento pacientov dosiahlo cieľovú hodnotu HbA1c
< 8,0 % v 26. a 52. týždni pri oboch dávkach dulaglutidu aj inzulínu glargínu.
Tabuľka 11: Výsledky 52-týždňovej aktívne kontrolovanej štúdie s dvomi dávkami dulaglutidu v porovnaní s inzulínom glargínom (u pacientov so stredne závažným až závažným chronickým ochorením obličiek)
HbA1c na Priemerná Pacienti s Zmena FBG Zmena začiatku zmena cieľovým telesnej liečby HbA1c HbA1c hmotnosti
(%) (%) < 8,0% (%) (mmol/l) (kg)
|
26. týždeň
|
Dulaglutid 1,5 mg
raz týždenne (n=192)
|
8,60
|
-1,19†
|
78,3
|
1,28##
|
-2,81##
|
Dulaglutid 0,75 mg
raz týždenne (n=190)
|
8,58
|
-1,12†
|
72,6
|
0,98##
|
-2,02##
|
Inzulín glargín+ raz
denne (n=194)
|
8,56
|
-1,13
|
75,3
|
-1,06
|
1,11
|
52. týždeň
|
Dulaglutid 1,5 mg
raz týždenne (n=192)
|
8,60
|
-1,10†
|
69,1
|
1,57##
|
-2,66##
|
Dulaglutid 0,75 mg
raz týždenne (n=190)
|
8,58
|
-1,10†
|
69,5
|
1,15##
|
-1,71##
|
Inzulín glargín+ raz
denne (n=194)
|
8,56
|
-1,00
|
70,3
|
-0,35
|
1,57
|
† 1-stranná hodnota p < 0,025; non-inferiorita dulaglutidu voči inzulínu glargínu
## p < 0,001 skupina liečby s dulaglutidom v porovnaní s inzulínom glargínom
+ Dávky inzulínu glargínu boli upravené s použitím algoritmu s cieľovou hodnotou plazmatickej glukózy nalačno
≤ 8,3 mmol/L
Miera výskytu zdokumentovanej symptomatickej hypoglykémie pri užívaní 1,5 mg a 0,75 mg Trulicity a pri užívaní inzulínu glargínu boli 4,44; 4,34 a 9,62 epizód/pacienta/rok, v uvedenom poradí. Žiadni pacienti nehlásili závažné prípady hypoglykémie s Trulicity 1,5 mg, šiesti
s Trulicity 0,75 mg a sedemnásti s inzulínom glargínom. Bezpečnostný profil Trulicity u pacientov s poruchou funkcie obličiek bol podobný profilu, ktorý bol pozorovaný v iných štúdiách s Trulicity.
Pediatrická populáciaEurópska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Trulicity v jednej alebo vo viacerých podskupinách pediatrickej populácie, pre schválenú indikáciu pri liečbe ochorenia
diabetes mellitus 2. typu (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpciaPo subkutánnom podaní pacientom s diabetom 2. typu dosahuje dulaglutid maximálne plazmatické koncentrácie v priebehu 48 hodín. Po niekoľkonásobnom subkutánnom podaní 1,5 mg dávky
dulaglutidu pacientom s diabetom 2. typu bola stredná maximálna (Cmax) expozícia približne
114 ng/ml a celková (AUC) expozícia 14 000 ngh/ml. Plazmatické koncentrácie v ustálenom stave
boli dosiahnuté medzi 2 - 4 týždňami podávania dulaglutidu raz týždenne (1,5 mg). Expozície po subkutánnom podaní jednorazovej (1,5 mg) dávky dulaglutidu do brucha, stehna alebo ramena boli porovnateľné. Stredná absolútna biologická dostupnosť dulaglutidu po jednorazovej 1,5 mg a 0,75 mg subkutánne podanej dávke bola 47 % a 65 %, v uvedenom poradí.
D
is
t
ri
b
úcia
Stredný objem distribúcie po subkutánnom podaní 0,75 mg a 1,5 mg dulaglutidu v ustálenom stave u pacientov s diabetom 2. typu bol približne 19,2 l a 17,4 l.
Biotransformácia
Predpokladá sa, že dulaglutid sa rozloží na svoje aminokyselinové zložky obvyklým spôsobom bielkovinového katabolizmu.
Eliminácia
Stredný zdanlivý klírens 0,75 mg a 1,5 mg dulaglutidu u ľudí v ustálenom stave bol 0,111 l/h a
0,107 l/h s polčasom eliminácie 4,7 dní.
Osobitné skupiny pacientov
Starší
Vek nemal klinicky významný účinok na farmakokinetické a farmakodynamické vlastnosti dulaglutidu.
Pohlavie a rasa
Vek a rasa nemali klinicky významný účinok na farmakokinetiku dulaglutidu.
Telesná hmotnosť alebo index telesnej hmotnosti
Farmakokinetické analýzy ukázali štatisticky významný inverzný vzťah medzi telesnou hmotnosťou
alebo indexom telesnej hmotnosti (BMI) a expozíciu dulaglutidu, hoci hmotnosť ani BMI nemali klinicky významný účinok na glykemickú kontrolu.
Porucha funkcie obličiek
Farmakokinetika dulaglutidu sa hodnotila v klinickej farmakologickej štúdii, pričom u zdravých subjektov a pacientov s miernym až závažným poškodením obličiek (CrCl < 30 ml/min), vrátane konečného štádia ochorenia obličiek (vyžadujúceho dialýzu), bola vo všeobecnosti rovnaká. Okrem toho, v 52-týždňovej klinickej štúdii u pacientov s diabetom 2. typu a stredne závažnou až závažnou poruchou funkcie obličiek (eGFR [podľa CKD-EPI] < 60 a ≥ 15 ml/min/1,73 m2), bol farmakokinetický profil Trulicity 0,75 mg a 1,5 mg jedenkrát týždenne podobný ako
v predchádzajúcich klinických štúdiách. Táto klinická štúdia nezahŕňala pacientov s konečným
štádiom poškodenia obličiek.
Porucha funkcie pečene
Farmakokinetika dulaglutidu sa hodnotila v klinickej farmakologickej štúdii. U subjektov s poškodením pečene sa v porovnaní so zdravými kontrolnými skupinami vyskytol štatisticky významný pokles expozície na dulaglutid, až 30 % u stredného Cmax a až 33 % u AUC. U subjektov s väčším poškodením pečene sa obvykle objavil nárast tmax dulaglutidu. Nebola však pozorovaná žiadna tendencia expozície na dulaglutid súvisiaca so stupňom poškodenia pečene. Tieto účinky neboli považované za klinicky významné.
Pediatrická populácia
Neuskutočnili sa žiadne štúdie zamerané na charakterizáciu farmakokinetiky dulaglutidu
u pediatrických pacientov.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje, získané na základe obvyklých farmakologických štúdií o bezpečnosti a toxicite po opakovanom podávaní, neodhalili žiadne osobitné riziko pre ľudí.
V 6-mesačnej štúdii zameranej na karcinogenitu u transgenických myší sa nevyskytla žiadna tumorogénna odpoveď. V 2-ročnej štúdii na potkanoch zameranej na karcinogenitu, pri ≥ 7-násobne vyššej expozícii ako je klinická u ľudí, po podaní 1,5 mg dulaglutidu týždenne, dulaglutid spôsobil
štatisticky významné, s dávkou súvisiace zvýšenie výskytu nádorov C-buniek štítnej žľazy
(kombináciu adenómov a karcinómov). Klinická relevancia týchto zistení je zatiaľ neznáma.
Počas trvania štúdií zameraných na fertilitu, bolo pri hladinách dávok súvisiacich s poklesom príjmu potravy a telesnej hmotnosti u samíc, pozorované zníženie počtu žltých teliesok a predĺženie estrogénového cyklu; neboli však pozorované žiadne účinky na ukazovatele fertility a počatia alebo embryonálny vývoj. V reprodukčných toxikologických štúdiách na potkanoch a králikoch boli pri 11- až 44-násobne vyšších expozíciách dulaglutidu pozorované účinky na kostru a spomalenie rastu plodu, ale neboli pozorované žiadne malformácie plodu. Liečba potkanov počas gravidity a laktácie pri 16- násobne vyšších expozíciách oproti klinickým spôsobovala pamäťový deficit u samičích potomkov. Dávkovanie dulaglutidu u samčích a samičích mláďat potkanov nevyvolalo pamäťový deficit ani pri
91-násobku ľudskej expozície.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
citrát sodný
kyselina citrónová bezvodá manitol
polysorbát 80
voda na injekciu
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 ºC – 8 ºC).
Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Počaspoužívania:
Trulicity sa môže uchovávať mimo chladničky najviac 14 dní, pri teplote do 30 ºC.
6.5 Druh obalu a obsah balenia
Sklenená striekačka (typu I) uzavretá v pere.
Balenia obsahujúce 2 a 4 naplnené perá a multibalenie obsahujúce 12 (3 balenia po 4 kusoch)
naplnených pier. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Pokyny na použitie
Naplnené pero je na jednorazové použitie.
Pokyny na použitie pera, ktoré sú súčasťou písomnej informácie pre používateľa sa musia dôsledne dodržiavať.
Trulicity sa nemá používať v prípade, ak sa v roztoku objavia častice, ak je roztok zakalený a/alebo zafarbený.
Ak Trulicity zamrzla, nesmie sa používať.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIEli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Holandsko
8. REGISTRAČNÉ ČÍSLOEU/1/14/956/001
EU/1/14/956/002
EU/1/14/956/003
EU/1/14/956/006
EU/1/14/956/007
EU/1/14/956/008
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21. novembra 2014
Dátum posledného predĺženia: 23. augusta 2019
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú k dispozícii na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.1. NÁZOV LIEKUTrulicity 0,75 mg injekčný roztok naplnený v injekčnej striekačke.
Trulicity 1,5 mg injekčný roztok naplnený v injekčnej striekačke.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIETrulicity 0,75 mg injekčný roztok
Každá naplnená injekčná striekačka obsahuje v 0,5 ml roztoku 0,75 mg dulaglutidu*.
Trulicity 1,5 mg injekčný roztok
Každá naplnená injekčná striekačka obsahuje v 0,5 ml roztoku 1,5 mg dulaglutidu*.
*Vyrobené v CHO bunkách technológiou rekombinantnej DNA.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMAInjekčný roztok
Číry, bezfarebný roztok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieDiabetes mellitus 2. typuTrulicity je indikovaná na liečbu dospelých s nedostatočne kontrolovaným diabetom mellitus 2. typu
ako dodatok diéty a cvičenia
• ako monoterapia v prípade, keď je metformín považovaný za nevhodný z dôvodu neznášanlivosti alebo kontraindikácií
• ako prídavná terapia k iným liekom určeným na liečbu diabetu.
Výsledky štúdií týkajúce sa kombinácií, účinkov na glykemickú kontrolu a kardiovaskulárne príhody, ako i skupín, ktoré boli predmetom skúmania, pozri v časti 4.4, 4.5 a 5.1.
4.2 Dávkovanie a spôsob podávaniaDávkovanieMonoterapiaOdporúčaná dávka je 0,75 mg raz týždenne.
Prídavná terapiaOdporúčaná dávka je 1,5 mg raz týždenne.
Pre potenciálne citlivé skupiny treba zvážiť počiatočnú dávku 0,75 mg raz týždenne.
Ak sa Trulicity pridá k existujúcej liečbe metformínom a/alebo pioglitazónom, môže sa pokračovať
v podávaní aktuálnej dávky metformínu a/alebo pioglitazónu. Ak sa Trulicity pridá k existujúcej liečbe metformínom a/alebo inhibítorom sodík-glukózového kotransportéra 2 (SGLT2i), môže sa pokračovať v podávaní aktuálnej dávky metformínu a/alebo SGLT2i. Ak sa pridá k existujúcej liečbe
sulfonylureou alebo inzulínom, môže sa zvážiť zníženie dávky sulfonylurey alebo inzulínu, aby sa
znížilo riziko hypoglykémie (pozri časti 4.4 a 4.8).
Použitie Trulicity nevyžaduje sledovanie si hladiny glukózy v krvi. Samokontrola hladiny glukózy v krvi je potrebná kvôli úprave dávky sulfonylurey alebo inzulínu, najmä ak sa začína liečba
s Trulicity a dávka inzulínu sa znižuje. Odporúča sa postupné znižovanie dávky inzulínu.
StaršíV súvislosti s vekom nie je potrebná žiadna úprava dávkovania (pozri časť 5.2).
Porucha funkcie obličiekU pacientov s miernou, stredne závažnou až závažnou poruchou funkcie obličiek (eGFR < 90 až ≥ 15
ml/min/1,73m2) nie je potrebná žiadna úprava dávkovania.
Skúsenosti u pacientov v konečnej fáze ochorenia obličiek (< 15 ml/min/1,73m2) sú veľmi
obmedzené, preto Trulicity nemožno odporučiť tejto skupine pacientov (pozri časti 5.1 a 5.2).
Porucha funkcie pečeneU pacientov s poruchou funkcie pečene nie je potrebná žiadna úprava dávkovania.
Pediatrická populáciaBezpečnosť a účinnosť dulaglutidu u detí vo veku do 18 rokov neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podávaniaTrulicity sa má podávať subkutánnou injekciou do brucha, stehna alebo ramena. Nemá sa podávať
vnútrožilovo ani vnútrosvalovo.
Dávka lieku sa môže podávať kedykoľvek v priebehu dňa, s jedlom alebo bez jedla.
Ak sa dávka vynechá a ostali aspoň 3 dni (72 hodín) do ďalšej plánovanej dávky, má sa podať čo najskôr. Ak do ďalšej plánovanej dávky ostáva menej ako 3 dni (72 hodín), vynechanú dávku treba preskočiť a nasledujúca dávka sa má podať ako obvykle, v určený deň. V každom prípade môžu potom pacienti pokračovať vo svojom pravidelnom režime dávkovania raz týždenne.
Deň podávania v týždni sa môže v prípade potreby zmeniť, ak bola posledná dávka podaná 3 alebo viac dní (72 hodín) predtým.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníDulaglutid sa nemá používať u pacientov s ochorením diabetes mellitus 1. typu a ani na liečbu diabetickej ketoacidózy. Dulaglutid nie je náhrada za inzulín. U pacientov závislých od inzulínu bola po náhlom prerušení podávania alebo znížení dávky inzulínu hlásená diabetická ketoacidóza (pozri časť 4.2).
DehydratáciaU pacientov liečených dulaglutidom, zvlášť na začiatku liečby, bola hlásená dehydratácia, niekedy
vedúca k akútnemu renálnemu zlyhaniu alebo k zhoršeniu renálnej nedostatočnosti. Mnohé z týchto hlásených renálnych nežiaducich udalostí sa vyskytlo u pacientov, ktorí pociťovali nevoľnosť, vracali, mali hnačku alebo boli dehydratovaní. Pacienti liečení dulaglutidom majú byť poučení o potenciálnom riziku dehydratácie, najmä v súvislosti s gastrointestinálnymi nežiaducimi účinkami a o opatreniach, ako sa vyvarovať nedostatku tekutín.
Dulaglutid nebol skúmaný u pacientov so závažným gastrointestinálnym ochorením, vrátane závažnej gastroparézy, a preto sa týmto pacientom ani neodporúča.
Akútna pankreatitídaPankreatitída bola hlásená pri používaní agonistov receptora GLP-1 vrátane dulaglutidu. V klinických štúdiách bola pankreatitída hlásená v súvislosti s dulaglutidom (pozri časť 4.8).
Pacienti majú byť informovaní o charakteristických príznakoch akútnej pankreatitídy. Ak existuje podozrenie na pankreatitídu, podávanie dulaglutidu sa má prerušiť. Ak sa diagnóza pankreatitídy potvrdí, podávanie dulaglutidu sa má natrvalo ukončiť. Pri absencii iných prejavov a príznakov
akútnej pankreatitídy nie je zvýšenie hladiny pankreatických enzýmov prediktívnym faktorom akútnej
pankreatitídy (pozri časť 4.8).
HypoglykémiaU pacientov používajúcich dulaglutid v kombinácii so sulfonylureou alebo inzulínom sa môže objaviť zvýšené riziko hypoglykémie. Riziko hypoglykémie môže poklesnúť po znížení dávky sulfonylurey alebo inzulínu (pozri časti 4.2 a 4.8).
Obsah sodíkaTento liek obsahuje menej ako 1 mmol sodíka (23 mg) v 1,5 mg dávke, t.j. zanedbateľné množstvo
sodíka.
4.5 Liekové a iné interakcieDulaglutid spôsobuje oneskorené vyprázdňovanie žalúdka, a preto má potenciál ovplyvňovať vstrebávanie súčasne podávaných perorálnych liekov. V nižšie opísaných klinických farmakologických štúdiách dulaglutid neovplyvnil v klinicky významnej miere vstrebávanie testovaných perorálne podávaných liekov. U pacientov užívajúcich perorálne lieky, ktoré si vyžadujú rýchlu gastrointestinálnu absorpciu alebo prípravky s predĺženým uvoľňovaním však treba zvážiť potenciálnu možnosť zmenenej expozície lieku.
SitagliptínPri súčasnom podaní sitagliptínu s jednou dávkou dulaglutidu nebola expozícia sitagliptínu ovplyvnená. Ďalšie súčasné podanie 2 po sebe nasledujúcich dávok dulaglutidu znížilo AUC(0-τ) sitagliptínu približne o 7,4 % hodnotu Cmax približne o 23,1 %. V porovnaní s podávaním sitagliptínu ako jedinej liečby sa po súčasnom podávaní sitagliptínu s dulaglutidom zvýšila hodnota tmax sitagliptínu približne o 0,5 hodiny.
Sitagliptín môže počas 24 hodín spôsobiť až 80 % inhibíciu DPP-4. Súčasné podávanie dulaglutidu a sitagliptínu zvyšuje expozíciu dulaglutidu o približne 38 % a hodnotu Cmax o približne 27 % a stredná hodnota tmax sa zvýši približne na 24 hodín. Preto má dulaglutid skutočne vysoký stupeň ochrany proti inaktivácii DPP-4 (pozri časť 5.1 Mechanizmus účinku). Zvýšená expozícia môže zosilniť účinky dulaglutidu na hladinu glukózy v krvi.
ParacetamolPo podaní prvej dávky dulaglutidu 1 mg sa hodnota Cmax paracetamolu znížila o 36 %, po podaní prvej dávky dulaglutidu 3 mg sa znížila o 50 % a stredná hodnota tmax sa objavila neskôr (o 3 a 4 hodiny,
v uvedenom poradí). Po súčasnom podávaní s najviac 3 mg dulaglutidu v ustálenom stave neboli na
AUC(0-12), Cmax ani tmax paracetamolu zaznamenané žiadne štatisticky významné rozdiely. Ak sa paracetamol podáva spolu s dulaglutidom, úprava dávky paracetamolu nie je potrebná.
AtorvastatínSúčasné podávanie dulaglutidu s atorvastatínom a jeho hlavným metabolitom
o-hydroxyatorvastatínom znížilo Cmax až na 70 % a AUC(0-∞) na 21 %. Stredná hodnota t1/2
atorvastatínu sa po podaní dulaglutidu zvýšila o 17 % a stredná hodnota t1/2
o-hydroxyatorvastatínu o
41 %. Tieto pozorovania nie sú klinicky významné. Pri podávaní atorvastatínu s dulaglutidom nie je potrebná žiadna úprava dávky atorvastatínu.
DigoxínPo súčasnom podaní digoxínu v ustálenom stave s 2 po sebe idúcimi dávkami dulaglutidu ostali
hodnoty celkovej expozície (AUCτ) a tmax digoxínu nezmenené; a hodnota Cmax sa znížila až na 22 %. Neočakáva sa, že táto zmena bude mať klinické následky. Pri podávaní digoxínu s dulaglutidom nie je potrebná žiadna úprava dávky digoxínu.
AntihypertenzívaSúčasné podávanie niekoľkých dávok dulaglutidu s lizinoprilom v ustálenom stave nespôsobilo žiadne klinicky významné zmeny v hodnotách AUC ani Cmax lizinoprilu. V 3. a 24. dni klinickej štúdie bolo pozorované štatisticky významné oneskorenie v tmax lizinoprilu o približne 1 hodinu. Pri súčasnom podávaní jednej dávky dulaglutidu a metoprololu, hodnota AUC metoprololu sa zvýšila o 19 % a hodnota Cmax o 32 %. Hoci sa hodnota tmax metoprololu oneskorila o 1 hodinu, táto zmena nebola klinicky významná. Tieto zmeny neboli klinicky významné, a preto pri podávaní lizinoprilu alebo metoprololu s dulaglutidom nie je potrebná žiadna úprava dávky lizinoprilu ani metoprololu.
WarfarínPo súčasnom podaní s dulaglutidom ostala expozícia S- a R-warfarínu a hodnota Cmax R-warfarínu nezmenená a hodnota Cmax S-warfarínu klesla o 22 %. Hodnota AUCINR sa zvýšila o 2 %, čo pravdepodobne nie je klinicky významné a nebol zaznamenaný žiaden vplyv na maximálny medzinárodný normalizovaný pomer odpovede (INRmax). Čas medzinárodného normalizovaného pomeru odpovede (tINRmax) sa oneskoril o 6 hodín, v súlade s oneskorením tmax o približne 4 hodiny u S-warfarínu a 6 hodín u R-warfarínu. Tieto zmeny nie sú klinicky významné. Pri podávaní warfarínu
spolu s dulaglutidom nie je potrebná žiadna úprava dávky warfarínu.
Perorálne kontraceptívaSúčasné podávanie dulaglutidu s perorálnymi kontraceptívami (norgestimát 0,18 mg/etinylestradiol
0,025 mg) nemalo vplyv na celkovú expozíciu norelgestromínu a etinylestradiolu. U norelgestromínu
bolo pozorované štatisticky významné zníženie hodnoty Cmax na 26 % a oneskorenia tmax o 2 hodiny a u etinylestradiolu zníženie hodnoty Cmax na 13 % a oneskorenia tmax o 0,30 hodiny. Tieto pozorovania nie sú klinicky významné. Pri podávaní perorálnych kontraceptív spolu s dulaglutidom nie je potrebná žiadna úprava dávky perorálnych kontraceptív.
MetformínPo súčasnom podaní niekoľkých dávok dulaglutidu s metformínom v ustálenom stave (vzorec pre
okamžité uvoľňovanie[IR]) sa hodnota AUCτ metformínu zvýšila na 15 % a jeho hodnota Cmax klesla až na 12 %, pričom hodnota tmax sa nezmenila. Tieto zmeny sú v súlade s oneskoreným vyprázdňovaním žalúdka pri dulaglutide a s farmakokinetickou variabilitou metformínu, a preto nie sú klinicky významné. Ak sa metformín IR podáva s dulaglutidom, nie je potrebná žiadna úprava dávky metformínu IR.
4.6 Fertilita, gravidita a laktáciaGraviditaNie sú známe žiadne alebo len obmedzené množstvo údajov o použití dulaglutidu u gravidných žien.
Štúdie na zvieratách ukázali reprodukčnú toxicitu (pozri časť 5.3). Preto sa podávanie dulaglutidu
v tehotenstve neodporúča.
DojčenieNie je známe, či sa dulaglutid vylučuje do ľudského materského mlieka. Nemožno vylúčiť riziko u novorodencov/dojčiat. Dulaglutid sa nemá používať počas dojčenia.
FertilitaÚčinok dulaglutidu na fertilitu ľudí nie je známy. U potkanov sa po liečbe dulaglutidom neprejavil
žiaden priamy vplyv na párenie alebo fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeTrulicity má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Ak sa používa v kombinácii so sulfonylureou alebo inzulínom, treba pacientom odporučiť, aby prijali preventívne opatrenia na predchádzanie hypoglykémii počas vedenia vozidiel a obsluhy strojov (pozri časť 4.4).
4.8 Nežiaduce účinkyZhrnutiebezpečnostnéhoprofiluV ukončených počiatočných registračných klinických štúdiách fázy II a III bolo expozícii dulaglutidu v monoterapii alebo dulaglutidu v kombinácii s inými hladinu glukózy znižujúcimi liekmi vystavených 4 006 pacientov. Najčastejšie hlásenými nežiaducimi reakciami v klinických štúdiách boli gastrointestinálne nežiaduce udalosti, vrátane nevoľnosti, vracania a hnačky. Tieto reakcie boli obvykle slabé až mierne a mali prechodný charakter. Výsledky štúdie skúmajúcej dlhodobé kardiovaskulárne výsledky so 4 949 pacientmi randomizovanými na liečbu dulaglutidom
a sledovanými po dobu priemerne 5,4 roka boli v súlade s týmito zisteniami.
ZoznamnežiaducichúčinkovvtabuľkeTieto nežiaduce reakcie súvisiace s liečbou boli identifikované na základe vyhodnotenia po celú dobu
trvania klinických štúdií fázy II, fázy III, dlhodobej kardiovaskulárnej štúdie a postmarketingových hlásení. Nežiaduce reakcie sú uvedené v tabuľke č. 1 v terminológii MedDRA podľa tried orgánových systémov v poradí podľa klesajúcej frekvencie výskytu (veľmi časté: ≥ 1/10; časté: ≥ 1/100 až < 1/10; menej časté: ≥ 1/1000 až < 1/100; zriedkavé: ≥ 1/10 000 až < 1/1000; veľmi zriedkavé: < 1/10 000 a neznáme: nedajú sa určiť z dostupných údajov). V každej skupine výskytu sa nežiaduce reakcie uvádzajú v poradí podľa klesajúcej frekvencie. Frekvencie príhod boli počítané na základe ich incidencie v registračných štúdiách fázy II a III.
Tabuľka č. 1: Frekvencia výskytu nežiaducich účinkov dulaglutidu
Triedy orgánových
systémov
| Veľmi časté
| Časté
| Menej časté
| Zriedkavé
| Neznáme
| Poruchy
imunitného systému
|
|
| hypersenzitivita
| anafylaktická
reakcia#
|
| Poruchy metabolizmu a výživy
| hypoglykémia*
(ak sa používa v kombinácii
s inzulínom, glimepiridom,
metformínom†
alebo metformínom
s glimepiridom)
| hypoglykémia*
(ak sa používa ako monoterapia
alebo v kombinácii s
metformínom a pioglitazónom)
| dehydratácia
|
|
| Poruchy gastrointesti- nálneho traktu
| nevoľnosť,
hnačka,
vracanie†,
bolesť brucha
| znížená chuť do
jedla, dyspepsia, zápcha,
nadúvanie, abdominálna
distenzia, refluxná choroba pažeráka, grganie
|
| akútna
pankreatitída
| nemechanická
intestinálna obštrukcia
| Poruchy pečene
a žlčových ciest
|
|
| cholelitiáza,
cholecystitída
|
|
| Poruchy kože
a podkožného tkaniva
|
|
|
| angioedém#
|
| Celkové poruchy a
reakcie v mieste podania
|
| únava
| reakcie v
mieste podania
|
|
| Laboratórne a funkčné vyšetrenia
|
| sínusová
tachykardia, atrioventrikulárna
blokáda 1. stupňa
(AVB)
|
|
|
|
|
|
# Z postmarketingových hlásení
* Zdokumentovaná, symptomatická hypoglykémia s hladinou glukózy v krvi ≤ 3,9 mmol/l
† Len pre 1,5 mg dávku. Pre dulaglutid 0,75 mg, frekvencia nežiaducich reakcií patrila do nižšej skupiny incidencie.
Opis vybraných nežiaducich reakciíHypoglykémiaAk sa 0,75 mg a 1,5 mg dulaglutidu použilo ako monoterapia alebo v kombinácii s liečbou
metformínom samotným alebo s metformínom a pioglitazónom, miera výskytu zdokumentovanej symptomatickej hypoglykémie bola 5,9 % až 10,9 % a frekvencia 0,14 – 0,62 epizód/pacienta/rok a neboli hlásené žiadne epizódy závažnej hypoglykémie.
Miera výskytu zdokumentovanej symptomatickej hypoglykémie, keď sa pridalo 0,75 mg a 1,5 mg dulaglutidu k režimu pozostávajúcemu zo sulfonylurey a metformínu bola 39 % a 40,3 % a frekvencia
1,67 a 1,67 epizód/pacienta/rok. Miera výskytu závažnej hypoglykémie bola 0 % a 0,7 % a frekvencia
0,00 a 0,01 epizód/pacienta/rok pre každú dávku v uvedenom poradí. Miera výskytu zdokumentovanej
symptomatickej hypoglykémie pri použití 1,5 mg dulaglutidu so samotnou sulfonylureou bola 11,3 %
a frekvencia 0,90 epizód/pacienta/rok a neboli zistené žiadne závažné epizódy hypoglykémie.
Miera výskytu zdokumentovanej symptomatickej hypoglykémie pri použití 1,5 mg dulaglutidu
v kombinácii s inzulínom glargínom bola 35,3 % a frekvencia 3,38 epizód/pacienta/rok. Miera výskytu závažnej hypoglykémie bola 0,7 % a frekvencia 0,01 epizód/pacienta/rok.
Miera výskytu hypoglykémie, keď sa pridalo 0,75 mg a 1,5 mg dulaglutidu k prandiálnemu inzulínu bola 85,3 % a 80,0 % a frekvencia 35,66 a 31,06 epizód/pacienta/rok. Miera výskytu závažnej hypoglykémie bola 2,4 % a 3,4 % a frekvencia 0,05 a 0,06 epizód/pacienta/rok.
Gastrointestinálne nežiaduce udalosti
Kumulatívne hlásenie gastrointestinálnych udalostí počas až 104 týždňov s dulaglutidom 0,75 mg a 1,5 mg zahŕňalo nevoľnosť (12,9 % a 21,2 %), hnačku (10,7 % a 13,7 %) a vracanie (6,9 % a
11,5 %). Tieto udalosti boli obvykle mierne alebo stredne závažné, bolo hlásené, že dosiahli vrchol
počas prvých 2 týždňov liečby, v priebehu nasledujúcich 4 týždňov ich počet rýchlo klesal a ich miera
výskytu potom ostala relatívne nemenná.
Vo farmakologických klinických štúdiách v trvaní najviac 6 týždňov, uskutočnených na pacientoch s diabetom 2. typu, bola väčšina gastrointestinálnych udalostí hlásená počas prvých 2-3 dní od podania počiatočnej dávky a s nasledujúcimi dávkami klesala.
Akútna pankreatitída
Incidencia akútnej pankreatitídy vo fáze II a II klinických štúdií bola 0,07 % pre dulaglutid v porovnaní s 0,14 % pre placebo a 0,19 % pre komparátorov s/bez prídavnej podpornej antidiabetickej liečby.
Enzýmy pankreasu
Dulaglutid sa spája so zvýšenou hladinou pankreatických enzýmov (lipáza a/alebo pankreatická amyláza) v priemere o 11 % až 21 % oproti vstupným hodnotám (pozri časť 4.4). V prípade, že nie sú
prítomné iné symptómy akútnej pankreatitídy, zvýšená hladina samotných pankreatických enzýmov nie je predikciou akútnej pankreatitídy.
Zvýšená srdcová frekvencia
Dulaglutid sa spája s nízkym priemerným zvýšením srdcovej frekvencie v hodnotách 2-4 údery za minútu (bpm) a s 1,4 % výskytom sínusovej tachykardie so súčasným nárastom o ≥ 15 bpm oproti
východiskovej hodnote.
AV blokáda 1. stupňa/predĺženie PR intervalu
Dulaglutid sa spája s nízkym priemerným zvýšením PR intervalu o 2-3 msec oproti východiskovej hodnote a s 1,5 % (pri 0,75 mg) a 2,4 % (pri 1,5 mg) výskytom AV blokády 1. stupňa.
Imunogenicita
V klinických štúdiách bola liečba dulaglutidom spojená s 1,6 % incidenciou náhleho zvýšenia
dulaglutidových protilátok, čo znamená, že štrukturálne zmeny v GLP 1 a modifikované časti IgG4
dulaglutidovej molekuly, spolu s vysokou homológiou s natívnym GLP 1 a natívnym IgG4, minimalizovali riziko imunitnej reakcie na dulaglutid. Pacienti s dulaglutidovými protilátkami mali vo všeobecnosti nízke titre, a hoci počet pacientov, u ktorých sa vytvorili dulaglutidové protilátky bol nízky, vyhodnotenie študijných dát fázy III neodhalilo žiadny zrejmý vplyv dulaglutidových protilátok na zmeny v HbA1c. U žiadneho z týchto pacientov so systémovou hypersenzitivitou sa nevyvinuli dulaglutidové protilátky.
Hypersenzitivita
U 0,5 % pacientov užívajúcich dulaglutid boli vo fázach II a III klinických štúdií hlásené prípady systémovej hypersenzitivity (napr. urtikária, edém). Počas prítomnosti dulaglutidu na trhu boli hlásené
prípady anafylaktických reakcií.
R
eakcie v mieste podania
Nežiaduce udalosti v mieste podania boli hlásené u 1,9 % pacientov používajúcich dulaglutid. Možné nežiaduce udalosti v mieste podania spôsobené imunitnou reakciou organizmu (napr. vyrážka, erytém) boli hlásené u 0,7 % pacientov a boli väčšinou mierne.
Prerušenie liečby ako následok nežiaducich účinkovV klinických štúdiách s dĺžkou 26 týždňov bol výskyt prerušenia liečby ako následku nežiaducich
udalostí s 0,75 mg dulaglutidom 2,6 % a s1,5 mg 6,1 % oproti prerušeniu liečby u placeba 3,7 %.
V priebehu trvania celej klinickej štúdie (až 104 týždňov) bol výskyt prerušenia liečby ako následku nežiaducich účinkov s 0,75 mg dulaglutidom 5,1 % a s 1,5 mg 8,4 %. Najčastejšími nežiaducimi účinkami vedúcimi k prerušeniu liečby boli nevoľnosť (1,0 % a 1,9 %), hnačka (0,5 % a 0,6 %) a vracanie (0,4 % a 0,6 %), ktoré boli obvykle hlásené počas prvých 4-6 týždňov.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieÚčinky predávkovania dulaglutidom v klinických štúdiách zahŕňajú gastrointestinálne poruchy a hypoglykémiu. V prípade predávkovania sa má začať s vhodnou podpornou liečbou podľa toho, aké sú klinické prejavy a príznaky pacienta.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antidiabetiká, antidiabetiká s výnimkou inzulínov; ATC kód: A10BJ05
MechanizmusúčinkuDulaglutid je agonista receptora glukagónu podobného peptidu 1 (GLP-1) s dlhodobým účinkom. Jedna molekula obsahuje 2 identické disulfidovým mostíkom spojené reťazce, z ktorých každý obsahuje modifikovanú ľudskú sekvenciu GLP-1 analógu kovalentne naviazanú na fragment ťažkého reťazca (Fc) modifikovaného ľudského imunoglobulínu G4 (IgG4) prostredníctvom malého peptidového linkera. GLP-1 analógová časť dulaglutidu je približne na 90 % homologická s prirodzeným ľudským GLP-1 (7-37). Prirodzený GLP-1 má polčas rozpadu 1,5-2 minúty ako následok degradácie prostredníctvom DPP-4 a renálneho klírensu. Na rozdiel od prirodzeného GLP-1 je dulaglutid rezistentný voči degradácii prostredníctvom DPP-4 a jeho objemnosť spomaľuje absorpciu
a znižuje renálny klírens. V dôsledku týchto technických vlastností vzniká rozpustná zmes
s predĺženým polčasom 4,7 dňa, čo umožňuje jej subkutánne podávanie raz týždenne. Okrem toho
bola molekula dulaglutidu navrhnutá tak, aby zabránila imunitnej odpovedi závislej od Fcγ receptora a
aby znižovala jeho imunogénny potenciál.
Dulaglutid vykazuje viaceré antihyperglykemické aktivity GLP-1. Pri zvýšenej koncentrácii glukózy dulaglutid zvyšuje intracelulárnu koncentráciu cyklického AMP (cAMP) v pankreatických beta bunkách, čo vedie k uvoľňovaniu inzulínu. Dulaglutid potláča sekréciu glukagónu, o ktorej je známe, že je u pacientov s diabetom 2. typu neprimerane zvýšená. Nižšie koncentrácie glukagónu vedú
k zníženiu vylučovania glukózy pečeňou. Dulaglutid tiež spomaľuje vyprázdňovanie žalúdka.
FarmakodynamickéúčinkyDulaglutid zlepšuje glykemickú kontrolu prostredníctvom dlhodobého účinku zníženia koncentrácie glukózy nalačno, pred jedlom a po jedle u pacientov s diabetom 2. typu, so začiatkom po prvom podaní dulaglutidu a pretrváva počas celého dávkovacieho intervalu raz týždenne.
Farmakodynamická klinická štúdia s dulaglutidom ukázala u pacientov s diabetom 2. typu obnovenie prvej fázy sekrécie inzulínu na úroveň, ktorá prekročila hladinu pozorovanú u zdravých subjektov na liečbe placebom a zlepšenie druhej fázy sekrécie inzulínu ako odpovede na intravenózny bolus glukózy. V tej istej klinickej štúdii sa ukázalo, že jediná 1,5 mg dávka dulaglutidu zvýšila maximálnu sekréciu inzulínu z β-buniek a v porovnaní s placebom zlepšila funkciu β-buniek u subjektov s diabetom 2. typu.
V súlade s farmakokinetickým profilom, dulaglutid má farmakodynamický profil vhodný na
podávanie raz týždenne (pozri časť 5.2).
Klinická účinnosť abezpečnosťGlykemická kontrolaBezpečnosť a účinnosť dulaglutidu boli hodnotené v deviatich randomizovaných, kontrolovaných klinických štúdiách fázy III, ktorých sa zúčastnilo 6 193 pacientov s diabetom 2. typu. Z nich 1 206 bolo vo veku ≥ 65 rokov, z ktorých 119 malo ≥ 75 rokov. Tieto klinické štúdie zahŕňali 3 808 pacientov liečených dulaglutidom, z ktorých 2 250 pacientom bola podávaná Trulicity v dávke 1,5 mg za týždeň a 1 558 pacientom bola podávaná Trulicity v dávke 0,75 mg za týždeň. Vo všetkých klinických štúdiách dulaglutid vyvolával klinicky významné zlepšenie glykemickej kontroly meranej pomocou glykovaného hemoglobínu A1c (HbA1c).
MonoterapiaDulaglutid bol hodnotený v 52- týždňovej klinickej štúdii kontrolovanej metformínom v monoterapii. Trulicity 1,5 mg a 0,75 mg bola lepšia ako metformín (1500-2000 mg/deň) v znižovaní hodnoty
HbA1c oproti východiskovým hodnotám a signifikantne vyššie percento pacientov dosiahlo za
26 týždňov cieľovú hodnotu HbA1c < 7,0 % a ≤ 6,5 % pri používaní Trulicity v porovnaní s metformínom.
Tabuľka 2: Výsledky 52-týždňovej štúdie s aktívne kontrolovanou monoterapiou s dvomi dávkami dulaglutidu v porovnaní s metformínom.
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny tel. hodnota zmena HbA1c FBG hmotnosti HbA1c HbA1c
(%) (%) <7,0% (%) ≤6,5% (%) (mmol/l) (kg)
|
26 týždňov
|
Dulaglutid 1,5 mg
raz týždenne (n=269)
|
7,63
|
-0,78††
|
61,5#
|
46,0##
|
-1,61
|
-2,29
|
Dulaglutid 0,75 mg
raz týždenne (n=270)
|
7,58 -0,71††
|
62,6#
|
40,0#
|
-1,46
|
-1,36#
|
Metformín
1500-2000 mg/deň
(n=268)
|
7,60 -0,56
|
53,6
|
29,8
|
-1,34
|
-2,22
|
52 týždňov
|
Dulaglutid 1,5 mg
raz týždenne (n=269)
|
7,63
|
-0,70††
|
60,0#
|
42,3##
|
-1,56#
|
-1,93
|
Dulaglutid 0,75 mg
raz týždenne (n=270)
|
7,58 -0,55†
|
53,2
|
34,7
|
-1,00
|
-1,09#
|
Metformín
1500-2000 mg/deň
(n=268)
|
7,60
|
-0,51
|
48,3
|
28,3
|
-1,15
|
-2,20
|
† multiplicitne upravená 1-stranná p-hodnota < 0,025 pre nonferioritu †† multiplicitne upravená
1-stranná p-hodnota < 0,025, pre superioritu dulaglutidu nad metformínom, vyhodnotené iba pre
HbA1c
# p < 0,05; ## p < 0, 001 liečebná skupina s dulaglutidom v porovnaní s metformínom
Miera výskytu zdokumentovanej symptomatickej hypoglykémie pri liečbe s 1,5 mg a 0,75 mg Trulicity bola 0,62 a 0,15 a 0,09 epizód/pacienta/rok. Neboli zaznamenané žiadne prípady závažnej hypoglykémie.
K
ombinovaná terapia s metformínom
Bezpečnosť a účinnosť dulaglutidu boli hodnotené v klinickej štúdii kontrolovanej placebom a aktívnou látkou (sitagliptínom 100 mg denne) v trvaní 104 týždňov, všetko v kombinácii s metformínom. Liečba s 1,5 mg a 0,75 mg Trulicity mala za následok výraznejšie zníženie hodnoty HbA1c v porovnaní so sitagliptínom po 52 týždňoch, čo bolo sprevádzané podstatne vyšším percentom pacientov dosahujúcich cieľové hodnoty HbA1c < 7,0 % a ≤ 6,5 %. Tieto účinky pretrvávali až do konca klinickej štúdie (104 týždňov).'
Tabuľka 3: Výsledky 104-týždňovej štúdie s placebom a aktívne kontrolovanou monoterapiou s dvomi dávkami dulaglutidu v porovnaní so sitagliptínom.
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny tel. hodnota zmena HbA1c FBG hmotnosti HbA1c HbA1c
(%) (%) <7,0 %(%) ≤6,5 %(%) (mmol/l) (kg)
|
26 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=304)
|
8,12
|
-1,22‡‡,##
|
60,9**,##
|
46,7**,##
|
-2,38**,##
|
-3,18**,##
|
Dulaglutid 0,75 mg raz
týždenne (n=302)
|
8,19
|
-1,01‡‡,##
|
55,2**,##
|
31,0**,##
|
-1,97**,##
|
-2,63**,##
|
Placebo (n= 177)
| 8,10
| 0,03
| 21,0
| 12,5
| -0,49
| -1,47
|
Sitagliptín 100 mg raz
denne (n=315)
|
8,09
|
-0,61
|
37,8
|
21,8
|
-0,97
|
-1,46
|
52 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=304)
|
8,12
|
-1,10††
|
57,6##
|
41,7##
|
-2,38##
|
-3,03##
|
Dulaglutid 0,75 mg raz
týždenne (n=302)
|
8,19
|
-0,87††
|
48,8##
|
29,0##
|
-1,63##
|
-2,60##
|
Sitagliptín 100 mg raz
denne(n=315)
|
8,09
|
-0,39
|
33,0
|
19,2
|
-0,90
|
-1,53
|
104 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=304)
|
8,12
|
-0,99††
|
54,3##
|
39,1##
|
-1,99##
|
-2,88##
|
Dulaglutid 0,75 mg raz
týždenne (n=302)
|
8,19
|
-0,71††
|
44,8##
|
24,2##
|
-1,39##
|
-2,39
|
Sitagliptín 100 mg raz
denne (n=315)
|
8,09
|
-0,32
|
31,1
|
14,1
|
-0,47
|
-1,75
|
†† multiplicitne upravená 1-stranná p-hodnota < 0,025 pre superioritu dulaglutidu v porovnaní so
sitagliptínom, vyhodnotené iba pre HbA1c po 52 a 104 týždňoch
‡‡ multiplicitne upravená 1-stranná p-hodnota < 0,001 pre superioritu dulaglutidu v porovnaní s placebom, vyhodnotené iba pre HbA1c
** p < 0,001 liečebná skupina s dulaglutidom v porovnaní s placebom
## p < 0,001 liečebná skupina s dulaglutidom v porovnaní so sitagliptínom
Miera výskytu zdokumentovanej symptomatickej hypoglykémie pri liečbe s 1,5 mg a 0,75 mg Trulicity bola 0,19 a 0,18 a 0,17 epizód/pacienta/rok. Počas liečby s dulaglutidom neboli pozorované žiadne prípady závažnej hypoglykémie.
Bezpečnosť a účinnosť dulaglutidu boli tiež hodnotené v klinickej štúdii kontrolovanej aktívnou látkou (1,8 mg liraglutidu denne) v trvaní 26 týždňov, oba lieky v kombinácii s metformínom. Liečba s Trulicity 1,5 mg mala v porovnaní s liraglutidom za následok podobné zníženie hodnoty HbA1c a pacienti dosiahli cieľové hodnoty HbA1c < 7,0 % a ≤ 6,5 % v porovnaní s liraglutidom.
Tabuľka 4: Výsledky 26-týždňovej aktívne kontrolovanej štúdie s jednou dávkou dulaglutidu v porovnaní s liraglutidom
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny tel. hodnota zmena HbA1c FBG hmotnosti HbA1c HbA1c
(%) (%) <7,0 %(%) ≤6,5 %(%) (mmol/l) (kg)
|
26 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=299)
|
8,06
|
-1,42‡
|
68,3
|
54,6
|
-1,93
|
-2,90#
|
Liraglutid+ 1,8 mg
denne (n=300)
|
8,05
|
-1,36
|
67,9
|
50,9
|
-1,90
|
-3,61
|
‡ 1-stranná p-hodnota p < 0,001 pre noninferioritu dulaglutidu v porovnaní s liraglutidom,
vyhodnotené iba pre HbA1c.
# p < 0,05 liečebná skupina s dulaglutidom v porovnaní s liraglutidom.
+ Pacienti randomizovaní na liraglutid začali s dávkou 0,6 mg denne. Po 1. týždni boli pacienti pretitrovaní na 1,2 mg denne, a potom po 2. týždni na 1,8 mg denne.
Miera výskytu zdokumentovanej symptomatickej hypoglykémie s dulaglutidom 1,5 mg bola
0,12 epizód/pacienta/rok a pri liraglutide to bolo 0,29 epizód/pacienta/rok. Neboli pozorované žiadne prípady závažnej hypoglykémie.
Kombinovaná terapia s metformínom a sulfonylureouV klinickej štúdii kontrolovanej aktívnou látkou v trvaní 78 týždňov bol dulaglutid porovnávaný s inzulínom glargínom, oba spolu s metformínom a sulfonylureou. Po 52 týždňoch 1,5 mg Trulicity vykazovala výraznejšie zníženie hodnoty HbA1c oproti inzulínu glargínu, ktorý pretvával počas
78 týždňov; zatiaľ čo s 0,75 mg Trulicity zníženie HbA1c nebolo horšie oproti inzulínu glargínu. S 1,5 mg Trulicity dosiahlo podstatne vyššie percento pacientov cieľové hodnoty HbA1c < 7,0 %
alebo ≤ 6,5 % v 52. a 78. týždni v porovnaní s inzulínom glargínom.
Tabuľka 5: Výsledky 78-týždňovej aktívne kontrolovanej štúdie s dvomi dávkami dulaglutidu v porovnaní s inzulínom glargínom
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny tel. hodnota zmena HbA1c FBG hmotnosti HbA1c HbA1c
(%) (%) <7,0 %(%) ≤6,5 %(%) (mmol/l) (kg)
|
52 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=273)
|
8,18
|
-1,08††
|
53,2##
|
27,0##
|
-1,50
|
-1,87##
|
Dulaglutid 0,75 mg
raz týždenne (n=272)
|
8,13
|
-0,76†
|
37,1
|
22,5#
|
-0,87##
|
-1,33##
|
Inzulín glargín+ raz
denne (n=262)
|
8,10
|
-0,63
|
30,9
|
13,5
|
-1,76
|
1,44
|
78 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=273)
|
8,18
|
-0,90††
|
49,0##
|
28,1##
|
-1,10#
|
-1,96##
|
Dulaglutid 0,75 mg
raz týždenne (n=272)
|
8,13
|
-0,62†
|
34,1
|
22,1
|
-0,58##
|
-1,54##
|
Inzulín glargín+ raz
denne (n=262)
|
8,10
|
-0,59
|
30,5
|
16,6
|
-1,58
|
1,28
|
† multiplicitne upravená 1-stranná p-hodnota < 0,025 pre nonferioritu; †† multiplicitne upravená
1-stranná p-hodnota < 0,025 pre superioritu dulaglutidu nad inzulínom glargínom, vyhodnotené iba pre HbA1c
# p < 0,05; ## p < 0,001 liečebná skupina s dulaglutidom v porovnaní s inzulínom glargínom
+ Dávky inzulínu glargínu boli upravené s použitím algoritmu s cieľovou hodnotou plazmovej glukózy nalačno < 5,6 mmol/l
Miera výskytu zdokumentovanej symptomatickej hypoglykémie počas používania 1,5 mg a 0,75 mg
Trulicity a inzulínu glargínu bola 1,67; 1,67 a 3,02 epizód/pacienta/rok, v uvedenom poradí. Boli
zaznamenané dva prípady závažnej hypoglykémie pri Trulicity 1,5 mg a dva prípady závažnej hypoglykémie pri inzulíne glargíne.
Kombinovaná terapia so sulfonylureou
Bezpečnosť a účinnosť dulaglutidu po pridaní k sulfonyluree boli hodnotené v placebom kontrolovanej 24-týždňovej klinickej štúdii. Liečba s Trulicity 1,5 mg v kombinácii s glimepiridom
viedla k štatisticky významnej redukcii HbA1c v porovnaní s placebom a glimepiridom počas
24 týždňov. Po 24 týždňoch dosiahlo cieľové hodnoty < 7,0 % a ≤ 6,5 % HbA1c signifikantne vyššie
percento pacientov liečených s Trulicity 1,5 mg v porovnaní s placebom.
Tabuľka 6: Výsledky 24-týždňovej placebom kontrolovanej štúdie s dulaglutidom ako prídavnej
liečby ku glimepiridu.
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny tel. hodnota zmena HbA1c FBG hmotnosti HbA1c HbA1c
(
%) (%) <7,0% (%) ≤6,5% (%) (mmol/l) (kg)
|
2
4 týždňov
|
Dulaglutid 1,5 mg
raz týždenne (n=239)
|
8,39
|
‡‡
|
‡‡
|
**
|
‡‡
|
-0,91
|
Placebo (n=60)
|
8,39
|
-0,11
|
18,9
|
9,4
|
0,16
|
-0,24
|
|
|
-1,38
55,3
40,0
-1,70
‡‡ p < 0,001 pre superioritu dulaglutidu v porovnaní s placebom, s celkovou kontrolovanou chybou
typu I
** p < 0,001 pre dulaglutidové liečebné rameno v porovnaní s placebom
Miera výskytu zdokumentovanej symptomatickej hypoglykémie počas používania Trulicity 1,5 mg a placeba bola 0,90 a 0,04 epizód/pacienta/rok v danom poradí. Neboli pozorované žiadne prípady závažnej hypoglykémie pre Trulicity ani placebo.
Kombinovaná liečba inhibítorom SGLT2 s metformínom alebo bez metformínu
Bezpečnosť a účinnosť dulaglutidu po pridaní k liečbe inhibítorom sodík-glukózového kotransportéra
2 (SGLT2i) (96 % s metformínom a 4 % bez metformínu) sa hodnotili v placebom kontrolovanej štúdii v trvaní 24 týždňov. Liečba s Trulicity 0,75 mg alebo Trulicity 1,5 mg v kombinácii s liečbou SGLT2i po 24 týždňoch preukázala štatisticky významné zníženie hodnôt HbA1c v porovnaní s placebom a SGLT2i. Pri užívaní Trulicity 0,75 mg aj 1,5 mg dosiahlo v 24. týždni podstatne vyššie percento pacientov cieľovú hodnotu HbA1c < 7,0 % a ≤ 6,5 % v porovnaní s placebom.
Tabuľka č. 7: Výsledky 24-týždňovej placebom kontrolovanej štúdie s dulaglutidom ako doplnkom k liečbe s SGLT2i
Vstupná Priemerná Pacienti s cieľovým Zmena Zmena hodnota zmena HbA1c FBG telesnej HbA1c HbA1c hmotnosti
(
%) (%)
<
7,0
%^ (%) ≤6,5% (%) (mmol/L) (kg)
|
2
4 týždňov
|
Dulaglutid 0,75 mg
raz týždenne (n=141)
|
8,05
|
-1,19‡‡
|
58,8
|
38,9**
|
-1,44
|
-2,6
|
Dulaglutid 1,5 mg
raz týždenne (n=142)
|
8,04
|
‡‡
|
‡‡
|
**
|
-1,77
|
-3,1
|
Placebo (n=140)
|
8,05
|
-0,51
|
31,2
|
14,6
|
-0,29
|
-2,3
|
|
|
-1,33
67,4
50,8
‡‡ p < 0,001 pre superioritu dulaglutidu oproti placebu, s celkovou kontrolovanou chybou typu I
** p < 0,001 pre skupinu liečenú dulaglutidom v porovnaní s placebom
^ pacienti, ktorí odstúpili z randomizovanej liečby pred 24. týždňom sa považovali za nespĺňajúcich cieľ
Miera výskytu zdokumentovanej symptomatickej hypoglykémie pri užívaní Trulicity 0,75 mg, Trulicity 1,5 mg a placeba bola 0,15; 0,16 a 0,12 epizód/pacienta/rok v uvedenom poradí. Jeden
pacient nahlásil závažnú hypoglykémiu pri užívaní Trulicity 0,75 mg v kombinácii s liečbou SGLT2i
a žiadny pri užívaní Trulicity 1,5 mg alebo placeba.
Kombinovaná terapia s metformínom a pioglitazónomV klinickej štúdii kontrolovanej placebom a aktívnou látkou (exenatidom dvakrát denne), oba
v kombinácii s metformínom a pioglitazónom, 1,5 mg a 0,75 mg Trulicity vykazovala významné zníženie hodnoty HbA1c v porovnaní s placebom a exenatidom. Bolo to sprevádzané podstatne vyšším percentom pacientov, ktorí dosiahli cieľovú hodnotu HbA1c < 7,0 % alebo ≤ 6,5 %.
Tabuľka 8: Výsledky 52-týždňovej aktívne kontrolovanej štúdie s dvomi dávkami dulaglutidu v porovnaní s exenatidom
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny tel. hodnota zmena HbA1c FBG hmotnosti HbA1c HbA1c
(%) (%) <7,0 %(%) ≤6,5 %(%) (mmol/l) (kg)
|
26 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=279)
|
8,10
|
-1,51‡‡,††
|
78,2**,##
|
62,7**,##
|
-2,36**,##
|
-1,30**
|
Dulaglutid 0,75 mg
raz týždenne (n=280)
|
8,05
|
-1,30‡‡/††
|
65,8**/##
|
53,2**/##
|
-1,90**/##
|
0,20 */##
|
Placebo (n=141)
| 8,06
| -0,46
| 42,9
| 24,4
| -0,26
| 1,24
|
Exenatid+ 10 mcg
2x denne (n=276)
|
8,07
|
-0,99
|
52,3
|
38,0
|
-1,35
|
-1,07
|
52 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=279)
|
8,10
|
-1,36††
|
70,8##
|
57,2##
|
-2,04##
|
-1,10
|
Dulaglutid 0,75 mg
raz týždenne (n=280)
|
8,05
|
-1,07††
|
59,1#
|
48,3##
|
-1,58#
|
0,44#
|
Exenatid+ 10 mcg
2x denne (n=276)
|
8,07
|
-0,80
|
49,2
|
34,6
|
-1,03
|
-0,80
|
†† multiplicitne upravená 1-stranná p-hodnota < 0,025 pre superioritu dulaglutidu nad exenatidom,
vyhodnotené iba pre HbA1c
‡‡ multiplicitne upravená 1-stranná p-hodnota < 0,001 pre superioritu dulaglutidu v porovnaní s placebom, vyhodnotené iba pre HbA1c
* p < 0,05;** p < 0,001 liečebná skupina s dulaglutidom v porovnaní s placebom
# p < 0,05;## p < 0,001 liečebná skupina s dulaglutidom v porovnaní s exenatidom
+ Dávka exenatidu bola počas prvých 4 týždňov 5 mcg dvakrát denne a potom 10 mcg dvakrát denne.
Miera výskytu zdokumentovanej symptomatickej hypoglykémie počas používania 1,5 mg a 0,75 mg
Trulicity bola 0,19 a 0,14 a 0,75 epizód/pacienta/rok. Pri dulaglutide neboli pozorované žiadne
prípady závažnej hypoglykémie a pri exenatide dvakrát denne boli zaznamenané dva prípady závažnej hypoglykémie.
Kombinovaná terapia s titrovaným bazálnym inzulínom, s alebo bez metformínuV 28-týždňovej placebom kontrolovanej štúdii sa porovnávala Trulicity 1,5 mg s placebom ako
prídavnou liečbou k titrovanému bazálnemu inzulínu glargínu (88 % s a 12 % bez metformínu), aby sa vyhodnotil účinok na glykemickú kontrolu a bezpečnosť. Na optimalizáciu dávky inzulínu glargínu, sa obe skupiny titrovali na cieľovú hladinu sérovej glukózy nalačno <5,6 mmol/l. Stredná východisková hodnota inzulínu glargínu bola 37 jednotiek/deň u pacientov užívajúcich placebo a 41 jednotiek/deň
u pacientov užívajúcich Trulicity 1,5 mg. Počiatočné hodnoty inzulínu glargínu u pacientov s HbA1c
< 8,0 % boli zredukované o 20 %. Na konci 28-týždňovej liečebnej periódy bola dávka
65 jednotiek/deň pre pacientov užívajúcich placebo a 51 jednotiek/deň pre pacientov s Trulicity
1,5 mg. Po 28 týždňoch viedla liečba s Trulicity 1.5 mg raz týždenne ku štatisticky významnej redukcii HbA1c v porovnaní s placebom a významne vyššie percento pacientov dosiahlo cieľové hodnoty HbA1c < 7,0 % a ≤ 6,5 % (Tabuľka 9).
Tabuľka 9: Výsledky 28-týždňovej štúdie porovnania dulaglutidu a placeba ako prídavnej liečby
k titrovanému inzulínu glargínu.
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny tel. hodnota zmena HbA1c FBG hmotnosti HbA1c HbA1c
(%) (%) <7,0 %(%) ≤6,5 %(%) (mmol/l) (%)
|
28 týždňov
|
Dulaglutid 1,5 mg
raz týždenne
a inzulín glargín
(n=150)
|
8,41
|
-1,44‡‡
|
66,7‡‡
|
50,0**
|
-2,48‡‡
|
-1,91‡‡
|
Placebo raz týždenne
a inzulín glargín
(n=150)
|
8,32
|
-0,67
|
33,3
|
16,7
|
-1,55
|
0,50
|
‡‡ p < 0,001 pre superioritu dulaglutidu v porovnaní s placebom, s celkovou kontrolovanou chybou typu I
** p < 0,001 dulaglutidové rameno v porovnaní s placebom
Miera výskytu zdokumentovanej symptomatickej hypoglykémie počas používania Trulicity 1,5 mg a inzulínu glargín bola 3,38 epizód/pacienta/rok v porovnaní s placebom a inzulínom glargín 4,38 epizód/pacienta/rok. Jeden pacient hlásil závažnú hypoglykémiu pri liečbe s Trulicity 1,5 mg a žiadny pri placebe.
Kombinovaná terapia s prandiálnym inzulínom a s metformínom alebo bez metformínuV tejto klinickej štúdii pacienti, ktorí pred zaradením do štúdie používali 1 alebo 2 injekcie inzulínu denne, ukončili svoj inzulínový režim pred klinickým skúšaním a boli randomizovaní na dulaglutid raz týždenne alebo inzulín glargín raz denne, oba v kombinácii s prandiálnym inzulínom lispro trikrát denne, s metformínom alebo bez metformínu. V 26. týždni bola 1,5 mg a 0,75 mg Trulicity lepšia ako inzulín glargín v znižovaní hladiny HbA1c a tento účinok pretrval až do 52. týždňa. Vyššie percento pacientov tiež dosiahlo cieľové hodnoty HbA1c < 7,0 % alebo ≤ 6,5 % v 26. týždni a hodnoty < 7,0 % v 52. týždni oproti tým, čo používali inzulín glargín.
Tabuľka 10: Výsledky 52-týždňovej aktívne kontrolovanej štúdie s dvomi dávkami dulaglutidu v porovnaní s inzulínom glargínom
Vých. Stredná Pacienti s cieľ. hodnotou Zmena Zmeny tel. hodnota zmena HbA1c FBG hmotnosti HbA1c HbA1c
(%) (%) <7,0 %(%) ≤6,5 %(%) (mmol/l) (%)
|
26 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=295)
|
8,46
|
-1,64††
|
67,6#
|
48,0#
|
-0,27##
|
-0,87##
|
Dulaglutid 0,75 mg
raz týždenne (n=293)
|
8,40
|
-1,59††
|
69,0#
|
43,0
|
0,22##
|
0,18##
|
Inzulín glargín+
raz denne (n=296)
|
8,53
|
-1,41
|
56,8
|
37,5
|
-1,58
|
2,33
|
52 týždňov
|
Dulaglutid 1,5 mg raz
týždenne (n=295)
|
8,46
|
-1,48††
|
58,5#
|
36,7
|
0,08##
|
-0,35##
|
Dulaglutid 0,75 mg
raz týždenne (n=293)
|
8,40
|
-1,42††
|
56,3
|
34,7
|
0,41##
|
0,86##
|
Inzulín glargín+
raz denne (n=296)
|
8,53
|
-1,23
|
49,3
|
30,4
|
-1,01
|
2,89
|
†† multiplicitne upravená 1-stranná p-hodnota < 0,025 pre superioritu dulaglutidu v porovnaní s
inzulínom glargínom, vyhodnotené iba pre HbA1c
# p < 0,05; ## p < 0,001 liečebná skupina s dulaglutidom v porovnaní s inzulínom glargínom
+ Dávky inzulínu glargínu boli upravené s použitím algoritmu s cieľovou hodnotou plazmovej glukózy nalačno < 5,6 mmol/l
Miera výskytu zdokumentovanej symptomatickej hypoglykémie počas používania 1,5 mg a 0,75 mg Trulicity a inzulínu glargínu bola 31,06; 35,66 a 40,95 epizód/pacienta/rok, v uvedenom poradí. Závažná hypoglykémia bola hlásená u desiatich pacientov používajúcich 1,5 mg Trulicity, u siedmich pacientov používajúcich 0,75 mg Trulicity a u pätnástich pacientov používajúcich inzulín glargín.
Glukóza v krvi nalačno
Liečba dulaglutidom mala za následok významné zníženie hladiny glukózy v krvi nalačno oproti
východiskovej hodnote. Najvyšší účinok na hladiny glukózy v krvi nalačno sa vyskytol do 2 týždňov. Zlepšenie hladiny glukózy v krvi nalačno pretrvalo počas najdlhšej klinickej štúdie v trvaní
104 týždňov.
Postprandiálna glukóza
Liečba dulaglutidom mala za následok významné zníženie strednej hladiny postprandiálnej glukózy oproti východiskovým hodnotám (zmeny od východiskových hodnôt po primárny časový
bod -1,95 mmol/l až -4,23 mmol/l).
Funkcia beta-buniek
Klinické štúdie s dulaglutidom ukázali zlepšenie funkcie beta-buniek pri meraní prostredníctvom vyhodnotenia modelu homeostázy (HOMA2-%B). Trvanie účinku na funkciu beta-buniek pretrvalo
počas najdlhšej klinickej štúdie v trvaní 104 týždňov.
Telesná hmotnosť
Trulicity 1,5 mg sa spájala s udržaním poklesu hmotnosti počas trvania klinických štúdií (od
východiskovej hodnoty po finálny časový bod -0,35 kg až -2,90 kg). Zmeny telesnej hmotnosti pri Trulicity 0,75 mg boli v rozmedzí od 0,86 kg do -2,63 kg. Pokles telesnej hmotnosti bol pozorovaný u pacientov, ktorým bol podávaný dulaglutid bez ohľadu na nevoľnosť, hoci pokles mal vyššie numerické hodnoty v skupine s nevoľnosťou.
Pacientom hlásené výsledky
Dulaglutid významne zlepšoval celkovú spokojnosť s liečbou v porovnaní s exenatidom podávaným
dvakrát denne. Okrem toho bola zaznamenaná významne nižšia pozorovaná frekvencia hyperglykémie a hypoglykémie v porovnaní s exenatidom podávaným dvakrát denne.
Krvný tlak
Účinok dulaglutidu na krvný tlak vyhodnotený podľa ambulantného monitorovania krvného tlaku
(ABPM) bol hodnotený v klinickej štúdii, ktorej sa zúčastnilo 755 pacientov s diabetom 2. typu. Pri liečbe dulaglutidom došlo po 16. týždňoch zníženie systolického krvného tlaku (SBP) (-2,8 mm Hg rozdiel v porovnaní s placebom). V hodnotách diastolického krvného tlaku (DBP) sa nevyskytli žiadne rozdiely. V poslednom časovom bode klinickej štúdie, po 26 týždňoch, sa u SBP a DBP ukázali rovnaké výsledky.
Kardiovaskulárne hodnotenie
Metaanalýza štúdií fázy II a III
V rámci metaanalýzy registračných štúdií fázy II a III sa celkovo u 51 pacientov (dulaglutid: 26 [N =
3 885]; všetky komparátory: 25 [N = 2 125]) vyskytla aspoň jedna kardiovaskulárna (CV) udalosť (úmrtie v dôsledku CV príčin, nefatálny IM, nefatálna mozgová porážka alebo hospitalizácia kvôli nestabilnej angíne pectoris). Výsledky ukazujú, že sa pri liečbe dulaglutidom v porovnaní s kontrolnou liečbou nevyskytlo zvýšené CV riziko (HR: 0,57; CI: [0,30; 1,10]).
Štúdia hodnotiaca kardiovaskulárne príhody
Dlhodobá kardiovaskulárna štúdia s Trulicity bola placebom kontrolovaná, dvojito zaslepená. Pacienti s diabetom 2. typu boli randomizovaní buď na liečbu Trulicity v dávke 1,5 mg (4 949) alebo
podávanie placeba (4 952), pričom obe skupiny dostávali aj štandardnú liečbu diabetu 2. typu (dávka
vo výške 0,75 mg sa v tejto štúdii nepodávala). Medián času následného sledovania bol 5,4 roka.
Priemerný vek bol 66,2 roka, priemerný BMI bol 32,3 kg/m² a 46,3 % pacientov boli ženy. 3 114 (31,5 %) pacientov malo preukázané kardiovaskulárne ochorenie. Priemerná východisková hladina HbA1c predstavovala 7,2 %. Rameno liečené Trulicity zahŕňalo pacientov vo veku ≥ 65 rokov
(n = 2619) a ≥ 75 rokov (n = 484) a pacientov s miernym (n = 2435), stredne ťažkým (n = 1031) alebo
ťažkým (n = 50) poškodením funkcie obličiek.
Primárnym cieľovým ukazovateľom bol čas od randomizácie do objavenia akejkoľvek závažnej nepriaznivej kardiovaskulárnej udalosti (Major Adverse Cardiovascular Event, MACE) – kardiovaskulárneho úmrtia, nefatálneho infarktu myokardu alebo nefatálnej mozgovej príhody.
V porovnaní s placebom Trulicity dosahovala lepšie výsledky v prevencii MACE (obrázok č. 1). Ako
je znázornené na obrázku č. 2, každá zložka MACE prispievala k zníženiu MACE.
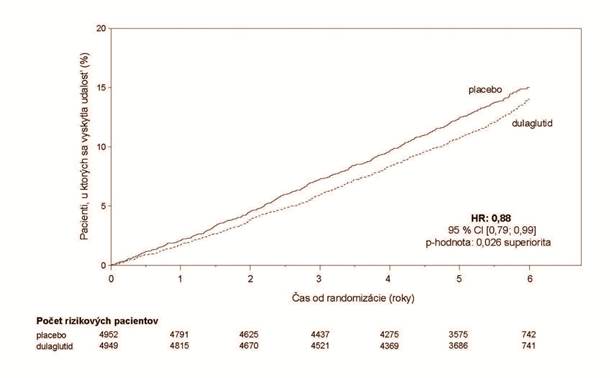
Obrázok č. 1: Kaplanova-Meierova krivka znázorňujúca čas do prvého výskytu kompozitného ukazovateľa: kardiovaskulárneho úmrtia, nefatálneho infarktu myokardu alebo nefatálnej mozgovej príhody v dlhodobej dulaglutidovej kardiovaskulárnej štúdii
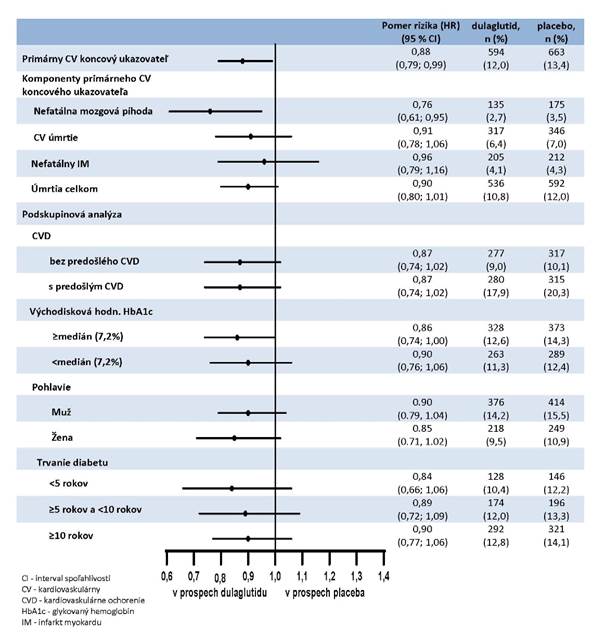
Obrázok č. 2: Grafické znázornenie (Forest plot) analýz jednotlivých druhov kardiovaskulárnych
udalostí, úmrtia z akejkoľvek príčiny a konzistentnosti účinku medzi podskupinami pre primárny cieľový ukazovateľ.
Bolo pozorované významné a trvalé zníženie hladín HbA1c medzi východiskovou hodnotou do
60. mesiaca pri porovnaní Trulicity a placeba používanými ako doplnok štandardnej starostlivosti
(-0,29 % verzus 0,22 %; odhadovaný rozdiel liečby (ETD) -0,51 % [-0,57; -0,45]; p < 0,001).
V porovnaní s placebom sa v skupine pacientov liečených Trulicity vyskytlo výrazne menej pacientov, ktorí dostali dodatočnú glykemickú liečbu (Trulicity: 2 086 [42,2 %]; placebo: 2 825 [57,0 %];
p < 0,001).
Osobitné skupiny pacientov
Použitie u pacientovsporuchoufunkcieobličiekV 52-týždňovej štúdii sa Trulicity 1,5 mg a 0,75 mg porovnávala s titrovaným inzulínom glargínom, ako prídavnou liečbou k prandiálnemu inzulínu lispro, na vyhodotenie účinku na glykemickú kontrolu a bezpečnosť pacientov so stredne závažným až závažným chronickým ochorením obličiek (eGFR
[podľa CKD-EPI] < 60 a ≥ 15 ml/min/1,73 m2). V čase randomizácie pacienti ukončili predštúdijný
inzulínový režim. Na začiatku liečby bola celková priemerná eGFR 38 ml/min/1,73 m2, 30 %
pacientov malo eGFR < 30 ml/min/1,73 m2.
V 26. týždni nebola 1,5 mg a 0,75 mg Trulicity inferiórna voči inzulínu glargínu v znižovaní HbA1c
a tento účinok pretrvával 52 týždňov. Podobné percento pacientov dosiahlo cieľovú hodnotu HbA1c
< 8,0 % v 26. a 52. týždni pri oboch dávkach dulaglutidu aj inzulínu glargínu.
Tabuľka 11: Výsledky 52-týždňovej aktívne kontrolovanej štúdie s dvomi dávkami dulaglutidu v porovnaní s inzulínom glargínom (u pacientov so stredne závažným až závažným chronickým ochorením obličiek)
HbA1c na Priemerná Pacienti s Zmena FBG Zmena začiatku zmena cieľovým telesnej liečby HbA1c HbA1c hmotnosti
(%) (%) < 8,0% (%) (mmol/l) (kg)
|
26. týždeň
|
Dulaglutid 1,5 mg
raz týždenne (n=192)
|
8,60
|
-1,19†
|
78,3
|
1,28##
|
-2,81##
|
Dulaglutid 0,75 mg
raz týždenne (n=190)
|
8,58
|
-1,12†
|
72,6
|
0,98##
|
-2,02##
|
Inzulín glargín+ raz
denne (n=194)
|
8,56
|
-1,13
|
75,3
|
-1,06
|
1,11
|
52. týždeň
|
Dulaglutid 1,5 mg
raz týždenne (n=192)
|
8,60
|
-1,10†
|
69,1
|
1,57##
|
-2,66##
|
Dulaglutid 0,75 mg
raz týždenne (n=190)
|
8,58
|
-1,10†
|
69,5
|
1,15##
|
-1,71##
|
Inzulín glargín+ raz
denne (n=194)
|
8,56
|
-1,00
|
70,3
|
-0,35
|
1,57
|
† 1-stranná hodnota p < 0,025; non-inferiorita dulaglutidu voči inzulínu glargínu
## p < 0,001 skupina liečby s dulaglutidom v porovnaní s inzulínom glargínom
+ Dávky inzulínu glargínu boli upravené s použitím algoritmu s cieľovou hodnotou plazmatickej glukózy nalačno
≤ 8,3 mmol/L
Miera výskytu zdokumentovanej symptomatickej hypoglykémie pri užívaní 1,5 mg a 0,75 mg Trulicity a pri užívaní inzulínu glargínu boli 4,44; 4,34 a 9,62 epizód/pacienta/rok, v uvedenom poradí. Žiadni pacienti nehlásili závažné prípady hypoglykémie s Trulicity 1,5 mg, šiesti
s Trulicity 0,75 mg a sedemnásti s inzulínom glargínom. Bezpečnostný profil Trulicity u pacientov s
poruchou funkcie obličiek bol podobný profilu, ktorý bol pozorovaný v iných štúdiách s Trulicity.
Pediatrická populáciaEurópska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Trulicity v jednej alebo vo viacerých podskupinách pediatrickej populácie pre schválenú indikáciu pri liečbe ochorenia diabetes mellitus 2. typu (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpciaPo subkutánnom podaní pacientom s diabetom 2. typu dosahuje dulaglutid maximálne plazmatické koncentrácie v priebehu 48 hodín. Po niekoľkonásobnom subkutánnom podaní 1,5 mg dávky dulaglutidu pacientom s diabetom 2. typu bola stredná maximálna (Cmax) expozícia približne
114 ng/ml a celková (AUC) expozícia 14 000 ngh/ml. Plazmatické koncentrácie v ustálenom stave boli dosiahnuté medzi 2 - 4 týždňami podávania dulaglutidu raz týždenne (1,5 mg). Expozície po
subkutánnom podaní jednorazovej (1,5 mg) dávky dulaglutidu do brucha, stehna alebo ramena boli
porovnateľné. Stredná absolútna biologická dostupnosť dulaglutidu po jednorazovej 1,5 mg a 0,75 mg subkutánne podanej dávke bola 47 % a 65 %, v uvedenom poradí.
D
is
t
ri
b
úcia
Stredný objem distribúcie po subkutánnom podaní 0,75 mg a 1,5 mg dulaglutidu v ustálenom stave u pacientov s diabetom 2. typu bol približne 19,2 l a 17,4 l.
Biotransformácia
Predpokladá sa, že dulaglutid sa rozloží na svoje aminokyselinové zložky obvyklým spôsobom bielkovinového katabolizmu.
Eliminácia
Stredný zdanlivý klírens 0,75 mg a 1,5 mg dulaglutidu u ľudí v ustálenom stave bol 0,111 l/h a
0,107 l/h s polčasom eliminácie 4,7 dní.
Osobitné skupiny pacientov
Starší
Vek nemal klinicky významný účinok na farmakokinetické a farmakodynamické vlastnosti dulaglutidu.
Pohlavie a rasa
Vek a rasa nemali klinicky významný účinok na farmakokinetiku dulaglutidu.
Telesná hmotnosť alebo index telesnej hmotnosti
Farmakokinetické analýzy ukázali štatisticky významný inverzný vzťah medzi telesnou hmotnosťou alebo indexom telesnej hmotnosti (BMI) a expozíciu dulaglutidu, hoci hmotnosť ani BMI nemali
klinicky významný účinok na glykemickú kontrolu.
Porucha funkcie obličiek
Farmakokinetika dulaglutidu sa hodnotila v klinickej farmakologickej štúdii, pričom u zdravých subjektov a pacientov s miernym až závažným poškodením obličiek (CrCl < 30 ml/min), vrátane konečného štádia ochorenia obličiek (vyžadujúceho dialýzu) bola vo všeobecnosti rovnaká. Okrem toho, v 52-týždňovej klinickej štúdii u pacientov s diabetom 2. typu a stredne závažnou až závažnou poruchou funkcie obličiek (eGFR [podľa CKD-EPI] < 60 a ≥ 15 ml/min/1,73 m2), bol farmakokinetický profil Trulicity 0,75 mg a 1,5 mg jedenkrát týždenne podobný ako
v predchádzajúcich klinických štúdiách. Táto klinická štúdia nezahŕňala pacientov s konečným štádiom poškodenia obličiek.
Porucha funkcie pečene
Farmakokinetika dulaglutidu sa hodnotila v klinickej farmakologickej štúdii. U subjektov s poškodením pečene sa v porovnaní so zdravými kontrolnými skupinami vyskytol štatisticky významný pokles expozície na dulaglutid, až 30 % u stredného Cmax a až 33 % u AUC. U subjektov s väčším poškodením pečene sa obvykle objavil nárast tmax dulaglutidu. Nebola však pozorovaná žiadna tendencia expozície na dulaglutid súvisiaca so stupňom poškodenia pečene. Tieto účinky neboli považované za klinicky významné.
Pediatrická populácia
Neuskutočnili sa žiadne štúdie zamerané na charakterizáciu farmakokinetiky dulaglutidu
u pediatrických pacientov.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje, získané na základe obvyklých farmakologických štúdií o bezpečnosti a toxicite po opakovanom podávaní, neodhalili žiadne osobitné riziko pre ľudí.
V 6-mesačnej štúdii zameranej na karcinogenitu u transgenických myší sa nevyskytla žiadna tumorogénna odpoveď. V 2-ročnej štúdii na potkanoch zameranej na karcinogenitu, pri ≥ 7-násobne vyššej expozícii ako je klinická u ľudí, po podaní 1,5 mg dulaglutidu týždenne, dulaglutid spôsobil
štatisticky významné, s dávkou súvisiace zvýšenie výskytu nádorov C-buniek štítnej žľazy
(kombináciu adenómov a karcinómov). Klinická relevancia týchto zistení je zatiaľ neznáma.
Počas trvania štúdií zameraných na fertilitu, bolo pri hladinách dávok súvisiacich s poklesom príjmu potravy a telesnej hmotnosti u samíc, pozorované zníženie počtu žltých teliesok a predĺženie estrogénového cyklu; neboli však pozorované žiadne účinky na ukazovatele fertility a počatia alebo embryonálny vývoj. V reprodukčných toxikologických štúdiách na potkanoch a králikoch boli pri 11- až 44-násobne vyšších expozíciách dulaglutidu pozorované účinky na kostru a spomalenie rastu plodu, ale neboli pozorované žiadne malformácie plodu. Liečba potkanov počas gravidity a laktácie pri 16- násobne vyšších expozíciách oproti klinickým spôsobovala pamäťový deficit u samičích potomkov. Dávkovanie dulaglutidu u samčích a samičích mláďat potkanov nevyvolalo pamäťový deficit ani pri
91-násobku ľudskej expozície.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
citrát sodný
kyselina citrónová bezvodá manitol
polysorbát 80
voda na injekciu
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 ºC – 8 ºC).
Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Počaspoužívania:
Trulicity sa môže uchovávať mimo chladničky najviac 14 dní, pri teplote do 30 ºC.
6.5 Druh obalu a obsah balenia
Sklenená striekačka (typu I).
Každá naplnená striekačka obsahuje 0,5 ml roztoku.
Balenia po 4 kusoch naplnených striekačiek a multibalenie obsahujúce 12 (3 balenia po 4 kusoch)
naplnených striekačiek. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Pokyny na použitie
Naplnená striekačka je na jednorazové použitie.
Pokyny na použitie injekčnej striekačky, ktoré sú súčasťou písomnej informácie sa musia dôsledne
dodržiavať.
Trulicity sa nemá používať v prípade, ak sa v roztoku objavia častice, ak je roztok zakalený a/alebo
zafarbený.
Ak Trulicity zamrzla, nesmie sa používať.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIEli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Holandsko
8. REGISTRAČNÉ ČÍSLOEU/1/14/956/004
EU/1/14/956/005
EU/1/14/956/009
EU/1/14/956/010
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21. novembra 2014
Dátum posledného predĺženia: 23. augusta 2019
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú k dispozícii na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.