
65 rokov)
U starších pacientov môže progresívne zhoršovanie renálnej funkcie viesť k stálemu poklesu nárokov na inzulín (pozri časť 4.8 a 5.1).
Zhoršená renálna funkcia
U pacientov so zhoršenou renálnou funkciou môžu byť nároky na inzulín znížené z dôvodu zníženého inzulínového metabolizmu (pozri časť 4.8).
Zhoršená funkcia pečene
U pacientov so zhoršenou funkciou pečene môžu byť nároky na inzulín znížené z dôvodu zníženej kapacity pre glukoneogenézu a zníženého inzulínového metabolizmu.
Pediatrická populácia
Toujeo sa môže používať u dospievajúcich a u detí vo veku od 6 rokov, pričom platia rovnaké princípy ako u dospelých pacientov (pozri časti 5.1 a 5.2). Pri prechode z iného bazálneho inzulínu na
Toujeo sa musí individuálne zvážiť zníženie dávky bazálneho a bolusového inzulínu, aby sa minimalizovalo riziko hypoglykémie (pozri časť 4.4).
Bezpečnosť a účinnosť Toujeo u detí vo veku do 6 nebola stanovená. K dispozícii nie sú žiadne údaje.
Spôsobpodávania
Toujeo je určený len na subkutánne podanie.
Toujeo sa podáva subkutánnou injekciou do do brušnej steny, deltového svalu alebo do stehna. Miesta podania injekcie sa musia v rámci danej oblasti meniť po každom podaní (pozri časť 4.8).
Toujeo sa nesmie podávať intravenózne. Predĺžené trvanie účinku Toujeo závisí od jeho aplikácie do subkutánneho tkaniva. Intravenózne podanie dávky, ktorá sa obvykle podáva subkutánne, by mohlo spôsobiť ťažkú hypoglykémiu.
Toujeo sa nesmie používať v inzulínových infúznych pumpách.
K dispozícii sú dva druhy naplnených pier Toujeo. Ukazovateľ dávky ukazuje počet jednotiek, ktorý sa má injekciou podať. Naplnené pero Toujeo SoloStar aj Toujeo DoubleStar je vyvinuté špecificky pre daný druh pera Toujeo a preto nie je potrebné žiadne prepočítavanie dávky.
Pred použitím naplneného pera Toujeo SoloStar alebo Toujeo DoubleStar je potrebné si pozorne prečítať Návod na používanie, ktorý je súčasťou písomnej informácie pre používateľa (pozri časť 6.6).
S naplneným perom Toujeo SoloStar sa môže jednou injekciou podať dávka od 1 do 80 jednotiek, odčítava sa po 1 jednotke.
Pomocou naplneného pera Toujeo DoubleStar sa môže jednou injekciou podať dávka od 2 do
160 jednotiek, odčítava sa po 2 jednotkách.
Ak sa prechádza z pera Toujeo SoloStar na Toujeo DoubleStar, v prípade, že pacient mal predchádzajúcu dávku s nepárnym číslom (napr. 23 jednotiek), táto dávka sa musí buď zvýšiť alebo znížiť o 1 jednotku (napr. na 24 alebo 22 jednotiek).
Naplnené pero Toujeo DoubleStar sa odporúča pacientom, ktorí potrebujú aspoň 20 jednotiek inzulínu denne (pozri časť 6.6).
Toujeo sa nesmie natiahnuť z náplne v naplnenom pere Toujeo SoloStar alebo Toujeo DoubleStar do injekčnej striekačky, pretože to môže spôsobiť ťažké predávkovanie (pozri časť 4.4, 4.9 a 6.6).
Pred každou injekciou je potrebné nasadiť novú sterilnú ihlu. Opakované použitie ihiel zvyšuje riziko ich upchatia, čo môže spôsobiť poddávkovanie alebo predávkovanie (pozri časť 4.4 a 6.6).
To isté inzulínové pero nikdy nesmie používať viac ako jedna osoba a to ani vtedy, ak sa ihla vymení. Zabráni sa tým možnému prenášaniu chorôb (pozri časť 6.6).
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Toujeo nie je inzulín voľby na liečbu diabetickej ketoacidózy. Namiesto toho sa v takýchto prípadoch odporúča intravenózne podať bežný inzulín.
V prípade nedostatočnej glukózovej kontroly alebo náchylnosti na hyperglykemické alebo hypoglykemické príhody sa musí ešte pred zvážením úpravy dávok prehodnotiť, ako pacient dodržiava predpísaný liečebný režim, injekčné miesta, správnu techniku aplikácie injekcií a iné významné faktory.
Hypoglykémia
Čas výskytu hypoglykémie závisí od profilu účinku použitých inzulínov a preto sa môže zmeniť pri zmene liečebného režimu.
Vyžaduje sa mimoriadna opatrnosť a intenzívne monitorovanie hladiny glukózy v krvi sa odporúča u pacientov, pre ktorých môžu byť hypoglykemické príhody obzvlášť klinicky významné, ako sú napríklad pacienti so signifikantnou stenózou koronárnych artérií alebo krvných ciev zásobujúcich mozog (riziko srdcových alebo mozgových hypoglykemických komplikácií), ako aj pacienti
s proliferatívnou retinopatiou, najmä ak sa neliečia fotokoaguláciou (riziko prechodnej amaurózy po hypoglykémii).
Pacienti majú byť upozornení na okolnosti, kedy sa varovné príznaky hypoglykémie zmenšujú. Varovné príznaky hypoglykémie sa môžu meniť, môžu byť menej výrazné alebo u určitých rizikových skupín môžu chýbať. Patria sem pacienti:
- s nápadne zlepšenou glykemickou kontrolou,
- s pozvoľným nástupom hypoglykémie,
- staršieho veku,
- po prechode zo zvieracieho na ľudský inzulín,
- s autonómnou neuropatiou v súčasnosti,
- s dlhodobou anamnézou cukrovky,
- s psychiatrickým ochorením,
- dostávajúci sprievodnú liečbu niektorými inými liekmi (pozri časť 4.5).
Tieto okolnosti môžu spôsobiť ťažkú hypoglykémiu (a možnú stratu vedomia) skôr, ako si pacient hypoglykémiu uvedomí.
Predĺžený účinok subkutánne podaného inzulínu glargín môže oneskoriť zotavenie sa po hypoglykémii.
Ak sa zistia normálne alebo znížené hodnoty glykovaného hemoglobínu, musí sa vziať do úvahy možnosť rekurentných nerozpoznaných (najmä nočných) príhod hypoglykémie.
Nevyhnutným predpokladom pre zníženie rizika hypoglykémie je to, aby pacient dodržiaval režim dávok a diétny režim, správne podávanie inzulínu a znalosť príznakov hypoglykémie.
Faktory, ktoré zvyšujú náchylnosť na hypoglykémiu, si vyžadujú obzvlášť podrobné sledovanie a
môžu si vyžiadať aj úpravu dávky. K nim patria:
- zmena injekčného miesta,
- zlepšená citlivosť na inzulín (napr. odstránením stresových faktorov),
- neobvyklá, zvýšená alebo predĺžená fyzická aktivita,
- interkurentné ochorenie (napr. vracanie, hnačka),
- neprimeraný príjem potravy,
- vynechanie jedla,
- konzumácia alkoholu,
- určité nekompenzované poruchy endokrinného systému (napr. pri hypotyreóze a pri nedostatočnej činnosti adenohypofýzy alebo kôry nadobličiek),
- súbežná liečba niektorými inými liekmi (pozri časť 4.5).
Prechodzinzulínuglargín100jednotiek/mlnaToujeoanaopak
Nakoľko inzulín glargín 100 jednotiek/ml a Toujeo nie sú bioekvivalentné a nie sú zameniteľné, prestavenie pacienta si môže vyžiadať zmenu dávky a musí prebiehať iba pod dôkladným lekárskym dohľadom (pozri časť 4.2).
PrechodzinýchinzulínovnaToujeoanaopak
Prestavenie pacienta na iný typ alebo druh inzulínu na Toujeo a naopak sa musí robiť pod prísnym lekárskym dohľadom. Zmena sily, druhu (iný výrobca), typu (bežný, NPH, lente, s dlhotrvajúcim účinkom, atď.), pôvodu (zvierací, ľudský, analóg ľudského inzulínu) a/alebo výrobného postupu môže mať za následok to, že je potrebné zmeniť dávku (pozri časť 4.2).
Interkurentnéochorenie
Interkurentné ochorenie si vyžaduje intenzívnejšie sledovanie metabolizmu. V mnohých prípadoch sa indikujú močové testy na ketóny a často sa musí upraviť dávka inzulínu. Nároky na inzulín sú často
zvýšené. Pacienti s diabetom mellitus 1. typu musia udržiavať pravidelný prísun aspoň malého
množstva sacharidov, aj keď sú schopní jesť len málo alebo vôbec nie, prípadne vracajú a pod. a nikdy nesmú inzulín úplne vynechať.
Inzulínovéprotilátky
Podávanie inzulínu môže spôsobiť tvorbu protilátok. V zriedkavých prípadoch si môže prítomnosť týchto inzulínových protilátok vyžiadať úpravu dávok inzulínu, aby sa upravil sklon ku hyperglykémii
alebo hypoglykémii.
KombináciaToujeospioglitazónom
Pri súčasnom použití pioglitazónu s inzulínom boli hlásené prípady srdcového zlyhania, predovšetkým u pacientov s rizikovými faktormi pre rozvoj srdcového zlyhania. Preto je potrebné súčasné použitie
pioglitazónu a inzulínu glargín starostlivo zvážiť. V prípade, že sa kombinácia použije, u pacientov sa
musia sledovať znaky a príznaky srdcového zlyhania, prírastku telesnej hmotnosti a edému. V prípade akéhokoľvek výskytu zhoršenia srdcových príznakov sa musí liečba pioglitazónom ihneď prerušiť.
Predchádzaniechybámvliečbe
Boli hlásené chyby v liečbe, kedy boli náhodne podané iné inzulíny, najmä rýchlo účinkujúce, maniesto inzulínov s dlhotrvajúcim účinkom. Pred každou injekciou je nutné vždy skontrolovať
označenie na inzulíne, aby sa zabránilo zámene Toujeo za iné inzulíny (pozri časť 6.6).
Na zabránenie chybám v dávkovaní a potenciálnemu predávkovaniu je potrebné pacientov poučiť, že nikdy nesmú natiahnuť Toujeo (inzulín glargín 300 jednotiek/ml) z náplne v naplnenom pere Toujeo SoloStar alebo Toujeo DoubleStar do injekčnej striekačky (pozri časť 4.9 a 6.6).
Pred každou injekciou je potrebné nasadiť novú sterilnú ihlu. Pacientov treba poučiť, že ihly sa nesmú používať opakovane. Opakované použitie ihiel zvyšuje riziko ich upchatia, čo môže spôsobiť poddávkovanie alebo predávkovanie. V prípade, že sa ihla upchá, pacient musí postupovať podľa pokynov uvedených v kroku 3 v Návode na používanie, ktorý je súčasťou písomnej informácie pre používateľa (pozri časť 6.6).
Pacienti si musia vizuálne overiť počet zvolených jednotiek zobrazených v okienku zobrazujúcom dávku na pere. Pacienti, ktorí sú nevidiaci alebo majú slabý zrak, musia byť upozornení, že potrebujú pomoc inej osoby s dobrým zrakom, ktorá vie používať inzulínové pero.
Pozri časť 4.2 pod “Spôsob podávania”.
Pomocné
l
átky
Tento liek obsahuje menej ako 1 mmol (23 mg) sodíka v jednej dávke t.j. je v podstate „bez obsahu sodíka“.
4.5 Liekové a iné interakcie
Celý rad látok ovplyvňuje glukózový metabolizmus a môže si vyžiadať úpravu dávky inzulínu glargín.
Medzi látky, ktoré môžu zosilňovať účinok znižujúci hladinu cukru v krvi a zvyšujú náchylnosť na hypoglykémiu, patria: antidiabetiká, inhibítory enzýmu konvertujúceho angiotenzín (ACE), disopyramid, fibráty, fluoxetín, inhibítory monoaminooxidázy (MAO), pentoxifylín, propoxyfén, salicyláty a sulfónamidové antibiotiká.
Medzi látky, ktoré môžu zoslabovať účinok znižujúci hladinu cukru v krvi, patria: kortikosteroidy, danazol, diazoxid, diuretiká, glukagón, izoniazid, estrogény a progestagény, fenotiazínové deriváty, somatotropín, sympatomimetiká (napr. epinefrín [adrenalín], salbutamol, terbutalín), tyroidné hormóny, atypické antipsychotické lieky (napr. klozapín a olanzapín) a inhibítory proteázy.
Betablokátory, klonidín, soli lítia alebo alkohol môžu buď zosilňovať alebo zoslabovať účinok inzulínu znižujúci hladinu cukru v krvi.Pentamidín môže spôsobiť hypoglykémiu, po ktorej môže niekedy nasledovať hyperglykémia.
Pod vplyvom sympatolytík, ako sú betablokátory, klonidín, guanetidín a rezerpín, sa naviac môžu oslabiť alebo chýbať príznaky adrenergnej kontraregulácie.
4.6 Fertilita, gravidita a laktácia
Gravidita
S používaním Toujeo u gravidných žien nie je žiadna klinická skúsenosť.
Z kontrolovaných klinických štúdii nie sú k dispozícii žiadne klinické údaje o gravidných ženách vystavených účinku inzulínu glargín. Údaje o veľkom počte gravidných žien (viac ako 1000 gravidít s inzulínom glargín 100 jednotiek/ml) nepreukázali žiadne špecifické nežiaduce účinky inzulínu glargín na graviditu a žiadne špecifické malformácie ani toxicitu inzulínu glargín pre plod/novorodenca.
Údaje získané u zvierat nepreukázali reprodukčnú toxicitu.
Ak je to klinicky potrebné, môže sa zvážiť použitie Toujeo počas gravidity.
Pre pacientky s predtým existujúcou alebo gestačnou cukrovkou je dôležité udržiavanie dobrej metabolickej kontroly počas gravidity, aby sa predišlo nepriaznivým dôsledkom v súvislosti
s hyperglykémiou. Nároky na inzulín môžu počas prvého trimestra poklesnúť a v druhom a treťom
trimestri všeobecne stúpajú. Okamžite po pôrode nároky na inzulín rapídne klesnú (zvýšené riziko hypoglykémie). Nevyhnutné je starostlivé sledovanie glykémie.
Laktácia
Nie je známe, či sa inzulín glargín vylučuje do materského mlieka. Nepredpokladajú sa žiadne metabolické účinky požitého inzulínu glargín na dojčeného novorodenca/dieťa, keďže inzulín glargín
ako peptid sa spracováva na aminokyseliny v ľudskom tráviacom trakte.
Dojčiace matky môžu vyžadovať úpravu dávky inzulínu a diétu.
Fertilita
Štúdie na zvieratách nepreukázali priame škodlivé účinky na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Následkom hypoglykémie alebo hyperglykémie, alebo napríklad ako dôsledok zhoršenia zraku, sa môže zhoršiť pacientova schopnosť sústrediť sa a reagovať. To môže predstavovať riziko
v situáciách, kedy sú tieto schopnosti zvlášť dôležité (napr. vedenie vozidla alebo obsluha strojov).
Pacientom majú byť odporučené také opatrenia, aby sa počas vedenia vozidla vyhli hypoglykémii. To je obzvlášť dôležité pre tých, ktorí majú oslabené alebo chýbajúce varovné príznaky hypoglykémie, alebo majú časté hypoglykemické príhody. Za týchto okolností sa musí zvážiť, či je vhodné viesť vozidlo alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
V klinických štúdiách uskutočnených s Toujeo a v klinickej praxi s inzulínom glargín
100 jednotiek/ml boli pozorované nasledujúce nežiaduce reakcie (pozri časť 5.1).
Hypoglykémia, vo všeobecnosti najčastejšia nežiaduca reakcia inzulínovej liečby, sa môže vyskytnúť vtedy, ak je dávka inzulínu privysoká vzhľadom na potrebu inzulínu.
Zoznamnežiaducichreakciívtabuľkovomformáte
Z klinických štúdií vyplynuli nasledujúce nežiaduce reakcie, ktoré sú zoradené podľa tried orgánových systémov a v poradí podľa klesajúceho výskytu (veľmi časté: ≥ 1/10; časté: ≥ 1/100 až < 1/10; menej časté: ≥ 1/1000 až < 1/100; zriedkavé: ≥ 1/10 000 až < 1/1000; veľmi zriedkavé: < 1/10 000);
neznáme: z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
MedDRA triedy orgánových systémov Poruchy imunitného systému Poruchy metabolizmu a výživy
Poruchy nervového systému
Veľmi časté Časté Menej časté Zriedkavé Veľmi zriedkavé
Alergické reakcie
Hypoglykémia
Dysgeúzia
Neznáme
Poruchy zraku Zhoršené videnie
Poruchy kože a podkožného tkaniva Poruchy kostrovej
a svalovej sústavy
a spojivového
tkaniva Celkové poruchy
a reakcie
v mieste podania
Lipohypertr ofia
Reakcie v mieste podania injekcie
Retinopatia
Lipoatrofia Kožná amyloidóza
Myalgia
Edém
 O
pis
vybraných
nežiaducich
reakcií
Poruchy metabolizmu a výživy
O
pis
vybraných
nežiaducich
reakcií
Poruchy metabolizmu a výživy
Závažné ataky hypoglykémie, najmä ak sú rekurentné, môžu spôsobiť neurologické poškodenie. Dlhotrvajúce alebo závažné hypoglykemické príhody môžu ohroziť život.
Znakom a príznakom neuroglykopénie predchádzajú u mnohých pacientov znaky adrenergnej kontraregulácie. Vo všeobecnosti platí, že čím väčší a rýchlejší je pokles hladiny glukózy v krvi, tým výraznejší je fenomén kontraregulácie a jej príznakov.
Poruchy imunitného systémuBezprostredné alergické reakcie na inzulín sú zriedkavé. Takéto reakcie na inzulín (vrátane inzulínu glargín) alebo na pomocné látky môžu byť spojené napríklad s generalizovanými kožnými reakciami,
angioedémom, bronchospazmom, hypotenziou a šokom a môžu ohroziť život. V klinických štúdiách s
Toujeo bol výskyt alergických reakcií podobný u pacientov liečených Toujeo (5,3%) ako u pacientov liečených inzulínom glargín 100 jednotiek/ml (4,5%).
Poruchy okaVýrazné zmeny glykemickej kontroly môžu dočasne zhoršiť zrak tým, že sa prechodne zmení zdurenie a refrakčný index šošovky.
Dlhodobo zlepšená glykemická kontrola zmenšuje riziko progresie diabetickej retinopatie. Avšak zintenzívnenie inzulínovej liečby s náhlym zlepšením glykemickej kontroly môže sprevádzať dočasné zhoršenie diabetickej retinopatie. U pacientov s proliferatívnou retinopatiou, najmä ak sa neliečia fotokoaguláciou, môžu ťažké hypoglykemické príhody vyústiť do prechodnej amaurózy.
Poruchy kože a podkožného tkaniva
V mieste injekcie sa môže vyskytnúť lipodystrofia a kožná amyloidóza, ktorá vedie k oneskorenej lokálnej absorpcii inzulínu. Priebežné striedanie miesta injekcie v rámci určitej injekčnej oblasti môže pomôcť znížiť alebo zabrániť takýmto reakciám.
Celkové poruchy a reakcie v mieste podaniaK reakciám v mieste podania injekcie patrí sčervenanie kože, bolesť, svrbenie, žihľavka, opuch alebo zápal. Väčšina miernych reakcií na inzulín v mieste injekcie obvykle vymizne za niekoľko dní až
týždňov. V klinických štúdiách s Toujeo u dospelých pacientov bol výskyt reakcií v mieste podania podobný u pacientov liečených Toujeo (2,5%) ako u pacientov liečených inzulínom glargín
100 jednotiek/ml (2,8%).
Inzulín môže zriedkavo spôsobiť opuch, najmä ak sa pôvodne slabá metabolická kontrola zlepšila intenzifikovanou inzulínovou liečbou.
PediatrickápopuláciaBezpečnosť a účinnosť lieku Toujeo sa preukázala v štúdii u detí vo veku od 6 do 18 rokov. Frekvencia, typ a závažnosť nežiaducich reakcií v pediatrickej populácii nenaznačujú rozdiely
v porovnaní so skúsenosťami vo všeobecnej populácii s diabetom (pozri časť 5.1). Údaje z klinickej štúdie týkajúce sa bezpečnosti u detí vo veku do 6 rokov nie sú dostupné.
InéšpeciálneskupinypacientovPodľa výsledkov z klinických štúdií bol bezpečnostný profil Toujeo u starších pacientov a u pacientov so zhoršenou funkciou obličiek podobný ako u celkovej populácie (pozri časť 5.1).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovaniePríznakyPredávkovanie inzulínom môže viesť k ťažkej a niekedy dlhotrvajúcej a život ohrozujúcej hypoglykémii.
LiečbaMierne hypoglykemické príhody sa obvykle liečia perorálnymi sacharidmi. Môže byť potrebná úprava dávky lieku, jedálneho lístka alebo telesnej aktivity.
Závažnejšie príhody spojené s kómou, záchvatmi alebo neurologickým poškodením možno liečiť intramuskulárnym alebo subkutánnym podaním glukagónu alebo intravenóznym podaním koncentrovanej glukózy. Keďže hypoglykémia sa po zdanlivom klinickom zotavení môže vrátiť, pacient musí udržiavať príjem sacharidov a je nutné pacienta pozorovať.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antidiabetiká, inzulíny a analógy na injekciu, pôsobiace dlhodobo. ATC kód: A10AE04.
MechanizmusúčinkuPrimárny účinok inzulínu, vrátane inzulínu glargín, je regulácia glukózového metabolizmu. Inzulín a jeho analógy znižujú hladinu glukózy v krvi stimuláciou periférneho vychytávania glukózy, najmä
kostrovým svalstvom a tukom a inhibíciou tvorby glukózy v pečeni. Inzulín inhibuje lipolýzu v adipocytoch, inhibuje proteolýzu a zvyšuje syntézu proteínov.
FarmakodynamickéúčinkyInzulín glargín je ľudský inzulínový analóg vyvinutý tak, aby mal nízku rozpustnosť v neutrálnom pH. Pri pH 4 je inzulín glargín úplne rozpustný. Po injekcii do podkožného tkaniva sa kyslý roztok
neutralizuje, následkom čoho sa tvoria mikroprecipitáty, z ktorých sa priebežne uvoľňuje v malých
množstvách inzulín glargín.
Podľa pozorovaní v euglykemických clamp štúdiách u pacientov s diabetom 1. typu účinok Toujeo na zníženie glukózy bol stabilnejší a dlhší v porovnaní s inzulínom glargín 100 jednotiek/ml po subkutánnej injekcii. Obrázok 1 znázorňuje výsledky skríženej (cross-over) štúdie u 18 pacientov s diabetom 1. typu po dobu maximálne 36 hodín po injekcii.Pri klinicky relevantných dávkach trval účinok Toujeo viac ako 24 hodín (až do 36 hodín).
Trvalejšie uvoľňovanie inzulínu glargín z precipitátu pri Toujeo oproti inzulínu glargín
100 jednotiek/ml je spôsobené znížením objemu injekcie o dve tretiny, ktoré má za následok menší povrch precipitátu.
Obrázok 1: Profil účinku v stabilnom stave u pacientov s diabetom 1. typu v 36-hodinovej euglykemickej clamp štúdii
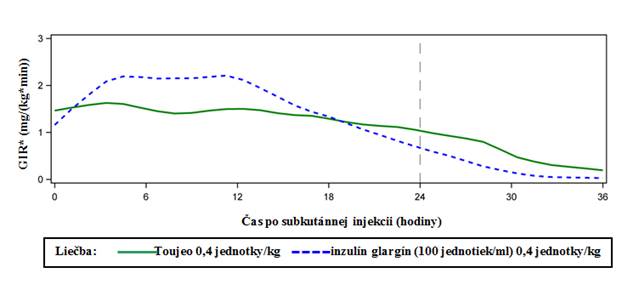
*GIR: rýchlosť infúzie glykózy: udáva sa ako množstvo infundovanej glukózy na udržanie konštantných plazmatických hladín glukózy (priemerné hodinové hodnoty). Koniec periódy pozorovania bol 36 hodín.
Inzulín glargín sa metabolizuje na 2 aktívne metabolity M1 a M2 (pozri časť 5.2).
Väzba na inzulínový receptor: štúdie
in vitro indikujú, že afinita inzulínu glargín a jeho metabolitov
M1 a M2 na receptor ľudského inzulínu je podobná ako u ľudského inzulínu.
Väzba na receptor IGF-1: afinita inzulínu glargín na ľudský receptor IGF-1 je približne 5 až 8-násobne väčšia ako u ľudského inzulínu (ale približne 70 až 80-násobne nižšia ako afinita IGF-1), zatiaľ čo M1 a M2 sa viažu na receptor IGF-1 s o niečo menšou afinitou v porovnaní s ľudským inzulínom.
Celková terapeutická koncentrácia inzulínu (inzulínu glargín a jeho metabolitov) zistená u pacientov
s diabetom 1. typu bola výrazne nižšia ako koncentrácia potrebná na obsadenie polovice maximálneho počtu IGF-1 receptorov a následnú aktiváciu mitogénno-proliferatívnej cesty spustenej receptorom
IGF-1. Fyziologické koncentrácie endogénneho IGF-1 môžu aktivovať mitogénno-proliferatívnu
cestu, avšak terapeutické koncentrácie zistené pri liečbe inzulínom vrátane Toujeo sú podstatne nižšie ako farmakologické koncentrácie potrebné na aktiváciu cesty IGF-1.
V klinických farmakologických štúdiách sa ukázalo, že pri intravenóznom podaní sú inzulín glargín a ľudský inzulín pri rovnakých dávkach ekvipotentné.
Telesná aktivita a iné premenné môžu ovplyvňovať časový priebeh účinku inzulínu glargín rovnako ako pri všetkých inzulínoch.
KlinickáúčinnosťabezpečnosťV otvorených, randomizovaných, kontrolovaných paralelných klinických štúdiách s trvaním do
26 týždňov, do ktorých bolo zahrnutých 546 pacientov s diabetom mellitus 1. typu a 2 474 pacientov
2. typu, sa porovnávala celková účinnosť a bezpečnosť Toujeo (inzulín glargín 300 jednotiek/ml)
podávaného raz denne na kontrolu glykémie s inzulínom glargín 100 jednotiek/ml podávaným raz denne (tabuľka 1 a 2).
Výsledky z klinických štúdií s Toujeo ukázali, že zníženie glykovaného hemoglobínu (HbA1c) od začiatku až do konca štúdie bolo non-inferiórne oproti inzulínu glargín 100 jednotiek/ml. Zníženie
glukózy v plazme na konci klinickej štúdie s Toujeo bolo podobné ako u inzulínu glargín
100 jednotiek/ml s pomalším znižovaním v priebehu obdobia titrácie Toujeo. Kontrola glykémie bola podobná pri podávaní Toujeo raz denne ráno alebo večer.
Zlepšenie HbA1C nebolo ovplyvnené pohlavím, etnicitou, vekom, dĺžkou trvania diabetu (<10 rokov a ≥10 rokov), hodnotou HbA1c na začiatku (<8% alebo ≥8%) ani počiatočným body mass indexom (BMI).
Na konci týchto klinických štúdií “treat-to-target” sa pozorovala v závoslosti od populácie pacientov a súbežnej liečby o 10-18% vyššia dávka v skupine s Toujeo ako v skupine s komparátorom (tabuľka 1
a 2).
Výsledky z klinických štúdií ukázali, že výskyt potvrdenej hypoglykémie (kedykoľvek počas dňa alebo noci) bol nižší u pacientov liečených Toujeo v porovnaní s pacientmi liečenými inzulínom glargín 100 jednotiek/ml, u pacientov s diabetom 2. typu liečených buď antidiabetikami mimo inzulínu alebo prandiálnym inzulínom.
Superiorita Toujeo nad inzulínom glargín 100 jednotiek/ml v znižovaní rizika potvrdenej nočnej hypoglykémie sa preukázala u pacientov s diabetom 2. typu liečených bazálnym inzulínom v
kombinácii buď s antidiabetikom mimo inzulínu (18% redukcia rizika) alebo s prandiálnym inzulínom
(21% redukcia rizka) v období od 9.týždňa do konca štúdie.
Celkovo boli tieto účinky na hypoglykémiu pozorované konzistentne bez ohľadu na vek, pohlavie, BMI a dobu trvania diabetu (<10 rokov a ≥10 rokov) u pacientov liečených Toujeo v porovnaní s pacientmi liečenými inzulínom glargín 100 jednotiek/ml.
U pacientov s diabetom 1. typu liečených Toujeo bol výskyt hypoglykémie podobný ako u pacientov liečených inzulínom glargín 100 jednotiek/ml (tabuľka 3).
Tabuľka 1: Výsledky z klinických štúdií pri diabete mellitus 1. typu
26 týždňov liečbyToujeo IGlar Liečba v kombinácii prandiálny inzulínový analóg počet liečených jedincov (mITTa) 273 273
HbA1cpriemerná počiatočná hodnota 8,13 8,12 upravená priemerná zmena od počiatočnej hodnoty -0,40 -0,44 upravený priemerný rozdielb 0,04 [-0,098 až 0,185]
dávka bazálneho inzulínu
c
(
U
/
kg)
26 týždňov liečby
T
oujeo IGlar
priemerná počiatočná hodnota 0,32 0,32
priemerná zmena od počiatočnej hodnoty 0,15 0,09
telesná hmotnosťd (kg)
priemerná počiatočná hodnota
priemerná zmena od počiatočnej hodnoty
IGlar: inzulín glargín 100 jednotiek/ml
81,89
0,46
81,80
1,02
a mITT: modifikovaná populácia podľa pôvodného liečebného zámeru (intention-to-treat)
b rozdiel v liečbe: Toujeo– inzulín glargín 100 jednotiek/ml; [95% interval spoľahlivosti]
c zmena od počiatočnej hodnoty do 6.mesiaca (pozorovaný prípad)
d zmena od počiatočnej hodnoty do poslednej hlavnej hodnoty 6-mesačnej liečby
Tabuľka2:Výsledkyzklinickýchštúdiíupacientovsdiabetommellitus2.typu
26 týždňov liečby
P
acienti predtým liečení bazálnym inzulínom
Prandiálny
Pacienti predtým liečení bazálnym inzulínom
Pacienti predtým bez inzulínu
Liečba v kombinácii
inzulínový analóg+/- metformín
Antidiabetiká mimo inzulínu
T
oujeo IGlar Toujeo IGlar Toujeo IGlar
počet liečených pacientova 404 400 403 405 432 430
HbA1c
priemerná počiatočná hodnota upravená priemerná zmena od
počiatočnej hodnoty
8,13
-0,90
8,14
-0,87
8,27
-0,73
8,22
-0,70
8,49
-1,42
8,58
-1,46
upravený priemerný rozdielb -0,03
[-0,144 až 0,083]
-0,03
[-0,168 až 0,099]
0,04
[-0,090 až 0,174]
dávka bazálneho inzulínu
c
(
U
/
kg)
priemerná počiatočná hodnota priemerná zmena od
počiatočnej hodnoty
telesná hmotnosťd (kg)
0,67
0,31
0,67
0,22
0,64
0,30
0.66
0,19
0.19
0,43
0.19
0,34
priemerná počiatočná hodnota priemerná zmena od
počiatočnej hodnoty
IGlar: inzulín glargín 100 jednotiek/ml
106,11
0,93
106,50
0,90
98,73
0,08
98,17
0,66
95,14
0,50
95,65
0,71
 e
e mITT: modifikovaná populácia podľa pôvodného liečebného zámeru (intention-to-treat)
f rozdiel v liečbe: Toujeo– inzulín glargín 100 jednotiek/ml; [95% interval spoľahlivosti]
g zmena od počiatočnej hodnoty do 6.mesiaca (pozorovaný prípad)
h zmena od počiatočnej hodnoty do poslednej hlavnej hodnoty 6-mesačnej liečby
Tabuľka 3 - Prehľad hypoglykemických epizód z klinickej štúdie u pacientov s diabetom mellitus
1. typu a 2. typu
D
i
abetická populácia
Liečba v kombinácii s
diabetes mellitus 1. typu
Pacienti predtým liečení bazálnym inzulínom
prandiálny inzulínový analóg
diabetes mellitus 2. typu
Pacienti predtým liečení bazálnym inzulínom
prandiálny inzulínový analóg+/-metformín
diabetes mellitus 2. typu
Pacienti predtým bez inzulínu alebo liečení bazálnym inzulínom
antidiabetiká mimo inzulínu
T
oujeo IGlar Toujeo IGlar Toujeo IGlar výskyt (%) ťažkej
a
hypoglykémie (n/celkový N)
celé obdobie štúdied
6,6 (18/274)
9,5 (26/275)
5,0 (20/404)
5,7 (23/402)
1,0 (8/838)
1,2 (10/844)
RR*: 0,69 [0,39;1,23] RR: 0,87 [0,48;1,55] RR: 0,82 [0,33;2,00]
výskyt (%) potvrdenej
b
h
ypoglykémie (n/celkový N)
celé obdobie štúdie
93,1 (255/274)
93,5 (257/275)
81,9 (331/404)
87,8 (353/402)
57,6 (483/838)
64,5 (544/844)
RR
: 1,00 [0,95;1,04] RR: 0,93 [0,88; 0,99] RR: 0,89 [0,83; 0,96]
výskyt (%) potvrdenej nočnej
c
hypoglykémie (n/celkový N)
od 9.týždňa do konca štúdie
59,3 (162/273)
56,0 (153/273)
36,1 (146/404)
46,0 (184/400)
18,4 (154/835)
22,5 (188/835)
'
 RR: 1,06 [0,92;1,23] RR: 0,79 [0,67;0,93] RR: 0,82 [0,68;0,99]
RR: 1,06 [0,92;1,23] RR: 0,79 [0,67;0,93] RR: 0,82 [0,68;0,99]
IGlar: inzulín glargín 100 jednotiek/ml
a Ťažká hypoglykémia: epizóda vyžadujúca pomoc inej osoby kvôli podaniu sacharidov, glukagónu alebo inej resuscitácii.
b Potvrdená hypoglykémia: akákoľvek ťažká hypoglykémia a/alebo hypoglykémia potvrdená hodnotou glukózy v plazme
≤3,9 mmol/l.
c Nočná hypoglykémia: epizóda, ktorá sa objaví v čase medzi 00:00 a 05:59 hod.
d 6-mesačné obdobie liečby
*RR: predpokladaný pomer rizika; [95% interval spoľahlivosti]
FlexibilitavčasovanídávkyV 2 randomizovaných, otvorených klinických štúdiách sa počas 3 mesiacov vyhodnocovala aj
bezpečnosť a účinnosť Toujeo podávaného s pevne daným časom podania dávky alebo flexibilným časom podania dávky. Pacienti s diabetom 2. typu (n=194) dostávali Toujeo raz denne večer buď v
pevne stanovenom čase alebo 3 hodiny pred alebo po obvyklom čase podávania dávky (flexibilný čas). Podávanie s flexibilným časom nemalo žiadny vplyv na kontrolu glykémie a na výskyt
hypoglykémie.
ProtilátkyVýsledky zo štúdií porovnávajúcich Toujeo a inzulín glargín 100 jednotiek/ml nepreukázali žiadny
rozdiel medzi Toujeo a inzulínom glargín 100 jednotiek/ml, pokiaľ ide o inzulínové protilátky, účinnosť, bezpečnosť alebo dávku bazálneho inzulínu.
Telesná hmotnosťU pacientov liečených Toujeo bola pozorovaná priemerná zmena hmotnosti menej ako 1 kg na konci
6-mesačného obdobia (pozri tabuľku 1 a 2).
Výsledky
zo
štúdietýkajúcesaprogresiediabetickejretinopatie
Účinky inzulínu glargín (podávaný jedenkrát denne) na diabetickú retinopatiu sa vyhodnocovali
v otvorenej 5-ročnej štúdii kontrolovanej NPH (NPH podávaný dvakrát denne) u 1024 pacientov s diabetom 2. typu, u ktorých bola sledovaná progresia retinopatie o 3 stupne a viac na základe vyhodnocovania snímky očného pozadia podľa škály Early Treatment Diabetic Retinopathy Study (ETDRS). Pri porovnaní inzulínu glargín 100 jednotiek/ml s NPH inzulínom sa nepozoroval žiadny významný rozdiel v progresii diabetickej retinopatie.
Záver z dlhodobejštúdietýkajúcisaúčinnostiabezpečnosti
Do multicentrickej, randomizovanej štúdie ORIGIN (Outcome Reduction with Initial Glargine
INtervention) s dizajnom 2x2 faktoriálnym usporiadaním bolo zahrnutých 12 537 účastníkov
s vysokým kardiovaskulárnym (CV) rizikom s hraničnou glykémiou nalačno (IFG) alebo s poruchou glukózovej tolerancie (IGT) (12% účastníkov) alebo s diabetom 2.typu liečeným ≤1 perorálnym diabetikom (88% účastníkov). Účastníci boli randomizovaní (1:1) buď do skupiny, ktorá dostávala inzulín glargín 100 jednotiek/ml (n=6264) titrovaný do dosiahnutia cieľovej hodnoty FPG ≤95 mg/dl (5,3 mmol/l) alebo do skupiny so štandardnou liečbou (n=6273).
Prvý kompozitný ukazovateľ týkajúci sa účinnosti bol čas do prvého výskytu úmrtia z CV príčin, nefatálneho infarktu myokardu (IM) alebo nefatálnej cievnej mozgovej príhody a druhý kompozitný ukazovateľ týkajúci sa účinnosti bol čas do prvého výskytu ktorejkoľvek udalosti zahrnutej v prvom kompozitnom ukazovateli alebo čas do revaskularizačného výkonu (koronárne tepny, karotídy alebo periférne cievy) alebo hospitalizácie kvôli zlyhaniu srdca.
Sekundárne cieľové ukazovatele (endpointy) zahŕňali mortalitu z akejkoľvek príčiny a kompozitné mikrovaskulárne ukazovatele.
Inzulín glargín 100 jednotiek/ml nezhoršoval relatívne riziko CV ochorenia a CV mortality
v porovnaní so štandardnou liečbou. V prvých dvoch kompozitných ukazovateľoch neboli zistené žiadne rozdiely medzi inzulínom glargín a štandardnou liečbou v akejkoľvek čiastkovej zložke
zahŕňajúcej primárne ukazovatele; pre úmrtie z akejkoľvek príčiny alebo pre kompozitné mikrovaskulárne ukazovatele.
Priemerná dávka inzulínu glargín 100 jednotiek/ml bola na konci štúdie 0,42 U/kg. Na začiatku mali účastníci medián hodnoty HbA1c 6,4 %. Medián hodnoty HbA1c sa počas celého trvania následného sledovania (follow-up) pohyboval v rozmedzí 5,9-6,4 % v skupine s inzulínom glargín 100 jednotiek/ml a 6,2 až 6,6 % v skupine so štandardnou liečbou.
Výskyt ťažkej hypoglykémie (počet postihnutých účastníkov na 100 liečených osôb počas 1 roka) bol
1,05 v skupine s inzulínom glargín 100 jednotiek/ml a 0,30 v skupine so štandardnou liečbou a výskyt potvrdenej nezávažnej hypoglykémie bol 7,71 v skupine s inzulínom glargín 100 jednotiek/ml a 2,44
v skupine so štandardnou liečbou. Počas celého trvania tejto 6-ročnej štúdie sa nevyskytla hypoglykémia u 42% účastníkov v skupine s inzulínom glargín 100 jednotiek/ml.
Pri poslednej návšteve lekára v rámci štúdie bol zistený priemerný nárast telesnej hmotnosti
z východiskovej hodnoty o 1,4 kg v skupine s inzulínom glargín 100 jednotiek/ml a priemerný pokles o 0,8 kg v skupine so štandardnou liečbou.
Pediatrickápopulácia
Účinnosť a bezpečnosť lieku Toujeo bola skúmaná v 1:1 randomizovanej, kontrolovanej, otvorenej klinickej štúdii u detí a dospievajúcich s diabetes mellitus 1. typu počas 26 týždňov (n=463).
Do skupiny s liekom Toujeo bolo zaradených 73 detí vo veku < 12 rokov a 160 detí vo veku
≥ 12 rokov. Liek Toujeo v dávke raz denne preukázal podobnú redukciu HbA1c a FPG
z východiskovej hodnoty do 26. týždňa v porovnaní s inzulínom glargín 100 jednotiek/ml.
Analýza odpovedí na dávku preukázala, že po úvodnej fáze titrácie sú dávky upravené podľa telesnej hmotnosti u pediatrických pacientov vyššie ako u dospelých pacientov v rovnovážnom stave.
Celkovo bol výskyt hypoglykémie u pacientov v každej kategórii, kde bola hlásená najmenej jedna udalosť, podobný v obidvoch liečených skupinách, u 97,9 % pacientov v skupine s liekom Toujeo
a u 98,2 % v skupine s inzulínom glargín 100 jednotiek/ml. Podobne bol porovnateľný aj výskyt nočnej hypogykémie v liečebných skupinách s liekom Toujeo a inzulínom glargín 100 jednotiek/ml.
Percento pacientov, u ktorých bola hlásená závažná hypoglykémia, bolo nižšie u pacientov v skupine
s liekom Toujeo v porovnaní s pacientmi v skupine s inzulínom glargín 100 jednotiek/ml, 6 % a 8,8 %
v uvedenom poradí. Percento pacientov s hyperglykemickými epizódami s ketózou bolo nižšie
s liekom Toujeo oproti inzulínu glargín 100 jednotiek/ml, 6,4 % a 11,8 % v uvedenom poradí. Pokiaľ ide o nežiaduce účinky a štandardné bezpečnostné parametre, neboli pri lieku Toujeo zistené žiadne
problémy s bezpečnosťou lieku. Rozvoj protilátok bol malý a nemal žiadny klinický dopad. Údaje
o účinnosti a bezpečnosti pre pediatrických pacientov s diabetes mellitus 2.typu boli extrapolované
z údajov pre dospievajúcich a dospelých pacientov s diabetes mellitus 1.typu a dospelých pacientov s diabetes mellitus 2.typu. Výsledky podporujú používanie lieku Toujeo u pediatrických pacientov
s diabetes mellitus 2.typu.
5.2 Farmakokinetické vlastnosti
Absorpciaadistribúcia
U zdravých jedincov a u diabetikov naznačovali sérové koncentrácie inzulínpomalšiu a predĺženejšiu absorpciu vedúcu k plochejšiemu profilu čas-koncentrácia po subkutánnom podaní injekcie Toujeo v porovnaní s inzulínom glargín 100 jednotiek/ml.
Farmakokinetický profil bol konzistentný s farmakodynamickou aktivitou Toujeo.
Hladina ustáleného stavu v terapeutickom rozmedzí sa dosiahne pri podávaní Toujeo raz denne po 3-4
dňoch.
Intraindividuálna variabilita definovaná ako koeficient zmeny expozície inzulínom počas 24 hodín bola po subkutánnom podaní v ustálenom stave nízka (17,4%).
Biotransformácia
Po podaní subkutánnej injekcie inzulínu glargín diabetickým pacientom sa inzulín glargín rýchlo metabolizuje v uhlíkovom zakončení beta reťazca za vzniku dvoch aktívnych metabolitov M1 (21A-
Gly-inzulín) a M2 (21A-Gly-des-30B-Thr-inzulín). Hlavná cirkulujúca zlúčenina v plazme je
metabolit M1. Expozícia M1 sa zvyšuje s podanou dávkou inzulínu glargín. Farmakokinetické
a farmakodynamické výsledky uvádzajú, že účinok inzulínu glargín podaného subkutánnou injekciou
je v zásade založený na expozícii M1. Inzulín glargín a metabolit M2 neboli u veľkej väčšiny prípadov zistiteľné a ak sa zistili, ich koncentrácia nebola závislá od podanej dávky inzulínu glargín.
Eliminácia
Pri intravenóznom podaní je polčas eliminácie inzulínu glargín a ľudského inzulínu porovnateľný.
Polčas po subkutánnom podaní Toujeo je determinovaný rýchlosťou absorpcie z podkožného tkaniva. Polčas Toujeo po subkutánnej injekcii je 18-19 hodín a nezávisí od dávky.
Pediatrickápopulácia
Populačná farmakokinetická analýza pre Toujeo bola robená na základe údajov o koncentrácii jeho hlavného metabolitu M1 s použitím údajov od 75 pediatrických subjektov (vo veku 6 až <18 rokov)
s diabetes mellitus 1.typu. Telesná hmotnosť ovplyvňuje klírens Toujeo nelineárnym spôsobom.
V dôsledku toho je expozícia (AUC) pri rovnakej dávke upravenej podľa telesnej hmotnosti u pediatrických pacientov mierne nižšia v porovnaní s dospelými pacientmi.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu a reprodukčnej toxicity neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
chlorid zinočnatý metakrezol glycerol
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
voda na injekciu
6.2 Inkompatibility
Toujeo sa nesmie miešať ani riediť so žiadnym iným inzulínom ani inými liekmi.
Miešanie alebo riedenie Toujeo mení jeho profil čas/účinok a miešanie spôsobuje precipitáciu.
6.3 Čas použiteľnosti
ToujeoSoloStar
30 mesiacov.
ToujeoDoubleStar
24 mesiacov.
Časpoužiteľnostipoprvompoužitípera
Liek sa môže uchovávať maximálne 6 týždňov pri teplote neprevyšujúcej 30°C tak, aby nebol vystavený priamemu teplu ani priamemu svetlu. Perá, ktoré sa používajú, sa nesmú uchovávať
v chladničke. Po každej injekcii sa musí na pero opäť nasadiť kryt na ochranu pred svetlom.
6.4 Špeciálne upozornenia na uchovávanie
Predprvýmpoužitím
Uchovávajte v chladničke (2°C–8°C).
Neuchovávajte v mrazničke ani nedávajte blízko mraziaceho boxu alebo mraziacej vložky. Uchovávajte naplnené pero vo vonkajšom obale na ochranu pred svetlom.
Pero poprvompoužitíaleboaksanosíakonáhradnépero
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
PeroSoloStar
Náplň (bezfarebné sklo typu 1) so šedým piestom (brómbutylová guma) a tesniacim krytom (hliník) so zátkou (izoprénový laminát a brómbutylová guma). Náplň je zaplombovaná do jednorazového
injekčného pera. Každá náplň obsahuje 1,5 ml roztoku.
Dostupné sú balenia 1, 3, 5 a 10 pier. Na trh nemusia byť uvedené všetky veľkosti balenia. Ihly nie sú súčasťou balenia.
PeroDoubleStar
Náplň (bezfarebné sklo typu 1) s čiernym piestom (brómbutylová guma) a tesniacim krytom (hliník) so zátkou (izoprénový laminát a brómbutylová guma). Náplň je zaplombovaná do jednorazového injekčného pera. Každá náplň obsahuje 3 ml roztoku.
Dostupné sú balenia 1, 3, 6 (2 balenia po3), 9 (3 balenia po3) a 10 pier. Na trh nemusia byť uvedené všetky veľkosti balenia.
Ihly nie sú súčasťou balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Predtým ako sa pero použije prvýkrát, musí sa skladovať aspoň 1 hodinu pri izbovej teplote.
Pred použitím naplneného pera Toujeo SoloStar alebo Toujeo DoubleStar je potrebné pozorne si prečítať Návod na používanie, ktorý je súčasťou Písomnej informácie pre používateľa. Naplnené perá Toujeo SoloStar sa musia používať podľa pokynov uvedených v tomto návode na používanie (pozri časť 4.2). Pacientov treba upozorniť, aby urobili skúšku bezpečnosti, ako je to uvedené v Návode na používanie, KROK 3. Ak ju neurobia, je tu možnosť, že nebude podaná plná dávka inzulínu. V takom prípade si musí pacient častejšie kontrolovať glykémiu a možno bude potrebné podať ďalší inzulín.
Pred použitím skontrolujte náplň. Môže sa použiť, len ak je roztok číry, bezfarebný, bez viditeľných tuhých častíc a len ak má konzistenciu podobnú vode. Keďže Toujeo je číry roztok, nevyžaduje pred použitím resuspenzáciu.
Pred každou injekciou je potrebné skontrolovať označenie na inzulíne, aby sa zabránilo zámene medzi Toujeo a inými inzulínmi. Sila “300” je zvýraznená medovo zlatou farbou na štítku na inzulíne (pozri časť 4.4).
Patienti majú byť informovaní, že ukazovateľ dávky naplneného pera Toujeo SoloStar alebo Toujeo DoubleStar ukazuje počet jednotiek Toujeo, ktoré sa majú injekciou podať. Nie je potrebné žiadne prepočítavanie dávky.
• Pero Toujeo SoloStar obsahuje 450 jednotiek Toujeo. Jednou injekciou sa môže podať dávka od
1 do 80 jednotiek, odčítava sa po 1 jednotke.
• Pero Toujeo DoubleStar pen obsahuje 900 jednotiek Toujeo. Jednou injekciou sa môže podať dávka od 2 do 160 jednotiek, odčítava sa po 2 jednotkách.
o Toujeo DoubleStar sa odporúča pacientom, u ktorých je potrebná dávka aspoň
20 jednotiek denne, aby sa znížilo riziko potenciálneho poddávkovania.
• Ak sa pred prvým použitím nového pera neurobí skúška bezpečnosti, môže dôsť k podaniu nízkej dávky inzulínu.
Toujeo sa nesmie natiahnuť z náplne v naplnenom pere do injekčnej striekačky, pretože to môže spôsobiť ťažké predávkovanie (pozri časť 4.2, 4.4 a 4.9).
Pred každou injekciou je potrebné nasadiť novú sterilnú ihlu. Ihly je potrebné ihneď po použití zlikvidovať. Ihly sa nesmú používať opakovane. Opakované použitie ihiel zvyšuje riziko ich upchatia, čo môže spôsobiť poddávkovanie alebo predávkovanie. Použitie novej sterilnej ihly na každú injekciu taktiež minimalizuje riziko kontaminácie a infekcie. V prípade, že sa ihla upchá, pacient musí postupovať podľa pokynov uvedených v kroku 3 v návode na používanie, ktorý je súčasťou Písomnej informácie pre používateľa (pozri časť 4.2 a 4.4).
Použité ihly sa musia odhodiť do nádoby zabezpečenej proti prepichnutiu a potom zlikvidovať v súlade s lokálnymi predpismi.
Prázdne perá sa nesmú nikdy znovu použiť a musia sa náležite zlikvidovať.
To isté inzulínové pero nikdy nesmie používať viac ako jedna osoba a to ani vtedy, ak sa ihla vymení. Zabráni sa tým možnému prenášaniu chorôb (pozri časť 4.2).
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Sanofi-Aventis Deutschland GmbH, D-65926 Frankfurt am Main, Nemecko.
8. REGISTRAČNÉ ČÍSLA
EU/1/00/133/033
EU/1/00/133/034
EU/1/00/133/035
EU/1/00/133/036
EU/1/00/133/037
EU/1/00/133/038
EU/1/00/133/039
EU/1/00/133/040
EU/1/00/133/041
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 27. jún 2000
Dátum posledného predĺženia: 17. február 2015
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.