
tov. Abnormality trombocytov 3. alebo 4.stupňa, vrátane trombocytopenických udalostí, sa pozorovali u 14 % pacientov, ktorí dostávali TMZ.
Rekurentný alebo progredujúcimalígnygliómV klinických skúšaniach boli najčastejšie sa vyskytujúce nežiaduce účinky súvisiace s liečbou
gastrointestinálne poruchy, konkrétne nauzea (43 %) a vracanie (36 %). Tieto reakcie dosahovali zvyčajne 1. alebo 2. stupeň (0 – 5 epizód vracania za 24 hodín) a buď spontánne ustúpili, alebo boli ľahko zvládnuté štandardnou antiemetickou liečbou. Incidencia závažnej nauzey a vracania bola 4 %.
Nežiaduce účinky zaznamenané počas klinických skúšaní s rekurentným alebo progredujúcim malígnym gliómom a následne po uvedení Temodalu do obehu sú zhrnuté v Tabuľke 5.
Tabuľka 5. Nežiaduce reakcie u pacientov s rekurentným alebo progredujúcim malígnym gliómom
|
Infekcie a nákazy
|
Zriedkavé
| oportúnne infekcie vrátane PCP
|
Poruchy krvi a lymfatického systému
|
Veľmi časté:
| neutropénia alebo lymfopénia (3. – 4. stupeň),
trombocytopénia (3. – 4. stupeň)
|
Menej časté:
| pancytopénia, anémia (3. – 4. stupeň), leukopénia
|
Poruchy metabolizmu a výživy
|
Veľmi časté:
| anorexia
|
Časté:
| pokles hmotnosti
|
Poruchy nervového systému
|
Veľmi časté:
| bolesť hlavy
|
Časté:
| somnolencia, závrat, parestézia
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Časté:
| dyspnoe
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté:
| vracanie, nauzea, zápcha
|
Časté:
| hnačka, bolesť brucha, dyspepsia
|
Poruchy kože a podkožného tkaniva
|
Časté:
| kožná vyrážka, pruritus, alopécia
|
Veľmi zriedkavé:
| multiformný erytém, erytrodermia, urtikária, exantém
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté:
|
únava
|
Časté:
|
horúčka, asténia, zimnica, nevoľnosť, bolesť, zmena
chuti
|
Veľmi zriedkavé:
|
alergické reakcie vrátane anafylaxie, angioedém
|
Laboratórne výsledky
Trombocytopénia a neutropénia 3. alebo 4. stupňa sa vyskytli u 19 %, resp. 17 % pacientov liečených na malígny glióm. Toto viedlo k hospitalizácii v 8 % a/alebo k prerušeniu liečby TMZ v 4 %. Myelosupresia bola predvídateľná (zvyčajne v priebehu niekoľko prvých cyklov, s najnižšími hodnotami medzi 21. a 28. dňom) a zotavenie nastalo rýchle, zvyčajne behom 1 – 2 týždňov. Výskyt kumulatívnej myelosupresie sa nepozoroval. Prítomnosť trombocytopénie môže zvýšiť riziko krvácania a prítomnosť neutropénie alebo leukopénie môže zvýšiť riziko infekcie.
PohlaviePodľa farmakokinetickej analýzy populácie klinického skúšania bola hodnota najnižšieho počtu (NADIR) neutrofilov dostupná u 101 žien a 169 mužov a hodnota najnižšieho počtu krvných doštičiek u 110 žien a 174 mužov. V prvom cykle liečby bol u žien v porovnaní s mužmi vyšší výskyt neutropénie 4. stupňa (ANC < 0,5 x 109/l), 12 % vs. 5 %, a trombocytopénie 4. stupňa (< 20 x 109/l),
9 % vs. 3 %. V súbore informácií od 400 jedincov s rekurentným gliómom sa v prvom cykle liečby objavila neutropénia 4. stupňa u 8 % žien v porovnaní so 4 % mužov. V štúdii s 288 jedincami
s novodiagnostikovaným multiformným glioblastómom sa v prvom cykle liečby objavila neutropénia
4. stupňa u 3 % žien v porovnaní s 0 % mužov a trombocytopénia 4. stupňa u 1 % žien v porovnaní s 0 % mužov.
Deti a dospievajúciPerorálny TMZ sa skúmal u detských a dospievajúcich pacientov (vo veku 3-18 rokov) s rekurentným
gliómom mozgového kmeňa alebo s rekurentným astrocytómom vysokého stupňa v dávkovacom režime podávanom denne počas 5 dní každých 28 dní. Hoci sú údaje obmedzené, očakáva sa, že znášanlivosť u detí bude rovnaká ako u dospelých. Bezpečnosť TMZ u detí mladších ako 3 roky sa nestanovila.
Skúsenosti po uvedeníliekunatrhAntineoplastické látky, a zvlášť alkylačné látky, boli spojené s potenciálnym rizikom
myelodysplastického syndrómu (MDS) a sekundárnych malignít, vrátane leukémie. U pacientov, liečených režimami s TMZ, boli hlásené veľmi zriedkavé prípady MDS a sekundárnych malignít, vrátane myeloidnej leukémie. Bola hlásená predĺžená pancytopénia, ktorá môže vyústiť do aplastickej anémie a v niektorých prípadoch viedla k fatálnemu koncu.
Veľmi zriedkavo boli hlásené prípady toxickej epidermálnej nekrolýzy a Stevens-Johnsonovho syndrómu.
Veľmi zriedkavo sa hlásili prípady intersticiálnej pneumonitídy/pneumonitídy, fibrózy pľúc
a fatálneho respiračného zlyhania.
Boli hlásené prípady hepatotoxicity vrátane zvýšenia hladín pečeňových enzýmov, hyperbilirubinémie, cholestázy a hepatitídy.
4.9 PredávkovanieU pacientov sa klinicky hodnotili dávky 500, 750, 1 000 a 1 250 mg/m2 (celková dávka na cyklus počas 5 dní). Toxicita limitujúca dávku bola hematologická a táto bola hlásená pri všetkých dávkach, ale predpokladá sa, že bude závažnejšia pri vyšších dávkach. Jeden pacient sa predávkoval užitím dávky 10 000 mg (celková dávka v jednom cykle počas 5 dní). Nežiaduce reakcie hlásené pri tomto predávkovaní boli pancytopénia, pyrexia, multiorgánové zlyhanie a smrť. Existujú záznamy
o pacientoch, ktorí užívali odporúčanú dávku po dobu viac ako 5 dní liečby (až do 64 dní), pričom hlásené nežiaduce udalosti zahŕňali útlm kostnej drene s infekciou alebo bez nej, ktoré boli
v niektorých prípadoch závažné a pretrvávali dlhšiu dobu a skončili sa smrťou. V prípade predávkovania je potrebné hematologické vyšetrenie. V prípade potreby sa majú vykonať podporné opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Cytostatiká - Iné alkylačné látky, ATC kód: L01A X03
Spôsob účinku
Temozolomid je triazén, ktorý pri fyziologickom pH podlieha rýchlej chemickej konverzii na aktívny
monometyl-triazenoimidazol-karboxamid (MTIC). Predpokladá sa, že cytotoxicitu MTIC primárne spôsobuje alkylácia na pozícii O6 guanínu, spolu s ďalšou alkyláciou na pozícii N7. Cytotoxické lézie, ktoré sa rozvinú následne, pravdepodobne zapríčiňuje aberantná oprava metylovaného aduktu.
Klinická účinnosť abezpečnosť
Novodiagnostikovaný multiformný glioblastóm
Celkovo 573 pacientov bolo randomizovaných tak, aby dostávali buď TMZ + RT (n=287), alebo RT
samotnú (n = 286). Pacienti v ramene TMZ + RT súbežne dostávali TMZ (75 mg/m2) raz denne, začínajúc v prvý deň RT až do posledného dňa RT, po dobu 42 dní (s maximom 49 dní). Potom
nasledovala monoterapia TMZ (150 - 200 mg/m2) 1. – 5. deň počas každého 28-dňového cyklu.
Liečba trvala až 6. cyklov a začínalo sa s ňou 4 týždne po ukončení RT. Pacienti v kontrolnom ramene
dostávali len RT. Počas RT a aj kombinovanej liečby TMZ sa vyžadovala profylaxia proti pneumónii spôsobenej Pneumocystis jirovecii (PCP).
TMZ sa podával ako záchranná terapia vo fáze sledovania po liečbe 161 pacientom z 282 (57 %)
z ramena so samotnou RT a 62 pacientom z 277 (22 %) z ramena TMZ + RT.
Pomer rizika (Hazard ratio - HR) celkového prežívania bol 1,59 (95 % CI pre HR = 1,33 – 1,91) s log- rank p < 0,0001 v prospech ramena s TMZ. Odhadovaná pravdepodobnosť prežívania 2 alebo viac rokov (26 % vs. 10 %) bola vyššia v ramene RT + TMZ. Súbežné pridanie TMZ k RT, s následnou monoterapiou TMZ, pri liečbe pacientov s novodiagnostikovaným multiformným glioblastómom preukázalo štatisticky významné zlepšenie celkového prežívania (Overall Survival – OS) v porovnaní so samotnou RT (Obrázok 1).
 O
brázok 1 Kaplan-Meierove krivky celkového prežívania (Intent to Treat – populácia, v ktorej
bola liečba zamýšľaná)
O
brázok 1 Kaplan-Meierove krivky celkového prežívania (Intent to Treat – populácia, v ktorej
bola liečba zamýšľaná)
Výsledky zo skúšania neboli konzistentné v podskupine pacientov so slabým výkonnostným stavom (WHO PS = 2, n = 70), v ktorej bolo celkové prežívanie a čas do progresie podobné v oboch ramenách. Nezdá sa však, že by v tejto skupine pacientov boli prítomné neprijateľné riziká.
Rekurentný alebo progredujúcimalígnygliómÚdaje o klinickej účinnosti u pacientov s multiformným glioblastómom (Karnofského skóre
[Karnofsky perfomance status – KPS] ≥70), progredujúcom alebo recidivujúcom po chirurgickej terapii a RT, sú založené na dvoch klinických skúšaniach s perorálnym TMZ. Jedno bolo nekomparatívne skúšanie u 138 pacientov (predtým dostávalo chemoterapiu 29 %) a druhé bolo randomizované aktívne kontrolované skúšanie TMZ
vs prokarbazínu u celkovo 225 pacientov (pred liečbou dostávalo chemoterapiu na báze nitrózourey 67 % pacientov). Primárnym cieľom oboch skúšaní bolo stanoviť prežívanie bez progresie nádoru (progression free survival – PFS), definované MRI zobrazením alebo neurologickým zhoršením. V nekomparatívnom skúšaní bolo PFS v 6. mesiaci
19 %, medián prežívania bez progresie nádoru bol 2,1 mesiaca a medián celkového prežívania 5,4
mesiaca. Častosť objektívnej odpovede (Objective response rate – ORR), založená na MRI zobrazení, bola 8 %.
V randomizovanom aktívne kontrolovanom klinickom skúšaní bolo 6-mesačné PFS signifikantne dlhšie u TMZ než u prokarbazínu (21 % oproti 8 %, chí-kvadrát p = 0,008) s mediánom PFS 2,89 mesiacov pre TMZ a 1,88 mesiacov pre prokarbazín (log rank p = 0,0063). Medián prežívania pre
TMZ bol 7,34 mesiaca a pre prokarbazín 5,66 mesiacov (log rank p = 0,33). Po 6 mesiacoch bol podiel prežívajúcich pacientov signifikantne vyšší v TMZ ramene (60 %) oproti ramenu s prokarbazínom
(44 %) (chí-kvadrát p = 0,019). U pacientov s predchádzajúcou chemoterapiou bol zaznamenaný
prínos u tých, ktorých KPS bolo ≥ 80.
Údaje o čase do zhoršenia neurologického stavu boli v prospech TMZ oproti prokarbazínu, takisto ako údaje o čase do zhoršenia celkového stavu (pokles na KPS na < 70 alebo pokles o najmenej 30 bodov). Mediány časov do progresie nádoru podľa týchto cieľov boli u TMZ dlhšie v rozsahu 0,7 až 2,1 mesiaca než u prokarbazínu (log rank p = < 0,01 – 0,03).
Rekurentný anaplastický astrocytóm
V multicentrickom, prospektívnom klinickom skúšaní II. fázy, v ktorom sa vyhodnocovala bezpečnosť
a účinnosť liečby perorálnym TMZ u pacientov s anaplastickým astrocytómom pri prvom relapse, bolo 6-mesačné PFS 46 %. Medián PFS bol 5,4 mesiaca. Medián celkového prežívania bol 14,6 mesiacov. V populácii pacientov, u ktorých bola liečba zamýšľaná (ITT) n=162, bola, podľa zhodnotenia centrálnym recenzentom, častosť odpovede 35 % (13 dosiahlo kompletnú remisiu a 43 parciálnu). Stabilné ochorenie bolo hlásené u 43 pacientov. 6-mesačné prežívanie bez príhody bolo
v ITT populácii 44 % s mediánom prežívania bez príhody 4,6 mesiacov, čo bolo podobné výsledkom prežívania bez progresie. Výsledky účinnosti boli podobné aj u populácie, ktorá bola vhodná na histológiu. Dosiahnutie rádiologicky objektívnej odpovede alebo udržania stavu bez progresie bolo silne viazané s udržanou alebo zlepšenou kvalitou života.
Deti a dospievajúci
Perorálny TMZ sa skúmal u detských a dospievajúcich pacientov (vo veku 3-18 rokov) s rekurentným
gliómom mozgového kmeňa alebo rekurentným astrocytómom vysokého stupňa v dávkovacom režime podávanom denne počas 5 dní každých 28 dní. Tolerancia na TMZ je podobná ako u dospelých.
5.2 Farmakokinetické vlastnosti
TMZ sa pri fyziologickom pH spontánne hydrolyzuje na primárne účinné zložky, 3-metyl-(triazén-1- yl)imidazol-4-karboxamid (MTIC). MTIC sa spontánne hydrolyzuje na 5-aminoimidazol-4- karboxamid (AIC), známy medziprodukt pri biosyntéze purínu a nukleovej kyseliny, a na metylhydrazín, ktorý sa považuje za účinnú alkylačnú zložku. Predpokladá sa, že za cytotoxicitu MTIC je primárne zodpovedná alkylácia DNA, predovšetkým na pozíciách O6 a N7 guanínu.
V závislosti od AUC TMZ je expozícia MTIC ~ 2,4 % a expozícia AIC ~ 23 %. In vivo bol t1/2 MTIC
podobný t1/2 TMZ, a to 1,8 hod.
Absorpcia
Po perorálnom podaní dospelým pacientom sa TMZ vstrebáva rýchlo a maximálne koncentrácie sa
dosahujú už za 20 minút po podaní (priemerný čas medzi 0,5 a 1,5 hodinou). Po perorálnom podaní TMZ označeného 14C, počas 7 dní po podaní, bola priemerná exkrécia 14C stolicou 0,8 %, čo ukazuje na jeho úplnú absorpciu.
Distribúcia
TMZ vykazuje nízku väzbu na bielkoviny (10 % až 20 %), a preto sa neočakáva jeho interakcia
s látkami, ktoré sa silne viažu na bielkoviny.
PET štúdie u ľudí, ako aj predklinické údaje ukazujú, že TMZ rýchlo prechádza hematoencefalickou bariérou a je prítomný v mozgovomiechovom moku. Prienik do mozgovomiechového moku bol potvrdený u jedného pacienta; meraním AUC sa zistilo, že koncentrácia TMZ v mozgovomiechovom moku dosahuje približne 30 % hladín v plazme, čo zodpovedá údajom zisteným u zvierat.
Eliminácia
Polčas (t1/2) v plazme je približne 1,8 hodín. Hlavnou cestou vylučovania 14C sú obličky. Po perorálnom podaní sa močom vylúči približne 5 % až 10 % dávky v nezmenenej forme v priebehu 24 hodín. Zvyšok sa vylúči ako kyselina temozolomidová, 5-aminoimidazol-4-karboxamid (AIC) alebo ako neidentifikované polárne metabolity.
Plazmatické koncentrácie stúpajú v závislosti od podanej dávky. Plazmatický klírens, distribučný objem a polčas sú nezávislé od podanej dávky.
O
sobitné skupiny pacientov
Analýza populačnej farmakokinetiky TMZ ukázala, že plazmatický klírens TMZ bol nezávislý od
veku pacienta, renálnych funkcií alebo od fajčenia. V inej farmakokinetickej štúdii boli plazmatické farmakokinetické profily u pacientov s miernym alebo stredne ťažkým poškodením funkcie pečene podobné plazmatickým farmakokinetickým profilom, pozorovaným u pacientov s normálnou funkciou pečene.
Detskí pacienti mali vyššie AUC ako dospelí pacienti; avšak maximálna tolerovaná dávka (MTD) bola
1 000 mg/m2/cyklus u detí aj u dospelých.
5.3 Predklinické údaje o bezpečnosti
Boli vykonané jednocyklové (5-dní podávanie, 23 dní bez liečby), 3- a 6-cyklové štúdie toxicity na potkanoch a psoch. Toxicita sa primárne prejavila na kostnej dreni, lymforetikulárnom systéme, testes a gastrointestinálnom trakte. Vo vyšších dávkach, ktoré boli letálne pre 60 % až 100 % testovaných potkanov a psov, došlo ku degenerácii sietnice. Väčšina toxických zmien sa ukázala byť reverzibilných, výnimkou boli nežiaduce udalosti na mužský reprodukčný systém a degenerácia sietnice. Keďže sa však dávky, ktoré zapríčinili degeneráciu sietnice, pohybovali v rozmedzí letálnych dávok a porovnateľný účinok nebol pozorovaný v klinických štúdiách, tento nález sa nepokladá za klinicky významný.
TMZ je embryotoxická, teratogénna a genotoxická alkylačná látka. TMZ je toxickejší pre potkany
a psov ako pre ľudí a klinická dávka sa približuje minimálnej letálnej dávke u potkanov a u psov. Na dávke závislé redukcie leukocytov a trombocytov sa javia ako senzitívne indikátory toxicity. V 6- cyklovej štúdii na potkanoch sa zaznamenali rôzne nádory, vrátane mamárnych karcinómov, keratoakantómov kože a bazocelulárnych adenómov, zatiaľ čo v štúdiách na psoch sa nádory alebo predneoplastické zmeny nezistili. Potkany sa javia byť zvlášť citlivé na onkogénne účinky TMZ, pričom prvé nádory sa zjavujú v priebehu 3 mesiacov od začiatku podávania. Táto doba latencie je veľmi krátka aj pre alkylačnú látku.
Testy chromozómových aberácií Ames/salmonely a ľudských lymfocytov z periférnej krvi (Human
Peripheral Blood Lymphocyte - HPBL) ukázali pozitívnu mutagénnnu odpoveď.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsahkapsuly: bezvodá laktóza, koloidný oxid kremičitý,
sodná soľ karboxymetylškrobu typu A, kyselina vínna,
kyselina stearová.
Obalkapsuly:
želatína,
oxid titaničitý (E 171), laurylsíran sodný,
žltý oxid železitý (E 172),
indigokarmín (E 132).
Potlač: šelak, propylénglykol, čistená voda,
hydroxid amónny, hydroxid draselný,
čierny oxid železitý (E 172).
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Balenie vo fľaši
Uchovávajte pri teplote neprevyšujúcej 30 °C.
Uchovávajte v pôvodnej fľaši na ochranu pred vlhkosťou. Fľašu udržiavajte dôkladne uzatvorenú.
Balenie vo vrecku
Uchovávajte pri teplote neprevyšujúcej 30 °C.
6.5 Druh obalu a obsah balenia
Balenie vo fľaši
Fľašky z jantárového skla typu I s polypropylénovými uzávermi bezpečnými pred deťmi obsahujúce 5
alebo 20 tvrdých kapsúl. Škatuľka obsahuje jednu fľašu.
Balenie vo vrecku
Vrecká sa skladajú z lineárneho polyetylénu s nízkou hustotou (najvnútornejšia vrstva), hliníka
a polyetyléntereftalátu.
Každé vrecko obsahuje 1 tvrdú kapsulu a dodáva sa v papierovej škatuli.
Škatuľa obsahuje 5 alebo 20 tvrdých kapsúl jednotlivo uzatvorených vo vreckách.
Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Kapsuly sa nesmú otvárať. Ak je kapsula poškodená, musíte zabrániť kontaktu práškového obsahu
s kožou alebo sliznicou. Ak sa Temodal dostane do kontaktu s kožou alebo sliznicou, okamžite
a dôkladne sa musí postihnutá oblasť umyť mydlom a vodou.
Pacientov treba poučiť, aby kapsuly uchovávali mimo dohľadu a dosahu detí, najlepšie v uzamknutej skrini. Náhodné prehltnutie môže byť pre deti smrteľné.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU
Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/98/096/001
EU/1/98/096/002
EU/1/98/096/024
EU/1/98/096/025
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 26. január 1999. Dátum posledného predĺženia: 26. január 2009.
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu
1. NÁZOV LIEKU
Temodal 20 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá tvrdá kapsula obsahuje 20 mg temozolomidu.
Pomocnálátkasoznámymúčinkom:
Každá tvrdá kapsula obsahuje 182,2 mg bezvodej laktózy. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tvrdá kapsula.
Tvrdé kapsuly majú nepriehľadné biele telo kapsuly, nepriehľadný žltý vrchnáčik a sú potlačené čiernym atramentom. Na vrchnáčiku je vytlačené „Temodal“. Na tele kapsuly je vytlačené „20 mg“, logo Schering-Plough a dva pásiky.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Temodal je indikovaný na liečbu:
- dospelých pacientov s novodiagnostikovaným multiformným glioblastómom súbežne
s rádioterapiou (RT) a následne ako monoterapia
- detí od troch rokov, dospievajúcich a dospelých pacientov s malígnym gliómom, ako je multiformný glioblastóm alebo anaplastický astrocytóm, u ktorých došlo po štandardnej terapii
k recidíve alebo progresii ochorenia.
4.2 Dávkovanie a spôsob podávania
Temodal majú predpisovať iba lekári skúsení v onkologickej liečbe nádorov mozgu. Možno podávať antiemetickú liečbu (pozri časť 4.4).
Dávkovanie
Dospelí pacienti s novodiagnostikovaným multiformným glioblastómom
Temodal sa podáva v kombinácii s fokálnou rádioterapiou (súbežná fáza) nasledovanou až do 6 cyklov
monoterapie temozolomidom (TMZ) (fáza monoterapie).
Súbežná fáza
TMZ sa podáva perorálne v dávke 75 mg/m2 denne po dobu 42 dní súbežne s fokálnou rádioterapiou (60 Gy podaných v 30 frakciách). Dávku sa neodporúča znižovať, ale každý týždeň sa má rozhodnúť, či sa podávanie TMZ oddiali alebo preruší, na základe kritérií hematologickej a nehematologickej toxicity. V podávaní TMZ možno pokračovať po dobu 42-dňovej súbežnej fázy (až do 49 dní), ak sú splnené všetky nasledovné podmienky:
- absolútny počet neutrofilov (Absolute Neutrophil Count – ANC) ≥ 1,5 x 109/l
- počet trombocytov ≥ 100 x 109/l
- celkové kritériá toxicity (Common Toxicity Criteria - CTC) nehematologickej toxicity (okrem alopécie, nevoľnosti a vracania) ≤ 1. stupeň.
Počas liečby sa má týždenne vyšetrovať úplný krvný obraz. Podávanie TMZ sa má v priebehu
súbežnej fázy dočasne prerušiť alebo trvalo ukončiť podľa kritérií hematologickej a nehematologickej toxicity, ako je uvedené v Tabuľke 1.
Tabuľka 1. Prerušenie alebo ukončenie podávania TMZ počas
súbežnej rádioterapie a terapie TMZ
|
Toxicita
| Prerušenie TMZa
| Ukončenie TMZ
|
Absolútny počet neutrofilov
| ≥ 0,5 a < 1,5 x 109/l
| < 0,5 x 109/l
|
Počet trombocytov
| ≥ 10 a < 100 x 109/l
| < 10 x 109/l
|
CTC nehematologickej toxicity
(okrem alopécie, nevoľnosti a vra-
cania)
|
CTC 2. stupňa
|
CTC 3. alebo 4. stupňa
|
a: Súbežná liečba s TMZ môže pokračovať, keď sú splnené všetky nasledovné podmienky: absolútny počet neutrofilov ≥ 1,5 x 109/l, počet trombocytov ≥ 100 x 109/l, CTC nehematologickej toxicity ≤ 1. stupeň (okrem alopécie, nevoľnosti a vracania).
Fáza monoterapieŠtyri týždne po ukončení súbežnej fázy TMZ + RT sa TMZ podáva až do 6 cyklov ako monoterapia. Dávka v 1. cykle (monoterapie) je 150 mg/m2 raz denne počas 5 dní, po ktorých nasleduje 23 dní bez liečby. Na začiatku 2. cyklu sa dávka zvýši na 200 mg/m2, ak CTC nehematologickej toxicity (okrem alopécie, nevoľnosti a vracania) za 1. cyklus je ≤ 2. stupeň, absolútny počet neutrofilov (ANC) je ≥ 1,5 x 109/l a počet trombocytov je ≥ 100 x 109/l. Ak sa v 2. cykle dávka nezvýšila, nemá sa zvyšovať ani
v nasledujúcich cykloch. Ak sa dávka už raz zvýšila, zostáva 200 mg/m2 denne počas prvých 5 dní v každom nasledujúcom cykle, s výnimkou objavenia sa toxicity. Znižovanie dávok a prerušovanie
liečby počas fázy monoterapie sa má riadiť podľa Tabuliek 2 a 3.
Počas liečby, sa má 22. deň (21 dní od prvej dávky TMZ) vyšetriť úplný krvný obraz. Dávkovanie sa má znížiť alebo podávanie prerušiť podľa Tabuľky 3.
Tabuľka 2. Stupne dávkovania TMZ pri liečbe monoterapiou
|
Stupeň
dávkovania
| Dávka TMZ (mg/m2/deň)
| Poznámky
|
–1
| 100
| Zníženie kvôli predchádzajúcej toxicite
|
0
| 150
| Dávka počas 1. cyklu
|
1
| 200
| Dávka počas 2. - 6. cyklu, ak sa neobjavila toxicita
|
Tabuľka 3. Znižovanie dávok alebo prerušovanie liečby TMZ počas liečby monoterapiou
|
Toxicita
| Zníženie TMZ o 1 stupeň dávkovaniaa
| Ukončenie TMZ
|
Absolútny počet neutrofilov
| < 1,0 x 109/l
| Pozri poznámku
pod čiarou b
|
Počet trombocytov
| < 50 x 109/l
| Pozri poznámku
pod čiarou b
|
CTC nehematologickej toxicity
(okrem alopécie, nevoľnosti a vra-
cania)
|
CTC 3. stupňa
|
CTC 4b. stupňa
|
a: Stupne dávkovania TMZ sú uvedené v Tabuľke 2.
b: TMZ sa má prerušiť ak:
• pri stupni dávkovania -1 (100 mg/m2) stále pretrváva neakceptovateľná toxicita
• sa po znížení dávky objaví rovnaká nehematologická toxicita 3. stupňa (okrem alopécie, nevoľnosti
a vracania).
D
ospelí a detskí pacienti vo veku 3 rokov alebo starší s rekurentným
a
l
ebo
progredujúcim
m
alígnym
gliómom:
Liečebný cyklus trvá 28 dní. Pacientom, ktorí predtým neboli liečení chemoterapiou, sa TMZ podáva
perorálne v dávke 200 mg/m2 raz denne počas prvých 5 dní, po ktorých nasleduje prerušenie liečby na
23 dní (spolu 28 dní). U pacientov, ktorí predtým boli liečení chemoterapiou, je úvodná dávka
150 mg/m2 raz denne, ktorá sa v druhom cykle zvýši na 200 mg/m2 raz denne počas 5 dní, ak sa neobjaví hematologická toxicita (pozri časť 4.4).
Osobitné skupiny pacientov
Deti a dospievajúci
U trojročných alebo starších pacientov sa TMZ používa iba pri rekurentnom alebo progredujúcom malígnom glióme. Skúsenosti u týchto detí sú veľmi obmedzené (pozri časti 4.4 a 5.1). Bezpečnosť a účinnosť TMZ u detí mladších ako 3 roky neboli stanovené. Nie sú k dispozícii žiadne údaje.
Pacienti s poškodenou funkciou pečene alebo obličiek
Farmakokinetika TMZ bola u pacientov s normálnou funkciou pečene a u pacientov s miernym alebo stredne ťažkým poškodením funkcie pečene porovnateľná. Nie sú dostupné údaje o podávaní TMZ pacientom so závažným poškodením funkcie pečene (trieda C podľa Childovej klasifikácie) alebo
s poškodením funkcie obličiek. Vzhľadom na farmakokinetické vlastnosti TMZ nie je pravdepodobné, že by sa u pacientov so závažným poškodením funkcie pečene alebo akýmkoľvek stupňom poškodenia
funkcie obličiek vyžadovali redukcie dávky. Ak sa však TMZ podáva týmto pacientom, má sa im
venovať zvýšená pozornosť.
Starší pacienti
Na základe farmakokinetickej analýzy v populácii pacientov vo veku 19-78 rokov, klírens TMZ nie je ovplyvnený vekom. U starších pacientov (> 70 rokov) sa však zdá, že majú zvýšené riziko neutropénie a trombocytopénie (pozri časť 4.4).
Spôsob podania
Temodal tvrdé kapsuly sa majú podávať nalačno.
Kapsuly sa musia prehltnúť celé a zapiť pohárom vody. Nesmú sa otvárať alebo hrýzť (žuť). Keď vracanie nastúpi po podaní dávky, v ten istý deň sa už nemá podať druhá dávka.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Precitlivenosť na dakarbazín (DTIC). Závažná myelosupresia (pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
Pneumocystis jirovecii pneumónia
Ukázalo sa, že pacienti, ktorí v pilotnej štúdii dostávali súbežne TMZ a RT počas predĺženého 42-
dňového dávkovania, boli zvlášť ohrození vývojom pneumónie vyvolanej Pneumocystis jirovecii (Pneumocystis jirovecii pneumonia - PCP). Z tohto dôvodu sa u všetkých pacientov, ktorí dostávajú súbežne TMZ a RT počas 42-dňovej schémy (s maximom 49 dní), vyžaduje profylaxia proti PCP, a to
bez ohľadu na počet lymfocytov. Ak sa objaví lymfopénia, pacienti pokračujú v profylaxii až do úpravy lymfopénie na stupeň ≤ 1.
Pri podávaní TMZ počas dlhšej dávkovacej schémy môže byť výskyt PCP vyšší. Avšak, všetci pacienti, ktorí dostávajú TMZ, najmä pacienti, ktorí dostávajú steroidy, musia byť starostlivo sledovaní, či sa u nich nevyvinie PCP, bez ohľadu na schému. U pacientov užívajúcich TMZ najmä v kombinácii s dexametazónom alebo s inými steroidmi, sa hlásili fatálne prípady respiračného zlyhania.
Malignity
Veľmi zriedkavo sa hlásili aj prípady myelodysplastického syndrómu a sekundárnych malignít vrátane
myeloidnej leukémie (pozri časť 4.8).
Antiemetická liečba
S používaním TMZ sa veľmi často spájajú nauzea a vracanie.
Antiemetickú liečbu možno podávať pred alebo následne po podaní TMZ.
Dospelí pacienti s novodiagnostikovaným multiformným glioblastómom
Antiemetická profylaxia sa odporúča pred úvodnou dávkou súbežnej fázy a dôrazne sa odporúča počas
fázy monoterapie.
Pacienti s rekurentným alebo progredujúcimmalígnymgliómom
U pacientov, ktorí v predchádzajúcich liečebných cykloch trpeli závažným vracaním (3. alebo 4.
stupňa), sa môže vyžadovať antiemetická liečba.
Laboratórne parametre
U pacientov liečených TMZ sa môže objaviť myelopuspresia vrátane predĺženej pancytopénie, ktorá
môže viesť k aplastickej anémii, ktorá v niektorých prípadoch viedla k fatálnemu koncu. Expozícia súbežne podávaným liekom spojeným s aplastickou anémiou vrátane karbamazepínu, fenytoínu
a sulfametoxazolu/trimetoprimu v niektorých prípadoch komplikovala posúdenie. Pred zahájením liečby je potrebné, aby laboratórne parametre dosahovali nasledovné hodnoty: ANC ≥ 1,5 x 109/l
a počet trombocytov ≥ 100 x 109/l. Dvadsiaty druhý deň liečby (21 dní po prvej dávke) alebo
v priebehu 48 hodín od tohto dňa a potom raz týždenne sa má vyšetriť úplný krvný obraz, až pokým ANC > 1,5 x 109/l a počet trombocytov > 100 x 109/l. Ak v priebehu ktoréhokoľvek cyklu poklesne ANC na < 1,0 x 109/l alebo je počet trombocytov < 50 x 109/l, dávka sa má v nasledujúcom cykle redukovať o jeden stupeň (pozri časť 4.2). Stupne dávkovania sú 100 mg/m2, 150 mg/m2 a 200 mg/m2. Najnižšia odporúčaná dávka je 100 mg/m2.
Deti a dospievajúci
Nie sú klinické skúsenosti s používaním TMZ u detí mladších ako 3 roky. Skúsenosti so staršími
deťmi a dospievajúcimi sú veľmi obmedzené (pozri časti 4.2 a 5.1).
Starší pacienti (> 70rokov)
Zdá sa, že starší pacienti sú zvýšene ohrození neutropéniou a trombocytopéniou oproti
pacientom mladším. Preto sa má starším pacientom venovať zvláštna starostlivosť, ak sa im podáva
TMZ.
Pacienti mužského pohlavia
Mužov, ktorí majú byť liečení TMZ treba poučiť, aby nesplodili dieťa až 6 mesiacov po užití
poslednej dávky a treba ich poučiť, aby sa ešte pred liečbou poradili o možnosti konzervácie spermií
zmrazením (pozri časť 4.6).
Laktóza
Tento liek obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej
intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento
liek.
4.5 Liekové a iné interakcie
V samostatnej štúdii fázy I podávanie TMZ s ranitidínom neovplyvnilo množstvo absorbovaného temozolomidu alebo expozíciu jeho aktívneho metabolitu monometyl-triazenoimidazol-karboxamidu (MTIC).
Podávanie TMZ s jedlom malo za následok pokles Cmax o 33 % a pokles plochy pod krivkou (AUC)
o 9 %.
Keďže nie je možné vylúčiť, že zmeny Cmax sú klinicky signifikantné, Temodal sa nemá podávať
s jedlom.
Na základe analýzy populačnej farmakokinetiky v klinických skúšaniach II. fázy, nemenilo súbežné podávanie dexametazónu, prochlórperazínu, fenytoínu, karbamazepínu, ondasetrónu, antagonistov H2 receptorov alebo fenobarbitalu klírens TMZ. Súbežné podávanie s kyselinou valproovou bolo spojené s malým, ale štatisticky významným, poklesom klírensu TMZ.
Neboli vykonané štúdie, ktoré by zisťovali účinok TMZ na metabolizmus alebo elimináciu iných liekov. Keďže sa však TMZ nepodlieha metabolizmu v pečeni a vykazuje nízku väzbu na bielkoviny, je jeho vplyv na farmakokinetiku iných liekov nepravdepodobný (pozri časť 5.2).
Použitie TMZ v kombinácii s ďalšími myelosupresívnymi látkami môže zvýšiť pravdepodobnosť
myelosupresie.
Deti a dospievajúci
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú žiadne údaje na gravidných ženách. V predklinických štúdiách na potkanoch a králikoch, ktorí
dostávali 150 mg/m2 TMZ bola dokázaná teratogenita a/alebo fetálna toxicita (pozri časť 5.3).
Temodal sa nemá podávať gravidným ženám. Ak sa musí uvažovať o použití v gravidite, pacientka musí byť oboznámená s možným rizikom pre plod.
Laktácia
Nie je známe, či sa TMZ vylučuje do ľudského mlieka; preto sa má dojčenie počas liečby TMZ
prerušiť.
Ženy vofertilnomveku
Ženy vo fertilnom veku majú byť poučené, aby používali účinnú antikoncepciu na zabránenie
gravidity, pokiaľ užívajú TMZ.
Plodnosť u mužovTMZ môže mať genotoxické účinky. Preto treba mužov, ktorí majú byť ním liečení, poučiť, aby
nesplodili dieťa po dobu až 6 mesiacov po prijatí poslednej dávky a tiež ich treba poučiť, aby sa ešte pred liečbou poradili o možnosti konzervácie spermií zmrazením, pretože existuje možnosť
ireverzibilnej neplodnosti spôsobenej liečbou TMZ.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeTMZ má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje vzhľadom na únavu
a somnolenciu (pozri časť 4.8).
4.8 Nežiaduce účinkySkúsenosti z klinickéhoskúšaniaU pacientov liečených TMZ, či už použitím v kombinácii s RT alebo ako monoterapia s následnou RT
pri novodiagnostikovanom multiformnom glioblastóme, alebo ako monoterapii u pacientov
s rekurentným alebo progredujúcim gliómom boli veľmi často hlásené nežiaduce reakcie podobné:
nauzea, vracanie, zápcha, nechutenstvo, bolesť hlavy a únava. Kŕče boli hlásené veľmi často u pacientov s novodiagnostikovaným multiformným glioblastómom liečených monoterapiou a vyrážka bola hlásená veľmi často u pacientov s novodiagnostikovaným multiformným
glioblastómom liečených TMZ súbežne s RT aj pri monoterapii a často u pacientov s rekurentným
gliómom. Väčšina hematologických nežiaducich reakcií bola hlásená často alebo veľmi často v oboch indikáciách (tabuľky 4 a 5); frekvencia laboratórnych nálezov stupňa 3 – 4 je uvedená po každej
tabuľke.
Nežiaduce účinky sú v tabuľkách uvedené v rámci tried orgánových systémov a frekvencie. Skupiny
frekvencií sú definované podľa nasledovnej konvencie: veľmi časté (≥ 1/10), časté (≥ 1/100, až <
1/10), menej časté (≥ 1/1 000, až < 1/100). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Novodiagnostikovaný multiformný glioblastómTabuľka 4 uvádza nežiaduce udalosti vyskytujúce sa pri liečbe u pacientov s novodiagnostikovaným
multiformným glioblastómom počas súbežnej fázy liečby a fázy monoterapie.
Tabuľka 4. Nežiaduce udalosti vyskytujúce sa pri liečbe počas súbežnej liečby a monoterapie u pacientov s novodiagnostikovaným multiformným glioblastómom
|
Trieda orgánového
systému
| TMZ + súbežná RT
n=288*
| TMZ monoterapia
n=224
|
Infekcie a nákazy
|
Časté:
| infekcia, herpes simplex, infekcia rany,
faryngitída, orálna kandidóza
| infekcia, orálna kandidóza
|
Menej časté:
|
| herpes simplex, herpes zoster,
symptómy podobné chrípke
|
Poruchy krvi a lymfatického systému
|
Časté:
| neutropénia, trombocytopénia,
lymfopénia, leukopénia
| febrilná neutropénia,
trombocytopénia, anémia, leukopénia
|
Menej časté:
| febrilná neutropénia, anémia
| lymfopénia, petechie
|
Poruchy endokrinného systému
|
Menej časté:
|
Cushingoidný stav
|
Cushingoidný stav
|
Poruchy metabolizmu a výživy
|
Veľmi časté:
|
anorexia
|
anorexia
|
Časté
|
hyperglykémia, pokles hmotnosti
|
pokles hmotnosti
|
Menej časté:
|
hypokaliémia, zvýšenie alkalickej
fosfatázy, zvýšenie hmotnosti
|
hyperglykémia, zvýšenie hmotnosti
|
Psychické poruchy
|
Časté:
|
úzkosť, emočná labilita, insomnia
|
úzkosť, depresia, emočná labilita,
insomnia
|
Menej časté:
|
agitácia, apatia, porucha správania,
depresia, halucinácie
|
halucinácie, strata pamäti
|
Poruchy nervového systému
|
Veľmi časté:
|
bolesť hlavy
|
kŕče, bolesť hlavy
|
Časté:
|
kŕče, znížené vedomie, somnolencia,
afázia, porucha rovnováhy, závrat, zmätenosť, zhoršená pamäť, zhoršená koncentrácia, neuropatia, parestézia, porucha reči, tras
|
hemiparéza, afázia, porucha
rovnováhy, somnolencia, zmätenosť, závrat, zhoršená pamäť, zhoršená koncentrácia, dysfázia, neurologická porucha (NOS), neuropatia, periférna neuropatia, parestézia, porucha reči, tras
|
Menej časté:
|
status epilepticus, extrapyramidálna
porucha, hemiparéza, ataxia, kognitívna
porucha, dysfázia, nezvyčajná chôdza, hyperestézia, hypoestézia, neurologická porucha (NOS), periférna neuropatia
|
hemiplégia, ataxia, nezvyčajná
koordinácia, nezvyčajná chôdza, hyperestézia, senzorická porucha
|
Poruchy oka
|
Časté:
|
rozmazané videnie
|
výpadok v zornom poli, rozmazané
videnie, diplopia
|
Menej časté:
|
hemianopia, znížená zraková ostrosť,
porucha zraku, výpadok v zornom poli, bolesť oka
|
znížená zraková ostrosť, bolesť oka,
suché oči
|
Poruchy ucha a labyrintu
|
Časté:
|
porucha sluchu
|
porucha sluchu, tinitus
|
Menej časté:
|
otitis media, tinitus, zvýšená citlivosť
sluchu, bolesť ucha
|
hluchota, vertigo, bolesť ucha
|
Poruchy srdca a srdcovej činnosti
|
Menej časté:
|
palpitácie
|
|
Poruchy ciev
|
Časté:
|
krvácanie, edém, edém nohy
|
krvácanie, hlboká žilová trombóza,
edém nohy
|
Menej časté:
|
mozgové krvácanie, hypertenzia
|
pľúcna embólia, edém, periférny
edém
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Časté:
|
dýchavičnosť, kašeľ
|
dýchavičnosť, kašeľ
|
Menej časté:
|
pneumónia, infekcia horných dýchacích
ciest, nosová kongescia
|
pneumónia, sinusitída, infekcia
horných dýchacích ciest, bronchitída
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté:
|
zápcha, nauzea, vracanie
|
zápcha, nauzea, vracanie
|
Časté:
|
stomatitída, hnačka, bolesť brucha,
dyspepsia, dysfágia
|
stomatitída, hnačka, dyspepsia,
dysfágia, sucho v ústach
|
Menej časté:
|
|
abdominálna distenzia, inkontinencia
stolice, gastrointestinálna porucha
(NOS), gastroenteritída, hemoroidy
|
Poruchy kože a podkožného tkaniva
|
Veľmi časté:
|
kožná vyrážka, alopécia
|
kožná vyrážka, alopécia
|
Časté:
|
dermatitída, suchá koža, erytém, pruritus
|
suchá koža, pruritus
|
Menej časté:
|
exfoliácia kože, fotosenzitívna reakcia,
nezvyčajná pigmentácia
|
erytém, nezvyčajná pigmentácia,
zvýšené potenie
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
Časté:
|
svalová slabosť, artralgia
|
svalová slabosť, artralgia,
muskuloskeletálna bolesť, myalgia
|
Menej časté:
|
myopatia, bolesť chrbta,
muskuloskeletálna bolesť, myalgia
|
myopatia, bolesť chrbta
|
Poruchy obličiek a močových ciest
|
Časté:
|
zvýšené močenie, inkontinencia moču
|
inkontinencia moču
|
Menej časté:
|
|
dyzúria
|
Poruchy reprodukčného systému a prsníkov
|
Menej časté:
|
impotencia
|
krvácanie z pošvy, menorágia,
amenorea, vaginitída, bolesť prsníka
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté:
|
únava
|
únava
|
Časté:
|
alergická reakcia, horúčka, radiačné
poškodenie, opuch tváre, bolesť, porucha chuti
|
alergická reakcia, horúčka, radiačné
poškodenie, bolesť, porucha chuti
|
Menej časté:
|
asténia, sčervenenie, návaly tepla,
zhoršenie stavu, zimnica, zmena farby jazyka, porucha čuchu, smäd
|
asténie, opuch tváre, bolesť, zhoršenie
stavu, zimnica, porucha zuba, porucha chuti
|
Laboratórne a funkčné vyšetrenia
|
Časté:
|
zvýšenie ALT
|
zvýšenie ALT
|

Menej časté: Zvýšenie pečeňových enzýmov, zvýšenie gamma GT, zvýšenie AST
*Pacient randomizovaný do ramena so samotnou RT, dostával TMZ + RT.
Laboratórne výsledkyPozorovala sa myelosupresia (neutropénia a trombocytopénia), známa ako dávku limitujúca toxicita pre väčšinu cytotoxických látok, vrátane TMZ. Keď sa skombinovali laboratórne abnormality
a nežiaduce udalosti z oboch fáz liečby, súbežnej aj monoterapie, pozorovali sa abnormality neutrofilov 3. alebo 4. stupňa, vrátane neutropenických udalostí, u 8 % pacientov. Abnormality
trombocytov 3. alebo 4.stupňa, vrátane trombocytopenických udalostí, sa pozorovali u 14 %
pacientov, ktorí dostávali TMZ.
Rekurentný alebo progredujúcimalígnygliómV klinických skúšaniach boli najčastejšie sa vyskytujúce nežiaduce účinky súvisiace s liečbou
gastrointestinálne poruchy, konkrétne nauzea (43 %) a vracanie (36 %). Tieto reakcie dosahovali zvyčajne 1. alebo 2. stupeň (0 – 5 epizód vracania za 24 hodín) a buď spontánne ustúpili, alebo boli
ľahko zvládnuté štandardnou antiemetickou liečbou. Incidencia závažnej nauzey a vracania bola 4 %.
Nežiaduce účinky zaznamenané počas klinických skúšaní s rekurentným alebo progredujúcim malígnym gliómom a následne po uvedení Temodalu do obehu sú zhrnuté v Tabuľke 5.
Tabuľka 5. Nežiaduce reakcie u pacientov s rekurentným alebo progredujúcim malígnym gliómom
|
Infekcie a nákazy
|
Zriedkavé
| oportúnne infekcie vrátane PCP
|
Poruchy krvi a lymfatického systému
|
Veľmi časté:
| neutropénia alebo lymfopénia (3. – 4. stupeň),
trombocytopénia (3. – 4. stupeň)
|
Menej časté:
| pancytopénia, anémia (3. – 4. stupeň), leukopénia
|
Poruchy metabolizmu a výživy
|
Veľmi časté:
| anorexia
|
Časté:
| pokles hmotnosti
|
Poruchy nervového systému
|
Veľmi časté:
| bolesť hlavy
|
Časté:
| somnolencia, závrat, parestézia
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Časté:
| dyspnoe
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté:
| vracanie, nauzea, zápcha
|
Časté:
| hnačka, bolesť brucha, dyspepsia
|
Poruchy kože a podkožného tkaniva
|
Časté:
| kožná vyrážka, pruritus, alopécia
|
Veľmi zriedkavé:
| multiformný erytém, erytrodermia, urtikária, exantém
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté:
| únava
|
Časté:
| horúčka, asténia, zimnica, nevoľnosť, bolesť, zmena
chuti
|
Veľmi zriedkavé:
| alergické reakcie vrátane anafylaxie, angioedém
|
Laboratórne výsledky
Trombocytopénia a neutropénia 3. alebo 4. stupňa sa vyskytli u 19 %, resp. 17 % pacientov liečených na malígny glióm. Toto viedlo k hospitalizácii v 8 % a/alebo k prerušeniu liečby TMZ v 4 %. Myelosupresia bola predvídateľná (zvyčajne v priebehu niekoľko prvých cyklov, s najnižšími hodnotami medzi 21. a 28. dňom) a zotavenie nastalo rýchle, zvyčajne behom 1 – 2 týždňov. Výskyt kumulatívnej myelosupresie sa nepozoroval. Prítomnosť trombocytopénie môže zvýšiť riziko krvácania a prítomnosť neutropénie alebo leukopénie môže zvýšiť riziko infekcie.
Pohlavie
Podľa farmakokinetickej analýzy populácie klinického skúšania bola hodnota najnižšieho počtu (NADIR) neutrofilov dostupná u 101 žien a 169 mužov a hodnota najnižšieho počtu krvných doštičiek u 110 žien a 174 mužov. V prvom cykle liečby bol u žien v porovnaní s mužmi vyšší výskyt neutropénie 4. stupňa (ANC < 0,5 x 109/l), 12 % vs. 5 %, a trombocytopénie 4. stupňa (< 20 x 109/l),
9 % vs. 3 %. V súbore informácií od 400 jedincov s rekurentným gliómom sa v prvom cykle liečby objavila neutropénia 4. stupňa u 8 % žien v porovnaní so 4 % mužov. V štúdii s 288 jedincami
s novodiagnostikovaným multiformným glioblastómom sa v prvom cykle liečby objavila neutropénia
4. stupňa u 3 % žien v porovnaní s 0 % mužov a trombocytopénia 4. stupňa u 1 % žien v porovnaní s 0 % mužov.
Deti a dospievajúci
Perorálny TMZ sa skúmal u detských a dospievajúcich pacientov (vo veku 3-18 rokov) s rekurentným
gliómom mozgového kmeňa alebo s rekurentným astrocytómom vysokého stupňa v dávkovacom režime podávanom denne počas 5 dní každých 28 dní. Hoci sú údaje obmedzené, očakáva sa, že znášanlivosť u detí bude rovnaká ako u dospelých. Bezpečnosť TMZ u detí mladších ako 3 roky sa nestanovila.
Skúsenosti po uvedeníliekunatrh
Antineoplastické látky, a zvlášť alkylačné látky, boli spojené s potenciálnym rizikom
myelodysplastického syndrómu (MDS) a sekundárnych malignít, vrátane leukémie. U pacientov, liečených režimami s TMZ, boli hlásené veľmi zriedkavé prípady MDS a sekundárnych malignít,
vrátane myeloidnej leukémie. Bola hlásená predĺžená pancytopénia, ktorá môže vyústiť do aplastickej
anémie a v niektorých prípadoch viedla k fatálnemu koncu.
Veľmi zriedkavo boli hlásené prípady toxickej epidermálnej nekrolýzy a Stevens-Johnsonovho syndrómu.
Veľmi zriedkavo sa hlásili prípady intersticiálnej pneumonitídy/pneumonitídy, fibrózy pľúc
a fatálneho respiračného zlyhania.
Boli hlásené prípady hepatotoxicity vrátane zvýšenia hladín pečeňových enzýmov, hyperbilirubinémie, cholestázy a hepatitídy.
4.9 Predávkovanie
U pacientov sa klinicky hodnotili dávky 500, 750, 1 000 a 1 250 mg/m2 (celková dávka na cyklus počas 5 dní). Toxicita limitujúca dávku bola hematologická a táto bola hlásená pri všetkých dávkach, ale predpokladá sa, že bude závažnejšia pri vyšších dávkach. Jeden pacient sa predávkoval užitím dávky 10 000 mg (celková dávka v jednom cykle počas 5 dní). Nežiaduce reakcie hlásené pri tomto predávkovaní boli pancytopénia, pyrexia, multiorgánové zlyhanie a smrť. Existujú záznamy
o pacientoch, ktorí užívali odporúčanú dávku po dobu viac ako 5 dní liečby (až do 64 dní), pričom hlásené nežiaduce udalosti zahŕňali útlm kostnej drene s infekciou alebo bez nej, ktoré boli
v niektorých prípadoch závažné a pretrvávali dlhšiu dobu a skončili sa smrťou. V prípade
predávkovania je potrebné hematologické vyšetrenie. V prípade potreby sa majú vykonať podporné
opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Cytostatiká - Iné alkylačné látky, ATC kód: L01A X03
Spôsob účinkuTemozolomid je triazén, ktorý pri fyziologickom pH podlieha rýchlej chemickej konverzii na aktívny
monometyl-triazenoimidazol-karboxamid (MTIC). Predpokladá sa, že cytotoxicitu MTIC primárne spôsobuje alkylácia na pozícii O6 guanínu, spolu s ďalšou alkyláciou na pozícii N7. Cytotoxické lézie, ktoré sa rozvinú následne, pravdepodobne zapríčiňuje aberantná oprava metylovaného aduktu.
Klinická účinnosť abezpečnosťNovodiagnostikovaný multiformný glioblastómCelkovo 573 pacientov bolo randomizovaných tak, aby dostávali buď TMZ + RT (n=287), alebo RT
samotnú (n = 286). Pacienti v ramene TMZ + RT súbežne dostávali TMZ (75 mg/m2) raz denne, začínajúc v prvý deň RT až do posledného dňa RT, po dobu 42 dní (s maximom 49 dní). Potom
nasledovala monoterapia TMZ (150 - 200 mg/m2) 1. – 5. deň počas každého 28-dňového cyklu.
Liečba trvala až 6. cyklov a začínalo sa s ňou 4 týždne po ukončení RT. Pacienti v kontrolnom ramene
dostávali len RT. Počas RT a aj kombinovanej liečby TMZ sa vyžadovala profylaxia proti pneumónii spôsobenej
Pneumocystis jirovecii (PCP).
TMZ sa podával ako záchranná terapia vo fáze sledovania po liečbe 161 pacientom z 282 (57 %)
z ramena so samotnou RT a 62 pacientom z 277 (22 %) z ramena TMZ + RT.
Pomer rizika (Hazard ratio - HR) celkového prežívania bol 1,59 (95 % CI pre HR = 1,33 – 1,91) s log- rank p < 0,0001 v prospech ramena s TMZ. Odhadovaná pravdepodobnosť prežívania 2 alebo viac rokov (26 % vs. 10 %) bola vyššia v ramene RT + TMZ. Súbežné pridanie TMZ k RT, s následnou monoterapiou TMZ, pri liečbe pacientov s novodiagnostikovaným multiformným glioblastómom preukázalo štatisticky významné zlepšenie celkového prežívania (Overall Survival – OS) v porovnaní so samotnou RT (Obrázok 1).
 Obrázok 1 Kaplan-Meierove krivky celkového prežívania (Intent to Treat - populácia, v ktorej bola liečba zamýšľaná)
Obrázok 1 Kaplan-Meierove krivky celkového prežívania (Intent to Treat - populácia, v ktorej bola liečba zamýšľaná)
Výsledky zo skúšania neboli konzistentné v podskupine pacientov so slabým výkonnostným stavom (WHO PS = 2, n = 70), v ktorej bolo celkové prežívanie a čas do progresie podobné v oboch ramenách. Nezdá sa však, že by v tejto skupine pacientov boli prítomné neprijateľné riziká.
Rekurentný alebo progredujúcimalígnyglióm
Údaje o klinickej účinnosti u pacientov s multiformným glioblastómom (Karnofského skóre
[Karnofsky perfomance status – KPS] ≥70), progredujúcom alebo recidivujúcom po chirurgickej terapii a RT, sú založené na dvoch klinických skúšaniach s perorálnym TMZ. Jedno bolo nekomparatívne skúšanie u 138 pacientov (predtým dostávalo chemoterapiu 29 %) a druhé bolo randomizované aktívne kontrolované skúšanie TMZ vs prokarbazínu u celkovo 225 pacientov (pred liečbou dostávalo chemoterapiu na báze nitrózourey 67 % pacientov). Primárnym cieľom oboch skúšaní bolo stanoviť prežívanie bez progresie nádoru (progression free survival – PFS), definované MRI zobrazením alebo neurologickým zhoršením. V nekomparatívnom skúšaní bolo PFS v 6. mesiaci
19 %, medián prežívania bez progresie nádoru bol 2,1 mesiaca a medián celkového prežívania 5,4 mesiaca. Častosť objektívnej odpovede (Objective response rate – ORR), založená na MRI zobrazení, bola 8 %.
V randomizovanom aktívne kontrolovanom klinickom skúšaní bolo 6-mesačné PFS signifikantne dlhšie u TMZ než u prokarbazínu (21 % oproti 8 %, chí-kvadrát p = 0,008) s mediánom PFS 2,89 mesiacov pre TMZ a 1,88 mesiacov pre prokarbazín (log rank p = 0,0063). Medián prežívania pre
TMZ bol 7,34 mesiaca a pre prokarbazín 5,66 mesiacov (log rank p = 0,33). Po 6 mesiacoch bol podiel prežívajúcich pacientov signifikantne vyšší v TMZ ramene (60 %) oproti ramenu s prokarbazínom
(44 %) (chí-kvadrát p = 0,019). U pacientov s predchádzajúcou chemoterapiou bol zaznamenaný
prínos u tých, ktorých KPS bolo ≥ 80.
Údaje o čase do zhoršenia neurologického stavu boli v prospech TMZ oproti prokarbazínu, takisto ako údaje o čase do zhoršenia celkového stavu (pokles na KPS na < 70 alebo pokles o najmenej 30 bodov). Mediány časov do progresie nádoru podľa týchto cieľov boli u TMZ dlhšie v rozsahu 0,7 až 2,1 mesiaca než u prokarbazínu (log rank p = < 0,01 – 0,03).
Rekurentný anaplastický astrocytóm
V multicentrickom, prospektívnom klinickom skúšaní II. fázy, v ktorom sa vyhodnocovala bezpečnosť
a účinnosť liečby perorálnym TMZ u pacientov s anaplastickým astrocytómom pri prvom relapse, bolo 6-mesačné PFS 46 %. Medián PFS bol 5,4 mesiaca. Medián celkového prežívania bol 14,6 mesiacov. V populácii pacientov, u ktorých bola liečba zamýšľaná (ITT) n=162, bola, podľa zhodnotenia centrálnym recenzentom, častosť odpovede 35 % (13 dosiahlo kompletnú remisiu a 43 parciálnu). Stabilné ochorenie bolo hlásené u 43 pacientov. 6-mesačné prežívanie bez príhody bolo
v ITT populácii 44 % s mediánom prežívania bez príhody 4,6 mesiacov, čo bolo podobné výsledkom prežívania bez progresie. Výsledky účinnosti boli podobné aj u populácie, ktorá bola vhodná na histológiu. Dosiahnutie rádiologicky objektívnej odpovede alebo udržania stavu bez progresie bolo silne viazané s udržanou alebo zlepšenou kvalitou života.
Deti a dospievajúci
Perorálny TMZ sa skúmal u detských a dospievajúcich pacientov (vo veku 3-18 rokov) s rekurentným
gliómom mozgového kmeňa alebo rekurentným astrocytómom vysokého stupňa v dávkovacom režime podávanom denne počas 5 dní každých 28 dní. Tolerancia na TMZ je podobná ako u dospelých.
5.2 Farmakokinetické vlastnosti
TMZ sa pri fyziologickom pH spontánne hydrolyzuje na primárne účinné zložky, 3-metyl-(triazén-1- yl)imidazol-4-karboxamid (MTIC). MTIC sa spontánne hydrolyzuje na 5-aminoimidazol-4- karboxamid (AIC), známy medziprodukt pri biosyntéze purínu a nukleovej kyseliny, a na metylhydrazín, ktorý sa považuje za účinnú alkylačnú zložku. Predpokladá sa, že za cytotoxicitu
MTIC je primárne zodpovedná alkylácia DNA, predovšetkým na pozíciách O6 a N7 guanínu.
V závislosti od AUC TMZ je expozícia MTIC ~ 2,4 % a expozícia AIC ~ 23 %. In vivo bol t1/2 MTIC
podobný t1/2 TMZ, a to 1,8 hod.
Absorpcia
Po perorálnom podaní dospelým pacientom sa TMZ vstrebáva rýchlo a maximálne koncentrácie sa
dosahujú už za 20 minút po podaní (priemerný čas medzi 0,5 a 1,5 hodinou). Po perorálnom podaní TMZ označeného 14C, počas 7 dní po podaní, bola priemerná exkrécia 14C stolicou 0,8 %, čo ukazuje na jeho úplnú absorpciu.
Distribúcia
TMZ vykazuje nízku väzbu na bielkoviny (10 % až 20 %), a preto sa neočakáva jeho interakcia
s látkami, ktoré sa silne viažu na bielkoviny.
PET štúdie u ľudí, ako aj predklinické údaje ukazujú, že TMZ rýchlo prechádza hematoencefalickou bariérou a je prítomný v mozgovomiechovom moku. Prienik do mozgovomiechového moku bol potvrdený u jedného pacienta; meraním AUC sa zistilo, že koncentrácia TMZ v mozgovomiechovom moku dosahuje približne 30 % hladín v plazme, čo zodpovedá údajom zisteným u zvierat.
Eliminácia
Polčas (t1/2) v plazme je približne 1,8 hodín. Hlavnou cestou vylučovania 14C sú obličky. Po perorálnom podaní sa močom vylúči približne 5 % až 10 % dávky v nezmenenej forme v priebehu 24 hodín. Zvyšok sa vylúči ako kyselina temozolomidová, 5-aminoimidazol-4-karboxamid (AIC) alebo ako neidentifikované polárne metabolity.
Plazmatické koncentrácie stúpajú v závislosti od podanej dávky. Plazmatický klírens, distribučný objem a polčas sú nezávislé od podanej dávky.
Osobitné skupiny pacientov
Analýza populačnej farmakokinetiky TMZ ukázala, že plazmatický klírens TMZ bol nezávislý od
veku pacienta, renálnych funkcií alebo od fajčenia. V inej farmakokinetickej štúdii boli plazmatické
farmakokinetické profily u pacientov s miernym alebo stredne ťažkým poškodením funkcie pečene podobné plazmatickým farmakokinetickým profilom, pozorovaným u pacientov s normálnou funkciou pečene.
Detskí pacienti mali vyššie AUC ako dospelí pacienti; avšak maximálna tolerovaná dávka (MTD) bola
1 000 mg/m2/cyklus u detí aj u dospelých.
5.3 Predklinické údaje o bezpečnosti
Boli vykonané jednocyklové (5-dní podávanie, 23 dní bez liečby), 3- a 6-cyklové štúdie toxicity na potkanoch a psoch. Toxicita sa primárne prejavila na kostnej dreni, lymforetikulárnom systéme, testes a gastrointestinálnom trakte. Vo vyšších dávkach, ktoré boli letálne pre 60 % až 100 % testovaných potkanov a psov, došlo ku degenerácii sietnice. Väčšina toxických zmien sa ukázala byť reverzibilných, výnimkou boli nežiaduce udalosti na mužský reprodukčný systém a degenerácia sietnice. Keďže sa však dávky, ktoré zapríčinili degeneráciu sietnice, pohybovali v rozmedzí letálnych dávok a porovnateľný účinok nebol pozorovaný v klinických štúdiách, tento nález sa nepokladá za klinicky významný.
TMZ je embryotoxická, teratogénna a genotoxická alkylačná látka. TMZ je toxickejší pre potkany
a psov ako pre ľudí a klinická dávka sa približuje minimálnej letálnej dávke u potkanov a u psov. Na dávke závislé redukcie leukocytov a trombocytov sa javia ako senzitívne indikátory toxicity. V 6- cyklovej štúdii na potkanoch sa zaznamenali rôzne nádory, vrátane mamárnych karcinómov,
keratoakantómov kože a bazocelulárnych adenómov, zatiaľ čo v štúdiách na psoch sa nádory alebo predneoplastické zmeny nezistili. Potkany sa javia byť zvlášť citlivé na onkogénne účinky TMZ, pričom prvé nádory sa zjavujú v priebehu 3 mesiacov od začiatku podávania. Táto doba latencie je veľmi krátka aj pre alkylačnú látku.
Testy chromozómových aberácií Ames/salmonely a ľudských lymfocytov z periférnej krvi (Human
Peripheral Blood Lymphocyte - HPBL) ukázali pozitívnu mutagénnnu odpoveď.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsahkapsuly: bezvodá laktóza, koloidný oxid kremičitý,
sodná soľ karboxymetylškrobu typu A, kyselina vínna,
kyselina stearová.
Obalkapsuly:
želatína,
oxid titaničitý (E 171), laurylsíran sodný,
žltý oxid železitý (E 172).
Potlač: šelak, propylénglykol, čistená voda, hydroxid amónny, hydroxid draselný,
čierny oxid železitý (E 172).
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Balenie vo fľaši
Uchovávajte pri teplote neprevyšujúcej 30 °C.
Uchovávajte v pôvodnej fľaši na ochranu pred vlhkosťou. Fľašu udržiavajte dôkladne uzatvorenú.
Balenie vo vrecku
Uchovávajte pri teplote neprevyšujúcej 30 °C.
6.5 Druh obalu a obsah balenia
B
alenie vo fľašiFľašky z jantárového skla typu I s polypropylénovými uzávermi bezpečnými pred deťmi obsahujúce 5
alebo 20 tvrdých kapsúl. Škatuľka obsahuje jednu fľašu.
Balenie vo vreckuVrecká sa skladajú z lineárneho polyetylénu s nízkou hustotou (najvnútornejšia vrstva), hliníka
a polyetyléntereftalátu.
Každé vrecko obsahuje 1 tvrdú kapsulu a dodáva sa v papierovej škatuli.
Škatuľa obsahuje 5 alebo 20 tvrdých kapsúl jednotlivo uzatvorených vo vreckách. Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomKapsuly sa nesmú otvárať. Ak je kapsula poškodená, musíte zabrániť kontaktu práškového obsahu
s kožou alebo sliznicou. Ak sa Temodal dostane do kontaktu s kožou alebo sliznicou, okamžite
a dôkladne sa musí postihnutá oblasť umyť mydlom a vodou.
Pacientov treba poučiť, aby kapsuly uchovávali mimo dohľadu a dosahu detí, najlepšie v uzamknutej skrini. Náhodné prehltnutie môže byť pre deti smrteľné.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMerck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU
Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/98/096/003
EU/1/98/096/004
EU/1/98/096/013
EU/1/98/096/014
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 26. január 1999. Dátum posledného predĺženia: 26. január 2009.
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu
1. NÁZOV LIEKU
Temodal 100 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá tvrdá kapsula obsahuje 100 mg temozolomidu.
Pomocnálátkasoznámymúčinkom:
Každá tvrdá kapsula obsahuje 175,7 mg bezvodej laktózy. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tvrdá kapsula.
Tvrdé kapsuly majú nepriehľadné biele telo kapsuly, nepriehľadný ružový vrchnáčik a sú potlačené čiernym atramentom. Na vrchnáčiku je vytlačené „Temodal“. Na tele kapsuly je vytlačené „100 mg“, logo Schering-Plough a dva pásiky.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Temodal je indikovaný na liečbu:
- dospelých pacientov s novodiagnostikovaným multiformným glioblastómom súbežne
s rádioterapiou (RT) a následne ako monoterapia
- detí od troch rokov, dospievajúcich a dospelých pacientov s malígnym gliómom, ako je multiformný glioblastóm alebo anaplastický astrocytóm, u ktorých došlo po štandardnej terapii
k recidíve alebo progresii ochorenia.
4.2 Dávkovanie a spôsob podávania
Temodal majú predpisovať iba lekári skúsení v onkologickej liečbe nádorov mozgu. Možno podávať antiemetickú liečbu (pozri časť 4.4).
Dávkovanie
Dospelí pacienti s novodiagnostikovaným multiformným glioblastómom
Temodal sa podáva v kombinácii s fokálnou rádioterapiou (súbežná fáza) nasledovanou až do 6 cyklov
monoterapie temozolomidom (TMZ) (fáza monoterapie).
Súbežná fáza
TMZ sa podáva perorálne v dávke 75 mg/m2 denne po dobu 42 dní súbežne s fokálnou rádioterapiou (60 Gy podaných v 30 frakciách). Dávku sa neodporúča znižovať, ale každý týždeň sa má rozhodnúť, či sa podávanie TMZ oddiali alebo preruší, na základe kritérií hematologickej a nehematologickej toxicity. V podávaní TMZ možno pokračovať po dobu 42-dňovej súbežnej fázy (až do 49 dní), ak sú splnené všetky nasledovné podmienky:
- absolútny počet neutrofilov (Absolute Neutrophil Count – ANC) ≥ 1,5 x 109/l
- počet trombocytov ≥ 100 x 109/l
- celkové kritériá toxicity (Common Toxicity Criteria - CTC) nehematologickej toxicity (okrem alopécie, nevoľnosti a vracania) ≤ 1. stupeň.
Počas liečby sa má týždenne vyšetrovať úplný krvný obraz. Podávanie TMZ sa má v priebehu
súbežnej fázy dočasne prerušiť alebo trvalo ukončiť podľa kritérií hematologickej a nehematologickej toxicity, ako je uvedené v Tabuľke 1.
Tabuľka 1. Prerušenie alebo ukončenie podávania TMZ počas
súbežnej rádioterapie a terapie TMZ
|
Toxicita
| Prerušenie TMZa
| Ukončenie TMZ
|
Absolútny počet neutrofilov
| ≥ 0,5 a < 1,5 x 109/l
| < 0,5 x 109/l
|
Počet trombocytov
| ≥ 10 a < 100 x 109/l
| < 10 x 109/l
|
CTC nehematologickej toxicity
(okrem alopécie, nevoľnosti a vra-
cania)
|
CTC 2. stupňa
|
CTC 3. alebo 4. stupňa
|
a: Súbežná liečba s TMZ môže pokračovať, keď sú splnené všetky nasledovné podmienky: absolútny počet neutrofilov ≥ 1,5 x 109/l, počet trombocytov ≥ 100 x 109/l, CTC nehematologickej toxicity ≤ 1. stupeň (okrem alopécie, nevoľnosti a vracania).
Fáza monoterapieŠtyri týždne po ukončení súbežnej fázy TMZ + RT sa TMZ podáva až do 6 cyklov ako monoterapia. Dávka v 1. cykle (monoterapie) je 150 mg/m2 raz denne počas 5 dní, po ktorých nasleduje 23 dní bez liečby. Na začiatku 2. cyklu sa dávka zvýši na 200 mg/m2, ak CTC nehematologickej toxicity (okrem alopécie, nevoľnosti a vracania) za 1. cyklus je ≤ 2. stupeň, absolútny počet neutrofilov (ANC) je ≥ 1,5 x 109/l a počet trombocytov je ≥ 100 x 109/l. Ak sa v 2. cykle dávka nezvýšila, nemá sa zvyšovať ani
v nasledujúcich cykloch. Ak sa dávka už raz zvýšila, zostáva 200 mg/m2 denne počas prvých 5 dní v každom nasledujúcom cykle, s výnimkou objavenia sa toxicity. Znižovanie dávok a prerušovanie
liečby počas fázy monoterapie sa má riadiť podľa Tabuliek 2 a 3.
Počas liečby, sa má 22. deň (21 dní od prvej dávky TMZ) vyšetriť úplný krvný obraz. Dávkovanie sa má znížiť alebo podávanie prerušiť podľa Tabuľky 3.
Tabuľka 2. Stupne dávkovania TMZ pri liečbe monoterapiou
|
Stupeň
dávkovania
| Dávka TMZ (mg/m2/deň)
| Poznámky
|
–1
| 100
| Zníženie kvôli predchádzajúcej toxicite
|
0
| 150
| Dávka počas 1. cyklu
|
1
| 200
| Dávka počas 2. - 6. cyklu, ak sa neobjavila toxicita
|
Tabuľka 3. Znižovanie dávok alebo prerušovanie liečby TMZ počas liečby monoterapiou
|
Toxicita
| Zníženie TMZ o 1 stupeň dávkovaniaa
| Ukončenie TMZ
|
Absolútny počet neutrofilov
| < 1,0 x 109/l
| Pozri poznámku
pod čiarou b
|
Počet trombocytov
| < 50 x 109/l
| Pozri poznámku
pod čiarou b
|
CTC nehematologickej toxicity
(okrem alopécie, nevoľnosti a vra-
cania)
|
CTC 3. stupňa
|
CTC 4b. stupňa
|
a: Stupne dávkovania TMZ sú uvedené v Tabuľke 2.
b: TMZ sa má prerušiť ak:
• pri stupni dávkovania -1 (100 mg/m2) stále pretrváva neakceptovateľná toxicita
• sa po znížení dávky objaví rovnaká nehematologická toxicita 3. stupňa (okrem alopécie, nevoľnosti
a vracania).
D
ospelí a detskí pacienti vo veku 3 rokov alebo starší s rekurentným
a
l
ebo
progredujúcim
m
alígnym
gliómom:
Liečebný cyklus trvá 28 dní. Pacientom, ktorí predtým neboli liečení chemoterapiou, sa TMZ podáva
perorálne v dávke 200 mg/m2 raz denne počas prvých 5 dní, po ktorých nasleduje prerušenie liečby na
23 dní (spolu 28 dní). U pacientov, ktorí predtým boli liečení chemoterapiou, je úvodná dávka
150 mg/m2 raz denne, ktorá sa v druhom cykle zvýši na 200 mg/m2 raz denne počas 5 dní, ak sa neobjaví hematologická toxicita (pozri časť 4.4).
Osobitné skupiny pacientov
Deti a dospievajúci
U trojročných alebo starších pacientov sa TMZ používa iba pri rekurentnom alebo progredujúcom malígnom glióme. Skúsenosti u týchto detí sú veľmi obmedzené (pozri časti 4.4 a 5.1). Bezpečnosť a účinnosť TMZ u detí mladších ako 3 roky neboli stanovené. Nie sú k dispozícii žiadne údaje.
Pacienti s poškodením funkcie pečene alebo obličiek
Farmakokinetika TMZ bola u pacientov s normálnou funkciou pečene a u pacientov s miernym alebo stredne ťažkým poškodením funkcie pečene porovnateľná. Nie sú dostupné údaje o podávaní TMZ pacientom so závažným poškodením funkcie pečene (trieda C podľa Childovej klasifikácie) alebo
s poškodením funkcie obličiek. Vzhľadom na farmakokinetické vlastnosti TMZ nie je pravdepodobné, že by sa u pacientov so závažným poškodením funkcie pečene alebo akýmkoľvek stupňom poškodenia
funkcie obličiek vyžadovali redukcie dávky. Ak sa však TMZ podáva týmto pacientom, má sa im
venovať zvýšená pozornosť.
Starší pacienti
Na základe farmakokinetickej analýzy v populácii pacientov vo veku 19-78 rokov, klírens TMZ nie je ovplyvnený vekom. U starších pacientov (> 70 rokov) sa však zdá, že majú zvýšené riziko neutropénie a trombocytopénie (pozri časť 4.4).
Spôsob podania
Temodal tvrdé kapsuly sa majú podávať nalačno.
Kapsuly sa musia prehltnúť celé a zapiť pohárom vody. Nesmú sa otvárať alebo hrýzť (žuť). Keď vracanie nastúpi po podaní dávky, v ten istý deň sa už nemá podať druhá dávka.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Precitlivenosť na dakarbazín (DTIC). Závažná myelosupresia (pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
Pneumocystis jirovecii pneumónia
Ukázalo sa, že pacienti, ktorí v pilotnej štúdii dostávali súbežne TMZ a RT počas predĺženého 42-
dňového dávkovania, boli zvlášť ohrození vývojom pneumónie vyvolanej Pneumocystis jirovecii (Pneumocystis jirovecii pneumonia - PCP). Z tohto dôvodu sa u všetkých pacientov, ktorí dostávajú súbežne TMZ a RT počas 42-dňovej schémy (s maximom 49 dní), vyžaduje profylaxia proti PCP, a to
bez ohľadu na počet lymfocytov. Ak sa objaví lymfopénia, pacienti pokračujú v profylaxii až do úpravy lymfopénie na stupeň ≤ 1.
Pri podávaní TMZ počas dlhšej dávkovacej schémy môže byť výskyt PCP vyšší. Avšak, všetci pacienti, ktorí dostávajú TMZ, najmä pacienti, ktorí dostávajú steroidy, musia byť starostlivo sledovaní, či sa u nich nevyvinie PCP, bez ohľadu na schému. U pacientov užívajúcich TMZ najmä v kombinácii s dexametazónom alebo s inými steroidmi, sa hlásili fatálne prípady respiračného zlyhania.
Malignity
Veľmi zriedkavo sa hlásili aj prípady myelodysplastického syndrómu a sekundárnych malignít vrátane
myeloidnej leukémie (pozri časť 4.8).
Antiemetická liečba
S používaním TMZ sa veľmi často spájajú nauzea a vracanie.
Antiemetickú liečbu možno podávať pred alebo následne po podaní TMZ.
Dospelí pacienti s novodiagnostikovaným multiformným glioblastómom
Antiemetická profylaxia sa odporúča pred úvodnou dávkou súbežnej fázy a dôrazne sa odporúča počas
fázy monoterapie.
Pacienti s rekurentným alebo progredujúcimmalígnymgliómom
U pacientov, ktorí v predchádzajúcich liečebných cykloch trpeli závažným vracaním (3. alebo 4.
stupňa), sa môže vyžadovať antiemetická liečba.
Laboratórne parametre
U pacientov liečených TMZ sa môže objaviť myelopuspresia vrátane predĺženej pancytopénie, ktorá
môže viesť k aplastickej anémii, ktorá v niektorých prípadoch viedla k fatálnemu koncu. Expozícia súbežne podávaným liekom spojeným s aplastickou anémiou vrátane karbamazepínu, fenytoínu
a sulfametoxazolu/trimetoprimu v niektorých prípadoch komplikovala posúdenie. Pred zahájením liečby je potrebné, aby laboratórne parametre dosahovali nasledovné hodnoty: ANC ≥ 1,5 x 109/l
a počet trombocytov ≥ 100 x 109/l. Dvadsiaty druhý deň liečby (21 dní po prvej dávke) alebo
v priebehu 48 hodín od tohto dňa a potom raz týždenne sa má vyšetriť úplný krvný obraz, až pokým ANC > 1,5 x 109/l a počet trombocytov > 100 x 109/l. Ak v priebehu ktoréhokoľvek cyklu poklesne ANC na < 1,0 x 109/l alebo je počet trombocytov < 50 x 109/l, dávka sa má v nasledujúcom cykle redukovať o jeden stupeň (pozri časť 4.2). Stupne dávkovania sú 100 mg/m2, 150 mg/m2 a 200 mg/m2. Najnižšia odporúčaná dávka je 100 mg/m2.
Deti a dospievajúci
Nie sú klinické skúsenosti s používaním TMZ u detí mladších ako 3 roky. Skúsenosti so staršími
deťmi a dospievajúcimi sú veľmi obmedzené (pozri časti 4.2 a 5.1).
Starší pacienti (> 70rokov)
Zdá sa, že starší pacienti sú zvýšene ohrození neutropéniou a trombocytopéniou oproti
pacientom mladším. Preto sa má starším pacientom venovať zvláštna starostlivosť, ak sa im podáva
TMZ.
Pacienti mužského pohlavia
Mužov, ktorí majú byť liečení TMZ treba poučiť, aby nesplodili dieťa až 6 mesiacov po užití
poslednej dávky a treba ich poučiť, aby sa ešte pred liečbou poradili o možnosti konzervácie spermií
zmrazením (pozri časť 4.6).
Laktóza
Tento liek obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej
intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento
liek.
4.5 Liekové a iné interakcie
V samostatnej štúdii fázy I podávanie TMZ s ranitidínom neovplyvnilo množstvo absorbovaného temozolomidu alebo expozíciu jeho aktívneho metabolitu monometyl-triazenoimidazol-karboxamidu (MTIC).
Podávanie TMZ s jedlom malo za následok pokles Cmax o 33 % a pokles plochy pod krivkou (AUC)
o 9 %.
Keďže nie je možné vylúčiť, že zmeny Cmax sú klinicky signifikantné, Temodal sa nemá podávať
s jedlom.
Na základe analýzy populačnej farmakokinetiky v klinických skúšaniach II. fázy, nemenilo súbežné podávanie dexametazónu, prochlórperazínu, fenytoínu, karbamazepínu, ondasetrónu, antagonistov H2 receptorov alebo fenobarbitalu klírens TMZ. Súbežné podávanie s kyselinou valproovou bolo spojené s malým, ale štatisticky významným, poklesom klírensu TMZ.
Neboli vykonané štúdie, ktoré by zisťovali účinok TMZ na metabolizmus alebo elimináciu iných liekov. Keďže sa však TMZ nepodlieha metabolizmu v pečeni a vykazuje nízku väzbu na bielkoviny, je jeho vplyv na farmakokinetiku iných liekov nepravdepodobný (pozri časť 5.2).
Použitie TMZ v kombinácii s ďalšími myelosupresívnymi látkami môže zvýšiť pravdepodobnosť
myelosupresie.
Deti a dospievajúci
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú žiadne údaje na gravidných ženách. V predklinických štúdiách na potkanoch a králikoch, ktorí
dostávali 150 mg/m2 TMZ bola dokázaná teratogenita a/alebo fetálna toxicita (pozri časť 5.3).
Temodal sa nemá podávať gravidným ženám. Ak sa musí uvažovať o použití v gravidite, pacientka musí byť oboznámená s možným rizikom pre plod.
Laktácia
Nie je známe, či sa TMZ vylučuje do ľudského mlieka; preto sa má dojčenie počas liečby TMZ
prerušiť.
Ženy vo fertilnom veku
Ženy vo fertilnom veku majú byť poučené, aby používali účinnú antikoncepciu na zabránenie
gravidity, pokiaľ užívajú TMZ.
Plodnosť u mužovTMZ môže mať genotoxické účinky. Preto treba mužov, ktorí majú byť ním liečení, poučiť, aby
nesplodili dieťa po dobu až 6 mesiacov po prijatí poslednej dávky a tiež ich treba poučiť, aby sa ešte pred liečbou poradili o možnosti konzervácie spermií zmrazením, pretože existuje možnosť
ireverzibilnej neplodnosti spôsobenej liečbou TMZ.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeTMZ má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje vzhľadom na únavu
a somnolenciu (pozri časť 4.8).
4.8 Nežiaduce účinkySkúsenosti z klinickéhoskúšaniaU pacientov liečených TMZ, či už použitím v kombinácii s RT alebo ako monoterapia s následnou RT
pri novodiagnostikovanom multiformnom glioblastóme, alebo ako monoterapii u pacientov
s rekurentným alebo progredujúcim gliómom boli veľmi často hlásené nežiaduce reakcie podobné:
nauzea, vracanie, zápcha, nechutenstvo, bolesť hlavy a únava. Kŕče boli hlásené veľmi často u pacientov s novodiagnostikovaným multiformným glioblastómom liečených monoterapiou a vyrážka bola hlásená veľmi často u pacientov s novodiagnostikovaným multiformným
glioblastómom liečených TMZ súbežne s RT aj pri monoterapii a často u pacientov s rekurentným
gliómom. Väčšina hematologických nežiaducich reakcií bola hlásená často alebo veľmi často v oboch indikáciách (tabuľky 4 a 5); frekvencia laboratórnych nálezov stupňa 3 – 4 je uvedená po každej
tabuľke.
Nežiaduce účinky sú v tabuľkách uvedené v rámci tried orgánových systémov a frekvencie. Skupiny
frekvencií sú definované podľa nasledovnej konvencie: veľmi časté (≥ 1/10), časté (≥ 1/100, až <
1/10), menej časté (≥ 1/1 000, až < 1/100). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Novodiagnostikovaný multiformný glioblastómTabuľka 4 uvádza nežiaduce udalosti vyskytujúce sa pri liečbe u pacientov s novodiagnostikovaným
multiformným glioblastómom počas súbežnej fázy liečby a fázy monoterapie.
Tabuľka 4. Nežiaduce udalosti vyskytujúce sa pri liečbe počas súbežnej liečby a monoterapie u pacientov s novodiagnostikovaným multiformným glioblastómom
|
Trieda orgánového
systému
| TMZ + súbežná RT
n=288*
| TMZ monoterapia
n=224
|
Infekcie a nákazy
|
Časté:
| infekcia, herpes simplex, infekcia rany,
faryngitída, orálna kandidóza
| infekcia, orálna kandidóza
|
Menej časté:
|
| herpes simplex, herpes zoster,
symptómy podobné chrípke
|
Poruchy krvi a lymfatického systému
|
Časté:
| neutropénia, trombocytopénia,
lymfopénia, leukopénia
| febrilná neutropénia,
trombocytopénia, anémia, leukopénia
|
Menej časté:
| febrilná neutropénia, anémia
| lymfopénia, petechie
|
Poruchy endokrinného systému
|
Menej časté:
|
Cushingoidný stav
|
Cushingoidný stav
|
Poruchy metabolizmu a výživy
|
Veľmi časté:
|
anorexia
|
anorexia
|
Časté
|
hyperglykémia, pokles hmotnosti
|
pokles hmotnosti
|
Menej časté:
|
hypokaliémia, zvýšenie alkalickej
fosfatázy, zvýšenie hmotnosti
|
hyperglykémia, zvýšenie hmotnosti
|
Psychické poruchy
|
Časté:
|
úzkosť, emočná labilita, insomnia
|
úzkosť, depresia, emočná labilita,
insomnia
|
Menej časté:
|
agitácia, apatia, porucha správania,
depresia, halucinácie
|
halucinácie, strata pamäti
|
Poruchy nervového systému
|
Veľmi časté:
|
bolesť hlavy
|
kŕče, bolesť hlavy
|
Časté:
|
kŕče, znížené vedomie, somnolencia,
afázia, porucha rovnováhy, závrat, zmätenosť, zhoršená pamäť, zhoršená koncentrácia, neuropatia, parestézia, porucha reči, tras
|
hemiparéza, afázia, porucha
rovnováhy, somnolencia, zmätenosť, závrat, zhoršená pamäť, zhoršená koncentrácia, dysfázia, neurologická porucha (NOS), neuropatia, periférna neuropatia, parestézia, porucha reči, tras
|
Menej časté:
|
status epilepticus, extrapyramidálna
porucha, hemiparéza, ataxia, kognitívna
porucha, dysfázia, nezvyčajná chôdza, hyperestézia, hypoestézia, neurologická porucha (NOS), periférna neuropatia
|
hemiplégia, ataxia, nezvyčajná
koordinácia, nezvyčajná chôdza, hyperestézia, senzorická porucha
|
Poruchy oka
|
Časté:
|
rozmazané videnie
|
výpadok v zornom poli, rozmazané
videnie, diplopia
|
Menej časté:
|
hemianopia, znížená zraková ostrosť,
porucha zraku, výpadok v zornom poli, bolesť oka
|
znížená zraková ostrosť, bolesť oka,
suché oči
|
Poruchy ucha a labyrintu
|
Časté:
|
porucha sluchu
|
porucha sluchu, tinitus
|
Menej časté:
|
otitis media, tinitus, zvýšená citlivosť
sluchu, bolesť ucha
|
hluchota, vertigo, bolesť ucha
|
Poruchy srdca a srdcovej činnosti
|
Menej časté:
|
palpitácie
|
|
Poruchy ciev
|
Časté:
|
krvácanie, edém, edém nohy
|
krvácanie, hlboká žilová trombóza,
edém nohy
|
Menej časté:
|
mozgové krvácanie, hypertenzia
|
pľúcna embólia, edém, periférny
edém
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Časté:
|
dýchavičnosť, kašeľ
|
dýchavičnosť, kašeľ
|
Menej časté:
|
pneumónia, infekcia horných dýchacích
ciest, nosová kongescia
|
pneumónia, sinusitída, infekcia
horných dýchacích ciest, bronchitída
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté:
|
zápcha, nauzea, vracanie
|
zápcha, nauzea, vracanie
|
Časté:
|
stomatitída, hnačka, bolesť brucha,
dyspepsia, dysfágia
|
stomatitída, hnačka, dyspepsia,
dysfágia, sucho v ústach
|
Menej časté:
|
|
abdominálna distenzia, inkontinencia
stolice, gastrointestinálna porucha
(NOS), gastroenteritída, hemoroidy
|
Poruchy kože a podkožného tkaniva
|
Veľmi časté:
|
kožná vyrážka, alopécia
|
kožná vyrážka, alopécia
|
Časté:
|
dermatitída, suchá koža, erytém, pruritus
|
suchá koža, pruritus
|
Menej časté:
|
exfoliácia kože, fotosenzitívna reakcia,
nezvyčajná pigmentácia
|
erytém, nezvyčajná pigmentácia,
zvýšené potenie
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
Časté:
|
svalová slabosť, artralgia
|
svalová slabosť, artralgia,
muskuloskeletálna bolesť, myalgia
|
Menej časté:
|
myopatia, bolesť chrbta,
muskuloskeletálna bolesť, myalgia
|
myopatia, bolesť chrbta
|
Poruchy obličiek a močových ciest
|
Časté:
|
zvýšené močenie, inkontinencia moču
|
inkontinencia moču
|
Menej časté:
|
|
dyzúria
|
Poruchy reprodukčného systému a prsníkov
|
Menej časté:
|
impotencia
|
krvácanie z pošvy, menorágia,
amenorea, vaginitída, bolesť prsníka
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté:
|
únava
|
únava
|
Časté:
|
alergická reakcia, horúčka, radiačné
poškodenie, opuch tváre, bolesť, porucha chuti
|
alergická reakcia, horúčka, radiačné
poškodenie, bolesť, porucha chuti
|
Menej časté:
|
asténia, sčervenenie, návaly tepla,
zhoršenie stavu, zimnica, zmena farby jazyka, porucha čuchu, smäd
|
asténie, opuch tváre, bolesť, zhoršenie
stavu, zimnica, porucha zuba, porucha chuti
|
Laboratórne a funkčné vyšetrenia
|
Časté:
|
zvýšenie ALT
|
zvýšenie ALT
|

Menej časté: Zvýšenie pečeňových enzýmov, zvýšenie gamma GT, zvýšenie AST
*Pacient randomizovaný do ramena so samotnou RT, dostával TMZ + RT.
Laboratórne výsledkyPozorovala sa myelosupresia (neutropénia a trombocytopénia), známa ako dávku limitujúca toxicita pre väčšinu cytotoxických látok, vrátane TMZ. Keď sa skombinovali laboratórne abnormality
a nežiaduce udalosti z oboch fáz liečby, súbežnej aj monoterapie, pozorovali sa abnormality neutrofilov 3. alebo 4. stupňa, vrátane neutropenických udalostí, u 8 % pacientov. Abnormality
trombocytov 3. alebo 4.stupňa, vrátane trombocytopenických udalostí, sa pozorovali u 14 %
pacientov, ktorí dostávali TMZ.
Rekurentný alebo progredujúcimalígnygliómV klinických skúšaniach boli najčastejšie sa vyskytujúce nežiaduce účinky súvisiace s liečbou
gastrointestinálne poruchy, konkrétne nauzea (43 %) a vracanie (36 %). Tieto reakcie dosahovali zvyčajne 1. alebo 2. stupeň (0 – 5 epizód vracania za 24 hodín) a buď spontánne ustúpili, alebo boli
ľahko zvládnuté štandardnou antiemetickou liečbou. Incidencia závažnej nauzey a vracania bola 4 %.
Nežiaduce účinky zaznamenané počas klinických skúšaní s rekurentným alebo progredujúcim malígnym gliómom a následne po uvedení Temodalu do obehu sú zhrnuté v Tabuľke 5.
Tabuľka 5. Nežiaduce reakcie u pacientov s rekurentným alebo progredujúcim malígnym gliómom
|
Infekcie a nákazy
|
Zriedkavé
| oportúnne infekcie vrátane PCP
|
Poruchy krvi a lymfatického systému
|
Veľmi časté:
| neutropénia alebo lymfopénia (3. – 4. stupeň),
trombocytopénia (3. – 4. stupeň)
|
Menej časté:
| pancytopénia, anémia (3. – 4. stupeň), leukopénia
|
Poruchy metabolizmu a výživy
|
Veľmi časté:
| anorexia
|
Časté:
| pokles hmotnosti
|
Poruchy nervového systému
|
Veľmi časté:
| bolesť hlavy
|
Časté:
| somnolencia, závrat, parestézia
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Časté:
| dyspnoe
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté:
| vracanie, nauzea, zápcha
|
Časté:
| hnačka, bolesť brucha, dyspepsia
|
Poruchy kože a podkožného tkaniva
|
Časté:
| kožná vyrážka, pruritus, alopécia
|
Veľmi zriedkavé:
| multiformný erytém, erytrodermia, urtikária, exantém
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté:
| únava
|
Časté:
| horúčka, asténia, zimnica, nevoľnosť, bolesť, zmena
chuti
|
Veľmi zriedkavé:
| alergické reakcie vrátane anafylaxie, angioedém
|
Laboratórne výsledky
Trombocytopénia a neutropénia 3. alebo 4. stupňa sa vyskytli u 19 %, resp. 17 % pacientov liečených na malígny glióm. Toto viedlo k hospitalizácii v 8 % a/alebo k prerušeniu liečby TMZ v 4 %. Myelosupresia bola predvídateľná (zvyčajne v priebehu niekoľko prvých cyklov, s najnižšími hodnotami medzi 21. a 28. dňom) a zotavenie nastalo rýchle, zvyčajne behom 1 – 2 týždňov. Výskyt kumulatívnej myelosupresie sa nepozoroval. Prítomnosť trombocytopénie môže zvýšiť riziko krvácania a prítomnosť neutropénie alebo leukopénie môže zvýšiť riziko infekcie.
Pohlavie
Podľa farmakokinetickej analýzy populácie klinického skúšania bola hodnota najnižšieho počtu (NADIR) neutrofilov dostupná u 101 žien a 169 mužov a hodnota najnižšieho počtu krvných doštičiek u 110 žien a 174 mužov. V prvom cykle liečby bol u žien v porovnaní s mužmi vyšší výskyt neutropénie 4. stupňa (ANC < 0,5 x 109/l), 12 % vs. 5 %, a trombocytopénie 4. stupňa (< 20 x 109/l),
9 % vs. 3 %. V súbore informácií od 400 jedincov s rekurentným gliómom sa v prvom cykle liečby objavila neutropénia 4. stupňa u 8 % žien v porovnaní so 4 % mužov. V štúdii s 288 jedincami
s novodiagnostikovaným multiformným glioblastómom sa v prvom cykle liečby objavila neutropénia
4. stupňa u 3 % žien v porovnaní s 0 % mužov a trombocytopénia 4. stupňa u 1 % žien v porovnaní s 0 % mužov.
Deti a dospievajúci
Perorálny TMZ sa skúmal u detských a dospievajúcich pacientov (vo veku 3-18 rokov) s rekurentným
gliómom mozgového kmeňa alebo s rekurentným astrocytómom vysokého stupňa v dávkovacom režime podávanom denne počas 5 dní každých 28 dní. Hoci sú údaje obmedzené, očakáva sa, že znášanlivosť u detí bude rovnaká ako u dospelých. Bezpečnosť TMZ u detí mladších ako 3 roky sa nestanovila.
Skúsenosti po uvedeníliekunatrh
Antineoplastické látky, a zvlášť alkylačné látky, boli spojené s potenciálnym rizikom
myelodysplastického syndrómu (MDS) a sekundárnych malignít, vrátane leukémie. U pacientov, liečených režimami s TMZ, boli hlásené veľmi zriedkavé prípady MDS a sekundárnych malignít,
vrátane myeloidnej leukémie. Bola hlásená predĺžená pancytopénia, ktorá môže vyústiť do aplastickej
anémie a v niektorých prípadoch viedla k fatálnemu koncu.
Veľmi zriedkavo boli hlásené prípady toxickej epidermálnej nekrolýzy a Stevens-Johnsonovho syndrómu.
Veľmi zriedkavo sa hlásili prípady intersticiálnej pneumonitídy/pneumonitídy, fibrózy pľúc
a fatálneho respiračného zlyhania.
Boli hlásené prípady hepatotoxicity vrátane zvýšenia hladín pečeňových enzýmov, hyperbilirubinémie, cholestázy a hepatitídy.
4.9 Predávkovanie
U pacientov sa klinicky hodnotili dávky 500, 750, 1 000 a 1 250 mg/m2 (celková dávka na cyklus počas 5 dní). Toxicita limitujúca dávku bola hematologická a táto bola hlásená pri všetkých dávkach, ale predpokladá sa, že bude závažnejšia pri vyšších dávkach. Jeden pacient sa predávkoval užitím dávky 10 000 mg (celková dávka v jednom cykle počas 5 dní). Nežiaduce reakcie hlásené pri tomto predávkovaní boli pancytopénia, pyrexia, multiorgánové zlyhanie a smrť. Existujú záznamy
o pacientoch, ktorí užívali odporúčanú dávku po dobu viac ako 5 dní liečby (až do 64 dní), pričom hlásené nežiaduce udalosti zahŕňali útlm kostnej drene s infekciou alebo bez nej, ktoré boli
v niektorých prípadoch závažné a pretrvávali dlhšiu dobu a skončili sa smrťou. V prípade
predávkovania je potrebné hematologické vyšetrenie. V prípade potreby sa majú vykonať podporné
opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Cytostatiká - Iné alkylačné látky, ATC kód: L01A X03
Spôsob účinkuTemozolomid je triazén, ktorý pri fyziologickom pH podlieha rýchlej chemickej konverzii na aktívny
monometyl-triazenoimidazol-karboxamid (MTIC). Predpokladá sa, že cytotoxicitu MTIC primárne spôsobuje alkylácia na pozícii O6 guanínu, spolu s ďalšou alkyláciou na pozícii N7. Cytotoxické lézie, ktoré sa rozvinú následne, pravdepodobne zapríčiňuje aberantná oprava metylovaného aduktu.
Klinická účinnosť abezpečnosťNovodiagnostikovaný multiformný glioblastómCelkovo 573 pacientov bolo randomizovaných tak, aby dostávali buď TMZ + RT (n=287), alebo RT
samotnú (n = 286). Pacienti v ramene TMZ + RT súbežne dostávali TMZ (75 mg/m2) raz denne, začínajúc v prvý deň RT až do posledného dňa RT, po dobu 42 dní (s maximom 49 dní). Potom
nasledovala monoterapia TMZ (150 - 200 mg/m2) 1. – 5. deň počas každého 28-dňového cyklu.
Liečba trvala až 6. cyklov a začínalo sa s ňou 4 týždne po ukončení RT. Pacienti v kontrolnom ramene
dostávali len RT. Počas RT a aj kombinovanej liečby TMZ sa vyžadovala profylaxia proti pneumónii spôsobenej
Pneumocystis jirovecii (PCP).
TMZ sa podával ako záchranná terapia vo fáze sledovania po liečbe 161 pacientom z 282 (57 %)
z ramena so samotnou RT a 62 pacientom z 277 (22 %) z ramena TMZ + RT.
Pomer rizika (Hazard ratio - HR) celkového prežívania bol 1,59 (95 % CI pre HR = 1,33 – 1,91) s log- rank p < 0,0001 v prospech ramena s TMZ. Odhadovaná pravdepodobnosť prežívania 2 alebo viac rokov (26 % vs. 10 %) bola vyššia v ramene RT + TMZ. Súbežné pridanie TMZ k RT, s následnou monoterapiou TMZ, pri liečbe pacientov s novodiagnostikovaným multiformným glioblastómom preukázalo štatisticky významné zlepšenie celkového prežívania (Overall Survival – OS) v porovnaní so samotnou RT (Obrázok 1).
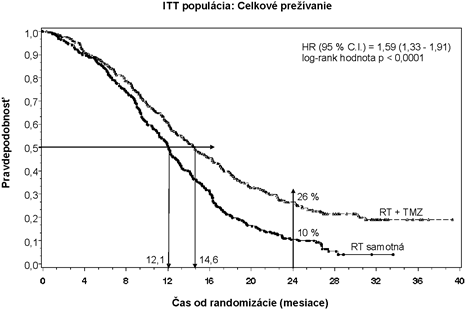 Obrázok 1 Kaplan-Meierove krivky celkového prežívania (Intent to Treat - populácia, v ktorej bola liečba zamýšľaná)
Obrázok 1 Kaplan-Meierove krivky celkového prežívania (Intent to Treat - populácia, v ktorej bola liečba zamýšľaná)
Výsledky zo skúšania neboli konzistentné v podskupine pacientov so slabým výkonnostným stavom (WHO PS = 2, n = 70), v ktorej bolo celkové prežívanie a čas do progresie podobné v oboch ramenách. Nezdá sa však, že by v tejto skupine pacientov boli prítomné neprijateľné riziká.
Rekurentný alebo progredujúcimalígnyglióm
Údaje o klinickej účinnosti u pacientov s multiformným glioblastómom (Karnofského skóre
[Karnofsky perfomance status – KPS] ≥70), progredujúcom alebo recidivujúcom po chirurgickej terapii a RT, sú založené na dvoch klinických skúšaniach s perorálnym TMZ. Jedno bolo nekomparatívne skúšanie u 138 pacientov (predtým dostávalo chemoterapiu 29 %) a druhé bolo randomizované aktívne kontrolované skúšanie TMZ vs prokarbazínu u celkovo 225 pacientov (pred liečbou dostávalo chemoterapiu na báze nitrózourey 67 % pacientov). Primárnym cieľom oboch skúšaní bolo stanoviť prežívanie bez progresie nádoru (progression free survival – PFS), definované MRI zobrazením alebo neurologickým zhoršením. V nekomparatívnom skúšaní bolo PFS v 6. mesiaci
19 %, medián prežívania bez progresie nádoru bol 2,1 mesiaca a medián celkového prežívania 5,4 mesiaca. Častosť objektívnej odpovede (Objective response rate – ORR), založená na MRI zobrazení, bola 8 %.
V randomizovanom aktívne kontrolovanom klinickom skúšaní bolo 6-mesačné PFS signifikantne dlhšie u TMZ než u prokarbazínu (21 % oproti 8 %, chí-kvadrát p = 0,008) s mediánom PFS 2,89 mesiacov pre TMZ a 1,88 mesiacov pre prokarbazín (log rank p = 0,0063). Medián prežívania pre
TMZ bol 7,34 mesiaca a pre prokarbazín 5,66 mesiacov (log rank p = 0,33). Po 6 mesiacoch bol podiel prežívajúcich pacientov signifikantne vyšší v TMZ ramene (60 %) oproti ramenu s prokarbazínom
(44 %) (chí-kvadrát p = 0,019). U pacientov s predchádzajúcou chemoterapiou bol zaznamenaný
prínos u tých, ktorých KPS bolo ≥ 80.
Údaje o čase do zhoršenia neurologického stavu boli v prospech TMZ oproti prokarbazínu, takisto ako údaje o čase do zhoršenia celkového stavu (pokles na KPS na < 70 alebo pokles o najmenej 30 bodov). Mediány časov do progresie nádoru podľa týchto cieľov boli u TMZ dlhšie v rozsahu 0,7 až 2,1 mesiaca než u prokarbazínu (log rank p = < 0,01 – 0,03).
Rekurentný anaplastický astrocytóm
V multicentrickom, prospektívnom klinickom skúšaní II. fázy, v ktorom sa vyhodnocovala bezpečnosť
a účinnosť liečby perorálnym TMZ u pacientov s anaplastickým astrocytómom pri prvom relapse, bolo 6-mesačné PFS 46 %. Medián PFS bol 5,4 mesiaca. Medián celkového prežívania bol 14,6 mesiacov. V populácii pacientov, u ktorých bola liečba zamýšľaná (ITT) n=162, bola, podľa zhodnotenia centrálnym recenzentom, častosť odpovede 35 % (13 dosiahlo kompletnú remisiu a 43 parciálnu). Stabilné ochorenie bolo hlásené u 43 pacientov. 6-mesačné prežívanie bez príhody bolo
v ITT populácii 44 % s mediánom prežívania bez príhody 4,6 mesiacov, čo bolo podobné výsledkom prežívania bez progresie. Výsledky účinnosti boli podobné aj u populácie, ktorá bola vhodná na histológiu. Dosiahnutie rádiologicky objektívnej odpovede alebo udržania stavu bez progresie bolo silne viazané s udržanou alebo zlepšenou kvalitou života.
Deti a dospievajúci
Perorálny TMZ sa skúmal u detských a dospievajúcich pacientov (vo veku 3-18 rokov) s rekurentným
gliómom mozgového kmeňa alebo rekurentným astrocytómom vysokého stupňa v dávkovacom režime podávanom denne počas 5 dní každých 28 dní. Tolerancia na TMZ je podobná ako u dospelých.
5.2 Farmakokinetické vlastnosti
TMZ sa pri fyziologickom pH spontánne hydrolyzuje na primárne účinné zložky, 3-metyl-(triazén-1- yl)imidazol-4-karboxamid (MTIC). MTIC sa spontánne hydrolyzuje na 5-aminoimidazol-4- karboxamid (AIC), známy medziprodukt pri biosyntéze purínu a nukleovej kyseliny, a na metylhydrazín, ktorý sa považuje za účinnú alkylačnú zložku. Predpokladá sa, že za cytotoxicitu
MTIC je primárne zodpovedná alkylácia DNA, predovšetkým na pozíciách O6 a N7 guanínu.
V závislosti od AUC TMZ je expozícia MTIC ~ 2,4 % a expozícia AIC ~ 23 %. In vivo bol t1/2 MTIC
podobný t1/2 TMZ, a to 1,8 hod.
Absorpcia
Po perorálnom podaní dospelým pacientom sa TMZ vstrebáva rýchlo a maximálne koncentrácie sa
dosahujú už za 20 minút po podaní (priemerný čas medzi 0,5 a 1,5 hodinou). Po perorálnom podaní TMZ označeného 14C, počas 7 dní po podaní, bola priemerná exkrécia 14C stolicou 0,8 %, čo ukazuje na jeho úplnú absorpciu.
Distribúcia
TMZ vykazuje nízku väzbu na bielkoviny (10 % až 20 %), a preto sa neočakáva jeho interakcia
s látkami, ktoré sa silne viažu na bielkoviny.
PET štúdie u ľudí, ako aj predklinické údaje ukazujú, že TMZ rýchlo prechádza hematoencefalickou bariérou a je prítomný v mozgovomiechovom moku. Prienik do mozgovomiechového moku bol potvrdený u jedného pacienta; meraním AUC sa zistilo, že koncentrácia TMZ v mozgovomiechovom moku dosahuje približne 30 % hladín v plazme, čo zodpovedá údajom zisteným u zvierat.
Eliminácia
Polčas (t1/2) v plazme je približne 1,8 hodín. Hlavnou cestou vylučovania 14C sú obličky. Po perorálnom podaní sa močom vylúči približne 5 % až 10 % dávky v nezmenenej forme v priebehu 24 hodín. Zvyšok sa vylúči ako kyselina temozolomidová, 5-aminoimidazol-4-karboxamid (AIC) alebo ako neidentifikované polárne metabolity.
Plazmatické koncentrácie stúpajú v závislosti od podanej dávky. Plazmatický klírens, distribučný objem a polčas sú nezávislé od podanej dávky
Osobitné skupiny pacientov
Analýza populačnej farmakokinetiky TMZ ukázala, že plazmatický klírens TMZ bol nezávislý od
veku pacienta, renálnych funkcií alebo od fajčenia. V inej farmakokinetickej štúdii boli plazmatické
farmakokinetické profily u pacientov s miernym alebo stredne ťažkým poškodením funkcie pečene podobné plazmatickým farmakokinetickým profilom, pozorovaným u pacientov s normálnou funkciou pečene.
Detskí pacienti mali vyššie AUC ako dospelí pacienti; avšak maximálna tolerovaná dávka (MTD) bola
1 000 mg/m2/cyklus u detí aj u dospelých.
5.3 Predklinické údaje o bezpečnosti
Boli vykonané jednocyklové (5-dní podávanie, 23 dní bez liečby), 3- a 6-cyklové štúdie toxicity na potkanoch a psoch. Toxicita sa primárne prejavila na kostnej dreni, lymforetikulárnom systéme, testes a gastrointestinálnom trakte. Vo vyšších dávkach, ktoré boli letálne pre 60 % až 100 % testovaných potkanov a psov, došlo ku degenerácii sietnice. Väčšina toxických zmien sa ukázala byť reverzibilných, výnimkou boli nežiaduce udalosti na mužský reprodukčný systém a degenerácia sietnice. Keďže sa však dávky, ktoré zapríčinili degeneráciu sietnice, pohybovali v rozmedzí letálnych dávok a porovnateľný účinok nebol pozorovaný v klinických štúdiách, tento nález sa nepokladá za klinicky významný.
TMZ je embryotoxická, teratogénna a genotoxická alkylačná látka. TMZ je toxickejší pre potkany
a psov ako pre ľudí a klinická dávka sa približuje minimálnej letálnej dávke u potkanov a u psov. Na dávke závislé redukcie leukocytov a trombocytov sa javia ako senzitívne indikátory toxicity. V 6- cyklovej štúdii na potkanoch sa zaznamenali rôzne nádory, vrátane mamárnych karcinómov,
keratoakantómov kože a bazocelulárnych adenómov, zatiaľ čo v štúdiách na psoch sa nádory alebo predneoplastické zmeny nezistili. Potkany sa javia byť zvlášť citlivé na onkogénne účinky TMZ, pričom prvé nádory sa zjavujú v priebehu 3 mesiacov od začiatku podávania. Táto doba latencie je veľmi krátka aj pre alkylačnú látku.
Testy chromozómových aberácií Ames/salmonely a ľudských lymfocytov z periférnej krvi (Human
Peripheral Blood Lymphocyte - HPBL) ukázali pozitívnu mutagénnnu odpoveď.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsahkapsuly: bezvodá laktóza, koloidný oxid kremičitý,
sodná soľ karboxymetylškrobu typu A, kyselina vínna,
kyselina stearová.
Obalkapsuly:
želatína,
oxid titaničitý (E 171), laurylsíran sodný,
červený oxid železitý (E 172).
Potlač: šelak, propylénglykol, čistená voda, hydroxid amónny, hydroxid draselný,
čierny oxid železitý (E 172).
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Balenie vo fľaši
Uchovávajte pri teplote neprevyšujúcej 30 °C.
Uchovávajte v pôvodnej fľaši na ochranu pred vlhkosťou. Fľašu udržiavajte dôkladne uzatvorenú.
Balenie vo vrecku
Uchovávajte pri teplote neprevyšujúcej 30 °C.
6.5 Druh obalu a obsah balenia
B
alenie vo fľaši
Fľašky z jantárového skla typu I s polypropylénovými uzávermi bezpečnými pred deťmi obsahujúce 5
alebo 20 tvrdých kapsúl. Škatuľka obsahuje jednu fľašu.
Balenie vo vreckuVrecká sa skladajú z lineárneho polyetylénu s nízkou hustotou (najvnútornejšia vrstva), hliníka
a polyetyléntereftalátu.
Každé vrecko obsahuje 1 tvrdú kapsulu a dodáva sa v papierovej škatuli.
Škatuľa obsahuje 5 alebo 20 tvrdých kapsúl jednotlivo uzatvorených vo vreckách. Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomKapsuly sa nesmú otvárať. Ak je kapsula poškodená, musíte zabrániť kontaktu práškového obsahu
s kožou alebo sliznicou. Ak sa Temodal dostane do kontaktu s kožou alebo sliznicou, okamžite
a dôkladne sa musí postihnutá oblasť umyť mydlom a vodou.
Pacientov treba poučiť, aby kapsuly uchovávali mimo dohľadu a dosahu detí, najlepšie v uzamknutej skrini. Náhodné prehltnutie môže byť pre deti smrteľné.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMerck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU
Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/98/096/005
EU/1/98/096/006
EU/1/98/096/015
EU/1/98/096/016
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 26. január 1999. Dátum posledného predĺženia: 26. január 2009.
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu
1. NÁZOV LIEKU
Temodal 140 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá tvrdá kapsula obsahuje 140 mg temozolomidu.
Pomocnálátkasoznámymúčinkom:
Každá tvrdá kapsula obsahuje 246 mg bezvodej laktózy. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tvrdá kapsula.
Tvrdé kapsuly majú nepriehľadné biele telo kapsuly, nepriehľadný modrý vrchnáčik a sú potlačené čiernym atramentom. Na vrchnáčiku je vytlačené „Temodal“. Na tele kapsuly je vytlačené „140 mg“, logo Schering-Plough a dva pásiky.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Temodal je indikovaný na liečbu:
- dospelých pacientov s novodiagnostikovaným multiformným glioblastómom súbežne
s rádioterapiou (RT) a následne ako monoterapia
- detí od troch rokov, dospievajúcich a dospelých pacientov s malígnym gliómom, ako je multiformný glioblastóm alebo anaplastický astrocytóm, u ktorých došlo po štandardnej terapii
k recidíve alebo progresii ochorenia.
4.2 Dávkovanie a spôsob podávania
Temodal majú predpisovať iba lekári skúsení v onkologickej liečbe nádorov mozgu. Možno podávať antiemetickú liečbu (pozri časť 4.4).
Dávkovanie
Dospelí pacienti s novodiagnostikovaným multiformným glioblastómom
Temodal sa podáva v kombinácii s fokálnou rádioterapiou (súbežná fáza) nasledovanou až do 6 cyklov
monoterapie temozolomidom (TMZ) (fáza monoterapie).
Súbežná fáza
TMZ sa podáva perorálne v dávke 75 mg/m2 denne po dobu 42 dní súbežne s fokálnou rádioterapiou (60 Gy podaných v 30 frakciách). Dávku sa neodporúča znižovať, ale každý týždeň sa má rozhodnúť, či sa podávanie TMZ oddiali alebo preruší, na základe kritérií hematologickej a nehematologickej toxicity. V podávaní TMZ možno pokračovať po dobu 42-dňovej súbežnej fázy (až do 49 dní), ak sú splnené všetky nasledovné podmienky:
- absolútny počet neutrofilov (Absolute Neutrophil Count – ANC) ≥ 1,5 x 109/l
- počet trombocytov ≥ 100 x 109/l
- celkové kritériá toxicity (Common Toxicity Criteria - CTC) nehematologickej toxicity (okrem alopécie, nevoľnosti a vracania) ≤ 1. stupeň.
Počas liečby sa má týždenne vyšetrovať úplný krvný obraz. Podávanie TMZ sa má v priebehu
súbežnej fázy dočasne prerušiť alebo trvalo ukončiť podľa kritérií hematologickej a nehematologickej toxicity, ako je uvedené v Tabuľke 1.
Tabuľka 1. Prerušenie alebo ukončenie podávania TMZ počas
súbežnej rádioterapie a terapie TMZ
|
Toxicita
| Prerušenie TMZa
| Ukončenie TMZ
|
Absolútny počet neutrofilov
| ≥ 0,5 a < 1,5 x 109/l
| < 0,5 x 109/l
|
Počet trombocytov
| ≥ 10 a < 100 x 109/l
| < 10 x 109/l
|
CTC nehematologickej toxicity
(okrem alopécie, nevoľnosti a vra-
cania)
|
CTC 2. stupňa
|
CTC 3. alebo 4. stupňa
|
a: Súbežná liečba s TMZ môže pokračovať, keď sú splnené všetky nasledovné podmienky: absolútny počet neutrofilov ≥ 1,5 x 109/l, počet trombocytov ≥ 100 x 109/l, CTC nehematologickej toxicity ≤ 1. stupeň (okrem alopécie, nevoľnosti a vracania).
Fáza monoterapieŠtyri týždne po ukončení súbežnej fázy TMZ + RT sa TMZ podáva až do 6 cyklov ako monoterapia. Dávka v 1. cykle (monoterapie) je 150 mg/m2 raz denne počas 5 dní, po ktorých nasleduje 23 dní bez liečby. Na začiatku 2. cyklu sa dávka zvýši na 200 mg/m2, ak CTC nehematologickej toxicity (okrem alopécie, nevoľnosti a vracania) za 1. cyklus je ≤ 2. stupeň, absolútny počet neutrofilov (ANC) je ≥ 1,5 x 109/l a počet trombocytov je ≥ 100 x 109/l. Ak sa v 2. cykle dávka nezvýšila, nemá sa zvyšovať ani
v nasledujúcich cykloch. Ak sa dávka už raz zvýšila, zostáva 200 mg/m2 denne počas prvých 5 dní v každom nasledujúcom cykle, s výnimkou objavenia sa toxicity. Znižovanie dávok a prerušovanie
liečby počas fázy monoterapie sa má riadiť podľa Tabuliek 2 a 3.
Počas liečby, sa má 22. deň (21 dní od prvej dávky TMZ) vyšetriť úplný krvný obraz. Dávkovanie sa má znížiť alebo podávanie prerušiť podľa Tabuľky 3.
Tabuľka 2. Stupne dávkovania TMZ pri liečbe monoterapiou
|
Stupeň
dávkovania
| Dávka TMZ (mg/m2/deň)
| Poznámky
|
–1
| 100
| Zníženie kvôli predchádzajúcej toxicite
|
0
| 150
| Dávka počas 1. cyklu
|
1
| 200
| Dávka počas 2. - 6. cyklu, ak sa neobjavila toxicita
|
Tabuľka 3. Znižovanie dávok alebo prerušovanie liečby TMZ počas liečby monoterapiou
|
Toxicita
| Zníženie TMZ o 1 stupeň dávkovaniaa
| Ukončenie TMZ
|
Absolútny počet neutrofilov
| < 1,0 x 109/l
| Pozri poznámku
pod čiarou b
|
Počet trombocytov
| < 50 x 109/l
| Pozri poznámku
pod čiarou b
|
CTC nehematologickej toxicity
(okrem alopécie, nevoľnosti a vra-
cania)
|
CTC 3. stupňa
|
CTC 4b. stupňa
|
a: Stupne dávkovania TMZ sú uvedené v Tabuľke 2.
b: TMZ sa má prerušiť ak:
• pri stupni dávkovania -1 (100 mg/m2) stále pretrváva neakceptovateľná toxicita
• sa po znížení dávky objaví rovnaká nehematologická toxicita 3. stupňa (okrem alopécie, nevoľnosti
a vracania).
D
ospelí a detskí pacienti vo veku 3 rokov alebo starší s rekurentným
a
l
ebo
progredujúcim
m
alígnym
gliómom:
Liečebný cyklus trvá 28 dní. Pacientom, ktorí predtým neboli liečení chemoterapiou, sa TMZ podáva
perorálne v dávke 200 mg/m2 raz denne počas prvých 5 dní, po ktorých nasleduje prerušenie liečby na
23 dní (spolu 28 dní). U pacientov, ktorí predtým boli liečení chemoterapiou, je úvodná dávka
150 mg/m2 raz denne, ktorá sa v druhom cykle zvýši na 200 mg/m2 raz denne počas 5 dní, ak sa neobjaví hematologická toxicita (pozri časť 4.4).
Osobitné skupiny pacientov
Deti a dospievajúci
U trojročných alebo starších pacientov sa TMZ používa iba pri rekurentnom alebo progredujúcom malígnom glióme. Skúsenosti u týchto detí sú veľmi obmedzené (pozri časti 4.4 a 5.1). Bezpečnosť a účinnosť TMZ u detí mladších ako 3 roky neboli stanovené. Nie sú k dispozícii žiadne údaje.
Pacienti s poškodením funkcie pečene alebo obličiek
Farmakokinetika TMZ bola u pacientov s normálnou funkciou pečene a u pacientov s miernym alebo stredne ťažkým poškodením funkcie pečene porovnateľná. Nie sú dostupné údaje o podávaní TMZ pacientom so závažným poškodením funkcie pečene (trieda C podľa Childovej klasifikácie) alebo
s poškodením funkcie obličiek. Vzhľadom na farmakokinetické vlastnosti TMZ nie je pravdepodobné, že by sa u pacientov so závažným poškodením funkcie pečene alebo akýmkoľvek stupňom poškodenia
funkcie obličiek vyžadovali redukcie dávky. Ak sa však TMZ podáva týmto pacientom, má sa im
venovať zvýšená pozornosť.
Starší pacienti
Na základe farmakokinetickej analýzy v populácii pacientov vo veku 19-78 rokov, klírens TMZ nie je ovplyvnený vekom. U starších pacientov (> 70 rokov) sa však zdá, že majú zvýšené riziko neutropénie a trombocytopénie (pozri časť 4.4).
Spôsob podania
Temodal tvrdé kapsuly sa majú podávať nalačno.
Kapsuly sa musia prehltnúť celé a zapiť pohárom vody. Nesmú sa otvárať alebo hrýzť (žuť). Keď vracanie nastúpi po podaní dávky, v ten istý deň sa už nemá podať druhá dávka.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Precitlivenosť na dakarbazín (DTIC).
Závažná myelosupresia (pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
Pneumocystis jirovecii pneumónia
Ukázalo sa, že pacienti, ktorí v pilotnej štúdii dostávali súbežne TMZ a RT počas predĺženého 42-
dňového dávkovania, boli zvlášť ohrození vývojom pneumónie vyvolanej Pneumocystis jirovecii (Pneumocystis jirovecii pneumonia - PCP). Z tohto dôvodu sa u všetkých pacientov, ktorí dostávajú súbežne TMZ a RT počas 42-dňovej schémy (s maximom 49 dní), vyžaduje profylaxia proti PCP, a to
bez ohľadu na počet lymfocytov. Ak sa objaví lymfopénia, pacienti pokračujú v profylaxii až do úpravy lymfopénie na stupeň ≤ 1.
Pri podávaní TMZ počas dlhšej dávkovacej schémy môže byť výskyt PCP vyšší. Avšak, všetci pacienti, ktorí dostávajú TMZ, najmä pacienti, ktorí dostávajú steroidy, musia byť starostlivo sledovaní, či sa u nich nevyvinie PCP, bez ohľadu na schému. U pacientov užívajúcich TMZ najmä v kombinácii s dexametazónom alebo s inými steroidmi, sa hlásili fatálne prípady respiračného zlyhania.
Malignity
Veľmi zriedkavo sa hlásili aj prípady myelodysplastického syndrómu a sekundárnych malignít vrátane
myeloidnej leukémie (pozri časť 4.8).
Antiemetická liečba
S používaním TMZ sa veľmi často spájajú nauzea a vracanie.
Antiemetickú liečbu možno podávať pred alebo následne po podaní TMZ.
Dospelí pacienti s novodiagnostikovaným multiformným glioblastómom
Antiemetická profylaxia sa odporúča pred úvodnou dávkou súbežnej fázy a dôrazne sa odporúča počas
fázy monoterapie.
Pacienti s rekurentným alebo progredujúcimmalígnymgliómom
U pacientov, ktorí v predchádzajúcich liečebných cykloch trpeli závažným vracaním (3. alebo 4.
stupňa), sa môže vyžadovať antiemetická liečba.
Laboratórne parametre
U pacientov liečených TMZ sa môže objaviť myelopuspresia vrátane predĺženej pancytopénie, ktorá
môže viesť k aplastickej anémii, ktorá v niektorých prípadoch viedla k fatálnemu koncu. Expozícia súbežne podávaným liekom spojeným s aplastickou anémiou vrátane karbamazepínu, fenytoínu
a sulfametoxazolu/trimetoprimu v niektorých prípadoch komplikovala posúdenie. Pred zahájením liečby je potrebné, aby laboratórne parametre dosahovali nasledovné hodnoty: ANC ≥ 1,5 x 109/l
a počet trombocytov ≥ 100 x 109/l. Dvadsiaty druhý deň liečby (21 dní po prvej dávke) alebo
v priebehu 48 hodín od tohto dňa a potom raz týždenne sa má vyšetriť úplný krvný obraz, až pokým ANC > 1,5 x 109/l a počet trombocytov > 100 x 109/l. Ak v priebehu ktoréhokoľvek cyklu poklesne ANC na < 1,0 x 109/l alebo je počet trombocytov < 50 x 109/l, dávka sa má v nasledujúcom cykle redukovať o jeden stupeň (pozri časť 4.2). Stupne dávkovania sú 100 mg/m2, 150 mg/m2 a 200 mg/m2. Najnižšia odporúčaná dávka je 100 mg/m2.
Deti a dospievajúci
Nie sú klinické skúsenosti s používaním TMZ u detí mladších ako 3 roky. Skúsenosti so staršími
deťmi a dospievajúcimi sú veľmi obmedzené (pozri časti 4.2 a 5.1).
Starší pacienti (> 70rokov)
Zdá sa, že starší pacienti sú zvýšene ohrození neutropéniou a trombocytopéniou oproti
pacientom mladším. Preto sa má starším pacientom venovať zvláštna starostlivosť, ak sa im podáva
TMZ.
Pacienti mužského pohlavia
Mužov, ktorí majú byť liečení TMZ treba poučiť, aby nesplodili dieťa až 6 mesiacov po užití
poslednej dávky a treba ich poučiť, aby sa ešte pred liečbou poradili o možnosti konzervácie spermií
zmrazením (pozri časť 4.6).
Laktóza
Tento liek obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej
intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento
liek.
4.5 Liekové a iné interakcie
V samostatnej štúdii fázy I podávanie TMZ s ranitidínom neovplyvnilo množstvo absorbovaného temozolomidu alebo expozíciu jeho aktívneho metabolitu monometyl-triazenoimidazol-karboxamidu (MTIC).
Podávanie TMZ s jedlom malo za následok pokles Cmax o 33 % a pokles plochy pod krivkou (AUC)
o 9 %.
Keďže nie je možné vylúčiť, že zmeny Cmax sú klinicky signifikantné, Temodal sa nemá podávať
s jedlom.
Na základe analýzy populačnej farmakokinetiky v klinických skúšaniach II. fázy, nemenilo súbežné podávanie dexametazónu, prochlórperazínu, fenytoínu, karbamazepínu, ondasetrónu, antagonistov H2 receptorov alebo fenobarbitalu klírens TMZ. Súbežné podávanie s kyselinou valproovou bolo spojené s malým, ale štatisticky významným, poklesom klírensu TMZ.
Neboli vykonané štúdie, ktoré by zisťovali účinok TMZ na metabolizmus alebo elimináciu iných liekov. Keďže sa však TMZ nepodlieha metabolizmu v pečeni a vykazuje nízku väzbu na bielkoviny, je jeho vplyv na farmakokinetiku iných liekov nepravdepodobný (pozri časť 5.2).
Použitie TMZ v kombinácii s ďalšími myelosupresívnymi látkami môže zvýšiť pravdepodobnosť
myelosupresie.
Deti a dospievajúci
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú žiadne údaje na gravidných ženách. V predklinických štúdiách na potkanoch a králikoch, ktorí
dostávali 150 mg/m2 TMZ bola dokázaná teratogenita a/alebo fetálna toxicita (pozri časť 5.3).
Temodal sa nemá podávať gravidným ženám. Ak sa musí uvažovať o použití v gravidite, pacientka musí byť oboznámená s možným rizikom pre plod.
Laktácia
Nie je známe, či sa TMZ vylučuje do ľudského mlieka; preto sa má dojčenie počas liečby TMZ
prerušiť.
Ženy vofertilnomveku
Ženy vo fertilnom veku majú byť poučené, aby používali účinnú antikoncepciu na zabránenie
gravidity, pokiaľ užívajú TMZ.
Plodnosť u mužovTMZ môže mať genotoxické účinky. Preto treba mužov, ktorí majú byť ním liečení, poučiť, aby
nesplodili dieťa po dobu až 6 mesiacov po prijatí poslednej dávky a tiež ich treba poučiť, aby sa ešte pred liečbou poradili o možnosti konzervácie spermií zmrazením, pretože existuje možnosť
ireverzibilnej neplodnosti spôsobenej liečbou TMZ.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeTMZ má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje vzhľadom na únavu
a somnolenciu (pozri časť 4.8).
4.8 Nežiaduce účinkySkúsenosti z klinickéhoskúšaniaU pacientov liečených TMZ, či už použitím v kombinácii s RT alebo ako monoterapia s následnou RT
pri novodiagnostikovanom multiformnom glioblastóme, alebo ako monoterapii u pacientov
s rekurentným alebo progredujúcim gliómom boli veľmi často hlásené nežiaduce reakcie podobné:
nauzea, vracanie, zápcha, nechutenstvo, bolesť hlavy a únava. Kŕče boli hlásené veľmi často u pacientov s novodiagnostikovaným multiformným glioblastómom liečených monoterapiou a vyrážka bola hlásená veľmi často u pacientov s novodiagnostikovaným multiformným
glioblastómom liečených TMZ súbežne s RT aj pri monoterapii a často u pacientov s rekurentným
gliómom. Väčšina hematologických nežiaducich reakcií bola hlásená často alebo veľmi často v oboch indikáciách (tabuľky 4 a 5); frekvencia laboratórnych nálezov stupňa 3 – 4 je uvedená po každej
tabuľke.
Nežiaduce účinky sú v tabuľkách uvedené v rámci tried orgánových systémov a frekvencie. Skupiny
frekvencií sú definované podľa nasledovnej konvencie: veľmi časté (≥ 1/10), časté (≥ 1/100, až <
1/10), menej časté (≥ 1/1 000, až < 1/100). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Novodiagnostikovaný multiformný glioblastómTabuľka 4 uvádza nežiaduce udalosti vyskytujúce sa pri liečbe u pacientov s novodiagnostikovaným
multiformným glioblastómom počas súbežnej fázy liečby a fázy monoterapie.
Tabuľka 4. Nežiaduce udalosti vyskytujúce sa pri liečbe počas súbežnej liečby a monoterapie u pacientov s novodiagnostikovaným multiformným glioblastómom
|
Trieda orgánového
systému
| TMZ + súbežná RT
n=288*
| TMZ monoterapia
n=224
|
Infekcie a nákazy
|
Časté:
| infekcia, herpes simplex, infekcia rany,
faryngitída, orálna kandidóza
| infekcia, orálna kandidóza
|
Menej časté:
|
| herpes simplex, herpes zoster,
symptómy podobné chrípke
|
Poruchy krvi a lymfatického systému
|
Časté:
| neutropénia, trombocytopénia,
lymfopénia, leukopénia
| febrilná neutropénia,
trombocytopénia, anémia, leukopénia
|
Menej časté:
| febrilná neutropénia, anémia
| lymfopénia, petechie
|
Poruchy endokrinného systému
|
Menej časté:
|
Cushingoidný stav
|
Cushingoidný stav
|
Poruchy metabolizmu a výživy
|
Veľmi časté:
|
anorexia
|
anorexia
|
Časté
|
hyperglykémia, pokles hmotnosti
|
pokles hmotnosti
|
Menej časté:
|
hypokaliémia, zvýšenie alkalickej
fosfatázy, zvýšenie hmotnosti
|
hyperglykémia, zvýšenie hmotnosti
|
Psychické poruchy
|
Časté:
|
úzkosť, emočná labilita, insomnia
|
úzkosť, depresia, emočná labilita,
insomnia
|
Menej časté:
|
agitácia, apatia, porucha správania,
depresia, halucinácie
|
halucinácie, strata pamäti
|
Poruchy nervového systému
|
Veľmi časté:
|
bolesť hlavy
|
kŕče, bolesť hlavy
|
Časté:
|
kŕče, znížené vedomie, somnolencia,
afázia, porucha rovnováhy, závrat, zmätenosť, zhoršená pamäť, zhoršená koncentrácia, neuropatia, parestézia, porucha reči, tras
|
hemiparéza, afázia, porucha
rovnováhy, somnolencia, zmätenosť, závrat, zhoršená pamäť, zhoršená koncentrácia, dysfázia, neurologická porucha (NOS), neuropatia, periférna neuropatia, parestézia, porucha reči, tras
|
Menej časté:
|
status epilepticus, extrapyramidálna
porucha, hemiparéza, ataxia, kognitívna porucha, dysfázia, nezvyčajná chôdza,
hyperestézia, hypoestézia, neurologická
porucha (NOS), periférna neuropatia
|
hemiplégia, ataxia, nezvyčajná
koordinácia, nezvyčajná chôdza, hyperestézia, senzorická porucha
|
Poruchy oka
|
Časté:
|
rozmazané videnie
|
výpadok v zornom poli, rozmazané
videnie, diplopia
|
Menej časté:
|
hemianopia, znížená zraková ostrosť,
porucha zraku, výpadok v zornom poli, bolesť oka
|
znížená zraková ostrosť, bolesť oka,
suché oči
|
Poruchy ucha a labyrintu
|
Časté:
|
porucha sluchu
|
porucha sluchu, tinitus
|
Menej časté:
|
otitis media, tinitus, zvýšená citlivosť
sluchu, bolesť ucha
|
hluchota, vertigo, bolesť ucha
|
Poruchy srdca a srdcovej činnosti
|
Menej časté:
|
palpitácie
|
|
Poruchy ciev
|
Časté:
|
krvácanie, edém, edém nohy
|
krvácanie, hlboká žilová trombóza,
edém nohy
|
Menej časté:
|
mozgové krvácanie, hypertenzia
|
pľúcna embólia, edém, periférny
edém
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Časté:
|
dýchavičnosť, kašeľ
|
dýchavičnosť, kašeľ
|
Menej časté:
|
pneumónia, infekcia horných dýchacích
ciest, nosová kongescia
|
pneumónia, sinusitída, infekcia
horných dýchacích ciest, bronchitída
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté:
|
zápcha, nauzea, vracanie
|
zápcha, nauzea, vracanie
|
Časté:
|
stomatitída, hnačka, bolesť brucha,
dyspepsia, dysfágia
|
stomatitída, hnačka, dyspepsia,
dysfágia, sucho v ústach
|
Menej časté:
|
|
abdominálna distenzia, inkontinencia
stolice, gastrointestinálna porucha
(NOS), gastroenteritída, hemoroidy
|
Poruchy kože a podkožného tkaniva
|
Veľmi časté:
|
kožná vyrážka, alopécia
|
kožná vyrážka, alopécia
|
Časté:
|
dermatitída, suchá koža, erytém, pruritus
|
suchá koža, pruritus
|
Menej časté:
|
exfoliácia kože, fotosenzitívna reakcia,
nezvyčajná pigmentácia
|
erytém, nezvyčajná pigmentácia,
zvýšené potenie
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
Časté:
|
svalová slabosť, artralgia
|
svalová slabosť, artralgia,
muskuloskeletálna bolesť, myalgia
|
Menej časté:
|
myopatia, bolesť chrbta,
muskuloskeletálna bolesť, myalgia
|
myopatia, bolesť chrbta
|
Poruchy obličiek a močových ciest
|
Časté:
|
zvýšené močenie, inkontinencia moču
|
inkontinencia moču
|
Menej časté:
|
|
dyzúria
|
Poruchy reprodukčného systému a prsníkov
|
Menej časté:
|
impotencia
|
krvácanie z pošvy, menorágia,
amenorea, vaginitída, bolesť prsníka
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté:
|
únava
|
únava
|
Časté:
|
alergická reakcia, horúčka, radiačné
poškodenie, opuch tváre, bolesť, porucha chuti
|
alergická reakcia, horúčka, radiačné
poškodenie, bolesť, porucha chuti
|
Menej časté:
|
asténia, sčervenenie, návaly tepla,
zhoršenie stavu, zimnica, zmena farby jazyka, porucha čuchu, smäd
|
asténie, opuch tváre, bolesť, zhoršenie
stavu, zimnica, porucha zuba, porucha chuti
|
Laboratórne a funkčné vyšetrenia
|
Časté:
|
zvýšenie ALT
|
zvýšenie ALT
|

Menej časté: Zvýšenie pečeňových enzýmov, zvýšenie gamma GT, zvýšenie AST
*Pacient randomizovaný do ramena so samotnou RT, dostával TMZ + RT.
Laboratórne výsledkyPozorovala sa myelosupresia (neutropénia a trombocytopénia), známa ako dávku limitujúca toxicita pre väčšinu cytotoxických látok, vrátane TMZ. Keď sa skombinovali laboratórne abnormality
a nežiaduce udalosti z oboch fáz liečby, súbežnej aj monoterapie, pozorovali sa abnormality neutrofilov 3. alebo 4. stupňa, vrátane neutropenických udalostí, u 8 % pacientov. Abnormality
trombocytov 3. alebo 4.stupňa, vrátane trombocytopenických udalostí, sa pozorovali u 14 %
pacientov, ktorí dostávali TMZ.
Rekurentný alebo progredujúcimalígnygliómV klinických skúšaniach boli najčastejšie sa vyskytujúce nežiaduce účinky súvisiace s liečbou
gastrointestinálne poruchy, konkrétne nauzea (43 %) a vracanie (36 %). Tieto reakcie dosahovali zvyčajne 1. alebo 2. stupeň (0 – 5 epizód vracania za 24 hodín) a buď spontánne ustúpili, alebo boli
ľahko zvládnuté štandardnou antiemetickou liečbou. Incidencia závažnej nauzey a vracania bola 4 %.
Nežiaduce účinky zaznamenané počas klinických skúšaní s rekurentným alebo progredujúcim malígnym gliómom a následne po uvedení Temodalu do obehu sú zhrnuté v Tabuľke 5.
Tabuľka 5. Nežiaduce reakcie u pacientov s rekurentným alebo progredujúcim malígnym gliómom
|
Infekcie a nákazy
|
Zriedkavé
| oportúnne infekcie vrátane PCP
|
Poruchy krvi a lymfatického systému
|
Veľmi časté:
| neutropénia alebo lymfopénia (3. – 4. stupeň),
trombocytopénia (3. – 4. stupeň)
|
Menej časté:
| pancytopénia, anémia (3. – 4. stupeň), leukopénia
|
Poruchy metabolizmu a výživy
|
Veľmi časté:
| anorexia
|
Časté:
| pokles hmotnosti
|
Poruchy nervového systému
|
Veľmi časté:
| bolesť hlavy
|
Časté:
| somnolencia, závrat, parestézia
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Časté:
| dyspnoe
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté:
| vracanie, nauzea, zápcha
|
Časté:
| hnačka, bolesť brucha, dyspepsia
|
Poruchy kože a podkožného tkaniva
|
Časté:
| kožná vyrážka, pruritus, alopécia
|
Veľmi zriedkavé:
| multiformný erytém, erytrodermia, urtikária, exantém
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté:
| únava
|
Časté:
| horúčka, asténia, zimnica, nevoľnosť, bolesť, zmena
chuti
|
Veľmi zriedkavé:
| alergické reakcie vrátane anafylaxie, angioedém
|
Laboratórne výsledky
Trombocytopénia a neutropénia 3. alebo 4. stupňa sa vyskytli u 19 %, resp. 17 % pacientov liečených na malígny glióm. Toto viedlo k hospitalizácii v 8 % a/alebo k prerušeniu liečby TMZ v 4 %. Myelosupresia bola predvídateľná (zvyčajne v priebehu niekoľko prvých cyklov, s najnižšími hodnotami medzi 21. a 28. dňom) a zotavenie nastalo rýchle, zvyčajne behom 1 – 2 týždňov. Výskyt kumulatívnej myelosupresie sa nepozoroval. Prítomnosť trombocytopénie môže zvýšiť riziko krvácania a prítomnosť neutropénie alebo leukopénie môže zvýšiť riziko infekcie.
Pohlavie
Podľa farmakokinetickej analýzy populácie klinického skúšania bola hodnota najnižšieho počtu (NADIR) neutrofilov dostupná u 101 žien a 169 mužov a hodnota najnižšieho počtu krvných doštičiek u 110 žien a 174 mužov. V prvom cykle liečby bol u žien v porovnaní s mužmi vyšší výskyt neutropénie 4. stupňa (ANC < 0,5 x 109/l), 12 % vs. 5 %, a trombocytopénie 4. stupňa (< 20 x 109/l),
9 % vs. 3 %. V súbore informácií od 400 jedincov s rekurentným gliómom sa v prvom cykle liečby objavila neutropénia 4. stupňa u 8 % žien v porovnaní so 4 % mužov. V štúdii s 288 jedincami
s novodiagnostikovaným multiformným glioblastómom sa v prvom cykle liečby objavila neutropénia
4. stupňa u 3 % žien v porovnaní s 0 % mužov a trombocytopénia 4. stupňa u 1 % žien v porovnaní s 0 % mužov.
Deti a dospievajúci
Perorálny TMZ sa skúmal u detských a dospievajúcich pacientov (vo veku 3-18 rokov) s rekurentným
gliómom mozgového kmeňa alebo s rekurentným astrocytómom vysokého stupňa v dávkovacom režime podávanom denne počas 5 dní každých 28 dní. Hoci sú údaje obmedzené, očakáva sa, že znášanlivosť u detí bude rovnaká ako u dospelých. Bezpečnosť TMZ u detí mladších ako 3 roky sa nestanovila.
Skúsenosti po uvedeníliekunatrh
Antineoplastické látky, a zvlášť alkylačné látky, boli spojené s potenciálnym rizikom
myelodysplastického syndrómu (MDS) a sekundárnych malignít, vrátane leukémie. U pacientov, liečených režimami s TMZ, boli hlásené veľmi zriedkavé prípady MDS a sekundárnych malignít,
vrátane myeloidnej leukémie. Bola hlásená predĺžená pancytopénia, ktorá môže vyústiť do aplastickej
anémie a v niektorých prípadoch viedla k fatálnemu koncu.
Veľmi zriedkavo boli hlásené prípady toxickej epidermálnej nekrolýzy a Stevens-Johnsonovho syndrómu.
Veľmi zriedkavo sa hlásili prípady intersticiálnej pneumonitídy/pneumonitídy, fibrózy pľúc
a fatálneho respiračného zlyhania.
Boli hlásené prípady hepatotoxicity vrátane zvýšenia hladín pečeňových enzýmov, hyperbilirubinémie, cholestázy a hepatitídy.
4.9 Predávkovanie
U pacientov sa klinicky hodnotili dávky 500, 750, 1 000 a 1 250 mg/m2 (celková dávka na cyklus počas 5 dní). Toxicita limitujúca dávku bola hematologická a táto bola hlásená pri všetkých dávkach, ale predpokladá sa, že bude závažnejšia pri vyšších dávkach. Jeden pacient sa predávkoval užitím dávky 10 000 mg (celková dávka v jednom cykle počas 5 dní). Nežiaduce reakcie hlásené pri tomto predávkovaní boli pancytopénia, pyrexia, multiorgánové zlyhanie a smrť. Existujú záznamy
o pacientoch, ktorí užívali odporúčanú dávku po dobu viac ako 5 dní liečby (až do 64 dní), pričom hlásené nežiaduce udalosti zahŕňali útlm kostnej drene s infekciou alebo bez nej, ktoré boli
v niektorých prípadoch závažné a pretrvávali dlhšiu dobu a skončili sa smrťou. V prípade
predávkovania je potrebné hematologické vyšetrenie. V prípade potreby sa majú vykonať podporné
opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Cytostatiká - Iné alkylačné látky, ATC kód: L01A X03
Spôsob účinkuTemozolomid je triazén, ktorý pri fyziologickom pH podlieha rýchlej chemickej konverzii na aktívny
monometyl-triazenoimidazol-karboxamid (MTIC). Predpokladá sa, že cytotoxicitu MTIC primárne spôsobuje alkylácia na pozícii O6 guanínu, spolu s ďalšou alkyláciou na pozícii N7. Cytotoxické lézie, ktoré sa rozvinú následne, pravdepodobne zapríčiňuje aberantná oprava metylovaného aduktu.
Klinická účinnosť abezpečnosťNovodiagnostikovaný multiformný glioblastómCelkovo 573 pacientov bolo randomizovaných tak, aby dostávali buď TMZ + RT (n=287), alebo RT
samotnú (n = 286). Pacienti v ramene TMZ + RT súbežne dostávali TMZ (75 mg/m2) raz denne, začínajúc v prvý deň RT až do posledného dňa RT, po dobu 42 dní (s maximom 49 dní). Potom
nasledovala monoterapia TMZ (150 - 200 mg/m2) 1. – 5. deň počas každého 28-dňového cyklu.
Liečba trvala až 6. cyklov a začínalo sa s ňou 4 týždne po ukončení RT. Pacienti v kontrolnom ramene
dostávali len RT. Počas RT a aj kombinovanej liečby TMZ sa vyžadovala profylaxia proti pneumónii spôsobenej
Pneumocystis jirovecii (PCP).
TMZ sa podával ako záchranná terapia vo fáze sledovania po liečbe 161 pacientom z 282 (57 %)
z ramena so samotnou RT a 62 pacientom z 277 (22 %) z ramena TMZ + RT.
Pomer rizika (Hazard ratio - HR) celkového prežívania bol 1,59 (95 % CI pre HR = 1,33 – 1,91) s log- rank p < 0,0001 v prospech ramena s TMZ. Odhadovaná pravdepodobnosť prežívania 2 alebo viac rokov (26 % vs. 10 %) bola vyššia v ramene RT + TMZ. Súbežné pridanie TMZ k RT, s následnou monoterapiou TMZ, pri liečbe pacientov s novodiagnostikovaným multiformným glioblastómom preukázalo štatisticky významné zlepšenie celkového prežívania (Overall Survival – OS) v porovnaní so samotnou RT (Obrázok 1).
 Obrázok 1 Kaplan-Meierove krivky celkového prežívania (Intent to Treat – populácia, v ktorej bola liečba zamýšľaná)
Obrázok 1 Kaplan-Meierove krivky celkového prežívania (Intent to Treat – populácia, v ktorej bola liečba zamýšľaná)
Výsledky zo skúšania neboli konzistentné v podskupine pacientov so slabým výkonnostným stavom (WHO PS = 2, n = 70), v ktorej bolo celkové prežívanie a čas do progresie podobné v oboch ramenách. Nezdá sa však, že by v tejto skupine pacientov boli prítomné neprijateľné riziká.
Rekurentný alebo progredujúcimalígnyglióm
Údaje o klinickej účinnosti u pacientov s multiformným glioblastómom (Karnofského skóre
[Karnofsky perfomance status – KPS] ≥70), progredujúcom alebo recidivujúcom po chirurgickej terapii a RT, sú založené na dvoch klinických skúšaniach s perorálnym TMZ. Jedno bolo nekomparatívne skúšanie u 138 pacientov (predtým dostávalo chemoterapiu 29 %) a druhé bolo randomizované aktívne kontrolované skúšanie TMZ vs prokarbazínu u celkovo 225 pacientov (pred liečbou dostávalo chemoterapiu na báze nitrózourey 67 % pacientov). Primárnym cieľom oboch skúšaní bolo stanoviť prežívanie bez progresie nádoru (progression free survival – PFS), definované MRI zobrazením alebo neurologickým zhoršením. V nekomparatívnom skúšaní bolo PFS v 6. mesiaci
19 %, medián prežívania bez progresie nádoru bol 2,1 mesiaca a medián celkového prežívania 5,4 mesiaca. Častosť objektívnej odpovede (Objective response rate – ORR), založená na MRI zobrazení, bola 8 %.
V randomizovanom aktívne kontrolovanom klinickom skúšaní bolo 6-mesačné PFS signifikantne dlhšie u TMZ než u prokarbazínu (21 % oproti 8 %, chí-kvadrát p = 0,008) s mediánom PFS 2,89 mesiacov pre TMZ a 1,88 mesiacov pre prokarbazín (log rank p = 0,0063). Medián prežívania pre
TMZ bol 7,34 mesiaca a pre prokarbazín 5,66 mesiacov (log rank p = 0,33). Po 6 mesiacoch bol podiel prežívajúcich pacientov signifikantne vyšší v TMZ ramene (60 %) oproti ramenu s prokarbazínom
(44 %) (chí-kvadrát p = 0,019). U pacientov s predchádzajúcou chemoterapiou bol zaznamenaný
prínos u tých, ktorých KPS bolo ≥ 80.
Údaje o čase do zhoršenia neurologického stavu boli v prospech TMZ oproti prokarbazínu, takisto ako údaje o čase do zhoršenia celkového stavu (pokles na KPS na < 70 alebo pokles o najmenej 30 bodov). Mediány časov do progresie nádoru podľa týchto cieľov boli u TMZ dlhšie v rozsahu 0,7 až 2,1 mesiaca než u prokarbazínu (log rank p = < 0,01 – 0,03).
Rekurentný anaplastický astrocytóm
V multicentrickom, prospektívnom klinickom skúšaní II. fázy, v ktorom sa vyhodnocovala bezpečnosť
a účinnosť liečby perorálnym TMZ u pacientov s anaplastickým astrocytómom pri prvom relapse, bolo 6-mesačné PFS 46 %. Medián PFS bol 5,4 mesiaca. Medián celkového prežívania bol 14,6 mesiacov. V populácii pacientov, u ktorých bola liečba zamýšľaná (ITT) n=162, bola, podľa zhodnotenia centrálnym recenzentom, častosť odpovede 35 % (13 dosiahlo kompletnú remisiu a 43 parciálnu). Stabilné ochorenie bolo hlásené u 43 pacientov. 6-mesačné prežívanie bez príhody bolo
v ITT populácii 44 % s mediánom prežívania bez príhody 4,6 mesiacov, čo bolo podobné výsledkom prežívania bez progresie. Výsledky účinnosti boli podobné aj u populácie, ktorá bola vhodná na histológiu. Dosiahnutie rádiologicky objektívnej odpovede alebo udržania stavu bez progresie bolo silne viazané s udržanou alebo zlepšenou kvalitou života.
Deti a dospievajúci
Perorálny TMZ sa skúmal u detských a dospievajúcich pacientov (vo veku 3-18 rokov) s rekurentným
gliómom mozgového kmeňa alebo rekurentným astrocytómom vysokého stupňa v dávkovacom režime podávanom denne počas 5 dní každých 28 dní. Tolerancia na TMZ je podobná ako u dospelých.
5.2 Farmakokinetické vlastnosti
TMZ sa pri fyziologickom pH spontánne hydrolyzuje na primárne účinné zložky, 3-metyl-(triazén-1- yl)imidazol-4-karboxamid (MTIC). MTIC sa spontánne hydrolyzuje na 5-aminoimidazol-4- karboxamid (AIC), známy medziprodukt pri biosyntéze purínu a nukleovej kyseliny, a na metylhydrazín, ktorý sa považuje za účinnú alkylačnú zložku. Predpokladá sa, že za cytotoxicitu
MTIC je primárne zodpovedná alkylácia DNA, predovšetkým na pozíciách O6 a N7 guanínu.
V závislosti od AUC TMZ je expozícia MTIC ~ 2,4 % a expozícia AIC ~ 23 %. In vivo bol t1/2 MTIC
podobný t1/2 TMZ, a to 1,8 hod.
Absorpcia
Po perorálnom podaní dospelým pacientom sa TMZ vstrebáva rýchlo a maximálne koncentrácie sa
dosahujú už za 20 minút po podaní (priemerný čas medzi 0,5 a 1,5 hodinou). Po perorálnom podaní TMZ označeného 14C, počas 7 dní po podaní, bola priemerná exkrécia 14C stolicou 0,8 %, čo ukazuje na jeho úplnú absorpciu.
Distribúcia
TMZ vykazuje nízku väzbu na bielkoviny (10 % až 20 %), a preto sa neočakáva jeho interakcia
s látkami, ktoré sa silne viažu na bielkoviny.
PET štúdie u ľudí, ako aj predklinické údaje ukazujú, že TMZ rýchlo prechádza hematoencefalickou bariérou a je prítomný v mozgovomiechovom moku. Prienik do mozgovomiechového moku bol potvrdený u jedného pacienta; meraním AUC sa zistilo, že koncentrácia TMZ v mozgovomiechovom moku dosahuje približne 30 % hladín v plazme, čo zodpovedá údajom zisteným u zvierat.
Eliminácia
Polčas (t1/2) v plazme je približne 1,8 hodín. Hlavnou cestou vylučovania 14C sú obličky. Po perorálnom podaní sa močom vylúči približne 5 % až 10 % dávky v nezmenenej forme v priebehu 24 hodín. Zvyšok sa vylúči ako kyselina temozolomidová, 5-aminoimidazol-4-karboxamid (AIC) alebo ako neidentifikované polárne metabolity.
Plazmatické koncentrácie stúpajú v závislosti od podanej dávky. Plazmatický klírens, distribučný objem a polčas sú nezávislé od podanej dávky.
Osobitné skupiny pacientov
Analýza populačnej farmakokinetiky TMZ ukázala, že plazmatický klírens TMZ bol nezávislý od
veku pacienta, renálnych funkcií alebo od fajčenia. V inej farmakokinetickej štúdii boli plazmatické
farmakokinetické profily u pacientov s miernym alebo stredne ťažkým poškodením funkcie pečene podobné plazmatickým farmakokinetickým profilom, pozorovaným u pacientov s normálnou funkciou pečene.
Detskí pacienti mali vyššie AUC ako dospelí pacienti; avšak maximálna tolerovaná dávka (MTD) bola
1 000 mg/m2/cyklus u detí aj u dospelých.
5.3 Predklinické údaje o bezpečnosti
Boli vykonané jednocyklové (5-dní podávanie, 23 dní bez liečby), 3- a 6-cyklové štúdie toxicity na potkanoch a psoch. Toxicita sa primárne prejavila na kostnej dreni, lymforetikulárnom systéme, testes a gastrointestinálnom trakte. Vo vyšších dávkach, ktoré boli letálne pre 60 % až 100 % testovaných potkanov a psov, došlo ku degenerácii sietnice. Väčšina toxických zmien sa ukázala byť reverzibilných, výnimkou boli nežiaduce udalosti na mužský reprodukčný systém a degenerácia sietnice. Keďže sa však dávky, ktoré zapríčinili degeneráciu sietnice, pohybovali v rozmedzí letálnych dávok a porovnateľný účinok nebol pozorovaný v klinických štúdiách, tento nález sa nepokladá za klinicky významný.
TMZ je embryotoxická, teratogénna a genotoxická alkylačná látka. TMZ je toxickejší pre potkany
a psov ako pre ľudí a klinická dávka sa približuje minimálnej letálnej dávke u potkanov a u psov. Na dávke závislé redukcie leukocytov a trombocytov sa javia ako senzitívne indikátory toxicity. V 6- cyklovej štúdii na potkanoch sa zaznamenali rôzne nádory, vrátane mamárnych karcinómov,
keratoakantómov kože a bazocelulárnych adenómov, zatiaľ čo v štúdiách na psoch sa nádory alebo predneoplastické zmeny nezistili. Potkany sa javia byť zvlášť citlivé na onkogénne účinky TMZ, pričom prvé nádory sa zjavujú v priebehu 3 mesiacov od začiatku podávania. Táto doba latencie je veľmi krátka aj pre alkylačnú látku.
Testy chromozómových aberácií Ames/salmonely a ľudských lymfocytov z periférnej krvi (Human
Peripheral Blood Lymphocyte - HPBL) ukázali pozitívnu mutagénnnu odpoveď.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsahkapsuly: bezvodá laktóza, koloidný oxid kremičitý,
sodná soľ karboxymetylškrobu typu A, kyselina vínna,
kyselina stearová.
Obalkapsuly:
želatína,
oxid titaničitý (E 171),
laurylsíran sodný,
indigokarmín (E 132).
Potlač: šelak, propylénglykol, čistená voda, hydroxid amónny, hydroxid draselný,
čierny oxid železitý (E 172).
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Balenie vo fľaši
Uchovávajte pri teplote neprevyšujúcej 30 °C.
Uchovávajte v pôvodnej fľaši na ochranu pred vlhkosťou. Fľašu udržiavajte dôkladne uzatvorenú.
Balenie vo vrecku
Uchovávajte pri teplote neprevyšujúcej 30 °C.
6.5 Druh obalu a obsah balenia
B
alenie vo fľašiFľašky z jantárového skla typu I s polypropylénovými uzávermi bezpečnými pred deťmi obsahujúce 5
alebo 20 tvrdých kapsúl. Škatuľka obsahuje jednu fľašu.
Balenie vo vreckuVrecká sa skladajú z lineárneho polyetylénu s nízkou hustotou (najvnútornejšia vrstva), hliníka
a polyetyléntereftalátu.
Každé vrecko obsahuje 1 tvrdú kapsulu a dodáva sa v papierovej škatuli.
Škatuľa obsahuje 5 alebo 20 tvrdých kapsúl jednotlivo uzatvorených vo vreckách. Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a
iné zaobchádzanie s liekomKapsuly sa nesmú otvárať. Ak je kapsula poškodená, musíte zabrániť kontaktu práškového obsahu
s kožou alebo sliznicou. Ak sa Temodal dostane do kontaktu s kožou alebo sliznicou, okamžite a dôkladne sa musí postihnutá oblasť umyť mydlom a vodou.
Pacientov treba poučiť, aby kapsuly uchovávali mimo dohľadu a dosahu detí, najlepšie v uzamknutej skrini. Náhodné prehltnutie môže byť pre deti smrteľné.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMerck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU
Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/98/096/009
EU/1/98/096/010
EU/1/98/096/017
EU/1/98/096/018
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 26. január 1999. Dátum posledného predĺženia: 26. január 2009.
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu
1. NÁZOV LIEKU
Temodal 180 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá tvrdá kapsula obsahuje 180 mg temozolomidu.
Pomocnálátkasoznámymúčinkom:
Každá tvrdá kapsula obsahuje 316,3 mg bezvodej laktózy. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tvrdá kapsula.
Tvrdé kapsuly majú nepriehľadné biele telo kapsuly, nepriehľadný oranžový vrchnáčik a sú potlačené čiernym atramentom. Na vrchnáčiku je vytlačené „Temodal“. Na tele kapsuly je vytlačené „180 mg“, logo Schering-Plough a dva pásiky.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Temodal je indikovaný na liečbu:
- dospelých pacientov s novodiagnostikovaným multiformným glioblastómom súbežne
s rádioterapiou (RT) a následne ako monoterapia
- detí od troch rokov, dospievajúcich a dospelých pacientov s malígnym gliómom, ako je multiformný glioblastóm alebo anaplastický astrocytóm, u ktorých došlo po štandardnej terapii
k recidíve alebo progresii ochorenia.
4.2 Dávkovanie a spôsob podávania
Temodal majú predpisovať iba lekári skúsení v onkologickej liečbe nádorov mozgu. Možno podávať antiemetickú liečbu (pozri časť 4.4).
Dávkovanie
Dospelí pacienti s novodiagnostikovaným multiformným glioblastómom
Temodal sa podáva v kombinácii s fokálnou rádioterapiou (súbežná fáza) nasledovanou až do 6 cyklov
monoterapie temozolomidom (TMZ) (fáza monoterapie).
Súbežná fáza
TMZ sa podáva perorálne v dávke 75 mg/m2 denne po dobu 42 dní súbežne s fokálnou rádioterapiou (60 Gy podaných v 30 frakciách). Dávku sa neodporúča znižovať, ale každý týždeň sa má rozhodnúť, či sa podávanie TMZ oddiali alebo preruší, na základe kritérií hematologickej a nehematologickej toxicity. V podávaní TMZ možno pokračovať po dobu 42-dňovej súbežnej fázy (až do 49 dní), ak sú splnené všetky nasledovné podmienky:
- absolútny počet neutrofilov (Absolute Neutrophil Count – ANC) ≥ 1,5 x 109/l
- počet trombocytov ≥ 100 x 109/l
- celkové kritériá toxicity (Common Toxicity Criteria - CTC) nehematologickej toxicity (okrem alopécie, nevoľnosti a vracania) ≤ 1. stupeň.
Počas liečby sa má týždenne vyšetrovať úplný krvný obraz. Podávanie TMZ sa má v priebehu
súbežnej fázy dočasne prerušiť alebo trvalo ukončiť podľa kritérií hematologickej a nehematologickej toxicity, ako je uvedené v Tabuľke 1.
Tabuľka 1. Prerušenie alebo ukončenie podávania TMZ počas
súbežnej rádioterapie a terapie TMZ
|
Toxicita
| Prerušenie TMZa
| Ukončenie TMZ
|
Absolútny počet neutrofilov
| ≥ 0,5 a < 1,5 x 109/l
| < 0,5 x 109/l
|
Počet trombocytov
| ≥ 10 a < 100 x 109/l
| < 10 x 109/l
|
CTC nehematologickej toxicity
(okrem alopécie, nevoľnosti a vra-
cania)
|
CTC 2. stupňa
|
CTC 3. alebo 4. stupňa
|
a: Súbežná liečba s TMZ môže pokračovať, keď sú splnené všetky nasledovné podmienky: absolútny počet neutrofilov ≥ 1,5 x 109/l, počet trombocytov ≥ 100 x 109/l, CTC nehematologickej toxicity ≤ 1. stupeň (okrem alopécie, nevoľnosti a vracania).
Fáza monoterapieŠtyri týždne po ukončení súbežnej fázy TMZ + RT sa TMZ podáva až do 6 cyklov ako monoterapia. Dávka v 1. cykle (monoterapie) je 150 mg/m2 raz denne počas 5 dní, po ktorých nasleduje 23 dní bez liečby. Na začiatku 2. cyklu sa dávka zvýši na 200 mg/m2, ak CTC nehematologickej toxicity (okrem alopécie, nevoľnosti a vracania) za 1. cyklus je ≤ 2. stupeň, absolútny počet neutrofilov (ANC) je ≥ 1,5 x 109/l a počet trombocytov je ≥ 100 x 109/l. Ak sa v 2. cykle dávka nezvýšila, nemá sa zvyšovať ani
v nasledujúcich cykloch. Ak sa dávka už raz zvýšila, zostáva 200 mg/m2 denne počas prvých 5 dní v každom nasledujúcom cykle, s výnimkou objavenia sa toxicity. Znižovanie dávok a prerušovanie
liečby počas fázy monoterapie sa má riadiť podľa Tabuliek 2 a 3.
Počas liečby, sa má 22. deň (21 dní od prvej dávky TMZ) vyšetriť úplný krvný obraz. Dávkovanie sa má znížiť alebo podávanie prerušiť podľa Tabuľky 3.
Tabuľka 2. Stupne dávkovania TMZ pri liečbe monoterapiou
|
Stupeň
dávkovania
| Dávka TMZ (mg/m2/deň)
| Poznámky
|
–1
| 100
| Zníženie kvôli predchádzajúcej toxicite
|
0
| 150
| Dávka počas 1. cyklu
|
1
| 200
| Dávka počas 2. - 6. cyklu, ak sa neobjavila toxicita
|
Tabuľka 3. Znižovanie dávok alebo prerušovanie liečby TMZ počas liečby
monoterapiou
|
Toxicita
| Zníženie TMZ o 1 stupeň dávkovaniaa
| Ukončenie TMZ
|
Absolútny počet neutrofilov
| < 1,0 x 109/l
| Pozri poznámku
pod čiarou b
|
Počet trombocytov
| < 50 x 109/l
| Pozri poznámku
pod čiarou b
|
CTC nehematologickej toxicity
(okrem alopécie, nevoľnosti a vra-
cania)
|
CTC 3. stupňa
|
CTC 4b. stupňa
|
a: Stupne dávkovania TMZ sú uvedené v Tabuľke 2.
b: TMZ sa má prerušiť ak:
• pri stupni dávkovania -1 (100 mg/m2) stále pretrváva neakceptovateľná toxicita
• sa po znížení dávky objaví rovnaká nehematologická toxicita 3. stupňa (okrem alopécie, nevoľnosti
a vracania).
D
ospelí a detskí pacienti vo veku 3 rokov alebo starší s rekurentným
a
l
ebo
progredujúcim
m
alígnym
gliómom:
Liečebný cyklus trvá 28 dní. Pacientom, ktorí predtým neboli liečení chemoterapiou, sa TMZ podáva
perorálne v dávke 200 mg/m2 raz denne počas prvých 5 dní, po ktorých nasleduje prerušenie liečby na
23 dní (spolu 28 dní). U pacientov, ktorí predtým boli liečení chemoterapiou, je úvodná dávka
150 mg/m2 raz denne, ktorá sa v druhom cykle zvýši na 200 mg/m2 raz denne počas 5 dní, ak sa neobjaví hematologická toxicita (pozri časť 4.4).
Osobitné skupiny pacientov
Deti a dospievajúci
U trojročných alebo starších pacientov sa TMZ používa iba pri rekurentnom alebo progredujúcom malígnom glióme. Skúsenosti u týchto detí sú veľmi obmedzené (pozri časti 4.4 a 5.1). Bezpečnosť a účinnosť TMZ u detí mladších ako 3 roky neboli stanovené. Nie sú k dispozícii žiadne údaje.
Pacienti s poškodením funkcie pečene alebo obličiek
Farmakokinetika TMZ bola u pacientov s normálnou funkciou pečene a u pacientov s miernym alebo stredne ťažkým poškodením funkcie pečene porovnateľná. Nie sú dostupné údaje o podávaní TMZ pacientom so závažným poškodením funkcie pečene (trieda C podľa Childovej klasifikácie) alebo
s poškodením funkcie obličiek. Vzhľadom na farmakokinetické vlastnosti TMZ nie je pravdepodobné, že by sa u pacientov so závažným poškodením funkcie pečene alebo akýmkoľvek stupňom poškodenia
funkcie obličiek vyžadovali redukcie dávky. Ak sa však TMZ podáva týmto pacientom, má sa im
venovať zvýšená pozornosť.
Starší pacienti
Na základe farmakokinetickej analýzy v populácii pacientov vo veku 19-78 rokov, klírens TMZ nie je ovplyvnený vekom. U starších pacientov (> 70 rokov) sa však zdá, že majú zvýšené riziko neutropénie a trombocytopénie (pozri časť 4.4).
Spôsob podania
Temodal tvrdé kapsuly sa majú podávať nalačno.
Kapsuly sa musia prehltnúť celé a zapiť pohárom vody. Nesmú sa otvárať alebo hrýzť (žuť). Keď vracanie nastúpi po podaní dávky, v ten istý deň sa už nemá podať druhá dávka.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Precitlivenosť na dakarbazín (DTIC). Závažná myelosupresia (pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
Pneumocystis jirovecii pneumónia
Ukázalo sa, že pacienti, ktorí v pilotnej štúdii dostávali súbežne TMZ a RT počas predĺženého 42-
dňového dávkovania, boli zvlášť ohrození vývojom pneumónie vyvolanej Pneumocystis jirovecii (Pneumocystis jirovecii pneumonia - PCP). Z tohto dôvodu sa u všetkých pacientov, ktorí dostávajú súbežne TMZ a RT počas 42-dňovej schémy (s maximom 49 dní), vyžaduje profylaxia proti PCP, a to'
bez ohľadu na počet lymfocytov. Ak sa objaví lymfopénia, pacienti pokračujú v profylaxii až do úpravy lymfopénie na stupeň ≤ 1.
Pri podávaní TMZ počas dlhšej dávkovacej schémy môže byť výskyt PCP vyšší. Avšak, všetci pacienti, ktorí dostávajú TMZ, najmä pacienti, ktorí dostávajú steroidy, musia byť starostlivo sledovaní, či sa u nich nevyvinie PCP, bez ohľadu na schému. U pacientov užívajúcich TMZ najmä v kombinácii s dexametazónom alebo s inými steroidmi, sa hlásili fatálne prípady respiračného zlyhania.
Malignity
Veľmi zriedkavo sa hlásili aj prípady myelodysplastického syndrómu a sekundárnych malignít vrátane
myeloidnej leukémie (pozri časť 4.8).
Antiemetická liečba
S používaním TMZ sa veľmi často spájajú nauzea a vracanie.
Antiemetickú liečbu možno podávať pred alebo následne po podaní TMZ.
Dospelí pacienti s novodiagnostikovaným multiformným glioblastómom
Antiemetická profylaxia sa odporúča pred úvodnou dávkou súbežnej fázy a dôrazne sa odporúča počas
fázy monoterapie.
Pacienti s rekurentným alebo progredujúcimmalígnymgliómom
U pacientov, ktorí v predchádzajúcich liečebných cykloch trpeli závažným vracaním (3. alebo 4.
stupňa), sa môže vyžadovať antiemetická liečba.
Laboratórne parametre
U pacientov liečených TMZ sa môže objaviť myelopuspresia vrátane predĺženej pancytopénie, ktorá
môže viesť k aplastickej anémii, ktorá v niektorých prípadoch viedla k fatálnemu koncu. Expozícia súbežne podávaným liekom spojeným s aplastickou anémiou vrátane karbamazepínu, fenytoínu
a sulfametoxazolu/trimetoprimu v niektorých prípadoch komplikovala posúdenie. Pred zahájením liečby je potrebné, aby laboratórne parametre dosahovali nasledovné hodnoty: ANC ≥ 1,5 x 109/l
a počet trombocytov ≥ 100 x 109/l. Dvadsiaty druhý deň liečby (21 dní po prvej dávke) alebo
v priebehu 48 hodín od tohto dňa a potom raz týždenne sa má vyšetriť úplný krvný obraz, až pokým ANC > 1,5 x 109/l a počet trombocytov > 100 x 109/l. Ak v priebehu ktoréhokoľvek cyklu poklesne ANC na < 1,0 x 109/l alebo je počet trombocytov < 50 x 109/l, dávka sa má v nasledujúcom cykle redukovať o jeden stupeň (pozri časť 4.2). Stupne dávkovania sú 100 mg/m2, 150 mg/m2 a 200 mg/m2. Najnižšia odporúčaná dávka je 100 mg/m2.
Deti a dospievajúci
Nie sú klinické skúsenosti s používaním TMZ u detí mladších ako 3 roky. Skúsenosti so staršími
deťmi a dospievajúcimi sú veľmi obmedzené (pozri časti 4.2 a 5.1).
Starší pacienti (> 70rokov)
Zdá sa, že starší pacienti sú zvýšene ohrození neutropéniou a trombocytopéniou oproti
pacientom mladším. Preto sa má starším pacientom venovať zvláštna starostlivosť, ak sa im podáva
TMZ.
Pacienti mužského pohlavia
Mužov, ktorí majú byť liečení TMZ treba poučiť, aby nesplodili dieťa až 6 mesiacov po užití
poslednej dávky a treba ich poučiť, aby sa ešte pred liečbou poradili o možnosti konzervácie spermií
zmrazením (pozri časť 4.6)
Laktóza
Tento liek obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej
intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento
liek.
4.5 Liekové a iné interakcie
V samostatnej štúdii fázy I podávanie TMZ s ranitidínom neovplyvnilo množstvo absorbovaného temozolomidu alebo expozíciu jeho aktívneho metabolitu monometyl-triazenoimidazol-karboxamidu (MTIC).
Podávanie TMZ s jedlom malo za následok pokles Cmax o 33 % a pokles plochy pod krivkou (AUC)
o 9 %.
Keďže nie je možné vylúčiť, že zmeny Cmax sú klinicky signifikantné, Temodal sa nemá podávať
s jedlom.
Na základe analýzy populačnej farmakokinetiky v klinických skúšaniach II. fázy, nemenilo súbežné podávanie dexametazónu, prochlórperazínu, fenytoínu, karbamazepínu, ondasetrónu, antagonistov H2 receptorov alebo fenobarbitalu klírens TMZ. Súbežné podávanie s kyselinou valproovou bolo spojené s malým, ale štatisticky významným, poklesom klírensu TMZ.
Neboli vykonané štúdie, ktoré by zisťovali účinok TMZ na metabolizmus alebo elimináciu iných liekov. Keďže sa však TMZ nepodlieha metabolizmu v pečeni a vykazuje nízku väzbu na bielkoviny, je jeho vplyv na farmakokinetiku iných liekov nepravdepodobný (pozri časť 5.2).
Použitie TMZ v kombinácii s ďalšími myelosupresívnymi látkami môže zvýšiť pravdepodobnosť
myelosupresie.
Deti a dospievajúci
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú žiadne údaje na gravidných ženách. V predklinických štúdiách na potkanoch a králikoch, ktorí
dostávali 150 mg/m2 TMZ bola dokázaná teratogenita a/alebo fetálna toxicita (pozri časť 5.3).
Temodal sa nemá podávať gravidným ženám. Ak sa musí uvažovať o použití v gravidite, pacientka musí byť oboznámená s možným rizikom pre plod.
Laktácia
Nie je známe, či sa TMZ vylučuje do ľudského mlieka; preto sa má dojčenie počas liečby TMZ
prerušiť.
Ženy vo fertilnom veku
Ženy vo fertilnom veku majú byť poučené, aby používali účinnú antikoncepciu na zabránenie
gravidity, pokiaľ užívajú TMZ.
Plodnosť u mužovTMZ môže mať genotoxické účinky. Preto treba mužov, ktorí majú byť ním liečení, poučiť, aby
nesplodili dieťa po dobu až 6 mesiacov po prijatí poslednej dávky a tiež ich treba poučiť, aby sa ešte pred liečbou poradili o možnosti konzervácie spermií zmrazením, pretože existuje možnosť
ireverzibilnej neplodnosti spôsobenej liečbou TMZ.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeTMZ má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje vzhľadom na únavu
a somnolenciu (pozri časť 4.8).
4.8 Nežiaduce účinkySkúsenosti z klinickéhoskúšaniaU pacientov liečených TMZ, či už použitím v kombinácii s RT alebo ako monoterapia s následnou RT
pri novodiagnostikovanom multiformnom glioblastóme, alebo ako monoterapii u pacientov
s rekurentným alebo progredujúcim gliómom boli veľmi často hlásené nežiaduce reakcie podobné:
nauzea, vracanie, zápcha, nechutenstvo, bolesť hlavy a únava. Kŕče boli hlásené veľmi často u pacientov s novodiagnostikovaným multiformným glioblastómom liečených monoterapiou a vyrážka bola hlásená veľmi často u pacientov s novodiagnostikovaným multiformným
glioblastómom liečených TMZ súbežne s RT aj pri monoterapii a často u pacientov s rekurentným
gliómom. Väčšina hematologických nežiaducich reakcií bola hlásená často alebo veľmi často v oboch indikáciách (tabuľky 4 a 5); frekvencia laboratórnych nálezov stupňa 3 – 4 je uvedená po každej
tabuľke.
Nežiaduce účinky sú v tabuľkách uvedené v rámci tried orgánových systémov a frekvencie. Skupiny
frekvencií sú definované podľa nasledovnej konvencie: veľmi časté (≥ 1/10), časté (≥ 1/100, až <
1/10), menej časté (≥ 1/1 000, až < 1/100). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Novodiagnostikovaný multiformný glioblastómTabuľka 4 uvádza nežiaduce udalosti vyskytujúce sa pri liečbe u pacientov s novodiagnostikovaným
multiformným glioblastómom počas súbežnej fázy liečby a fázy monoterapie.
Tabuľka 4. Nežiaduce udalosti vyskytujúce sa pri liečbe počas súbežnej liečby a monoterapie u pacientov s novodiagnostikovaným multiformným glioblastómom
|
Trieda orgánového
systému
| TMZ + súbežná RT
n=288*
| TMZ monoterapia
n=224
|
Infekcie a nákazy
|
Časté:
| infekcia, herpes simplex, infekcia rany,
faryngitída, orálna kandidóza
| infekcia, orálna kandidóza
|
Menej časté:
|
| herpes simplex, herpes zoster,
symptómy podobné chrípke
|
Poruchy krvi a lymfatického systému
|
Časté:
| neutropénia, trombocytopénia,
lymfopénia, leukopénia
| febrilná neutropénia,
trombocytopénia, anémia, leukopénia
|
Menej časté:
| febrilná neutropénia, anémia
| lymfopénia, petechie
|
Poruchy endokrinného systému
|
Menej časté:
|
Cushingoidný stav
|
Cushingoidný stav
|
Poruchy metabolizmu a výživy
|
Veľmi časté:
|
anorexia
|
anorexia
|
Časté
|
hyperglykémia, pokles hmotnosti
|
pokles hmotnosti
|
Menej časté:
|
hypokaliémia, zvýšenie alkalickej
fosfatázy, zvýšenie hmotnosti
|
hyperglykémia, zvýšenie hmotnosti
|
Psychické poruchy
|
Časté:
|
úzkosť, emočná labilita, insomnia
|
úzkosť, depresia, emočná labilita,
insomnia
|
Menej časté:
|
agitácia, apatia, porucha správania,
depresia, halucinácie
|
halucinácie, strata pamäti
|
Poruchy nervového systému
|
Veľmi časté:
|
bolesť hlavy
|
kŕče, bolesť hlavy
|
Časté:
|
kŕče, znížené vedomie, somnolencia,
afázia, porucha rovnováhy, závrat, zmätenosť, zhoršená pamäť, zhoršená koncentrácia, neuropatia, parestézia, porucha reči, tras
|
hemiparéza, afázia, porucha
rovnováhy, somnolencia, zmätenosť, závrat, zhoršená pamäť, zhoršená koncentrácia, dysfázia, neurologická porucha (NOS), neuropatia, periférna neuropatia, parestézia, porucha reči, tras
|
Menej časté:
|
status epilepticus, extrapyramidálna
porucha, hemiparéza, ataxia, kognitívna porucha, dysfázia, nezvyčajná chôdza,
hyperestézia, hypoestézia, neurologická
porucha (NOS), periférna neuropatia
|
hemiplégia, ataxia, nezvyčajná
koordinácia, nezvyčajná chôdza, hyperestézia, senzorická porucha
|
Poruchy oka
|
Časté:
|
rozmazané videnie
|
výpadok v zornom poli, rozmazané
videnie, diplopia
|
Menej časté:
|
hemianopia, znížená zraková ostrosť,
porucha zraku, výpadok v zornom poli, bolesť oka
|
znížená zraková ostrosť, bolesť oka,
suché oči
|
Poruchy ucha a labyrintu
|
Časté:
|
porucha sluchu
|
porucha sluchu, tinitus
|
Menej časté:
|
otitis media, tinitus, zvýšená citlivosť
sluchu, bolesť ucha
|
hluchota, vertigo, bolesť ucha
|
Poruchy srdca a srdcovej činnosti
|
Menej časté:
|
palpitácie
|
|
Poruchy ciev
|
Časté:
|
krvácanie, edém, edém nohy
|
krvácanie, hlboká žilová trombóza,
edém nohy
|
Menej časté:
|
mozgové krvácanie, hypertenzia
|
pľúcna embólia, edém, periférny
edém
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Časté:
|
dýchavičnosť, kašeľ
|
dýchavičnosť, kašeľ
|
Menej časté:
|
pneumónia, infekcia horných dýchacích
ciest, nosová kongescia
|
pneumónia, sinusitída, infekcia
horných dýchacích ciest, bronchitída
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté:
|
zápcha, nauzea, vracanie
|
zápcha, nauzea, vracanie
|
Časté:
|
stomatitída, hnačka, bolesť brucha,
dyspepsia, dysfágia
|
stomatitída, hnačka, dyspepsia,
dysfágia, sucho v ústach
|
Menej časté:
|
|
abdominálna distenzia, inkontinencia
stolice, gastrointestinálna porucha
(NOS), gastroenteritída, hemoroidy
|
Poruchy kože a podkožného tkaniva
|
Veľmi časté:
|
kožná vyrážka, alopécia
|
kožná vyrážka, alopécia
|
Časté:
|
dermatitída, suchá koža, erytém, pruritus
|
suchá koža, pruritus
|
Menej časté:
|
exfoliácia kože, fotosenzitívna reakcia,
nezvyčajná pigmentácia
|
erytém, nezvyčajná pigmentácia,
zvýšené potenie
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
Časté:
|
svalová slabosť, artralgia
|
svalová slabosť, artralgia,
muskuloskeletálna bolesť, myalgia
|
Menej časté:
|
myopatia, bolesť chrbta,
muskuloskeletálna bolesť, myalgia
|
myopatia, bolesť chrbta
|
Poruchy obličiek a močových ciest
|
Časté:
|
zvýšené močenie, inkontinencia moču
|
inkontinencia moču
|
Menej časté:
|
|
dyzúria
|
Poruchy reprodukčného systému a prsníkov
|
Menej časté:
|
impotencia
|
krvácanie z pošvy, menorágia,
amenorea, vaginitída, bolesť prsníka
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté:
|
únava
|
únava
|
Časté:
|
alergická reakcia, horúčka, radiačné
poškodenie, opuch tváre, bolesť, porucha chuti
|
alergická reakcia, horúčka, radiačné
poškodenie, bolesť, porucha chuti
|
Menej časté:
|
asténia, sčervenenie, návaly tepla,
zhoršenie stavu, zimnica, zmena farby jazyka, porucha čuchu, smäd
|
asténie, opuch tváre, bolesť, zhoršenie
stavu, zimnica, porucha zuba, porucha chuti
|
Laboratórne a funkčné vyšetrenia
|
Časté:
|
zvýšenie ALT
|
zvýšenie ALT
|

Menej časté: Zvýšenie pečeňových enzýmov, zvýšenie gamma GT, zvýšenie AST
*Pacient randomizovaný do ramena so samotnou RT, dostával TMZ + RT.
Laboratórne výsledkyPozorovala sa myelosupresia (neutropénia a trombocytopénia), známa ako dávku limitujúca toxicita pre väčšinu cytotoxických látok, vrátane TMZ. Keď sa skombinovali laboratórne abnormality
a nežiaduce udalosti z oboch fáz liečby, súbežnej aj monoterapie, pozorovali sa abnormality neutrofilov 3. alebo 4. stupňa, vrátane neutropenických udalostí, u 8 % pacientov. Abnormality
trombocytov 3. alebo 4.stupňa, vrátane trombocytopenických udalostí, sa pozorovali u 14 %
pacientov, ktorí dostávali TMZ.
Rekurentný alebo progredujúcimalígnygliómV klinických skúšaniach boli najčastejšie sa vyskytujúce nežiaduce účinky súvisiace s liečbou
gastrointestinálne poruchy, konkrétne nauzea (43 %) a vracanie (36 %). Tieto reakcie dosahovali zvyčajne 1. alebo 2. stupeň (0 – 5 epizód vracania za 24 hodín) a buď spontánne ustúpili, alebo boli
ľahko zvládnuté štandardnou antiemetickou liečbou. Incidencia závažnej nauzey a vracania bola 4 %.
Nežiaduce účinky zaznamenané počas klinických skúšaní s rekurentným alebo progredujúcim malígnym gliómom a následne po uvedení Temodalu do obehu sú zhrnuté v Tabuľke 5.
Tabuľka 5. Nežiaduce reakcie u pacientov s rekurentným alebo progredujúcim malígnym gliómom
|
Infekcie a nákazy
|
Zriedkavé
| oportúnne infekcie vrátane PCP
|
Poruchy krvi a lymfatického systému
|
Veľmi časté:
| neutropénia alebo lymfopénia (3. – 4. stupeň),
trombocytopénia (3. – 4. stupeň)
|
Menej časté:
| pancytopénia, anémia (3. – 4. stupeň), leukopénia
|
Poruchy metabolizmu a výživy
|
Veľmi časté:
| anorexia
|
Časté:
| pokles hmotnosti
|
Poruchy nervového systému
|
Veľmi časté:
| bolesť hlavy
|
Časté:
| somnolencia, závrat, parestézia
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Časté:
| dyspnoe
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté:
| vracanie, nauzea, zápcha
|
Časté:
| hnačka, bolesť brucha, dyspepsia
|
Poruchy kože a podkožného tkaniva
|
Časté:
| kožná vyrážka, pruritus, alopécia
|
Veľmi zriedkavé:
| multiformný erytém, erytrodermia, urtikária, exantém
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté:
| únava
|
Časté:
| horúčka, asténia, zimnica, nevoľnosť, bolesť, zmena
chuti
|
Veľmi zriedkavé:
| alergické reakcie vrátane anafylaxie, angioedém
|
Laboratórne výsledky
Trombocytopénia a neutropénia 3. alebo 4. stupňa sa vyskytli u 19 %, resp. 17 % pacientov liečených na malígny glióm. Toto viedlo k hospitalizácii v 8 % a/alebo k prerušeniu liečby TMZ v 4 %. Myelosupresia bola predvídateľná (zvyčajne v priebehu niekoľko prvých cyklov, s najnižšími hodnotami medzi 21. a 28. dňom) a zotavenie nastalo rýchle, zvyčajne behom 1 – 2 týždňov. Výskyt kumulatívnej myelosupresie sa nepozoroval. Prítomnosť trombocytopénie môže zvýšiť riziko krvácania a prítomnosť neutropénie alebo leukopénie môže zvýšiť riziko infekcie.
Pohlavie
Podľa farmakokinetickej analýzy populácie klinického skúšania bola hodnota najnižšieho počtu (NADIR) neutrofilov dostupná u 101 žien a 169 mužov a hodnota najnižšieho počtu krvných doštičiek u 110 žien a 174 mužov. V prvom cykle liečby bol u žien v porovnaní s mužmi vyšší výskyt neutropénie 4. stupňa (ANC < 0,5 x 109/l), 12 % vs. 5 %, a trombocytopénie 4. stupňa (< 20 x 109/l),
9 % vs. 3 %. V súbore informácií od 400 jedincov s rekurentným gliómom sa v prvom cykle liečby objavila neutropénia 4. stupňa u 8 % žien v porovnaní so 4 % mužov. V štúdii s 288 jedincami
s novodiagnostikovaným multiformným glioblastómom sa v prvom cykle liečby objavila neutropénia
4. stupňa u 3 % žien v porovnaní s 0 % mužov a trombocytopénia 4. stupňa u 1 % žien v porovnaní s 0 % mužov.
Deti a dospievajúci
Perorálny TMZ sa skúmal u detských a dospievajúcich pacientov (vo veku 3-18 rokov) s rekurentným
gliómom mozgového kmeňa alebo s rekurentným astrocytómom vysokého stupňa v dávkovacom režime podávanom denne počas 5 dní každých 28 dní. Hoci sú údaje obmedzené, očakáva sa, že znášanlivosť u detí bude rovnaká ako u dospelých. Bezpečnosť TMZ u detí mladších ako 3 roky sa nestanovila.
Skúsenosti po uvedeníliekunatrh
Antineoplastické látky, a zvlášť alkylačné látky, boli spojené s potenciálnym rizikom
myelodysplastického syndrómu (MDS) a sekundárnych malignít, vrátane leukémie. U pacientov, liečených režimami s TMZ, boli hlásené veľmi zriedkavé prípady MDS a sekundárnych malignít,
vrátane myeloidnej leukémie. Bola hlásená predĺžená pancytopénia, ktorá môže vyústiť do aplastickej
anémie a v niektorých prípadoch viedla k fatálnemu koncu.
Veľmi zriedkavo boli hlásené prípady toxickej epidermálnej nekrolýzy a Stevens-Johnsonovho syndrómu.
Veľmi zriedkavo sa hlásili prípady intersticiálnej pneumonitídy/pneumonitídy, fibrózy pľúc
a fatálneho respiračného zlyhania.
Boli hlásené prípady hepatotoxicity vrátane zvýšenia hladín pečeňových enzýmov, hyperbilirubinémie, cholestázy a hepatitídy.
4.9 Predávkovanie
U pacientov sa klinicky hodnotili dávky 500, 750, 1 000 a 1 250 mg/m2 (celková dávka na cyklus počas 5 dní). Toxicita limitujúca dávku bola hematologická a táto bola hlásená pri všetkých dávkach, ale predpokladá sa, že bude závažnejšia pri vyšších dávkach. Jeden pacient sa predávkoval užitím dávky 10 000 mg (celková dávka v jednom cykle počas 5 dní). Nežiaduce reakcie hlásené pri tomto predávkovaní boli pancytopénia, pyrexia, multiorgánové zlyhanie a smrť. Existujú záznamy
o pacientoch, ktorí užívali odporúčanú dávku po dobu viac ako 5 dní liečby (až do 64 dní), pričom hlásené nežiaduce udalosti zahŕňali útlm kostnej drene s infekciou alebo bez nej, ktoré boli
v niektorých prípadoch závažné a pretrvávali dlhšiu dobu a skončili sa smrťou. V prípade
predávkovania je potrebné hematologické vyšetrenie. V prípade potreby sa majú vykonať podporné
opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Cytostatiká - Iné alkylačné látky, ATC kód: L01A X03
Spôsob účinkuTemozolomid je triazén, ktorý pri fyziologickom pH podlieha rýchlej chemickej konverzii na aktívny
monometyl-triazenoimidazol-karboxamid (MTIC). Predpokladá sa, že cytotoxicitu MTIC primárne spôsobuje alkylácia na pozícii O6 guanínu, spolu s ďalšou alkyláciou na pozícii N7. Cytotoxické lézie, ktoré sa rozvinú následne, pravdepodobne zapríčiňuje aberantná oprava metylovaného aduktu.
Klinická účinnosť abezpečnosťNovodiagnostikovaný multiformný glioblastómCelkovo 573 pacientov bolo randomizovaných tak, aby dostávali buď TMZ + RT (n=287), alebo RT
samotnú (n = 286). Pacienti v ramene TMZ + RT súbežne dostávali TMZ (75 mg/m2) raz denne, začínajúc v prvý deň RT až do posledného dňa RT, po dobu 42 dní (s maximom 49 dní). Potom
nasledovala monoterapia TMZ (150 - 200 mg/m2) 1. – 5. deň počas každého 28-dňového cyklu.
Liečba trvala až 6. cyklov a začínalo sa s ňou 4 týždne po ukončení RT. Pacienti v kontrolnom ramene
dostávali len RT. Počas RT a aj kombinovanej liečby TMZ sa vyžadovala profylaxia proti pneumónii spôsobenej
Pneumocystis jirovecii (PCP).
TMZ sa podával ako záchranná terapia vo fáze sledovania po liečbe 161 pacientom z 282 (57 %)
z ramena so samotnou RT a 62 pacientom z 277 (22 %) z ramena TMZ + RT.
Pomer rizika (Hazard ratio - HR) celkového prežívania bol 1,59 (95 % CI pre HR = 1,33 – 1,91) s log- rank p < 0,0001 v prospech ramena s TMZ. Odhadovaná pravdepodobnosť prežívania 2 alebo viac rokov (26 % vs. 10 %) bola vyššia v ramene RT + TMZ. Súbežné pridanie TMZ k RT, s následnou monoterapiou TMZ, pri liečbe pacientov s novodiagnostikovaným multiformným glioblastómom preukázalo štatisticky významné zlepšenie celkového prežívania (Overall Survival – OS) v porovnaní so samotnou RT (Obrázok 1).
 Obrázok 1 Kaplan-Meierove krivky celkového prežívania (Intent to Treat - populácia, v ktorej bola liečba zamýšľaná)
Obrázok 1 Kaplan-Meierove krivky celkového prežívania (Intent to Treat - populácia, v ktorej bola liečba zamýšľaná)
Výsledky zo skúšania neboli konzistentné v podskupine pacientov so slabým výkonnostným stavom (WHO PS = 2, n = 70), v ktorej bolo celkové prežívanie a čas do progresie podobné v oboch ramenách. Nezdá sa však, že by v tejto skupine pacientov boli prítomné neprijateľné riziká.
Rekurentný alebo progredujúcimalígnyglióm
Údaje o klinickej účinnosti u pacientov s multiformným glioblastómom (Karnofského skóre
[Karnofsky perfomance status – KPS] ≥70), progredujúcom alebo recidivujúcom po chirurgickej terapii a RT, sú založené na dvoch klinických skúšaniach s perorálnym TMZ. Jedno bolo nekomparatívne skúšanie u 138 pacientov (predtým dostávalo chemoterapiu 29 %) a druhé bolo randomizované aktívne kontrolované skúšanie TMZ vs prokarbazínu u celkovo 225 pacientov (pred liečbou dostávalo chemoterapiu na báze nitrózourey 67 % pacientov). Primárnym cieľom oboch skúšaní bolo stanoviť prežívanie bez progresie nádoru (progression free survival – PFS), definované MRI zobrazením alebo neurologickým zhoršením. V nekomparatívnom skúšaní bolo PFS v 6. mesiaci
19 %, medián prežívania bez progresie nádoru bol 2,1 mesiaca a medián celkového prežívania 5,4 mesiaca. Častosť objektívnej odpovede (Objective response rate – ORR), založená na MRI zobrazení, bola 8 %.
V randomizovanom aktívne kontrolovanom klinickom skúšaní bolo 6-mesačné PFS signifikantne dlhšie u TMZ než u prokarbazínu (21 % oproti 8 %, chí-kvadrát p = 0,008) s mediánom PFS 2,89 mesiacov pre TMZ a 1,88 mesiacov pre prokarbazín (log rank p = 0,0063). Medián prežívania pre
TMZ bol 7,34 mesiaca a pre prokarbazín 5,66 mesiacov (log rank p = 0,33). Po 6 mesiacoch bol podiel prežívajúcich pacientov signifikantne vyšší v TMZ ramene (60 %) oproti ramenu s prokarbazínom
(44 %) (chí-kvadrát p = 0,019). U pacientov s predchádzajúcou chemoterapiou bol zaznamenaný
prínos u tých, ktorých KPS bolo ≥ 80.
Údaje o čase do zhoršenia neurologického stavu boli v prospech TMZ oproti prokarbazínu, takisto ako údaje o čase do zhoršenia celkového stavu (pokles na KPS na < 70 alebo pokles o najmenej 30 bodov). Mediány časov do progresie nádoru podľa týchto cieľov boli u TMZ dlhšie v rozsahu 0,7 až 2,1 mesiaca než u prokarbazínu (log rank p = < 0,01 – 0,03).
Rekurentný anaplastický astrocytóm
V multicentrickom, prospektívnom klinickom skúšaní II. fázy, v ktorom sa vyhodnocovala bezpečnosť
a účinnosť liečby perorálnym TMZ u pacientov s anaplastickým astrocytómom pri prvom relapse, bolo 6-mesačné PFS 46 %. Medián PFS bol 5,4 mesiaca. Medián celkového prežívania bol 14,6 mesiacov. V populácii pacientov, u ktorých bola liečba zamýšľaná (ITT) n=162, bola, podľa zhodnotenia centrálnym recenzentom, častosť odpovede 35 % (13 dosiahlo kompletnú remisiu a 43 parciálnu). Stabilné ochorenie bolo hlásené u 43 pacientov. 6-mesačné prežívanie bez príhody bolo
v ITT populácii 44 % s mediánom prežívania bez príhody 4,6 mesiacov, čo bolo podobné výsledkom prežívania bez progresie. Výsledky účinnosti boli podobné aj u populácie, ktorá bola vhodná na histológiu. Dosiahnutie rádiologicky objektívnej odpovede alebo udržania stavu bez progresie bolo silne viazané s udržanou alebo zlepšenou kvalitou života.
Deti a dospievajúci
Perorálny TMZ sa skúmal u detských a dospievajúcich pacientov (vo veku 3-18 rokov) s rekurentným
gliómom mozgového kmeňa alebo rekurentným astrocytómom vysokého stupňa v dávkovacom režime podávanom denne počas 5 dní každých 28 dní. Tolerancia na TMZ je podobná ako u dospelých.
5.2 Farmakokinetické vlastnosti
TMZ sa pri fyziologickom pH spontánne hydrolyzuje na primárne účinné zložky, 3-metyl-(triazén-1- yl)imidazol-4-karboxamid (MTIC). MTIC sa spontánne hydrolyzuje na 5-aminoimidazol-4- karboxamid (AIC), známy medziprodukt pri biosyntéze purínu a nukleovej kyseliny, a na metylhydrazín, ktorý sa považuje za účinnú alkylačnú zložku. Predpokladá sa, že za cytotoxicitu
MTIC je primárne zodpovedná alkylácia DNA, predovšetkým na pozíciách O6 a N7 guanínu.
V závislosti od AUC TMZ je expozícia MTIC ~ 2,4 % a expozícia AIC ~ 23 %. In vivo bol t1/2 MTIC
podobný t1/2 TMZ, a to 1,8 hod.
Absorpcia
Po perorálnom podaní dospelým pacientom sa TMZ vstrebáva rýchlo a maximálne koncentrácie sa
dosahujú už za 20 minút po podaní (priemerný čas medzi 0,5 a 1,5 hodinou). Po perorálnom podaní TMZ označeného 14C, počas 7 dní po podaní, bola priemerná exkrécia 14C stolicou 0,8 %, čo ukazuje na jeho úplnú absorpciu.
Distribúcia
TMZ vykazuje nízku väzbu na bielkoviny (10 % až 20 %), a preto sa neočakáva jeho interakcia
s látkami, ktoré sa silne viažu na bielkoviny.
PET štúdie u ľudí, ako aj predklinické údaje ukazujú, že TMZ rýchlo prechádza hematoencefalickou bariérou a je prítomný v mozgovomiechovom moku. Prienik do mozgovomiechového moku bol potvrdený u jedného pacienta; meraním AUC sa zistilo, že koncentrácia TMZ v mozgovomiechovom moku dosahuje približne 30 % hladín v plazme, čo zodpovedá údajom zisteným u zvierat.
Eliminácia
Polčas (t1/2) v plazme je približne 1,8 hodín. Hlavnou cestou vylučovania 14C sú obličky. Po perorálnom podaní sa močom vylúči približne 5 % až 10 % dávky v nezmenenej forme v priebehu 24 hodín. Zvyšok sa vylúči ako kyselina temozolomidová, 5-aminoimidazol-4-karboxamid (AIC) alebo ako neidentifikované polárne metabolity.
Plazmatické koncentrácie stúpajú v závislosti od podanej dávky. Plazmatický klírens, distribučný objem a polčas sú nezávislé od podanej dávky.
Osobitné skupiny pacientov
Analýza populačnej farmakokinetiky TMZ ukázala, že plazmatický klírens TMZ bol nezávislý od
veku pacienta, renálnych funkcií alebo od fajčenia. V inej farmakokinetickej štúdii boli plazmatické
farmakokinetické profily u pacientov s miernym alebo stredne ťažkým poškodením funkcie pečene podobné plazmatickým farmakokinetickým profilom, pozorovaným u pacientov s normálnou funkciou pečene.
Detskí pacienti mali vyššie AUC ako dospelí pacienti; avšak maximálna tolerovaná dávka (MTD) bola
1 000 mg/m2/cyklus u detí aj u dospelých.
5.3 Predklinické údaje o bezpečnosti
Boli vykonané jednocyklové (5-dní podávanie, 23 dní bez liečby), 3- a 6-cyklové štúdie toxicity na potkanoch a psoch. Toxicita sa primárne prejavila na kostnej dreni, lymforetikulárnom systéme, testes a gastrointestinálnom trakte. Vo vyšších dávkach, ktoré boli letálne pre 60 % až 100 % testovaných potkanov a psov, došlo ku degenerácii sietnice. Väčšina toxických zmien sa ukázala byť reverzibilných, výnimkou boli nežiaduce udalosti na mužský reprodukčný systém a degenerácia sietnice. Keďže sa však dávky, ktoré zapríčinili degeneráciu sietnice, pohybovali v rozmedzí letálnych dávok a porovnateľný účinok nebol pozorovaný v klinických štúdiách, tento nález sa nepokladá za klinicky významný.
TMZ je embryotoxická, teratogénna a genotoxická alkylačná látka. TMZ je toxickejší pre potkany
a psov ako pre ľudí a klinická dávka sa približuje minimálnej letálnej dávke u potkanov a u psov. Na dávke závislé redukcie leukocytov a trombocytov sa javia ako senzitívne indikátory toxicity. V 6- cyklovej štúdii na potkanoch sa zaznamenali rôzne nádory, vrátane mamárnych karcinómov,
keratoakantómov kože a bazocelulárnych adenómov, zatiaľ čo v štúdiách na psoch sa nádory alebo predneoplastické zmeny nezistili. Potkany sa javia byť zvlášť citlivé na onkogénne účinky TMZ, pričom prvé nádory sa zjavujú v priebehu 3 mesiacov od začiatku podávania. Táto doba latencie je veľmi krátka aj pre alkylačnú látku.
Testy chromozómových aberácií Ames/salmonely a ľudských lymfocytov z periférnej krvi (Human
Peripheral Blood Lymphocyte - HPBL) ukázali pozitívnu mutagénnnu odpoveď.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsahkapsuly: bezvodá laktóza, koloidný oxid kremičitý,
sodná soľ karboxymetylškrobu typu A, kyselina vínna,
kyselina stearová.
Obalkapsuly:
želatína,
oxid titaničitý (E 171), laurylsíran sodný,
žltý oxid železitý (E 172),
červený oxid železitý (E 172).
Potlač: šelak, propylénglykol, čistená voda, hydroxid amónny, hydroxid draselný,
čierny oxid železitý (E 172).
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Balenie vo fľaši
Uchovávajte pri teplote neprevyšujúcej 30 °C.
Uchovávajte v pôvodnej fľaši na ochranu pred vlhkosťou. Fľašu udržiavajte dôkladne uzatvorenú.
Balenie vo vrecku
Uchovávajte pri teplote neprevyšujúcej 30 °C.
6.5 Druh obalu a obsah balenia
B
alenie vo fľašiFľašky z jantárového skla typu I s polypropylénovými uzávermi bezpečnými pred deťmi obsahujúce 5
alebo 20 tvrdých kapsúl. Škatuľka obsahuje jednu fľašu.
Balenie vo vreckuVrecká sa skladajú z lineárneho polyetylénu s nízkou hustotou (najvnútornejšia vrstva), hliníka
a polyetyléntereftalátu.
Každé vrecko obsahuje 1 tvrdú kapsulu a dodáva sa v papierovej škatuli.
Škatuľa obsahuje 5 alebo 20 tvrdých kapsúl jednotlivo uzatvorených vo vreckách. Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomKapsuly sa nesmú otvárať. Ak je kapsula poškodená, musíte zabrániť kontaktu práškového obsahu
s kožou alebo sliznicou. Ak sa Temodal dostane do kontaktu s kožou alebo sliznicou, okamžite
a dôkladne sa musí postihnutá oblasť umyť mydlom a vodou.
Pacientov treba poučiť, aby kapsuly uchovávali mimo dohľadu a dosahu detí, najlepšie v uzamknutej skrini. Náhodné prehltnutie môže byť pre deti smrteľné.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMerck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU
Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/98/096/011
EU/1/98/096/012
EU/1/98/096/019
EU/1/98/096/020
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 26. január 1999. Dátum posledného predĺženia: 26. január 2009.
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu
1. NÁZOV LIEKU
Temodal 250 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá tvrdá kapsula obsahuje 250 mg temozolomidu.
Pomocnálátkasoznámymúčinkom:
Každá tvrdá kapsula obsahuje 154,3 mg bezvodej laktózy. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tvrdá kapsula.
Tvrdé kapsuly majú nepriehľadné biele telo kapsuly a vrchnáčik a sú potlačené čiernym atramentom. Na vrchnáčiku je vytlačené „Temodal“. Na tele kapsuly je vytlačené „250 mg“, logo Schering-Plough a dva pásiky.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Temodal je indikovaný na liečbu:
- dospelých pacientov s novodiagnostikovaným multiformným glioblastómom súbežne
s rádioterapiou (RT) a následne ako monoterapia
- detí od troch rokov, dospievajúcich a dospelých pacientov s malígnym gliómom, ako je multiformný glioblastóm alebo anaplastický astrocytóm, u ktorých došlo po štandardnej terapii
k recidíve alebo progresii ochorenia.
4.2 Dávkovanie a spôsob podávania
Temodal majú predpisovať iba lekári skúsení v onkologickej liečbe nádorov mozgu.
Možno podávať antiemetickú liečbu (pozri časť 4.4). Dávkovanie
Dospelí pacienti s novodiagnostikovaným multiformným glioblastómom
Temodal sa podáva v kombinácii s fokálnou rádioterapiou (súbežná fáza) nasledovanou až do 6 cyklov
monoterapie temozolomidom (TMZ) (fáza monoterapie).
Súbežná fáza
TMZ sa podáva perorálne v dávke 75 mg/m2 denne po dobu 42 dní súbežne s fokálnou rádioterapiou (60 Gy podaných v 30 frakciách). Dávku sa neodporúča znižovať, ale každý týždeň sa má rozhodnúť, či sa podávanie TMZ oddiali alebo preruší, na základe kritérií hematologickej a nehematologickej toxicity. V podávaní TMZ možno pokračovať po dobu 42-dňovej súbežnej fázy (až do 49 dní), ak sú splnené všetky nasledovné podmienky:
- absolútny počet neutrofilov (Absolute Neutrophil Count – ANC) ≥ 1,5 x 109/l
- počet trombocytov ≥ 100 x 109/l
- celkové kritériá toxicity (Common Toxicity Criteria - CTC) nehematologickej toxicity (okrem alopécie, nevoľnosti a vracania) ≤ 1. stupeň.
Počas liečby sa má týždenne vyšetrovať úplný krvný obraz. Podávanie TMZ sa má v priebehu
súbežnej fázy dočasne prerušiť alebo trvalo ukončiť podľa kritérií hematologickej a nehematologickej toxicity, ako je uvedené v Tabuľke 1.
Tabuľka 1: Prerušenie alebo ukončenie podávania TMZ počas
súbežnej rádioterapie a terapie TMZ
|
Toxicita
| Prerušenie TMZa
| Ukončenie TMZ
|
Absolútny počet neutrofilov
| ≥ 0,5 a < 1,5 x 109/l
| < 0,5 x 109/l
|
Počet trombocytov
| ≥ 10 a < 100 x 109/l
| < 10 x 109/l
|
CTC nehematologickej toxicity
(okrem alopécie, nevoľnosti a vra-
cania)
|
CTC 2. stupňa
|
CTC 3. alebo 4. stupňa
|
a: Súbežná liečba s TMZ môže pokračovať, keď sú splnené všetky nasledovné podmienky: absolútny počet neutrofilov ≥ 1,5 x 109/l, počet trombocytov ≥ 100 x 109/l, CTC nehematologickej toxicity ≤ 1. stupeň (okrem alopécie, nevoľnosti a vracania).
Fáza monoterapieŠtyri týždne po ukončení súbežnej fázy TMZ + RT sa TMZ podáva až do 6 cyklov ako monoterapia. Dávka v 1. cykle (monoterapie) je 150 mg/m2 raz denne počas 5 dní, po ktorých nasleduje 23 dní bez liečby. Na začiatku 2. cyklu sa dávka zvýši na 200 mg/m2, ak CTC nehematologickej toxicity (okrem alopécie, nevoľnosti a vracania) za 1. cyklus je ≤ 2. stupeň, absolútny počet neutrofilov (ANC) je ≥ 1,5 x 109/l a počet trombocytov je ≥ 100 x 109/l. Ak sa v 2. cykle dávka nezvýšila, nemá sa zvyšovať ani
v nasledujúcich cykloch. Ak sa dávka už raz zvýšila, zostáva 200 mg/m2 denne počas prvých 5 dní v každom nasledujúcom cykle, s výnimkou objavenia sa toxicity. Znižovanie dávok a prerušovanie
liečby počas fázy monoterapie sa má riadiť podľa Tabuliek 2 a 3.
Počas liečby, sa má 22. deň (21 dní od prvej dávky TMZ) vyšetriť úplný krvný obraz. Dávkovanie sa má znížiť alebo podávanie prerušiť podľa Tabuľky 3.
Tabuľka 2. Stupne dávkovania TMZ pri liečbe monoterapiou
|
Stupeň
dávkovania
| Dávka TMZ (mg/m2/deň)
| Poznámky
|
–1
| 100
| Zníženie kvôli predchádzajúcej toxicite
|
0
| 150
| Dávka počas 1. cyklu
|
1
| 200
| Dávka počas 2. - 6. cyklu, ak sa neobjavila toxicita
|
Tabuľka 3. Znižovanie dávok alebo prerušovanie liečby TMZ počas liečby
monoterapiou
|
Toxicita
| Zníženie TMZ o 1 stupeň dávkovaniaa
| Ukončenie TMZ
|
Absolútny počet neutrofilov
| < 1,0 x 109/l
| Pozri poznámku
pod čiarou b
|
Počet trombocytov
| < 50 x 109/l
| Pozri poznámku
pod čiarou b
|
CTC nehematologickej toxicity
(okrem alopécie, nevoľnosti a vra-
cania)
|
CTC 3. stupňa
|
CTC 4b. stupňa
|
a: Stupne dávkovania TMZ sú uvedené v Tabuľke 2.
b: TMZ sa má prerušiť ak:
• pri stupni dávkovania -1 (100 mg/m2) stále pretrváva neakceptovateľná toxicita
• sa po znížení dávky objaví rovnaká nehematologická toxicita 3. stupňa (okrem alopécie, nevoľnosti
a vracania).
D
ospelí a detskí pacienti vo veku 3 rokov alebo starší s rekurentným
a
l
ebo
progredujúcim
m
alígnym
gliómom:
Liečebný cyklus trvá 28 dní. Pacientom, ktorí predtým neboli liečení chemoterapiou, sa TMZ podáva
perorálne v dávke 200 mg/m2 raz denne počas prvých 5 dní, po ktorých nasleduje prerušenie liečby na
23 dní (spolu 28 dní). U pacientov, ktorí predtým boli liečení chemoterapiou, je úvodná dávka
150 mg/m2 raz denne, ktorá sa v druhom cykle zvýši na 200 mg/m2 raz denne počas 5 dní, ak sa neobjaví hematologická toxicita (pozri časť 4.4).
Osobitné skupiny pacientov
Deti a dospievajúci
U trojročných alebo starších pacientov sa TMZ používa iba pri rekurentnom alebo progredujúcom malígnom glióme. Skúsenosti u týchto detí sú veľmi obmedzené (pozri časti 4.4 a 5.1). Bezpečnosť a účinnosť TMZ u detí mladších ako 3 roky neboli stanovené. Nie sú k dispozícii žiadne údaje.
Pacienti s poškodením funkcie pečene alebo obličiek
Farmakokinetika TMZ bola u pacientov s normálnou funkciou pečene a u pacientov s miernym alebo stredne ťažkým poškodením funkcie pečene porovnateľná. Nie sú dostupné údaje o podávaní TMZ pacientom so závažným poškodením funkcie pečene (trieda C podľa Childovej klasifikácie) alebo
s poškodením funkcie obličiek. Vzhľadom na farmakokinetické vlastnosti TMZ nie je pravdepodobné, že by sa u pacientov so závažným poškodením funkcie pečene alebo akýmkoľvek stupňom poškodenia
funkcie obličiek vyžadovali redukcie dávky. Ak sa však TMZ podáva týmto pacientom, má sa im
venovať zvýšená pozornosť.
Starší pacienti
Na základe farmakokinetickej analýzy v populácii pacientov vo veku 19-78 rokov, klírens TMZ nie je ovplyvnený vekom. U starších pacientov (> 70 rokov) sa však zdá, že majú zvýšené riziko neutropénie a trombocytopénie (pozri časť 4.4).
Spôsob podania
Temodal tvrdé kapsuly sa majú podávať nalačno.
Kapsuly sa musia prehltnúť celé a zapiť pohárom vody. Nesmú sa otvárať alebo hrýzť (žuť). Keď vracanie nastúpi po podaní dávky, v ten istý deň sa už nemá podať druhá dávka.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Precitlivenosť na dakarbazín (DTIC). Závažná myelosupresia (pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
Pneumocystis jirovecii pneumónia
Ukázalo sa, že pacienti, ktorí v pilotnej štúdii dostávali súbežne TMZ a RT počas predĺženého 42-
dňového dávkovania, boli zvlášť ohrození vývojom pneumónie vyvolanej Pneumocystis jirovecii (Pneumocystis jirovecii pneumonia - PCP). Z tohto dôvodu sa u všetkých pacientov, ktorí dostávajú súbežne TMZ a RT počas 42-dňovej schémy (s maximom 49 dní), vyžaduje profylaxia proti PCP, a to
bez ohľadu na počet lymfocytov. Ak sa objaví lymfopénia, pacienti pokračujú v profylaxii až do úpravy lymfopénie na stupeň ≤ 1.
Pri podávaní TMZ počas dlhšej dávkovacej schémy môže byť výskyt PCP vyšší. Avšak, všetci pacienti, ktorí dostávajú TMZ, najmä pacienti, ktorí dostávajú steroidy, musia byť starostlivo sledovaní, či sa u nich nevyvinie PCP, bez ohľadu na schému. U pacientov užívajúcich TMZ najmä v kombinácii s dexametazónom alebo s inými steroidmi, sa hlásili fatálne prípady respiračného zlyhania.
Malignity
Veľmi zriedkavo sa hlásili aj prípady myelodysplastického syndrómu a sekundárnych malignít vrátane
myeloidnej leukémie (pozri časť 4.8).
Antiemetická liečba
S používaním TMZ sa veľmi často spájajú nauzea a vracanie.
Antiemetickú liečbu možno podávať pred alebo následne po podaní TMZ.
Dospelí pacienti s novodiagnostikovaným multiformným glioblastómom
Antiemetická profylaxia sa odporúča pred úvodnou dávkou súbežnej fázy a dôrazne sa odporúča počas
fázy monoterapie.
Pacienti s rekurentným alebo progredujúcimmalígnymgliómom
U pacientov, ktorí v predchádzajúcich liečebných cykloch trpeli závažným vracaním (3. alebo 4.
stupňa), sa môže vyžadovať antiemetická liečba.
Laboratórne parametre
U pacientov liečených TMZ sa môže objaviť myelopuspresia vrátane predĺženej pancytopénie, ktorá
môže viesť k aplastickej anémii, ktorá v niektorých prípadoch viedla k fatálnemu koncu. Expozícia súbežne podávaným liekom spojeným s aplastickou anémiou vrátane karbamazepínu, fenytoínu
a sulfametoxazolu/trimetoprimu v niektorých prípadoch komplikovala posúdenie. Pred zahájením liečby je potrebné, aby laboratórne parametre dosahovali nasledovné hodnoty: ANC ≥ 1,5 x 109/l
a počet trombocytov ≥ 100 x 109/l. Dvadsiaty druhý deň liečby (21 dní po prvej dávke) alebo
v priebehu 48 hodín od tohto dňa a potom raz týždenne sa má vyšetriť úplný krvný obraz, až pokým ANC > 1,5 x 109/l a počet trombocytov > 100 x 109/l. Ak v priebehu ktoréhokoľvek cyklu poklesne ANC na < 1,0 x 109/l alebo je počet trombocytov < 50 x 109/l, dávka sa má v nasledujúcom cykle redukovať o jeden stupeň (pozri časť 4.2). Stupne dávkovania sú 100 mg/m2, 150 mg/m2 a 200 mg/m2. Najnižšia odporúčaná dávka je 100 mg/m2.
Deti a dospievajúci
Nie sú klinické skúsenosti s používaním TMZ u detí mladších ako 3 roky. Skúsenosti so staršími
deťmi a dospievajúcimi sú veľmi obmedzené (pozri časti 4.2 a 5.1).
Starší pacienti (> 70rokov)
Zdá sa, že starší pacienti sú zvýšene ohrození neutropéniou a trombocytopéniou oproti
pacientom mladším. Preto sa má starším pacientom venovať zvláštna starostlivosť, ak sa im podáva
TMZ.
Pacienti mužského pohlavia
Mužov, ktorí majú byť liečení TMZ treba poučiť, aby nesplodili dieťa až 6 mesiacov po užití
poslednej dávky a treba ich poučiť, aby sa ešte pred liečbou poradili o možnosti konzervácie spermií
zmrazením (pozri časť 4.6)
Laktóza
Tento liek obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej
intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento
liek.
4.5 Liekové a iné interakcie
V samostatnej štúdii fázy I podávanie TMZ s ranitidínom neovplyvnilo množstvo absorbovaného temozolomidu alebo expozíciu jeho aktívneho metabolitu monometyl-triazenoimidazol-karboxamidu (MTIC).
Podávanie TMZ s jedlom malo za následok pokles Cmax o 33 % a pokles plochy pod krivkou (AUC)
o 9 %.
Keďže nie je možné vylúčiť, že zmeny Cmax sú klinicky signifikantné, Temodal sa nemá podávať
s jedlom.
Na základe analýzy populačnej farmakokinetiky v klinických skúšaniach II. fázy, nemenilo súbežné podávanie dexametazónu, prochlórperazínu, fenytoínu, karbamazepínu, ondasetrónu, antagonistov H2 receptorov alebo fenobarbitalu klírens TMZ. Súbežné podávanie s kyselinou valproovou bolo spojené s malým, ale štatisticky významným, poklesom klírensu TMZ.
Neboli vykonané štúdie, ktoré by zisťovali účinok TMZ na metabolizmus alebo elimináciu iných liekov. Keďže sa však TMZ nepodlieha metabolizmu v pečeni a vykazuje nízku väzbu na bielkoviny, je jeho vplyv na farmakokinetiku iných liekov nepravdepodobný (pozri časť 5.2).
Použitie TMZ v kombinácii s ďalšími myelosupresívnymi látkami môže zvýšiť pravdepodobnosť
myelosupresie.
Deti a dospievajúci
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú žiadne údaje na gravidných ženách. V predklinických štúdiách na potkanoch a králikoch, ktorí
dostávali 150 mg/m2 TMZ bola dokázaná teratogenita a/alebo fetálna toxicita (pozri časť 5.3).
Temodal sa nemá podávať gravidným ženám. Ak sa musí uvažovať o použití v gravidite, pacientka
musí byť oboznámená s možným rizikom pre plod.
Laktácia
Nie je známe, či sa TMZ vylučuje do ľudského mlieka; preto sa má dojčenie počas liečby TMZ
prerušiť.
Ženy vofertilnomveku
Ženy vo fertilnom veku majú byť poučené, aby používali účinnú antikoncepciu na zabránenie
gravidity, pokiaľ užívajú TMZ.
Plodnosť u mužovTMZ môže mať genotoxické účinky. Preto treba mužov, ktorí majú byť ním liečení, poučiť, aby
nesplodili dieťa po dobu až 6 mesiacov po prijatí poslednej dávky a tiež ich treba poučiť, aby sa ešte pred liečbou poradili o možnosti konzervácie spermií zmrazením, pretože existuje možnosť
ireverzibilnej neplodnosti spôsobenej liečbou TMZ.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeTMZ má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje vzhľadom na únavu
a somnolenciu (pozri časť 4.8).
4.8 Nežiaduce účinkySkúsenosti z klinickéhoskúšaniaU pacientov liečených TMZ, či už použitím v kombinácii s RT alebo ako monoterapia s následnou RT
pri novodiagnostikovanom multiformnom glioblastóme, alebo ako monoterapii u pacientov
s rekurentným alebo progredujúcim gliómom boli veľmi často hlásené nežiaduce reakcie podobné:
nauzea, vracanie, zápcha, nechutenstvo, bolesť hlavy a únava. Kŕče boli hlásené veľmi často u pacientov s novodiagnostikovaným multiformným glioblastómom liečených monoterapiou a vyrážka bola hlásená veľmi často u pacientov s novodiagnostikovaným multiformným
glioblastómom liečených TMZ súbežne s RT aj pri monoterapii a často u pacientov s rekurentným
gliómom. Väčšina hematologických nežiaducich reakcií bola hlásená často alebo veľmi často v oboch indikáciách (tabuľky 4 a 5); frekvencia laboratórnych nálezov stupňa 3 – 4 je uvedená po každej
tabuľke.
Nežiaduce účinky sú v tabuľkách uvedené v rámci tried orgánových systémov a frekvencie. Skupiny
frekvencií sú definované podľa nasledovnej konvencie: veľmi časté (≥ 1/10), časté (≥ 1/100, až <
1/10), menej časté (≥ 1/1 000, až < 1/100). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Novodiagnostikovaný multiformný glioblastómTabuľka 4 uvádza nežiaduce udalosti vyskytujúce sa pri liečbe u pacientov s novodiagnostikovaným
multiformným glioblastómom počas súbežnej fázy liečby a fázy monoterapie.
Tabuľka 4. Nežiaduce udalosti vyskytujúce sa pri liečbe počas súbežnej liečby a monoterapie u pacientov s novodiagnostikovaným multiformným glioblastómom
|
Trieda orgánového
systému
| TMZ + súbežná RT
n=288*
| TMZ monoterapia
n=224
|
Infekcie a nákazy
|
Časté:
| infekcia, herpes simplex, infekcia rany,
faryngitída, orálna kandidóza
| infekcia, orálna kandidóza
|
Menej časté:
|
| herpes simplex, herpes zoster,
symptómy podobné chrípke
|
Poruchy krvi a lymfatického systému
|
Časté:
| neutropénia, trombocytopénia,
lymfopénia, leukopénia
| febrilná neutropénia,
trombocytopénia, anémia, leukopénia
|
Menej časté:
| febrilná neutropénia, anémia
| lymfopénia, petechie
|
Poruchy endokrinného systému
|
Menej časté:
|
Cushingoidný stav
|
Cushingoidný stav
|
Poruchy metabolizmu a výživy
|
Veľmi časté:
|
anorexia
|
anorexia
|
Časté
|
hyperglykémia, pokles hmotnosti
|
pokles hmotnosti
|
Menej časté:
|
hypokaliémia, zvýšenie alkalickej
fosfatázy, zvýšenie hmotnosti
|
hyperglykémia, zvýšenie hmotnosti
|
Psychické poruchy
|
Časté:
|
úzkosť, emočná labilita, insomnia
|
úzkosť, depresia, emočná labilita,
insomnia
|
Menej časté:
|
agitácia, apatia, porucha správania,
depresia, halucinácie
|
halucinácie, strata pamäti
|
Poruchy nervového systému
|
Veľmi časté:
|
bolesť hlavy
|
kŕče, bolesť hlavy
|
Časté:
|
kŕče, znížené vedomie, somnolencia,
afázia, porucha rovnováhy, závrat, zmätenosť, zhoršená pamäť, zhoršená koncentrácia, neuropatia, parestézia, porucha reči, tras
|
hemiparéza, afázia, porucha
rovnováhy, somnolencia, zmätenosť, závrat, zhoršená pamäť, zhoršená koncentrácia, dysfázia, neurologická porucha (NOS), neuropatia, periférna neuropatia, parestézia, porucha reči, tras
|
Menej časté:
|
status epilepticus, extrapyramidálna
porucha, hemiparéza, ataxia, kognitívna porucha, dysfázia, nezvyčajná chôdza,
hyperestézia, hypoestézia, neurologická
porucha (NOS), periférna neuropatia
|
hemiplégia, ataxia, nezvyčajná
koordinácia, nezvyčajná chôdza, hyperestézia, senzorická porucha
|
Poruchy oka
|
Časté:
|
rozmazané videnie
|
výpadok v zornom poli, rozmazané
videnie, diplopia
|
Menej časté:
|
hemianopia, znížená zraková ostrosť,
porucha zraku, výpadok v zornom poli, bolesť oka
|
znížená zraková ostrosť, bolesť oka,
suché oči
|
Poruchy ucha a labyrintu
|
Časté:
|
porucha sluchu
|
porucha sluchu, tinitus
|
Menej časté:
|
otitis media, tinitus, zvýšená citlivosť
sluchu, bolesť ucha
|
hluchota, vertigo, bolesť ucha
|
Poruchy srdca a srdcovej činnosti
|
Menej časté:
|
palpitácie
|
|
Poruchy ciev
|
Časté:
|
krvácanie, edém, edém nohy
|
krvácanie, hlboká žilová trombóza,
edém nohy
|
Menej časté:
|
mozgové krvácanie, hypertenzia
|
pľúcna embólia, edém, periférny
edém
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Časté:
|
dýchavičnosť, kašeľ
|
dýchavičnosť, kašeľ
|
Menej časté:
|
pneumónia, infekcia horných dýchacích
ciest, nosová kongescia
|
pneumónia, sinusitída, infekcia
horných dýchacích ciest, bronchitída
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté:
|
zápcha, nauzea, vracanie
|
zápcha, nauzea, vracanie
|
Časté:
|
stomatitída, hnačka, bolesť brucha,
dyspepsia, dysfágia
|
stomatitída, hnačka, dyspepsia,
dysfágia, sucho v ústach
|
Menej časté:
|
|
abdominálna distenzia, inkontinencia
stolice, gastrointestinálna porucha
(NOS), gastroenteritída, hemoroidy
|
Poruchy kože a podkožného tkaniva
|
Veľmi časté:
|
kožná vyrážka, alopécia
|
kožná vyrážka, alopécia
|
Časté:
|
dermatitída, suchá koža, erytém, pruritus
|
suchá koža, pruritus
|
Menej časté:
|
exfoliácia kože, fotosenzitívna reakcia,
nezvyčajná pigmentácia
|
erytém, nezvyčajná pigmentácia,
zvýšené potenie
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
Časté:
|
svalová slabosť, artralgia
|
svalová slabosť, artralgia,
muskuloskeletálna bolesť, myalgia
|
Menej časté:
|
myopatia, bolesť chrbta,
muskuloskeletálna bolesť, myalgia
|
myopatia, bolesť chrbta
|
Poruchy obličiek a močových ciest
|
Časté:
|
zvýšené močenie, inkontinencia moču
|
inkontinencia moču
|
Menej časté:
|
|
dyzúria
|
Poruchy reprodukčného systému a prsníkov
|
Menej časté:
|
impotencia
|
krvácanie z pošvy, menorágia,
amenorea, vaginitída, bolesť prsníka
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté:
|
únava
|
únava
|
Časté:
|
alergická reakcia, horúčka, radiačné
poškodenie, opuch tváre, bolesť, porucha chuti
|
alergická reakcia, horúčka, radiačné
poškodenie, bolesť, porucha chuti
|
Menej časté:
|
asténia, sčervenenie, návaly tepla,
zhoršenie stavu, zimnica, zmena farby jazyka, porucha čuchu, smäd
|
asténie, opuch tváre, bolesť, zhoršenie
stavu, zimnica, porucha zuba, porucha chuti
|
Laboratórne a funkčné vyšetrenia
|
Časté:
|
zvýšenie ALT
|
zvýšenie ALT
|

Menej časté: Zvýšenie pečeňových enzýmov, zvýšenie gamma GT, zvýšenie AST
*Pacient randomizovaný do ramena so samotnou RT, dostával TMZ + RT.
Laboratórne výsledkyPozorovala sa myelosupresia (neutropénia a trombocytopénia), známa ako dávku limitujúca toxicita pre väčšinu cytotoxických látok, vrátane TMZ. Keď sa skombinovali laboratórne abnormality
a nežiaduce udalosti z oboch fáz liečby, súbežnej aj monoterapie, pozorovali sa abnormality neutrofilov 3. alebo 4. stupňa, vrátane neutropenických udalostí, u 8 % pacientov. Abnormality
trombocytov 3. alebo 4.stupňa, vrátane trombocytopenických udalostí, sa pozorovali u 14 %
pacientov, ktorí dostávali TMZ.
Rekurentný alebo progredujúcimalígnygliómV klinických skúšaniach boli najčastejšie sa vyskytujúce nežiaduce účinky súvisiace s liečbou
gastrointestinálne poruchy, konkrétne nauzea (43 %) a vracanie (36 %). Tieto reakcie dosahovali zvyčajne 1. alebo 2. stupeň (0 – 5 epizód vracania za 24 hodín) a buď spontánne ustúpili, alebo boli
ľahko zvládnuté štandardnou antiemetickou liečbou. Incidencia závažnej nauzey a vracania bola 4 %.
Nežiaduce účinky zaznamenané počas klinických skúšaní s rekurentným alebo progredujúcim malígnym gliómom a následne po uvedení Temodalu do obehu sú zhrnuté v Tabuľke 5.
Tabuľka 5. Nežiaduce reakcie u pacientov s rekurentným alebo progredujúcim malígnym gliómom
|
Infekcie a nákazy
|
Zriedkavé
| oportúnne infekcie vrátane PCP
|
Poruchy krvi a lymfatického systému
|
Veľmi časté:
| neutropénia alebo lymfopénia (3. – 4. stupeň),
trombocytopénia (3. – 4. stupeň)
|
Menej časté:
| pancytopénia, anémia (3. – 4. stupeň), leukopénia
|
Poruchy metabolizmu a výživy
|
Veľmi časté:
| anorexia
|
Časté:
| pokles hmotnosti
|
Poruchy nervového systému
|
Veľmi časté:
| bolesť hlavy
|
Časté:
| somnolencia, závrat, parestézia
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Časté:
| dyspnoe
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté:
| vracanie, nauzea, zápcha
|
Časté:
| hnačka, bolesť brucha, dyspepsia
|
Poruchy kože a podkožného tkaniva
|
Časté:
| kožná vyrážka, pruritus, alopécia
|
Veľmi zriedkavé:
| multiformný erytém, erytrodermia, urtikária, exantém
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté:
| únava
|
Časté:
| horúčka, asténia, zimnica, nevoľnosť, bolesť, zmena
chuti
|
Veľmi zriedkavé:
| alergické reakcie vrátane anafylaxie, angioedém
|
Laboratórne výsledky
Trombocytopénia a neutropénia 3. alebo 4. stupňa sa vyskytli u 19 %, resp. 17 % pacientov liečených na malígny glióm. Toto viedlo k hospitalizácii v 8 % a/alebo k prerušeniu liečby TMZ v 4 %. Myelosupresia bola predvídateľná (zvyčajne v priebehu niekoľko prvých cyklov, s najnižšími hodnotami medzi 21. a 28. dňom) a zotavenie nastalo rýchle, zvyčajne behom 1 – 2 týždňov. Výskyt kumulatívnej myelosupresie sa nepozoroval. Prítomnosť trombocytopénie môže zvýšiť riziko krvácania a prítomnosť neutropénie alebo leukopénie môže zvýšiť riziko infekcie.
Pohlavie
Podľa farmakokinetickej analýzy populácie klinického skúšania bola hodnota najnižšieho počtu (NADIR) neutrofilov dostupná u 101 žien a 169 mužov a hodnota najnižšieho počtu krvných doštičiek u 110 žien a 174 mužov. V prvom cykle liečby bol u žien v porovnaní s mužmi vyšší výskyt neutropénie 4. stupňa (ANC < 0,5 x 109/l), 12 % vs. 5 %, a trombocytopénie 4. stupňa (< 20 x 109/l),
9 % vs. 3 %. V súbore informácií od 400 jedincov s rekurentným gliómom sa v prvom cykle liečby objavila neutropénia 4. stupňa u 8 % žien v porovnaní so 4 % mužov. V štúdii s 288 jedincami
s novodiagnostikovaným multiformným glioblastómom sa v prvom cykle liečby objavila neutropénia
4. stupňa u 3 % žien v porovnaní s 0 % mužov a trombocytopénia 4. stupňa u 1 % žien v porovnaní s 0 % mužov.
Deti a dospievajúci
Perorálny TMZ sa skúmal u detských a dospievajúcich pacientov (vo veku 3-18 rokov) s rekurentným
gliómom mozgového kmeňa alebo s rekurentným astrocytómom vysokého stupňa v dávkovacom režime podávanom denne počas 5 dní každých 28 dní. Hoci sú údaje obmedzené, očakáva sa, že znášanlivosť u detí bude rovnaká ako u dospelých. Bezpečnosť TMZ u detí mladších ako 3 roky sa nestanovila.
Skúsenosti po uvedeníliekunatrh
Antineoplastické látky, a zvlášť alkylačné látky, boli spojené s potenciálnym rizikom
myelodysplastického syndrómu (MDS) a sekundárnych malignít, vrátane leukémie. U pacientov, liečených režimami s TMZ, boli hlásené veľmi zriedkavé prípady MDS a sekundárnych malignít,
vrátane myeloidnej leukémie. Bola hlásená predĺžená pancytopénia, ktorá môže vyústiť do aplastickej
anémie a v niektorých prípadoch viedla k fatálnemu koncu.
Veľmi zriedkavo boli hlásené prípady toxickej epidermálnej nekrolýzy a Stevens-Johnsonovho syndrómu.
Veľmi zriedkavo sa hlásili prípady intersticiálnej pneumonitídy/pneumonitídy, fibrózy pľúc
a fatálneho respiračného zlyhania.
Boli hlásené prípady hepatotoxicity vrátane zvýšenia hladín pečeňových enzýmov, hyperbilirubinémie, cholestázy a hepatitídy.
4.9 Predávkovanie
U pacientov sa klinicky hodnotili dávky 500, 750, 1 000 a 1 250 mg/m2 (celková dávka na cyklus počas 5 dní). Toxicita limitujúca dávku bola hematologická a táto bola hlásená pri všetkých dávkach, ale predpokladá sa, že bude závažnejšia pri vyšších dávkach. Jeden pacient sa predávkoval užitím dávky 10 000 mg (celková dávka v jednom cykle počas 5 dní). Nežiaduce reakcie hlásené pri tomto predávkovaní boli pancytopénia, pyrexia, multiorgánové zlyhanie a smrť. Existujú záznamy
o pacientoch, ktorí užívali odporúčanú dávku po dobu viac ako 5 dní liečby (až do 64 dní), pričom hlásené nežiaduce udalosti zahŕňali útlm kostnej drene s infekciou alebo bez nej, ktoré boli
v niektorých prípadoch závažné a pretrvávali dlhšiu dobu a skončili sa smrťou. V prípade
predávkovania je potrebné hematologické vyšetrenie. V prípade potreby sa majú vykonať podporné
opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Cytostatiká - Iné alkylačné látky, ATC kód: L01A X03
Spôsob účinkuTemozolomid je triazén, ktorý pri fyziologickom pH podlieha rýchlej chemickej konverzii na aktívny
monometyl-triazenoimidazol-karboxamid (MTIC). Predpokladá sa, že cytotoxicitu MTIC primárne spôsobuje alkylácia na pozícii O6 guanínu, spolu s ďalšou alkyláciou na pozícii N7. Cytotoxické lézie, ktoré sa rozvinú následne, pravdepodobne zapríčiňuje aberantná oprava metylovaného aduktu.
Klinická účinnosť abezpečnosťNovodiagnostikovaný multiformný glioblastómCelkovo 573 pacientov bolo randomizovaných tak, aby dostávali buď TMZ + RT (n=287), alebo RT
samotnú (n = 286). Pacienti v ramene TMZ + RT súbežne dostávali TMZ (75 mg/m2) raz denne, začínajúc v prvý deň RT až do posledného dňa RT, po dobu 42 dní (s maximom 49 dní). Potom
nasledovala monoterapia TMZ (150 - 200 mg/m2) 1. – 5. deň počas každého 28-dňového cyklu.
Liečba trvala až 6. cyklov a začínalo sa s ňou 4 týždne po ukončení RT. Pacienti v kontrolnom ramene
dostávali len RT. Počas RT a aj kombinovanej liečby TMZ sa vyžadovala profylaxia proti pneumónii spôsobenej
Pneumocystis jirovecii (PCP).
TMZ sa podával ako záchranná terapia vo fáze sledovania po liečbe 161 pacientom z 282 (57 %)
z ramena so samotnou RT a 62 pacientom z 277 (22 %) z ramena TMZ + RT.
Pomer rizika (Hazard ratio - HR) celkového prežívania bol 1,59 (95 % CI pre HR = 1,33 – 1,91) s log- rank p < 0,0001 v prospech ramena s TMZ. Odhadovaná pravdepodobnosť prežívania 2 alebo viac rokov (26 % vs. 10 %) bola vyššia v ramene RT + TMZ. Súbežné pridanie TMZ k RT, s následnou monoterapiou TMZ, pri liečbe pacientov s novodiagnostikovaným multiformným glioblastómom preukázalo štatisticky významné zlepšenie celkového prežívania (Overall Survival – OS) v porovnaní so samotnou RT (Obrázok 1).
 Obrázok 1 Kaplan-Meierove krivky celkového prežívania (Intent to Treat – populácia, v ktorej bola liečba zamýšľaná)
Obrázok 1 Kaplan-Meierove krivky celkového prežívania (Intent to Treat – populácia, v ktorej bola liečba zamýšľaná)
Výsledky zo skúšania neboli konzistentné v podskupine pacientov so slabým výkonnostným stavom (WHO PS = 2, n = 70), v ktorej bolo celkové prežívanie a čas do progresie podobné v oboch ramenách. Nezdá sa však, že by v tejto skupine pacientov boli prítomné neprijateľné riziká.
Rekurentný alebo progredujúcimalígnyglióm
Údaje o klinickej účinnosti u pacientov s multiformným glioblastómom (Karnofského skóre
[Karnofsky perfomance status – KPS] ≥70), progredujúcom alebo recidivujúcom po chirurgickej terapii a RT, sú založené na dvoch klinických skúšaniach s perorálnym TMZ. Jedno bolo nekomparatívne skúšanie u 138 pacientov (predtým dostávalo chemoterapiu 29 %) a druhé bolo randomizované aktívne kontrolované skúšanie TMZ vs prokarbazínu u celkovo 225 pacientov (pred liečbou dostávalo chemoterapiu na báze nitrózourey 67 % pacientov). Primárnym cieľom oboch skúšaní bolo stanoviť prežívanie bez progresie nádoru (progression free survival – PFS), definované MRI zobrazením alebo neurologickým zhoršením. V nekomparatívnom skúšaní bolo PFS v 6. mesiaci
19 %, medián prežívania bez progresie nádoru bol 2,1 mesiaca a medián celkového prežívania 5,4 mesiaca. Častosť objektívnej odpovede (Objective response rate – ORR), založená na MRI zobrazení, bola 8 %.
V randomizovanom aktívne kontrolovanom klinickom skúšaní bolo 6-mesačné PFS signifikantne dlhšie u TMZ než u prokarbazínu (21 % oproti 8 %, chí-kvadrát p = 0,008) s mediánom PFS 2,89 mesiacov pre TMZ a 1,88 mesiacov pre prokarbazín (log rank p = 0,0063). Medián prežívania pre
TMZ bol 7,34 mesiaca a pre prokarbazín 5,66 mesiacov (log rank p = 0,33). Po 6 mesiacoch bol podiel prežívajúcich pacientov signifikantne vyšší v TMZ ramene (60 %) oproti ramenu s prokarbazínom
(44 %) (chí-kvadrát p = 0,019). U pacientov s predchádzajúcou chemoterapiou bol zaznamenaný
prínos u tých, ktorých KPS bolo ≥ 80.
Údaje o čase do zhoršenia neurologického stavu boli v prospech TMZ oproti prokarbazínu, takisto ako údaje o čase do zhoršenia celkového stavu (pokles na KPS na < 70 alebo pokles o najmenej 30 bodov). Mediány časov do progresie nádoru podľa týchto cieľov boli u TMZ dlhšie v rozsahu 0,7 až 2,1 mesiaca než u prokarbazínu (log rank p = < 0,01 – 0,03).
Rekurentný anaplastický astrocytóm
V multicentrickom, prospektívnom klinickom skúšaní II. fázy, v ktorom sa vyhodnocovala bezpečnosť
a účinnosť liečby perorálnym TMZ u pacientov s anaplastickým astrocytómom pri prvom relapse, bolo 6-mesačné PFS 46 %. Medián PFS bol 5,4 mesiaca. Medián celkového prežívania bol 14,6 mesiacov. V populácii pacientov, u ktorých bola liečba zamýšľaná (ITT) n=162, bola, podľa zhodnotenia centrálnym recenzentom, častosť odpovede 35 % (13 dosiahlo kompletnú remisiu a 43 parciálnu). Stabilné ochorenie bolo hlásené u 43 pacientov. 6-mesačné prežívanie bez príhody bolo
v ITT populácii 44 % s mediánom prežívania bez príhody 4,6 mesiacov, čo bolo podobné výsledkom prežívania bez progresie. Výsledky účinnosti boli podobné aj u populácie, ktorá bola vhodná na histológiu. Dosiahnutie rádiologicky objektívnej odpovede alebo udržania stavu bez progresie bolo silne viazané s udržanou alebo zlepšenou kvalitou života.
Deti a dospievajúci
Perorálny TMZ sa skúmal u detských a dospievajúcich pacientov (vo veku 3-18 rokov) s rekurentným
gliómom mozgového kmeňa alebo rekurentným astrocytómom vysokého stupňa v dávkovacom režime podávanom denne počas 5 dní každých 28 dní. Tolerancia na TMZ je podobná ako u dospelých.
5.2 Farmakokinetické vlastnosti
TMZ sa pri fyziologickom pH spontánne hydrolyzuje na primárne účinné zložky, 3-metyl-(triazén-1- yl)imidazol-4-karboxamid (MTIC). MTIC sa spontánne hydrolyzuje na 5-aminoimidazol-4- karboxamid (AIC), známy medziprodukt pri biosyntéze purínu a nukleovej kyseliny, a na metylhydrazín, ktorý sa považuje za účinnú alkylačnú zložku. Predpokladá sa, že za cytotoxicitu
MTIC je primárne zodpovedná alkylácia DNA, predovšetkým na pozíciách O6 a N7 guanínu.
V závislosti od AUC TMZ je expozícia MTIC ~ 2,4 % a expozícia AIC ~ 23 %. In vivo bol t1/2 MTIC
podobný t1/2 TMZ, a to 1,8 hod.
Absorpcia
Po perorálnom podaní dospelým pacientom sa TMZ vstrebáva rýchlo a maximálne koncentrácie sa
dosahujú už za 20 minút po podaní (priemerný čas medzi 0,5 a 1,5 hodinou). Po perorálnom podaní TMZ označeného 14C, počas 7 dní po podaní, bola priemerná exkrécia 14C stolicou 0,8 %, čo ukazuje na jeho úplnú absorpciu.
Distribúcia
TMZ vykazuje nízku väzbu na bielkoviny (10 % až 20 %), a preto sa neočakáva jeho interakcia
s látkami, ktoré sa silne viažu na bielkoviny.
PET štúdie u ľudí, ako aj predklinické údaje ukazujú, že TMZ rýchlo prechádza hematoencefalickou bariérou a je prítomný v mozgovomiechovom moku. Prienik do mozgovomiechového moku bol potvrdený u jedného pacienta; meraním AUC sa zistilo, že koncentrácia TMZ v mozgovomiechovom moku dosahuje približne 30 % hladín v plazme, čo zodpovedá údajom zisteným u zvierat.
Eliminácia
Polčas (t1/2) v plazme je približne 1,8 hodín. Hlavnou cestou vylučovania 14C sú obličky. Po perorálnom podaní sa močom vylúči približne 5 % až 10 % dávky v nezmenenej forme v priebehu 24 hodín. Zvyšok sa vylúči ako kyselina temozolomidová, 5-aminoimidazol-4-karboxamid (AIC) alebo ako neidentifikované polárne metabolity.
Plazmatické koncentrácie stúpajú v závislosti od podanej dávky. Plazmatický klírens, distribučný objem a polčas sú nezávislé od podanej dávky.
Osobitné skupiny pacientov
Analýza populačnej farmakokinetiky TMZ ukázala, že plazmatický klírens TMZ bol nezávislý od
veku pacienta, renálnych funkcií alebo od fajčenia. V inej farmakokinetickej štúdii boli plazmatické farmakokinetické profily u pacientov s miernym alebo stredne ťažkým poškodením funkcie pečene
podobné plazmatickým farmakokinetickým profilom, pozorovaným u pacientov s normálnou funkciou
pečene.
Detskí pacienti mali vyššie AUC ako dospelí pacienti; avšak maximálna tolerovaná dávka (MTD) bola
1 000 mg/m2/cyklus u detí aj u dospelých.
5.3 Predklinické údaje o bezpečnosti
Boli vykonané jednocyklové (5-dní podávanie, 23 dní bez liečby), 3- a 6-cyklové štúdie toxicity na potkanoch a psoch. Toxicita sa primárne prejavila na kostnej dreni, lymforetikulárnom systéme, testes a gastrointestinálnom trakte. Vo vyšších dávkach, ktoré boli letálne pre 60 % až 100 % testovaných potkanov a psov, došlo ku degenerácii sietnice. Väčšina toxických zmien sa ukázala byť reverzibilných, výnimkou boli nežiaduce udalosti na mužský reprodukčný systém a degenerácia sietnice. Keďže sa však dávky, ktoré zapríčinili degeneráciu sietnice, pohybovali v rozmedzí letálnych dávok a porovnateľný účinok nebol pozorovaný v klinických štúdiách, tento nález sa nepokladá za klinicky významný.
TMZ je embryotoxická, teratogénna a genotoxická alkylačná látka. TMZ je toxickejší pre potkany
a psov ako pre ľudí a klinická dávka sa približuje minimálnej letálnej dávke u potkanov a u psov. Na dávke závislé redukcie leukocytov a trombocytov sa javia ako senzitívne indikátory toxicity. V 6- cyklovej štúdii na potkanoch sa zaznamenali rôzne nádory, vrátane mamárnych karcinómov,
keratoakantómov kože a bazocelulárnych adenómov, zatiaľ čo v štúdiách na psoch sa nádory alebo predneoplastické zmeny nezistili. Potkany sa javia byť zvlášť citlivé na onkogénne účinky TMZ, pričom prvé nádory sa zjavujú v priebehu 3 mesiacov od začiatku podávania. Táto doba latencie je veľmi krátka aj pre alkylačnú látku.
Testy chromozómových aberácií Ames/salmonely a ľudských lymfocytov z periférnej krvi (Human
Peripheral Blood Lymphocyte - HPBL) ukázali pozitívnu mutagénnnu odpoveď.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsahkapsuly: bezvodá laktóza, koloidný oxid kremičitý,
sodná soľ karboxymetylškrobu typu A, kyselina vínna,
kyselina stearová.
Obalkapsuly:
želatína,
oxid titaničitý (E 171),
laurylsíran sodný.
Potlač: šelak, propylénglykol, čistená voda, hydroxid amónny, hydroxid draselný,
čierny oxid železitý (E 172).
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Balenie vo fľaši
Uchovávajte pri teplote neprevyšujúcej 30 °C.
Uchovávajte v pôvodnej fľaši na ochranu pred vlhkosťou. Fľašu udržiavajte dôkladne uzatvorenú.
Balenie vo vrecku
Uchovávajte pri teplote neprevyšujúcej 30 °C.
6.5 Druh obalu a obsah balenia
B
alenie vo fľašiFľašky z jantárového skla typu I s polypropylénovými uzávermi bezpečnými pred deťmi obsahujúce 5
alebo 20 tvrdých kapsúl. Škatuľka obsahuje jednu fľašu.
Balenie vo vreckuVrecká sa skladajú z lineárneho polyetylénu s nízkou hustotou (najvnútornejšia vrstva), hliníka
a polyetyléntereftalátu.
Každé vrecko obsahuje 1 tvrdú kapsulu a dodáva sa v papierovej škatuli.
Škatuľa obsahuje 5 alebo 20 tvrdých kapsúl jednotlivo uzatvorených vo vreckách. Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomKapsuly sa nesmú otvárať. Ak je kapsula poškodená, musíte zabrániť kontaktu práškového obsahu
s kožou alebo sliznicou. Ak sa Temodal dostane do kontaktu s kožou alebo sliznicou, okamžite
a dôkladne sa musí postihnutá oblasť umyť mydlom a vodou.
Pacientov treba poučiť, aby kapsuly uchovávali mimo dohľadu a dosahu detí, najlepšie v uzamknutej skrini. Náhodné prehltnutie môže byť pre deti smrteľné.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMerck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU
Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/98/096/007
EU/1/98/096/008
EU/1/98/096/021
EU/1/98/096/022
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 26. január 1999. Dátum posledného predĺženia: 26. január 2009.
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu