
toacidózy sa musí zvážiť v prípade nešpecifických symptómov, ako sú nauzea, vracanie, anorexia, bolesť brucha, nadmerný smäd, ťažkosti s dýchaním, zmätenosť, neobvyklá únava alebo ospalosť. Ak sa vyskytnú tieto príznaky, pacienti majú byť okamžite vyšetrení na ketoacidózu, bez ohľadu na hladinu glukózy v krvi.
U pacientov so suspektnou alebo diagnostikovanou DKA sa má liečba empagliflozínom okamžite prerušiť.
Liečba sa má prerušiť u pacientov hospitalizovaných kvôli závažným chirurgickým zákrokom alebo akútnym závažným ochoreniam. V obidvoch prípadoch je možné liečbu empagliflozínom obnoviť po stabilizovaní stavu pacienta.
Pred začatím liečby empagliflozínom sa majú zvážiť faktory v anamnéze pacienta, ktoré by ho mohli predisponovať ku ketoacidóze.
Pacienti, u ktorých môže byť vyššie riziko DKA zahŕňajú pacientov s nízkou funkčnou rezervou beta-buniek (napr. pacienti s diabetom typu 2 s nízkou hladinou C-peptidu alebo latentným autoimunitným diabetom u dospelých (LADA) alebo pacienti s pankreatitídou v anamnéze), pacienti s ochoreniami vedúcimi k obmedzenému príjmu potravy alebo k závažnej dehydratácii, pacienti,
u ktorých sú dávky inzulínu znížené, a pacienti so zvýšenou potrebou inzulínu z dôvodu akútneho ochorenia, chirurgického zákroku alebo nadmerného požívania alkoholu. U týchto pacientov sa majú
používať inhibítory SGLT2 s opatrnosťou.
Obnovenie liečby inhibítormi SGLT2 u pacientov s anamnézou DKA počas liečby inhibítormi SGLT2 sa neodporúča, s výnimkou prípadov, keď bol identifikovaný a vyriešený iný jednoznačný spúšťací faktor DKA.
Bezpečnosť a účinnosť empagliflozínu u pacientov s diabetom typu 1 sa nestanovili a empagliflozín sa nemá používať na liečbu pacientov s diabetom typu 1. Obmedzené údaje z klinických skúšaní naznačujú, že DKA sa vyskytuje často u pacientov s diabetom typu 1 liečených inhibítormi SGLT2.
Laktátová acidóza
Laktátová acidóza je veľmi zriedkavá, ale závažná (vysoká mortalita, ak nie je k dispozícii okamžitá
liečba), metabolická komplikácia, ktorá sa môže objaviť z dôvodu akumulácie metformínu. Hlásené prípady laktátovej acidózy u pacientov užívajúcich metformín sa objavili hlavne u pacientov s diabetes
mellitus so zlyhaním obličiek alebo s akútnym zhoršením funkcie obličiek. V situáciách, pri ktorých
môže dôjsť k poruche funkcie obličiek, napríklad v prípade dehydratácie (závažná hnačka alebo vracanie) alebo na začiatku antihypertenzívnej liečby alebo liečby diuretikami alebo na začiatku liečby
nesteroidovým protizápalovým liekom (NSAID), je potrebná osobitná opatrnosť. Pri uvedených
akútnych stavoch dočasne prerušte podávanie metformínu.
Pre zabránenie laktátovej acidózy je potrebné zhodnotiť iné súvisiace rizikové faktory, ako sú zle kontrolovaný diabetes, ketóza, dlhotrvajúce hladovanie, nadmerné požívanie alkoholu, porucha funkcie pečene a akýkoľvek stav spojený s hypoxiou (ako napríklad dekompenzované srdcové zlyhanie, akútny infarkt myokardu) (pozri časť 4.3).
Riziko laktátovej acidózy sa musí zvážiť v prípade nešpecifických prejavov, ako sú svalové kŕče, tráviace ťažkosti, ako je bolesť brucha a ťažká asténia. Pacientov je potrebné informovať, aby tieto prejavy v prípade ich výskytu okamžite hlásili svojmu lekárovi, najmä ak pacienti metformín predtým dobre tolerovali. Liek Synjardy prestaňte podávať, aspoň dočasne, kým sa situácia neustáli. Opätovné zahájenie podávania lieku Synjardy je potrebné následne konzultovať a zvážiť pomer prínosu a rizika u jednotlivých osôb, ako aj funkciu obličiek.
Diagnóza
Laktátová acidóza je charakterizovaná acidotickým dyspnoe, bolesťou brucha a hypotermiou, po ktorých nasleduje kóma. Diagnostickými laboratórnymi nálezmi sú znížená hodnota pH krvi,
plazmatické hladiny laktátu nad 5 mmol/l a zvýšená aniónová medzera a pomer laktátu/pyruvátu. V
prípade laktátovej acidózy má byť pacient okamžite hospitalizovaný (pozri časť 4.9).
Lekári by mali pacientov upozorniť na riziko a príznaky laktátovej acidózy.
Poruchafunkcie obličiek
Vzhľadom na mechanizmus účinku bude znížená funkcia obličiek viesť k zníženej účinnosti
empagliflozínu. Metformín sa vylučuje obličkami. Pred začiatkom liečby a pravidelne potom sa majú preto stanovovať sérové hladiny kreatinínu:
· minimálne raz za rok u pacientov s normálnou funkciou obličiek.
· minimálne dva až štyrikrát za rok u pacientov s hladinami kreatinínu v sére v hornej hranici normálu a u starších jedincov.
Znížená funkcia obličiek u starších pacientov je častá a asymptomatická. V situáciách, kedy sa funkcia
obličiek môže poškodiť, napr. v prípade dehydratácie alebo pri začiatku antihypertenzívnej liečby alebo liečby diuretikami a pri začiatku liečby nesteroidným protizápalovým liekom (NSAID), sa má postupovať s opatrnosťou.
V takýchto prípadoch sa pred zahájením liečby liekom Synjardy odporúča skontrolovať funkciu obličiek.
Funkcia srdca
U pacientov so zlyhávaním srdca je vyššie riziko hypoxie a renálnej insuficiencie U pacientov so
stabilným chronickým zlyhávaním srdca je možné liek Synjardy používať spolu s pravidelným sledovaním funkcie srdca a obličiek. U pacientov s akútnym a nestabilným zlyhávaním srdca je liek Synjardy kontraindikovaný (pozri časť 4.3).
Poškodenie pečene
Pri empagliflozíne sa v klinických štúdiách hlásili prípady poškodenia pečene. Príčinný vzťah medzi
empagliflozínom a poškodením pečene sa nestanovil.
Podanie kontrastnejlátkyobsahujúcejjód
Intravaskulárne podanie kontrastných materiálov obsahujúcich jód v rádiologických štúdiach môže
viesť k zlyhaniu obličiek. Môže to indukovať kumuláciu metformínu a zvýšiť riziko laktátovej acidózy. Tento liek sa preto musí pred vyšetrením alebo v čase vyšetrenia vysadiť a nesmie sa opätovne nasadiť
skôr ako 48 hodín potom a smie sa nasadiť len po opätovnom vyhodnotení funkcie obličiek a pri zistení,
že nedošlo k jej ďalšiemu zhoršeniu (pozri časť 4.5).
Chirurgický zákrok
Keďže tento liek obsahuje metformín, liečba sa musí vysadiť 48 hodín pred elektívnym chirurgickým
zákrokom s celkovou, spinálnou alebo peridurálnou anestéziou. Liečba sa zvyčajne nesmie opätovne nasadiť skôr ako 48 hodín po chirurgickom zákroku a len po opätovnom vyhodnotení funkcie obličiek a
pri zistení, že je normálna.
Riziko deplécieobjemu
Na základe mechanizmu účinku inhibítorov SGLT2 môže osmotická diuréza sprevádzajúca
terapeutickú glukozúriu viesť k miernemu poklesu krvného tlaku (pozri časť 5.1). U pacientov, pre ktorých môže pokles krvného tlaku vyvolaný empagliflozínom predstavovať riziko, ako sú pacienti so
známym kardiovaskulárnym ochorením, pacienti užívajúci liečbu antihypertenzívami s hypotenziou v
anamnéze alebo pacienti vo veku 75 rokov a starší, sa má preto postupovať opatrne.
V situáciách, ktoré môžu viesť k strate tekutín (napr. ochorenie gastrointestinálneho traktu), sa u pacientov užívajúcich Synjardy odporúča pozorné sledovanie stavu objemu (napr. telesné vyšetrenie, merania krvného tlaku, laboratórne vyšetrenia vrátane hematokritu) a elektrolytov. Kým nedôjde k náprave straty tekutín, má sa zvážiť dočasné prerušenie liečby liekom Synjardy.
Infekcie močovýchciest
Celková frekvencia výskytu infekcie močových ciest, ktorá sa hlásila ako nežiaduca udalosť, bola u
pacientov liečených 10 mg empagliflozínu k základnej liečbe metformínom vyššia v porovnaní s pacientmi liečenými placebom alebo 25 mg empagliflozínu k základnej liečbe metformínom (pozri
časť 4.8). Komplikovaná infekcia močových ciest (napr. pyelonefritída alebo urosepsa) sa vyskytla v
podobnej frekvencii u pacientov liečených empagliflozínom v porovnaní s placebom. U pacientov s komplikovanými infekciami močových ciest sa má však zvážiť dočasné vysadenie empagliflozínu.
Staršie osoby
Účinok empagliflozínu na vylučovanie glukózy močom súvisí s osmotickou diurézou, ktorá môže
ovplyvniť stav hydratácie. U pacientov vo veku 75 rokov a starších sa môže vyskytovať zvýšené riziko deplécie objemu. Terapeutické skúsenosti u pacientov vo veku 85 rokov a starších sú obmedzené. V
tejto populácii sa neodporúča začínať liečbu (pozri časť 4.2).
Zlyhanie srdca
Skúsenosti so zlyhaním srdca triedy I-II podľa klasifikácie Newyorskej srdcovej asociácie (NYHA) sú
obmedzené a v klinických štúdiách s empagliflozínom neexistujú žiadne skúsenosti so zlyhaním srdca triedy III-IV podľa klasifikácie NYHA.
Laboratórne vyhodnoteniamoču
Vzhľadom na mechanizmus účinku lieku budú mať pacienti užívajúci Synjardy pozitívny výsledok
vyšetrenia glukózy v moči.
4.5 Liekové a iné interakcie
Spolu podávanie opakovaných dávok empagliflozínu a metformínu u zdravých jedincov významne nemení farmakokinetiku empagliflozínu alebo metformínu.
Pri lieku Synjardy sa neuskutočnili žiadne interakčné štúdie. Nasledujúce tvrdenia odzrkadľujú informácie, ktoré sú dostupné pri jednotlivých liečivách.
Empagliflozín
Farmakodynamickéinterakcie
Diuretiká
Keďže Synjardy obsahuje empagliflozín, môže prispieť k diuretickému účinku tiazidu a kľučkových diuretík a môže zvýšiť riziko dehydratácie a hypotenzie (pozri časť 4.4).
Inzulín a liečivá podporujúce vylučovanie inzulínu
Inzulín a liečivá podporujúce vylučovanie inzulínu, ako sú sulfonylmočoviny, môžu zvýšiť riziko hypoglykémie. Na zníženie rizika hypoglykémie sa preto môže vyžadovať nižšia dávka inzulínu alebo liečiva podporujúceho vylučovanie inzulínu, ak sa používa v kombinácii s empagliflozínom (pozri časti 4.2 a 4.8).
Farmakokinetické interakcie
Účinky iných liekov na empagliflozín
Údaje in vitro naznačujú, že primárnou cestou metabolizmu empagliflozínu u ľudí je glukuronidácia prostredníctvom uridín 5‘-difosfát glukuronyltransferázy UGT1A3, UGT1A8, UGT1A9 a UGT2B7.
Empagliflozín je substrát ľudských vychytávacích transportérov OAT3, OATP1B1 a OATP1B3, ale nie
OAT1 a OCT2. Empagliflozín je substrát P-glykoproteínu (P-gp) a proteínu rezistencie rakoviny prsníka (breast cancer resistance protein, BCRP).
Súbežné podávanie empagliflozínu s probenecidom, inhibítorom enzýmov UGT a OAT3, viedlo k 26 % zvýšeniu maximálnych plazmatických koncentrácií (Cmax) empagliflozínu a k 53 % zvýšeniu plochy pod krivkou závislosti koncentrácie od času (AUC). Tieto zmeny sa nepovažovali za klinicky významné.
Účinok indukcie UGT na empagliflozín sa neskúmal. Má sa predísť súbežnému podávaniu so známymi induktormi enzýmov UGT z dôvodu možného rizika poklesu účinnosti.
Interakčná štúdia s gemfibrozilom, inhibítorom transportérov OAT3 a OATP1B1/1B3 in vitro, preukázala, že sa po súbežnom podaní zvýšila Cmax empagliflozínu o 15 % a AUC o 59 %. Tieto zmeny sa nepovažovali za klinicky významné.
Inhibícia transportérov OATP1B1/1B3 v dôsledku súbežného podávania s rifampicínom viedla k 75 % zvýšeniu Cmax a k 35 % zvýšeniu AUC empagliflozínu. Tieto zmeny sa nepovažovali za klinicky významné.
Pri súbežnom podávaní verapamilu, inhibítora P-gp a bez neho bola expozícia empagliflozínu podobná, čo naznačuje, že inhibícia P-gp nemá žiadny klinicky významný vplyv na empagliflozín.
Interakčné štúdie vykonané u zdravých dobrovoľníkov naznačujú, že farmakokinetika empagliflozínu nebola ovplyvnená súbežným podávaním s metformínom, glimepiridom, pioglitazónom, sitagliptínom, linagliptínom, warfarínom, verapamilom, ramiprilom, simvastatínom, torasemidom a hydrochlórotiazidom.
Účinky empagliflozínu na iné lieky
Na základe štúdií in vitro empagliflozín neinhibuje, neinaktivuje ani neindukuje izoformy CYP450. Empagliflozín neinhibuje UGT1A1, UGT1A3, UGT1A8, UGT1A9 alebo UGT2B7. Liekové interakcie
týkajúce sa hlavných izoforiem CYP450 a UGT s empagliflozínom a súbežne podávanými substrátmi týchto enzýmov sa preto považujú za nepravdepodobné.
Empagliflozín v terapeutických dávkach neinhibuje P-gp. Na základe štúdií in vitro sa považuje za nepravdepodobné, že by empagliflozín spôsoboval interakcie s liekmi, ktoré sú substrátmi P-gp. Súbežné podávanie digoxínu, substrátu P-gp, s empagliflozínom viedlo k 6 % zvýšeniu AUC a k 14 % zvýšeniu Cmax digoxínu. Tieto zmeny sa nepovažovali za klinicky významné.
Empagliflozín in vitro neinhibuje ľudské vychytávacie transportéry, ako sú OAT3, OATP1B1 a OATP1B3, pri klinicky významných plazmatických koncentráciách a liekové interakcie so substrátmi týchto vychytávacích transportérov sa ako také považujú za nepravdepodobné.
Interakčné štúdie vykonané u zdravých dobrovoľníkov naznačujú, že empagliflozín nemá žiadny klinicky významný účinok na farmakokinetiku metformínu, glimepiridu, pioglitazónu, sitagliptínu, linagliptínu, simvastatínu, warfarínu, ramiprilu, digoxínu, diuretík a perorálnych kontraceptív.
Metformín
Kombinácie,ktorésaneodporúčajú
Pri akútnej intoxikácii alkoholom existuje zvýšené riziko laktátovej acidózy (najmä v prípade hladovania, nedostatočnej výživy alebo poškodenia funkcie pečene spôsobeného liečivom metformín (pozri časť 4.4)). Je potrebné predísť konzumácii alkoholu a liekov obsahujúcich alkohol.
Katiónové liečivá, ktoré sa eliminujú tubulárnou sekréciou v obličkách (napr. cimetidín), môžu interagovať s metformínom súperením o tubulárne transportné systémy v obličkách.
Intravaskulárne podanie kontrastných látok obsahujúcich jód v rádiologických štúdiach môže viesť k zlyhaniu obličiek, čo má za následok akumuláciu metformínu a riziko laktátovej acidózy. Tento liek sa preto musí pred vyšetrením alebo v čase vyšetrenia vysadiť a nesmie sa opätovne nasadiť do 48 hodín
potom a smie sa nasadiť len po opätovnom vyhodnotení funkcie obličiek a pri zistení, že nedošlo k jej ďalšiemu zhoršeniu (pozri časť 4.4).
Kombinácia,priktorejsavyžadujeopatrnosťpripoužívaní
Glukokortikoidy (podávané systémovo alebo lokálne), beta-2-agonisty a diuretiká majú vnútorný hyperglykemický účinok. Pacientov je potrebné informovať a má sa vykonávať častejšie sledovanie hladiny glukózy v krvi, najmä na začiatku liečby takýmito liekmi. Ak je to nevyhnutné, dávka lieku s antihyperglykemickým účinkom sa má upraviť počas liečby iným liekom a po jeho vysadení.
Inzulín a liečivá podporujúce vylučovanie inzulínu
Inzulín a liečivá podporujúce vylučovanie inzulínu, ako sú sulfonylmočoviny, môžu zvýšiť riziko hypoglykémie. Na zníženie rizika hypoglykémie sa preto môže vyžadovať nižšia dávka inzulínu alebo liečiva podporujúceho vylučovanie inzulínu, ak sa používa v kombinácii s metformínom (pozri časti 4.2 a 4.8).
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne údaje o použití tohto lieku alebo empagliflozínu u gravidných žien. Štúdie na
zvieratách preukazujú, že empagliflozín v neskorom štádiu gravidity prechádza placentou vo veľmi obmedzenom rozsahu, ale nenaznačujú priame ani nepriame účinky z hľadiska skorého embryonálneho
vývoja. Štúdie na zvieratách však preukázali nežiaduce účinky na postnatálny vývin. Obmedzené množstvo údajov naznačuje, že užívanie metformínu u gravidných žien nie je spojené so zvýšeným rizikom vrodených malformácií. Štúdie na zvieratách s kombináciou empagliflozínu a metformínu
alebo s metformínom samotným preukázali reprodukčnú toxicitu len pri vyšších dávkach metformínu
(pozri časť 5.3).
Ak pacientka plánuje graviditu a počas gravidity sa odporúča, aby sa diabetes mellitus neliečil týmto liekom, ale aby sa na udržanie čo najnormálnejších hladín glukózy v krvi použil inzulín, aby sa znížilo riziko malformácií plodu, ktoré je spojené s abnormálnymi hladinami glukózy v krvi.
Dojčenie
Metformín sa vylučuje do ľudského mlieka. Nepreukázal sa žiaden účinok u dojčených
novorodencov/dojčiat liečených žien. O vylučovaní empagliflozínu do mlieka nie sú u ľudí k dispozícii žiadne údaje. Dostupné údaje pri zvieratách preukázali vylučovanie empagliflozínu a metformínu do mlieka. Riziko u novorodencov/dojčiat nemôže byť vylúčené.
Tento liek sa nemá používať počas laktácie. Fertilita
Nevykonali sa žiadne štúdie o účinku tohto lieku alebo empagliflozínu na fertilitu u ľudí. Štúdie s
empagliflozínom alebo metformínom na zvieratách nepreukázali priame alebo nepriame účinky z hľadiska fertility (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Synjardy má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti majú byť poučení, aby počas vedenia vozidiel a obsluhy strojov vykonali opatrenia na zabránenie hypoglykémii, najmä ak sa Synjardy používa v kombinácii so sulfonylmočovinou a/alebo inzulínom.
4.8 Nežiaduce účinky
Súhrn profilubezpečnosti
Do klinických štúdií na vyhodnotenie bezpečnosti empagliflozínu vo forme prídavnej liečby k
metformínu bolo zaradených celkovo 7052 pacientov s diabetes mellitus 2. typu, z ktorých 4740
pacientov bolo liečených empagliflozínom vo forme prídavnej liečby k metformínu.
Placebom kontrolované dvojito zaslepené štúdie 18- až 24-týždňovej expozície zahŕňali 3456 pacientov, z ktorých 1271 bolo liečených 10 mg empagliflozínu vo forme prídavnej liečby k metformínu a 1259 bolo liečených 25 mg empagliflozínu vo forme prídavnej liečby k metformínu. Najčastejšie hlásené nežiaduce udalosti v klinických štúdiách pri kombinácii s inzulínom a/alebo sulfonylmočovinou boli hypoglykémia, infekcie močových ciest, infekcie genitálneho traktu a zvýšená miera močenia (pozri popis vybraných vedľajších účinkov). V klinických štúdiách s empagliflozínom vo forme prídavnej liečby k metformínu sa neidentifikovali žiadne ďalšie nežiaduce reakcie v porovnaní s vedľajšími účinkami pri jednotlivých zložkách.
Tabuľkový zoznamnežiaducichreakcií
Nežiaduce reakcie sú uvedené podľa absolútnej frekvencie. Frekvencie sú definované ako veľmi časté
(≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1
000), veľmi zriedkavé (< 1/10 000) alebo neznáme (z dostupných údajov).
Tabuľka 1: Nežiaduce reakcie hlásené v štúdiách kontrolovaných placebom
Trieda orgánových systémov
Infekcie a nákazy
Veľmi časté Časté Menej časté
Vaginálna kandidóza, vulvovaginitída, balanitída a iná infekcia pohlavných orgánov1, 2
Infekcia močových ciest1, 2
Zriedkavé Veľmi zriedkavé
Poruchy metabolizmu a výživy
Poruchy nervového systému
Hypoglykémia (pri užívaní so sulfonylmočovinou alebo inzulínom)1
Poruchy chuti3
Diabetická ketoacidóza a, b
Laktátová acidóza3
Nedostatok
vitamínu
B123, 4
Poruchy ciev Deplécia objemu1, 2
Poruchy gastro- intestinálneho traktu
Poruchy pečene a žlčových ciest
Poruchy kože a podkožného tkaniva Poruchy obličiek a močových ciest Laboratórne
a funkčné vyšetrenia
Gastrointestinálne príznaky3, 5
Pruritus
(generalizovaný)
Zvýšená miera močenia1, 2
Dysúria2
Zvýšená hladina kreatinínu v krvi/pok les glomerulá rnej filtrácie1
Abnormality vyšetrení funkcie pečene3
Hepatitída3
Erytém3
Urtikária3

1 Ďalšie informácie nájdete v podčastiach nižšie.
2 Identifikované nežiaduce reakcie empagliflozínu v monoterapii.
3 Identifikované nežiaduce reakcie metformínu v monoterapii.
4 Dlhodobá liečba metformínom bola spojená so zníženou absorpciou vitamínu B12, čo môže veľmi zriedkavo viesť ku klinicky významnému nedostatku vitamínu B12 (napr. megaloblastická anémia).
5 Gastrointestinálne príznaky, ako je napr. nevoľnosť, vracanie, hnačka, bolesť brucha a strata chuti do
jedla sa objavujú najčastejšie počas začiatku liečby a vo väčšine prípadov odoznejú spontánne.
a vyplýva zo skúseností po uvedení lieku na trh
b pozri časť 4.4
Popis vybranýchnežiaducichreakcií
Hypoglykémia
Frekvencia výskytu hypoglykémie závisela od základnej liečby v príslušných štúdiách.
Celková hypoglykémia
Frekvencia výskytu pacientov s hypoglykemickými príhodami bola podobná pri empagliflozíne a placebe vo forme prídavnej liečby k metformínu a pri kombinácii empagliflozínu s metformínom u
pacientov doteraz neliečených liekmi v porovnaní s pacientmi liečenými empagliflozínom a
metformínom ako samostatnými zložkami. Zvýšená frekvencia sa zaznamenala v prípade, ak sa empagliflozín podával vo forme prídavnej liečby k metformínu a sulfonylmočovine (10 mg
empagliflozínu: 16,1 %, 25 mg empagliflozínu: 11,5 % a placebo: 8,4 %) alebo vo forme prídavnej
liečby k metformínu a inzulínu (10 mg empagliflozínu: 31,3 %, 25 mg empagliflozínu: 36,2 % a placebo: 34,7 %).
Silná hypoglykémia (hypoglykémia vyžadujúca pomoc)
Frekvencia výskytu pacientov s príhodami silnej hypoglykémie bola nízka (< 1 %) a podobná pri empagliflozíne a placebe vo forme prídavnej liečby k metformínu a pri kombinácii empagliflozínu s metformínom u pacientov doteraz neliečených liekmi v porovnaní s pacientmi liečenými empagliflozínom a metformínom ako samostatnými zložkami. Udalosti silnej hypoglykémie sa objavili u 0,5 % pacientov liečených 10 mg empagliflozínu, 0 % pacientov liečených 25 mg empagliflozínu a
0,5 % pacientov liečených placebom pri pridaní k metformínu a inzulínu. Pri kombinácii metformínu a sulfonylmočoviny sa udalosť silnej hypoglykémie nevyskytla u žiadneho pacienta.
Infekciamočovýchciest
Celková frekvencia výskytu nežiaducich udalostí infekcie močových ciest bola vyššia u pacientov liečených metformínom, ktorí dostávali 10 mg empagliflozínu (8,8 %) v porovnaní s 25 mg empagliflozínu (6,6 %) alebo placebom (7,8 %). Podobne ako pri placebe, infekcia močových ciest sa hlásila častejšie pri empagliflozíne u pacientov s chronickými alebo opätovne sa vyskytujúcimi infekciami močových ciest v anamnéze. Závažnosť infekcií močových ciest (t. j. mierna/stredne závažná/závažná) bola podobná placebu. Udalosti infekcie močových ciest sa častejšie hlásili pri 10 mg empagliflozínu v porovnaní s placebom u žien, ale nie pri 25 mg empagliflozínu. Frekvencie výskytu infekcií močových ciest boli nízke u mužov a medzi liečebnými skupinami boli vyrovnané.
Vaginálnakandidóza,vulvovaginitída,balanitídaaináinfekciapohlavnýchorgánov
U pacientov liečených metformínom, ktorí dostávali 10 mg empagliflozínu (4,0 %) a 25 mg empagliflozínu (3,9 %), sa v porovnaní s placebom (1,3 %) častejšie hlásila vaginálna kandidóza, vulvovaginitída, balanitída a iné infekcie pohlavných orgánov a častejšie sa hlásili u žien pri
empagliflozíne v porovnaní s placebom. Táto odlišnosť vo frekvencii výskytu bola menej výrazná u mužov. Intenzita infekcií pohlavných orgánov bola mierna a stredne závažná, žiadna z nich nebola závažná.
Zvýšenámieramočenia
Ako sa predpokladalo na základe mechanizmu účinku, zvýšená miera močenia (na základe hodnotenia
PT vyšetrenia vrátane polakizúrie, polyúrie a noktúrie) sa vo vyšších frekvenciách pozorovala u pacientov liečených metformínom, ktorí dostávali 10 mg empagliflozínu (3,0 %) a 25 mg empagliflozínu (2,9 %) v porovnaní s placebom (1,4 %) vo forme prídavnej liečby k metformínu. Intenzita zvýšenej miery močenia bola mierna až stredne závažná. Frekvencia výskytu hlásenej noktúrie bola medzi placebom a empagliflozínom porovnateľná (< 1 %).
Deplécia
objemu
Celková frekvencia výskytu deplécie objemu (vrátane vopred definovaných pojmov zníženého krvného tlaku (ambulantne), zníženého systolického krvného tlaku, dehydratácie, hypotenzie, hypovolémie, ortostatickej hypotenzie a synkopy) bola u pacientov liečených metformínom, ktorí dostávali empagliflozín, nízka: 0,6 % pri 10 mg empagliflozínu, 0,3 % pri 25 mg empagliflozínu a 0,1 % pri placebe. Účinok empagliflozínu na vylučovanie glukózy močom súvisí s osmotickou diurézou, ktorá môže ovplyvniť stav hydratácie pacientov vo veku 75 rokov a starších. U pacientov vo veku ≥ 75 rokov sa udalosti deplécie objemu hlásili u jedného pacienta liečeného 25 mg empagliflozínu vo forme prídavnej liečby k metformínu.
Zvýšenáhladinakreatinínuvkrvi/poklesglomerulárnejfiltrácieCelková frekvencia výskytu pacientov so zvýšenou hladinou kreatinínu v krvi a poklesom glomerulárnej filtrácie bola podobná pri empagliflozíne a placebe (nárast kreatinínu v krvi:
empagliflozín 10 mg 0,6 %, empagliflozín 25 mg 0,1 %, placebo 0,5 %, pokles glomerulárnej filtrácie:
empagliflozín 10 mg 0,1 %, empagliflozín 25 mg 0 %, placebo 0,3 %).
Úvodné nárasty kreatinínu a úvodné poklesy odhadovanej glomerulárnej filtrácie u pacientov liečených empagliflozínom ako prídavnou liečbou k liečbe metformínom boli vo všeobecnosti dočasné pri
kontinuálnej liečbe alebo vratné po prerušení liečby liekom.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovaniePríznakyEmpagliflozínJednorazové dávky až do 800 mg empagliflozínu (čo zodpovedá až 32-násobku najvyššej odporúčanej dennej dávky) u zdravých dobrovoľníkov a opakované denné dávky až do 100 mg empagliflozínu (čo
zodpovedá 4-násobku najvyššej odporúčanej dennej dávky) u pacientov s diabetes mellitus 2. typu
nepreukázali v kontrolovaných klinických štúdiách žiadny toxický účinok. Empagliflozín zvýšil vylučovanie glukózy močom, čo viedlo k zvýšeniu objemu moču. Pozorované zvýšenie objemu moču
nebolo závislé od dávky a nie je klinicky významné. U ľudí neexistujú žiadne skúsenosti s dávkami nad
800 mg.
MetformínPri dávkach metformínu až do 85 g sa hypoglykémia nepozorovala, hoci v takýchto prípadoch sa objavila laktátová acidóza. Predávkovanie vysokými dávkami metformínu alebo súbežné riziká môžu
viesť k laktátovej acidóze. Laktátová acidóza je naliehavým zdravotným stavom a musí sa liečiť v nemocnici.
LiečbaV prípade predávkovania sa má začať s liečbou, ktorá je primeraná klinickému stavu pacienta.
Najúčinnejšou metódou na odstránenie laktátu a metformínu je hemodialýza. Odstránenie empagliflozínu hemodialýzou sa neskúmalo.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antidiabetiká, kombinácia perorálnych antidiabetík, ATC kód: A10BD20
Mechanizmus účinku
Synjardy kombinuje dve antihyperglykemické liečivá s komplementárnymi mechanizmami účinku na
zlepšenie kontroly glykémie u pacientov s diabetes mellitus typu 2: empagliflozín, inhibítor kotranspotéra sodíka a glukózy 2 (SGLT2) a metformíniumchlorid, člen skupiny biguanidov.
Empagliflozín
Empagliflozín je reverzibilný, vysoko účinný (IC50 1,3 nmol) a selektívny kompetitívny inhibítor SGLT2. Empagliflozín neinhibuje iné transportéry glukózy, ktoré sú dôležité pre transport glukózy do periférnych tkanív a je 5000-násobne selektívnejší pre SGLT2 v porovnaní so SGLT1, hlavným transportérom zodpovedným za vstrebávanie glukózy v čreve. SGLT2 je vo vysokej miere exprimovaný v obličkách, zatiaľ čo k jeho expresii v ostatných tkanivách nedochádza alebo je veľmi nízka. Ako hlavný transportér zodpovedá za reabsorpciu glukózy z glomerulárneho filtrátu späť do krvného obehu. U pacientov s diabetes mellitus 2. typu a hyperglykémiou sa prefiltruje a reabsorbuje vyššie množstvo glukózy.
Empagliflozín zlepšuje kontrolu glykémie u pacientov s diabetes mellitus 2. typu znížením reabsorpcie glukózy v obličkách. Množstvo glukózy vylúčené obličkami prostredníctvom tohto mechanizmu vylučovania glukózy do moču závisí od koncentrácie glukózy v krvi a GFR. Inhibícia SGLT2 u pacientov s diabetes mellitus 2. typu a hyperglykémiou vedie k rozsiahlemu vylučovaniu glukózy do moču.
U pacientov s diabetes mellitus 2. typu sa vylučovanie glukózy močom zvýšilo okamžite po prvej dávke empagliflozínu a pretrváva počas 24-hodinového intervalu dávkovania. Zvýšené vylučovanie glukózy močom sa na konci 4-týždňového obdobia liečby udržalo, pričom priemer bol približne 78 g/deň pri
25 mg empagliflozínu. Zvýšené vylučovanie glukózy močom viedlo u pacientov s diabetes mellitus
2. typu k okamžitému zníženiu plazmatickej hladiny glukózy.
Empagliflozín zlepšuje plazmatickú hladinu glukózy nalačno a aj po jedle. Mechanizmus účinku empagliflozínu nie je závislý od funkcie beta buniek a dráhy inzulínu a to prispieva k nízkemu riziku hypoglykémie. Zaznamenalo sa zlepšenie náhradných ukazovateľov funkcie beta buniek vrátane hodnotenia pomocou modelu homeostázy β (Homeostasis Model Assessment-β, HOMA-β). Navyše vylučovanie glukózy močom spúšťa úbytok kalórií spojený s úbytkom telesného tuku a znížením telesnej hmotnosti. Glukozúria pozorovaná pri empagliflozíne je spojená s miernou diurézou, ktorá môže prispievať k pretrvávajúcemu a stredne závažnému zníženiu krvného tlaku.
Metformín
Metformín je biguanid s antihyperglykemickými účinkami, ktorý znižuje bazálnu a postprandiálnu plazmatickú glukózu. Nestimuluje sekréciu inzulínu, a preto nespôsobuje hypoglykémiu.
Metformín môže účinkovať prostredníctvom 3 mechanizmov:
· znížením tvorby hepatálnej glukózy inhibíciou glukoneogenézy a glykogenolýzy,
· zlepšením periférneho vychytávania a využitia glukózy vo svaloch zvýšením citlivosti na inzulín,
· a spomalením absorpcie glukózy v črevách.
Metformín stimuluje intracelulárnu syntézu glykogénu účinkom na glykogénsyntázu. Metformín zvyšuje transportnú kapacitu všetkých typov membránových transportérov glukózy (GLUT) známych v súčasnosti.
U ľudí má metformín, nezávisle od jeho účinku na glykémiu, priaznivý účinok na metabolizmus lipidov. Toto sa preukázalo v terapeutických dávkach v kontrolovaných strednodobých alebo dlhodobých klinických štúdiách: metformín znižuje hladiny celkového cholesterolu, LDL cholesterolu a triglyceridov.
Klinická účinnosťabezpečnosť
V 7 dvojito zaslepených, placebom alebo aktívne kontrolovaných klinických štúdiách v trvaní
minimálne 24 týždňov sa celkovo liečilo 4 704 pacientov s diabetes mellitus 2. typu, z ktorých 1109
dostávalo 10 mg empagliflozínu a 1863 dostávalo 25 mg empagliflozínu vo forme prídavnej liečby k metformínu. Z týchto pacientov celkovo 530 pacientov dostávalo empagliflozín vo forme prídavnej
liečby k metformínu a inzulínu, z ktorých 266 pacientov bolo liečených 10 mg empagliflozínu a 264
pacientov 25 mg empagliflozínu.
Liečba empagliflozínom v kombinácii s metformínom s inými antidiabetikami (pioglitazón, sulfonylmočovina, inhibítory DPP-4 a inzulín) alebo bez nich viedla ku klinicky významným zlepšeniam hodnoty HbA1c, plazmatickej hladiny glukózy nalačno (FPG), telesnej hmotnosti, systolického a diastolického krvného tlaku. Podávanie 25 mg empagliflozínu viedlo k vyššiemu podielu pacientov, ktorí dosiahli cieľovú hodnotu HbA1c menej ako 7 % a k menšiemu podielu pacientov, ktorí potrebovali záchrannú liečbu glykémie v porovnaní s 10 mg empagliflozínu a placebom. U pacientov vo veku 75 rokov a starších sa pri liečbe empagliflozínom pozorovali číselne nižšie zníženia hodnoty HbA1c. Vyššia východisková hodnota HbA1c sa spájala s väčším poklesom hodnoty HbA1c.
Empagliflozínvoformeprídavnejliečbykmetformínu,sulfonylmočovine,pioglitazónuEmpagliflozín vo forme prídavnej liečby k metformínu, metformínu a sulfonylmočovine alebo pioglitazónu a metformínu viedol k štatisticky významným (p < 0,0001) zníženiam hodnoty HbA1c a telesnej hmotnosti v porovnaní s placebom (tabuľka 2). Okrem toho viedol ku klinicky významnému zníženiu FPG, systolického a diastolického krvného tlaku v porovnaní s placebom.
V dvojito zaslepenom, placebom kontrolovanom predĺžení týchto štúdií sa zníženie hodnoty HbA1c, telesnej hmotnosti a krvného tlaku udržalo až do 76. týždňa.
Tabuľka 2: Výsledky účinnosti v 24-týždňových placebom kontrolovaných štúdiách
Prídavná liečba k liečbe metformínoma
Placebo empagliflozín
10 mg 25 mg
N 207 217 213
HbA1c (%)
Východisková hodnota
(priemer) 7,90
Zmena od východiskovej
7,94
7,86
hodnoty1 -0,13 -0,70 -0,77
Rozdiel oproti placebu1
(97,5 % IS) -0,57* (-0,72, -0,42) -0,64* (-0,79, -0,48)
N 184 199 191
Pacienti (%), ktorí dosiahli
HbA1c < 7 % s východiskovou hodnotou HbA1c ≥ 7 %
2
12,5 37,7 38,7
N 207 217 213
Telesná hmotnosť (kg)Východisková hodnota
(priemer) 79,73 81,59 82,21
Zmena od východiskovej
hodnoty1 -0,45 -2,08 -2,46
Rozdiel oproti placebu1
(97,5 % IS) -1,63* (-2,17, -1,08) -2,01* (-2,56, -1,46)
N 207 217 213
STK (mmHg)2Východisková hodnota
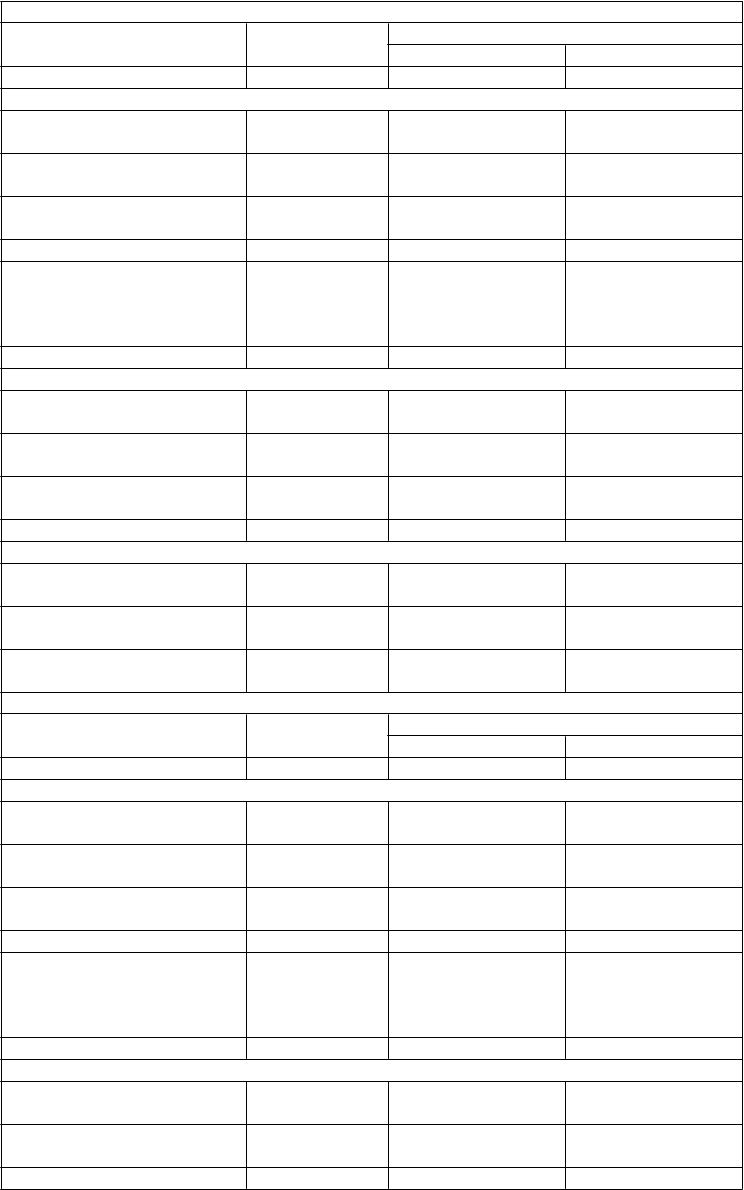
(priemer) 128,6 129,6 130,0
Zmena od východiskovej
hodnoty1 -0,4 -4,5 -5,2
Rozdiel oproti placebu1
(95 % IS) -4,1* (-6,2, -2,1) -4,8* (-6,9, -2,7)
Prídavná liečba k liečbe metformínom a sulfonylmočovinoua
Placebo empagliflozín10 mg 25 mgN 225 225 216
HbA1c (%)Východisková hodnota
(priemer) 8,15 8,07 8,10
Zmena od východiskovej
hodnoty1 -0,17 -0,82 -0,77
Rozdiel oproti placebu1
(97,5 % IS) -0,64* (-0,79, -0,49) -0,59* (-0,74, -0,44)
N 216 209 202
Pacienti (%), ktorí dosiahli
HbA1c < 7 % s východiskovou hodnotou HbA1c ≥ 7 %
2
9,3 26,3 32,2
N 225 225 216
Telesná hmotnosť (kg)
Východisková hodnota
(priemer) 76,23 77,08 77,50
Zmena od východiskovej
hodnoty1 -0,39 -2,16 -2,39
Rozdiel oproti placebu1 -1,76* (-2,25, -1,28) -1,99* (-2,48, -1,50)
(97,5 % IS)
N 225 225 216
STK (mmHg)2
Východisková hodnota
(priemer) 128,8 128,7 129,3
Zmena od východiskovej
hodnoty1 -1,4 -4,1 -3,5
Rozdiel oproti placebu1
(95 % IS) -2,7 (-4,6, -0,8) -2,1 (-4,0, -0,2)
Prídavná liečba k liečbe pioglitazónom + metformínb
Placebo empagliflozín
10 mg 25 mg
N 124 125 127
HbA1c (%)
Východisková hodnota
(priemer) 8,15
Zmena od východiskovej
8,07
8,10
hodnoty1 -0,11 -0,55 -0,70
Rozdiel oproti placebu1
(97,5 % IS) -0,45* (-0,69, -0,21) -0,60* (-0,83, -0,36)
N 118 116 123
Pacienti (%), ktorí dosiahli
HbA1c < 7 % s východiskovou hodnotou HbA1c ≥ 7 %
2
8,5 22,4 28,5
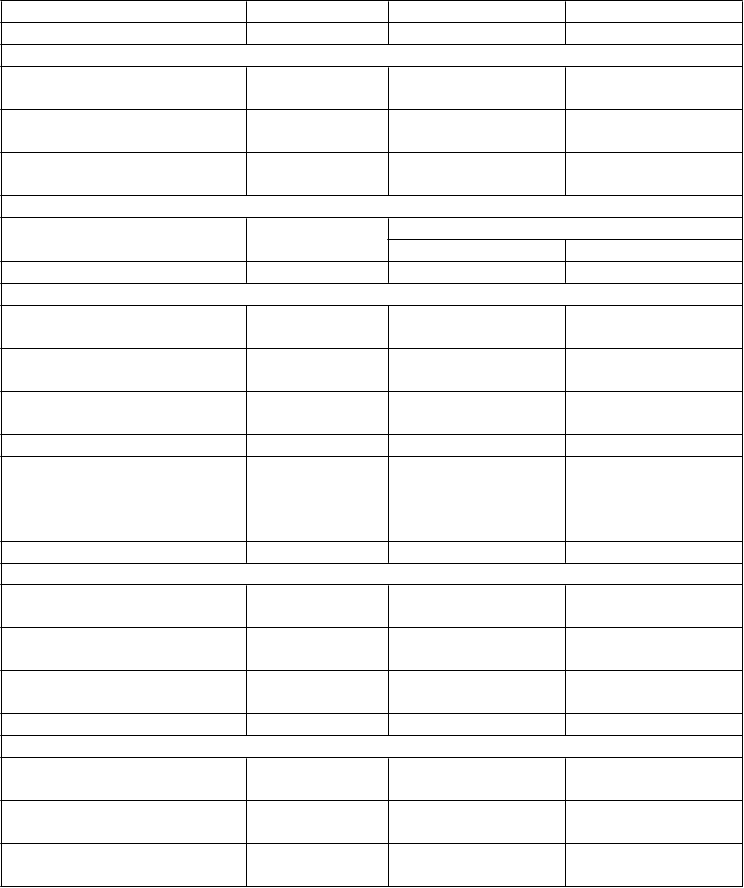
N 124 125 127
Telesná hmotnosť (kg)Východisková hodnota
(priemer) 79,45 79,44 80,98
Zmena od východiskovej
hodnoty1 0,40 -1,74 -1,59
Rozdiel oproti placebu1
(97,5 % IS) -2,14* (-2,93, -1,35) -2,00* (-2,78, -1,21)
N 124 125 127
STK (mmHg)2, 3
Východisková hodnota
(priemer) 125,5 126,3 126,3
Zmena od východiskovej
hodnoty1 0,8 -3,5 -3,3
Rozdiel oproti placebu1
(95 % IS) -4,2** (-6,94, -1,53) -4,1** (-6,76, -1,37)
a Celý analyzovaný súbor (FAS) s použitím prevodu hodnôt z posledného sledovania (LOCF) pred podaním záchrannej liečby glykémie
b Analýza podskupiny u pacientov užívajúcich základnú liečbu metformínom (FAS, LOCF)
1 Priemer upravený podľa východiskovej hodnoty
2 Nie je hodnotené z hľadiska štatistickej významnosti ako súčasť sekvenčného potvrdzujúceho testovania
3 LOCF, hodnoty cenzurované po podaní záchrannej liečby antihypertenzívom
* hodnota p < 0,0001
** hodnota p < 0,01
Empagliflozín v kombinácii s metformínom u pacientov doteraz neliečených liekmi
Bola vykonaná štúdia faktoriálneho dizajnu v trvaní 24 týždňov na hodnotenie účinnosti a bezpečnosti empagliflozínu u pacientov doteraz neliečených liekmi. Liečba empagliflozínom v kombinácii s metformínom (5 mg a 500 mg, 5 mg a 1 000 mg, 12,5 mg a 500 mg a 12,5 mg a 1 000 mg podávané dvakrát denne) preukázala štatisticky výrazné zlepšenia HbA1c (tabuľka 3) a viedla k vyššej redukcii FPG (v porovnaní s jednotlivými zložkami) a telesnej hmotnosti (v porovnaní s metformínom).
Tabuľka 3: Výsledky účinnosti v 24. týždni porovnávajúce empagliflozín v kombinácii s metformínom s jednotlivými zložkamia
Empagliflozín 10 mgb Empagliflozín 25 mgb Metformínc
+ Met
1000 mgc
+ Met
2000 mgc
Bez
Met
+ Met
1000
mgc
+ Met
2000 mgc
Bez
Met
1000
mg
2000
mg
N 169 171 172 170 170 167 171 170
HbA1c (%)
Východisko vá hodnota (priemer) Zmena z východisko- vej hodnoty1
8,68 8,65 8,62 8,84 8,66 8,86 8,69 8,55
-1,98 -2,07 -1,35 -1,93 -2,08 -1,36 -1,18 -1,75
Porovnanie s empa. (95% CI)1
Porovnanie s met. (95% CI)1
-0,63* (-0,86,
-0,40)
-0,79* (-1,03,
-0,56)
-0,72* (-0,96,
-0,49)
-0,33* (-0,56,
-0,09)
-0,57* (-0,81,
-0,34)
-0,75* (-0,98,
-0,51)
-0,72* (-0,95,
-0,48)
-0,33* (-0,56,
-0,10)
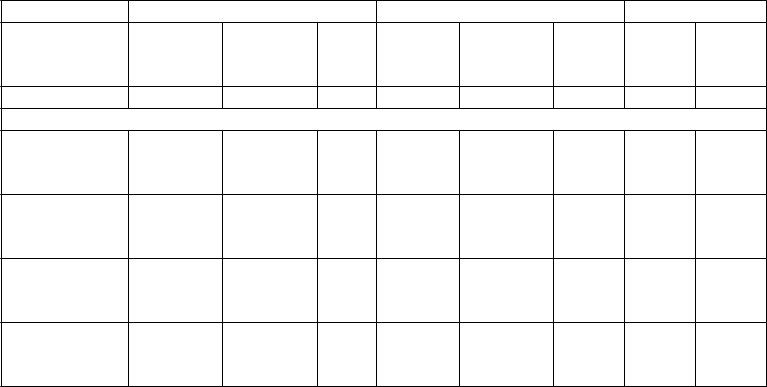
Met = metformín, empa = empagliflozín
1 priemer prispôsobený podľa východiskovej hodnoty
a Boli vykonané analýzy na celom analyzovanom súbore (FAS) pomocou prístupu pozorovaných prípadov (OC)
b Podávané v dvoch rovnako rozdelených dávkach denne pri podávaní spolu s metformínom
c Podávané v dvoch rovnako rozdelených dávkach denne
*p ≤ 0,0062 pre HbA1c
Empagliflozínvoformeprídavnejliečbykmetformínuvporovnanísglimepiridom,24-mesačnéúdajeV štúdii porovnávajúcej účinnosť a bezpečnosť 25 mg empagliflozínu oproti glimepiridu (až do 4 mg denne) u pacientov s nedostatočnou kontrolou glykémie užívajúcich metformín samostatne viedla liečba empagliflozínom podávaným denne k superiórnemu zníženiu hodnoty HbA1c (tabuľka 4) a ku klinicky významnému zníženiu FPG v porovnaní s glimepiridom. Empagliflozín podávaný denne viedol k štatisticky významnému zníženiu telesnej hmotnosti, systolického a diastolického krvného tlaku a k štatisticky nižšiemu podielu pacientov s udalosťami hypoglykémie v porovnaní s glimepiridom (2,5 % pri empagliflozíne, 24,2 % pri glimepiride, p < 0,0001).

Tabuľka 4: Výsledky účinnosti v 104. týždni v aktívne kontrolovanej štúdii porovnávajúcej empagliflozín s glimepiridom vo forme prídavnej liečby k metformínua
Empagliflozín 25 mg glimepiridbN 765 780
HbA1c (%)Východisková hodnota (priemer) 7,92 7,92
Zmena od východiskovej hodnoty1 -0,66 -0,55
Rozdiel oproti glimepiridu1 (97,5 % IS) -0,11* (-0,20, -0,01)
N 690 715
Pacienti (%), ktorí dosiahli HbA1c < 7 % svýchodiskovou hodnotou HbA1c ≥ 7 %2 33,6 30,9
N 765 780
Telesná hmotnosť (kg)Východisková hodnota (priemer) 82,52 83,03
Zmena od východiskovej hodnoty1 -3,12 1,34
Rozdiel oproti glimepiridu1 (97,5 % IS) -4,46** (-4,87, -4,05)
N 765 780
STK (mmHg)3Východisková hodnota (priemer) 133,4 133,5
Zmena od východiskovej hodnoty1 -3,1 2,5
Rozdiel oproti glimepiridu1 (97,5 % IS) -5,6** (-7,0, -4,2)
a Celý analyzovaný súbor (FAS) s použitím prevodu hodnôt z posledného sledovania (LOCF) pred podaním záchrannej liečby glykémie
b Až do 4 mg glimepiridu
1 Priemer upravený podľa východiskovej hodnoty
2 Nie je hodnotené z hľadiska štatistickej významnosti ako súčasť sekvenčného potvrdzujúceho testovania
3 LOCF, hodnoty cenzurované po podaní záchrannej liečby antihypertenzívom
* hodnota p < 0,0001 pre non-inferioritu a hodnota p = 0,0153 pre superioritu
** hodnota p < 0,0001
Prídavná liečbakliečbeinzulínomEmpagliflozín vo forme prídavnej liečby k viacerým denným dávkam inzulínuÚčinnosť a bezpečnosť empagliflozínu vo forme prídavnej liečby k viacerým denným dávkam inzulínu so súbežnou liečbou metformínom sa vyhodnotila v dvojito zaslepenom, placebom kontrolovanom
skúšaní trvajúcom 52 týždňov. Počas úvodných 18 týždňov a posledných 12 týždňov sa dávka inzulínu udržiavala stabilná, ale bola upravená tak, aby sa medzi 19. a 40. týždňom dosiahli hladiny glukózy
< 100 mg/dl [5,5 mmol/l] pred jedlom a hladiny glukózy < 140 mg/dl [7,8 mmol/l] po jedle.
V 18. týždni poskytol empagliflozín štatisticky významné zlepšenie hodnoty HbA1c v porovnaní s placebom (tabuľka 5).
V 52. týždni viedla liečba empagliflozínom k štatisticky významnému zníženiu hodnoty HbA1c a k
zníženiu dávky inzulínu v porovnaní s placebom a k zníženiu FPG a telesnej hmotnosti.
Tabuľka 5: Výsledky účinnosti v 18. a 52. týždni v placebom kontrolovanej štúdii empagliflozínu vo forme prídavnej liečby k viacerým denným dávkam inzulínu s metformínom alebo bez neho
Placebo empagliflozín
10 mg 25 mg
N 135 128 137
HbA1c (%) v 18. týždnia
Východisková hodnota
(priemer) 8,29
Zmena od východiskovej
hodnoty1 -0,58
Rozdiel oproti placebu1
8,42
-0,99
8,29
-1,03
(97,5 % IS) -0,41* (-0,61, -0,21) -0,45* (-0,65, -0,25)
N 86 84 87
HbA1c (%) v 52. týždnib
Východisková hodnota
(priemer) 8,26
Zmena od východiskovej
hodnoty1 -0,86
Rozdiel oproti placebu1
8,43
-1,23
8,38
-1,31
(97,5 % IS) -0,37** (-0,67, -0,08) -0,45* (-0,74, -0,16)
N 84 84 87
Pacienti (%), ktorí dosiahli HbA1c < 7 % s
východiskovou hodnotou HbA1c ≥ 7 % v 52. týždnib, 2
27,4 41,7 48,3
N 86 83 86
Dávka inzulínu (IU/deň)
v 52. týždnib, 3
Východisková hodnota
(priemer) 91,01
Zmena od východiskovej
hodnoty1 12,84
Rozdiel oproti placebu1
91,77
0,22
90,22
-2,25
(97,5 % IS) -12,61** (-21,43, -3,80) -15,09** (-23,79, -6,40)
N 86 84 87
Telesná hmotnosť (kg)
v 52. týždnib
Východisková hodnota
(priemer) 97,78
Zmena od východiskovej
hodnoty1 0,42
Rozdiel oproti placebu1
98,86
-2,47
94,93
-1,94

(97,5 % IS) -2,89* (-4,29, -1,49) -2,37* (-3,75, -0,98)
a Analýza podskupiny u pacientov užívajúcich základnú liečbu metformínom (FAS, LOCF)
b Analýza podskupiny u pacientov užívajúcich základnú liečbu metformínom (PPS-Completers, LOCF)
1 Priemer upravený podľa východiskovej hodnoty
2 Nie je hodnotené z hľadiska štatistickej významnosti ako súčasť sekvenčného potvrdzujúceho testovania
3 19.-40. týždeň: režim cieľovej liečby pri úprave dávky inzulínu na dosiahnutie vopred definovaných
cieľových hladín glukózy (< 100 mg/dl (5,5 mmol/l) pred jedlom, < 140 mg/dl (7,8 mmol/l) po jedle).
* hodnota p ≤ 0,0005
** hodnota p < 0,005
Empagliflozín vo forme prídavnej liečby k bazálnemu inzulínu
Účinnosť a bezpečnosť empagliflozínu vo forme prídavnej liečby k bazálnemu inzulínu so súbežnou liečbou metformínom sa vyhodnotila v dvojito zaslepenom, placebom kontrolovanom skúšaní trvajúcom 78 týždňov. Počas úvodných 18 týždňov sa dávka inzulínu udržiavala stabilná, ale bola upravená tak, aby sa v nasledujúcich 60 týždňoch dosiahla FPG < 110 mg/dl.
V 18. týždni poskytol empagliflozín štatisticky významné zlepšenie hodnoty HbA1c. Cieľová hodnota
HbA1c < 7 % sa dosiahla pri väčšom podiele pacientov liečených empagliflozínom a s východiskovou hodnotou HbA1c ≥ 7,0 % v porovnaní s placebom (tabuľka 6).
V 78. týždni sa účinkom empagliflozínu udržalo zníženie hodnoty HbA1c a použitie nižšej dávky
inzulínu. Okrem toho, empagliflozín viedol k zníženiu FPG, telesnej hmotnosti a krvného tlaku.
Tabuľka 6 Výsledky účinnosti v 18. a 78. týždni v placebom kontrolovanej štúdii empagliflozínu vo forme prídavnej liečby k bazálnemu inzulínu s metformínoma
Placebo
empagliflozín
10 mg
empagliflozín
25 mg
N 96 107 99
HbA1c (%) v 18. týždni
Východisková hodnota
(priemer) 8,02
Zmena od východiskovej
8,21
8,35

hodnoty1 -0,09 -0,62 -0,72
Rozdiel oproti placebu1
(97,5 % IS) -0,54* (-0,77, -0,30) -0,63* (-0,88, -0,39)
N 89 105 94
HbA1c (%) v 78. týždniVýchodisková hodnota
(priemer) 8,03 8,24 8,29
Zmena od východiskovej
hodnoty1 -0,08 -0,42 -0,71
Rozdiel oproti placebu1
(97,5 % IS) -0,34** (-0,64, -0,05) -0,63* (-0,93, -0,33)
N 89 105 94
Dávka bazálneho inzulínu(IU/deň) v 78. týždniVýchodisková hodnota
(priemer) 49,61 47,25 49,37
Zmena od východiskovej
hodnoty1 4,14 -2,07 -0,28
Rozdiel oproti placebu1
(97,5 % IS) -6,21** (-11,81, -0,61) -4,42 (-10,18, 1,34)
a Analýza podskupiny celého analyzovaného súboru (FAS) u pacientov užívajúcich doplňujúcu základnú liečbu metformínom - jedinci, ktorí dokončili štúdiu, s použitím prevodu hodnôt z posledného sledovania (LOCF) pred podaním záchrannej liečby glykémie
1 Priemer upravený podľa východiskovej hodnoty
* hodnota p < 0,0001
** hodnota p ≤ 0,025
EmpagliflozínalinagliptínvoformeprídavnejliečbykmetformínuV dvojito zaslepenej štúdii u pacientov s nedostatočnou kontrolou glykémie poskytla 24-týždňová liečba obidvoma dávkami empagliflozínu a linagliptínu pridaná k liečbe metformínom štatisticky
významné (p < 0,0001) zníženia hodnoty HbA1c (zmena od východiskovej hodnoty -1,08 % pri 10 mg empagliflozínu a 5 mg linagliptínu, 1, 19 % pri 25 mg empagliflozínu a 5 mg linagliptínu, -0,70 % pri
5 mg linagliptínu). V porovnaní s 5 mg linagliptínu poskytli obidve dávky empagliflozínu a 5 mg
linagliptínu štatisticky významné zníženia FPG a krvného tlaku. Obe dávky poskytli podobné, štatisticky významné zníženia telesnej hmotnosti, vyjadrenej v kg a vo forme percentuálnej zmeny. Cieľová hodnota HbA1c < 7 % sa dosiahla pri väčšom podiele pacientov liečených empagliflozínom, s
východiskovou hodnotou HbA1c ≥ 7,0 % a liečených empagliflozínom a linagliptínom v porovnaní s
5 mg linagliptínu. Klinicky významné zníženia hodnoty HbA1c sa udržiavali počas 52 týždňov.
Empagliflozín dvakrát denne oproti dávkovaniu jedenkrát denne vo forme prídavnej liečby k liečbemetformínom
Účinnosť a bezpečnosť empagliflozínu dvakrát denne oproti dávkovaniu jedenkrát denne (denná dávka
10 mg a 25 mg) vo forme prídavnej liečby u pacientov s dostatočnou kontrolou glykémie užívajúcich metformín v monoterapii sa hodnotila v dvojito zaslepenej, placebom kontrolovanej štúdii trvajúcej 16
týždňov. Všetky liečby empagliflozínom viedli k významným zníženiam hodnoty HbA1c od
východiskovej hodnoty (celkový priemer 7,8 %) po 16 týždňoch liečby v porovnaní s placebom. Dávkovacie režimy empagliflozínu dvakrát denne k základnej liečbe metformínom viedli k
porovnateľným zníženiam hodnôt HbA1c oproti dávkovacím režimom jedenkrát denne s odlišnosťou
liečby v zníženiach hodnoty HbA1c od východiskového stavu do 16. týždňa -0,02 % (95 % IS -0,16,
0,13) pri 5 mg empagliflozínu dvakrát denne oproti 10 mg jedenkrát denne a -0,11 % (95 % IS -0,26,
0,03) pri 12,5 mg empagliflozínu dvakrát denne oproti 25 mg jedenkrát denne.
Kardiovaskulárnabezpečnosť
V prospektívnej vopred špecifikovanej metaanalýze nezávisle posudzovaných kardiovaskulárnych príhod, ktoré pochádzali z 12 klinických štúdií fázy 2 a 3 zahŕňajúcich 10 036 pacientov s diabetes
mellitus 2. typu, empagliflozín nezvýšil kardiovaskulárne riziko.
Hladinaglukózy2hodinypojedle
Liečba empagliflozínom vo forme prídavnej liečby k metformínu alebo metformínu a sulfonylmočovine viedla ku klinicky významnému zníženiu hladiny glukózy 2 hodiny po jedle (priemerný tolerančný test jedla) v 24. týždni (prídavná liečba k metformínu: placebo: +5,9 mg/dl, 10 mg'
empagliflozínu: -46,0 mg/dl, 25 mg empagliflozínu: -44,6 mg/dl, prídavná liečba k metformínu a sulfonylmočovine: placebo: -2,3 mg/dl, 10 mg empagliflozínu: -35,7 mg/dl, 25 mg empagliflozínu: -36,6 mg/dl).
PacientisvýchodiskovouhodnotouHbA1c≥ 9 %
Vo vopred špecifikovanej analýze pacientov s východiskovou hodnotou HbA1c ≥ 9,0 % viedla liečba
10 mg alebo 25 mg empagliflozínu vo forme prídavnej liečby k štatisticky významným zníženiam hodnoty HbA1c v 24. týždni (upravená priemerná zmena od východiskovej hodnoty -1,49 % pri 25 mg empagliflozínu, -1,40 % pri 10 mg empagliflozínu a -0,44 % pri placebe).
Telesnáhmotnosť
Vo vopred špecifikovanej združenej analýze 4 placebom kontrolovaných štúdií viedla liečba empagliflozínom (68 % všetkých pacientov užívajúcich základnú liečbu metformínom) k zníženiu
telesnej hmotnosti v porovnaním s placebom v 24. týždni (-2,04 kg pri 10 mg empagliflozínu, -2,26 kg pri 25 mg empagliflozínu a -0,24 kg pri placebe), ktoré sa udržalo až do 52. týždňa (-1,96 kg pri 10 mg empagliflozínu, -2,25 kg pri 25 mg empagliflozínu a -0,16 kg pri placebe).
Krvnýtlak
Účinnosť a bezpečnosť empagliflozínu sa vyhodnotila v dvojito zaslepenej, placebom kontrolovanej štúdii trvajúcej 12 týždňov u pacientov s diabetes mellitus 2. typu a vysokým krvným tlakom
užívajúcich rôzne antidiabetiká a až 2 antihypertenzívne liečby. Liečba empagliflozínom jedenkrát
denne viedla k štatisticky významnému zlepšeniu hodnoty HbA1c a 24-hodinovej priemernej hodnoty systolického a diastolického krvného tlaku na základe ambulantného sledovania krvného tlaku (tabuľka
7). Liečba empagliflozínom poskytla zníženia STK a DTK v sede.
Tabuľka 7 Výsledky účinnosti v 12. týždni v placebom kontrolovanej štúdii empagliflozínu u pacientov s diabetes mellitus 2. typu a nekontrolovaným krvným tlakoma
Placebo empagliflozín
10 mg 25 mg
N 271 276 276
HbA1c (%) v 12. týždni1
Východisková hodnota
(priemer) 7,90
Zmena od východiskovej
7,87
7,92
hodnoty2 0,03 -0,59 -0,62
Rozdiel oproti placebu1
(95 % IS)2 -0,62* (-0,72, -0,52) -0,65* (-0,75, -0,55)
24-hodinový STK v 12. týždni3
Východisková hodnota
(priemer) 131,72
Zmena od východiskovej
131,34
131,18
hodnoty4 0,48 -2,95 -3,68
Rozdiel oproti placebu4
(95 % IS) -3,44* (-4,78, -2,09) -4,16* (-5,50, -2,83)
24-hodinový DTK v 12. týždni3
Východisková hodnota
(priemer) 75,16
Zmena od východiskovej
75,13
74,64
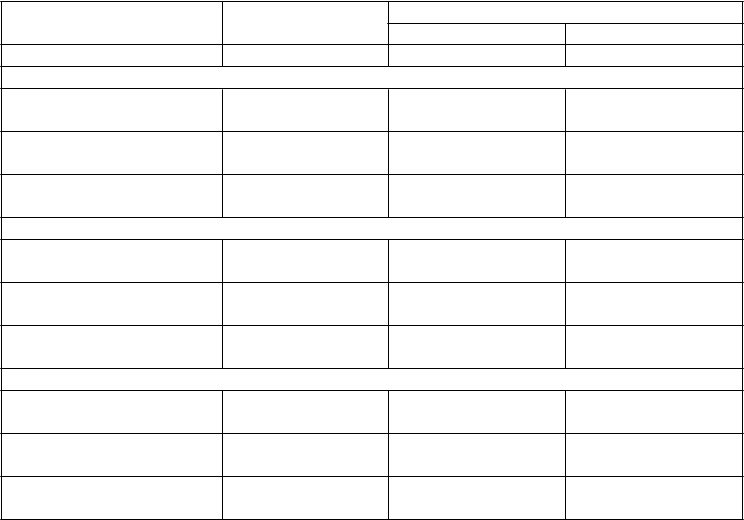
hodnoty5 0,32 -1,04 -1,40
Rozdiel oproti placebu5
(95 % IS) -1,36** (-2,15, -0,56) -1,72* (-2,51, -0,93)
a Celý analyzovaný súbor (FAS)
1 LOCF, hodnoty cenzurované po užívaní záchrannej liečby antidiabetikom
2 Priemer upravený podľa východiskovej hodnoty HbA1c, východiskovej hodnoty eGFR, geografického regiónu a počtu antihypertenzív
3 LOCF, hodnoty cenzurované po užívaní záchrannej liečby antidiabetikom alebo po zmene záchrannej
liečby antihypertenzívom
4 Priemer upravený podľa východiskovej hodnoty SKT, východiskovej hodnoty HbA1c, východiskovej hodnoty eGFR, geografického regiónu a počtu antihypertenzív
5 Priemer upravený podľa východiskovej hodnoty DKT, východiskovej hodnoty HbA1c, východiskovej
hodnoty eGFR, geografického regiónu a počtu antihypertenzív
* hodnota p < 0,0001
** hodnota p < 0,001
Vo vopred špecifikovanej združenej analýze 4 placebom kontrolovaných štúdií viedla liečba empagliflozínom (68 % pacientov užívalo základnú liečbu metformínom) k zníženiu systolického krvného tlaku (10 mg empagliflozínu: -3,9 mmHg, 25 mg empagliflozínu: -4,3 mmHg) v porovnaní s placebom (-0,5 mmHg) a diastolického krvného tlaku (10 mg empagliflozínu: -1,8 mmHg, 25 mg empagliflozínu: -2,0 mmHg) v porovnaní s placebom (-0,5 mmHg) v 24. týždni, ktoré sa udržalo až do
52. týždňa.
MetformínProspektívna randomizovaná štúdia (UKPDS) preukázala dlhodobý prínos intenzívnej kontroly glukózy v krvi pri diabetes mellitus 2. typu. Analýza výsledkov u obéznych pacientov liečených metformínom
po zlyhaní liečbou samotnou diétou preukázala:
· významné zníženie absolútneho rizika akejkoľvek komplikácie súvisiacej s diabetes mellitus v skupine s metformínom (29,8 udalostí/1000 pacientorokov) oproti samotnej diéte (43,3 udalostí/1000 pacientorokov), p = 0,0023 a oproti skupinám s kombinovanou liečbou
sulfonylmočovinou a inzulínom v monoterapii (40,1 udalostí/1000 pacientorokov), p = 0,0034,
· významné zníženie absolútneho rizika akejkoľvek mortality súvisiacej s diabetes mellitus:
metformín 7,5 udalostí/1000 pacientorokov, samotná diéta 12,7 udalostí/1000 pacientorokov, p
= 0,017.
· významné zníženie absolútneho rizika celkovej mortality: metformín 13,5 udalostí/1000
pacientorokov oproti samotnej diéte 20,6 udalostí/1 000 pacientorokov, (p = 0,011) a oproti skupinám s kombinovanou liečbou sulfonylmočovinou a inzulínom v monoterapii 18,9 udalostí/1000 pacientorokov (p = 0,021).
· významné zníženie absolútneho rizika infarktu myokardu: metformín 11 udalostí/1000
pacientorokov, samotná diéta 18 udalostí/1000 pacientorokov, (p = 0,01).
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií so Synjardy vo
všetkých podskupinách pediatrickej populácie s diabetes mellitus 2. typu (informácie o použití u detí a dospievajúcich, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Synjardy
Výsledky bioekvivalenčných štúdií u zdravých jedincov preukázali, že kombinované tablety Synjardy
(empagliflozín/metformíniumchlorid) 5 mg/850 mg, 5 mg/1000 mg, 12,5 mg/850 mg a
12,5 mg/1000 mg sú bioekvivalentné so súbežným podávaním príslušných dávok empagliflozínu a metformínu vo forme oddelených tabliet.
Podávanie 12,5 mg empagliflozínu/1000 mg metformínu v stave sýtosti viedlo k 9 % zníženiu AUC a
28 % zníženiu Cmax pri empagliflozíne v porovnaní so stavom hladovania. Pri metformíne sa AUC znížila o 12 % a Cmax sa znížila o 26 % v porovnaní so stavom hladovania. Pozorovaný vplyv jedla na empagliflozín a metformín sa nepovažoval za klinicky významný. Keďže sa však odporúča podávať metformín s jedlom, Synjardy sa tiež navrhuje podávať s jedlom.
Nasledujúce tvrdenia odzrkadľujú farmakokinetické informácie, ktoré sú dostupné pri jednotlivých liečivách Synjardy.
Empagliflozín
Absorpcia
Farmakokinetika empagliflozínu sa vo veľkej miere opísala u zdravých jedincov a pacientov s diabetes mellitus 2. typu. Po perorálnom podaní sa empagliflozín rýchlo absorboval, pričom maximálne
plazmatické koncentrácie sa vyskytli pri mediáne tmax 1,5 hodiny po podaní dávky. Plazmatické koncentrácie potom bifázicky klesli s rýchlou fázou distribúcie a relatívne pomalou terminálnou fázou. Pri 10 mg empagliflozínu užívanom jedenkrát denne bola priemerná plazmatická AUC v rovnovážnom
stave 1 870 nmol.h a Cmax bola 259 nmol/l a pri 25 mg empagliflozínu bola AUC v rovnovážnom stave 4
740 nmol.h a 687 nmol/l. Systémová expozícia empagliflozínu sa zvýšila proporcionálne k dávke.
Farmakokinetické parametre jednorazovej dávky a ustáleného stavu empagliflozínu boli podobné, čo naznačuje lineárnu farmakokinetiku z hľadiska času. Vo farmakokinetike empagliflozínu sa medzi zdravými dobrovoľníkmi a pacientmi s diabetes mellitus 2. typu nevyskytli žiadne klinicky významné rozdiely.
Farmakokinetika 5 mg empagliflozínu dvakrát denne a 10 mg empagliflozínu jedenkrát denne je u zdravých jedincov porovnateľná. Celková expozícia (AUCss) empagliflozínu počas 24-hodinového obdobia s 5 mg empagliflozínu podávanými dvakrát denne bola podobná 10 mg empagliflozínu podávanými jedenkrát denne. Ako sa predpokladalo, 5 mg empagliflozínu podávaných dvakrát denne v porovnaní s 10 mg empagliflozínu jedenkrát denne viedlo k nižšej Cmax a vyšším minimálnym plazmatickým koncentráciám empagliflozínu (Cmin).
Podávanie 25 mg empagliflozínu po konzumácii jedla s vysokým obsahom tuku a vysoko kalorického jedla viedlo k mierne nižšej expozícii; AUC sa znížila približne o 16 % a Cmax približne o 37 v porovnaní so stavom nalačno. Pozorovaný vplyv jedla na farmakokinetiku empagliflozínu sa nepovažoval za klinicky významný a empagliflozín sa môže podávať s jedlom alebo bez jedla. Podobné výsledky sa získali pri podávaní kombinovaných tabliet Synjardy (empagliflozín/metformín) s jedlom s vysokým obsahom tuku a vysokým obsahom kalórií.
Distribúcia
Zdanlivý distribučný objem v ustálenom stave bol na základe analýzy populačnej farmakokinetiky stanovený na 73,8 l. Po podaní perorálneho roztoku [14C]-empagliflozínu zdravým dobrovoľníkom, bolo rozdelenie červených krviniek približne 37 % a väzba na plazmatické bielkoviny bola 86 %.
Biotransformácia
V ľudskej plazme sa nestanovili žiadne hlavné metabolity empagliflozínu, ako bolo definované minimálne 10 % celkového materiálu súvisiaceho s liekom a najviac zastúpenými metabolitmi boli tri glukuronidové konjugáty (2-, 3- a 6-O-glukuronid). Štúdie in vitro naznačili, že primárnou cestou metabolizmu empagliflozínu u ľudí je glukuronidácia prostredníctvom uridín
5‘-difosfát-glukuronyltransferáz UGT2B7, UGT1A3, UGT1A8 a UGT1A9.
Eliminácia
Na základe analýzy populačnej farmakokinetiky sa zdanlivý terminálny polčas eliminácie empagliflozínu stanovil na 12,4 hodiny a zdanlivý klírens po perorálnom podaní bol 10,6 l/hodinu.
Interindividuálne variability klírensu empagliflozínu po perorálnom podaní boli 39,1 % a reziduálne variability klírensu empagliflozínu po perorálnom podaní boli 35,8 %. Pri dávkovaní jedenkrát denne sa ustálené plazmatické koncentrácie empagliflozínu dosiahli po piatej dávke. V súlade s polčasom sa v
rovnovážnom stave pozorovala akumulácia až do 22 % s ohľadom na plazmatickú AUC. Po podaní perorálneho roztoku [14C]-empagliflozínu zdravým dobrovoľníkom sa približne 96 % podanej izotopom značenej látky vylúčilo stolicou (41 %) alebo močom (54 %). Väčšina izotopom značenej látky vylúčenej stolicou bola vo forme nezmeneného materského liečiva a približne polovica izotopom značenej látky sa vo forme nezmeneného materského liečiva vylúčila do moču.
Osobitné skupinypacientov
Porucha funkcie obličiek
U pacientov s miernou poruchou funkcie obličiek sa AUC empagliflozínu zvýšila približne o 18 %, u pacientov so stredne závažnou poruchou funkcie obličiek približne o 20 %, u pacientov so závažnou poruchou funkcie obličiek (klírens kreatininu < 30-< 90 ml/min) o 66 % a u pacientov so zlyhávaním obličiek/ochorením obličiek v terminálnom štádiu (ESRD) približne o 48 % v porovnaní s jedincami s normálnou funkciou obličiek. Maximálne plazmatické hladiny empagliflozínu boli podobné u jedincov so stredne závažnou poruchou funkcie obličiek a zlyhávaním obličiek/ESRD v porovnaní s pacientmi s normálnou funkciou obličiek. Maximálne plazmatické hladiny empagliflozínu boli zhruba o 20 % vyššie u jedincov s miernou a závažnou poruchou funkcie obličiek pri porovnaní s jedincami s normálnou funkciou obličiek. Farmakokinetická analýza skupín pacientov preukázala, že zdanlivý klírens po perorálnom podaní empagliflozínu sa znížil so znížením klírensu kreatinínu, čo viedlo k zvýšeniu expozície lieku.
Porucha funkcie pečene
U pacientov s miernou poruchou funkcie pečene podľa klasifikácie podľa Childa-Pugha sa AUC empagliflozínu zvýšila približne o 23 % a Cmax približne o 4 %, u pacientov so stredne závažnou poruchou funkcie pečene podľa klasifikácie podľa Childa-Pugha sa AUC empagliflozínu zvýšila približne o 47 % a Cmax približne o 23 % a u pacientov so závažnou poruchou funkcie pečene podľa Childa-Pugha sa AUC empagliflozínu zvýšila približne o 75 % a Cmax približne o 48 % v porovnaní s jedincami s normálnou funkciou pečene.
Index telesnej hmotnosti
Index telesnej hmotnosti nemá na základe analýzy populačnej farmakokinetiky žiadny klinicky významný účinok na farmakokinetiku empagliflozínu. V tejto analýze bola odhadovaná AUC nižšia o
5,82 % u pacientov s BMI 30 kg/m2, o 10,4 % u pacientov s BMI 35 kg/m2 a o 17,3 % u pacientov s
BMI 45 kg/m2 v porovnaní s jedincami s indexom telesnej hmotnosti 25 kg/m2.
Pohlavie
Pohlavie nemalo na základe analýzy populačnej farmakokinetiky žiadny klinicky významný účinok na farmakokinetiku empagliflozínu.
Rasa
Vo farmakokinetickej analýze skupín pacientov bola odhadovaná AUC o 13,5 % vyššia u pacientov ázijského pôvodu s indexom telesnej hmoty 25 kg/m2 v porovnaní s pacientmi iného ako ázijského pôvodu s indexom telesnej hmoty 25 kg/m2.
Staršie osoby
Vek nemal na základe analýzy populačnej farmakokinetiky žiadny klinicky významný vplyv na farmakokinetiku empagliflozínu.
Pediatrická populácia
Štúdie opisujúce farmakokinetiku empagliflozínu u pediatrických pacientov sa ešte nevykonali.
Metformín
Absorpcia
Po podaní perorálnej dávky metformínu sa tmax dosiahne za 2,5 hodiny. Absolútna biologická dostupnosť 500 mg alebo 850 mg tablety metformíniumchloridu je u zdravých jedincov približne
50-60 %. Po perorálnej dávke bolo v stolici vylúčených 20-30 % nevstrebanej frakcie. Po perorálnom
podaní je absorpcia metformínu saturovateľná a neúplná. Predpokladá sa, že farmakokinetika absorpcie metformínu je nelineárna. Pri odporúčaných dávkach metformínu a dávkovacích režimoch sa rovnovážne plazmatické koncentrácie dosiahnu za 24 až 48 hodín a zvyčajne sú nižšie ako 1 mikrogram/ml. V kontrolovaných klinických štúdiách maximálne plazmatické hladiny metformínu (Cmax) neprekročili 5 mikrogramov/ml, a to ani pri maximálnych dávkach.
Jedlo znižuje rozsah a mierne oneskoruje absorpciu metformínu. Po podaní dávky 850 mg metformíniumchloridu sa pozorovala o 40 % nižšia maximálna plazmatická koncentrácia, 25 % pokles AUC a predĺženie času do maximálnej plazmatickej koncentrácie o 35 minút. Klinický význam týchto poklesov nie je známy.
Distribúcia
Väzba na plazmatické bielkoviny je zanedbateľná. Metformín preniká do erytrocytov. Maximálna koncentrácia v krvi je nižšia ako plazmatická koncentrácia a dochádza k nej približne v rovnakom čase.
Erytrocyty predstavujú najpravdepodobnejšie sekundárny distribučný kompartment. Priemerný
distribučný objem (Vd) sa pohyboval v rozmedzí 63-276 l.
Biotransformácia
Metformín sa vylučuje nezmenený močom. U ľudí neboli identifikované žiadne metabolity.
Eliminácia
Renálny klírens metformínu je > 400 ml/min, čo poukazuje na to, že sa metformín eliminuje glomerulárnou filtráciou a tubulárnou sekréciou. Po perorálnych dávkach je zjavný terminálny polčas
eliminácie približne 6,5 hodín.
Pri poškodení funkcie obličiek sa renálny klírens zníži v pomere, v akom klírens kreatinínu, čím sa polčas eliminácie predĺži, čo vedie k zvýšeným plazmatickým hladinám metformínu.
Osobitné
skupinypacientov
Pediatrická populácia
Štúdia jednorazovej dávky: po jednorazových dávkach 500 mg metformíniumchloridu sa u pediatrických pacientov preukázal podobný farmakokinetický profil ako farmakokinetický profil u
zdravých dospelých.
Štúdia opakovanej dávky: Po opakovaných dávkach 500 mg dvakrát denne počas 7 dní u pediatrických pacientov bola maximálna plazmatická koncentrácia (Cmax) nižšia o približne 33 % a systémová expozícia (AUC0-t) nižšia o približne 40 % v porovnaní s dospelými osobami s diabetes mellitus, ktorí dostávali opakované dávky 500 mg dvakrát denne počas 14 dní. Keďže sa dávka individuálne titruje na základe glykemickej kontroly, toto má obmedzenú klinickú významnosť.
5.3 Predklinické údaje o bezpečnosti
Empagliflozín ametformín
Štúdie všeobecnej toxicity na potkanoch s trvaním až do 13 týždňov vykonané s kombináciou
empagliflozínu a metformínu neodhalili žiadne ďalšie cieľové orgány v porovnaní s empagliflozínom alebo metformínom samostatne. Kombinovaná liečba zvýšila niektoré odpovede, ako napr. účinky na
fyziológiu obličiek, rovnováhu elektrolytov a acidobázický stav. Iba hypochlorémia však bola
považovaná za nežiaducu, a to pri expozíciách približne 9-násobku klinickej expozície AUC
maximálnej odporúčanej dávky empagliflozínu a 3-násobku klinickej expozície AUC maximálnej odporúčanej dávky metformínu.
Štúdia embryofetálneho vývinu na gravidných potkanoch nenaznačila teratogénny účinok pripisovaný empagliflozínu a metformínu pri expozíciách približne 14-násobku klinickej expozície AUC empagliflozínu súvisiacej s najvyššou dávkou a 4-násobku klinickej expozície AUC metformínu súvisiacej s 2000 mg dávkou.
Empagliflozín
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, genotoxicity,
fertility a skorého embryonálneho vývinu neodhalili žiadne osobitné riziko pre ľudí.
V dlhodobých štúdiách toxicity pri hlodavcoch a psoch sa prejavy toxicity pozorovali pri expozíciách vyšších alebo rovných 10-násobku klinickej dávky empagliflozínu. Väčšina toxických účinkov bola identická so sekundárnymi farmakologickými vlastnosťami súvisiacimi s vylučovaním glukózy močom a nerovnováhou elektrolytov vrátane poklesu telesnej hmotnosti a telesného tuku, zvýšenej konzumácie jedla, hnačky, dehydratácie, poklesu sérovej hladiny glukózy a zvýšenia sérových hladín ostatných parametrov odzrkadľujúcich zvýšený metabolizmus bielkovín a glukoneogenézu, zmien v močení, ako sú polyúria a glukozúria a mikroskopických zmien zahŕňajúcich tvorbu minerálov v obličkách a v niektorých mäkkých a vaskulárnych tkanivách. Mikroskopický dôkaz o účinkoch zosilnených farmakologických vlastností na obličky, ktoré sa pozorovali u niektorých druhov, zahŕňal tubulárnu dilatáciu a tvorbu minerálov v tubuloch a panvičke približne pri 4-násobnej klinickej AUC expozície empagliflozínu súvisiacej s 25 mg dávkou.
Empagliflozín nie je genotoxický.
V 2-ročnej štúdii karcinogenity empagliflozín nezvýšil výskyt nádorov u samíc potkana až do najvyššej dávky 700 mg/kg/deň, ktorá zodpovedá približne 72-násobku maximálnej klinickej AUC expozície empagliflozínu. U samcov potkana sa pri najvyššej dávke, ale nie pri 300 mg/kg/deň, čo zodpovedá
26-násobku maximálnej klinickej expozície empagliflozínu, pozorovali benígne vaskulárne proliferatívne lézie (hemangiómy) mezenterickej lymfatickej uzliny súvisiace s liečbou. U samcov
potkana sa pri dávke 300 mg/kg/deň a vyššej, ale nie pri dávke 100 mg/kg/deň, ktorá zodpovedá
približne 18-násobku maximálnej klinickej expozícii empagliflozínu, vo vyššej miere pozorovali
nádory intersticiálnych buniek semenníkov. Obidva nádory boli časté pri potkanoch a je nepravdepodobné, že by sa vzťahovali na ľudí.
Empagliflozín nezvýšil výskyt nádorov u samíc myší pri dávkach až do 1000 mg/kg/deň, čo zodpovedá približne 62-násobku maximálnej klinickej expozície empagliflozínu. Empagliflozín spôsobil vznik nádorov obličiek u samcov myší pri dávke 1000 mg/kg/deň, ale nie pri dávke 300 mg/kg/deň, čo zodpovedá približne 11-násobku maximálnej klinickej expozície empagliflozínu. Mechanizmus účinku pri týchto nádoroch závisí od prirodzenej predispozície samcov myší na renálnu patológiu a metabolická cesta neodráža stav u ľudí. Nádory obličiek u samcov myší sa nepovažujú za významné pre ľudí.
Pri expozíciách, ktoré dostatočne presahujú expozíciu u ľudí po terapeutických dávkach, empagliflozín nemal žiadne nežiaduce účinky na fertilitu ani skorý embryonálny vývin. Empagliflozín podávaný počas obdobia organogenézy nemal teratogénny účinok. Len pri dávkach toxických pre matky spôsoboval aj pokrivenie kostí končatiny u potkanov a zvýšený výskyt embryofetálnych potratov u králikov.
V štúdiách pre- a postnatálnej toxicity s potkanmi sa pri expozíciách u matiek, ktoré predstavovali približne 4-násobok maximálnej klinickej expozície empagliflozínu, pozorovalo zníženie prírastku na hmotnosti mláďat. Pri systémovej expozícii ekvivalentnej maximálnej klinickej expozícii empagliflozínu sa žiadny takýto účinok nepozoroval. Význam týchto zistení pre ľudí nie je jasný.
V štúdiách juvenilnej toxicity empagliflozínu u populácie potkanov od 21. dňa po narodení do 90. dňa po narodení sa nepozorovala žiadna nežiaduca, naopak minimálna až mierna renálna tubulárna a pelvická dilatácia u mladých potkanov iba pri dávke 100 mg/kg/deň, čo zodpovedá približne 11‑ násobku maximálnej klinickej dávky 25 mg. Tieto zistenia chýbali po 13 týždňovom rekonvalescenčnom období bez lieku.
Metformín
Predklinické údaje pre metformín získané na základe obvyklých farmakologických štúdií bezpečnosti,
toxicity po opakovanom podávaní, genotoxicity alebo karcinogénneho potenciálu alebo reprodukčnej toxicity neodhalili žiadne osobitné riziko pre ľudí. Pri hladinách dávky 500 mg/kg/deň podávaných
potkanom Wistar Hannover, súvisiacich so 7- násobkom maximálnej odporúčanej dávky metformínu u ľudí (MRHD) sa teratogenita metformínu pozorovala najvýraznejšie ako zvýšenie počtu malformácií skeletu.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Synjardy5mg/850mgfilmomobalenétabletyaSynjardy5mg/1000mgfilmomobalenétablety
Jadrotablety kukuričný škrob
kopovidón (K-hodnota nominálne 28) bezvodý koloidný oxid kremičitý magnéziumstearát
Filmovýobal hypromelóza makrogol 400
oxid titaničitý (E171)
mastenec
žltý oxid železitý (E172)
Synjardy
12,5mg/850 mg
filmo
m
obalen
é
tablet
y
a
Synjard
y
12,
5
mg/1000 mg
filmom
obalené
tablety
Jadro
tablety kukuričný škrob
kopovidón (K-hodnota nominálne 28)
bezvodý koloidný oxid kremičitý magnéziumstearát
Filmovýobal hypromelóza makrogol 400
oxid titaničitý (E171)
mastenec
čierny oxid železitý (E172)
červený oxid železitý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
PVC/PVDC/hliníkové blistre s perforáciou umožňujúcou oddelenie jednotlivých dávok.
Veľkosti balenia po 10 x 1, 14 x 1, 30 x 1, 56 x 1, 60 x 1, 90 x 1, 100 x 1 filmom obalená tableta a viacpočetné balenia obsahujúce 120 (2 balenia po 60 x 1), 180 (2 balenia po 90 x 1) a 200 (2 balenia po
100 x 1) filmom obalených tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Boehringer Ingelheim International GmbH Binger Str. 173
D-55216 Ingelheim nad Rýnom
Nemecko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
Synjardy5mg/850mgfilmomobalenétablety
EU/1/15/1003/001
EU/1/15/1003/002
EU/1/15/1003/003
EU/1/15/1003/004
EU/1/15/1003/005
EU/1/15/1003/037
EU/1/15/1003/006
EU/1/15/1003/007
EU/1/15/1003/008
EU/1/15/1003/009
Synjardy5mg/1000mgfilmomobalenétabletyEU/1/15/1003/010
EU/1/15/1003/011
EU/1/15/1003/012
EU/1/15/1003/013
EU/1/15/1003/014
EU/1/15/1003/038
EU/1/15/1003/015
EU/1/15/1003/016
EU/1/15/1003/017
EU/1/15/1003/018
Synjardy12,5mg/850mgfilmomobalenétabletyEU/1/15/1003/019
EU/1/15/1003/020
EU/1/15/1003/021
EU/1/15/1003/022
EU/1/15/1003/023
EU/1/15/1003/039
EU/1/15/1003/024
EU/1/15/1003/025
EU/1/15/1003/026
EU/1/15/1003/027
Synjardy12,5mg/1000 mgfilmomobalenétabletyEU/1/15/1003/028
EU/1/15/1003/029
EU/1/15/1003/030
EU/1/15/1003/031
EU/1/15/1003/032
EU/1/15/1003/040
EU/1/15/1003/033
EU/1/15/1003/034
EU/1/15/1003/035
EU/1/15/1003/036
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 27. máj 2015
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.