eobjaví obláčik.
·
Keď sa objaví obláčik, zopakujte kroky 4 – 6 ešte trikrát.
Teraz je inhalátor pripravený na použitie a poskytne 60 vstrekov (30 dávok).

| Každodenné používanie OTOČTE OTOČTE
· Ponechajte uzáver zatvorený.
· OTÁČAJTE priesvitný kryt v smere šípok na obale, až kým nezapadne (polovičné otočenie).
| 
|
OTVORTE
· OTVÁRAJTE uzáver, až kým nepovolí a nie je úplne otvorený.
| 
|
STLAČTE
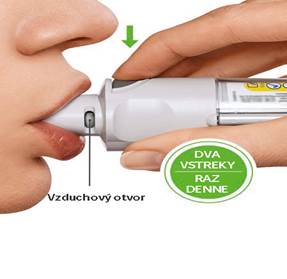
· Pomaly a úplne vydýchnite.
· Zovrite pery okolo náustku bez toho, aby ste zakryli vzduchové otvory. Nasmerujte inhalátor na zadnú stranu hrdla.
· Zatiaľ čo sa pomaly hlboko nadýchnete ústami, STLAČTE tlačidlo uvoľňujúce dávku a pokračujte pomaly v nádychu, kým vydržíte.
· Zadržte dych na 10 sekúnd alebo tak dlho ako vydržíte.
· Pri obidvoch vstrekoch zopakujte: OTOČTE, OTVORTE, STLAČTE.
· Zatvorte kryt, kým sa inhalátor znova nepoužije.
| 
|
Kedy treba vymeniť náplň Spiolto RespimatIndikátor dávok ukazuje, koľko vstrekov ostáva v náplni.

Ostáva 60 vstrekov.

Ostáva menej ako 10 vstrekov. Obstarajte novú náplň.

Náplň je spotrebovaná. Otočte priesvitným krytom a uvoľnite ju. Inhalátor je teraz v zablokovanej polohe. Náplň vytiahnite z inhalátora. Vložte novú náplň (pokračujte krokom 2).
4.3 KontraindikáciePrecitlivenosť na tiotrópium, olodaterol alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Precitlivenosť na atropín alebo jeho deriváty, napr. ipratropium alebo oxitropium, v anamnéze.
4.4 Osobitné upozornenia a opatrenia pri používaníAstmaSpiolto Respimat sa nemá používať pri astme. Účinnosť a bezpečnosť Spiolta Respimat pri astme neboli sledované.
Liek nie je určený na akútne použitieSpiolto Respimat nie je indikovaný na liečbu akútnych záchvatov bronchospazmu, t. j. ako záchranná liečba.
Paradoxný bronchospazmusTak ako pri iných inhalačných liekoch, aj Spiolto Respimat môže viesť k paradoxnému bronchospazmu, ktorý môže ohrozovať život. Ak sa vyskytne paradoxný bronchospazmus, Spiolto Respimat sa má okamžite vysadiť a nahradiť alternatívnou liečbou.
Anticholinergické účinky súvisiace s tiotrópiomGlaukóm so zatvoreným uhlom, hyperplázia prostaty alebo obštrukcia hrdla močového mechúraPre anticholinergickú aktivitu tiotrópia sa má Spiolto Respimat podávať opatrne u pacientov s glaukómom so zatvoreným uhlom, s hyperpláziou prostaty alebo obštrukciou hrdla močového mechúra.
Očné príznakyPacienti si majú dávať pozor, aby im roztok nevnikol do očí. Majú byť poučení, že to môže spôsobiť precipitáciu alebo zhoršenie glaukómu so zatvoreným uhlom, bolesť očí alebo diskomfort, prechodné neostré videnie, irizáciu videnia alebo farebné obrazce spojené s červenými očami z konjunktiválnej kongescie a korneálneho edému. Ak sa objaví ktorákoľvek z kombinácii týchto očných príznakov, pacienti majú prestať používať Spiolto Respimat a okamžite to konzultovať so špecialistom.
Zubné kazySucho v ústach, ktoré bolo zaznamenané pri anticholinergickej liečbe, môže pri dlhodobom používaní viesť k zubným kazom.
Pacienti s poruchou funkcie obličiekKeďže pri znížených obličkových funkciách stúpa plazmatická koncentrácia tiotrópia, u pacientov so stredne ťažkou až ťažkou poruchou funkcie obličiek (klírens kreatinínu ≤ ako 50 ml/min) sa Spiolto Respimat podáva vtedy, ak očakávaný prínos prevyšuje potenciálne riziko. U pacientov s ťažkou poruchou funkcie obličiek nie sú dlhodobé skúsenosti (pozri časť 5.2).
Kardiovaskulárne účinkySkúsenosti s liekom Spiolto Respimat sú obmedzené u pacientov s infarktom myokardu počas predchádzajúceho roka, nestabilnou alebo život ohrozujúcou srdcovou arytmiou, hospitalizovaných z dôvodu srdcového zlyhania počas predchádzajúceho roka alebo s diagnózou paroxyzmálnej tachykardie (> 100 tepov za minútu) v anamnéze, pretože títo pacienti boli z klinických štúdií vylúčení. V týchto skupinách pacientov sa má Spiolto Respimat používať opatrne.
Tak ako iné beta
2-adrenergné agonisty, aj olodaterol môže mať u niektorých pacientov klinicky významný účinok na kardiovaskulárny systém, čo sa môže prejaviť ako zvýšená tepová frekvencia, zvýšený krvný tlak a/alebo iné príznaky. V prípade výskytu takýchto účinkov môže byť potrebné prerušiť liečbu. Ďalej sa hlásili zmeny na elektrokardiograme (EKG) vyvolané beta-adrenergnými agonistami, ako je sploštenie vlny T a depresia segmentu ST, hoci klinický význam týchto pozorovaní nie je známy.
Dlhodobo pôsobiace beta
2-adrenergné agonisty sa majú podávať s opatrnosťou pacientom s kardiovaskulárnymi ochoreniami, najmä s ischemickou chorobou srdca, ťažkou kardiálnou dekompenzáciou, srdcovými arytmiami, hypertrofickou obštrukčnou kardiomyopatiou
, hypertenziou a aneuryzmou, pacientom s konvulzívnymi poruchami alebo tyreotoxikózou, pacientom so známym alebo suspektným predĺžením intervalu QT (napr. QT > 0,44 s) a pacientom, ktorí na sympatomimetické amíny neprimerane reagujú.
HypokaliémiaU niektorých pacientov môžu beta
2-adrenergné agonisty spôsobiť významnú hypokaliémiu, ktorá môže eventuálne vyvolať nežiaduce účinky na kardiovaskulárny systém. Zníženie hladiny draslíka v sére je zvyčajne prechodné, nevyžaduje si suplementáciu. U pacientov s ťažkou CHOCHP môže hypoxia a súčasná liečba ďalšími liekmi zosilniť hypokaliémiu (pozri časť 4.5), čo môže zvýšiť náchylnosť na srdcové arytmie.
HyperglykémiaInhalácia vysokých dávok beta
2-adrenergných agonistov môže viesť k zvýšeniu hladiny glukózy v plazme.
AnestéziaOpatrnosť je potrebná v prípade plánovaných operácií s anestetikami na báze halogénových uhľovodíkov z dôvodu zvýšenej náchylnosti na nežiaduce účinky beta-agonisticky pôsobiacich bronchodilatancií na srdce.
Spiolto Respimat sa nemá používať v kombinácii s inými liekmi, ktoré obsahujú dlhodobo pôsobiace beta
2-adrenergné agonisty.
Pacienti, ktorí používajú inhalačné krátkodobo pôsobiace beta
2-adrenergné agonisty na pravidelnej báze (napr. štyrikrát denne), majú byť poučení o tom, ako ich používať len na symptomatickú úľavu akútnych respiračných príznakov.
Spiolto Respimat sa nemá používať častejšie než jedenkrát denne.
PrecitlivenosťTak ako pri všetkých liekoch, aj po podaní Spiolta Respimat sa môžu vyskytnúť okamžité reakcie z precitlivenosti.
Pomocné látkyBenzalkónium-chlorid môže spôsobiť sipot a problémy s dýchaním. U pacientov s astmou je zvýšené riziko výskytu týchto nežiaducich účinkov.
4.5 Liekové a iné interakcieAj keď sa nevykonali žiadne formálne štúdie
in vivo zamerané na liekové interakcie medzi Spioltom Respimat a inými liekmi, inhalačný Spiolto Respimat sa používa súbežne s inými liekmi na CHOCHP vrátane krátkodobo pôsobiacich sympatomimetických bronchodilatancií a inhalačných kortikosteroidov bez klinických dôkazov liekových interakcií.
AnticholinergikáSúbežné podávanie tiotrópium-bromidu, jednej zložky lieku Spiolto Respimat, s inými liekmi obsahujúcimi anticholinergiká sa neskúmalo, a preto sa neodporúča.
Adrenergné látkySúbežné podávanie iných adrenergných látok (samotných alebo ako súčasť kombinovanej liečby) môže zosilniť nežiaduce účinky lieku Spiolto Respimat.
Deriváty xantínu, steroidy alebo diuretikáSúbežná liečba derivátmi xantínu, steroidmi alebo diuretikami nešetriacimi draslík môže zosilniť akýkoľvek hypokaliemizujúci účinok adrenergných agonistov (pozri časť 4.4).
BetablokátoryBeta-adrenergné blokátory môžu oslabiť alebo antagonizovať účinok olodaterolu. Podľa potreby možno zvážiť kardioselektívne beta-adrenergné blokátory, musia sa však podávať s opatrnosťou.
Inhibítory MAO a tricyklické antidepresíva, lieky predlžujúce QTcInhibítory monoaminooxidázy, tricyklické antidepresíva alebo iné liečivá, o ktorých je známe, že predlžujú interval QTc, môžu zosilniť účinok Spiolta Respimat na kardiovaskulárny systém.
Farmakokinetické interakcie liečivo-liečivoV štúdiách interakcií liečivo-liečivo so súbežným podaním flukonazolu, ktorý sa použil ako modelový inhibítor CYP2C9, sa nepozoroval žiaden významný účinok na systémovú expozíciu olodaterolu.
Súbežné podanie ketokonazolu ako silného inhibítora P-gp a CYP3A4 zvýšilo systémovú expozíciu olodaterolu približne o 70 %. Nie je potrebná úprava dávky lieku Spiolto Respimat.
In vitro výskumy potvrdili, že olodaterol neinhibuje enzýmy CYP ani transportéry liečiv pri plazmatických koncentráciách dosiahnutých v klinickej praxi.
4.6 Fertilita, gravidita a laktáciaGraviditaTiotrópiumO používaní tiotrópia u tehotných žien je veľmi obmedzené množstvo údajov. Štúdie na zvieratách nenasvedčujú žiadnemu priamemu ani nepriamemu škodlivému účinku, pokiaľ ide o reprodukčnú toxicitu v klinicky relevantných dávkach (pozri časť 5.3).
OlodaterolNie sú k dispozícii žiadne údaje o gravidných ženách vystavených účinku olodaterolu. Predklinické údaje pre olodaterol preukázali účinky typické pre beta-adrenergné agonisty pri vysokých násobkoch liečebných dávok (pozri časť 5.3).
Ako preventívne opatrenie je vhodnejšie vyhnúť sa používaniu lieku Spiolto Respimat počas gravidity.
Tak ako iné beta
2-adrenergné agonisty, aj olodaterol, jedna zložka lieku Spiolto Respimat, môže inhibovať pôrodné kontrakcie v dôsledku relaxačného účinku na hladké svalstvo maternice.
DojčenieNie sú dostupné klinické údaje od dojčiacich žien vystavených účinkom tiotrópia a/alebo olodaterolu.
V štúdiách na zvieratách sa tak pri tiotrópiu, ako aj pri olodaterole zistili účinné látky a/alebo ich metabolity v mlieku dojčiacich potkanov, nie je však známe, či sa tiotrópium a/alebo olodaterol vylučuje do ľudského materského mlieka
Rozhodnutie o tom, či pokračovať v dojčení alebo ukončiť ho alebo pokračovať v liečbe Spioltom Respimat, alebo ukončiť ju, sa má urobiť po zohľadnení prínosu dojčenia pre dieťa a prínosu liečby Spioltom Respimat pre ženu.
FertilitaKlinické údaje týkajúce sa fertility nie sú pre tiotrópium a olodaterol ani pre kombináciu oboch zložiek dostupné. Predklinické štúdie vykonané s jednotlivými zložkami, tiotrópiom a olodaterolom, nepreukázali žiadne náznaky nežiaducich účinkov na fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNevykonali sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje.
Pacientov však treba upozorniť, aby pri používaní Spiolta Respimat hlásili závrat a neostré videnie. Preto sa má pri vedení vozidiel a obsluhe strojov odporučiť opatrnosť. Ak sa u pacientov tieto príznaky vyskytnú, majú sa vyvarovať potenciálne nebezpečným činnostiam, ako je vedenie vozidiel alebo obsluha strojov.
4.8 Nežiaduce účinkya.
Súhrn profilu bezpečnostiMnoho uvedených nežiaducich účinkov možno pripísať anticholinergickým vlastnostiam tiotrópium-bromidu alebo ß
2-adrenergným vlastnostiam olodaterolu, zložkám lieku Spiolto Respimat.
b.
Tabuľkový zoznam nežiaducich účinkovFrekvencie priradené nežiaducim účinkom uvedeným nižšie sa zakladajú na odhadovaných pomeroch incidencie nežiaducich liekových reakcií (t. j. udalostí pripisovaných Spioltu Respimat), pozorovaných v skupine s tiotrópiom v dávke 5 mikrogramov/s olodaterolom v dávke 5 mikrogramov (5 646 pacientov), získaných zo 8 klinických štúdií kontrolovaných liečivom alebo placebom prebiehajúcich v paralelných skupinách s pacientmi s CHOCHP s trvaním liečby v rozsahu 4 až 52 týždňov.
Nežiaduce účinky hlásené vo všetkých klinických štúdiách lieku Spiolto Respimat sú uvedené nižšie podľa tried systémových orgánov.
Patria medzi ne aj všetky nežiaduce účinky, ktoré sa vyskytli pri každej zložke podávanej samostatne.
Frekvencia je uvedená s použitím nasledujúcej konvencie:
Veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až <1/1 000); veľmi zriedkavé (<1/10 000), neznáme (nedajú sa odhadnúť z dostupných údajov)
Trieda orgánových systémov
| Nežiaduca reakcia
| Frekvencia
| Infekcie a nákazy
| Nazofaryngitída
| neznáme
| Poruchy metabolizmu a výživy
| Dehydratácia
| neznáme
| Poruchy nervového systému
| Závraty
| menej časté
| Insomnia
| zriedkavé
| Bolesti hlavy
| menej časté
| Poruchy oka
| Neostré videnie
| zriedkavé
| Glaukóm
| neznáme
| Zvýšený vnútroočný tlak
| neznáme
| Poruchy srdca a srdcovej činnosti
| Atriálna fibrilácia
| zriedkavé
| Tachykardia
| menej časté
| Palpitácie
| zriedkavé
| Supraventrikulárna tachykardia
| zriedkavé
| Hypertenzia
| zriedkavé
| Poruchy dýchacej sústavy, hrudníka a mediastína
| Kašeľ
| menej časté
| Dysfónia
| menej časté
| Laryngitída
| zriedkavé
| Faryngitída
| zriedkavé
| Epistaxa
| zriedkavé
| Bronchospazmus
| zriedkavé
| Sinusitída
| neznáme
| Poruchy gastrointestinálneho traktu
| Sucho v ústach
| menej časté
| Zápcha
| zriedkave
| Orofaryngeálna kandidóza
| zriedkavé
| Gingivitída
| zriedkavé
| Nauzea
| zriedkavé
| Intestinálna obštrukcia vrátane
paralytického ilea
| neznáme
| Dysfágia
| neznáme
| Gastroezofageálny reflux
| neznáme
| Glositída
| neznáme
| Stomatitída
| zriedkavé
| Zubný kaz
| neznáme
| Poruchy kože a podkožného tkaniva,
poruchy imunitného systému
| Precitlivenosť
| zriedkavé
| Angioedém
| zriedkavé
| Urtikária
| zriedkavé
| Pruritus
| zriedkavé
| Anafylaktická reakcia
| neznáme
| Vyrážka
| zriedkavé
| Infekcia kože a vred na koži
| neznáme
| Suchá koža
| neznáme
| Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
| Artralgia
| zriedkavé
| Bolesť chrbta1
| zriedkavé
| Opuch kĺbov
| zriedkavé
| Poruchy obličiek a močových ciest
| Retencia moču
| zriedkavé
| Infekcia močových ciest
| zriedkavé
| Dyzúria
| zriedkavé
|
|
1 nežiaduce účinky hlásené pri Spiolte Respimat, ale nie pri jednotlivých zložkách podávaných samostatne
|
c.
Popis vybraných nežiaducich účinkov;Spiolto Respimat v dôsledku svojich zložiek tiotrópium a olodaterol zlučuje anticholinergické a ß
2-adrenergné vlastnosti.
Profil anticholinergických nežiaducich reakciíV dlhodobých 52-týždňových klinických štúdiách so Spioltom Respimat bolo najčastejšie pozorovaným nežiaducim anticholinergickým účinkom sucho v ústach, ktoré sa vyskytlo približne u 1,3 % pacientov liečených liekom Spiolto Respimat a u 1,7 % pacientov v liečebnej skupine s tiotrópiom v dávke 5 mikrogramov a u 1 % pacientov v liečebnej skupine s olodaterolom v dávke 5 mikrogramov. Sucho v ústach viedlo k prerušeniu liečby u 2 z 4 968 pacientov (0,04 %) liečených Spioltom Respimat.
Medzi závažné nežiaduce účinky v súvislosti s anticholinergickými účinkami patrí glaukóm, zápcha, intestinálna obštrukcia vrátane paralytického ilea a retencia moču.
Profil beta2-adrenergných nežiaducich reakciíOlodaterol, jedna zložka Spiolta Respimat, je člen terapeutickej triedy dlhodobo pôsobiacich beta
2-adrenergných agonistov. Preto sa má zohľadniť výskyt iných nežiaducich účinkov súvisiacich s triedou beta-adrenergných agonistov, ako je arytmia, ischémia myokardu, angína pektoris, hypotenzia, tremor, nervozita, svalové kŕče, únava, malátnosť, hypokaliémia, hyperglykémia a metabolická acidóza.
d.
Iné osobitné populácieVo vyššom veku sa môže vyskytnúť zvýšenie anticholinergických účinkov.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 PredávkovanieO predávkovaní liekom Spiolto Respimat je obmedzené množstvo informácií. Spiolto Respimat bol sledovaný v dávke 5 mikrogramov/10 mikrogramov (tiotrópium/olodaterol) u pacientov s CHOCHP a v dávke 10 mikrogramov/40 mikrogramov (tiotrópium/olodaterol) u zdravých dobrovoľníkov; nepozorovali sa žiadne klinicky relevantné účinky. Predávkovanie by mohlo viesť k zosilneným antimuskarínovým účinkom tiotrópia a/alebo nadmerným β
2-agonistickým účinkom olodaterolu.
PríznakyPredávkovanie anticholinergikom tiotrópiumVysoké dávky tiotrópia môžu viesť k anticholinergickým prejavom a príznakom.
U zdravých dobrovoľníkov sa nevyskytli žiadne nežiaduce systémové anticholinergické účinky po jednorazovej inhalačnej dávke do 340 mikrogramov tiotrópium-bromidu. Navyše u zdravých dobrovoľníkov neboli pozorované žiadne relevantné nežiaduce účinky okrem sucha v ústach/krku a suchej sliznice nosa, po 14-dňovej liečbe inhalačným roztokom tiotrópia do 40 mikrogramov s výnimkou výrazne zníženej produkcie slín od 7. dňa.
Predávkovanie ß2-agonistom olodaterolPredávkovanie olodaterolom bude pravdepodobne viesť k nadmerným účinkom typickým pre beta
2-adrenergné agonisty, napr. k ischémii myokardu, hypertenzii alebo hypotenzii, tachykardii, arytmiám, palpitácii, závratu, nervozite, insomnii, úzkosti, bolesti hlavy, tremoru, suchu v ústach, svalovým kŕčom, nauzei, únave, malátnosti, hypokaliémii, hyperglykémii a metabolickej acidóze.
Liečba predávkovaniaLiečba liekom Spiolto Respimat sa má ukončiť. Indikovaná je podporná a symptomatická liečba. V závažných prípadoch majú byť pacienti hospitalizovaní. Možno uvažovať o použití kardioselektívnych betablokátorov, no len s maximálnou opatrnosťou, pretože použitie beta-adrenergného blokátora môže vyvolať bronchospazmus.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Liečivá na obštrukčné choroby dýchacích ciest, adrenergiká v kombinácii s anticholinergikami
ATC kód: R03AL06
Mechanizmus účinkuSpiolto Respimat Spiolto Respimat je inhalačný roztok s fixnou kombináciou antagonistu muskarínových receptorov s dlhodobým účinkom, tiotrópium, a dlhodobo pôsobiaceho agonistu beta
2-adrenergných receptorov, olodaterol (LAMA/LABA), ktorý je podaný prostredníctvom inhalátora produkujúceho jemnú hmlovinu Spiolto Respimat.
Dve aktívne zložky lieku poskytujú aditívny bronchodilatačný účinok v dôsledku ich odlišného mechanizmu účinkovania. Keďže sa ukazuje, že muskarínové receptory sú výraznejšie umiestnené v centrálnych dýchacích cestách, zatiaľ čo ß
2-adrenoreceptory majú vyššiu hladinu expresie v periférnych dýchacích cestách, kombinácia tiotrópia a olodaterolu by mala zabezpečiť optimálnu bronchodilatáciu vo všetkých oblastiach pľúc.
TiotrópiumTiotrópium-bromid je dlhodobo účinkujúci špecifický antagonista muskarínových receptorov. Má podobnú afinitu k subtypom M
1 – M
5.V dýchacích cestách sa tiotrópium-bromid kompetitívne a reverzibilne viaže na M
3 receptory hladkého svalstva bronchov, antagonizuje cholinergický (bronchokonstrikčný) účinok acetylcholínu, čím spôsobuje relaxáciu hladkého svalstva bronchov. Účinok je závislý od dávky a trvá viac než 24 hodín. Tiotrópium-bromid ako N-kvartérne anticholinergikum je topicky (broncho-)selektívny pri inhalačnom podávaní, čím je daný akceptovateľný terapeutický rozsah, skôr než sa prejavia systémové anticholinergické účinky.
OlodaterolOlodaterol má vysokú afinitu a vysokú selektivitu k ľudskému beta
2-adrenoceptoru.
In vitro štúdie preukázali, že olodaterol vykazuje 241-násobne vyššiu agonistickú aktivitu na beta
2-adrenoceptoroch v porovnaní s beta
1-adrenoceptormi a 2 299-násobne vyššiu agonistickú aktivitu v porovnaní s beta
3-adrenoceptormi.
Zlúčenina vykazuje svoje farmakologické účinky prostredníctvom naviazania sa na beta
2-adrenoceptory a ich aktiváciou po lokálnom podaní vo forme inhalácie.
Aktivácia týchto receptorov v dýchacích cestách vedie k stimulácii intracelulárnej adenylátcyklázy, enzýmu, ktorý sprostredkúva syntézu cyklického-3’,5’-adenozínmonofosfátu (cAMP). Zvýšené hladiny cAMP indukujú bronchodilatáciu relaxáciou hladkých svalových buniek dýchacích ciest.
Olodaterol má predklinický profil dlhodobo pôsobiaceho selektívneho agonistu beta
2-adrenoceptorov (LABA) s rýchlym nástupom účinku a trvaním účinku minimálne 24 hodín.
Beta‑adrenoceptory sú rozdelené na tri podtypy: beta
1‑adrenoceptory prevažne expresované v hladkom svalstve srdca, beta
2-adrenoceptory prevažne expresované v hladkom svalstve dýchacích ciest a beta
3-adrenoceptory prevažne expresované v tukovom tkanive. Beta
2-agonisty spôsobujú bronchodilatáciu. Napriek tomu, že beta
2-adrenoceptor je prevažne adrenergný receptor v hladkých svaloch dýchacích ciest, je prítomný aj na povrchu rôznych ďalších buniek vrátane epitelu pľúc a endotelových buniek a v srdci. Presná funkcia beta
2-receptorov v srdci nie je známa, no ich prítomnosť zvyšuje pravdepodobnosť, že aj vysoko selektívne beta
2-adrenergné agonisty môžu mať účinky na srdce.
Účinky na elektrofyziológiu srdcaTiotrópiumV štúdii zameranej na QT interval, zahŕňajúcej 53 zdravých dobrovoľníkov, podávanie inhalačného prášku tiotrópium v dávke 18 mikrogramov a 54 mikrogramov (t. j. trojnásobok terapeutickej dávky) počas 12 dní neviedlo k významnému predĺženiu QT intervalov na EKG.
OlodaterolÚčinok olodaterolu na interval QT/QTc na EKG sa skúmal u 24 zdravých mužov dobrovoľníkov a žien dobrovoľníčok v dvojito zaslepenej, randomizovanej, placebom a liečivom (moxifloxacín) kontrolovanej štúdii. Olodaterol v jednorazových dávkach 10, 20, 30 a 50 mikrogramov preukázal, že v porovnaní s placebom priemerná zmena voči východiskovému stavu v intervale QT po 20 minútach až 2 hodinách po podaní sa zvýšili v závislosti od dávky od 1,6 (10 mikrogramov olodaterolu) do 6,5 ms (50 mikrogramov olodaterolu), pričom horný limit obojstranného 90 % intervalu spoľahlivosti bol kratší než 10 ms pri všetkých hladinách dávok pre jednotlivé korigované intervaly QT (QTcI).
Účinok 5 mikrogramov a 10 mikrogramov olodaterolu na tepovú frekvenciu a rytmus srdca sa hodnotil pomocou priebežného 24-hodinového zaznamenávania EKG (monitorovanie Holterom) v podskupine 772 pacientov v 48-týždňových, placebom kontrolovaných štúdiách fázy 3. Nepozorovala sa dávková ani časová súvislosť s tendenciami alebo so vzormi závažných priemerných zmien tepovej frekvencie alebo predčasných úderov. Posuny východiskových hodnôt na konci liečby pri predčasných úderoch nenaznačili významné rozdiely medzi 5 mikrogramami olodaterolu, 10 mikrogramami olodaterolu a placebom.
Spiolto RespimatVo dvoch 52-týždňových randomizovaných, dvojito zaslepených štúdiách s liekom Spiolto Respimat bolo zaradených 5 162 pacientov s CHOCHP. V združenej analýze sa počet účastníkov so zmenami QTcF (s korekciou podľa Fridericia) intervalu > 30 ms oproti východiskovej hodnote 40 minút po podaní dávky v 85., 169. a 365. deň pohyboval v rozpätí od 3,1 %, 4,7 % a 3,6 % v skupine so Spioltom Respimat v porovnaní s 4,1%, 4,4 % a 3,6 % v skupine s olodaterolom 5 mikrogramov a 3,4 %, 2,3 % a 4,6 % v skupine s tiotrópiom 5 mikrogramov, v danom poradí.
Klinická účinnosť a bezpečnosťKlinický vývojový program fázy III pre Spiolto Respimat zahŕňal tri randomizované, dvojito zaslepené štúdie:
(i) dve opakované 52-týždňové klinické štúdie s paralelnými skupinami porovnávajúce Spiolto Respimat s tiotrópiom 5 mikrogramov a olodaterolom 5 mikrogramov (1 029 účastníkov používalo Spiolto Respimat) [Klinické štúdie 1 a 2],
(ii) jedna 6-týždňová skrížená klinická štúdia porovnávajúca Spiolto Respimat s tiotrópiom
5 mikrogramov a olodaterolom 5 mikrogramov a placebom (139 účastníkov používalo Spiolto Respimat) [Klinická štúdia 3].
V týchto klinických štúdiách sa komparátory, tiotrópium 5 mikrogramov, olodaterol 5 mikrogramov a placebo, podávali prostredníctvom inhalátora Respimat.
Charakteristika pacientovVäčšina z 5 162 pacientov zaradených do globálnych 52-týždňových klinických štúdií [Klinické štúdie 1 a 2] boli muži (73 %), belosi (71 %) alebo Aziati (25 %), s priemerným vekom 64,0 rokov. Priemerný FEV
1 po podaní bronchodilatátora bol 1,37 l (GOLD 2 [50 %], GOLD 3 [39 %], GOLD 4 [11 %]). Priemerná schopnosť reagovať na podanie β
2-agonistu bola 16,6 % východiskovej hodnoty (0,171 l)). Medzi respiračné lieky povolené v rámci súbežnej liečby patrili inhalačné steroidy [47 %] a xantíny [10 %].
6-týždňová klinická štúdia [Klinická štúdia 3] sa vykonala v Európe a Severnej Amerike. Väčšina zo zaradených 219 pacientov boli muži (59 %) a belosi (99 %), s priemerným vekom 61,1 roka. Priemerný FEV
1 po podaní bronchodilatátora bol 1,55 l (GOLD 2 [64 %], GOLD 3 [34 %], GOLD 4 [2 %]). Priemerná schopnosť reagovať na podanie β
2-agonistu bola 15,9 % východiskovej hodnoty (0,193 l). Medzi respiračné lieky povolené v rámci súbežnej liečby patrili inhalačné steroidy [41 %] a xantíny [4 %].
Účinky na pľúcne funkcieV 52-týždňových štúdiách poskytol Spiolto Respimat podávaný raz denne ráno jasné zlepšenie pľúcnych funkcií v priebehu 5 minút po prvej dávke v porovnaní s tiotrópiom 5 mikrogramov (priemerné 0,137 l zvýšenie FEV
1 pri Spiolte Respimat vs 0,058 l pri tiotrópiu 5 mikrogramov [p < 0,0001] a 0,125 l pri olodaterole 5 mikrogramov [p = 0,16]).
V oboch štúdiách sa pozorovali signifikantné zlepšenia v odpovedi FEV
1 AUC
0–3h a odpovedi minimálneho FEV
1 po 24 týždňoch (primárne koncové ukazovatele pľúcnych funkcií) pri Spiolte Respimat v porovnaní s tiotrópiom 5 mikrogramov a olodaterolom 5 mikrogramov (tabuľka 1).
Tabuľka 1 Rozdiel v odpovedi FEV1 AUC0–3h a odpovedi minimálneho FEV1 pri Spiolte Respimat v porovnaní s tiotrópiom 5 mikrogramov, olodaterolom 5 mikrogramov po 24 týždňoch (Klinická štúdia 1 a 2)
| Odpoveď FEV1 AUC0-3h
| Odpoveď minimálneho FEV1
|
| Štúdia 1
| Štúdia 2
| Štúdia 1
| Štúdia 2
|
| n
| Priemer
| N
| Priemer
| n
| Priemer
| n
| Priemer
|
Spiolto Respimat verzus
| 522
| –
| 502
| –
| 521
| –
| 497
| –
|
Tiotrópium 5 mikrogramov
| 526
| 0,117 l
| 500
| 0,103 l
| 520
| 0,071 l
| 498
| 0,050 l
|
Olodaterol 5 mikrogramov
| 525
| 0,123 l
| 507
| 0,132 l
| 519
| 0,082 l
| 503
| 0,088 l
|
východisková hodnota FEV
1 pred liečbou: Štúdia 1 = 1,16 l; Štúdia 2 = 1,15 l
p ≤ 0,0001 pri všetkých porovnaniach
n = počet pacientov
Pacienti s vyšším stupňom reverzibility pri meraní východiskových hodnôt vo všeobecnosti preukázali so Spioltom Respimat vyššiu bronchodilatačnú odpoveď ako pacienti s nižším stupňom reverzibility pri meraní východiskových hodnôt.
Zvýšené bronchodilatačné účinky Spiolta Respimat v porovnaní s tiotrópiom 5 mikrogramov a olodaterolom 5 mikrogramov sa zachovali počas celého 52-týždňového obdobia liečby. Spiolto Respimat zlepšil aj rannú a večernú maximálnu výdychovú rýchlosť (PEFR, peak expiratory flow rate) v porovnaní s tiotrópiom 5 mikrogramov a olodaterolom 5 mikrogramov, meranú podľa denných záznamov pacienta.
V 6-týždňovej klinickej štúdii Spiolto Respimat preukázal signifikantne vyššiu odpoveď FEV
1 v porovnaní s tiotrópiom 5 mikrogramov, olodaterolom 5 mikrogramov a placebom (p < 0,0001) počas celého 24-hodinového dávkovacieho intervalu (tabuľka 2).
Tabuľka 2 Priemerný rozdiel v FEV1 (l) za 3, 12 a 24 hodín a rozdiel v minimálnom FEV1 (l) pri Spiolte Respimat v porovnaní s tiotrópiom 5 mikrogramov, olodaterolom 5 mikrogramov a placebo po 6 týždňoch (Klinická štúdia 3)
| n
| 3 h priemer
| n
| 12 h priemer
| 24 h priemer1
| Minimálne
|
Spiolto Respimat verzus
| 138
|
| 138
|
|
|
|
Tiotrópium 5 mikrogramov
| 137
| 0,109
| 135
| 0,119
| 0,110
| 0,079
|
Olodaterol 5 mikrogramov
| 138
| 0,109
| 136
| 0,126
| 0,115
| 0,092
|
Placebo
| 135
| 0,325
| 132
| 0,319
| 0,280
| 0,207
|
východisková hodnota FEV
1 pred liečbou = 1,30 l
1primárny koncový ukazovateľ
p < 0,0001 pri všetkých porovnaniach
n = počet pacientov
DyspnoePo 24 týždňoch (klinické skúšanie 1 a 2) bolo priemerné fokálne skóre TDI 1,98 jednotky pri Spiolte Respimat, so signifikantným zlepšením v porovnaní s tiotrópiom 5 mikrogramov (priemerný rozdiel 0,36; p = 0,008) a olodaterolom 5 mikrogramov (priemerný rozdiel 0,42; p = 0,002).
Viac pacientov liečených Spioltom Respimat malo klinicky významné zlepšenie fokálneho skóre TDI (MCID, definované ako hodnota najmenej 1 jednotky) v porovnaní s tiotrópiom 5 mikrogramov (54,9 % vs 50,6 %, p = 0,0546) a olodaterolom 5 mikrogramov (54,9 % vs 48,2 %, p = 0,0026).
Použitie záchrannej liečbyPacienti liečení Spioltom Respimat použili menej záchranného salbutamolu počas dňa a noci v porovnaní s pacientmi liečenými tiotrópiom 5 mikrogramov a olodaterolom 5 mikrogramov (priemerné použitie záchranného lieku cez deň pri Spiolte Respimat 0,76 prípadu za deň v porovnaní s 0,97 prípadu za deň pri tiotrópiu 5 mikrogramov a 0,87 prípadu za deň pri olodaterole 5 mikrogramov, p < 0,0001; priemerné použitie záchranného lieku cez noc pri Spiolte Respimat 1,24 prípadu za deň v porovnaní s 1,69 prípadu za deň pri tiotrópiu 5 mikrogramov a 1,52 prípadu za deň pri olodaterole 5 mikrogramov, p < 0,0001, klinické skúšanie 1 a 2).
Celkové hodnotenie pacientomPacienti liečení Spioltom Respimat si všimli významnejšie zlepšenie svojho respiračného stavu v porovnaní s tiotrópiom 5 mikrogramov a olodaterolom 5 mikrogramov, a to na základe škály Celkového hodnotenia pacientom (Patient's Global Rating, PGR) (klinickú skúšanie 1 a 2).'
ExacerbácieTiotrópium v dávke 5 mikrogramov už v minulosti preukázalo štatisticky signifikantné zníženie rizika exacerbácií CHOCHP v porovnaní s placebom. Exacerbácie CHOCHP boli zaradené ako ďalší koncový ukazovateľ v 52-týždňových pivotných klinických štúdiách (klinické štúdie 1 a 2). V spoločnom súbore údajov bol podiel pacientov, u ktorých sa vyskytla najmenej jedna stredne závažná/závažná exacerbácia CHOCHP, 27,7 % pri Spiolte Respimat a 28,8 % pri tiotrópiu 5 mikrogramov (p = 0,39). Tieto štúdie neboli špecificky navrhnuté na hodnotenie účinku liečby z hľadiska exacerbácií CHOCHP.
V klinickom randomizovanom, dvojito zaslepenom, aktívne kontrolovanom klinickom skúšaní, prebiehajúcom v paralelných skupinách v trvaní jedného roka (klinické skúšanie 9), sa Spiolto Respimat porovnával s tiotrópiom 5 mikrogramov, čo sa týka exacerbácií CHOCHP. Ako súbežná liečba boli povolené všetky respiračné lieky okrem anticholinergík, dlhodobo pôsobiacich beta-agonistov a ich kombinácií, t.j. rýchlo pôsobiace beta agonisty, inhalačné kortikosteroidy a xantíny. Primárnym koncovým ukazovateľom bolo zistiť medziročnú mieru výskytu stredne závažných až závažných exacerbácií CHOCHP (3 939 pacientov dostávalo Spiolto Respimat a 3 941 pacientov dostávalo tiotrópium 5 mikrogramov).
Väčšina pacientov boli muži (71,4 %) a belosi (79,3 %). Priemerný vek bol 66,4 rokov, priemerný FEV1 po podaní bronchodilatancia bol 1,187 l (SD 0,381) a 29,4 % pacientov zaznamenalo v minulosti klinicky významné kardiovaskulárne ochorenie.
Stredne závažné až závažné exacerbácie CHOCHP sa definovali ako „súbor udalostí/príznakov dolných dýchacích ciest (ich nárast alebo vznik nových), ktoré súviseli so základným ochorením CHOCHP, s trvaním tri alebo viac dní, čo si vyžiadalo predpísanie antibiotík a/alebo systémových steroidov a/alebo hospitalizáciu“.
Liečba Spioltom Respimat viedla k 7 % zníženiu medziročnej miery výskytu stredne závažných až závažných exacerbácií CHOCHP v porovnaní s liečbou tiotrópiom 5 mikrogramov (rate ratio (RR) 0,93; 99 % konfidenčný interval (CI), 0,85-1,02; p=0,0498). V štúdii sa nedosiahla hodnota p < 0,01, čo bola pred-špecifikovaná miera významnosti pre klinickú štúdiu.
Kvalita života súvisiaca so zdravotným stavomSpiolto Respimat preukázal zlepšenie kvality života, súvisiace so zdravotným stavom, čo sa dokázalo znížením celkového skóre respiračného dotazníka nemocnice Sv. Juraja (SGRQ). Po 24 týždňoch (klinické skúšanie 1 a 2) sa zistilo štatisticky významné zlepšenie priemerného celkového skóre SGRQ pre Spiolto Respimat v porovnaní s tiotrópiom 5 mikrogramov a olodaterolom 5 mikrogramov (Tabuľka 3); zlepšenie sa zistilo vo všetkých doménach dotazníka SGRQ. Viac pacientov, ktorí boli liečení Spioltom Respimat, zaznamenalo klinicky významné zlepšenie celkového skóre SGRQ (MCID, čo sa definovalo ako pokles o najmenej 4 jednotky voči východiskovým hodnotám) v porovnaní s tiotrópiom 5 mikrogramov (57,5 % vs. 48,7 %, p = 0,0001) a olodaterolom 5 mikrogramov (57,5 % vs. 44,8 %, p < 0,0001).
Tabuľka 3: Celkové skóre dotazníka SGRQ po 24 týždňoch liečby (Štúdia 1 a 2)
|
|
n
| Priemerná liečba (zmena východiskových hodnôt)
| Rozdiel voči Spiolto Respimat
|
|
| Priemer (p-hodnota)
|
Celkové skóre
| Východiskové hodnoty
|
| 43,5
|
|
| Spiolto Respimat
| 979
| 36,7 (-6,8)
|
|
| Tiotrópium 5 mikrogramov
| 954
| 37,9 (-5,6)
| -1,23 (p = 0,025)
|
| Olodaterol 5 mikrogramov
| 954
| 38,4 (-5,1)
| -1,69 (p = 0,002)
|
n= počet pacientov
V dvoch ďalších placebom kontrolovaných klinických skúšaniach v trvaní 12 týždňov (klinické skúšanie 7 a 8) bolo celkové skóre SGRQ po 12 týždňoch zaradené ako primárny koncový ukazovateľ ako miera kvality života súvisiacej so zdravotným stavom.
V klinických skúšaniach v trvaní 12 týždňov preukázal Spiolto Respimat zlepšenie, v porovnaní s placebom v týždni 12, čo sa týka celkového priemerného skóre SGRQ (primárny koncový ukazovateľ) v hodnote -4,9 (95 % CI: −6,9; −2,9; p < 0,0001) a -4,6 (95 % CI: −6,5; −2,6; p < 0,0001). V spojenej pomocnej analýze klinických skúšaní v trvaní 12 týždňov, bol podiel pacientov s klinicky významným poklesom celkového skóre SGRQ v týždni 12 (čo sa definuje ako pokles o najmenej 4 jednotky voči východiskovým hodnotám) vyšší u Spiolto Respimat (52 % [206/393]) ako u tiotrópia 5 mikrogramov (41 % [159/384]; miera pravdepodobnosti: 1,56 (95 % CI: 1,17; 2,07), p = 0,0022) a placeba (32 % [118/370]; miera pravdepodobnosti: 2,35 (95 % CI: 1,75; 3,16), p < 0,0001).
Inspiračná kapacita, ťažkosti pri dýchaní a tolerancia fyzickej záťažeÚčinok lieku Spiolto Respimat na inspiračnú kapacitu, ťažkosti pri dýchaní a toleranciu fyzickej záťaže obmedzenú príznakmi sa skúmal v troch randomizovaných, dvojito zaslepených klinických štúdiách u pacientov s CHOCHP:
(i) dve opakované 6-týždňové krížové klinické skúšania porovnávajúce Spiolto Respimat s tiotrópiom 5 mikrogramov, olodaterolom 5 mikrogramov a placebom počas bicyklovania s konštantnou záťažou (450 účastníkov dostávalo Spiolto Respimat) [klinické skúšanie 4 a 5],
(ii) jedno 12-týždňové klinické skúšanie s paralelnými skupinami, porovnávajúce Spiolto Respimat s placebom počas bicyklovania s konštantnou záťažou (139 účastníkov dostávalo Spiolto Respimat) a chôdze s konštantnou rýchlosťou (podskupina pacientov) [klinické skúšanie 6].
Spiolto Respimat signifikantne zlepšil respiračnú kapacitu v pokoji dve hodiny po podaní dávky v porovnaní s tiotrópiom 5 mikrogramov (0,114 l, p < 0,0001; klinická štúdia 4, 0,088 l, p = 0,0005; klinické skúšanie 5), olodaterolom 5 mikrogramov (0,119 l, p < 0,0001; klinické skúšanie 4, 0,080 l, p = 0,0015; klinické skúšanie 5) a placebom (0,244 l, p < 0,0001; klinické skúšanie 4, 0,265 l, p < 0,0001; klinické skúšanie 5) po 6 týždňoch.
V klinických skúšaniach 4 a 5 Spiolto Respimat signifikantne zlepšil čas tolerancie fyzickej záťaže počas bicyklovania s konštantnou záťažou v porovnaní s placebom po 6 týždňoch (klinické skúšanie 4: geometrický priemer času tolerancie fyzickej záťaže 454 sekúnd pri Spiolte Respimat v porovnaní so 375 sekundami pri placebe (20,9 % zlepšenie, p < 0,0001); klinické skúšanie 5: geometrický priemerný čas tolerancie fyzickej záťaže 466 sekúnd pri Spiolte Respimat v porovnaní so 411 sekundami pri placebe (13,4 % zlepšenie, p < 0,0001).
V klinickom skúšaní 6 Spiolto Respimat signifikantne zlepšil čas tolerancie fyzickej záťaže počas bicyklovania s konštantnou záťažou v porovnaní s placebom po 12 týždňoch (geometrický čas tolerancie fyzickej záťaže 528 sekúnd pri Spiolte Respimat v porovnaní so 464 sekundami pri placebe (13,8 % zlepšenie, p = 0,021).
Pediatrická populáciaEurópska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií so Spioltom Respimat vo všetkých podskupinách pediatrickej populácie s chronickou obštrukčnou chorobou pľúc (CHOCHP) podľa rozhodnutia o výnimkách pre určitú triedu (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostia.
Všeobecný úvodKeď sa tiotrópium a olodaterol podávali spolu inhalačne, farmakokinetické parametre každej zložky sa podobali farmakokinetickým parametrom pozorovaným vtedy, keď sa každá účinná látka podala samostatne.
Tiotrópium a olodaterol vykazovali lineárnu farmakokinetiku v terapeutickom rozpätí. Po opakovanej inhalácii jedenkrát denne sa rovnovážny stav tiotrópia dosiahol do 7. dňa. Rovnovážny stav olodaterolu sa dosiahne po 8 dňoch inhalácie raz denne a kumulácia v porovnaní s jednorazovou dávkou je 1,8-násobná.
b.
Všeobecná charakteristika liečiva po podaní liekuAbsorpciaTiotrópium: Údaje od mladých zdravých dobrovoľníkov o vylučovaní do moču dokazujú, že približne 33 % dávky inhalovanej inhalátorom RESPIMAT sa dostane do systémovej cirkulácie. Zistilo sa, že absolútna biologická dostupnosť perorálne podaného roztoku je 2 – 3 %. Maximálne plazmatické koncentrácie tiotrópia sú pozorované 5 – 7 minút po inhalácii cez RESPIMAT.
Olodaterol: U zdravých dobrovoľníkov bola absolútna biologická dostupnosť olodaterolu po inhalácii odhadnutá približne na 30 %, ak sa však podával vo forme perorálneho roztoku, absolútna biologická dostupnosť bola nižšia než 1 %. Maximálne plazmatické koncentrácie olodaterolu sa vo všeobecnosti dosiahnu v priebehu 10 až 20 minút po inhalácii liečiva cez RESPIMAT.
DistribúciaVäzba
tiotrópia na plazmatické bielkoviny je 72 % a distribučný objem je 32 l/kg. Štúdie na potkanoch ukazujú, že tiotrópium vo významnom rozsahu neprechádza hematoencefalickou bariérou.
Väzba
olodaterolu na plazmatické bielkoviny je približne 60 % a distribučný objem je 1 110 l. Olodaterol je substrátom transportérov P-gp, OAT1, OAT3 a OCT1. Olodaterol nie je substrátom nasledujúcich transportérov: BCRP, MRP, OATP2, OATP8, OATP-B, OCT2 a OCT3.
BiotransformáciaTiotrópium: Rozsah biotransformácie je malý. Je to zrejmé z renálnej exkrécie 74 % nezmenenej látky po intravenóznom podaní. Ester tiotrópium-bromidu sa neenzymaticky štiepi na alkohol a kyselinu (N-metylskopín a kyselinu dietylénglykolovú), ktoré sa neviažu na muskarínové receptory.
In vitro experimenty na mikrozómoch ľudskej pečene a ľudských hepatocytoch naznačujú, že určité množstvo látky (< 20 % dávky po intravenóznom podaní) sa metabolizuje oxidáciou závislou od cytochrómu P450 (CYP) 2D6 a 3A4 a následne konjugáciou s glutatiónom na rôzne metabolity fázy II.
Olodaterol sa značne metabolizuje priamou glukuronidáciou a O-demetyláciou na metoxyskupine, po ktorých nasleduje konjugácia. Zo šiestich identifikovaných metabolitov sa iba nekonjugovaný produkt demetylácie viaže na beta
2-receptory. Tento metabolit však nie je v plazme detegovateľný po dlhodobej inhalácii odporúčanej terapeutickej dávky ani po dávkach 4-násobne vyšších. Izoenzýmy cytochrómu P450 CYP2C9 a CYP2C8, so zanedbateľným vplyvom CYP3A4, sa podieľajú na O-demetylácii olodaterolu, zatiaľ čo sa potvrdilo, že izoformy uridín-difosfát-glykozyl-transferázy UGT2B7, UGT1A1, 1A7 a 1A9 sa podieľajú na vzniku glukuronidov olodaterolu.
ElimináciaTiotrópium: Celkový klírens u zdravých dobrovoľníkov je 880 ml/min. Intravenózne podané tiotrópium sa zväčša nezmenené vylúči močom (74 %). Po inhalácii roztoku pacientmi s CHOCHP do dosiahnutia rovnovážneho stavu tvorí renálne vylučovanie 18,6 % dávky, zvyšok predstavuje prevažne neabsorbovanú látku v čreve, ktorá je vylúčená stolicou. Renálny klírens tiotrópia prevyšuje glomerulárnu filtráciu, čo naznačuje sekréciu látky do moču. Účinný polčas tiotrópia po inhalácii pacientmi s CHOCHP sa pohybuje medzi 27 a 45 h.
Olodaterol: Celkový klírens olodaterolu u zdravých dobrovoľníkov je 872 ml/min a renálny klírens je 173 ml/min. Po intravenóznom podaní [
14C]-značeného olodaterolu sa 38 % rádioaktívnej dávky objavilo v moči a 53 % sa objavilo v stolici. Množstvo nezmeneného olodaterolu zisteného v moči po intravenóznom podaní bolo 19 %. Po perorálnom podaní sa v moči zistilo iba 9 % rádioaktivity (0,7 % nezmeneného olodaterolu), zatiaľ čo v stolici bol zistený hlavný podiel (84 %). Viac než 90 % dávky sa vylúčilo v priebehu 6 a 5 dní po intravenóznom a perorálnom podaní, v danom poradí. Po inhalácii vylučovanie nezmeneného olodaterolu močom počas dávkovacieho intervalu u zdravých dobrovoľníkov v rovnovážnom stave predstavovalo 5 % – 7 % dávky. Plazmatické koncentrácie olodaterolu po inhalácii klesajú multifázicky s terminálnym polčasom približne 45 hodín.
c.
Osobitné skupiny pacientovTiotrópium: Tak ako sa očakáva pri všetkých prevažne renálne vylučovaných liekoch, zvyšujúci sa vek sa spájal so znížením renálneho klírensu tiotrópia z 347 ml/min u pacientov s CHOCHP vo veku < 65 rokov na 275 ml/min u pacientov s CHOCHP vo veku ≥ 65 rokov.Toto neviedlo k zodpovedajúcemu zvýšeniu hodnôt AUC
0–6, ss ani C
max,ss.
Olodaterol: Farmakokinetická metaanalýza s použitím údajov z dvoch kontrolovaných klinických štúdií, ktoré zahŕňali 405 pacientov s CHOCHP a 296 pacientov s astmou, preukázala, že nie je potrebná úprava dávky na základe vplyvu veku, pohlavia a telesnej hmotnosti na systémovú expozíciu olodaterolu.
RasaOlodaterol: Porovnanie farmakokinetických údajov v štúdiách a skrížene medzi štúdiami s olodaterolom odhalilo tendenciu vyššej systémovej expozície u Japoncov a iných Aziatov v porovnaní s belochmi.
V klinických štúdiách s belochmi a Aziatmi sa neidentifikovali žiadne bezpečnostné obavy pri dvojnásobných dávkach odporúčanej terapeutickej dávky olodaterolu Respimat do jedného roka.
Insuficiencia obličiekTiotrópium: Po inhalačnom podaní tiotrópia raz denne do dosiahnutia rovnovážneho stavu u pacientov s CHOCHP viedla ľahká porucha funkcie obličiek (CL
CR 50 – 80 ml/min) k mierne vyšším hodnotám AUC
0–6,ss (o 1,8 – 30 % vyššej) a podobným hodnotám C
max,ss v porovnaní s pacientmi s normálnou funkciou obličiek (CL
CR > 80 ml/min). U pacientov, ktorí majú stredne ťažkú až ťažkú poruchu funkcie obličiek (CL
CR < 50 ml/min), intravenózne podávanie tiotrópia viedlo k dvojnásobne vyššej celkovej expozícii (o 82 % vyššej AUC
0–4h a o 52 % vyššej C
max) v porovnaní s pacientmi s normálnou funkciou obličiek, čo sa potvrdilo aj pozorovaniami po inhalácii suchého prášku.
Olodaterol: U pacientov s poruchou funkcie obličiek neboli klinicky významné zvýšenia systémovej expozície.
Insuficiencia pečeneTiotrópium: Neočakáva sa, že by pečeňová nedostatočnosť mala relevantný vplyv na farmakokinetiku tiotrópia. Tiotrópium je predominantne eliminované renálnou exkréciou (74 % u mladých zdravých dobrovoľníkov) a jednoduchý ester sa neenzymaticky štiepi na farmakologicky neaktívne látky.
Olodaterol: Medzi jedincami s ľahkou až stredne ťažkou poruchou funkcie pečene a ich zdravými kontrolami neboli viditeľné rozdiely v eliminácii olodaterolu ani väzba na bielkoviny sa nelíšila. Nevykonala sa štúdia s jedincami s ťažkou poruchou funkcie pečene.
5.3 Predklinické údaje o bezpečnostiTiotrópium + olodaterolÚčinky v predklinických štúdiách s kombináciou tiotrópium/olodaterol sa pozorovali iba pri expozíciách považovaných za dostatočne prekračujúce maximálnu expozíciu u ľudí, čo poukazuje na malý význam pre klinické používanie.
TiotrópiumŠtúdie zamerané na genotoxicitu a karcinogénny potenciál nepreukázali u ľudí žiadne výnimočné riziko. Škodlivý vplyv na tehotenstvo, embryonálny/fetálny vývoj, pôrod alebo postnatálny vývoj sa zistil len pri maternálnych toxických dávkach. Tiotrópium-bromid nie je teratogénny pri potkanoch ani králikoch. Zmeny na respiračnom (iritácia) a urogenitálnom (prostatitída) systéme a reprodukčná toxicita sa zistili pri lokálnom a systémovom podávaní dávok vyšších ako päťnásobok terapeutickej dávky.
OlodaterolŠtúdie zamerané na genotoxicitu a karcinogénny potenciál nepreukázali u ľudí žiadne výnimočné riziko. Pozorovala sa zvýšená incidencia leiomyómu mezoovária pri potkanoch a leiomyómu maternice a leiomyosarkómu pri myšiach. Toto sa považuje za účinok triedy liekov, ktorý sa pozoroval pri hlodavcoch po dlhodobej expozícii vysokým dávkam β
2-agonistov. Dosiaľ sa β
2-agonisty nespájali s nádorovými ochoreniami u ľudí.
Pri potkanoch sa nevyskytli teratogénne účinky po inhalácii dávok do 1 054 mikrogramov/kg/deň (> 2 600-násobok expozície u ľudí (AUC
(0–24h)) pri dávke 5
μg). Pri gravidných NZW králikoch (NZW, novozélandský biely králik) vykazovala inhalačná dávka olodaterolu 2 489 mikrogramov/kg/deň (približne 7 130-násobok expozície u ľudí pri 5 mikrogramoch na základe AUC
(0–24h)) toxicitu na plod následkom charakteristickej stimulácie beta-adrenoceptorov; patrí sem nepravidelná osifikácia, krátke/zakrivené kosti, čiastočne otvorené oko, rázštep podnebia, kardiovaskulárne abnormality. Po inhalácii dávky 974 mikrogramov/kg/deň (približne 1 353-násobok dávky 5 mikrogramov na základe AUC
(0–24h)) sa nevyskytli významné účinky.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokbenzalkónium-chlorid
edetan disodný
voda, čistená
1 M kyselina chlorovodíková(na úpravu pH)
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti3 roky
Čas použiteľnosti náplne po prvom otvorení: 3 mesiace
Čas použiteľnosti inhalátora po prvom otvorení: 1 rok
Odporúčané použitie: 6 náplní na inhalátor
Poznámka: Fungovanie opakovane použiteľného inhalátora RESPIMAT bolo preukázané pri skúškach s 540 inhaláciami (zodpovedajúcimi 9 náplniam).
6.4 Špeciálne upozornenia na uchovávanieNeuchovávajte v mrazničke.
6.5 Druh obalu a obsah baleniaDruh a materiál obalu, ktorý je v kontakte s liekom:
Roztok je naplnený do polyetylénových/polypropylénových náplní s polypropylénovým ochranným uzáverom s integrovaným silikónovým tesniacim krúžkom. Náplň je uložená v hliníkovom valci.
Každá náplň obsahuje 4 ml inhalačného roztoku.
Veľkosť balenia a priložené pomôcky:
Jednotlivé balenie: 1 opakovane použiteľný inhalátor Respimat a 1 náplň, obsahujúca 60 vstrekov (30 liečebných dávok)
Trojité balenie: 1 opakovane použiteľný inhalátor Respimat a 3 náplne, obsahujúce po 60 vstrekov (po 30 liečebných dávok)
Jednotlivé balenie náplne: 1 náplň, obsahujúca 60 vstrekov (30 liečebných dávok)
Trojité balenie náplne: 3 náplne, obsahujúce po 60 vstrekov (po 30 liečebných dávok)
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomNepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBoehringer Ingelheim International GmbH
Binger Strasse 173
D-55216 Ingelheim nad Rýnom
Nemecko
8. REGISTRAČNÉ ČÍSLO 14/0203/15-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 16. júna 2015
10. DÁTUM REVÍZIE TEXTUOktóber 2020