
vylúčené osoby s oslabeným imunitným systémom alebo osoby, ktoré užívali imunosupresíva v intervale 6 mesiacov pred klinickou štúdiou, ako aj tehotné účastníčky alebo osoby so známou anamnézou infekcie vírusom SARS-CoV-2. Účastníci so stabilizovaným ochorením HIV neboli vylúčení. Očkovacie látky proti chrípke sa mohli podávať 14 dní pred podaním alebo 14 dní po podaní ktorejkoľvek dávky vakcíny Spikevax. Účastníci museli takisto dodržať minimálny 3-mesačný interval od podania krvných produktov/produktov plazmy alebo imunoglobulínov pred klinickou štúdiou, aby im mohlo byť podané placebo alebo vakcína Spikevax.
Celkovo bol sledovaný výskyt ochorenia COVID-19 u 30 351 účastníkov s mediánom 92 dní
(rozmedzie: 1 – 122 dní).
Populácia, u ktorej sa robila primárna analýza účinnosti (ďalej sa uvádza ako súbor podľa protokolu alebo PPS,
Per Protocol Set) pozostávala z 28 207 účastníkov, ktorým bola podaná buď vakcína Spikevax (n = 14 134), alebo placebo (n = 14 073). Táto populácia mala negatívny východiskový status pre vírus SARS-CoV-2. Populácia PPS zahŕňala 47,4 % žien, 52,6 % mužov, 79,5 % belochov,
9,7 % afroameričanov, 4,6 % Ázijcov a 6,2 % iných. 19,7 % účastníkov bolo identifikovaných ako
Hispáncov alebo latinskoameričanov. Medián veku účastníkov bol 53 rokov (rozmedzie 18 – 94).
U účastnikov zaradených do PPS bol povolený dávkovací interval -7 až +14 dní pre podanie druhej
dávky (plánovanej na 29. deň). 98 % účastníkov dostalo druhú dávku očkovacej látky 25 dní až 35 dní po prvej dávke (čo zodpovedá -3 až +7 dňom okolo času 28 dní).
Prípady ochorenia COVID-19 boli potvrdené polymerázovou reťazovou reakciou s reverznou transkripciou (RT-PCR) a komisiou pre klinické posúdenie.
Celková účinnosť očkovacej látky a účinnosť podľa kľúčových vekových skupín sú uvedené
v tabuľke 4.
Tabuľka 4. Analýza účinnosti vakcíny: potvrdené ochorenie COVID-19# bez ohľadu na závažnosť od 14. dňa po podaní 2. dávky – súbor podľa protokolu
V
e
k
ová skupina (roky)
|
Ú
č
astníci
N
|
P
r
í
p
ady ochore- nia COVID-
19
n
|
M
i
era
výskytu
ochorenia
C
O
V
ID-1
9 na 1 000 osobo- rokov
|
Ú
č
astníci
N
|
P
r
í
p
ady ochore- nia COVID-
19
n
|
M
i
era
výskytu ochorenia COVID-1
9 na 1 000 osobo- rokov
|
% účinnosti vakcíny
(
95 % IS)*
|
Celkovo
(≥ 18)
|
14 134
|
11
|
3,328
|
14 073
|
185
|
56,510
|
94,1 (89,3; 96,8)**
|
18 až < 65
|
10 551
|
7
|
2,875
|
10 521
|
156
|
64,625
|
95,6 (90,6; 97,9)
|
≥ 65
|
3 583
|
4
|
4,595
|
3 552
|
29
|
33,728
|
86,4 (61,4; 95,2)
|
≥ 65 až
< 75
|
2 953
|
4
|
5,586
|
2 864
|
22
|
31,744
|
82,4 % (48,9; 93,9)
|
≥ 75
|
630
|
0
|
0
|
688
|
7
|
41,968
|
100 % (NE, 100)
|
#COVID-19: symptomatické ochorenie COVID-19 vyžadujúce si pozitívny výsledok RT-PCR testu
a najmenej 2 systémové príznaky alebo 1 respiračný príznak. Prípady vyskytujúce sa od 14. dňa po podaní
2. dávky.
*Účinnosť vakcíny a 95 % interval spoľahlivosti (IS) zo stratifikovaného Coxovho modelu proporcionálneho rizika.
**IS neupravený pre multiplicitu. Štatistické analýzy s upravenou multiplicitou boli vykonané pri predbežnej analýze u nižšieho počtu prípadov ochorenia COVID-19, ktoré sa tu neuvádzajú.
Spomedzi všetkých účastníkov v PPS neboli hlásené žiadne prípady závažného ochorenia
COVID-19 v skupine, ktorej bola podaná očkovacia látka, v porovnaní s 30 prípadmi zo 185 (16 %) v skupine, ktorej bolo podané placebo. Z 30 účastníkov so závažným ochorením bolo 9 hospitalizovaných, z ktorých 2 boli prijatí na jednotku intenzívnej starostlivosti. Väčšina zvyšných závažných prípadov splnila len kritérium týkajúce sa saturácie kyslíkom (SpO2) pre závažné ochorenie (≤ 93 % pri izbovom vzduchu).
Účinnosť vakcíny Spikevax pri prevencii ochorenia COVID-19 bez ohľadu na predchádzajúcu infekciu vírusom SARS-CoV-2 (zistená úvodným sérologickým testovaním a testovaním vzoriek
z nazofaryngálneho výteru) od 14. dňa po podaní 2. dávky bola 93,6 % (95 % interval spoľahlivosti
88,6; 96,5 %).
Okrem toho, analýzy primárneho koncového ukazovateľa účinnosti v podskupinách preukázali podobné výsledky účinnosti v rámci pohlaví, etnických skupín a účastníkov so zdravotnými komorbiditami spojenými s vysokým rizikom závažného ochorenia COVID-19.
Imunogenita u dospelých – po posilňovacej dávke (0,25 ml, 50 mikrogramov)Bezpečnosť, reaktogenita a imunogenita posilňovacej dávky vakcíny Spikevax sa hodnotia
v prebiehajúcej randomizovanej, pre pozorovateľa zaslepenej, placebom kontrolovanej štúdii fázy 2 na potvrdenie dávky u účastníkov vo veku 18 rokov a starších (NCT04405076). V tejto štúdii dostalo
198 účastníkov dve dávky (0,5 ml, 100 mikrogramov s odstupom 1 mesiaca) vakcíny Spikevax ako primárny cyklus. V otvorenej fáze dostalo 149 z týchto účastníkov (
Per Protocol Set) jednu posilňovaciu dávku (0,25 ml, 50 mikrogramov) najmenej 6 mesiacov po očkovaní druhou dávkou
v primárnom cykle. Ukázalo sa, že jedna posilňovacia dávka (0,25 ml, 50 mikrogramov) viedla ku
geometrickému priemernému násobnému zvýšeniu (geometric mean fold rise, GMFR) 12,99 (95 % IS:
11,04; 15,29) neutralizačných protilátok z obdobia pred posilňovacou dávkou v porovnaní s obdobím
28 dní po posilňovacej dávke. GMFR neutralizačných protilátok bol 1,53 (95 % IS: 1,32; 1,77) pri porovnaní obdobia 28 dní po 2. dávke (primárny cyklus) s obdobím 28 dní po posilňovacej dávke.
I
m
unogenita posilňovacej dávky po primárnom cykle inou schválenou vakcínou proti COVID-19
u dospelých
Bezpečnosť a imunogenita heterológnej posilňovacej dávky vakcínou Spikevax sa skúmala v štúdii iniciovanom skúšajúcim so 154 účastníkmi. Minimálny časový interval medzi primárnym cyklom používajúcim vakcínu proti COVID-19 na báze vektora alebo na báze RNA a posilňovacou vakcínou Spikevax bol 12 týždňov (rozsah: 12 týždňov až 20,9 týždňov). Dávka používaná na posilnenie v tejto štúdii bola 100 mikrogramov. Titre neutralizačných protilátok merané pseudovírusovým neutralizačným testom sa hodnotili v 1. deň pred podaním a 15. deň a 29. deň po podaní posilňovacej dávky. Odpoveď na posilňovaciu dávku bola preukázaná bez ohľadu na primárne očkovanie.
Dostupné sú len krátkodobé údaje o imunogenite. Dlhodobá ochrana a imunologická pamäť nie sú v súčasnosti známe.
Bezpečnosť a imunogenita siedmich vakcín proti COVID-19 ako tretej dávky (posilňovacej dávky) vo
Veľkej Británii
COV-BOOST je multicentrická, randomizovaná štúdia fázy 2 iniciovaná skúšajúcim, skúmajúca tretiu
posilňovaciu dávku očkovania proti COVID-19 s podskupinou na podrobné imunologické skúmanie. Účastníkmi boli dospelí vo veku 30 rokov a starší, v dobrom fyzickom zdraví (boli povolené mierne až stredne závažné, dobre kontrolované komorbidity), ktorí dostali dve dávky buď vakcíny Pfizer/BioNTech alebo Oxford/AstraZeneca (prvá dávka v decembri 2020, januári 2021 alebo
februári 2021) a v čase ich zaradenia do skúšania uplynulo najmenej 84 dní po druhej dávke. Vakcína Spikevax posilnila protilátkové a neutralizačné odpovede a bola dobre znášaná bez ohľadu na primárny cyklus. Dávka použitá na posilnenie v tejto štúdii bola 100 mikrogramov. Titre neutralizačných protilátok merané pseudovírusovým neutralizačným testom sa hodnotili v 28. deň po posilňovacej dávke.
Neutralizačné protilátky proti B.1.617.2 (Delta) variantu pred podaním a po podaní posilňovacej
dávky u dospelých
Výsledky pseudovírusového neutralizačného testu (PsVNA) proti B.1.617.2 (Delta) variantu
stanovené pred podaním posilňovacej dávky a 29. deň po podaní posilňovacej dávky ukázali, že podanie posilňovacej dávky vakcíny Spikevax (0,25 ml, 50 mikrogramov) u dospelých indukovalo
17-násobné zvýšenie neutralizačných protilátok proti Delta variantu v porovnaní s hladinami pred
podaním posilňovacej dávky (GMFR = 17,28; 95 % IS: 14,38; 20,77; n = 295).
Klinická účinnosť u dospievajúcich vo veku od 12 do 17 rokov
V prebiehajúcej randomizovanej, placebom kontrolovanej klinickej štúdii fázy 2/3 zaslepenej pre
pozorovateľa (NCT04649151) u dospievajúcich sa hodnotila bezpečnosť, reaktogenita a účinnosť vakcíny Spikevax u dospievajúcich vo veku od 12 do 17 rokov. Účastníci so známou anamnézou infekcie vírusom SARS-CoV-2 boli z účasti na klinickej štúdii vylúčení. Celkovo bolo
3 732 účastníkov randomizovaných v pomere 2 : 1 pre podávanie 2 dávok vakcíny Spikevax alebo fyziologického roztoku ako placeba s časovým odstupom 1 mesiaca.
Sekundárna analýza účinnosti sa vykonala u 3 181 účastníkov, ktorým boli podané 2 dávky vakcíny Spikevax (n = 2 139) alebo placeba (n = 1 042) a ktorí mali negatívny východiskový status SARS CoV-2 v súbore podľa protokolu. Medzi účastníkmi, ktorým bola podaná vakcína Spikevax,
a účastníkmi, ktorým bolo podané placebo, neboli žiadne významné rozdiely v demografických
charakteristikách ani v už existujúcich zdravotných stavoch.
Ochorenie COVID-19 bolo definované ako symptomatické ochorenie COVID-19 potvrdené pozitívnym výsledkom RT-PCR testu a najmenej 2 systémové príznaky alebo 1 respiračný príznak. Ide o prípady od 14. dňa po druhej dávke.
V skupine s vakcínou Spikevax sa vyskytli nulové symptomatické prípady ochorenia COVID-19
a v skupine s placebom 4 symptomatické prípady ochorenia COVID-19.
I
m
unogenita u dospievajúcich vo veku od 12 do 17 rokov – po primárnom cykle očkovania vakcínou
Spikevax
Analýza non-inferiority hodnotiaca 50 % neutralizačné titre SARS- CoV-2 a miery sérologickej
odpovede 28 dní po 2. dávke bola vykonaná v podskupinách na hodnotenie imunogenity podľa protokolu u dospievajúcich vo veku od 12 do 17 rokov (n = 340) v štúdii u dospievajúcich
a u účastníkov vo veku od 18 do 25 rokov (n = 296) v štúdii u dospelých. Účastníci nevykazovali na
začiatku štúdie žiaden imunologický ani virologický dôkaz o predchádzajúcej infekcii SARS- CoV-2. Pomer geometrického priemeru (geometric mean ratio, GMR) titrov neutralizačných protilátok
u dospievajúcich vo veku od 12 do 17 rokov v porovnaní s účastníkmi vo veku od 18 do 25 rokov bol
1,08 (95 % IS: 0,94; 1,24). Rozdiel v miere sérologickej odpovede bol 0,2 % (95 % IS: -1,8; 2,4).
Kritériá non-inferiority (dolná hranica 95 % IS pri GMR > 0,67 a dolná hranica 95 % IS rozdielu v miere sérologickej odpovede > -10 %) boli splnené.
Imunogenita u dospievajúcich vo veku 12 až 17 rokov – po posilňovacej dávke Spikevax (pôvodnej)
Primárnym cieľom hodnotenia imunogenity posilňovacej fázy v tejto štúdii bolo vyhodnotiť
účinnosť posilňovacej dávky u účastníkov vo veku 12 až 17 rokov porovnaním imunitných odpovedí po posilňovacej dávke (29. deň) s imunitnými odpoveďami získanými po 2. dávke primárneho cyklu (57. deň) u mladých dospelých (vo veku 18 až 25 rokov) v štúdii dospelých. Účinnosť posilňovacej dávky 50 mikrogramov Spikevaxu sa vyhodnotí, ak imunitné odpovede po posilňovacej dávke (geometrický priemer koncentrácie (GMC), titre neutralizačných protilátok (nAb) a miera sérologickej odpovede (SRR)) spĺňajú vopred stanovené kritériá non-inferiority (pre GMC aj SRR) v porovnaní s odpoveďami nameranými po ukončení primárneho cyklu 100 mikrogramov Spikevaxu medzi podskupinou mladých dospelých (18 až 25 rokov) v kľúčovej štúdii účinnosti u dospelých.
V otvorenej fáze tejto štúdie dostali účastníci vo veku od 12 do 17 rokov jednu posilňovaciu dávku najmenej 5 mesiacov po ukončení primárneho cyklu (dve dávky s odstupom 1 mesiaca). Populácia na analýzu primárnej imunogenity v tejto štúdii zahŕňala 257 účastníkov pre posilňovaciu dávku a náhodnú podskupinu 295 účastníkov zo štúdie mladých dospelých (vo veku ≥ 18 až ≤ 25 rokov), ktorí predtým absolvovali primárny očkovací cyklus dvoch dávok Spikevaxu s odstupom 1 mesiaca. Obe skupiny účastníkov zaradených do analyzovanej populácie nemali pred prvou dávkou primárneho cyklu a pred posilňovacou dávkou žiadne sérologické ani virologické dôkazy o infekcii SARS-CoV-2.
Pomer geometrického priemeru (GMR) u dospievajúcich s posilňovacou dávkou na 29. deň pri GMC v porovnaní s mladými dospelými: GMR v 57. dni bol 5,1 (95 % CI: 4,5, 5,8), čo spĺňa kritériá non- inferiority (t. j. dolná hranica 95 % CI > 0,667 (1/1,5); bodový odhad ≥ 0,8); rozdiel miery sérologickej odpovede (SRR) bol 0,7 % (95 % CI: -0,8, 2,4), čo spĺňa kritériá non-inferiority (dolná hranica 95 % rozdiel miery sérologickej odpovede (SRR) > -10 %).
U 257 účastníkov bol geometrický priemer koncentrácie (GMC) titrov neutralizačných protilátok (nAb) pred podaním posilňovacej dávky (1. deň) 400,4 (95 % CI: 370,0, 433,4); v 29. dni po podaní posilňovacej dávky bol GMC 7172,0 (95 % CI: 6610,4, 7781,4). Po podaní posilňovacej dávky v 29. deň sa GMC zvýšil približne 18-násobne oproti GMC pred podaním posilňovacej dávky, čo dokazuje účinnosť posilňovacej dávky pre dospievajúcich. Miera sérologickej odpovede (SRR) bola 100 (95 % CI: 98,6, 100,0).
Predpokladané kritériá úspešnosti hodnotenia primárneho cieľa imunogenity boli splnené, čo umožnilo na základe štúdie u dospelých vyvodiť záver o účinnosti vakcíny.
Klinická účinnosť u detí vo veku od 6 rokov do 11 rokov
Pediatrická štúdia je prebiehajúca, randomizovaná, placebom kontrolovaná klinická štúdia fázy 2/3 zaslepená pre pozorovateľa na vyhodnotenie bezpečnosti, reaktogenity a účinnosti vakcíny Spikevax u detí vo veku od 6 rokov do 11 rokov v USA a Kanade (NCT04796896). Účastníci so známou anamnézou infekcie vírusom SARS-CoV-2 boli z účasti na klinickej štúdii vylúčení. Celkovo
4 011 účastníkov bolo randomizovaných v pomere 3 : 1 pre podávanie 2 dávok vakcíny Spikevax
alebo fyziologického roztoku ako placeba s časovým odstupom 1 mesiaca.
Sekundárna analýza účinnosti hodnotiaca potvrdené prípady COVID-19, ktoré sa nazbierali až do dátumu ukončenia zberu údajov 10. novembra 2021, sa vykonala u 3 497 účastníkov, ktorí dostali dve dávky (0,25 ml v 0. a 1. mesiaci) vakcíny Spikevax (n = 2 644) alebo placebo (n = 853) a mali negatívny východiskový status SARS-CoV-2 v súbore podľa protokolu (Per Protocol Set). Medzi účastníkmi, ktorým bola podaná vakcína Spikevax, a účastníkmi, ktorým bolo podané placebo, neboli žiadne významné rozdiely v demografických charakteristikách.
Ochorenie COVID-19 bolo definované ako symptomatické ochorenie COVID-19 potvrdené pozitívnym výsledkom RT-PCR testu a najmenej 2 systémovými príznakmi alebo 1 respiračným príznakom. Ide o prípady od 14. dňa po druhej dávke.
V skupine s vakcínou Spikevax sa vyskytli tri prípady ochorenia COVID-19 (0,1 %) a v skupine s placebom štyri prípady chorenia COVID-19 (0,5 %).
Imunogenita u detí vo veku 6 až 11 rokov
Analýza hodnotiaca 50 % neutralizačné titre SARS-CoV-2 a mieru sérologickej odpovede 28 dní po
podaní dávky 2 sa vykonala u podskupiny detí vo veku 6 až 11 rokov (n = 319) v pediatrickej štúdii a u účastníkov vo veku 18 až 25 rokov (n = 295) v štúdii pre dospelých. Účastníci nemali na začiatku štúdie žiadne imunologické alebo virologické dôkazy o predchádzajúcej infekcii SARS-CoV-2. GMR titrov neutralizačných protilátok u detí vo veku 6 až 11 rokov v porovnaní s osobami vo veku 18 až 25 rokov bol 1,239 (95 % CI: 1,072, 1,432). Rozdiel v miere sérologickej odpovede bol 0,1 % (95 % CI: -
1,9, 2,1). Boli splnené kritériá non-inferiority (dolná hranica 95 % CI pre GMR > 0,67 a dolná hranica
95 % CI rozdielu v miere sérologickej odpovede SRR > -10 %).
Imunogenita u detí vo veku od 6 do 11 rokov – po posilňovacej dávke Spikevax (pôvodnej) Primárnym cieľom hodnotenia imunogenity posilňovacej fázy v tejto štúdii bolo vyhodnotiť účinnosť posilňovacej dávky u účastníkov vo veku 6 rokov až 11 rokov porovnaním imunitných odpovedí po posilňovacej dávke (29. deň) s imunitnými odpoveďami získanými po 2. dávke primárneho cyklu (57. deň) u mladých dospelých (vo veku 18 až 25 rokov) v tejto štúdii, v ktorej sa
preukázala 93 % účinnosť. Účinnosť posilňovacej dávky 25 mikrogramov Spikevaxu sa odvodzuje, ak imunitné odpovede po podaní posilňovacej dávky (geometrická priemerná koncentrácia (GMC) neutralizačných protilátok (nAb) a miera sérologickej odpovede (SRR)) spĺňajú vopred stanovené kritériá non-inferiority (pre GMC aj SRR) v porovnaní s odpoveďami nameranými po ukončení primárneho cyklu 100 mikrogramov Spikevaxu medzi podskupinou mladých dospelých (18 až 25 rokov) v kľúčovej štúdii účinnosti u dospelých.
V otvorenej fáze tejto štúdie dostali účastníci vo veku od 6 do 11 rokov jednu posilňovaciu dávku najmenej 6 mesiacov po ukončení primárneho cyklu (dve dávky s odstupom 1 mesiaca). Populácia na analýzu primárnej imunogenity zahŕňala 95 účastníkov s posilňovacou dávkou vo veku 6 až 11 rokov a náhodnú podskupinu 295 účastníkov zo štúdie mladých dospelých, ktorí dostali dve dávky
Spikevaxu s odstupom 1 mesiaca. Obe skupiny účastníkov zaradených do populácie na analýzu nemali pred prvou dávkou primárneho cyklu a pred posilňovacou dávkou žiadne sérologické alebo
virologické dôkazy o infekcii SARS-CoV-2.
U 95 účastníkov bola v 29. deň po podaní posilňovacej dávky hodnota geometrického priemeru koncentrácie (GMC) 5847,5 (95 % CI: 4999,6, 6839,1). Miera sérologickej odpovede SRR bola 100 (95 % CI: 95,9, 100,0). Skúmali sa sérové hladiny titrov neutralizačných protilátok (nAb) u detí vo veku 6 až 11 rokov v podskupine imunogenity Per Protocol s negatívnym stavom pred podaním posilňovacej dávky SARS-CoV-2 a porovnanie s hladinami u mladých dospelých (18 až 25 rokov). Pomer geometrického priemeru (GMR) pri GMC s posilňovacou dávkou na 29. deň v porovnaní s GMC u mladých dospelých v 57. dni bol 4,2 (95 % CI: 3,5, 5,0), čo spĺňa kritériá non-inferiority (t. j. dolná hranica 95 % CI > 0,667); rozdiel SRR bol 0,7 % (95 % CI: -3,5, 2,4), čo spĺňa kritériá non- inferiority (dolná hranica 95 % rozdielu v miere sérologickej odpovede SRR > -10 %).
Predpokladané vopred stanovené kritériá úspešnosti pre primárny cieľ imunogenity boli splnené, čo umožnilo vyvodiť záver o účinnosti posilňovacej dávky vakcíny. Rýchla odpoveď na očkovaciu látku, ktorá sa prejavila do 4 týždňov od podania posilňovacej dávky, je dôkazom silného prvotného očkovania vyvolaného primárnym cyklom Spikevaxu.
Neutralizačné protilátky proti B.1.617.2 (Delta) variantu u detí vo veku od 6 rokov do 11 rokov Vzorky séra podskupín na hodnotenie imunogenity podľa protokolu (n = 134) prebiehajúcej pediatrickej štúdie získané na začiatku štúdie a v 57. deň sa testovali použitím PsVNA na základe B.1.617.2 (Delta) variantu.
U detí vo veku od 6 rokov do 11 rokov bol GMFR od začiatku štúdie po 57. deň 81,77 (95 % IS:
70,38; 95,00) pre Delta variant (meraný PsVNA). Okrem toho 99,3 % detí splnilo definíciu sérologickej odpovede.
Klinická účinnosť u detí vo veku od 6 mesiacov do 5 rokov
Prebiehajúca štúdia fázy 2/3 sa uskutočnila s cieľom vyhodnotiť bezpečnosť, znášanlivosť, reaktogenitu a účinnosť vakcíny Spikevax u zdravých detí vo veku od 6 mesiacov do 11 rokov. Do štúdie boli zaradené deti v 3 vekových skupinách: od 6 rokov do 11 rokov, od 2 rokov do 5 rokov a od
6 mesiacov do 23 mesiacov.
U 5 476 účastníkov vo veku od 6 mesiacov do 5 rokov, ktorí dostali dve dávky (v 0. a 1. mesiaci) vakcíny Spikevax (n = 4 105) alebo placebo (n = 1 371) a mali negatívny východiskový status SARS- CoV-2 v súbore na hodnotenie účinnosti podľa protokolu (Per Protocol Set for Efficacy), sa vykonala deskriptívna analýza účinnosti hodnotiaca potvrdené prípady COVID-19 získané do dátumu ukončenia získavania údajov 21. februára 2022. Medzi účastníkmi, ktorým bola podaná vakcína Spikevax, a účastníkmi, ktorým bolo podané placebo, neboli žiadne významné rozdiely demografických charakteristikách.
Medián dĺžky sledovania účinnosti po 2. dávke bol 71 dní u účastníkov vo veku od 2 rokov do 5 rokov a 68 dní u účastníkov vo veku od 6 mesiacov do 23 mesiacov.
Účinnosť vakcíny v tejto štúdii bola pozorovaná v období, keď v obehu prevažujúcim variantom bol variant B.1.1.529 (Omicron).
Účinnosť vakcíny v 2. časti pre súbor na hodnotenie účinnosti podľa protokolu pre prípady COVID-19
14 dní alebo viac po 2. dávke s použitím „definície prípadu COVID-19 P301“ (t. j. definície použitej v kľúčovej štúdii účinnosti u dospelých) bola 36,8 % (95 % IS: 12,5, 54,0) pre deti od 2 do 5 rokov
a 50,6 % (95 % IS: 21,4, 68,6) pre deti vo veku od 6 mesiacov do 23 mesiacov.
Imunogenita u detí vo veku od 6 mesiacov do 5 rokov
V prípade detí vo veku od 2 do 5 rokov porovnanie odpovedí nAb (neutralizačnými protilátkami) z 57.
dňa v tejto časti 2, v podskupine imunogenity podľa protokolu (n = 264; 25 mikrogramov) s odpoveďami mladých dospelých (n = 295; 100 mikrogramov) preukázalo GMR 1,014 (95 % IS:
0,881, 1,167), čo spĺňa kritériá non-inferiority (t. j. dolná hranica 95 % IS pre GMR ≥ 0,67; bodový odhad ≥ 0,8). Geometrické priemerné násobné zvýšenie (geometric mean fold rise, GMFR) od východiskovej hodnoty do 57. dňa u týchto detí bol 183,3 (95 % IS: 164,03, 204,91). Rozdiel v miere sérologickej odpovede (SRR) medzi deťmi a mladými dospelými bol -0,4 % (95 % IS: -2,7 %, 1,5 %), čo tiež spĺňa kritériá non-inferiority (dolná hranica 95 % IS rozdielu SRR > -10 %).
V prípade dojčiat a batoliat vo veku od 6 mesiacov do 23 mesiacov sa porovnaním odpovedí nAb (neutralizačnými protilátkami) z 57. dňa v tejto časti 2, v podskupine na hodnotenie imunogenity podľa protokolu (n = 230; 25 mikrogramov) s odpoveďami mladých dospelých (n = 295;
100 mikrogramov) preukázal GMR 1,280 (95 % IS: 1,115, 1,470), čo spĺňa kritériá non-inferiority (t. j. dolná hranica 95 % IS pre GMR ≥ 0,67; bodový odhad ≥ 0,8). Rozdiel v miere SRR medzi dojčatami/batoľatami a mladými dospelými bol 0,7 % (95 % IS: -1,0 %, 2,5 %), čo tiež spĺňa kritériá non-inferiority (dolná hranica 95 % IS rozdielu v miere sérologickej odpovede > -10 %).
V súlade s tým boli vopred stanovené kritériá úspešnosti pre primárny cieľ imunogenity splnené pre obe vekové skupiny, čo umožnilo vyvodiť účinnosť 25 mikrogramov u detí vo veku od 2 rokov do
5 rokov a u dojčiat a batoliat vo veku od 6 mesiacov do 23 mesiacov (tabuľky 5 a 6).
Tabuľka 5. Zhrnutie pomeru geometrického priemeru koncentrácie a miery sérologickej odpovede – porovnanie osôb vo veku od 6 mesiacov do 23 mesiacov s účastníkmi vo veku od18 rokov do 25 rokov – súbor na hodnotenie imunogenity podľa protokolu
| od 6 mesiacov do
23 mesiacov
n = 230
| od 18 rokov do
25 rokov
n = 291
| od 6 mesiacov do
23 mesiacov/
od 18 rokov do 25 rokov
|
Test
| Časový
| GMC (95 % IS)*
| GMC (95 % IS)*
| Pomer GMC
| Splnený
|
| bod
|
|
| (95 % IS)a
| cieľ non-
|
| inferiority
(Á/N)b
|
SARS-CoV-2 neutralizačný testc
|
28 dní po
2. dávke
| 1 780,7
(1 606,4; 1 973,8)
| 1 390,8
(1 269,1; 1 524,2)
| 1,3 (1,1; 1,5)
|
Á
|
Sérologická odpoveď
% (95 % IS)d
|
Sérologická odpoveď
% (95 % IS)d
|
Rozdiel v miere sérologickej odpovede % (95 % IS)e
|
100 (98,4; 100)
| 99,3 (97,5; 99,9)
| 0,7
(-1,0; 2,5)
|
GMC = geometrický priemer koncentrácie
n = počet účastníkov s nechýbajúcimi údajmi na začiatku a v 57. deň
* Hodnoty protilátok uvádzané ako hodnoty pod dolnou hranicou stanovenia (LLOQ) sa nahrádzajú hodnotou 0,5 x LLOQ. Hodnoty vyššie ako horná hranica stanovenia (ULOQ) sa nahradia hodnotou ULOQ, ak nie sú k dispozícii skutočné hodnoty.
a Hladiny protilátok po logaritmickej transformácii sa analyzujú pomocou modelu analýzy kovariancie (ANCOVA) s premennou skupiny (účastníci vo veku od 6 mesiacov do 5 rokov a mladí dospelí) ako fixným efektom. Výsledné stredné hodnoty LS, rozdiel stredných hodnôt LS a 95 % IS sú na účely prezentácie spätne transformované na pôvodnú stupnicu.
b Non-inferiorita sa vyhlási, ak dolná hranica 2-stranného 95 % IS pre pomer GMC je väčšia ako 0,67
s bodovým odhadom > 0,8 a dolná hranica 2-stranného 95 % IS pre rozdiel v miere sérologickej odpovede je väčšia ako -10 % s bodovým odhadom > -5 %.
c Konečné geometrické priemery koncentrácie protilátok (GMC) v AU/ml boli stanovené pomocou
mikroneutralizačného testu SARS-CoV-2.
d Sérologická odpoveď v dôsledku očkovania špecifického pre SARS-CoV-2 RVP koncentrácia neutralizačných protilátok na úrovni subjektu je v protokole definovaná ako zmena z hodnoty pod LLOQ na hodnotu rovnú alebo vyššiu ako 4 x LLOQ, alebo aspoň 4-násobné zvýšenie, ak je východisková hodnota rovná alebo vyššia ako LLOQ. Sérologická odpoveď 95 % IS sa vypočíta pomocou Clopperovej-Pearsonovej metódy.
e Rozdiel v miere sérologickej odpovede 95 % IS je vypočítaný pomocou Miettinen-Nurminenových (skóre)
hraníc spoľahlivosti.
Tabuľka 6. Zhrnutie pomeru geometrického priemeru koncentrácií a miery sérologickej odpovede – porovnanie osôb vo veku od 2 rokov do 5 rokov s účastníkmi vo veku od 18 do25 rokov – súbor na hodnotenie imunogenity podľa protokolu
| od 2 rokov do
5 rokov
n = 264
| od 18 rokov do
25 rokov
n = 291
| od 2 rokov d 5 rokov/
od 18 rokov do 25 rokov
|
Test
| Časový bod
| GMC (95% IS)*
| GMC (95% IS)*
| Pomer GMC (95% IS)a
| Splnený cieľ non- inferiority (Á/N)
b
|
| | | | | |
SARS-CoV-2 neutralizačný testc
|
28 dní po
2. dávke
|
1 410,0
(1 273,8;
1 560,8)
|
1 390,8
(1 262,5; 1 532,1)
|
1,0 (0,9; 1,2)
|
Á
|
S
ér
ologická odpoveď
%
|
S
ér
ologická odpoveď
%
|
R
ozdiel v miere sérologickej odpovede %
|
(95 % IS
)d
|
(95 % IS
)d
|
(95 % IS
)e
|
98,9 (96,7; 99,8)
|
99,3 (97,5; 99,9)
|
-0,4
(-2,7; 1,5)
|
GMC = geometrický priemer koncentrácie
n = počet účastníkov s nechýbajúcimi údajmi na začiatku a v 57. deň
* Hodnoty protilátok uvádzané ako hodnoty pod dolnou hranicou stanovenia (LLOQ) sa nahrádzajú hodnotou 0,5 x LLOQ. Hodnoty vyššie ako horná hranica stanovenia (ULOQ) sa nahradia hodnotou ULOQ, ak nie sú k dispozícii skutočné hodnoty.
a Hladiny protilátok po logaritmickej transformácii sa analyzujú pomocou modelu analýzy kovariancie (ANCOVA) s premennou skupiny (účastníci vo veku od 6 mesiacov do 5 rokov a mladí dospelí) ako fixným efektom. Výsledné stredné hodnoty LS, rozdiel stredných hodnôt LS a 95 % IS sú na účely prezentácie spätne transformované na pôvodnú stupnicu.
b Non-inferiorita sa vyhlási, ak dolná hranica 2-stranného 95 % IS pre pomer GMC je väčšia ako 0,67
s bodovým odhadom > 0,8 a dolná hranica 2-stranného 95 % IS pre rozdiel v miere sérologickej odpovede je väčšia ako -10 % s bodovým odhadom > -5 %.
c Konečné geometrické priemery koncentrácie protilátok (GMC) v AU/ml boli stanovené pomocou mikroneutralizačného testu SARS-CoV-2.
d Sérologická odpoveď v dôsledku očkovania špecifického pre SARS-CoV-2 RVP koncentrácia neutralizačných protilátok na úrovni subjektu je v protokole definovaná ako zmena z hodnoty pod LLOQ na hodnotu rovnú alebo vyššiu ako 4 x LLOQ, alebo aspoň 4-násobné zvýšenie, ak je východisková hodnota rovná alebo vyššia ako LLOQ. Sérologická odpoveď 95 % IS sa vypočíta pomocou Clopperovej-Pearsonovej metódy.
e Rozdiel v miere sérologickej odpovede 95 % IS je vypočítaný pomocou Miettinen-Nurminenových (skóre)
hraníc spoľahlivosti.
Staršie osobyVakcína Spikevax bola hodnotená u osôb vo veku 6 mesiacov a starších vrátane 3 768 účastníkov vo
veku 65 rokov a starších. Účinnosť vakcíny Spikevax u starších osôb (≥ 65 rokov) zodpovedala účinnosti u mladších dospelých účastníkov (18 – 64 rokov).
Pediatrická populáciaEurópska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s vakcínou
Spikevax v jednej alebo vo viacerých podskupinách pediatrickej populácie na prevenciu
COVID-19 (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiNeaplikovateľné.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe obvyklých štúdií toxicity po opakovanom podávaní a reprodukčnej a vývinovej toxicity neodhalili žiadne osobitné riziko pre ľudí.
Celkovátoxicita
Štúdie celkovej toxicity sa uskutočnili na potkanoch (intramuskulárne podané až do 4 dávok viac než dávka u ľudí raz za 2 týždne). Pozoroval sa prechodný a reverzibilný edém a erytém v mieste podania injekcie, a prechodné a reverzibilné zmeny vo výsledkoch laboratórnych testov (vrátane zvýšených hodnôt eozinofilov, aktivovaného parciálneho tromboplastínového času a fibrinogénu). Výsledky naznačujú, že riziko toxicity u ľudí je nízke.
Genotoxicita/karcinogenita
In vitro a in vivo štúdie genotoxicity sa vykonali v prípade novej lipidovej zložky SM-102 vakcíny.
Výsledky naznačujú nízky potenciál genotoxicity u ľudí. Neboli vykonané štúdie karcinogenity.
Reprodukčná toxicita
V štúdii vývinovej toxicity sa 0,2 ml forma očkovacej látky obsahujúca rovnaké množstvo mRNA
(100 mikrogramov) a ďalšie zložky ako jednorazová dávka vakcíny Spikevax podávaná u ľudí podávala samiciam potkanov intramuskulárnou cestou štyrikrát: 28 a 14 dní pred párením a v 1.
a 13. gestačný deň. Imunitná odpoveď prostredníctvom protilátok proti SARS-CoV-2 sa vyskytla
u zvierat-matiek pred párením až do konca štúdie v 21. dni laktácie, ako aj u plodov a potomkov. Nevyskytli sa žiadne nežiaduce účinky na samičiu fertilitu, graviditu, embryofetálny, postnatálny vývoj alebo vývoj mláďat súvisiace s očkovacou látkou. K dispozícii nie sú žiadne údaje o prechode vakcíny Spikevax cez placentu alebo o jej vylučovaní do mlieka.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
SM-102 (heptadekán-9-yl 8-{(2-hydroxyetyl)[6-oxo-6-(undecyloxy)hexyl]amino}oktanoát)
cholesterol
1,2-distearoyl-sn-glycero-3-fosfocholín (DSPC)
1,2-dimyristoyl-rac-glycero-3-metoxypolyetylénglykol-2000 (PEG2000-DMG)
trometamol trometamólium-chlorid kyselina octová
octan sodný, trihydrát sacharóza
voda na injekcie
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi ani riediť.
6.3 Čas použiteľnosti
Neotvorenáviacdávkováinjekčnáliekovka(Spikevax0,2mg/mlinjekčnádisperziaaSpikevax
0,1 mg/ml injekčnádisperzia)
9 mesiacov pri teplote -50 °C až -15 °C.
V rámci 9-mesačného obdobia sa môže neotvorená injekčná liekovka s vakcínou po vybratí
z mrazničky uchovávať v chladničke pri teplote 2 °C až 8 °C, chránená pred svetlom, maximálne po dobu 30 dní. V rámci tohto obdobia sa vakcína môže prepravovať najviac 12 hodín pri teplote 2 °C až
8 °C (pozri časť 6.4).
Chemická a fyzikálna stabilita bola tiež preukázaná pre neotvorené injekčné liekovky s vakcínou pri uchovávaní po dobu 12 mesiacov pri teplote -50 °C až -15 °C pod podmienkou, že po rozmrazení
a uchovávaní pri teplote 2 °C až 8 °C, chránená pred svetlom, sa neotvorená injekčná liekovka použije do maximálne 14 dní (namiesto 30 dní, ak sa uchováva pri teplote -50 ºC až -15 ºC po dobu
9 mesiacov) a celkový čas uchovávania nepresiahne 12 mesiacov.
Po rozmrazení sa vakcína nesmie znovu zmrazovať.
Neotvorená vakcína sa môže uchovávať po vybratí z chladničky po dobu maximálne 24 hodín pri teplote 8 °C až 25 °C.
Prepichnutáviacdávkováinjekčnáliekovka(Spikevax0,2mg/mlinjekčnádisperziaaSpikevax
0,1 mg/mlinjekčnádisperzia)
Chemická a fyzikálna stabilita počas používania bola preukázaná počas 19 hodín pri teplote 2 °C až
25 °C po prvom prepichnutí (v rámci povoleného času použiteľnosti 30 dní, respektíve 14 dní, pri teplote 2 °C až 8 °C a vrátane 24 hodín pri teplote 8 °C až 25 °C). Z mikrobiologického hľadiska sa má liek použiť okamžite. Ak sa vakcína nepoužije okamžite, za čas použiteľnosti a podmienky uchovávania počas používania zodpovedá používateľ.
Spikevax 50 mikrogramov injekčná disperziavnaplnenejinjekčnejstriekačke
9 mesiacov pri teplote -50 °C až -15 °C.
V rámci 9-mesačného obdobia sa môže naplnená injekčná striekačka s vakcínou po vybratí
z mrazničky uchovávať v chladničke pri teplote 2 °C až 8 °C, chránená pred svetlom, maximálne po dobu 30 dní (pozri časť 6.4).
Chemická a fyzikálna stabilita bola tiež preukázaná pre neotvorené naplnené injekčné striekačky
s vakcínou pri uchovávaní po dobu 12 mesiacov pri teplote -50 °C až -15 °C pod podmienkou, že po rozmrazení a uchovávaní pri teplote 2 °C až 8 °C, chránená pred svetlom, sa neotvorená naplnená injekčná striekačka použije do maximálne 14 dní (namiesto 30 dní, ak sa uchováva pri
teplote -50 ºC až -15 ºC po dobu 9 mesiacov) a celkový čas uchovávania nepresiahne 12 mesiacov. Po rozmrazení sa vakcína nesmie opätovne zmraziť.
Naplnené injekčné striekačky sa môžu uchovávať pri teplote 8 °C až 25 °C do 24 hodín po vybratí z chladničky.
6.4 Špeciálne upozornenia na uchovávanie
Spikevax0,2mg/mlinjekčnádisperziaaSpikevax0,1mg/mlinjekčnádisperzia(viacdávkovéinjekčnéliekovky)
Uchovávajte v mrazničke pri teplote od -50 °C do -15 °C.
Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky uchovávania po rozmrazení a prvom otvorení, pozri časť 6.3.
Podmienky uchovávania viacdávkovej injekčnej liekovky po prvom otvorení sú uvedené v časti 6.3.
Preprava rozmrazených viacdávkových injekčných liekoviek v tekutom stave pri teplote 2 °C až 8 °C Ak nie je možná preprava pri teplote -50 °C až -15 °C, podľa dostupných údajov je možná preprava jednej alebo viacerých rozmrazených injekčných liekoviek v tekutom stave trvajúca najviac 12 hodín pri teplote 2 °C až 8 °C (v rámci času použiteľnosti 30 dní, respektíve 14 dní, pri teplote 2 °C až 8 °C). Po rozmrazení a preprave v tekutom stave pri teplote 2 °C až 8 °C sa injekčné liekovky nemajú znovu zmrazovať a až do použitia sa majú uchovávať pri teplote 2 °C až 8 °C.
Spikevax50mikrogramovinjekčnádisperziavnaplnenejinjekčnejstriekačke
Uchovávajte v mrazničke pri teplote od -50 °C do -15 °C.
Naplnenú injekčnú striekačku uchovávajte vo vonkajšom obale na ochranu pred svetlom. Podmienky uchovávania po rozmrazení a prvom otvorení, pozri časť 6.3.
Preprava rozmrazených naplnených injekčných striekačiek v tekutom stave pri teplote 2 °C až 8 °C Ak nie je možná preprava pri teplote -50 °C až -15 °C, podľa dostupných údajov je možná preprava jednej alebo viacerých rozmrazených naplnených injekčných striekačiek v tekutom stave pri teplote
2 °C až 8 °C (v rámci času použiteľnosti 30 dní, respektíve 14 dní pri teplote 2 °C až 8 °C). Po rozmrazení a preprave v tekutom stave pri teplote 2 °C až 8 °C sa naplnené injekčné striekačky nemajú znovu zmrazovať a až do použitia sa majú uchovávať pri teplote 2 °C až 8 °C.
6.5 Druh obalu a obsah baleniaViacdávkové injekčné liekovkySpikevax 0,2 mg/ml injekčná disperzia5 ml disperzie vo viacdávkovej injekčnej liekovke (sklo typu 1 alebo ekvivalent skla typu 1 alebo
cyklický olefínový polymér s vnútornou bariérovou vrstvou) so zátkou (chlórbutylová guma)
a červeným odklápacím plastovým viečkom s uzáverom (hliníkový uzáver).
Veľkosť balenia: 10 viacdávkových injekčných liekoviek. Každá injekčná liekovka obsahuje 5 ml.
Spikevax 0,1 mg/ml injekčná disperzia2,5 ml disperzie vo viacdávkovej injekčnej liekovke (sklo typu 1 alebo ekvivalent skla typu 1 alebo cyklický olefínový polymér s vnútornou bariérovou vrstvou) so zátkou (chlórbutylová guma)
a modrým odklápacím plastovým viečkom s uzáverom (hliníkový uzáver).
Veľkosť balenia: 10 viacdávkových injekčných liekoviek. Každá injekčná liekovka obsahuje 2,5 ml.
Spikevax 50 mikrogramov injekčná disperzia v naplnenej injekčnej striekačke0,5 ml disperzie v naplnenej injekčnej striekačke (z cyklického olefínového polyméru) s piestovou
zátkou (potiahnutá brómbutylovou gumou) a hrotovým uzáverom (brómbutylová guma, bez ihly).
Naplnené injekčné striekačky sú balené v 5 priehľadných blistroch, z ktorých každý obsahuje
2 naplnené injekčné striekačky.
Veľkosť balenia: 10 naplnených injekčných striekačiek. Každá naplnená injekčná striekačka
obsahuje 0,5 ml. Nepoužívajte naplnenú injekčnú striekačku na podanie čiastočného objemu 0,25 ml.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomTúto vakcínu má pripravovať a podávať vyškolený zdravotnícky pracovník aseptickým postupom na zabezpečenie sterility disperzie.
Injekčné liekovky a naplnené injekčné striekačky skladujú zmrazené pri teplote -50 °C až -15 °C.

V
i
ac
dávková injekčná liekovkaPo rozmrazení je vakcína pripravená na podanie.
Nepretrepávajte ani nerieďte. Obsah injekčnej liekovky krúživým pohybom opatrne premiešajte po rozmrazení a pred každým odobratím dávky.
Ubezpečte sa, že injekčná liekovka má červené odklápacie viečko a že názov lieku je Spikevax
0,2 mg/ml. Ak má injekčná liekovka modré odklápacie viečko a názov lieku je Spikevax bivalent
Original/Omicron BA.1 alebo Spikevax bivalent Original/Omicron BA.4-5, pozrite si Súhrn charakteristických vlastností lieku pre ten liek.
Spikevax 0,2 mg/ml injekčná disperziaZ každej injekčnej liekovky (červené odklápacie viečko) je možné odobrať maximálne desať (10)
dávok (po 0,5 ml) alebo maximálne dvadsať (20) dávok (po 0,25 ml).
Zátku prepichnite podľa možností vždy na inom mieste. Neprepichujte zátku injekčnej liekovky viac ako 20-krát.
V každej injekčnej liekovke je určitý objem navyše, aby sa zabezpečilo, že možno odobrať maximálne
10 dávok po 0,5 ml alebo maximálne 20 dávok (po 0,25 ml).
Pred použitím rozmrazte každú viacdávkovú injekčnú liekovku podľa nižšie uvedených pokynov (Tabuľka 7). Po rozmrazení injekčnej liekovky v chladničke ju pred podaním nechajte 15 minút stáť pri izbovej teplote.
Tabuľka 7. Pokyny na rozmrazovanie viacdávkových injekčných liekoviek pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke)
|
Trvanie rozmrazova nia
| Teplota rozmrazovani a (pri izbovej teplote)
|
Trvanie rozmrazovania
|
Viacdávková injekčná liekovka
|
2 °C – 8 °C
| 2 hodiny a 30
minút
|
15 °C – 25 °C
|
1 hodina
|
 Spikevax 0,1 mg/ml injekčná disperzia
Spikevax 0,1 mg/ml injekčná disperzia
Z každej injekčnej liekovky (modré vyklápacie viečko) možno odobrať päť (5) dávok (každá po
0,5 ml) alebo maximálne desať (10) dávok (po 0,25 ml).
Ubezpečte sa, že injekčná liekovka má modré odklápacie viečko a že názov lieku je Spikevax
0,1 mg/ml. Ak má injekčná liekovka modré odklápacie viečko a názov lieku je Spikevax bivalent Original/Omicron BA.1 alebo Spikevax bivalent Original/Omicron BA.4-5, pozrite si Súhrn charakteristických vlastností lieku pre ten liek.
Zátku prepichnite podľa možností vždy na inom mieste.
V každej injekčnej liekovke je určitý objem navyše, aby sa zabezpečilo, že možno odobrať 5 dávok po
0,5 ml alebo maximálne 10 dávok (po 0,25 ml).
Pred použitím rozmrazte každú viacdávkovú injekčnú liekovku podľa nižšie uvedených pokynov (Tabuľka 8). Po rozmrazení injekčnej liekovky v chladničke ju pred podaním nechajte 15 minút stáť pri izbovej teplote.
Tabuľka 8. Pokyny na rozmrazovanie viacdávkových injekčných liekoviek pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke)
|
Trvanie rozmrazova nia
| Teplota rozmrazovani a (pri izbovej teplote)
|
Trvanie rozmrazovania
|
Viacdávková injekčná liekovka
|
2 °C – 8 °C
| 2 hodiny a 30
minút
|
15 °C – 25 °C
|
1 hodina
|
 Spikevax 0,2 mg/ml injekčná disperzia a Spikevax 0,1 mg/ml injekčná disperzia
Spikevax 0,2 mg/ml injekčná disperzia a Spikevax 0,1 mg/ml injekčná disperzia
 S
pikevax 50 mikrogramov injekčná disperzia v naplnenej injekčnej striekačke
S
pikevax 50 mikrogramov injekčná disperzia v naplnenej injekčnej striekačkeObsah naplnenej injekčnej striekačky nepretrepávajte ani nerieďte.
Každá naplnená injekčná striekačka je určená len na jednorazové použitie. Po rozmrazení je vakcína pripravená na podanie.
Z každej naplnenej injekčnej striekačky možno podať jednu (1) dávku po 0,5 ml. Nepoužívajte naplnenú injekčnú striekačku na podanie čiastočného objemu 0,25 ml.
Spikevax sa dodáva v jednodávkovej naplnenej injekčnej striekačke (bez ihly) obsahujúcej 0,5 ml (50
mikrogramov) mRNA a pred podaním sa musí rozmraziť.
Každú naplnenú injekčnú striekačku pred použitím rozmrazte podľa nižšie uvedených pokynov. Injekčné striekačky sa môžu rozmrazovať v blistroch (každý blister obsahuje 2 naplnené injekčné
striekačky) alebo vo vonkajšom obale, buď v chladničke, alebo pri izbovej teplote (Tabuľka 9). Po rozmrazení injekčnej striekačky v chladničke ju pred podaním nechajte 15 minút stáť pri izbovej teplote.
Tabuľka 9. Pokyny na rozmrazovanie naplnených injekčných striekačiek a vonkajších obalov pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a dĺžka trvania
|
Teplota rozmrazovania (v chladničke) (°C)
| Trvanie rozmrazo- vania (minúty)
| Teplota rozmrazovani a (pri izbovej teplote) (°C)
|
Trvanie rozmrazovania (minúty)
|
Naplnená injekčná striekačka v blistrovom balení
|
2 – 8
|
55
|
15 – 25
|
45
|
Vonkajší obal
| 2 – 8
| 155
| 15 – 25
| 140
|
Ubezpečte sa, že názov lieku v naplnenej injekčnej striekačke je Spikevax 50 mikrogramov injekčná
disperzia v naplnenej injekčnej striekačke. Ak je názov lieku Spikevax bivalent Original/Omicron
BA.1 alebo Spikevax bivalent Original/Omicron BA.4-5, pozrite si Súhrn charakteristických vlastností lieku pre ten liek.
Pokyny na zaobchádzanie s naplnenými injekčnými striekačkami• Pred podaním nechajte každú naplnenú injekčnú striekačku stáť 15 minút pri izbovej teplote
(15 °C až 25 °C).
• Nepretrepávajte.
• Naplnená injekčná striekačka sa musí pred podaním vizuálne skontrolovať na prítomnosť častíc a zmenu farby.
• Spikevax je biela až sivobiela disperzia. Môže obsahovať biele alebo priehľadné častice, ktoré sú súčasťou produktu. Vakcínu nepodávajte, ak má zmenenú farbu alebo obsahuje iné častice.
• Ihly nie sú súčasťou balenia s naplnenými injekčnými striekačkami.
• Použite sterilnú ihlu vhodnej veľkosti na intramuskulárnu injekciu (ihly 21G alebo tenšie).
• Odstráňte uzáver hrotu z injekčnej striekačky otáčaním proti smeru hodinových ručičiek.
• Ihlu nasaďte otáčaním v smere hodinových ručičiek, kým ihla bezpečne nezapadne na injekčnú striekačku.
• Keď ste pripravený na podanie, odstráňte kryt ihly.
• Podajte celú dávku intramuskulárne.
LikvidáciaVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMODERNA BIOTECH SPAIN, S.L. Calle del Príncipe de Vergara 132 Plt 12
Madrid 28002
Španielsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
EU/1/20/1507/001
EU/1/20/1507/002
EU/1/20/1507/003
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 6. januára 2021
Dátum posledného predĺženia registrácie: 3. októbra 2022
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUSpikevax bivalent Original/Omicron BA.1 (50 mikrogramov/50 mikrogramov)/ml injekčná disperzia Spikevax bivalent Original/Omicron BA.1 25 mikrogramov/25 mikrogramov injekčná disperzia Spikevax bivalent Original/Omicron BA.1 25 mikrogramov/25 mikrogramov injekčná disperzia
v naplnenej injekčnej striekačke
mRNA očkovacia látka proti COVID-19 (modifikovaný nukleozid)
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIETabuľka 1. Spikevax bivalent Original/Omicron BA.1 kvalitatívne a kvantitatívne zloženieSila
| Obal
| Dávka (dávky)
| Zloženie na dávku
|
Spikevax bivalent
Original/Omicron BA.1 (50 mikrogramov/50 mikrogramov)/ml injekčná disperzia
| Viacdávková
2,5 ml injekčná liekovka
(modré odklápacie viečko)
| 5 dávok po
0,5 ml alebo 10 dávok po 0,25 ml
| Jedna dávka (0,5 ml)
obsahuje
25 mikrogramov elazomeranu
a 25 mikrogramov
imelazomeranu, mRNA očkovacej látky proti COVID-
19 (zapuzdrenej do lipidových nanočastíc).
Jedna dávka
(0,25 ml) obsahuje
12,5 mikrogramov
elazomeranu
a 12,5 mikrogramov imelazomeranu, mRNA očkovacej látky proti COVID-
19 (zapuzdrenej do
lipidových nanočastíc).
|
Viacdávková
5 ml injekčná
liekovka (modré odklápacie viečko)
| 10 dávok po
0,5 ml alebo 20
dávok po 0,25
ml
|
Spikevax bivalent
Original/Omicron BA.1
25 mikrogramov/25 mikrogramov injekčná disperzia
| Jednodávková
0,5 ml injekčná liekovka
(modré
odklápacie viečko)
| 1 dávka 0,5 ml
Len na jednorazové použitie.
|
Jedna dávka (0,5 ml)
obsahuje
25 mikrogramov elazomeranu
a 25 mikrogramov
imelazomeranu, mRNA očkovacej látky proti COVID-
|
Spikevax bivalent
Original/Omicron BA.1
25 mikrogramov/25 mikrogramov injekčná disperzia v naplnenej injekčnej striekačke
| Naplnená injekčná striekačka
| 1 dávka 0,5 ml Len na jednorazové použitie.
|
|
|
|
19 (zapuzdrenej do lipidových nanočastíc).
|
Elazomeran je jednovláknová mediátorová RNA (mRNA) s čiapočkou na 5’ konci produkovaná
pomocou bezbunkovej
in vitro transkripcie z príslušných šablón DNA, kódujúca „spike“ (S) proteín
vírusu SARS-CoV-2 (pôvodná).
Imelazomeran je jednovláknová mediátorová RNA (mRNA ) s čiapočkou na 5’ konci produkovaná pomocou bezbunkovej
in vitro transkripcie z príslušných šablón DNA, kódujúca „spike“ (S) proteín vírusu SARS-CoV-2 (Omicron BA.1).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMAInjekčná disperzia
Biela až sivobiela disperzia (pH: 7,0 – 8,0).
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieVakcína Spikevax bivalent Original/Omicron BA.1 je indikovaná na aktívnu imunizáciu na prevenciu ochorenia COVID-19 spôsobeného SARS-CoV-2 u osôb vo veku 6 rokov a starších, ktorí predtým dostali aspoň základný cyklus očkovania proti COVID-19 (pozri časti 4.2 a 5.1).
Použitie tejto očkovacej látky má byť v súlade s oficiálnymi odporúčaniami.
4.2 Dávkovanie a spôsob podávaniaDávkovanieOsoby vo veku 12 rokov a staršieDávka očkovacej látky Spikevax bivalent Original/Omicron BA.1 je 0,5 ml podávaná intramuskulárne.
Osoby vo veku od 6 rokov do 11 rokovDávka očkovacej látky Spikevax bivalent Original/Omicron BA.1 je 0,25 ml podávaná intramuskulárne.
Medzi podaním očkovacej látky Spikevax bivalent Original/Omicron BA.1 a poslednou predchádzajúcou dávkou očkovacej látky proti COVID-19 by mal byť interval aspoň 3 mesiace.
Vakcína Spikevax bivalent Original/Omicron BA.1 je indikovaná len pre osoby, ktoré v minulosti absolvovali aspoň základný cyklus očkovania proti COVID-19.
Podrobnosti o primárnom cykle očkovania pre osoby vo veku 6 rokov a staršie pozri v súhrne charakteristických vlastností lieku Spikevax 0,2 mg/ml injekčná disperzia.
Pediatrická populácia
Bezpečnosť a účinnosť vakcíny Spikevax bivalent Original/Omicron BA.1 u detí mladších ako
6 rokov neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Staršie osoby
U starších osôb vo veku ≥ 65 rokov nie je potrebná žiadna úprava dávkovania.
Spôsob podávania
Vakcína sa má podávať intramuskulárne. Uprednostňované miesto podania je deltový sval ramena.
Nepodávajte túto vakcínu intravaskulárne, subkutánne ani intradermálne.
Vakcína sa nesmie miešať v rovnakej injekčnej striekačke so žiadnymi inými vakcínami ani liekmi. Opatrenia, ktoré sa majú urobiť pred podaním vakcíny, pozri časť 4.4.
Pokyny týkajúce sa rozmrazenia, zaobchádzania a likvidácie vakcíny, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Sledovateľnosť
Aby sa zlepšila (do)sledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov a číslo
šarže podaného lieku.
Precitlivenosť aanafylaxia
U osôb, ktoré dostali očkovaciu látku Spikevax (pôvodná), bola hlásená anafylaxia. Má byť vždy
okamžite dostupné vhodné lekárske ošetrenie a dohľad pre prípad vzniku anafylaktickej reakcie po
podaní očkovacej látky.
Po očkovaní sa odporúča dôkladné sledovanie po dobu najmenej 15 minút. Osobám, u ktorých po podaní predchádzajúcej dávky vakcíny Spikevax (pôvodná) došlo k anafylaxii, sa nemajú podať ďalšie dávky vakcíny Spikevax bivalent Original/Omicron BA.1.
Myokarditída a perikarditída
Existuje zvýšené riziko myokarditídy a perikarditídy po očkovaní očkovacou látkou Spikevax
(pôvodná).
Tieto ochorenia sa môžu objaviť už do niekoľkých dní po očkovaní a vyskytli sa najmä počas prvých
14 dní. Boli pozorované častejšie po druhej dávke v porovnaní s prvou dávkou a častejšie u mladších mužov (pozri časť 4.8). Rizikový profil sa zdá byť podobný pri druhej a tretej dávke.
Z dostupných údajov vyplýva, že priebeh myokarditídy a perikarditídy po očkovaní sa nelíši od myokarditídy alebo perikarditídy vo všeobecnosti.
Zdravotnícki pracovníci majú venovať zvýšenú pozornosť prejavom a príznakom myokarditídy
a perikarditídy. Očkované osoby majú byť poučené, aby okamžite vyhľadali lekársku pomoc, ak sa
u nich po očkovaní objavia príznaky naznačujúce myokarditídu alebo perikarditídu, napríklad (akútna
a pretrvávajúca) bolesť na hrudníku, dýchavičnosť alebo palpitácie.
Zdravotnícki pracovníci si majú pri diagnostike a liečbe tohto ochorenia prečítať usmernenia a/alebo sa poradiť so špecialistami.
Reakcie spojené s úzkosťou
Pri očkovaní sa môžu vyskytnúť reakcie súvisiace s úzkosťou vrátane vazovagálnych reakcií
(synkopa), hyperventilácie alebo reakcií súvisiacich so stresom ako psychogénna odpoveď na podanie injekcie ihlou. Je dôležité vykonať opatrenia na zabránenie zranenia spôsobeného omdlievaním.
Súbežné ochorenie
Očkovanie sa má odložiť u osôb so závažným akútnym ochorením s horúčkou alebo akútnou
infekciou. Pre miernu infekciu a/alebo nízku horúčku sa očkovanie nemá odkladať.
Trombocytopénia a poruchy koagulácie
Tak ako pri iných intramuskulárnych injekciách, aj táto vakcína sa má podávať s opatrnosťou u osôb
liečených antikoagulanciami alebo u osôb s trombocytopéniou, alebo akoukoľvek poruchou koagulácie (ako je napríklad hemofília), pretože u týchto osôb sa môže po intramuskulárnom podaní vyskytnúť krvácanie alebo tvorba podliatin.
Vzplanutia syndrómu kapilárneho presakovania
Počas prvých dní po očkovaní očkovacou látkou Spikevax (pôvodná) bolo hlásených niekoľko
prípadov vzplanutia syndrómu kapilárneho presakovania (CLS). Zdravotnícki pracovníci majú poznať prejavy a príznaky syndrómu CLS, aby tento stav ihneď rozpoznali a liečili. U osôb s ochorením CLS v anamnéze je potrebné očkovanie plánovať v spolupráci s príslušnými lekárskymi odborníkmi.
Imunokompromitované osoby
Účinnosť a bezpečnosť vakcíny Spikevax bivalent Original/Omicron BA.1 sa nehodnotili
u imunokompromitovaných osôb vrátane osôb užívajúcich imunosupresívnu liečbu. Účinnosť vakcíny
Spikevax bivalent Original/Omicron BA.1 môže byť u imunokompromitovaných osôb nižšia.
Trvanie ochrany
Trvanie ochrany vyvolanej očkovacou látkou nie je známe, keďže sa ešte stále stanovuje
v prebiehajúcich klinických štúdiách.
Obmedzenia účinnosti vakcíny
Rovnako ako u všetkých vakcín, ani očkovanie vakcínou Spikevax bivalent Original/Omicron BA.1
nemusí chrániť každého kto ju dostane.
Pomocné látky so známym účinkom
Sodík
Táto vakcína obsahuje menej ako 1 mmol sodíka (23 mg), t. j. v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
Súbežné podávanie vakcíny Spikevax bivalent Original/Omicron BA.1 s inými vakcínami sa
4.6 Fertilita, gravidita a laktácia
G
ra
vidita
Doposiaľ nie sú k dispozícii žiadne údaje týkajúce sa používania vakcíny Spikevax bivalent
Original/Omicron BA.1 počas tehotenstva.
Veľké množstvo observačných údajov od tehotných žien očkovaných vakcínou Spikevax (pôvodná) v druhom a treťom trimestri však nepreukázalo zvýšenie nepriaznivých výsledkov gravidity. Aj keď údaje o výsledkoch gravidity po očkovaní v prvom trimestri sú v súčasnosti obmedzené, nepozorovalo sa zvýšené riziko potratu. Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky
z hľadiska gravidity, embryofetálneho vývinu, pôrodu alebo postnatálneho vývinu (pozri časť 5.3). Keďže rozdiely medzi produktmi sú obmedzené na sekvenciu spike proteínu a neexistujú žiadne klinicky významné rozdiely v reaktogenite, Spikevax bivalent Original/Omicron BA.1 sa môže používať počas tehotenstva.
Dojčenie
Doposiaľ nie sú k dispozícii žiadne údaje týkajúce sa používania vakcíny Spikevax bivalent
Original/Omicron BA.1 počas dojčenia.
Neočakáva sa však žiaden účinok u dojčených novorodencov/dojčiat, keďže systémová expozícia vakcíne u dojčiacich žien je zanedbateľná. Observačné údaje od žien, ktoré po očkovaní vakcínou Spikevax (pôvodnou) dojčili, nepreukázali riziko výskytu nežiaducich účinkov u dojčených novorodencov/dojčiat. Spikevax bivalent Original/Omicron BA.1 sa môže používať počas dojčenia.
Fertilita
Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej
toxicity (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Vakcína Spikevax bivalent Original/Omicron BA.1 nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Niektoré z účinkov uvedených v časti 4.8 však môžu dočasne ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Dospelí
Bezpečnosť vakcíny Spikevax (pôvodná) sa hodnotila v prebiehajúcej randomizovanej, placebom
kontrolovanej klinickej štúdii fázy 3 zaslepenej pre pozorovateľa, ktorá sa uskutočnila v USA a na ktorej sa zúčastnilo 30 351 účastníkov vo veku 18 rokov a starších, ktorí dostali najmenej jednu dávku vakcíny Spikevax (pôvodná) (n = 15 185) alebo placebo (n = 15 166) (NCT04470427). V čase očkovania bol priemerný vek populácie 52 rokov (rozpätie 18 – 95); 22 831 (75,2 %) účastníkov bolo vo veku 18 až 64 rokov a 7 520 (24,8 %) účastníkov bolo vo veku 65 rokov a starších.
Najčastejšie hlásenými nežiaducimi reakciami boli bolesť v mieste podania injekcie (92 %), únava
(70 %), bolesť hlavy (64,7 %), myalgia (61,5 %) artralgia (46,4 %), zimnica (45,4 %), nauzea/vracanie (23 %), axilárny opuch/citlivosť (19,8 %), horúčka (15,5 %), opuch v mieste podania injekcie (14,7 %) a začervenanie (10 %). Intenzita nežiaducich reakcií bola zvyčajne mierna alebo stredná a nežiaduce reakcie odzneli do niekoľkých dní po očkovaní. O niečo nižšia frekvencia reaktogenity bola spojená s vyšším vekom.
Celkovo bol v mladších vekových skupinách vyšší výskyt niektorých nežiaducich reakcií: výskyt axilárneho opuchu/citlivosti, únavy, bolesti hlavy, myalgie, artralgie, zimnice, nauzey/vracania
a horúčky bol vyšší u dospelých vo veku od 18 do < 65 rokov než u dospelých vo veku 65 rokov
a starších.
Lokálne a systémové nežiaduce reakcie boli častejšie hlásené po 2. dávke než po 1. dávke.
Dospievajúci vo veku od 12 do 17 rokov
Údaje o bezpečnosti lieku Spikevax (pôvodná) u dospievajúcich boli získané v prebiehajúcej randomizovanej, placebom kontrolovanej, pre pozorovateľa zaslepenej klinickej štúdii fázy 2/3 s viacerými časťami, ktorá sa uskutočnila v Spojených štátoch. Prvej časti štúdie sa zúčastnilo
3 726 účastníkov vo veku od 12 do 17 rokov, ktorí dostali najmenej jednu dávku vakcíny Spikevax (n
= 2 486) alebo placebo (n = 1 240) (NCT04649151). Demografické charakteristiky u účastníkov, ktorí dostali vakcínu Spikevax, a účastníkov, ktorí dostali placebo, boli podobné.
Najčastejšími nežiaducimi reakciami u dospievajúcich vo veku od 12 do 17 rokov boli bolesť v mieste podania injekcie (97 %), bolesť hlavy (78 %), únava (75 %), myalgia (54 %), zimnica (49 %), axilárny opuch/citlivosť (35 %), artralgia (35 %), nauzea/vracanie (29 %), opuch v mieste podania injekcie
(28 %), erytém v mieste podania injekcie (26 %) a horúčka (14 %).
Táto štúdia prešla do otvorenej štúdie fázy 2/3, v ktorej 1 346 účastníkov vo veku 12 až 17 rokov dostalo posilňovaciu dávku Spikevaxu najmenej 5 mesiacov po druhej dávke primárneho cyklu. V otvorenej časti štúdie sa nezistili žiadne ďalšie nežiaduce reakcie.
Deti vo veku od 6 rokov do 11 rokov
Údaje o bezpečnosti vakcíny Spikevax (pôvodná) u detí sa získavali v prebiehajúcej randomizovanej klinickej štúdii fázy 2/3 zaslepenej pre pozorovateľa, pozostávajúcom z dvoch častí, ktoré sa uskutočnilo v USA a Kanade (NCT04796896). 1. časť je otvorená fáza štúdie bezpečnosti, výberu dávky a imunogenity a zahŕňala 380 účastníkov vo veku od 6 rokov do 11 rokov, ktorí dostali najmenej 1 dávku (0,25 ml) vakcíny Spikevax (pôvodná). 2. časť je placebom kontrolovaná fáza skúšania bezpečnosti a zahŕňala 4 016 účastníkov vo veku od 6 rokov do 11 rokov, ktorí dostali najmenej jednu dávku (0,25 ml) vakcíny Spikevax (pôvodná) (n = 3 012) alebo placebo (n = 1 004). Žiadny z účastníkov z 1. časti sa nezúčastnil v 2. časti. Demografické charakteristiky účastníkov, ktorí dostali vakcínu Spikevax (pôvodná) a účastníkov, ktorí dostali placebo, boli podobné.
Najčastejšími nežiaducimi reakciami u účastníkov vo veku od 6 rokov do 11 rokov po podaní primárneho cyklu (v 2. časti) boli bolesť v mieste podania injekcie (98,4 %), únava (73,1 %), bolesť hlavy (62,1 %), myalgia (35,3 %), zimnica (34,6 %), nauzea/vracanie (29,3 %), axilárny opuch/citlivosť (27,0 %), horúčka (25,7 %), erytém v mieste podania injekcie (24,0 %), opuch
v mieste podania injekcie (22,3 %) a artralgia (21,3 %).
Protokol štúdie bol zmenený a doplnený tak, aby zahŕňal otvorenú fázu podávania posilňovacích dávok, do ktorej bolo zaradených 1 294 účastníkov vo veku od 6 rokov do 11 rokov, ktorí dostali posilňovaciu dávku Spikevaxu (pôvodnú) najmenej 6 mesiacov po druhej dávke primárneho cyklu. V otvorenej časti štúdie sa nezistili žiadne ďalšie nežiaduce reakcie.
Deti vo veku od 6 mesiacov do 5 rokov
V Spojených štátoch a Kanade prebieha randomizované, placebom kontrolované, pre pozorovateľa
zaslepené klinické skúšanie fázy 2/3 na vyhodnotenie bezpečnosti, znášanlivosti, reaktogenity a účinnosti vakcíny Spikevax. Toto klinické skúšanie zahŕňalo 10 390 účastníkov vo veku od
6 mesiacov do 11 rokov, ktorí dostali aspoň jednu dávku vakcíny Spikevax (pôvodná) (n = 7 798)
alebo placeba (n = 2 592).
Do klinického skúšania boli zaradené deti v 3 vekových skupinách: od 6 rokov do 11 rokov, od 2 rokov do 5 rokov a od 6 mesiacov do 23 mesiacov. Toto pediatrické klinické skúšanie zahŕňalo 6 388 účastníkov vo veku od 6 mesiacov do 5 rokov, ktorí dostali aspoň jednu dávku vakcíny Spikevax (pôvodná) (n = 4 791) alebo placeba (n = 1 597). Demografické charakteristiky účastníkov, ktorí dostali Spikevax (pôvodná), a účastníkov, ktorí dostali placebo, boli podobné.
V tomto klinickom skúšaní boli nežiaduce reakcie u účastníkov vo veku od 6 mesiacov do
23 mesiacov po podaní primárneho cyklu podráždenosť/plač (81,5 %), bolesť v mieste vpichu
(56,2 %), ospalosť (51,1 %), strata chuti do jedla (45,7 %), horúčka (21,8 %), opuch v mieste vpichu
(18,4 %), erytém v mieste vpichu (17,9 %) a opuch/citlivosť podpazušia (12,2 %).
Nežiaduce reakcie u účastníkov vo veku od 24 do 36 mesiacov po podaní primárneho cyklu zahŕňali bolesť v mieste vpichu (76,8 %), podráždenosť/plač (71,0 %), ospalosť (49,7 %), strata chuti do jedla (42,4 %), horúčku (26,1 %), erytém v mieste vpichu (17,9 %), opuch v mieste vpichu (15,7 %) a opuch/citlivosť podpazušia (11,5 %).
Nežiaduce reakcie u účastníkov vo veku od 37 mesiacov do 5 rokov po podaní primárneho cyklu zahŕňali bolesť v mieste vpichu (83,8 %), únavu (61,9 %), bolesť hlavy (22,9 %), myalgiu (22,1 %), horúčku (20,9 %), zimnicu (16,8 %), nevoľnosť/vracanie (15,2 %), opuch/citlivosť podpazušia
(14,3 %), artralgiu (12,8 %), erytém v mieste vpichu (9,5 %) a opuch v mieste vpichu (8,2 %).
Tabuľkový zoznam nežiaducich reakciíNižšie uvedený profil bezpečnosti vychádza z údajov získaných z niekoľkých placebom
kontrolovaných klinických štúdií:
- 30 351 dospelých vo veku ≥ 18 rokov,
- 3 726 dospievajúcich vo veku od 12 do 17 rokov,
- 4 002 detí vo veku od 6 rokov do 11 rokov,
- 6 388 detí vo veku od 6 mesiacov do 5 rokov,
- a zo skúseností po uvedení lieku na trh.
Hlásené nežiaduce reakcie sú uvedené podľa nasledujúcej konvencie frekvencií: Veľmi časté (≥ 1/10)
Časté (≥ 1/100 až < 1/10)
Menej časté (≥ 1/1 000 až < 1/100) Zriedkavé (≥ 1/10 000 až < 1/1 000) Veľmi zriedkavé (< 1/10 000)
Neznáme (z dostupných údajov nemožno odhadnúť)
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti (Tabuľka 2).
Tabuľka 2. Nežiaduce reakcie z klinických štúdií s vakcínou Spikevax (pôvodná) a zo skúsenosti po uvedení na trh u detí a osôb vo veku 6 mesiacov a staršíchTrieda orgánových systémov podľa
MedDRA
| Frekvencia
| Nežiaduca reakcia (reakcie)
|
Poruchy krvi a lymfatického systému
| Veľmi časté
| Lymfadenopatia*
|
Poruchy imunitného systému
| Neznáme
| Anafylaxia
Precitlivenosť
|
Poruchy metabolizmu a výživy
| Veľmi časté
| Znížená chuť do jedla†
|
Psychické poruchy
| Veľmi časté
| Podráždenosť/plač†
|
Poruchy nervového systému
| Veľmi časté
| Bolesť hlavy
Ospalosť†
|
Menej časté
| Závrat
|
|
Zriedkavé
|
Akútna periférna paralýza tváre‡ Hypestézia
Parestézia
|
P
oruchy srdca a srdcovej činnosti
|
Veľmi zriedkavé
|
Myokarditída
|
Perikarditída
|
P
oruchy gastrointestinálneho traktu
|
Veľmi časté
|
Nauzea/vracanie
|
Časté
|
Hnačka
|
|
Menej časté
|
Bolesť brucha§
|
P
oruchy kože a podkožného tkaniva
|
Časté
|
Vyrážka
|
Menej časté
|
Urtikária¶
|
Neznáme
|
Multiformný erytém
|
P
oruchy kostrovej a svalovej sústavy
a spojivového tkaniva
|
Veľmi časté
|
Myalgia
Artralgia
|
P
oruchy reprodukčného systému a
p
r
s
n
í
k
ov
|
Neznáme
|
Silné menštruačné krvácanie#
|
C
e
l
k
ové poruchy a reakcie v mieste podania
|
Veľmi časté
|
Bolesť v mieste podania injekcie
Únava
Zimnica
Pyrexia
Opuch v mieste podania injekcie
Erytém v mieste podania injekcie
|
Časté
|
Urtikária v mieste podania injekcie Vyrážka v mieste podania injekcie Oneskorená reakcia v mieste podania injekcie♠
|
Menej časté
|
Pruritus v mieste podania injekcie
|
Zriedkavé
|
Opuch tváre♥
|
Neznáme
|
Rozsiahly opuch očkovanej končatiny
|
* Lymfadenopatia bola zaznamenaná ako axilárna lymfadenopatia na rovnakej strane ako miesto podania injekcie. V niektorých prípadoch boli postihnuté iné lymfatické uzliny (napr. cervikálne, supraklavikulárne).
† Pozorované u pediatrickej populácie (vo veku od 6 mesiacov do 5 rokov).
‡ Počas celého obdobia sledovania bezpečnosti bola hlásená akútna periférna paralýza (alebo ochrnutie) tváre u troch účastníkov v skupine s podávaním vakcíny Spikevax a u jedného účastníka v skupine s podávaním placeba. K nástupu reakcie v skupine s podávaním očkovacej látky došlo v 22., 28. a 32. deň po podaní 2. dávky.
§ Bolesť brucha sa pozorovala u pediatrickej populácie (vo veku 6 až 11 rokov): 0,2 % v skupine s vakcínou Spikevax a 0 %
v skupine s placebom.
¶ Urtikária bola pozorovaná buď s akútnym nástupom (v priebehu niekoľkých dní po očkovaní), alebo s oneskoreným nástupom (približne do dvoch týždňov po očkovaní).
# Predpokladá sa, že väčšina prípadov nie je závažná a je dočasná.
♠ Medián času do nástupu reakcie bol 9 dní po prvej injekcii a 11 dní po druhej injekcii. Medián trvania bol 4 dni po prvej
injekcii a 4 dni po druhej injekcii.
♥ Dve závažné nežiaduce udalosti opuchu tváre boli hlásené u osôb, ktorým bola podaná očkovacia látka a ktorým boli v minulosti podané injekcie s dermatologickým výplňovým materiálom. Nástup opuchu bol hlásený v 1. a 3. deň,
v uvedenom poradí, vzhľadom na deň očkovania.
Reaktogenita a bezpečnostný profil u 343 účastníkov, ktorým bola podaná vakcína Spikevax (pôvodná) a ktorí boli na začiatku štúdie séropozitívni na SARS-CoV-2, boli porovnateľné s reaktogenitou a bezpečnostným profilom u účastníkov, ktorí boli na začiatku štúdie séronegatívni na SARS-CoV-2.
Dospelí (posilňovacia dávka)
Bezpečnosť, reaktogenita a imunogenita posilňovacej dávky vakcíny Spikevax (pôvodná) sa vyhodnocujú v prebiehajúcej randomizovanej, pre pozorovateľa zaslepenej, placebom kontrolovanej štúdii fázy 2 na potvrdenie dávky u účastníkov vo veku 18 rokov a starších (NCT04405076). V tejto štúdii dostalo 198 účastníkov dve dávky (0,5 ml, 100 mikrogramov s odstupom 1 mesiaca) primárneho cyklu vakcíny Spikevax (pôvodná). V otvorenej fáze tejto štúdie dostalo 167 z týchto účastníkov jednu posilňovaciu dávku (0,25 ml, 50 mikrogramov) najmenej 6 mesiacov po očkovaní druhou dávkou primárneho cyklu. Profil vyžiadaných nežiaducich reakcií pri posilňovacej dávke (0,25 ml,
50 mikrogramov) bol podobný profilu vyžiadaných nežiaducich reakcií po druhej dávke primárneho cyklu.
Spikevax bivalent Original/Omicron BA.1 (posilňovacia dávka)Bezpečnosť, reaktogenita a imunogenita posilňovacej dávky Spikevax bivalent Original/Omicron BA.1 sa hodnotí v prebiehajúcej otvorenej štúdii fázy 2/3 u účastníkov vo veku 18 rokov a starších (mRNA-1273-P205). V tejto štúdii dostalo 437 účastníkov posilňovaciu dávku Spikevax bivalent Original/Omicron BA.1 50 mikrogramov a 377 účastníkov dostalo posilňovaciu dávku Spikevax (pôvodná) 50 mikrogramov.
Posilňovacia dávka Spikevax bivalent Original/Omicron BA.1 mala profil reaktogenity podobný profilu posilňovacej dávky Spikevax (pôvodná) podávanej ako druhá posilňovacia dávka. Frekvencia nežiaducich reakcií po imunizácii posilňovacou dávkou Spikevax bivalent Original/Omicron BA.1 bola tiež podobná alebo nižšia v porovnaní s prvou posilňovacou dávkou Spikevax (pôvodná)
(50 mikrogramov) a v porovnaní s druhou dávkou primárneho cyklu Spikevax (pôvodná) (100 mikrogramov). Neboli identifikované žiadne nové bezpečnostné signály.
Opis vybraných nežiaducich reakciíMyokarditídaZvýšené riziko myokarditídy po očkovaní očkovacou látkou Spikevax (pôvodná) je najvyššie u mladších mužov (pozri časť 4.4).
V dvoch veľkých, európskych, farmako-epidemiologických štúdiách sa určilo zvýšené riziko
u mladších mužov po druhej dávke očkovacej látky Spikevax (pôvodná). Z jednej štúdie vyplynulo, že v období 7 dní po podaní druhej dávky sa u mužov vo veku 12 – 29 rokov vyskytlo približne o 1,316 (95 % IS 1,299 – 1,333) prípadov myokarditídy na 10 000 osôb viac ako u neexponovaných osôb.
V ďalšej štúdii sa v období 28 dní po podaní druhej dávky u mužov vo veku 16 – 24 rokov vyskytlo o 1,88 (95 % IS 0,956 – 2,804) prípadov myokarditídy na 10 000 osôb viac ako u neexponovaných osôb.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V a uviedli číslo šarže, ak je k dispozícii.
4.9 PredávkovanieV prípade predávkovania sa odporúča sledovanie životných funkcií a možná symptomatická liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: očkovacie látky, iné vírusové očkovacie látky, ATC kód: J07BX03
Mechanizmusúčinku Vakcíny Spikevax (elazomeran) aj Spikevax bivalent Original/Omicron BA.1 (elazomeran/imelazomeran) obsahujú mRNA zapuzdrenú v lipidových nanočasticiach. mRNA kóduje spike proteín vírusu SARS-CoV-2 v plnej dĺžke, ktorý je modifikovaný 2 substitúciami prolínom v rámci domény heptad repetície 1 (S-2P) z dôvodu stabilizácie spike proteínu do pred-fúznej konformácie. Po intramuskulárnom injekčnom podaní, bunky v mieste podania injekcie a spádové lymfatické uzliny prijmú lipidové nanočastice, čím sa sekvencia mRNA účinne dopraví do buniek s účelom translácie na vírusový proteín. Dodaná mRNA nevstupuje do bunkového jadra ani
neinteraguje s genómom, nereplikuje sa a je exprimovaná dočasne, a to najmä dendrickými bunkami a makrofágmi subkapsulárneho sínusu. Exprimovaný, na membránu viazaný spike proteín vírusu SARS-CoV-2 je následne rozpoznaný bunkami imunitného systému ako cudzí antigén. To vyvoláva odpoveď T-buniek a B-buniek, ktoré vytvárajú neutralizačné protilátky, ktoré môžu prispievať k ochrane pred ochorením COVID-19.
Klinická účinnosť
Imunogenita u dospelých – po posilňovacej dávke Spikevax bivalent Original/Omicron BA.1 (0,5 ml,
25 mikrogramov/25 mikrogramov)
Bezpečnosť, reaktogenita a imunogenita posilňovacej dávky Spikevax bivalent Original/Omicron BA.1 sa hodnotí v prebiehajúcej otvorenej štúdii fázy 2/3 u účastníkov vo veku 18 rokov a starších (mRNA-1273-P205). V tejto štúdii dostalo 437 účastníkov posilňovaciu dávku Spikevax bivalent Original/Omicron BA.1 50 mikrogramov a 377 účastníkov dostalo posilňovaciu dávku Spikevax (pôvodná) 50 mikrogramov.
Časť G štúdie P205 hodnotila bezpečnosť, reaktogenitu a imunogenitu vakcíny Spikevax bivalent Original/Omicron BA.1, keď sa podávala ako druhá posilňovacia dávka dospelým, ktorí predtým dostali 2 dávky vakcíny Spikevax (pôvodná) (100 mikrogramov) ako primárny cyklus a posilňovaciu dávku Spikevax (pôvodná) (50 mikrogramov) najmenej 3 mesiace pred zaradením do skúšania. V časti F štúdie P205 dostali účastníci Spikevax bivalent Original/Omicron BA.1 (25 mikrogramov/25 mikrogramov) ako druhú posilňovaciu dávku a skupina z časti G slúži v rámci štúdie ako nesúbežná porovnávacia skupina k skupine Spikevax bivalent Original/Omicron BA.1.
V tejto štúdii bola analýza primárnej imunogenity založená na súbore primárnej imunogenity, ktorý zahŕňa účastníkov bez dôkazov infekcie SARS-CoV-2 na začiatku (pred posilňovacou dávkou).
V primárnej analýze bol 28 dní po posilňovacej dávke zistený odhadovaný geometrický priemer titrov neutralizačných protilátok (GMT) pre pôvodný SARS-CoV-2 a zodpovedajúci 95 % IS 6 422,3
(5 990,1; 6 885,7) po posilňovacej dávke vakcínou Spikevax bivalent Original/Omicron BA.1
a 5 286,6 (4 887,1; 5 718,9) po posilňovacej dávke vakcínou Spikevax (pôvodná). Tieto GMT
vypovedajú o rozdiele v odpovedi medzi vakcínou Spikevax bivalent Original/Omicron BA.1
a vakcínou Spikevax (pôvodná) proti pôvodnému kmeňu SARS CoV-2 (D614G). GMR (97,5 % IS)
bol 1,22 (1,08; 1,37), čo spĺňalo vopred špecifikované kritériá non-inferiority (dolná hranica 97,5 %
CI ≥ 0,67).
Odhadovaný geometrický priemer titrov neutralizačných protilátok proti Omicron, BA.1 na 29. deň bol 2 479,9 (2 264,5; 2 715,8) v skupine s posilňovacou dávkou Spikevax bivalent Original/Omicron BA.1 a 1 421,2 (1 283,0; 1 574,4) v skupine s posilňovacou dávkou Spikevax (pôvodná) a GMR
(97,5 % IS) bol 1,75 (1,49; 2,04), čo spĺňalo vopred špecifikované kritérium superiority (dolná hranica
IS > 1).
Klinická účinnosť u dospelých
V randomizovanej, placebom kontrolovanej klinickej štúdii fázy 3 zaslepenej pre pozorovateľa (NCT04470427) u dospelých boli z účasti na klinickej štúdii vylúčené osoby s oslabeným imunitným systémom alebo osoby, ktoré užívali imunosupresíva v intervale 6 mesiacov pred klinickou štúdiou, ako aj tehotné účastníčky alebo osoby so známou anamnézou infekcie vírusom SARS-CoV-2. Účastníci so stabilizovaným ochorením HIV neboli vylúčení. Očkovacie látky proti chrípke sa mohli podávať 14 dní pred podaním alebo 14 dní po podaní ktorejkoľvek dávky vakcíny Spikevax (pôvodná). Účastníci museli takisto dodržať minimálny 3-mesačný interval od podania krvných
produktov/produktov plazmy alebo imunoglobulínov pred klinickou štúdiou, aby im mohlo byť podané placebo alebo vakcína Spikevax (pôvodná).
Celkovo bol sledovaný výskyt ochorenia COVID-19 u 30 351 účastníkov s mediánom 92 dní
(rozmedzie: 1 – 122 dní).
Populácia, u ktorej sa robila primárna analýza účinnosti (ďalej sa uvádza ako súbor podľa protokolu alebo PPS,
Per Protocol Set) pozostávala z 28 207 účastníkov, ktorým bola podaná buď vakcína Spikevax (pôvodná) (n = 14 134), alebo placebo (n = 14 073). Táto populácia mala negatívny východiskový status pre vírus SARS-CoV-2. Populácia PPS zahŕňala 47,4 % žien, 52,6 %
mužov, 79,5 % belochov, 9,7 % afroameričanov, 4,6 % Ázijcov a 6,2 % iných. 19,7 % účastníkov
bolo identifikovaných ako Hispáncov alebo latinskoameričanov. Medián veku účastníkov bol 53 rokov (rozmedzie 18 – 94). U účastníkov zaradených do PPS bol povolený dávkovací interval -7 až +14 dní pre podanie druhej dávky (plánovanej na 29. deň). 98 % účastníkov dostalo druhú dávku očkovacej látky 25 dní až 35 dní po prvej dávke (čo zodpovedá -3 až +7 dňom okolo času 28 dní).
Prípady ochorenia COVID-19 boli potvrdené polymerázovou reťazovou reakciou s reverznou transkripciou (RT PCR) a komisiou pre klinické posúdenie.
Celková účinnosť očkovacej látky a účinnosť podľa kľúčových vekových skupín sú uvedené v tabuľke 3.
Tabuľka 3. Analýza účinnosti vakcíny: potvrdené ochorenie COVID-19# bez ohľadu na závažnosť od 14. dňa po podaní 2. dávky – súbor podľa protokolu
Veková skupina (roky)
| Vakcína Spikevax (pôvodná)
| Placebo
|
% účinnosti vakcíny (95
% IS)*
|
Účastníci
N
|
Prípady ochore- nia COVID-
19
n
| Miera výskytu
ochorenia
COVID-1
9 na 1 000 osobo- rokov
|
Účastníci
N
|
Prípady ochore- nia COVID-
19
n
| Miera výskytu ochorenia COVID-1
9 na 1
000
osobo-
rokov
|
Celkovo
(≥ 18)
|
14 134
|
11
|
3,328
|
14 073
|
185
|
56,510
| 94,1 (89,3; 96,8)**
|
18 až < 65
|
10 551
|
7
|
2,875
|
10 521
|
156
|
64,625
| 95,6 (90,6; 97,9)
|
≥ 65
|
3 583
|
4
|
4,595
|
3 552
|
29
|
33,728
| 86,4 (61,4; 95,2)
|
≥ 65 až
< 75
|
2 953
|
4
|
5,586
|
2 864
|
22
|
31,744
| 82,4 % (48,9; 93,9)
|
≥ 75
|
630
|
0
|
0
|
688
|
7
|
41,968
| 100 % (NE, 100)
|
#COVID-19: symptomatické ochorenie COVID-19 vyžadujúce si pozitívny výsledok RT-PCR testu a najmenej 2 systémové príznaky alebo 1 respiračný príznak. Prípady vyskytujúce sa od 14. dňa po podaní 2. dávky.
*Účinnosť vakcíny a 95 % interval spoľahlivosti (IS) zo stratifikovaného Coxovho modelu proporcionálneho rizika.
**IS neupravený pre multiplicitu. Štatistické analýzy s upravenou multiplicitou boli vykonané pri predbežnej analýze u nižšieho počtu prípadov ochorenia COVID-19, ktoré sa tu neuvádzajú.
Spomedzi všetkých účastníkov v PPS neboli hlásené žiadne prípady závažného ochorenia
COVID-19 v skupine, ktorej bola podaná očkovacia látka, v porovnaní s 30 prípadmi zo 185 (16 %)
v skupine, ktorej bolo podané placebo. Z 30 účastníkov so závažným ochorením bolo
9 hospitalizovaných, z ktorých 2 boli prijatí na jednotku intenzívnej starostlivosti. Väčšina zvyšných
závažných prípadov splnila len kritérium týkajúce sa saturácie kyslíkom (SpO2) pre závažné ochorenie (≤ 93 % pri izbovom vzduchu).
Účinnosť vakcíny Spikevax (pôvodná) pri prevencii ochorenia COVID-19 bez ohľadu na predchádzajúcu infekciu vírusom SARS-CoV- 2 (zistená úvodným sérologickým testovaním
a testovaním vzoriek z nazofaryngálneho výteru) od 14. dňa po podaní 2. dávky bola 93,6 % (95 %
interval spoľahlivosti 88,6; 96,5 %).
Okrem toho, analýzy primárneho koncového ukazovateľa účinnosti v podskupinách preukázali podobné výsledky účinnosti v rámci pohlaví, etnických skupín a účastníkov so zdravotnými komorbiditami spojenými s vysokým rizikom závažného ochorenia COVID-19.
Imunogenita u dospelých – po posilňovacej dávke (0,25 ml, 50 mikrogramov)
Bezpečnosť, reaktogenita a imunogenita posilňovacej dávky vakcíny Spikevax sa hodnotia
v prebiehajúcej randomizovanej, pre pozorovateľa zaslepenej, placebom kontrolovanej štúdii fázy 2 na potvrdenie dávky u účastníkov vo veku 18 rokov a starších (NCT04405076). V tejto štúdii dostalo
198 účastníkov dve dávky (0,5 ml, 100 mikrogramov s odstupom 1 mesiaca) vakcíny Spikevax
(pôvodná) ako primárny cyklus. V otvorenej fáze dostalo 149 z týchto účastníkov (Per Protocol Set) jednu posilňovaciu dávku (0,25 ml, 50 mikrogramov) najmenej 6 mesiacov po očkovaní druhou dávkou v primárnom cykle. Ukázalo sa, že jedna posilňovacia dávka (0,25 ml, 50 mikrogramov)
viedla ku geometrickému priemernému násobnému zvýšeniu (geometric mean fold rise, GMFR) 12,99 (95 % IS: 11,04; 15,29) neutralizačných protilátok z obdobia pred posilňovacou dávkou v porovnaní
s obdobím 28 dní po posilňovacej dávke. GMFR neutralizačných protilátok bol 1,53 (95 % IS: 1,32;
1,77) pri porovnaní obdobia 28 dní po 2. dávke (primárny cyklus) s obdobím 28 dní po posilňovacej dávke.
Imunogenita posilňovacej dávky po primárnom cykle inou schválenou vakcínou proti COVID-19
u dospelých
Bezpečnosť a imunogenita heterológnej posilňovacej dávky vakcínou Spikevax sa skúmala v štúdii iniciovanom skúšajúcim so 154 účastníkmi. Minimálny časový interval medzi primárnym cyklom používajúcim vakcínu proti COVID-19 na báze vektora alebo na báze RNA a posilňovacou vakcínou Spikevax bol 12 týždňov (rozsah: 12 týždňov až 20,9 týždňov). Dávka používaná na posilnenie v tejto štúdii bola 100 mikrogramov. Titre neutralizačných protilátok merané pseudovírusovým neutralizačným testom sa hodnotili v 1. deň pred podaním a 15. deň a 29. deň po podaní posilňovacej dávky. Odpoveď na posilňovaciu dávku bola preukázaná bez ohľadu na primárne očkovanie.
Dostupné sú len krátkodobé údaje o imunogenite. Dlhodobá ochrana a imunologická pamäť nie sú v súčasnosti známe.
Bezpečnosť a imunogenita siedmich vakcín proti COVID-19 ako tretej dávky (posilňovacej dávky) vo
Veľkej Británii
COV-BOOST je multicentrická, randomizovaná štúdia fázy 2 iniciovaná skúšajúcim, skúmajúca tretiu posilňovaciu dávku očkovania proti COVID-19 s podskupinou na podrobné imunologické skúmanie. Účastníkmi boli dospelí vo veku 30 rokov a starší, v dobrom fyzickom zdraví (boli povolené mierne
až stredne závažné, dobre kontrolované komorbidity), ktorí dostali dve dávky buď vakcíny
Pfizer/BioNTech alebo Oxford/AstraZeneca (prvá dávka v decembri 2020, januári 2021 alebo
februári 2021) a v čase ich zaradenia do skúšania uplynulo najmenej 84 dní po druhej dávke. Vakcína
Spikevax posilnila protilátkové a neutralizačné odpovede a bola dobre znášaná bez ohľadu na primárny cyklus. Dávka použitá na posilnenie v tejto štúdii bola 100 mikrogramov. Titre neutralizačných protilátok merané pseudovírusovým neutralizačným testom sa hodnotili v 28. deň po posilňovacej dávke.
Neutralizačné protilátky proti B.1.617.2 (Delta) variantu pred podaním a po podaní posilňovacej
dávky u dospelých
Výsledky pseudovírusového neutralizačného testu (PsVNA) proti B.1.617.2 (Delta) variantu stanovené pred podaním posilňovacej dávky a 29. deň po podaní posilňovacej dávky ukázali, že podanie posilňovacej dávky vakcíny Spikevax (0,25 ml, 50 mikrogramov) u dospelých indukovalo
17-násobné zvýšenie neutralizačných protilátok proti Delta variantu v porovnaní s hladinami pred podaním posilňovacej dávky (GMFR = 17,28; 95 % IS: 14,38; 20,77; n = 295).
Klinická účinnosť u dospievajúcich vo veku od 12 do 17 rokov
V prebiehajúcej randomizovanej, placebom kontrolovanej klinickej štúdii fázy 2/3 zaslepenej pre pozorovateľa (NCT04649151) u dospievajúcich sa hodnotila bezpečnosť, reaktogenita a účinnosť vakcíny Spikevax (pôvodná) u dospievajúcich vo veku od 12 do 17 rokov. Účastníci so známou anamnézou infekcie vírusom SARS-CoV-2 boli z účasti na klinickej štúdii vylúčení. Celkovo bolo
3 732 účastníkov randomizovaných v pomere 2 : 1 pre podávanie 2 dávok vakcíny Spikevax alebo fyziologického roztoku ako placeba s časovým odstupom 1 mesiaca.
Sekundárna analýza účinnosti sa vykonala u 3 181 účastníkov, ktorým boli podané 2 dávky vakcíny Spikevax (pôvodná) (n = 2 139) alebo placeba (n = 1 042) a ktorí mali negatívny východiskový status SARS CoV-2 v súbore podľa protokolu. Medzi účastníkmi, ktorým bola podaná vakcína Spikevax,
a účastníkmi, ktorým bolo podané placebo, neboli žiadne významné rozdiely v demografických charakteristikách ani v už existujúcich zdravotných stavoch.
Ochorenie COVID-19 bolo definované ako symptomatické ochorenie COVID-19 potvrdené pozitívnym výsledkom RT-PCR testu a najmenej 2 systémové príznaky alebo 1 respiračný príznak. Ide o prípady od 14. dňa po druhej dávke.
V skupine s vakcínou Spikevax sa vyskytli nulové symptomatické prípady ochorenia COVID-19
a v skupine s placebom 4 symptomatické prípady ochorenia COVID-19.
Imunogenita u dospievajúcich vo veku od 12 do 17 rokov – po primárnom očkovaní očkovacou látkou
Spikevax
Analýza non-inferiority hodnotiaca 50 % neutralizačné titre SARS- CoV-2 a miery sérologickej
odpovede 28 dní po 2. dávke bola vykonaná v podskupinách na hodnotenie imunogenity podľa protokolu u dospievajúcich vo veku od 12 do 17 rokov (n = 340) v štúdii u dospievajúcich
a u účastníkov vo veku od 18 do 25 rokov (n = 296) v štúdii u dospelých. Účastníci nevykazovali na
začiatku štúdie žiaden imunologický ani virologický dôkaz o predchádzajúcej infekcii SARS- CoV-2. Pomer geometrického priemeru (geometric mean ratio, GMR) titrov neutralizačných protilátok
u dospievajúcich vo veku od 12 do 17 rokov v porovnaní s účastníkmi vo veku od 18 do 25 rokov bol
1,08 (95 % IS: 0,94; 1,24). Rozdiel v miere sérologickej odpovede bol 0,2 % (95 % IS: -1,8; 2,4). Kritériá non-inferiority (dolná hranica 95 % IS pri GMR > 0,67 a dolná hranica 95 % IS rozdielu v miere sérologickej odpovede > -10 %) boli splnené.
Imunogenita u dospievajúcich vo veku 12 až 17 rokov – po posilňovacej dávke Spikevax (pôvodnej)
Primárnym cieľom hodnotenia imunogenity posilňovacej fázy v tejto štúdii bolo vyhodnotiť
účinnosť posilňovacej dávky u účastníkov vo veku 12 až 17 rokov porovnaním imunitných odpovedí po posilňovacej dávke (29. deň) s imunitnými odpoveďami získanými po 2. dávke primárneho cyklu (57. deň) u mladých dospelých (vo veku 18 až 25 rokov) v štúdii dospelých. Účinnosť posilňovacej dávky 50 mikrogramov Spikevaxu sa vyhodnotí, ak imunitné odpovede po posilňovacej dávke (geometrický priemer koncentrácie (GMC), titre neutralizačných protilátok (nAb) a miera sérologickej odpovede (SRR)) spĺňajú vopred stanovené kritériá non-inferiority (pre GMC aj SRR) v porovnaní s odpoveďami nameranými po ukončení primárneho cyklu 100 mikrogramov Spikevaxu medzi podskupinou mladých dospelých (18 až 25 rokov) v kľúčovej štúdii účinnosti u dospelých.
V otvorenej fáze tejto štúdie dostali účastníci vo veku od 12 do 17 rokov jednu posilňovaciu dávku najmenej 5 mesiacov po ukončení primárneho cyklu (dve dávky s odstupom 1 mesiaca). Populácia na analýzu primárnej imunogenity v tejto štúdii zahŕňala 257 účastníkov pre posilňovaciu dávku a náhodnú podskupinu 295 účastníkov zo štúdie mladých dospelých (vo veku ≥ 18 až ≤ 25 rokov), ktorí predtým absolvovali primárny očkovací cyklus dvoch dávok Spikevaxu s odstupom 1 mesiaca. Obe skupiny účastníkov zaradených do analyzovanej populácie nemali pred prvou dávkou primárneho cyklu a pred posilňovacou dávkou žiadne sérologické ani virologické dôkazy o infekcii SARS-CoV-2.
Pomer geometrického priemeru (GMR) u dospievajúcich s posilňovacou dávkou na 29. deň pri GMC v porovnaní s mladými dospelými: GMR v 57. dni bol 5,1 (95 % CI: 4,5, 5,8), čo spĺňa kritériá non- inferiority (t. j. dolná hranica 95 % CI > 0,667 (1/1,5); bodový odhad ≥ 0,8); rozdiel miery sérologickej odpovede (SRR) bol 0,7 % (95 % CI: -0,8, 2,4), čo spĺňa kritériá non-inferiority (dolná hranica 95 % rozdiel miery sérologickej odpovede (SRR) > -10 %).
U 257 účastníkov bol geometrický priemer koncentrácie (GMC) titrov neutralizačných protilátok (nAb) pred podaním posilňovacej dávky (1. deň) 400,4 (95 % CI: 370,0, 433,4); v 29. dni po podaní posilňovacej dávky bol GMC 7172,0 (95 % CI: 6610,4, 7781,4). Po podaní posilňovacej dávky v 29. deň sa GMC zvýšil približne 18-násobne oproti GMC pred podaním posilňovacej dávky, čo dokazuje účinnosť posilňovacej dávky pre dospievajúcich. Miera sérologickej odpovede (SRR) bola 100 (95 % CI: 98,6, 100,0).
Predpokladané kritériá úspešnosti hodnotenia primárneho cieľa imunogenity boli splnené, čo umožnilo na základe štúdie u dospelých vyvodiť záver o účinnosti vakcíny.
Klinická účinnosť u detí vo veku od 6 rokov do 11 rokov
Pediatrická štúdia je prebiehajúca, randomizovaná, placebom kontrolovaná klinická štúdia fázy 2/3 zaslepená pre pozorovateľa na vyhodnotenie bezpečnosti, reaktogenity a účinnosti vakcíny Spikevax (pôvodná) u detí vo veku od 6 rokov do 11 rokov v USA a Kanade (NCT04796896). Účastníci so známou anamnézou infekcie vírusom SARS-CoV-2 boli z účasti na klinickej štúdii vylúčení. Celkovo
4 011 účastníkov bolo randomizovaných v pomere 3 : 1 pre podávanie 2 dávok vakcíny Spikevax
(pôvodná) alebo fyziologického roztoku ako placeba s časovým odstupom 1 mesiaca.
Sekundárna analýza účinnosti hodnotiaca potvrdené prípady COVID-19, ktoré sa nazbierali až do dátumu ukončenia zberu údajov 10. novembra 2021, sa vykonala u 3 497 účastníkov, ktorí dostali dve dávky (0,25 ml v 0. a 1. mesiaci) vakcíny Spikevax (pôvodná) (n = 2 644) alebo placebo (n = 853)
a mali negatívny východiskový status SARS-CoV-2 v súbore podľa protokolu (Per Protocol Set). Medzi účastníkmi, ktorým bola podaná vakcína Spikevax (pôvodná), a účastníkmi, ktorým bolo podané placebo, neboli žiadne významné rozdiely v demografických charakteristikách.
Ochorenie COVID-19 bolo definované ako symptomatické ochorenie COVID-19 potvrdené pozitívnym výsledkom RT-PCR testu a najmenej 2 systémovými príznakmi alebo 1 respiračným príznakom. Ide o prípady od 14. dňa po druhej dávke.
V skupine s vakcínou Spikevax (pôvodná) sa vyskytli tri prípady ochorenia COVID-19 (0,1 %)
a v skupine s placebom štyri prípady chorenia COVID-19 (0,5 %).
Imunogenita u detí vo veku od 6 do 11 rokov
Analýza hodnotiaca 50 % neutralizačné titre SARS-CoV-2 a miery sérologickej odpovede 28 dní po
2. dávke bola vykonaná v podskupine detí vo veku od 6 rokov do 11 rokov (n = 319) v pediatrickej štúdii a u účastníkov vo veku od 18 do 25 rokov (n = 295) v štúdii u dospelých. Účastníci nevykazovali na začiatku štúdie žiadny imunologický ani virologický dôkaz predchádzajúcej infekcie SARS-CoV-2. GMR titrov neutralizačných protilátok u detí vo veku od 6 rokov do 11 rokov
v porovnaní s osobami vo veku od 18 do 25 rokov bol 1,239 (95 % IS: 1,072; 1,432). Rozdiel v miere sérologickej odpovede bol 0,1 % (95 % IS: -1,9; 2,1). Kritériá non-inferiority (dolná hranica 95 % IS pri GMR > 0,67 a dolná hranica 95 % IS rozdielu v miere sérologickej odpovede > -10 %) boli splnené.
Imunogenita u detí vo veku od 6 do 11 rokov – po posilňovacej dávke Spikevax (pôvodnej) Primárnym cieľom hodnotenia imunogenity posilňovacej fázy v tejto štúdii bolo vyhodnotiť účinnosť posilňovacej dávky u účastníkov vo veku 6 rokov až 11 rokov porovnaním imunitných odpovedí po posilňovacej dávke (29. deň) s imunitnými odpoveďami získanými po 2. dávke primárneho cyklu (57. deň) u mladých dospelých (vo veku 18 až 25 rokov) v tejto štúdii, v ktorej sa
preukázala 93 % účinnosť. Účinnosť posilňovacej dávky 25 mikrogramov Spikevaxu sa odvodzuje, ak imunitné odpovede po podaní posilňovacej dávky (geometrická priemerná koncentrácia (GMC)
neutralizačných protilátok (nAb) a miera sérologickej odpovede (SRR)) spĺňajú vopred stanovené kritériá non-inferiority (pre GMC aj SRR) v porovnaní s odpoveďami nameranými po ukončení primárneho cyklu 100 mikrogramov Spikevaxu medzi podskupinou mladých dospelých (18 až 25 rokov) v kľúčovej štúdii účinnosti u dospelých.
V otvorenej fáze tejto štúdie dostali účastníci vo veku od 6 do 11 rokov jednu posilňovaciu dávku najmenej 6 mesiacov po ukončení primárneho cyklu (dve dávky s odstupom 1 mesiaca). Populácia na analýzu primárnej imunogenity zahŕňala 95 účastníkov s posilňovacou dávkou vo veku 6 až 11 rokov a náhodnú podskupinu 295 účastníkov zo štúdie mladých dospelých, ktorí dostali dve dávky
Spikevaxu s odstupom 1 mesiaca. Obe skupiny účastníkov zaradených do populácie na analýzu nemali
pred prvou dávkou primárneho cyklu a pred posilňovacou dávkou žiadne sérologické alebo virologické dôkazy o infekcii SARS-CoV-2.
U 95 účastníkov bola v 29. deň podania posilňovacej dávky hodnota geometrického priemeru koncentrácie (GMC) 5847,5 (95 % CI: 4999,6, 6839,1). Miera sérologickej odpovede SRR bola 100 (95 % CI: 95,9, 100,0). Skúmali sa sérové hladiny titrov neutralizačných protilátok (nAb) u detí vo veku 6 až 11 rokov v podskupine imunogenity Per Protocol s negatívnym stavom pred podaním posilňovacej dávky SARS-CoV-2 a porovnanie s hladinami u mladých dospelých (18 až 25 rokov). Pomer geometrického priemeru (GMR) pri GMC s posilňovacou dávkou na 29. deň v porovnaní s GMC u mladých dospelých v 57. dni bol 4,2 (95 % CI: 3,5, 5,0), čo spĺňa kritériá non-inferiority (t. j. dolná hranica 95 % CI > 0,667); rozdiel SRR bol 0,7 % (95 % CI: -3,5, 2,4), čo spĺňa kritériá non- inferiority (dolná hranica 95 % rozdielu v miere sérologickej odpovede SRR > -10 %).
Predpokladané vopred stanovené kritériá úspešnosti pre primárny cieľ imunogenity boli splnené, čo umožnilo vyvodiť záver o účinnosti posilňovacej dávky vakcíny. Rýchla reakcia na odpoveď očkovacej látky, ktorá sa prejavila do 4 týždňov od podania posilňovacej dávky, je dôkazom silného prvotného očkovania vyvolaného primárnym cyklom Spikevaxu.
Neutralizačné protilátky proti B.1.617.2 (Delta) variantu u detí vo veku od 6 rokov do 11 rokov Vzorky séra podskupín na hodnotenie imunogenity podľa protokolu (n = 134) prebiehajúcej pediatrickej štúdie získané na začiatku štúdie a v 57. deň sa testovali použitím PsVNA na základe B.1.617.2 (Delta) variantu. U detí vo veku od 6 rokov do 11 rokov bol GMFR od začiatku štúdie po
57. deň 81,77 (95 % IS: 70,38; 95,00) pre Delta variant (meraný PsVNA). Okrem toho 99,3 % detí
splnilo definíciu sérologickej odpovede.
Klinická účinnosť u detí vo veku od 6 mesiacov do 5 rokov
Prebiehajúca štúdia fázy 2/3 sa uskutočnila s cieľom vyhodnotiť bezpečnosť, znášanlivosť,
reaktogenitu a účinnosť vakcíny Spikevax u zdravých detí vo veku od 6 mesiacov do 11 rokov. Do štúdie boli zaradené deti v 3 vekových skupinách: od 6 rokov do 11 rokov; od 2 rokov do 5 rokov; a od 6 mesiacov do 23 mesiacov.
U 5 476 účastníkov vo veku od 6 mesiacov do 5 rokov, ktorí dostali dve dávky (v 0. a 1. mesiaci) vakcíny Spikevax (n = 4 105) alebo placebo (n = 1 371) a mali negatívny východiskový status SARS- CoV-2 v súbore na hodnotenie účinnosti podľa protokolu (Per Protocol Set for Efficacy), sa vykonala deskriptívna analýza účinnosti hodnotiaca potvrdené prípady COVID-19 získané do dátumu ukončenia získavania údajov 21. februára 2022. Medzi účastníkmi, ktorým bola podaná vakcína Spikevax, a účastníkmi, ktorým bolo podané placebo, neboli žiadne významné rozdiely v demografických charakteristikách.
Medián dĺžky sledovania účinnosti po 2. dávke bol 71 dní u účastníkov vo veku od 2 rokov do 5 rokov a 68 dní u účastníkov vo veku od 6 mesiacov do 23 mesiacov.
Účinnosť vakcíny v tejto štúdii bola pozorovaná v období, keď v obehu prevažujúcim variantom bol variant B.1.1.529 (Omicron).
Účinnosť vakcíny v 2. časti pre súbor na hodnotenie účinnosti podľa protokolu pre prípady COVID-19
14 dní alebo viac po 2. dávke s použitím „definície prípadu COVID-19 P301“ (t. j. definície použitej v kľúčovej štúdii účinnosti u dospelých) bola 36,8 % (95 % IS: 12,5, 54,0) pre deti od 2 rokov do 5 rokov a 50,6 % (95 % IS: 21,4, 68,6) pre deti vo veku od 6 mesiacov do 23 mesiacov.
Imunogenita u detí vo veku od 6 mesiacov do 5 rokovV prípade detí vo veku od 2 rokov do 5 rokov porovnanie odpovedí nAb (neutralizačnými protilátkami) z 57. dňa v tejto časti 2, v podskupine imunogenity podľa protokolu (n = 264;
25 mikrogramov) s odpoveďami mladých dospelých (n = 295; 100 mikrogramov) preukázalo GMR
1,014 (95 % IS: 0,881, 1,167), čo spĺňa kritériá non-inferiority (t. j. dolná hranica 95 % IS pre
GMR ≥ 0,67; bodový odhad ≥ 0,8). Geometrické priemerné násobné zvýšenie (geometric mean fold rise, GMFR) od východiskovej hodnoty do 57. dňa u týchto detí bol 183,3 (95 % IS: 164,03, 204,91). Rozdiel v miere sérologickej odpovede (SRR) medzi deťmi a mladými dospelými bol -0,4 %
(95 % IS: -2,7 %, 1,5 %), čo tiež spĺňa kritériá non-inferiority (dolná hranica 95 % IS rozdielu
SRR > -10 %).
V prípade dojčiat a batoliat vo veku od 6 mesiacov do 23 mesiacov sa porovnaním odpovedí neutralizačnými protilátkami z 57. dňa v tejto časti 2, v podskupine na hodnotenie imunogenity podľa protokolu (n = 230; 25 mikrogramov) s odpoveďami mladých dospelých (n = 295; 100 mikrogramov) preukázal GMR 1,280 (95 % IS: 1,115, 1,470), čo spĺňa kritériá non-inferiority (t. j. dolná hranica
95 % IS pre GMR ≥ 0,67; bodový odhad ≥ 0,8). Rozdiel v miere SRR medzi dojčatami/batoľatami a mladými dospelými bol 0,7 % (95 % IS: -1,0 %, 2,5 %), čo tiež spĺňa kritériá non-inferiority (dolná hranica 95 % IS rozdielu v miere sérologickej odpovede > -10 %).
V súlade s tým boli vopred stanovené kritériá úspešnosti pre primárny cieľ imunogenity splnené pre obe vekové skupiny, čo umožnilo vyvodiť účinnosť 25 mikrogramov u detí vo veku od 2 rokov do
5 rokov a u dojčiat a batoliat vo veku od 6 mesiacov do 23 mesiacov (tabuľky 4 a 5).
Tabuľka 4. Zhrnutie pomeru geometrického priemeru koncentrácie a miery sérologickej odpovede – porovnanie osôb vo veku od 6 mesiacov do 23 mesiacov s účastníkmi vo veku od18 rokov do 25 rokov – súbor na hodnotenie imunogenity podľa protokolu
| od 6 mesiacov do
23 mesiacov
n = 230
| od 18 rokov do
25 rokov
n = 291
| od 6 mesiacov do
23 mesiacov/
od 18 rokov do 25 rokov
|
Test
| Časový
| GMC (95 % IS)*
| GMC (95 % IS)*
| Pomer GMC
| Splnený cieľ
|
| bod
|
|
| (95 % IS)a
| non-
|
| inferiority
(Á/N)b
|
SARS-CoV-2 neutralizačný testc
|
28 dní po
2. dávke
| 1 780,7
(1 606,4; 1 973,8)
| 1 390,8
(1 269,1; 1 524,2)
| 1,3 (1,1; 1,5)
|
Á
|
Sérologická odpoveď
% (95 % IS)d
|
Sérologická odpoveď
% (95 % IS)d
|
Rozdiel v miere sérologickej odpovede % (95 % IS)e
|
100 (98,4; 100)
| 99,3 (97,5; 99,9)
| 0,7
(-1,0; 2,5)
|
GMC = geometrický priemer koncentrácie
n = počet účastníkov s nechýbajúcimi údajmi na začiatku a v 57. deň
* Hodnoty protilátok uvádzané ako hodnoty pod dolnou hranicou stanovenia (LLOQ) sa nahrádzajú hodnotou 0,5 x LLOQ. Hodnoty vyššie ako horná hranica stanovenia (ULOQ) sa nahradia hodnotou ULOQ, ak nie sú k dispozícii skutočné hodnoty.
a Hladiny protilátok po logaritmickej transformácii sa analyzujú pomocou modelu analýzy kovariancie (ANCOVA) s premennou skupiny (účastníci vo veku od 6 mesiacov do 5 rokov a mladí dospelí) ako fixným efektom. Výsledné stredné hodnoty LS, rozdiel stredných hodnôt LS a 95 % IS sú na účely prezentácie spätne transformované na pôvodnú stupnicu.
b Non-inferiorita sa vyhlási, ak dolná hranica 2-stranného 95 % IS pre pomer GMC je väčšia ako 0,67 s bodovým odhadom > 0,8 a dolná hranica 2-stranného 95 % IS pre rozdiel v miere sérologickej odpovede je väčšia ako -10 % s bodovým odhadom > 5 %.
c Konečné geometrické priemery koncentrácie protilátok (GMC) v AU/ml boli stanovené pomocou
mikronutralizačného testu SARS-CoV-2.
d Sérologická odpoveď v dôsledku očkovania špecifického pre SARS-CoV-2 RVP koncentrácia neutralizačných protilátok na úrovni subjektu je v protokole definovaná ako zmena z hodnoty pod LLOQ na hodnotu rovnú alebo vyššiu ako 4 x LLOQ, alebo aspoň 4-násobné zvýšenie, ak je východisková hodnota rovná alebo vyššia ako LLOQ. Sérologická odpoveď 95 % IS sa vypočíta pomocou Clopperovej-Pearsonovej metódy.
e Rozdiel v miere sérologickej odpovede 95 % IS je vypočítaný pomocou Miettinen-Nurminenových (skóre)
hraníc spoľahlivosti.
Tabuľka 5. Zhrnutie pomeru geometrického priemeru koncentrácií a miery sérologických odpovedí – porovnanie osôb vo veku od 2 rokov do 5 rokov s účastníkmi vo veku od 18 do25 rokov – súbor na hodnotenie imunogenity podľa protokolu
| od 2 rokov do
5 rokov
n = 264
| od 18 rokov do
25 rokov
n = 291
| od 2 rokov d 5 rokov/
od 18 rokov do 25 rokov
|
Test
| Časový bod
| GMC
(95 % IS)*
| GMC (95 % IS)*
| Pomer GMC (95% IS)a
| Splnený cieľ non-inferiority (Á/N)b
|
SARS-CoV-2 neutralizačný testc
|
28 dní po
2. dávke
| 1 410,0
(1 273,8; 1 560,8)
| 1 390,8
(1 262,5; 1 532,1)
| 1,0 (0,9; 1,2)
|
Á
|
Sérologická odpoveď
%
(95 % IS)d
|
Sérologická odpoveď
%
(95 % IS)d
|
Rozdiel v miere sérologickej odpovede % (95 % IS)e
|
98,9 (96,7; 99,8)
| 99,3 (97,5; 99,9)
| -0,4
(-2,7; 1,5)
|
GMC = geometrický priemer koncentrácie
n = počet účastníkov s nechýbajúcimi údajmi na začiatku a v 57. deň
* Hodnoty protilátok uvádzané ako hodnoty pod dolnou hranicou stanovenia (LLOQ) sa nahrádzajú hodnotou 0,5 x LLOQ. Hodnoty vyššie ako horná hranica stanovenia (ULOQ) sa nahradia hodnotou ULOQ, ak nie sú k dispozícii skutočné hodnoty.
a Hladiny protilátok po logaritmickej transformácii sa analyzujú pomocou modelu analýzy kovariancie (ANCOVA) s premennou skupiny (účastníci vo veku od 6 mesiacov do 5 rokov a mladí dospelí) ako fixným efektom. Výsledné stredné hodnoty LS, rozdiel stredných hodnôt LS a 95 % IS sú na účely prezentácie spätne transformované na pôvodnú stupnicu.
b Non-inferiorita sa vyhlási, ak dolná hranica 2-stranného 95 % IS pre pomer GMC je väčšia ako 0,67
s bodovým odhadom > 0,8 a dolná hranica 2-stranného 95 % IS pre rozdiel v miere sérologickej odpovede je väčšia ako -10 % s bodovým odhadom > 5 %.
c Konečné geometrické priemery koncentrácie protilátok (GMC) v AU/ml boli stanovené pomocou mikronutralizačného testu SARS-CoV-2.
d Sérologická odpoveď v dôsledku očkovania špecifického pre SARS-CoV-2 RVP koncentrácia
neutralizačných protilátok na úrovni subjektu je v protokole definovaná ako zmena z hodnoty pod LLOQ na hodnotu rovnú alebo vyššiu ako 4 x LLOQ, alebo aspoň 4-násobné zvýšenie, ak je východisková hodnota rovná alebo vyššia ako LLOQ. Sérologická odpoveď 95 % IS sa vypočíta pomocou Clopperovej-Pearsonovej metódy.
e Rozdiel v miere sérologickej odpovede 95 % IS je vypočítaný pomocou Miettinen-Nurminenových (skóre)
hraníc spoľahlivosti.
S
t
ar
ši
e osoby
Vakcína Spikevax (pôvodná) bola hodnotená u osôb vo veku 6 mesiacov a starších
vrátane 3 768 účastníkov vo veku 65 rokov a starších. Účinnosť vakcíny Spikevax (pôvodná)
u starších osôb (≥ 65 rokov) zodpovedala účinnosti u mladších dospelých účastníkov (18 – 64 rokov).
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s vakcínou Spikevax
(pôvodná) v jednej alebo vo viacerých podskupinách pediatrickej populácie na prevenciu
COVID-19 (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Neaplikovateľné.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých štúdií toxicity po opakovanom podávaní a reprodukčnej a vývinovej toxicity neodhalili žiadne osobitné riziko pre ľudí.
Celková toxicita
Štúdie celkovej toxicity sa uskutočnili na potkanoch (intramuskulárne podané až do 4 dávok viac než
dávka u ľudí raz za 2 týždne). Pozoroval sa prechodný a reverzibilný edém a erytém v mieste podania injekcie, a prechodné a reverzibilné zmeny vo výsledkoch laboratórnych testov (vrátane zvýšených hodnôt eozinofilov, aktivovaného parciálneho tromboplastínového času a fibrinogénu). Výsledky naznačujú, že riziko toxicity u ľudí je nízke.
Genotoxicita/karcinogenita
In vitro a in vivo štúdie genotoxicity sa vykonali v prípade novej lipidovej zložky SM-102 vakcíny.
Výsledky naznačujú nízky potenciál genotoxicity u ľudí. Neboli vykonané štúdie karcinogenity.
Reprodukčná toxicita
V štúdii vývinovej toxicity sa 0,2 ml forma očkovacej látky obsahujúca rovnaké množstvo mRNA
(100 mikrogramov) a ďalšie zložky ako jednorazová dávka vakcíny Spikevax (pôvodná) podávaná
u ľudí podávala samiciam potkanov intramuskulárnou cestou štyrikrát: 28 a 14 dní pred párením a v 1.
a 13. gestačný deň. Imunitná odpoveď prostredníctvom protilátok proti SARS-CoV-2 sa vyskytla u zvierat-matiek pred párením až do konca štúdie v 21. dni laktácie, ako aj u plodov a potomkov. Nevyskytli sa žiadne nežiaduce účinky na samičiu fertilitu, graviditu, embryofetálny, postnatálny vývoj alebo vývoj mláďat súvisiace s očkovacou látkou. K dispozícii nie sú žiadne údaje o prechode vakcíny Spikevax (pôvodná) cez placentu alebo o jej vylučovaní do mlieka.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
SM-102 (heptadekán-9-yl 8-{(2-hydroxyetyl)[6-oxo-6-(undecyloxy)hexyl]amino}oktanoát)
cholesterol
1,2-distearoyl-sn-glycero-3-fosfocholín (DSPC)
1,2-dimyristoyl-rac-glycero-3-metoxypolyetylénglykol-2000 (PEG2000-DMG)
trometamol trometamólium-chlorid
kyselina octová
octan sodný, trihydrát sacharóza
voda na injekcie
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi ani riediť.
6.3 Čas použiteľnosti
Neotvorenáviacdávkováinjekčnáliekovka(SpikevaxbivalentOriginal/OmicronBA.1(50mikrogramov/50mikrogramov)/mlinjekčnádisperzia)
9 mesiacov pri teplote -50 °C až -15 °C.
V rámci 9-mesačného obdobia sa môže neotvorená injekčná liekovka s vakcínou po vybratí z mrazničky uchovávať v chladničke pri teplote 2 °C až 8 °C, chránená pred svetlom, maximálne po dobu 30 dní. V rámci tohto obdobia sa injekčné liekovky môžu prepravovať najviac 12 hodín pri teplote 2 °C až 8 °C (pozri časť 6.4).
Chemická a fyzikálna stabilita bola tiež preukázaná pre neotvorené injekčné liekovky s vakcínou pri uchovávaní po dobu 12 mesiacov pri teplote -50 °C až -15 °C pod podmienkou, že po rozmrazení a uchovávaní pri teplote 2 °C až 8 °C, chránená pred svetlom, sa neotvorená injekčná liekovka
použije do maximálne 14 dní (namiesto 30 dní, ak sa uchováva pri teplote -50 ºC až -15 ºC po dobu
9 mesiacov) a celkový čas uchovávania nepresiahne 12 mesiacov. Po rozmrazení sa vakcína nesmie znovu zmrazovať.
Neotvorená vakcína sa môže uchovávať po vybratí z chladničky po dobu maximálne 24 hodín pri
teplote 8 °C až 25 °C.
Prepichnutáviacdávkováinjekčnáliekovka(SpikevaxbivalentOriginal/OmicronBA.1(50mikrogramov/50mikrogramov)/mlinjekčnádisperzia)
Chemická a fyzikálna stabilita počas používania bola preukázaná počas 19 hodín pri teplote 2 °C až
25 °C po prvom prepichnutí (v rámci povoleného času použiteľnosti 30 dní, respektíve 14 dní pri
teplote 2 °C až 8 °C a vrátane 24 hodín pri teplote 8 °C až 25 °C). Z mikrobiologického hľadiska sa má liek použiť okamžite. Ak sa vakcína nepoužije okamžite, za čas použiteľnosti a podmienky uchovávania počas používania zodpovedá používateľ.
Neotvorenájednodávkováinjekčnáliekovka(SpikevaxbivalentOriginal/OmicronBA.1
25 mikrogramov/25 mikrogramov injekčná disperzia)
9 mesiacov pri teplote -50 °C až -15 ºC.
V rámci 9-mesačného obdobia sa môžu jednodávkové injekčné liekovky po vybratí z mrazničky uchovávať v chladničke pri teplote 2 °C až 8 °C, chránené pred svetlom, maximálne po dobu 30 dní. V rámci tohto obdobia sa jednodávkové injekčné liekovky môžu prepravovať najviac 12 hodín pri
teplote 2 °C až 8 °C (pozri časť 6.4).
Chemická a fyzikálna stabilita bola tiež preukázaná pre neotvorené jednodávkové injekčné liekovky pri uchovávaní po dobu 12 mesiacov pri teplote -50 °C až -15 °C pod podmienkou, že po rozmrazení a uchovávaní pri teplote 2 °C až 8 °C sa neotvorená jednodávková injekčná
liekovka, chránená pred svetlom, použije do maximálne 14 dní (namiesto 30 dní, ak sa uchováva pri
teplote -50 ºC až -15 ºC po dobu 9 mesiacov) a celkový čas uchovávania nepresiahne 12 mesiacov. Po rozmrazení sa vakcína nesmie znovu zmrazovať.
Jednodávkové injekčné liekovky sa môžu uchovávať po vybratí z chladničky po dobu maximálne
24 hodín pri teplote 8 °C až 25 °C.
SpikevaxbivalentOriginal/OmicronBA.125mikrogramov/25mikrogramovinjekčnádisperziavnaplnenejinjekčnejstriekačke
9 mesiacov pri teplote -50 °C až -15 °C.
V rámci 9-mesačného obdobia sa môžu naplnené injekčné striekačky po vybratí z mrazničky uchovávať v chladničke pri teplote 2 °C až 8 °C, chránené pred svetlom, maximálne po dobu 30 dní (pozri časť 6.4).
Chemická a fyzikálna stabilita bola tiež preukázaná pre neotvorené naplnené injekčné striekačky pri uchovávaní po dobu 12 mesiacov pri teplote -50 °C až -15 °C pod podmienkou, že po rozmrazení
a uchovávaní pri teplote 2 °C až 8 °C sa neotvorená naplnená injekčná striekačka, chránená pred svetlom, použije do maximálne 14 dní (namiesto 30 dní, ak sa uchováva pri teplote -50 ºC až -15 ºC po dobu 9 mesiacov) a celkový čas uchovávania nepresiahne 12 mesiacov.
Po rozmrazení sa vakcína nesmie znovu zmrazovať.
Naplnené injekčné striekačky sa môžu uchovávať po vybratí z chladničky po dobu maximálne
24 hodín pri teplote 8 °C až 25 °C.
6.4 Špeciálne upozornenia na uchovávanie
SpikevaxbivalentOriginal/OmicronBA.1(50mikrogramov/50mikrogramov)/mlinjekčnádisperzia
(viacdávkové injekčné liekovky)
Uchovávajte v mrazničke pri teplote od -50 °C do -15 °C.
Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom. Podmienky uchovávania po rozmrazení a prvom otvorení, pozri časť 6.3.
Podmienky uchovávania viacdávkovej injekčnej liekovky po prvom otvorení sú uvedené v časti 6.3.
Preprava rozmrazených viacdávkových injekčných liekoviek v tekutom stave pri teplote 2 °C až 8 °C Ak nie je možná preprava pri teplote -50 °C až -15 °C, podľa dostupných údajov je možná preprava jednej alebo viacerých rozmrazených injekčných liekoviek v tekutom stave trvajúca najviac 12 hodín pri teplote 2 °C až 8 °C (v rámci času použiteľnosti 30 dní, respektíve 14 dní pri teplote 2 °C až 8 °C). Po rozmrazení a preprave v tekutom stave pri teplote 2 °C až 8 °C sa injekčné liekovky nemajú znovu zmrazovať a až do použitia sa majú uchovávať pri teplote 2 °C až 8 °C.
SpikevaxbivalentOriginal/OmicronBA.125mikrogramov/25mikrogramovinjekčnádisperzia
(jednodávkové injekčné liekovky)
Uchovávajte v mrazničke pri teplote -50 ºC to -15 ºC.
Jednodávkovú injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom. Podmienky uchovávania po rozmrazení nájdete v časti 6.3.
Preprava jednodávkových injekčných liekoviek v tekutom stave pri teplote 2 °C až 8 °C
Ak nie je možná preprava pri teplote -50 °C až -15 °C, podľa dostupných údajov je možná preprava
jednej alebo viacerých rozmrazených jednodávkových injekčných liekoviek v tekutom stave pri teplote 2 °C až 8 °C (v rámci času použiteľnosti 30 dní, respektíve 14 dní pri teplote 2 °C až 8 °C). Po rozmrazení a preprave v tekutom stave pri teplote 2 °C až 8 °C sa jednodávkové injekčné liekovky nemajú znovu zmrazovať a až do použitia sa majú uchovávať pri teplote 2 °C až 8 °C.
SpikevaxbivalentOriginal/OmicronBA.125mikrogramov/25mikrogramovinjekčnádisperziavnaplnenejinjekčnejstriekačke
Uchovávajte v mrazničke pri teplote -50 °C až -15 °C.
Naplnenú injekčnú striekačku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky uchovávania po rozmrazení nájdete v časti 6.3.
Preprava rozmrazených naplnených injekčných striekačiek v tekutom stave pri teplote 2 °C až 8 °C Ak nie je možná preprava pri teplote -50 °C až -15 °C, podľa dostupných údajov je možná preprava jednej alebo viacerých rozmrazených naplnených injekčných striekačiek v tekutom stave pri teplote
2 °C až 8 °C (v rámci času použiteľnosti 30 dní, respektíve 14 dní pri teplote 2 °C až 8 °C). Po rozmrazení a preprave v tekutom stave pri teplote 2 °C až 8 °C sa naplnené injekčné striekačky nemajú znovu zmrazovať a až do použitia sa majú uchovávať pri teplote 2 °C až 8 °C.
6.5 Druh obalu a obsah balenia
SpikevaxbivalentOriginal/OmicronBA.1(50mikrogramov/50mikrogramov)/mlinjekčnádisperzia
(viacdávkové injekčné liekovky)
2,5 ml alebo 5 ml disperzie vo viacdávkovej injekčnej liekovke (sklo typu 1 alebo ekvivalent skla
typu 1 alebo cyklický olefínový polymér s vnútornou bariérovou vrstvou) so zátkou (chlórbutylová guma) a modrým odklápacím plastovým viečkom s uzáverom (hliníkový uzáver).
Veľkosť balenia:
10 viacdávkových injekčných liekoviek. Každá injekčná liekovka obsahuje 2,5 ml.
10 viacdávkových injekčných liekoviek. Každá injekčná liekovka obsahuje 5 ml. Na trh nemusia byť uvedené všetky veľkosti balenia.
SpikevaxbivalentOriginal/OmicronBA.125mikrogramov/25mikrogramovinjekčnádisperzia
(jednodávkové injekčné liekovky)
0,5 ml disperzie v jednodávkovej injekčnej liekovke (sklo typu 1 alebo ekvivalent skla typu 1) so
zátkou (chlórbutylová guma) a modrým odklápacím plastovým viečkom s uzáverom (hliníkový uzáver).
Veľkosť balenia: 10 jednodávkových injekčných liekoviek. Každá injekčná liekovka obsahuje 0,5 ml. SpikevaxbivalentOriginal/OmicronBA.125mikrogramov/25mikrogramovinjekčnádisperzia
v naplnenej injekčnej striekačke
0,5 ml disperzie v naplnenej injekčnej striekačke (z cyklického olefínového polyméru) s piestovou
zátkou (potiahnutá brómbutylovou gumou) a hrotovým uzáverom (brómbutylová guma, bez ihly).
Naplnené injekčné striekačky sú balené v 5 priehľadných blistroch, z ktorých každý obsahuje
2 naplnené injekčné striekačky.
Veľkosť balenia: 10 naplnených injekčných striekačiek. Každá naplnená injekčná striekačka obsahuje 0,5 ml.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Túto vakcínu má pripravovať a podávať vyškolený zdravotnícky pracovník aseptickým postupom na zabezpečenie sterility disperzie.
Injekčné liekovky a naplnené injekčné striekačky sa skladujú zmrazené pri teplote -50 °C až -15 °C. SpikevaxbivalentOriginal/OmicronBA.1(50mikrogramov/50mikrogramov)/mlinjekčnádisperzia
(
viacdávkové injekčné liekovky)Po rozmrazení je vakcína pripravená na podanie.
Nepretrepávajte ani nerieďte. Obsah injekčnej liekovky krúživým pohybom opatrne premiešajte po rozmrazení a pred každým odobratím dávky.
Ubezpečte sa, že injekčná liekovka má modré odklápacie viečko a že názov lieku je Spikevax bivalent
Original/Omicron BA.1. Ak má injekčná liekovka modré odklápacie viečko a názov lieku je Spikevax
0,1 mg/ml alebo Spikevax bivalent Original/Omicron BA.4-5, pozrite si Súhrn charakteristických
vlastností lieku pre ten liek.
Zátku prepichnite podľa možností vždy na inom mieste. Neprepichujte injekčnú liekovku viac ako 20-
krát.
V každej viacdávkovej injekčnej liekovke je určitý objem navyše, aby sa zabezpečilo, že možno odobrať 5 dávok alebo 10 dávok po 0,5 ml, alebo 10 alebo 20 dávok po 0,25 ml, v závislosti od veľkosti liekovky.
Pred použitím rozmrazte každú viacdávkovú injekčnú liekovku podľa nižšie uvedených pokynov (Tabuľka 6). Po rozmrazení injekčnej liekovky v chladničke ju pred podaním nechajte 15 minút stáť pri izbovej teplote.
Tabuľka 6. Pokyny na rozmrazovanie viacdávkových injekčných liekoviek pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke)
|
Trvanie rozmrazova nia
| Teplota
rozmrazovani a (pri izbovej teplote)
|
Trvanie rozmrazovania
|
Viacdávková injekčná
liekovka
|
2 °C – 8 °C
| 2 hodiny a 30
minút
|
15 °C – 25 °C
|
1 hodina
|
 SpikevaxbivalentOriginal/OmicronBA.125mikrogramov/25mikrogramovinjekčnádisperzia(jednodávkovéinjekčnéliekovky)
SpikevaxbivalentOriginal/OmicronBA.125mikrogramov/25mikrogramovinjekčnádisperzia(jednodávkovéinjekčnéliekovky)
Po rozmrazení je vakcína pripravená na podanie.
Nepretrepávajte ani nerieďte. Obsah injekčnej liekovky krúživým pohybom opatrne premiešajte po rozmrazení a pred každým odobratím dávky.
Ubezpečte sa, že injekčná liekovka má modré odklápacie viečko a že názov lieku je Spikevax bivalent Original/Omicron BA.1. Ak má injekčná liekovka modré odklápacie viečko a názov lieku je Spikevax bivalent Original/Omicron BA.4-5, pozrite si Súhrn charakteristických vlastností lieku pre ten liek.
Rozmrazte každú jednotlivú dávku podľa dole uvedených pokynov. Každá jednodávková injekčná liekovka alebo vonkajší obal obsahujúci 10 injekčných liekoviek sa môže rozmraziť, buď
v chladničke, alebo pri izbovej teplote (Tabuľka 7). Po rozmrazení injekčnej liekovky v chladničke ju
pred podaním nechajte 15 minút stáť pri izbovej teplote.
Tabuľka 7. Pokyny na rozmrazovanie jednodávkových injekčných liekoviek a vonkajšieho obalu pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke) (°C)
|
Trvanie rozmrazovania (minúty)
| Teplota
rozmrazovani
a
(pri izbovej teplote) (°C)
|
Trvanie rozmrazovania (minúty)
|
Jednodávková injekčná liekovka
|
2 – 8
|
45
|
15 – 25
|
15
|
Vonkajší obal
| 2 – 8
| 1 hodina a 45 minút
| 15 – 25
| 45
|
Ak sa injekčné liekovky rozmrazujú pri teplote 2 až 8 °C, má sa pred podaním jednotlivá injekčná
liekovka ponechať približne 15 minút pri izbovej teplote (15 °C až 25 °C).
PodávanieVakcína sa musí podávať intramuskulárne. Uprednostňovaným miestom je deltový sval ramena.
Nepodávajte túto vakcínu intravaskulárne, subkutánne ani intradermálne.
Viacdávkové injekčné liekovky
S
pikevax
bivalent
O
r
i
ginal/Omicron
B
A
.
1
25
mi
krogramov/25
mi
krogramov
i
njekčná
disperzia
v
naplnenej
injekčnej
striekačke
Nepretrepávajte ani nerieďte obsah naplnenej injekčnej striekačky.
Každá naplnená injekčná striekačka je len na jednorazové použitie. Po rozmrazení je vakcína pripravená na použitie.
Z každej naplnenej injekčnej striekačky sa môže podať jedna (1) dávka 0,5 ml.
Vakcína Spikevax bivalent Original/Omicron BA.1 sa dodáva ako jednodávková, naplnená injekčná striekačka (bez ihly) obsahujúca 0,5 ml (25 mikrogramov elazomeranu a 25 mikrogramov imelazomeranu) mRNA a musí sa pred podaním rozmraziť.
Pred použitím každú naplnenú injekčnú striekačku rozmrazte podľa nasledujúcich pokynov. Injekčné striekačky sa môžu rozmrazovať v blistrových baleniach (každý blister obsahuje 2 naplnené injekčné striekačky) alebo vo svojom vonkajšom obale, buď v chladničke, alebo pri izbovej teplote
(Tabuľka 8). Po rozmrazení injekčnej liekovky v chladničke ju pred podaním nechajte 15 minút stáť pri izbovej teplote.
Tabuľka 8. Pokyny na rozmrazovanie vakcíny Spikevax bivalent Original/Omicron BA.1naplnené injekčné striekačky a vonkajších obalov pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke) (°C)
| Trvanie rozmrazov ania (minúty)
| Teplota rozmrazovani a (pri izbovej teplote) (°C)
|
Trvanie rozmrazovania (minúty)
|
Naplnená injekčná striekačka v blistrovom obale
|
2 – 8
|
55
|
15 – 25
|
45
|
Vonkajší obal
| 2 – 8
| 155
| 15 – 25
| 140
|
Ubezpečte sa, že názov lieku v naplnenej injekčnej striekačke je Spikevax bivalent Original/Omicron
BA.1. Ak je názov lieku Spikevax 50 mikrogramov alebo Spikevax bivalent Original/Omicron BA.4-
5, pozrite si Súhrn charakteristických vlastností lieku pre ten liek.
Návod na zaobchádzanie s naplnenými injekčnými striekačkami Spikevax bivalent Original/OmicronBA.1• Pred podaním nechajte každú naplnenú injekčnú striekačku stáť 15 minút pri izbovej teplote
(15 °C až 25 °C).
• Nepretrepávajte.
• Naplnená injekčná striekačka sa musí pred podaním vizuálne skontrolovať na prítomnosť častíc a zmenu farby.
• Vakcína Spikevax bivalent Original/Omicron BA.1 je biela až sivobiela disperzia. Môže obsahovať biele alebo priehľadné častice, ktoré sú súčasťou produktu. Vakcínu nepodávajte, ak má zmenenú farbu alebo obsahuje iné častice.
• Balenia s naplnenými injekčnými striekačkami neobsahujú ihly.
• Použite sterilnú ihlu vhodnej veľkosti na intramuskulárnu injekciu (21G alebo tenšie ihly).
• Odstráňte uzáver hrotu z injekčnej striekačky otáčaním proti smeru hodinových ručičiek.
• Ihlu pripojte na striekačku tak, že ju otáčate v smere hodinových ručičiek, kým nedrží pevne.
• Keď ste pripravený na podanie, odstráňte kryt ihly.
• Celú dávku podajte intramuskulárne.
LikvidáciaVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMODERNA BIOTECH SPAIN, S.L. Calle del Príncipe de Vergara 132 Plt 12
Madrid 28002
Španielsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/20/1507/004
EU/1/20/1507/005
EU/1/20/1507/007
EU/1/20/1507/008
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 6. januára 2021
Dátum posledného predĺženia registrácie: 3. októbra 2022
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií
o bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na
nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUSpikevax bivalent Original/Omicron BA.4-5 (50 mikrogramov/50 mikrogramov)/ml injekčná disperzia
Spikevax bivalent Original/Omicron BA.4-5 25 mikrogramov/25 mikrogramov injekčná disperzia
Spikevax bivalent Original/Omicron BA.4-5 25 mikrogramov/25 mikrogramov injekčná disperzia v naplnenej injekčnej striekačke
mRNA očkovacia látka proti COVID-19 (modifikovaný nukleozid)
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIETabuľka 1. Spikevax bivalent Original/Omicron BA.4-5 kvalitatívne a kvantitatívne zloženieSila
| Obal
| Dávka (dávky)
| Zloženie na dávku
|
Spikevax bivalent Original/Omicron BA.4-5 (50 mikrogramov/50 mikrogramov)/ml injekčná disperzia
| Viacdávková
2,5 ml injekčná liekovka
(modré
odklápacie viečko)
| 5 dávok po
0,5 ml
|
Jedna dávka (0,5 ml)
obsahuje
25 mikrogramov elazomeranu
a 25 mikrogramov
davezomeranu, mRNA očkovacej látky proti COVID-
19 (zapuzdrenej do lipidových nanočastíc).
|
Spikevax bivalent
Original/Omicron BA.4-5
25 mikrogramov/25 mikrogramov injekčná disperzia
| Jednodávková
0,5 ml injekčná liekovka
(modré odklápacie viečko)
| 1 dávka 0,5 ml
Len na jednorazové použitie.
|
Spikevax bivalent
Original/Omicron BA.4-5
25 mikrogramov/25 mikrogramov injekčná disperzia v naplnenej injekčnej striekačke
| Naplnená
injekčná striekačka
| 1 dávka po 0,5
ml
Len na jednorazové použitie.
|
|
Elazomeran je jednovláknová mediátorová RNA (mRNA) s čiapočkou na 5’ konci produkovaná
pomocou bezbunkovej
in vitro transkripcie z príslušných šablón DNA, kódujúca „spike“ (S) proteín
vírusu SARS-CoV-2.
Davezomeran je jednovláknová mediátorová RNA (mRNA) s čiapočkou na 5’ konci produkovaná pomocou bezbunkovej
in vitro transkripcie z príslušných šablón DNA, kódujúca spike“ (S) proteín vírusu SARS-CoV-2 (Omicron variant, BA.4-5). S-proteíny línií BA.4 a BA.5 variantu Omicron vírusu SARS-CoV-2 sú identické.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčná disperzia
Biela až sivobiela disperzia (pH: 7,0 – 8,0).
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Vakcína Spikevax bivalent Original/Omicron BA.4-5 je indikovaná na aktívnu imunizáciu na prevenciu ochorenia COVID-19 spôsobeného SARS-CoV-2 u osôb vo veku 12 rokov a starších, ktorí predtým dostali aspoň základný cyklus očkovania proti COVID-19 (pozri časti 4.2 a 5.1).
Použitie tejto očkovacej látky má byť v súlade s oficiálnymi odporúčaniami.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Dávka očkovacej látky Spikevax bivalent Original/Omicron BA.4-5 je 0,5 ml podávaná
intramuskulárne.
Medzi podaním očkovacej látky Spikevax bivalent Original/Omicron BA.4-5 a poslednou predchádzajúcou dávkou očkovacej látky proti COVID-19 by mal byť interval aspoň 3 mesiace.
Vakcína Spikevax bivalent Original/Omicron BA.4-5 je indikovaná len pre osoby, ktoré v minulosti absolvovali aspoň základný cyklus očkovania proti COVID-19.
Podrobnosti o základnom cykle očkovania pre osoby vo veku 12 rokov a staršie pozri v súhrne charakteristických vlastností lieku Spikevax 0,2 mg/ml injekčná disperzia.
Pediatrická populácia
Bezpečnosť a účinnosť vakcíny Spikevax bivalent Original/Omicron BA.4-5 u detí mladších ako
12 rokov neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Staršie osoby
U starších osôb vo veku ≥ 65 rokov nie je potrebná žiadna úprava dávkovania.
Spôsob podávania
Vakcína sa má podávať intramuskulárne. Uprednostňované miesto podania je deltový sval ramena.
Nepodávajte túto vakcínu intravaskulárne, subkutánne ani intradermálne.
Vakcína sa nesmie miešať v rovnakej injekčnej striekačke so žiadnymi inými vakcínami ani liekmi. Opatrenia, ktoré sa majú urobiť pred podaním vakcíny, pozri časť 4.4.
Pokyny týkajúce sa rozmrazenia, zaobchádzania a likvidácie vakcíny, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Sledovateľnosť
Aby sa zlepšila (do)sledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov a číslo šarže podaného lieku.
Precitlivenosť aanafylaxia
U osôb, ktoré dostali očkovaciu látku Spikevax (pôvodná), bola hlásená anafylaxia. Má byť vždy
okamžite dostupné vhodné lekárske ošetrenie a dohľad pre prípad vzniku anafylaktickej reakcie po podaní očkovacej látky.
Po očkovaní sa odporúča dôkladné sledovanie po dobu najmenej 15 minút. Osobám, u ktorých po podaní predchádzajúcej dávky vakcíny Spikevax (pôvodná) došlo k anafylaxii, sa nemajú podať ďalšie dávky vakcíny Spikevax bivalent Original/Omicron BA.4-5.
Myokarditída a perikarditída
Existuje zvýšené riziko myokarditídy a perikarditídy po očkovaní očkovacou látkou Spikevax
(pôvodná).
Tieto ochorenia sa môžu objaviť už do niekoľkých dní po očkovaní a vyskytli sa najmä počas prvých
14 dní. Boli pozorované častejšie po druhej dávke v porovnaní s prvou dávkou a častejšie u mladších mužov (pozri časť 4.8). Rizikový profil sa zdá byť podobný pri druhej a tretej dávke.
Z dostupných údajov vyplýva, že priebeh myokarditídy a perikarditídy po očkovaní sa nelíši od
myokarditídy alebo perikarditídy vo všeobecnosti.
Zdravotnícki pracovníci majú venovať zvýšenú pozornosť prejavom a príznakom myokarditídy
a perikarditídy. Očkované osoby majú byť poučené, aby okamžite vyhľadali lekársku pomoc, ak sa
u nich po očkovaní objavia príznaky naznačujúce myokarditídu alebo perikarditídu, napríklad (akútna a pretrvávajúca) bolesť na hrudníku, dýchavičnosť alebo palpitácie.
Zdravotnícki pracovníci si majú pri diagnostike a liečbe tohto ochorenia prečítať usmernenia a/alebo sa poradiť so špecialistami.
Reakcie spojené s úzkosťou
Pri očkovaní sa môžu vyskytnúť reakcie súvisiace s úzkosťou vrátane vazovagálnych reakcií
(synkopa), hyperventilácie alebo reakcií súvisiacich so stresom ako psychogénna odpoveď na podanie injekcie ihlou. Je dôležité vykonať opatrenia na zabránenie zranenia spôsobeného omdlievaním.
Súbežné ochorenie
Očkovanie sa má odložiť u osôb so závažným akútnym ochorením s horúčkou alebo akútnou
infekciou. Pre miernu infekciu a/alebo nízku horúčku sa očkovanie nemá odkladať.
Trombocytopénia a poruchy koagulácie
Tak ako pri iných intramuskulárnych injekciách, aj táto vakcína sa má podávať s opatrnosťou u osôb
liečených antikoagulanciami alebo u osôb s trombocytopéniou, alebo akoukoľvek poruchou koagulácie (ako je napríklad hemofília), pretože u týchto osôb sa môže po intramuskulárnom podaní vyskytnúť krvácanie alebo tvorba podliatin.
Vzplanutia syndrómu kapilárneho presakovania
Počas prvých dní po očkovaní očkovacou látkou Spikevax (pôvodná) bolo hlásených niekoľko
prípadov vzplanutia syndrómu kapilárneho presakovania (CLS). Zdravotnícki pracovníci majú poznať
prejavy a príznaky syndrómu CLS, aby tento stav ihneď rozpoznali a liečili. U osôb s ochorením CLS
v anamnéze je potrebné očkovanie plánovať v spolupráci s príslušnými lekárskymi odborníkmi.
Imunokompromitované osoby
Účinnosť a bezpečnosť vakcíny Spikevax bivalent Original/Omicron BA.4-5 sa nehodnotili
u imunokompromitovaných osôb vrátane osôb užívajúcich imunosupresívnu liečbu. Účinnosť vakcíny
Spikevax bivalent Original/Omicron BA.4-5 môže byť u imunokompromitovaných osôb nižšia.
Trvanie ochrany
Trvanie ochrany vyvolanej očkovacou látkou nie je známe, keďže sa ešte stále stanovuje
v prebiehajúcich klinických štúdiách.
Obmedzenia účinnostivakcíny
Rovnako ako u všetkých vakcín, ani očkovanie vakcínou Spikevax bivalent Original/Omicron BA.4-5
nemusí chrániť každého kto ju dostane.
Pomocné látkysoznámymúčinkom
Sodík
Táto vakcína obsahuje menej ako 1 mmol sodíka (23 mg) na 0,5 ml dávku, t. j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
Súbežné podávanie vakcíny Spikevax bivalent Original/Omicron BA.4-5 s inými vakcínami sa neskúmalo.
4.6 Fertilita, gravidita a laktácia
Gravidita
Doposiaľ nie sú k dispozícii žiadne údaje týkajúce sa používania vakcíny Spikevax bivalent
Original/Omicron BA.4-5 počas tehotenstva.
Veľké množstvo observačných údajov od tehotných žien očkovaných vakcínou Spikevax (pôvodná) v druhom a treťom trimestri však nepreukázalo zvýšenie nepriaznivých výsledkov gravidity. Aj keď údaje o výsledkoch gravidity po očkovaní v prvom trimestri sú v súčasnosti obmedzené, nepozorovalo sa zvýšené riziko potratu. Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky
z hľadiska gravidity, embryofetálneho vývinu, pôrodu alebo postnatálneho vývinu (pozri časť 5.3).
Keďže rozdiely medzi produktmi sú obmedzené na sekvenciu spike proteínu a neexistujú žiadne klinicky významné rozdiely v reaktogenite, Spikevax bivalent Original/Omicron BA.4-5 sa môže používať počas tehotenstva.
Dojčenie
Doposiaľ nie sú k dispozícii žiadne údaje týkajúce sa používania vakcíny Spikevax bivalent
Original/Omicron BA.4-5 počas dojčenia.
Neočakáva sa však žiaden účinok u dojčených novorodencov/dojčiat, keďže systémová expozícia vakcíne u dojčiacich žien je zanedbateľná. Observačné údaje od žien, ktoré po očkovaní vakcínou Spikevax (pôvodnou) dojčili, nepreukázali riziko výskytu nežiaducich účinkov u dojčených novorodencov/dojčiat. Spikevax bivalent Original/Omicron BA.4-5 sa môže používať počas dojčenia.
F
er
tilita
Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej
toxicity (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Vakcína Spikevax bivalent Original/Omicron BA.4-5 nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Niektoré z účinkov uvedených v časti 4.8 však môžu dočasne ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Dospelí
Bezpečnosť vakcíny Spikevax (pôvodná) sa hodnotila v prebiehajúcej randomizovanej, placebom kontrolovanej klinickej štúdii fázy 3 zaslepenej pre pozorovateľa, ktorá sa uskutočnila v USA a na ktorej sa zúčastnilo 30 351 účastníkov vo veku 18 rokov a starších, ktorí dostali najmenej jednu dávku vakcíny Spikevax (pôvodná) (n = 15 185) alebo placebo (n = 15 166) (NCT04470427). V čase očkovania bol priemerný vek populácie 52 rokov (rozpätie 18 – 95); 22 831 (75,2 %) účastníkov bolo vo veku 18 až 64 rokov a 7 520 (24,8 %) účastníkov bolo vo veku 65 rokov a starších.
Najčastejšie hlásenými nežiaducimi reakciami boli bolesť v mieste podania injekcie (92 %), únava
(70 %), bolesť hlavy (64,7 %), myalgia (61,5 %) artralgia (46,4 %), zimnica (45,4 %), nauzea/vracanie (23 %), axilárny opuch/citlivosť (19,8 %), horúčka (15,5 %), opuch v mieste podania injekcie (14,7 %) a začervenanie (10 %). Intenzita nežiaducich reakcií bola zvyčajne mierna alebo stredná a nežiaduce reakcie odzneli do niekoľkých dní po očkovaní. O niečo nižšia frekvencia reaktogenity bola spojená s vyšším vekom.
Celkovo bol v mladších vekových skupinách vyšší výskyt niektorých nežiaducich reakcií: výskyt axilárneho opuchu/citlivosti, únavy, bolesti hlavy, myalgie, artralgie, zimnice, nauzey/vracania
a horúčky bol vyšší u dospelých vo veku od 18 do < 65 rokov než u dospelých vo veku 65 rokov a starších.
Lokálne a systémové nežiaduce reakcie boli častejšie hlásené po 2. dávke než po 1. dávke.
Dospievajúci vo veku od 12 do 17 rokov
Údaje o bezpečnosti lieku Spikevax u dospievajúcich boli získané v prebiehajúcej randomizovanej, placebom kontrolovanej, pre pozorovateľa zaslepenej klinickej štúdii fázy 2/3 s viacerými časťami, ktorá sa uskutočnila v Spojených štátoch. Prvej časti štúdie sa zúčastnilo 3 726 účastníkov vo veku od
12 do 17 rokov, ktorí dostali najmenej jednu dávku vakcíny Spikevax (n = 2 486) alebo placebo (n =
1 240) (NCT04649151). Demografické charakteristiky u účastníkov, ktorí dostali vakcínu Spikevax, a účastníkov, ktorí dostali placebo, boli podobné.
Najčastejšími nežiaducimi reakciami u dospievajúcich vo veku od 12 do 17 rokov boli bolesť v mieste podania injekcie (97 %), bolesť hlavy (78 %), únava (75 %), myalgia (54 %), zimnica (49 %), axilárny opuch/citlivosť (35 %), artralgia (35 %), nauzea/vracanie (29 %), opuch v mieste podania injekcie
(28 %), erytém v mieste podania injekcie (26 %) a horúčka (14 %).
Táto štúdia prešla do otvorenej štúdie fázy 2/3, v ktorej 1 346 účastníkov vo veku 12 až 17 rokov dostalo posilňovaciu dávku Spikevaxu najmenej 5 mesiacov po druhej dávke primárneho cyklu. V otvorenej časti štúdie sa nezistili žiadne ďalšie nežiaduce reakcie.
Deti vo veku od 6 rokov do 11 rokov
Údaje o bezpečnosti vakcíny Spikevax (pôvodná) u detí sa získavali v prebiehajúcej randomizovanej klinickej štúdii fázy 2/3 zaslepenej pre pozorovateľa, pozostávajúcom z dvoch častí, ktoré sa
uskutočnilo v USA a Kanade (NCT04796896). 1. časť je otvorená fáza štúdie bezpečnosti, výberu dávky a imunogenity a zahŕňala 380 účastníkov vo veku od 6 rokov do 11 rokov, ktorí dostali najmenej 1 dávku (0,25 ml) vakcíny Spikevax (pôvodná). 2. časť je placebom kontrolovaná fáza skúšania bezpečnosti a zahŕňala 4 016 účastníkov vo veku od 6 rokov do 11 rokov, ktorí dostali najmenej jednu dávku (0,25 ml) vakcíny Spikevax (pôvodná) (n = 3 012) alebo placebo (n = 1 004). Žiadny z účastníkov z 1. časti sa nezúčastnil v 2. časti. Demografické charakteristiky účastníkov, ktorí dostali vakcínu Spikevax (pôvodná) a účastníkov, ktorí dostali placebo, boli podobné.
Najčastejšími nežiaducimi reakciami u účastníkov vo veku od 6 rokov do 11 rokov po podaní primárneho cyklu (v 2. časti) boli bolesť v mieste podania injekcie (98,4 %), únava (73,1 %), bolesť hlavy (62,1 %), myalgia (35,3 %), zimnica (34,6 %), nauzea/vracanie (29,3 %), axilárny opuch/citlivosť (27,0 %), horúčka (25,7 %), erytém v mieste podania injekcie (24,0 %), opuch
v mieste podania injekcie (22,3 %) a artralgia (21,3 %).
Protokol štúdie bol zmenený a doplnený tak, aby zahŕňal otvorenú fázu podávania posilňovacích dávok, do ktorej bolo zaradených 1 294 účastníkov vo veku od 6 rokov do 11 rokov, ktorí dostali posilňovaciu dávku Spikevaxu najmenej 6 mesiacov po druhej dávke primárneho cyklu. V otvorenej časti štúdie sa nezistili žiadne ďalšie nežiaduce reakcie.
Deti vo veku od 6 mesiacov do 5 rokov
V Spojených štátoch a Kanade prebieha randomizované, placebom kontrolované, pre pozorovateľa zaslepené klinické skúšanie fázy 2/3 na vyhodnotenie bezpečnosti, znášanlivosti, reaktogenity a účinnosti vakcíny Spikevax. Toto klinické skúšanie zahŕňalo 10 390 účastníkov vo veku od
6 mesiacov do 11 rokov, ktorí dostali aspoň jednu dávku vakcíny Spikevax (pôvodná) (n = 7 798)
alebo placeba (n = 2 592).
Do klinického skúšania boli zaradené deti v 3 vekových skupinách: od 6 rokov do 11 rokov, od 2 rokov do 5 rokov a od 6 mesiacov do 23 mesiacov. Toto pediatrické klinické skúšanie zahŕňalo 6 388 účastníkov vo veku od 6 mesiacov do 5 rokov, ktorí dostali aspoň jednu dávku vakcíny Spikevax (pôvodná) (n = 4 791) alebo placeba (n = 1 597). Demografické charakteristiky účastníkov, ktorí dostali Spikevax (pôvodná), a účastníkov, ktorí dostali placebo, boli podobné.
V tomto klinickom skúšaní boli nežiaduce reakcie u účastníkov vo veku od 6 mesiacov do
23 mesiacov po podaní primárneho cyklu podráždenosť/plač (81,5 %), bolesť v mieste vpichu
(56,2 %), ospalosť (51,1 %), strata chuti do jedla (45,7 %), horúčka (21,8 %), opuch v mieste vpichu
(18,4 %), erytém v mieste vpichu (17,9 %) a opuch/citlivosť podpazušia (12,2 %).
Nežiaduce reakcie u účastníkov vo veku od 24 do 36 mesiacov po podaní primárneho cyklu zahŕňali bolesť v mieste vpichu (76,8 %), podráždenosť/plač (71,0 %), ospalosť (49,7 %), strata chuti do jedla (42,4 %), horúčku (26,1 %), erytém v mieste vpichu (17,9 %), opuch v mieste vpichu (15,7 %) a opuch/citlivosť podpazušia (11,5 %).
Nežiaduce reakcie u účastníkov vo veku od 37 mesiacov do 5 rokov po podaní primárneho cyklu zahŕňali bolesť v mieste vpichu (83,8 %), únavu (61,9 %), bolesť hlavy (22,9 %), myalgiu (22,1 %), horúčku (20,9 %), zimnicu (16,8 %), nevoľnosť/vracanie (15,2 %), opuch/citlivosť podpazušia
(14,3 %), artralgiu (12,8 %), erytém v mieste vpichu (9,5 %) a opuch v mieste vpichu (8,2 %).
Tabuľkový zoznam nežiaducich reakcií
Nižšie uvedený profil bezpečnosti vychádza z údajov získaných z niekoľkých placebom
kontrolovaných klinických štúdií:
- 30 351 dospelých vo veku ≥ 18 rokov,
- 3 726 dospievajúcich vo veku od 12 do 17 rokov,
- 4 002 detí vo veku od 6 rokov do 11 rokov,
- 6 388 detí vo veku od 6 mesiacov do 5 rokov,
- a zo skúseností po uvedení lieku na trh.
Hlásené nežiaduce reakcie sú uvedené podľa nasledujúcej konvencie frekvencií:
Veľmi časté (≥ 1/10) Časté (≥ 1/100 až < 1/10)
Menej časté (≥ 1/1 000 až < 1/100) Zriedkavé (≥ 1/10 000 až < 1/1 000) Veľmi zriedkavé (< 1/10 000)
Neznáme (z dostupných údajov nemožno odhadnúť)
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti (Tabuľka 2).
Tabuľka 2. Nežiaduce reakcie z klinických štúdií s vakcínou Spikevax (pôvodná) a zo skúsenosti po uvedení na trh u detí a osôb vo veku 6 mesiacov a staršíchTrieda orgánových systémov podľa
MedDRA
| Frekvencia
| Nežiaduca reakcia (reakcie)
|
Poruchy krvi a lymfatického systému
| Veľmi časté
| Lymfadenopatia*
|
Poruchy imunitného systému
| Neznáme
| Anafylaxia
Precitlivenosť
|
Poruchy metabolizmu a výživy
| Veľmi časté
| Znížená chuť do jedla†
|
Psychické poruchy
| Veľmi časté
| Podráždenosť/plač†
|
Poruchy nervového systému
| Veľmi časté
| Bolesť hlavy
Ospalosť†
|
Menej časté
| Závrat
|
Zriedkavé
| Akútna periférna paralýza tváre‡ Hypestézia
Parestézia
|
Poruchy srdca a srdcovej činnosti
| Veľmi zriedkavé
| Myokarditída
|
Perikarditída
|
Poruchy gastrointestinálneho traktu
| Veľmi časté
| Nauzea/vracanie
|
Časté
| Hnačka
|
| Menej časté
| Bolesť brucha§
|
Poruchy kože a podkožného tkaniva
| Časté
| Vyrážka
|
Menej časté
| Urtikária¶
|
Neznáme
| Multiformný erytém
|
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
| Veľmi časté
| Myalgia
Artralgia
|
Poruchy reprodukčného systému a
prsníkov
| Neznáme
| Silné menštruačné krvácanie#
|
Celkové poruchy a reakcie v mieste podania
| Veľmi časté
| Bolesť v mieste podania injekcie
Únava
Zimnica
Pyrexia
Opuch v mieste podania injekcie
Erytém v mieste podania injekcie
|
Časté
| Urtikária v mieste podania injekcie
Vyrážka v mieste podania injekcie
|
|
|
Oneskorená reakcia v mieste podania injekcie♠
|
Menej časté
|
Pruritus v mieste podania injekcie
|
Zriedkavé
|
Opuch tváre♥
|
Neznáme
|
Rozsiahly opuch očkovanej končatiny
|
* Lymfadenopatia bola zaznamenaná ako axilárna lymfadenopatia na rovnakej strane ako miesto podania injekcie. V niektorých prípadoch boli postihnuté iné lymfatické uzliny (napr. cervikálne, supraklavikulárne).
† Pozorované u pediatrickej populácie (vo veku od 6 mesiacov do 5 rokov).
‡ Počas celého obdobia sledovania bezpečnosti bola hlásená akútna periférna paralýza (alebo ochrnutie) tváre u troch účastníkov v skupine s podávaním vakcíny Spikevax a u jedného účastníka v skupine s podávaním placeba. K nástupu reakcie v skupine s podávaním očkovacej látky došlo v 22., 28. a 32. deň po podaní 2. dávky.
§ Bolesť brucha sa pozorovala u pediatrickej populácie (vo veku 6 až 11 rokov): 0,2 % v skupine s vakcínou Spikevax a 0 %
v skupine s placebom.
¶ Urtikária bola pozorovaná buď s akútnym nástupom (v priebehu niekoľkých dní po očkovaní), alebo s oneskoreným nástupom (približne do dvoch týždňov po očkovaní).
# Predpokladá sa, že väčšina prípadov nie je závažná a je dočasná.
♠ Medián času do nástupu reakcie bol 9 dní po prvej injekcii a 11 dní po druhej injekcii. Medián trvania bol 4 dni po prvej injekcii a 4 dni po druhej injekcii.
♥ Dve závažné nežiaduce udalosti opuchu tváre boli hlásené u osôb, ktorým bola podaná očkovacia látka a ktorým boli v minulosti podané injekcie s dermatologickým výplňovým materiálom. Nástup opuchu bol hlásený v 1. a 3. deň,
v uvedenom poradí, vzhľadom na deň očkovania.
Reaktogenita a bezpečnostný profil u 343 účastníkov, ktorým bola podaná vakcína Spikevax (pôvodná) a ktorí boli na začiatku štúdie séropozitívni na SARS-CoV-2, boli porovnateľné s reaktogenitou a bezpečnostným profilom u účastníkov, ktorí boli na začiatku štúdie séronegatívni na SARS-CoV-2.
Dospelí (posilňovacia dávka)Bezpečnosť, reaktogenita a imunogenita posilňovacej dávky vakcíny Spikevax (pôvodná) sa vyhodnocujú v prebiehajúcej randomizovanej, pre pozorovateľa zaslepenej, placebom kontrolovanej štúdii fázy 2 na potvrdenie dávky u účastníkov vo veku 18 rokov a starších (NCT04405076). V tejto štúdii dostalo 198 účastníkov dve dávky (0,5 ml, 100 mikrogramov s odstupom 1 mesiaca) primárneho cyklu vakcíny Spikevax (pôvodná). V otvorenej fáze tejto štúdie dostalo 167 z týchto účastníkov jednu posilňovaciu dávku (0,25 ml, 50 mikrogramov) najmenej 6 mesiacov po očkovaní druhou dávkou primárneho cyklu. Profil vyžiadaných nežiaducich reakcií pri posilňovacej dávke (0,25 ml,
50 mikrogramov) bol podobný profilu vyžiadaných nežiaducich reakcií po druhej dávke primárneho cyklu.
Spikevax bivalent Original/Omicron BA.1 (posilňovacia dávka)Bezpečnosť, reaktogenita a imunogenita posilňovacej dávky Spikevax bivalent Original/Omicron BA.1 sa hodnotí v prebiehajúcej otvorenej štúdii fázy 2/3 u účastníkov vo veku 18 rokov a starších (mRNA-1273-P205). V tejto štúdii dostalo 437 účastníkov posilňovaciu dávku Spikevax bivalent Original/Omicron BA.1 50 mikrogramov a 377 účastníkov dostalo posilňovaciu dávku Spikevax (pôvodná) 50 mikrogramov.
Posilňovacia dávka Spikevax bivalent Original/Omicron BA.1 mala profil reaktogenity podobný profilu posilňovacej dávky Spikevax (pôvodná) podávanej ako druhá posilňovacia dávka. Frekvencia nežiaducich reakcií po imunizácii posilňovacou dávkou Spikevax bivalent Original/Omicron BA.1 bola tiež podobná alebo nižšia v porovnaní s prvou posilňovacou dávkou Spikevax (pôvodná)
(50 mikrogramov) a v porovnaní s druhou dávkou primárneho cyklu Spikevax (pôvodná) (100 mikrogramov). Neboli identifikované žiadne nové bezpečnostné signály.
Opisvybranýchnežiaducichreakcií
My
okarditída
Zvýšené riziko myokarditídy po očkovaní očkovacou látkou Spikevax (pôvodná) je najvyššie
u mladších mužov (pozri časť 4.4).
V dvoch veľkých, európskych, farmako-epidemiologických štúdiách sa určilo zvýšené riziko
u mladších mužov po druhej dávke očkovacej látky Spikevax (pôvodná). Z jednej štúdie vyplynulo, že v období 7 dní po podaní druhej dávky sa u mužov vo veku 12 – 29 rokov vyskytlo približne o 1,316 (95 % IS 1,299 – 1,333) prípadov myokarditídy na 10 000 osôb viac ako u neexponovaných osôb.
V ďalšej štúdii sa v období 28 dní po podaní druhej dávky u mužov vo veku 16 – 24 rokov vyskytlo
o 1,88 (95 % IS 0,956 – 2,804) prípadov myokarditídy na 10 000 osôb viac ako u neexponovaných osôb.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V a uviedli číslo šarže, ak je k dispozícii.
4.9 PredávkovanieV prípade predávkovania sa odporúča sledovanie životných funkcií a možná symptomatická liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: očkovacie látky, iné vírusové očkovacie látky, ATC kód: J07BX03
Mechanizmus účinkuVakcíny Spikevax (elazomeran) aj Spikevax bivalent Original/Omicron BA.1
(elazomeran/imelazomeran) obsahujú mRNA zapuzdrenú v lipidových nanočasticiach. mRNA kóduje spike proteín vírusu SARS-CoV-2 v plnej dĺžke, ktorý je modifikovaný 2 substitúciami prolínom v rámci domény heptad repetície 1 (S-2P) z dôvodu stabilizácie spike proteínu do pred-fúznej konformácie. Po intramuskulárnom injekčnom podaní, bunky v mieste podania injekcie a spádové lymfatické uzliny prijmú lipidové nanočastice, čím sa sekvencia mRNA účinne dopraví do buniek s účelom translácie na vírusový proteín. Dodaná mRNA nevstupuje do bunkového jadra ani
neinteraguje s genómom, nereplikuje sa a je exprimovaná dočasne, a to najmä dendrickými bunkami a makrofágmi subkapsulárneho sínusu. Exprimovaný, na membránu viazaný spike proteín vírusu SARS-CoV-2 je následne rozpoznaný bunkami imunitného systému ako cudzí antigén. To vyvoláva odpoveď T-buniek a B-buniek, ktoré vytvárajú neutralizačné protilátky, ktoré môžu prispievať
k ochrane pred ochorením COVID-19. mRNA s modifikovanými nukleozidmi vo vakcíne Spikevax bivalent Original/Omicron BA.4-5 (elazomeran/davezomeran) je vo forme lipidových častíc, ktoré umožňujú doručenie mRNA s modifikovanými nukleozidmi do hostiteľských buniek, aby sa umožnila expresia antigénu SARS-CoV-2 S. Vakcína vyvoláva imunitnú odpoveď na antigén S, ktorá chráni pred COVID-19.
Klinická účinnosťImunogenita u dospelých – po posilňovacej dávke Spikevax bivalent Original/Omicron BA.1 (0,5 ml,25 mikrogramov/25 mikrogramov)Bezpečnosť, reaktogenita a imunogenita posilňovacej dávky Spikevax bivalent Original/Omicron BA.1 sa hodnotí v prebiehajúcej otvorenej štúdii fázy 2/3 u účastníkov vo veku 18 rokov a starších (mRNA-1273-P205). V tejto štúdii dostalo 437 účastníkov posilňovaciu dávku Spikevax bivalent
Original/Omicron BA.1 50 mikrogramov a 377 účastníkov dostalo posilňovaciu dávku Spikevax
(pôvodná) 50 mikrogramov.
Časť G štúdie P205 hodnotila bezpečnosť, reaktogenitu a imunogenitu vakcíny Spikevax bivalent Original/Omicron BA.1, keď sa podávala ako druhá posilňovacia dávka dospelým, ktorí predtým dostali 2 dávky vakcíny Spikevax (pôvodná) (100 mikrogramov) ako primárny cyklus a posilňovaciu dávku Spikevax (pôvodná) (50 mikrogramov) najmenej 3 mesiace pred zaradením do skúšania. V časti F štúdie P205 dostali účastníci Spikevax bivalent Original/Omicron BA.1 (25 mikrogramov/25 mikrogramov) ako druhú posilňovaciu dávku a skupina z časti G slúži v rámci štúdie ako nesúbežná porovnávacia skupina k skupine Spikevax bivalent Original/Omicron BA.1.
V tejto štúdii bola analýza primárnej imunogenity založená na súbore primárnej imunogenity, ktorý zahŕňa účastníkov bez dôkazov infekcie SARS-CoV-2 na začiatku (pred posilňovacou dávkou).
V primárnej analýze bol 28 dní po posilňovacej dávke zistený odhadovaný geometrický priemer titrov neutralizačných protilátok (GMT) pre pôvodný SARS-CoV-2 a zodpovedajúci 95 % IS 6 422,3
(5 990,1; 6 885,7) po posilňovacej dávke vakcínou Spikevax bivalent Original/Omicron BA.1
a 5 286,6 (4 887,1; 5 718,9) po posilňovacej dávke vakcínou Spikevax (pôvodná). Tieto GMT
vypovedajú o rozdiele v odpovedi medzi vakcínou Spikevax bivalent Original/Omicron BA.1
a vakcínou Spikevax (pôvodná) proti pôvodnému kmeňu SARS CoV-2 (D614G). GMR (97,5 % IS) bol 1,22 (1,08; 1,37), čo spĺňalo vopred špecifikované kritériá non-inferiority (dolná hranica 97,5 % CI ≥ 0,67).
Odhadovaný geometrický priemer titrov neutralizačných protilátok proti kmeňu Omicron, BA.1 na
29. deň bol 2 479,9 (2 264,5; 2 715,8) v skupine s posilňovacou dávkou Spikevax bivalent Original/Omicron BA.1 a 1 421,2 (1 283,0; 1 574,4) v skupine s posilňovacou dávkou Spikevax (pôvodná) a GMR (97,5 % IS) bol 1,75 (1,49; 2,04), čo spĺňalo vopred špecifikované kritérium superiority (dolná hranica IS >1).
Klinická účinnosť u dospelých
V randomizovanej, placebom kontrolovanej klinickej štúdii fázy 3 zaslepenej pre pozorovateľa
(NCT04470427) u dospelých boli z účasti na klinickej štúdii vylúčené osoby s oslabeným imunitným systémom alebo osoby, ktoré užívali imunosupresíva v intervale 6 mesiacov pred klinickou štúdiou, ako aj tehotné účastníčky alebo osoby so známou anamnézou infekcie vírusom SARS-CoV-2. Účastníci so stabilizovaným ochorením HIV neboli vylúčení. Očkovacie látky proti chrípke sa mohli podávať 14 dní pred podaním alebo 14 dní po podaní ktorejkoľvek dávky vakcíny Spikevax (pôvodná). Účastníci museli takisto dodržať minimálny 3-mesačný interval od podania krvných produktov/produktov plazmy alebo imunoglobulínov pred klinickou štúdiou, aby im mohlo byť podané placebo alebo vakcína Spikevax (pôvodná).
Celkovo bol sledovaný výskyt ochorenia COVID-19 u 30 351 účastníkov s mediánom 92 dní
(rozmedzie: 1 – 122 dní).
Populácia, u ktorej sa robila primárna analýza účinnosti (ďalej sa uvádza ako súbor podľa protokolu alebo PPS, Per Protocol Set) pozostávala z 28 207 účastníkov, ktorým bola podaná buď vakcína Spikevax (pôvodná) (n = 14 134), alebo placebo (n = 14 073). Táto populácia mala negatívny východiskový status pre vírus SARS-CoV-2. Populácia PPS zahŕňala 47,4 % žien, 52,6 %
mužov, 79,5 % belochov, 9,7 % afroameričanov, 4,6 % Ázijcov a 6,2 % iných. 19,7 % účastníkov
bolo identifikovaných ako Hispáncov alebo latinskoameričanov. Medián veku účastníkov bol 53 rokov (rozmedzie 18 – 94). U účastnikov zaradených do PPS bol povolený dávkovací interval -7 až +14 dní pre podanie druhej dávky (plánovanej na 29. deň). 98 % účastníkov dostalo druhú dávku očkovacej látky 25 dní až 35 dní po prvej dávke (čo zodpovedá -3 až +7 dňom okolo času 28 dní).
Prípady ochorenia COVID-19 boli potvrdené polymerázovou reťazovou reakciou s reverznou transkripciou (RT PCR) a komisiou pre klinické posúdenie. Celková účinnosť očkovacej látky a účinnosť podľa kľúčových vekových skupín sú uvedené v tabuľke 3.
T
abuľka 3. Analýza účinnosti vakcíny: potvrdené ochorenie COVID-19
#
b
e
z ohľadu na závažnosť od 14. dňa po podaní 2. dávky – súbor podľa protokolu
V
e
k
ová skupina (roky)
|
V
akcína Spikevax (pôvodná)
|
P
l
acebo
|
% účinnosti vakcíny (95
% IS)*
|
Ú
č
astníci
N
|
Prípady ochore- nia COVID-
19
n
|
M
i
er
a výskytu ochorenia COVID-19 na
1 000 osobo-
r
okov
|
Ú
č
astníci
N
|
Prípady ochore- nia COVID-
19
n
|
M
i
er
a výskytu ochorenia COVID-19 na
1 000 osobo-
r
okov
|
Celkovo
(≥ 18)
|
14 134
|
11
|
3,328
|
14 073
|
185
|
56,510
|
94,1
(89,3; 96,8)**
|
18 až < 65
|
10 551
|
7
|
2,875
|
10 521
|
156
|
64,625
|
95,6
(90,6; 97,9)
|
≥ 65
|
3 583
|
4
|
4,595
|
3 552
|
29
|
33,728
|
86,4
(61,4; 95,2)
|
≥ 65 až < 75
|
2 953
|
4
|
5,586
|
2 864
|
22
|
31,744
|
82,4 % (48,9; 93,9)
|
≥ 75
|
630
|
0
|
0
|
688
|
7
|
41,968
|
100 % (NE, 100)
|
|
|
#COVID-19: symptomatické ochorenie COVID-19 vyžadujúce si pozitívny výsledok RT-PCR testu
a najmenej 2 systémové príznaky alebo 1 respiračný príznak. Prípady vyskytujúce sa od 14. dňa po podaní 2. dávky.
*Účinnosť vakcíny a 95 % interval spoľahlivosti (IS) zo stratifikovaného Coxovho modelu
proporcionálneho rizika.
**IS neupravený pre multiplicitu. Štatistické analýzy s upravenou multiplicitou boli vykonané pri predbežnej analýze u nižšieho počtu prípadov ochorenia COVID-19, ktoré sa tu neuvádzajú.
Spomedzi všetkých účastníkov v PPS neboli hlásené žiadne prípady závažného ochorenia
COVID-19 v skupine, ktorej bola podaná očkovacia látka, v porovnaní s 30 prípadmi zo 185 (16 %)
v skupine, ktorej bolo podané placebo. Z 30 účastníkov so závažným ochorením bolo
9 hospitalizovaných, z ktorých 2 boli prijatí na jednotku intenzívnej starostlivosti. Väčšina zvyšných závažných prípadov splnila len kritérium týkajúce sa saturácie kyslíkom (SpO2) pre závažné ochorenie (≤ 93 % pri izbovom vzduchu).
Účinnosť vakcíny Spikevax (pôvodná) pri prevencii ochorenia COVID-19 bez ohľadu na predchádzajúcu infekciu vírusom SARS-CoV- 2 (zistená úvodným sérologickým testovaním
a testovaním vzoriek z nazofaryngálneho výteru) od 14. dňa po podaní 2. dávky bola 93,6 % (95 %
interval spoľahlivosti 88,6; 96,5 %).
Okrem toho, analýzy primárneho koncového ukazovateľa účinnosti v podskupinách preukázali podobné výsledky účinnosti v rámci pohlaví, etnických skupín a účastníkov so zdravotnými komorbiditami spojenými s vysokým rizikom závažného ochorenia COVID-19.
Imunogenita u dospelých – po posilňovacej dávke (0,25 ml, 50 mikrogramov)Bezpečnosť, reaktogenita a imunogenita posilňovacej dávky vakcíny Spikevax (pôvodná) sa hodnotia
v prebiehajúcej randomizovanej, pre pozorovateľa zaslepenej, placebom kontrolovanej štúdii fázy 2 na potvrdenie dávky u účastníkov vo veku 18 rokov a starších (NCT04405076). V tejto štúdii dostalo 198 účastníkov dve dávky (0,5 ml, 100 mikrogramov s odstupom 1 mesiaca) vakcíny Spikevax (pôvodná) ako primárny cyklus. V otvorenej fáze dostalo 149 z týchto účastníkov (
Per Protocol Set) jednu posilňovaciu dávku (0,25 ml, 50 mikrogramov) najmenej 6 mesiacov po očkovaní druhou dávkou v primárnom cykle. Ukázalo sa, že jedna posilňovacia dávka (0,25 ml, 50 mikrogramov) viedla ku geometrickému priemernému násobnému zvýšeniu (geometric mean fold rise, GMFR) 12,99 (95 % IS:
11,04; 15,29) neutralizačných protilátok z obdobia pred posilňovacou dávkou v porovnaní s obdobím
28 dní po posilňovacej dávke. GMFR neutralizačných protilátok bol 1,53 (95 % IS: 1,32; 1,77) pri porovnaní obdobia 28 dní po 2. dávke (primárny cyklus) s obdobím 28 dní po posilňovacej dávke.
Imunogenita posilňovacej dávky po primárnom cykle inou schválenou vakcínou proti COVID-19
u dospelých
Bezpečnosť a imunogentia heterológnej posilňovacej dávky vakcínou Spikevax (pôvodná) sa skúmala v štúdii iniciovanom skúšajúcim so 154 účastníkmi. Minimálny časový interval medzi primárnym cyklom používajúcim vakcínu proti COVID-19 na báze vektora alebo na báze RNA a posilňovacou vakcínou Spikevax (pôvodná) bol 12 týždňov (rozsah: 12 týždňov až 20,9 týždňov). Dávka používaná na posilnenie v tejto štúdii bola 100 mikrogramov. Titre neutralizačných protilátok merané pseudovírusovým neutralizačným testom sa hodnotili v 1. deň pred podaním a 15. deň a 29. deň po podaní posilňovacej dávky. Odpoveď na posilňovaciu dávku bola preukázaná bez ohľadu na primárne očkovanie.
Dostupné sú len krátkodobé údaje o imunogenite. Dlhodobá ochrana a imunologická pamäť nie sú v súčasnosti známe.
Bezpečnosť a imunogenita siedmich vakcín proti COVID-19 ako tretej dávky (posilňovacej dávky) vo
Veľkej Británii
COV-BOOST je multicentrická, randomizovaná štúdia fázy 2 iniciovaná skúšajúcim, skúmajúca tretiu posilňovaciu dávku očkovania proti COVID-19 s podskupinou na podrobné imunologické skúmanie. Účastníkmi boli dospelí vo veku 30 rokov a starší, v dobrom fyzickom zdraví (boli povolené mierne
až stredne závažné, dobre kontrolované komorbidity), ktorí dostali dve dávky buď vakcíny
Pfizer/BioNTech alebo Oxford/AstraZeneca (prvá dávka v decembri 2020, januári 2021 alebo
februári 2021) a v čase ich zaradenia do skúšania uplynulo najmenej 84 dní po druhej dávke. Vakcína Spikevax (pôvodná) posilnila protilátkové a neutralizačné odpovede a bola dobre znášaná bez ohľadu na primárny cyklus. Dávka použitá na posilnenie v tejto štúdii bola 100 mikrogramov. Titre neutralizačných protilátok merané pseudovírusovým neutralizačným testom sa hodnotili v 28. deň po posilňovacej dávke.
Neutralizačné protilátky proti B.1.617.2 (Delta) variantu pred podaním a po podaní posilňovacej
dávky u dospelých
Výsledky pseudovírusového neutralizačného testu (PsVNA) proti B.1.617.2 (Delta) variantu stanovené pred podaním posilňovacej dávky a 29. deň po podaní posilňovacej dávky ukázali, že podanie posilňovacej dávky vakcíny Spikevax (pôvodná) (0,25 ml, 50 mikrogramov) u dospelých indukovalo 17-násobné zvýšenie neutralizačných protilátok proti Delta variantu v porovnaní
s hladinami pred podaním posilňovacej dávky (GMFR = 17,28; 95 % IS: 14,38; 20,77; n = 295).
Klinická účinnosť u dospievajúcich vo veku od 12 do 17 rokov
V prebiehajúcej randomizovanej, placebom kontrolovanej klinickej štúdii fázy 2/3 zaslepenej pre pozorovateľa (NCT04649151) u dospievajúcich sa hodnotila bezpečnosť, reaktogenita a účinnosť vakcíny Spikevax (pôvodná) u dospievajúcich vo veku od 12 do 17 rokov. Účastníci so známou anamnézou infekcie vírusom SARS-CoV-2 boli z účasti na klinickej štúdii vylúčení. Celkovo bolo
3 732 účastníkov randomizovaných v pomere 2 : 1 pre podávanie 2 dávok vakcíny Spikevax
(pôvodná) alebo fyziologického roztoku ako placeba s časovým odstupom 1 mesiaca.
Sekundárna analýza účinnosti sa vykonala u 3 181 účastníkov, ktorým boli podané 2 dávky vakcíny Spikevax (pôvodná) (n = 2 139) alebo placeba (n = 1 042) a ktorí mali negatívny východiskový status SARS CoV-2 v súbore podľa protokolu. Medzi účastníkmi, ktorým bola podaná vakcína Spikevax (pôvodná), a účastníkmi, ktorým bolo podané placebo, neboli žiadne významné rozdiely
v demografických charakteristikách ani v už existujúcich zdravotných stavoch.
Ochorenie COVID-19 bolo definované ako symptomatické ochorenie COVID-19 potvrdené pozitívnym výsledkom RT-PCR testu a najmenej 2 systémové príznaky alebo 1 respiračný príznak. Ide o prípady od 14. dňa po druhej dávke.
V skupine s vakcínou Spikevax (pôvodná) sa vyskytlo nula symptomatických prípadov ochorenia
COVID-19 a v skupine s placebom 4 symptomatické prípady ochorenia COVID-19.
Imunogenita u dospievajúcich vo veku od 12 do 17 rokov po primárnom cykle očkovania vakcínou
Spikevax
Analýza non-inferiority hodnotiaca 50 % neutralizačné titre SARS- CoV- 2 a miery sérologickej
odpovede 28 dní po 2. dávke bola vykonaná v podskupinách na hodnotenie imunogenity podľa protokolu u dospievajúcich vo veku od 12 do 17 rokov (n = 340) v štúdii u dospievajúcich
a u účastníkov vo veku od 18 do 25 rokov (n = 296) v štúdii u dospelých. Účastníci nevykazovali na začiatku štúdie žiaden imunologický ani virologický dôkaz o predchádzajúcej infekcii SARS- CoV- 2. Pomer geometrického priemeru (geometric mean ratio, GMR) titrov neutralizačných protilátok
u dospievajúcich vo veku od 12 do 17 rokov v porovnaní s účastníkmi vo veku od 18 do 25 rokov bol
1,08 (95 % IS: 0,94; 1,24). Rozdiel v miere sérologickej odpovede bol 0,2 % (95 % IS: -1,8; 2,4).
Kritériá non-inferiority (dolná hranica 95 % IS pri GMR > 0,67 a dolná hranica 95 % IS rozdielu v miere sérologickej odpovede > -10 %) boli splnené.
Imunogenita u dospievajúcich vo veku 12 až 17 rokov – po posilňovacej dávke Spikevax (pôvodnej)
Primárnym cieľom hodnotenia imunogenity posilňovacej fázy v tejto štúdii bolo vyhodnotiť
účinnosť posilňovacej dávky u účastníkov vo veku 12 až 17 rokov porovnaním imunitných odpovedí po posilňovacej dávke (29. deň) s imunitnými odpoveďami získanými po 2. dávke primárneho cyklu (57. deň) u mladých dospelých (vo veku 18 až 25 rokov) v štúdii dospelých. Účinnosť posilňovacej dávky 50 mikrogramov Spikevaxu sa vyhodnotí, ak imunitné odpovede po posilňovacej dávke (geometrický priemer koncentrácie (GMC), titre neutralizačných protilátok (nAb) a miera sérologickej odpovede (SRR)) spĺňajú vopred stanovené kritériá non-inferiority (pre GMC aj SRR) v porovnaní s odpoveďami nameranými po ukončení primárneho cyklu 100 mikrogramov Spikevaxu medzi podskupinou mladých dospelých (18 až 25 rokov) v kľúčovej štúdii účinnosti u dospelých.
V otvorenej fáze tejto štúdie dostali účastníci vo veku od 12 do 17 rokov jednu posilňovaciu dávku najmenej 5 mesiacov po ukončení primárneho cyklu (dve dávky s odstupom 1 mesiaca). Populácia na analýzu primárnej imunogenity v tejto štúdii zahŕňala 257 účastníkov pre posilňovaciu dávku a náhodnú podskupinu 295 účastníkov zo štúdie mladých dospelých (vo veku ≥ 18 až ≤ 25 rokov), ktorí predtým absolvovali primárny očkovací cyklus dvoch dávok Spikevaxu s odstupom 1 mesiaca. Obe skupiny účastníkov zaradených do analyzovanej populácie nemali pred prvou dávkou primárneho cyklu a pred posilňovacou dávkou žiadne sérologické ani virologické dôkazy o infekcii SARS-CoV-2.
Pomer geometrického priemeru (GMR) u dospievajúcich s posilňovacou dávkou na 29. deň pri GMC v porovnaní s mladými dospelými: GMR v 57. dni bol 5,1 (95 % CI: 4,5, 5,8), čo spĺňa kritériá non- inferiority (t. j. dolná hranica 95 % CI > 0,667 (1/1,5); bodový odhad ≥ 0,8); rozdiel miery sérologickej odpovede (SRR) bol 0,7 % (95 % CI: -0,8, 2,4), čo spĺňa kritériá non-inferiority (dolná hranica 95 % rozdiel miery sérologickej odpovede (SRR) > -10 %).
U 257 účastníkov bol geometrický priemer koncentrácie (GMC) titrov neutralizačných protilátok (nAb) pred podaním posilňovacej dávky (1. deň) 400,4 (95 % CI: 370,0, 433,4); v 29. dni po podaní posilňovacej dávky bol GMC 7 172,0 (95 % CI: 6610,4, 7781,4). Po podaní posilňovacej dávky v 29. deň sa GMC zvýšil približne 18-násobne oproti GMC pred podaním posilňovacej dávky, čo dokazuje účinnosť posilňovacej dávky pre dospievajúcich. Miera sérologickej odpovede (SRR) bola 100 (95 % CI: 98,6, 100,0).
Predpokladané kritériá úspešnosti hodnotenia primárneho cieľa imunogenity boli splnené, čo umožnilo na základe štúdie u dospelých vyvodiť záver o účinnosti vakcíny.
Klinická účinnosť u detí vo veku od 6 rokov do 11 rokov
Pediatrická štúdia je prebiehajúca, randomizovaná, placebom kontrolovaná klinická štúdia fázy 2/3 zaslepená pre pozorovateľa na vyhodnotenie bezpečnosti, reaktogenity a účinnosti vakcíny Spikevax (pôvodná) u detí vo veku od 6 rokov do 11 rokov v USA a Kanade (NCT04796896). Účastníci so známou anamnézou infekcie vírusom SARS-CoV-2 boli z účasti na klinickej štúdii vylúčení. Celkovo
4 011 účastníkov bolo randomizovaných v pomere 3 : 1 pre podávanie 2 dávok vakcíny Spikevax
(pôvodná) alebo fyziologického roztoku ako placeba s časovým odstupom 1 mesiaca.
Sekundárna analýza účinnosti hodnotiaca potvrdené prípady COVID-19, ktoré sa nazbierali až do dátumu ukončenia zberu údajov 10. novembra 2021, sa vykonala u 3 497 účastníkov, ktorí dostali dve dávky (0,25 ml v 0. a 1. mesiaci) vakcíny Spikevax (pôvodná) (n = 2 644) alebo placebo (n = 853)
a mali negatívny východiskový status SARS-CoV-2 v súbore podľa protokolu (Per Protocol Set). Medzi účastníkmi, ktorým bola podaná vakcína Spikevax (pôvodná), a účastníkmi, ktorým bolo podané placebo, neboli žiadne významné rozdiely v demografických charakteristikách.
Ochorenie COVID-19 bolo definované ako symptomatické ochorenie COVID-19 potvrdené pozitívnym výsledkom RT-PCR testu a najmenej 2 systémovými príznakmi alebo 1 respiračným príznakom. Ide o prípady od 14. dňa po druhej dávke.
V skupine s vakcínou Spikevax (pôvodná) sa vyskytli tri prípady ochorenia COVID-19 (0,1 %)
a v skupine s placebom štyri prípady chorenia COVID-19 (0,5 %).
Imunogenita u detí vo veku od 6 do 11 rokov
Analýza hodnotiaca 50 % neutralizačné titre SARS-CoV-2 a miery sérologickej odpovede 28 dní po
2. dávke bola vykonaná v podskupine detí vo veku od 6 rokov do 11 rokov (n = 319) v pediatrickej
štúdii a u účastníkov vo veku od 18 do 25 rokov (n = 295) v štúdii u dospelých. Účastníci nevykazovali na začiatku štúdie žiadny imunologický ani virologický dôkaz predchádzajúcej infekcie SARS-CoV-2. GMR titrov neutralizačných protilátok u detí vo veku od 6 rokov do 11 rokov
v porovnaní s osobami vo veku od 18 do 25 rokov bol 1,239 (95 % IS: 1,072; 1,432). Rozdiel v miere sérologickej odpovede bol 0,1 % (95 % IS: -1,9; 2,1). Kritériá non-inferiority (dolná hranica 95 % IS pri GMR > 0,67 a dolná hranica 95 % IS rozdielu v miere sérologickej odpovede > -10 %) boli splnené.
Imunogenita u detí vo veku od 6 do 11 rokov – po posilňovacej dávke Spikevax (pôvodnej) Primárnym cieľom hodnotenia imunogenity posilňovacej fázy v tejto štúdii bolo vyhodnotiť účinnosť posilňovacej dávky u účastníkov vo veku 6 rokov až 11 rokov porovnaním imunitných odpovedí po posilňovacej dávke (29. deň) s imunitnými odpoveďami získanými po 2. dávke primárneho cyklu (57. deň) u mladých dospelých (vo veku 18 až 25 rokov) v tejto štúdii, v ktorej sa
preukázala 93 % účinnosť. Účinnosť posilňovacej dávky 25 mikrogramov Spikevaxu sa odvodzuje, ak imunitné odpovede po podaní posilňovacej dávky (geometrická priemerná koncentrácia (GMC) neutralizačných protilátok (nAb) a miera sérologickej odpovede (SRR)) spĺňajú vopred stanovené kritériá non-inferiority (pre GMC aj SRR) v porovnaní s odpoveďami nameranými po ukončení primárneho cyklu 100 mikrogramov Spikevaxu medzi podskupinou mladých dospelých (18 až 25 rokov) v kľúčovej štúdii účinnosti u dospelých.
V otvorenej fáze tejto štúdie dostali účastníci vo veku od 6 do 11 rokov jednu posilňovaciu dávku najmenej 6 mesiacov po ukončení primárneho cyklu (dve dávky s odstupom 1 mesiaca). Populácia na analýzu primárnej imunogenity zahŕňala 95 účastníkov s posilňovacou dávkou vo veku 6 až 11 rokov a náhodnú podskupinu 295 účastníkov zo štúdie mladých dospelých, ktorí dostali dve dávky
Spikevaxu s odstupom 1 mesiaca. Obe skupiny účastníkov zaradených do populácie na analýzu nemali
pred prvou dávkou primárneho cyklu a pred posilňovacou dávkou žiadne sérologické alebo virologické dôkazy o infekcii SARS-CoV-2.
U 95 účastníkov bola v 29. deň podania posilňovacej dávky hodnota geometrického priemeru koncentrácie (GMC) 5847,5 (95 % CI: 4999,6, 6839,1). Miera sérologickej odpovede SRR bola 100 (95 % CI: 95,9, 100,0). Skúmali sa sérové hladiny titrov neutralizačných protilátok (nAb) u detí vo veku 6 až 11 rokov v podskupine imunogenity Per Protocol s negatívnym stavom pred podaním posilňovacej dávky SARS-CoV-2 a porovnanie s hladinami u mladých dospelých (18 až 25 rokov). Pomer geometrického priemeru (GMR) pri GMC s posilňovacou dávkou na 29. deň v porovnaní s GMC u mladých dospelých v 57. dni bol 4,2 (95 % CI: 3,5, 5,0), čo spĺňa kritériá non-inferiority (t. j.
dolná hranica 95 % CI > 0,667); rozdiel SRR bol 0,7 % (95 % CI: -3,5, 2,4), čo spĺňa kritériá non-
inferiority (dolná hranica 95 % rozdielu v miere sérologickej odpovede SRR > -10 %).
Predpokladané vopred stanovené kritériá úspešnosti pre primárny cieľ imunogenity boli splnené, čo umožnilo vyvodiť záver o účinnosti posilňovacej dávky vakcíny. Rýchla reakcia na odpoveď očkovacej látky, ktorá sa prejavila do 4 týždňov od podania posilňovacej dávky, je dôkazom silného prvotného očkovania vyvolaného primárnym cyklom Spikevaxu.
Neutralizačné protilátky proti B.1.617.2 (Delta) variantu u detí vo veku od 6 rokov do 11 rokov Vzorky séra podskupín na hodnotenie imunogenity podľa protokolu (n = 134) prebiehajúcej pediatrickej štúdie získané na začiatku štúdie a v 57. deň sa testovali použitím PsVNA na základe B.1.617.2 (Delta) variantu. U detí vo veku od 6 rokov do 11 rokov bol GMFR od začiatku štúdie po
57. deň 81,77 (95 % IS: 70,38; 95,00) pre Delta variant (meraný PsVNA). Okrem toho 99,3 % detí
splnilo definíciu sérologickej odpovede.
Klinická účinnosť u detí vo veku od 6 mesiacov do 5 rokov
Prebiehajúca štúdia fázy 2/3 sa uskutočnila s cieľom vyhodnotiť bezpečnosť, znášanlivosť,
reaktogenitu a účinnosť vakcíny Spikevax u zdravých detí vo veku od 6 mesiacov do 11 rokov. Do štúdie boli zaradené deti v 3 vekových skupinách: od 6 rokov do 11 rokov; od 2 rokov do 5 rokov; a od 6 mesiacov do 23 mesiacov.
U 5 476 účastníkov vo veku od 6 mesiacov do 5 rokov, ktorí dostali dve dávky (v 0. a 1. mesiaci) vakcíny Spikevax (n = 4 105) alebo placebo (n = 1 371) a mali negatívny východiskový status SARS- CoV-2 v súbore na hodnotenie účinnosti podľa protokolu (Per Protocol Set for Efficacy), sa vykonala deskriptívna analýza účinnosti hodnotiaca potvrdené prípady COVID-19 získané do dátumu ukončenia získavania údajov 21. februára 2022. Medzi účastníkmi, ktorým bola podaná vakcína Spikevax, a účastníkmi, ktorým bolo podané placebo, neboli žiadne významné rozdiely v demografických charakteristikách.
Medián dĺžky sledovania účinnosti po 2. dávke bol 71 dní u účastníkov vo veku od 2 rokov do 5 rokov a 68 dní u účastníkov vo veku od 6 mesiacov do 23 mesiacov.
Účinnosť vakcíny v tejto štúdii bola pozorovaná v období, keď v obehu prevažujúcim variantom bol variant B.1.1.529 (Omicron).
Účinnosť vakcíny v 2. časti pre súbor na hodnotenie účinnosti podľa protokolu pre prípady COVID-19
14 dní alebo viac po 2. dávke s použitím „definície prípadu COVID-19 P301“ (t. j. definície použitej
v kľúčovej štúdii účinnosti u dospelých) bola 36,8 % (95 % IS: 12,5, 54,0) pre deti od 2 rokov do 5
rokov a 50,6 % (95 % IS: 21,4, 68,6) pre deti vo veku od 6 mesiacov do 23 mesiacov.
Imunogenita u detí vo veku od 6 mesiacov do 5 rokov
V prípade detí vo veku od 2 rokov do 5 rokov porovnanie odpovedí nAb (neutralizačnými protilátkami) z 57. dňa v tejto časti 2, v podskupine imunogenity podľa protokolu (n = 264;
25 mikrogramov) s odpoveďami mladých dospelých (n = 295; 100 mikrogramov) preukázalo GMR
1,014 (95 % IS: 0,881, 1,167), čo spĺňa kritériá non-inferiority (t. j. dolná hranica 95 % IS pre GMR ≥ 0,67; bodový odhad ≥ 0,8). Geometrické priemerné násobné zvýšenie (GMFR) od východiskovej hodnoty do 57. dňa u týchto detí bol 183,3 (95 % IS: 164,03, 204,91). Rozdiel v miere sérologickej odpovede (SRR) medzi deťmi a mladými dospelými bol -0,4 % (95 % IS: -2,7 %, 1,5 %), čo tiež spĺňa kritériá non-inferiority (dolná hranica 95 % IS rozdielu SRR > -10 %).
V prípade dojčiat a batoliat vo veku od 6 mesiacov do 23 mesiacov sa porovnaním odpovedí neutralizačnými protilátkami z 57. dňa v tejto časti 2, v podskupine na hodnotenie imunogenity podľa protokolu (n = 230; 25 mikrogramov) s odpoveďami mladých dospelých (n = 295; 100 mikrogramov) preukázal GMR 1,280 (95 % IS: 1,115, 1,470), čo spĺňa kritériá non-inferiority (t. j. dolná hranica
95 % IS pre GMR ≥ 0,67; bodový odhad ≥ 0,8). Rozdiel v miere SRR medzi dojčatami/batoľatami a mladými dospelými bol 0,7 % (95 % IS: -1,0 %, 2,5 %), čo tiež spĺňa kritériá non-inferiority (dolná hranica 95 % IS rozdielu v miere sérologickej odpovede > -10 %).
V súlade s tým boli vopred stanovené kritériá úspešnosti pre primárny cieľ imunogenity splnené pre obe vekové skupiny, čo umožnilo vyvodiť účinnosť 25 mikrogramov u detí vo veku od 2 rokov do
5 rokov a u dojčiat a batoliat vo veku od 6 mesiacov do 23 mesiacov (tabuľky 4 a 5).
Tabuľka 4. Zhrnutie pomeru geometrického priemeru koncentrácie a miery sérologickej odpovede – porovnanie osôb vo veku od 6 mesiacov do 23 mesiacov s účastníkmi vo veku od18 rokov do 25 rokov – súbor na hodnotenie imunogenity podľa protokolu
| od 6 mesiacov do
23 mesiacov
n = 230
| od 18 rokov do
25 rokov
n = 291
| od 6 mesiacov do
23 mesiacov/
od 18 rokov do 25 rokov
|
Test
| Časový bod
| GMC (95 % IS)*
| GMC (95 % IS)*
| Pomer GMC (95 % IS)a
| Splnený cieľ non- inferiority (Á/N)b
|
SARS-CoV-2 neutralizačný testc
|
28 dní
po
2. dávke
| 1 780,7
(1 606,4; 1 973,8)
| 1 390,8
(1 269,1; 1 524,2)
| 1,3
(1,1; 1,5)
|
Á
|
Sérologická odpoveď
% (95 % IS)d
|
Sérologická odpoveď
% (95 % IS)d
|
Rozdiel v miere sérologickej odpovede % (95 % IS)e
|
100 (98,4; 100)
| 99,3 (97,5; 99,9)
| 0,7
(-1,0; 2,5)
|
GMC = geometrický priemer koncentrácie
n = počet účastníkov s nechýbajúcimi údajmi na začiatku a v 57. deň
*Hodnoty protilátok uvádzané ako hodnoty pod dolnou hranicou stanovenia (LLOQ) sa nahrádzajú hodnotou 0,5 x LLOQ. Hodnoty vyššie ako horná hranica stanovenia (ULOQ) sa nahradia hodnotou
ULOQ, ak nie sú k dispozícii skutočné hodnoty.
a Hladiny protilátok po logaritmickej transformácii sa analyzujú pomocou modelu analýzy kovariancie
(ANCOVA) s premennou skupiny (účastníci vo veku od 6 mesiacov do 5 rokov a mladí dospelí) ako
fixným efektom. Výsledné stredné hodnoty LS, rozdiel stredných hodnôt LS a 95 % IS sú na účely prezentácie spätne transformované na pôvodnú stupnicu.
b Non-inferiorita sa vyhlási, ak dolná hranica 2-stranného 95 % IS pre pomer GMC je väčšia ako 0,67
s bodovým odhadom > 0,8 a dolná hranica 2-stranného 95 % IS pre rozdiel v miere sérologickej
odpovede je väčšia ako -10 % s bodovým odhadom > 5 %.
c Konečné geometrické priemery koncentrácie protilátok (GMC) v AU/ml boli stanovené pomocou mikronutralizačného testu SARS-CoV-2.
d Sérologická odpoveď v dôsledku očkovania špecifického pre SARS-CoV-2 RVP koncentrácia neutralizačných protilátok na úrovni subjektu je v protokole definovaná ako zmena z hodnoty pod LLOQ na hodnotu rovnú alebo vyššiu ako 4 x LLOQ, alebo aspoň 4-násobné zvýšenie, ak je východisková
hodnota rovná alebo vyššia ako LLOQ. Sérologická odpoveď 95 % IS sa vypočíta pomocou
Clopperovej-Pearsonovej metódy.
e Rozdiel v miere sérologickej odpovede 95 % IS je vypočítaný pomocou Miettinen-Nurminenových
(skóre) hraníc spoľahlivosti.
Tabuľka 5. Zhrnutie pomeru geometrického priemeru koncentrácií a miery sérologických odpovedí – porovnanie osôb vo veku od 2 rokov do 5 rokov s účastníkmi vo veku od 18 do25 rokov – súbor na hodnotenie imunogenity podľa protokolu
| od 2 rokov do
5 rokov
n = 264
| od 18 rokov do
25 rokov
n = 291
| od 2 rokov d 5 rokov/
od 18 rokov do 25 rokov
|
Test
| Časový
bod
| GMC (95 % IS)*
| GMC (95 % IS)*
| Pomer GMC (95% IS)a
| Splnený cieľ
non-inferiority
(Á/N)b
|
| | | | | |
SARS-CoV-2 neutralizačný testc
|
28 dní po
2. dávke
|
1 410,0
(1 273,8; 1 560,8)
|
1 390,8
(1 262,5; 1 532,1)
|
1,0 (0,9; 1,2)
|
Á
|
S
ér
ologická odpoveď
%
(
95 % IS)
d
|
S
ér
ologická odpoveď
%
(
95 % IS)
d
|
R
ozdiel v miere sérologickej odpovede % (95 % IS)
e
|
98,9 (96,7; 99,8)
|
99,3 (97,5; 99,9)
|
-0,4
(-2,7; 1,5)
|
GMC = geometrický priemer koncentrácie
n = počet účastníkov s nechýbajúcimi údajmi na začiatku a v 57. deň
*Hodnoty protilátok uvádzané ako hodnoty pod dolnou hranicou stanovenia (LLOQ) sa nahrádzajú
hodnotou 0,5 x LLOQ. Hodnoty vyššie ako horná hranica stanovenia (ULOQ) sa nahradia hodnotou
ULOQ, ak nie sú k dispozícii skutočné hodnoty.
a Hladiny protilátok po logaritmickej transformácii sa analyzujú pomocou modelu analýzy kovariancie
(ANCOVA) s premennou skupiny (účastníci vo veku od 6 mesiacov do 5 rokov a mladí dospelí) ako
fixným efektom. Výsledné stredné hodnoty LS, rozdiel stredných hodnôt LS a 95 % IS sú na účely prezentácie spätne transformované na pôvodnú stupnicu.
b Non-inferiorita sa vyhlási, ak dolná hranica 2-stranného 95 % IS pre pomer GMC je väčšia ako 0,67
s bodovým odhadom > 0,8 a dolná hranica 2-stranného 95 % IS pre rozdiel v miere sérologickej odpovede je väčšia ako -10 % s bodovým odhadom > 5 %.
c Konečné geometrické priemery koncentrácie protilátok (GMC) v AU/ml boli stanovené pomocou
mikronutralizačného testu SARS-CoV-2.
d Sérologická odpoveď v dôsledku očkovania špecifického pre SARS-CoV-2 RVP koncentrácia neutralizačných protilátok na úrovni subjektu je v protokole definovaná ako zmena z hodnoty pod LLOQ
na hodnotu rovnú alebo vyššiu ako 4 x LLOQ, alebo aspoň 4-násobné zvýšenie, ak je východisková hodnota rovná alebo vyššia ako LLOQ. Sérologická odpoveď 95 % IS sa vypočíta pomocou Clopperovej-Pearsonovej metódy.
e Rozdiel v miere sérologickej odpovede 95 % IS je vypočítaný pomocou Miettinen-Nurminenových
(skóre) hraníc spoľahlivosti.
Staršie osobyVakcína Spikevax (pôvodná) bola hodnotená u osôb vo veku 6 mesiacov a starších
vrátane 3 768 účastníkov vo veku 65 rokov a starších. Účinnosť vakcíny Spikevax (pôvodná)
u starších osôb (≥ 65 rokov) zodpovedala účinnosti u mladších dospelých účastníkov (18 – 64 rokov).
Pediatrická populáciaEurópska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s vakcínou Spikevax
(pôvodná) v jednej alebo vo viacerých podskupinách pediatrickej populácie na prevenciu
COVID-19 (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiNeaplikovateľné.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe obvyklých štúdií toxicity po opakovanom podávaní a reprodukčnej a vývinovej toxicity neodhalili žiadne osobitné riziko pre ľudí.
Celková toxicitaŠtúdie celkovej toxicity sa uskutočnili na potkanoch (intramuskulárne podané až do 4 dávok viac než
dávka u ľudí raz za 2 týždne). Pozoroval sa prechodný a reverzibilný edém a erytém v mieste podania
injekcie, a prechodné a reverzibilné zmeny vo výsledkoch laboratórnych testov (vrátane zvýšených hodnôt eozinofilov, aktivovaného parciálneho tromboplastínového času a fibrinogénu). Výsledky naznačujú, že riziko toxicity u ľudí je nízke.
Genotoxicita/karcinogenita
In vitro a in vivo štúdie genotoxicity sa vykonali v prípade novej lipidovej zložky SM-102 vakcíny.
Výsledky naznačujú nízky potenciál genotoxicity u ľudí. Neboli vykonané štúdie karcinogenity.
Reprodukčná toxicita
V štúdii vývinovej toxicity sa 0,2 ml forma očkovacej látky obsahujúca rovnaké množstvo mRNA
(100 mikrogramov) a ďalšie zložky ako jednorazová dávka vakcíny Spikevax (pôvodná) podávaná
u ľudí podávala samiciam potkanov intramuskulárnou cestou štyrikrát: 28 a 14 dní pred párením a v 1. a 13. gestačný deň. Imunitná odpoveď prostredníctvom protilátok proti SARS-CoV-2 sa vyskytla
u zvierat-matiek pred párením až do konca štúdie v 21. dni laktácie, ako aj u plodov a potomkov. Nevyskytli sa žiadne nežiaduce účinky na samičiu fertilitu, graviditu, embryofetálny, postnatálny vývoj alebo vývoj mláďat súvisiace s očkovacou látkou. K dispozícii nie sú žiadne údaje o prechode vakcíny Spikevax (pôvodná) cez placentu alebo o jej vylučovaní do mlieka.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
SM-102 (heptadekán-9-yl 8-{(2-hydroxyetyl)[6-oxo-6-(undecyloxy)hexyl]amino}oktanoát)
cholesterol
1,2-distearoyl-sn-glycero-3-fosfocholín (DSPC)
1,2-dimyristoyl-rac-glycero-3-metoxypolyetylénglykol-2000 (PEG2000-DMG)
trometamol
trometamólium-chlorid kyselina octová
octan sodný, trihydrát
sacharóza
voda na injekcie
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi ani riediť.
6.3 Čas použiteľnosti
Neotvorená viacdávkováinjekčná liekovka(SpikevaxbivalentOriginal/OmicronBA.4-5(50mikrogramov/50mikrogramov)/mlinjekčnádisperzia)
9 mesiacov pri teplote -50 °C až -15 °C.
V rámci 9-mesačného obdobia sa môže neotvorená injekčná liekovka s vakcínou po vybratí z mrazničky uchovávať v chladničke pri teplote 2 °C až 8 °C, chránená pred svetlom, maximálne po dobu 30 dní. Počas tohto obdobia sa vakcína môže prepravovať najviac 12 hodín pri teplote 2 °C až'
8 °C (pozri časť 6.4).
Chemická a fyzikálna stabilita bola tiež preukázaná pre neotvorené injekčné liekovky s vakcínou pri uchovávaní po dobu 12 mesiacov pri teplote -50 °C až -15 °C pod podmienkou, že po rozmrazení a uchovávaní pri teplote 2 °C až 8 °C, chránená pred svetlom, sa neotvorená injekčná liekovka
použije do maximálne 14 dní (namiesto 30 dní, ak sa uchováva pri teplote -50 ºC až -15 ºC po dobu
9 mesiacov) a celkový čas uchovávania nepresiahne 12 mesiacov.
Po rozmrazení sa vakcína nesmie znovu zmrazovať.
Neotvorená vakcína sa môže uchovávať po vybratí z chladničky po dobu maximálne 24 hodín pri
teplote 8 °C až 25 °C.
Prepichnutá viacdávkováinjekčná liekovka(SpikevaxbivalentOriginal/OmicronBA.4-5(50mikrogramov/50mikrogramov)/mlinjekčnádisperzia)
Chemická a fyzikálna stabilita počas používania bola preukázaná počas 19 hodín pri teplote 2 °C až
25 °C po prvom prepichnutí (v rámci povoleného času použiteľnosti 30 dní, respektíve 14 dní pri teplote 2 °C až 8 °C a vrátane 24 hodín pri teplote 8 °C až 25 °C). Z mikrobiologického hľadiska sa má liek použiť okamžite. Ak sa vakcína nepoužije okamžite, za čas použiteľnosti a podmienky uchovávania počas používania zodpovedá používateľ.
Neotvorená jednodávkováinjekčná liekovka(SpikevaxbivalentOriginal/OmicronBA.4-5
25 mikrogramov/25 mikrogramov injekčná disperzia)
9 mesiacov pri teplote -50 °C až -15 °C.
V rámci 9-mesačného obdobia sa môže neotvorená injekčná liekovka s vakcínou po vybratí z mrazničky uchovávať v chladničke pri teplote 2 °C až 8 °C, chránená pred svetlom, maximálne po dobu 30 dní. Počas tohto obdobia sa vakcína môže prepravovať najviac 12 hodín pri teplote 2 °C až
8 °C (pozri časť 6.4).
Chemická a fyzikálna stabilita bola tiež preukázaná pre neotvorené injekčné liekovky s vakcínou pri uchovávaní po dobu 12 mesiacov pri teplote -50 °C až -15 °C pod podmienkou, že po rozmrazení a uchovávaní pri teplote 2 °C až 8 °C, chránená pred svetlom, sa neotvorená injekčná liekovka
použije do maximálne 14 dní (namiesto 30 dní, ak sa uchováva pri teplote -50 ºC až -15 ºC po dobu
9 mesiacov) a celkový čas uchovávania nepresiahne 12 mesiacov.
Po rozmrazení sa vakcína nesmie znovu zmrazovať.
Neotvorená vakcína sa môže uchovávať po vybratí z chladničky po dobu maximálne 24 hodín pri
teplote 8 °C až 25 °C.
SpikevaxbivalentOriginal/OmicronBA.4-5
25 mikrogramov/25mikrogramovinjekčnádisperziavnaplnenejinjekčnejstriekačke
9 mesiacov pri teplote -50 °C až -15 °C.
V rámci 9-mesačného obdobia sa môžu naplnené injekčné striekačky po vybratí z mrazničky uchovávať v chladničke pri teplote 2 °C až 8 °C, chránené pred svetlom, maximálne po dobu 30 dní (pozri časť 6.4).
Chemická a fyzikálna stabilita bola tiež preukázaná pre neotvorené naplnené injekčné striekačky pri uchovávaní po dobu 12 mesiacov pri teplote -50 °C až -15 °C pod podmienkou, že po rozmrazení a uchovávaní pri teplote 2 °C až 8 °C, chránená pred svetlom, sa naplnená injekčná striekačka
použije do maximálne 14 dní (namiesto 30 dní, ak sa uchováva pri teplote -50 ºC až -15 ºC po dobu
9 mesiacov) a celkový čas uchovávania nepresiahne 12 mesiacov.
Po rozmrazení sa vakcína nesmie znovu zmrazovať.
Naplnené injekčné striekačky sa môžu uchovávať po vybratí z chladničky po dobu maximálne
24 hodín pri teplote 8 °C až 25 °C.
6.4 Špeciálne upozornenia na uchovávanie
S
pikevax
bivalent
O
r
i
ginal/Omicron
B
A
.
4-5
(
50
m
i
krogramov/50
m
i
krogramov)/ml
i
njekčná
disperzia
(viacdávkové
i
njekčné
li
ekovky)
Uchovávajte v mrazničke pri teplote od -50 °C do -15 °C.
Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom. Podmienky uchovávania po rozmrazení a prvom otvorení, pozri časť 6.3.
Podmienky uchovávania viacdávkovej injekčnej liekovky po prvom otvorení, pozri časť 6.3.
Preprava rozmrazených viacdávkových injekčných liekoviek v tekutom stave pri teplote 2 °C až 8 °C Ak nie je možná preprava pri teplote -50 °C až -15 °C, podľa dostupných údajov je možná preprava jednej alebo viacerých rozmrazených injekčných liekoviek v tekutom stave trvajúca najviac 12 hodín pri teplote 2 °C až 8 °C (v rámci času použiteľnosti 30 dní, respektíve 14 dní pri teplote 2 °C až 8 °C). Po rozmrazení a preprave v tekutom stave pri teplote 2 °C až 8 °C sa injekčné liekovky nemajú znovu zmrazovať a až do použitia sa majú uchovávať pri teplote 2 °C až 8 °C.
SpikevaxbivalentOriginal/OmicronBA.4-525mikrogramov/25 mikrogramovinjekčnádisperzia
(jednodávkové injekčné liekovky)
Uchovávajte v mrazničke pri teplote od -50 °C do -15 °C.
Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom. Podmienky uchovávania po rozmrazení a prvom otvorení, pozri časť 6.3.
Preprava rozmrazených jednodávkových injekčných liekoviek v tekutom stave pri teplote 2 °C až 8 °C Ak nie je možná preprava pri teplote -50 °C až -15 °C, podľa dostupných údajov je možná preprava jednej alebo viacerých rozmrazených injekčných liekoviek v tekutom stave trvajúca najviac 12 hodín pri teplote 2 °C až 8 °C (v rámci času použiteľnosti 30 dní, respektíve 14 dní pri teplote 2 °C až 8 °C). Po rozmrazení a preprave v tekutom stave pri teplote 2 °C až 8 °C sa injekčné liekovky nemajú znovu zmrazovať a až do použitia sa majú uchovávať pri teplote 2 °C až 8 °C.
SpikevaxbivalentOriginal/OmicronBA.4-525mikrogramov/25mikrogramovinjekčnádisperziavnaplnenejinjekčnejstriekačke
Uchovávajte v mrazničke pri teplote od -50 °C do -15 °C.
Naplnenú injekčnú striekačku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky uchovávania po rozmrazení a prvom otvorení, pozri časť 6.3.
Preprava rozmrazených naplnených injekčných striekačiek v tekutom stave pri teplote 2 °C až 8 °C Ak nie je možná preprava pri teplote -50 °C až -15 °C, podľa dostupných údajov je možná preprava jednej alebo viacerých rozmrazených injekčných liekoviek v tekutom stave pri teplote 2 °C až 8 °C (v rámci času použiteľnosti 30 dní, respektíve 14 dní pri teplote 2 °C až 8 °C). Po rozmrazení a preprave v tekutom stave pri teplote 2 °C až 8 °C sa injekčné liekovky nemajú znovu zmrazovať a až do použitia sa majú uchovávať pri teplote 2 °C až 8 °C.
6.5 Druh obalu a obsah balenia
SpikevaxbivalentOriginal/OmicronBA.4-5(50mikrogramov/50mikrogramov)/mlinjekčnádisperzia(viacdávkovéinjekčnéliekovky)
2,5 ml disperzie vo viacdávkovej injekčnej liekovke (sklo typu 1 alebo ekvivalent skla typu 1 alebo
cyklický olefínový polymér s vnútornou bariérovou vrstvou) so zátkou (chlórbutylová guma)
a modrým odklápacím plastovým viečkom s uzáverom (hliníkový uzáver).
Veľkosť balenia: 10 viacdávkových injekčných liekoviek. Každá injekčná liekovka obsahuje 2,5 ml.
S
pikevax
bivalent
O
r
i
ginal/Omicron
B
A
.
4-5
25
mikrogramov/25
mikrogramov
injekčná
disperzia
(
j
e
dnodávkové injekčné liekovky)0,5 ml disperzie v jednodávkovej injekčnej liekovke (sklo typu 1 alebo ekvivalent skla typu 1) so
zátkou (chlórbutylová guma) a modrým odklápacím plastovým viečkom s uzáverom (hliníkový uzáver).
Veľkosť balenia: 10 jednodávkových injekčných liekoviek. Každá injekčná liekovka obsahuje 0,5 ml.
SpikevaxbivalentOriginal/OmicronBA.4-525mikrogramov/25mikrogramovinjekčnádisperziavnaplnenej injekčnej striekačke0,5 ml disperzie v naplnenej injekčnej striekačke (cyklický olefínový polymér) s piestovou zátkou
(potiahnutá bromobutylová guma) a uzáverom hrotu (bromobutylová guma, bez ihly).
Naplnená injekčná striekačka je balená v 5 priehľadných blistroch, ktoré obsahujú 2 naplnené injekčné striekačky v každom blistri.
Veľkosť balenia: 10 naplnených injekčných striekačiek. Každá naplnená injekčná striekačka obsahuje
0,5 ml.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomTúto vakcínu má pripravovať a podávať vyškolený zdravotnícky pracovník aseptickým postupom na zabezpečenie sterility disperzie.
SpikevaxbivalentOriginal/OmicronBA.4-5(50mikrogramov/50mikrogramov)/mlinjekčnádisperzia(viacdávkovéinjekčnéliekovky)Po rozmrazení je vakcína pripravená na podanie.
Nepretrepávajte ani nerieďte. Obsah injekčnej liekovky krúživým pohybom opatrne premiešajte po rozmrazení a pred každým odobratím dávky.
Ubezpečte sa, že injekčná liekovka má modré odklápacie viečko a že názov lieku je Spikevax bivalent Original/Omicron BA.4-5. Ak má injekčná liekovka modré odklápacie viečko a názov lieku je Spikevax 0,1 mg/ml alebo Spikevax bivalent Original/Omicron BA.1, pozrite si Súhrn charakteristických vlastností lieku pre ten liek.
Zátku prepichnite podľa možností vždy na inom mieste.
V každej viacdávkovej injekčnej liekovke je určitý objem navyše, aby sa zabezpečilo, že možno odobrať 5 dávok po 0,5 ml.
Pred použitím rozmrazte každú viacdávkovú injekčnú liekovku podľa nižšie uvedených pokynov (Tabuľka 6). Po rozmrazení injekčnej liekovky v chladničke ju pred podaním nechajte 15 minút stáť pri izbovej teplote.
Tabuľka 6. Pokyny na rozmrazovanie viacdávkových injekčných liekoviek pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke)
|
Trvanie rozmrazova nia
| Teplota rozmrazovani a (pri izbovej teplote)
|
Trvanie rozmrazovania
|
Viacdávková injekčná liekovka
|
2 °C – 8 °C
|
2 hodiny a 30
minút
|
15 °C – 25 °C
|
1 hodina
|
 S
pikevax
bivalent
O
r
i
ginal/Omicron
B
A
.
1
25
mikrogramov/25
mikrogramov
injekčná
disperzia
(
j
e
dnodávkové injekčné liekovky)
S
pikevax
bivalent
O
r
i
ginal/Omicron
B
A
.
1
25
mikrogramov/25
mikrogramov
injekčná
disperzia
(
j
e
dnodávkové injekčné liekovky)Po rozmrazení je vakcína pripravená na použitie.
Nepretrepávajte ani nerieďte. Obsah injekčnej liekovky krúživým pohybom opatrne premiešajte po rozmrazení a pred odobratím dávky.
Ubezpečte sa, že injekčná liekovka má modré odklápacie viečko a že názov lieku je Spikevax bivalent Original/Omicron BA.4-5. Ak má injekčná liekovka modré odklápacie viečko a názov lieku je Spikevax bivalent Original/Omicron BA.1, pozrite si Súhrn charakteristických vlastností lieku pre ten liek.
Rozmrazte každú jednotlivú dávku podľa dole uvedených pokynov. Každú jednodávkovú injekčnú liekovku alebo vonkajší obal s 10 injekčnými liekovkami je možné rozmraziť, buď v chladničke, alebo pri izbovej teplote (Tabuľka 7). Pred podaním nechajte injekčnú liekovku 15 minút stáť pri izbovej teplote.
Tabuľka 7. Pokyny na rozmrazovanie jednodávkových injekčných liekoviek a vonkajších obalov pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke)
|
Trvanie rozmrazovania (minúty)
| Teplota rozmrazovani a (pri izbovej teplote)
|
Trvanie rozmrazovania (minúty)
|
Jednodávková injekčná liekovka
|
2 °C až 8 °C
| 45 minút
|
15 °C až 25 °C
| 15 minút
|
Vonkajší obal
| 2 °C až 8 °C
| 1 hodina 45 minút
| 15 °C až 25 °C
| 45 minút
|
Ak sa injekčné liekovky rozmrazujú pri teplote 2 až 8 °C, má sa pred podaním jednotlivá injekčná
liekovka ponechať približne 15 minút pri izbovej teplote (15 °C až 25 °C).
P
odávanie
V
a
kcína
s
a
m
usí
podávať
intramuskulárne.
Uprednostňovaným
miestom
je
deltový
sval
ramena.
N
e
podávajte túto vakcínu intravaskulárne, subkutánne ani intradermálne. ViacdávkovéinjekčnéliekovkyVakcínaSpikevaxbivalentOriginal/OmicronBA.4-525mikrogramov/25mikrogramovinjekčnádisperzia vnaplnenejinjekčnejstriekačke
ViacdávkovéinjekčnéliekovkyVakcínaSpikevaxbivalentOriginal/OmicronBA.4-525mikrogramov/25mikrogramovinjekčnádisperzia vnaplnenejinjekčnejstriekačkeObsah naplnenej injekčnej striekačky netrepte ani nerieďte.
Každá naplnená injekčná striekačka je určená len na jedno použitie. Po rozmrazení je vakcína pripravená na použitie.
Z každej naplnenej injekčnej striekačky možno podať jednu (1) dávku 0,5 ml.
Vakcína Spikevax bivalent Original/Omicron BA.4-5 sa dodáva ako jednodávková, naplnená injekčná striekačka (bez ihly) obsahujúca 0,5 ml (25 mikrogramov elazomeranu a 25 mikrogramov davezomeranu) mRNA a musí sa pred podaním rozmraziť.
Pred použitím každú naplnenú injekčnú striekačku rozmrazte podľa nasledujúcich pokynov. Injekčné striekačky sa môžu rozmrazovať v blistrových baleniach (každý blister obsahuje 2 naplnené injekčné striekačky) alebo vo svojom vonkajšom obale, buď v chladničke, alebo pri izbovej teplote (Tabuľka
8).
Tabuľka 8. Pokyny na rozmrazovanie naplnených injekčných striekačiek Spikevax bivalentOriginal/Omicron BA.4-5 a vonkajších obalov pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke) (°C)
|
Trvanie rozmrazovania (minúty)
|
Teplota rozmrazovani a
|
Trvanie rozmrazovania (minúty)
|
|
|
|
(
p
r
i izbovej teplote) (°C)
|
|
Naplnená injekčná striekačka
v blistrovom obale
|
2 – 8
|
55
|
15 – 25
|
45
|
Vonkajší obal
|
2 – 8
|
155
|
15 – 25
|
140
|
Ubezpečte sa, že názov lieku v naplnenej injekčnej striekačke je Spikevax bivalent Original/Omicron
BA.4-5. Ak je názov lieku Spikevax 50 mikrogramov alebo Spikevax bivalent Original/Omicron
BA.1, pozrite si Súhrn charakteristických vlastností lieku pre ten liek.
Návod na zaobchádzanie s naplnenými injekčnými striekačkami Spikevax bivalent Original/OmicronBA.4-5• Pred podaním nechajte každú naplnenú injekčnú striekačku stáť 15 minút pri izbovej teplote
(15 °C až 25 °C).
• Nepretrepávajte.
• Naplnená injekčná striekačka sa musí pred podaním vizuálne skontrolovať na prítomnosť častíc a zmenu farby.
• Vakcína Spikevax bivalent Original/Omicron BA.4-5 je biela až sivobiela disperzia. Môže obsahovať biele alebo priehľadné častice, ktoré sú súčasťou produktu. Vakcínu nepodávajte, ak má zmenenú farbu alebo obsahuje iné častice.
• Balenia s naplnenými injekčnými striekačkami neobsahujú ihly.
• Použite sterilnú ihlu vhodnej veľkosti na intramuskulárnu injekciu (21G alebo tenšie ihly).
• Odstráňte uzáver hrotu z injekčnej striekačky otáčaním proti smeru hodinových ručičiek.
• Ihlu pripojte na striekačku tak, že ju otáčate v smere hodinových ručičiek, kým nedrží pevne.
• Keď ste pripravený na podanie, odstráňte kryt ihly.
• Celú dávku podajte intramuskulárne.
LikvidáciaVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMODERNA BIOTECH SPAIN, S.L. Calle del Príncipe de Vergara 132 Plt 12
Madrid 28002
Španielsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/20/1507/006
EU/1/20/1507/009
EU/1/20/1507/010
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 6. januára 2021
Dátum posledného predĺženia registrácie: 3. októbra 2022
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
Sledovateľnosť
Aby sa zlepšila (do)sledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov a číslo
šarže podaného lieku.
Uchovávanie a príprava na podanie
Vakcínu Spikevax má podávať vyškolený zdravotnícky pracovník.
Po rozmrazení je vakcína pripravená na podanie. Nepretrepávajte ani nerieďte.
Pred podaním sa vakcína musí vizuálne skontrolovať na prítomnosť častíc a zmenu farby.
Vakcína Spikevax je biela až sivobiela disperzia. Môže obsahovať biele alebo priehľadné častice,
ktoré sú súčasťou produktu. Vakcínu nepodávajte, ak má zmenenú farbu alebo ak obsahuje iné častice.
Injekčné liekovky a naplnené injekčné striekačky sa skladujú zmrazené pri teplote -50 °C až -15 °C.
 Spikevax0,2mg/mlinjekčnádisperzia(viacdávkovéinjekčnéliekovkysčervenýmodklápacímplastovýmviečkom)
Spikevax0,2mg/mlinjekčnádisperzia(viacdávkovéinjekčnéliekovkysčervenýmodklápacímplastovýmviečkom)Z každej viacdávkovej injekčnej liekovky je možné odobrať desať (10) dávok (po 0,5 ml) alebo
maximálne dvadsať (20) dávok (po 0,25 ml).
Zátku prepichnite podľa možností vždy na inom mieste. Neprepichujte zátku injekčnej liekovky s červeným viečkom viac ako 20-krát.
Ubezpečte sa, že injekčná liekovka má červené odklápacie viečko a že názov lieku je Spikevax
0,2 mg/ml. Ak má injekčná liekovka modré odklápacie viečko a názov lieku je Spikevax bivalent Original/Omicron BA.1 alebo Spikevax bivalent Original/Omicron BA.4-5, pozrite si Súhrn charakteristických vlastností lieku pre ten liek.
Pred použitím rozmrazte každú viacdávkovú injekčnú liekovku podľa nižšie uvedených pokynov (Tabuľka 3). Po rozmrazení injekčnej liekovky v chladničke ju pred podaním nechajte 15 minút stáť pri izbovej teplote.
Tabuľka 3. Pokyny na rozmrazovanie viacdávkových injekčných liekoviek pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke)
|
Trvanie rozmrazova nia
| Teplota rozmrazovani a (pri izbovej teplote)
|
Trvanie rozmrazovania
|
Viacdávková injekčná liekovka
|
2 °C – 8 °C
| 2 hodiny a 30
minút
|
15 °C – 25 °C
|
1 hodina
|
 S
pikevax
0
,
1
m
g/ml
i
n
j
e
kčná
disperzia
(
viacdávkové
i
n
j
e
kčné
li
e
kovky
s
m
odrým
odklápacím
plastovým viečkom)
S
pikevax
0
,
1
m
g/ml
i
n
j
e
kčná
disperzia
(
viacdávkové
i
n
j
e
kčné
li
e
kovky
s
m
odrým
odklápacím
plastovým viečkom)Z každej viacdávkovej injekčnej liekovky je možné odobrať päť (5) dávok (po 0,5 ml) alebo
maximálne desať (10) dávok (po 0,25 ml).
Zátku prepichnite podľa možností vždy na inom mieste.
Ubezpečte sa, že injekčná liekovka má modré odklápacie viečko a že názov lieku je Spikevax
0,1 mg/ml. Ak má injekčná liekovka modré odklápacie viečko a názov lieku je Spikevax bivalent Original/Omicron BA.1 alebo Spikevax bivalent Original/Omicron BA.4-5, pozrite si Súhrn charakteristických vlastností lieku pre ten liek.
Pred použitím rozmrazte každú viacdávkovú injekčnú liekovku podľa nižšie uvedených pokynov (Tabuľka 4). Po rozmrazení injekčnej liekovky v chladničke ju pred podaním nechajte 15 minút stáť pri izbovej teplote.
Tabuľka 4. Pokyny na rozmrazovanie viacdávkových injekčných liekoviek pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke)
|
Trvanie rozmrazova nia
| Teplota rozmrazovani a (pri izbovej teplote)
|
Trvanie rozmrazovania
|
Viacdávková injekčná liekovka
|
2 °C – 8 °C
| 2 hodiny a 30
minút
|
15 °C – 25 °C
|
1 hodina
|
 S
pikevax
50
mi
krogramov
i
njekčná
disperzia
v
naplnenej
injekčnej
striekačke
S
pikevax
50
mi
krogramov
i
njekčná
disperzia
v
naplnenej
injekčnej
striekačke
Obsah naplnenej injekčnej striekačky nepretrepávajte ani nerieďte.
Každá naplnená injekčná striekačka je len na jednorazové použitie. Po rozmrazení je vakcína pripravená na použitie.
Z každej naplnenej injekčnej striekačky sa môže podať jedna (1) dávka po 0,5 ml. Nepoužívajte naplnenú injekčnú striekačku na podanie čiastočného objemu 0,25 ml.
Vakcína Spikevax sa dodáva ako jednodávková, naplnená injekčná striekačka (bez ihly) obsahujúca
0,5 ml (50 mikrogramov) mRNA a musí sa pred podaním rozmraziť.
Počas uchovávania minimalizujte vystavenie izbovému osvetleniu a zabráňte vystaveniu priamemu slnečnému svetlu a ultrafialovému svetlu.
Pred použitím každú naplnenú injekčnú striekačku rozmrazte podľa nasledujúcich pokynov. Striekačky sa môžu rozmrazovať v blistrových baleniach (každý blister obsahuje 2 naplnenené injekčné striekačky) alebo vo vonkajšom obale, buď v chladničke, alebo pri izbovej teplote
(Tabuľka 5). Po rozmrazení injekčnej liekovky v chladničke ju pred podaním nechajte 15 minút stáť
pri izbovej teplote.
Tabuľka 5. Inštrukcie na rozmrazovanie naplnených injekčných striekačiek a vonkajších obalov pred použitím
Konfigurácia
| Inštrukcie na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke) (°C)
|
Čas rozmrazovania (minút)
| Teplota
rozmrazovania (pri izbovej teplote)
(°C)
|
Čas rozmrazovania (minút)
|
Naplnená injekčná striekačka v blistrovom obale
|
2 – 8
|
55
|
15 – 25
|
45
|
Vonkajší obal
| 2 – 8
| 155
| 15 – 25
| 140
|
Ubezpečte sa, že názov lieku v naplnenej injekčnej striekačke je Spikevax 50 mikrogramov injekčná disperzia v naplnenej injekčnej striekačke. Ak je názov lieku Spikevax bivalent Original/Omicron BA.1 alebo Spikevax bivalent Original/Omicron BA.4-5, pozrite si Súhrn charakteristických vlastností lieku pre ten liek.
Návod na zaobchádzanie s naplnenými injekčnými striekačkami
• Pred podaním nechajte každú naplnenú injekčnú striekačku stáť 15 minút pri izbovej teplote
(15 °C až 25 °C).
• Nepretrepávajte.
• Naplnená injekčná striekačka sa musí pred podaním vizuálne skontrolovať na prítomnosť častíc a zmenu farby.
• Vakcína Spikevax je biela až sivobiela disperzia. Môže obsahovať biele alebo priehľadné častice, ktoré sú súčasťou produktu. Vakcínu nepodávajte, ak má zmenenú farbu alebo obsahuje iné častice.
• Balenia s naplnenými injekčnými striekačkami neobsahujú ihly.
• Použite sterilnú ihlu vhodnej veľkosti na intramuskulárnu injekciu (21G alebo tenšie ihly).
• Odstráňte uzáver hrotu z injekčnej striekačky otáčaním proti smeru hodinových ručičiek.
• Ihlu pripojte na striekačku tak, že ju otáčate v smere hodinových ručičiek, kým nedrží pevne.
• Keď ste pripravený na podanie, odstráňte kryt ihly.
• Celú dávku podajte intramuskulárne.
• Po rozmrazení znova nezmrazujte.
Likvidácia
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami. Dávkovaniearozpis
T
abuľka 6. Dávkovanie vakcíny Spikevax pre primárny cyklus, tretiu dávku u závažne imunokompromitovaných osôb a posilňovaciu dávku
O
č
k
ovanie
|
Sp
i
k
e
vax 0,2 mg/ml injekčná disperzia
|
Sp
i
k
e
vax 0,1 mg/ml injekčná disperzia a
Sp
i
k
e
vax 50 mikrogramov injekčná disperzia v naplnenej injekčnej striekačke*
|
P
r
i
m
árny cyklus
Odporúča sa, aby ste dostali druhú dávku tej istej vakcíny
28 dní po podaní prvej dávky,
aby sa dokončil očkovací cyklus.
|
Osoby vo veku 12 rokov
a staršie
dve 0,5 ml injekcie
|
Neaplikovateľné†
|
Deti vo veku od 6 rokov do
11 rokov
dve 0,25 ml injekcie
|
Deti vo veku od 6 rokov do
11 rokov
dve 0,5 ml injekcie
|
Neaplikovateľné
|
Deti vo veku od 6 mesiacov do
5 rokov
dve injekcie po 0,25 ml*
|
T
ret
i
a dávka u závažne imunokompromitovaných osôb
najmenej 1 mesiac po druhej dávke
|
Osoby vo veku 12 rokov a staršie
0,5 ml
|
Neaplikovateľné‡
|
Deti vo veku od 6 rokov do
11 rokov
0,25 ml
|
Deti vo veku od 6 rokov do
11 rokov
0,5 ml
|
Neaplikovateľné
|
Deti vo veku od 6 mesiacov do
5 rokov
0,25 ml*
|
P
osilňovacia dávka
môže sa podať najmenej
3 mesiace po druhej dávke
|
Osoby vo veku 12 rokov
a staršie
0,25 ml
|
Osoby vo veku 12 rokov
a staršie
0,5 ml
|
Neaplikovateľné
|
Deti vo veku od 6 rokov do 11
rokov 0,25 ml
|
* Nepoužívajte naplnenú injekčnú striekačku na podanie čiastočného objemu 0,25 ml.
† Pre primárny cyklus pre osoby vo veku 12 rokov a staršie sa má použiť injekčná liekovka so silou
0,2 mg/ml.
‡ Pre tretiu dávku u závažne imunokompromitovaných pacientov vo veku 12 rokov a starších sa má použiť injekčná liekovka so silou 0,2 mg/ml.
Tak ako pri všetkých injekčných vakcínach, musí byť vždy okamžite k dispozícii príslušná liečba a lekársky dohľad pre prípad výskytu anafylaktickej reakcie po podaní vakcíny Spikevax.
Zdravotnícky pracovník musí pozorovať zaočkovanú osobu aspoň 15 minút po podaní vakcíny. Vysokodávková štvorvalentná vakcína proti chrípke sa môže podávať súbežne s vakcínou Spikevax.
Vakcína Spikevax sa nesmie miešať v rovnakej injekčnej striekačke s inými vakcínami alebo liekmi.
PodávanieVakcína sa musí podávať intramuskulárne. Uprednostňovaným miestom je deltový sval ramena alebo
u dojčiat a malých detí predná bočná strana stehna. Nepodávajte túto vakcínu intravaskulárne, subkutánne, ani intradermálne.
V
i
acdávkové injekčné liekovky
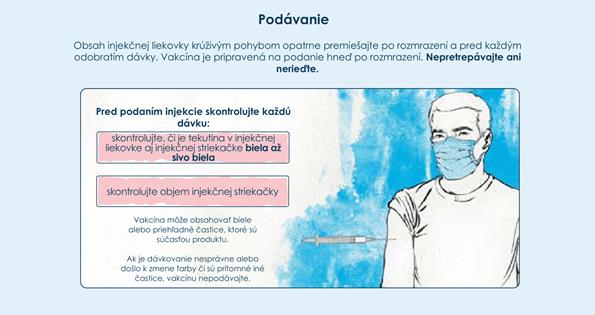 N
aplnené injekčné striekačky
N
aplnené injekčné striekačky
Použite sterilnú ihlu s veľkosťou vhodnou na intramuskulárnu injekciu (21 G alebo tenšiu). Zložte hrotový uzáver z naplnenej injekčnej striekačky tak, že ho otočíte proti smeru hodinových ručičiek. Pripojte ihlu otáčaním v smere hodinových ručičiek, kým ihla bezpečne nezapadne na injekčnú striekačku. Keď ste pripravený na podanie, odstráňte kryt ihly. Podajte celú dávku intramuskulárne. Po použití injekčnú striekačku zlikvidujte. Len na jednorazové použitie.
P
ís
omná informácia pre používateľa
Sp
i
k
e
vax bivalent Original/Omicron BA.1
(
50 mikrogramov/50 mikrogramov)/ml injekčná disperzia
Sp
i
k
e
vax bivalent Original/Omicron BA.1
25 mikrogramov/25 mikrogramov injekčná disperzia
Sp
i
k
e
vax bivalent Original/Omicron BA.1
25 mikrogramov/25 mikrogramov injekčná disperzia v naplnenej injekčnej striekačke mRNA očkovacia látka proti COVID-19 (modifikovaný nukleozid) elazomeran/imelazomeran

Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že nahlásite akékoľvek vedľajšie účinky, ak sa u vás vyskytnú. Informácie o tom, ako hlásiť vedľajšie účinky, nájdete na konci časti 4.
Pozorne si prečítajte celú písomnú informáciu predtým, ako dostanete túto vakcínu, pretože obsahuje pre vás dôležité informácie.- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára, lekárnika alebo
zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto
písomnej informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete:1. Čo je vakcína Spikevax bivalent Original/Omicron BA.1 a na čo sa používa
2. Čo potrebujete vedieť predtým, ako vám podajú vakcínu Spikevax bivalent Original/Omicron
BA.1
3. Ako sa vakcína Spikevax bivalent Original/Omicron BA.1 podáva
4. Možné vedľajšie účinky
5. Ako uchovávať vakcínu Spikevax bivalent Original/Omicron BA.1
6. Obsah balenia a ďalšie informácie
1. Čo je vakcína Spikevax bivalent Original/Omicron BA.1 a na čo sa používaVakcína Spikevax bivalent Original/Omicron BA.1 je vakcína, ktorá sa používa na ochranu pred ochorením COVID-19 spôsobeným vírusom SARS-CoV-2. Podáva sa osobám vo veku 6 rokov
a starším. Liečivom vo vakcíne Spikevax bivalent Original/Omicron BA.1 je mRNA kódujúca „spike“
proteín vírusu SARS-CoV-2. mRNA je zapuzdrená do SM-102 lipidových nanočastíc.
Vakcína Spikevax bivalent Original/Omicron BA.1 je určená iba pre osoby, ktoré už absolvovali aspoň základný očkovací cyklus proti COVID-19.
Keďže vakcína Spikevax bivalent Original/Omicron BA.1 neobsahuje vírus, nemôže u vás spôsobiť ochorenie COVID-19.
Ako vakcína účinkujeVakcína Spikevax bivalent Original/Omicron BA.1 podnieti prirodzenú obranu tela (imunitný systém). Účinok vakcíny spôsobí, že si telo vytvorí ochranu (protilátky) pred vírusom, ktorý spôsobuje ochorenie COVID-19. Vakcína Spikevax bivalent Original/Omicron BA.1 využíva látku nazývanú mediátorová ribonukleová kyselina (messenger ribonucleic acid, mRNA) na prenos pokynov, ktoré môžu bunky v tele použiť na vytvorenie bielkovinového výbežku (spike proteín), ktorý sa nachádza aj na víruse. Bunky potom vytvoria protilátky proti spike proteínu na pomoc v boji proti vírusu. To vás pomôže chrániť pred ochorením COVID-19.
2. Čo potrebujete vedieť predtým, ako vám podajú vakcínu Spikevax bivalent
O
r
i
ginal/Omicron BA.1
V
akcína sa nesmie podať ak ste alergický na liečivo alebo na ktorúkoľvek z ďalších zložiek tejto vakcíny (uvedených v časti 6).
Upozornenia a opatrenia
Predtým, ako vám podajú vakcínu Spikevax bivalent Original/Omicron BA.1, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru:
- ak ste v minulosti mali závažnú, život ohrozujúcu alergickú reakciu po akomkoľvek inom očkovaní alebo po podaní vakcíny Spikevax (pôvodná) v minulosti,
- ak máte veľmi slabý alebo oslabený imunitný systém,
- ak ste už niekedy omdleli po podaní injekcie ihlou,
- ak máte poruchu krvácania,
- ak máte vysokú horúčku alebo závažnú infekciu; ak však máte miernu horúčku alebo infekciu horných dýchacích ciest, ako napríklad prechladnutie, môžete byť očkovaný,
- ak máte akékoľvek závažné ochorenie,
- ak máte úzkosť súvisiacu s injekciami.
Existuje zvýšené riziko myokarditídy (zápalu srdcového svalu) a perikarditídy (zápalu výstelky mimo srdca) po očkovaní očkovacou látkou Spikevax (pôvodná) (pozri časť 4).
Tieto ochorenia sa môžu objaviť už niekoľko dní po očkovaní a vyskytli sa najmä počas prvých
14 dní. Boli pozorované častejšie po druhej dávke ako po prvej dávke a častejšie u mladších mužov.
Po očkovaní máte venovať pozornosť prejavom myokarditídy a perikarditídy, ako je napríklad dýchavičnosť, palpitácie (búšenie srdca) a bolesť v hrudníku, a v prípade ich výskytu okamžite vyhľadať lekársku pomoc.
Ak sa vás týka niektorý z vyššie uvedených prípadov (alebo si nie ste istý), obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru predtým, ako vám podajú vakcínu Spikevax bivalent Original/Omicron BA.1.
Vzplanutia syndrómu kapilárneho presakovania (CLS)
Po očkovaní očkovacou látkou Spikevax (pôvodná) bolo hlásených niekoľko prípadov vzplanutia syndrómu kapilárneho presakovania (spôsobujúceho vytekanie tekutiny z malých krvných ciev (kapilár), čo viedlo k rýchlemu opuchu rúk a nôh, náhlemu zvýšeniu hmotnosti a pocitu na omdletie, nízkemu krvnému tlaku). Ak sa ste už v minulosti mali príhody ochorenia CLS, poraďte sa s lekárom predtým, ako vám bude podaná očkovacia látka Spikevax bivalent Original/Omicron BA.1.
Trvanie ochrany
Rovnako ako v prípade iných vakcín, ani tretia dávka vakcíny Spikevax bivalent Original/Omicron
BA.1 nemusí úplne chrániť všetkých, ktorí ju dostávajú, a nie je známe, ako dlho budete chránení.
Deti
Vakcínu Spikevax bivalent Original/Omicron BA.1 sa neodporúča podávať deťom mladším ako
6 rokov.
Iné lieky a vakcína Spikevax bivalent Original/Omicron BA.1
Ak teraz užívate alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky, povedzte to svojmu lekárovi alebo lekárnikovi. Vakcína Spikevax bivalent Original/Omicron BA.1 môže ovplyvniť spôsob, akým účinkujú iné lieky, a iné lieky môžu ovplyvniť spôsob, akým účinkuje vakcína Spikevax bivalent Original/Omicron BA.1.
Osoby s oslabeným imunitným systémom
U ľudí s oslabeným imunitným systémom môže byť účinnosť vakcíny Spikevax bivalent Original/Omicron BA.1 nižšia. V týchto prípadoch musíte naďalej dodržiavať fyzické bezpečnostné opatrenia, ktoré pomáhajú predchádzať ochoreniu COVID-19. Okrem toho osoby, ktoré sú v úzkom kontakte s vami, majú byť podľa potreby očkované. O individuálnych odporúčaniach sa poraďte
so svojím lekárom.
Tehotenstvo a dojčenie
Ak ste tehotná alebo ak si myslíte, že ste tehotná, povedzte to svojmu lekárovi, zdravotnej sestre alebo lekárnikovi predtým, ako dostanete túto vakcínu. Doposiaľ nie sú k dispozícii žiadne údaje týkajúce sa používania vakcíny Spikevax bivalent Original/Omicron BA.1 počas tehotenstva. Avšak veľké množstvo údajov od tehotných žien očkovaných vakcínou Spikevax (pôvodná) počas druhého
a tretieho trimestra nepreukázalo negatívne účinky na tehotenstvo ani na novorodenca. Aj keď sú údaje o účinkoch na tehotenstvo alebo na novorodenca po očkovaní v prvom trimestri obmedzené, nepozorovalo sa žiadne zvýšené riziko potratu. Keďže rozdiely medzi týmito dvoma vakcínami spočívajú len v spike proteíne vo vakcíne a neexistujú medzi nimi klinicky významné rozdiely, Spikevax bivalent Original/Omicron BA.1 sa môže používať počas tehotenstva.
Doposiaľ nie sú k dispozícii žiadne údaje týkajúce sa používania vakcíny Spikevax bivalent
Original/Omicron BA.1 počas dojčenia.
Neočakáva sa však žiaden účinok na dojčeného novorodenca/dojča. Údaje od žien, ktoré dojčili po vakcinácii s vakcínou Spikevax (pôvodná) nepreukázali riziko nežiadúcich účinkov na dojčeného novorodenca/dojča. Vakcína Spikevax bivalent Original/Omicron BA.1 sa môže podávať počas dojčenia.
Vedenie vozidiel a obsluha strojov
Ak sa necítite dobre po podaní vakcíny, neveďte vozidlá ani neobsluhujte stroje. Počkajte, kým
nevymiznú akékoľvek vplyvy vakcíny, a až potom môžete viesť vozidlá alebo obsluhovať stroje.
Vakcína Spikevax bivalent Original/Omicron BA.1 obsahuje sodík
Tento liek obsahuje menej ako 1 mmol (23 mg) sodíka v jednej dávke, t. j. v podstate zanedbateľné množstvo sodíka.
3. Ako vám podajú vakcínu Spikevax bivalent Original/Omicron BA.1
Osoby vo veku 12 rokov a staršie
Dávka vakcíny Spikevax bivalent Original/Omicron BA.1 je 0,5 ml. Podáva sa najmenej 3 mesiace po poslednej predchádzajúcej dávke vakcíny proti COVID-19.
Osoby vo veku od 6 rokov do 11 rokov
Dávka vakcíny Spikevax bivalent Original/Omicron BA.1 je 0,25 ml. Podáva sa najmenej 3 mesiace po poslednej predchádzajúcej dávke vakcíny proti COVID-19.
Váš lekár alebo zdravotná sestra vám injekčne podajú vakcínu do svalu (intramuskulárna injekcia)
v ramene.
Po každom podaní vakcíny vás bude lekár alebo zdravotná sestra sledovať aspoň 15 minút, či sa u vás neprejavuje alergická reakcia.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tejto vakcíny, opýtajte sa svojho lekára, lekárnika alebo zdravotnej sestry.
Vakcína Spikevax bivalent Original/Omicron BA.1 je určená iba pre osoby, ktoré už absolvovali aspoň základný očkovací cyklus proti COVID-19.
Podrobnosti o základnom cykle očkovania pre osoby vo veku 6 rokov a staršie pozri v písomnej informácii pre používateľa pre Spikevax 0,2 mg/ml injekčnú disperziu.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj táto vakcína môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. Ak sa u vás vyskytne akýkoľvek z nasledujúcich prejavov a príznakov alergickej reakcie, vyhľadajte
okamžitú lekársku pomoc:
- pocit na omdletie alebo závrat,
- zmeny srdcového rytmu,
- dýchavičnosť,
- sipenie,
- opuch pier, tváre alebo hrdla,
- žihľavka alebo vyrážka,
- nevoľnosť alebo vracanie,
- bolesť žalúdka.
Ak sa u vás vyskytne akýkoľvek iný vedľajší účinok, obráťte sa na svojho lekára alebo zdravotnú sestru. Môžu k nim patriť tieto:
Veľmi časté (môžu postihovať viac ako 1 z 10 osôb):
- opuch/citlivosť v podpazuší,
- znížená chuť do jedla (pozorovaná u detí vo veku od 6 mesiacov do 5 rokov),
- podráždenosť/plač (pozorované u detí vo veku od 6 mesiacov do 5 rokov),
- bolesť hlavy,
- ospalosť (pozorovaná u detí vo veku od 6 mesiacov do 5 rokov),
- nevoľnosť,
- vracanie,
- bolesť svalov a kĺbov a stuhnutosť,
- bolesť alebo opuch v mieste podania injekcie,
- začervenanie v mieste podania injekcie (v niektorých prípadoch sa môže vyskytnúť približne 9
až 11 dní po podaní injekcie),
- pocit veľkej únavy,
- zimnica,
- horúčka.
Časté (môžu postihovať menej ako 1 z 10 osôb):
- hnačka,
- vyrážka,
- vyrážka alebo žihľavka v mieste podania injekcie (v niektorých prípadoch sa môžu vyskytnúť približne 9 až 11 dní po podaní injekcie).
Menej časté (môžu postihovať menej ako 1 zo 100 osôb):
- svrbenie v mieste podania injekcie,
- závrat,
- bolesť brucha,
- vyvýšená, svrbivá vyrážka (žihľavka, ktorá sa môže objaviť od podania injekcie až do približne dvoch týždňov po podaní injekcie).
Zriedkavé (môžu postihovať menej ako 1 z 1 000 osôb)
- dočasné jednostranné ochrnutie tváre (Bellova obrna),
- opuch tváre (u pacientov, ktorí dostali kozmetické injekcie do tváre, sa môže vyskytnúť opuch
tváre),
- znížené vnímanie alebo cit pri dotyku,
- nezvyčajný pocit na koži, ako je tŕpnutie alebo mravčenie (parestézia).
V
e
ľ
m
i zriedkavé (môžu postihovať menej ako 1 z 10 000 osôb)
- zápal srdcového svalu (myokarditída) alebo zápal výstelky mimo srdca (perikarditída), ktorý
môže viesť k dýchavičnosti, palpitáciám (búšeniu srdca) alebo bolesti v hrudníku.
Neznáma frekvencia- závažné alergické reakcie s ťažkosťami s dýchaním (anafylaxia),
- reakcia imunitného systému v dôsledku zvýšenej citlivosti alebo neznášanlivosti
(precitlivenosť),
- kožná reakcia, ktorá spôsobuje červené fľaky alebo škvrny na koži, ktoré môžu vyzerať ako terč
alebo „stred terča“ s tmavočerveným stredom, okolo ktorého sa nachádzajú svetločervené kruhy
(multiformný erytém),
- nadmerný opuch očkovanej končatiny,
- silné menštruačné krvácanie (predpokladá sa, že väčšina prípadov nie je závažná a je dočasná).
Hlásenie vedľajších účinkovAk sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára, lekárnika alebo
zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na
národné centrum hlásenia uvedenév PríloheV a uviesť číslo šarže, ak je k dispozícii. Hlásením vedľajších účinkov môžete prispieť
k získaniu ďalších informácií o bezpečnosti tejto vakcíny.
5. Ako uchovávať vakcínu Spikevax bivalent Original/Omicron BA.1Túto vakcínu uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte túto vakcínu po dátume exspirácie, ktorý je uvedený na označení po EXP. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Informácie o uchovávaní, exspirácii, používaní a zaobchádzaní sú opísané v časti určenej pre
zdravotníckych pracovníkov na konci tejto písomnej informácie.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo vakcína Spikevax bivalent Original/Omicron BA.1 obsahujeTabuľka 1. Zloženie podľa typu obaluSila
| Obal
| Dávka (dávky)
| Zloženie na dávku
|
Spikevax bivalent Original/Omicron BA.1 (50 mikrogramov/50 mikrogramov)/ml injekčná disperzia
| Viacdávková
2,5 ml
injekčná liekovka
| 5 dávok po 0,5 ml
alebo 10 dávok po
0,25 ml
|
Jedna dávka (0,5 ml) obsahuje
25 mikrogramov elazomeranu a 25 mikrogramov imelazomeranu, mRNA očkovacej látky proti COVID-
19 (zapuzdrenej do lipidových nanočastíc).
Jedna dávka (0,25 ml)
obsahuje 12,5 mikrogramov
|
Viacdávková
5 ml injekčná liekovka
| 10 dávok po
0,5 ml alebo 20
dávok po 0,25 ml
|
|
|
|
elazomeranu
a 12,5 mikrogramov imelazomeranu, mRNA očkovacej látky proti COVID-
19 (zapuzdrenej do lipidových nanočastíc).
|
Sp
i
k
e
vax bivalent
O
r
i
ginal/Omicron BA.1
25 mikrogramov/25 mikr
ogramov injekčná disperzia
|
Jednodávková
0,5 ml injekčná liekovka
|
1 dávka 0,5 ml
Len na jednorazové použitie.
|
Jedna dávka (0,5 ml) obsahuje
25 mikrogramov elazomeranu a 25 mikrogramov imelazomeranu, mRNA očkovacej látky proti COVID-
19 (zapuzdrenej do lipidových nanočastíc).
|
Sp
i
k
e
vax bivalent
O
r
i
ginal/Omicron BA.1
25 mikrogramov/25 mikr ogramov injekčná disperzia v naplnenej injekčnej striekačke
|
Naplnená injekčná striekačka
|
1 dávka 0,5 ml
Len na jednorazové použitie.
|
Elazomeran je jednovláknová mediátorová RNA (mRNA) s čiapočkou na 5’ konci produkovaná
pomocou bezbunkovej
in vitro transkripcie z príslušných šablón DNA, kódujúca „spike“ (S) proteín
vírusu SARS-CoV-2 (pôvodná).
Imelazomeran je jednovláknová mediátorová RNA (mRNA ) s čiapočkou na 5’ konci produkovaná pomocou bezbunkovej
in vitro transkripcie z príslušných šablón DNA, kódujúca celú dĺžku variantu s kodónovo optimalizovanou prefúzne stabilizovanou konformáciou (K983P a V984P) SARSCoV-2
„spike“ (S) glykoproteínu (Omicron variant, BA.1).
Ďalšie zložky sú SM-102 (heptadekán-9-yl 8-{(2-hydroxyetyl)[6-oxo-6-
(undecyloxy)hexyl]amino}oktanoát), cholesterol, 1,2-distearoyl-sn-glycero-3-fosfocholín
(DSPC), 1,2-dimyristoyl-rac-glycero-3-metoxypolyetylénglykol-2000 (PEG2000-DMG), trometamol,
trometamólium-chlorid, kyselina octová, trihydrát octanu sodného, sacharóza, voda na injekcie.
Ako vyzerá vakcína Spikevax bivalent Original/Omicron BA.1 a obsah baleniaSpikevax bivalent Original/Omicron BA.1 (50 mikrogramov/50 mikrogramov)/mlinjekčnádisperziaVakcína Spikevax bivalent Original/Omicron BA.1 je biela až sivobiela disperzia dodávaná v 2,5 ml
alebo 5 ml sklenenej viacdávkovej injekčnej liekovke s gumenou zátkou a modrým odklápacím plastovým viečkom s hliníkovým uzáverom.
Veľkosť balenia:
10 viacdávkových injekčných liekoviek. Jedna injekčná liekovka obsahuje 2,5 ml.
10 viacdávkových injekčných liekoviek. Jedna injekčná liekovka obsahuje 5 ml. Na trh nemusia byť uvedené všetky veľkosti balenia.
Spikevax bivalent Original/Omicron BA.1 25 mikrogramov/25 mikrogramov injekčná disperziaVakcína Spikevax bivalent Original/Omicron BA.1 je biela až sivobiela disperzia dodávaná v 0,5 ml
sklenenej jednodávkovej injekčnej liekovke s gumenou zátkou a modrým odklápacím plastovým
viečkom s hliníkovým uzáverom.
Veľkosť balenia: 10 jednodávkových injekčných liekoviek
S
pikevax
bivalent
O
r
i
ginal/Omicron
B
A
.
1
25
mi
krogramov/25
mi
krogramov
i
njekčná
disperzia
v
naplnenej
injekčnej
striekačke
Vakcína Spikevax bivalent Original/Omicron BA.1 je biela až sivobiela disperzia dodávaná
v naplnenej injekčnej striekačke (z cyklického olefínového polyméru) s piestovou zátkou a hrotovým
(špicatým) uzáverom (bez ihly).
Naplnené injekčné striekačky sú balené v 5 priehľadných blistroch obsahujúcich po 2 naplnené injekčné striekačky v každom blistri.
Veľkosť balenia: 10 naplnených injekčných striekačiek
Držiteľ rozhodnutia o registrácii
MODERNA BIOTECH SPAIN, S.L. Calle del Príncipe de Vergara 132 Plt 12
Madrid 28002
Španielsko
Výrobca
Rovi Pharma Industrial Services, S.A. Paseo de Europa, 50
28703. San Sebastián de los Reyes
Madrid, Španielsko
Recipharm Monts
18 Rue de Montbazon
Monts, Francúzsko 37260
Moderna Biotech Spain S.L.
Calle del Príncipe de Vergara 132 Plt 12
Madrid 28002
Španielsko
Rovi Pharma Industrial Services, S.A. Calle Julián Camarillo n°35
28037 Madrid, Španielsko
Patheon Italia S.p.a. Viale G.B. Stucchi
110 20900 Monza, Taliansko
Patheon Italia S.p.A.
2 Trav. SX Via Morolense 5
03013 Ferentino (FR), Taliansko
Ak potrebujete akékoľvek informácie o tomto lieku, kontaktujte držiteľa rozhodnutia o registrácii.
B
e
l
gië/Belgique/Belgien
Tél/Tel: 0800 81 460
Lietuva
Tel: 88 003 1114
Б
ълг
ария
Teл: 00800 115 4477
Luxembourg/Luxemburg
Tél/Tel: 800 85 499
Č
e
s
k
á republika
Tel: 800 050 719
Magyarország
Tel: 06 809 87488
D
anmark
Tlf: 80 81 06 53
Malta
Tel: 8006 5066
D
e
u
t
s
c
h
l
and
Tel: 0800 100 9632
Nederland
Tel: 0800 409 0001
E
e
s
t
i
Tel: 800 0044 702
Norge
Tlf: 800 31 401
Ελ
λ
ά
δ
α
Τηλ: 008004 4149571
Österreich
Tel: 0800 909636
E
s
p
a
ña
Tel: 900 031 015
Polska
Tel: 800 702 406
F
r
ance
Tél: 0805 54 30 16
Portugal
Tel: 800 210 256
H
r
vatska
Tel: 08009614
Ireland
Tel: 1800 800 354
România
Tel: 0800 400 625
Slovenija
Tel: 080 083082
Ísland
Sími: 800 4382
Slovenská republika
Tel: 0800 191 647
Italia
Tel: 800 928 007
Suomi/Finland
Puh/Tel: 0800 774198
Κύ
π
ρ
ος
Τηλ: 80091080
Sverige
Tel: 020 10 92 13
L
atvija
Tel: 80 005 898
United Kingdom (Northern Ireland)
Tel: 0800 085 7562
T
áto písomná informácia bola naposledy aktualizovaná
Aby ste získali písomnú informáciu pre používateľa v iných jazykoch, naskenujte si tento kód pomocou mobilného zariadenia.

Alebo navštívte URL
https://www.ModernaCovid19Global.comPodrobné informácie o tejto vakcíne sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu.
Táto písomná informácia je dostupná vo všetkých jazykoch EÚ/EHP na webovej stránke Európskej agentúry pre lieky.
------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:SledovateľnosťAby sa zlepšila (do)sledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov a číslo
šarže podaného lieku.
SpikevaxbivalentOriginal/OmicronBA.1(50μg/50μg)/mlinjekčnádisperzia(viacdávkovéinjekčnéliekovkysmodrýmodklápacímplastovýmviečkom)Vakcínu Spikevax bivalent Original/Omicron BA.1 má podávať vyškolený zdravotnícky pracovník.
Po rozmrazení je vakcína pripravená na podanie. Nepretrepávajte ani nerieďte.
Pred podaním sa vakcína musí vizuálne skontrolovať na prítomnosť častíc a zmenu farby.
Vakcína Spikevax bivalent Original/Omicron BA.1 je biela až sivobiela disperzia. Môže obsahovať biele alebo priehľadné častice, ktoré sú súčasťou produktu. Vakcínu nepodávajte, ak má zmenenú farbu alebo ak obsahuje iné častice.
Injekčné liekovky sa skladujú zmrazené pri teplote -50 °C až -15 °C.
Z každej viacdávkovej injekčnej liekovky je možné odobrať päť (5) alebo desať (10) dávok (po
0,5 ml), v závislosti od veľkosti injekčnej liekovky. Z každej viacdávkovej injekčnej liekovky možno
odobrať desať (10) alebo dvadsať (20) dávok (po 0,25 ml) v závislosti od veľkosti injekčnej liekovky.
Ubezpečte sa, že injekčná liekovka má modré odklápacie viečko a že názov lieku je Spikevax bivalent
Original/Omicron BA.1. Ak má injekčná liekovka modré odklápacie viečko a názov lieku je Spikevax
0,1 mg/ml alebo Spikevax bivalent Original/Omicron BA.4-5, pozrite si Súhrn charakteristických vlastností lieku pre ten liek.
Zátku prepichnite podľa možností vždy na inom mieste.
Pred použitím rozmrazte každú viacdávkovú injekčnú liekovku podľa nižšie uvedených pokynov (Tabuľka 2). Po rozmrazení injekčnej liekovky v chladničke ju pred podaním nechajte 15 minút stáť pri izbovej teplote.
Tabuľka 2. Pokyny na rozmrazovanie viacdávkových injekčných liekoviek pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke)
|
Trvanie rozmrazova nia
| Teplota rozmrazovani a (pri izbovej teplote)
|
Trvanie rozmrazovania
|
Viacdávková injekčná liekovka
|
2 °C – 8 °C
| 2 hodiny a 30
minút
|
15 °C – 25 °C
|
1 hodina
|
 J
e
dnodávkové
i
njekčné
li
e
kovky
(
S
pikevax
bivalent
O
r
i
ginal/Omicron
B
A
.
1
25 mikrogramov/25 mikrogramov injekčná disperzia)
J
e
dnodávkové
i
njekčné
li
e
kovky
(
S
pikevax
bivalent
O
r
i
ginal/Omicron
B
A
.
1
25 mikrogramov/25 mikrogramov injekčná disperzia)Po rozmrazení je vakcína pripravená na podanie.
Nepretrepávajte ani nerieďte. Obsah injekčnej liekovky krúživým pohybom opatrne premiešajte po rozmrazení a pred odobratím dávky. Rozmrazte každú jednodávkovú injekčnú liekovku podľa dole uvedených pokynov. Každú jednodávkovú injekčnú liekovku alebo vonkajší obal s 10 injekčnými liekovkami je možné rozmraziť, buď v chladničke, alebo pri izbovej teplote (Tabuľka 3). Po rozmrazení injekčnej liekovky v chladničke ju pred podaním nechajte 15 minút stáť pri izbovej teplote.
Tabuľka 3. Pokyny na rozmrazovanie jednodávkových injekčných liekoviek a vonkajších obalov pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke)
|
Trvanie rozmrazovania
| Teplota rozmrazovani a (pri izbovej teplote)
|
Trvanie rozmrazovania
|
Jednodávková injekčná liekovka
|
2 °C až 8 °C
| 45 minút
|
15 °C až 25 °C
| 15 minút
|
Vonkajší obal
| 2 °C až 8 °C
| 1 hodina 45 minút
| 15 °C až 25 °C
| 45 minút
|
Ak sa injekčné liekovky rozmrazujú pri teplote 2 až 8 °C, má sa pred podaním jednotlivá injekčná
liekovka ponechať približne 15 minút pri izbovej teplote (15 °C až 25 °C).
SpikevaxbivalentOriginal/OmicronBA.125mikrogramov/25mikrogramovinjekčnádisperziavnaplnenejinjekčnejstriekačkeNepretrepávajte ani nerieďte obsah naplnenej injekčnej striekačky.
Každá naplnená injekčná striekačka je len na jednorazové použitie. Po rozmrazení je vakcína pripravená na použitie
Z každej naplnenej injekčnej striekačky sa môže podať jedna (1) dávka po 0,5 ml.
Vakcína Spikevax bivalent Original/Omicron BA.1 sa dodáva ako jednodávková, naplnená injekčná striekačka (bez ihly) obsahujúca 0,5 ml (25 mikrogramov elazomeranu a 25 mikrogramov imelasomeranu) mRNA a musí sa pred podaním rozmraziť.
Počas uchovávania minimalizujte vystavenie izbovému osvetleniu a zabráňte vystaveniu priamemu slnečnému svetlu a ultrafialovému svetlu.
Pred použitím každú naplnenú injekčnú striekačku rozmrazte podľa nasledujúcich pokynov. Striekačky sa môžu rozmrazovať v blistrových baleniach (každý blister obsahuje 2 naplnenené injekčné striekačky) alebo vo vonkajšom obale, buď v chladničke, alebo pri izbovej teplote
(Tabuľka 4). Po rozmrazení injekčnej striekačky v chladničke ju pred podaním nechajte 15 minút stáť pri izbovej teplote.
Tabuľka 4. Pokyny na rozmrazovanie naplnených injekčných striekačiek a vonkajších obalovSpikevax bivalent Original/Omicron BA.1 pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke) (°C)
|
Trvanie rozmrazovania (minúty)
| Teplota
rozmrazovania (pri izbovej teplote)
(°C)
|
Trvanie rozmrazovania (minúty)
|
Naplnená injekčná striekačka
v blistrovom obale
|
2 – 8
|
55
|
15 – 25
|
45
|
Vonkajší obal
| 2 – 8
| 155
| 15 – 25
| 140
|
Ubezpečte sa, že názov lieku v naplnenej injekčnej striekačke je Spikevax bivalent Original/Omicron
BA.1. Ak je názov lieku Spikevax 50 mikrogramov alebo Spikevax bivalent Original/Omicron BA.4-
5, pozrite si Súhrn charakteristických vlastností lieku pre ten liek.
Pokyny na zaobchádzanie s naplnenými injekčnými striekačkami• Pred podaním nechajte každú naplnenú injekčnú striekačku stáť 15 minút pri izbovej teplote
(15 °C až 25 °C).
• Nepretrepávajte.
• Naplnená injekčná striekačka sa musí pred podaním vizuálne skontrolovať na prítomnosť častíc a zmenu farby.
• Vakcína Spikevax bivalent Original/Omicron BA.1 je biela až sivobiela disperzia. Môže obsahovať biele alebo priehľadné častice, ktoré sú súčasťou produktu. Vakcínu nepodávajte, ak má zmenenú farbu alebo obsahuje iné častice.
• Balenia s naplnenými injekčnými striekačkami neobsahujú ihly.
• Použite sterilnú ihlu vhodnej veľkosti na intramuskulárnu injekciu (21G alebo tenšie ihly).
• Odstráňte uzáver hrotu z injekčnej striekačky otáčaním proti smeru hodinových ručičiek.
• Ihlu pripojte na striekačku tak, že ju otáčate v smere hodinových ručičiek, kým nedrží pevne.
• Keď ste pripravený na podanie, odstráňte kryt ihly.
• Celú dávku podajte intramuskulárne.
• Po rozmrazení znova nezmrazujte.
Likvidácia Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Dávkovanie a rozpisOsoby vo veku 12 rokov a staršieDávka vakcíny Spikevax bivalent Original/Omicron BA.1 je 0,5 ml. Podáva sa najmenej 3 mesiace po poslednej predchádzajúcej dávke vakcíny proti COVID-19.
Osoby vo veku od 6 rokov do 11 rokovDávka vakcíny Spikevax bivalent Original/Omicron BA.1 je 0,25 ml. Podáva sa najmenej 3 mesiace po poslednej predchádzajúcej dávke vakcíny proti COVID-19.
Tak ako pri všetkých injekčných vakcínach, musí byť vždy okamžite k dispozícii príslušná liečba a lekársky dohľad pre prípad výskytu anafylaktickej reakcie po podaní vakcíny Spikevax bivalent Original/Omicron BA.1.
Zdravotnícky pracovník musí pozorovať zaočkovanú osobu aspoň 15 minút po podaní vakcíny. Nie sú k dispozícii údaje na vyhodnotenie súbežného podávania vakcíny Spikevax bivalent
Original/Omicron BA.1 s inými vakcínami. Vakcína Spikevax bivalent Original/Omicron BA.1 sa
nesmie miešať v rovnakej injekčnej striekačke s inými vakcínami alebo liekmi.
PodávanieVakcína sa musí podávať intramuskulárne. Uprednostňovaným miestom je deltový sval ramena.
Nepodávajte túto vakcínu intravaskulárne, subkutánne ani intradermálne.
Viacdávková injekčná liekovkaNaplnené injekčné striekačkyPoužite sterilnú ihlu s veľkosťou vhodnou na intramuskulárnu injekciu (21 G alebo tenšiu). Zložte hrotový uzáver z naplnenej injekčnej striekačky tak, že ho otočíte proti smeru hodinových ručičiek. Pripojte ihlu otáčaním v smere hodinových ručičiek, kým ihla bezpečne nezapadne na injekčnú striekačku. Keď ste pripravený na podanie, odstráňte kryt ihly. Podajte celú dávku intramuskulárne. Po použití injekčnú striekačku zlikvidujte. Len na jednorazové použitie.
P
ís
omná informácia pre používateľa
Sp
i
k
e
vax bivalent Original/Omicron BA.4-5
(
50 mikrogramov/50 mikrogramov)/ml injekčná disperzia
Sp
i
k
e
vax bivalent Original/Omicron BA.4-5
25 mikrogramov/25 mikrogramov/ml injekčná disperzia
Sp
i
k
e
vax bivalent Original/Omicron BA.4-5
25 mikrogramov/25 mikrogramov/ml injekčná disperzia v naplnenej injekčnej striekačke mRNA očkovacia látka proti COVID-19 (modifikovaný nukleozid) elazomeran/davezomeran
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že nahlásite akékoľvek vedľajšie účinky, ak sa u vás vyskytnú. Informácie o tom, ako hlásiť vedľajšie účinky, nájdete na konci časti 4.
Pozorne si prečítajte celú písomnú informáciu predtým, ako dostanete túto vakcínu, pretože obsahuje pre vás dôležité informácie.- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete:1. Čo je vakcína Spikevax bivalent Original/Omicron BA.4-5 a na čo sa používa
2. Čo potrebujete vedieť predtým, ako vám podajú vakcínu Spikevax bivalent Original/Omicron
BA.4-5
3. Ako sa vakcína Spikevax bivalent Original/Omicron BA.4-5 podáva
4. Možné vedľajšie účinky
5. Ako uchovávať vakcínu Spikevax bivalent Original/Omicron BA.4-5
6. Obsah balenia a ďalšie informácie
1. Čo je vakcína Spikevax bivalent Original/Omicron BA.4-5 a na čo sa používaVakcína Spikevax bivalent Original/Omicron BA.4-5 je vakcína, ktorá sa používa na ochranu pred ochorením COVID-19 spôsobeným vírusom SARS-CoV-2. Podáva sa osobám vo veku 12 rokov
a starším. Liečivom vo vakcíne Spikevax bivalent Original/Omicron BA.4-5 je mRNA kódujúca
„spike“ proteín vírusu SARS-CoV-2. mRNA je zapuzdrená do SM-102 lipidových nanočastíc.
Vakcína Spikevax bivalent Original/Omicron BA.4-5 je určená iba pre osoby, ktoré už absolvovali aspoň základný očkovací cyklus proti COVID-19.
Keďže vakcína Spikevax bivalent Original/Omicron BA.4-5 neobsahuje vírus, nemôže u vás spôsobiť ochorenie COVID-19.
Ako vakcína účinkujeVakcína Spikevax bivalent Original/Omicron BA.4-5 podnieti prirodzenú obranu tela (imunitný systém). Účinok vakcíny spôsobí, že si telo vytvorí ochranu (protilátky) pred vírusom, ktorý spôsobuje ochorenie COVID-19. Vakcína Spikevax bivalent Original/Omicron BA.4-5 využíva látku nazývanú mediátorová ribonukleová kyselina (messenger ribonucleic acid, mRNA) na prenos pokynov, ktoré môžu bunky v tele použiť na vytvorenie bielkovinového výbežku (spike proteín), ktorý sa nachádza aj na víruse. Bunky potom vytvoria protilátky proti spike proteínu na pomoc v boji proti vírusu. To vás pomôže chrániť pred ochorením COVID-19.
2. Čo potrebujete vedieť predtým, ako vám podajú vakcínu Spikevax bivalent
O
r
i
ginal/Omicron BA.4-5
V
akcína sa nesmie podať ak ste alergický na liečivo alebo na ktorúkoľvek z ďalších zložiek tejto vakcíny (uvedených v časti 6).
Upozornenia a opatrenia
Predtým, ako vám podajú vakcínu Spikevax bivalent Original/Omicron BA.4-5, obráťte sa na svojho
lekára, lekárnika alebo zdravotnú sestru:
- ak ste v minulosti mali závažnú, život ohrozujúcu alergickú reakciu po akomkoľvek inom očkovaní alebo po podaní vakcíny Spikevax (pôvodná) v minulosti,
- ak máte veľmi slabý alebo oslabený imunitný systém,
- ak ste už niekedy omdleli po podaní injekcie ihlou,
- ak máte poruchu krvácania,
- ak máte vysokú horúčku alebo závažnú infekciu; ak však máte miernu horúčku alebo infekciu horných dýchacích ciest, ako napríklad prechladnutie, môžete byť očkovaný,
- ak máte akékoľvek závažné ochorenie,
- ak máte úzkosť súvisiacu s injekciami.
Existuje zvýšené riziko myokarditídy (zápalu srdcového svalu) a perikarditídy (zápalu výstelky mimo srdca) po očkovaní očkovacou látkou Spikevax (pôvodná) (pozri časť 4).
Tieto ochorenia sa môžu objaviť už niekoľko dní po očkovaní a vyskytli sa najmä počas prvých
14 dní. Boli pozorované častejšie po druhej dávke ako po prvej dávke a častejšie u mladších mužov.
Po očkovaní máte venovať pozornosť prejavom myokarditídy a perikarditídy, ako je napríklad dýchavičnosť, palpitácie (búšenie srdca) a bolesť v hrudníku, a v prípade ich výskytu okamžite vyhľadať lekársku pomoc.
Ak sa vás týka niektorý z vyššie uvedených prípadov (alebo si nie ste istý), obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru predtým, ako vám podajú vakcínu Spikevax bivalent Original/Omicron BA.4-5.
Vzplanutia syndrómu kapilárneho presakovania (CLS)
Po očkovaní očkovacou látkou Spikevax (pôvodná) bolo hlásených niekoľko prípadov vzplanutia syndrómu kapilárneho presakovania (spôsobujúceho vytekanie tekutiny z malých krvných ciev (kapilár), čo viedlo k rýchlemu opuchu rúk a nôh, náhlemu zvýšeniu hmotnosti a pocitu na omdletie, nízkemu krvnému tlaku). Ak sa ste už v minulosti mali príhody ochorenia CLS, poraďte sa s lekárom predtým, ako vám bude podaná očkovacia látka Spikevax bivalent Original/Omicron BA.4-5.
Trvanie ochrany
Rovnako ako v prípade iných vakcín, ani tretia dávka vakcíny Spikevax bivalent Original/Omicron
BA.4-5 nemusí úplne chrániť všetkých, ktorí ju dostávajú, a nie je známe, ako dlho budete chránení.
Deti
Vakcínu Spikevax bivalent Original/Omicron BA.4-5 sa neodporúča podávať deťom mladším ako
12 rokov.
Iné lieky a vakcína Spikevax bivalent Original/Omicron BA.4-5
Ak teraz užívate alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky, povedzte to svojmu lekárovi alebo lekárnikovi. Vakcína Spikevax bivalent Original/Omicron BA.4-5 môže ovplyvniť spôsob, akým účinkujú iné lieky, a iné lieky môžu ovplyvniť spôsob, akým účinkuje vakcína Spikevax bivalent Original/Omicron BA.4-5.
Os
oby s oslabeným imunitným systémom
U ľudí s oslabeným imunitným systémom môže byť účinnosť vakcíny Spikevax bivalent Original/Omicron BA.4-5 nižšia. V týchto prípadoch musíte naďalej dodržiavať fyzické bezpečnostné opatrenia, ktoré pomáhajú predchádzať ochoreniu COVID-19. Okrem toho osoby, ktoré sú v úzkom kontakte s vami, majú byť podľa potreby očkované. O individuálnych odporúčaniach sa poraďte
so svojím lekárom.
Tehotenstvo a dojčenie
Ak ste tehotná alebo ak si myslíte, že ste tehotná, povedzte to svojmu lekárovi, zdravotnej sestre alebo lekárnikovi predtým, ako dostanete túto vakcínu. Doposiaľ nie sú k dispozícii žiadne údaje týkajúce sa používania vakcíny Spikevax bivalent Original/Omicron BA.4-5 počas tehotenstva. Avšak veľké množstvo údajov od tehotných žien očkovaných vakcínou Spikevax (pôvodná) počas druhého
a tretieho trimestra nepreukázalo negatívne účinky na tehotenstvo ani na novorodenca. Aj keď sú
údaje o účinkoch na tehotenstvo alebo na novorodenca po očkovaní v prvom trimestri obmedzené, nepozorovalo sa žiadne zvýšené riziko potratu. Keďže rozdiely medzi týmito dvoma vakcínami spočívajú len v spike proteíne vo vakcíne a neexistujú medzi nimi klinicky významné rozdiely, Spikevax bivalent Original/Omicron BA.4-5 sa môže používať počas tehotenstva.
Doposiaľ nie sú k dispozícii žiadne údaje týkajúce sa používania vakcíny Spikevax bivalent
Original/Omicron BA.4-5 počas dojčenia.
Neočakáva sa však žiaden účinok na dojčeného novorodenca/dojča. Údaje od žien, ktoré dojčili po vakcinácii s vakcínou Spikevax (pôvodná) nepreukázali riziko nežiadúcich účinkov na dojčeného novorodenca/dojča. Vakcína Spikevax bivalent Original/Omicron BA.4-5 sa môže podávať počas dojčenia.
Vedenie vozidiel a obsluha strojov
Ak sa necítite dobre po podaní vakcíny, neveďte vozidlá ani neobsluhujte stroje. Počkajte, kým nevymiznú akékoľvek vplyvy vakcíny, a až potom môžete viesť vozidlá alebo obsluhovať stroje.
Vakcína Spikevax bivalent Original/Omicron BA.4-5 obsahuje sodík
Tento liek obsahuje menej ako 1 mmol (23 mg) sodíka v jednej dávke, t. j. v podstate zanedbateľné množstvo sodíka.
3. Ako vám podajú vakcínu Spikevax bivalent Original/Omicron BA.4-5
Dávka vakcíny Spikevax bivalent Original/Omicron BA.4-5 je 0,5 ml. Podáva sa najmenej 3 mesiace po poslednej predchádzajúcej dávke vakcíny proti COVID-19.
Váš lekár alebo zdravotná sestra vám injekčne podajú vakcínu do svalu (intramuskulárna injekcia)
v ramene.
Po každom podaní vakcíny vás bude lekár alebo zdravotná sestra sledovať aspoň 15 minút, či sa u vás neprejavuje alergická reakcia.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tejto vakcíny, opýtajte sa svojho lekára, lekárnika alebo zdravotnej sestry.
Vakcína Spikevax bivalent Original/Omicron BA.4-5 je určená iba pre osoby, ktoré už absolvovali aspoň základný očkovací cyklus proti COVID-19.
Podrobnosti o základnom cykle očkovania pre osoby vo veku 12 rokov a staršie pozri v písomnej informácii pre používateľa pre Spikevax 0,2 mg/ml injekčnú disperziu.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj táto vakcína môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
Ak sa u vás vyskytne akýkoľvek z nasledujúcich prejavov a príznakov alergickej reakcie, vyhľadajte
okamžitúlekársku pomoc:
- pocit na omdletie alebo závrat,
- zmeny srdcového rytmu,
- dýchavičnosť,
- sipenie,
- opuch pier, tváre alebo hrdla,
- žihľavka alebo vyrážka,
- nevoľnosť alebo vracanie,
- bolesť žalúdka.
Ak sa u vás vyskytne akýkoľvek iný vedľajší účinok, obráťte sa na svojho lekára alebo zdravotnú sestru. Môžu k nim patriť tieto:
Veľmi časté (môžu postihovať viac ako 1 z 10 osôb):
- opuch/citlivosť v podpazuší,
- znížená chuť do jedla (pozorovaná u detí vo veku od 6 mesiacov do 5 rokov),
- podráždenosť/plač (pozorované u detí vo veku od 6 mesiacov do 5 rokov),
- bolesť hlavy,
- ospalosť (pozorovaná u detí vo veku 6 mesiacov do 5 rokov),
- nevoľnosť,
- vracanie,
- bolesť svalov a kĺbov a stuhnutosť,
- bolesť alebo opuch v mieste podania injekcie,
- začervenanie v mieste podania injekcie (v niektorých prípadoch sa môže vyskytnúť približne 9
až 11 dní po podaní injekcie),
- pocit veľkej únavy,
- zimnica,
- horúčka.
Časté (môžu postihovať menej ako 1 z 10 osôb):
- hnačka,
- vyrážka,
- vyrážka alebo žihľavka v mieste podania injekcie (v niektorých prípadoch sa môžu vyskytnúť približne 9 až 11 dní po podaní injekcie).
Menej časté (môžu postihovať menej ako 1 zo 100 osôb):
- svrbenie v mieste podania injekcie,
- závrat,
- bolesť brucha,
- vyvýšená, svrbivá vyrážka (žihľavka, ktorá sa môže objaviť od podania injekcie až do približne
dvoch týždňov po podaní injekcie).
Zriedkavé (môžu postihovať menej ako 1 z 1 000 osôb)
- dočasné jednostranné ochrnutie tváre (Bellova obrna),
- opuch tváre (u pacientov, ktorí dostali kozmetické injekcie do tváre, sa môže vyskytnúť opuch tváre),
- znížené vnímanie alebo cit pri dotyku,
- nezvyčajný pocit na koži, ako je tŕpnutie alebo mravčenie (parestézia).
Veľmi zriedkavé (môžu postihovať menej ako 1 z 10 000 osôb)
- zápal srdcového svalu (myokarditída) alebo zápal výstelky mimo srdca (perikarditída), ktorý môže viesť k dýchavičnosti, palpitáciám (búšeniu srdca) alebo bolesti v hrudníku.
N
ez
n
áma frekvencia
- závažné alergické reakcie s ťažkosťami s dýchaním (anafylaxia),
- reakcia imunitného systému v dôsledku zvýšenej citlivosti alebo neznášanlivosti
(precitlivenosť),
- kožná reakcia, ktorá spôsobuje červené fľaky alebo škvrny na koži, ktoré môžu vyzerať ako terč
alebo „stred terča“ s tmavočerveným stredom, okolo ktorého sa nachádzajú svetločervené kruhy
(multiformný erytém),
- nadmerný opuch očkovanej končatiny,
- silné menštruačné krvácanie (predpokladá sa, že väčšina prípadov nie je závažná a je dočasná).
Hlásenie vedľajších účinkovAk sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára, lekárnika alebo
zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené
v
Prílohe V a uviesť číslo šarže, ak je k dispozícii. Hlásením vedľajších účinkov môžete prispieť
k získaniu ďalších informácií o bezpečnosti tejto vakcíny.
5. Ako uchovávať vakcínu Spikevax bivalent Original/Omicron BA.4-5Túto vakcínu uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte túto vakcínu po dátume exspirácie, ktorý je uvedený na označení po EXP. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Informácie o uchovávaní, exspirácii, používaní a zaobchádzaní sú opísané v časti určenej pre zdravotníckych pracovníkov na konci tejto písomnej informácie.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo vakcína Spikevax bivalent Original/Omicron BA.4-5 obsahujeTabuľka 1. Zloženie podľa typu obaluSila
| Obal
| Dávka (dávky)
| Zloženie na dávku
|
Spikevax bivalent
Original/Omicron BA.4-
5 (50 mikrogramov/50
mikrogramov)/ml injekčná disperzia
| Viacdávkov á 2,5 ml injekčná liekovka
| 5 dávok po 0,5 ml
|
Jedna dávka (0,5 ml) obsahuje
25 mikrogramov elazomeranu a 25 mikrogramov davezomeranu, mRNA očkovacej látky proti COVID-
19 (zapuzdrenej do lipidových nanočastíc).
|
Spikevax bivalent
Original/Omicron BA.4-
5
25 mikrogramov/25 mik rogramov injekčná disperzia
| Jednodávko vá 0,5 ml injekčná liekovka
| 1 dávka po 0,5 ml
Len na jednorazové použitie.
|
Sp
i
k
e
vax bivalent
O
r
i
ginal/Omicron BA.4-
5
25 mikrogramov/25 mik rogramov injekčná disperzia v naplnenej injekčnej striekačke
|
Naplnená injekčná striekačka
|
1 dávka po 0,5 ml
Len na jednorazové použitie.
|
|
Elazomeran je jednovláknová mediátorová RNA (mRNA) s čiapočkou na 5’ konci produkovaná
pomocou bezbunkovej
in vitro transkripcie z príslušných šablón DNA, kódujúca „spike“ (S) proteín vírusu SARS-CoV-2 (pôvodná).
Davezomeran je jednovláknová mediátorová RNA (mRNA) s čiapočkou na 5’ konci produkovaná pomocou bezbunkovej
in vitro transkripcie z príslušných šablón DNA, kódujúca spike“ S-proteín línií BA.4 a BA.5 variantu Omicron vírusu SARS-CoV-2. S-proteíny línií BA.4 a BA.5 variantu Omicron vírusu SARS-CoV-2 sú identické.
Ďalšie zložky sú SM-102 (heptadekán-9-yl 8-{(2-hydroxyetyl)[6-oxo-6-
(undecyloxy)hexyl]amino}oktanoát), cholesterol, 1,2-distearoyl-sn-glycero-3-fosfocholín
(DSPC), 1,2-dimyristoyl-rac-glycero-3-metoxypolyetylénglykol-2000 (PEG2000-DMG), trometamol, trometamólium-chlorid, kyselina octová, trihydrát octanu sodného, sacharóza, voda na injekcie.
Ako vyzerá vakcína Spikevax bivalent Original/Omicron BA.4-5 a obsah baleniaVakcína Spikevax bivalent Original/Omicron BA.4-5 je biela až sivobiela disperzia dodávaná v 2,5 ml sklenenej viacdávkovej injekčnej liekovke s gumenou zátkou a modrým odklápacím plastovým viečkom s hliníkovým uzáverom.
Veľkosť balenia: 10 viacdávkových injekčných liekoviek. Každá injekčná liekovka obsahuje 2,5 ml.
Spikevax bivalent Original/Omicron BA.4-5 25 mikrogramov/25 mikrogramov/ml injekčná disperziaVakcína Spikevax bivalent Original/Omicron BA.4-5 je biela až sivobiela disperzia dodávaná v
sklenenej jednodávkovej injekčnej liekovke s gumenou zátkou a modrým odklápacím plastovým viečkom s hliníkovým uzáverom.
Veľkosť balenia: 10 jednodávkových injekčných liekoviek. Jedna injekčná liekovka obsahuje 0,5 ml.
SpikevaxbivalentOriginal/OmicronBA.4-525mikrogramov/25mikrogramov/mlinjekčnádisperziavnaplnenejinjekčnejstriekačkeVakcína Spikevax bivalent Original/Omicron BA.4-5 je biela až sivobiela disperzia dodávaná
v naplnenej injekčnej striekačke (z cyklického olefínového polyméru) s piestovou zátkou a hrotovým uzáverom (bez ihly).
Naplnené injekčné striekačky sú balené v 5 priehľadných blistroch, z ktorých každý obsahuje
2 naplnené injekčné striekačky.
Veľkosť balenia: 10 naplnených injekčných striekačiek
Držiteľ rozhodnutia o registráciiMODERNA BIOTECH SPAIN, S.L.
Calle del Príncipe de Vergara 132 Plt 12
Madrid 28002
Španielsko
Výrobca
Rovi Pharma Industrial Services, S.A. Paseo de Europa, 50
28703. San Sebastián de los Reyes
Madrid, Španielsko
Moderna Biotech Spain S.L.
Calle del Príncipe de Vergara 132 Plt 12
Madrid 28002
Španielsko
Rovi Pharma Industrial Services, S.A. Calle Julián Camarillo n°35
28037 Madrid, Španielsko
Patheon Italia S.p.a. Viale G.B. Stucchi
110 20900 Monza, Taliansko
Patheon Italia S.p.A.
2 Trav. SX Via Morolense 5
03013 Ferentino (FR) Taliansko
Ak potrebujete akékoľvek informácie o tomto lieku, kontaktujte držiteľa rozhodnutia o registrácii.
B
e
l
gië/Belgique/Belgien
Tél/Tel: 0800 81 460
Lietuva
Tel: 88 003 1114
Б
ълг
ария
Teл: 00800 115 4477
Luxembourg/Luxemburg
Tél/Tel: 800 85 499
Č
e
s
k
á republika
Tel: 800 050 719
Magyarország
Tel: 06 809 87488
D
anmark
Tlf: 80 81 06 53
Malta
Tel: 8006 5066
D
e
u
t
s
c
h
l
and
Tel: 0800 100 9632
Nederland
Tel: 0800 409 0001
E
e
s
t
i
Tel: 800 0044 702
Norge
Tlf: 800 31 401
Ελ
λ
ά
δ
α
Τηλ: 008004 4149571
Österreich
Tel: 0800 909636
E
s
p
a
ña
Tel: 900 031 015
Polska
Tel: 800 702 406
F
r
ance
Tél: 0805 54 30 16
Portugal
Tel: 800 210 256
H
r
vatska
Tel: 08009614
Ireland
Tel: 1800 800 354
România
Tel: 0800 400 625
Slovenija
Tel: 080 083082
Ísland
Sími: 800 4382
Slovenská republika
Tel: 0800 191 647
Italia
Tel: 800 928 007
Suomi/Finland
Puh/Tel: 0800 774198
Κύ
π
ρ
ος
Τηλ: 80091080
Sverige
Tel: 020 10 92 13
L
atvija
Tel: 80 005 898
United Kingdom (Northern Ireland)
Tel: 0800 085 7562
T
áto písomná informácia bola naposledy aktualizovaná
Aby ste získali písomnú informáciu pre používateľa v iných jazykoch, naskenujte si tento kód pomocou mobilného zariadenia.

Alebo navštívte URL
https://www.ModernaCovid19Global.comPodrobné informácie o tejto vakcíne sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu.
Táto písomná informácia je dostupná vo všetkých jazykoch EÚ/EHP na webovej stránke Európskej
agentúry pre lieky.
------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:SledovateľnosťAby sa zlepšila (do)sledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov a číslo
šarže podaného lieku.
VakcínaSpikevaxbivalentOriginal/OmicronBA.4-5(50mikrogramov/50mikrogramov)/mlinjekčnádisperzia(viacdávkováinjekčnáliekovkasmodrýmodklápacímplastovýmviečkom)Vakcínu Spikevax bivalent Original/Omicron BA.4-5 má podávať vyškolený zdravotnícky pracovník.
Po rozmrazení je vakcína pripravená na podanie. Nepretrepávajte ani nerieďte.
Pred podaním sa vakcína musí vizuálne skontrolovať na prítomnosť častíc a zmenu farby.
Vakcína Spikevax bivalent Original/Omicron BA.4-5 je biela až sivobiela disperzia. Môže obsahovať biele alebo priehľadné častice, ktoré sú súčasťou produktu. Vakcínu nepodávajte, ak má zmenenú farbu alebo ak obsahuje iné častice.
Injekčné liekovky sa skladujú zmrazené pri teplote -50 °C až -15 °C.
Z každej viacdávkovej injekčnej liekovky je možné odobrať päť (5) dávok (po 0,5 ml).
Ubezpečte sa, že injekčná liekovka má modré odklápacie viečko a že názov lieku je Spikevax bivalent Original/Omicron BA.4-5 (50 mikrogramov/50 mikrogramov)/ml injekčná disperzia. Ak má injekčná liekovka modré odklápacie viečko a názov lieku je Spikevax 0,1 mg/ml injekčná disperzia alebo Spikevax bivalent Original/Omicron BA.1, pozrite si Súhrn charakteristických vlastností lieku pre ten liek.
Zátku prepichnite podľa možností vždy na inom mieste.
Pred použitím rozmrazte každú viacdávkovú injekčnú liekovku podľa nižšie uvedených pokynov (Tabuľka 2). Po rozmrazení injekčnej liekovky v chladničke ju pred podaním nechajte 15 minút stáť pri izbovej teplote.
Tabuľka 2. Pokyny na rozmrazovanie viacdávkových injekčných liekoviek pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke)
|
Trvanie rozmrazova nia
| Teplota
rozmrazovani a (pri izbovej teplote)
|
Trvanie rozmrazovania
|
Viacdávková injekčná
liekovka
|
2 °C – 8 °C
| 2 hodiny a 30
minút
|
15 °C – 25 °C
|
1 hodina
|

S
pikevax
bivalent
O
r
i
ginal/Omicron
B
A
.
1
25
mi
krogramov/25
mi
krogramov
i
njekčná
disperzia
(
j
e
dnodávkové injekčné liekovky)Po rozmrazení je vakcína pripravená na podanie.
Nepretrepávajte ani nerieďte. Obsah injekčnej liekovky krúživým pohybom opatrne premiešajte po rozmrazení a pred každým odobratím dávky.
Ubezpečte sa, že injekčná liekovka má modré odklápacie viečko a že názov lieku je Spikevax bivalent Original/Omicron BA.1. Ak má injekčná liekovka modré odklápacie viečko a názov lieku je Spikevax bivalent Original/Omicron BA.4-5, pozrite si Súhrn charakteristických vlastností lieku pre ten liek.
Počas uchovávania minimalizujte jej vystavenie svetlu v miestnosti a nevystavujte ju priamemu slnečnému svetlu ani ultrafialovému žiareniu.
Rozmrazte každú jednotlivú dávku podľa dole uvedených pokynov. Každá jednodávková injekčná liekovka alebo vonkajší obal obsahujúci 10 injekčných liekoviek sa môže rozmraziť, buď
v chladničke, alebo pri izbovej teplote (Tabuľka 3). Po rozmrazení injekčnej liekovky v chladničke ju pred podaním nechajte 15 minút stáť pri izbovej teplote.
Tabuľka 3. Pokyny na rozmrazovanie jednodávkových injekčných liekoviek a vonkajšieho obalu pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke)
|
Trvanie rozmrazovania
| Teplota rozmrazovani a (pri izbovej teplote)
|
Trvanie rozmrazovania (minúty)
|
Jednodávková injekčná liekovka
|
2 °C až 8 °C
|
45 minút
|
15 °C až 25 °C
|
15 minút
|
Vonkajší obal
| 2 °C až 8 °C
| 1 hodina 45 minút
| 15 °C až 25 °C
| 45 minút
|
Ak sa injekčné liekovky rozmrazujú pri teplote 2 až 8 °C, má sa pred podaním jednotlivá injekčná
liekovka ponechať približne 15 minút pri izbovej teplote (15 °C až 25 °C).
VakcínaSpikevaxbivalentOriginal/OmicronBA.125mikrogramov/25mikrogramovinjekčnádisperziavnaplnenejinjekčnejstriekačkeNepretrepávajte ani nerieďte obsah naplnenej injekčnej striekačky.
Každá naplnená injekčná striekačka je len na jednorazové použitie. Po rozmrazení je vakcína pripravená na použitie.
Z každej naplnenej injekčnej striekačky sa môže podať jedna (1) dávka 0,5 ml.
Vakcína Spikevax bivalent Original/Omicron BA.4-5 sa dodáva ako jednodávková, naplnená injekčná striekačka (bez ihly) obsahujúca 0,5 ml (25 mikrogramov elazomeranu a 25 mikrogramov davezomeranu) mRNA a musí sa pred podaním rozmraziť.
Počas uchovávania minimalizujte jej vystavenie svetlu v miestnosti a nevystavujte ju priamemu slnečnému svetlu ani ultrafialovému žiareniu.
Rozmrazte každú jednotlivú dávku podľa dole uvedených pokynov. Každú jednodávkovú injekčnú liekovku alebo vonkajší obal s 10 injekčnými liekovkami je možné rozmraziť, buď v chladničke, alebo pri izbovej teplote (Tabuľka 4).
Tabuľka 4. Pokyny na rozmrazovanie vakcíny Spikevax bivalent Original/Omicron BA.4-5naplnené injekčné striekačky a vonkajších obalov pred použitím
Konfigurácia
| Pokyny na rozmrazovanie a trvanie rozmrazovania
|
Teplota rozmrazovania (v chladničke) (°C)
|
Trvanie rozmrazovania (minúty)
| Teplota rozmrazovani a
(pri izbovej teplote) (°C)
|
Trvanie rozmrazovania (minúty)
|
Naplnená
injekčná striekačka v blistrovom obale
|
2 – 8
| 55
|
15 – 25
| 45
|
Vonkajší obal
| 2 – 8
| 155
| 15 – 25
| 140
|
Ubezpečte sa, že názov lieku v naplnenej injekčnej striekačke je Spikevax bivalent Original/Omicron
BA.4-5. Ak je názov lieku Spikevax 50 mikrogramov, pozrite si Súhrn charakteristických vlastností
lieku pre ten liek.
Návod na zaobchádzanie s naplnenými injekčnými striekačkami• Pred podaním nechajte každú naplnenú injekčnú striekačku stáť 15 minút pri izbovej teplote
(15 °C až 25 °C).
• Nepretrepávajte.
• Naplnená injekčná striekačka sa musí pred podaním vizuálne skontrolovať na prítomnosť častíc a zmenu farby.
• Vakcína Spikevax bivalent Original/Omicron BA.4-5 je biela až sivobiela disperzia. Môže obsahovať biele alebo priehľadné častice, ktoré sú súčasťou produktu. Vakcínu nepodávajte, ak má zmenenú farbu alebo obsahuje iné častice.
• Balenia s naplnenými injekčnými striekačkami neobsahujú ihly.
• Použite sterilnú ihlu vhodnej veľkosti na intramuskulárnu injekciu (21G alebo tenšie ihly).
• Odstráňte uzáver hrotu z injekčnej striekačky otáčaním proti smeru hodinových ručičiek.
• Ihlu pripojte na striekačku tak, že ju otáčate v smere hodinových ručičiek, kým nedrží pevne.
• Keď ste pripravený na podanie, odstráňte kryt ihly.
• Celú dávku podajte intramuskulárne.
• Po rozmrazení znova nezmrazujte.
LikvidáciaVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
Dávkovanie a rozpisDávka vakcíny Spikevax bivalent Original/Omicron BA.4-5 je 0,5 ml. Podáva sa najmenej 3 mesiace
po poslednej predchádzajúcej dávke vakcíny proti COVID-19.
Tak ako pri všetkých injekčných vakcínach, musí byť vždy okamžite k dispozícii príslušná liečba a lekársky dohľad pre prípad výskytu anafylaktickej reakcie po podaní vakcíny Spikevax bivalent Original/Omicron BA.4-5.
Zdravotnícky pracovník musí pozorovať zaočkovanú osobu aspoň 15 minút po podaní vakcíny. Nie sú k dispozícii údaje na vyhodnotenie súbežného podávania vakcíny Spikevax bivalent
Original/Omicron BA.4-5 s inými vakcínami. Vakcína Spikevax bivalent Original/Omicron BA.4-5 sa nesmie miešať v rovnakej injekčnej striekačke s inými vakcínami alebo liekmi.
PodávanieVakcína sa musí podávať intramuskulárne. Uprednostňovaným miestom je deltový sval ramena.
Nepodávajte túto vakcínu intravaskulárne, subkutánne ani intradermálne.
Viacdávková injekčná liekovkaNaplnené injekčné striekačkyPoužite sterilnú ihlu s veľkosťou vhodnou na intramuskulárnu injekciu (21 G alebo tenšiu). Zložte hrotový uzáver z naplnenej injekčnej striekačky tak, že ho otočíte proti smeru hodinových ručičiek. Pripojte ihlu otáčaním v smere hodinových ručičiek, kým ihla bezpečne nezapadne na injekčnú striekačku. Keď ste pripravený na podanie, odstráňte kryt ihly. Podajte celú dávku intramuskulárne. Po použití injekčnú striekačku zlikvidujte. Len na jednorazové použitie.