
r defektu sa aplikuje 10 - 70 sféroidov.
Pediatrická populácia
Bezpečnosť a účinnosť lieku Spherox u detí vo veku 15 až 18 rokov neboli stanovené.
Bezpečnosť a účinnosť lieku Spherox u detí mladších ako 15 rokov neboli stanovené. K dispozícii nie sú žiadne údaje.
Staršie osoby
Bezpečnosť a účinnosť lieku Spherox u pacientov starších ako 50 rokov neboli stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podávania
Na intraartikulárne použitie.
Liek Spherox sa pacientom podáva intraartikulárnou implantáciou.
Implantácia sa musí vykonať počas chirurgického zákroku (prednostne artroskopie alebo miniartrotómie). Vyžaduje sa debridement v oblasti defektu. Subchondrálna platnička nemá byť poškodená. Sféroidy sa dodávajú v naplnenej injekčnej striekačke alebo v aplikátore [dĺžka stopky
150 mm (co.fix 150)]. Sféroidy sa majú rovnomerne aplikovať na bázu defektu a v prípade potreby sa
majú naniesť na celú oblasť defektu pomocou chirurgických nástrojov. Sféroidy do 20 minút samy
priľnú na bázu defektu. Potom sa chirurgická rana môže uzavrieť bez ďalšieho zakrytia liečenej oblasti
(napr. periosteálnym lalokom) alebo fixácie sféroidov s použitím fibrínového lepidla. Liečba defektov s veľkosťou do 10 cm2 je vhodná v prípade jednotlivých defektov, ako aj priľahlých defektov (kombinovaná oblasť).
Pacienti liečení liekom Spherox musia podstúpiť špecifický rehabilitačný program (pozri časť 4.4). Tento program môže trvať až jeden rok v závislosti od odporúčania lekára.
Informácie o príprave a manipulácii s liekom Spherox, pozri časť 6.6.
4.3 Kontraindikácie
• Pacienti, ktorí nemajú úplne uzavretú epifyzeálnu rastovú platničku v postihnutom kĺbe.
• Primárna (generalizovaná) osteoartritída.
• Pokročilá osteoartritída postihnutého kĺbu (prekračujúca II. stupeň podľa Kellgrena
a Lawrenca).
• Infekcia zapríčinená vírusom hepatitídy B (HBV), vírusom hepatitídy C (HCV) alebo vírusmi
HIV I/II.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
Spherox je autológny liek a nesmie sa podávať žiadnemu inému pacientovi ako darcovi.
Pred použitím sa musí overiť, či meno pacienta zodpovedá informáciám o pacientovi/darcovi, ktoré sú uvedené na prepravných dokumentoch a označení lieku. Takisto treba skontrolovať, či je na primárnom obale uvedené správne číslo objednávky (číslo dávky).
Ak je primárny alebo sekundárny obal poškodený, a preto nie je sterilný, liek Spherox sa nesmie
aplikovať.
Aplikácia lieku Spherox u pacientov s defektmi chrupavky mimo kolenného kĺbu sa neodporúča. Bezpečnosť a účinnosť lieku Spherox u pacientov s defektmi chrupavky mimo femorálneho kondylu a kolenného jabĺčka neboli stanovené. K dispozícii nie sú žiadne údaje.
O
patrenia pri používaní
Liečba u pacientov s lokálnymi zápalmi alebo s akútnymi, ako aj nedávnymi infekciami kostí alebo
kĺbov sa má dočasne odložiť, kým sa nedoloží zotavenie z infekcie.
Z hlavných štúdií s liekom Spherox boli vylúčení pacienti s príznakmi chronických zápalových
ochorení.
K možným komplikujúcim faktorom patria súbežné problémy s kĺbmi, ako je skorá osteoartritída, defekty subchondrálnej chrupavky, nestabilita kĺbu, lézie ligamentov alebo menisku, abnormálna distribúcia hmotnosti v kĺbe, vbočenie alebo vybočenie, nesprávna poloha jabĺčka a metabolické, zápalové, imunologické alebo neoplastické ochorenia postihnutého kĺbu. Úspešnosť postupu môže nepriaznivo ovplyvniť neliečený edém kosti zodpovedajúci defektu chrupavky, ktorý sa má liečiť. Ak je to možné, súbežné problémy s kĺbom treba napraviť pred implantáciou alebo najneskôr v čase implantácie lieku Spherox.
Pri rozhodovaní o liečbe fazetových defektov (tzv. kissing lesions väčších ako II. stupeň podľa ICRS)
sa má vziať do úvahy stupeň prekrývania a miesto defektov v kĺbe.
Pooperačná hemartróza sa vyskytuje najmä u pacientov s predispozíciou na hemorágiu alebo
s nedostatočnou chirurgickou kontrolou hemorágie. Pred operáciou sa majú vyšetriť hemostatické funkcie pacienta. Tromboprofylaxia sa má podať podľa miestnych usmernení.
Aplikácia lieku Spherox u obéznych pacientov sa neodporúča.
Rehabilitácia
Po implantácii má pacient dodržiavať príslušný rehabilitačný program. Fyzická aktivita sa má obnoviť
podľa odporúčania lekára. Príliš skorá a intenzívna aktivita môže narušiť štep a trvanlivosť klinického
prínosu lieku Spherox.
Po implantácii sa má zaručiť dodržiavanie primeraného rehabilitačného programu (najmä u pacientov
s duševnými poruchami alebo so závislosťou).
Prípady, keďsaliekSpheroxnemôžedodať
Ak výroba sféroidov nebola úspešná alebo ak nie sú splnené kritériá na vydanie, napr. v dôsledku
nedostatočnej kvality biopsie, liek sa nemôže dodať. Lekár bude o tom okamžite informovaný.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
Lokálne aplikované antibiotiká alebo dezinfekčné látky môžu byť pre kĺbovú chrupavku toxické,
a preto sa priamy kontakt lieku Spherox s týmito látkami neodporúča.
Pacienti liečení kortikosteroidmi boli z hlavných štúdií s liekom Spherox vylúčení.
4.6 Fertilita, gravidita a laktácia
Gravidita a dojčenie
V prípade autológnych chondrocytov alebo sféroidov z autológnych chondrocytov nie sú k dispozícii
žiadne klinické údaje týkajúce sa expozície lieku v tehotenstve.
Keďže liek Spherox sa používa na nápravu defektov chrupavky kĺbu, a preto sa implantuje počas
chirurgického zákroku, jeho použitie u gravidných alebo dojčiacich žien sa neodporúča.
Fertilita
Nie sú k dispozícii žiadne údaje o možných účinkoch liečby liekom Spherox na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Vzhľadom na chirurgickú povahu základného zákroku má implantácia lieku Spherox veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Počas obdobia rehabilitácie môže byť táto schopnosť obmedzená z dôvodu zníženej pohyblivosti. Pacienti sa preto majú poradiť s ošetrujúcim lekárom
a dôsledne dodržiavať jeho pokyny.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Počas liečby liekom Spherox sa môžu vyskytnúť nežiaduce reakcie súvisiace s chirurgickým
zákrokom (implantáciou) alebo s liekom Spherox.
Nežiaduce reakcie súvisiace s liekom Spherox
• Delaminácia štepu
• Hypertrofia
Nežiaduce reakcie súvisiace s operáciou kĺbu
• Kĺbová efúzia
• Artralgia
Tabuľkový zoznamnežiaducichreakcií
Z hlavných klinických skúšaní sú k dispozícii informácie o nežiaducich reakciách u 177 pacientov.
Zohľadnili sa takisto nežiaduce reakcie získané dopytovaním ošetrujúcich chirurgov, ako aj zo spontánnych hlásení.
Nežiaduce reakcie sú uvedené podľa triedy orgánových systémov a podľa frekvencie v tabuľke 1
nižšie: veľmi časté (≥ 1/10), časté (≥ 1/100 až <1/10), menej časté (≥ 1/1 000 až <1/100), zriedkavé (≥
1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (nemožno ich odhadnúť z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 1: Nežiaduce účinky
Trieda orgánových systémov Frekvencia Nežiaduca reakcia
Poruchy imunitného systému časté precitlivenosť
P
oruchy srdca a srdcovej
činnosti
menej časté tachykardia
P
oruchy ciev menej časté hematóm,
povrchová tromboflebitída, hlboká žilová trombóza, lymfedém
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
veľmi časté kĺbová efúzia, artralgia, opuch kĺbu
časté svalová slabosť, zablokovanie kĺbu, krepitácia v kĺbe, chondropatia, tendinitída
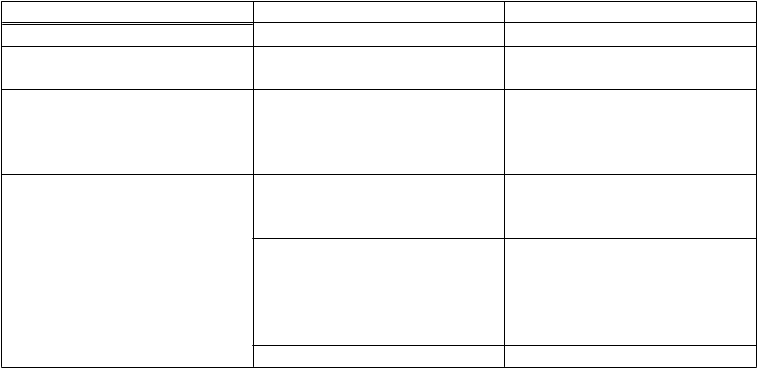
menej časté hypertrofia,
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia chondromalácia, synoviálna cysta
C
elkové poruchy a reakcie
v mieste podania
Ú
razy, otravy a komplikácie
li
e
čebného postupu
časté porucha chôdze,

bolesť
menej časté nepríjemný pocit
časté poranenie menisku, natiahnutie väzov
menej časté komplikácie súvisiace so stehmi,
delaminácia štepu
O
pis vybratých
nežiaducich
účinkov
D
elaminácia štepu
Delaminácia štepu je čiastočné alebo úplné odlúčenie vytvoreného tkaniva od subchondrálnej kosti
a okolitej chrupavky. Úplná delaminácia štepu je závažná komplikácia, ktorá môže byť sprevádzaná bolesťou. K rizikovým faktorom patria najmä neliečené súbežné ochorenia, ako je edém
subchondrálnej kosti.
Hypertrofia transplantátuPočas liečby liekom Spherox sa môže vyskytnúť symptomatická hypertrofia transplantátu, ktorá
spôsobuje bolesť.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieV prípadoch, keď sa odporúčaná dávka výrazne prekročila (až 170 sféroidov/cm² v rámci skúšania iniciovaného skúšajúcim pracovníkom s následným obdobím sledovania v trvaní 12 mesiacov), sa nepozorovali žiadne negatívne účinky.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Iné lieky na poruchy kostrovej a svalovej sústavy, ATC kód: M09AX02
Mechanizmus účinkuImplantácia autológnych chondrocytov (ACI) je založená na odobratí vlastných chondrocytov pacienta
izolovaných zo zdravej chrupavky, ich kultivácii
in vitro a následnej implantácii na miesto defektu chrupavky. Liek Spherox sa kultivuje a implantuje v podobe trojrozmerných sféroidov.
Klinická účinnosťLiek Spherox je dostupný od roku 2004 pre konkrétnych pacientov na liečbu defektov chrupavky
klasifikovaných ako 3. alebo 4. stupeň podľa Outerbridge, alebo III. alebo IV. stupeň podľa ICRS (Outerbridge 1961, ICRS Cartilage Injury Evaluation Package 2000). Liečení boli najmä pacienti
s defektom chrupavky v kolene.
Liek Spherox sa analyzoval v prospektívnej randomizovanej nekontrolovanej otvorenej multicentrickej klinickej štúdii vo fáze II, na ktorej sa zúčastnilo 75 pacientov s fokálnym defektom chrupavky (III. alebo IV. stupeň podľa ICRS) v kolene s veľkosťou defektu 4 - 10 cm2. Dvadsaťpäť pacientov bolo liečených 10 - 30 sféroidmi/cm² defektu, 25 pacientov bolo liečených 40 –
70 sféroidmi/cm² defektu a 25 pacientov bolo liečených 3 - 7 sféroidmi/cm² defektu. Priemerný vek pacientov bol 34 rokov (v rozmedzí od 19 do 48 rokov) s priemerným indexom telesnej hmotnosti (BMI) 25,2. Vo všetkých troch skupinách dávkovaní sa po 12, 24 a 36 mesiacoch pozorovalo významné zlepšenie (α < 0,05) skóre KOOS (Skóre poranenia kolena a výsledku osteoartritídy)
v porovnaní so skóre pred liečbou. V prípade všetkých skupín dávkovaní sa priemerné celkové skóre
KOOS na stupnici od 0 (najhoršie) do 100 (najlepšie) v prvom roku po liečbe zvýšilo z 57,0 na 73,4
a naďalej sa trochu zvyšovalo, pričom po 18 mesiacoch dosiahlo hodnotu 74,6, po dvoch rokoch 73,8 a po troch rokoch 77,0. Zmeny v každej skupine dávkovaní mali podobný rozsah a vo vzájomných (párových) analýzach troch skupín sa neodhalili štatisticky významné rozdiely medzi skupinami. Ďalšie skóre pacientov, napr. skóre Medzinárodného výboru pre dokumentáciu ochorení kolena (IKDC; subjektívne hodnotenie kolena) a Lysholmovo skóre takisto preukázali po 12, 24
a 36 mesiacoch významné zlepšenie v porovnaní s hodnotami pred liečbou.
Výsledky zobrazovania magnetickou rezonanciou (MRI) podľa hodnotiaceho systému nápravy tkaniva
chrupavky na základe pozorovania magnetickou rezonanciou (MOCART) (0 = najhorší výsledok;
100 = najlepší výsledok) preukázali zlepšenie v prvých 36 mesiacoch z 59,8 bodu pri 2. návšteve (tri mesiace po liečbe) až na 72,4 bodu v skupine pacientov liečených 3 - 7 sféroidmi/cm² defektu, zo 64,5 bodu pri 2. návšteve až na 79,6 bodu v dávkovacej skupine 10 - 30 sféroidov/cm² defektu a zo 64,7 bodu pri 2. návšteve až na 72,1 bodu v dávkovacej skupine 40 - 70 sféroidov/cm² defektu.'
V súčasnosti prebieha multicentrická prospektívna randomizovaná kontrolovaná klinická štúdia vo fáze III. Cieľom tejto štúdie je porovnať účinnosť a bezpečnosť liečby defektov chrupavky (od 1 do menej než 4 cm2) pri femorálnom kondyle kolenného kĺbu liekom Spherox a liečby mikrofraktúrou počas obdobia piatich rokov. Záverečné štatistické vyhodnotenie sa uskutoční 24 mesiacov po liečbe. Súčasná predbežná analýza uskutočnená 12 mesiacov po liečbe odhalila, že:
Liečebné skupiny boli vyvážené, pokiaľ ide o veľkosť, demografiu a ochorenie. Analyzovaná
populácia zahŕňala 102 pacientov (41 žien, 61 mužov) s priemerným vekom 37 rokov (v rozmedzí od
18 do 49 rokov) a priemerným indexom telesnej hmotnosti (BMI) 25,8. Veľkosť defektu sa pohybovala od 0,5 do 4 cm2. Väčšinou sa vyskytoval stupeň IV A podľa ICRS a potom nasledovali stupne IIIB a IIIA (56, 23 a 10 pacientov). Ani jeden z pacientov nepodstúpil v minulosti liečbu lézie mikrofraktúrou.
V rámci predbežnej analýzy sa na základe vyhodnotenia celkového skóre KOOS v populácii
s úmyslom liečby (ITT) preukázalo, že obidve liečby viedli v porovnaní s východzími hodnotami k štatisticky významnému zlepšeniu. V prípade pacientov liečených liekom Spherox sa celkové
priemerné skóre KOOS (stupnica 0 - 100) pri kontrolnej návšteve 12 mesiacov po liečbe zvýšilo z
východzej hodnoty 56,6 ± 15,4 na 78,7 ± 18,6. V prípade pacientov liečených mikrofraktúrou sa
priemerné celkové skóre KOOS zvýšilo z 51,7 ± 16,5 na 68,1 ± 18,6 (p < 0,0001 v obidvoch prípadoch). Pokiaľ ide o analýzu medzi skupinami, liečba liekom Spherox prešla testom podobnej účinnosti v porovnaní s mikrofraktúrou (Δ 5,7 s nižšou hranicou IS v hodnote –1,0). Skóre MOCART s hodnotou 67 v skupine liečenej liekom Spherox a s hodnotou 62 v skupine liečenej mikrofraktúrou pri kontrolnej návšteve tri mesiace po liečbe sa zlepšilo na 81 a 77 dvanásť mesiacov po liečbe
(0 = najhorší výsledok; 100 = najlepší výsledok).
Na základe podskóre IKDC, ako aj výsledkov formulára hodnotenia zdravia v súčasnosti IKDC
a modifikovaného Lysholmovho skóre sa takisto zistilo celkové zlepšenie v obidvoch liečebných skupinách oproti východzím hodnotám, pričom sa dosiahli numericky trochu lepšie výsledky
v skupine liečenej liekom Spherox, avšak bez štatistickej významnosti.
5.2 Farmakokinetické vlastnosti
Vzhľadom na povahu a určené klinické použitie lieku Spherox nie je možné aplikovať konvenčné
štúdie farmakokinetiky, absorpcie, distribúcie, metabolizmu a eliminácie.
5.3 Predklinické údaje o bezpečnosti
Sféroidy vytvorené ex vivo sa implantovali myšiam (subkutánna implantácia explantátov chrupavky v s ľudskými sféroidmi) alebo malým prasiatkam (autológne sféroidy implantované do defektov chrupavky). Nepozorovali sa žiadne príznaky zápalu, synovitídy, infekcií, rejekcie, hypertrofie alebo toxicity imunitného systému, tumorogenicity alebo biodistribúcie.
Pri skúmaní biodistribúcie a tumorogenicity spĺňajúcom požiadavky GLP sa v prípade NSG myší nepreukázali nijaké príznaky biodistribúcie a/alebo migrácie z implantovaných ľudských sféroidov.
Nezistilo sa žiadne podozrenie na potenciálnu tumorogenézu alebo zvýšený výskyt nádorov
v dôsledku implantovaných sféroidov. V štúdii na ovciach sa po injekcii sféroidov do kolenného kĺbu
takisto nepozorovala biodistribúcia.
Z toho vyplýva, že pri použití sféroidov u ľudí nehrozia žiadne riziká.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Chlorid sodný
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
72 hodín
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote od 1 °C do 10 °C. Nezmrazujte.
Nevystavujte žiareniu.
Neotvárajte vonkajší obal pred použitím, aby ste zabránili mikrobiálnej kontaminácii.
6.5 Druh obalu a obsah balenia a špeciálne zariadenie na použitie, podanie alebo implantáciu
Sféroidy sa dodávajú v aplikátore alebo v naplnenej injekčnej striekačke ako primárne jednotkové balenie.
Aplikátor [dĺžka stopky 150 mm (co.fix 150)] je zabalený v sterilnej tube a obalený ďalším vreckom. Tuba môže obsahovať maximálne dva systémy co.fix 150. Katéter aplikátora je vyrobený
z termoplastického polyuretánu, tesniaca zátka je na jednej strane z akrylonitrilbutadiénstyrénu a na druhej strane je zo silikónu. Aplikátor sa dodáva s aplikačným zariadením (sterilná injekčná striekačka).
Naplnená injekčná striekačka sa skladá z luerového zámku, tesniaceho krúžku a krycieho uzáveru. Je zabalená v sterilnej tube so skrutkovacím uzáverom a obalená ďalším vreckom. Všetky časti naplnenej injekčnej striekačky sú vyrobené z polypropylénu, tesniaci krúžok je vyrobený z izoprénu. Silikónový olej slúži ako lubrikant. Naplnená injekčná striekačka sa dodáva s aplikačným zariadením (zavedená kanyla alebo filtračná stopka).
Veľkosti balenia
Počet dodaných primárnych jednotkových balení závisí od typu primárneho jednotkového balenia a od
počtu sféroidov potrebných na konkrétnu veľkosť defektu (10 - 70 sféroidov/cm²).
Jeden aplikátor má maximálnu kapacitu 60 sféroidov v objeme až 200 mikrolitrov izotonického roztoku chloridu sodného.
Jedna naplnená injekčná striekačka má maximálnu kapacitu 100 sféroidov v objeme až
1 000 mikrolitrov izotonického roztoku chloridu sodného.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomAk je primárny alebo sekundárny obal poškodený, a preto nie je sterilný, liek Spherox sa nemá
aplikovať.
Zvyšné sféroidy sa nesmú uchovávať na neskoršiu aplikáciu.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIICO.DON AG Warthestraße 21
14513 Teltow
Nemecko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/17/1181/001
EU/1/17/1181/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.