
enia pri používaní
Liek sa nemá podávať injekčne. Pacienti majú byť informovaní, aby liek SIMBRINZA neprehĺtali. Účinkynaoči
SIMBRINZA sa neskúmal u pacientov s glaukómom so zúženým uhlom a jeho použitie sa u týchto
pacientov neodporúča.
Možný vplyv brinzolamidu na endoteliálnu funkciu rohovky sa neskúmal u pacientov so zhoršenou funkciou rohoviek (najmä u pacientov s nízkym počtom endoteliálnych buniek). Konkrétne, pacienti, ktorí nosia kontaktné šošovky, neboli skúmaní a odporúča sa starostlivé monitorovanie týchto pacientov pri používaní brinzolamidu, keďže inhibítory karboanhydrázy môžu ovplyvňovať hydratáciu rohovky a nosenie kontaktných šošoviek môže pre rohovku zvyšovať riziko. Odporúča sa starostlivé monitorovanie pacientov s ohrozením rohovky, ako sú pacienti s ochorením diabetes mellitus alebo dystrofiou rohovky. SIMBRINZA
sa môže používať pri nosení kontaktných šošoviek, ak sú pacienti starostlivo monitorovaní (pozri ďalej:
Benzalkóniumchlorid).
Brimonidín tartrát môže spôsobiť alergickú reakciu očí. Ak sa vyskytne alergická reakcia, liečba sa má zastaviť. Pri používaní brimonidín tartrátu boli hlásené oneskorené očné reakcie z precitlivenosti, pričom niektoré súviseli so zvýšením IOP.
Potenciálne účinky po ukončení liečby liekom SIMBRINZA sa neskúmali. Aj keď sa neskúmalo trvanie účinku lieku SIMBRINZA na zníženie IOP, predpokladá sa, že účinok brinzolamidu na zníženie IOP bude trvať 5-7 dní. Účinok brimonidínu na zníženie IOP môže trvať dlhšie.
Systémovéúčinky
SIMBRINZA obsahuje brinzolamid, sulfónamidový inhibítor karboanhydrázy a hoci sa podáva topicky,
absorbuje sa systémovo. Rovnaké typy nežiaducich reakcií, ktoré sa pripisujú sulfónamidom, sa môžu vyskytnúť pri topickom podaní. Ak sa vyskytnú príznaky závažných reakcií alebo precitlivenosti, používanie tohto lieku sa má ukončiť.
Poruchy
srdca
a
srdcovej
činnosti
Po podaní lieku SIMBRINZA sa u niektorých pacientov pozorovalo mierne zníženie krvného tlaku. Keď sa súbežne s liekom SIMBRINZA používajú určité lieky, napríklad antihypertenzíva a/alebo srdcové glykozidy, alebo v prípade pacientov so závažným alebo nestabilným a nekontrolovaným kardiovaskulárnym ochorením je potrebná obozretnosť (pozri časť 4.5)
SIMBRINZA sa má používať obozretne u pacientov s depresiou, cerebrálnou alebo koronárnou nedostatočnosťou, Raynaudovým syndrómom, ortostatickou hypotenziou alebo s ochorením tromboangiitis obliterans.
Acidobázické poruchy
Pri používaní perorálnych inhibítorov karboanhydrázy boli hlásené acidobázické poruchy. SIMBRINZA obsahuje brinzolamid, inhibítor karboanhydrázy a hoci sa podáva topicky, absorbuje sa systémovo. Rovnaké typy nežiaducich reakcií, ktoré sa pripisujú perorálnym inhibítorom karboanhydrázy (t.j. acidobázické poruchy), sa môžu vyskytnúť pri topickom podaní (pozri časť 4.5).
Používajte obozretne u pacientov s rizikom poruchy funkcie obličiek vzhľadom na možné riziko
metabolickej acidózy. SIMBRINZA je kontraindikovaný u pacientov so závažnou poruchou funkcie obličiek
(pozri časť 4.3).
Poruchafunkciepečene
SIMBRINZA sa neskúmal u pacientov s poruchou funkcie pečene; pri liečbe takýchto pacientov je potrebná obozretnosť (pozri časť 4.2).
Duševnábdelosť
Perorálne inhibítory karboanhydrázy môžu u starších pacientov narušiť schopnosť vykonávať úlohy vyžadujúce duševnú bdelosť a/alebo fyzickú koordináciu. SIMBRINZA sa absorbuje systémovo a tieto
účinky sa preto môžu vyskytnúť pri topickom podaní (pozri časť 4.7).
Benzalkóniumchlorid
SIMBRINZA obsahuje benzalkóniumchlorid, ktorý môže zapríčiniť podráždenie očí a je známe, že mení zafarbenie mäkkých kontaktných šošoviek. Je potrebné vyhýbať sa kontaktu s mäkkými kontaktnými
šošovkami. Pacienti musia byť informovaní, aby si vybrali kontaktné šošovky pred aplikáciou lieku
SIMBRINZA a po podaní dávky počkali 15 minút pred opätovným vložením kontaktných šošoviek do očí.
Bolo tiež hlásené, že benzalkóniumchlorid spôsobuje bodkovanú keratopatiu a/alebo toxickú ulceratívnu keratopatiu. Pri častom alebo predĺženom používaní je potrebné starostlivé monitorovanie.
Pediatrická populácia
Bezpečnosť a účinnosť lieku SIMBRINZA u detí a dospievajúcich vo veku od 2 do 17 rokov nebola stanovená. U novorodencov a dojčiat používajúcich brimonidínové očné kvapky v rámci liečby vrodeného
glaukómu boli hlásené symptómy predávkovania brimonidínom (vrátane straty vedomia, hypotenzie, hypotónie, bradykardie, hypotermie, cyanózy a apnoe). SIMBRINZA je preto kontraindikovaný u detí
mladších ako 2 roky (pozri časť 4.3).
Liečba detí vo veku 2 roky a starších (najmä detí vo vekovom rozsahu 2 až 7 rokov a/alebo s hmotnosťou <
20 kg) sa neodporúča vzhľadom na potenciálne vedľajšie účinky súvisiace s centrálnym nervovým systémom
(pozri časť 4.9).
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s liekom SIMBRINZA.
SIMBRINZA je kontraindikovaný u pacientov užívajúcich inhibítory monoaminooxidázy a u pacientov užívajúcich antidepresíva, ktoré ovplyvňujú noradrenagický prenos (napr. tricyklické antidepresíva a mianserín) (pozri časť 4.3). Tricyklické antidepresíva môžu znížiť očnú hypotenzívnu odpoveď na liek SIMBRINZA.
Obozretnosť je potrebná vzhľadom na možnosť aditívneho alebo zosilneného účinku pri užívaní látok
spôsobujúcich útlm CNS (napr. alkohol, barbituráty, opiáty, sedatíva alebo anestetiká).
K dispozícii nie sú žiadne údaje o hladine cirkulujúcich katecholamínov po podaní SIMBRINZY. U pacientov užívajúcich lieky, ktoré môžu ovplyvniť metabolizmus a vychytávanie cirkulujúcich amínov (napr. chlorpromazín, metylfenidát, rezerpín, inhibítory spätného vychytávania sérotonínu-norepinefrínu) je však potrebná obozretnosť.
Alfa adrenergickí agonisti (napr. brimonidín tartrát) môžu ako trieda znižovať pulz a krvný tlak. Po podaní SIMBRINZY sa u niektorých pacientov pozorovalo mierne zníženie krvného tlaku. Keď sa súbežne s liekom SIMBRINZA používajú také lieky, ako sú napríklad antihypertenzíva a/alebo srdcové glykozidy, je potrebná obozretnosť.
Obozretnosť je potrebná, keď sa začína liečba (alebo keď sa mení dávka) súbežnými systémovými liekmi (bez ohľadu na liekovú formu), ktoré môžu vytvárať interakcie s α-adrenergickými agonistami alebo môžu narušiť ich účinok, t.j. agonistami alebo antagonistami adrenergického receptora (napr. izoprenalín, prazosín).
Brinzolamid je inhibítor karboanhydrázy a hoci sa podáva topicky, absorbuje sa systémovo. Pri používaní perorálnych inhibítorov karboanhydrázy boli hlásené acidobázické poruchy. V prípade pacientov užívajúcich liek SIMBRINZA sa musí vziať do úvahy možnosť interakcií.
U pacientov užívajúcich perorálny inhibítor karboanhydrázy a topický brinzolamid je možný aditívny vplyv na známe systémové účinky inhibície karboanhydrázy. Súbežné podávanie lieku SIMBRINZA a perorálnych inhibítorov karboanhydrázy sa neodporúča.
Izoenzýmy cytochrómu P-450 zodpovedné za metabolizmus brinzolamidu zahŕňajú enzým CYP3A4 (hlavný), CYP2A6, CYP2B6, CYP2C8 a CYP2C9. Predpokladá sa, že inhibítory enzýmu CYP3A4, napríklad ketokonazol, itrakonazol, klotrimazol, ritonavir a troleandomycín, budú inhibovať metabolizmus brinzolamidu prostredníctvom enzýmu CYP3A4. Ak sa súbežne podávajú inhibítory enzýmu CYP3A4, odporúča sa obozretnosť. Akumulácia brinzolamidu je však nepravdepodobná, keďže liek sa vylučuje najmä obličkami. Brinzolamid nie je inhibítor izoenzýmov cytochrómu P-450.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití lieku SIMBRINZA u gravidných žien. Brinzolamid bol po systémovom podávaní teratogénny u potkanov, ale nie u králikov. Štúdie na zvieratách skúmajúce perorálny brimonidín nepoukazujú na priame škodlivé účinky z hľadiska reprodukčnej toxicity. V štúdiách na zvieratách sa zistilo, že brimonidín prechádza cez placentu a v obmedzenej miere vstupuje do obehu plodu. SIMBRINZA sa neodporúča používať počas gravidity a u žien vo fertilnom veku nepoužívajúcich antikoncepciu.
Laktácia
Nie je známe, či sa topický liek SIMBRINZA vylučuje do ľudského mlieka. Dostupné farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie minimálnych množstiev brinzolamidu po perorálnom podaní do materského mlieka. Brimonidín podávaný perorálne sa vylučuje do materského mlieka. SIMBRINZU nemajú používať ženy, ktoré dojčia deti.
Fertilita
Neklinické údaje nepreukazujú žiadny vplyv brinzolamidu alebo brimonidínu na fertilitu. Nie sú k dispozícii údaje o účinku topického očného podávania lieku SIMBRINZA na ľudskú fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
SIMBRINZA má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
SIMBRINZA môže spôsobiť závraty, únavu a/alebo ospalosť, čo môže narušiť schopnosť viesť vozidlá alebo obsluhovať stroje.
Dočasné neostré videnie alebo iné poruchy zraku môžu ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje. Ak sa po podaní instilácie vyskytne neostré videnie, pacient musí pred vedením motorového vozidla alebo obsluhovaním strojov počkať, kým sa mu zrak nevyjasní.
Perorálne inhibítory karboanhydrázy môžu u starších pacientov narušiť schopnosť vykonávať úlohy vyžadujúce duševnú bdelosť a/alebo fyzickú koordináciu (pozri časť 4.4).
4.8 Nežiaduce účinky
Zhrnutiebezpečnostnéhoprofilu
V klinických skúšaniach zahŕňajúcich liek SIMBRINZA v dávkovaní dvakrát denne najčastejšie nežiaduce reakcie boli očná hyperémia a očné alergické reakcie, ktoré sa vyskytovali približne u 6-7 % pacientov a
dysgeúzia (horká alebo nezvyčajná chuť v ústach po podaní instilácie), ktorá sa vyskytuje približne u 3 %
pacientov. Bezpečnostný profil lieku SIMBRINZA bol podobný ako v prípade jednotlivých zložiek
(brinzolamid 10 mg/ml a brimonidín 2 mg/ml).
Tabuľkovýzoznamnežiaducichreakcií
Počas klinických štúdií skúmajúcich liek SIMBRINZA podávaný dvakrát denne a počas klinických štúdií a sledovania po uvedení jednotlivých zložiek, brinzolamindu a brimonidínu, na trh, boli hlásené nasledujúce
nežiaduce reakcie. Sú klasifikované podľa nasledujúcej konvencie: veľmi časté ( ≥ 1/10), časté (≥ 1/100 až <
1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000) , veľmi zriedkavé (<1/10 000)
alebo nie sú známe (nedajú sa stanoviť z dostupných údajov). V rámci každej kategórie frekvencie sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
T
rieda orgánových
systémov
N
ežiaduce reakcie
Infekcie a nákazy Menej časté: nazofaryngitída2, faryngitída2, sínusitída2
Neznáme: rinitída2
Poruchy krvi a lymfatického systému Poruchy imunitného systému
Menej časté: znížený počet červených krviniek2, zvýšená
hladina chloridu v krvi2
Menej časté: precitlivenosť3
Psychické poruchy Menej časté: apatia2, depresia2,3, depresívna nálada2, insomnia1,
znížené libido2, nočné mory2, nervozita2
Poruchy nervového systému
Časté: somnolencia1, závrat3, dysgeúzia1
Menej časté: bolesť hlavy1, motorická dysfunkcia2, amnézia2, porucha pamäte2, parestézia2
Veľmi zriedkavé: synkopa3
Neznáme: tremor2, hypoestézia2, ageúzia2
Poruchy oka Časté: očná alergia1, keratitída1, bolesť oka1, očný diskomfort1, neostré videnie1, abnormálne videnie3, očná hyperémia1, zblednutie spojiviek3
Menej časté: erózia rohovky1, edém rohovky2, blefaritída1, depozity v rohovke (keratické precipitáty) 1, porucha spojovky
(papily) 1, fotofóbia1, fotopsia2, opuch oka2, opuch očného
viečka1, edém spojiviek1, suché oko1, výtok z oka1, znížená zraková ostrosť2, zvýšené slzenie1, pterýgium2, erytém očného viečka1, meibomitída2, diplopia2, uprený pohľad2, hypoestézia oka2, pigmentácia očného bielka2, cysta pod spojivkou2, abnormálny pocit v oku1, astenopia1
Veľmi zriedkavé: uveitída3, mióza3
Neznáme: poruchy zraku2, madaróza2
T
rieda orgánových systémov
N
ežiaduce reakcie
Poruchy ucha a labyrintu Menej časté: závrat1, tinitus2
Poruchy srdca a srdcovej
činnosti
Menej časté: kardiorespiračná tieseň2, angína pektoris2, arytmia3, palpitácie2,3, nepravidelná pulzová frekvencia2, bradykardia2,3, tachykardia3
Poruchy ciev Menej časté: hypotenzia1
Veľmi zriedkavé: hypertenzia3
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest Poruchy kože
a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva Poruchy obličiek
a močových ciest
Menej časté: dyspnoe2, bronchiálna hyperaktivita2, faryngolaryngeálna bolesť2, suché hrdlo1, kašeľ2, epistaxa2, kongescia horných dýchacích ciest2, nazálna kongescia1, rinorea2, podráždenie hrdla2, suchý nos1, kvapkanie z nosa1, kýchanie2
Neznáme: astma2
Časté: suché ústa1
Menej časté: dyspepsia1, ezofagitída2, abdominálny diskomfort1, hnačka2, vracanie2, nauzea2, častá stolica2, flatulencia2, orálna hypoestézia2, orálna parestézia1

Neznáme: abnormálny test na funkciu pečene2
Menej časté: kontaktná dermatitída1, urtikária2, vyrážka2, makulo-papulárna vyrážka2, celkový pruritus2, alopécia2, napätie v koži2
Neznáme: tvárový edém3, dermatitída2,3, erytém2,3
Menej časté: bolesť chrbta2, svalové spazmy2, myalgia2
Neznáme: artralgia2, bolesť v končatine2
Menej časté: bolesť obličiek2
Neznáme: polakiúria2
Poruchy reprodukčného systému a prsníkov Celkové poruchy a reakcie v mieste podania
Menej časté: erektilná dysfunkcia2
Menej časté: bolesť2, hrudný diskomfort2, abnormálny pocit2, pocit nervozity2, podráždenosť2, rezíduum lieku1
Neznáme: bolesť v hrudníku2, periférny edém2,3
1 nežiaduca reakcia pozorovaná pri použití lieku Simbrinza
2 ďalšia nežiaduca reakcia pozorovaná pri použití brinzolamindu v monoterapii
3 ďalšia nežiaduca reakcia pozorovaná pri použití brimonidínu v monoterapii
Opisvybranýchnežiaducichreakcií
Najčastejšia systémová nežiaduca reakcia súvisiaca s používaním lieku SIMBRINZA bola dysgeúzia
(3,4 %). Pravdepodobne je spôsobená prechodom očných kvapiek do nosohltanu cez nazolakrimálny kanál a pripisuje sa najmä brinzolamidovej zložke lieku SIMBRINZA. Výskyt tohto účinku môže znížiť nazolakrimálna oklúzia alebo jemné privretie očného viečka po podaní instilácie (pozri časť 4.2).
SIMBRINZA obsahuje brinzolamid, sulfónamidový inhibítor karboanhydrázy so systémovou absorpciou. So systémovými inhibítormi karboanhydrázy sú zvyčajne spojené gastrointestinálne účinky, účinky na nervový systém, hematologické, renálne a metabolické účinky. Rovnaký typ nežiaducich reakcií, ktoré sa pripisujú perorálnym inhibítorom karboanhydrázy, sa môžu vyskytnúť pri topickom podaní.
K nežiaducim reakciám, ktoré často súvisia s brimonidínovou zložkou lieku SIMBRINZA, patrí vznik očných reakcií alergického typu, únava a/alebo ospalosť a sucho v ústach. Použitie brimonidínu je spojené s minimálnym poklesom krvného tlaku. U niektorých pacientov používajúcich liek SIMBRINZA sa vyskytlo zníženie krvného tlaku, podobne ako pri používaní brimonidínu v monoterapii.
H
l
ásenie
podozrení
na
nežiaduce
r
eakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieAk sa vyskytne predávkovanie liekom SIMBRINZA, liečba má byť symptomatická a podporná. Dýchacie
cesty pacienta treba udržiavať priechodné.
V dôsledku brinzolamidovej zložky lieku SIMBRINZA sa môže vyskytnúť nerovnováha elektrolytov, vznik acidotického stavu a možné účinky na nervový systém. Musí sa sledovať sérová hladina elektrolytov (najmä draslíka) a hodnota pH krvi.
K dispozícii sú veľmi obmedzené údaje o náhodnom požití brimonidínovej zložky lieku SIMBRINZA u dospelých. Jediná nežiaduca udalosť, ktorá bola dosiaľ hlásená, bola hypotenzia. Uvádza sa, že po hypotenzívnej epizóde nasleduje rebound hypertenzia.
Bolo hlásené, že perorálne predávkovanie ďalšími alfa-2-agonistami spôsobuje také príznaky, ako sú hypotenzia, asténia, vracanie, letargia, sedácia, bradykardia, arytmie, mióza, apnoe, hypotónia, hypotermia, respiračná tieseň a záchvaty.
Pediatrická populáciaBoli hlásené závažné nežiaduce účinky po neúmyselnom požití brimonidínovej zložky SIMBRINZA pediatrickými subjektmi. U týchto subjektov sa vyskytli príznaky útlmu CNS, zvyčajne dočasná kóma alebo nízka úroveň vedomia, letargia, somnolencia, hypotónia, bradykardia, hypotermia, bledosť, respiračná tieseň a apnoe a prijatie na jednotku intenzívnej starostlivosti s intubáciou v prípade indikácie. Bolo hlásené, že všetci subjekti sa úplne zotavili, zvyčajne do 6-24 hodín.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Oftalomologiká, Antiglaukómový prípravok a miotiká; ATC kód: S01EC54.
MechanizmusúčinkuSIMBRINZA obsahuje dve účinné látky, brinzolamid a brimonidín tartrát. Tieto dve zložky znižujú vnútroočný tlak (IOP) u pacientov, ktorí majú glaukóm s otvoreným uhlom (OAG) a očnú hypertenziu (OHT) tak, že suprimujú vytváranie komorového moku v ciliárnom procese v oku. Hoci brinzolamid aj brimonidín znižujú IOP supresiou sekrécie komorového moku, mechanizmus ich účinku je odlišný.
Brinzolamid účinkuje tak, že inhibuje enzým karboanhydrázu (CA-II) v ciliárnom epiteli, čím sa zníži produkcia hydrogénuhličitanových iónov s následným znížením transportu sodíka a tekutiny v ciliárnom epiteli, čo vedie k zníženému vytváraniu komorového moku. Brimonidín, alfa-2 adrenergický agonista, inhibuje enzým adenylátcyklázu a sumprimuje vytváranie komorového moku v závislosti od cAMP. Podávanie brimonidínu vedie tiež k zvýšeniu uveosklérového výtoku.
Farmakodynamické účinky Kl i ni ck á účinnosť a bez pečnosť V jednej 6-mesačnej kontrolovanej klinickej štúdii skúmajúcej podiel jednotlivých zložiek, ktorá zahŕňala
560 pacientov s glaukómom s otvoreným ohlom (vrátane pseudoexfoliácie alebo pigmentovej disperznej zložky) a/alebo očnou hypertenziou, ktorí boli podľa názoru skúšajúceho nedostatočne kontrolovaní monoterapiou alebo už používali viac liekov na zníženie IOP a ktorí mali priemernú dennú hodnotu IOP vo východiskovom bode 26 mmHg, pomocou lieku SIMBRINZA podávaného dvakrát denne sa dosiahlo priemerné denné zníženie IOP približne o 8 mmHg. Pri použití lieku SIMBRINZA sa pozorovalo štatisticky
významné zníženie priemernej dennej hodnoty IOP v porovnaní s brinzolamidom v dávkovaní 10 mg/ml alebo brimonidínom v dávkovaní 2 mg/ml dvakrát denne pri všetkých návštevách počas štúdie (obrázok 1).
Obrázok 1. Zmena priemerneja dennej (9:00, +2 hodiny, +7 hodín) hodnoty IOP oproti východiskovému bodu (mmHg)—štúdia skúmajúca podiel jednotlivých zložiek
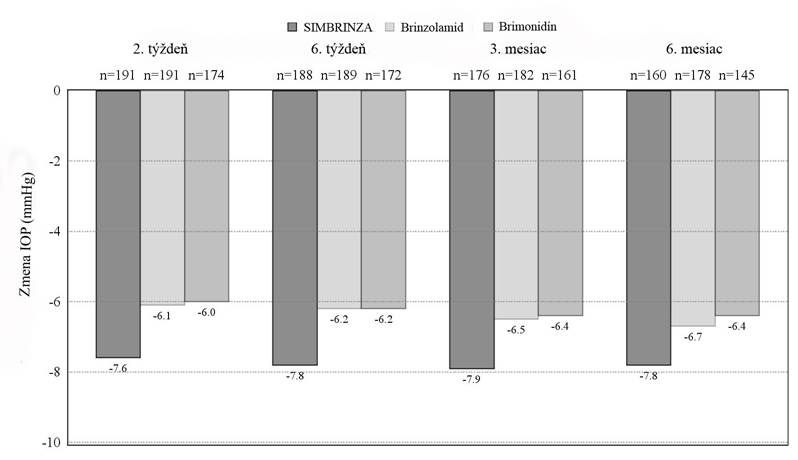
aPriemery dosiahnuté metódou najmenších štvorcov odvodené zo štatistického modelu, ktorý predstavuje miesto štúdie, vrstva IOP vo východiskovom bode o 9:00 a korelované merania hodnôt IOP u pacienta. Všetky rozdiely v liečbe (SIMBRINZA v porovnaní s jednotlivými zložkami) boli štatisticky významné
s hodnotou p=0,0001 alebo nižšou.
Priemerné zníženia hodnoty IOP oproti východiskovému bodu v každom časovom bode pri každej návšteve boli pri použití lieku SIMBRINZA väčšie (6 až 9 mmHg) ako pri použití brinzolamidu (5 až 7 mmHg) alebo brimonidínu (4 až 7 mmHg) v monoterapii. Priemerné percentuálne zníženia hodnoty IOP oproti východiskovému bodu pri použití lieku SIMBRINZA boli v rozsahu 23 až 34 %. Percento pacientov s hodnotou IOP nižšou ako 18 mmHg bolo vyššie v skupine, ktorá používala liek SIMBRINZA ako v skupine, ktorá používala brinzolamid pri 9 z 12 hodnotení až do 6. mesiaca a boli väčšie v skupine, ktorá používala liek SIMBRINZA ako v skupine, ktorá používala brimonidín pri všetkých 12 hodnoteniach až do 6. mesiaca. Pri návšteve v 3. mesiaci hodnotiacej primárnu účinnosť sa zistilo zníženie hodnoty IOP menšie ako
18 mmHg v časovom bode + 2 hodiny (čas zodpovedajúci maximálnej účinnosti ráno) u 61,7 % pacientov v skupine, ktorá používala liek SIMBRINZA, 40,1 % v skupine, ktorá používala brinzolamid a 40,0 % v skupine, ktorá používala brimonidín.
V jednej 6-mesačnej kontrolovanej klinickej štúdii non-inferiority, ktorá zahŕňala 890 pacientov s glaukómom s otvoreným uhlom (vrátane pseudoexfoliácie alebo pigmentovej disperznej zložky) a/alebo očnou hypertenziou, ktorí podľa názoru skúšajúceho boli nedostatočne kontrolovaní monoterapiou alebo už používali viac liekov na zníženie IOP a ktorí mali priemernú dennú hodnotu IOP vo východiskovom bode 26 až 27 mmHg, pri všetkých návštevách počas štúdie sa preukázala non-inferiorita lieku SIMBRINZA v porovnaní s brinzolamidom 10 mg/ml + brimonidínom 2 mg/ml podávanými súbežne vzhľadom na'
priemerné denné zníženie hodnoty IOP oproti východiskovému bodu (tabuľka 1).
Tabuľka 1. Porovnanie zmeny v priemernej dennej hodnote IOP (mmHg) oproti východiskovému bodu –
štúdia non-inferiority
Návšteva SIMBRINZA
Priemera
Brinzolamid + Brimonidín

Priemera
Rozdiel
Priemera (95 % IS)
2. týždeň -8,4 (n=394) -8,4 (n=384) -0,0 (-0,4, 0,3)
6. týždeň -8,5 (n=384) -8,4 (n=377) -0,1 (-0,4, 0,2)
3. mesiac -8,5 (n=384) -8,3 (n=373) -0,1 (-0,5, 0,2)
6. mesiac -8,1 (n=346) -8,2 (n=330) 0,1 (-0,3, 0,4)
aPriemery dosiahnuté metódou najmenších štvorcov odvodené zo štatistického modelu, ktorý predstavuje miesto štúdie, vrstva IOP vo východiskovom bode o 9:00 a korelované merania hodnôt IOP u pacienta
Priemerné zníženia hodnoty IOP oproti východiskovému bodu v každom časovom bode pri každej návšteve boli podobné pri používaní lieku SIMBRINZA alebo jednotlivých zložiek podávaných súbežne (7 až
10 mmHg). Priemerné percentuálne zníženia hodnoty IOP oproti východiskovému bodu pri používaní lieku
SIMBRINZA boli v rozsahu 25 až 37 %. Percento pacientov s hodnotou IOP nižšou ako 18 mmHg bolo podobné pri všetkých návštevách v rámci štúdie pre rovnaký časový bod až do 6. mesiaca v skupine, ktorá používala liek SIMBRINZA a v skupinách, ktoré používali brinzolamid + brimonidín. Pri návšteve v 3. mesiaci hodnotiacej primárnu účinnosť sa pozorovala hodnota IOP nižšia ako 18 mmHg v časovom bode +
2 hodiny (čas zodpovedajúci maximálnej účinnosti ráno) u 65,6 % pacientov v skupine, ktorá používala liek
SIMBRINZA a u 63,7 % pacientov v skupinách, ktoré používali brinzolamid + brimonidín.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom SIMBRINZA
vo všetkých podskupinách pediatrickej populácie pre liečbu glaukómu a očnej hypertenzie (informácie o použití v pediatrickej populácii, pozri časť 4.2)
5.2 Farmakokinetické vlastnosti
Absorpcia
Brinzolamid sa absorbuje cez rohovku po topickom očnom podaní. Látka sa absorbuje tiež do systémového obehu, kde sa viaže so silnou afinitou na karboanhydrázu v červených krvinkách (RBC). Plazmatické koncentrácie v plazme sú veľmi nízke. Polčas rozpadu v krvi je u ľudí predĺžený (>100 dní) v dôsledku väzby RBC na karboanhydrázu.
Brimonidín sa rýchlo absorbuje do oka po topickom podaní. U králikov sa maximálna koncentrácia v oku vo
väčšine prípadov dosiahla za menej ako jednu hodinu. Maximálna plazmatická koncentrácia u ľudí je <
1 ng/ml a dosiahla sa do < 1 hodiny. Plazmatická hladina klesá s polčasom približne 2-3 hodiny. Pri
dlhodobom používaní sa nepozoruje žiadna akumulácia.
V klinickej štúdii skúmajúcej topické očné podávanie, ktorá porovnávala systémovú farmakokinetiku lieku SIMBRINZA podávaného dva alebo trikrát denne s brinzolamidom a brimonidínom podávanými individuálne s použitím dvoch rovnakých dávkovaní, farmakokinetika brinzolamidu a N- dezetylbrinzolamidu v krvi v rovnovážnom stave bola v prípade kombinovaného lieku podobná ako v prípade brinzolamidu podávaného v monoterapii. Plazmatická farmakokinetika brimonidínu z kombinácie v rovnovážnom stave bola tiež podobná ako v prípade brimonidínu podávaného v monoterapii s výnimkou liečebnej skupiny, ktorá používala liek SIMBRINZA dvakrát denne, u ktorej bola priemerná hodnota AUC0-
12 hodín asi o 25 % nižšia ako pre brimonidín podávaný v monoterapii dvakrát denne.
Distribúcia
Štúdie na králikoch preukázali, že maximálna koncentrácia brinzolamidu v oku po topickom podaní sa pozoruje v predných tkanivách, napríklad v rohovke, spojivke, komorovom moku a dúhovke-ciliárnom teliesku. Retencia v očných tkanivách je predĺžená v dôsledku väzby na karboanhydrázu. Brinzolamid sa viaže stredne (asi 60 %) na ľudské plazmatické proteíny.
Brimonidín prejavuje afinitu k pigmentovaným očným tkanivám, najmä dúhovke-ciliárnemu teliesku, v dôsledku známej väzby na melanín. Údaje o klinickej a neklinickej bezpečnosti však dokazujú, že liek je pri dlhodobom podávaní dobre znášaný a bezpečný.
Biotransformácia
Brinzolamid sa metabolizuje v pečeni prostredníctvom izozýmov cytochrómu P450, najmä enzýmov CYP3A4, CYP2A6, CYP2B6, CYP2C8 a CYP2C9. Primárny metabolit je N-dezetylbrinzolamid a potom nasledujú metabolity N-dezmetoxypropyl a O-dezmetyl, ako aj analóg kyseliny N-propiónovej, ktorý sa vytvára oxidáciou N-propylového bočného reťazca O-dezmetylbrinzolamidu. Brinzolamid a
N-dezetylbrinzolamid neinhibujú izozýmy cytochrómu P450 v koncentrácii, ktorá je najmenej 100-násobne
vyššia ako maximálna systémová hladina.
Brimonidín sa vo veľkej miere metabolizuje v pečeni prostredníctvom aldehydoxidázy, pričom sa vytvárajú hlavné metabolity 2-oxobrimonidín, 3-oxobrimonidín a 2,3-dioxobrimonidín. Pozoruje sa tiež oxidatívne štiepenie imidazolínového kruhu na 5-bróm-6-guanidínchinoxalín.
Eliminácia
Brinzolamid sa vylučuje najmä močom v nezmenenej forme. Brinzolamid a
N-dezetylbrinzolamid tvoria v moči u ľudí asi 60 %, respektíve 6 % dávky. Údaje u potkanov preukázali
určitú mieru biliárnej sekrécie (asi 30 %), najmä vo forme metabolitov.
Brimonidín sa vylučuje najmä močom vo forme metabolitov. U potkanov a opíc tvoria metabolity v moči 60
až 75 % perorálnej alebo intravenóznej dávky.
Linearita/nelinearita
Farmakokinetika brinzolamidu je prirodzene nelineárna v dôsledku saturovateľnej väzby na karboanhydrázu v krvi a rôznych tkanivách. Expozícia v rovnovážnom stave sa nezvyšuje úmerne k dávke.
Brimonidín však prejavuje lineárnu farmakokinetiku v klinicky terapeutickom rozsahu dávky.
Farmakokinetický/farmakodynamickývzťah
SIMBRINZA je určený na lokálny účinok v oku. Posúdenie expozície v ľudskom oku v účinných dávkach nie je možné uskutočniť. Farmakokinetický/farmakodynamický vzťah zníženia IOP u ľudí nebol stanovený.
Ďalšieosobitnépopulácie
S liekom SIMBRINZA sa neuskutočnili štúdie na stanovenie vplyvu veku, rasy a poruchy funkcie obličiek alebo pečene. Štúdia skúmajúca používanie brinzolamidu u Japoncov v porovnaní s nejaponskými subjektmi preukázala podobnú systémovú farmakokinetiku u týchto dvoch skupín. V štúdii skúmajúcej brinzolamid u subjektov s poruchou funkcie obličiek sa preukázalo 1,6- až 2,8-násobné zvýšenie systémovej expozície brinzolamidu a N-dezetylbrinzolamidu u subjektov s normálnou funkciou obličiek a subjektov so stredne závažnou poruchou funkcie obličiek. Toto zvýšenie koncentrácie materiálu súvisiaceho s látkou v červených krvinkách v rovnovážnom stave neinhibovalo aktivitu karboanhydrázy v červených krvinkách na úrovni, ktorá je spojená so systémovými vedľajšími účinkami. Kombinovaný liek sa však neodporúča v prípade pacientov so závažnou poruchou funkcie obličiek (klírens kreatinínu < 30 ml/minútu).
Hodnoty Cmax, AUC a polčas rozpadu brimonidínu u starších osôb (> 65 rokov) sú podobné ako v prípade mladých dospelých. Vplyv poruchy funkcie obličiek a pečene na systémovú farmakokinetiku brimonidínu sa nehodnotil. Vzhľadom na nízku systémovú expozíciu brimonidínu po topickom očnom podaní sa predpokladá, že zmeny v plazmatickej expozícii nebudú klinicky významné.
Pediatrická populácia
Systémová farmakokinetika brinzolamidu a brimonidínu podávaných v monoterapii alebo v kombinácii sa u pediatrických pacientov neskúmala.
5.3 Predklinické údaje o bezpečnosti
Brinzolamid
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity alebo karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
Účinky v predklinických štúdiách toxicity pre reprodukciu a vývin sa pozorovali iba pri expozíciách považovaných za dostatočne vyššie, ako je maximálna expozícia u ľudí, čo poukazuje na malý význam týchto zistení pre klinické použitie. Perorálne dávky brinzolamidu až do 6 mg/kg/deň toxické pre matku (261-násobok odporúčanej dennej klinickej dávky 23 µg/kg/deň) neodhalili u králikov žiadny účinok na fetálny vývin. Dávky 18 mg/kg/deň (783-násobok odporúčanej dennej klinickej dávky), ale nie dávky
6 mg/kg/deň, podávané potkanom, viedli k mierne zníženej osifikácii lebky a sterna u plodov. Tieto zistenia súviseli s metabolickou acidózou so zníženým prírastkom telesnej hmotnosti u samíc a zníženou hmotnosťou
plodov. U mláďat samíc, ktoré dostávali dávku 2 až 18 mg/kg/deň, sa pozorovalo zníženie hmotnosti plodov
v závislosti od dávky. Pri použití dávky 5 mg/kg/deň počas laktácie sa nepozorovali u potomstva žiadne nežiaduce účinky.
Brimonidín
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývinu neodhalili
žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Benzalkóniumchlorid propylénglykol karbomér 974P kyselina boritá manitol
chlorid sodný tyloxapol
kyselina chlorovodíková a/alebo hydroxid sodný (na úpravu pH)
čistená voda
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky.
4 týždne po prvom otvorení.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
8 ml oválne nepriehľadné fľašky z polyetylénu nízkej hustoty (LDPE) s hrotom kvapkadla z LDPE a bielym
polypropylénovým skrutkovacím uzáverom (s odlupovacím obalom) obsahujúce 5 ml suspenzie.
Škatuľka obsahujúca 1 alebo 3 fľašky.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky na likvidáciu.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAlcon Laboratories (UK) Ltd Frimley Business Park Frimley, Camberley
Surrey GU16 7SR
Veľká Británia
8. REGISTRAČNÉ ČÍSLOEU/1/14/933/001-002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.