itíde a laryngitíde a pred a po extrakcii zubu.
4.2 Dávkovanie a spôsob podávaniaDávkovanieDospelí: Jednotlivá dávka je jedno až dve vstreknutia. Môžu sa opakovať každé 2 hodiny, 3 až 5-krát denne.
Na dosiahnutie optimálneho účinku sa neodporúča užívať liek tesne pred alebo po vyčistení zubov. Stanovená dávka sa nemá prekročiť.
Septolete extra sa môže užívať až 7 dní.
Starší pacientiOdporúčaná dávka je rovnaká ako pre dospelých.
Pediatrická populáciaDeti vo veku nad 12 rokov: Jednotlivá dávka je jedno až dve vstreknutia. Môžu sa opakovať každé 2 hodiny, 3 až 5-krát denne.
Deti vo veku od 6 do 12 rokov: Jednotlivá dávka je jedno vstreknutie. Môže sa opakovať každé 2 hodiny, 3 až 5-krát denne.
Septolete extra je kontraindikované u detí mladších ako 6 rokov.
Spôsob podávaniaPred prvým použitím Septolete extra orálnej aerodisperzie stlačte niekoľkokrát hlavičku spreja, aby ste získali plnú dávku. Ak ste aerodisperziu dlhší čas nepoužívali (najmenej 1 týždeň), stlačte hlavičku spreja jedenkrát, aby ste získali plnú dávku.
|
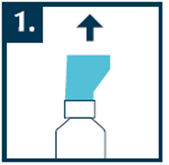
Pred použitím odstráňte plastový uzáver.
|
|
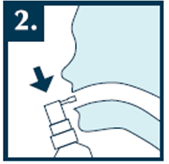
Otvorte ústa, nasmerujte rozprašovač na hrdlo a stlačte hlavičku spreja 1 až 2-krát. Pri aplikovaní lieku zadržte dych.
|
Po každom použití umiestnite na hlavičku spreja plastový uzáver.
Pri jednom stlačení hlavičky spreja sa uvoľní 0,1 ml orálnej roztokovej aerodisperzie, ktorá obsahuje 0,15 mg benzydamíniumchloridu a 0,5 mg cetylpyridíniumchloridu.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Deti mladšie ako 6 rokov, keďže lieková forma nie je vhodná pre túto vekovú skupinu.
4.4 Osobitné upozornenia a opatrenia pri používaníSeptolete extra sa nemá užívať viac ako 7 dní. Ak sa po 3 dňoch neprejavia viditeľné výsledky, je potrebné poradiť sa s lekárom.
Použitie topických prípravkov, najmä dlhodobo, môže viesť k senzibilizácii a v takom prípade je nutné liečbu prerušiť a nahradiť vhodnejšou terapiou.
Septolete extra sa nesmie užívať v kombinácii s aniónovými zlúčeninami, ako sú tie, ktoré sa nachádzajú v zubných pastách, a preto sa neodporúča užívať liek tesne pred alebo po vyčistení zubov.
Septolete extra orálna roztoková aerodisperzia sa nemá dostať do priameho kontaktu s očami.
Prípravok sa nesmie vdychovať.
Tento liek obsahuje malé množstvo etanolu (alkohol), menej ako 100 mg v jednej dávke.
4.5 Liekové a iné interakcieSeptolete extra sa nemá užívať súbežne s inými antiseptikami.
4.6 Fertilita, gravidita a laktáciaGraviditaNeexistujú žiadne alebo len obmedzené údaje o užívaní benzydamíniumchloridu a cetylpyridíniumchloridu u tehotných žien.
Septolete extra sa neodporúča počas gravidity.
LaktáciaNie je známe, či sa benzydamíniumchlorid alebo jeho metabolity vylučujú do ľudského mlieka.
Riziko pre novorodencov/dojčatá nemožno vylúčiť.
Musí sa vykonať rozhodnutie, či prerušiť laktáciu alebo prerušiť/vyhnúť sa terapii s liekom Septolete extra s prihliadnutím na prínos laktácie pre dieťa a prínos liečby pre ženu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeSeptolete extra nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky- Veľmi časté (³1/10)
- Časté (³1/100 až <1/10)
- Menej časté (³1/1 000 až <1/100)
- Zriedkavé (³1/10 000 až <1/1 000)
- Veľmi zriedkavé (<1/10 000)
- Neznáme (nie je možné odhadnúť z dostupných údajov)
Tabuľkový zoznam nežiaducich účinkov
| Zriedkavé
| Veľmi zriedkavé
| Neznáme
|
Poruchy imunitného systému
| Reakcie z precitlivenosti
|
|
|
Poruchy nervového systému
|
|
| Pálivý pocit na sliznici
Anestézia sliznice v ústach
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| Bronchospazmus
|
|
|
Poruchy gastrointestinálneho traktu
|
| Podráždenie sliznice v ústnej dutine
Pálivý pocit v ústach
|
|
Poruchy kože a podkožného tkaniva
| Žihľavka
Fotosenzitivita
|
|
|
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.
4.9 PredávkovanieSymptómyToxické prejavy predávkovania benzydamínom sú vzrušenie, kŕče, potenie, ataxia, triaška a vracanie. Keďže špecifické antidotum nie je známe, liečba akútnej intoxikácie benzydamínom je výhradne symptomatická.
Prejavy a symptómy intoxikácie v dôsledku požitia vysokého množstva cetylpyridíniumchloridu zahŕňajú nevoľnosť, vracanie, dýchavičnosť, cyanózu, asfyxiu s nasledovným ochrnutím dýchacích svalov, útlm CNS, hypotenziu a kómu. Letálna dávka u ľudí je približne 1-3 gramy.
LiečbaKeďže špecifické antidotum nie je známe, liečba akútneho predávkovania je výhradne symptomatická.
5. Farmakologické vlastnosti5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: laryngologiká, antiseptiká, ATC klasifikácia: R02AA20.
Mechanizmus účinkuBenzydamíniumchlorid je molekula s chemickou štruktúrou nesteroidnej látky s protizápalovými a analgetickými vlastnosťami. Mechanizmus účinku sa pripisuje inhibícii syntézy prostaglandínov a tým redukcii lokálnych prejavov zápalu (ako sú bolesť, začervenanie, opuch, teplo a narušenie funkcie). Cetylpyridíniumchlorid je katiónové antiseptikum zo skupiny kvartérnych amóniových solí. '
Klinická účinnosť a bezpečnosťBenzydamín sa používa prevažne na liečbu porúch orofaryngeálnej dutiny.
Cetylpyridíniumchlorid je účinný proti grampozitívnym a menej účinný proti gramnegatívnym baktériám a preto má optimálny antiseptický a germicídny účinok. Taktiež má antimykotické vlastnosti.
5.2 Farmakokinetické vlastnostiAbsorpciaZ dvoch liečiv, cetylpyridínium a benzydamín, iba benzydamín je absorbovaný. Cetylpyridínium preto nevytvára farmakokinetické interakcie s benzydamínom na systémovej úrovni.
Absorpcia benzydamínu cez orofaryngeálnu sliznicu je podložená prítomnosťou detekovateľného množstva liečiva v sére avšak v množstve nedostatočnom na vytvorenie systémových účinkov.
Benzydamín je však absorbovaný pri systémovom podaní. Preto je absorpcia benzydamínu vyššia pri farmaceutických formách, ktoré sa rozpúšťajú v ústach, v porovnaní s topickým podaním (ako orálna aerodisperzia). Navyše, absorpcia benzydamínu z orálnej aerodisperzie je pri odporúčaných dávkach zanedbateľná.
DistribúciaDistribučný objem je rovnaký pri všetkých farmaceutických formách.
ElimináciaVylučovanie prebieha primárne močom a z väčšej časti vo forme inaktívnych metabolitov. Výsledky pre biologický polčas a systémový klírens sú podobné vo všetkých farmaceutických formách.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
Štúdia zdôvodňujúca kombináciu dvoch liečiv preukázala, že liek má optimálnu znášanlivosť a nemá žiadnu toxicitu. Testy znášanlivosti kombinácie benzydamíniumchloridu a cetylpyridíniumchloridu vykonané na zvieratách preukázali dobrý profil znášanlivosti. Kombinácia benzydamíniumchloridu a cetylpyridíniumchloridu neviedla k zmenám v črevnej mikroflóre.
Benzydamíniumchlorid a cetylpyridíniumchlorid v orálnej aerodisperzii preukázali u zdravých dobrovoľníkov optimálnu znášanlivosť, pretože neviedli k lokálnemu ani systémovému toxickému účinku.
6. Farmaceutické informácie6.1 Zoznam pomocných látoketanol (96 %)
glycerol (E422)
makrogol glycerol hydroxystearát
sodná soľ sacharínu (E954)
silica mäty piepornej
čistená voda
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky
Prípravok sa má po prvom otvorení skladovať pri teplote do 25°C a spotrebovať do 6 mesiacov.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 25°C.
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah baleniaPlastová fľaša (HDPE) s bielym mechanickým rozprašovačom a modrým plastovým uzáverom (PP): 30 ml orálnej roztokovej aerodisperzie v škatuľke. 30 ml orálnej roztokovej aerodisperzie postačuje na 250 vstrekov.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
7. Držiteľ rozhodnutia o registráciiKRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Slovinsko
8. Registračné číslO69/0294/15-S
9. Dátum PRVEJ registrácie/PREDĹŽENIA REGISTRÁCIE10. Dátum revízie textuJúl 2015