
/>Liek RIXUBIS nevysadzujte bez toho, aby ste sa poradili so svojim lekárom.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára alebo lekárnika.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. U lieku RIXUBIS je možná precitlivenosť alergického typu. Tieto reakcie môžu zahŕňať pocity
pálenia a bodanie v mieste infúzie, zimnicu, sčervenanie, letargiu, nepokoj, pichanie, žihľavku,
svrbenie a vyrážky, nízky krvný tlak, rýchly tep srdca, zvieravý pocit na hrudi, dýchavičnosť, opuch hrdla, anafylaxiu (ťažká alergická reakcia), bolesti hlavy, nevoľnosť a zvracanie. Okamžite, prosím, informujte svojho lekára, ak sa u vás prejaví akýkoľvek z týchto vedľajších účinkov. Pri týchto reakciách je nutné bezodkladné lekárske ošetrenie (pozri časť 2 Upozornenia a opatrenia).
Nasledovné vedľajšie účinky boli pozorované pri liečbe liekom RIXUBIS:
Časté vedľajšie účinky (vyskytujú sa u menej ako 1 z 10 ľudí)
- poruchy chuti
- bolesť v končatinách.
Vedľajšie účinky s neznámou frekvenciou (frekvenciu nemožno odhadnúť z dostupných údajov)
- alergické reakcie (precitlivenosť).
Pri tomto produkte neboli pozorované problémy s nadmernou zrážanlivosťou krvi (tromboembolické príhody), tie sa však môžu vyskytnúť pri všetkých výrobkoch s faktorom IX. Môže ísť o srdcový infarkt, krvné zrazeniny v žilách alebo krvné zrazeniny v pľúcach.
Hlásenie vedľajších účinkov
Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Vedľajšie účinky môžete hlásiť aj priamo prostredníctvom národného systému hlásenia uvedeného v Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o
bezpečnosti tohto lieku.
5. Ako uchovávať liek RIXUBISUchovávajte tento liek mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na štítku a vonkajšom obale po skratke
EXP. Dátum exspirácie sa vzťahuje na posledný deň v mesiaci.
Uchovávajte v chladničke (2 °C - 8 °C). Neuchovávajte v mrazničke.
Pred otvorením môže byť produkt vybratý z chladničky na obdobie maximálne 6 mesiacov a pri teplote neprekračujúcej 30 ºC. Nový dátum trvanlivosti má byť napísaný na vonkajšom obale. Tento nový dátum trvanlivosti nesmie prekračovať pôvodný dátum uvedený na vonkajšom obale. Na konci tohto obdobia sa prípravok nesmie znovu uložiť do chladničky, ale má sa použiť alebo znehodnotiť.
Rekonštituovaný roztok použite okamžite.
Nepoužívajte liek RIXUBIS, ak roztok nie je číry a bezfarebný.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo RIXUBIS obsahuje- Liečivo je nonakog gama (rekombinantný ľudský koagulačný faktor IX), 250 IU, čo zodpovedá koncentrácii 50 IU/ml po rekonštitúcii s 5 ml rozpúšťadla.
- Ďalšie zložky prášku sú sacharóza, manitol, chlorid sodný, chlorid vápenatý, L-histidín, polysorbát 80.
Liekovka pre rozpúšťadlo: 5 ml sterilizovanej vody na injekciu.
Ako RIXUBIS vyzerá a obsah baleniaRIXUBIS je prášok a rozpúšťadlo na injekčný roztok
Balenie obsahuje:
· jednu liekovku prášku RIXUBIS 250 IU v sklenej liekovke s gumenou zátkou
· jednu liekovku 5 ml sterilizovanej vody na injekciu v sklenej liekovke s gumenou zátkou
· jedno zariadenie BAXJECT II (bezihlové rekonštitučné zariadenie)
Držiteľ rozhodnutia o registrácii
Baxter Innovations GmbH Industriestrasse 67
A-1221 Viedeň
Výrobca
Baxter SA
Boulevard René Branquart 80
B-7860 Lessines
Belgicko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte, prosím, miestneho zástupcu držiteľa rozhodnutia o registrácii:
België/Belgique/Belgien
Baxalta Belgium SPRL Tél/Tel: +32 2 386 80 00
Lietuva
UAB ″Baxter Lithuania″
Tel: +370 5 269 16 90/+370 5 252 71 00
България
Бакстер България ЕООД
тел.: +359 2 9808482
Luxembourg/Luxemburg
Baxalta Belgium SPRL Tél/Tel: +32 2 386 80 00
Česká republika
Baxter Czech spol.s.r.o. Tel.: +420 225774111
Magyarország
Baxter Hungary Kft. Tel.: +361 202 19 80
Danmark
Baxalta Denmark A/S Tlf: +45 48 16 64 00
Malta
Baxalta UK Limited
Tel.: +44 1635 206345
Deutschland
Baxalta Deutschland GmbH Tel: +49 89 31 701-0
Nederland
Baxalta Netherlands B.V. Tel: +31 30 2488911
Eesti
OÜ Baxter Estonia
Tel.: +372 6 515 120
Norge
SHELFCO - Baxalta Norway AS Tlf: +47 22 58 4800
Ελλάδα
Baxter (Hellas) Ε.Π.Ε.
Τηλ.: +30 210 28 80 000
Österreich
Baxalta Österreich GmbH Tel.: +43 1 71120 0
España
Baxalta Spain S.L. Tel: +34 96 2722800
Polska
Baxter Polska Sp. z o.o. Tel.: +48 22 4883 777
France
Baxalta France SAS Tél: +33 1 3461 5050
Portugal
Baxalta Portugal, Unipessoal, Lda. Tel: +351 21 925 25 00
Hrvatska
Baxter d.o.o.
Tel: +386 1 420 16 80
România
FARMACEUTICA REMEDIA SA Tel.: +40 21 321 16 40
Ireland
Baxalta UK Limited
Tel: +353 1 2065500
Slovenija
Baxter d.o.o.
Tel.: +386 1 420 16 80
Ísland
Lyfjaver ehf.
Sími: +354 533 6100
Slovenská republika
Baxter Slovakia s.r.o. Tel: +421 2 59418455
Italia
Baxalta Italy S.r.l. Tel: +39 06 324911
Suomi/Finland
SHELFCO - Baxalta Finland Oy
Puh/Tel: +358 9 8621111
Κύπρος
Baxter (Hellas) Ε.Π.Ε.
Τηλ.: +30 210 28 80 000
Sverige
Baxalta Sweden AB Tel: +46 8 6326400
Latvija
SIA BAXTER Latvia
Tel.: +371 67 784 784
United Kingdom
Baxalta UK Limited
Tel: +44 1635 206345
Táto písomná informácia pre používateľa bola naposledy aktualizovaná v mesiac/RRRR.
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu.
--------------------------------------------------------------------------------------------------------------------------- Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
DávkovanieDávkovanie a dĺžka substitučnej terapie závisia od závažnosti nedostatku faktora IX, od miesta a
rozsahu krvácania a od klinického stavu pacienta, veku a farmakokinetických parametrov faktora IX, ako je prírastková obnova a polčas života.
Odporúča sa, aby sa podávaná dávka a frekvencia opakovaných infúzií počas liečby určovala podľa stanovených hladín faktora IX. Reakcia jednotlivých pacientov na faktor IX môže byť rôzna, čím sa demonštrujú rôzne polčasy života a obnovy. U pacientov s podváhou alebo nadváhou môže dávka založená na telesnej hmotnosti vyžadovať úpravu. Najmä v prípade veľkých chirurgických zásahov je nevyhnutné presné monitorovanie substitučnej liečby pomocou koagulačnej analýzy (plazmovej aktivity faktora IX).
Aby sa zabezpečilo dosiahnutie požadovanej hladiny plazmovej aktivity faktora IX, odporúča sa starostlivé monitorovanie s použitím príslušného testu aktivity faktora IX a ak je to potrebné, mali by byť vykonané príslušné úpravy dávky a frekvencie opakovaných infúzií. Pri použití jednostupňového testu zrážanlivosti založeného na tromboplastínovom čase (aPTT) in vitro na stanovenie aktivity faktora IX z krvných vzoriek pacientov môžu byť výsledky testovania plazmovej aktivity faktora IX významne ovplyvnené druhom činidla aPTT a referenčného štandardu použitého v teste. Táto skutočnosť je dôležitá najmä vtedy, ak sa zmení laboratórium, ktoré test vykonáva, alebo sa zmenia činidlá použité v teste.
Počet dávok podávaného faktora IX sa vyjadruje v medzinárodných jednotkách (IU), ktoré zodpovedajú štandardom WHO pre produkty s faktorom IX. Plazmatická aktivita faktora IX sa vyjadruje v percentách (v pomere k normálnej ľudskej plazme) alebo v IU (v pomere k medzinárodným štandardom pre faktor IX v plazme).
Jedna (IU aktivity faktora IX zodpovedá množstvu faktora IX v jednom mililitri normálnej ľudskej plazmy.
Liečba na vyžiadanie
Výpočet požadovanej dávky faktora IX je založený na empirickom zistení, že 1 medzinárodná jednotka (IU) faktora IX na kg telesnej hmotnosti zvyšuje aktivitu plazmatického faktora IX
o 0,9 IU/dl (v rozmedzí 0,5 až 1,4 IU/dl) alebo 0,9 % bežnej aktivity u pacientov od 12 rokov a starších (ďalšie informácie pozri časť 5.2).
Požadovaná dávka sa určuje podľa tohto vzorca: Pacienti 12-roční a starší
Požadované
jednotky
= telesná hmotnosť (kg) x želaný nárast faktora IX
(%) alebo (IU/dl)
x prevrátená hodnota
pozorovanej obnovy
(dl/kg)
Pre prírastkovú obnovu 0,9 IU/dl na IU/kg sa dávka vypočítava takto:
Požadované
jednotky
= telesná hmotnosť (kg) x želaný nárast faktora IX
(%) alebo (IU/dl)
x 1,1 dl/kg
Množstvo lieku, ktoré sa má použiť, a frekvencia použitia sa majú vždy riadiť podľa základnej
klinickej účinnosti u každého pacienta.
V prípade týchto hemoragických príhod by aktivita faktora IX nemala v danom období klesnúť pod určenú hladinu plazmatickej aktivity (v % normálu alebo IU/dl). Túto tabuľku možno použiť ako ukazovateľ v prípade krvácania alebo operácie:
Stupeň hemorágie/typ chirurgického zákroku
| Požadovaná úroveň faktora
IX (%) alebo (IU/dl)
| Frekvencia dávok (v hodinách)/ Trvanie terapie (v dňoch)
|
Hemorágia
Začínajúca hemartróza, krvácanie do svalov alebo ústnej dutiny
Intenzívnejšia hemartróza, krvácanie do svalov alebo hematóm
Hemorágia ohrozujúca život.
|
20 – 40
30 – 60
60 – 100
|
Opakujte každých 24 hodín.
Aspoň 1 deň, kým sa krvácanie spojené s bolesťou nezastaví alebo sa nedosiahne vyliečenie.
Opakujte infúziu každých 24 hodín počas 3 – 4 dní alebo viac, dokiaľ bolesť a akútne postihnutie neustúpi.
Opakujte infúziu každých 8 až 24 hodín, kým hrozba neustúpi.
|
Operácia
Operácia menšieho rozsahu vrátane trhania zubov
|
30 – 60
|
Každých 24 hodín počas aspoň 1 dňa, kým sa nedosiahne vyliečenie.
|
Operácia veľkého rozsahu
|
80 – 100
(predoperačné a pooperačné)
|
Opakujte infúziu každých 8 až 24 hodín až do primeraného vyliečenia rany, nasleduje terapia počas ďalších
aspoň 7 dní na udržanie aktivity faktora
IX 30 % až 60 % (IU/dl).
|
Dôkladné monitorovanie substitučnej liečby je mimoriadne dôležité najmä pri operáciách veľkého
rozsahu a hemorágiách ohrozujúcich život.
Profylaxia
Na dlhodobú profylaxiu krvácania u pacientov s ťažkou hemofíliou B sú obvyklé dávky 40 až 60 IU
faktora IX na kilogram telesnej hmotnosti v intervale 3 až 4 dni u pacientov od 12 rokov. V niektorých prípadoch môžu byť v závislosti od pacientovej farmakokinetiky, veku, fenotypu krvácania a fyzickej aktivity potrebné kratšie intervaly dávkovania alebo vyššie dávky.
Nepretržitá infúzia
Liek RIXUBIS nepodávajte nepretržitou infúziou.
Pediatrická populácia
Liečba na vyžiadanie:
Výpočet požadovanej dávky faktora IX je založený na empirickom zistení, že 1 medzinárodná jednotka (IU) faktora IX na kg telesnej hmotnosti zvyšuje aktivitu plazmatického faktora IX činnosť
o 0,7 IU/dl (v rozmedzí 0,31 až 1,0 IU/dl) alebo 0,7 % bežnej aktivity u pacientov mladších 12 rokov
(ďalšie informácie pozri časť 5.2).
Požadované dávkovanie sa určuje podľa tohto vzorca: Pacienti mladší ako 12 rokov:
Požadované
jednotky
= telesná hmotnosť (kg) x želaný nárast faktora IX
(%) alebo (IU/dl)
x prevrátená hodnota
pozorovanej obnovy
(dl/kg)
Pre prírastkovú obnovu 0,7 IU/dl na IU/kg sa dávka vypočítava takto:
Požadované
jednotky
= telesná hmotnosť (kg) x želaný nárast faktora IX
(%) alebo (IU/dl)
x 1,4 dl/kg
Rovnakú tabuľku ako u dospelých možno použiť ako ukazovateľ v prípade krvácania alebo operácie
(pozri vyššie).
Profylaxia:
Odporúčaná dávka pre pediatrických pacientov mladších ako 12 rokov je 40 až 80 IU/kg v
intervaloch 3 až 4 dni. V niektorých prípadoch môžu byť v závislosti od pacientovej farmakokinetiky, veku, fenotypu krvácania a fyzickej aktivity potrebné kratšie intervaly dávkovania alebo vyššie dávky.
Písomná informácia pre používateľa
RIXUBIS 500 IU prášok a rozpúšťadlo na injekčný roztok
Nonakog gama (rekombinantný ľudský koagulačný faktor IX)

Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že nahlásite akékoľvek vedľajšie účinky, ak sa u vás vyskytnú. Informácie o tom ako hlásiť vedľajšie účinky, nájdete na konci časti 4.
Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento liek, pretože obsahuje pre vás dôležité informácie.- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
- Tento liek bol predpísaný vám. Nedávajte ho nikomu inému. Môže mu uškodiť dokonca aj vtedy, ak má rovnaké príznaky ochorenia ako vy.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika.
To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Pozri časť 4.
V tejto písomnej informácii pre používateľa sa dozviete:1. Čo je RIXUBIS a na čo sa používa
2. Čo potrebujete vedieť predtým, ako použijete RIXUBIS
3. Ako používať RIXUBIS
4. Možné vedľajšie účinky
5. Ako uchovávať RIXUBIS
6. Obsah balenia a ďalšie informácie
1. Čo je RIXUBIS a na čo sa používaRIXUBIS obsahuje aktívnu substanciu nonakog gama a je výrobkom s koagulačným faktorom IX. Faktor IX je bežnou zložkou ľudskej krvi. Je nevyhnutný pre účinné zrážanie krvi. RIXUBIS sa používa u pacientov s hemofíliou B (Christmasovou chorobou, dedičnou chorobou krvácania spôsobenou nedostatkom faktora IX). Účinkuje tak, že nahrádza chýbajúci faktor IX, čím aktivuje zrážanie krvi pacienta.
RIXUBIS sa používa na liečbu a prevenciu krvácania u pacientov s hemofíliou B vo všetkých vekových skupinách.
2. Čo potrebujete vedieť predtým, ako použijete RIXUBIS RIXUBIS neužívajte- ak ste alergický na nonakog gama alebo ďalšie súčasti tohto lieku (uvedené v časti 6)
- ak ste alergický na škrečie bielkoviny.
Upozornenia a opatreniaU lieku RIXUBIS je možná precitlivenosť alergického typu. Zastavte infúziu a okamžite kontaktujte svojho lekára alebo vyhľadajte lekársku pomoc, ak pocítite príznaky precitlivenosti/alergické reakcie,
ako je žihľavka, vyrážka, tlak na hrudi, sipot, nízky krvný tlak alebo anafylaxia (závažná alergická
reakcia, ktorá môže spôsobiť ťažkosti pri prehĺtaní a/alebo dýchaní, sčervenanie alebo opuch tváre a/alebo rúk) Pri týchto reakciách je nutné bezodkladné lekárske ošetrenie. Váš lekár tiež môže
vykonať krvný test na kontrolu, či ste si nevytvorili protilátky neutralizujúce aktivitu (inhibítory) proti svojmu lieku, keďže inhibítory sa môžu vyvíjať spolu s alergiami. Pacienti s inhibítormi faktora IX môžu mať zvýšené riziko anafylaxie počas budúcej liečby s faktorom IX.
Okamžite kontaktujte svojho lekára, pokiaľ sa vám krvácanie nezastavilo podľa očakávaní alebo na obmedzenie krvácania potrebujete výrazne zvýšené dávky lieku RIXUBIS. Váš lekár vykoná krvný test na kontrolu, či ste si nevytvorili protilátky neutralizujúce aktivitu (inhibítory) voči lieku RIXUBIS. Riziko vytvorenia inhibítorov je najvyššie u pacientov, ktorí ešte neboli liečení liekom na substitúciu faktora IX alebo v prvotnej fáze liečby, tzn. u malých detí.
Produkciu faktora IX v tele riadi gén faktora IX. U pacientov so špecifickou mutáciou génu faktora IX (napr. jeho výrazným nedostatkom) je vyššia pravdepodobnosť vytvorenia inhibítorov faktora IX a alergickej reakcie počas prvotnej fáze s akýmkoľvek koncentrátom faktora IX. Ak sa u vás teda takáto mutácia vyskytuje, váš lekár vás bude dôkladnejšie monitorovať na známky alergickej reakcie.
Ak trpíte ochorením pečene alebo ochorením srdca alebo ste nedávno prekonali závažnú operáciu, informujte, prosím, svojho lekára, pretože je zvýšené riziko komplikácii so zrážaním krvi (koaguláciou).
Poruchy obličiek (nefrotický syndróm) boli hlásené pri pokusoch o navodenie imunitnej tolerancie u pacientov s hemofíliou B s inhibítormi faktora IX a so sklonom k alergickým reakciám po vysokých dávkach faktora IX.
Pri každom podaní dávky RIXUBIS sa odporúča, aby sa vždy zaznamenal názov a číslo šarže lieku a aby sa viedli záznamy o použitých šaržách (napr. do denníku).
Iné lieky a RIXUBIS
Ak užívate alebo ste v poslednom čase užívali ešte iné lieky, prosím, oznámte to svojmu lekárovi alebo lekárnikovi. Interakcie lieku RIXUBIS s inými liečivami nie sú známe.
Tehotenstvo, dojčenie a plodnosť
Ak ste tehotná alebo dojčíte, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom alebo lekárnikom predtým, ako začnete užívať tento liek. Hemofília B sa u žien
vyskytuje len zriedka.
Vedenie vozidla a obsluha strojov
Liek RIXUBIS nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
RIXUBIS obsahuje sodík
Tento liek obsahuje 19 mg sodíka na liekovku. Musí sa to vziať do úvahy u pacientov na diéte s kontrolovaným príjmom sodíka.
3. Ako používať RIXUBIS
Liečba liekom RIXUBIS bude začatá lekárom, ktorý má skúsenosti so starostlivosťou o pacientov s hemofíliou B.
Vždy užívajte tento liek presne tak, ako vám povedal váš lekár. Ak si nie ste niečím istí, poraďte sa so svojím lekárom.
Váš lekár rozhodne, akú dávku lieku RIXUBIS dostanete. Dávkovanie a dĺžka závisia od závažnosti nedostatku faktora IX, od miesta a rozsahu krvácania a od klinického stavu pacienta, veku a od toho, ako rýchlo vaše telo spracováva faktor IX. Tieto údaje bude nutné pravidelne kontrolovať.
Po rekonštitúcii prášku s priloženým rozpúšťadlom vám liek RIXUBIS intravenózne podá váš lekár alebo sestra. Liek RIXUBIS vám môže injekciou podať aj niekto ďalší alebo vy sami, ale len ak ste na to odborne vyškolení.
 Rekonštitúcia a podávanie
Rekonštitúcia a podávanie
- Na rekonštitúciu používať iba priložené rozpúšťadlo a rekonštitučné zariadenie (BAXJECT II).
- Na podávanie je nutné použiť striekačku s konektorom typu luer-lock.
- Nepoužívajte, ak je zariadenie BAXJECT II, jeho systém sterilnej bariéry alebo balenie poškodené alebo vykazuje akékoľvek známky poškodenia.
RekonštitúciaPoužite aseptickú techniku
1. Pokiaľ je produkt stále uchovávaný v chladničke, vezmite z nej prášok RIXUBIS i rozpustné liekovky a nechajte ich zohriať sa na izbovú teplotu (medzi 15 °C a 25 °C).
2. Dôkladne si umyte ruky pomocou mydla a teplej vody.
3. Odstráňte uzávery z liekoviek prášku a rozpúšťadla.
4. Očistite zátky alkoholovými tampónmi. Položte liekovky na čistý rovný povrch.
5. Otvorte balenie zariadenia BAXJECT II. Odlúpnite papierové viečko bez toho, aby ste sa dotkli vnútrajška (obr. a). Nevyberajte zariadenie z balenia.
6. Obráťte balenie a priehľadným plastovým tŕňom prepichnite zátku rozpúšťadla. Uchopte balenie za jeho okraj a pretiahnite ho cez BAXJECT II (obr. b). Neodstraňujte modrý kryt zo zariadenia BAXJECT II.
7. Zariadenie BAXJECT II je teraz pripojené k liekovke rozpúšťadla. Otočte celý systém tak, aby bola liekovka navrchu zariadenia. Bielym plastovým tŕňom prepichnite zátku RIXUBIS. Vákuum vtiahne rozpúšťadlo do liekovky RIXUBIS (obr. c).
8. Jemne otáčajte, kým sa všetok materiál nerozpustí. Produkt sa rozpúšťa rýchlo (do 2 minút).
Uistite sa, že liek RIXUBIS sa úplne rozpustil, inak neprejde všetok rekonštituovaný roztok cez filter zariadenia. Rekonštituované lieky sa majú pred podaním vizuálne skontrolovať, či sa
v ňom nenachádzajú častice a či nezmenil farbu. Roztok má byť číry alebo mierne opalizujúci. Nepoužívajte roztoky, ktoré sú zakalené alebo sú v nich usadeniny.
Obr. a Obr. b Obr. cPo rekonštitúcii znovu nezmrazujte a nevracajte do chladničky.
Použite ihneď.
PodávaniePoužite aseptickú techniku
1. Odstráňte modrý kryt zo zariadenia BAXJECT II.
Nenaťahujte vzduch do injekčnej striekačky. Pripojte striekačku k zariadeniu BAXJECT II (obr. d).
2. Obráťte systém (liekovka s rekonštituovaným roztokom musí byť navrchu). Pomaly späť
vtiahnite piest a tak vtiahnite rekonštituovaný roztok do striekačky (obr. e).
3. Odpojte striekačku.
4. Pripojte na striekačku motýľovú ihlu. Injekciu podajte intravenózne. Roztok má byť podávaný pomaly na úrovni, ktorá je pacienta pohodlná, maximálne 10 ml za minútu.
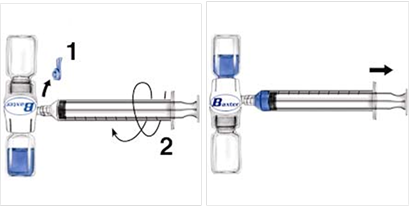 Obr. d Obr. e
Obr. d Obr. ePri každom podaní dávky RIXUBIS sa odporúča, aby sa vždy zaznamenal názov a číslo šarže lieku a
aby sa viedli záznamy o použitých šaržách (napr. do denníku).
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Ak použijete viac RIXUBIS, ako máteVždy používajte liek RIXUBIS presne tak, ako vám povedal váš lekár. Ak si nie ste niečím istí, poraďte sa so svojím lekárom. Ak ste si podali viac lieku RIXUBIS, ako sa odporúča, v čo najkratšom čase kontaktujte svojho lekára.
Ak zabudnete použiť RIXUBISNepodávajte si infúziou dvojnásobnú dávku, aby ste nahradili vynechanú dávku. Ďalšiu injekciu si podajte podľa harmonogramu a ďalej sa riaďte pokynmi svojho lekára.
Ak prestanete používať RIXUBISLiek RIXUBIS nevysadzujte bez toho, aby ste sa poradili so svojim lekárom.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára alebo lekárnika.
4. Možné vedľajšie účinkyTak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. U lieku RIXUBIS je možná precitlivenosť alergického typu. Tieto reakcie môžu zahŕňať pocity
pálenia a bodanie v mieste infúzie, zimnicu, sčervenanie, letargiu, nepokoj, pichanie, žihľavku,
svrbenie a vyrážky, nízky krvný tlak, rýchly tep srdca, zvieravý pocit na hrudi, dýchavičnosť, opuch hrdla, anafylaxiu (ťažká alergická reakcia), bolesti hlavy, nevoľnosť a zvracanie. Okamžite, prosím, informujte svojho lekára, ak sa u vás prejaví akýkoľvek z týchto vedľajších účinkov. Pri týchto reakciách je nutné bezodkladné lekárske ošetrenie (pozri časť 2 Upozornenia a opatrenia).
Nasledovné vedľajšie účinky boli pozorované pri liečbe liekom RIXUBIS:
Časté vedľajšie účinky (vyskytujú sa u menej ako 1 z 10 ľudí)
- poruchy chuti
- bolesť v končatinách.
Vedľajšie účinky s neznámou frekvenciou (frekvenciu nemožno odhadnúť z dostupných údajov)
- alergické reakcie (precitlivenosť).
Pri tomto produkte neboli pozorované problémy s nadmernou zrážanlivosťou krvi (tromboembolické príhody), tie sa však môžu vyskytnúť pri všetkých výrobkoch s faktorom IX. Môže ísť o srdcový infarkt, krvné zrazeniny v žilách alebo krvné zrazeniny v pľúcach.
Hlásenie vedľajších účinkov
Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Vedľajšie účinky môžete hlásiť aj priamo prostredníctvom národného systému hlásenia uvedeného v Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií
o bezpečnosti tohto lieku.
5. Ako uchovávať liek RIXUBISUchovávajte tento liek mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na štítku a vonkajšom obale po skratke
EXP. Dátum exspirácie sa vzťahuje na posledný deň v mesiaci.
Uchovávajte v chladničke (2 °C - 8 °C). Neuchovávajte v mrazničke.
Pred otvorením môže byť produkt vybratý z chladničky na obdobie maximálne 6 mesiacov a pri teplote neprekračujúcej 30 ºC. Nový dátum trvanlivosti má byť napísaný na vonkajšom obale. Tento nový dátum trvanlivosti nesmie prekračovať pôvodný dátum uvedený na vonkajšom obale. Na konci tohto obdobia sa prípravok nesmie znovu uložiť do chladničky, ale má sa použiť alebo znehodnotiť.
Rekonštituovaný roztok použite okamžite.
Nepoužívajte liek RIXUBIS, ak roztok nie je číry a bezfarebný.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo RIXUBIS obsahuje- Liečivo je nonakog gama (rekombinantný ľudský koagulačný faktor IX), 500 IU, čo zodpovedá koncentrácii 100 IU/ml po rekonštitúcii s 5 ml rozpúšťadla.
- Ďalšie zložky prášku sú sacharóza, manitol, chlorid sodný, chlorid vápenatý, L-histidín, polysorbát 80.
Liekovka pre rozpúšťadlo: 5 ml sterilizovanej vody na injekciu.
Ako RIXUBIS vyzerá a obsah baleniaRIXUBIS je prášok a rozpúšťadlo na injekčný roztok
Balenie obsahuje:
· jednu liekovku prášku RIXUBIS 500 IU v sklenej liekovke s gumenou zátkou
· jednu liekovku 5 ml sterilizovanej vody na injekciu v sklenej liekovke s gumenou zátkou
· jedno zariadenie BAXJECT II (bezihlové rekonštitučné zariadenie)
Držiteľ rozhodnutia o registrácii
Baxter Innovations GmbH Industriestrasse 67
A-1221 Viedeň
VýrobcaBaxter SA
Boulevard René Branquart 80
B-7860 Lessines
Belgicko
Písomná informácia pre používateľaRIXUBIS 1000 IU prášok a rozpúšťadlo na injekčný roztokNonakog gama (rekombinantný ľudský koagulačný faktor IX)

Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že nahlásite akékoľvek vedľajšie účinky, ak sa u vás vyskytnú. Informácie o tom ako hlásiť vedľajšie účinky, nájdete na konci časti 4.
Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento liek, pretože obsahuje pre vás dôležité informácie.- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
- Tento liek bol predpísaný vám. Nedávajte ho nikomu inému. Môže mu uškodiť dokonca aj vtedy, ak má rovnaké príznaky ochorenia ako vy.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika.
To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Pozri časť 4.
V tejto písomnej informácii pre používateľa sa dozviete:1. Čo je RIXUBIS a na čo sa používa
2. Čo potrebujete vedieť predtým, ako použijete RIXUBIS
3. Ako používať RIXUBIS
4. Možné vedľajšie účinky
5. Ako uchovávať RIXUBIS
6. Obsah balenia a ďalšie informácie
1. Čo je RIXUBIS a na čo sa používaRIXUBIS obsahuje aktívnu substanciu nonakog gama a je výrobkom s koagulačným faktorom IX. Faktor IX je bežnou zložkou ľudskej krvi. Je nevyhnutný pre účinné zrážanie krvi. RIXUBIS sa používa u pacientov s hemofíliou B (Christmasovou chorobou, dedičnou chorobou krvácania spôsobenou nedostatkom faktora IX). Účinkuje tak, že nahrádza chýbajúci faktor IX, čím aktivuje zrážanie krvi pacienta.
RIXUBIS sa používa na liečbu a prevenciu krvácania u pacientov s hemofíliou B vo všetkých vekových skupinách.
2. Čo potrebujete vedieť predtým, ako použijete RIXUBIS RIXUBIS neužívajte- ak ste alergický na nonakog gama alebo ďalšie súčasti tohto lieku (uvedené v časti 6)
- ak ste alergický na škrečie bielkoviny.
Upozornenia a opatreniaU lieku RIXUBIS je možná precitlivenosť alergického typu. Zastavte infúziu a okamžite kontaktujte svojho lekára alebo vyhľadajte lekársku pomoc, ak pocítite príznaky precitlivenosti/alergické reakcie,
ako je žihľavka, vyrážka, tlak na hrudi, sipot, nízky krvný tlak alebo anafylaxia (závažná alergická
reakcia, ktorá môže spôsobiť ťažkosti pri prehĺtaní a/alebo dýchaní, sčervenanie alebo opuch tváre a/alebo rúk) Pri týchto reakciách je nutné bezodkladné lekárske ošetrenie. Váš lekár tiež môže
vykonať krvný test na kontrolu, či ste si nevytvorili protilátky neutralizujúce aktivitu (inhibítory) proti svojmu lieku, keďže inhibítory sa môžu vyvíjať spolu s alergiami. Pacienti s inhibítormi faktora IX môžu mať zvýšené riziko anafylaxie počas budúcej liečby s faktorom IX.
Okamžite kontaktujte svojho lekára, pokiaľ sa vám krvácanie nezastavilo podľa očakávaní alebo na obmedzenie krvácania potrebujete výrazne zvýšené dávky lieku RIXUBIS. Váš lekár vykoná krvný test na kontrolu, či ste si nevytvorili protilátky neutralizujúce aktivitu (inhibítory) voči lieku RIXUBIS. Riziko vytvorenia inhibítorov je najvyššie u pacientov, ktorí ešte neboli liečení liekom na substitúciu faktora IX alebo v prvotnej fáze liečby, tzn. u malých detí.
Produkciu faktora IX v tele riadi gén faktora IX. U pacientov so špecifickou mutáciou génu faktora IX (napr. jeho výrazným nedostatkom) je vyššia pravdepodobnosť vytvorenia inhibítorov faktora IX a alergickej reakcie počas prvotnej fáze s akýmkoľvek koncentrátom faktora IX. Ak sa u vás teda takáto mutácia vyskytuje, váš lekár vás bude dôkladnejšie monitorovať na známky alergickej reakcie.
Ak trpíte ochorením pečene alebo ochorením srdca alebo ste nedávno prekonali závažnú operáciu, informujte, prosím, svojho lekára, pretože je zvýšené riziko komplikácii so zrážaním krvi (koaguláciou).
Poruchy obličiek (nefrotický syndróm) boli hlásené pri pokusoch o navodenie imunitnej tolerancie u pacientov s hemofíliou B s inhibítormi faktora IX a so sklonom k alergickým reakciám po vysokých dávkach faktora IX.
Pri každom podaní dávky RIXUBIS sa odporúča, aby sa vždy zaznamenal názov a číslo šarže lieku a aby sa viedli záznamy o použitých šaržách (napr. do denníku).
Iné lieky a RIXUBIS
Ak užívate alebo ste v poslednom čase užívali ešte iné lieky, prosím, oznámte to svojmu lekárovi alebo lekárnikovi. Interakcie lieku RIXUBIS s inými liečivami nie sú známe.
Tehotenstvo, dojčenie a plodnosť
Ak ste tehotná alebo dojčíte, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom alebo lekárnikom predtým, ako začnete užívať tento liek. Hemofília B sa u žien
vyskytuje len zriedka.
Vedenie vozidla a obsluha strojov
Liek RIXUBIS nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
RIXUBIS obsahuje sodík
Tento liek obsahuje 19 mg sodíka na liekovku. Musí sa to vziať do úvahy u pacientov na diéte s kontrolovaným príjmom sodíka.
3. Ako používať RIXUBIS
Liečba liekom RIXUBIS bude začatá lekárom, ktorý má skúsenosti so starostlivosťou o pacientov s hemofíliou B.
Vždy užívajte tento liek presne tak, ako vám povedal váš lekár. Ak si nie ste niečím istí, poraďte sa so svojím lekárom.
Váš lekár rozhodne, akú dávku lieku RIXUBIS dostanete. Dávkovanie a dĺžka závisia od závažnosti nedostatku faktora IX, od miesta a rozsahu krvácania a od klinického stavu pacienta, veku a od toho, ako rýchlo vaše telo spracováva faktor IX. Tieto údaje bude nutné pravidelne kontrolovať.
Po rekonštitúcii prášku s priloženým rozpúšťadlom vám liek RIXUBIS intravenózne podá váš lekár alebo sestra. Liek RIXUBIS vám môže injekciou podať aj niekto ďalší alebo vy sami, ale len ak ste na to odborne vyškolení.
 Rekonštitúcia a podávanie
Rekonštitúcia a podávanie
- Na rekonštitúciu používať iba priložené rozpúšťadlo a rekonštitučné zariadenie (BAXJECT II).
- Na podávanie je nutné použiť striekačku s konektorom typu luer-lock.
- Nepoužívajte, ak je zariadenie BAXJECT II, jeho systém sterilnej bariéry alebo balenie poškodené alebo vykazuje akékoľvek známky poškodenia.
RekonštitúciaPoužite aseptickú techniku
1. Pokiaľ je produkt stále uchovávaný v chladničke, vezmite z nej prášok RIXUBIS i rozpustné liekovky a nechajte ich zohriať sa na izbovú teplotu (medzi 15 °C a 25 °C).
2. Dôkladne si umyte ruky pomocou mydla a teplej vody.
3. Odstráňte uzávery z liekoviek prášku a rozpúšťadla.
4. Očistite zátky alkoholovými tampónmi. Položte liekovky na čistý rovný povrch.
5. Otvorte balenie zariadenia BAXJECT II. Odlúpnite papierové viečko bez toho, aby ste sa dotkli vnútrajška (obr. a). Nevyberajte zariadenie z balenia.
6. Obráťte balenie a priehľadným plastovým tŕňom prepichnite zátku rozpúšťadla. Uchopte balenie za jeho okraj a pretiahnite ho cez BAXJECT II (obr. b). Neodstraňujte modrý kryt zo zariadenia BAXJECT II.
7. Zariadenie BAXJECT II je teraz pripojené k liekovke rozpúšťadla. Otočte celý systém tak, aby bola liekovka navrchu zariadenia. Bielym plastovým tŕňom prepichnite zátku RIXUBIS. Vákuum vtiahne rozpúšťadlo do liekovky RIXUBIS (obr. c).
8. Jemne otáčajte, kým sa všetok materiál nerozpustí. Produkt sa rozpúšťa rýchlo (do 2 minút).
Uistite sa, že liek RIXUBIS sa úplne rozpustil, inak neprejde všetok rekonštituovaný roztok cez filter zariadenia. Rekonštituované lieky sa majú pred podaním vizuálne skontrolovať, či sa
v ňom nenachádzajú častice a či nezmenil farbu. Roztok má byť číry alebo mierne opalizujúci. Nepoužívajte roztoky, ktoré sú zakalené alebo sú v nich usadeniny.
Obr. a Obr. b Obr. cPo rekonštitúcii znovu nezmrazujte a nevracajte do chladničky.
Použite ihneď.
PodávaniePoužite aseptickú techniku
1. Odstráňte modrý kryt zo zariadenia BAXJECT II.
Nenaťahujte vzduch do injekčnej striekačky. Pripojte striekačku k zariadeniu BAXJECT II (obr. d).
2. Obráťte systém (liekovka s rekonštituovaným roztokom musí byť navrchu). Pomaly späť
vtiahnite piest a tak vtiahnite rekonštituovaný roztok do striekačky (obr. e).
3. Odpojte striekačku.
4. Pripojte na striekačku motýľovú ihlu. Injekciu podajte intravenózne. Roztok má byť podávaný pomaly na úrovni, ktorá je pacienta pohodlná, maximálne 10 ml za minútu.
 Obr. d Obr. e
Obr. d Obr. ePri každom podaní dávky RIXUBIS sa odporúča, aby sa vždy zaznamenal názov a číslo šarže lieku a
aby sa viedli záznamy o použitých šaržách (napr. do denníku).
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Ak použijete viac RIXUBIS, ako máteVždy používajte liek RIXUBIS presne tak, ako vám povedal váš lekár. Ak si nie ste niečím istí, poraďte sa so svojím lekárom. Ak ste si podali viac lieku RIXUBIS, ako sa odporúča, v čo najkratšom čase kontaktujte svojho lekára.
Ak zabudnete použiť RIXUBISNepodávajte si infúziou dvojnásobnú dávku, aby ste nahradili vynechanú dávku. Ďalšiu injekciu si podajte podľa harmonogramu a ďalej sa riaďte pokynmi svojho lekára.
Ak prestanete používať RIXUBISLiek RIXUBIS nevysadzujte bez toho, aby ste sa poradili so svojim lekárom.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára alebo lekárnika.
4. Možné vedľajšie účinkyTak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. U lieku RIXUBIS je možná precitlivenosť alergického typu. Tieto reakcie môžu zahŕňať pocity
pálenia a bodanie v mieste infúzie, zimnicu, sčervenanie, letargiu, nepokoj, pichanie, žihľavku,
svrbenie a vyrážky, nízky krvný tlak, rýchly tep srdca, zvieravý pocit na hrudi, dýchavičnosť, opuch hrdla, anafylaxiu (ťažká alergická reakcia), bolesti hlavy, nevoľnosť a zvracanie. Okamžite, prosím, informujte svojho lekára, ak sa u vás prejaví akýkoľvek z týchto vedľajších účinkov. Pri týchto reakciách je nutné bezodkladné lekárske ošetrenie (pozri časť 2 Upozornenia a opatrenia).
Nasledovné vedľajšie účinky boli pozorované pri liečbe liekom RIXUBIS:
Časté vedľajšie účinky (vyskytujú sa u menej ako 1 z 10 ľudí)
- poruchy chuti
- bolesť v končatinách.
Vedľajšie účinky s neznámou frekvenciou (frekvenciu nemožno odhadnúť z dostupných údajov)
- alergické reakcie (precitlivenosť).
Pri tomto produkte neboli pozorované problémy s nadmernou zrážanlivosťou krvi (tromboembolické príhody), tie sa však môžu vyskytnúť pri všetkých výrobkoch s faktorom IX. Môže ísť o srdcový infarkt, krvné zrazeniny v žilách alebo krvné zrazeniny v pľúcach.
Hlásenie vedľajších účinkov
Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Vedľajšie účinky môžete hlásiť aj priamo prostredníctvom národného systému hlásenia uvedeného v Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o
bezpečnosti tohto lieku.
5. Ako uchovávať liek RIXUBISUchovávajte tento liek mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na štítku a vonkajšom obale po skratke
EXP. Dátum exspirácie sa vzťahuje na posledný deň v mesiaci.
Uchovávajte v chladničke (2 °C - 8 °C). Neuchovávajte v mrazničke.
Pred otvorením môže byť produkt vybratý z chladničky na obdobie maximálne 6 mesiacov a pri teplote neprekračujúcej 30 ºC. Nový dátum trvanlivosti má byť napísaný na vonkajšom obale. Tento nový dátum trvanlivosti nesmie prekračovať pôvodný dátum uvedený na vonkajšom obale. Na konci tohto obdobia sa prípravok nesmie znovu uložiť do chladničky, ale má sa použiť alebo znehodnotiť.
Rekonštituovaný roztok použite okamžite.
Nepoužívajte liek RIXUBIS, ak roztok nie je číry a bezfarebný.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo RIXUBIS obsahuje- Liečivo je nonakog gama (rekombinantný ľudský koagulačný faktor IX), 1000 IU, čo zodpovedá koncentrácii 200 IU/ml po rekonštitúcii s 5 ml rozpúšťadla.
- Ďalšie zložky prášku sú sacharóza, manitol, chlorid sodný, chlorid vápenatý, L-histidín, polysorbát 80.
Liekovka pre rozpúšťadlo: 5 ml sterilizovanej vody na injekciu.
Ako RIXUBIS vyzerá a obsah baleniaRIXUBIS je prášok a rozpúšťadlo na injekčný roztok
Balenie obsahuje:
· jednu liekovku prášku RIXUBIS 1000 IU v sklenej liekovke s gumenou zátkou
· jednu liekovku 5 ml sterilizovanej vody na injekciu v sklenej liekovke s gumenou zátkou
· jedno zariadenie BAXJECT II (bezihlové rekonštitučné zariadenie)
Držiteľ rozhodnutia o registrácii
Baxter Innovations GmbH Industriestrasse 67
A-1221 Viedeň
Výrobca
Baxter SA
Boulevard René Branquart 80
B-7860 Lessines
Belgicko
--------------------------------------------------------------------------------------------------------------------------- Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
Dávkovanie
Dávkovanie a dĺžka substitučnej terapie závisia od závažnosti nedostatku faktora IX, od miesta a
rozsahu krvácania a od klinického stavu pacienta, veku a farmakokinetických parametrov faktora IX, ako je prírastková obnova a polčas života.
Odporúča sa, aby sa podávaná dávka a frekvencia opakovaných infúzií počas liečby určovala podľa stanovených hladín faktora IX. Reakcia jednotlivých pacientov na faktor IX môže byť rôzna, čím sa demonštrujú rôzne polčasy života a obnovy. U pacientov s podváhou alebo nadváhou môže dávka založená na telesnej hmotnosti vyžadovať úpravu. Najmä v prípade veľkých chirurgických zásahov je nevyhnutné presné monitorovanie substitučnej liečby pomocou koagulačnej analýzy (plazmovej aktivity faktora IX).
Aby sa zabezpečilo dosiahnutie požadovanej hladiny plazmovej aktivity faktora IX, odporúča sa starostlivé monitorovanie s použitím príslušného testu aktivity faktora IX a ak je to potrebné, mali by byť vykonané príslušné úpravy dávky a frekvencie opakovaných infúzií. Pri použití jednostupňového testu zrážanlivosti založeného na tromboplastínovom čase (aPTT) in vitro na stanovenie aktivity faktora IX z krvných vzoriek pacientov môžu byť výsledky testovania plazmovej aktivity faktora IX významne ovplyvnené druhom činidla aPTT a referenčného štandardu použitého v teste. Táto skutočnosť je dôležitá najmä vtedy, ak sa zmení laboratórium, ktoré test vykonáva, alebo sa zmenia činidlá použité v teste.
Počet dávok podávaného faktora IX sa vyjadruje v medzinárodných jednotkách (IU), ktoré zodpovedajú štandardom WHO pre produkty s faktorom IX. Plazmatická aktivita faktora IX sa vyjadruje v percentách (v pomere k normálnej ľudskej plazme) alebo v IU (v pomere k medzinárodným štandardom pre faktor IX v plazme).
Jedna (IU aktivity faktora IX zodpovedá množstvu faktora IX v jednom mililitri normálnej ľudskej plazmy.
Liečba na vyžiadanie
Výpočet požadovanej dávky faktora IX je založený na empirickom zistení, že 1 medzinárodná jednotka (IU) faktora IX na kg telesnej hmotnosti zvyšuje aktivitu plazmatického faktora IX
o 0,9 IU/dl (v rozmedzí 0,5 až 1,4 IU/dl) alebo 0,9 % bežnej aktivity u pacientov od 12 rokov a starších (ďalšie informácie pozri časť 5.2).
Požadovaná dávka sa určuje podľa tohto vzorca: Pacienti 12-roční a starší
Požadované
jednotky
= telesná hmotnosť (kg) x želaný nárast faktora IX
(%) alebo (IU/dl)
x prevrátená hodnota
pozorovanej obnovy
(dl/kg)
Pre prírastkovú obnovu 0,9 IU/dl na IU/kg sa dávka vypočítava takto:
Požadované
jednotky
= telesná hmotnosť (kg) x želaný nárast faktora IX
(%) alebo (IU/dl)
x 1,1 dl/kg
Množstvo lieku, ktoré sa má použiť, a frekvencia použitia sa majú vždy riadiť podľa základnej
klinickej účinnosti u každého pacienta.
V prípade týchto hemoragických príhod by aktivita faktora IX nemala v danom období klesnúť pod určenú hladinu plazmatickej aktivity (v % normálu alebo IU/dl). Túto tabuľku možno použiť ako ukazovateľ v prípade krvácania alebo operácie:
Stupeň hemorágie/typ chirurgického zákroku
| Požadovaná úroveň faktora
IX (%) alebo (IU/dl)
| Frekvencia dávok (v hodinách)/ Trvanie terapie (v dňoch)
|
Hemorágia
Začínajúca hemartróza, krvácanie do svalov alebo ústnej dutiny
Intenzívnejšia hemartróza, krvácanie do svalov alebo hematóm
Hemorágia ohrozujúca život.
|
20 – 40
30 – 60
60 – 100
|
Opakujte každých 24 hodín.
Aspoň 1 deň, kým sa krvácanie spojené s bolesťou nezastaví alebo sa nedosiahne vyliečenie.
Opakujte infúziu každých 24 hodín počas 3 – 4 dní alebo viac, dokiaľ bolesť a akútne postihnutie neustúpi.
Opakujte infúziu každých 8 až 24 hodín, kým hrozba neustúpi.
|
Operácia
Operácia menšieho rozsahu vrátane trhania zubov
|
30 – 60
|
Každých 24 hodín počas aspoň 1 dňa, kým sa nedosiahne vyliečenie.
|
Operácia veľkého rozsahu
|
80 – 100
(predoperačné a pooperačné)
|
Opakujte infúziu každých 8 až 24 hodín až do primeraného vyliečenia rany, nasleduje terapia počas ďalších
aspoň 7 dní na udržanie aktivity faktora
IX 30 % až 60 % (IU/dl).
|
Dôkladné monitorovanie substitučnej liečby je mimoriadne dôležité najmä pri operáciách veľkého
rozsahu a hemorágiách ohrozujúcich život.
ProfylaxiaNa dlhodobú profylaxiu krvácania u pacientov s ťažkou hemofíliou B sú obvyklé dávky 40 až 60 IU
faktora IX na kilogram telesnej hmotnosti v intervale 3 až 4 dni u pacientov od 12 rokov. V niektorých prípadoch môžu byť v závislosti od pacientovej farmakokinetiky, veku, fenotypu krvácania a fyzickej aktivity potrebné kratšie intervaly dávkovania alebo vyššie dávky.
Nepretržitá infúziaLiek RIXUBIS nepodávajte nepretržitou infúziou.
Pediatrická populáciaLiečba na vyžiadanie:
Výpočet požadovanej dávky faktora IX je založený na empirickom zistení, že 1 medzinárodná jednotka (IU) faktora IX na kg telesnej hmotnosti zvyšuje aktivitu plazmatického faktora IX činnosť
o 0,7 IU/dl (v rozmedzí 0,31 až 1,0 IU/dl) alebo 0,7 % bežnej aktivity u pacientov mladších 12 rokov
(ďalšie informácie pozri časť 5.2).
Požadované dávkovanie sa určuje podľa tohto vzorca: Pacienti mladší ako 12 rokov:
Požadované
jednotky
= telesná hmotnosť (kg) x želaný nárast faktora IX
(%) alebo (IU/dl)
x prevrátená hodnota
pozorovanej obnovy
(dl/kg)
Pre prírastkovú obnovu 0,7 IU/dl na IU/kg sa dávka vypočítava takto:
Požadované
jednotky
= telesná hmotnosť (kg) x želaný nárast faktora IX
(%) alebo (IU/dl)
x 1,4 dl/kg
Rovnakú tabuľku ako u dospelých možno použiť ako ukazovateľ v prípade krvácania alebo operácie
(pozri vyššie).
Profylaxia:
Odporúčaná dávka pre pediatrických pacientov mladších ako 12 rokov je 40 až 80 IU/kg v
intervaloch 3 až 4 dni. V niektorých prípadoch môžu byť v závislosti od pacientovej farmakokinetiky, veku, fenotypu krvácania a fyzickej aktivity potrebné kratšie intervaly dávkovania alebo vyššie dávky.
Písomná informácia pre používateľa
RIXUBIS 2000 IU prášok a rozpúšťadlo na injekčný roztok
Nonakog gama (rekombinantný ľudský koagulačný faktor IX)

Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že nahlásite akékoľvek vedľajšie účinky, ak sa u vás vyskytnú. Informácie o tom ako hlásiť vedľajšie účinky, nájdete na konci časti 4.
Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento liek, pretože obsahuje pre vás dôležité informácie.- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
- Tento liek bol predpísaný vám. Nedávajte ho nikomu inému. Môže mu uškodiť dokonca aj vtedy, ak má rovnaké príznaky ochorenia ako vy.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika.
To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Pozri časť 4.
V tejto písomnej informácii pre používateľa sa dozviete:1. Čo je RIXUBIS a na čo sa používa
2. Čo potrebujete vedieť predtým, ako použijete RIXUBIS
3. Ako používať RIXUBIS
4. Možné vedľajšie účinky
5. Ako uchovávať RIXUBIS
6. Obsah balenia a ďalšie informácie
1. Čo je RIXUBIS a na čo sa používaRIXUBIS obsahuje aktívnu substanciu nonakog gama a je výrobkom s koagulačným faktorom IX. Faktor IX je bežnou zložkou ľudskej krvi. Je nevyhnutný pre účinné zrážanie krvi. RIXUBIS sa používa u pacientov s hemofíliou B (Christmasovou chorobou, dedičnou chorobou krvácania spôsobenou nedostatkom faktora IX). Účinkuje tak, že nahrádza chýbajúci faktor IX, čím aktivuje zrážanie krvi pacienta.
RIXUBIS sa používa na liečbu a prevenciu krvácania u pacientov s hemofíliou B vo všetkých vekových skupinách.
2. Čo potrebujete vedieť predtým, ako použijete RIXUBIS RIXUBIS neužívajte- ak ste alergický na nonakog gama alebo ďalšie súčasti tohto lieku (uvedené v časti 6)
- ak ste alergický na škrečie bielkoviny.
Upozornenia a opatreniaU lieku RIXUBIS je možná precitlivenosť alergického typu. Zastavte infúziu a okamžite kontaktujte svojho lekára alebo vyhľadajte lekársku pomoc, ak pocítite príznaky precitlivenosti/alergické reakcie,
ako je žihľavka, vyrážka, tlak na hrudi, sipot, nízky krvný tlak alebo anafylaxia (závažná alergická
reakcia, ktorá môže spôsobiť ťažkosti pri prehĺtaní a/alebo dýchaní, sčervenanie alebo opuch tváre a/alebo rúk) Pri týchto reakciách je nutné bezodkladné lekárske ošetrenie. Váš lekár tiež môže
vykonať krvný test na kontrolu, či ste si nevytvorili protilátky neutralizujúce aktivitu (inhibítory) proti svojmu lieku, keďže inhibítory sa môžu vyvíjať spolu s alergiami. Pacienti s inhibítormi faktora IX môžu mať zvýšené riziko anafylaxie počas budúcej liečby s faktorom IX.
Okamžite kontaktujte svojho lekára, pokiaľ sa vám krvácanie nezastavilo podľa očakávaní alebo na obmedzenie krvácania potrebujete výrazne zvýšené dávky lieku RIXUBIS. Váš lekár vykoná krvný test na kontrolu, či ste si nevytvorili protilátky neutralizujúce aktivitu (inhibítory) voči lieku RIXUBIS. Riziko vytvorenia inhibítorov je najvyššie u pacientov, ktorí ešte neboli liečení liekom na substitúciu faktora IX alebo v prvotnej fáze liečby, tzn. u malých detí.
Produkciu faktora IX v tele riadi gén faktora IX. U pacientov so špecifickou mutáciou génu faktora IX (napr. jeho výrazným nedostatkom) je vyššia pravdepodobnosť vytvorenia inhibítorov faktora IX a alergickej reakcie počas prvotnej fáze s akýmkoľvek koncentrátom faktora IX. Ak sa u vás teda takáto mutácia vyskytuje, váš lekár vás bude dôkladnejšie monitorovať na známky alergickej reakcie.
Ak trpíte ochorením pečene alebo ochorením srdca alebo ste nedávno prekonali závažnú operáciu, informujte, prosím, svojho lekára, pretože je zvýšené riziko komplikácii so zrážaním krvi (koaguláciou).
Poruchy obličiek (nefrotický syndróm) boli hlásené pri pokusoch o navodenie imunitnej tolerancie
u pacientov s hemofíliou B s inhibítormi faktora IX a so sklonom k alergickým reakciám po vysokých dávkach faktora IX.
Pri každom podaní dávky RIXUBIS sa odporúča, aby sa vždy zaznamenal názov a číslo šarže lieku a aby sa viedli záznamy o použitých šaržách (napr. do denníku).
Iné lieky a RIXUBIS
Ak užívate alebo ste v poslednom čase užívali ešte iné lieky, prosím, oznámte to svojmu lekárovi alebo lekárnikovi. Interakcie lieku RIXUBIS s inými liečivami nie sú známe.
Tehotenstvo, dojčenie a plodnosť
Ak ste tehotná alebo dojčíte, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom alebo lekárnikom predtým, ako začnete užívať tento liek. Hemofília B sa u žien
vyskytuje len zriedka.
Vedenie vozidla a obsluha strojov
Liek RIXUBIS nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
RIXUBIS obsahuje sodík
Tento liek obsahuje 19 mg sodíka na liekovku. Musí sa to vziať do úvahy u pacientov na diéte s kontrolovaným príjmom sodíka.
3. Ako používať RIXUBIS
Liečba liekom RIXUBIS bude začatá lekárom, ktorý má skúsenosti so starostlivosťou o pacientov s hemofíliou B.
Vždy užívajte tento liek presne tak, ako vám povedal váš lekár. Ak si nie ste niečím istí, poraďte sa so svojím lekárom.
Váš lekár rozhodne, akú dávku lieku RIXUBIS dostanete. Dávkovanie a dĺžka závisia od závažnosti nedostatku faktora IX, od miesta a rozsahu krvácania a od klinického stavu pacienta, veku a od toho, ako rýchlo vaše telo spracováva faktor IX. Tieto údaje bude nutné pravidelne kontrolovať.
Po rekonštitúcii prášku s priloženým rozpúšťadlom vám liek RIXUBIS intravenózne podá váš lekár alebo sestra. Liek RIXUBIS vám môže injekciou podať aj niekto ďalší alebo vy sami, ale len ak ste na to odborne vyškolení.
 Rekonštitúcia a podávanie
Rekonštitúcia a podávanie
- Na rekonštitúciu používať iba priložené rozpúšťadlo a rekonštitučné zariadenie (BAXJECT II).
- Na podávanie je nutné použiť striekačku s konektorom typu luer-lock.
- Nepoužívajte, ak je zariadenie BAXJECT II, jeho systém sterilnej bariéry alebo balenie poškodené alebo vykazuje akékoľvek známky poškodenia.
RekonštitúciaPoužite aseptickú techniku
1. Pokiaľ je produkt stále uchovávaný v chladničke, vezmite z nej prášok RIXUBIS i rozpustné liekovky a nechajte ich zohriať sa na izbovú teplotu (medzi 15 °C a 25 °C).
2. Dôkladne si umyte ruky pomocou mydla a teplej vody.
3. Odstráňte uzávery z liekoviek prášku a rozpúšťadla.
4. Očistite zátky alkoholovými tampónmi. Položte liekovky na čistý rovný povrch.
5. Otvorte balenie zariadenia BAXJECT II. Odlúpnite papierové viečko bez toho, aby ste sa dotkli vnútrajška (obr. a). Nevyberajte zariadenie z balenia.
6. Obráťte balenie a priehľadným plastovým tŕňom prepichnite zátku rozpúšťadla. Uchopte balenie za jeho okraj a pretiahnite ho cez BAXJECT II (obr. b). Neodstraňujte modrý kryt zo zariadenia BAXJECT II.
7. Zariadenie BAXJECT II je teraz pripojené k liekovke rozpúšťadla. Otočte celý systém tak, aby bola liekovka navrchu zariadenia. Bielym plastovým tŕňom prepichnite zátku RIXUBIS. Vákuum vtiahne rozpúšťadlo do liekovky RIXUBIS (obr. c).
8. Jemne otáčajte, kým sa všetok materiál nerozpustí. Produkt sa rozpúšťa rýchlo (do 2 minút).
Uistite sa, že liek RIXUBIS sa úplne rozpustil, inak neprejde všetok rekonštituovaný roztok cez filter zariadenia. Rekonštituované lieky sa majú pred podaním vizuálne skontrolovať, či sa
v ňom nenachádzajú častice a či nezmenil farbu. Roztok má byť číry alebo mierne opalizujúci. Nepoužívajte roztoky, ktoré sú zakalené alebo sú v nich usadeniny.
Obr. a Obr. b Obr. cPo rekonštitúcii znovu nezmrazujte a nevracajte do chladničky.
Použite ihneď.
PodávaniePoužite aseptickú techniku
1. Odstráňte modrý kryt zo zariadenia BAXJECT II.
Nenaťahujte vzduch do injekčnej striekačky. Pripojte striekačku k zariadeniu BAXJECT II (obr. d).
2. Obráťte systém (liekovka s rekonštituovaným roztokom musí byť navrchu). Pomaly späť
vtiahnite piest a tak vtiahnite rekonštituovaný roztok do striekačky (obr. e).
3. Odpojte striekačku.
4. Pripojte na striekačku motýľovú ihlu. Injekciu podajte intravenózne. Roztok má byť podávaný pomaly na úrovni, ktorá je pacienta pohodlná, maximálne 10 ml za minútu.
 Obr. d Obr. e
Obr. d Obr. ePri každom podaní dávky RIXUBIS sa odporúča, aby sa vždy zaznamenal názov a číslo šarže lieku'
a aby sa viedli záznamy o použitých šaržách (napr. do denníku).
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Ak použijete viac RIXUBIS, ako máteVždy používajte liek RIXUBIS presne tak, ako vám povedal váš lekár. Ak si nie ste niečím istí, poraďte sa so svojím lekárom. Ak ste si podali viac lieku RIXUBIS, ako sa odporúča, v čo najkratšom čase kontaktujte svojho lekára.
Ak zabudnete použiť RIXUBISNepodávajte si infúziou dvojnásobnú dávku, aby ste nahradili vynechanú dávku. Ďalšiu injekciu si podajte podľa harmonogramu a ďalej sa riaďte pokynmi svojho lekára.
Ak prestanete používať RIXUBISLiek RIXUBIS nevysadzujte bez toho, aby ste sa poradili so svojim lekárom.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára alebo lekárnika.
4. Možné vedľajšie účinkyTak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. U lieku RIXUBIS je možná precitlivenosť alergického typu. Tieto reakcie môžu zahŕňať pocity
pálenia a bodanie v mieste infúzie, zimnicu, sčervenanie, letargiu, nepokoj, pichanie, žihľavku,
svrbenie a vyrážky, nízky krvný tlak, rýchly tep srdca, zvieravý pocit na hrudi, dýchavičnosť, opuch hrdla, anafylaxiu (ťažká alergická reakcia), bolesti hlavy, nevoľnosť a zvracanie. Okamžite, prosím, informujte svojho lekára, ak sa u vás prejaví akýkoľvek z týchto vedľajších účinkov. Pri týchto reakciách je nutné bezodkladné lekárske ošetrenie (pozri časť 2 Upozornenia a opatrenia).
Nasledovné vedľajšie účinky boli pozorované pri liečbe liekom RIXUBIS:
Časté vedľajšie účinky (vyskytujú sa u menej ako 1 z 10 ľudí)
- poruchy chuti
- bolesť v končatinách.
Vedľajšie účinky s neznámou frekvenciou (frekvenciu nemožno odhadnúť z dostupných údajov)
- alergické reakcie (precitlivenosť).
Pri tomto produkte neboli pozorované problémy s nadmernou zrážanlivosťou krvi (tromboembolické príhody), tie sa však môžu vyskytnúť pri všetkých výrobkoch s faktorom IX. Môže ísť o srdcový infarkt, krvné zrazeniny v žilách alebo krvné zrazeniny v pľúcach.
Hlásenie vedľajších účinkov
Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Vedľajšie účinky môžete hlásiť aj priamo prostredníctvom národného systému hlásenia uvedeného v Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií
o bezpečnosti tohto lieku.
5. Ako uchovávať liek RIXUBISUchovávajte tento liek mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na štítku a vonkajšom obale po skratke
EXP. Dátum exspirácie sa vzťahuje na posledný deň v mesiaci.
Uchovávajte v chladničke (2 °C - 8 °C). Neuchovávajte v mrazničke.
Pred otvorením môže byť produkt vybratý z chladničky na obdobie maximálne 6 mesiacov a pri teplote neprekračujúcej 30 ºC. Nový dátum trvanlivosti má byť napísaný na vonkajšom obale. Tento nový dátum trvanlivosti nesmie prekračovať pôvodný dátum uvedený na vonkajšom obale. Na konci tohto obdobia sa prípravok nesmie znovu uložiť do chladničky, ale má sa použiť alebo znehodnotiť.
Rekonštituovaný roztok použite okamžite.
Nepoužívajte liek RIXUBIS, ak roztok nie je číry a bezfarebný.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo RIXUBIS obsahuje- Liečivo je nonakog gama (rekombinantný ľudský koagulačný faktor IX), 2000 IU, čo zodpovedá koncentrácii 400 IU/ml po rekonštitúcii s 5 ml rozpúšťadla.
- Ďalšie zložky prášku sú sacharóza, manitol, chlorid sodný, chlorid vápenatý, L-histidín, polysorbát 80.
Liekovka pre rozpúšťadlo: 5 ml sterilizovanej vody na injekciu.
Ako RIXUBIS vyzerá a obsah baleniaRIXUBIS je prášok a rozpúšťadlo na injekčný roztok
Balenie obsahuje:
· jednu liekovku prášku RIXUBIS 2000 IU v sklenej liekovke s gumenou zátkou
· jednu liekovku 5 ml sterilizovanej vody na injekciu v sklenej liekovke s gumenou zátkou
· jedno zariadenie BAXJECT II (bezihlové rekonštitučné zariadenie)
Držiteľ rozhodnutia o registrácii
Baxter Innovations GmbH Industriestrasse 67
A-1221 Viedeň
Výrobca
Baxter SA
Boulevard René Branquart 80
B-7860 Lessines
Belgicko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte, prosím, miestneho zástupcu držiteľa rozhodnutia o registrácii:
België/Belgique/Belgien
Baxalta Belgium SPRL Tél/Tel: +32 2 386 80 00
Lietuva
UAB ″Baxter Lithuania″
Tel: +370 5 269 16 90/+370 5 252 71 00
България
Бакстер България ЕООД
тел.: +359 2 9808482
Luxembourg/Luxemburg
Baxalta Belgium SPRL Tél/Tel: +32 2 386 80 00
Česká republika
Baxter Czech spol.s.r.o. Tel.: +420 225774111
Magyarország
Baxter Hungary Kft. Tel.: +361 202 19 80
Danmark
Baxalta Denmark A/S Tlf: +45 48 16 64 00
Malta
Baxalta UK Limited
Tel.: +44 1635 206345
Deutschland
Baxalta Deutschland GmbH Tel: +49 89 31 701-0
Nederland
Baxalta Netherlands B.V. Tel: +31 30 2488911
Eesti
OÜ Baxter Estonia
Tel.: +372 6 515 120
Norge
SHELFCO - Baxalta Norway AS Tlf: +47 22 58 4800
Ελλάδα
Baxter (Hellas) Ε.Π.Ε.
Τηλ.: +30 210 28 80 000
Österreich
Baxalta Österreich GmbH Tel.: +43 1 71120 0
España
Baxalta Spain S.L. Tel: +34 96 2722800
Polska
Baxter Polska Sp. z o.o. Tel.: +48 22 4883 777
France
Baxalta France SAS Tél: +33 1 3461 5050
Portugal
Baxalta Portugal, Unipessoal, Lda. Tel: +351 21 925 25 00
Hrvatska
Baxter d.o.o.
Tel: +386 1 420 16 80
România
FARMACEUTICA REMEDIA SA Tel.: +40 21 321 16 40
Ireland
Baxalta UK Limited
Tel: +353 1 2065500
Slovenija
Baxter d.o.o.
Tel.: +386 1 420 16 80
Ísland
Lyfjaver ehf.
Sími: +354 533 6100
Slovenská republika
Baxter Slovakia s.r.o. Tel: +421 2 59418455
Italia
Baxalta Italy S.r.l. Tel: +39 06 324911
Suomi/Finland
SHELFCO - Baxalta Finland Oy
Puh/Tel: +358 9 8621111
Κύπρος
Baxter (Hellas) Ε.Π.Ε.
Τηλ.: +30 210 28 80 000
Sverige
Baxalta Sweden AB Tel: +46 8 6326400
Latvija
SIA BAXTER Latvia
Tel.: +371 67 784 784
United Kingdom
Baxalta UK Limited
Tel: +44 1635 206345
Táto písomná informácia pre používateľa bola naposledy aktualizovaná v mesiac/RRRR.
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu.
--------------------------------------------------------------------------------------------------------------------------- Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
DávkovanieDávkovanie a dĺžka substitučnej terapie závisia od závažnosti nedostatku faktora IX, od miesta a
rozsahu krvácania a od klinického stavu pacienta, veku a farmakokinetických parametrov faktora IX, ako je prírastková obnova a polčas života.
Odporúča sa, aby sa podávaná dávka a frekvencia opakovaných infúzií počas liečby určovala podľa stanovených hladín faktora IX. Reakcia jednotlivých pacientov na faktor IX môže byť rôzna, čím sa demonštrujú rôzne polčasy života a obnovy. U pacientov s podváhou alebo nadváhou môže dávka založená na telesnej hmotnosti vyžadovať úpravu. Najmä v prípade veľkých chirurgických zásahov je nevyhnutné presné monitorovanie substitučnej liečby pomocou koagulačnej analýzy (plazmovej aktivity faktora IX).
Aby sa zabezpečilo dosiahnutie požadovanej hladiny plazmovej aktivity faktora IX, odporúča sa starostlivé monitorovanie s použitím príslušného testu aktivity faktora IX a ak je to potrebné, mali by byť vykonané príslušné úpravy dávky a frekvencie opakovaných infúzií. Pri použití jednostupňového testu zrážanlivosti založeného na tromboplastínovom čase (aPTT) in vitro na stanovenie aktivity faktora IX z krvných vzoriek pacientov môžu byť výsledky testovania plazmovej aktivity faktora IX významne ovplyvnené druhom činidla aPTT a referenčného štandardu použitého v teste. Táto skutočnosť je dôležitá najmä vtedy, ak sa zmení laboratórium, ktoré test vykonáva, alebo sa zmenia činidlá použité v teste.
Počet dávok podávaného faktora IX sa vyjadruje v medzinárodných jednotkách (IU), ktoré zodpovedajú štandardom WHO pre produkty s faktorom IX. Plazmatická aktivita faktora IX sa vyjadruje v percentách (v pomere k normálnej ľudskej plazme) alebo v IU (v pomere k medzinárodným štandardom pre faktor IX v plazme).
Jedna (IU aktivity faktora IX zodpovedá množstvu faktora IX v jednom mililitri normálnej ľudskej plazmy.
Liečba na vyžiadanie
Výpočet požadovanej dávky faktora IX je založený na empirickom zistení, že 1 medzinárodná jednotka (IU) faktora IX na kg telesnej hmotnosti zvyšuje aktivitu plazmatického faktora IX
o 0,9 IU/dl (v rozmedzí 0,5 až 1,4 IU/dl) alebo 0,9 % bežnej aktivity u pacientov od 12 rokov a starších (ďalšie informácie pozri časť 5.2).
Požadovaná dávka sa určuje podľa tohto vzorca: Pacienti 12-roční a starší
Požadované
jednotky
= telesná hmotnosť (kg) x želaný nárast faktora IX
(%) alebo (IU/dl)
x prevrátená hodnota
pozorovanej obnovy
(dl/kg)
Pre prírastkovú obnovu 0,9 IU/dl na IU/kg sa dávka vypočítava takto:
Požadované
jednotky
= telesná hmotnosť (kg) x želaný nárast faktora IX
(%) alebo (IU/dl)
x 1,1 dl/kg
Množstvo lieku, ktoré sa má použiť, a frekvencia použitia sa majú vždy riadiť podľa základnej
klinickej účinnosti u každého pacienta.
V prípade týchto hemoragických príhod by aktivita faktora IX nemala v danom období klesnúť pod určenú hladinu plazmatickej aktivity (v % normálu alebo IU/dl). Túto tabuľku možno použiť ako ukazovateľ v prípade krvácania alebo operácie:
Stupeň hemorágie/typ chirurgického zákroku
| Požadovaná úroveň faktora
IX (%) alebo (IU/dl)
| Frekvencia dávok (v hodinách)/ Trvanie terapie (v dňoch)
|
Hemorágia
Začínajúca hemartróza, krvácanie do svalov alebo ústnej dutiny
Intenzívnejšia hemartróza, krvácanie do svalov alebo hematóm
Hemorágia ohrozujúca život.
|
20 – 40
30 – 60
60 – 100
|
Opakujte každých 24 hodín.
Aspoň 1 deň, kým sa krvácanie spojené s bolesťou nezastaví alebo sa nedosiahne vyliečenie.
Opakujte infúziu každých 24 hodín počas 3 – 4 dní alebo viac, dokiaľ bolesť a akútne postihnutie neustúpi.
Opakujte infúziu každých 8 až 24 hodín, kým hrozba neustúpi.
|
Operácia
Operácia menšieho rozsahu vrátane trhania zubov
|
30 – 60
|
Každých 24 hodín počas aspoň 1 dňa, kým sa nedosiahne vyliečenie.
|
Operácia veľkého rozsahu
|
80 – 100
(predoperačné a pooperačné)
|
Opakujte infúziu každých 8 až 24 hodín až do primeraného vyliečenia rany, nasleduje terapia počas ďalších
aspoň 7 dní na udržanie aktivity faktora
IX 30 % až 60 % (IU/dl).
|
Dôkladné monitorovanie substitučnej liečby je mimoriadne dôležité najmä pri operáciách veľkého
rozsahu a hemorágiách ohrozujúcich život.
Profylaxia
Na dlhodobú profylaxiu krvácania u pacientov s ťažkou hemofíliou B sú obvyklé dávky 40 až 60 IU
faktora IX na kilogram telesnej hmotnosti v intervale 3 až 4 dni u pacientov od 12 rokov. V niektorých prípadoch môžu byť v závislosti od pacientovej farmakokinetiky, veku, fenotypu krvácania a fyzickej aktivity potrebné kratšie intervaly dávkovania alebo vyššie dávky.
Nepretržitá infúzia
Liek RIXUBIS nepodávajte nepretržitou infúziou.
Pediatrická populácia
Liečba na vyžiadanie:
Výpočet požadovanej dávky faktora IX je založený na empirickom zistení, že 1 medzinárodná jednotka (IU) faktora IX na kg telesnej hmotnosti zvyšuje aktivitu plazmatického faktora IX činnosť
o 0,7 IU/dl (v rozmedzí 0,31 až 1,0 IU/dl) alebo 0,7 % bežnej aktivity u pacientov mladších 12 rokov
(ďalšie informácie pozri časť 5.2).
Požadované dávkovanie sa určuje podľa tohto vzorca: Pacienti mladší ako 12 rokov:
Požadované
jednotky
= telesná hmotnosť (kg) x želaný nárast faktora IX
(%) alebo (IU/dl)
x prevrátená hodnota
pozorovanej obnovy
(dl/kg)
Pre prírastkovú obnovu 0,7 IU/dl na IU/kg sa dávka vypočítava takto:
Požadované
jednotky
= telesná hmotnosť (kg) x želaný nárast faktora IX
(%) alebo (IU/dl)
x 1,4 dl/kg
Rovnakú tabuľku ako u dospelých možno použiť ako ukazovateľ v prípade krvácania alebo operácie
(pozri vyššie).
Profylaxia:
Odporúčaná dávka pre pediatrických pacientov mladších ako 12 rokov je 40 až 80 IU/kg v
intervaloch 3 až 4 dni. V niektorých prípadoch môžu byť v závislosti od pacientovej farmakokinetiky, veku, fenotypu krvácania a fyzickej aktivity potrebné kratšie intervaly dávkovania alebo vyššie dávky.
Písomná informácia pre používateľa
RIXUBIS 3000 IU prášok a rozpúšťadlo na injekčný roztok
Nonakog gama (rekombinantný ľudský koagulačný faktor IX)

Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že nahlásite akékoľvek vedľajšie účinky, ak sa u vás vyskytnú. Informácie o tom ako hlásiť vedľajšie účinky, nájdete na konci časti 4.
Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento liek, pretože obsahuje pre vás dôležité informácie.- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
- Tento liek bol predpísaný vám. Nedávajte ho nikomu inému. Môže mu uškodiť dokonca aj vtedy, ak má rovnaké príznaky ochorenia ako vy.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika.
To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Pozri časť 4.
V tejto písomnej informácii pre používateľa sa dozviete:1. Čo je RIXUBIS a na čo sa používa
2. Čo potrebujete vedieť predtým, ako použijete RIXUBIS
3. Ako používať RIXUBIS
4. Možné vedľajšie účinky
5. Ako uchovávať RIXUBIS
6. Obsah balenia a ďalšie informácie
1. Čo je RIXUBIS a na čo sa používaRIXUBIS obsahuje aktívnu substanciu nonakog gama a je výrobkom s koagulačným faktorom IX. Faktor IX je bežnou zložkou ľudskej krvi. Je nevyhnutný pre účinné zrážanie krvi. RIXUBIS sa používa u pacientov s hemofíliou B (Christmasovou chorobou, dedičnou chorobou krvácania spôsobenou nedostatkom faktora IX). Účinkuje tak, že nahrádza chýbajúci faktor IX, čím aktivuje zrážanie krvi pacienta.
RIXUBIS sa používa na liečbu a prevenciu krvácania u pacientov s hemofíliou B vo všetkých vekových skupinách.
2. Čo potrebujete vedieť predtým, ako použijete RIXUBIS RIXUBIS neužívajte- ak ste alergický na nonakog gama alebo ďalšie súčasti tohto lieku (uvedené v časti 6)
- ak ste alergický na škrečie bielkoviny.
Upozornenia a opatreniaU lieku RIXUBIS je možná precitlivenosť alergického typu. Zastavte infúziu a okamžite kontaktujte svojho lekára alebo vyhľadajte lekársku pomoc, ak pocítite príznaky precitlivenosti/alergické reakcie,
ako je žihľavka, vyrážka, tlak na hrudi, sipot, nízky krvný tlak alebo anafylaxia (závažná alergická
reakcia, ktorá môže spôsobiť ťažkosti pri prehĺtaní a/alebo dýchaní, sčervenanie alebo opuch tváre a/alebo rúk) Pri týchto reakciách je nutné bezodkladné lekárske ošetrenie. Váš lekár tiež môže
vykonať krvný test na kontrolu, či ste si nevytvorili protilátky neutralizujúce aktivitu (inhibítory) proti svojmu lieku, keďže inhibítory sa môžu vyvíjať spolu s alergiami. Pacienti s inhibítormi faktora IX môžu mať zvýšené riziko anafylaxie počas budúcej liečby s faktorom IX.
Okamžite kontaktujte svojho lekára, pokiaľ sa vám krvácanie nezastavilo podľa očakávaní alebo na obmedzenie krvácania potrebujete výrazne zvýšené dávky lieku RIXUBIS. Váš lekár vykoná krvný test na kontrolu, či ste si nevytvorili protilátky neutralizujúce aktivitu (inhibítory) voči lieku RIXUBIS. Riziko vytvorenia inhibítorov je najvyššie u pacientov, ktorí ešte neboli liečení liekom na substitúciu faktora IX alebo v prvotnej fáze liečby, tzn. u malých detí.
Produkciu faktora IX v tele riadi gén faktora IX. U pacientov so špecifickou mutáciou génu faktora IX (napr. jeho výrazným nedostatkom) je vyššia pravdepodobnosť vytvorenia inhibítorov faktora IX a alergickej reakcie počas prvotnej fáze s akýmkoľvek koncentrátom faktora IX. Ak sa u vás teda takáto mutácia vyskytuje, váš lekár vás bude dôkladnejšie monitorovať na známky alergickej reakcie.
Ak trpíte ochorením pečene alebo ochorením srdca alebo ste nedávno prekonali závažnú operáciu, informujte, prosím, svojho lekára, pretože je zvýšené riziko komplikácii so zrážaním krvi (koaguláciou).
Poruchy obličiek (nefrotický syndróm) boli hlásené pri pokusoch o navodenie imunitnej tolerancie u pacientov s hemofíliou B s inhibítormi faktora IX a so sklonom k alergickým reakciám po vysokých dávkach faktora IX.
Pri každom podaní dávky RIXUBIS sa odporúča, aby sa vždy zaznamenal názov a číslo šarže lieku a aby sa viedli záznamy o použitých šaržách (napr. do denníku).
Iné lieky a RIXUBIS
Ak užívate alebo ste v poslednom čase užívali ešte iné lieky, prosím, oznámte to svojmu lekárovi alebo lekárnikovi. Interakcie lieku RIXUBIS s inými liečivami nie sú známe.
Tehotenstvo, dojčenie a plodnosť
Ak ste tehotná alebo dojčíte, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom alebo lekárnikom predtým, ako začnete užívať tento liek. Hemofília B sa u žien
vyskytuje len zriedka.
Vedenie vozidla a obsluha strojov
Liek RIXUBIS nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
RIXUBIS obsahuje sodík
Tento liek obsahuje 19 mg sodíka na liekovku. Musí sa to vziať do úvahy u pacientov na diéte s kontrolovaným príjmom sodíka.
3. Ako používať RIXUBIS
Liečba liekom RIXUBIS bude začatá lekárom, ktorý má skúsenosti so starostlivosťou o pacientov s hemofíliou B.
Vždy užívajte tento liek presne tak, ako vám povedal váš lekár. Ak si nie ste niečím istí, poraďte sa so svojím lekárom.
Váš lekár rozhodne, akú dávku lieku RIXUBIS dostanete. Dávkovanie a dĺžka závisia od závažnosti nedostatku faktora IX, od miesta a rozsahu krvácania a od klinického stavu pacienta, veku a od toho, ako rýchlo vaše telo spracováva faktor IX. Tieto údaje bude nutné pravidelne kontrolovať.
Po rekonštitúcii prášku s priloženým rozpúšťadlom vám liek RIXUBIS intravenózne podá váš lekár alebo sestra. Liek RIXUBIS vám môže injekciou podať aj niekto ďalší alebo vy sami, ale len ak ste na to odborne vyškolení.
 Rekonštitúcia a podávanie
Rekonštitúcia a podávanie
- Na rekonštitúciu používať iba priložené rozpúšťadlo a rekonštitučné zariadenie (BAXJECT II).
- Na podávanie je nutné použiť striekačku s konektorom typu luer-lock.
- Nepoužívajte, ak je zariadenie BAXJECT II, jeho systém sterilnej bariéry alebo balenie poškodené alebo vykazuje akékoľvek známky poškodenia.
RekonštitúciaPoužite aseptickú techniku
1. Pokiaľ je produkt stále uchovávaný v chladničke, vezmite z nej prášok RIXUBIS i rozpustné liekovky a nechajte ich zohriať sa na izbovú teplotu (medzi 15 °C a 25 °C).
2. Dôkladne si umyte ruky pomocou mydla a teplej vody.
3. Odstráňte uzávery z liekoviek prášku a rozpúšťadla.
4. Očistite zátky alkoholovými tampónmi. Položte liekovky na čistý rovný povrch.
5. Otvorte balenie zariadenia BAXJECT II. Odlúpnite papierové viečko bez toho, aby ste sa dotkli vnútrajška (obr. a). Nevyberajte zariadenie z balenia.
6. Obráťte balenie a priehľadným plastovým tŕňom prepichnite zátku rozpúšťadla. Uchopte balenie za jeho okraj a pretiahnite ho cez BAXJECT II (obr. b). Neodstraňujte modrý kryt zo zariadenia BAXJECT II.
7. Zariadenie BAXJECT II je teraz pripojené k liekovke rozpúšťadla. Otočte celý systém tak, aby bola liekovka navrchu zariadenia. Bielym plastovým tŕňom prepichnite zátku RIXUBIS. Vákuum vtiahne rozpúšťadlo do liekovky RIXUBIS (obr. c).
8. Jemne otáčajte, kým sa všetok materiál nerozpustí. Produkt sa rozpúšťa rýchlo (do 2 minút).
Uistite sa, že liek RIXUBIS sa úplne rozpustil, inak neprejde všetok rekonštituovaný roztok cez filter zariadenia. Rekonštituované lieky sa majú pred podaním vizuálne skontrolovať, či sa
v ňom nenachádzajú častice a či nezmenil farbu. Roztok má byť číry alebo mierne opalizujúci. Nepoužívajte roztoky, ktoré sú zakalené alebo sú v nich usadeniny.
Obr. a Obr. b Obr. cPo rekonštitúcii znovu nezmrazujte a nevracajte do chladničky.
Použite ihneď.
PodávaniePoužite aseptickú techniku
1. Odstráňte modrý kryt zo zariadenia BAXJECT II.
Nenaťahujte vzduch do injekčnej striekačky. Pripojte striekačku k zariadeniu BAXJECT II (obr. d).
2. Obráťte systém (liekovka s rekonštituovaným roztokom musí byť navrchu). Pomaly späť
vtiahnite piest a tak vtiahnite rekonštituovaný roztok do striekačky (obr. e).
3. Odpojte striekačku.
4. Pripojte na striekačku motýľovú ihlu. Injekciu podajte intravenózne. Roztok má byť podávaný pomaly na úrovni, ktorá je pacienta pohodlná, maximálne 10 ml za minútu.
 Obr. d Obr. e
Obr. d Obr. ePri každom podaní dávky RIXUBIS sa odporúča, aby sa vždy zaznamenal názov a číslo šarže lieku a
aby sa viedli záznamy o použitých šaržách (napr. do denníku).
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Ak použijete viac RIXUBIS, ako máteVždy používajte liek RIXUBIS presne tak, ako vám povedal váš lekár. Ak si nie ste niečím istí, poraďte sa so svojím lekárom. Ak ste si podali viac lieku RIXUBIS, ako sa odporúča, v čo najkratšom čase kontaktujte svojho lekára.
Ak zabudnete použiť RIXUBISNepodávajte si infúziou dvojnásobnú dávku, aby ste nahradili vynechanú dávku. Ďalšiu injekciu si podajte podľa harmonogramu a ďalej sa riaďte pokynmi svojho lekára.
Ak prestanete používať RIXUBISLiek RIXUBIS nevysadzujte bez toho, aby ste sa poradili so svojim lekárom.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára alebo lekárnika.
4. Možné vedľajšie účinkyTak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. U lieku RIXUBIS je možná precitlivenosť alergického typu. Tieto reakcie môžu zahŕňať pocity
pálenia a bodanie v mieste infúzie, zimnicu, sčervenanie, letargiu, nepokoj, pichanie, žihľavku,
svrbenie a vyrážky, nízky krvný tlak, rýchly tep srdca, zvieravý pocit na hrudi, dýchavičnosť, opuch hrdla, anafylaxiu (ťažká alergická reakcia), bolesti hlavy, nevoľnosť a zvracanie. Okamžite, prosím, informujte svojho lekára, ak sa u vás prejaví akýkoľvek z týchto vedľajších účinkov. Pri týchto reakciách je nutné bezodkladné lekárske ošetrenie (pozri časť 2 Upozornenia a opatrenia).
Nasledovné vedľajšie účinky boli pozorované pri liečbe liekom RIXUBIS:
Časté vedľajšie účinky (vyskytujú sa u menej ako 1 z 10 ľudí)
- poruchy chuti
- bolesť v končatinách.
Vedľajšie účinky s neznámou frekvenciou (frekvenciu nemožno odhadnúť z dostupných údajov)
- alergické reakcie (precitlivenosť).
Pri tomto produkte neboli pozorované problémy s nadmernou zrážanlivosťou krvi (tromboembolické príhody), tie sa však môžu vyskytnúť pri všetkých výrobkoch s faktorom IX. Môže ísť o srdcový infarkt, krvné zrazeniny v žilách alebo krvné zrazeniny v pľúcach.
Hlásenie vedľajších účinkov
Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Vedľajšie účinky môžete hlásiť aj priamo prostredníctvom národného systému hlásenia uvedeného v Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o
bezpečnosti tohto lieku.
5. Ako uchovávať liek RIXUBISUchovávajte tento liek mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na štítku a vonkajšom obale po skratke
EXP. Dátum exspirácie sa vzťahuje na posledný deň v mesiaci.
Uchovávajte v chladničke (2 °C - 8 °C). Neuchovávajte v mrazničke.
Pred otvorením môže byť produkt vybratý z chladničky na obdobie maximálne 6 mesiacov a pri teplote neprekračujúcej 30 ºC. Nový dátum trvanlivosti má byť napísaný na vonkajšom obale. Tento nový dátum trvanlivosti nesmie prekračovať pôvodný dátum uvedený na vonkajšom obale. Na konci tohto obdobia sa prípravok nesmie znovu uložiť do chladničky, ale má sa použiť alebo znehodnotiť.
Rekonštituovaný roztok použite okamžite.
Nepoužívajte liek RIXUBIS, ak roztok nie je číry a bezfarebný.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo RIXUBIS obsahuje- Liečivo je nonakog gama (rekombinantný ľudský koagulačný faktor IX), 3000 IU, čo zodpovedá koncentrácii 600 IU/ml po rekonštitúcii s 5 ml rozpúšťadla.
- Ďalšie zložky prášku sú sacharóza, manitol, chlorid sodný, chlorid vápenatý, L-histidín, polysorbát 80.
Liekovka pre rozpúšťadlo: 5 ml sterilizovanej vody na injekciu.
Ako RIXUBIS vyzerá a obsah baleniaRIXUBIS je prášok a rozpúšťadlo na injekčný roztok
Balenie obsahuje:
· jednu liekovku prášku RIXUBIS 3000 IU v sklenej liekovke s gumenou zátkou
· jednu liekovku 5 ml sterilizovanej vody na injekciu v sklenej liekovke s gumenou zátkou
· jedno zariadenie BAXJECT II (bezihlové rekonštitučné zariadenie)
Držiteľ rozhodnutia o registrácii
Baxter Innovations GmbH Industriestrasse 67
A-1221 Viedeň
Výrobca
Baxter SA
Boulevard René Branquart 80
B-7860 Lessines
Belgicko