
zvýšený, ak CYP2C8 je inhibovaný. Teda metabolizmus, a tým klírens repaglinidu, môže byť zmenený látkami, ktoré ovplyvňujú enzýmy cytochrómu P-
450 inhibíciou alebo indukciou. Mimoriadna opatrnosť musí byť zabezpečená pri súčasnom
podávaní oboch inhibítorov CYP2C8 a 3A4 spolu s repaglinidom.
Na základe in vitro údajov, repaglinid sa zdá byť substrátom pre účinnú pečeňovú absorpciu (organický anión transportujúci proteín OATP1B1). Látky, ktoré inhibujú OATP1B1, môžu mať tiež schopnosť zvýšiť plazmové koncentrácie repaglinidu, ako to bolo ukázané pre cyklosporín (pozri nižšie).
Nasledujúce látky môžu zvyšovať a/alebo predlžovať hypoglykemický vplyv repaglinidu: gemfibrozil, klaritromycín, itrakonazol, ketokonazol, trimetoprim, cyklosporín, deferasirox, klopidogrel, iné antidiabetické liečivá, inhibítory monoaminooxidázy (IMAO), neselektívne betablokátory, inhibítory angiotenzín konvertujúceho enzýmu (ACE), salicyláty, NSAIDs, oktreotid, alkohol a anabolické steroidy.
U zdravých dobrovoľníkov súčasné podávanie gemfibrozilu (600 mg dvakrát denne), inhibítora
CYP2C8 a repaglinidu (jednotlivá dávka 0,25 mg), zvyšuje AUC repaglinidu 8,1 násobne a Cmax
2,4 násobne. Biologický polčas sa predĺžil z 1,3 na 3,7 hodiny, čo môže viesť k zosilneniu a
predĺženiu repaglinidového efektu zníženia hladiny glukózy v krvi a koncentrácia repaglinidu v plazme po 7. hodine sa účinkom gemfibrozilu zvýšila 28,6 násobne. Súčasné podávanie
gemfibrozilu a repaglinidu je kontraindikované (pozri časť 4.3).
Súčasné podávanie trimetoprimu (160 mg dvakrát denne), slabého inhibítora CYP2C8 a repaglinidu (jednotlivá dávka 0,25 mg) spôsobuje zvýšenie AUC, Cmax and t½ (1,6 násobne,
1,4 násobne a 1,2 násobne) repaglinidu so štatisticky nevýznamným efektom na hladiny glukózy v krvi. Tento nedostatočný farmakodynamický efekt bol pozorovaný pri nižšej než terapeutickej dávke repaglinidu. Pretože bezpečnostný profil tejto kombinácie nebol stanovený pre dávky
repaglinidu vyššie ako 0,25 mg a 320 mg pre trimetoprim, súčasnému používaniu trimetoprimu s
repaglinidom by sa malo vyhnúť. Ak je nevyhnutné spoločné používanie, musí sa starostlivo sledovať hladina glukózy v krvi a musí byť vykonávané dôsledné klinické sledovanie (pozri časť
4.4).
Rifampicín, možný induktor CYP3A4 ale tiež CYP2C8 účinkuje aj ako induktor a aj inhibítor metabolizmu repaglinidu. Sedemdňová prípravná liečba s rifampicínom (600 mg), nasledovaná spoločným podávaním s repaglinidom (jednotlivá dávka 4 mg), mala na 7. deň za následok 50% zníženie AUC (kombinovaný účinok indukcie aj inhibície). Ak bol repaglinid podaný 24 hodín po poslednej dávke rifampicínu, bola pozorovaná 80% redukcia AUC repaglinidu (účinok samotnej indukcie). Súčasné podávanie rifampicínu a repaglinidu by si preto mohlo vyžiadať úpravu dávky repaglinidu, ktorá musí byť založená na starostlivom sledovaní koncentrácií glukózy v krvi pri
oboch iniciáciách liečby rifampicínom (akútna inhibícia), pri nasledujúcom dávkovaní (zmiešaná inhibícia a indukcia) a pri ukončení liečby (indukcia samotná). Približne dva týždne po ukončení liečby rifampicínom, sa už induktívny efekt rifampicínu neprejavuje. Nie je možné vylúčiť, že iné induktory, napr. fenytoín, karbamazepín, fenobarbital, ľubovník bodkovaný, môžu mať podobný účinok.
Bol sledovaný účinok ketokonazolu, prototypu účinného a kompetitívneho inhibítora CYP3A4, na farmakokinetiku repaglinidu u zdravých jedincov. Súčasné podávanie 200 mg ketokonazolu zvýšilo repaglinid (AUC a Cmax) 1,2 násobne s profilmi koncentrácií glukózy v krvi zmenené o menej ako 8%, keď je podávaný súčasne (jednotlivá dávka 4 mg repaglinidu). Tiež bolo sledované súčasné podávanie 100 mg itrakonazolu, inhibítora CYP3A4 u zdravých dobrovoľníkov, pričom AUC vzrástla 1,4 násobne. Nepreukázal sa významný efekt na hladinu glukózy u zdravých dobrovoľníkov. V interakčnej štúdii na zdravých dobrovoľníkoch, súbežné podávanie 250 mg klaritromicínu, silného inhibítora mechanizmu CYP3A4 nepatrne zvýšilo AUC repaglinidu 1,4 násobne a Cmax 1,7 násobne a zvýšilo stredný prírastok AUC sérového inzulínu 1,5 násobne a maximálnu koncentráciu 1,6 násobne. Presný mechanizmus tejto interakcie nie je objasnený.
V štúdii uskutočnenej na zdravých dobrovoľníkoch, súčasné podávanie repaglinidu (jednotlivá
dávka 0,25 mg) a cyklosporínu (opakovaná dávka 100 mg) zvyšovalo AUC repaglinidu
2,5 násobne a Cmax repaglinidu 1,8 násobne. Pretože nebola stanovená interakcia pre dávky vyššie ako 0,25 mg pre repaglinid, musí byť zamedzené súčasnému použitiu cyklosporínu
s repaglinidom. Ak sa javí kombinácia ako nevyhnutná, musí byť vykonávaný starostlivý klinický
monitoring a monitoring hladiny glukózy v krvi (pozri časť 4.4).
V interakčnej štúdii so zdravými dobrovoľníkmi viedlo súbežné podávanie deferasiroxu
(30 mg/kg/deň, 4 dni), slabého inhibítora CYP2C8 a CYP3A4 a repaglinidu (jednotlivá dávka,
0,5 mg) k zvýšeniu systémovej expozície repaglinidu (AUC) na 2,3-násobok (90% IS [2,03-
2,63]) kontroly, 1,6-násobnému (90% IS [1,42-1,84]) zvýšeniu Cmax a miernemu signifikantnému
zníženiu glykémie. Vzhľadom nato, že interakcia nebola stanovená s dávkami repaglinidu
vyššími ako 0,5 mg, súbežnému užívaniu deferasiroxu s repaglinidom sa treba vyhnúť. Ak je táto kombinácia nevyhnutná, má sa vykonávať starostlivé klinické monitorovanie a monitorovanie
glukózy v krvi (pozri časť 4.4).
V interakčnej štúdií so zdravými dobrovoľníkmi, pri súbežnom podávaní klopidogrelu (300 mg počiatočná saturačná dávka), CYP2C8 inhibítora, sa zvýšila expozícia repaglinidu (AUC0–∞)
5,1- násobne a pri pokračovaní dávkou (75 mg denná dávka) sa zvýšila expozícia repaglinidu
(AUC0–∞) 3,9-násobne. Bolo pozorované malé, signifikantné zníženie hodnoty glykémie.
Pretože nebol stanovený bezpečnostný profil pacientov pri súbežnej liečbe, je potrebné vyhnúť sa
súbežnému užívaniu klopidogrelu a repaglinidu. Ak je nevyhnutné súbežné podávanie, má sa starostlivo sledovať hladina glukózy v krvi a má sa vykonávať dôsledné klinické sledovanie (pozri časť 4.4).
ß- blokátory môžu maskovať príznaky hypoglykémie.
Súčasné podávanie cimetidínu, nifedipínu, estrogénu alebo simvastatínu s repaglinidom, všetky
substráty CYP3A4 nezmenili signifikantne farmakokinetické parametre repaglinidu.
Repaglinid nemal klinicky relevantný vplyv na farmakokinetické vlastnosti digoxínu, teofylínu alebo warfarínu v ustálenom stave, keď bol podávaný zdravým dobrovoľníkom. Preto nie je potrebná úprava dávkovania týchto látok, keď sú podávané spolu s repaglinidom.
Nasledujúce látky môžu znižovať hypoglykemický vplyv repaglinidu:
perorálne kontraceptíva, rifampicín, barbituráty, karbamazepín, tiazidy, kortikosteroidy, danazol, tyroidné hormóny a sympatikomimetiká.
Ak sú pacientovi užívajúcemu repaglinid tieto lieky predpísané alebo ich užívanie je zrušené,
pacient musí byť dôkladne sledovaný kvôli zmenám hladiny cukru v krvi.
Keď je repaglinid užívaný spolu s inými liekmi ktoré sú prevažne vylučované žlčou, tak ako repaglinid, je potrebné vziať do úvahy ich možné interakcie.
Deti a dospievajúci
U detí a dospievajúcich sa neuskutočnili žiadne interakčné štúdie.
4.6 Fertilita, gravidita a laktácia
Gravidita
U gravidných žien sa neuskutočnili štúdie s repaglinidom. Repaglinid sa nemá predpisovať
gravidným ženám.
Laktácia
U dojčiacich žien sa neuskutočnili štúdie s repaglinidom. Repaglinid nemajú užívať dojčiace
ženy.
Fertilita
Údaje zo štúdií na zvieratách skúmajúcich účinky na embryonálny vývoj a na vývoj potomstva,
ako aj vylučovanie do materského mlieka je popísaný v časti 5.3.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Repaglinide Accord nemá priamy vplyv na schopnosť viesť vozidlá a obsluhovať stroje, ale môže
spôsobiť hypoglykémiu.
Pacienti majú posúdiť predbežné opatrenia, aby sa vyvarovali hypoglykémii pri vedení vozidla. Toto je obzvlášť dôležité u tých pacientov, ktorí majú zníženú alebo im chýba schopnosť uvedomiť si varovné signály hypoglykémie alebo sa hypoglykémia u nich často opakuje. Za týchto okolností má byť zvážená schopnosť viesť vozidlo.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Najčastejšie hlásenými nežiaducimi reakciami sú zmeny hladiny glukózy v krvi, napr. hypoglykémia. Výskyt týchto reakcií závisí od individuálnych faktorov, ako sú stravovacie návyky, dávkovanie, pohybová aktivita a stres.
Tabuľkovýzoznamnežiaducichreakcií
Na základe skúseností s repaglinidom a inými antidiabetikami sa vyskytlinasledovné nežiaduce reakcie : frekvencie sú definované ako: časté (≥1/100 až <1/10); menej časté (≥1/1,000 až
<1/100); zriedkavé (≥ 1/10 000 až < 1/1000); veľmi zriedkavé (< 1/10 000); a neznáme
(z dostupných údajov).
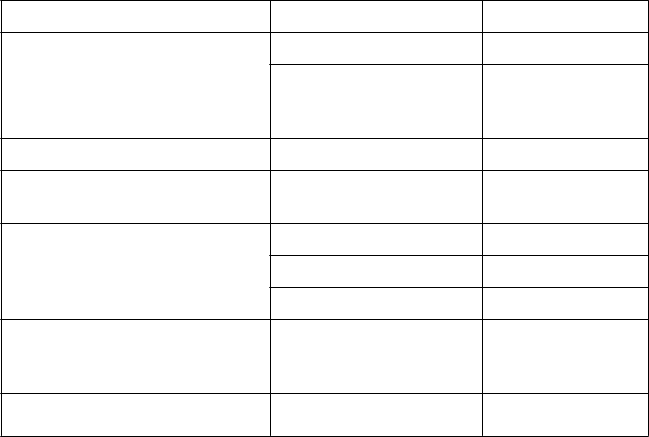
Poruchy imunitného systému Alergické reakcie* Veľmi zriedkavé
Poruchy metabolizmu a výživy Hypoglykémia Časté
Hypoglykemická kóma a hypoglykemické bezvedomie
Neznáme
Poruchy oka Refračné poruchy* Veľmi zriedkavé
Poruchy srdca a srdcovej činnosti Kardiovaskulárne ochorenie Zriedkavé
Poruchy gastrointestinálneho traktu
Bolesť brucha, hnačka Časté
Vracanie, zácpa Veľmi zriedkavé
Nauzea Neznáme
Poruchy pečene a žlčových ciest Abnormálna funkcia pečene,zvýšenie pečeňových enzýmov*
Veľmi zriedkavé
Poruchy kože a podkožného tkaniva
Hypersenzitivita* Neznáme

*pozri časť Opis vybraných nežiaducich reakcií nižšie
Opis vybraných nežiaducich reakciíAlergické reakcieGeneralizované reakcie z precitlivenosti (napr. anafylaktická reakcia) alebo imunologické reakcie také ako vaskulitída.
Refrakčné poruchyJe známe, že zmeny hladiny glukózy v krvi môžu viesť k prechodným poruchám zraku, najmä na
začiatku liečby. Takéto poruchy boli hlásené iba v niekoľkých prípadoch po začatí liečby repaglinidom. Žiadny z takýchto prípadov neviedol v klinických štúdiách k ukončeniu liečby repaglinidom.
Abnormálna funkcia pečene,zvýšené hladiny pečeňových enzýmovOjedinelé prípady zvýšenia hladín pečeňových enzýmov boli hlásené počas liečby repaglinidom. Väčšina prípadov bola mierna a prechodná, a veľmi málo pacientov ukončilo liečbu kvôli zvýšeným hladinám pečeňových enzýmov. Vo veľmi zriedkavých prípadoch bola hlásená závažná dysfunkcia pečene.
HypersenzitivitaMôžu sa objaviť reakcie precitlivenosti na koži, ako je sčervenanie kože, svrbenie, vyrážky a žihľavka. Nie je dôvod na podozrenie na skríženú alergiu so sulfonylureou v dôsledku rozdielu v
chemickej štruktúre.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby
hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.
4.9 Predávkovanie
Repaglinid bol podávaný so zvyšujúcou sa týždennou dávkou 4 - 20 mg štyrikrát denne, po dobu
6 týždňov. Neobjavili sa obavy ohľadom bezpečnosti. Výskyt hypoglykémie v tejto štúdii bol
eliminovaný zvýšeným energetickým príjmom, relatívne predávkovanie môže mať za následok prehnané zníženie glukózy spojené so sprievodnými hypoglykemickými príznakmi (závrat, potenie, tremor, bolesť hlavy a pod.). Keď sa objavia tieto príznaky, adekvátnou reakciou na ne je zvýšenie nízkej hladiny glukózy v krvi (perorálne sacharidmi).Ťažká hypoglykémia spojená so záchvatmi, stratou vedomia alebo kómou musí byť liečená intravenózne podanou glukózou.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antidiabetiká, iné antidiabetiká s výnimkou inzulínov, ATC kód: A10B X02
Spôsobúčinku
Repaglinid je perorálna látka stimulujúca vylučovanie inzulínu, s krátkodobým účinkom. Repaglinid znižuje hladinu glukózy v krvi náhlym uvoľnením inzulínu z pankreasu. Účinok je závislý na funkčnosti ß-buniek v ostrovčekoch pankreasu.
Na rozdiel od iných látok stimulujúcich sekréciu, repaglinid zatvára na ATP závislé draslíkové
kanály cez cieľovú bielkovinu v ß-bunkách. Táto depolarizácia ß-buniek vedie k otvoreniu
vápnikových kanálov. Výsledkom je zvýšenie prílevu vápnika, ktorý indukuje vylučovanie
inzulínu z ß-bunky.
Farmakodynamickéúčinky
U pacientov s diabetom 2. typu sa inzulinotropná odpoveď na jedlo objavuje počas 30 minút po podaní perorálnej dávky repaglinidu. Výsledkom je zníženie glukózy počas jedla. Zvýšená
hladina inzulínu nepretrváva v dobe medzi jedlami. Hladina repaglinidu v plazme sa rýchlo
znižuje a u pacientov s diabetom 2. typu boli zistené nízke koncentrácie v plazme po 4 hodinách od užitia.
Klinickáúčinnosťabezpečnosť
Na dávke závislé zníženie glukózy v krvi bolo dokázané u diabetikov 2. typu, ktorí dostávali repaglinid v dávkach 0,5 až 4 mg.
Výsledky klinických štúdií dokázali, že repaglinid je vhodné dávkovať v závislosti na hlavnom
jedle (preprandiálne dávkovanie).
Dávky sú obvykle podávané 15 minút pred jedlom, ale čas sa môže meniť od doby bezprostredne
pred jedlom až po 30 minút pred jedlom.
Jedna epidemiologická štúdia naznačila zvýšené riziko výskytu akútneho koronárneho syndrómu u pacientov liečených repaglinidom, v porovnaní s pacientami liečenými sulfonylureou (pozri časti 4.4 a 4.8).
5.2 Farmakokinetické vlastnosti
Absorpcia
Repaglinid je rýchlo vstrebávaný tráviacim traktom a rýchlo sa zvyšuje koncentrácia liečiva v plazme. Vrchol jeho hladiny v plazme sa dosahuje za hodinu po podaní. Po dosiahnutí maxima, hladina v plazme rýchlo klesá
Farmakokinetika repaglinidu je charakterizovaná priemernou absolútnou biologickou
dostupnosťou, ktorá je 63% (CV 11%)
Nezistili sa žiadne klinicky relevantné rozdiely vo farmakokinetike repaglinidu pri podávaní 0, 15
alebo 30 minút pred jedlom alebo nalačno.
V klinických štúdiách sa zistila vysoká interindividuálna variabilita (60 %) plazmatickej koncentrácie repaglinidu. Intraindividuálna variabilita je nízka až stredná (35 %) a keďže je repaglinid potrebné titrovať s ohľadom na klinickú odpoveď, účinnosť nie je ovplyvnená interindividuálnou variabilitou.
Distribúcia
Farmakokinetika repaglinidu je charakteristická nízkym distribučným objemom 30 l
(konzistentné s distribúciou do medzibunkovej tekutiny) a vysokou väzbovosťou na plazmatické
bielkoviny u ľudí (vyššia než 98 %).
Eliminácia
Repaglinid sa z krvi eliminuje rýchlo, do 4–6 hodín. Polčas eliminácie z plazmy je približne jedna
hodina.
Repaglinid sa takmer úplne metabolizuje a neboli identifikované žiadne metabolity s klinicky
významným hypoglykemickým účinkom.
Metabolity repaglinidu sa primárne vylučujú žlčou. Malá časť (menej než 8 %) podanej dávky sa objaví v moči, primárne v podobe metabolitov. Menej než 1 % repaglinidu sa vylučuje stolicou.
Osobitné skupiny pacientov
Expozícia repaglinidom je zvýšená u diabetikov 2. typu s pečeňovou nedostatočnosťou a aj u
starších pacientov. AUC (SD) po 2 mg jednorazovej dávke (4 mg u pacientov s pečeňovou nedostatočnosťou) bol 31,4 ng/ml x hodina (28,3) u zdravých dobrovoľníkov, 304,9 ng/ml x hodina (228,0) u pacientov s pečeňovou nedostatočnosťou a 117,9 ng/ml x hodina (83,8) u starších pacientov s diabetom 2. typu.
Po piatich dňoch liečby repaglinidom (2 mg x 3/deň) u pacientov s ťažkým poškodením funkcie obličiek (klírens kreatinínu: 20-39 ml/minútu), výsledky ukazujú dvojnásobné signifikantné
zvýšenie expozície (AUC) a polčasu (t1/2) v porovnaní s pacientmi s normálnou funkciou obličiek.
Deti a dospievajúci
K dispozícii nie sú žiadne údaje.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
V štúdiách u zvierat sa preukázalo, že repaglinid nemá teratogénny účinok. U plodov
a novonarodených mláďat samíc potkanov vystavených v poslednom štádiu tehotenstva
a v priebehu laktácie vysokým dávkam repaglinidu sa zistila embryotoxicita a vývin abnormálnej
končatiny. Repaglinid bol detegovaný v mlieku zvierat.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokCelulóza, mikrokryštalická (E460) Hydrogénfosforečnan vápenatý, bezvodný Kukuričný škrobPovidón Glycerín Magnéziumstearát
Meglumín
Poloxamér 188
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaBlistre hliník/hliník v baleniu obsahujúcim 30, 90, 120, 180 alebo 270 tabliet.
Fľaštička z HDPE obsahujúca 100 tabliet v baleniu o 1 fľaštičke.Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAccord Healthcare Limited,
Sage house, 319 Pinner road, Harrow, HA1 4HF
Veľká Británia
8. REGISTRAČNÉ ČÍSLO(
ČÍSLA)EU/1/11/743/001-004, EU/1/11/743/005, EU/1/11/743/016
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 22. Prosince 2011
Dátum posledného predĺženia registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Repaglinide Accord 1 mg tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá tableta obsahuje 1 mg repaglinidu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tableta
Svetlo žlté až žlté, okrúhle, bikonvexné neobaľované tablety so skosenými hranami a vyrytým označením „R“ na jednej strane a bez označenia na druhej strane, ktoré môžu mať škvrnitý povrch..
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Repaglinid je indikovaný u dospelých s diabetes mellitus 2.typu , u ktorých sa hyperglykémiu už nedarí uspokojivo liečiť diétou, znižovaním hmotnosti a cvičením. Repaglinid je tiež indikovaný u dospelých s diabetes mellitus 2. typu v kombinácii s metformínom, keď samostatná liečba metformínom je nedostatočná.
Liečba má byť iniciovaná ako doplnok diéty a cvičení na zníženie glukózy v krvi v závislosti od
jedla.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Repaglinid je podávaný tesne pred jedlom a je určený individuálne aby sa optimalizovala kontrola glykémie. Okrem toho obvykle pacient sám sleduje hladinu glukózy v krvi a/alebo v moči. Hladina glukózy v krvi pacienta musí byť pravidelne sledovaná lekárom, aby mohol určiť minimálnu účinnú dávku. Ako odpoveď na liečbu sa u pacienta sleduje hladina glykovaného hemoglobínu. Pravidelné sledovanie je potrebné na odhalenie neprimeraného zníženia glukózy v krvi pri odporúčanej maximálnej dávke (napr. primárne zlyhanie) a na detekciu straty adekvátnej odpovede zníženia glukózy v krvi po počiatočnom období účinnosti (napr. sekundárne zlyhanie).
Krátkodobé podávanie repaglinidu môže byť dostatočné počas obdobia prechodného poklesu kontroly u pacientov s diabetom 2. typu, obvykle dobre kompenzovaných diétou.
Začiatočnádávka
Dávka má byť určená lekárom podľa potreby pacienta.
Odporučená počiatočná dávka je 0,5 mg. Medzi dvomi titračnými krokmi musia byť jeden až dva
týždne (čo je podmienené odpoveďou glukózy v krvi).
Ak sú pacienti prestavovaní z iného perorálneho antidiabetika, odporúčaná počiatočná dávka je
1 mg.
Udržiavacia dávkaOdporučená jednorazová maximálna dávka je 4 mg užitá s hlavným jedlom. Celková maximálna denná dávka nesmie prekročiť 16 mg.
Osobitné skupiny pacientovStarší pacientiNeuskutočnili sa žiadne klinické štúdie u pacientov >75 rokov.
Porucha funkcie obličiekRepaglinid nie je ovplyvnený ochorením obličiek (pozri časť 5.2).
Osem percent jednej dávky repaglinidu je vylučovaných obličkami a celkový klírens lieku v plazme je znížený u pacientov s poškodením funkcie obličiek. U diabetických pacientov
s poškodením funkcie obličiek je zvýšená citlivosť na inzulín, preto je potrebná opatrnosť pri
titrovaní dávky u týchto pacientov.
Porucha funkcie pečeneNeuskutočnili sa žiadne klinické štúdie u pacientov s pečeňovou nedostatočnosťou .
Oslabení a podvyživení pacientiU oslabených alebo podvyživených pacientov počiatočná a udržiavacia dávka musí byť opatrne
titrovaná a požadovanú dávku treba starostlivo voliť tak, aby nedochádzalo ku hypoglykémiám.
 Pacienti liečení inými perorálnymi antidiabetikami
Pacienti liečení inými perorálnymi antidiabetikamiPacienti môžu byť priamo prestavení z iných perorálnych antidiabetík na repaglinid. Nie je stanovený presný vzťah medzi dávkovaním repaglinidu a ostatnými perorálnymi antidiabetikami. Odporučená maximálna počiatočná dávka u týchto pacientov je 1 mg užitá pred hlavným jedlom.
Repaglinid môže byť užívaný v kombinácii s metformínom v tých prípadoch, keď metformín sám nie je schopný dostatočne kontrolovať hladinu glukózy v krvi. V týchto prípadoch dávka metformínu má byť udržiavacia a repaglinid podávaný sprievodne. Počiatočná dávka repaglinidu je 0,5 mg podávaná pred hlavným jedlom, za sledovania hladiny glukózy v krvi, tak ako pri monoterapii.
Deti a dospievajúciBezpečnosť a účinnosť repaglinidu u detí vo veku menej než 18 rokov neboli stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podaniaRepaglinid sa užíva pred hlavným jedlom (t.j. tesne pred jedlom).
Dávky sa obyčajne užívajú 15 minút pred jedlom, ale možno ich užívať od 30 pred jedlom až tesne pred nadchádzajúcim jedlom (t. j. tesne druhým, tretím alebo štvrtým denným jedlom). Pacienti, ktorí vynechali jedlo (alebo pridali jedlo navyšše), musia byť poučení o vynechaní (alebo pridaní) dávky pri tomto jedle.
V prípade súbežného použitia iných liečiv pozri časti 4.4 a 4.5 na stanovenie dávky.
4.3 Kontraindikácie
• Precitlivenosť na repaglinid alebo na ktorúkoľvek z pomocných látok uvedených v časti
6.1. uvedených v časti 6.1,
• Diabetes mellitus 1. typu negatívny C- peptid
• Diabetická ketoacidóza, s kómou alebo bez kómy
• Vážne poruchy funkcie pečene
• Súčasné užívanie gemfibrozilu (pozri časť 4.5).
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecne
Repaglinid má byť predpísaný ak je slabá kontrola glukózy v krvi a symptómy diabetu trvajú aj napriek primeraným snahám s diétou, cvičením a redukciou hmotnosti.
Keď je pacient, stabilizovaný na niektorom perorálnom antidiabetiku, vystavený stresom ako horúčka, trauma, infekcia alebo operácia môže prísť ku strate kontroly nad glykémiou. V tomto období môže byť potrebné prerušiť liečbu repaglinidom a dočasne prejsť na liečbu inzulínom.
Hypokglykémia
Repaglinid podobne ako iné látky stimulujúce, sekréciu inzulínu môže spôsobiť hypoglykémiu.
Kombinácia so sekretagogami inzulínu
Účinok na pokles glukózy v krvi sa môže pri liečbe perorálnymi antidiabetikami u pacientov časom znížiť. Tento fakt môže byť zapríčinený postupujúcou závažnosťou cukrovky alebo zníženou odpoveďou na liek. Tento fenomén je známy ako sekundárne zlyhanie, na rozdiel od primárneho zlyhania liečby, kedy liek je neefektívny u pacientov, ktorým je podávaný prvý raz. Odhadnúť, či ide o pacienta so sekundárnym zlyhaním liečby je možné až po úprave dávky a pri dodržaní diéty a cvičení.
Repaglinid sa viaže na určité miesta s krátkodobým pôsobením na ß-bunky. Použitie repaglinidu
v prípade sekundárneho zlyhania látok stimulujúcich sekréciu inzulínu nebolo klinicky sledované. Klinické testy skúmajúce kombinácie s inými látkami stimulujúcimi sekréciu inzulínu neboli
robené.
Kombinácia s Neutrálnym Protamínom Hagedorn (NPH) inzulínom alebo tiazolidíndiónmi
Boli uskutočnené štúdie s kombinovanou liečbou s o (NPH) inzulínom alebo tiazolidendiónmi.
Avšak profil prínosu rizika treba stanoviť v porovnaní s inými kombinovanými liečbami.
Kombinácia s metformínom
Kombinovaná liečba s metformínom je spojená so zvýšeným rizikom hypoglykémie.
Akútny koronárny syndróm
Použitie repaglinidu môže byť spojené so zvýšeným výskytom akútneho koronárneho syndrómu
(napr. infarkt myokardu), (pozri časti 4.8 a 5.1).
Súčasnépodávanie
Repaglinid musí byť použitý s opatrnosťou alebo sa použitiu treba vyhnúť u pacientov, ktorí užívajú lieky s účinkom na metabolizmus repaglinidu (pozri časť 4.5). Ak je nevyhnutné
spoločné podávanie, musí sa starostlivo sledovať hladina glukózy v krvi a musí byť vykonávané
dôsledné klinické sledovanie.
4.5 Liekové a iné interakcie
O mnohých liekoch je známe, že, ovplyvňujú metabolizmus repaglinidu. Preto má lekár brať do
úvahy možné interakcie:
In vitro údaje ukazujú, že repaglinid je prednostne metabolizovaný CYP2C8, ale aj CYP3A4. Klinické údaje u zdravých dobrovoľníkov podporujú predpoklad, že CYP2C8 je najdôležitejším enzýmom zahrnutým v metabolizme repaglinidu s CYP3A4,ktorý zohráva menšiu úlohu, ale relatívny prínos CYP3A4 môže byť zvýšený, ak CYP2C8 je inhibovaný. Teda metabolizmus, a tým klírens repaglinidu, môže byť zmenený látkami, ktoré ovplyvňujú enzýmy cytochrómu P-
450 inhibíciou alebo indukciou. Mimoriadna opatrnosť musí byť zabezpečená pri súčasnom
podávaní oboch inhibítorov CYP2C8 a 3A4 spolu s repaglinidom.
Na základe in vitro údajov, repaglinid sa zdá byť substrátom pre účinnú pečeňovú absorpciu (organický anión transportujúci proteín OATP1B1). Látky, ktoré inhibujú OATP1B1, môžu mať tiež schopnosť zvýšiť plazmové koncentrácie repaglinidu, ako to bolo ukázané pre cyklosporín (pozri nižšie).
Nasledujúce látky môžu zvyšovať a/alebo predlžovať hypoglykemický vplyv repaglinidu: gemfibrozil, klaritromycín, itrakonazol, ketokonazol, trimetoprim, cyklosporín, deferasirox, klopidogrel, iné antidiabetické liečivá, inhibítory monoaminooxidázy (IMAO), neselektívne betablokátory, inhibítory angiotenzín konvertujúceho enzýmu (ACE), salicyláty, NSAIDs, oktreotid, alkohol a anabolické steroidy.
U zdravých dobrovoľníkov súčasné podávanie gemfibrozilu (600 mg dvakrát denne), inhibítora
CYP2C8 a repaglinidu (jednotlivá dávka 0,25 mg), zvyšuje AUC repaglinidu 8,1 násobne a Cmax
2,4 násobne. Biologický polčas sa predĺžil z 1,3 na 3,7 hodiny, čo môže viesť k zosilneniu a
predĺženiu repaglinidového efektu zníženia hladiny glukózy v krvi a koncentrácia repaglinidu v plazme po 7. hodine sa účinkom gemfibrozilu zvýšila 28,6 násobne. Súčasné podávanie
gemfibrozilu a repaglinidu je kontraindikované (pozri časť 4.3).
Súčasné podávanie trimetoprimu (160 mg dvakrát denne), slabého inhibítora CYP2C8 a repaglinidu (jednotlivá dávka 0,25 mg) spôsobuje zvýšenie AUC, Cmax and t½ (1,6 násobne,
1,4 násobne a 1,2 násobne) repaglinidu, so štatisticky nevýznamným efektom na hladiny glukózy v krvi. Tento nedostatočný farmakodynamický efekt bol pozorovaný pri nižšej než terapeutickej dávke repaglinidu. Pretože bezpečnostný profil tejto kombinácie nebol stanovený pre dávky
repaglinidu vyššie ako 0,25 mg a 320 mg pre trimetoprim, súčasnému používaniu trimetoprimu s repaglinidom by sa malo vyhnúť. Ak je nevyhnutné spoločné používanie, musí sa starostlivo
sledovať hladina glukózy v krvi a musí byť vykonávané dôsledné klinické sledovanie (pozri časť
4.4).
Rifampicín, možný induktor CYP3A4 ale tiež CYP2C8 účinkuje aj ako induktor a aj inhibítor metabolizmu repaglinidu. Sedemdňová prípravná liečba s rifampicínom (600 mg), nasledovaná spoločným podávaním s repaglinidom (jednotlivá dávka 4 mg), mala na 7. deň za následok 50% zníženie AUC (kombinovaný účinok indukcie aj inhibície). Ak bol repaglinid podaný 24 hodín po poslednej dávke rifampicínu, bola pozorovaná 80% redukcia AUC repaglinidu (účinok samotnej indukcie). Súčasné podávanie rifampicínu a repaglinidu by si preto mohlo vyžiadať úpravu dávky repaglinidu, ktorá musí byť založená na starostlivom sledovaní koncentrácií glukózy v krvi pri
oboch iniciáciách liečby rifampicínom (akútna inhibícia), pri nasledujúcom dávkovaní (zmiešaná inhibícia a indukcia) a pri ukončení liečby (indukcia samotná). Približne dva týždne po ukončení liečby rifampicínom, sa už induktívny efekt rifampicínu neprejavuje. Nie je môžné vylúčiť, že iné induktory, napr. fenytoín, karbamazepín, fenobarbital, ľubovník bodkovaný, môžu mať podobný účinok.
Bol sledovaný účinok ketokonazolu, prototypu účinného a kompetitívneho inhibítora CYP3A4, na farmakokinetiku repaglinidu u zdravých jedincov. Súčasné podávanie 200 mg ketokonazolu zvýšilo repaglinid (AUC a Cmax) 1,2 násobne s profilmi koncentrácií glukózy v krvi zmenené o menej ako 8%, keď je podávaný súčasne (jednotlivá dávka 4 mg repaglinidu). Tiež bolo sledované súčasné podávanie 100 mg itrakonazolu, inhibítora CYP3A4 u zdravých dobrovoľníkov, pričom AUC vzrástla 1,4 násobne. Nepreukázal sa významný efekt na hladinu glukózy u zdravých dobrovoľníkov. V interakčnej štúdii na zdravých dobrovoľníkoch, súbežné podávanie 250 mg klaritromicínu, silného inhibítora mechanizmu CYP3A4 nepatrne zvýšilo AUC repaglinidu 1,4 násobne a Cmax 1,7 násobne a zvýšilo stredný prírastok AUC sérového inzulínu 1,5 násobne a maximálnu koncentráciu 1,6 násobne. Presný mechanizmus tejto interakcie nie je objasnený.
V štúdii uskutočnenej na zdravých dobrovoľníkoch, súčasné podávanie repaglinidu (jednotlivá dávka 0,25 mg) a cyklosporínu (opakovaná dávka 100 mg) zvyšovalo AUC repaglinidu
2,5 násobne a Cmax repaglinidu 1,8 násobne. Pretože nebola stanovená interakcia pre dávky vyššie ako 0,25 mg pre repaglinid, musí byť zamedzené súčasnému použitiu cyklosporínu
s repaglinidom. Ak sa javí kombinácia ako nevyhnutná, musí byť vykonávaný starostlivý klinický
monitoring a monitoring hladiny glukózy v krvi (pozri časť 4.4).
V interakčnej štúdii so zdravými dobrovoľníkmi viedlo súbežné podávanie deferasiroxu
(30 mg/kg/deň, 4 dni), slabého inhibítora CYP2C8 a CYP3A4 a repaglinidu (jednotlivá dávka,
0,5 mg) k zvýšeniu systémovej expozície repaglinidu (AUC) na 2,3-násobok (90% IS [2,03-
2,63]) kontroly, 1,6-násobnému (90% IS [1,42-1,84]) zvýšeniu Cmax a miernemu signifikantnému
zníženiu glykémie. Vzhľadom nato, že interakcia nebola stanovená s dávkami repaglinidu
vyššími ako 0,5 mg, súbežnému užívaniu deferasiroxu s repaglinidom sa treba vyhnúť. Ak je táto
kombinácia nevyhnutná, má sa vykonávať starostlivé klinické monitorovanie a monitorovanie
glukózy v krvi (pozri časť 4.4).
V interakčnej štúdií so zdravými dobrovoľníkmi, pri súbežnom podávaní klopidogrelu (300 mg počiatočná saturačná dávka), CYP2C8 inhibítora, sa zvýšila expozícia repaglinidu (AUC0–∞)
5,1- násobne a pri pokračovaní dávkou (75 mg denná dávka) sa zvýšila expozícia repaglinidu
(AUC0–∞) 3,9-násobne. Bolo pozorované malé, signifikantné zníženie hodnoty glykémie.
Pretože nebol stanovený bezpečnostný profil pacientov pri súbežnej liečbe, je potrebné vyhnúť sa
súbežnému užívaniu klopidogrelu a repaglinidu. Ak je nevyhnutné súbežné podávanie, má sa starostlivo sledovať hladina glukózy v krvi a má sa vykonávať dôsledné klinické sledovanie (pozri časť 4.4).
ß- blokátory môžu maskovať príznaky hypoglykémie.
Súčasné podávanie cimetidínu, nifedipínu, estrogénu alebo simvastatínu s repaglinidom, všetky
substráty CYP3A4 nezmenili signifikantne farmakokinetické parametre repaglinidu.
Repaglinid nemal klinicky relevantný vplyv na farmakokinetické vlastnosti digoxínu, teofylínu alebo warfarínu v ustálenom stave, keď bol podávaný zdravým dobrovoľníkom. Preto nie je potrebná úprava dávkovania týchto látok, keď sú podávané spolu s repaglinidom.
Nasledujúce látky môžu znižovať hypoglykemický vplyv repaglinidu:
perorálne kontraceptíva, rifampicín, barbituráty, karbamazepín, tiazidy, kortikosteroidy, danazol, tyroidné hormóny a sympatikomimetiká.
Ak sú pacientovi užívajúcemu repaglinid tieto lieky predpísané alebo ich užívanie je zrušené, pacient musí byť dôkladne sledovaný kvôli zmenám hladiny cukru v krvi.
Keď je repaglinid užívaný spolu s inými liekmi ktoré sú prevažne vylučované žlčou, tak ako repaglinid, je potrebné vziať do úvahy ich možné interakcie.
Deti a dospievajúci
U detí a dospievajúcich sa neuskutočnili žiadne interakčné štúdie.
4.6 Fertilita, gravidita a laktácia
Gravidita
U gravidných žien sa neuskutočnili štúdie s repaglinidom. Repaglinid sa nemá predpisovať
gravidným ženám.
Laktácia
U dojčiacich žien sa neuskutočnili štúdie s repaglinidom. Repaglinid nemajú užívať dojčiace
ženy.
Fertilita
Údaje zo štúdií na zvieratách skúmajúcich účinky na embryonálny vývoj a na vývoj potomstva,
ako aj vylučovanie do materského mlieka je popísaný v časti 5.3.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Repaglidin nemá priamy vplyv na schopnosť viesť vozidlá a obsluhovať stroje, ale môže spôsobiť hypoglykémiu.
Pacienti majú posúdiť predbežné opatrenia, aby sa vyvarovali hypoglykémii pri vedení vozidla. Toto je obzvlášť dôležité u tých pacientov, ktorí majú zníženú alebo im chýba schopnosť uvedomiť si varovné signály hypoglykémie alebo sa hypoglykémia u nich často opakuje. Za týchto okolností má byť zvážená schopnosť viesť vozidlo.
4.8 Nežiaduce účinky
Súhrnbezpečnostného profilu
Najčastejšie hlásenými nežiaducimi reakciami sú zmeny hladiny glukózy v krvi, napr. hypoglykémia. Výskyt týchto reakcií závisí od individuálnych faktorov, ako sú stravovacie návyky, dávkovanie, pohybová aktivita a stres.
Tabuľkovýzoznamnežiaducich reakcií
Na základe skúseností s repaglinidom a inými antidiabetikami sa vyskytli nasledovné nežiadúce
reakcie: frekvencie výskytu sú definované ako: časté (≥1/100 až <1/10); menej časté (≥1/1000 až
<1/100); zriedkavé (≥ 1/10 000 až < 1/1000); veľmi zriedkavé (< 1/10 000); neznáme
(z dostupných údajov).
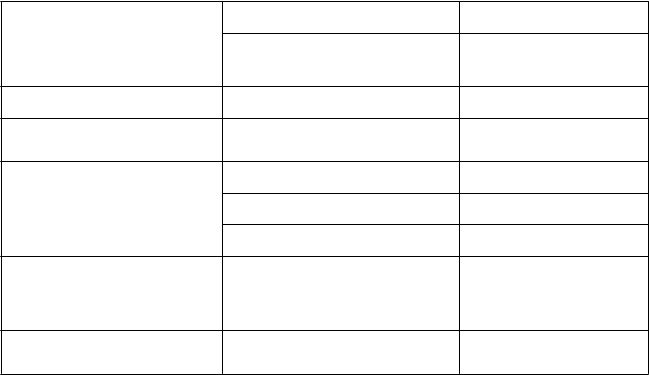
Poruchy imunitného systému Alergické reakcie* Veľmi zriedkavé
Poruchy metabolizmu a výživy Hypoglykémia Časté
Hypoglykemická kóma a hypoglykemické bezvedomie
Neznáme
Poruchy oka Refračné poruchy* Veľmi zriedkavé
Poruchy srdca a srdcovej činnosti Kardiovaskulárne ochorenie
Zriedkavé
Poruchy gastrointestinálneho traktu
Bolesť brucha, hnačka Časté
Vracanie, zácpa Veľmi zriedkavé
Nauzea Neznáme
Poruchy pečene a žlčových ciest Abnormálna funkcia pečene,zvýšenie pečeňových enzýmov*
Veľmi zriedkavé
Poruchy kože a podkožného tkaniva
Hypersenzitivita* Neznáme
*pozri časť Opis vybraných nežiaducich reakcií, nižšie
Opis vybraných nežiaducich reakciíAlergické reakcieGeneralizované reakcie z precitlivenosti (napr. anafylaktická reakcia) alebo imunologické reakcie také ako vaskulitída.
Refrakčné poruchyJe známe, že zmeny hladiny glukózy v krvi môžu viesť k prechodným poruchám zraku, najmä na začiatku liečby. Takéto poruchy boli hlásené iba v niekoľkých prípadoch po začatí liečby repaglinidom. Žiadny z takýchto prípadov neviedol v klinických štúdiách k ukončeniu liečby repaglinidom.
Abnormálna funkcia pečene,zvýšenie hladiny pečeňových enzýmovOjedinelé prípady zvýšenia hladín pečeňových enzýmov boli hlásené počas liečby repaglinidom. Väčšina prípadov bola mierna a prechodná, a veľmi málo pacientov ukončilo liečbu kvôli
zvýšeným hladinám pečeňových enzýmov. Vo veľmi zriedkavých prípadoch bola hlásená
závažná dysfunkcia pečene.
HypersenzitivitaMôžu sa objaviť reakcie precitlivenosti na koži, ako je sčervenanie kože, svrbenie, vyrážky a žihľavka. Nie je dôvod na podozrenie na skríženú alergiu so sulfonylureou v dôsledku rozdielu v chemickej štruktúre.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieRepaglinid bol podávaný so zvyšujúcou sa týždennou dávkou 4 - 20 mg štyrikrát denne, po dobu
6 týždňov. Neobjavili sa obavy ohľadom bezpečnosti. Výskyt hypoglykémie v tejto štúdii bol eliminovaný zvýšeným energetickým príjmom, relatívne predávkovanie môže mať za následok
prehnané zníženie glukózy spojené so sprievodnými hypoglykemickými príznakmi (závrat,
potenie, tremor, bolesť hlavy a pod.). Keď sa objavia tieto príznaky, adekvátnou reakciou na ne je zvýšenie nízkej hladiny glukózy v krvi (perorálne sacharidmi).Ťažká hypoglykémia spojená so
záchvatmi, stratou vedomia alebo kómou musí byť liečená intravenózne podanou glukózou.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antidiabetiká, iné antidiabetiká s výnimkou inzulínov , ATC kód: A10B X02
SpôsobúčinkuRepaglinid je perorálna látka stimulujúca vylučovanie inzulínu, s krátkodobým účinkom. Repaglinid znižuje hladinu glukózy v krvi náhlym uvoľnením inzulínu z pankreasu. Účinok je závislý na funkčnosti ß-buniek v ostrovčekoch pankreasu.
Na rozdiel od iných látok stimulujúcich sekréciu, repaglinid zatvára na ATP závislé draslíkové
kanály cez cieľovú bielkovinu v ß-bunkách. Táto depolarizácia ß-buniek vedie k otvoreniu
vápnikových kanálov. Výsledkom je zvýšenie prílevu vápnika, ktorý indukuje vylučovanie
inzulínu z ß-bunky.
FarmakodynamickéúčinkyU pacientov s diabetom 2. typu sa inzulinotropná odpoveď na jedlo objavuje počas 30 minút po
podaní perorálnej dávky repaglinidu. Výsledkom je zníženie glukózy počas jedla. Zvýšená hladina inzulínu nepretrváva v dobe medzi jedlami. Hladina repaglinidu v plazme sa rýchlo znižuje a u pacientov s diabetom 2. typu boli zistené nízke koncentrácie v plazme po 4 hodinách od užitia.
KlinickáúčinnosťabezpečnosťNa dávke závislé zníženie glukózy v krvi bolo dokázané u diabetikov 2. typu, ktorí dostávali repaglinid v dávkach 0,5 až 4 mg.
Klinické štúdie dokázali, že repaglinid je vhodné dávkovať v závislosti na hlavnom jedle
(preprandiálne dávkovanie).
Dávky sú obvykle podávané 15 minút pred jedlom, ale čas sa môže meniť od doby bezprostredne
pred jedlom až po 30 minút pred jedlom.
Jedna epidemiologická štúdia naznačila zvýšené riziko výskytu akútneho koronárneho syndrómu u pacientov liečených repaglinidom, v porovnaní s pacientami liečenými sulfonylureou (pozri časti 4.4 a 4.8).
5.2 Farmakokinetické vlastnosti
A
bsorpcia
Repaglinid je rýchlo vstrebávaný tráviacim traktom a rýchlo sa zvyšuje koncentrácia liečiva v
plazme. Vrchol jeho hladiny v plazme sa dosahuje za hodinu po podaní. Po dosiahnutí maxima, hladina v plazme rýchlo klesá
Farmakokinetika repaglinidu je charakterizovaná priemernou absolútnou biologickou
dostupnosťou, ktorá je 63% (CV 11%).
Nezistili sa žiadne klinicky relevantné rozdiely vo farmakokinetike repaglinidu pri podávaní 0, 15
alebo 30 minút pred jedlom alebo nalačno.
V klinických štúdiách sa zistila vysoká interindividuálna variabilita (60 %) plazmatickej koncentrácie repaglinidu. Intraindividuálna variabilita je nízka až stredná (35 %) a keďže je repaglinid potrebné titrovať s ohľadom na klinickú odpoveď, účinnosť nie je ovplyvnená interindividuálnou variabilitou.
Distribúcia
Farmakokinetika repaglinidu je charakteristická nízkym distribučným objemom 30 l
(konzistentné s distribúciou do medzibunkovej tekutiny) a vysokou väzbovosťou na plazmatické
bielkoviny u ľudí (vyššia než 98 %).
Eliminácia
Repaglinid sa z krvi eliminuje rýchlo, do 4–6 hodín. Polčas eliminácie z plazmy je približne jedna hodina.
Repaglinid sa takmer úplne metabolizuje a neboli identifikované žiadne metabolity s klinicky
významným hypoglykemickým účinkom.
Metabolity repaglinidu sa primárne vylučujú žlčou. Malá časť (menej než 8 %) podanej dávky sa objaví v moči, primárne v podobe metabolitov. Menej než 1 % repaglinidu sa vylučuje stolicou.
Osobitné skupiny pacientov
Expozícia repaglinidom je zvýšená u diabetikov 2. typu s pečeňovou nedostatočnosťou a aj u
starších pacientov. AUC (SD) po 2 mg jednorazovej dávke (4 mg u pacientov s pečeňovou nedostatočnosťou) bol 31,4 ng/ml x hodina (28,3) u zdravých dobrovoľníkov, 304,9 ng/ml x hodina (228,0) u pacientov s pečeňovou nedostatočnosťou a 117,9 ng/ml x hodina (83,8) u starších pacientov s diabetom 2. typu.
Po piatich dňoch liečby repaglinidom (2 mg x 3/deň) u pacientov s ťažkým poškodením funkcie obličiek (klírens kreatinínu: 20-39 ml/minútu), výsledky ukazujú dvojnásobné signifikantné
zvýšenie expozície (AUC) a polčasu (t1/2) v porovnaní s pacientmi s normálnou funkciou obličiek.
Deti a dospievajúci
K dispozícii nie sú žiadne údaje.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
V štúdiách u zvierat sa preukázalo, že repaglinid nemá teratogénny účinok. U plodov
a novonarodených mláďat samíc potkanov vystavených v poslednom štádiu tehotenstva
a v priebehu laktácie vysokým dávkam repaglinidu sa zistila embryotoxicita a vývin abnormálnej
končatiny. Repaglinid bol detegovaný v mlieku zvierat.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokCelulóza, mikrokryštalická (E460) Hydrogénfosforečnan vápenatý, bezvodný Kukuričný škrob
Povidón
Glycerín Magnéziumstearát Meglumín Poloxamér 188
Žltý kysličník železitý (E172)
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaBlistre hliník/hliník v baleniu obsahujúcom 30, 90, 120, 180 alebo 270 tabliet.
Fľaštička z HDPE obsahujúca 100 tabliet v baleniu o 1 fľaštičke.Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAccord Healthcare Limited,
Sage house, 319 Pinner Road, Harrow, HA1 4HF
Veľká Británia
8. REGISTRAČNÉ ČÍSLO(
ČÍSLA)EU/1/11/743/006-009, EU/1/11/743/010, EU/1/11/743/017
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 22. prosince 2011
Dátum posledného predĺženia registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.1. NÁZOV LIEKURepaglinide Accord 2 mg tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá tableta obsahuje 2 mg repaglinidu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMATableta
Broskyňovej farby, okrúhle, bikonvexné neobaľované tablety so skosenými hranami a vyrytým označením „R“ na jednej strane a bez označenia na druhej strane, ktoré môžu mať škvrnitý povrch.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieRepaglinid je indikovaný u dospelých s diabetes mellitus 2.typu u ktorých sa hyperglykémiu už nedarí uspokojivo liečiť diétou, znižovaním hmotnosti a cvičením. Repaglinid je tiež indikovaný u dospelých s diabetes mellitus 2. typu v kombinácii s metformínom, keď samostatná liečba metformínom je nedostatočná.
Liečba má byť iniciovaná ako doplnok diéty a cvičení na zníženie glukózy v krvi v závislosti od
jedla.
4.2 Dávkovanie a spôsob podávaniaDávkovanieRepaglinid je podávaný tesne pred jedlom a je určený individuálne aby sa optimalizovala kontrola glykémie. Okrem toho obvykle pacient sám sleduje hladinu glukózy v krvi a/alebo v moči. Hladina glukózy v krvi pacienta musí byť pravidelne sledovaná lekárom, aby mohol určiť minimálnu účinnú dávku. Ako odpoveď na liečbu sa u pacienta sleduje hladina glykovaného hemoglobínu. Pravidelné sledovanie je potrebné na odhalenie neprimeraného zníženia glukózy v krvi pri odporúčanej maximálnej dávke (napr. primárne zlyhanie) a na detekciu straty adekvátnej odpovede zníženia glukózy v krvi po počiatočnom období účinnosti (napr. sekundárne zlyhanie).
Krátkodobé podávanie repaglinidu môže byť dostatočné počas obdobia prechodného poklesu
kontroly u pacientov s diabetom 2. typu, obvykle dobre kompenzovaných diétou.
ZačiatočnádávkaDávka má byť určená lekárom podľa potreby pacienta.
Odporučená počiatočná dávka je 0,5 mg. Medzi dvomi titračnými krokmi musia byť jeden až dva týždne (čo je podmienené odpoveďou glukózy v krvi).
Ak sú pacienti prestavovaní z iného perorálneho antidiabetika, odporúčaná počiatočná dávka je
1 mg.
Udržiavacia dávkaOdporučená jednorazová maximálna dávka je 4 mg užitá s hlavným jedlom.
Celková maximálna denná dávka nesmie prekročiť 16 mg.'
Osobitné skupiny pacientovStarší pacientiNeuskutočnili sa žiadne klinické štúdie u pacientov >75 rokov.
Porucha funkcie obličiekRepaglinid nie je ovplyvnený ochorením obličiek (pozri časť 5.2).
Osem percent jednej dávky repaglinidu je vylučovaných obličkami a celkový klírens lieku v plazme je znížený u pacientov s poškodením funkcie obličiek. U diabetických pacientov
s poškodením funkcie obličiek je zvýšená citlivosť na inzulín, preto je potrebná opatrnosť pri
titrovaní dávky u týchto pacientov.
Porucha funkcie pečeneNeuskutočnili sa žiadne klinické štúdie u pacientov s pečeňovou nedostatočnosťou
Oslabení alebo podvyživení pacientiU oslabených alebo podvyživených pacientov počiatočná a udržiavacia dávka musí byť opatrne titrovaná a požadovanú dávku treba starostlivo voliť tak, aby nedochádzalo ku hypoglykémiám.
Pacienti liečení inými perorálnymi antidiabetikamiPacienti môžu byť priamo prestavení z iných perorálnych antidiabetík na repaglinid. Nie je stanovený presný vzťah medzi dávkovaním repaglinidu a ostatnými perorálnymi antidiabetikami. Odporučená maximálna počiatočná dávka u týchto pacientov je 1 mg užitá pred hlavným jedlom.
Repaglinid môže byť užívaný v kombinácii s metformínom v tých prípadoch, keď metformín sám nie je schopný dostatočne kontrolovať hladinu glukózy v krvi. V týchto prípadoch dávka metformínu má byť udržiavacia a repaglinid podávaný sprievodne. Počiatočná dávka repaglinidu je 0,5 mg podávaná pred hlavným jedlom, za sledovania hladiny glukózy v krvi, tak ako pri monoterapii.
Deti a dospievajúciBezpečnosť a účinnosť repaglinidu u detí vo veku menej ako 18 rokov neboli stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podaniaRepaglinid sa užíva pred hlavným jedlom (t. j. tesne pred jedlom).
Dávky sa obyčajne užívajú 15 minút pred jedlom, ale možno ich užívať od 30 minút pred jedlom až tesne pred nadchádzajúcim jedlom (t. j. tesne druhým, tretím alebo štvrtým denným jedlom). Pacienti, ktorí vynechali jedlo (alebo pridali jedlo navyšše), musia byť poučení o vynechaní (alebo pridaní) dávky pri tomto jedle.
V prípade súbežného použitia iných liečiv pozri časti 4.4 a 4.5 na stanovenie dávky.
4.3 Kontraindikácie• Precitlivenosť na repaglinid alebo na ktorúkoľvek z pomocných látok uvedených v časti
6.1.
• Diabetes mellitus 1. typu negatívny C- peptid
• Diabetická ketoacidóza, s kómou alebo bez kómy
• Vážne poruchy funkcie pečene
• Súčasné užívanie gemfibrozilu (pozri časť 4.5)
4.4 Osobitné upozornenia a opatrenia pri používaníVšeobecneRepaglinid má byť predpísaný ak je slabá kontrola glukózy v krvi a symptómy diabetu trvajú aj napriek primeraným snahám s diétou, cvičením a redukciou hmotnosti.
Keď je pacient, stabilizovaný na niektorom perorálnom antidiabetiku, vystavený stresom ako horúčka, trauma, infekcia alebo operácia môže prísť ku strate kontroly nad glykémiou. V tomto období môže byť potrebné prerušiť liečbu repaglinidom a dočasne prejsť na liečbu inzulínom.
HypoglykémiaRepaglinid podobne ako iné látky stimulujúce, môže spôsobiť hypoglykémiu.
Kombinácia so sekretagogami inzulínuÚčinok na pokles glukózy v krvi sa môže pri liečbe perorálnymi antidiabetikami u pacientov časom znížiť. Tento fakt môže byť zapríčinený postupujúcou závažnosťou cukrovky alebo
zníženou odpoveďou na liek. Tento fenomén je známy ako sekundárne zlyhanie, na rozdiel od primárneho zlyhania liečby, kedy liek je neefektívny u pacientov, ktorým je podávaný prvý raz.
Odhadnúť, či ide o pacienta so sekundárnym zlyhaním liečby je možné až po úprave dávky a pri
dodržaní diéty a cvičení.
Repaglinid sa viaže na určité miesta s krátkodobým pôsobením na ß-bunky. Použitie repaglinidu
v prípade sekundárneho zlyhania látok stimulujúcich sekréciu inzulínu nebolo klinicky sledované. Klinické testy skúmajúce kombinácie s inými látkami stimulujúcimi sekréciu inzulínu neboli
robené.
Kombinácia s Neutrálnym Protamínom Hagedorn (NPH) inzulínom alebo tiazolidíndiónmi Boli uskutočnené štúdie s kombinovanou liečbou s (NPH) inzulínom alebo tiazolidendiónmi. Avšak profil prínosu rizika treba stanoviť v porovnaní s inými kombinovanými liečbami.
Kombinácia s metformínomKombinovaná liečba s metformínom je spojená so zvýšeným rizikom hypoglykémie.
Akútny koronárny syndrómPoužitie repaglinidu môže byť spojené so zvýšeným výskytom akútneho koronárneho syndrómu
(napr. infarkt myokardu), pozri časti 4.8 a 5.1.
SúčasnépodávanieRepaglinid musí byť použitý s opatrnosťou alebo sa použitiu treba vyhnúť u pacientov, ktorí užívajú lieky s účinkom na metabolizmus repaglinidu (pozri časť 4.5). Ak je nevyhnutné spoločné podávanie, musí sa starostlivo sledovať hladina glukózy v krvi a musí byť vykonávané dôsledné klinické sledovanie.
4.5 Liekové a iné interakcieO mnohých liekoch je známe, že, ovplyvňujú metabolizmus repaglinidu. Preto má lekár brať do
úvahy možné interakcie:
In vitro údaje ukazujú, že repaglinid je prednostne metabolizovaný CYP2C8, ale aj CYP3A4. Klinické údaje u zdravých dobrovoľníkov podporujú predpoklad, že CYP2C8 je najdôležitejším enzýmom zahrnutým v metabolizme repaglinidu s CYP3A4, ktorý zohráva menšiu úlohu, ale relatívny prínos CYP3A4 môže byť zvýšený, ak CYP2C8 je inhibovaný. Teda metabolizmus, a tým klírens repaglinidu, môže byť zmenený látkami, ktoré ovplyvňujú enzýmy cytochrómu P-
450 inhibíciou alebo indukciou. Mimoriadna opatrnosť musí byť zabezpečená pri súčasnom
podávaní oboch inhibítorov CYP2C8 a 3A4 spolu s repaglinidom.
Na základe
in vitro údajov, repaglinid sa zdá byť substrátom pre účinnú pečeňovú absorpciu (organický anión transportujúci proteín OATP1B1). Látky, ktoré inhibujú OATP1B1, môžu mať tiež schopnosť zvýšiť plazmové koncentrácie repaglinidu, ako to bolo ukázané pre cyklosporín (pozri nižšie).
Nasledujúce látky môžu zvyšovať a/alebo predlžovať hypoglykemický vplyv repaglinidu: gemfibrozil, klaritromycín, itrakonazol, ketokonazol, trimetoprim, cyklosporín, deferasirox, klopidogrel, iné antidiabetické liečivá, inhibítory monoaminooxidázy (IMAO), neselektívne betablokátory, inhibítory angiotenzín konvertujúceho enzýmu (ACE), salicyláty, NSAIDs, oktreotid, alkohol a anabolické steroidy.
U zdravých dobrovoľníkov súčasné podávanie gemfibrozilu (600 mg dvakrát denne), inhibítora
CYP2C8 a repaglinidu (jednotlivá dávka 0,25 mg), zvyšuje AUC repaglinidu 8,1 násobne a Cmax
2,4 násobne. Biologický polčas sa predĺžil z 1,3 na 3,7 hodiny, čo môže viesť k zosilneniu a
predĺženiu repaglinidového efektu zníženia hladiny glukózy v krvi a koncentrácia repaglinidu v plazme po 7. hodine sa účinkom gemfibrozilu zvýšila 28,6 násobne. Súčasné podávanie
gemfibrozilu a repaglinidu je kontraindikované (pozri časť 4.3).
Súčasné podávanie trimetoprimu (160 mg dvakrát denne), slabého inhibítora CYP2C8 a repaglinidu (jednotlivá dávka 0,25 mg) spôsobuje zvýšenie AUC, Cmax and t½ (1,6 násobne,
1,4 násobne a 1,2 násobne) repaglinidu, so štatisticky nevýznamným efektom na hladiny glukózy
v krvi. Tento nedostatočný farmakodynamický efekt bol pozorovaný pri nižšej než terapeutickej dávke repaglinidu. Pretože bezpečnostný profil tejto kombinácie nebol stanovený pre dávky repaglinidu vyššie ako 0,25 mg a 320 mg pre trimetoprim, súčasnému používaniu trimetoprimu s repaglinidom by sa malo vyhnúť. Ak je nevyhnutné spoločné používanie, musí sa starostlivo sledovať hladina glukózy v krvi a musí byť vykonávané dôsledné klinické sledovanie (pozri časť
4.4).
Rifampicín, možný induktor CYP3A4 ale tiež CYP2C8 účinkuje aj ako induktor a aj inhibítor metabolizmu repaglinidu. Sedemdňová prípravná liečba s rifampicínom (600 mg), nasledovaná spoločným podávaním s repaglinidom (jednotlivá dávka 4 mg), mala na 7. deň za následok 50% zníženie AUC (kombinovaný účinok indukcie aj inhibície). Ak bol repaglinid podaný 24 hodín po poslednej dávke rifampicínu, bola pozorovaná 80% redukcia AUC repaglinidu (účinok samotnej indukcie). Súčasné podávanie rifampicínu a repaglinidu by si preto mohlo vyžiadať úpravu dávky repaglinidu, ktorá musí byť založená na starostlivom sledovaní koncentrácií glukózy v krvi pri oboch iniciáciách liečby rifampicínom (akútna inhibícia), pri nasledujúcom dávkovaní (zmiešaná inhibícia a indukcia) a pri ukončení liečby (indukcia samotná). Približne dva týždne po ukončení liečby rifampicínom, sa už induktívny efekt rifampicínu neprejavuje. Nie je možné vylúčiť, že iné
induktory, napr. fenytoín, karbamazepín, fenobarbital, ľubovník bodkovaný, môžu mať podobný účinok.
Bol sledovaný účinok ketokonazolu, prototypu účinného a kompetitívneho inhibítora CYP3A4, na farmakokinetiku repaglinidu u zdravých jedincov. Súčasné podávanie 200 mg ketokonazolu zvýšilo repaglinid (AUC a Cmax) 1,2 násobne s profilmi koncentrácií glukózy v krvi zmenené o menej ako 8%, keď je podávaný súčasne (jednotlivá dávka 4 mg repaglinidu). Tiež bolo sledované súčasné podávanie 100 mg itrakonazolu, inhibítora CYP3A4 u zdravých dobrovoľníkov, pričom AUC vzrástla 1,4 násobne. Nepreukázal sa významný efekt na hladinu glukózy u zdravých dobrovoľníkov. V interakčnej štúdii na zdravých dobrovoľníkoch, súbežné podávanie 250 mg klaritromicínu, silného inhibítora mechanizmu CYP3A4 nepatrne zvýšilo AUC repaglinidu 1,4 násobne a Cmax 1,7 násobne a zvýšilo stredný prírastok AUC sérového inzulínu 1,5 násobne a maximálnu koncentráciu 1,6 násobne. Presný mechanizmus tejto interakcie nie je objasnený.
V štúdii uskutočnenej na zdravých dobrovoľníkoch, súčasné podávanie repaglinidu (jednotlivá
dávka 0,25 mg) a cyklosporínu (opakovaná dávka 100 mg) zvyšovalo AUC repaglinidu
2,5 násobne a Cmax repaglinidu 1,8 násobne. Pretože nebola stanovená interakcia pre dávky vyššie ako 0,25 mg pre repaglinid, musí byť zamedzené súčasnému použitiu cyklosporínu
s repaglinidom. Ak sa javí kombinácia ako nevyhnutná, musí byť vykonávaný starostlivý klinický
monitoring a monitoring hladiny glukózy v krvi (pozri časť 4.4).
V interakčnej štúdii so zdravými dobrovoľníkmi viedlo súbežné podávanie deferasiroxu
(30 mg/kg/deň, 4 dni), slabého inhibítora CYP2C8 a CYP3A4 a repaglinidu (jednotlivá dávka,
0,5 mg) k zvýšeniu systémovej expozície repaglinidu (AUC) na 2,3-násobok (90% IS [2,03-
2,63]) kontroly, 1,6-násobnému (90% IS [1,42-1,84]) zvýšeniu Cmax a miernemu signifikantnému
zníženiu glykémie. Vzhľadom nato, že interakcia nebola stanovená s dávkami repaglinidu
vyššími ako 0,5 mg, súbežnému užívaniu deferasiroxu s repaglinidom sa treba vyhnúť. Ak je táto
kombinácia nevyhnutná, má sa vykonávať starostlivé klinické monitorovanie a monitorovanie
glukózy v krvi (pozri časť 4.4).
V interakčnej štúdií so zdravými dobrovoľníkmi, pri súbežnom podávaní klopidogrelu (300 mg počiatočná saturačná dávka), CYP2C8 inhibítora, sa zvýšila expozícia repaglinidu (AUC0–∞)
5,1- násobne a pri pokračovaní dávkou (75 mg denná dávka) sa zvýšila expozícia repaglinidu
(AUC0–∞) 3,9-násobne. Bolo pozorované malé, signifikantné zníženie hodnoty glykémie.
Pretože nebol stanovený bezpečnostný profil pacientov pri súbežnej liečbe, je potrebné vyhnúť sa
súbežnému užívaniu klopidogrelu a repaglinidu. Ak je nevyhnutné súbežné podávanie, má sa starostlivo sledovať hladina glukózy v krvi a má sa vykonávať dôsledné klinické sledovanie (pozri časť 4.4).
ß- blokátory môžu maskovať príznaky hypoglykémie.
Súčasné podávanie cimetidínu, nifedipínu, estrogénu alebo simvastatínu s repaglinidom, všetky
substráty CYP3A4 nezmenili signifikantne farmakokinetické parametre repaglinidu.
Repaglinid nemal klinicky relevantný vplyv na farmakokinetické vlastnosti digoxínu, teofylínu alebo warfarínu v ustálenom stave, keď bol podávaný zdravým dobrovoľníkom. Preto nie je potrebná úprava dávkovania týchto látok, keď sú podávané spolu s repaglinidom.
Nasledujúce látky môžu znižovať hypoglykemický vplyv repaglinidu:
perorálne kontraceptíva, rifampicín, barbituráty, karbamazepín, tiazidy, kortikosteroidy, danazol, tyroidné hormóny a sympatikomimetiká.
Ak sú pacientovi užívajúcemu repaglinid tieto lieky predpísané alebo ich užívanie je zrušené,
pacient musí byť dôkladne sledovaný kvôli zmenám hladiny cukru v krvi.
Keď je repaglinid užívaný spolu s inými liekmi ktoré sú prevažne vylučované žlčou, tak ako repaglinid, je potrebné vziať do úvahy ich možné interakcie.
Deti a dospievajúci
U detí a dospievajúcich sa neuskutočnili žiadne interakčné štúdie.
4.6 Fertilita, gravidita a laktácia
Gravidita
U gravidných žien sa neuskutočnili štúdie s repaglinidom. Repaglinid sa nemá predpisovať
gravidným ženám.
Laktácia
U dojčiacich žien sa neuskutočnili štúdie s repaglinidom. Repaglinid nemajú užívať dojčiace
ženy.
Fertilita
Údaje zo štúdií na zvieratách skúmajúcich účinky na embryonálny vývoj a na vývoj potomstva,
ako aj vylučovanie do materského mlieka je popísaný v časti 5.3.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Repaglinid nemá priamy vplyv na schopnosť viesť vozidlá a obsluhovať stroje, ale môže spôsobiť
hypoglykémiu.
Pacienti majú posúdiť predbežné opatrenia, aby sa vyvarovali hypoglykémii pri vedení vozidla. Toto je obzvlášť dôležité u tých pacientov, ktorí majú zníženú alebo im chýba schopnosť uvedomiť si varovné signály hypoglykémie alebo sa hypoglykémia u nich často opakuje. Za týchto okolností má byť zvážená schopnosť viesť vozidlo.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie hlásenými nežiaducimi reakciami sú zmeny hladiny glukózy v krvi, napr. hypoglykémia. Výskyt týchto reakcií závisí od individuálnych faktorov, ako sú stravovacie návyky, dávkovanie, pohybová aktivita a stres.
Tabuľkovýzoznam nežiaducich reakcií
Na základe skúseností s repaglinidom a inými antidiabetikami sa vyskytli nasledovné nežiadúce
reakcie : frekvencie výskytu sú definované ako: časté (≥1/100 až <1/10); menej časté (≥1/1000 až
<1/100); zriedkavé (≥ 1/10 000 až < 1/1000); veľmi zriedkavé (< 1/10 000); a neznáme
(z dostupných údajov).

Poruchy imunitného systému
Alergické reakcie* Veľmi zriedkavé
Poruchy metabolizmu
Hypoglykémia Časté
a výživy
Hypoglykemická kóma a hypoglykemické bezvedomie
Neznáme
Poruchy oka Refračné poruchy* Veľmi zriedkavé
Poruchy srdca a srdcovej
činnosti Poruchy gastrointestinálneho traktu
Kardiovaskulárne ochorenie Zriedkavé
Bolesť brucha, hnačka Časté
Vracanie, zácpa Veľmi zriedkavé
Nauzea Neznáme
Poruchy pečene a žlčových
ciest
Abnormálna funkcia pečene,zvýšenie pečeňových enzýmov*
Veľmi zriedkavé
Poruchy kože
a podkožného tkaniva
Hypersenzitivita* Neznáme
*pozri časť Opis vybraných nežiaducich reakcií, nižšie
Opis vybraných nežiaducich reakciíAlergické reakcieGeneralizované reakcie z precitlivenosti (napr. anafylaktická reakcia) alebo imunilogické reakcie také ako vaskulitída.
Refrakčné poruchyJe známe, že zmeny hladiny glukózy v krvi môžu viesť k prechodným poruchám zraku, najmä na
začiatku liečby. Takéto poruchy boli hlásené iba v niekoľkých prípadoch po začatí liečby
repaglinidom. Žiadny z takýchto prípadov neviedol v klinických štúdiách k ukončeniu liečby
repaglinidom.
Abnormálna funkcia pečene,zvýšené hladiny pečeňových enzýmovOjedinelé prípady zvýšenia hladín pečeňových enzýmov boli hlásené počas liečby repaglinidom. Väčšina prípadov bola mierna a prechodná, a veľmi málo pacientov ukončilo liečbu kvôli
zvýšeným hladinám pečeňových enzýmov. Vo veľmi zriedkavých prípadoch bola hlásená
závažná dysfunkcia pečene.
HypersenzitivitaMôžu sa objaviť reakcie precitlivenosti na koži, ako je sčervenanie kožesvrbenie, vyrážky a žihľavka. Nie je dôvod na podozrenie na skríženú alergiu so sulfonylureou v dôsledku rozdielu v
chemickej štruktúre.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 Predávkovanie
Repaglinid bol podávaný so zvyšujúcou sa týždennou dávkou 4 - 20 mg štyrikrát denne, po dobu
6 týždňov. Neobjavili sa obavy ohľadom bezpečnosti. Výskyt hypoglykémie v tejto štúdii bol eliminovaný zvýšeným energetickým príjmom, relatívne predávkovanie môže mať za následok prehnané zníženie glukózy spojené so sprievodnými hypoglykemickými príznakmi (závrat, potenie, tremor, bolesť hlavy a pod.). Keď sa objavia tieto príznaky, adekvátnou reakciou na ne je zvýšenie nízkej hladiny glukózy v krvi (perorálne sacharidmi).Ťažká hypoglykémia spojená so záchvatmi, stratou vedomia alebo kómou musí byť liečená intravenózne podanou glukózou.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina:Antidiabetiká, iné antidiabetiká s výnimkou inzulínov , ATC kód: A10B X02
Spôsobúčinku
Repaglinid je perorálna látka stimulujúca vylučovanie inzulínu, s krátkodobým účinkom. Repaglinid znižuje hladinu glukózy v krvi náhlym uvoľnením inzulínu z pankreasu. Účinok je
závislý na funkčnosti ß-buniek v ostrovčekoch pankreasu.
Na rozdiel od iných látok stimulujúcich sekréciu, repaglinid zatvára na ATP závislé draslíkové kanály cez cieľovú bielkovinu v ß-bunkách. Táto depolarizácia ß-buniek vedie k otvoreniu vápnikových kanálov. Výsledkom je zvýšenie prílevu vápnika, ktorý indukuje vylučovanie inzulínu z ß-bunky.
Farmakodynamickéúčinky
U pacientov s diabetom 2. typu sa inzulinotropná odpoveď na jedlo objavuje počas 30 minút po
podaní perorálnej dávky repaglinidu. Výsledkom je zníženie glukózy počas jedla. Zvýšená
hladina inzulínu nepretrváva v dobe medzi jedlami. Hladina repaglinidu v plazme sa rýchlo znižuje a u pacientov s diabetom 2. typu boli zistené nízke koncentrácie v plazme po 4 hodinách od užitia.
Klinickáúčinnosťabezpečnosť
Na dávke závislé zníženie glukózy v krvi bolo dokázané u diabetikov 2. typu, ktorí dostávali repaglinid v dávkach 0,5 až 4 mg.
Výsledky klinických štúdií dokázali, že repaglinid je vhodné dávkovať v závislosti na hlavnom
jedle (preprandiálne dávkovanie).
Dávky sú obvykle podávané 15 minút pred jedlom, ale čas sa môže meniť od doby bezprostredne pred jedlom až po 30 minút pred jedlom.
Jedna epidemiologická štúdia naznačila zvýšené riziko výskytu akútnehokoronárneho syndrómu u pacientov liečených repaglinidom, v porovnaní s pacientami liečenými sulfonylureou (pozri časti 4.4 a 4.8).
5.2 Farmakokinetické vlastnosti
Absorpcia
Repaglinid je rýchlo vstrebávaný tráviacim traktom a rýchlo sa zvyšuje koncentrácia liečiva v plazme. Vrchol jeho hladiny v plazme sa dosahuje za hodinu po podaní. Po dosiahnutí maxima, hladina v plazme rýchlo klesá
Farmakokinetika repaglinidu je charakterizovaná priemernou absolútnou biologickou
dostupnosťou, ktorá je 63% (CV 11%),
Nezistili sa žiadne klinicky relevantné rozdiely vo farmakokinetike repaglinidu pri podávaní 0, 15
alebo 30 minút pred jedlom alebo nalačno.
V klinických štúdiách sa zistila vysoká interindividuálna variabilita (60 %) plazmatickej koncentrácie repaglinidu. Intraindividuálna variabilita je nízka až stredná (35 %) a keďže je repaglinid potrebné titrovať s ohľadom na klinickú odpoveď, účinnosť nie je ovplyvnená interindividuálnou variabilitou.
Distribúcia
Farmakokinetika repaglinidu je charakteristická nízkym distribučným objemom 30 l (konzistentné s distribúciou do medzibunkovej tekutiny) a vysokou väzbovosťou na plazmatické bielkoviny u ľudí (vyššia než 98 %).
Eliminácia
Repaglinid sa z krvi eliminuje rýchlo, do 4–6 hodín. Polčas eliminácie z plazmy je približne jedna
hodina.
Repaglinid sa takmer úplne metabolizuje a neboli identifikované žiadne metabolity s klinicky významným hypoglykemickým účinkom.
Metabolity repaglinidu sa primárne vylučujú žlčou. Malá časť (menej než 8 %) podanej dávky sa objaví v moči, primárne v podobe metabolitov. Menej než 1 % repaglinidu sa vylučuje stolicou.
Osobitné skupiny pacientov
Expozícia repaglinidom je zvýšená u diabetikov 2. typu s pečeňovou nedostatočnosťou a aj u
starších pacientov. AUC (SD) po 2 mg jednorazovej dávke (4 mg u pacientov s pečeňovou nedostatočnosťou) bol 31,4 ng/ml x hodina (28,3) u zdravých dobrovoľníkov, 304,9 ng/ml x
hodina (228,0) u pacientov s pečeňovou nedostatočnosťou a 117,9 ng/ml x hodina (83,8) u
starších pacientov s diabetom 2. typu.
Po piatich dňoch liečby repaglinidom (2 mg x 3/deň) u pacientov s ťažkým poškodením funkcie obličiek (klírens kreatinínu: 20-39 ml/minútu), výsledky ukazujú dvojnásobné signifikantné
zvýšenie expozície (AUC) a polčasu (t1/2) v porovnaní s pacientmi s normálnou funkciou obličiek.
Deti a dospievajúci
K dispozícii nie sú žiadne údaje
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
V štúdiách u zvierat sa preukázalo, že repaglinid nemá teratogénny účinok. U plodov
a novonarodených mláďat samíc potkanov vystavených v poslednom štádiu tehotenstva
a v priebehu laktácie vysokým dávkam repaglinidu, sa zistila embryotoxicita a vývin abnormálnej
končatiny. Repaglinid bol detegovaný v mlieku zvierat.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Celulóza, mikrokryštalická (E460) Hydrogénfosforečnan vápenatý, bezvodný Kukuričný škrobPovidón
Glycerín
Magnéziumstearát
Meglumín
Poloxamér 188
Červený kysličník železitý (E172)
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaBlistre hliník/hliník v baleniu obsahujúcom 30, 90, 120, 180 alebo 270 tabliet.
Fľaštička z HDPE obsahujúca 100 tabliet v baleniu o 1 fľaštičke. Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAccord Healthcare Limited,
Sage house, 319 Pinner Road, Harrow, HA1 4HF
Veľká Británia
8. REGISTRAČNÉ ČÍSLO(
ČÍSLA)EU/1/11/743/011-014, EU/1/11/743/015, EU/1/11/743/018
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE