
to, že rasagilín zosilňuje účinky levodopy, môžu sa zvýšiť nežiaduce reakcie levodopy a existujúca dyskinéza sa môže zhoršiť. Znížením dávky levodopy sa môžu tieto nežiaduce reakcie zmierniť.
Pri súčasnom užívaní rasagilínu s levodopou boli zaznamenané hypotenzné účinky. Pacienti
s Parkinsonovou chorobou sú vzhľadom na problémy s chôdzou obzvlášť citliví na výskyt nežiaducich reakcií hypotenzie.
Dopaminergné účinky
Nadmerná ospanlivosť počas dňa (excessive daytime sleepiness, EDS) a epizódy náhleho upadnutia do
spánku (sudden sleep onset, SOS)
Rasagilín môže spôsobiť ospanlivosť počas dňa, somnolenciu a niekedy, najmä ak sa užíva s inými dopaminergnými liekmi, zaspávanie počas každodenných činností. Pacientov je potrebné o tom informovať a odporučiť im, aby boli pri vedení vozidiel a obsluhovaní strojov počas liečby rasagilínom opatrní. Pacienti, u ktorých sa vyskytne somnolencia a/alebo epizóda náhleho upadnutia
do spánku nesmú viesť vozidlá a obsluhovať stroje (pozri časť 4.7).
Poruchy kontroly impulzov (impulse control disorders, ICD)
U pacientov liečených dopamínovými agonistami a/alebo pri inej dopamínergickej liečbe môže vzniknúť ICD. Podobné hlásenia týkajúce sa poruchy kontroly impulzov boli zaznamenané postmarketingovo u rasagilínu. Pacienti majú byť pravidelne monitorovaní kvôli rozvinutiu porúch
kontroly impulzov.
Pacientov a ich ošetrujúcich je potrebné upozorniť na prejavy v správaní pri poruchách kontroly impulzov, ktoré boli pozorované u pacientov liečených rasagilínom vrátane prípadov nutkania, obsesívnych myšlienok, patologického hráčstva, zvýšeného libida, hypersexuality, impulzívneho spravania sa, chorobného utrácania alebo nakupovania.
Melanóm
Výskyt prípadov melanómu počas programu klinického vývoja upriamil pozornosť na možné spojenie
s rasagilínom. Zozbierané údaje naznačujú, že Parkinsonova choroba, a nie žiaden konkrétny liek, je
spojená so zvýšeným rizikom rakoviny kože (nie výlučne melanómu). Akékoľvek podozrivé poškodenie kože má prehodnotiť špecialista.
Porucha funkcie pečene
Pri začatí liečby rasagilínom je potrebná zvýšená opatrnosť u pacientov s miernou poruchou funkcie
pečene. Je potrebné vyvarovať sa podávaniu rasagilínu pacientom so stredne ťažkou poruchou funkcie pečene. Liečba rasagilínom sa má ukončiť v prípade, že sa porucha funkcie pečene zhorší z mierneho na stredne ťažký stupeň (pozri časť 5.2).
4.5 Liekové a iné interakcie
Inhibítory MAO
Rasagilín je kontraindikovaný spolu s inými inhibítormi MAO (vrátane liekov a prírodných
prípravkov, ktoré nie sú viazané na lekársky predpis, ako napríklad ľubovník bodkovaný), pretože nastáva riziko neselektívnej inhibície MAO, ktorá môže spôsobiť hypertenznú krízu (pozri časť 4.3).
Petidín
Vážne nežiaduce reakcie boli zaznamenané pri súčasnom podávaní petidínu a inhibítorov MAO
vrátane iných selektívnych inhibítorov MAO-B. Súčasné podávanie rasagilínu a petidínu je kontraindikované (pozri časť 4.3).
Sympatomimetiká
Boli zaznamenané liekové interakcie pri súčasnom podávaní inhibítorov MAO a sympatomimetík.
Vzhľadom na inhibičnú aktivitu rasagilínu voči MAO sa neodporúča súčasné používanie rasagilínu a takých sympatomimetík aké sú prítomné v nosových a orálnych dekongestívach alebo liekov na nádchu, ktoré obsahujú efedrín alebo pseudoefedrín (pozri časť 4.4).
Dextrometorfán
Boli zaznamenané liekové interakcie pri súčasnom podaní dextrometorfánu a neselektívnych
inhibítorov MAO. Vzhľadom na inhibičnú aktivitu rasagilínu voči MAO sa súčasné podávanie rasagilínu a dextrometorfánu neodporúča (pozri časť 4.4).
SNRI/SSRI/tricyklické a tetracyklickéantidepresíva
Je potrebné vyvarovať sa súčasnému podávaniu rasagilínu s fluoxetínom alebo fluvoxamínom (pozri
časť 4.4).
Súčasné použitie rasagilínu so selektívnymi inhibítormi spätného vychytávania serotonínu (SSRI)/ selektívnymi inhibítormi spätného vychytávania serotonínu a noradrenalínu (SNRI) v klinickom skúšaní pozri v časti 4.8.
Závažné nežiaduce reakcie boli hlásené pri súčasnom užívaní SSRI, SNRI, tricyklických a tetracyklických antidepresív spolu s inhibítormi MAO. Vzhľadom na inhibičnú aktivitu rasagilínu voči MAO by sa antidepresíva mali podávať so zvýšenou opatrnosťou.
Látky, ktoré ovplyvňujú aktivitu CYP1A2
In vitro štúdie metabolizmu preukázali, že cytochróm P450 1A2 (CYP1A2) je hlavným enzýmom
zodpovedným za metabolizmus rasagilínu.
Inhibítory CYP1A2
Podávanie rasagilínu s ciprofloxacínom (inhibítorom CYP1A2) zvýšilo AUC rasagilínu o 83 %. Podávanie rasagilínu s teofylínom (substrátom CYP1A2) neovplyvnilo farmakokinetiku ani jednej z látok. Vzhľadom na to, účinné inhibítory CYP1A2 môžu zmeniť plazmatickú koncentráciu rasagilínu a majú sa podávať s opatrnosťou.
Induktory CYP1A2
U fajčiacich pacientov je riziko zníženia plazmatickej koncentrácie rasagilínu vzhľadom na indukciu metabolizujúceho enzýmu CYP1A2.
Ďalšie izoenzýmy cytochrómu P450
In vitro štúdie preukázali, že rasagilín v koncentrácii 1 µg/ml (čo zodpovedá hladine, ktorá je
160-násobok priemeru Cmax ~ 5,9-8,5 ng/ml u pacientov s Parkinsonovou chorobou po viacnásobnom podaní 1 mg rasagilínu) neinhiboval izoenzýmy cytochrómu P450, CYP1A2, CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4 a CYP4A. Tieto výsledky dokazujú, že nie je pravdepodobné, aby rasagilín v terapeutických koncentráciách signifikantne interferoval so substrátmi týchto enzýmov (pozri časť 5.3).
Levodopa a inéliekynaParkinsonovuchorobu
U pacientov s Parkinsonovou chorobou liečených rasagilínom ako adjuvantnou terapiou k chronickej
liečbe levodopou nebol žiaden klinicky významný účinok liečby levodopou na klírens rasagilínu. Súčasné podávanie rasagilínu a entakapónu zvýšilo orálny klírens rasagilínu o 28 %.
Interakcie tyramín/rasagilín
Výsledky piatich záťažových štúdií (u dobrovoľníkov a pacientov s Parkinsonovou chorobou) spolu
s výsledkami domáceho monitorovania krvného tlaku po jedle (u 464 pacientov, ktorým bolo podávané 0,5 alebo 1 mg rasagilínu denne alebo placebo ako adjuvantná terapia k levodope počas 6 mesiacov bez obmedzenia tyramínu) a fakt, že neboli zaznamenané žiadne interakcie medzi tyramínom a rasagilínom dokazujú, že rasagilín sa môže bezpečne používať bez dietetického obmedzenia tyramínu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne údaje o použití rasagilínu u gravidných žien. Štúdie na zvieratách
nepreukázali priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej toxicity (pozri časť 5.3). Ako preventívne opatrenie je vhodnejšie vyhnúť sa užívaniu rasagilínu počas gravidity.
Dojčenie
Predklinické údaje naznačujú, že rasagilín inhibuje sekréciu prolaktínu, a teda môže inhibovať
laktáciu. Nie je známe, či sa rasagilín vylučuje do materského mlieka. Pri podávaní dojčiacim ženám je potrebná opatrnosť.
Fertilita
Nie sú k dispozícii žiadne údaje o účinku rasagilínu na fertilitu u ľudí. Predklinické údaje naznačujú,
že rasagilín nemá na fertilitu žiaden účinok.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
U pacientov, u ktorých sa vyskytnú somnolencia/epizódy náhleho spánku, môže mať rasagilín významný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
Pacienti majú byť upozornení, aby boli obozretní pri ovládaní nebezpečných strojov, vrátane vedenia vozidiel, až kým si nebudú dostatočne istí, že rasagilín ich už nežiaduco neovplyvňuje.
Pacienti liečení rasagilínom, u ktorých sa prejaví somnolencia a/alebo epizódy náhleho spánku, musia byť informovaní, aby neviedli vozidlá a nezapájali sa do činností, pri ktorých by narušená bdelosť mohla pre nich alebo pre iné osoby predstavovať riziko závažného zranenia alebo úmrtia (napr. obsluha strojov), a to dovtedy, kým nebudú mať dostatočné skúsenosti s rasagilínom a inými dopaminergnými liekmi na to, aby posúdili, či nepriaznivo ovplyvňuje ich duševný a/alebo pohybový výkon.
Ak sa kedykoľvek počas liečby vyskytne zvýšená somnolencia alebo nové epizódy zaspávania počas každodenných činností (napr. pri sledovaní televízie, cestovaní ako pasažieri v aute atď.), pacienti nesmú viesť vozidlá ani sa zapájať do potenciálne nebezpečných činností.
Pacienti nesmú počas liečby viesť vozidlá, obsluhovať stroje ani pracovať vo výškach, ak sa už u nich pred použitím rasagilínu vyskytla somnolencia a/alebo bez varovania zaspali.
Pacienti majú byť upozornení na možné aditívne účinky sedatívnych liekov, alkoholu alebo iných látok tlmiacich centrálny nervový systém (napr. benzodiazepíny, antipsychotiká, antidepresíva)
v kombinácii s rasagilínom alebo pri súčasnom užívaní liekov, ktoré zvyšujú plazmatické hladiny rasagilínu (napr. ciprofloxacín) (pozri časť 4.4).
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
V klinických štúdiách u pacientov s Parkinsonovou chorobou boli najčastejšie hlásenými nežiaducimi
reakciami: bolesť hlavy, depresia, vertigo a chrípka (influenza a rinitída) pri monoterapii; dyskinéza, ortostatická hypotenzia, pád, bolesť brucha, nauzea a vracanie, a sucho v ústach pri adjuvantnej liečbe k levodope; muskuloskeletálna bolesť ako bolesť chrbta a krku, a atralgia pri oboch liečebných režimoch. Tieto nežiaduce reakcie neboli spojené so zvýšenou frekvenciou vysadenia liečby.
Tabuľkový zoznam nežiaducich reakcií
Nežiaduce reakcie sú uvedené nižšie v tabuľke 1 a 2 podľa triedy orgánových systémov a frekvencie
výskytu na základe nasledujúcej dohody: veľmi časté (≥ 1/10), časté (≥ 1/100 až <1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (≥ 1/10 000), neznáme (z dostupných údajov).
Monoterapia
Nižšie uvedený tabuľkový zoznam obsahuje nežiaduce reakcie, u ktorých bol v placebom kontrolovaných štúdiách zaznamenaný vyšší výskyt u pacientov, ktorým bol podávaný 1 mg rasagilínu
denne.
Trieda orgánových
systémov
Veľmi časté Časté Menej časté Neznáme
Infekcie a nákazy chrípka
Benígne a malígne nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy)
Poruchy krvi a lymfatického systému Poruchy
imunitného systému
rakovina kože
leukopénia alergia
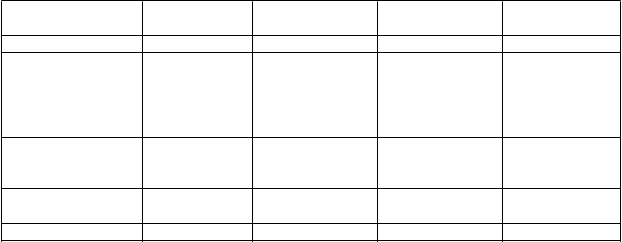 Poruchy
Poruchy znížená chuť do
Trieda orgánových systémov metabolizmu a výživy
Veľmi časté Časté Menej časté Neznáme
jedla
Psychické poruchy depresia,
halucinácie*
poruchy kontroly impulzov*
Poruchy nervového systému
bolesť hlavy cerebrovaskulárna príhoda
sérotonínový syndróm*, nadmerná ospanlivosť počas dňa (EDS) a epizódy náhleho upadnutia do spánku (SOS)
Poruchy oka konjunktivitída
Poruchy ucha a labyrintu Poruchy srdca a srdcovej činnosti
vertigo
angina pectoris infarkt myokardu
Poruchy ciev hypertenzia*
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest Celkové poruchy a reakcie v mieste podania
rinitída flatulencia
dermatitída vezikulobulózny exantém
muskuloskeletálna bolesť,
bolesť krku, artritída nutkanie na močenie horúčka, celkový pocit choroby
*Pozri časť „Opis vybraných nežiaducich reakcií“
Adjuvantná terapia
Nižšie uvedený tabuľkový zoznam obsahuje nežiaduce reakcie, ktorých výskyt bol zaznamenaný vo vyššej miere v placebom kontrolovaných štúdiách u pacientov, ktorým bol podávaný 1 mg rasagilínu
denne
Trieda orgánových
systémov
Benígne a malígne nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy)
Poruchy metabolizmu a výživy
Veľmi časté Časté Menej časté Neznáme
kožný melanóm*
znížená chuť do jedla

 Psychické poruchy
Psychické poruchy halucinácie*, zmätenosť poruchy kontroly
abnormálne sny impulzov*
Poruchy nervového systému
Poruchy srdca a srdcovej činnosti
dyskinéza dystónia, syndróm karpálneho kanála, porucha rovnováhy
cerebrovaskulárna príhoda
angina pectoris
sérotonínový syndróm*, nadmerná ospanlivosť počas dňa (EDS) a epizódy náhleho upadnutia do spánku (SOS)
Poruchy ciev ortostatická hypotenzia*
hypertenzia*
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva Poruchy kostrovej a svalovej sústavy a spojivového
tkaniva*
Laboratórne a funkčné vyšetrenia Úrazy, otravy a komplikácie liečebného postupu
bolesť brucha, zápcha,
nauzea a vracanie, sucho v ústach vyrážka
artralgia, bolesť krku
zníženie telesnej hmotnosti
pád
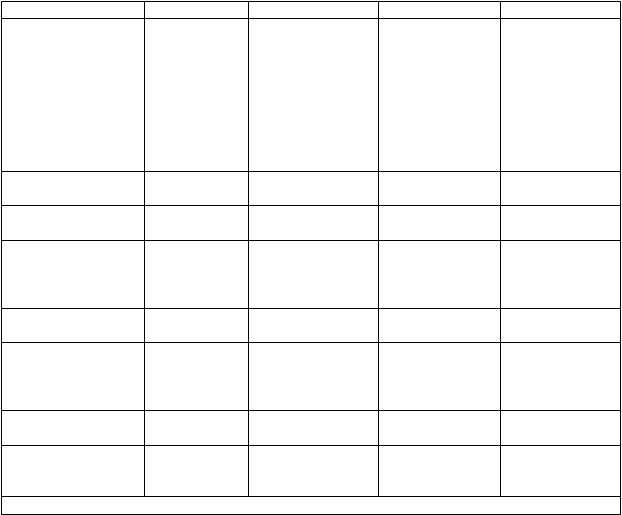
*Pozri časť „Opis vybraných nežiaducich reakcií“
OpisvybranýchnežiaducichreakciíOrtostatická hypotenziaV zaslepených placebom kontrolovaných štúdiách bola hlásená ťažká ortostatická hypotenzia
u jedného pacienta (0,3 %) v skupine s rasagilínom (adjuvantné štúdie) a u žiadneho v skupine
s placebom. Údaje z klinických skúšaní ďalej naznačujú, že ortostatická hypotenzia sa vyskytuje najčastejšie počas prvých dvoch mesiacov liečby rasagilínom a postupom času má tendenciu klesať.
HypertenziaRasagilín selektívne inhibuje MAO-B a v indikovanej dávke (1 mg/deň) nie je spojený so zvýšenou citlivosťou na tyramín. V zaslepených placebom kontrolovaných štúdiách (monoterapia a adjuvantná liečba) nebola hlásená ťažká hypertenzia u žiadneho pacienta v skupine s rasagilínom.
V postregistračnom období boli u pacientov užívajúcich rasagilín hlásené prípady zvýšeného krvného tlaku vrátane zriedkavých závažných prípadov hypertenznej krízy spojenej s užitím neznámeho
množstva na tyramín bohatých potravín. V postregistračnom období bol hlásený jeden prípad zvýšeného krvného tlaku u pacienta užívajúceho tetrahydrozolín hydrochlorid na vazokonstrikciu očných ciev popri užívaní rasagilínu.
Poruchy kontroly impulzovV monoterapeutickej placebom kontrolovanej štúdii bol hlásený jeden prípad hypersexuality. Počas expozície po uvedení lieku na trh boli s neznámou frekvenciou výskytu hlásené nasledujúce prípady: nutkanie, kompulzívne nakupovanie, dermatilománia, syndróm dopamínovej dysregulácie, porucha kontroly impulzov, impulzívne správanie, kleptománia, krádež, obsesívne myšlienky, obsesívno- kompulzívna porucha, stereotypnosť, hráčstvo, patologické hráčstvo, zvýšené libido, hypersexualita,
psychosexuálna porucha, sexuálne nevhodné správanie. Polovica hlásených prípadov ICD bola
hodnotená ako závažné. Len jednotlivé prípady hlásených prípadov sa v čase ich hlásenia nezotavili.
Nadmerná ospanlivosť počas dňa (EDS) a epizódy náhleho upadnutia do spánku (SOS)
U pacientov liečených dopamínovými agonistami a/alebo pri inej dopamínergickej liečbe sa môže vyskytnúť nadmerná ospanlivosť počas dňa (hypersomnia, letargia, sedácia, záchvaty spánku, somnolencia, náhle upadnutie do spánku). Nadmerná ospanlivosť počas dňa podobného charakteru bola hlásená po uvedení rasagilínu na trh.
Hlásené boli prípady pacientov liečených rasagilínom a inými dopaminergnými liekmi, ktorí zaspali počas každodenných činností. Akj keď mnohí z týchto pacientov hlásili somnolenciu počas liečby
rasagilínom spolu s inými dopaminergnými liekmi, niektorí nezaznamenali žiadne varovné signály,
ako je nadmerná ospalosť, a boli presvedčení, že tesne pred touto príhodou boli duchaprítomní. Niektoré z týchto príhod boli hlásené viac ako 1 rok po začatí liečby.
HalucinácieParkinsonova choroba je sprevádzaná halucináciami a zmätenosťou. Podľa skúseností po uvedení
lieku na trh boli tieto príznaky pozorované aj u pacientov s Parkinsonovou chorobou, ktorí boli liečení rasagilínom.
Serotonínový syndrómV klinických skúšaniach rasagilínu nebolo povolené súčasné používanie fluoxetínu alebo fluvoxamínu s rasagilínom, avšak bolo povolené súčasné použitie rasagilínu s nasledujúcimi antidepresívami
v uvedených dávkach: amitriptylín ≤ 50 mg/denne, trazodón ≤ 100 mg/denne, citalopram
≤ 20 mg/denne, sertralin ≤ 100 mg/denne a paroxetin ≤ 30 mg/denne (pozri časť 4.5).
V období po uvedení lieku na trh boli zaznamenané prípady potenciálne život ohrozujúceho serotonínového syndrómu s pridruženou agitáciou, zmätenosťou, rigiditou, horúčkou a kŕčovými zášklbmi svalov (myoklonom) u pacientov liečených antidepresívami, meperidínom, tramadolom, metadónom alebo propoxyfénom súčasne s rasagilínom.
Malígny melanómFrekvencia výskytu kožného melanómu v placebom kontrolovaných klinických štúdiách bola 2/380 (0,5 %) v skupine s 1 mg rasagilínu ako adjuvantná liečba k liečbe levodopou v porovnaní
s frekvenciou 1/388 (0,3 %) v skupine s placebom. Ďalšie prípady malígneho melanómu boli hlásené počas obdobia po uvedení lieku na trh. Tieto prípady boli vo všetkých správach považované za závažné.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 PredávkovanieSymptómySymptómy hlásené z predávkovania rasagilínom v rozsahu dávok od 3 mg do 100 mg zahŕňajú
hypomániu, hypertenznú krízu a serotonínový syndróm.
Predávkovanie môže byť spojené s významnou inhibíciou MAO-A aj MAO-B. V štúdii bola podaná zdravým dobrovoľníkom jednorazová dávka 20 mg/deň a v 10-dňovej štúdii bolo podané zdravým dobrovoľníkom 10 mg/deň. Nežiaduce reakcie boli mierneho až stredne ťažkého stupňa a neboli dôsledkom liečby rasagilínom. V štúdii so zvyšovaním dávky u pacientov chronicky liečených levodopou, ktorým bol podávaný rasagilín v dávke 10 mg/deň, boli zaznamenané kardiovaskulárne nežiaduce reakcie (vrátane hypertenzie a posturálnej hypotenzie), čo vyústilo do prerušenia terapie. Tieto symptómy sú podobné príznakom pozorovaným pri neselektívnych inhibítoroch MAO.'
Liečba
Neexistuje žiadne špecifické antidotum. V prípade predávkovania majú byť pacienti monitorovaní a má byť stanovená vhodná symptomatická a podporná terapia.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiparkinsoniká, inhibítory monoaminooxidázy typu B, ATC kód: N04BD02
Mechanizmus účinku
Dokázalo sa, že rasagilín je účinný ireverzibilný selektívny inhibítor MAO-B, ktorý môže spôsobiť
zvýšenie extracelulárnych hladín dopamínu v striate. Zvýšená hladina dopamínu a následné zvýšenie dopaminergnej aktivity pravdepodobne sprostredkováva priaznivé účinky rasagilínu, ako sa ukázalo na modeloch dopaminergných motorických dysfunkcií.
1-aminoindan je aktívny hlavný metabolit a nie je inhíbitorom MAO-B. Klinickáúčinnosťabezpečnosť
Účinnosť rasagilínu bola stanovená v troch štúdiách: ako monoterapeutická liečba v štúdii I a ako
adjuvantná terapia k levodope v štúdiách II a III.
Monoterapia
V randomizovanej štúdii I bolo 404 pacientom podané placebo (138 pacientov), 1 mg rasagilínu denne
(134 pacientov) alebo 2 mg rasagilínu denne (132 pacientov) a boli liečení počas 26 týždňov, bez aktívneho komparátora.
V tejto štúdii bola hlavným kritériom účinnosti zmena oproti východiskovým hodnotám v celkovom skóre Unifikovanej hodnotiacej škály Parkinsonovej choroby (Unified Parkinson’s Disease Rating Scale, UPDRS, časti I-III). Rozdiel medzi priemernou zmenou medzi začiatkom a koncom terapie, t.j.
26 týždňom (metódou LOCF, Last Observation Carried Forward) bol štatisticky významný (UDPRS, časti I-III: pre rasagilín 1 mg v porovnaní s placebom -4,2; 95 % CI [-5,7; -2,7], p<0,0001; pre
rasagilín 2 mg v porovnaní s placebom -3,6; 95 % CI [-5,0; -2,1], p<0,0001; UDPRS Motor, časť II:
pre rasagilín 1 mg v porovnaní s placebom –2,7; 95 % CI [-3,87; -1,55], p<0,0001; pre rasagilín 2 mg v porovnaní s placebom –1,68; 95 % CI [-2,85; -0,51], p=0,0050). Účinok bol zrejmý, aj keď jeho rozsah bol mierny v tejto populácii pacientov s miernym ochorením. Pri hodnotení škálou PD- QUALIF bol účinok na kvalitu života signifikantný a prínosný.
Adjuvantná terapia
V randomizovanej štúdii II, bolo pacientom podané placebo (229 pacientov), alebo 1 mg rasagilínu denne (231 pacientov) alebo inhibítor katechol-O-metyltransferázy (COMT), entakapón 200 mg spolu so stanovenými dávkami levodopy (LD)/ inhibítora dekarboxylázy (227 pacientov) a boli liečení počas
18 týždňov. V randomizovanej štúdii III bolo pacientom podané placebo (159 pacientov), 0,5 mg rasagilínu denne (164 pacientov) alebo 1 mg rasagilínu denne (149 pacientov) a boli liečení počas
26 týždňov.
V oboch štúdiách bola hlavným kritériom účinnosti zmena priemerného počtu hodín strávených v
„OFF“ stave v priebehu dňa medzi začiatkom a ukončením terapie (stanovená z domácich
„24-hodinových“ denníkov vedených 3 dni pred každou návštevou lekára).
V štúdii II, priemerný rozdiel v počte hodín času „OFF“ v porovnaní s placebom bol -0,78 h, 95 % CI
[-1,18; -0,39], p=0,0001. Celkový priemerný denný pokles času „OFF“ bol podobný v skupine, ktorej bol podávaný entakapón (-0,80 h, 95 % CI [-1,20; -0,41], p<0,0001) a v skupine, ktorej bol podávaný rasagilín v dávke 1 mg. V štúdii III, priemerný rozdiel v porovnaní s placebom bol -0,94 h, 95 % CI
[-1,36; -0,51], p<0,0001. Štatisticky významné zlepšenie v porovnaní s placebom sa preukázalo aj
v skupine s dávkou 0,5 mg rasagilínu, hoci rozsah zlepšenia bol menší. Význam týchto výsledkov pre dosiahnutie primárneho konečného ukazovateľa účinnosti bol potvrdený skupinou dodatočných štatistických modelov a bol dokázaný v troch skupinových analýzach (Intention-to-treat (ITT), na protokol a na ukončené prípady).
Sekundárne kritériá účinnosti zahŕňali celkové zhodnotenie zlepšenia stavu vyšetrujúcim, škálou Denných Aktivít (Activities of Daily Living, ADL) v čase OFF a motorickou UPDRS v čase ON. Rasagilín vykazoval štatisticky významný prínos v porovnaní s placebom.
5.2 Farmakokinetické vlastnosti
Absorpcia
Rasagilín sa vstrebáva rýchlo a dosahuje maximálnu plazmatickú koncentráciu (Cmax) za približne
0,5 hodiny. Absolútna biodostupnosť jednorazovej dávky rasagilínu je okolo 36 %. Jedlo nemá vplyv
na tmax rasagilínu, aj keď Cmax a expozícia (AUC) boli znížené o približne 60 % a 20 % v tomto poradí, keď bol liek podaný s jedlom s vysokým obsahom tuku. Pretože AUC nie je výrazne ovplyvnené jedlom, rasagilín sa môže podávať s jedlom aj bez jedla.
Distribúcia
Priemerný objem distribúcie po podaní jednorazovej intravenóznej dávky rasagilínu je 243 l. Väzba
plazmatickými proteínmi po podaní jednorazovej perorálnej dávky 14C rasagilínu je približne
60 až 70 %.
Biotransformácia
Rasagilín sa pred vylúčením skoro úplne biotransformuje v pečeni. Rasagilín sa metabolizuje dvoma
hlavnými cestami: N-dealkyláciou a/alebo hydroxyláciou so vznikom: 1-aminoindanu, 3-hydroxy-N- propargyl-1 aminoindanu a 3-hydroxy-1-aminoindanu. In vitro experimenty dokazujú, že obe metabolické cesty rasagilínu závisia od systému cytochrómu P 450, pričom najdôležitejšiu úlohu
v metabolizme rasagilínu zohráva izoenzým CYP1A2. Konjugácia rasagilínu a jeho metabolitov je takisto dôležitá cesta eliminácie so vznikom glukuronidov. Pokusy ex vivo a in vitro ukazujú, že rasagilín nie je inhibítorom ani induktorom hlavných enzýmov CYP450 (pozri časť 4.5).
Eliminácia
Perorálne podaný 14C rasagilín sa eliminuje hlavne močom (62,6 %), sekundárne stolicou (21,8 %)
a celková eliminácia predstavuje 84,4 % dávky v priebehu 38 dní. Menej ako 1 % rasagilínu sa vylúči močom v nezmenenej forme.
Linearita/nelinearita
Farmakokinetika rasagilínu je u pacientov s Parkinsonovou chorobou lineárna v rozmedzí dávky
0,5 - 2 mg. Polčas rozpadu je 0,6 - 2 hodiny.
Porucha funkcie pečene
Pacienti s poruchou funkcie pečene: u pacientov s miernou poruchou funkcie pečene sa AUC zvýšilo
o 80 % a Cmax o 38 %. U pacientov so stredne ťažkou poruchou funkcie pečene sa AUC zvýšilo o 568
% a Cmax o 83 % (pozri časť 4.4).
Porucha funkcie obličiek
Pacienti s poruchou funkcie obličiek: farmakokinetické vlastnosti rasagilínu u pacientov s miernou
(CLcr 50 - 80 ml/min) a stredne ťažkou (CLcr 30 - 49 ml/min) poruchou funkcie obličiek boli podobné ako u zdravých osôb.
Staršie osoby
Vek má u starších osôb (> 65 rokov) malý vplyv na farmakokinetické vlastnosti rasagilínu (pozri
časť 4.2).
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogenity, reprodukcie a vývinu neodhalili žiadne osobitné riziko pre ľudí.
Rasagilín nepreukazoval genotoxický potenciál in vivo a vo viacerých in vitro systémoch používajúcich baktérie alebo hepatocyty. Pri metabolickej aktivácii rasagilín indukoval nárast chromozomálnych aberácii pri koncentráciách s nadmernou cytotoxicitou, ktoré sú nedosiahnuteľné pri klinickom použití.
Pri systémovej expozícii u potkanov rasagilín nebol karcinogénny pri 84 - 339-násobkoch očakávanej plazmatickej expozície u ľudí v dávke 1 mg/deň. U myší bol pozorovaný zvýšený výskyt kombinovaného bronchiálneho/alveolárneho adenómu a/alebo karcinómu pri systémovej expozícii pri
144 - 213-násobkoch očakávanej plazmatickej expozície u ľudí v dávke 1 mg/deň.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol
Kukuričný škrob
Predželatínovaný kukuričný škrob Koloidný oxid kremičitý, bezvodý Kyselina stearová
Mastenec
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
Blistre: 3 roky
Fľaše: 3 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 30 °C.
6.5 Druh obalu a obsah balenia
Blistre
Al/Al blistre po 7, 10, 28, 30, 100 alebo 112 tabliet.
Perforované blistre Al/Al s jednotlivou dávkou v balení 10 x 1 tableta, 30 x 1 tableta a 100 x 1 tableta.
Fľaše
Biele, HDPE fľaše s alebo bez poistného viečka bezpečného pre deti, s obsahom 30 tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky na likvidáciu.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIITeva B.V. Swensweg 5
2031 GA Haarlem
Holandsko
8. REGISTRAČNÉ ČÍSLOEU/1/14/977/001-010
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12. január 2015
Dátum posledného predĺženia registrácie:
10. DÁTUM REVÍZIE TEXTUMM/RRRR
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.