
r />poruchách elektrolytov/ketoacidóze/hyperosmolárnych poruchách]), znovu skontrolujte do 24 hodín a podľa klinickej potreby.
Ak FG klesne na ≤500 mg/dl alebo ≤27,8 mmol/l, potom postupujte
podľa špecifických odporúčaní pre hodnotu FG <500 mg/dl.
Ak sa po 24 hodinách potvrdí FG >500 mg/dl alebo ≥27,8 mmol/l,

liečbu s Piqray natrvalo ukončite.
1 Hladiny glukózy nalačno vyjadrujú stupňovanie hyperglykémie podľa CTCAE, verzia 4.03
CTCAE = spoločné terminologické kritériá pre nežiaduce udalosti (Common Terminology Criteria for
Adverse Events).
2 Má sa začať liečba príslušnými antidiabetikami podľa príslušnej informácie o predpisovaní z hľadiska odporúčaní týkajúcich sa dávkovania a titrácie dávky, vrátane pokynov pre lokálnu liečbu diabetu.
Metformín sa odporúčal v klinickej štúdii fázy III s nasledujúcim pokynom: Liečba metformínom sa
má začať dávkou 500 mg raz denne. Na základe znášanlivosti sa môže dávka metformínu zvýšiť na 500 mg dvakrát denne, po ktorej nasleduje dávka 500 mg s raňajkami a 1000 mg s večerným jedlom, v prípade potreby je možné ďalšie zvýšenie na 1000 mg dvakrát denne (pozri časť 4.4).
3 Ako sa odporúča v klinickej štúdii fázy III, inzulín sa môže používať 1-2 dni, kým hyperglykémia nevymizne. Vo väčšine prípadov hyperglykémie vyvolanej alpelisibom to však nemusí byť potrebné vzhľadom na krátky polčas rozpadu alpelisibu a predpoklad, že hladiny glukózy sa po prerušení liečby liečby s Piqray budú normalizovať.
U pacientov liečených alpelisibom sa zistilo, že rizikové faktory pre hyperglykémiu sú východiskový
diabetický a prediabetický stav, východiskový BMI ≥30 a východiskový vek ≥75 rokov. Tieto rizikové faktory boli prítomné u 74,7 % pacientov s akýmkoľvek stupňom hyperglykémie a u 86,2 % pacientov s hyperglykémiou 3. alebo 4. stupňa (pozri časť 4.4).
Vyrážka
V čase začatia liečby s Piqray sa môže zvážiť profylaktické podávanie perorálnych antihistaminík. Okrem toho sa na liečbu symptómov vyrážky odporúčajú antihistaminiká.
Pri prvých prejavoch vyrážky sa má začať liečba lokálne aplikovanými kortikosteroidmi a pri stredne ťažkých až ťažkých formách vyrážky sa majú zvážiť perorálne kortikosteroidy. Na základe závažnosti vyrážky môže byť potrebné prerušenie liečby, zníženie dávky alebo ukončenie liečby s Piqray, ako je popísané v tabuľke 3 (pozri časť 4.8).
Tabuľka 3 Úprava dávky a liečba vyrážky1Stupeň
| Odporúčanie
|
Všetky stupne
| Vždy sa má zvážiť konzultácia s dermatológom.
|
1. stupeň
(<10 % plochy povrchu tela [body surface area, BSA] s aktívnou kožnou toxicitou)
| Nie je potrebná žiadna úprava dávky Piqray.
Začnite liečbu lokálne aplikovanými kortikosteroidmi. Zvážte pridanie liečby perorálnymi antihistaminikami na zvládnutie symptómov.
|
2. stupeň
(10-30 % BSA s aktívnou kožnou
toxicitou)
| Nie je potrebná žiadna úprava dávky Piqray.
Začnite alebo zintenzívnite liečbu lokálne aplikovanými kortikosteroidmi a perorálnymi antihistaminikami.
Zvážte liečbu nízkou dávkou perorálnych kortikosteroidov.
|
3. stupeň (napr. ťažká forma vyrážky,
ktorá nereaguje na liečbu)
(>30 % BSA s aktívnou kožnou
toxicitou)
| Prerušte liečbu s Piqray, kým vyrážka nedosiahne
≤1. stupeň.
Začnite alebo zintenzívnite liečbu lokálne aplikovanými
/perorálnymi kortikosteroidmi a antihistaminikami.
Po zlepšení na ≤1. stupeň pokračujte v liečbe s Piqray
s rovnakou úrovňou dávky ako pri prvom výskyte vyrážky
a pri druhom výskyte nasledujúcou nižšou úrovňou dávky.
|
4. stupeň (napr. vážne pľuzgierovité
alebo exfoliatívne postihnutie kože) (akékoľvek % BSA spojené
s rozsiahlou superinfekciou,
s indikovanými intravenóznymi antibiotikami; život ohrozujúce následky)
| Liečbu s Piqray natrvalo ukončite.
|
1 Stupňovanie podľa CTCAE, verzia 5.0
|
HnačkaTabuľka 4 Úprava dávky a liečba hnačkyStupeň1
| Odporúčanie
|
1. stupeň
| Nie je potrebná žiadna úprava dávky Piqray. Začnite vhodnú liečbu a sledujte
podľa klinickej potreby.
|
2. stupeň
| Začnite alebo zintenzívnite vhodnú liečbu a sledujte podľa klinickej potreby.
Prerušte liečbu s Piqray až do zotavenia na ≤1. stupeň, potom pokračujte
v liečbe s Piqray rovnakou úrovňou dávky.
|
3. alebo
4. stupeň2
| Začnite alebo zintenzívnite vhodnú liečbu a sledujte podľa klinickej potreby.
Prerušte liečbu s Piqray až do zotavenia na ≤1. stupeň, potom pokračujte
v liečbe s Piqray s nasledujúcou nižšou úrovňou dávky.
|
1 Stupňovanie podľa CTCAE, verzia 5.0.
2 Pacienti sa majú naviac liečiť podľa národných štandardov starostlivosti, vrátane monitorovania elektrolytov, podávania antiemetík a liekov proti hnačke a/alebo náhrady tekutín a doplnkov elektrolytov, podľa klinickej potreby.
|
I
né toxicity
T
abuľka 5 Úprava dávky a liečba iných toxicít (okrem hyperglykémie, vyrážky a hnačky)
1
Stupeň
|
O
dporúčanie
|
1. alebo
2. stupeň
|
Nie je potrebná žiadna úprava dávky Piqray. Začnite vhodnú liečbu a sledujte
podľa klinickej potreby2,3.
|
3. stupeň
|
Prerušte liečbu s Piqray, kým sa nedosiahne ≤1. stupeň, potom pokračujte
v liečbe s Piqray s nasledujúcou nižšou úrovňou dávky2.
|
4. stupeň
|
Liečbu s Piqray natrvalo ukončite3.
|
1 Stupňovanie podľa CTCAE, verzia 5.0
2 Pri pankreatitíde 2. a 3. stupňa prerušte liečbu s Piqray až do zotavenia na ≤1. stupeň a pokračujte v liečbe nasledujúcou nižšou úrovňou dávky. Je povolené len jedno zníženie dávky. Ak sa toxicita opakovane vyskytne, liečbu s Piqray natrvalo ukončite.
3 Pri zvýšení celkového bilirubínu na 2. stupeň prerušte liečbu s Piqray až do zotavenia na ≤1. stupeň
a pokračujte v liečbe rovnakou dávkou, ak dôjde k zotaveniu do ≤14 dní, alebo pokračujte v liečbe
nasledujúcou nižšou úrovňou dávky, ak dôjde k zotaveniu po >14 dňoch.
|
O
sobitné populácie
Starší pacienti
U pacientov vo veku 65 rokov alebo starších nie je potrebná žiadna úprava dávky (pozri časť 5.2). Existujú obmedzené údaje u pacientov vo veku ≥75 rokov a najmä u pacientov vo veku ≥85 rokov.
Poškodenie funkcie obličiekNa základe populačnej farmakokinetickej analýzy nie je potrebná žiadna úprava dávky u pacientov s miernym alebo stredne ťažkým poškodením funkcie obličiek (pozri časť 5.2). Opatrnosť je potrebná u pacientov s ťažkým poškodením funkcie obličiek, pretože u tejto populácie nie sú žiadne skúsenosti s liečbou s Piqray.
Poškodenie funkcie pečeneNa základe štúdie poškodenia funkcie pečene u pacientov bez rakoviny s poškodením funkcie pečene nie je potrebná žiadna úprava dávky u pacientov s miernym, stredne ťažkým alebo ťažkým poškodením funkcie pečene (trieda A, B alebo C podľa Childa-Pugha, v uvedenom poradí) (pozri časť 5.2).
Pediatrická populáciaBezpečnosť a účinnosť Piqray u detí vo veku 0-18 rokov neboli stanovené. K dispozícii nie sú žiadne
údaje.
Spôsob podávaniaPiqray je na perorálne použitie. Tablety sa musia prehĺtať celé. Pred prehltnutím sa nesmú žuť, drviť alebo deliť. Tablety, ktoré sú zlomené, prasknuté alebo inak porušené, sa nesmú požiť.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Fulvestrant
Vzhľadom na obmedzené údaje u pacientov s predchádzajúcou liečbou fulvestrantom (n=39, štúdia
CBYL719X2101) sa účinnosť v tejto populácii nepovažuje za preukázanú (pozri časť 5.1).
Precitlivenosť (vrátane anafylaktickej reakcie)
V klinických štúdiách u pacientov liečených s Piqray boli hlásené závažné reakcie z precitlivenosti
(vrátane anafylaktickej reakcie a anafylaktického šoku), prejavujúce sa symptómami vrátane, ale nie obmedzené na dýchavičnosť, začervenanie, vyrážku, horúčku alebo tachykardiu (pozri časť 4.8).
U pacientov so závažnými reakciami z precitlivenosti sa má liečba s Piqray natrvalo ukončiť a nemá
sa znova začínať. Okamžite sa má začať vhodná liečba.
Závažné kožné reakcie
U pacientov liečených s alpelisibom boli hlásené závažné kožné reakcie. V klinickej štúdii fázy III
boli hlásené Stevensov-Johnsonov syndróm (SJS) a multiformný erytém (erythema multiforme, EM) u 1 (0,4 %) a 3 (1,1 %) pacientov, v uvedenom poradí. V postmarketingovom období bola hlásená reakcia na liek s eozinofíliou a systémové symptómy (drug reacion with eosinophilia and systemic symptoms, DRESS) (pozri časť 4.8).
Liečba s Piqray sa nemá začať u pacientov so závažnými kožnými reakciami v anamnéze.
Pacienti majú byť poučení o prejavoch a symptómoch závažných kožných reakcií (napr. prodromálne prejavy horúčky, symptómy podobné chrípke, slizničné lézie alebo progresívna kožná vyrážka). Ak sú prítomné prejavy alebo symptómy závažných kožných reakcií, liečba s Piqray sa má prerušiť, kým sa nestanoví etiológia reakcie. Odporúča sa konzultácia s dermatológom.
Ak sa potvrdí závažná kožná reakcia, liečba s Piqray sa má natrvalo ukončiť. Liečba s Piqray sa nemá znova začať u pacientov, u ktorých sa vyskytli závažné kožné reakcie. Ak sa závažná kožná reakcia nepotvrdí, môže byť potrebné prerušenie liečby s Piqray, zníženie dávky alebo ukončenie liečby, ako je popísané v tabuľke 3 (pozri časť 4.2).
Hyperglykémia
U pacientov liečených s Piqray bola hlásená závažná hyperglykémia, vrátane ketoacidózy.
V klinickej štúdii fázy III sa hyperglykémia vyskytovala častejšie u pacientov, ktorí boli pri skríningu diabetickí (0 z 12 pacientov [0 %] s 1.-2. stupňom a 10 z 12 pacientov [83,3 %] s 3.-4. stupňom), prediabetickí (42 zo 159 pacientov [26,4 %] s 1.-2. stupňom a 77 zo 159 pacientov [48,4 %]
s 3.-4. stupňom), mali BMI ≥30 (13 zo 74 pacientov [17,6 %] s 1.-2. stupňom a 38 zo 74 pacientov
[51,4 %] s 3.-4. stupňom) alebo boli vo veku ≥75 rokov (6 z 34 pacientov [17,6 %] s 1.-2. stupňom
a 19 z 34 pacientov [55,9 %] s 3.-4. stupňom).
Keďže hyperglykémia sa môže objaviť s rýchlym nástupom po začatí liečby, odporúča sa časté samosledovanie v prvých 4 týždňoch a najmä v prvých 2 týždňoch liečby, podľa klinickej potreby. Špecifický plán, ktorý sa odporúča na sledovanie hladiny glukózy nalačno, je popísaný v tabuľke 6.
V klinickej štúdii fázy III pacienti s diabetes mellitus v anamnéze zintenzívnili používanie antidiabetík počas liečby s Piqray.
Všetci pacienti majú byť poučení o zmenách životného štýlu, ktoré môžu znížiť hyperglykémiu (napr.
diétne obmedzenia).
T
abuľka 6 Plán na sledovanie hladiny glukózy nalačno
|
O
dporúčaný plán na sledovanie hladín glukózy nalačno a HbA1c u všetkých pacientov liečených s Piqray
|
O
dporúčaný plán na sledovanie hladín glukózy nalačno a HbA1c u pacientov s diabetom, prediabetom, BMI ≥30 alebo vo
veku ≥75 rokov liečených s Piqray
|
P
r
i skríningu, pred začatím liečby s Piqray
|
Vyšetrite glukózu v plazme na lačno (fasting plasma glucose, FPG), HbA1c a optimalizujte hladinu glukózy v krvi pacienta (pozri tabuľku 2).
|
P
o začatí liečby s
Piqray
|
Sledujte FPG v 1., 2., 4., 6. a 8. týždni po začatí liečby a potom mesačne.
|
Pravidelne sledujte/nechajte pacienta
sledovať hladinu glukózy nalačno, častejšie v prvých 4 týždňoch a najmä v prvých 2 týždňoch liečby, v súlade
s pokynmi zdravotníckeho pracovníka*.
|
Sledujte/nechajte pacienta sledovať
hladinu glukózy nalačno denne počas prvých 2 týždňov liečby. Potom pokračujte v sledovaní glukózy nalačno tak často, ako je potrebné na zvládnutie hyperglykémie v súlade
s pokynmi zdravotníckeho pracovníka*.
|
HbA1c sa má sledovať po 4 týždňoch liečby a potom každé 3 mesiace.
|
A
k sa objaví
hyperglykémia po
z
ačatí liečby s Piqray
|
Pravidelne sledujte hladinu glukózy nalačno podľa národných štandardov
starostlivosti a aspoň dovtedy, kým hladina glukózy nalačno neklesne na
normálnu úroveň.
|
Počas liečby antidiabetikom pokračujte v sledovaní hladiny glukózy nalačno
najmenej raz týždenne počas 8 týždňov a potom každé 2 týždne, a v sledovaní
hladiny glukózy nalačno v súlade s pokynmi zdravotníckeho pracovníka, ktorý má skúsenosti v liečbe hyperglykémie.
|
* Akékoľvek monitorovanie hladiny glukózy sa má vykonávať podľa uváženia lekára podľa klinickej
potreby.
|
Pacienti majú byť poučení o prejavoch a symptómoch hyperglykémie (napr. nadmerný smäd, častejšie
močenie alebo väčšie množstvo moču ako obvykle, zvýšená chuť do jedla so stratou telesnej
hmotnosti).
Zo 190 pacientov s hyperglykémiou bolo 87,4 % (166/190) liečených antidiabetikami a u 75,8 % (144/190) bolo hlásené použitie metformínu ako samostatnej látky alebo v kombinácii s inými antidiabetikami (napr. inzulín, inhibítory dipeptidylpeptidázy-4 (DPP-4), inhibítory SGLT2
a sulfonylmočoviny).
Perorálne antidiabetiká sa použili u 154 pacientov. Z týchto 154 pacientov ukončilo 17 (11,0 %) liečbu počas štúdie kvôli hyperglykémii. Súbežná liečba inzulínom sa použila u 54 pacientov; z toho 13
(24,1 %) ukončilo liečbu počas štúdie kvôli hyperglykémii.
Zo 162 pacientov s hyperglykémiou ≥2. stupňa malo 155 zlepšenie aspoň o 1 stupeň, medián času do zlepšenia od prvej udalosti bol 8 dní (95% IS: 8 až 10 dní).
Z pacientov so zvýšenou hladinou FPG, ktorí pokračovali v liečbe fulvestrantom
po ukončení liečby s Piqray (n=58), malo 98,3 % (n=57) hladiny FPG, ktoré sa vrátili na pôvodnú
úroveň.
Bezpečnosť lieku Piqray u pacientov s diabetom 1. typu a nekontrolovaným diabetom 2. typu nebola
stanovená, pretože títo pacienti boli vylúčení z klinickej štúdie fázy III. Pacienti s diabetom 2. typu v anamnéze boli zaradení do klinickej štúdie fázy III. Pacienti s diabetes mellitus v anamnéze môžu vyžadovať intenzívnejšiu liečbu diabetu a musia byť starostlivo sledovaní.
Na základe závažnosti hyperglykémie môže byť potrebné prerušenie liečby, zníženie dávky alebo ukončenie liečby s Piqray, ako je popísané v tabuľke 2 (pozri časť 4.2).
Pneumonitída
V klinických štúdiách bola u pacientov liečených s Piqray hlásená pneumonitída, vrátane závažných
prípadov pneumonitídy/akútneho intersticiálneho ochorenia pľúc. Pacienti majú byť poučení, aby okamžite hlásili akékoľvek nové alebo zhoršujúce sa respiračné symptómy. U pacientov, ktorí majú
nové alebo zhoršujúce sa respiračné symptómy, alebo u ktorých existuje podozrenie, že sa u nich
vyvinula pneumonitída, musia liečbu s Piqray okamžite prerušiť a pacient musí byť vyšetrený na
pneumonitídu. Diagnóza neinfekčnej pneumonitídy sa má vziať do úvahy u pacientov, u ktorých sa objavia nešpecifické respiračné prejavy a symptómy, ako je hypoxia, kašeľ, dýchavičnosť alebo intersticiálne infiltráty pri rádiologickom vyšetrení, a u ktorých sa príslušnými vyšetreniami vylúčili infekčné, neoplastické a iné príčiny. U všetkých pacientov s potvrdenou pneumonitídou sa má liečba s Piqray natrvalo ukončiť.
Hnačka
Počas liečby s Piqray bola hlásená závažná hnačka a klinické následky, ako je dehydratácia a akútne
poškodenie obličiek, ktoré boli vyliečené vhodným zásahom. 59,5 % pacientov (n=169) malo počas liečby s Piqray hnačku. Hnačka 3. stupňa sa vyskytla u 7 % (n=20) pacientov bez hlásených prípadov
4. stupňa. U pacientov s hnačkou 2. alebo 3. stupňa (n=76) bol medián času do prvého výskytu 50 dní
(rozmedzie: 1 až 954 dní).
Zníženie dávky Piqray bolo potrebné u 5,6 % pacientov a 2,8 % pacientov ukončilo liečbu s Piqray kvôli hnačke. U 169 pacientov, u ktorých sa vyskytla hnačka, boli na zvládnutie symptómov potrebné lieky proti hnačke (napr. loperamid) u 64,5 % (109/169).
Na základe závažnosti hnačky môže byť potrebné prerušenie liečby, zníženie dávky alebo ukončenie liečby s Piqray, ako je popísané v tabuľke 4 (pozri časť 4.2).
Pacientov je potrebné poučiť, aby začali liečbu hnačky, zvýšili príjem perorálnych tekutín a informovali svojho lekára, ak sa počas užívania Piqray objaví hnačka.
Osteonekróza čeľuste
Ak sa Piqray a bisfosfonáty alebo denosumab používajú súbežne alebo následne, je potrebná
opatrnosť. Liečba s Piqray sa nemá začať u pacientov s pokračujúcou osteonekrózou čeľuste z predchádzajúcej alebo súbežnej liečby bisfosfonátmi/denosumabom. Pacientov je potrebné upozorniť, aby počas liečby s Piqray okamžite hlásili akékoľvek nové alebo zhoršujúce sa perorálne symptómy (ako je mobilita zubov, bolesť alebo opuch, nehojace sa bolestivé miesta v ústach alebo výtok).
U pacientov, u ktorých sa vyvinie osteonekróza čeľuste, sa má začať štandardná liečba.
Symptomatické viscerálne ochorenie
Bezpečnosť a účinnosť tohto lieku sa neskúmala u pacientov so symptomatickým viscerálnym
ochorením.
Sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej filmom obalenej tablete, t.j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Lieky, ktoré môžu zvýšiťplazmatickékoncentráciealpelisibu
Inhibítory BCRP
Alpelisib je substrátom pre BCRP in vitro. BCRP sa podieľa na hepatobiliárnom exporte
a intestinálnej sekrécii alpelisibu, preto inhibícia BCRP v pečeni a v čreve počas eliminácie môže viesť k zvýšeniu systémovej expozície alpelisibu. Odporúča sa preto opatrnosť a sledovanie toxicity počas súbežnej liečby inhibítormi BCRP (napr. eltrombopag, lapatinib, pantoprazol).
Lieky, ktoré môžuznížiťplazmatickékoncentráciealpelisibu
Antacidá
Súbežné podávanie antagonistu H2 receptora ranitidínu v kombinácii s jednotlivou 300 mg perorálnou dávkou alpelisibu mierne znížilo biologickú dostupnosť alpelisibu a znížilo celkovú expozíciu alpelisibu. V prítomnosti nízkokalorického jedla s nízkym obsahom tuku (low-fat low-calorie, LFLC) sa AUCinf znížila v priemere o 21 % a Cmax o 36 % pri ranitidíne. Pri absencii potravy bol účinok výraznejší pri 30% znížení AUCinf a 51% znížení Cmax pri ranitidíne v porovnaní so stavom nalačno bez súbežného podávania ranitidínu. Populačná farmakokinetická analýza nepreukázala žiadny významný účinok súbežného podávania látok znižujúcich aciditu, vrátane inhibítorov protónovej pumpy, antagonistov H2 receptorov a antacíd, na farmakokinetiku alpelisibu. Alpelisib sa preto môže podávať súbežne s látkami znižujúcimi aciditu, ak sa alpelisib užije bezprostredne po jedle (pozri
časť 4.2).
Lieky, ktorých plazmatickékoncentráciemôžubyťovplyvnenéalpelisibom
Na základe výsledkov štúdií indukcie a inhibície metabolizmu in vitro môže alpelisib indukovať
metabolický klírens súbežne podávaných liekov metabolizovaných prostredníctvom CYP2B6,
CYP2C9 a CYP3A a môže inhibovať metabolický klírens súbežne podávaných liekov metabolizovaných prostredníctvom CYP2C8, CYP2C9, CYP2C19 a CYP3A4 (časovo závislá inhibícia), ak sa in vivo dosiahnu dostatočne vysoké koncentrácie.
Substráty CYP3A4
Nie je potrebná žiadna úprava dávky, ak sa Piqray podáva súbežne so substrátmi CYP3A4 (napr.
everolimus, midazolam).
V štúdií liekových interakcií súbežné podávanie alpelisibu s everolimusom, citlivým substrátom CYP3A4, potvrdilo, že medzi alpelisibom a substrátmi CYP3A4 neexistujú klinicky významné farmakokinetické interakcie (zvýšenie AUC o 11,2 %). Pri dávkach alpelisibu v rozmedzí od 250 do
300 mg sa nepozorovala žiadna zmena v expozícii everolimu.
Odporúča sa opatrnosť, keď sa Piqray používa v kombinácii so substrátmi CYP3A4, ktoré majú aj ďalší časovo závislý inhibičný a indukčný potenciál na CYP3A4, ktorý ovplyvňuje ich vlastný metabolizmus (napr. rifampicín, ribociklib, enkorafenib).
Substráty CYP2C9 s úzkym terapeutickým indexom
Ak neexistujú klinické údaje o CYP2C9, odporúča sa opatrnosť. Hodnotenia in vitro naznačili, že
farmakologická aktivita substrátov CYP2C9 s úzkym terapeutickým indexom, ako je warfarín, sa
môže znížiť indukčnými účinkami alpelisibu na CYP2C9.
C
it
l
i
v
é substráty CYP2B6 s úzkym terapeutickým indexom
Citlivé substráty CYP2B6 (napr. bupropión) alebo substráty CYP2B6 s úzkym terapeutickým oknom sa majú používať opatrne v kombinácii s Piqray, pretože alpelisib môže znížiť klinickú aktivitu týchto liekov.
Látky, ktoré sú substrátmi transportérov
Hodnotenia in vitro naznačili, že alpelisib (a/alebo jeho metabolit BZG791) má potenciál inhibovať
aktivity transportérov liekov OAT3 a črevných BCRP a P-gp. Piqray sa má používať s opatrnosťou
v kombinácii s citlivými substrátmi týchto transportérov, ktoré vykazujú úzky terapeutický index,
pretože Piqray môže zvýšiť systémovú expozíciu týchto substrátov.
Hormonálna antikoncepcia
Neuskutočnili sa žiadne klinické štúdie, ktoré hodnotili potenciál liekových interakcií medzi
alpelisibom a hormonálnou antikoncepciou.
4.6 Fertilita, gravidita a laktácia
Piqray je indikovaný u mužov a postmenopauzálnych žien. Nemá sa používať u žien, ktoré sú alebo môžu byť gravidné alebo dojčia (pozri časť 4.1).
Ženy vofertilnomveku/antikoncepciaumužovažien
Ženy vo fertilnom veku majú byť informované, že štúdie na zvieratách a mechanizmus účinku ukázali,
že alpelisib môže byť škodlivý pre vyvíjajúci sa plod. Štúdie embryofetálneho vývoja na potkanoch
a králikoch preukázali, že perorálne podávanie alpelisibu počas organogenézy vyvolalo
embryotoxicitu, fetotoxicitu a teratogenitu (pozri časť 5.3).
Ak ženy vo fertilnom veku užívajú Piqray, majú používať účinnú antikoncepciu (napr. metóda dvojitej
bariéry), keď užívajú Piqray a najmenej 1 týždeň po ukončení liečby s Piqray.
Pacienti mužského pohlavia, ktorých sexuálne partnerky sú gravidné, možno gravidné alebo môžu otehotnieť, musia počas pohlavného styku, kým užívajú Piqray a najmenej 1 týždeň po ukončení liečby s Piqray, používať kondómy.
Prečítajte si časť 4.6 súhrnu charakteristických vlastností lieku fulvestrant. Gravidita
Piqray nie je indikovaný a nemá sa používať u žien, ktoré sú alebo môžu byť tehotné (pozri časť 4.1).
Nie sú k dispozícii údaje o použití alpelisibu u gravidných žien. Štúdie na zvieratách preukázali
reprodukčnú toxicitu (pozri časť 5.3). Piqray sa neodporúča užívať počas gravidity a u žien
vo fertilnom veku nepoužívajúcich antikoncepciu.
Pred začatím liečby s Piqray sa má overiť stav gravidity u žien vo fertilnom veku. Dojčenie
Nie je známe, či sa alpelisib vylučuje do ľudského mlieka alebo do mlieka u zvierat.
Z dôvodu možných závažných nežiaducich reakcií u dojčeného dieťaťa sa odporúča, aby ženy počas liečby s Piqray a najmenej 1 týždeň po poslednej dávke Piqray nedojčili.
Fertilita
K dispozícii nie sú žiadne údaje o účinkoch alpelisibu na fertilitu. Na základe štúdií toxicity po
opakovanom podaní na zvieratách môže alpelisib zhoršiť fertilitu samcov a samíc s reprodukčným
potenciálom (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Piqray má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacientov je potrebné upozorniť, aby boli opatrní pri vedení vozidiel alebo obsluhe strojov, ak sa u nich počas liečby s Piqray objaví únava alebo rozmazané videnie (pozri časť 4.8).
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Bezpečnostný profil je založený na údajoch od 284 pacientov v ramene s Piqray plus fulvestrant
v dvojito zaslepenej, placebom kontrolovanej štúdii fázy III.
Najčastejšie ADR (hlásené pri frekvencii >20 % v kombinovanej populácii štúdie s prítomnou mutáciou alebo bez prítomnosti mutácie) boli zvýšené plazmatické hladiny glukózy (79,2 %), zvýšená hladina kreatinínu (67,6 %), hnačka (59,5 %), zvýšená hladina gamaglutamyltransferázy (53,2 %), vyrážka (51,8 %), znížený počet lymfocytov (55,3 %), nauzea (46,8 %), zvýšená hladina alanínaminotransferázy (44,0 %), anémia (44,0 %), únava (43,3 %), zvýšená hladina lipázy (42,6 %), znížená chuť do jedla (35,9 %), stomatitída (30,3 %), vracanie (28,5 %), znížená telesná hmotnosť (27,8 %), hypokalciémia (27,8 %), znížená plazmatická hladina glukózy (26,8 %), predĺžený aktivovaný parciálny tromboplastínový čas (aPTT) (22,2 %) a alopécia (20,4 %).
Najčastejšie ADR 3. alebo 4. stupňa (hlásené pri frekvencii ≥2 %) boli zvýšená plazmatická hladina glukózy (39,1 %), vyrážka (19,4 %), zvýšená hladina gamaglutamyltransferázy (12,0 %), znížený počet lymfocytov (9,2 %), hnačka (7,0 %), zvýšená hladina lipázy (7,0 %), hypokaliémia (6,3 %), únava (5,6 %), znížená telesná hmotnosť (5,3 %), anémia (4,9 %), hypertenzia (4,6 %), zvýšená hladina alanínaminotransferázy (4,2 %), nauzea (2,8 %), zvýšená hladina kreatinínu (2,8 %), stomatitída (2,5 %), hypokalciémia (2,1 %) a zápal slizníc (2,1 %).
Najčastejšie ADR, ktoré viedli k ukončeniu liečby, boli hyperglykémia (6,3 %), vyrážka (4,2 %),
hnačka (2,8 %) a únava (2,5 %).
Tabuľkový zoznamnežiaducichreakcií
ADR z klinickej štúdie fázy III a postmarketingové skúsenosti (tabuľka 7) sú uvedené podľa triedy
orgánových systémov MedDRA. V rámci každej triedy orgánových systémov sú ADR zoradené podľa frekvencie, pričom ako prvé sú uvedené najčastejšie reakcie. V rámci každej skupiny frekvencií sú
ADR uvedené v poradí podľa klesajúcej závažnosti. Okrem toho zodpovedajúca kategória frekvencie
pre každú nežiaducu liekovú reakciu je založená na nasledujúcej konvencii: veľmi časté (≥1/10); časté
(≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až <1/1 000); veľmi
zriedkavé (<1/10 000); neznáme (nedá sa odhadnúť z dostupných údajov).
T
abuľka 7 ADR pozorované v klinickej štúdii fázy III a počas postmarketingových skúseností
N
ežiaduca lieková reakcia
|
A
kýkoľvek stupeň (%)
|
3. alebo 4. stupeň (%)
|
Infekcie a nákazy
|
Infekcie močových ciest1
|
Veľmi časté
|
29 (10,2)
|
2 (0,7)*
|
P
oruchy krvi a lymfatického systému
|
Anémia
|
Veľmi časté
|
125 (44,0)
|
14 (4,9)*
|
Znížený počet lymfocytov
|
Veľmi časté
|
157 (55,3)
|
26 (9,2)
|
Znížený počet trombocytov
|
Veľmi časté
|
43 (15,1)
|
4 (1,4)*
|
P
oruchy imunitného systému
|
Precitlivenosť2
|
Časté
|
11 (3,9)
|
2 (0,7)*
|
P
oruchy metabolizmu a výživy
|
Zvýšená hladina glukózy v plazme
|
Veľmi časté
|
225 (79,2)
|
111 (39,1)
|
Znížená hladina glukózy v plazme
|
Veľmi časté
|
76 (26,8)
|
1 (0,4)
|
Znížená chuť do jedla
|
Veľmi časté
|
102 (35,9)
|
2 (0,7)*
|
Hypokaliémia
|
Veľmi časté
|
42 (14,8)
|
18 (6,3)
|
Hypokalciémia
|
Veľmi časté
|
79 (27,8)
|
6 (2,1)
|
Pokles hladiny horčíka
|
Veľmi časté
|
34 (12,0)
|
1 (0,4)
|
Dehydratácia
|
Časté
|
10 (3,5)
|
1 (0,4)*
|
Ketoacidóza3
|
Menej časté
|
2 (0,7)
|
2 (0,7)
|
P
sychické poruchy
|
Insomnia
|
Časté
|
22 (7,7)
|
|
P
oruchy nervového systému
|
Bolesť hlavy
|
Veľmi časté
|
55 (19,4)
|
2 (0,7)*
|
Dysgeúzia4
|
Veľmi časté
|
44 (15,5)
|
1 (0,4)*
|
P
oruchy oka
|
Rozmazané videnie
|
Časté
|
15 (5,3)
|
1 (0,4)*
|
Suchosť oka
|
Časté
|
10 (3,5)
|
|
P
oruchy ciev
|
Hypertenzia
|
Časté
|
27 (9,5)
|
13 (4,6)
|
Lymfedém
|
Časté
|
16 (5,6)
|
|
P
oruchy dýchacej sústavy, hrudníka a mediastína
|
Pneumonitída5
|
Časté
|
5 (1,8)
|
1 (0,4)*
|
P
oruchy gastrointestinálneho traktu
|
Hnačka
|
Veľmi časté
|
169 (59,5)
|
20 (7,0)*
|
Nauzea
|
Veľmi časté
|
133 (46,8)
|
8 (2,8)*
|
Stomatitída6
|
Veľmi časté
|
86 (30,3)
|
7 (2,5)*
|
Vracanie
|
Veľmi časté
|
81 (28,5)
|
2 (0,7)*
|
Bolesť brucha
|
Veľmi časté
|
50 (17,6)
|
4 (1,4)*
|
Dyspepsia
|
Veľmi časté
|
33 (11,6)
|
|
Bolesť zubov
|
Časté
|
13 (4,6)
|
1 (0,4)*
|
Gingivitída
|
Časté
|
11 (3,9)
|
1 (0,4)*
|
Bolesť ďasien
|
Časté
|
9 (3,2)
|
|
Cheilitída
|
Časté
|
8 (2,8)
|
|
Pankreatitída
|
Menej časté
|
1 (0,4)
|
1 (0,4)
|
P
oruchy kože a podkožného tkaniva
|
Vyrážka7
|
Veľmi časté
|
147 (51,8)
|
55 (19,4)*
|
Alopécia
|
Veľmi časté
|
58 (20,4)
|
|
Pruritus
|
Veľmi časté
|
53 (18,7)
|
2 (0,7)*
|
Suchosť kože8
|
Veľmi časté
|
53 (18,7)
|
1 (0,4)*
|
Erytém9
|
Časté
|
18 (6,3)
|
2 (0,7)*
|
Dermatitída10
|
Časté
|
10 (3,5)
|
2 (0,7)*
|
Syndróm palmárno-plantárnej
erytrodyzestézie
|
Časté
|
5 (1,8)
|
|
Multiformný erytém
|
Časté
|
3 (1,1)
|
2 (0,7)*
|
Stevensov-Johnsonov syndróm
|
Menej časté
|
1 (0,4)
|
1 (0,4)*
|
Reakcia na liek s eozinofíliou
a systémové symptómy (DRESS)#
|
Neznáme
|
Neznáme
|
Neznáme
|
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
Svalové kŕče
|
Časté
|
22 (7,7)
|
|
Myalgia
|
Časté
|
19 (6,7)
|
1 (0,4)*
|
Osteonekróza čeľuste
|
Časté
|
16 (5,6)
|
5 (1,8)*
|
P
oruchy obličiek a močových ciest
|
Akútne poškodenie obličiek
|
Časté
|
16 (5,6)
|
5 (1,8)
|
C
elkové poruchy a reakcie v mieste podania
|
Únava11
|
Veľmi časté
|
123 (43,3)
|
16 (5,6)*
|
Zápal slizníc
|
Veľmi časté
|
56 (19,7)
|
6 (2,1)*
|
Periférny edém
|
Veľmi časté
|
47 (16,5)
|
|
Pyrexia
|
Veľmi časté
|
45 (15,8)
|
2 (0,7)
|
Suchosť slizníc12
|
Veľmi časté
|
36 (12,7)
|
1 (0,4)
|
Edém13
|
Časté
|
18 (6,3)
|
|
L
aboratórne a funkčné vyšetrenia
|
Znížená telesná hmotnosť
|
Veľmi časté
|
79 (27,8)
|
15 (5,3)*
|
Zvýšená hladina kreatinínu v krvi
|
Veľmi časté
|
192 (67,6)
|
8 (2,8)*
|
Zvýšená hladina
gamaglutamyltransferázy
|
Veľmi časté
|
151 (53,2)
|
34 (12,0)
|
Zvýšená hladina
alanínaminotransferázy
|
Veľmi časté
|
125 (44,0)
|
12 (4,2)*
|
Zvýšená hladina lipázy
|
Veľmi časté
|
121 (42,6)
|
20 (7,0)
|
Predĺžený aktivovaný parciálny
tromboplastínový čas (aPTT)
|
Veľmi časté
|
63 (22,2)
|
2 (0,7)
|
Znížená hladina albumínu
|
Veľmi časté
|
41 (14,4)
|
1 (0,4)
|
Zvýšená hladina glykozylovaného
hemoglobínu
|
Časté
|
8 (2,8)
|
0
|
* Nepozorovali sa žiadne ADR 4. stupňa
# Nežiaduce reakcie hlásené počas postmarketingových skúseností. Sú získané zo spontánnych hlásení,
pri ktorých nie je vždy možné spoľahlivo stanoviť frekvenciu alebo príčinný vzťah k expozícii liekom.
1 Infekcie močových ciest: zahŕňajú tiež jediný prípad urosepsy
2 Precitlivenosť: zahŕňa tiež alergickú dermatitídu
3 Ketoacidóza: zahŕňa tiež diabetickú ketoacidózu
4 Dysgeúzia: zahŕňa tiež ageúziu, hypogeúziu
5 Pneumonitída: zahŕňa tiež intersticiálne ochorenie pľúc
6 Stomatitída: zahŕňa tiež aftózny vred a vredy v ústach
7 Vyrážka: zahŕňa tiež makulopapulárnu vyrážku, makulárnu vyrážku, generalizovanú vyrážku,
papulárnu vyrážku, pruritickú vyrážku
8 Suchosť kože: zahŕňa tiež kožné trhliny, xerózu, xerodermu
9 Erytém: zahŕňa tiež generalizovaný erytém
10 Dermatitída: zahŕňa tiež akneiformnú dermatitídu
11 Únava: zahŕňa tiež asténiu
12 Suchosť slizníc: zahŕňa tiež suchosť v ústach, vulvovaginálnu suchosť
13 Edém: zahŕňa tiež opuch tváre, edém tváre, opuch očných viečok
|
O
pis vybraných ADR
H
yperglykémia
Hyperglykémia (FPG >160 mg/dl) bola hlásená u 190 (66,9 %) pacientov; udalosti 2. stupňa (FPG
160-250 mg/dl), 3. stupňa (FPG >250-500 mg/dl) a 4. stupňa (FPG >500 mg/dl) boli hlásené u 16,2 %,
33,8 % a 4,6 % pacientov, v uvedenom poradí.
Na základe východiskových hodnôt FPG a HbA1c sa 56 % pacientov považovalo za prediabetických (FPG >100-126 mg/dl [5,6 až 6,9 mmol/l] a/alebo HbA1c 5,7-6,4 %) a 4,2 % pacientov sa považovalo za diabetikov (FPG ≥126 mg/dl [≥7,0 mmol/l] a/alebo HbA1c ≥6,5 %). U 74,8 % pacientov, ktorí boli na začiatku liečby prediabetickí, sa počas liečby alpelisibom vyskytla hyperglykémia (akéhokoľvek stupňa). U všetkých pacientov s hyperglykémiou ≥2. stupňa (FPG ≥160 mg/dl) bol medián času do prvého výskytu 15 dní (rozmedzie: 5 dní až 900 dní) (na základe laboratórnych nálezov). Medián trvania hyperglykémie ≥2. stupňa bol 10 dní (95% IS: 8 až 13 dní). U pacientov s hyperglykémiou
≥2. stupňa bol medián času do zlepšenia (najmenej o jeden stupeň od prvej udalosti) 8 dní (95% IS: 8
až 10 dní). U všetkých pacientov, ktorí pokračovali v liečbe fulvestrantom po ukončení liečby
s Piqray, sa hladiny FPG vrátili na pôvodnú úroveň (normálnu).
Hyperglykémia sa liečila antidiabetikami, pozri časť 4.4.
Vyráž ka
Udalosti výskytu vyrážok (vrátane makulopapulárnej vyrážky, makulárnej, generalizovanej,
papulárnej a pruritickej, dermatitídy a akneiformnej dermatitídy) boli hlásené u 153 (53,9 %)
pacientov. Vyrážka mala prevažne miernu alebo stredne ťažkú formu (1. alebo 2. stupňa) a reagovala na liečbu, a v niektorých prípadoch bola spojená so svrbením a suchosťou kože. Udalosti 2. a 3. stupňa boli hlásené u 13,7 % a 20,1 % pacientov, v uvedenom poradí, s mediánom času do prvého výskytu
12 dní (rozmedzie: 2 dni až 220 dní).
Spomedzi pacientov, ktorí dostávali profylaktickú liečbu proti vyrážkam vrátane antihistaminík, bol výskyt vyrážky hlásený menej často ako v celkovej populácii; 26,1 % vs. 53,9 % pre všetky stupne,
11,4 % vs. 20,1 % pre 3. stupeň a 3,4 % vs. 4,2 % pre výskyt vyrážky vedúci k trvalému ukončeniu liečby s Piqray. Liečba antihistaminikami môže teda začať profylakticky, v čase začatia liečby s Piqray.
Gastrointestinálna toxicita (nauzea, hnačk a , vracanie)
Hnačka, nauzea a vracanie boli hlásené u 59,5 %, 46,8 % a 28,5 % pacientov, v uvedenom poradí
(pozri tabuľku 7).
Udalosti hnačky 2. a 3. stupňa boli hlásené u 19,7 % a 7,0 % pacientov, v uvedenom poradí, s mediánom času do prvého výskytu ≥2. stupňa 50 dní (rozmedzie: 1 deň až 954 dní).
Počas liečby s Piqray bola hlásená závažná hnačka a klinické následky, ako je dehydratácia a akútne poškodenie obličiek, ktoré boli vyliečené vhodným zásahom (pozri tabuľku 4). Na zvládnutie symptómov sa použili antiemetiká (napr. ondansetron) a lieky proti hnačke (napr. loperamid) u 28/153 (17,6 %) a 109/169 (64,5 %) pacientov, v uvedenom poradí.
Ost eonek róza čeľuste (o steonecrosis of the jaw, ONJ)
ONJ bola hlásená u 5,6 % pacientov (16/284) v ramene s Piqray plus fulvestrant. Pätnásti pacienti, ktorí mali ONJ, boli súbežne exponovaní bisfosfonátom (napr. kyselina zoledrónová). U pacientov, ktorí dostávajú Piqray a bisfosfonáty, nie je preto možné vylúčiť riziko vzniku ONJ.
St arší pacienti
U pacientov vo veku ≥65 rokov liečených alpelisibom s fulvestrantom bola vyššia incidencia
hyperglykémie 3.-4. stupňa (45,3 %) v porovnaní s pacientmi vo veku <65 rokov (33,5 %), zatiaľ čo
u pacientov vo veku <75 rokov sa hyperglykémia 3.-4. stupňa vyskytla u 36 % pacientov v porovnaní s 55,9 % u pacientov vo veku ≥75 rokov.
H
l
ásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieSymptómyNežiaduce reakcie spojené s predávkovaním boli v súlade s bezpečnostným profilom Piqray a zahŕňali
hyperglykémiu, nauzeu, asténiu a vyrážku.
LiečbaVo všetkých prípadoch predávkovania sa podľa potreby majú začať všeobecné symptomatické
a podporné opatrenia. Nie je známe žiadne antidotum pre Piqray.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: cytostatiká, iné cytostatiká, ATC kód: L01XX65
Mechanizmus účinkuAlpelisib je α-špecifický inhibítor fosfatidylinozitol 3-kinázy (PI3Kα) triedy I. Získanie funkčných'
mutácií v géne kódujúcom katalytickú α-podjednotku PI3K (PIK3CA) vedie k aktivácii signalizácie
PI3Kα a AKT, bunkovej transformácii a tvorbe nádorov v modeloch
in vitro a
in vivo.
V bunkových líniách karcinómu prsníka alpelisib inhiboval fosforyláciu cieľov PI3K vrátane AKT, a vykazoval aktivitu v bunkových líniách nesúcich mutáciu PIK3CA.
In vivo alpelisib inhiboval signálnu dráhu PI3K/AKT a znížil rast nádoru v modeloch xenoštepu,
vrátane modelov karcinómu prsníka.
Ukázalo sa, že inhibícia PI3K liečbou alpelisibom indukuje zvýšenie transkripcie estrogénového receptora (ER) v bunkách karcinómu prsníka. Kombinácia alpelisibu a fulvestrantu preukázala zvýšenú protinádorovú aktivitu v porovnaní s každou samotnou liečbou v modeloch xenoštepu odvodených z ER pozitívnych, PIK3CA mutovaných bunkových línií karcinómu prsníka.
Signálna dráha PI3K/AKT je zodpovedná za homeostázu glukózy, a preto sa pri cieľovej nežiaducej reakcii inhibície PI3K očakáva hyperglykémia.
Klinická účinnosťabezpečnosťKlinická účinnosť a bezpečnosť Piqray sa hodnotili v pilotnej fáze III randomizovanej, dvojito
zaslepenej, placebom kontrolovanej štúdii s alpelisibom v kombinácii s fulvestrantom
u postmenopauzálnych žien a mužov s HR+, HER2- pokročilým (lokoregionálne rekurentným alebo metastatickým) karcinómom prsníka, ktorých ochorenie progredovalo alebo sa opakovane vyskytlo
počas liečby založenej na inhibítoroch aromatázy alebo po nej (v kombinácii s inhibítorom CDK4/6
alebo bez neho).
Celkom 572 pacientov bolo zaradených do dvoch kohort, jedna kohorta s mutáciami PIK3CA a jedna kohorta bez mutácií PIK3CA karcinómu prsníka. Pacienti boli randomizovaní, aby dostávali buď alpelisib 300 mg plus fulvestrant alebo placebo plus fulvestrant v pomere 1:1. Randomizácia bola stratifikovaná prítomnosťou metastáz v pľúcach a/alebo pečeni a predchádzajúcou liečbou inhibítorom (inhibítormi) CDK4/6.
V kohorte s mutáciami PIK3CA bolo randomizovaných 169 pacientov s jednou alebo viacerými mutáciami PIK3CA (C420R, E542K, E545A, E545D [len 1635G>T], E545G, E545K, Q546E, Q546R, H1047L, H1047R alebo H1047Y), aby dostávali alpelisib v kombinácii s fulvestrantom,
a 172 pacientov bolo randomizovaných, aby dostávali placebo v kombinácii s fulvestrantom. V tejto kohorte malo 170 (49,9 %) pacientov metastázy v pečeni/pľúcach a 20 (5,9 %) pacientov sa predtým
liečilo inhibítorom CDK4/6.
Pacienti mali medián veku 63 rokov (rozmedzie: 25 až 92 rokov). 44,9 % pacientov bolo vo veku
65 rokov alebo starší a ≤85 rokov. Zahrnutí pacienti boli belosi (66,3 %), aziati (21,7 %) a černosi
alebo afroameričania (1,2 %). Populácia štúdie zahŕňala jedného mužského jedinca zaradeného do kohorty s mutáciou PIK3CA a liečeného alpelisibom a fulvestrantom. 66,0 % a 33,4 % jedincov malo výkonnostný stav hodnotený podľa kritérií ECOG 0 a 1, v uvedenom poradí.
97,7 % pacientov predtým dostávalo endokrinnú liečbu. U 67,7 % jedincov bola poslednou liečbou pred zaradením do štúdie endokrinná liečba. Letrozol a anastrozol boli najčastejšie používanou endokrinnou liečbou. Nastavenie poslednej endokrinnej liečby pred zaradením do štúdie bola terapeutická liečba u 47,8 % jedincov a adjuvantná liečba u 51,9 % jedincov. Celkovo u 85,6 % pacientov sa ochorenie považovalo za rezistentné na endokrinnú liečbu; primárna endokrinná rezistencia (de novo rezistencia) sa pozorovala u 13,2 % a sekundárna endokrinná rezistencia (relaps/progresia po počiatočnej odpovedi) u 72,4 % pacientov.
Demografické charakteristiky a východiskové charakteristiky ochorenia, stav výkonnosti hodnotený podľa ECOG, nálož nádoru a predchádzajúca antineoplastická liečba medzi ramenami štúdie boli dobre vyvážené.
Počas randomizovanej fázy liečby sa alpelisib 300 mg alebo placebo podávali perorálne pravidelne raz denne. Fulvestrant 500 mg sa podával intramuskulárne v 1. cykle 1. a 15. deň a potom následne 1. deň
28-dňového cyklu počas fázy liečby (podávanie ±3 dni).
Počas štúdie alebo po progresii ochorenia nemali pacienti povolený prechod z liečby s placebom na
liečbu s alpelisibom.
Primárnym koncovým ukazovateľom štúdie bolo prežívanie bez progresie ochorenia (progression-free survival, PFS) u pacientov s pokročilým karcinómom prsníka s mutáciami PIK3CA na základe hodnotenia skúšajúceho podľa kritérií hodnotenia odpovede solídnych tumorov (Response Evaluation Criteria in Solid Tumors, RECIST v1.1). Kľúčovým sekundárnym koncovým ukazovateľom bolo celkové prežívanie (overall survival, OS) u pacientov s mutáciou PIK3CA.
Ďalšie sekundárne koncové ukazovatele zahŕňali PFS u pacientov bez mutácií PIK3CA, OS
u pacientov bez mutácií PIK3CA.
Medián trvania sledovania (medzi randomizáciou a dátumom ukončenia zberu údajov 12. júna 2018)
v kohorte s mutáciami PIK3CA bol 20 mesiacov.
Výsledky účinnosti v kohorte s mutáciami PIK3CA preukázali štatisticky významné zlepšenie PFS
u pacientov dostávajúcich alpelisib plus fulvestrant v porovnaní s pacientmi, ktorí dostávali placebo plus fulvestrant s odhadovaným 35% znížením rizika progresie ochorenia alebo úmrtia.
T
abuľka 8 Štúdia C2301 – Súhrn výsledkov účinnosti (kohorta s mutáciami PIK3CA)
|
Piqray + fulvestrant
(
n=169)
|
Placebo + fulvestrant
(
n=172)
|
Ú
daje na základe primárnej analýzy údajov s dátumom ukončenia zberu údajov 12. júna 2018
|
Medián prežívania bez progresie ochorenia (PFS) (mesiace, 95% IS)
|
Rádiologické hodnotenie skúšajúcim#
|
Kohorta s mutáciami PIK3CA
(N=341)
|
11,0
(7,5-14,5)
|
5,7
(3,7-7,4)
|
Pomer rizika (95% IS)
|
0,65 (0,50-0,85)
|
p-hodnotaa
|
0,00065
|
Hodnotenie zaslepenou nezávislou revíznou komisiou*#
|
Kohorta s mutáciami PIK3CA
(N=173)
|
11,1
(7,3-16,8)
|
3,7
(2,1-5,6)
|
Pomer rizika (95% IS)
|
0,48 (0,32-0,71)
|
p-hodnota
|
N/A
|
Ú
daje na základe druhej predbežnej OS analýzy
s dátumom ukončenia zberu údajov
30. septembra
2019
|
Medián prežívania bez progresie ochorenia (PFS) (mesiace, 95% IS)
|
Rádiologické hodnotenie skúšajúcim#
|
Kohorta s mutáciami PIK3CA
(N=341)
|
11,0
(7,5-14,5)
|
5,7
(3,7-7,4)
|
Pomer rizika (95% IS)
|
0,64 (0,50-0,81)
|
p-hodnota
|
N/A
|
C
elkové prežívanie (OS) (mesiace, 95% IS)
|
Kohorta s mutáciami PIK3CA
(N=341)
|
40,6
(32,2-NE)
|
31,2
(26,8-NE)
|
Hazard ratio (95% CI)
|
0,77 (0,56-1,06)
|
p-valuea
|
0,06
|
IS = interval spoľahlivosti; N = počet pacientov; N/A = neaplikovateľné; NE = nehodnotiteľné
a p-hodnota je získaná z jednostranného stratifikovaného log-rank testu.
# Podľa RECIST 1.1
* Na základe 50% kontrolovaného prístupu
|
|
|
|
|
|
V kohorte s mutáciou PIK3CA, analýzy PFS v podskupinách na základe hodnotenia skúšajúcim
pomocou randomizačných stratifikačných faktorov preukázali všeobecne konzistentný liečebný účinok v prospech ramena s alpelisibom, bez ohľadu na prítomnosť alebo neprítomnosť pľúcnych/pečeňových metastáz.
U 20 pacientov s predchádzajúcou liečbou inhibítorom CDK4/6 bol pomer rizika (
hazard ratio, HR)
0,48 (95% IS: 0,17; 1,36); medián PFS bol 1,8 mesiacov (95% IS: 1,7; 3,6) v ramene s placebom plus fulvestrant a 5,5 mesiacov (95% IS: 1,6; 16,8) v ramene s alpelisibom plus fulvestrant.
Na základe analýzy údajov k dátumu ukončenia zberu údajov 12. jún 2018 boli výsledky PFS pre podskupinu endokrinne rezistentných pacientov (HR=0,64; 95% IS: 0,49; 0,85, n=292) a endokrinne citlivých pacientov (HR=0,87; 95% IS: 0,35; 2,17, n=39) v prospech ramena s alpelisibom plus fulvestrant. Počet endokrinne citlivých pacientov s mutáciou PIK3CA bol obmedzený (n=39) a má sa interpretovať s opatrnosťou.
Na základe analýzy údajov k dátumu ukončenia zberu údajov 12. jún 2018 bola celková miera odpovede u pacientov s merateľným ochorením na začiatku štúdie 35,7 % (95% IS: 27,4; 44,7)
v ramene s alpelisibom plus fulvestrant a 16,2 % (95% IS: 10,4; 23,5) v ramene s placebom plus fulvestrant.
 O
brázok 1 Kaplanova-Meierova krivka prežívania bez progresie ochorenia v kohorte s mutáciami PIK3CA na základe hodnotenia lokálneho skúšajúceho
O
brázok 1 Kaplanova-Meierova krivka prežívania bez progresie ochorenia v kohorte s mutáciami PIK3CA na základe hodnotenia lokálneho skúšajúceho
Sledované časy
Alpelisib + fulv. (n/N = 103/169) Placebo + fulv. (n/N = 129/172)
Pomer rizika = 0,65
95% IS [0,50; 0,85]
Kaplanove-Meierove mediány (mesiace) Alpelisib + fulv.: 11,0
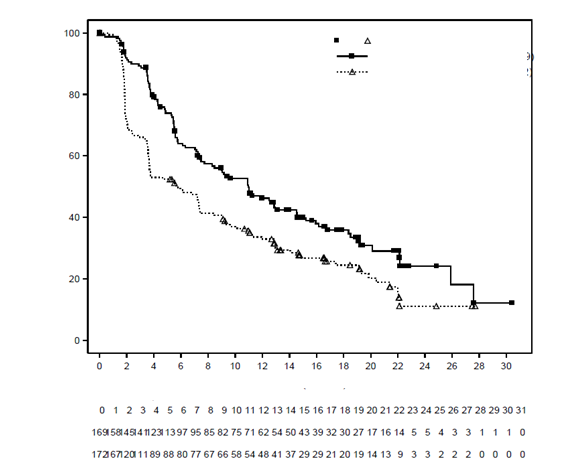
Placebo + fulv.: 5,7
Log-rank 1-stranná p-hodnota = 0,00065
Čas (mesiace)
Počet pacientov riziku
Čas (mesiace)
Alpelisib + fulv.
Placebo + fulv.
Kohorta bez mutácií PIK3CA
U pacientov, ktorých tumory nemali mutáciu tkaniva PIK3CA, sa nepozoroval žiadny prínos v PFS.
Predc hádzaj úca l ieč ba f ul ves t rantom v št údii CBY L719X2101
Pacienti s predchádzajúcou liečbou fulvestrantom neboli zahrnutí do pilotnej štúdie. V štúdii CBYL719X2101 fázy I hlásilo 39 jedincov predchádzajúcu liečbu fulvestrantom. Najlepšie celkové odpovede na liečbu alpelisibom plus fulvestrant u 21 jedincov s mutáciou PIK3CA a merateľným ochorením na začiatku štúdie boli čiastočná odpoveď u 7 jedincov, stabilné ochorenie u 11 jedincov a progresívne ochorenie u 2 jedincov. Kvôli obmedzeným údajom sa preto dôkaz o účinnosti tejto liečby u pacientov s predchádzajúcou liečbou fulvestrantom zatiaľ nepotvrdil (pozri časť 4.4).
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Piqray vo
všetkých podskupinách pediatrickej populácie pre karcinóm prsníka (informácie o použití
v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Farmakokinetika alpelisibu sa skúmala u pacientov v režime perorálneho dávkovania v rozmedzí od
30 do 450 mg denne. Zdraví jedinci dostávali jednotlivé perorálne dávky v rozmedzí od 300 do
400 mg. Farmakokinetika bola porovnateľná u onkologických pacientov i zdravých jedincov.
Absorpcia
Po perorálnom podaní alpelisibu sa medián času do dosiahnutia maximálnej plazmatickej koncentrácie
(Tmax) pohyboval v rozmedzí 2,0 až 4,0 hodín, nezávisle od dávky, času alebo režimu. Na základe
modelovania absorpcie bola biologická dostupnosť odhadnutá ako veľmi vysoká (>99 %) pri podmienkach užívania spolu s jedlom, ale nižšia pri podmienkach užívania nalačno (~68,7 % pri dávke 300 mg). U väčšiny pacientov sa dá očakávať, že plazmatické hladiny alpelisibu sa
v rovnovážnom stave pri dennom podávaní dosiahnu na 3. deň od začiatku liečby.
Vplyv jedla
Absorpcia alpelisibu je ovplyvnená jedlom. U zdravých dobrovoľníkov došlo po jednorazovej 300 mg perorálnej dávke alpelisibu, v porovnaní so stavom po vysokokalorickom jedle s vysokým obsahom
tuku (high-fat high-calorie, HFHC) (985 kalórií s 58,1 g tuku) k zvýšeniu AUCinf o 73 % a Cmax
o 84 %, a po LFLC jedle (334 kalórií s 8,7 g tuku) došlo k zvýšeniu AUCinf o 77 % a Cmax o 145 %.
Nezistil sa žiadny významný rozdiel AUCinf medzi LFLC a HFHC s geometrickým priemerným pomerom 0,978 (IS: 0,876; 1,09), čo ukazuje, že ani obsah tuku, ani celkový kalorický príjem nemajú významný vplyv na absorpciu. Potenciálna príčina vplyvu jedla je zvýšenie gastrointestinálnej
rozpustnosti žlčou, ktorá sa vylučuje ako odpoveď na príjem jedla. Piqray sa preto musí užívať ihneď
po jedle, každý deň približne v rovnakom čase.
Distribúcia
Alpelisib sa mierne viaže na proteín s voľnou frakciou 10,8 % bez ohľadu na koncentráciu. Alpelisib
bol rovnomerne distribuovaný medzi červené krvinky a plazmu s priemerným pomerom in vivo krv
k plazme 1,03. Keďže alpelisib je substrátom efluxných transportérov u ľudí, neočakáva sa, že dôjde k penetrácii hematoencefalickej bariéry u ľudí. Distribučný objem alpelisibu v rovnovážnom stave (Vss/F) sa odhaduje na 114 litrov (intersubjektívne CV% 46 %).
Biotransformácia
Štúdie in vitro preukázali, že tvorba hydrolytického metabolitu BZG791 chemickou a enzymatickou
hydrolýzov amidov bola hlavnou metabolickou cestou, po ktorej nasledoval menší podiel metabolizácie cez CYP3A4. K hydrolýze alpelisibu dochádza systematicky chemickým rozkladom a enzymatickou hydrolýzou ubikvitárne exprimovanými enzýmami s vysokou kapacitou (esterázy, amidázy, cholínesteráza), ktoré nie sú obmedzené iba na pečeň. Metabolity a glukuronidy sprostredkované CYP3A4 predstavovali ~15 % dávky; BZG791 predstavoval ~40-45 % dávky. Zvyšok absorbovanej frakcie dávky sa vylúčil ako alpelisib.
Eliminácia
Alpelisib vykazuje nízky klírens s 9,2 l/h (CV% 21 %) na základe populačnej farmakokinetickej
analýzy pri podmienkach užívania spolu s jedlom. Biologický polčas odvodený z populácie, nezávislý od dávky a času, bol 8 až 9 hodín v rovnovážnom stave s dávkou 300 mg raz denne.
V štúdii hmotnostnej rovnováhy u ľudí sa po perorálnom podaní alpelisib a jeho metabolity vylučovali
stolicou (81,0 %), najmä hepatobiliárnym exportom a/alebo intestinálnou sekréciou alpelisibu, alebo
sa metabolizovali na BZG791. Vylučovanie močom je malé (13,5 %), s nezmeneným alpelisibom (2 %). Po jednorazovom perorálnom podaní [14C]-alpelisibu sa do 8 dní získalo 94,5 % z celkovej podanej rádioaktívnej dávky.
Linearita/nelinearita
Zistilo sa, že farmakokinetika je lineárna s ohľadom na dávku a čas pri podmienkach užívania spolu
s jedlom v rozmedzí 30 až 450 mg. Po viacnásobných dávkach je expozícia alpelisibu (AUC) v rovnovážnom stave iba mierne vyššia ako expozícia po jednorazovej dávke, s priemernou akumuláciou 1,3 až 1,5 pri dennom dávkovacom režime.
Metabolické interakcie
Substráty CYP3A4
V štúdii liekových interakcií s citlivým substrátom CYP3A4 everolimom sa AUC zvýšila o 11,2 %.
V dôsledku liekovej interakcie so substrátmi CYP3A4 sa neočakáva žiadna klinicky významná zmena.
Induktory a inhibítory CYP3A4
Účinky induktorov alebo inhibítorov CYP3A4 sa v klinických štúdiách nehodnotili. V dôsledku nízkej frakcie (<15 %) metabolizovanej prostredníctvom CYP3A4 sa neočakávajú žiadne klinicky významné
zmeny v celkovej expozícii.
Interakcia na úrovni transportérov
Na základe in vitro údajov nie je možné u pacientov pri terapeutickej dávke vylúčiť inhibíciu
renálneho transportéra organického aniónu 3 (organic anion transporter 3, OAT3) alpelisibom
(a/alebo jeho metabolitu BZG791).
Alpelisib vykázal iba slabú in vitro inhibíciu voči ubikvitárne exprimovaným efluxným transportérom (P-gp, BCRP, MRP2, BSEP), transportérom solutovaných nosičov na vstupe do pečene (OATP1B1, OATP1B3, OCT1) a transportérom solutovaných nosičov v obličkách (OAT1, OCT2, MATE1, MATE2K). Pretože neviazané systematické koncentrácie v rovnovážnom stave (alebo koncentrácie na vstupe do pečene) pri terapeutickej dávke aj pri maximálnej tolerovanej dávke sú signifikantne nižšie ako experimentálne stanovené neviazané inhibičné konštanty alebo IC50, inhibícia sa nebude prejavovať v klinickej významnosti. V dôsledku vysokých koncentrácií alpelisibu v črevnom lúmene nie je možné úplne vylúčiť účinok na črevný P-gp a BCRP.
Osobitné populácie
Vplyv veku, telesnej hmotnosti a pohlavia
Populačná farmakokinetická analýza ukázala, že neexistujú žiadne klinicky relevantné vplyvy veku, telesnej hmotnosti alebo pohlavia na systémovú expozíciu alpelisibu, ktorá by si mohla vyžadovať
úpravu dávky Piqray.
Paediatrickí pacienti (ml adší ako 18 rokov)
Farmakokinetika Piqray u detí vo veku 0-18 rokov nebola stanovená. K dispozícii nie sú žiadne údaje.
St arší pacienti (vo veku 65 rok ov al ebo st arší )
Z 284 pacientov, ktorí dostali Piqray v štúdii fázy III (v ramene s alpelisibom plus fulvestrant) bolo
117 pacientov vo veku ≥65 rokov a 34 pacientov bolo vo veku medzi 75 a 87 rokmi. Medzi týmito pacientmi a mladšími pacientmi sa nepozorovali žiadne celkové rozdiely v expozícii Piqray (pozri časť 4.2).
Rasa/et ni cká prí slušnosť
Populačná farmakokinetická analýza a farmakokinetická analýza zo štúdie fázy I u japonských pacientov s karcinómom ukázala, že neexistujú žiadne klinicky významné vplyvy etnickej príslušnosti na systémovú expozíciu Piqray.
Nekompartmentálne farmakokinetické parametre po jednorazovej dávke a viacnásobných denných dávkach Piqray u japonských pacientov boli veľmi podobné parametrom hláseným u belošskej populácie.
Poškodeni e f unkci e obl iči ek
Na základe populačnej farmakokinetickej analýzy, ktorá zahŕňala 117 pacientov s normálnou funkciou obličiek (eGFR ≥90 ml/min/1,73 m2) / (CLcr ≥90 ml/min), 108 pacientov s miernym poškodením funkcie obličiek (eGFR 60 až <90 ml/min/1,73 m2)/ (CLcr 60 až <90 ml/min) a 45 pacientov so
stredne ťažkým poškodením funkcie obličiek (eGFR 30 až <60 ml/min/1,73 m2), mierne a stredne
ťažké poškodenie funkcie obličiek nemalo žiadny vplyv na expozíciu alpelisibu (pozri časť 4.2).
Poškodeni e f unkci e peče ne
Na základe farmakokinetickej štúdie u pacientov s poškodením funkcie pečene malo stredne ťažké
a ťažké poškodenie funkcie pečene zanedbateľný vplyv na expozíciu alpelisibu (pozri časť 4.2).
Priemerná expozícia alpelisibu bola zvýšená 1,26-násobne u pacientov s ťažkým (GMR: 1,00 pre Cmax;
1,26 pre AUClast/AUCinf) poškodením funkcie pečene.
Na základe populačnej farmakokinetickej analýzy, ktorá zahŕňala 230 pacientov s normálnou funkciou pečene, 41 pacientov s miernym poškodením funkcie pečene a žiadnych pacientov so stredne ťažkým poškodením funkcie pečene, čo ďalej podporovalo zistenia zo štúdie zameranej na poškodenie funkcie pečene, mierne a stredne ťažké poškodenie funkcie pečene nemalo žiadny vplyv na expozíciu alpelisibu (pozri časť 4.2).
5.3 Predklinické údaje o bezpečnosti
Farmakologická bezpečnosťa toxicita po opakovanom podávaní
Väčšina pozorovaných účinkov alpelisibu súvisí s jeho farmakologickou aktivitou ako
p110α-špecifického inhibítora dráhy PI3K, ako je vplyv na homeostázu glukózy, ktorý vedie
k hyperglykémii a riziku zvýšeného krvného tlaku. Kostná dreň a lymfoidné tkanivo, pankreas
a niektoré reprodukčné orgány oboch pohlaví boli hlavnými cieľovými orgánmi pre nežiaduce účinky. Účinky na kostnú dreň a lymfoidné tkanivo boli spravidla reverzibilné po ukončení liečby. Účinky na pankreas a reprodukčné orgány sa úplne nezmenili, ale mali tendenciu k reverzii.
Kardi ovas kul árna farmakologi cká bezpe čnosť
Inhibícia hERG kanálov (IC50 9,4 µM) in vitro sa preukázala pri koncentráciách ~13-násobne vyšších, ako je expozícia u ľudí pri odporúčanej dávke 300 mg/deň. Nepozoroval sa žiadny relevantný elektrofyziologický účinok na psov.
Karcinogenita a mutagenita
Neuskutočnili sa žiadne štúdie karcinogenity.
Výsledky štandardných štúdií genotoxicity s alpelisibom boli negatívne. V štúdii toxicity po opakovanej dávke na potkanoch, pri ktorej bola integrovaná analýza mikronukleov, boli úrovne expozície alpelisibu u samcov 1,4-krát vyššie a u samíc 2-násobne vyššie ako terapeutické expozície u dospelých ľudí liečených odporúčanou dávkou. Preto nie je možné vylúčiť genotoxicitu alpelisibu u ľudí.
Reprodukčná toxicita
Štúdie embryo-fetálneho vývoja na potkanoch a králikoch preukázali, že perorálne podanie alpelisibu
počas organogenézy vyvolalo embryotoxicitu, fetotoxicitu a teratogenitu. U potkanov a králikov sa po
prenatálnej expozícii alpelisibu pozoroval zvýšený výskyt pre- a postimplantačných strát, znížená hmotnosť plodu a zvýšený výskyt abnormalít plodu (zväčšená mozgová komora, znížená osifikácia kostí a kostné malformácie), ktoré sa začali pri expozíciách nižších, ako sú expozície u ľudí pri najvyššej odporúčanej dávke 300 mg, čo naznačuje potenciálny klinický význam.
Štúdia fertility na potkanoch nebola uskutočnená. V štúdiách toxicity po opakovanom podávaní sa však pozorovali nežiaduce účinky na reprodukčné orgány, ako je vaginálna alebo maternicová atrofia a zmeny cyklov ruje u potkanov, zníženie hmotnosti prostaty a semenníkov u potkanov a psov
a atrofia prostaty u psov pri klinicky relevantných dávkach na základe AUC.
Fototoxicita
In vitro test fototoxicity na bunkovej línií fibroblastov Balb/c 3T3 u myší neidentifikoval relevantný
potenciál fototoxicity pre alpelisib.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
mikrokryštalická celulóza
manitol
sodná soľ karboxymetylškrobu
hypromelóza
stearát horečnatý
Filmový obal
hypromelóza
čierny oxid železitý (E172)
červený oxid železitý (E172) oxid titaničitý (E171) makrogol
mastenec
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah
PVC/PCTFE/Al (polyvinylchlorid/polychlórotrifluóroetylén/hliník) blister zatavený do blistrovej karty obsahujúcej 14 filmom obalených tabliet.
Piqray 50 mg a 200 mg filmom obalené tablety
Balenia obsahujúce 28 filmom obalených tabliet (14 po 50 mg a 14 po 200 mg) alebo 56 filmom
obalených tabliet (28 po 50 mg a 28 po 200 mg).
Multibalenia obsahujúce 168 filmom obalených tabliet (3x 56, z ktorých každé obsahuje 28 tabliet po
50 mg a 28 tabliet po 200 mg).
Piqray 150 mg filmom obalené tablety
Balenia obsahujúce 28 alebo 56 filmom obalených tabliet.
Multibalenia obsahujúce 168 (3x 56) filmom obalených tabliet.
Piqray 200 mg filmom obalené tabletyBalenia obsahujúce 14 alebo 28 filmom obalených tabliet.
Multibalenia obsahujúce 84 (3x 28) filmom obalených tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Írsko
8. REGISTRAČNÉ ČÍSLAEU/1/20/1455/001-009
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu