
kčný limit: 100 kópií/ml, čo zodpovedá 50 medzinárodným jednotkám/ml). Trvalá odpoveď sa definovala ako jedna negatívna vzorka približne 6 mesiacov po ukončení liečby.
Tabuľka 12: Virologická odpoveď u HCV pacientov
| Monoterapia Pegasysom
| Kombinovaná liečba Pegasysom
|
pacienti s cirhózou aj bez nej
| Pacienti s cirhózou
| pacienti s cirhózou aj bez nej
|
Štúdia NV15496 + NV15497 + NV15801
| Štúdia NV15495
| Štúdia
NV15942
| Štúdia NV15801
|
Pegasys
180 µg
(N = 701)
48 týždňov
| interferón alfa-2a
6 MIU/3 MIU
&
3 MIU
(N = 478)
48 týždňov
| Pegasys
180 µg
(N = 87)
48 týždňov
| interferón alfa-2a
3 MIU
(N = 88)
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200
mg
(N = 436)
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
(N = 453)
48 týždňov
| interferón alfa-2b
3 MIU
&
ribavirín
1000/1200
mg
(N = 444)
48 týždňov
|
Odpoveď
na konci liečby
|
55 - 69 %
|
22 - 28 %
|
44 %
|
14 %
|
68 %
|
69 %
|
52 %
|
Celková
trvalá odpoveď
|
28 - 39 %
|
11 - 19 %
|
30 %∗
|
8 %∗
|
63 %
|
54 %∗∗
|
45 %∗∗
|
∗ 95 % CI pre rozdiel: 11 % až 33 % p = 0,001 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
∗∗ 95 % CI pre rozdiel: 3 % až 16 % p = 0,003 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
Virologické odpovede na liečbu vo vzťahu ku genotypu a vírusovej záťaži pred liečbou u HCV monoinfikovaných pacientov liečených Pegasysom v kombinácii s ribavirínom a v závislosti na genotype, vírusovej záťaži pred liečbou a rýchlej virologickej odpovede v 4. týždni sú zhrnuté
v tabuľke 13 a v tabuľke 14. Výsledky štúdie NV15942 poskytujú racionálne podklady pre odporúčania liečebných režimov na základe genotypu, vírusovej záťaže na začiatku liečby a virologickej odpovede v 4. týždni (pozri tabuľky 1, 13 a 14).
Rozdiel medzi liečebnými režimami nebol vo všeobecnosti ovplyvnený prítomnosťou/neprítomnosťou cirhózy; preto tieto základné charakteristiky neovplyvňujú tieto odporúčania pre liečbu pre
genotypy 1, 2 alebo 3.
Tabuľka 13:Trvalá virologická odpoveď u HCV pacientov po kombinovanej liečbe Pegasysom a ribavirínom v závislosti na genotype a vírusovej záťaži pred liečbou
|
Štúdia NV15942
|
Štúdia NV15801
|
Pegasys
180 µg
&
ribavirín
800 mg
24 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
|
Pegasys
180 µg
&
ribavirín
800 mg
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Interferón alfa-
2b
3 MIU
&
ribavirín
1000/1200 mg
48 týždňov
|
Genotyp 1
Nízka
vírusová záťaž
Vysoká vírusová záťaž
|
29 %(29/101)
41 %(21/51)
16 %(8/50)
|
42 %(49/118) ∗
52 %(37/71)
26 %(12/47)
|
41 %(102/250) ∗
55 %(33/60)
36 %(69/190)
|
52 %(142/271) ∗
65 %(55/85)
47 %(87/186)
|
45 %(134/298)
53 %(61/115)
40 %(73/182)
|
36 %(103/285)
44 %(41/94)
33 %(62/189)
|
Genotyp 2/3
Nízka
vírusová záťaž
Vysoká vírusová záťaž
|
84 %(81/96)
85 %(29/34)
84 %(52/62)
|
81 %(117/144)
83 %(39/47)
80 %(78/97)
|
79 %(78/99)
88 %(29/33)
74 %(49/66)
|
80 %(123/153)
77 %(37/48)
82 %(86/105)
|
71 %(100/140)
76 %(28/37)
70 %(72/103)
|
61 %(88/145)
65 %(34/52)
58 %(54/93)
|
Genotyp 4
|
(0/5)
|
(8/12)
|
(5/8)
|
(9/11)
|
(10/13)
|
(5/11)
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; Vysoká vírusová záťaž = > 800 000 IU/ml
* Pegasys 180 µg & ribavirín 1000/1200 mg, 48 týždňov v porovnaní s Pegasysom 180 µg & ribavirínom 800 mg
48 týždňov: Odds Ratio (95 % CI) = 1,52 (1,07 až 2,17), p=0,020 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
* Pegasys 180 µg & ribavirín 1000/1200 mg, 48 týždňov v porovnaní s Pegasysom 180 µg & ribavirínom 1000/1200 mg,
24 týždňov: Odds Ratio (95 % CI) = 2,12 (1,30 až 3,46), p=0,002 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
Možnosť zvážiť skrátenie dĺžky trvania liečby na 24 týždňov u pacientov s genotypom 1 a 4 sa sledovala na podklade dosiahnutej trvalej virologickej odpovede u pacientov s rýchlou virologickou odpoveďou v 4. týždni v štúdiách NV15942 a ML17131 (pozri tabuľku 14).
Štúdia NV15942
| Štúdia ML17131
|
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Genotyp 1
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 90 % (28/31)
93 % (25/27)
75 % (3/4)
| 92 % (47/51)
96 % (26/27)
88 % (21/24)
| 77 % (59/77)
80 % (52/65)
58 % (7/12)
| Genotyp 1 nie RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 24 % (21/87)
27 % (12/44)
21 % (9/43)
| 43 % (95/220)
50 % (31/62)
41 % (64/158)
| -
-
-
| Genotyp 4 RVR
| (5/6)
| (5/5)
| 92 % (22/24)
| Genotyp 4 nie RVR
| (3/6)
| (4/6)
| -
|
|
|
Tabuľka 14: Trvalá virologická odpoveď v závislosti na rýchlej virologickej odpovedi v 4. týždni pre genotyp 1 a 4 po kombinovanej liečbe Pegasysom a ribavirínom u HCV pacientovNízka vírusová záťaž = ≤ 800 000 IU/ml; Vysoká vírusová záťaž = > 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedegovateľná HCV RNA) v 4. týždni a nedegovateľná HCV RNA v 24 týždni.
Údaje, i keď obmedzené, ukazujú, že skrátenie času na 24 týždňov, sa môže spájať s vysokým rizikom relapsu (pozri tabuľku 15).
Tabuľka 15: Relaps vo virologickej odpovedi na konci liečby u populácie s rýchlou virologickou odpoveďou
| Štúdia NV15942
| Štúdia NV15801
|
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Genotyp 1 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 6,7 % (2/30)
3,8 % (1/26)
25 % (1/4)
| 4,3 % (2/47)
0 % (0/25)
9,1 % (2/22)
| 0 % (0/24)
0 % (0/17)
0 % (0/7)
|
Genotyp 4 RVR
| (0/5)
| (0/5)
| 0 % (0/4)
|
Možnosť skrátenia liečby na 16 týždňov u pacientov genotypu 2 alebo 3 bola skúmaná na základe
trvalej virologickej odpovede pozorovanej u pacientov s rýchlou virologickou odpoveďou v 4. týždni v štúdii NV17317 (pozri tabuľku 16).
V štúdii NV17317 všetci pacienti infikovaní vírusovým genotypom 2 alebo 3 dostávali Pegasys
180 ug subkutánne raz týždenne a ribavirín v dávke 800 mg a boli randomizovaní na liečbu počas 16
alebo 24 týždňov. Celková liečba počas 16 týždňov viedla ku nižšej trvalej virologickej odpovedi
(65 %) než liečba počas 24 týždňov (76 %) (p<0,0001).
Trvalá virologická odpoveď dosiahnutá po 16. týždňoch liečby a po 24. týždňoch liečby sa sledovala retrospektívnou analýzou pacientov, ktorí boli HCV RNA negatívni v 4. týždni a mali iniciálne LVL (pozri tabuľku 16).
Tabuľka 16:Trvalá virologická odpoveď celkovo a na základe rýchlej virologickej odpovede v 4. týždni pre genotyp 2 alebo 3 po kombinovanej liečbe liekom Pegasysoms ribavirínom u HCV pacientovŠtúdia NV17317
|
a
| Pegasys 180 µg
&
ribavirín
800 mg
16 týždňov
| Pegasys 180 µg
&
ribavirín
800 mg
24 týždňov
| Rozdiel v liečbe
[95 %CI]
| p-hodnota
|
Genotyp 2 alebo 3
| 65 % (443/679)
| 76 % (478/630)
| -10,6 % [-15,5 %; -0,06 %]
| p<0,0001
|
Genotyp 2 alebo 3 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 82 % (378/461)
89 % (147/166)
78 % (231/295)
| 90 % (370/410)
94 % (141/150)
88 % (229/260)
| -8,2 % [-12,8 %; -3,7 %]
-5,4 % [-12 %; 0,9 %]
-9,7 % [-15,9 %;-3,6 %]
| p=0,0006
p=0,11
p=0,002
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž => 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedetegovateľné hladiny HCV RNA) v 4. týždni
V súčasnosti nie je jasné, či vyššia dávka ribavirínu (napr. 1 000/2 000 mg/deň podľa telesnej hmotnosti) vedie k vyššej trvalej virologickej odpovedi (SVR) než dávka 800 mg/deň, keď je liečba skrátená na 16 týždňov.
Údaje naznačujú, že skrátenie liečby na 16 týždňov sa môže spájať so zvýšeným rizikom relapsu
(pozri tabuľku 17).
Tabuľka 17:Relaps vo virologickej odpovedi po ukončení liečby u pacientov genotypu 2 alebo 3s rýchlou virologickou odpoveďou
|
Štúdia NV17317
|
|
Pegasys
180 µg
&
ribavirín
800 mg
16 týždňov
|
Pegasys
180 µg
&
ribavirín
800 mg
24 týždňov
|
Rozdiel v liečbe
[95 %CI]
|
p-hodnota
|
Genotyp 2 alebo 3 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
15 % (67/439)
6 % (10/155)
20 % (57/284)
|
6 % (23/386)
1 % (2/141)
9 % (21/245)
|
9,3 % [5,2 %; 13,6 %]
5 % [0,6 % ; 10,3 %]
11,5 % [5,6 % ; 17,4 %]
|
p<0,0001
p=0,04
p=0,0002
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž = > 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedetegovateľné hladiny HCV RNA) v 4. týždni
Lepšia účinnosť Pegasysu v porovnaní s interferónom alfa-2a sa ukázala aj na histologickej odpovedi, vrátane pacientov s cirhózou a/alebo HIV-HCV koinfekciou.
Dospelí pacienti s chronickou hepatitídou C, ktorí neodpovedali na predchádzajúcu liečbu V štúdii MV17150 boli pacienti, ktorí neodpovedali na predchádzajú liečbu pegylovaným interferónom alfa-2b a ribavirínom, boli randomizovaní do štyroch rôznych liečebných skupín:
• Pegasys 360 µg/týždeň počas 12 týždňov a následne 180 µg/týždeň počas ďalších 60 týždňov;
• Pegasys 360 µg/týždeň počas 12 týždňov a následne 180 µg/týždeň počas ďalších 36 týždňov;
• Pegasys 180 µg/týždeň počas 72 týždňov;
• Pegasys 180 µg/týždeň počas 48 týždňov.
Všetci pacienti užívali ribavirín (1 000 alebo 1 200 mg/deň) v kombinácii s Pegasysom. Všetky
liečebné skupiny boli následne sledované počas 24-týždňového obdobia bez liečby.
Na základe viacnásobnej regresnej analýzy a súhrnnej skupinovej analýzy hodnotiacej vplyv dĺžky trvania liečby a podávania indukčnej dávky sa jednoznačne stanovilo, že liečba v trvaní 72 týždňov je primárnym faktorom dosiahnutia trvalej virologickej odpovede. Rozdiely v trvalej virologickej odpovedi (SVR) podmienené dĺžkou trvania liečby, demografickými ukazovateľmi a najlepšími odpoveďami na predchádzajúcu liečbu sú uvedené v tabuľke 18.
Tabuľka 18: Virologická odpoveď v 12. týždni (VR) a trvalá virologická odpoveď (SVR) u pacientov, ktorí neodpovedali na liečbu kombináciou peginterferónu alfa-2b a ribavirínu a ktorí dosiahli virologickú odpoveď v 12. týždni po liečbe kombináciou Pegasysu a ribavirínu
| Štúdia MV17150
|
|
|
| Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
72 alebo 48 týždňov (N = 942) pacienti s
VR v týždni 12 a
(N = 876)
| Pegasys 360/180
alebo 180 μg
&
ribavirín
1000/1200 mg
72 týždňov
(N = 473)
SVR u pacientov s VR v týždni 12 b (N = 100)
| Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
48 týždňov
(N = 469)
SVR u pacientov s VR v týždni 12 b (N = 57)
|
Celková trvalá odpoveď
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 18 % (157/876)
35 % (56/159)
14 % (97/686)
| 57 % (57/100)
63 % (22/35)
54 % (34/63)
| 35 % (20/57)
38 % (8/21)
32 % (11/34)
|
Genotyp 1/4
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 17 % (140/846)
35 % (54/154)
13 % (84/663)
| 55 % (52/94)
63 % (22/35)
52 % (30/58)
| 35 % (16/46)
37 % (7/19)
35 % (9/26)
|
Genotyp 2/3
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 58 % (15/26)
(2/5) (11/19)
| (4/5)
—
(3/4)
| (3/10)
(1/2) (1/7)
|
Prítomnosť cirhózy
Cirhóza
Neprítomnosť cirhózy
|
8 % (19/239)
22 % (137/633)
|
(6/13)
59 % (51/87)
|
(3/6)
34 % (17/50)
|
|
Štúdia MV17150
|
|
|
|
Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
72 alebo 48 týždňov (N = 942) pacienti s
VR v týždni 12 a
(N = 876)
|
Pegasys 360/180
alebo 180 μg
&
ribavirín
1000/1200 mg
72 týždňov
(N = 473)
SVR u pacientov s VR v týždni 12 b (N = 100)
|
Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
48 týždňov
(N = 469)
SVR u pacientov s VR v týždni 12 b (N = 57)
|
Najlepšia odpoveď počas predchádzajúcej liečby
Pokles u HCV RNA ≥2log10
Pokles u HCV RNA <2log10
Chýbanie najlepšej odpovede
|
28 % (34/121)
12 % (39/323)
19 % (84/432)
|
68 % (15/22)
64 % (16/25)
49 % (26/53)
|
(6/12) (5/14)
29 % (9/31)
|
Vysoká vírusová záťaž = > 800 000 IU/ml, nízka vírusová záťaž = ≤ 800 000 IU/ml;
a Pacienti, ktorí dosiahli potlačenie aktivity vírusu v 12. týždni (nedetegovateľná HCV RNA definovaná ako < 50 IU/ml) boli považovaní za pacientov s dosiahnutou virologickou odpoveďou v 12. týždni. Pacienti, ktorým chýbali výsledky HCV RNA
v
12. týždni boli vylúčení z analýzy.
b Pacienti, ktorí dosiahli potlačenie aktivity vírusu v 12. týždni, ale chýbali im výsledky HCV RNA na konci sledovania boli považovaní za pacientov, neodpovedajúcich na liečbu.
V štúdii HALT-C boli pacienti s chronickou hepatitídou C a pokročilou fibrózou alebo cirhózou, ktorí neodpovedali na predchádzajúcu liečbu interferónom alfa alebo pegylovaným interferónom alfa
v monoterapii alebo v kombinácii s ribavirínom, liečení Pegasysom 180 µg/týždeň a ribavirínom
1 000/1 200 mg denne. Pacienti, ktorí po 20 týždňoch liečby dosiahli nedetegovateľné hladiny
HCV RNA, pokračovali v kombinovanej liečbe Pegasysom a ribavirínom trvajúcej celkovo
48 týždňov a po ukončení liečby boli sledovaní 24 týždňov. Pravdepodobnosť trvalej virologickej odpovede sa líšila v závislosti od predchádzajúceho režimu liečby; pozri tabuľku 19.
Tabuľka 19: Trvalá virologická odpoveď v štúdii HALT-C uvedená podľa predchádzajúceho režimu liečby u pacientov, ktorí naňneodpovedali Predchádzajúca liečba Pegasys 180 µg a
 ribavirín
ribavirín 1 000/1 200 mg počas 48 týždňov
Interferón 27 % (70/255)
Pegylovaný interferón 34 % (13/38)
Interferón a ribavirín 13 % (90/692)
Pegylovaný interferón a ribavirín 11 % (7/61) HIV-HCV koinfikovaní pacientiVirologické odpovede u pacientov, ktorí sú liečení s Pegasysom v monoterapii a s Pegasysom a ribavirínom v kombinácii v závislosti na genotype a vírusovej záťaži pred liečbou pre HIV-HCV koinfikovaných pacientov sú zhrnuté nižšie v tabuľke 20.
Tabuľka 20:Trvalá virologická odpoveď po liečbe Pegasysom v kombinácii s ribavirínom v závislosti na genotype a vírusovej záťaži u HIV-HCV súčasne infikovaných pacientov pred liečbouŠtúdia NR15961
|
| Interferón alfa-2a
3 MIU
&
ribavirín 800 mg
48 týždňov
| Pegasys
180 µg
&
placebo
48 týždňov
| Pegasys
180 µg
&
ribavirín 800 mg
48 týždňov
|
Všetci pacienti
| 12 % (33/285)*
| 20 % (58/286) *
| 40 % (116/289) *
|
Genotyp 1
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
7 % (12/171)
19 % (8/42)
3% (4/129)
|
14 % (24/175)
38 % (17/45)
5 % (7/130)
|
29 % (51/176)
61 % (28/46)
18 % (23/130)
|
Genotyp 2-3
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
20 % (18/89)
27 % (8/30)
17 % (10/59)
|
36 % (32/90)
38 % (9/24)
35 % (23/66)
|
62% (59/95)
61 % (17/28)
63 % (42/67)
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž = > 800 000 IU/ml
* Pegasys 180 µg & ribavirín 800 mg oproti Interferón alfa-2a 3 MIU, ribavirín 800 mg: Pomer pravdepodobnosti (95 % CI)=5,40 (3,42 – 8,54),… p-hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0001
* Pegasys 180 µg & ribavirín 800 mg oproti Pegasys 180 µg: Pomer pravdepodobnosti (95 % CI)=2,89 (1,93 – 4,32),… p- hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0001
* Interferón alfa-2a 3 MIU & ribavirín 800 mg oproti Pegasys 180 µg: Pomer pravdepodobnosti (95 % CI)=0,53 (0,33 –
0,85),… p-hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0084
Nasledujúca štúdia (NV18209) u pacientov s koinfekciou HCV genotyp 1 a HIV porovnávala liečbu Pegasysom 180 µg týždenne s dávkou ribavirínu 800 mg alebo s dávkou ribavirínu 1 000 mg (<75 kg telesnej hmotnosti)/1 200 mg (≥75 kg telesnej hmotnosti) denne počas 48 týždňov. Štúdia nebola dizajnovaná na preukázanie účinnosti. Bezpečnostné profily u obidvoch skupín s ribavirínom boli konzistentné so známym bezpečnostným profilom pri kombinovanej liečbe Pegasysom a ribavirínom
a nepoukazujú na žiadne relevantné rozdiely, okrem mierneho nárastu anémie v skupine s vyššou dávkou ribavínu.
HCV pacienti s normálnymi hladinami ALTV štúdii NR16071 náhodne vybratí HCV pacienti s normálnymi hodnotami ALT užívali Pegasys
180 µg/týždeň a ribavirín 800 mg/deň počas 24 alebo 48 týždňov. Potom nasledoval 24 týždňové obdobie bez liečby alebo pacienti boli bez liečby po dobu 72 týždňov. SVR popisované v liečebných ramenách tejto štúdie boli podobné zodpovedajúcim liečebným ramenám zo štúdie NV15942.
Pediatrická populáciaV riešiteľom sponzorovanej klinickej štúdii CHIPS (Chronic Hepatitis C International Paediatric Study) 65 pediatrických pacientov (6-18 rokov) s chronickou HCV infekciou boli pacienti liečení Pegasysom 100 μg/m2 s.c. raz týždenne a ribavirínom 15 mg/kg/deň 24 týždňov (genotypy 2 a 3) alebo 48 týždňov (všetky iné genotypy). Predbežné a obmedzené údaje bezpečnosti neukázali žiadny evidentný odklon od známeho profilu bezpečnosti pri kombinovanej liečbe u dospelých pacientov s chronickou HCV infekciou, ale, dôležité je, že nebol hlásený potenciálny nárast. Výsledky účinnosti boli podobné výsledkom hlásených u dospelých.
V štúdii NV17424 (PEDS-C) boli predtým neliečení pediatrickí pacienti vo veku 5 až 17 rokov (55 % vo veku < 12 rokov) s kompenzovanou chronickou hepatitídou C a detekovateľnou HCV RNA liečení Pegasysom v dávke180 μg x BSA/1,73 m2 jedenkrát týždenne počas 48 týždňov s alebo bez ribavirínu v dávke 15 mg/kg/deň . Všetci pacienti boli po liečbe sledovaní počas 24 týždňov. Celkovo 55 pacientov bolo liečených úvodnou kombinovanou liečbou Pegasysom plus ribaviríno, z nich 51 %
bolo žien, 82 % belochov a 82 % bolo infikovaných vírusom HCV genotyp 1. Výsledky štúdie účinnosti u týchto pacientov sú zhrnuté v tabuľke 21.
Tabuľka 21: Pretrvávajúca virologická odpoveď v štúdii NV17424
| Pegasys
180 µg x BSA/1,73 m² +
ribavirín 15 mg/kg (N = 55)*
|
Všetky genotypy HCV**
| 29 (53 %)
|
HCV genotyp 1
| 21/45 (47 %)
|
HCV genotyp 2 a 3
| 8/10 (80 %)
|
*Výsledky naznačujú nedetegovateľnú HCV-RNA definovanú ako HCV RNA menej ako 50 IU/ml 24 týždňov po liečbe použitím AMPLICOR HCV testu v2.
**Plánované trvanie liečby bolo 48 týždňov bez ohľadu na genotyp
5.2 Farmakokinetické vlastnosti
Absorpcia
Po jednorazovej subkutánnej injekcii Pegasysu 180 mikrogramov zdravým jedincom sa merateľné sérové koncentrácie peginterferónu alfa-2a zistili v priebehu 3 až 6 hodín. Počas 24 hodín dosiahli namerané hladiny 80 % maximálnej koncentrácie v sére. Absorpcia Pegasysu je plynulá, pričom maximálne hladiny v sére sa dosiahnu 72 až 96 hodín po podaní. Absolútna biologická dostupnosť Pegasysu je 84 % a je podobná ako pri interferóne alfa-2a.
Distribúcia
Peginterferón alfa-2a sa nachádza najmä v krvnom obehu a extracelulárnej tekutine, čoho dôkazom je hodnota distribučného objemu v rovnovážnom stave (Vd) 6 - 14 litrov u ľudí po intravenóznom podaní. V štúdiách hmotnostnej rovnováhy, distribúcie látky v tkanivách a celotelovej autorádioluminografie vykonaných u potkanov sa zistilo, že okrem vysokej koncentrácie v krvi sa peginterferón alfa-2a dostáva do pečene, obličiek a kostnej drene.
Biotransformácia
Metabolizmus Pegasysu ešte nie je úplne objasnený, avšak štúdie na potkanoch naznačujú, že obličky sú hlavným exkrečným orgánom rádioaktívne označeného materiálu.
Eliminácia
U ľudí je hodnota systémového klírensu peginterferónu alfa-2a približne 100- násobne nižšia ako natívneho interferónu alfa-2a. Po intravenóznom podaní je terminálny polčas peginterferónu alfa-2a u zdravých osôb približne 60 – 80 hodín v porovnaní s 3 – 4 hodinami v prípade štandardného interferónu. Terminálny polčas po subkutánnom podaní pacientom je dlhší so strednou hodnotou 160 hodín (84 – 353 hodín). Terminálny polčas môže odrážať eliminačnú fázu látky, ale taktiež plynulú absorpciu Pegasysu.
Linearita/nelinearita
U zdravých osôb a u pacientov s chronickou hepatitídou B alebo C sa pri dávkovaní raz týždenne pozorovalo od dávky závislé zvyšovanie expozície voči Pegasysu.
U pacientov s chronickou hepatitídou B alebo C dochádza po 6 až 8 týždňoch podávania Pegasysu v dávke raz týždenne k dvoj- až trojnásobnému zvýšeniu sérových hladín peginterferónu alfa-2a
v porovnaní s podávaním jednorazovej dávky. Po 8-týždňovom podávaní Pegasysu raz týždenne nedochádza k ďalšej akumulácii. Po 48 týždňoch liečby je pomer medzi maximálnou a minimálnou hladinou približne 1,5 - 2. Sérové koncentrácie peginterferónu alfa-2a pretrvávajú celý 1 týždeň (168 hodín).
Pacienti s poruchou funkcie obličiek
Dysfunkcia obličiek je spojená s mierne zníženou hodnotou pomeru CL/F a predĺženým polčasom. U pacientov (n=3) CLcrea medzi 20 a 40 ml/min bola priemerná hodnota pomeru CL/F o 25 % nižšia ako u pacientov s normálnou funkciou obličiek. U dialyzovaných pacientov s ochorením obličiek
v terminálnej fáze sa zistilo 25 – 45 % zníženie klírensu, pričom dávky 135 mikrogramov u týchto pacientov vedú k podobnej expozícii ako dávky 180 mikrogramov u pacientov s normálnou funkciou
obličiek (pozri časť 4.2).
Pozrite si tiež Súhrn charakteristických vlastností lieku (SmPC) ribavirínu, ak sa Pegasys použije v kombinácii s ribavirínom.
Pohlavie
Farmakokinetika Pegasysu po podaní jednorazovej subkutánnej injekcie bola porovnateľná u zdravých jedincov mužského a ženského pohlavia.
Pediatrická populácia
V populačnej farmakokinetickej štúdii (NR16141) dostávalo 14 detí vo veku 2 až 8 rokov s CHC Pegasys v monoterapii v dávke: 180 µg x BSA/1,73 m2. FK model vytvorený na základe tejto štúdie preukazuje lineárny vplyv BSA na zjavný klírens liečiva v rozmedzí skúmaného veku. Preto nižšie BSA dieťaťa, nižší klírens liečiva a vyššia výsledná expozícia. Predpokladá sa, že priemerná expozícia (AUC) počas dávkovacieho intervalu je o 25 % až 70 % vyššia ako expozícia pozorovaná u dospelých, ktorí dostávajú fixnú dávku 180 µg.
Staršie osoby
U osôb starších ako 62 rokov sa zistila dlhšia absorpcia Pegasysu po jednorazovom podaní subkutánnej injekcie v dávke 180 mikrogramov, hoci stále bola plynulá v porovnaní s mladými zdravými osobami (tmax 115 hodín vs. 82 hodín, osoby staršie ako 62 rokov). Hodnota AUC bola mierne zvýšená (1 663 vs. 1 295 ng.hod/ml), avšak maximálne koncentrácie (9,1 vs. 10,3 ng/ml) boli podobné u osôb starších ako 62 rokov. Na základe expozície voči lieku, farmakodynamickej odpovedi a znášanlivosti je možné prehlásiť, že geriatrickí pacienti si nevyžadujú podávanie nižšej dávky Pegasysu (pozri časť 4.2).
Dysfunkcia pečene
Farmakokinetika Pegasysu u zdravých osôb bola podobná ako u pacientov s hepatitídou B alebo C.
U pacientov s cirhózou (stupeň A podľa Child-Pughovej klasifikácie) a pacientov bez cirhózy sa zistila porovnateľná expozícia a farmakokinetické profily.
Miesto podania
Subkutánne podávanie Pegasysu je nutné obmedziť na oblasť brucha a stehna, pretože stupeň absorpcie hodnotený na základe hodnôt AUC bol o 20 – 30 % vyšší po podaní injekcie do brucha a stehna. V štúdiách po podaní Pegasysu do ramena sa v porovnaní s podaním do brucha alebo stehna zistila znížená expozícia voči Pegasysu.
5.3 Predklinické údaje o bezpečnosti
Neklinické štúdie skúmajúce toxicitu Pegasysu boli limitované v dôsledku druhovej špecifickosti interferónov. Štúdie akútnej a chronickej toxicity sa vykonali u opíc cynomolgus, pričom nálezy pozorované u zvierat dostávajúcich peginterferón boli podobnej povahy ako nálezy vyvolané interferónom alfa-2a.
S Pegasysom sa nevykonali žiadne štúdie reprodukčnej toxicity. Tak ako pri iných interferónoch alfa, aj po podávaní peginterferónu alfa-2a samiciam opíc sa pozorovalo predĺženie menštruačného cyklu. Liečba interferónom alfa-2a viedla k štatisticky významnému zvýšeniu abortívneho účinku u opíc resus. Hoci sa u potomstva narodeného v termíne nezistili žiadne teratogénne účinky, nežiaduce účinky nie je možné vylúčiť u ľudí.
Pegasys plus ribavirín
Ak sa používa v kombinácii s ribavirínom, Pegasys nevyvoláva žiadne účinky u opíc, ktoré by predtým neboli pozorované pri podávaní jednotlivých liečiv v rámci monoterapie. Hlavnou zmenou
v súvislosti s liečbou bola reverzibilná mierna až stredne ťažká anémia, závažnosť ktorej bola vyššia
ako po podávaní jednotlivých liečiv v rámci monoterapie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
chlorid sodný
benzylalkoholnátriumacetát kyselina octová
voda na injekcie
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti3 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v chladničke pri teplote 2°C – 8°C. Neuchovávajte v mrazničke. Liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia1 ml injekčného roztoku v injekčnej liekovke (sklo typ I) so zátkou (butylová guma). Dostupné v baleniach 1 alebo 4 injekčné liekovky. Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciuInjekčný roztok je určený len na jednorazové použitie. Pred podaním sa má zrakom skontrolovať, či roztok neobsahuje tuhé čiastočky alebo či sa nezmenila jeho farba.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIRoche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/02/221/001
EU/1/02/221/002
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 20. jún 2002
Dátum posledného predĺženia: 20. jún 2007
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Pegasys 180 mikrogramov injekčný roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá injekčná liekovka s 1 ml roztoku obsahuje 180 mikrogramov peginterferónu alfa-2a*. Sila vyjadruje množstvo podielu interferónu alfa-2a v peginterferóne alfa-2a bez ohľadu na pegyláciu.
*Liečivo peginterferón alfa-2a je kovalentný konjugát bielkoviny interferónu alfa-2a vyrobený rekombinantnou DNA technológiou v Escherichia coli s bis -[monometoxypolyetylénglykolom].
Účinnosť tohto lieku sa nemá porovnávať s inými pegylovanými alebo nepegylovanými bielkovinami v tej istej terapeutickej skupine. Viac informácií, pozri časť 5.1.
Pomocná látka so známym účinkom: Benzylalkohol (10 mg/1 ml) Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok (injekcia).
Roztok je číry, bezfarebný až svetložltý.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Chronická hepatitída B
Pegasys je indikovaný na liečbu chronickej hepatitídy B (CHB) s pozitívnym obalovým antigénom
hepatitídy B (HBeAg) alebo HBeAg negatívnej chronickej hepatitídy B u dospelých pacientov
s kompenzovaným ochorením pečene a s dôkazom vírusovej replikácie, zvýšenou hladinou ALT a histologicky overeným zápalom pečene a/alebo fibrózy (pozri časti 4.4 a 5.1).
Chronická hepatitída C
Dospelí pacienti
Pegasys je indikovaný na liečbu chronickej hepatitídy C (CHC) u dospelých s pozitívnym nálezom ribonukleovej kyseliny vírusu hepatitídy C (HCV-RNA) v sére. Toto zahŕňa pacientov
s kompenzovanou formou cirhózy pečene a/alebo súčasne infikovaných HIV vírusom s klinicky stabilným obrazom HIV infekcie (pozri časť 4.4).
Optimálny spôsob použitia Pegasysu u pacientov s chronickou hepatitídou C je kombinácia s ribavirínom. Kombinácia Pegasysu a ribavirínu je indikovaná na liečbu u predtým neliečených pacientov a u dospelých pacientov, u ktorých zlyhala predchádzajúca liečba interferónom alfa (pegylovaným alebo nepegylovaným) v monoterapii alebo v kombinovanej liečbe s ribavirínom.
Monoterapia je indikovaná najmä v prípade neznášanlivosti alebo kontraindikácie liečby ribavirínom.
Pediatrickí pacienti vo veku 5 rokov a viac :
Pegasys v kombinácii s ribavirínom je indikovaný na liečbu chronickej hepatitídy C u predtým neliečených detí a dospievjúcich vo veku 5 a viac rokov, u ktorých je prítomná pozitivita sérovej HCV-RNA.
Pri rozhodovaní, či začať v detstve s liečbou, je dôležité vziať do úvahy inhibíciu rastu indukovanú kombinovanou liečbou. Nie je isté, či je inhibícia rastu reverzibilná. Rozhodnutie o liečbe sa má urobiť individuálne pre každý prípad (pozri časť 4.4).
4.2 Dávkovanie a spôsob podávania
Liečbu Pegasysom má začať iba lekár, ktorý má skúsenosti s liečbou pacientov s hepatitídou B alebo
C.
Ak sa Pegasys bude podávať v kombinácii s ribavirínom, prečítajte si tiež súhrn charakteristických vlastností ribavirínu (SmPC).
Dávkovanie
Chronická hepatitída B – dospelí pacienti
Odporúčané dávkovanie a dĺžka liečby Pegasysom u HBeAg-pozitívnych a HBeAg-negatívnych pacientov s chronickou hepatitídou B je 180 mikrogramov raz týždenne počas 48 týždňov, subkutánne do brucha alebo do stehna.
Chronická hepatitída C - predtým neliečení dospelí pacienti
Odporúčaná dávka Pegasysu je 180 mikrogramov raz týždenne a podáva sa subkutánne do brucha alebo stehna v kombinácii s perorálnym ribavirínom alebo ako monoterapia.
Dávkovanie ribavirínu pri kombinovanej liečbe s Pegasysom sa uvádza v tabuľke 1. Dávka ribavirínu sa má užívať spolu s jedlom.
Dĺžka liečby
U pacientov s chronickou hepatitídou C závisí dĺžka kombinovanej liečby s ribavirínom od genotypu vírusu. Pacienti infikovaní HCV s genotypom 1, ktorí majú detegovateľnú HCV RNA v 4. týždni sa majú liečiť 48 týždňov bez ohľadu na vírusovú záťaž pred liečbou.
O liečbe v trvaní 24 týždňov sa môže uvažovať u pacientov infikovaných s
- genotypom 1 a nízkou vírusovou záťažou (LVL) na začiatku liečby ( ≤ 800 000 IU/ml) alebo
- genotypom 4,
ktorí sa stali HCV RNA negatívni v 4. týždni liečby a zostali HCV RNA negatívni v 24. týždni. Avšak celkove môže byť 24 týždňová liečba spojená s vyšším rizikom relapsu ako liečba trvajúca 48 týždňov (pozri časť 5.1). Pri rozhodovaní o dĺžke liečby sa má u týchto pacientov brať do úvahy tolerancia na
kombinovanú liečbu a ďalšie prognostické faktory, ako stupeň fibrózy. Ešte s väčšou opatrnosťou sa
má uvažovať o skrátení trvania liečby u pacientov infikovaných s vírusom s genotypom 1 a vysokou vírusovou záťažou (>800 000 IU/ml) na začiatku liečby, ktorí sa stali HCV RNA negatívni v 4. týždni liečby a zostali negatívni v 24. týždni, pretože obmedzené údaje naznačujú, že to môže signifikantne negatívne ovplyvniť trvalú virologickú odpoveď.
Pacienti infikovaní HCV s genotypom 2 alebo 3, ktorí majú detegovateľnú HCV RNA v 4. týždni, bez ohľadu na vírusovú záťaž pred liečbou majú byť liečení 24 týždňov. 16-týždňová liečba sa môže zvažovať iba u vybraných pacientov, infikovaných genotypom 2 alebo 3 s iniciálnou LVL
(≤ 800 000 IU/ml), ktorí sa stanú HCV negatívni v 4. týždni liečby a zostávajú negatívni v 16. týždni. Všeobecne sa liečba trvajúca 16 týždňov môže spájať s nižšou možnosťou odpovede a je spojená s vyšším rizikom relapsu ako 24-týždňová liečba (pozri časť 5.1). U týchto pacientov sa má pri zvažovaní zmeny štandardnej 24 týždňovej liečby vziať do úvahy tolerancia kombinovanej liečby
a prítomnosť ďalších klinických alebo prognostických faktorov ako napr. stupeň fibrózy. Skrátenie
trvania liečby u pacientov infikovaných genotypom 2 alebo 3 s iniciálnou HVL (> 800 000 IU/ml), ktorí sa stanú v 4. týždni liečby HCV negatívni sa má zvažovať pozornejšie, nakoľko toto môže významne negatívne ovplyvniť trvalú virologickú odpoveď (pozri tabuľku 1).
Dostupné údaje o infikovaných pacientoch s genotypom 5 alebo 6 sú obmedzené; preto sa odporúča
48 týždňová kombinovaná liečba s 1 000 mg alebo 1 200 mg ribavirínu.
Tabuľka 1:Odporúčané dávkovanie pre kombinovanú liečbu u HCV pacientovGenotyp
| Dávka Pegasysu
| Dávka ribavirínu
| Trvanie
|
Genotyp 1 LVL s RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 24 týždňov alebo
48 týždňov
|
Genotyp 1 s HVL s RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 48 týždňov
|
Genotyp 4 s RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 24 týždňov alebo
48 týždňov
|
Genotyp 1 alebo 4 bez
RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 48 týždňov
|
Genotyp 2 alebo 3 bez
RVR**
| 180 mikrogramov
| 800 mg
| 24 týždňov
|
Genotyp 2 alebo 3
LVL s RVR**
| 180 mikrogramov
| 800 mg(a)
| 16 týždňov(a) alebo
24 týždňov
|
Genotyp 2 alebo 3
HVL s RVR**
| 180 mikrogramov
| 800 mg
| 24 týždňov
|
*RVR = rýchla virologická odpoveď (nedegovateľná HCV RNA) v 4. týždni a nedetegovateľná HCV RNA v 24. týždni
**RVR = rýchla virologická odpoveď (HCV RNA negativita) v 4. týždni
LVL = ≤ 800 000 IU/ml; HVL= > 800 000 IU/ml
(a) V súčasnosti nie je jasné, či vyššia dávka ribavirínu (napr. 1 000 /1 200 mg/deň podľa telesnej hmotnosti) vedie k vyššej trvalej virologickej odpovedi (SVR) než dávka 800 mg/deň, keď je liečba skrátená na 16 týždňov.
Konečný klinický účinok skrátenej 16 týždňovej liečby oproti 24 týždňovej liečbe nie je známy vzhľadom na potrebu opakovanej liečby u pacientov, ktorí neodpovedajú na liečbu a pacientov s relapsom ochorenia.
Odporúčaná dĺžka liečby Pegasysom v monoterapii je 48 týždňov.
Chronická hepatitída C - predtým liečení dospelí pacientiOdporúčaná dávka Pegasysu v kombinácii s ribavirínom je 180 µg raz týždenne podávaná subkutánne. Pacientom s telesnou hmotnosťou < 75 kg sa má podávať 1 000 mg ribavirínu denne a pacientom
s telesnou hmotnosťou ≥ 75 kg sa má podávať 1 200 mg ribavirínu denne bez ohľadu na genotyp.
U pacientov, ktorí majú v 12. týždni detegovateľné hladiny vírusu, sa má liečba ukončiť. Odporúčaná
celková dĺžka liečby je 48 týždňov. Ak sa zvažuje liečba u pacientov infikovaných vírusom
genotypu 1, ktorí neodpovedali na predchádzajúcu liečbu peginterferónom a ribavirínom, odporúčaná celková dĺžka liečby je 72 týždňov (pozri časť 5.1).
Súčasná infekcia vírusom HIV a HCV u dospelých pacientovOdporúčané dávkovanie Pegasysu v monoterapii alebo v kombinácii s ribavirínom je
180 mikrogramov raz za týždeň subkutánne počas 48 týždňov Pre pacientov infikovných HCV
s genotypom 1 a s telesnou hmotnosťou <75 kg je dávka ribavirínu je 1 000 mg denne a s telesnou hmotnosťou ≥75 kg je 1 200 mg denne. Pre pacientov infikovaných HCV s iným genotypom ako genotyp 1 je dávka ribavirínu 800 mg denne. Dĺžka liečby kratšia ako 48 týždňov sa dostatočne neskúmala.
Predikcia odpovede alebo chýbanie odpovede - predtým neliečení pacienti Ukázalo sa, že včasná virologická odpoveď v 12-tom týždni, ktorá je definovaná ako pokles vírusovej záťaže o 2 log alebo nedetekovateľné hladiny HCV RNA, predikuje pretrvávajúcu odpoveď (pozri tabuľky 2 a 12).
Tabuľka 2:Prediktívna hodnota virologickej odpovede v 12. týždni kombinovanej liečbyPegasysom pri odporúčanom dávkovacom režimeGenotyp
| Negatívna
| Pozitívna
|
Žiadna
odpoveď
do 12. Odpoveď Prediktívna týždňa nepretrváva hodnota
|
Odpoveď
do 12. Odpoveď Prediktívna týždňa pretrváva hodnota
|
Genotyp 1 (N = 569)
| 102 97 95 %
(97/102)
| 467 271 58 %
(271/467)
|
Genotyp 2 a 3 (N = 96)
| 3 3 100 %
(3/3)
| 93 81 87 %
(81/93)
|
Negatívna prediktívna hodnota na trvalú odpoveď u pacientov liečených Pegasysom v monoterapii
bola 98 %.
Podobná negatívna prediktívna hodnota sa pozorovala u súčasne HIV-HCV infikovaných pacientov liečených Pegasysom v monoterapii alebo v kombinácii s ribavirínom (100 % (130/130) alebo 98 % (83/85)). Pozitívne prediktívne hodnoty na úrovni 45 % (50/110) resp. 70 % (59/84) u súčasne HIV- HCV infikovaných pacientov sa pozorovali pri genotype 1 a genotype 2/3, ak títo dostávali kombinovanú liečbu.
Predikcia odpovede alebo chýbanie odpovede - predtým liečení pacientiU pacientov, ktorí neodpovedali na predchádzajúcu liečbu a boli opakovane liečení 48 alebo
72 týždňov, sa ukázalo, že potlačenie aktivity vírusu v 12. týždni (nedetegovateľná HCV RNA definovaná ako <50 IU/ml) je prediktívnym faktorom trvalej virologickej odpovede. Ak nebolo dosiahnuté potlačenie vírusovej aktivity v 12. týždni pri režime liečby 48 alebo 72 týždňov, je pravdepodobnosť nedosiahnutia trvalej virologickej odpovede pri 48-týždňovej liečbe 96 % (363 z
380) a pri 72-týždňovej liečbe 96 % (324 z 339). Ak bolo dosiahnuté potlačenie vírusovej aktivity v 12. týždni pri režime liečby 48 alebo 72 týždňov, je pravdepodobnosť dosiahnutia trvalej
virologickej odpovede pri 48-týždňovej liečbe 35 % (20 z 57) a pri 72-týždňovej liečbe 57 % (57 zo
100).
Úprava dávkovania u dospelých pacientov v dôsledku nežiaducich reakciíVšeobecnePri nutnosti úpravy dávkovania v dôsledku stredne ťažkých až ťažkých nežiaducich reakcií (klinickej a/alebo laboratórnej povahy) je vhodné u dospelých pacientov znížiť začiatočnú dávku na
135 mikrogramov. V niektorých prípadoch môže byť potrebné znížiť dávkovanie na 90 mikrogramov alebo 45 mikrogramov. Po ústupe nežiaducich reakcií je možné zvážiť zvýšenie dávkovania až na pôvodnú hodnotu (pozri časti 4.4 a 4.8).
Hematologické nežiaduce reakcie (pozri tiež tabuľku 3)Pri poklese počtu neutrofilov na < 750/mm3 u dospelých pacientov sa odporúča znížiť dávkovanie lieku. U pacientov s absolútnym počtom neutrofilov (ANC) < 500/mm3 sa liečba prerušuje až do obnovenia hodnôt ANC > 1000/mm3. Liečbu Pegasysom je možné opäť začať dávkou
90 mikrogramov a má sa sledovať počet neutrofilov. V tabuľke 7 je uvedený návod na zníženie dávky
u pediatrických pacientov na základe hodnôt ANC.
Ak počet trombocytov klesne na < 50 000/mm3, má sa znížiť dávkovanie na 90 mikrogramov. Pri znížení počtu trombocytov na hodnotu < 25 000/ mm3 sa odporúča liečbu ukončiť.
Pre liečbu farmakologicky podmienenej anémie u dospelých platia nasledovné špecifické odporúčania:
denná dávka ribavirínu sa má znížiť na 600 mg (200 mg ráno a 400 mg večer), ak nastane niektorá
z nasledujúcich situácií: (1) u pacienta bez závažného kardiovaskulárneho ochorenia dôjde k poklesu hodnôt hemoglobínu na < 10 g/dl a ≥ 8,5 g/dl alebo (2) u pacienta so stabilizovaným kardiovaskulárnym ochorením dôjde k poklesu hodnôt hemoglobínu ≥ 2 g/dl v priebehu ktorýchkoľvek 4 týždňov liečby. Návrat k pôvodnému dávkovaniu sa neodporúča. Liečba ribavirínom
sa ukončí, ak nastane niektorá z nasledujúcich situácií: (1) u pacienta bez závažného kardiovaskulárneho ochorenia dôjde k poklesu hodnôt hemoglobínu < 8,5 g/dl; (2) u pacienta so stabilizovaným kardiovaskulárnym ochorením sa hodnoty hemoglobínu udržujú < 12 g/dl napriek 4- týždňovej liečbe s redukovaným dávkovaním. Ak sa abnormality upravia, je možné obnoviť liečbu
ribavirínom v dennej dávke 600 mg. Ošetrujúci lekár môže zvážiť ďalšie zvýšenie dávkovania na
800 mg denne. Návrat k pôvodnému dávkovaniu sa neodporúča.
| Znížiť
dávkovanie ribavirínu na
600 mg
| Vysadiť ribavirín
| Znížiť dávkovanie
Pegasysu na
135/90/45 mikrogramov
| Vysadiť
Pegasys
| Vysadiť
kombinovanú liečbu
| Absolútny počet neutrofilov
|
|
| < 750/mm3
| < 500/mm3
|
| Počet trombocytov
|
|
| < 50 000/mm3
> 25 000/mm3
|
| < 25 000/mm3
| Hemoglobín
- bez ochorenia srdca
| < 10 g/dl
a ≥ 8,5 g/dl
| < 8,5 g/dl
|
|
|
| Hemoglobín
- stabilizované ochorenie srdca
| pokles
o ≥ 2 g/dl počas
ľubovoľných
4 týždňov
| < 12 g/dl napriek
4 týždňovej liečbe s redukovaným dávkovaním
|
|
|
|
|
|
Tabuľka 3:Úprava dávkovania v dôsledku nežiaducich účinkov (ďalšie informácie pozri v texte vyššie)Pri neznášanlivosti ribavirínu je možné pokračovať v monoterapii Pegasysom.
Funkcia pečeneU pacientov s chronickou hepatitídou C sa často vyskytuje kolísanie odchýlok pečeňových testov. U pacientov liečených Pegasysom vrátane pacientov s virologickou odpoveďou sa pozorovalo zvýšenie hladín ALT nad východiskovú hodnotu (BL).
V klinických skúšaniach zameraných na chronickú hepatitídu C s dospelými pacientmi sa u 8 zo 451
pacientov dostávajúcich kombinovanú liečbu pozorovalo izolované zvýšenie ALT (≥ 10x ULN alebo
≥ 2x BL u pacientov s východiskovou hodnotou ALT ≥ 10x ULN), ktoré sa upravilo bez nutnosti
zmeny dávkovania. Ak je hodnota ALT trvale vyššia alebo naďalej stúpa, dávkovanie sa na začiatku
znižuje na 135 mikrogramov. Ak napriek zníženiu dávkovania hodnoty ALT naďalej stúpajú alebo ich sprevádza zvýšenie hladiny bilirubínu alebo známky dekompenzácie funkcie pečene, má sa liečba ukončiť (pozri časť 4.4). V tabuľke 7 je uvedený návod pre zníženie dávky pre pediatrických
pacientov na základe hladín ALT.
U pacientov s chronickou hepatitídou B nie je nezvyčajné prechodné zvýšenie hladín ALT, ktoré niekedy prekročí desaťnásobok hornej hranice normálnej hodnoty a môže odrážať imunitný klírens. Liečba by sa za normálnych okolností nemala začať, ak je hladina ALT viac než desaťkrát vyššia ako horná hranica jej normálnej hodnoty. Treba zvážiť pokračovanie liečby s častejším sledovaním funkcie pečene pri náhlom zvýšení hladín ALT. Ak sa dávka Pegasysu zníži, alebo ak sa liek vysadí, pri poklese hladiny ALT sa liečba môže obnoviť (pozri časť 4.4).
Osobitné skupiny pacientovStarší ľudia Na začiatku liečby Pegasysom u starších pacientov nie je potrebná žiadna úprava odporúčaného dávkovania 180 mikrogramov raz týždenne (pozri časť 5.2).
Porucha funkcie obličiekU pacientov s ochorením obličiek v terminálnej fáze sa používa začiatočná dávka 135 mikrogramov (pozri časť 5.2 ). Bez ohľadu na začiatočnú dávku alebo stupeň poškodenia funkcie obličiek je potrebné pacientov sledovať a v prípade nežiaducich reakcií je nutné primerane znížiť dávkovanie Pegasysu počas liečebnej kúry.
Porucha funkcie pečeneUkázalo sa, že Pegasys je účinný a bezpečný u pacientov s kompenzovanou cirhózou (napr. A podľa
Child-Pughovej klasifikácie). Pegasys sa nehodnotil u pacientov s dekompenzovanou cirhózou (napr. B alebo C podľa Child-Pughovej klasifikácie alebo krvácajúce ezofageálne varixy) (pozri časť 4.3).
Podľa Child-Pughovej klasifikácie sa pacienti rozdeľujú do skupín A, B a C resp. s “miernou” “stredne ťažkou” a “ťažkou” poruchou funkcie , čomu zodpovedá skóre 5 - 6, 7 - 9 a 10 - 15.
Upravené hodnotenie Hodnotenie
| Stupeň abnormality
| Skóre
|
Encefalopatia
| Žiadny
Stupeň 1 - 2
Stupeň 3 – 4*
| 1
2
3
|
Ascites
| Žiadny
Mierny
Stredný
| 1
2
3
|
Hladina sérového bilirubínu (mg/dl)
v SI jednotkách = μmol/l
| < 2
2,0 - 3
> 3
< 34
34 - 51
> 51
| 1
2
3
1
2
3
|
Hladina sérového albumínu (g/dl)
| > 3,5
2,8 – 3,5
< 2,8
| 1
2
3
|
INR
| < 1,7
1,7 - 2,3
> 2,3
| 1
2
3
|
* Hodnotenie stupňa závažnosti podľa autorov Trey, Burns a Saunders (1966)
Pediatrická populáciaPegasys je kontraindikovaný u novorodencov a malých detí vo veku do 3 rokov z dôvodu prítomnosti pomocnej látky benzylalkoholu (pozri časti 4.3 a 4.4).
Pre deti a dospievajúcich vo veku 5 až 17 rokov s chronickou hepatitídou C s povrchom tela (BSA) väčším ako 0,7 m2 sú odporúčané dávky Pegasysu a ribavirínu uvedené v tabuľke 4 a v tabuľke 5. Pre pediatrických pacientov sa odporúča použiť Pegasys v naplnených injekčných striekačkách. Použitie Pegasysom naplnených pier neumožňuje primeranú úpravu dávky pre týchto pacientov. Pacienti, ktorí začali liečbu pred svojimi 18-timi narodeninami, majú pokračovať v pediatrickom dávkovaní až do skončenia liečby.
Pegasys sa nesmie použiť u detí s povrchom tela (BSA) menším ako 0,71 m2, keďže pre túto subpopuláciu nie sú dostupné údaje.
Pre výpočet BSA sa odporúča používať Mostellerov vzorec:
 Dĺžka liečby
Dĺžka liečby
Dĺžka liečby Pegasysom v kombinácii s ribavirínom u pediatrických pacientovpediatrických pacientov s chronickou hepatitídou C závisí od genotypu vírusu. Pacienti infikovaní vírusovými genotypom 2
alebo 3 majú dostať 24 týždňovú liečbu, zatiaľ čo pacienti infikovaní iným genotypom majú dostať 48
týždňovú liečbu.
Pacienti, ktorí majú ešte detegovateľné hladiny HCV-RNA a to aj napriek počiatočnej 24 týždňovej liečbe, majú ukončiť liečbu, pretože je nepravdepodobné, že pokračovaním v liečbe budú schopní dosiahnuť trvalú virologickú odpoveď.
Tabuľka 4: Odporúčania na dávkovanie Pegasysu u pediatrických pacientov vo veku 5 až 17rokov Rozmedzie plochy povrchu tela (BSA) (m2)
| Týždenná dávka (mikrogramy)
|
0,71-0,74
| 65
|
0,75-1,08
| 90
|
1,09-1,51
| 135
|
> 1,51
| 180
|
Pre deti a dospievajúcich vo veku 5 až 17 rokov s chronickou hepatitídou C odporúčaná dávka
ribavirínu vychádza z telesnej hmotnosti pacienta s cieľovou dávkou 15 mg/kg/deň rozdelenou do dvoch denných dávok. V tabuľke 5 je uvedené dávkovanie za použitia 200 mg tabliet ribavirínu pre deti a dospievajúcich s hmotnosťou 23 kg a viac. Pacienti a ich opatrovatelia sa nesmú pokúšať rozlomiť 200 mg tablety.
Tabuľka 5: Odporúčania na dávkovanie ribavirínu u pediatrických pacientov vo veku 5 až 17rokov Telesná hmotnosť kg (lbs)
| Denná dávka ribavirínu
(pribl. 15 mg/kg/deň)
| Počet tabliet ribavirínu
|
23 – 33 (51-73)
| 400 mg/deň
| 1 x 200 mg tablety ráno
1 x 200 mg tablety večer
|
34 – 46 (75-101)
| 600 mg/deň
| 1 x 200 mg tablety ráno
2 x 200 mg tablety večer
|
47 – 59 (103-131)
| 800 mg/deň
| 2 x 200 mg tablety ráno
2 x 200 mg tablety večer
|
60 – 74 (132-163)
| 1 000 mg/deň
| 2 x 200 mg tablety ráno
3 x 200 mg tablety večer
|
≥ 75 (> 165)
| 1 200 mg/deň
| 3 x 200 mg tablety ráno
3 x 200 mg tablety večer
|
Úprava dávky u pediatrických pacientov kvôli nežiaducim reakciámU pediatrických pacientov je možné na základe toxicity (pozri tabuľku 6) urobiť až tri stupne modifikácie dávky pred zvážením prerušenia alebo vysadenia dávky.
Tabuľka 6: Odporúčaná úprava dávky Pegasysu u pediatrických pacientovZačiatočná dávka
(mikrogramy)
| 1. stupeň zníženia
(mikrogramy)
| 2. stupeň zníženia
(mikrogramy)
| 3. stupeň zníženia
(mikrogramy)
|
65
|
45
|
30
|
20
|
90
|
65
|
45
|
20
|
135
|
90
|
65
|
30
|
180
|
135
|
90
|
45
|
V prípade výskytu toxicity, ktorá môže súvisieť s podávaním Pegasysu a/alebo ribavirínu, sa môže
znížiť dávka jedného alebo obidvoch liekov. Okrem toho sa môže ribavirín alebo kombinovaná liečba Pegasys plus ribavirín vysadiť. Je dôležité poznamenať, že ribavirín sa nesmie nikdy podávať ako monoterapia. Odporúčania na úpravu dávky z dôvodu toxicity, o ktorej je známe, že má súvislosť
s podávaním Pegasysu a ktoré sú špecifické pre pediatrickú populáciu, sú uvedené v tabuľke 7. Pokiaľ nie je uvedené inak, v prípade všetkých ostatných toxických prejavov sa má postupovať podľa odporúčaní pre dospelých.
Tabuľka 7: Odporúčania na úpravu dávky Pegasysu z dôvodu toxicity u pediatrických pacientovToxicita
| Úprava dávky Pegasysu
|
Neutropénia
| 750-999 buniek/mm3: 1.-2. týždeň – okamžitá úprava 1. stupňa; 3.-48.
týždeň: žiadna úprava.
500-749 buniek/mm3: 1.-2. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte dávkou s úpravou 1. stupňa s kontrolou hodnoty leukocytov jedenkrát týždenne počas 3 nasledujúcich týždňov, aby ste sa ubezpečili, že ich počet je > 750 buniek/mm3; 3.-48. týždeň – okamžitá úprava 1. stupňa.
250-499 buniek/mm3: 1.-2. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte dávkou s úpravou 2. stupňa; 3.-48. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte
v dávkovaní s úpravou 1. stupňa.
< 250 buniek/mm3 (alebo febrilná neutropénia) liečbu vysaďte.
|
Zvýšená hladina
alanínaminotransaminázy
(ALT)
| V prípade pretrvávajúcich alebo narastajúcich zvýšení ≥ 5 ale < 10 x
ULN, znížte dávku s úpravou 1. stupňa a jedenkrát týždenne sledujte hladinu ALT na uistenie, že je stabilná alebo klesá
V prípade pretrvávajúcich hodnôt ALT ≥ 10 x ULN vysaďte liečbu.
|
ULN=horná hranica normy
U pediatrických pacientovje toxicita súvisiaca s liečbou ribavirínom, ako napríklad anémia, ktorá sa objaví počas liečby, riešiteľná znížením celkovej dávky. Stupne zníženia dávky sú uvedené v tabuľke
8.
Tabuľka 8: Odporúčania na úpravu dávky ribavirínu u pediatrických pacientovCelková dávka
(približne 15 mg/kg/deň)
| Jednokroková úprava dávky
(približne 7,5 mg/kg/deň)
|
Počet tabliet ribavirínu
|
400 mg/deň
| 200 mg/deň
| 1 x 200 mg tabliet ráno
|
600 mg/deň
|
400 mg/deň
| 1 x 200 mg tabliet ráno
1 x 200 mg tabliet večer
|
800 mg/deň
|
400 mg/deň
| 1 x 200 mg tabliet ráno
1 x 200 mg tabliet večer
|
1 000 mg/deň
|
600 mg/deň
| 1 x 200 mg tabliet ráno
2 x 200 mg tabliet večer
|
1 200 mg/deň
| 600 mg/deň
| 1 x 200 mg tabliet ráno
|


2 x 200 mg tabliet večer
Skúsenosti s Pegasysom pri liečbe pediatrických pacientov s HCV vo veku od 3 do 5 rokov alebo tých,
ktorí v minulosti neboli adekvátne liečení, sú len obmedzené. Neexistujú žiadne údaje u pediatrických pacientov súčasne infikovaných vírusmi HCV a HIV alebo s poruchou funkcie obličiek.
Spôsob podaniaPegasys sa podáva subkutánne do brucha alebo stehna. V štúdiách s podaním Pegasysu do ramena
bola zistená znížená expozícia Pegasysom (pozri časť 5.2).
Pegasys je navrhnutý na podávanie samotným pacientom alebo opatrovateľom. Každú injekčnú liekovku má používať len jedna osoba a je určená len na jednorazové použitie.
Pre nezdravotníckych pracovníkov, ktorí podávajú tento liek, sa odporúča primerané školenie. Pacient musí postupovať presne podľa “Pokynov pre používateľa” vložených v škatuľke.
4.3 Kontraindikácie• Precitlivenosť na liečivo, na interferóny alfa alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
• Autoimunitná hepatitída
• Ťažká dysfunkcia pečene alebo dekompenzovaná cirhóza pečene
• Anamnéza ťažkého kardiovaskulárneho ochorenia vrátane nestabilného alebo nekontrolovaného
ochorenia srdca počas predchádzajúcich 6 mesiacov (pozri časť 4.4)
• HIV-HCV pacienti s cirhózou s Child-Pughovým skóre ≥6, okrem stavu, keď je cirhóza nepriamo spôsobená hyperbilirubinémiou vyvolanou liekmi ako atazanavir a indinavir
• Kombinácia s telbivudínom (pozri časť 4.5)
• Novorodenci a deti do 3 rokov vzhľadom na prítomnosť pomocnej látky – benzylalkoholu
(pozri časť 4.4 o benzylalkohole)
• Psychické poruchy, obvzvlášť závažná depresia , suicidálne myšlienky alebo pokus o samovraždu u pediatrických pacientov v súčasnosti alebo v anamnéze.
Ak sa Pegasys má použiť v kombinácii s ribavirínom, prečítajte si súhrn charakteristických vlastností
(SmPC) ribavirínu, ktorý obsahuje kontraindikácie jeho použitia.
4.4 Osobitné upozornenia a opatrenia pri používaníPsychické poruchy a centrálny nervový systém (CNS): Počas liečby Pegasysom a aj po jej ukončení, najmä počas 6-mesačného sledovania po liečbe, sa pozorovali u niektorých pacientov závažné účinky na CNS, hlavne depresia, samovražedné predstavy a pokus o samovraždu. Pri použití alfa interferónov sa pozorovali ďalšie účinky na CNS s prejavmi ako je agresívne správanie (niekedy namierené proti iným osobám ako je myšlienka na vraždu), bipolárne poruchy, mánia, zmätenosť a poruchy vedomia. U všetkých pacientov majú byť prísne monitorované všetky znaky alebo symptómy psychických porúch. Ak sa objavia symptómy psychických porúch, ošetrujúci lekár musí vziať do úvahy možnú závažnosť týchto príznakov a zvážiť potrebu adekvátnej liečby. Ak psychiatrické symptómy pretrvávajú alebo sa zhoršujú, alebo ak sa spozorujú samovražedné predstavy, odporúča sa liečbu Pegasysom ukončiť a pacienta odporučiť do prislúchajúcej psychiatrickej starostlivosti a/alebo liečby.
Pacienti s už existujúcim psychiatrickým ochorením alebo s údajom o závažnom psychiatrickom ochorení v anamnéze: Ak sa rozhodne, že liečba Pegasysom je nutná u pacienta, ktorý má existujúce alebo v anamnéze prítomné závažné psychiatrické ochorenie, má sa liečba začať až po zaistení vhodnej individuálnej diagnostiky a liečby psychiatrického stavu.

Použitie Pegasysu u pediatrických pacientov s psychickými poruchami v súčasnosti alebo v anamnéze je kontraindikované (pozri časť 4.3).
Rast a vývoj (deti a dospievajúci): Úbytok hmotnosti a inhibícia rastu bola bežná v priebehu liečby trvajúcej až 48 týždňov u pacientov vo veku 5 až 17 rokov (pozri časti 4.8 a 5.1).
2 roky po liečbe Pegasysom bolo 16 % pediatrických pacientov stále 15 percentilov alebo viac pod svojou východiskovou krivkou hmotnosti a 11 % zostalo 15 percentilov alebo viac pod svojou východiskovou krivkou výšky.
Individuálne posúdenie prínosu liečby a rizika u detíOčakávaný prínos liečby sa má starostlivo zvažovať berúc pritom do úvahy zistenia z klinických skúšaní týkajúce sa bezpečnosti pozorované u pediatrických pacientov (pozri časti 4.8 a 5.1).
- Je dôležité vziať do úvahy, že kombinovaná liečba viedla k inhibícii rastu, ktorej reverzibilita nie je istá.
- Toto riziko je potrebné zvážiť berúc do úvahy charakter ochorenia dieťaťa, akým je dôkaz o progresii ochorenia (najmä fibrózy), komorbidity, ktoré môžu negatívne ovplyvniť priebeh
ochorenia (napr. súčasná infekcia vírusom HIV), ako aj prognostické faktory odpovede (HCV
genotyp a vírusová záťaž).
Ak je to možné, dieťa sa má liečiťpo pubertálnej akcelerácii rastu, aby sa znížilo riziko inhibície rastu. Neexistujú žiadne údaje o dlhodobých účinkoch na pohlavné dozrievanie.
Ak sa Pegasys podáva v kombinácii s ribavirínom, prečítajte si súhrn charakteristických vlastností
(SmPC) ribavirínu.
Histológia pečene pred liečbouVšetci pacienti s chronickou hepatitídou C, ktorí sa zúčastnili štúdie, sa podrobili biopsii pečene, ale v určitých prípadoch (napr. u pacientov s genotypom 2 alebo 3) sa môže liečba nasadiť aj bez histologického dôkazu. Pri rozhodovaní o nutnosti biopsie pečene pred začiatkom liečby sa má postupovať podľa platných liečebných postupov.
U pacientov s normálnymi hodnotami ALT sa progresia do fibrózy v priemere vyskytuje s nižšou intenzitou ako u pacientov so zvýšenými hodnotami ALT. Toto musí byť zhodnotené spoločne s ostatnými kritériami ako HCV genotyp, vek pacienta, extrahepatálne prejavy, riziko prenosu atď., ktoré ovplyvňujú rozhodnutie liečiť alebo neliečiť.
Laboratórne vyšetrenia pred liečbou a počas nejPred začiatkom liečby Pegasysom sa u všetkých pacientov odporúča vykonať štandardné hematologické a biochemické laboratórne vyšetrenia.
Pred začiatkom liečby Pegasysom musia byť východiskové hodnoty sledovaných parametrov nasledovné:
- počet trombocytov ≥ 90 000/mm3
- absolútny počet neutrofilov ≥ 1 500/mm3
- primerane kontrolovaná funkcia štítnej žľazy (TSH a T4)
Hematologické vyšetrenia sa majú opakovať každé 2 - 4 týždne a biochemické vyšetrenia každé 4
týždne. Počas liečby sa má periodicky robiť doplnkové vyšetrenie.
V klinických štúdiách sa počas liečby Pegasysom pozorovalo zníženie počtu leukocytov (WBC) ako aj absolútneho počtu neutrofilov (ANC), ku ktorému obyčajne došlo počas prvých dvoch týždňov liečby (pozri časť 4.8). Progresívne znižovanie po 8 týždňoch liečby sa zistilo len v zriedkavých prípadoch. Pokles ANC bol obyčajne reverzibilný po znížení dávkovania alebo ukončení liečby (pozri časť 4.2), normálne hodnoty sa dosiahli u väčšiny pacientov za 8 týždňov a na základné hodnoty sa vrátili u všetkých pacientov približne po 16 týždňoch.
Liečbu Pegasysom sprevádzalo zníženie počtu trombocytov, ktorý sa vrátil na úroveň pred liečbou počas obdobia sledovania po liečbe (pozri časť 4.8). V niektorých prípadoch bola potrebná úprava dávkovania (pozri časť 4.2).
V klinických štúdiách sa u 15 % pacientov s chronickou hepatitídou C liečených Pegasysom
v kombinácii s ribavirínom pozoroval výskyt anémie (hemoglobín <10 g/dl). Frekvencia závisí na dĺžke trvania liečby a na dávke ribavirínu (pozri časť 4.8). U ženskej populácie je vyššie riziko vývoja anémie.
Pri podávaní Pegasysu v kombinácii s inými potenciálne myelosupresívnymi látkami je potrebná opatrnosť.
V literatúre sú hlásenia o výskyte pancytopénie a o útlme kostnej drene, ku ktorým došlo v priebehu 3 až 7 týždňov po podaní peginterferónu a ribavirínu podaného súbežne s azatioprinom. Táto myelotoxicita bola reverzibilná do 4 až 6 týždňov po vysadení antivirotickej terapie proti hepatitíde C a súčasne podávaného azatioprinu a neobnovila sa po opätovnom zavedení ktoréhokoľvek z týchto liečiv podávaných v monoterapii (pozri časť 4.5).
Použitie kombinovanej liečby Pegasysom a ribavirínom u pacientov s chronickou hepatitídou C,
u ktorých zlyhala predchádzajúca liečba, sa dostatočne nesledovalo u pacientov, ktorí predchádzajúcu liečbu predčasne ukončili kvôli hematologickým nežiaducim reakciám. Lekári, ktorí uvažujú o liečbe týchto pacientov, majú starostlivo zvážiť riziká opakovanej liečby oproti jej prínosom.
Endokrinný systém
Pri používaní interferónov alfa vrátane Pegasysu sa popísali poruchy funkcie štítnej žľazy, resp. zhoršenie predchádzajúcich ochorení štítnej žľazy. Pred začiatkom liečby Pegasysom sa majú vyšetriť hladiny TSH a T4. Liečbu Pegasysom je možné zahájiť alebo je možné v nej pokračovať, ak sa hodnoty TSH počas liečby udržia v normálnom rozmedzí. Počas liečebnej kúry sa majú vyšetriť hladiny TSH, ak sa u pacienta objavia klinické príznaky svedčiace o možnej poruche funkcie štítnej
žľazy (pozri časť 4.8). Pri liečbe Pegasysom sa môže pozorovať hypoglykémia, hyperglykémia a
diabetes mellitus (pozri časť 4.8). Pacienti, u ktorých sa tieto stavy nemôžu účinne kontrolovať liekmi, sa nemajú začať liečiť Pegasysom alebo Pegasysom v kombinácii s ribavirínom. U pacientov, u ktorých sa toto ochorenie rozvinulo počas liečby a nemôžu sa liečiť liekmi, má sa liečba Pegasysom alebo Pegasysom v kombinácii s ribavirínom ukončiť.
Kardiovaskulárny systém
Liečbu interferónmi alfa vrátane Pegasysu sprevádzala hypertenzia, supraventrikulárne arytmie, kongestívne srdcové zlyhanie, bolesť na hrudníku a infarkt myokardu. Odporúča sa, aby sa pacienti so srdcovými abnormalitami v predchorobí podrobili elektrokardiografickému vyšetreniu pred začiatkom liečby Pegasysom. Pri akomkoľvek zhoršení kardiovaskulárneho stavu sa musí liečba prerušiť resp. ukončiť. U pacientov s kardiovaskulárnym ochorením si môže anémia vyžiadať zníženie dávkovania alebo vysadenie liečby ribavirínom (pozri časť 4.2).
Funkcia pečene
Liečba Pegasysom sa musí ukončiť u pacientov, u ktorých sa počas liečby objavia známky dekompenzácie pečene. Pri liečbe Pegasysom sa pozorovalo zvýšenie hladín ALT oproti východiskovej hodnote, ku ktorému došlo aj u pacientov s virologickou odpoveďou na liečbu. Ak napriek zníženiu dávkovania hodnota ALT naďalej stúpa a je klinicky významná resp. ju sprevádza zvýšenie hladiny priameho bilirubínu, liečba sa musí ukončiť (pozri časti 4.2 a 4.8).
V prípade chronickej hepatitídy B, na rozdiel od chronickej hepatitídy C, nie je nezvyčajné zhoršenie ochorenia počas liečby, ktoré je charakterizované prechodným a potenciálne významným zvýšením sérovej ALT. V klinických štúdiách s Pegasysom pri HBV sa pozorovalo výrazné zvýšenie hladiny transaminázy, sprevádzané miernymi zmenami v ďalších parametroch hepatálnej funkcie, pričom sa nedokázala dekompenzácia pečene. Približne v polovici prípadov zvýšenia ALT prekračujúceho desaťnásobok hornej hranice normálnej hodnoty sa dávkovanie Pegasysu znížilo alebo liek sa vysadil,
až kým neklesli hodnoty transaminázy, zatiaľ čo u zvyšku pacientov liečba ostala nezmenená. Vo všetkých prípadoch sa odporučilo častejšie sledovanie hepatálnej funkcie.
Precitlivenosť
V zriedkavých prípadoch sa počas liečby interferónom alfa môžu vyskytnúť závažné akútne reakcie
z precitlivenosti (napr. urtikária, angioedém, bronchokonstrikcia, anafylaxia). Ak sa vyskytnú, musí sa liečba ukončiť a okamžite zahájiť príslušná farmakoterapia. Prechodný exantém si nevyžaduje nutnosť prerušenia liečby.
Autoimunitné ochorenie
Popísaný bol vznik autoprotilátok a autoimunitných porúch počas liečby interferónmi alfa. Zvýšené riziko môžu mať pacienti predisponovaní na rozvoj autoimunitných porúch. Pacientov, ktorí majú znaky alebo príznaky zlučiteľné s autoimunitnými poruchami, sa má starostlivo vyšetriť a potom prehodnotiť pomer prínosu a rizika pokračovania liečby interferónom (pozri tiež Endokrinný systém v častiach 4.4 a 4.8).
U pacientov s chronickou hepatitídou C liečených interferónom boli hlásené prípady Vogt-Koyanagi- Harada (VKH) syndrómu. Tento syndróm je granulomatózne zápalové ochorenie, ktoré postihuje oči, sluchový systém, meningy a kožu. Ak je podozrenie na VKH syndróm, má sa antivirotická liečba ukončiť a uvažovať o liečbe kortikoidmi (pozri časť 4.8).
Horúčka/infekcie
Zatiaľ čo horúčka môže byť spojená so syndrómom podobným chrípke, čo sa často uvádza pri liečbe interferónom, musia sa vylúčiť iné príčiny pretrvávajúcej horúčky, zvlášť závažné infekcie (bakteriálne, vírusové, plesňové), najmä u pacientov s neutropéniou. V priebehu liečby interferónmi alfa, vrátane Pegasysu sa zaznamenal vznik závažných infekcií (bakteriálnych, vírusových, plesňových) a sepsa. Okamžite sa má začať odpovedajúca liečba proti infekcii a má sa zvážiť prerušenie liečby.
Očné zmeny
Pri liečbe Pegasysom sa zriedkavo popísala retinopatia, vrátane krvácania do sietnice, vatových škvŕn, edému papily, neuropatie zrakového nervu a uzáveru retinálnej artérie alebo vény, ktorý môže viesť
k strate zraku. Všetci pacienti sa majú pred začiatkom liečby podrobiť očnému vyšetreniu. Každý pacient udávajúci zhoršenie alebo stratu zraku sa musí okamžite podrobiť kompletnému očnému vyšetreniu. Dospelí a pediatrickí pacienti s očnými poruchami v predchorobí (napr. diabetickou alebo hypertenznou retinopatiou), sa majú počas liečby Pegasysom podrobiť pravidelným očným
vyšetreniam. Liečba Pegasysom sa má ukončiť u pacientov s novovzniknutými alebo zhoršenými
poruchami zraku.
Pľúcne zmeny
Počas liečby Pegasysom sa opísali pľúcne zmeny vrátane dýchavice, pľúcnych infiltrátov, pneumónie a pneumonitídy. V prípade pretrvávajúcich alebo nevysvetlených pľúcnych infiltrátov alebo zhoršenia funkcie pľúc sa má liečba ukončiť.
Kožné poruchy
Liečba interferónmi alfa bola sprevádzaná exacerbáciou alebo rozvojom psoriázy a sarkoidózy. Pegasys sa musí opatrne používať u pacientov s psoriázou a v prípadoch vzniku resp. zhoršenia psoriatických lézií sa musí liečba ukončiť.
Transplantácia
Bezpečnosť a účinnosť liečby Pegasysom a ribavirínom sa u pacientov po transplantácii pečene a iných orgánov nehodnotila. Podobne ako pri iných interferónoch alfa, boli hlásené odvrhnutia transplantátov pečene a obličiek po liečbe Pegasysom samotným alebo po kombinovanej liečbe s ribavirínom.
Súčasná infekcia HIV-HCV
Prosím pozrite si súhrny charakteristických vlastností pre antiretrovírusové lieky, ktoré sa užívajú súbežne s HCV liečbou pre porozumenie a zvládnutie toxických účinkov každého lieku a možnosti prekrývania sa toxických účinkov pri liečbe Pegasysom s ribavirínom alebo bez ribavirínu. V štúdii NR15961 u pacientov, ktorí boli súbežne liečení so stavudínom a interferónom s alebo bez ribavirínu, bol výskyt pankreatitídy a/alebo laktátovej acidózy 3 % (12/398).
U pacientov súčasne infikovaných HCV a HIV, ktorí dostávajú vysoko-účinnú liečbu anti- retrovírusovými látkami (HAART), môže byť vyššie riziko vzniku laktátovej acidózy. Preto je potrebná opatrnosť pri pridaní kombinovanej liečby Pegasys a ribavirín k liečbe HAART (pozri SPC ribavirínu).
Súčasne infikovanípacienti s pokročilou infekciou a pokročilou cirhózou pečene liečení HAART môžu mať vyššie riziko dekompenzácie pečene a úmrtia, ak dostávajú ribavirín v kombinácii s interferónmi vrátane Pegasysu. Zmeny východiskových hodnôt u koinfikovaných pacientov s cirhózou, ktoré môžu byť spojené s dekompenzáciou pečene, zahŕňajú: zvýšený sérový bilirubín, znížený hemoglobín, zvýšenú alkalickú fosfatázu alebo znížený počet krvných doštičiek a liečbu didanozínom (ddI).
Súbežná liečba ribavirínom a zidovudínom sa neodporúča vzhľadom na zvýšené riziko vzniku anémie
(pozri časť 4.5).
Počas liečby pacienti s kombinovanou infekciou sa majú starostlivo sledovať na znaky a symptómy dekompenzácie pečene (vrátane ascitu encefalopatie, krvácania z varixov, poškodenej syntézy
v pečeni; napr. Childovo-Pughovo skóre 7 alebo vyššie). Childovo-Pughovo skóre môže byť ovplyvnené faktormi spojenými s liečbou (ako nepriama hyperbilirubinémia, znížený albumín) a nemusia nevyhnutne viesť k dekompenzácii pečene. Liečba Pegasysom sa má ihneď ukončiť u pacientov s dekompenzáciou pečene.
U pacientov súčasne infikovaných HCV a HIV, údaje o účinnosti a bezpečnosti sú obmedzené
u pacientov s počtom CD4 buniek nižším ako 200 buniek/µl. Opatrnosť je preto potrebná u pacientov s nízkym počtom CD4 buniek.
Dentálne a periodontálne poruchy
U pacientov, ktorí dostávajú Pegasys v kombinácii s ribavirínom, sa hlásili dentálne a periodontálne poruchy, ktoré môžu viesť k strate zubov. Navyše suché ústa môžu mať škodlivý účinok na zuby a mukózne membrány úst počas dlhotrvajúcej liečby Pegasysom v kombinácii s ribavirínom. Pacienti si
majú dvakrát denne dôkladne čistiť zuby a majú mať pravidelné kontrolné vyšetrenie zubným
lekárom. Okrem toho u niektorých pacientov sa môže objaviť vracanie. Ak sa takáto reakcia vyskytne, má sa im odporučiť dôkladne si potom vypláchnuť ústa.
Použitie dlhodobej liečby peginterferónom v monoterapii (neschválené použitie)
V randomizovanej, kontrolovanej štúdii (HALT-C) uskutočnej v USA u pacientov infikovaných vírusom HCV s rozličným stupňom fibrózy, ktorí neodpovedali na liečbu, sa sledovala 3,5-ročná liečba Pegasysom v monoterapii v dávke 90 mikrogramov/týždeň, pričom sa nezistilo žiadne signifikantné zníženie výskytu progresie fibrózy alebo súvisiacich klinických príhod.
Pomocná látka
Pegasys obsahuje benzylakohol. Nesmie sa podávať predčasne narodeným deťom ani novorodencom. Môže spôsobiť toxické reakcie a anafylaktické reakcie u dojčiat a detí vo veku do 3 rokov.
4.5 Liekové a iné interakcie
Interakčné štúdie sa uskutočnili len u dospelých.
Podávanie Pegasysu zdravým mužským dobrovoľníkom v dávke 1 x 180 mikrogramov týždenne počas 4 týždňov nemalo žiadny vplyv na farmakokinetické profily mefenytoínu, dapsonu,
debrisochínu a tolbutamidu, čo poukazuje na to, že Pegasys neovplyvňuje in vivo metabolickú aktivitu izoenzýmov cytochrómu P450 3A4, 2C9, 2C19 a 2D6.
V rovnakej štúdii sa pozorovalo 25 % zvýšenie hodnoty AUC pre teofylín (marker aktivity cytochrómu P450 1A2), čo potvrdzuje, že Pegasys je inhibítorom aktivity cytochrómu P450 1A2. U pacientov liečených súbežne teofylínom a Pegasysom sa majú sledovať sérové koncentrácie teofylínu a vhodne upraviť jeho dávkovanie. Je pravdepodobné, že k maximálnej interakcii medzi teofylínom a Pegasysom dôjde po viac ako 4 týždňoch liečby Pegasysom.
Pacienti s izolovanou infekciou vírusom HCV a pacienti s izolovanou infekciou vírusom HBV
Vo farmakologickej štúdii dostávalo 24 HCV infikovaných pacientov súbežne udržiavaciu liečbu
metadonom (stredná dávka 95 mg, v rozmedzí od 30 mg do 150 mg), liečba s Pegasysom
180 mikrogramov, subkutánne raz týždenne počas 4 týždňov, bola spojená s priemernými hodnotami metadonu, ktoré boli 10 % až 15 % vyššie než východiskové hodnoty. Klinický význam tohto zistenia nie je známy, napriek tomu sa majú pacienti sledovať pre príznaky a symptómy metadonovej toxicity. Zvlášť sa majú sledovať pacienti, ktorí užívajú vysokú dávku metadonu, u ktorých je riziko predĺženia QT intervalu.
Ribavirín, keďže má inhibičný účinok na inozín-monofosfátdehydrogenázu, môže zasahovať do metabolizmu azatioprinu, čo eventuálne môže viesť ku kumulácii 6-metyltioinozín-monofosfátu (6- MTIMP), ktorý sa spája so vznikom myelotoxicity u pacientov liečených azatioprinom. Má sa vyhnúť použitiu peginterferónu alfa-2a a ribavirínu podaného súbežne s azatioprinom. V jednotlivých prípadoch, ak prínos podávania ribavirínu súčasne s azatioprinom oprávňuje podstúpiť možné riziko, odporúča sa dôkladne monitorovať hematologické parametre počas súbežného podávania azatioprinu so zreteľom odhaliť známky myelotoxicity − v prípade, že k nej dôjde, treba liečbu týmito liekmi ukončiť (pozri časť 4.4).
Výsledky z farmakokinetických podštúdií v rámci pilotnej štúdie fázy III nepreukázali žiadnu farmakokinetickú interakciu medzi lamivudínom a Pegasysom u pacientov s HBV alebo medzi Pegasysom a ribavirínom u pacientov s HCV.
V klinickom skúšaní bola skúmaná kombinácia telbivudínu 600 mg denne s pegylovaným interferónom alfa-2a, 180 mikrogramov raz týždenne podané subkutánne. Skúšanie ukázalo, že kombinácia je spojená so zvýšeným rizikom vzniku periférnej neuropatie. Mechanizmus vzniku týchto udalostí nie je známy; a tak kombinovaná liečba telbivudínom s inými interferónmi (pegylovanými alebo štandardnými) môže tiež znamenať nesmierne riziko. Okrem toho, prínos kombinovanej liečby telbivudínom s interferónom alfa (pegylovaným alebo štandardným) nie je v súčasnosti preukázaný. Preto je kombinácia Pegasysu s telbivudínom kontraindikovaná (pozri časť 4.3).
Pacienti súčasne infikovaní vírusmi HIV-HCV
U 47 HIV-HCV infikovaných pacientov, ktorí sa zúčastnili na 12-týždňovej farmakokinetickej časti
štúdie skúmajúcej účinok ribavirínu na vnútrobunkovú fosforyláciu niektorých inhibítorov nukleozidovej reverznej transkriptázy (lamivudín a zidovudín alebo stavudín) sa nepozoroval žiadny zjavný dôkaz o liekovej interakcii. Avšak v dôsledku vysokej variability boli intervaly spoľahlivosti dosť široké. Nezdá sa, že plazmatická expozícia ribavirínu je ovplyvnená súčasným podávaním inhibítorov nukleozidovej reverznej transkriptázy (NRTI).
Súbežné podávanie ribavirínu a didanozínu sa neodporúča. Expozícia didanozínu alebo jeho aktívnemu metabolitu (dideoxyadenozín 5´-trifosfát) sa zvyšuje in vitro ak sa didanozín podáva spolu s ribavirínom. Pri používaní ribavirínu sa popísali prípady zlyhania pečene s následkom smrti, ako aj periférna neuropatia, pankreatitída a symptomatická hyperlaktatémia/laktátová acidóza.
Keď bol zidovudín súčasťou režimu používaného na liečbu HIV, bolo hlásené zvýraznenie anémie spôsobenej ribavirínom. Presný mechanizmus zostáva nevysvetlený. Súčasné podávanie ribavirínu
kombinovaná antiretrovírusová liečba stanovená, má sa zvážiť nahradenie zidovudínu. Je to zvlášť
dôležité u pacientov, u ktorých zidovudín spôsobil anémiu.
4.6 Fertilita, gravidita a laktácia
Nie sú k dispozícii žiadne alebo iba obmedzené údaje o použití peginterferónu alfa-2a u gravidných žien. Štúdie na zvieratách s peginterferónom alfa-2a preukázali reprodukčnú toxicitu (pozri časť 5.3) a nie je známe potenciálne riziko u ľudí. Liečba Pegasysom počas gravidity sa používa iba vtedy, ak jej úžitok pre matku prevýši jeho riziko pre plod.
Laktácia
Nie je známe, či sa peginterferón alfa-2a/jeho metabolity vylučujú do materského mlieka. Dojčenie sa má ukončiť pred začatím liečby pre možnosť vzniku nežiaducich reakcií u dojčených detí.
Fertilita
Nie sú k dispozícii žiadne údaje o účinkoch peginterferónu alfa-2a na fertilitu žien. Pri podávaní peginterferónu alfa-2a samiciam opíc sa pozorovalo predĺženie menštruačného cyklu (pozri časť 5.3).
Použitie s ribavirínom
U všetkých zvieracích druhov, ktoré boli vystavené ribavirínu, sa dokázali významné teratogénne a/alebo embryocídne účinky. Ribavirín je u gravidných žien kontraindikovaný. Je potrebná mimoriadna opatrnosť na zabránenie gravidity u pacientok alebo partneriek pacientov, ktorí užívajú Pegasys v kombinácii s ribavirínom. Pacientky v plodnom veku musia používať účinnú antikoncepciu počas liečby a ešte 4 mesiace po ukončení liečby. Pacienti alebo partnerky musia používať účinnú antikoncepciu počas liečby a ešte 7 mesiacov po ukončení liečby. Prosím pozrite si SmPC ribavirínu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pegasys má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti, ktorí trpia závratom, zmätenosťou, ospalosťou alebo únavou, sa majú vyvarovať vedeniu vozidiel
alebo obsluhovaniu strojov.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Chronická hepatitída C
Výskyt a závažnosť väčšiny nežiaducich účinkov u pacientov liečených Pegasysom je podobná ako u pacientov dostávajúcich interferón alfa-2a (pozri tabuľku 9). Väčšina častých nežiaducich reakcií pozorovaných po Pegasyse 180 mikrogramov bola miernej až strednej intenzity, pričom bolo možné ich zvládnuť bez potreby zmeny dávkovania alebo ukončenia liečby.
Chronická hepatitída B
V klinických štúdiách, ktoré skúmali 48-týždňovú liečbu a 24-týždňové sledovanie po liečbe bol bezpečnostný profil Pegasysu pri chronickej hepatitíde B podobný ako v prípade chronickej hepatitídy C. Frekvencia výskytu väčšiny nežiaducich reakcií, s výnimkou pyrexie, bola výrazne nižšia v prípade CHB liečenej Pegasysom v monoterapii v porovnaní s HCV pacientami liečenými s Pegasysom
v monoterapii (pozri tabuľku 9). Nežiaduce účinky malo 88 % pacientov liečených Pegasysom
v porovnaní s 53 % pacientov v porovnávacej skupine s lamivudínom, kým 6 % pacientov liečených Pegasysom a 4 % pacientov liečených lamivudínom mali závažné nežiaduce účinky počas štúdií. Nežiaduce účinky alebo abnormálne laboratórne hodnoty viedli u 5 % pacientov k ukončeniu liečby v skupine liečenej Pegasysom, zatiaľ čo menej ako 1 % pacientov ukončilo liečbu v skupine liečenej lamivudínom z tých istých dôvodov. Percento pacientov s cirhózou, ktorí ukončili liečbu bolo podobné ako u pacientov v celkovej populácii v každej liečenej skupine.
Chronická hepatitída C u pacientov, ktorí neodpovedali na predchádzajúcu liečbu
U pacientov, ktorí neodpovedali na predchádzajúcu liečbu, bol bezpečnostný profil Pegasysu
v kombinácii s ribavirínom celkovo podobný ako u predtým neliečených pacientov. V klinickom skúšaní u pacientov, ktorí neodpovedali na predchádzajúcu liečbu pegylovaným interferónom
alfa-2b/ribavirínom, v ktorej boli pacienti podrobení buď 48-týždňovej, alebo 72-týždňovej liečbe, došlo kvôli nežiaducim udalostiam alebo laboratórnym odchýlkam k predčasnému ukončeniu liečby Pegasysom u 6 % pacientov a liečby ribavirínom u 7 % pacientov v skupine liečenej 48 týždňov a v skupine liečenej 72 týždňov z rovnakého dôvodu liečbu Pegasysom predčasne ukončilo 12 %
pacientov a liečbu ribavirínom 13 % pacientov. Podobne aj u pacientov s cirhózou alebo prechodom
do cirhózy sa predčasné ukončenie liečby Pegasysom a liečby ribavirínom vyskytovalo častejšie v skupine liečenej 72 týždňov (13 % a 15 %) než v skupine liečenej 48 týždňov (6 % a 6 %). Pacienti, ktorí kvôli hematologickej toxicite predčasne ukončili predchádzajúcu liečbu pegylovaným interferónom alfa-2b/ribavirínom, boli z účasti na tejto štúdii vylúčení.
V ďalšom klinickom skúšaní boli 48 týždňov liečení pacienti s pokročilou fibrózou alebo cirhózou (Ishakovo skóre 3 až 6), ktorí neodpovedali na predchádzajúcu liečbu a ktorí mali pred zaradením do štúdie počet trombocytov iba 50 000/mm3. Odchýlky laboratórnych hematologických parametrov pozorované počas prvých 20 týždňov štúdie zahŕňali anémiu (26 % pacientov malo hladinu hemoglobínu < 10 g/dl), neutropéniu (30 % pacientov malo ANC < 750/mm3) a trombocytopéniu
(13 % pacientov malo počet trombocytov < 50 000/mm3) (pozri časť 4.4).
Súčasná infekcia vírusom chronickej hepatitídy C a vírusom HIV
U pacientov súčasne infikovaných vírusmi HIV-HCV boli profily klinických nežiaducich reakcií pri liečbe Pegasysom samotným alebo v kombinácii s ribavirínom podobné ako profily pacientov infikovaných len HCV. U HIV-HCV pacientov, ktorí dostávali Pegasys a ribavirín v kombinovanej liečbe, boli hlásené ďalšie nežiaduce účinky u ≥ 1 % až ≤ 2 % pacientov: hyperlaktacidémia/laktát acidóza, chrípka, pneumónia, psychická labilita, apatia, hučanie v ušiach, faryngolaryngeálna bolesť, zápal pery, získaná lipodystrofia a chromatúria. Liečba Pegasysom bola spojená s poklesom absolútneho počtu CD4+ buniek počas prvých 4 týždňov bez zníženia percenta CD4+ buniek. Pokles počtu CD4+ buniek bol po znížení dávky alebo po ukončení liečby reverzibilný. Používanie Pegasysu nemalo žiadny pozorovateľný negatívny vplyv na kontrolu HIV virémie počas liečby alebo následnom sledovaní pacientov. U koinfikovaných pacientov s počtom CD4+ buniek < 200/μl sú údaje
o bezpečnosti obmedzené.
Tabuľkový súhrn nežiaducich reakcií
V tabuľke 9 sú zhrnuté nežiaduce účinky hlásené u CHB alebo CHC pacientov pri liečbe Pegasysom
v monoterapii a u CHC pacientov liečených Pegasysom v kombinácii s ribavirínom. Nežiaduce účinky hlásené v klinických štúdiách sú zoradené do skupín podľa frekvencie a to nasledovne: veľmi časté
(≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až
< 1/1 000), veľmi zriedkavé (< 1/10 000). Frekvencia nežiaducich účinkov na základe spontánnych
hlásení vychádzajúcich zo skúseností po uvedení lieku na trh nie je známa (nemožno ju odhadnúť z dostupných údajov). V rámci jednotlivých skupín je frekvencia nežiaducich účinkov z hľadiska závažnosti usporiadaná v klesajúcom poradí.
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Infekcie a
nákazy
|
|
bronchitída,
infekcie horných dýchacích ciest, kandidóza
ústnej dutiny, herpes simplex, hubovité,
vírusové
a bakteriálne infekcie
|
pneumónia,
kožná infekcia
|
endokarditída,
zápal
vonkajšieho ucha
|
|
sepsa
|
Benígne a
malígne nádory
|
|
|
neoplazma
pečene
|
|
|
|
Poruchy krvi
a lymfatického systému
|
|
trombocytopéni
a, anémia, lymfadenopatia
|
|
pancytopénia
|
aplastická
anémia
|
izolovaná
aplázia červených krviniek
|
Poruchy
imunitného systému
|
|
|
sarkoidóza,
tyroiditída
|
anafylaxia,
systémový lupus erythematosus, reumatoidná artritída
|
idiopatická
alebo tromboticko- trombocyto- penická purpura
|
odvrhnutie
transplantá-tu pečene
a obličiek, Vogt- Koyanagi-
Harada
ochorenie
|
Poruchy
endokrinnéh o systému
|
|
hypotyreóza,
hypertyreóza
|
diabetes
|
diabetická
ketoacidóza
|
|
|
Poruchy
metabolizmu a výživy
|
anorexia
|
|
dehydratácia
|
|
|
|
Psychické
poruchy
|
depresia*,
úzkosť, nespavosť*
|
agresia, zmeny
nálady, emočné poruchy nervozita, pokles libida
|
samovražedn
é myšlienky, halucinácie
|
samovražda,
psychotická porucha
|
|
mánia,
bipolárne poruchy, myšlienky na vraždu
|
Poruchy
nervového systému
|
bolesť
hlavy, závrat*, zníženie
koncentrá-
cie
|
synkopa,
migréna, porucha pamäti slabosť,
hypoestézia,
hyperestézia, parestézia, tremor, porucha chuti, nočné mory, ospanlivosť
|
periférna neuropatia
|
kóma, kŕče, paréza tváre
|
|
cerebrálna ischémia
|
Poruchy oka
|
|
neostré videnie,
bolesť oka, zápal oka, xeroftalmia
|
krvácanie do
sietnice
|
zraková
neuropatia, papiloedém, poškodenie ciev sietnice, retinopatia, vred rohovky
|
strata zraku
|
serózne
odlúčenie sietnice
|
|
|
Tabuľka 9:Nežiaduce účinky hlásené v klinických skúšaniach a po uvedení lieku na trh pri monoterapii Pegasysom u pacientov s HBV alebo s HCV alebo v kombinácii s ribavirínom u HCV pacientov
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Poruchy
ucha a labyrintu
|
|
vertigo, bolesť
ucha
|
strata sluchu
|
|
|
|
Poruchy
srdca a srdcovej činnosti
|
|
tachykardia,
periférny edém, palpitácie,
|
|
infarkt
myokardu, kongestívne zlyhanie srdca, kardiomyopatia, angína, arytmia, fibrilácia predsiene, perikarditída, supra - vertikulárna tachykardia
|
|
|
Poruchy ciev
|
|
sčervenanie
|
hypertenzia
|
krvácanie do
mozgu, vaskulitída
|
|
periférna
ischémia
|
Poruchy
dýchacej sústavy hrudníka amediastína
|
dýchavica
|
námahová
dýchavica, krvácanie
z nosa, zápal nosohltana,
kongescia
prínosných dutín, nádcha, kongescia nosovej sliznice, bolesť hrdla
|
sipot
|
intersticiálna
pneumónia, vrátane úmrtia, pľúcna embólia
|
|
|
Poruchy
gastrointesti nál-neho traktu
|
hnačka*,
nevoľnosť*, bolesť brucha*
|
vracanie,
dyspepsia, dysfágia, ulcerácia dutiny ústnej, krvácanie ďasien, glositída, stomatitída, plynatosť, sucho v ústach
|
gastrointestin
álne krvácanie
|
peptický vred,
pankreatitída
|
|
ischemická
kolitída
|
Poruchy
pečene a žlčových ciest
|
|
|
porucha
funkcie pečene
|
zlyhanie pečene,
cholangitída, stukovatenie pečene
|
|
|
Poruchy
kože a podkožného tkaniva
|
alopécia,
dermatití- da, svrbenie, suchá koža
|
psoriáza,
urtikária, ekzém, vyrážka, zvýšené potenie, kožná porucha, fotosenzitivita, nočné potenie
|
|
|
Stevens-
Johnsonov syndróm, toxická epidermálna nekrolýza, angioedém, erythema multiforme
|
|
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Poruchy
kostrovej a svalovej sústavy a
spojivového
tkaniva
|
myalgia,
artralgia
|
bolesť chrbta,
artritída, svalová slabosť, bolesť
kostí, bolesť
šije, bolesť svalov a kostrového systému, svalové kŕče
|
|
myozitída
|
|
rabdomyo- lýza
|
Poruchy
obličiek a močo- vých ciest
|
|
|
|
renálna
insuficiencia
|
|
|
Poruchy
reprodukčné ho systému a prsníkov
|
|
impotencia
|
|
|
|
|
Celkové
poruchy a reakcie
v mieste podania
|
pyrexia,
zimnica* bolesť*, asténia, únava, reakcia
v mieste podania injekcie*, citlivosť*
|
bolesť na
hrudníku, príznaky podobné chrípke, malátnosť, letargia, návaly tepla, smäd
|
|
|
|
|
Laboratórne
a funkčné vyšetrenia
|
|
úbytok
hmotnosti
|
|
|
|
|
Úrazy,
otravy a komplikácie liečebného postupu
|
|
|
|
predávkovanie
liekom
|
|
|
*Tieto nežiaduce reakcie boli časté (
≥1/100 až < 1/10) u CHB pacientov liečených Pegasysom v monoterapii.
Popis vybraných nežiaducich reakciíLaboratórne hodnotyLiečbu Pegasysom sprevádzali nasledovné odchýlky laboratórnych parametrov: zvýšenie ALT, zvýšenie bilirubínu, poruchy rovnováhy elektrolytov (hypokaliémia, hypokalciémia, hypofosfatémia),

hyperglykémia, hypoglykémia a zvýšenie triglyceridov (pozri časť 4.4). U oboch spôsobov liečby, t.j. pri použití Pegasysu v monoterapii aj v kombinácii s ribavirínom sa u 2 % pacientov pozoroval vzostup hladín ALT, ktorý si vyžiadal úpravu dávkovania alebo ukončenie liečby.
Liečba Pegasysom bola spojená s poklesom hematologických parametrov (leukopénia, neutropénia, lymfopénia, trombocytopénia a pokles hemoglobínu), ktoré sa po úprave dávkovania obyčajne zlepšili a vrátili na úroveň spred liečby v priebehu 4 - 8 týždňov po ukončení liečby (pozri časti 4.2 a 4.4).
Mierna neutropénia (ANC: 0,749 – 0,5 x 109/l) sa pozorovala u 24 % (216/887) pacientov a ťažká neutropénia (ANC: < 0,5 x 109/l) u 5 % (41/887) pacientov, ktorí dostávali Pegasys v dávke
180 mikrogramov v kombinácii s ribavirínom v dávke 1 000 mg alebo 1 200 mg počas 48 týždňov.
Protilátky proti interferónu
U 1 – 5 % pacientov liečených Pegasysom sa zistila prítomnosť neutralizačných protilátok. Podobne ako v prípade ďalších interferónov, vyšší výskyt neutralizačných protilátok sa pozoroval aj pri
chronickej hepatitíde B. Avšak pri žiadnej z týchto chorôb to nesúviselo s nedostatočnou terapeutickou
odpoveďou.
Funkcia štítnej žľazyLiečbu Pegasysom sprevádzali klinicky významné odchýlky hodnôt parametrov štítnej žľazy, ktoré si vyžadovali klinický zásah (pozri časť 4.4). Výskyt pozorovaných odchýlok (4,9 %) u pacientov
liečených Pegasysom v kombinácii s ribavirínom (NV15801) je podobný ako u pacientov liečených
inými interferónmi.
Laboratórne hodnoty u pacientov súčasne infikovaných vírusmi HIV-HCVHoci hematologická toxicita neutropénie, trombocytopénie a anémie sa vyskytovala častejšie u HIV- HCV pacientov, väčšina prípadov sa dala zvládnuť úpravou dávkovania a použitím rastových faktorov a vzácne došlo k predčasnému ukončeniu liečby. Pokles hladín ANC pod 500 buniek/mm3 sa
pozoroval u 13 % a 11 % pacientov, ktorí dostávali Pegasys v monoterapii a v kombinácii v uvedenom poradí. Pokles počtu krvných doštičiek pod 50 000/mm3 sa pozoroval u 10 % a 8 % pacientov, ktorí dostávali Pegasys v monoterapii a v kombinácii v uvedenom poradí. Anémia (hemoglobín < 10 g/dl)
sa popísala u 7 % a 14 % pacientov liečených Pegasysom v monoterapii a v kombinácii v uvedenom
poradí.
Pediatrická populáciaChronická hepatitída CV klinickom skúšaní so 114 pediatrickými pacientmi (vo veku 5 až 17 rokov) liečenými samotným Pegasysom alebo v kombinácii s ribavirínom (pozri časť 5.1) boli úpravy dávky potrebné u približne jednej tretiny pacientov najčastejšie kvôli neutropénii a anémii. Vo všeobecnosti bol bezpečnostný profil pozorovaný u pediatrických pacientov podobný ako profil pozorovaný u dospelých. Vpediatrickej štúdii najrozšírenejšie nežiaduce reakcie u pacientov liečených kombinovanou liečbou Pegasysom a ribavirínom počas až 48 týždňov boli ochorenie podobné chrípke (91 %), bolesť hlavy (64 %), gastrointestinálne ochorenie (56 %) a reakcie v mieste podania injekcie (45 %). Úplný zoznam nežiaducich reakcií hlásených v tejto liečebnej skupine (n = 55) je uvedený v tabuľke 10. Sedem pacientov užívajúcich kombinovanú liečbu Pegasysom a ribavirínom počas 48 týždňov prerušilo
liečbu s bezpečnostných dôvodov (depresia, abnormálne hodnotenie psychického stavu, prechodná slepota, exudáty na sietnici , hyperglykémia, diabetes mellitus typu 1 a anémia). Väčšina nežiaducich reakcií zaznamenaných v štúdii bola mierna alebo stredne závažná. Závažné nežiaduce reakcie sa zaznamenali u 2 pacientov v skupine s kombinovanou liečbou Pegasysom plus ribavirín (hyperglykémia a cholecystektómia).
Tabuľka 10: Nežiaduce reakcie hlásené u pediatrických pacientov infikovaných vírusom HCVpripisované Pegasysu plus ribavirínu v štúdii NV17424Telový systém
| Veľmi časté
| Časté
|
Infekcie a nákazy
|
| infekčná mononukleóza,
streptokoková faryngitída, chrípka, vírusová gastroenteritída, kandidóza, gastroenteritída, zubný absces, hordeolum, infekcia močových ciest, zápal nosohltana
|
Poruchy krvi a lymfatického
systému
|
| anémia
|
Poruchy metabolizmu a výživy
| zníženie chute do jedla
| hyperglykémia, diabetes mellitus
typu 1
|
T
elový systém
|
V
eľmi časté
|
Č
asté
|
Psychické poruchy
|
insomnia
|
depresia, úzkosť, halucinácie,
nenormálne správanie, agresia, hnev, zníženie pozornosti/neusporiadaná hyperaktivita
|
Poruchy nervového systému
|
bolesť hlavy
|
závrat, porucha pozornosti, migréna
|
Poruchy oka
|
|
prechodná slepota, exudáty na
sietnici, zhoršenie videnia, podráždenie oka, bolesť oka, svrbenie oka
|
Poruchy ucha a labyrintu
|
|
bolesť ucha
|
Poruchy dýchacej sústavy, hrudníka
a mediastína
|
|
dyspnoe, epistaxa
|
Poruchy gastrointestinálneho traktu
|
gastrointestinálna porucha
|
bolesť v nadbrušku, stomatitída,
nevoľnosť, aftózna stomatitída, orálna porucha
|
Poruchy kože a
podkožného tkaniva
|
vyrážka, svrbenie, alopécia
|
opuch tváre, liekový exantém
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
|
muskuloskeletálna bolesť
|
bolesť chrbta, bolesť končatín
|
Poruchy obličiek a močových ciest
|
|
dyzúria, inkontinencia, porucha
močového traktu
|
Poruchy reprodukčného systému a
prsníkov
|
|
výtok z pošvy
|
Celkové poruchy a reakcie v mieste
podania
|
ochorenie podobné chrípke, reakcia
v mieste podania injekcie, iritabilita, únava
|
horúčka, hematóm v mieste podania
injekcie do žily, , bolesť
|
Laboratórne a funkčné vyšetrenia
|
|
abnormálny psychiatrický nález
|
Chirurgické a liečebné postupy
|
|
extrakcia zuba, cholecystektómia
|
Sociálne podmienky
|
|
problém s učením
|
U pediatrických pacientov sa pozorovala inhibícia rastu (pozri časť 4.4). V porovnaní
s východiskovým stavom sa u pediatrických pacientov po 48 týždňoch terapie kombinovanou liečbou
Pegasysom plus ribavirínom pediatrických pacientov preukázalo oneskorenie v náraste hmotnosti
a výšky. Počas liečby klesli percentily „hmotnosti vzhľadom na vek“ a percentily„výšky vzhľadom na vek“ v porovnaní s normálnou populáciou. Na konci 2-ročného sledovania po liečbe sa väčšina jedincov vrátila k východiskovým percentilom normálnej rastovej krivky pre hmotnosť a výšku (priemerný percentil hmotnosti bol 64 % na začiatku a 60 % 2 roky po liečbe; priemerný percentil výšky bol 54 % na začiatku a 56 % 2 roky po liečbe). Na konci liečby sa u 43 % jedincov znížil percentil hmotnosti o 15 percentilov alebo viac a u 25 % sa znížil percentil výšky o 15 percentilov alebo viac v porovnaní s normálnou rastovou krivkou. 2 roky po liečbe bolo 16 % osôb stále 15 percentilov alebo viac pod svojou východiskovou krivkou hmotnosti a 11 % 15 percentilov alebo viac pod svojou východiskovou krivkou výšky.
Laboratórne hodnotyZníženie hemoglobínu, počtu neutrofilov a trombocytov môže vyžadovať zníženie dávky alebo trvalé vysadenie liečby (pozri tabuľku 3 a tabuľku 7). Väčšina patologických zmien v laboratórnych
parametroch zaznamenaných počas klinického skúšania sa v krátkom čase po ukončení liečby vrátila
na východiskovú úroveň.
4.9 PredávkovanieOpísali sa prípady predávkovania v rozsahu od dvoch injekcií podaných počas 2 nasledujúcich dní
(namiesto týždenného intervalu) až po každodenné podávanie injekcií počas 1 týždňa (t.j.
1 260 mikrogramov/týždeň). U žiadneho z týchto pacientov sa neobjavili nezvyčajné resp. závažné alebo liečbu limitujúce udalosti. V klinických štúdiách pri karcinóme obličiek a chronickej myeloidnej leukémii sa podávali týždenné dávky až do 540 mikrogramov a 630 mikrogramov. Medzi toxické
prejavy limitujúce dávkovanie patrila únava, elevácia pečeňových enzýmov, neutropénia, trombocytopénia, čo zodpovedá interferónovej liečbe.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Imunostimulanciá, interferóny, ATC kód: L03A B11
Spôsob účinku
Konjugácia reagentu PEG (bis-monometoxypolyetylénglykol) s interferónom alfa-2a vedie k vzniku
pegylovaného interferónu alfa-2a (Pegasys). Pegasys in vitro vykazuje antivírusové a antiproliferatívne účinky, ktoré sú charakteristické pre interferón alfa-2a.
Interferón alfa-2a je konjugovaný s bis-[monometoxypolyetylénglykolom] v rozsahu substitúcie jedného mólu polyméru/mól bielkoviny. Priemerná molekulová hmotnosť je asi 60 000, z ktorej podiel bielkoviny tvorí približne 20 000.
Farmakodynamické účinky
U pacientov s hepatitídou C reagujúcich na liečbu Pegasysom 180 mikrogramov dochádza
k bifázickému poklesu hladín HCV RNA. Prvá fáza poklesu sa objavuje 24 až 36 hodín po prvej dávke Pegasysu. Po nej dochádza k druhej fáze poklesu, ktorá pretrváva počas nasledovných 4 - 16 týždňov u pacientov, ktorí dosiahnu pretrvávajúcu odpoveď na liečbu. Ribavirín nemá žiadny významný vplyv na začiatočnú vírusovú kinetiku počas prvých 4 až 6 týždňov u pacientov liečených kombináciou ribavirínu a pegylovaného interferónu alfa-2a alebo interferónu alfa.
Klinická účinnosť a bezpečnosť
Chronická hepatitída B
Na všetkých klinických skúšaniach sa zúčastnili pacienti s chronickou hepatitídou B, u ktorých sa zistila aktívna vírusová replikácia meraná ako HBV DNA, zvýšené hladiny ALT a biopsia pečene bola konzistentná s chronickou hepatitídou. V štúdii WV16240 sa zúčastnili pacienti, ktorí boli pozitívni na HBeAg, zatiaľ čo v štúdii WV16241 sa zúčastnili pacienti, ktorí boli negatívni na HBeAg a pozitívni na anti-HBe. V obidvoch štúdiách liečba trvala 48 týždňov a sledovanie po liečbe trvalo 24 týždňov. V obidvoch štúdiách sa porovnával Pegasys plus placebo vs. Pegasys plus lamivudín vs. lamivudín v monoterapii. Do týchto klinických skúšaní neboli zaradení pacienti s HBV-HIV koinfekciou.
Miery odpovedí na konci sledovania u týchto dvoch štúdií sú uvedené v tabuľke 11. V štúdii WV16240, primárne koncové ukazovatele na hodnotenie účinnosti boli HBeAg sérokonverzia a HBV- DNA pod 105 kópií/ml. V štúdii WV16241, primárne koncové ukazovatele na hodnotenie účinnosti boli normalizácia ALT a HBV-DNA pod 2 x 104 kópií/ml. HBV DNA sa merala pomocou testu COBAS AMPLICORTM HBV MONITOR (hranica detekcie 200 kópií/ml).
Celkove 283/1351 (21 %) pacientov malo pokročilú fibrózu alebo cirhózu, 85/1351 (6 %) malo cirhózu. Neboli rozdiely v miere odpovede medzi týmito pacientmi a tými bez pokročilej fibrózy alebo cirhózy.
Tabuľka 11: Sérologická, virologická a biochemická odpoveď pri chronickej hepatitíde B
|
HBeAg-pozitívni pacienti
Štúdia WV16240
|
HBeAg-negatívni / anti-HBe-pozitívni pacienti
Štúdia WV16241
|
Parameter odpovede
|
Pegasys
180 µg
&
placebo
(N = 271)
|
Pegasys
180 µg
&
lamivudín
100 mg
(N = 271)
|
lamivudín
100 mg
(N = 272)
|
Pegasys
180 µg
&
placebo
(N = 177)
|
Pegasys
180 µg
&
lamivudín
100 mg
(N = 179)
|
lamivudín
100 mg
(N = 181)
|
HBeAg
sérokonverzia
|
32 %#
|
27 %
|
19 %
|
N/A
|
N/A
|
N/A
|
HBV DNA
odpoveď*
|
32 %#
|
34 %
|
22 %
|
43 %#
|
44 %
|
29 %
|
ALT
normalizácia
|
41 %#
|
39 %
|
28 %
|
59 %#
|
60 %
|
44 %
|
HBsAg
sérokonverzia
|
3 %#
|
3 %
|
0 %
|
3 %
|
2 %
|
0 %
|
|
|
* Pre HBeAg-pozitívnych pacientov: HBV DNA < 105 kópií/ml
Pre HBeAg-negatívnych / anti-HBe-pozitívnych pacientov: HBV DNA < 2 x 104 kópií/ml
# p-hodnota (vs. lamivudín) ≤ 0,01 (stratifikovaný Cochran-Mantel-Haenszelov test)
Histologická odpoveď bola v každej štúdii vo všetkých troch liečebných skupinách podobná; avšak pacienti, u ktorých sa dokázala trvalá odpoveď 24 týždňov po ukončení liečby, s oveľa vyššou pravdepodobnosťou dosiahli tiež histologické zlepšenie.
Všetci pacienti, ktorí ukončili štúdie fázy III, boli vhodní na zaradenie do štúdie s dlhodobým sledovaním (WV16866). V skupine pacientov v štúdii WV16240, ktorí dostávali Pegasys
v monoterapii a boli zaradení do štúdie s dlhodobým sledovaním, stupeň trvalej HBeAg sérokonverzie
12 mesiacov po ukončení terapie bol 48 % (73/153). U pacientov, ktorí dostávali Pegasys
v monoterapii v štúdii WV16241, stupeň HBV DNA odpovede a normalizácie ALT 12 mesiacov po ukončení liečby bol 42 % (41/97) a 59 % (58/99).
Chronická hepatitída CPredpoklad odpovede na liečbuPozrite si časť 4.2 v tabuľke 2.
Závislosť odpovede na liečbu od dávky pri monoterapiiPri priamom porovnaní dávok 90 mikrogramov a 180 mikrogramov bola dávka 180 mikrogramov spojená s lepšou pretrvávajúcou virologickou odpoveďou na liečbu u pacientov s cirhózou, avšak
v štúdii s pacientmi bez cirhózy sa pri dávkach 135 mikrogramov a 180 mikrogramov dosiahli veľmi podobné výsledky.
Potvrdzujúce klinické štúdie u dospelých predtým neliečených pacientovVšetky klinické štúdie zahŕňali pacientov, ktorí predtým nedostávali interferón a u ktorých sa chronická hepatitída C potvrdila prítomnosťou detekovateľných hladín HCV RNA v sére, zvýšenými hladinami ALT (s výnimkou štúdie NR16071) a biopsiou pečene s nálezom chronickej hepatitídy. Štúdia NV15495 špecificky zahŕňala pacientov s diagnózou cirhózy (približne 80 %) alebo prechodu do cirhózy (približne 20 %), ktoré sa potvrdili histologicky. Do štúdie NR15961 sa zahrnuli len HIV- HCV koinfikovaní pacienti (pozri tabuľku 20). Títo pacienti mali stabilné HIV ochorenie a priemer počtu CD4 T-buniek bol okolo 500 buniek/μl.
Údaje o liečebných režimoch, dĺžke trvania liečby a výsledkoch štúdií u HCV monoinfikovaných pacientov a HIV-HCV koinfikovaných pacientov sa uvádzajú v tabuľkách 12, 13, 14 a v tabuľke 20. Virologická odpoveď na liečbu sa definovala ako nemerateľné hladiny HCV RNA pri vyšetrení COBAS AMPLICOR™ HCV Test, Version 2.0 (detekčný limit: 100 kópií/ml, čo zodpovedá
50 medzinárodným jednotkám/ml). Trvalá odpoveď sa definovala ako jedna negatívna vzorka približne 6 mesiacov po ukončení liečby.
Tabuľka 12: Virologická odpoveď u HCV pacientov
| Monoterapia Pegasysom
| Kombinovaná liečba Pegasysom
|
pacienti s cirhózou aj bez nej
| Pacienti s cirhózou
| pacienti s cirhózou aj bez nej
|
Štúdia NV15496 + NV15497 + NV15801
| Štúdia NV15495
| Štúdia
NV15942
| Štúdia NV15801
|
Pegasys
180 µg
(N = 701)
48 týždňov
| interferón alfa-2a
6 MIU/3 MIU
&
3 MIU
(N = 478)
48 týždňov
| Pegasys
180 µg
(N = 87)
48 týždňov
| interferón alfa-2a
3 MIU
(N = 88)
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200
mg
(N = 436)
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
(N = 453)
48 týždňov
| interferón alfa-2b
3 MIU
&
ribavirín
1000/1200
mg
(N = 444)
48 týždňov
|
Odpoveď
na konci liečby
|
55 - 69 %
|
22 - 28 %
|
44 %
|
14 %
|
68 %
|
69 %
|
52 %
|
Celková
trvalá odpoveď
|
28 - 39 %
|
11 - 19 %
|
30 %∗
|
8 %∗
|
63 %
|
54 %∗∗
|
45 %∗∗
|
∗ 95 % CI pre rozdiel: 11 % až 33 % p = 0,001 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
∗∗ 95 % CI pre rozdiel: 3 % až 16 % p = 0,003 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
Virologické odpovede na liečbu vo vzťahu ku genotypu a vírusovej záťaži pred liečbou u HCV monoinfikovaných pacientov liečených Pegasysom v kombinácii s ribavirínom a v závislosti na genotype, vírusovej záťaži pred liečbou a rýchlej virologickej odpovede v 4. týždni sú zhrnuté
v tabuľke 13 a v tabuľke 14. Výsledky štúdie NV15942 poskytujú racionálne podklady pre odporúčania liečebných režimov na základe genotypu, vírusovej záťaže na začiatku liečby a virologickej odpovede v 4. týždni (pozri tabuľky 1, 13 a 14).
Rozdiel medzi liečebnými režimami nebol vo všeobecnosti ovplyvnený prítomnosťou/neprítomnosťou cirhózy; preto tieto základné charakteristiky neovplyvňujú tieto odporúčania pre liečbu pre
genotypy 1, 2 alebo 3.
Tabuľka 13: Trvalá virologická odpoveď u HCV pacientov po kombinovanej liečbe Pegasysom a ribavirínom v závislosti na genotype a vírusovej záťaži pred liečbou
|
Štúdia NV15942
|
Štúdia NV15801
|
Pegasys
180 µg
&
ribavirín
800 mg
24 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
|
Pegasys
180 µg
&
ribavirín
800 mg
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Interferón alfa-
2b
3 MIU
&
ribavirín
1000/1200 mg
48 týždňov
|
Genotyp 1
Nízka
vírusová záťaž
Vysoká vírusová záťaž
|
29 %(29/101)
41 %(21/51)
16 %(8/50)
|
42 %(49/118) ∗
52 %(37/71)
26 %(12/47)
|
41 %(102/250) ∗
55 %(33/60)
36 %(69/190)
|
52 %(142/271) ∗
65 %(55/85)
47 %(87/186)
|
45 %(134/298)
53 %(61/115)
40 %(73/182)
|
36 %(103/285)
44 %(41/94)
33 %(62/189)
|
Genotyp 2/3
Nízka
vírusová záťaž
Vysoká vírusová záťaž
|
84 %(81/96)
85 %(29/34)
84 %(52/62)
|
81 %(117/144)
83 %(39/47)
80 %(78/97)
|
79 %(78/99)
88 %(29/33)
74 %(49/66)
|
80 %(123/153)
77 %(37/48)
82 %(86/105)
|
71 %(100/140)
76 %(28/37)
70 %(72/103)
|
61 %(88/145)
65 %(34/52)
58 %(54/93)
|
Genotyp 4
|
(0/5)
|
(8/12)
|
(5/8)
|
(9/11)
|
(10/13)
|
(5/11)
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; Vysoká vírusová záťaž = > 800 000 IU/ml
* Pegasys 180 µg & ribavirín 1000/1200 mg, 48 týždňov v porovnaní s Pegasysom 180 µg & ribavirínom 800 mg
48 týždňov: Odds Ratio (95 % CI) = 1,52 (1,07 až 2,17), p=0,020 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
* Pegasys 180 µg & ribavirín 1000/1200 mg, 48 týždňov v porovnaní s Pegasysom 180 µg & ribavirínom 1000/1200 mg,
24 týždňov: Odds Ratio (95 % CI) = 2,12 (1,30 až 3,46), p=0,002 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
Možnosť zvážiť skrátenie dĺžky trvania liečby na 24 týždňov u pacientov s genotypom 1 a 4 sa sledovala na podklade dosiahnutej trvalej virologickej odpovede u pacientov s rýchlou virologickou odpoveďou v 4. týždni v štúdiách NV15942 a ML17131 (pozri tabuľku 14).
Štúdia NV15942
| Štúdia ML17131
|
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Genotyp 1
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 90 % (28/31)
93 % (25/27)
75 % (3/4)
| 92 % (47/51)
96 % (26/27)
88 % (21/24)
| 77 % (59/77)
80 % (52/65)
58 % (7/12)
| Genotyp 1 nie RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 24 % (21/87)
27 % (12/44)
21 % (9/43)
| 43 % (95/220)
50 % (31/62)
41 % (64/158)
| -
-
-
| Genotyp 4 RVR
| (5/6)
| (5/5)
| 92 % (22/24)
| Genotyp 4 nie RVR
| (3/6)
| (4/6)
| -
|
|
|
Tabuľka 14:Trvalá virologická odpoveď v závislosti na rýchlej virologickej odpovedi v 4. týždni pre genotyp 1 a 4 po kombinovanej liečbe Pegasysom a ribavirínom u HCV pacientovNízka vírusová záťaž = ≤ 800 000 IU/ml; Vysoká vírusová záťaž = > 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedegovateľná HCV RNA) v 4. týždni a nedegovateľná HCV RNA v 24 týždni.
Údaje, i keď obmedzené, ukazujú, že skrátenie času na 24 týždňov, sa môže spájať s vysokým rizikom relapsu (pozri tabuľku 15).
Tabuľka 15: Relaps vo virologickej odpovedi na konci liečby u populácie s rýchlou virologickou odpoveďou
| Štúdia NV15942
| Štúdia NV15801
|
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Genotyp 1 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 6,7 % (2/30)
3,8 % (1/26)
25 % (1/4)
| 4,3 % (2/47)
0 % (0/25)
9,1 % (2/22)
| 0 % (0/24)
0 % (0/17)
0 % (0/7)
|
Genotyp 4 RVR
| (0/5)
| (0/5)
| 0 % (0/4)
|
Možnosť skrátenia liečby na 16 týždňov u pacientov genotypu 2 alebo 3 bola skúmaná na základe
trvalej virologickej odpovede pozorovanej u pacientov s rýchlou virologickou odpoveďou v 4. týždni v štúdii NV17317 (pozri tabuľku 16).
V štúdii NV17317 všetci pacienti infikovaní vírusovým genotypom 2 alebo 3 dostávali Pegasys 180ug subkutánne raz týždenne a ribavirín v dávke 800 mg a boli randomizovaní na liečbu počas 16 alebo 24 týždňov. Celková liečba počas 16 týždňov viedla ku nižšej trvalej virologickej odpovedi (65 %) než liečba počas 24 týždňov (76 %) (p<0,0001).
Trvalá virologická odpoveď dosiahnutá po 16. týždňoch liečby a po 24. týždňoch liečby sa sledovala retrospektívnou analýzou pacientov, ktorí boli HCV RNA negatívni v 4. týždni a mali iniciálne LVL (pozri tabuľku 16).
Tabuľka 16:Trvalá virologická odpoveď celkovo a na základe rýchlej virologickej odpovede v 4. týždni pre genotyp 2 alebo 3 po kombinovanej liečbe liekom Pegasysoms ribavirínom u HCV pacientovŠtúdia NV17317
|
a
| Pegasys 180 µg
&
ribavirín
800 mg
16 týždňov
| Pegasys 180 µg
&
ribavirín
800 mg
24 týždňov
| Rozdiel v liečbe
[95 % CI]
| p-hodnota
|
Genotyp 2 alebo 3
| 65 % (443/679)
| 76 % (478/630)
| -10,6 % [-15,5 %; -0,06 %]
| p<0,0001
|
Genotyp 2 alebo 3 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 82 % (378/461)
89 % (147/166)
78 % (231/295)
| 90 % (370/410)
94 % (141/150)
88 % (229/260)
| -8,2 % [-12,8 %; -3,7 %]
-5,4 % [-12 %; 0,9 %]
-9,7 % [-15,9 %;-3,6 %]
| p=0,0006
p=0,11
p=0,002
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž => 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedetegovateľné hladiny HCV RNA) v 4. týždni
V súčasnosti nie je jasné, či vyššia dávka ribavirínu (napr. 1 000/2 000 mg/deň podľa telesnej hmotnosti) vedie k vyššej trvalej virologickej odpovedi (SVR) než dávka 800 mg/deň, keď je liečba skrátená na 16 týždňov.
Údaje naznačujú, že skrátenie liečby na 16 týždňov sa môže spájať so zvýšeným rizikom relapsu
(pozri tabuľku 17).
Tabuľka 17: Relaps vo virologickej odpovedi po ukončení liečby u pacientov genotypu 2 alebo 3s rýchlou virologickou odpoveďou
|
Štúdia NV17317
|
|
Pegasys
180 µg
&
ribavirín
800 mg
16 týždňov
|
Pegasys
180 µg
&
ribavirín
800 mg
24 týždňov
|
Rozdiel v liečbe
[95 % CI]
|
p hodnota
|
Genotyp 2 alebo 3 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
15 % (67/439)
6 % (10/155)
20 % (57/284)
|
6 % (23/386)
1 % (2/141)
9 % (21/245)
|
9,3 % [5,2 %; 13,6 %]
5 % [0,6 % ; 10,3 %]
11,5 % [5,6 % ; 17,4 %]
|
p<0,0001
p=0,04
p=0,0002
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž = > 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedetegovateľné hladiny HCV RNA) v 4. týždni
Lepšia účinnosť Pegasysu v porovnaní s interferónom alfa-2a sa ukázala aj na histologickej odpovedi, vrátane pacientov s cirhózou a/alebo HIV-HCV koinfekciou.
Dospelí pacienti s chronickou hepatitídou C, ktorí neodpovedali na predchádzajúcu liečbu V štúdii MV17150 boli pacienti, ktorí neodpovedali na predchádzajú liečbu pegylovaným interferónom alfa-2b a ribavirínom, boli randomizovaní do štyroch rôznych liečebných skupín:
• Pegasys 360 µg/týždeň počas 12 týždňov a následne 180 µg/týždeň počas ďalších 60 týždňov;
• Pegasys 360 µg/týždeň počas 12 týždňov a následne 180 µg/týždeň počas ďalších 36 týždňov;
• Pegasys 180 µg/týždeň počas 72 týždňov;
• Pegasys 180 µg/týždeň počas 48 týždňov.
Všetci pacienti užívali ribavirín (1 000 alebo 1 200 mg/deň) v kombinácii s Pegasysom. Všetky
liečebné skupiny boli následne sledované počas 24-týždňového obdobia bez liečby.
Na základe viacnásobnej regresnej analýzy a súhrnnej skupinovej analýzy hodnotiacej vplyv dĺžky trvania liečby a podávania indukčnej dávky sa jednoznačne stanovilo, že liečba v trvaní 72 týždňov je primárnym faktorom dosiahnutia trvalej virologickej odpovede. Rozdiely v trvalej virologickej odpovedi (SVR) podmienené dĺžkou trvania liečby, demografickými ukazovateľmi a najlepšími odpoveďami na predchádzajúcu liečbu sú uvedené v tabuľke 18.
Tabuľka 18: Virologická odpoveď v 12. týždni (VR) a trvalá virologická odpoveď (SVR) u pacientov, ktorí neodpovedali na liečbu kombináciou peginterferónu alfa-2b a ribavirínu a ktorí dosiahli virologickú odpoveď v 12. týždni po liečbe kombináciou Pegasysu a ribavirínu
| Štúdia MV17150
|
|
|
| Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
72 alebo 48 týždňov (N = 942) pacienti s
VR v týždni 12 a
(N = 876)
| Pegasys 360/180
alebo 180 μg
&
ribavirín
1000/1200 mg
72 týždňov
(N = 473)
SVR u pacientov s VR v týždni 12 b (N = 100)
| Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
48 týždňov
(N = 469)
SVR u pacientov s VR v týždni 12 b (N = 57)
|
Celková trvalá odpoveď
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 18 % (157/876)
35 % (56/159)
14 % (97/686)
| 57 % (57/100)
63 % (22/35)
54 % (34/63)
| 35 % (20/57)
38 % (8/21)
32 % (11/34)
|
Genotyp 1/4
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 17 % (140/846)
35 % (54/154)
13 % (84/663)
| 55 % (52/94)
63 % (22/35)
52 % (30/58)
| 35 % (16/46)
37 % (7/19)
35 % (9/26)
|
Genotyp 2/3
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 58 % (15/26)
(2/5) (11/19)
| (4/5)
—
(3/4)
| (3/10)
(1/2) (1/7)
|
Prítomnosť cirhózy
Cirhóza
Neprítomnosť cirhózy
|
8 % (19/239)
22 % (137/633)
|
(6/13)
59 % (51/87)
|
(3/6)
34 % (17/50)
|
|
Štúdia MV17150
|
|
|
|
Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
72 alebo 48 týždňov (N = 942) pacienti s
VR v týždni 12 a
(N = 876)
|
Pegasys 360/180
alebo 180 μg
&
ribavirín
1000/1200 mg
72 týždňov
(N = 473)
SVR u pacientov s VR v týždni 12 b (N = 100)
|
Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
48 týždňov
(N = 469)
SVR u pacientov s VR v týždni 12 b (N = 57)
|
Najlepšia odpoveď počas predchádzajúcej liečby
Pokles u HCV RNA ≥2log10
Pokles u HCV RNA <2log10
Chýbanie najlepšej odpovede
|
28 % (34/121)
12 % (39/323)
19 % (84/432)
|
68 % (15/22)
64 % (16/25)
49 % (26/53)
|
(6/12) (5/14)
29 % (9/31)
|
Vysoká vírusová záťaž = > 800 000 IU/ml, nízka vírusová záťaž = ≤ 800 000 IU/ml;
a Pacienti, ktorí dosiahli potlačenie aktivity vírusu v 12. týždni (nedetegovateľná HCV RNA definovaná ako < 50 IU/ml) boli považovaní za pacientov s dosiahnutou virologickou odpoveďou v 12. týždni. Pacienti, ktorým chýbali výsledky HCV RNA
v
12. týždni boli vylúčení z analýzy.
b Pacienti, ktorí dosiahli potlačenie aktivity vírusu v 12. týždni, ale chýbali im výsledky HCV RNA na konci sledovania boli považovaní za pacientov, neodpovedajúcich na liečbu.
V štúdii HALT-C boli pacienti s chronickou hepatitídou C a pokročilou fibrózou alebo cirhózou, ktorí neodpovedali na predchádzajúcu liečbu interferónom alfa alebo pegylovaným interferónom alfa
v monoterapii alebo v kombinácii s ribavirínom, liečení Pegasysom 180 µg/týždeň a ribavirínom
1 000/1 200 mg denne. Pacienti, ktorí po 20 týždňoch liečby dosiahli nedetegovateľné hladiny
HCV RNA, pokračovali v kombinovanej liečbe Pegasysom a ribavirínom trvajúcej celkovo
48 týždňov a po ukončení liečby boli sledovaní 24 týždňov. Pravdepodobnosť trvalej virologickej odpovede sa líšila v závislosti od predchádzajúceho režimu liečby; pozri tabuľku 19.
Tabuľka 19:Trvalá virologická odpoveď v štúdii HALT-C uvedená podľa predchádzajúceho režimu liečby u pacientov, ktorí naňneodpovedali Predchádzajúca liečba Pegasys 180 µg a
 ribavirín
ribavirín 1 000/1 200 mg počas 48 týždňov
Interferón 27 % (70/255)
Pegylovaný interferón 34 % (13/38)
Interferón a ribavirín 13 % (90/692)
Pegylovaný interferón a ribavirín 11 % (7/61) HIV-HCV koinfikovaní pacientiVirologické odpovede u pacientov, ktorí sú liečení s Pegasysom v monoterapii a s Pegasysom a ribavirínom v kombinácii v závislosti na genotype a vírusovej záťaži pred liečbou pre HIV-HCV koinfikovaných pacientov sú zhrnuté nižšie v tabuľke 20.
Tabuľka 20:Trvalá virologická odpoveď po liečbe Pegasysom v kombinácii s ribavirínom v závislosti na genotype a vírusovej záťaži u HIV-HCV súčasne infikovaných pacientov pred liečbouŠtúdia NR15961
|
| Interferón alfa-2a
3 MIU
&
ribavirín 800 mg
48 týždňov
| Pegasys
180 µg
&
placebo
48 týždňov
| Pegasys
180 µg
&
ribavirín 800 mg
48 týždňov
|
Všetci pacienti
| 12 % (33/285)*
| 20 % (58/286) *
| 40 % (116/289) *
|
Genotyp 1
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
7 % (12/171)
19 % (8/42)
3% (4/129)
|
14 % (24/175)
38 % (17/45)
5 % (7/130)
|
29 % (51/176)
61 % (28/46)
18 % (23/130)
|
Genotyp 2-3
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
20 % (18/89)
27 % (8/30)
17 % (10/59)
|
36 % (32/90)
38 % (9/24)
35 % (23/66)
|
62% (59/95)
61 % (17/28)
63 % (42/67)
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž = > 800 000 IU/ml
* Pegasys 180 µg & ribavirín 800 mg oproti Interferón alfa-2a 3 MIU, ribavirín 800 mg: Pomer pravdepodobnosti (95 % CI)=5,40 (3,42 – 8,54),… p-hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0001
* Pegasys 180 µg & ribavirín 800 mg oproti Pegasys 180 µg: Pomer pravdepodobnosti (95 % CI)=2,89 (1,93 – 4,32),… p- hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0001
* Interferón alfa-2a 3 MIU & ribavirín 800 mg oproti Pegasys 180 µg: Pomer pravdepodobnosti (95 % CI)=0,53 (0,33 –
0,85),… p-hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0084
Nasledujúca štúdia (NV18209) u pacientov s koinfekciou HCV genotyp 1 a HIV porovnávala liečbu Pegasysom 180 µg týždenne s dávkou ribavirínu 800 mg alebo s dávkou ribavirínu 1 000 mg (<75 kg telesnej hmotnosti)/1 200 mg (≥75 kg telesnej hmotnosti) denne počas 48 týždňov. Štúdia nebola dizajnovaná na preukázanie účinnosti. Bezpečnostné profily u obidvoch skupín s ribavirínom boli konzistentné so známym bezpečnostným profilom pri kombinovanej liečbe Pegasysom a ribavirínom
a nepoukazujú na žiadne relevantné rozdiely, okrem mierneho nárastu anémie v skupine s vyššou dávkou ribavínu.
HCV pacienti s normálnymi hladinami ALTV štúdii NR16071 náhodne vybratí HCV pacienti s normálnymi hodnotami ALT užívali Pegasys
180 µg/týždeň a ribavirín 800 mg/deň počas 24 alebo 48 týždňov. Potom nasledoval 24 týždňové obdobie bez liečby alebo pacienti boli bez liečby po dobu 72 týždňov. SVR popisované v liečebných ramenách tejto štúdie boli podobné zodpovedajúcim liečebným ramenám zo štúdie NV15942.
Pediatrická populáciaV riešiteľom sponzorovanej klinickej štúdii CHIPS (Chronic Hepatitis C International Paediatric Study) 65 pediatrických pacientov (6-18 rokov) s chronickou HCV infekciou boli pacienti liečení Pegasysom 100 μg/m2 s.c. raz týždenne a ribavirínom 15 mg/kg/deň 24 týždňov (genotypy 2 a 3) alebo 48 týždňov (všetky iné genotypy). Predbežné a obmedzené údaje bezpečnosti neukázali žiadny evidentný odklon od známeho profilu bezpečnosti pri kombinovanej liečbe u dospelých pacientov s chronickou HCV infekciou, ale, dôležité je, že nebol hlásený potenciálny nárast. Výsledky účinnosti boli podobné výsledkom hlásených u dospelých.
V štúdii NV17424 (PEDS-C) boli predtým neliečení pediatrickí pacienti vo veku 5 až 17 rokov (55 % vo veku < 12 rokov) s kompenzovanou chronickou hepatitídou C a detekovateľnou HCV RNA liečení Pegasysom v dávke180 μg x BSA/1,73 m2 jedenkrát týždenne počas 48 týždňov s alebo bez ribavirínu v dávke 15 mg/kg/deň . Všetci pacienti boli po liečbe sledovaní počas 24 týždňov. Celkovo 55 pacientov bolo liečených úvodnou kombinovanou liečbou Pegasysom plus ribaviríno, z nich 51 %
bolo žien, 82 % belochov a 82 % bolo infikovaných vírusom HCV genotyp 1. Výsledky štúdie účinnosti u týchto pacientov sú zhrnuté v tabuľke 21.
Tabuľka 21: Pretrvávajúca virologická odpoveď v štúdii NV17424
| Pegasys
180 µg x BSA/1,73 m² +
ribavirín 15 mg/kg (N = 55)*
|
Všetky genotypy HCV**
| 29 (53 %)
|
HCV genotyp 1
| 21/45 (47 %)
|
HCV genotyp 2 a 3***
| 8/10 (80 %)
|
*Výsledky naznačujú nedetegovateľnú HCV-RNA definovanú ako HCV RNA menej ako 50 IU/ml 24 týždňov po liečbe použitím AMPLICOR HCV testu v2.
**Plánované trvanie liečby bolo 48 týždňov bez ohľadu na genotyp
5.2 Farmakokinetické vlastnosti
Absorpcia
Po jednorazovej subkutánnej injekcii Pegasysu 180 mikrogramov zdravým jedincom sa merateľné sérové koncentrácie peginterferónu alfa-2a zistili v priebehu 3 až 6 hodín. Počas 24 hodín dosiahli namerané hladiny 80 % maximálnej koncentrácie v sére. Absorpcia Pegasysu je plynulá, pričom maximálne hladiny v sére sa dosiahnu 72 až 96 hodín po podaní. Absolútna biologická dostupnosť Pegasysu je 84 % a je podobná ako pri interferóne alfa-2a.
Distribúcia
Peginterferón alfa-2a sa nachádza najmä v krvnom obehu a extracelulárnej tekutine, čoho dôkazom je hodnota distribučného objemu v rovnovážnom stave (Vd) 6 - 14 litrov u ľudí po intravenóznom podaní. V štúdiách hmotnostnej rovnováhy, distribúcie látky v tkanivách a celotelovej autorádioluminografie vykonaných u potkanov sa zistilo, že okrem vysokej koncentrácie v krvi sa peginterferón alfa-2a dostáva do pečene, obličiek a kostnej drene.
Biotransformácia
Metabolizmus Pegasysu ešte nie je úplne objasnený, avšak štúdie na potkanoch naznačujú, že obličky sú hlavným exkrečným orgánom rádioaktívne označeného materiálu.
Eliminácia
U ľudí je hodnota systémového klírensu peginterferónu alfa-2a približne 100- násobne nižšia ako natívneho interferónu alfa-2a. Po intravenóznom podaní je terminálny polčas peginterferónu alfa-2a u zdravých osôb približne 60 – 80 hodín v porovnaní s 3 – 4 hodinami v prípade štandardného interferónu. Terminálny polčas po subkutánnom podaní pacientom je dlhší so strednou hodnotou 160 hodín (84 – 353 hodín). Terminálny polčas môže odrážať eliminačnú fázu látky, ale taktiež plynulú absorpciu Pegasysu.
Linearita/nelinearita
U zdravých osôb a u pacientov s chronickou hepatitídou B alebo C sa pri dávkovaní raz týždenne pozorovalo od dávky závislé zvyšovanie expozície voči Pegasysu.
U pacientov s chronickou hepatitídou B alebo C dochádza po 6 až 8 týždňoch podávania Pegasysu v dávke raz týždenne k dvoj- až trojnásobnému zvýšeniu sérových hladín peginterferónu alfa-2a
v porovnaní s podávaním jednorazovej dávky. Po 8-týždňovom podávaní Pegasysu raz týždenne nedochádza k ďalšej akumulácii. Po 48 týždňoch liečby je pomer medzi maximálnou a minimálnou hladinou približne 1,5 - 2. Sérové koncentrácie peginterferónu alfa-2a pretrvávajú celý 1 týždeň (168 hodín).
Pacienti s poruchou funkcie obličiek
Dysfunkcia obličiek je spojená s mierne zníženou hodnotou pomeru CL/F a predĺženým polčasom. U pacientov (n=3) CLcrea medzi 20 a 40 ml/min bola priemerná hodnota pomeru CL/F o 25 % nižšia ako u pacientov s normálnou funkciou obličiek. U dialyzovaných pacientov s ochorením obličiek
v terminálnej fáze sa zistilo 25 – 45 % zníženie klírensu, pričom dávky 135 mikrogramov u týchto pacientov vedú k podobnej expozícii ako dávky 180 mikrogramov u pacientov s normálnou funkciou
obličiek (pozri časť 4.2).
Pozrite si tiež Súhrn charakteristických vlastností lieku (SPC) ribavirínu, ak sa Pegasys použije v kombinácii s ribavirínom.
Pohlavie
Farmakokinetika Pegasysu po podaní jednorazovej subkutánnej injekcie bola porovnateľná u zdravých jedincov mužského a ženského pohlavia.
Pediatrická populácia
V populačnej farmakokinetickej štúdii (NR16141) dostávalo 14 detí vo veku 2 až 8 rokov s CHC Pegasys v monoterapii v dávke: 180 µg x BSA/1,73 m2. FK model vytvorený na základe tejto štúdie preukazuje lineárny vplyv BSA na zjavný klírens liečiva v rozmedzí skúmaného veku. Preto nižšie BSA dieťaťa, nižší klírens liečiva a vyššia výsledná expozícia. Predpokladá sa, že priemerná expozícia (AUC) počas dávkovacieho intervalu je o 25 % až 70 % vyššia ako expozícia pozorovaná u dospelých, ktorí dostávajú fixnú dávku 180 µg.
Staršie osoby
U osôb starších ako 62 rokov sa zistila dlhšia absorpcia Pegasysu po jednorazovom podaní subkutánnej injekcie v dávke 180 mikrogramov, hoci stále bola plynulá v porovnaní s mladými zdravými osobami (tmax 115 hodín vs. 82 hodín, osoby staršie ako 62 rokov). Hodnota AUC bola mierne zvýšená (1 663 vs. 1 295 ng.hod/ml), avšak maximálne koncentrácie (9,1 vs. 10,3 ng/ml) boli podobné u osôb starších ako 62 rokov. Na základe expozície voči lieku, farmakodynamickej odpovedi a znášanlivosti je možné prehlásiť, že geriatrickí pacienti si nevyžadujú podávanie nižšej dávky Pegasysu (pozri časť 4.2).
Dysfunkcia pečene
Farmakokinetika Pegasysu u zdravých osôb bola podobná ako u pacientov s hepatitídou B alebo C.
U pacientov s cirhózou (stupeň A podľa Child-Pughovej klasifikácie) a pacientov bez cirhózy sa zistila porovnateľná expozícia a farmakokinetické profily.
Miesto podania
Subkutánne podávanie Pegasysu je nutné obmedziť na oblasť brucha a stehna, pretože stupeň absorpcie hodnotený na základe hodnôt AUC bol o 20 – 30 % vyšší po podaní injekcie do brucha a stehna. V štúdiách po podaní Pegasysu do ramena sa v porovnaní s podaním do brucha alebo stehna zistila znížená expozícia voči Pegasysu.
5.3 Predklinické údaje o bezpečnosti
Neklinické štúdie skúmajúce toxicitu Pegasysu boli limitované v dôsledku druhovej špecifickosti interferónov. Štúdie akútnej a chronickej toxicity sa vykonali u opíc cynomolgus, pričom nálezy pozorované u zvierat dostávajúcich peginterferón boli podobnej povahy ako nálezy vyvolané interferónom alfa-2a.
S Pegasysom sa nevykonali žiadne štúdie reprodukčnej toxicity. Tak ako pri iných interferónoch alfa aj po podávaní peginterferónu alfa-2a samiciam opíc sa pozorovalo predĺženie menštruačného cyklu. Liečba interferónom alfa-2a viedla k štatisticky významnému zvýšeniu abortívneho účinku u opíc resus. Hoci sa u potomstva narodeného v termíne nezistili žiadne teratogénne účinky, nežiaduce účinky nie je možné vylúčiť u ľudí.
Pegasys plus ribavirín
Ak sa používa v kombinácii s ribavirínom, Pegasys nevyvoláva žiadne účinky u opíc, ktoré by predtým neboli pozorované pri podávaní jednotlivých liečiv v rámci monoterapie. Hlavnou zmenou v súvislosti s liečbou bola reverzibilná mierna až stredne ťažká anémia, závažnosť ktorej bola vyššia ako po podávaní jednotlivých liečiv v rámci monoterapie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
chlorid sodný polysorbát 80 benzylalkoholnátriumacetát kyselina octová
voda na injekcie
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti3 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v chladničke pri teplote 2°C – 8°C. Neuchovávajte v mrazničke. Liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia1 ml injekčného roztoku v injekčnej liekovke (sklo typ I) so zátkou (butylová guma). Dostupné v baleniach 1 alebo 4 injekčné liekovky. Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciuInjekčný roztok je určený len na jednorazové použitie. Pred podaním sa má zrakom skontrolovať, či roztok neobsahuje tuhé čiastočky alebo či sa nezmenila jeho farba.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIRoche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/02/221/003
EU/1/02/221/004
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 20. jún 2002
Dátum posledného predĺženia: 20. jún 2007
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Pegasys 90 mikrogramov injekčný roztok v naplnenej injekčnej striekačke
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá naplnená injekčná striekačka s 0,5 ml roztoku obsahuje 90 mikrogramov peginterferónu alfa-
2a*. Sila vyjadruje množstvo podielu interferónu alfa-2a v peginterferóne alfa-2a bez ohľadu na pegyláciu.
*Liečivo peginterferón alfa-2a je kovalentný konjugát bielkoviny interferónu alfa-2a vyrobený rekombinantnou DNA technológiou v Escherichia coli s bis -[monometoxypolyetylénglykolom].
Účinnosť tohto lieku sa nemá porovnávať s inými pegylovanými alebo nepegylovanými bielkovinami v tej istej terapeutickej skupine. Viac informácií, pozri časť 5.1.
Pomocná látka so známym účinkom: Benzylalkohol (10 mg/1 ml) Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok (injekcia) .
Roztok je číry, bezfarebný až svetložltý..
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Chronická hepatitída B
Pegasys je indikovaný na liečbu chronickej hepatitídy B (CHB) s pozitívnym obalovým antigénom
hepatitídy B (HBeAg) alebo HBeAg negatívnej chronickej hepatitídy B u dospelých pacientov
s kompenzovaným ochorením pečene a s dôkazom vírusovej replikácie, zvýšenou hladinou ALT a histologicky overeným zápalom pečene a/alebo fibrózy (pozri časti 4.4 a 5.1).
Chronická hepatitída C
Dospelí pacienti
Pegasys je indikovaný na liečbu chronickej hepatitídy C (CHC) u dospelých s pozitívnym nálezom ribonukleovej kyseliny vírusu hepatitídy C (HCV-RNA) v sére. Toto zahŕňa pacientov
s kompenzovanou formou cirhózy pečene a/alebo súčasne infikovaných HIV vírusom s klinicky stabilným obrazom HIV infekcie (pozri časť 4.4).
Optimálny spôsob použitia Pegasysu u pacientov s chronickou hepatitídou C je kombinácia s ribavirínom. Kombinácia Pegasysu a ribavirínu je indikovaná na liečbu u predtým neliečených pacientov a u dospelých pacientov, u ktorých zlyhala predchádzajúca liečba interferónom alfa (pegylovaným alebo nepegylovaným) v monoterapii alebo v kombinovanej liečbe s ribavirínom.
Monoterapia je indikovaná najmä v prípade neznášanlivosti alebo kontraindikácie liečby ribavirínom.
Pediatrickí pacienti vo veku 5 rokov a viac :
Pegasys v kombinácii s ribavirínom je indikovaný na liečbu chronickej hepatitídy C u predtým neliečených detí a dospievajúcich vo veku 5 a viac rokov, u ktorých je prítomná pozitivita sérovej HCV-RNA.
Pri rozhodovaní, či začať v detstve s liečbou, je dôležité vziať do úvahy inhibíciu rastu indukovanú kombinovanou liečbou. Nie je isté, či je inhibícia rastu reverzibilná. Rozhodnutie o liečbe sa má urobiť individuálne pre každý prípad (pozri časť 4.4).
4.2 Dávkovanie a spôsob podávania
Liečbu Pegasysom má začať iba lekár, ktorý má skúsenosti s liečbou pacientov s hepatitídou B alebo
C.
Ak sa Pegasys bude podávať v kombinácii s ribavirínom, prečítajte si tiež súhrn charakteristických vlastností ribavirínu (SmPC).
Dávkovanie
Chronická hepatitída B – dospelí pacienti
Odporúčané dávkovanie a dĺžka liečby Pegasysom u HBeAg-pozitívnych a HBeAg-negatívnych pacientov s chronickou hepatitídou B je 180 mikrogramov raz týždenne počas 48 týždňov, subkutánne do brucha alebo do stehna.
Chronická hepatitída C - predtým neliečení dospelí pacienti
Odporúčaná dávka Pegasysu je 180 mikrogramov raz týždenne a podáva sa subkutánne do brucha
alebo stehna v kombinácii s perorálnym ribavirínom alebo ako monoterapia.
Dávkovanie ribavirínu pri kombinovanej liečbe s Pegasysom sa uvádza v tabuľke 1. Dávka ribavirínu sa má užívať spolu s jedlom.
Dĺžka liečby
U pacientov s chronickou hepatitídou C závisí dĺžka kombinovanej liečby s ribavirínom od genotypu vírusu. Pacienti infikovaní HCV s genotypom 1, ktorí majú detegovateľnú HCV RNA v 4. týždni sa majú liečiť 48 týždňov bez ohľadu na vírusovú záťaž pred liečbou.
O liečbe v trvaní 24 týždňov sa môže uvažovať u pacientov infikovaných s
- genotypom 1 a nízkou vírusovou záťažou (LVL) na začiatku liečby (≤ 800 000 IU/ml) alebo
- genotypom 4,
ktorí sa stali HCV RNA negatívni v 4. týždni liečby a zostali HCV RNA negatívni v 24. týždni. Avšak celkove môže byť 24 týždňová liečba spojená s vyšším rizikom relapsu, ako liečba trvajúca 48
týždňov (pozri časť 5.1). Pri rozhodovaní o dĺžke liečby sa u týchto pacientov má brať do úvahy tolerancia na kombinovanú liečbu a ďalšie prognostické faktory, ako stupeň fibrózy. Ešte s väčšou opatrnosťou sa má uvažovať o skrátení dĺžky trvania liečby u pacientov infikovaných s vírusom s
genotypom 1 a vysokou vírusovou záťažou (>800 000 IU/ml) na začiatku liečby, ktorí sa stali HCV
RNA negatívni v 4. týždni liečby a zostali negatívni v 24. týždni, pretože obmedzené údaje naznačujú, že môže to signifikantne negatívne ovplyvniť trvalú virologickú odpoveď.
Pacienti infikovaní HCV s genotypom 2 alebo 3, ktorí majú detegovateľnú HCV RNA v 4. týždni, bez ohľadu na vírusovú záťaž pred liečbou majú byť liečení 24 týždňov. 16-týždňová liečba sa môže zvažovať iba u vybraných pacientov, infikovaných genotypom 2 alebo 3 s iniciálnou LVL
(≤ 800 000 IU/ml), ktorí sa stanú HCV negatívni v 4. týždni liečby a zostávajú negatívni v 16. týždni. Všeobecne sa liečba trvajúca 16 týždňov môže spájať s nižšou možnosťou odpovede a je spojená s vyšším rizikom relapsu ako 24-týždňová liečba (pozri časť 5.1). U týchto pacientov sa má pri zvažovaní zmeny štandardnej 24 týždňovej liečby vziať do úvahy tolerancia kombinovanej liečby
trvania liečby u pacientov infikovaných genotypom 2 alebo 3 s iniciálnou HVL (> 800 000 IU/ml), ktorí sa stanú v 4. týždni liečby HCV negatívni sa má zvažovať pozornejšie, nakoľko toto môže významne negatívne ovplyvniť trvalú virologickú odpoveď (pozri tabuľku 1).
Dostupné údaje o infikovaných pacientoch s genotypom 5alebo 6 sú obmedzené; preto sa odporúča 48
týždňová kombinovaná liečba s 1 000 mg alebo 1 200 mg ribavirínu.
Tabuľka 1: Odporúčané dávkovanie pre kombinovanú liečbu u HCV pacientovGenotyp
| Dávka Pegasysu
| Dávka ribavirínu
| Trvanie
|
Genotyp 1 LVL s
RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 24 týždňov alebo
48 týždňov
|
Genotyp 1 HVL s
RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 48 týždňov
|
Genotyp 4 s RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 24 týždňov alebo
48 týždňov
|
Genotyp 1 alebo 4 bez
RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 48 týždňov
|
Genotyp 2 alebo 3 bez
RVR**
| 180 mikrogramov
| 800 mg
| 24 týždňov
|
Genotyp 2 alebo 3
LVL s RVR**
| 180 mikrogramov
| 800 mg(a)
| 16 týždňov(a) alebo
24 týždňov
|
Genotyp 2 alebo 3
HVL s RVR**
| 180 mikrogramov
| 800 mg
| 24 týždňov
|
*RVR = rýchla virologická odpoveď (nedegovateľná HCV RNA) v 4. týždni a nedegovateľná HCV RNA v 24. týždni
**RVR = rýchla virologická odpoveď (HCV RNA negativita) v 4. týždni
LVL =
≤ 800 000 IU/ml; HVL= > 800 000 IU/ml
(a) V súčasnosti nie je jasné, či vyššia dávka ribavirínu (napr. 1 000/2 000 mg/deň podľa telesnej hmotnosti) vedie k vyššej trvalej virologickej odpovedi (SVR) než dávka 800 mg/deň, keď je liečba skrátená na 16 týždňov.
Konečný klinický účinok skrátenej 16 týždňovej liečby oproti 24 týždňovej liečbe nie je známy vzhľadom na potrebu opakovanej liečby u pacientov, ktorí neodpovedajú na liečbu a pacientov s relapsom ochorenia.
Odporúčaná dĺžka liečby Pegasysom v monoterapii je 48 týždňov.
Chronická hepatitída C - predtým liečení dospelí pacientiOdporúčaná dávka Pegasysu v kombinácii s ribavirínom je 180 µg raz týždenne podávaná subkutánne. Pacientom s telesnou hmotnosťou < 75 kg sa má podávať 1 000 mg ribavirínu denne a pacientom
s telesnou hmotnosťou ≥ 75 kg sa má podávať 1 200 mg ribavirínu denne bez ohľadu na genotyp.
U pacientov, ktorí majú v 12. týždni detegovateľné hladiny vírusu, sa má liečba ukončiť. Odporúčaná
celková dĺžka liečby je 48 týždňov. Ak sa zvažuje liečba u pacientov infikovaných vírusom genoptypu
1, ktorí neodpovedali na predchádzajúcu liečbu peginterferónom a ribavirínom, odporúčaná celková dĺžka liečby je 72 týždňov (pozri časť 5.1).
Súčasná infekcia vírusom HIV a HCV u dospelých pacientovOdporúčané dávkovanie Pegasysu v monoterapii alebo v kombinácii s ribavirínom je
180 mikrogramov raz za týždeň subkutánne počas 48 týždňov. Pre pacientov infikovných HCV s genotypom 1 a s telesnou hmotnosťou <75 kg je dávka ribavirínu 1 000 mg denne a s telesnou hmotnosťou ≥75 kg je dávka 1 200 mg denne. Pre pacientov infikovaných HCV s iným genotypom ako genotyp 1 je dávka ribavirínu 800 mg denne. Dĺžka liečby kratšia ako 48 týždňov sa dostatočne neskúmala.
Predikcia odpovede alebo chýbanie odpovede u dospelých pacientovPredpoklad odpovede alebo chýbanie odpovede - predtým neliečení pacienti Ukázalo sa, že včasná virologická odpoveď v 12-tom týždni, ktorá je definovaná ako pokles vírusovej záťaže o 2 log alebo nedetekovateľné hladiny HCV RNA, predikuje pretrvávajúcu odpoveď (pozri tabuľky 2 a 11).
Tabuľka 2: Prediktívna hodnota virologickej odpovede v 12. týždni kombinovanej liečbyPegasysom pri odporúčanom dávkovacom režimeGenotyp
| Negatívna
| Pozitívna
|
Žiadna
odpoveď
do 12. Odpoveď Predpokladaná týždňa nepretrváva hodnota
|
Odpoveď
do 12. Odpoveď Predpokladaná týždňa pretrváva hodnota
|
Genotyp 1
(N = 569)
| 102 97 95 %
(97/102)
| 467 271 58 %
(271/467)
|
Genotyp 2 a 3
(N = 96)
| 3 3 100 %
(3/3)
| 93 81 87 %
(81/93)
|
Negatívna prediktívna hodnota na trvalú odpoveď u pacientov liečených Pegasysom v monoterapii
bola 98 %.
Podobná negatívna prediktívna hodnota sa pozorovala u HIV-HCV koinfikovaných pacientov liečených Pegasysom v monoterapii alebo v kombinácii s ribavirínom (100 % (130/130) alebo 98 % (83/85)). Pozitívne predpokladané hodnoty 45 % (50/110) alebo 70 % (59/84) u HIV-HCV koinfikovaných pacientov sa pozorovali pri genotype 1 a genotype 2/3, ktorí dostávali kombinovanú liečbu.
Predikcia odpovede alebo chýbanie odpovede - predtým liečení pacientiU pacientov, ktorí neodpovedali na predchádzajúcu liečbu a boli opakovane liečení 48 alebo
72 týždňov, sa ukázalo, že potlačenie aktivity vírusu v 12. týždni (nedetegovateľná HCV RNA definovaná ako <50 IU/ml) predpokladá trvalú virologickú odpoveď. Ak nebolo dosiahnuté potlačenie vírusovej aktivity v 12. týždni pri režime liečby 48 alebo 72 týždňov, je pravdepodobnosť nedosiahnutia trvalej virologickej odpovede pri 48-týždňovej liečbe 96 % (363 z 380) a pri
72-týždňovej liečbe 96 % (324 z 339). Ak bolo dosiahnuté potlačenie vírusovej aktivity v 12. týždni pri režime liečby 48 alebo 72 týždňov, je pravdepodobnosť dosiahnutia trvalej virologickej odpovede pri 48-týždňovej liečbe 35 % (20 z 57) a pri 72-týždňovej liečbe 57 % (57 zo 100).
Úprava dávkovania u dospelých pacientov v dôsledku nežiaducich reakciíVšeobecnePri nutnosti úpravy dávkovania v dôsledku stredne ťažkých až ťažkých nežiaducich reakcií (klinickej a/alebo laboratórnej povahy) je vhodné u dospelých pacientov znížiť začiatočnú dávku na
135 mikrogramov. V niektorých prípadoch môže byť potrebné znížiť dávkovanie na 90 mikrogramov alebo 45 mikrogramov. Po ústupe nežiaducich reakcií je možné zvážiť zvýšenie dávkovania až na pôvodnú hodnotu (pozri časti 4.4 a 4.8).
Hematologické nežiaduce reakcie (pozri tiež tabuľku 3)Pri poklese počtu neutrofilov na < 750/mm3 u dospelých pacientov sa odporúča znížiť dávkovanie lieku. U pacientov s absolútnym počtom neutrofilov (ANC) < 500/mm3, sa liečba prerušuje až do obnovenia hodnôt ANC > 1000/mm3. Liečbu Pegasysom je možné opäť začať dávkou
90 mikrogramov a má sa sledovať počet neutrofilov. V tabuľke 7 je uvedený návod na zníženie dávky
pre pediatrických pacientov na základe hodnôt ANC.
Ak počet trombocytov klesne na < 50 000/mm3, má sa znížiť dávkovanie na 90 mikrogramov. Pri znížení počtu trombocytov na hodnotu < 25 000/ mm3 sa odporúča liečbu ukončiť.
Pre liečbu farmakologicky podmienenej anémie u dospelých platia nasledovné špecifické odporúčania:
denná dávka ribavirínu sa má znížiť na 600 mg (200 mg ráno a 400 mg večer), ak nastane niektorá
z nasledujúcich situácií: (1) u pacienta bez závažného kardiovaskulárneho ochorenia dôjde k poklesu hodnôt hemoglobínu na < 10 g/dl a ≥ 8,5 g/dl alebo (2) u pacienta so stabilizovaným kardiovaskulárnym ochorením dôjde k poklesu hodnôt hemoglobínu ≥ 2 g/dl v priebehu ktorýchkoľvek 4 týždňov liečby. Návrat k pôvodnému dávkovaniu sa neodporúča. Liečba ribavirínom
sa ukončí, ak nastane niektorá z nasledujúcich situácií: (1) u pacienta bez závažného kardiovaskulárneho ochorenia dôjde k poklesu hodnôt hemoglobínu < 8,5 g/dl alebo(2) u pacienta so stabilizovaným kardiovaskulárnym ochorením sa hodnoty hemoglobínu udržujú < 12 g/dl napriek 4- týždňovej liečbe s redukovaným dávkovaním. Ak sa abnormality upravia, je možné obnoviť liečbu
ribavirínom v dennej dávke 600 mg. Ošetrujúci lekár môže zvážiť ďalšie zvýšenie dávkovania na
800 mg denne. Návrat k pôvodnému dávkovaniu sa neodporúča.
Tabuľka 3: Úprava dávkovania v dôsledku nežiaducich účinkov (ďalšie informácie pozri v texte vyššie)
| Znížiť
dávkovanie ribavirínu na
600 mg
| Vysadiť
ribavirín
| Znížiť dávkovanie
Pegasysu na
135/90/45 mikrogramov
| Vysadiť
Pegasys
| Vysadiť
kombinovanú liečbu
|
Absolútny počet neutrofilov
|
|
| < 750/mm3
| < 500/mm3
|
|
Počet
trombocytov
|
|
| < 50 000/mm3
> 25 000/mm3
|
| < 25 000/mm3
|
Hemoglobín
- bez ochorenia srdca
| < 10 g/dl
a ≥ 8,5 g/dl
| < 8,5 g/dl
|
|
|
|
Hemoglobín
- stabilizo- vané ochorenie srdca
| pokles
o ≥ 2 g/dl počas
ľubovoľných
4 týždňov
| < 12 g/dl
napriek
4 týždňovej liečbe
s redukovaným dávkovaním
|
|
|
|
Pri neznášanlivosti ribavirínu je možné pokračovať v monoterapii Pegasysom.
Funkcia pečeneU pacientov s chronickou hepatitídou C sa často vyskytuje kolísanie odchýlok pečeňových testov. U pacientov liečených Pegasysom vrátane pacientov s virologickou odpoveďou sa pozorovalo
zvýšenie hladín ALT nad východiskovú hodnotu (BL).
V klinických skúšaniach zameraných na chronickú hepatitídu C s dospelými pacientmi sa u 8 zo 451
pacientov dostávajúcich kombinovanú liečbu pozorovalo izolované zvýšenie ALT (≥ 10x ULN alebo
≥ 2x BL u pacientov s východiskovou hodnotou ALT ≥ 10x ULN), ktoré sa upravilo bez nutnosti
zmeny dávkovania. Ak je hodnota ALT trvale vyššia alebo naďalej stúpa, dávkovanie sa na začiatku
znižuje na 135 mikrogramov. Ak napriek zníženiu dávkovania hodnoty ALT naďalej stúpajú alebo ich sprevádza zvýšenie hladiny bilirubínu alebo známky dekompenzácie funkcie pečene, má sa liečba ukončiť (pozri časť 4.4). V tabuľke 7 je uvedený návod pre zníženie dávky pre pediatrických
pacientov na základe hladín ALT.
U pacientov s chronickou hepatitídou B nie je nezvyčajné prechodné zvýšenie hladín ALT, ktoré niekedy prekročí desaťnásobok hornej hranice normálnej hodnoty a môže odrážať imunitný klírens. Liečba by sa za normálnych okolností nemala začať, ak je hladina ALT viac než desaťkrát vyššia ako horná hranica normálnej hodnoty. Treba zvážiť pokračovanie liečby s častejším sledovaním funkcie pečene pri náhlom zvýšení hladín ALT. Ak sa dávka Pegasysu zníži alebo ak sa liek vysadí, pri poklese hladiny ALT sa liečba môže obnoviť (pozri časť 4.4).
Osobitné skupiny pacientov
Starší ľudia
Na začiatku liečby Pegasysom u starších pacientov nie je potrebná žiadna úprava odporúčaného dávkovania 180 mikrogramov raz týždenne (pozri časť 5.2).
Porucha funkcie obličiekU pacientov s ochorením obličiek v terminálnej fáze sa používa začiatočná dávka 135 mikrogramov (pozri časť 5.2 ). Bez ohľadu na začiatočnú dávku alebo stupeň poškodenia funkcie obličiek je potrebné pacientov sledovať a v prípade nežiaducich reakcií je nutné primerane znížiť dávkovanie Pegasysu počas liečebnej kúry.
Porucha funkcie pečeneUkázalo sa, že Pegasys je účinný a bezpečný u pacientov s kompenzovanou cirhózou (napr. A podľa
Child-Pughovej klasifikácie). Pegasys sa nehodnotil u pacientov s dekompenzovanou cirhózou (napr. B alebo C podľa Child-Pughovej klasifikácie alebo krvácajúce ezofageálne varixy) (pozri časť 4.3).
Podľa Child-Pughovej klasifikácie sa pacienti rozdeľujú do skupín A, B a C resp. s “miernou” “stredne ťažkou” a “ťažkou” poruchou funkcie, čomu zodpovedá skóre 5 - 6, 7 - 9 a 10 - 15.
Upravené hodnotenie Hodnotenie
| Stupeň abnormality
| Skóre
|
Encefalopatia
| Žiadny
Stupeň 1 - 2
Stupeň 3 – 4*
| 1
2
3
|
Ascites
| Žiadny
Mierny
Stredný
| 1
2
3
|
Hladina sérového bilirubínu (mg/dl)
v SI jednotkách = μmol/l
| < 2
2,0 - 3
> 3
< 34
34 - 51
> 51
| 1
2
3
1
2
3
|
Hladina sérového albumínu (g/dl)
| > 3,5
2,8 – 3,5
< 2,8
| 1
2
3
|
INR
| < 1,7
1,7 - 2,3
> 2,3
| 1
2
3
|
* Hodnotenie stupňa závažnosti podľa autorov Trey, Burns a Saunders (1966)
Pediatrická populáciaPegasys je kontraindikovaný u novorodencov a malých detí vo veku do 3 rokov z dôvodu prítomnosti
pomocnej látky benzylalkoholu (pozri časti 4.3 a 4.4).
Pre deti a dospievajúcich vo veku 5 až 17 rokov s chronickou hepatitídou C s povrchom tela (BSA) väčším ako 0,7 m2 sú odporúčané dávky Pegasysu a ribavirínu uvedené v tabuľke 4 a v tabuľke 5. Pre pediatrických pacientov sa odporúča použiť Pegasys v naplnených injekčných striekačkách. Použitie Pegasysom naplnených pier neumožňuje primeranú úpravu dávky pre týchto pacientov. Pacienti, ktorí začali liečbu pred svojimi 18-timi narodeninami, majú pokračovať v pediatrickom dávkovaní až do skončenia liečby.
Pegasys sa nesmie použiť u detí s povrchom tela (BSA) menším ako 0,71 m2, keďže pre túto subpopuláciu nie sú dostupné údaje.
Pre výpočet BSA sa odporúča používať Mostellerov vzorec:
 Dĺžka liečby
Dĺžka liečbyDĺžka liečby Pegasysom v kombinácii s ribavirínom u pediatrických pacientov s chronickou hepatitídou C závisí od genotypu vírusu. Pacienti infikovaní vírusovými genotypom 2 alebo 3 majú dostať 24 týždňovú liečbu, zatiaľ čo pacienti infikovaní iným genotypom majú dostať 48 týždňovú liečbu.
Pacienti, ktorí majú ešte detegovateľné hladiny HCV-RNA a to aj napriek počiatočnej 24 týždňovej liečbe, majú ukončiť liečbu, pretože je nepravdepodobné, že pokračovaním v liečbe budú schopní dosiahnuť trvalú virologickú odpoveď.
Tabuľka 4: Odporúčania na dávkovanie Pegasysu u pediatrických pacientov vo veku 5 až 17rokov Rozmedzie plochy povrchu tela (BSA) (m2)
| Týždenná dávka (mikrogramy)
|
0,71-0,74
| 65
|
0,75-1,08
| 90
|
1,09-1,51
| 135
|
> 1,51
| 180
|
Pre deti a dospievajúcich vo veku 5 až 17 rokov s chronickou hepatitídou C odporúčaná dávka
ribavirínu vychádza z telesnej hmotnosti pacienta s cieľovou dávkou 15 mg/kg/deň rozdelenou do dvoch denných dávok. V tabuľke 5 je uvedené dávkovanie za použitia 200 mg tabliet ribavirínu pre deti a dospievajúcich s hmotnosťou 23 kg a viac. Pacienti a ich opatrovatelia sa nesmú pokúšať rozlomiť 200 mg tablety.
Tabuľka 5: Odporúčania na dávkovanie ribavirínu u pediatrických pacientov vo veku 5 až 17rokov Telesná hmotnosť kg (lbs)
| Denná dávka ribavirínu
(pribl. 15 mg/kg/deň)
| Počet tabliet ribavirínu
|
23 – 33 (51-73)
| 400 mg/deň
| 1 x 200 mg tablety ráno
1 x 200 mg tablety večer
|
34 – 46 (75-101)
| 600 mg/deň
| 1 x 200 mg tablety ráno
2 x 200 mg tablety večer
|
47 – 59 (103-131)
| 800 mg/deň
| 2 x 200 mg tablety ráno
2 x 200 mg tablety večer
|
60 – 74 (132-163)
| 1 000 mg/deň
| 2 x 200 mg tablety ráno
3 x 200 mg tablety večer
|
≥ 75 (> 165)
| 1 200 mg/deň
| 3 x 200 mg tablety ráno
3 x 200 mg tablety večer
|
Úprava dávky u pediatrických pacientov kvôli nežiaducim reakciámU pediatrických pacientov je možné na základe toxicity (pozri tabuľku 6) urobiť až tri stupne modifikácie dávky pred zvážením prerušenia alebo vysadenia dávky.
Začiatočná dávka
(mikrogramy)
| 1. stupeň zníženia
(mikrogramy)
| 2. stupeň zníženia
(mikrogramy)
| 3. stupeň zníženia
(mikrogramy)
| 65
| 45
| 30
| 20
| 90
| 65
| 45
| 20
| 135
| 90
| 65
| 30
|
|
|
Tabuľka 6: Odporúčaná úprava dávky Pegasysu u pediatrických pacientov
V prípade výskytu toxicity, ktorá môže súvisieť s podávaním Pegasysu a/alebo ribavirínu, sa môže
znížiť dávka jedného alebo obidvoch liekov. Okrem toho sa môže ribavirín alebo kombinovaná liečba Pegasys plus ribavirín vysadiť. Je dôležité poznamenať, že ribavirín sa nesmie nikdy podávať ako monoterapia. Odporúčania na úpravu dávky z dôvodu toxicity, o ktorej je známe, že má súvislosť
s podávaním Pegasysu a ktoré sú špecifické pre pediatrickú populáciu, sú uvedené v tabuľke 7. Pokiaľ nie je uvedené inak, v prípade všetkých ostatných toxických prejavov sa má postupovať podľa odporúčaní pre dospelých.
Toxicita
| Úprava dávky Pegasysu
| Neutropénia
| 750-999 buniek/mm3: 1.-2. týždeň – okamžitá úprava 1. stupňa; 3.-48. týždeň: žiadna úprava.
500-749 buniek/mm3: 1.-2. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte dávkou s úpravou 1. stupňa s kontrolou hodnoty leukocytov jedenkrát týždenne počas 3 nasledujúcich týždňov, aby ste sa ubezpečili, že ich počet je > 750 buniek/mm3; 3.-48. týždeň – okamžitá úprava 1. stupňa.
250-499 buniek/mm3: 1.-2. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte dávkou s úpravou 2. stupňa; 3.-48. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte
v dávkovaní s úpravou 1. stupňa.
< 250 buniek/mm3 (alebo febrilná neutropénia) liečbu vysaďte.
| Zvýšená hladina
alanínaminotransaminázy
(ALT)
| V prípade pretrvávajúcich alebo narastajúcich zvýšení ≥ 5 ale < 10 x
ULN, znížte dávku s úpravou 1. stupňa a jedenkrát týždenne sledujte hladinu ALT na uistenie, že je stabilná alebo klesá
V prípade pretrvávajúcich hodnôt ALT ≥ 10 x ULN vysaďte liečbu.
|
|
|
Tabuľka 7: Odporúčania na úpravu dávky Pegasysu z dôvodu toxicity u pediatrických pacientovULN=horná hranica normy
U pediatrických pacientov je toxicita súvisiaca s liečbou ribavirínom, ako napríklad anémia, ktorá sa objaví počas liečby, riešiteľná znížením celkovej dávky. Stupne zníženia dávky sú uvedené v tabuľke
8.
Tabuľka 8: Odporúčania na úpravu dávky ribavirínu u pediatrických pacientovCelková dávka
(približne 15 mg/kg/deň)
| Jednokroková úprava dávky
(približne 7,5 mg/kg/deň)
|
Počet tabliet ribavirínu
|
400 mg/deň
| 200 mg/deň
| 1 x 200 mg tabliet ráno
|
600 mg/deň
|
400 mg/deň
| 1 x 200 mg tabliet ráno
1 x 200 mg tabliet večer
|
800 mg/deň
|
400 mg/deň
| 1 x 200 mg tabliet ráno
1 x 200 mg tabliet večer
|
1 000 mg/deň
|
600 mg/deň
| 1 x 200 mg tabliet ráno
2 x 200 mg tabliet večer
|
1 200 mg/deň
|
600 mg/deň
| 1 x 200 mg tabliet ráno
2 x 200 mg tabliet večer
|

Skúsenosti s Pegasysom pri liečbe pediatrických pacientov s HCV vo veku od 3 do 5 rokov alebo tých, ktorí v minulosti neboli adekvátne liečení, sú len obmedzené. Neexistujú žiadne údaje u pediatrických pacientov súčasne infikovaných vírusmi HCV a HIV alebo s poruchou funkcie obličiek.
Spôsob podaniaPegasys sa podáva subkutánne do brucha alebo stehna. V štúdiách s podaním Pegasysu do ramena
bola zistená znížená expozícia Pegasysom (pozri časť 5.2).
Pegasys je navrhnutý na podávanie samotným pacientom alebo opatrovateľom. Každú injekčnú liekovku má používať len jedna osoba a je určená len na jednorazové použitie.
Pre nezdravotníckych pracovníkov, ktorí podávajú tento liek, sa odporúča primerané školenie. Pacient musí postupovať presne podľa “Pokynov pre používateľa” vložených v škatuľke.
4.3 Kontraindikácie• Precitlivenosť na liečivo, na interferóny alfa alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
• Autoimunitná hepatitída
• Ťažká dysfunkcia pečene alebo dekompenzovaná cirhóza pečene
• Anamnéza ťažkého kardiovaskulárneho ochorenia vrátane nestabilného alebo nekontrolovaného
ochorenia srdca počas predchádzajúcich 6 mesiacov (pozri časť 4.4)
• HIV-HCV pacienti s cirhózou s Child-Pughovým skóre ≥6, okrem stavu, keď je cirhóza nepriamo spôsobená hyperbilirubinémiou vyvolanou liekmi ako atazanavir a indinavir
• Kombinácia s telbivudínom (pozri časť 4.5)
• Novorodenci a deti do 3 rokov vzhľadom na prítomnosť pomocnej látky – benzylalkoholu
(pozri časť 4.4 o benzylalkohole)
• Psychické poruchy, obvzvlášť závažná depresia , suicidálne myšlienky alebo pokus o samovraždu u pediatrických pacientov v súčasnosti alebo v anamnéze.
Ak sa Pegasys má použiť v kombinácii s ribavirínom, prečítajte si súhrn charakteristických vlastností
(SmPC) ribavirínu, ktorý obsahuje kontraindikácie jeho použitia.
4.4 Osobitné upozornenia a opatrenia pri používaníPsychické poruchy a centrálny nervový systém (CNS): Počas liečby Pegasysom a aj po jej ukončení, najmä počas 6-mesačného sledovania po liečbe, sa pozorovali u niektorých pacientov závažné účinky na CNS, hlavne depresia, samovražedné predstavy a pokus o samovraždu. Pri použití alfa interferónov sa pozorovali ďalšie účinky na CNS s prejavmi ako je agresívne správanie (niekedy namierené proti iným osobám ako je myšlienka na vraždu), bipolárne poruchy, mánia, zmätenosť a poruchy vedomia. U všetkých pacientov majú byť prísne monitorované všetky znaky alebo symptómy psychických porúch. Ak sa objavia symptómy psychických porúch, ošetrujúci lekár musí vziať do úvahy možnú závažnosť týchto príznakov a zvážiť potrebu adekvátnej liečby. Ak psychiatrické symptómy pretrvávajú alebo sa zhoršujú alebo ak sa spozorujú samovražedné predstavy, odporúča sa liečbu Pegasysom ukončiť a pacienta odporučiť do prislúchajúcej psychiatrickej starostlivosti a/alebo liečby.
Pacienti s už existujúcim psychiatrickým ochorením alebo s údajom o závažnom psychiatrickom ochorení v anamnéze: Ak sa rozhodne, že liečba Pegasysom je nutná u pacienta, ktorý má existujúce alebo v anamnéze prítomné závažné psychiatrické ochorenie, má sa liečba začať až po zaistení vhodnej individuálnej diagnostiky a liečby psychiatrického stavu.
Použitie Pegasysu u pediatrických pacientov s psychickými poruchami v súčasnosti alebo v anamnéze je kontraindikované (pozri časť 4.3).
 Rast a vývoj (deti a dospievajúci):
Rast a vývoj (deti a dospievajúci): Úbytok hmotnosti a inhibícia rastu bola bežná v priebehu liečby trvajúcej až 48 týždňov u pacientov vo veku 5 až 17 rokov (pozri časti 4.8 a 5.1).
2 roky po liečbe Pegasysom bolo 16 % pediatrických pacientov stále 15 percentilov alebo viac pod svojou východiskovou krivkou hmotnosti a 11 % zostalo 15 percentilov alebo viac pod svojou východiskovou krivkou výšky.
Individuálne posúdenie prínosu liečby a rizika u detíOčakávaný prínos liečby sa má starostlivo zvažovať berúc pritom do úvahy zistenia z klinických skúšaní týkajúce sa bezpečnosti pozorované u pediatrických pacientov (pozri časti 4.8 a 5.1).
- Je dôležité vziať do úvahy, že kombinovaná liečba viedla k inhibícii rastu, ktorej
reverzibilita nie je istá.
- Toto riziko je potrebné zvážiť berúc do úvahy charakter ochorenia dieťaťa, akým je dôkaz
o progresii ochorenia (najmä fibróza), komorbidity, ktoré môžu negatívne ovplyvniť priebeh ochorenia (napr. súčasná infekcia vírusom HIV), ako aj prognostické faktory odpovede (HCV
genotyp a vírusová záťaž).
Ak je to možné, že dieťa sa má liečiť po pubertálnej akcelerácii rastu, aby sa znížilo riziko inhibície rastu. Neexistujú žiadne údaje o dlhodobých účinkoch na pohlavné dozrievanie.
Ak sa Pegasys podáva v kombinácii s ribavirínom, prečítajte si súhrn charakteristických vlastností
(SmPC) ribavirínu.
Histológia pečene pred liečbou
Všetci pacienti s chronickou hepatitídou C, ktorí sa zúčastnili štúdie, sa podrobili biopsii pečene, ale v určitých prípadoch (napr. u pacientov s genotypom 2 alebo 3) sa môže liečba nasadiť aj bez histologického dôkazu. Pri rozhodovaní o nutnosti biopsie pečene pred začiatkom liečby sa má postupovať podľa platných liečebných postupov.
U pacientov s normálnymi hodnotami ALT sa progresia do fibrózy v priemere vyskytuje s nižšou intenzitou ako u pacientov so zvýšenými hodnotami ALT. Toto musí byť zhodnotené spoločne s ostatnými kritériami ako HCV genotyp, vek pacienta, extrahepatálne prejavy, riziko prenosu atď., ktoré ovplyvňujú rozhodnutie liečiť alebo neliečiť.
Laboratórne vyšetrenia pred liečbou a počas nej
Pred začiatkom liečby Pegasysom sa u všetkých pacientov odporúča vykonať štandardné hematologické a biochemické laboratórne vyšetrenia.
Pred začiatkom liečby Pegasysom musia byť východiskové hodnoty sledovaných parametrov nasledovné:
- počet trombocytov ≥ 90 000/mm3
- absolútny počet neutrofilov ≥ 1 500/mm3
- primerane kontrolovaná funkcia štítnej žľazy (TSH a T4)
Hematologické vyšetrenia sa majú opakovať každé 2 - 4 týždne a biochemické vyšetrenia každé 4
týždne. Počas liečby sa má periodicky robiť doplnkové vyšetrenie.
V klinických štúdiách sa počas liečby Pegasysom pozorovalo zníženie počtu leukocytov (WBC) ako aj absolútneho počtu neutrofilov (ANC), ku ktorému obyčajne došlo počas prvých dvoch týždňov liečby (pozri časť 4.8). Progresívne znižovanie po 8 týždňoch liečby sa zistilo len v zriedkavých prípadoch. Pokles ANC bol obyčajne reverzibilný po znížení dávkovania alebo ukončení liečby (pozri časť 4.2), normálne hodnoty sa dosiahli u väčšiny pacientov za 8 týždňov a na základné hodnoty sa vrátili u všetkých pacientov približne po 16 týždňoch.
Liečbu Pegasysom sprevádzalo zníženie počtu trombocytov, ktorý sa vrátil na úroveň pred liečbou počas obdobia sledovania po liečbe (pozri časť 4.8). V niektorých prípadoch bola potrebná úprava dávkovania (pozri časť 4.2).
V klinických štúdiách sa u 15 % pacientov s chronickou hepatitídou C liečených Pegasysom
v kombinácii s ribavirínom pozoroval výskyt anémie (hemoglobín <10 g/dl). Frekvencia závisí na dĺžke trvania liečby a na dávke ribavirínu (pozri časť 4.8). U ženskej populácie je vyššie riziko vývoja anémie.
Pri podávaní Pegasysu v kombinácii s inými potenciálne myelosupresívnymi látkami je potrebná opatrnosť.
V literatúre sú hlásenia o výskyte pancytopénie a o útlme kostnej drene, ku ktorým došlo v priebehu 3 až 7 týždňov po podaní peginterferónu a ribavirínu podaného súbežne s azatioprinom. Táto myelotoxicita bola reverzibilná do 4 až 6 týždňov po vysadení antivirotickej terapie proti hepatitíde C a súčasne podávaného azatioprinu a neobnovila sa po opätovnom zavedení ktoréhokoľvek z týchto liečiv podávaných v monoterapii (pozri časť 4.5).
Použitie kombinovanej liečby Pegasysom a ribavirínom u pacientov s chronickou hepatitídou C,
u ktorých zlyhala predchádzajúca liečba, sa dostatočne nesledovalo u pacientov, ktorí predchádzajúcu liečbu predčasne ukončili kvôli hematologickým nežiaducim reakciám. Lekári, ktorí uvažujú o liečbe týchto pacientov, majú starostlivo zvážiť riziká opakovanej liečby oproti jej prínosom.
Endokrinný systém
Pri používaní interferónov alfa vrátane Pegasysu sa popísali poruchy funkcie štítnej žľazy, resp. zhoršenie predchádzajúcich ochorení štítnej žľazy. Pred začiatkom liečby Pegasysom sa majú vyšetriť hladiny TSH a T4. Liečbu Pegasysom je možné zahájiť alebo je možné v nej pokračovať, ak sa hodnoty TSH počas liečby udržia v normálnom rozmedzí. Počas liečebnej kúry sa majú vyšetriť hladiny TSH, ak sa u pacienta objavia klinické príznaky svedčiace o možnej poruche funkcie štítnej žľazy (pozri časť 4.8). Pri liečbe Pegasysom sa môže pozorovať hypoglykémia, hyperglykémia a diabetes mellitus (pozri časť 4.8). Pacienti, u ktorých sa tieto stavy nemôžu účinne kontrolovať liekmi, sa nemajú začať liečiť Pegasysom alebo Pegasysom v kombinácii s ribavirínom. U pacientov, u ktorých sa toto ochorenie rozvinulo počas liečby a nemôžu sa liečiť liekmi, má sa liečba Pegasysom alebo Pegasysom v kombinácii s ribavirínom ukončiť.
Kardiovaskulárny systém
Liečbu interferónmi alfa vrátane Pegasysu sprevádzala hypertenzia, supraventrikulárne arytmie, kongestívne srdcové zlyhanie, bolesť na hrudníku a infarkt myokardu. Odporúča sa, aby sa pacienti so srdcovými abnormalitami v predchorobí podrobili elektrokardiografickému vyšetreniu pred začiatkom liečby Pegasysom. Pri akomkoľvek zhoršení kardiovaskulárneho stavu sa musí liečba prerušiť resp. ukončiť. U pacientov s kardiovaskulárnym ochorením si môže anémia vyžiadať zníženie dávkovania alebo vysadenie liečby ribavirínom (pozri časť 4.2).
Funkcia pečene
Liečba Pegasysom sa musí ukončiť u pacientov, u ktorých sa počas liečby objavia známky dekompenzácie pečene. Pri liečbe Pegasysom sa pozorovalo zvýšenie hladín ALT oproti východiskovej hodnote, ku ktorému došlo aj u pacientov s virologickou odpoveďou na liečbu. Ak napriek zníženiu dávkovania hodnota ALT naďalej stúpa a je klinicky významná resp. ju sprevádza zvýšenie hladiny priameho bilirubínu, liečba sa musí ukončiť (pozri časti 4.2 a 4.8).
V prípade chronickej hepatitídy B, na rozdiel od chronickej hepatitídy C, nie je nezvyčajné zhoršenie ochorenia počas liečby, ktoré je charakterizované prechodným a potenciálne významným zvýšením sérovej ALT. V klinických štúdiách s Pegasysom pri HBV sa pozorovalo výrazné zvýšenie hladiny transaminázy, sprevádzané miernymi zmenami v ďalších parametroch hepatálnej funkcie, pričom sa nedokázala dekompenzácia pečene. Približne v polovici prípadov zvýšenia ALT prekračujúceho desaťnásobok hornej hranice normálnej hodnoty sa dávkovanie Pegasysu znížilo alebo liek sa vysadil, až kým neklesli hodnoty transaminázy, zatiaľ čo u zvyšku pacientov liečba ostala nezmenená. Vo všetkých prípadoch sa odporučilo častejšie sledovanie hepatálnej funkcie.
Precitlivenosť
V zriedkavých prípadoch sa počas liečby interferónom alfa môžu vyskytnúť závažné akútne reakcie
z precitlivenosti (napr. urtikária, angioedém, bronchokonstrikcia, anafylaxia). Ak sa vyskytnú, musí sa liečba ukončiť a okamžite zahájiť príslušná farmakoterapia. Prechodný exantém si nevyžaduje nutnosť prerušenia liečby.
Autoimunitné ochorenie
Popísal sa vznik autoprotilátok a autoimunitných porúch počas liečby interferónmi alfa. Zvýšené riziko môžu mať pacienti predisponovaní na rozvoj autoimunitných porúch. Pacientov, ktorí majú znaky alebo príznaky zlučiteľné s autoimunitnými poruchami, sa má starostlivo vyšetriť a potom prehodnotiť pomer prínosu a rizika pokračovania liečby interferónom (pozri tiež Endokrinný systém v častiach 4.4 a 4.8).
U pacientov s chronickou hepatitídou C liečených interferónom boli hlásené prípady Vogt-Koyanagi- Harada (VKH) syndrómu. Tento syndróm je granulomatózne zápalové ochorenie, ktoré postihuje oči, sluchový systém, meningy a kožu. Ak je podozrenie na VKH syndróm, má sa antivirotická liečba ukončiť a uvažovať o liečbe kortikoidmi (pozri časť 4.8).
Horúčka/infekcie
Zatiaľ čo horúčka môže byť spojená so syndrómom podobným chrípke, čo sa často uvádza pri liečbe interferónom, musia sa vylúčiť iné príčiny pretrvávajúcej horúčky, zvlášť závažné infekcie (bakteriálne, vírusové, plesňové), najmä u pacientov s neutropéniou. V priebehu liečby interferónmi alfa, vrátane Pegasysu sa zaznamenal vznik závažných infekcií (bakteriálnych, vírusových, plesňových) a sepsa. Okamžite sa má začať odpovedajúca liečba proti infekcii a má sa zvážiť prerušenie liečby.
Očné zmeny
Pri liečbe Pegasysom sa zriedkavo popísala retinopatia, vrátane krvácania do sietnice, vatových škvŕn, edému papily, neuropatie zrakového nervu a uzáveru retinálnej artérie alebo vény, ktorý môže viesť
k strate zraku. Všetci pacienti sa majú pred začiatkom liečby podrobiť očnému vyšetreniu. Každý pacient udávajúci zhoršenie alebo stratu zraku sa musí okamžite podrobiť kompletnému očnému vyšetreniu. Dospelí a pediatrický pacienti s očnými poruchami v predchorobí (napr. diabetickou alebo hypertenznou retinopatiou), sa majú počas liečby Pegasysom podrobiť pravidelným očným vyšetreniam. Liečba Pegasysom sa má ukončiť u pacientov s novovzniknutými alebo zhoršenými poruchami zraku.
Pľúcne zmeny
Počas liečby Pegasysom sa opísali pľúcne zmeny vrátane dýchavice, pľúcnych infiltrátov, pneumónie a pneumonitídy. V prípade pretrvávajúcich alebo nevysvetlených pľúcnych infiltrátov alebo zhoršenia funkcie pľúc sa má liečba ukončiť.
Kožné poruchy
Liečba interferónmi alfa bola sprevádzaná exacerbáciou alebo rozvojom psoriázy a sarkoidózy. Pegasys sa musí opatrne používať u pacientov s psoriázou a v prípadoch vzniku resp. zhoršenia psoriatických lézií sa musí liečba ukončiť.
Transplantácia
Bezpečnosť a účinnosť liečby Pegasysom a ribavirínom sa u pacientov po transplantácii pečene a iných orgánov nehodnotila. Boli hlásené odvrhnutia transplantátov pečene a obličiek po liečbe Pegasysom samotným alebo po kombinovanej liečbe s ribavirínom.
Súčasná infekcia HIV-HCV
Prosím, pozrite si súhrny charakteristických vlastností pre antiretrovírusové lieky, ktoré sa užívajú súbežne s HCV liečbou pre porozumenie a zvládnutie toxických účinkov každého lieku a možnosti prekrývania sa toxických účinkov pri liečbe Pegasysom s ribavirínom alebo bez ribavirínu. V štúdii NR15961 u pacientov, ktorí boli súbežne liečení so stavudínom a interferónom s alebo bez ribavirínu, bol výskyt pankreatitídy a/alebo laktátovej acidózy 3 % (12/398).
U pacientov súčasne infikovaných HCV a HIV, ktorí dostávajú vysoko-účinnú liečbu anti- retrovírusovými látkami (HAART), môže byť vyššie riziko vzniku laktátovej acidózy. Preto je potrebná opatrnosť pri pridávaní kombinovanej liečby Pegasys a ribavirín k liečbe HAART (pozri SPC ribavirínu).
Súčasne infikovaní pacienti s pokročilou infekciou a pokročilou cirhózou pečene liečení HAART
môžu mať vyššie riziko dekompenzácie pečene a úmrtia, ak dostávajú ribavirín v kombinácii s interferónmi vrátane Pegasysu. Zmeny východiskových hodnôt u koinfikovaných pacientov
s cirhózou, ktoré môžu byť spojené s dekompenzáciou pečene, zahŕňajú: zvýšený sérový bilirubín, znížený hemoglobín, zvýšenú alkalickú fosfatázu alebo znížený počet krvných doštičiek a liečbu didanozínom (ddI).
Súbežná liečba ribavirínom a zidovudínom sa neodporúča vzhľadom na zvýšené riziko vzniku anémie
(pozri časť 4.5).
Počas liečby pacienti s kombinovanou infekciou sa majú starostlivo sledovať na znaky a symptómy dekompenzácie pečene (vrátane ascitu encefalopatie, krvácania z varixov, poškodenej syntézy
v pečeni; napr. Childovo-Pughovo skóre 7 alebo vyššie). Childovo-Pughovo skóre môže byť ovplyvnené faktormi spojenými s liečbou (ako nepriama hyperbilirubinémia, znížený albumín) a nemusia nevyhnutne viesť k dekompenzácii pečene. Liečba Pegasysom sa má ihneď ukončiť u pacientov s dekompenzáciou pečene.
U pacientov súčasne infikovaných HCV a HIV, údaje o účinnosti a bezpečnosti sú obmedzené
u pacientov s počtom CD4 buniek nižším ako 200 buniek/µl. Opatrnosť je preto potrebná u pacientov s nízkym počtom CD4 buniek.
Dentálne a periodontálne poruchy
U pacientov, ktorí dostávajú Pegasys v kombinácii s ribavirínom, sa hlásili dentálne a periodontálne poruchy, ktoré môžu viesť k strate zubov. Navyše suché ústa môžu mať škodlivý účinok na zuby a
mukózne membrány úst počas dlhotrvajúcej liečby Pegasysom v kombinácii s ribavirínom. Pacienti si
majú dvakrát denne dôkladne čistiť zuby a majú mať pravidelné kontrolné vyšetrenie zubným
lekárom. Okrem toho u niektorých pacientov sa môže objaviť vracanie. Ak sa takáto reakcia vyskytne, má sa im odporučiť dôkladne si potom vypláchnuť ústa.
Použitie dlhodobej liečby peginterferónom v monoterapii (neschválené použitie)
V randomizovanej, kontrolovanej štúdii (HALT-C) uskutočnej v USA u pacientov infikovaných
vírusom HCV s rozličným stupňom fibrózy, ktorí neodpovedali na liečbu, sa sledovala 3,5-ročná liečba Pegasysom v monoterapii v dávke 90 mikrogramov/týždeň, pričom sa nezistilo žiadne signifikantné zníženie výskytu progresie fibrózy alebo súvisiacich klinických príhod.
Pomocná látka
Pegasys obsahuje benzylakohol. Nesmie sa podávať predčasne narodeným deťom ani novorodencom. Môže spôsobiť toxické reakcie a anafylaktické reakcie u dojčiat a detí vo veku do 3 rokov.
4.5 Liekové a iné interakcie
Interakčné štúdie sa uskutočnili len u dospelých.
Podávanie Pegasysu zdravým mužským dobrovoľníkom v dávke 1 x 180 mikrogramov týždenne počas 4 týždňov nemalo žiadny vplyv na farmakokinetické profily mefenytoínu, dapsonu,
debrisochínu a tolbutamidu, čo poukazuje na to, že Pegasys neovplyvňuje in vivo metabolickú aktivitu izoenzýmov cytochrómu P450 3A4, 2C9, 2C19 a 2D6.
V rovnakej štúdii sa pozorovalo 25 % zvýšenie hodnoty AUC pre teofylín (marker aktivity cytochrómu P450 1A2), čo potvrdzuje, že Pegasys je inhibítorom aktivity cytochrómu P450 1A2. U pacientov liečených súbežne teofylínom a Pegasysom sa majú sledovať sérové koncentrácie teofylínu a vhodne upraviť jeho dávkovanie. Je pravdepodobné, že k maximálnej interakcii medzi teofylínom a Pegasysom dôjde po viac ako 4 týždňoch liečby Pegasysom.
Pacienti s izolovanou infekciou vírusom HCV a pacienti s izolovanou infekciuo vírusom HBV
Vo farmakologickej štúdii dostávalo 24 HCV infikovaných pacientov súbežne udržiavaciu liečbu metadonom (stredná dávka 95 mg, v rozmedzí od 30 mg do 150 mg), liečba s Pegasysom
180 mikrogramov, subkutánne raz týždenne počas 4 týždňov, bola spojená s priemernými hodnotami metadonu, ktoré boli 10 % až 15 % vyššie než východiskové hodnoty. Klinický význam tohto zistenia nie je známy, napriek tomu sa majú pacienti sledovať pre príznaky a symptómy metadonovej toxicity. Zvlášť sa majú sledovať pacienti, ktorí užívajú vysokú dávku metadonu, u ktorých je riziko predĺženia
QT intervalu.
Ribavirín, keďže má inhibičný účinok na inozín-monofosfátdehydrogenázu, môže zasahovať do metabolizmu azatioprinu, čo eventuálne môže viesť ku kumulácii 6-metyltioinozín-monofosfátu (6- MTIMP), ktorý sa spája so vznikom myelotoxicity u pacientov liečených azatioprinom. Má sa vyhnúť použitiu peginterferónu alfa-2a a ribavirínu podaného súbežne s azatioprinom. V jednotlivých prípadoch, ak prínos podávania ribavirínu súčasne s azatioprinom oprávňuje podstúpiť možné riziko, odporúča sa dôkladne monitorovať hematologické parametre počas súbežného podávania azatioprinu so zreteľom odhaliť známky myelotoxicity. V prípade, že k nej dôjde, treba liečbu týmito liekmi ukončiť (pozri časť 4.4).
Výsledky z farmakokinetických podštúdií v rámci pilotnej štúdie fázy III nepreukázali žiadnu farmakokinetickú interakciu medzi lamivudínom a Pegasysom u pacientov s HBV alebo medzi Pegasysom a ribavirínom u pacientov s HCV.
V klinickom skúšaní bola skúmaná kombinácia telbivudínu 600 mg denne s pegylovaným interferónom alfa-2a, 180 mikrogramov raz týždenne podané subkutánne. Skúšanie ukázalo, že kombinácia je spojená so zvýšeným rizikom vzniku periférnej neuropatie. Mechanizmus vzniku týchto udalostí nie je známy; a tak kombinovaná liečba telbivudínom s inými interferónmi (pegylovanými alebo štandardnými) môže tiež znamenať nesmierne riziko. Okrem toho, prínos kombinovanej liečby telbivudínom s interferónom alfa (pegylovaným alebo štandardným) nie je v súčasnosti preukázaný. Preto je kombinácia Pegasysu s telbivudínom kontraindikovaná (pozri časť 4.3).
Pacienti súčasne infikovaní vírusmi HIV-HCV
U 47 HIV-HCV infikovaných pacientov, ktorí sa zúčastnili na 12-týždňovej farmakokinetickej časti štúdie skúmajúcej účinok ribavirínu na vnútrobunkovú fosforyláciu niektorých inhibítorov nukleozidovej reverznej transkriptázy (lamivudín a zidovudín alebo stavudín) sa nepozoroval žiadny zjavný dôkaz o liekovej interakcii. Avšak v dôsledku vysokej variability boli intervaly spoľahlivosti dosť široké. Nezdá sa, že plazmatická expozícia ribavirínu je ovplyvnená súčasným podávaním inhibítorov nukleozidovej reverznej transkriptázy (NRTIs).
Súčasné podávanie ribavirínu a didanozínu sa neodporúča. Expozícia didanozínu alebo jeho
aktívnemu metabolitu (dideoxyadenozín 5´-trifosfát) sa zvyšuje in vitro, ak sa didanozín podáva spolu s ribavirínom. Pri používaní ribavirínu sa popísali hlásené prípady zlyhania pečene s následkom smrti, ako aj periférna neuropatia, pankreatitída a symptomatická hyperlaktatémia/laktátová acidóza.
Keď bol zidovudín súčasťou režimu používaného na liečbu HIV, bolo hlásené zvýraznenie anémie spôsobenej ribavirínom. Presný mechanizmus zostáva nevysvetlený. Súčasné podávanie ribavirínu
a zidovudínu sa neodporúča vzhľadom na zvýšené riziko vzniku anémie (pozri časť 4.4). Ak už bola kombinovaná antiretrovírusová liečba stanovená, má sa zvážiť nahradenie zidovudínu. Je to zvlášť dôležité u pacientov, u ktorých zidovudín spôsobil anémiu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne alebo iba obmedzené údaje o použití peginterferónu alfa-2a u gravidných žien. Štúdie na zvieratách s peginterferónom alfa-2a preukázali reprodukčnú toxicitu (pozri časť 5.3) a nie je známe potenciálne riziko u ľudí. Liečba Pegasysom počas gravidity sa používa iba vtedy, ak jej úžitok pre matku prevýši jeho riziko pre plod.
Laktácia
Nie je známe, či sa peinterferón alfa 2-a/jeho metabolity vylučujú do materského mlieka. Dojčenie sa má ukončiť pred začatím liečby pre možnosť vzniku nežiaducich reakcií u dojčených detí.
Fertilita
Nie sú k dispozícii žiadne údaje o účinkoch peginterferónu alfa-2a na fertilitu žien. Pri podávaní peginterferónu alfa-2a samiciam opíc sa pozorovalo predĺženie menštruačného cyklu (pozri časť 5.3).
Použitie s ribavirínom
U všetkých zvieracích druhov, ktoré boli vystavené ribavirínu, sa dokázali významné teratogénne a/alebo embryocídne účinky. Ribavirín je u gravidných žien kontraindikovaný. Je potrebná
mimoriadna opatrnosť na zabránenie gravidity u pacientok alebo partneriek pacientov, ktorí užívajú
Pegasys v kombinácii s ribavirínom. Pacientky v plodnom veku musia používať účinnú antikoncepciu počas liečby a ešte 4 mesiace po ukončení liečby. Pacienti alebo partnerky musia používať účinnú antikoncepciu počas liečby a ešte 7 mesiacov po ukončení liečby. Prosím pozrite si SmPC ribavirínu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pegasys má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti, ktorí trpia závratom, zmätenosťou, ospalosťou alebo únavou, sa majú vyvarovať vedeniu vozidiel
alebo obsluhovaniu strojov.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Chronická hepatitída C
Výskyt a závažnosť väčšiny nežiaducich reakcií u pacientov liečených Pegasysom je podobná ako u pacientov dostávajúcich interferón alfa-2a pozri tabuľku 9). Väčšina častých nežiaducich reakcií pozorovaných po Pegasyse 180 mikrogramov bola miernej až strednej intenzity, pričom ich bolo možné zvládnuť bez potreby zmeny dávkovania alebo ukončenia liečby.
Chronická hepatitída B
V klinických štúdiách, ktoré skúmali 48-týždňovú liečbu a 24-týždňové sledovanie po liečbe bol bezpečnostný profil Pegasysu pri chronickej hepatitíde B podobný ako v prípade chronickej hepatitídy C. Frekvencia výskytu väčšiny nežiaducich reakcií, s výnimkou pyrexie, bola výrazne nižšia v prípade CHB liečenej Pegasysom v monoterapii v porovnaní s HCV pacientami liečenými s Pegasysom v monoterapii (pozri tabuľku 9). Nežiaduce účinky malo 88 % pacientov liečených
Pegasysom v porovnaní s 53 % pacientov v porovnávacej skupine s lamivudínom, kým 6 % pacientov liečených Pegasysom a 4% pacientov liečených lamivudínom mali závažné nežiaduce účinky počas štúdií. Nežiaduce účinky alebo abnormálne laboratórne hodnoty viedli u 5 % pacientov k ukončeniu
liečby v skupine liečenej Pegasysom, zatiaľ čo menej ako 1 % pacientov ukončilo liečbu v skupine liečenej lamivudínom z tých istých dôvodov. Percento pacientov s cirhózou, ktorí ukončili liečbu bolo podobné ako u pacientov v celkovej populácii v každej liečenej skupine.
Chronická hepatitída C u pacientov, ktorí neodpovedali na predchádzajúcu liečbu
U pacientov, ktorí neodpovedali na predchádzajúcu liečbu, bol bezpečnostný profil Pegasysu
v kombinácii s ribavirínom celkovo podobný ako u predtým neliečených pacientov. V klinickom skúšaní u pacientov, ktorí neodpovedali na predchádzajúcu liečbu pegylovaným interferónom
alfa-2b/ribavirínom, v ktorej boli pacienti podrobení buď 48-týždňovej, alebo 72-týždňovej liečbe, došlo kvôli nežiaducim udalostiam alebo laboratórnym odchýlkam k predčasnému ukončeniu liečby Pegasysom u 6 % pacientov a liečby ribavirínom u 7 % pacientov v skupine liečenej 48 týždňov a v skupine liečenej 72 týždňov z rovnakého dôvodu liečbu Pegasysom predčasne ukončilo 12 % pacientov a liečbu ribavirínom 13 % pacientov. Podobne aj u pacientov s cirhózou alebo prechodom
do cirhózy sa predčasné ukončenie liečby Pegasysom a liečby ribavirínom vyskytovalo častejšie v
skupine liečenej 72 týždňov (13 % a 15 %) než v skupine liečenej 48 týždňov (6 % a 6 %). Pacienti, ktorí kvôli hematologickej toxicite predčasne ukončili predchádzajúcu liečbu pegylovaným interferónom alfa-2b/ribavirínom, boli z účasti na tejto štúdii vylúčení.
V ďalšom klinickom skúšaní boli 48 týždňov liečení pacienti s pokročilou fibrózou alebo cirhózou (Ishakovo skóre 3 až 6), ktorí neodpovedali na predchádzajúcu liečbu a ktorí mali pred zaradením do štúdie počet trombocytov iba 50 000/mm3. Odchýlky laboratórnych hematologických parametrov pozorované počas prvých 20 týždňov štúdie zahŕňali anémiu (26 % pacientov malo hladinu hemoglobínu < 10 g/dl), neutropéniu (30 % pacientov malo ANC < 750/mm3) a trombocytopéniu
(13 % pacientov malo počet trombocytov < 50 000/mm3) (pozri časť 4.4).
Súčasná infekcia vírusom chronickej hepatitídy C a vírusom HIV
U pacientov súčasne infikovaných vírusmi HIV-HCV boli profily klinických nežiaducich reakcií pri liečbe Pegasysom samotným alebo v kombinácii s ribavirínom podobné ako profily u pacientov infikovaných len HCV. U HIV-HCV pacientov, ktorí dostávali Pegasys a ribavirín v kombinovanej liečbe, boli hlásené ďalšie nežiaduce účinky u ≥ 1 % až ≤ 2 % pacientov: hyperlaktacidémia/laktát acidóza, chrípka, pneumónia, psychická labilita, apatia, hučanie v ušiach, faryngolaryngeálna bolesť, zápal pery, získaná lipodystrofia a chromatúria. Liečba Pegasysom bola spojená s poklesom absolútneho počtu CD4+ buniek počas prvých 4 týždňov bez zníženia percenta CD4+ buniek. Pokles počtu CD4+ buniek bol po znížení dávky alebo po ukončení liečby reverzibilný. Používanie Pegasysu nemalo žiadny pozorovateľný negatívny vplyv na kontrolu HIV virémie počas liečby alebo následnom sledovaní pacientov. U koinfikovaných pacientov s počtom CD4+ buniek < 200/μl sú údaje
o bezpečnosti obmedzené.
Tabuľkový súhrn nežiaducich reakcií
V tabuľke 9 sú zhrnuté nežiaduce účinky hlásené u CHB alebo CHC pacientov pri liečbe Pegasysom
v monoterapii a u CHC pacientov liečených Pegasysom v kombinácii s ribavirínom. Nežiaduce účinky hlásené v klinických štúdiách sú zoradené do skupín podľa frekvencie a to nasledovne: veľmi časté
(≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až
< 1/1 000), veľmi zriedkavé (< 1/10 000). Frekvencia nežiaducich účinkov na základe spontánnych
hlásení vychádzajúcich zo skúseností po uvedení lieku na trh nie je známa (nemožno ju odhadnúť z dostupných údajov). V rámci jednotlivých skupín je frekvencia nežiaducich účinkov z hľadiska závažnosti usporiadaná v klesajúcom poradí.
Tabuľka 9: Nežiaduce účinky hlásené v klinických skúšaniach a po uvedení lieku na trh
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Infekcie a
nákazy
|
|
bronchitída,
infekcie horných dýchacích ciest, kandidóza
ústnej dutiny, herpes simplex, hubovité,
vírusové
a bakteriálne infekcie
|
pneumónia,
kožná infekcia
|
endokarditída,
zápal
vonkajšieho ucha
|
|
sepsa
|
Benígne a
malígne nádory
|
|
|
neoplazma
pečene
|
|
|
|
Poruchy krvi
a lymfatického systému
|
|
trombocytopéni
a, anémia, lymfadenopatia
|
|
pancytopénia
|
aplastická
anémia
|
izolovaná
aplázia červených krviniek
|
Poruchy
imunitného systému
|
|
|
sarkoidóza,
tyroiditída
|
anafylaxia,
systémový lupus erythematosus, reumatoidná artritída
|
idiopatická
alebo tromboticko- trombocyto- penická purpura
|
odvrhnutie
transplantá-tu pečene
a obličiek, Vogt- Koyanagi-
Harada
ochorenie
|
Poruchy
endokrinnéh o systému
|
|
hypotyreóza,
hypertyreóza
|
diabetes
|
diabetická
ketoacidóza
|
|
|
Poruchy
metabolizmu a výživy
|
anorexia
|
|
dehydratácia
|
|
|
|
Psychické
poruchy
|
depresia*,
úzkosť, nespavosť*
|
agresia, zmeny
nálady, emočné poruchy nervozita, pokles libida
|
samovražedn
é myšlienky, halucinácie
|
samovražda,
psychotická porucha
|
|
mánia,
bipolárne poruchy, myšlienky na vraždu
|
Poruchy
nervového systému
|
bolesť
hlavy, závrat*, zníženie
koncentrá-
cie
|
synkopa,
migréna, porucha pamäti slabosť,
hypoestézia,
hyperestézia, parestézia, tremor, porucha chuti, nočné mory, ospanlivosť
|
periférna neuropatia
|
kóma, kŕče, paréza tváre
|
|
cerebrálna ischémia
|
Poruchy oka
|
|
neostré videnie,
bolesť oka, zápal oka, xeroftalmia
|
krvácanie do
sietnice
|
zraková
neuropatia, papiloedém, poškodenie ciev sietnice, retinopatia, vred rohovky
|
strata zraku
|
serózne
odlúčenie sietnice
|
|
|
pri monoterapii Pegasysom u pacientov s HBV alebo s HCV alebo v kombinácii s ribavirínom u HCV pacientov
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Poruchy
ucha a labyrintu
|
|
vertigo, bolesť
ucha
|
strata sluchu
|
|
|
|
Poruchy
srdca a srdcovej činnosti
|
|
tachykardia,
periférny edém, palpitácie,
|
|
infarkt
myokardu, kongestívne zlyhanie srdca, kardiomyopatia, angína, arytmia, fibrilácia predsiene, perikarditída, supra - vertikulárna tachykardia
|
|
|
Poruchy ciev
|
|
sčervenanie
|
hypertenzia
|
krvácanie do
mozgu, vaskulitída
|
|
periférna
ischémia
|
Poruchy
dýchacej sústavy hrudníka amediastína
|
dýchavica
|
námahová
dýchavica, krvácanie
z nosa, zápal nosohltana,
kongescia
prínosných dutín, nádcha, kongescia nosovej sliznice, bolesť hrdla
|
sipot
|
intersticiálna
pneumónia, vrátane úmrtia, pľúcna embólia
|
|
|
Poruchy
gastrointesti nál-neho traktu
|
hnačka*,
nevoľnosť*, bolesť brucha*
|
vracanie,
dyspepsia, dysfágia, ulcerácia dutiny ústnej, krvácanie ďasien, glositída, stomatitída, plynatosť, sucho v ústach
|
gastrointestin
álne krvácanie
|
peptický vred,
pankreatitída
|
|
ischemická
kolitída
|
Poruchy
pečene a žlčových ciest
|
|
|
porucha
funkcie pečene
|
zlyhanie pečene,
cholangitída, stukovatenie pečene
|
|
|
Poruchy
kože a podkožného tkaniva
|
alopécia,
dermatití- da, svrbenie, suchá koža
|
psoriáza,
urtikária, ekzém, vyrážka, zvýšené potenie, kožná porucha, fotosenzitivita, nočné potenie
|
|
|
Stevens-
Johnsonov syndróm, toxická epidermálna nekrolýza, angioedém, erythema multiforme
|
|
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Poruchy
kostrovej a svalovej sústavy a
spojivového
tkaniva
|
myalgia,
artralgia
|
bolesť chrbta,
artritída, svalová slabosť, bolesť
kostí, bolesť
šije, bolesť svalov a kostrového systému, svalové kŕče
|
|
myozitída
|
|
rabdomyo- lýza
|
Poruchy
obličiek a močo- vých ciest
|
|
|
|
renálna
insuficiencia
|
|
|
Poruchy
reprodukčné ho systému a prsníkov
|
|
impotencia
|
|
|
|
|
Celkové
poruchy a reakcie
v mieste podania
|
pyrexia,
zimnica* bolesť*, asténia, únava, reakcia
v mieste podania injekcie*, citlivosť*
|
bolesť na
hrudníku, príznaky podobné chrípke, malátnosť, letargia, návaly tepla, smäd
|
|
|
|
|
Laboratórne
a funkčné vyšetrenia
|
|
úbytok
hmotnosti
|
|
|
|
|
Úrazy,
otravy a komplikácie liečebného postupu
|
|
|
|
predávkovanie
liekom
|
|
|
*Tieto nežiaduce reakcie boli časté (
≥1/100 až < 1/10) u CHB pacientov liečených Pegasysom v monoterapii.
Popis vybraných nežiaducich reakciíLaboratórne hodnoty
Liečbu Pegasysom sprevádzali nasledovné odchýlky laboratórnych parametrov: zvýšenie ALT, zvýšenie bilirubínu, poruchy rovnováhy elektrolytov (hypokaliémia, hypokalciémia, hypofosfatémia), hyperglykémia, hypoglykémia a zvýšenie triglyceridov (pozri časť 4.4). U oboch spôsobov liečby, t.j. pri použití Pegasysu v monoterapii aj v kombinácii s ribavirínom sa u 2 % pacientov pozoroval vzostup hladín ALT, ktorý si vyžiadal úpravu dávkovania alebo ukončenie liečby.
Liečba Pegasysom bola spojená s poklesom hematologických parametrov (leukopénia, neutropénia, lymfopénia, trombocytopénia a pokles hemoglobínu), ktoré sa po úprave dávkovania obyčajne zlepšili a vrátili na úroveň spred liečby v priebehu 4 - 8 týždňov po ukončení liečby (pozri časti 4.2 a 4.4).
Mierna neutropénia (ANC: 0,749 – 0,5 x 109/l) sa pozorovala u 24 % (216/887) pacientov a ťažká neutropénia (ANC: < 0,5 x 109/l) u 5 % (41/887) pacientov, ktorí dostávali Pegasys v dávke
180 mikrogramov v kombinácii s ribavirínom v dávke 1 000 mg alebo 1 200 mg počas 48 týždňov.
Protilátky proti interferónu
U 1 – 5 % pacientov liečených Pegasysom sa zistila prítomnosť neutralizačných protilátok. Podobne ako v prípade ďalších interferónov, vyšší výskyt neutralizačných protilátok sa pozoroval aj pri
chronickej hepatitíde B. Avšak pri žiadnej z týchto chorôb to nesúviselo s nedostatočnou terapeutickou
odpoveďou.
Funkcia štítnej žľazyLiečbu Pegasysom sprevádzali klinicky významné odchýlky hodnôt parametrov štítnej žľazy, ktoré si vyžadovali klinický zásah (pozri časť 4.4). Výskyt pozorovaných odchýlok (4,9 %) u pacientov
liečených Pegasysom v kombinácii s ribavirínom (NV15801) je podobný ako u pacientov liečených
inými interferónmi.
Laboratórne hodnoty u pacientov súčasne infikovaných vírusmi HIV-HCVHoci hematologická toxicita neutropénie, trombocytopénie a anémie sa vyskytovala častejšie u HIV- HCV pacientov, väčšina prípadov sa dala zvládnuť úpravou dávkovania a použitím rastových faktorov a vzácne došlo k predčasnému ukončeniu liečby. Pokles hladín ANC pod 500 buniek/mm3 sa
pozoroval u 13 % a 11 % pacientov, ktorí dostávali Pegasys v monoterapii a v kombinácii v uvedenom poradí. Pokles počtu krvných doštičiek pod 50 000/mm3 sa pozoroval u 10 % a 8 % pacientov, ktorí dostávali Pegasys v monoterapii a v kombinácii v uvedenom poradí. Anémia (hemoglobín < 10 g/dl)
sa popísala u 7 % a 14 % pacientov liečených Pegasysom v monoterapii a v kombinácii v uvedenom
poradí.
Pediatrická populácia
Chronická hepatitída CV klinickom skúšaní so 114 pediatrickými pacientmi (vo veku 5 až 17 rokov) liečenými samotným Pegasysom alebo v kombinácii s ribavirínom (pozri časť 5.1) boli úpravy dávky potrebné u približne jednej tretiny pacientov najčastejšie kvôli neutropénii a anémii. Vo všeobecnosti bol bezpečnostný profil pozorovaný u pediatrických pacientov podobný ako profil pozorovaný u dospelých. V pediatrickej śtúdii najrozšírenejšie nežiaduce reakcie u pacientov liečených kombinovanou liečbou Pegasysom a ribavirínom počas až 48 týždňov boli ochorenie podobné chrípke (91 %), bolesť hlavy (64 %), gastrointestinálne ochorenie (56 %) a reakcie v mieste podania injekcie (45 %). Úplný zoznam nežiaducich reakcií hlásených v tejto liečebnej skupine (n = 55) je uvedený v tabuľke 10. Sedem pacientov užívajúcich kombinovanú liečbu Pegasysom a ribavirínom počas 48 týždňov prerušilo
liečbu s bezpečnostných dôvodov (depresia, abnormálne hodnotenie psychického stavu, prechodná slepota, exudáty na sietnici , hyperglykémia, diabetes mellitus typu 1 a anémia). Väčšina nežiaducich reakcií zaznamenaných v štúdii bola mierna alebo stredne závažná. Závažné nežiaduce reakcie sa zaznamenali u 2 pacientov v skupine s kombinovanou liečbou Pegasysom plus ribavirín (hyperglykémia a cholecystektómia).
Tabuľka 10: Nežiaduce reakcie hlásené u pediatrických pacientov infikovaných vírusom HCVpripisované Pegasysu plus ribavirínu v štúdii NV17424Telový systém
| Veľmi časté
| Časté
|
Infekcie a nákazy
|
| infekčná mononukleóza,
streptokoková faryngitída, chrípka, vírusová gastroenteritída, kandidóza, gastroenteritída, zubný absces, hordeolum, infekcia močových ciest, zápal nosohltana
|
Poruchy krvi a lymfatického
systému
|
| anémia
|
Poruchy metabolizmu a výživy
| zníženie chute do jedla
| hyperglykémia, diabetes mellitus
typu 1
|
T
elový systém
|
V
eľmi časté
|
Č
asté
|
Psychické poruchy
|
insomnia
|
depresia, úzkosť, halucinácie,
nenormálne správanie, agresia, hnev, zníženie pozornosti/neusporiadaná hyperaktivita
|
Poruchy nervového systému
|
bolesť hlavy
|
závrat, porucha pozornosti, migréna
|
Poruchy oka
|
|
prechodná slepota, exudáty na
sietnici, zhoršenie videnia, podráždenie oka, bolesť oka, svrbenie oka
|
Poruchy ucha a labyrintu
|
|
bolesť ucha
|
Poruchy dýchacej sústavy, hrudníka
a mediastína
|
|
dyspnoe, epistaxa
|
Poruchy gastrointestinálneho traktu
|
gastrointestinálna porucha
|
bolesť v nadbrušku, stomatitída,
nevoľnosť, aftózna stomatitída, orálna porucha
|
Poruchy kože a
podkožného tkaniva
|
vyrážka, svrbenie, alopécia
|
opuch tváre, liekový exantém
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
|
muskuloskeletálna bolesť
|
bolesť chrbta, bolesť končatín
|
Poruchy obličiek a močových ciest
|
|
dyzúria, inkontinencia, porucha
močového traktu
|
Poruchy reprodukčného systému a
prsníkov
|
|
výtok z pošvy
|
Celkové poruchy a reakcie v mieste
podania
|
ochorenie podobné chrípke, reakcia
v mieste podania injekcie, iritabilita, únava
|
horúčka, hematóm v mieste podania
injekcie do žily, , bolesť
|
Laboratórne a funkčné vyšetrenia
|
|
abnormálny psychiatrický nález
|
Chirurgické a liečebné postupy
|
|
extrakcia zuba, cholecystektómia
|
Sociálne podmienky
|
|
problém s učením
|
U pediatrických pacientov sa pozorovala inhibícia rastu (pozri časť 4.4). U pediatrických pacientov
liečených kombinovanou liečbou Pegasysom plus ribavirín sa preukázalo oneskorenie v priberaní hmotnosti a narastaní do výšky po 48 týždňoch liečby v porovnaní s východiskovým stavom. Percentily hmotnosti a výšky osoby normálnej populácie sa počas liečby znížili. Na konci 2-ročného sledovania po liečbe sa väčšina jedincov vrátila k východiskovým percentilom normálnej rastovej krivky pre hmotnosť a výšku (priemerný percentil hmotnosti pre vek bol 64 % na začiatku a 60 % 2 roky po liečbe; priemerný percentil výšky bol 54 % na začiatku a 56 % 2 roky po liečbe). Na konci liečby sa u 43 % jedincov znížil percentil hmotnosti o 15 percentilov alebo viac a u 25 % sa znížil percentil výšky o 15 percentilov alebo viac na normálnej rastovej krivke. 2 roky po liečbe bolo 16 % osôb stále 15 percentilov alebo viac pod svojou východiskovou krivkou hmotnosti a 11 % 15 percentilov alebo viac pod svojou východiskovou krivkou výšky.
Laboratórne hodnotyZníženie hemoglobínu, neutrofilov a trombocytov môže vyžadovať zníženie dávky alebo trvalé vysadenie liečby (pozri tabuľku 3 a tabuľku 7). Väčšina laboratórnych anomálií zaznamenaných počas klinického skúšania sa v krátkej dobe po ukončení liečby vrátila na východiskovú úroveň.
4.9 PredávkovanieOpísali sa prípady predávkovania v rozsahu od dvoch injekcií podaných počas 2 nasledujúcich dní
(namiesto týždenného intervalu) až po každodenné podávanie injekcií počas 1 týždňa (t.j.
1 260 mikrogramov/týždeň). U žiadneho z týchto pacientov sa neobjavili nezvyčajné resp. závažné alebo liečbu limitujúce udalosti. V klinických štúdiách pri karcinóme obličiek a chronickej myeloidnej leukémii sa podávali týždenné dávky až do 540 mikrogramov a 630 mikrogramov. Medzi toxické prejavy limitujúce dávkovanie patrila únava, elevácia pečeňových enzýmov, neutropénia, trombocytopénia, čo zodpovedá interferónovej liečbe.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Imunostimulanciá, interferóny, ATC kód: L03A B11
Spôsob účinku
Konjugácia reagentu PEG (bis-monometoxypolyetylénglykol) s interferónom alfa-2a vedie k vzniku
pegylovaného interferónu alfa-2a (Pegasys). Pegasys in vitro vykazuje antivírusové a antiproliferatívne účinky, ktoré sú charakteristické pre interferón alfa-2a.
Interferón alfa-2a je konjugovaný s bis-[monometoxypolyetylénglykolom] v rozsahu substitúcie jedného mólu polyméru/mól bielkoviny. Priemerná molekulová hmotnosť je asi 60 000, z ktorej podiel bielkoviny tvorí približne 20 000.
Farmakodynamické účinky
U pacientov s hepatitídou C reagujúcich na liečbu Pegasysom 180 mikrogramov dochádza
k bifázickému poklesu hladín HCV RNA. Prvá fáza poklesu sa objavuje 24 až 36 hodín po prvej dávke Pegasysu. Po nej dochádza k druhej fáze poklesu, ktorá pretrváva počas nasledovných 4 - 16 týždňov u pacientov, ktorí dosiahnu pretrvávajúcu odpoveď na liečbu. Ribavirín nemá žiadny významný vplyv na začiatočnú vírusovú kinetiku počas prvých 4 až 6 týždňov u pacientov liečených kombináciou ribavirínu a pegylovaného interferónu alfa-2a alebo interferónu alfa.
Klinická účinnosť a bezpečnosť
Chronická hepatitída B:
Na všetkých klinických skúšaniach sa zúčastnili pacienti s chronickou hepatitídou B, u ktorých sa
zistila aktívna vírusová replikácia meraná ako HBV DNA, zvýšené hladiny ALT a biopsia pečene bola konzistentná s chronickou hepatitídou. V štúdii WV16240 sa zúčastnili pacienti, ktorí boli pozitívni na HBeAg, zatiaľ čo v štúdii WV16241 sa zúčastnili pacienti, ktorí boli negatívni na HBeAg a pozitívni na anti-HBe. V obidvoch štúdiách liečba trvala 48 týždňov a sledovanie po liečbe trvalo 24 týždňov. V obidvoch štúdiách sa porovnával Pegasys plus placebo vs. Pegasys plus lamivudín vs. lamivudín v monoterapii. Do týchto klinických skúšaní neboli zaradení pacienti s HBV-HIV koinfekciou.
Miery odpovedí na konci sledovania u týchto dvoch štúdií sú uvedené v tabuľke 11. V štúdii WV16240, primárne koncové ukazovatele na hodnotenie účinnosti boli HBeAg sérokonverzia a HBV- DNA pod 105 kópií/ml. V štúdii WV16241, primárne koncové ukazovatele na hodnotenie účinnosti boli normalizácia ALT a HBV-DNA pod 2 x 104 kópií/ml. HBV DNA sa merala pomocou testu COBAS AMPLICORTM HBV MONITOR (hranica detekcie 200 kópií/ml).
Celkove 283/1351 (21 %) pacientov malo pokročilú fibrózu alebo cirhózu, 85/1351 (6 %) malo cirhózu. Neboli rozdiely v miere odpovede medzi týmito pacientmi a tými bez pokročilej fibrózy alebo cirhózy.
Tabuľka 11: Sérologická, virologická a biochemická odpoveď pri chronickej hepatitíde B
|
HBeAg-pozitívni pacienti
Štúdia WV16240
|
HBeAg-negatívni / anti-HBe-pozitívni pacienti
Štúdia WV16241
|
Parameter odpovede
|
Pegasys
180 µg
&
placebo
(N = 271)
|
Pegasys
180 µg
&
lamivudín
100 mg
(N = 271)
|
lamivudín
100 mg
(N = 272)
|
Pegasys
180 µg
&
placebo
(N = 177)
|
Pegasys
180 µg
&
lamivudín
100 mg
(N = 179)
|
lamivudín
100 mg
(N = 181)
|
HBeAg
sérokonverzia
|
32 %#
|
27 %
|
19 %
|
N/A
|
N/A
|
N/A
|
HBV DNA
odpoveď*
|
32 %#
|
34 %
|
22 %
|
43 %#
|
44 %
|
29 %
|
ALT
normalizácia
|
41 %#
|
39 %
|
28 %
|
59 %#
|
60 %
|
44 %
|
HBsAg
sérokonverzia
|
3 %#
|
3 %
|
0 %
|
3 %
|
2 %
|
0 %
|
|
|
* Pre HBeAg-pozitívnych pacientov: HBV DNA < 105 kópií/ml
Pre HBeAg-negatívnych / anti-HBe-pozitívnych pacientov: HBV DNA < 2 x 104 kópií/ml
# p-hodnota (vs. lamivudín) ≤ 0,01 (stratifikovaný Cochran-Mantel-Haenszelov test)
Histologická odpoveď bola v každej štúdii vo všetkých troch liečebných skupinách podobná; avšak pacienti, u ktorých sa dokázala trvalá odpoveď 24 týždňov po ukončení liečby, s oveľa vyššou pravdepodobnosťou dosiahli tiež histologické zlepšenie.
Všetci pacienti, ktorí ukončili štúdie fázy III, boli vhodní na zaradenie do štúdie s dlhodobým sledovaním (WV16866). V skupine pacientov v štúdii WV16240, ktorí dostávali Pegasys
v monoterapii a boli zaradení do štúdie s dlhodobým sledovaním, stupeň trvalej HBeAg sérokonverzie
12 mesiacov po ukončení terapie bol 48 % (73/153). U pacientov, ktorí dostávali Pegasys
v monoterapii v štúdii WV16241, stupeň HBV DNA odpovede a normalizácie ALT 12 mesiacov po ukončení liečby bol 42 % (41/97) a 59 % (58/99).
Chronická hepatitída CPredpoklad odpovede na liečbuPozrite si časť 4.2 v tabuľke 2.
Závislosť odpovede na liečbu od dávky pri monoterapiiPri priamom porovnaní dávok 90 mikrogramov a 180 mikrogramov bola dávka 180 mikrogramov spojená s lepšou pretrvávajúcou virologickou odpoveďou na liečbu u pacientov s cirhózou, avšak
v štúdii s pacientmi bez cirhózy sa pri dávkach 135 mikrogramov a 180 mikrogramov dosiahli veľmi podobné výsledky.
Potvrdzujúce klinické štúdie u dospelých predtým neliečených pacientovVšetky klinické štúdie zahŕňali pacientov, ktorí predtým nedostávali interferón a u ktorých sa chronická hepatitída C potvrdila prítomnosťou detekovateľných hladín HCV RNA v sére, zvýšenými hladinami ALT (s výnimkou štúdie NR16071) a biopsiou pečene s nálezom chronickej hepatitídy.
Štúdia NV15495 špecificky zahŕňala pacientov s diagnózou cirhózy (približne 80 %) alebo prechodu
do cirhózy (približne 20 %), ktoré sa potvrdili histologicky. Do štúdie NR15961 sa zahrnuli len HIV- HCV koinfikovaní pacienti(pozri tabuľku 20). Títo pacienti mali stabilné HIV ochorenie a priemer počtu CD4 T-buniek bol okolo 500 buniek/μl.
Údaje o liečebných režimoch, dĺžke trvania liečby a výsledkoch štúdií u HCV monoinfikovaných
pacientov a HIV-HCV koinfikovaných pacientov sa uvádzajú v tabuľkách 12, 13, 14 a v tabuľke 20.
Virologická odpoveď na liečbu sa definovala ako nemerateľné hladiny HCV RNA pri vyšetrení COBAS AMPLICOR™ HCV Test, Version 2.0 (detekčný limit: 100 kópií/ml, čo zodpovedá 50 medzinárodným jednotkám/ml). Trvalá odpoveď sa definovala ako jedna negatívna vzorka približne 6 mesiacov po ukončení liečby.
Tabuľka 12: Virologická odpoveď u HCV pacientov
| Monoterapia Pegasysom
| Kombinovaná liečba Pegasysom
|
pacienti s cirhózou aj bez nej
| Pacienti s cirhózou
| pacienti s cirhózou aj bez nej
|
Štúdia NV15496 + NV15497 + NV15801
| Štúdia NV15495
| Štúdia
NV15942
| Štúdia NV15801
|
Pegasys
180 µg
(N = 701)
48 týždňov
| interferón alfa-2a
6 MIU/3 MIU
&
3 MIU
(N = 478)
48 týždňov
| Pegasys
180 µg
(N = 87)
48 týždňov
| interferón alfa-2a
3 MIU
(N = 88)
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200
mg
(N = 436)
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
(N = 453)
48 týždňov
| interferón alfa-2b
3 MIU
&
ribavirín
1000/1200
mg
(N = 444)
48 týždňov
|
Odpoveď
na konci liečby
|
55 - 69 %
|
22 - 28 %
|
44 %
|
14 %
|
68 %
|
69 %
|
52 %
|
Celková
trvalá odpoveď
|
28 - 39 %
|
11 - 19 %
|
30 %∗
|
8 %∗
|
63 %
|
54 %∗∗
|
45 %∗∗
|
∗ 95 % CI pre rozdiel: 11 % až 33 % p = 0,001 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
∗∗ 95 % CI pre rozdiel: 3 % až 16 % p = 0,003 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
Virologické odpovede na liečbu vo vzťahu ku genotypu a vírusovej záťaži pred liečbou u HCV monoinfikovaných pacientov liečených Pegasysom v kombinácii s ribavirínom a v závislosti na genotype, vírusovej záťaži pred liečbou a rýchlej virologickej odpovede v 4. týždni sú zhrnuté
v tabuľke 13 a v tabuľke 14. Výsledky štúdie NV15942 poskytujú racionálne podklady pre odporúčania liečebných režimov na základe genotypu, vírusovej záťaže na začiatku liečby a virologickej odpovede v 4. týždni (pozri tabuľky 1, 13 a 14).
Rozdiel medzi liečebnými režimami nebol vo všeobecnosti ovplyvnený prítomnosťou/neprítomnosťou cirhózy; preto tieto základné charakteristiky neovplyvňujú tieto odporúčania pre liečbu pre genotypy
1, 2 alebo 3.
Tabuľka 13: Trvalá virologická odpoveď u HCV pacientov po kombinovanej liečbe Pegasysom a ribavirínom v závislosti na genotype a vírusovej záťaži pred liečbou
|
Štúdia NV15942
|
Štúdia NV15801
|
Pegasys
180 µg
&
ribavirín
800 mg
24 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
|
Pegasys
180 µg
&
ribavirín
800 mg
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Interferón alfa-
2b
3 MIU
&
ribavirín
1000/1200 mg
48 týždňov
|
Genotyp 1
Nízka
vírusová záťaž
Vysoká vírusová záťaž
|
29 %(29/101)
41 %(21/51)
16 %(8/50)
|
42 %(49/118) ∗
52 %(37/71)
26 %(12/47)
|
41 %(102/250) ∗
55 %(33/60)
36 %(69/190)
|
52 %(142/271) ∗
65 %(55/85)
47 %(87/186)
|
45 %(134/298)
53 %(61/115)
40 %(73/182)
|
36 %(103/285)
44 %(41/94)
33 %(62/189)
|
Genotyp 2/3
Nízka
vírusová záťaž
Vysoká vírusová záťaž
|
84 %(81/96)
85 %(29/34)
84 %(52/62)
|
81 %(117/144)
83 %(39/47)
80 %(78/97)
|
79 %(78/99)
88 %(29/33)
74 %(49/66)
|
80 %(123/153)
77 %(37/48)
82 %(86/105)
|
71 %(100/140)
76 %(28/37)
70 %(72/103)
|
61 %(88/145)
65 %(34/52)
58 %(54/93)
|
Genotyp 4
|
(0/5)
|
(8/12)
|
(5/8)
|
(9/11)
|
(10/13)
|
(5/11)
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; Vysoká víusová záťaž = > 800 000 IU/ml
* Pegasys 180 µg& ribavirín 1000/1200 mg, 48 týždňov v porovnaní s Pegasysom 180 µg & ribavirínom 800 mg 48 týždňov: Odds Ratio (95 % CI) = 1,52 (1,07 až 2,17), p=0,020 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
* Pegasys 180 µg & ribavirín 1000/1200 mg, 48 týždňov v porovnaní s Pegasysom 180 µg & ribavirínom 1000/1200 mg,
24 týždňov: Odds Ratio (95 % CI) = 2,12 (1,30 až 3,46), p=0,002 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
Možnosť zvážiť skrátenie dĺžky trvania liečby na 24 týždňov u pacientov s genotypom 1 a 4 sa sledovala na podklade dosiahnutej trvalej virologickej odpovede u pacientov s rýchlou virologickou odpoveďou v 4. týždni v štúdiách NV15942 a ML17131 (pozri tabuľku 14).
Tabuľka 14: Trvalá virologická odpoveď v závislosti na rýchlej virologickej odpovedi v 4. týždni pre genotyp1 a 4 po kombinovanej liečbe Pegasysom a ribavirínom u HCV pacientovŠtúdia NV15942
| Štúdia ML17131
|
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
|
Genotyp 1
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 90 % (28/31)
93 % (25/27)
75 % (3/4)
| 92 % (47/51)
96 % (26/27)
88 % (21/24)
| 77 % (59/77)
80 % (52/65)
58 % (7/12)
|
Genotyp 1 nie RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 24 % (21/87)
27 % (12/44)
21 % (9/43)
| 43 % (95/220)
50 % (31/62)
41 % (64/158)
| -
-
-
|
Genotyp 4 RVR
| (5/6)
| (5/5)
| 92 % (22/24)
|
Genotyp 4 nie RVR
| (3/6)
| (4/6)
| -
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; Vysoká vírusová záťaž = > 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedegovateľná HCV RNA) v 4. týždni a nedegovateľná HCV RNA v 24 týždni.
Údaje, i keď obmedzené, ukazujú, že skrátenie času na 24 týždňov, sa môže spájať s vysokým rizikom relapsu (pozri tabuľku 15).
|
Štúdia NV15942
|
Štúdia NV15801
|
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Genotyp 1 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
6,7 % (2/30)
3,8 % (1/26)
25 % (1/4)
|
4,3 % (2/47)
0 % (0/25)
9,1 % (2/22)
|
0 % (0/24)
0 % (0/17)
0 % (0/7)
|
Genotyp 4 RVR
|
(0/5)
|
(0/5)
|
0 % (0/4)
|
|
|
Tabuľka 15: Relaps vo virologickej odpovedi na konci liečby u populácie s rýchlou virologickou odpoveďou
Možnosť skrátenia liečby na 16 týždňov u pacientov genotypu 2 alebo 3 bola skúmaná na základe
trvalej virologickej odpovede pozorovanej u pacientov s rýchlou virologickou odpoveďou v 4. týždni v štúdii NV17317 (pozri tabuľku 16).
V štúdii NV17317 všetci pacienti infikovaní vírusovým genotypom 2 alebo 3 dostávali Pegasys
180 μg subkutánne raz týždenne a ribavirín v dávke 800 mg a boli randomizovaní na liečbu počas 16
alebo 24 týždňov. Celková liečba počas 16 týždňov viedla ku nižšej trvalej virologickej odpovedi
(65 %) než liečba počas 24 týždňov (76 %) (p<0,0001).
Trvalá virologická odpoveď dosiahnutá po 16. týždňoch liečby a po 24. týždňoch liečby sa sledovala retrospektívnou analýzou pacientov, ktorí boli HCV RNA negatívni v 4. týždni a mali iniciálne LVL (pozri tabuľku 16).
Tabuľka 16: Trvalá virologická odpoveď celkovo a na základe rýchlej virologickej odpovede vŠtúdia NV17317
| a
| Pegasys 180 µg
&
ribavirín
800 mg
16 týždňov
| Pegasys 180 µg
&
ribavirín
800 mg
24 týždňov
| Rozdiel v liečbe
[95 %CI]
| p-hodnota
| Genotyp 2 alebo 3
| 65 % (443/679)
| 76 % (478/630)
| -10,6 % [-15,5 %; -0,06 %]
| p<0,0001
| Genotyp 2 alebo 3 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 82 % (378/461)
89 % (147/166)
78 % (231/295)
| 90 % (370/410)
94 % (141/150)
88 % (229/260)
| -8,2 % [-12,8 %; -3,7 %]
-5,4 % [-12 %; 0,9 %]
-9,7 % [-15,9 %;-3,6 %]
| p=0,0006
p=0,11
p=0,002
|
|
|
4. týždni pre genotyp alebo 3 po kombinovanej liečbe liekom Pegasysom s ribavirínom u HCV pacientovNízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž => 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedetegovateľné hladiny HCV RNA) v 4. týždni
V súčasnosti nie je jasné, či vyššia dávka ribavirínu (napr. 1 000/2 000 mg/deň podľa telesnej hmotnosti) vedie k vyššej trvalej virologickej odpovedi (SVR) než dávka 800 mg/deň, keď je liečba skrátená na 16 týždňov.
Údaje naznačujú, že skrátenie liečby na 16 týždňov sa môže spájať so zvýšeným rizikom relapsu(pozri tabuľku 17).
Tabuľka 17: Relaps vo virologickej odpovedi po ukončení liečby u pacientov genotypu 2 alebo 3s rýchlou virologickou odpoveďou Štúdia NV17317
Štúdia NV17317
|
Pegasys
180 µg
&
ribavirín
800 mg
16 týždňov
|
Pegasys
180 µg
&
ribavirín
800 mg
24 týždňov
|
Rozdiel v liečbe
[95 %CI]
|
p hodnota
|
Genotyp 2 alebo 3 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
15 % (67/439)
6 % (10/155)
20 % (57/284)
|
6 % (23/386)
1 % (2/141)
9 % (21/245)
|
9,3 % [5,2 %; 13,6 %]
5 % [0,6 % ; 10,3 %]
11,5 % [5,6 % ; 17,4 %]
|
p<0,0001
p=0,04
p=0,0002
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž = > 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedetegovateľné hladiny HCV RNA) v 4. týždni
Lepšia účinnosť Pegasysu v porovnaní s interferónom alfa-2a sa ukázala aj na histologickej odpovedi, vrátane pacientov s cirhózou a/alebo HIV-HCV koinfekciou.
Dospelí pacienti s chronickou hepatitídou C, ktorí neodpovedali na predchádzajúcu liečbu V štúdii MV17150 boli pacienti, ktorí neodpovedali na predchádzajú liečbu pegylovaným interferónom alfa-2b a ribavirínom, boli randomizovaní do štyroch rôznych liečebných skupín:
• Pegasys 360 µg/týždeň počas 12 týždňov a následne 180 µg/týždeň počas ďalších 60 týždňov;
• Pegasys 360 µg/týždeň počas 12 týždňov a následne 180 µg/týždeň počas ďalších 36 týždňov;
• Pegasys 180 µg/týždeň počas 72 týždňov;
• Pegasys 180 µg/týždeň počas 48 týždňov.
Všetci pacienti užívali ribavirín (1 000 alebo 1 200 mg/deň) v kombinácii s Pegasysom. Všetky
liečebné skupiny boli následne sledované počas 24-týždňového obdobia bez liečby.
Na základe viacnásobnej regresnej analýzy a súhrnnej skupinovej analýzy hodnotiacej vplyv dĺžky trvania liečby a podávania indukčnej dávky sa jednoznačne stanovilo, že liečba v trvaní 72 týždňov je primárnym faktorom dosiahnutia trvalej virologickej odpovede. Rozdiely v trvalej virologickej odpovedi (SVR) podmienené dĺžkou trvania liečby, demografickými ukazovateľmi a najlepšími odpoveďami na predchádzajúcu liečbu sú uvedené v tabuľke 18.
| Štúdia MV17150
|
|
|
| Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
72 alebo 48 týždňov
(N = 942)
pacienti s
VR v týždni 12 a
(N = 876)
| Pegasys 360/180
alebo 180 μg
&
ribavirín
1000/1200 mg
72 týždňov
(N = 473)
SVR u pacientov s VR v týždni 12 b (N = 100)
| Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
48 týždňov
(N = 469)
SVR u pacientov s VR v týždni 12 b (N = 57)
| Celková trvalá odpoveď
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 18 % (157/876)
35 % (56/159)
14 % (97/686)
| 57 % (57/100)
63 % (22/35)
54 % (34/63)
| 35 % (20/57)
38 % (8/21)
32 % (11/34)
| Genotyp 1/4
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 17 % (140/846)
35 % (54/154)
13 % (84/663)
| 55 % (52/94)
63 % (22/35)
52 % (30/58)
| 35 % (16/46)
37 % (7/19)
35 % (9/26)
| Genotyp 2/3
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 58 % (15/26)
(2/5) (11/19)
| (4/5)
—
(3/4)
| (3/10)
(1/2) (1/7)
| Prítomnosť cirhózy
Cirhóza
Neprítomnosť cirhózy
|
8 % (19/239)
22 % (137/633)
|
(6/13)
59 % (51/87)
|
(3/6)
34 % (17/50)
|
|
|
Tabuľka 18: Virologická odpoveď v 12. týždni (VR) a trvalá virologická odpoveď (SVR) u pacientov, ktorí neodpovedali na liečbu kombináciou peginterferónu alfa-2b a ribavirínu a ktorí dosiahli virologickú odpoveď v 12. týždni po liečbe kombináciou Pegasysu a ribavirínu
|
Štúdia MV17150
|
|
|
|
Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
72 alebo 48 týždňov (N = 942) pacienti s
VR v týždni 12 a
(N = 876)
|
Pegasys 360/180
alebo 180 μg
&
ribavirín
1000/1200 mg
72 týždňov
(N = 473)
SVR u pacientov s VR v týždni 12 b (N = 100)
|
Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
48 týždňov
(N = 469)
SVR u pacientov s VR v týždni 12 b (N = 57)
|
Najlepšia odpoveď počas predchádzajúcej liečby
Pokles u HCV RNA ≥2log10
Pokles u HCV RNA <2log10
Chýbanie najlepšej odpovede
|
28 % (34/121)
12 % (39/323)
19 % (84/432)
|
68 % (15/22)
64 % (16/25)
49 % (26/53)
|
(6/12) (5/14)
29 % (9/31)
|
Vysoká vírusová záťaž = > 800 000 IU/ml, nízka vírusová záťaž = ≤ 800 000 IU/ml;
a Pacienti, ktorí dosiahli potlačenie aktivity vírusu v 12. týždni (nedetegovateľná HCV RNA definovaná ako <50 IU/ml) boli považovaní za pacientov s dosiahnutou virologickou odpoveďou v 12. týždni. Pacienti, ktorým chýbali výsledky HCV
RNA v 12. týždni boli vylúčení z analýzy.
b Pacienti, ktorí dosiahli potlačenie aktivity vírusu v 12. týždni, ale chýbali im výsledky HCV RNA na konci sledovania boli považovaní za pacientov, neodpovedajúcich na liečbu.
V štúdii HALT-C boli pacienti s chronickou hepatitídou C a pokročilou fibrózou alebo cirhózou, ktorí neodpovedali na predchádzajúcu liečbu interferónom alfa alebo pegylovaným interferónom alfa
v monoterapii alebo v kombinácii s ribavirínom, liečení Pegasysom 180 µg/týždeň a ribavirínom
1 000/1 200 mg denne. Pacienti, ktorí po 20 týždňoch liečby dosiahli nedetegovateľné hladiny
HCV RNA, pokračovali v kombinovanej liečbe Pegasysom a ribavirínom trvajúcej celkovo
48 týždňov a po ukončení liečby boli sledovaní 24 týždňov. Pravdepodobnosť trvalej virologickej odpovede sa líšila v závislosti od predchádzajúceho režimu liečby; pozri tabuľku 19.
 Tabuľka 19: Trvalá virologická odpoveď v štúdii HALT-C uvedená podľa predchádzajúcehorežimu liečby u pacientov, ktorí naň neodpovedaliPredchádzajúca liečba Pegasys
Tabuľka 19: Trvalá virologická odpoveď v štúdii HALT-C uvedená podľa predchádzajúcehorežimu liečby u pacientov, ktorí naň neodpovedaliPredchádzajúca liečba Pegasys 180 µg a
 ribavirín
ribavirín 1 000/1 200 mg počas 48 týždňov
Interferón 27 % (70/255)
Pegylovaný interferón 34 % (13/38)
Interferón a ribavirín 13 % (90/692)
Pegylovaný interferón a ribavirín 11 % (7/61) HIV-HCV koinfikovaní pacientiVirologické odpovede u pacientov, ktorí sú liečení s Pegasysom v monoterapii a s Pegasysom a ribavirínom v kombinácii v závislosti na genotype a vírusovej záťaži pred liečbou pre HIV-HCV koinfikovaných pacientov sú zhrnuté nižšie v tabuľke 20.
Tabuľka 20: Trvalá virologická odpoveď po liečbe Pegasysom v kombinácii s ribavirínom v závislosti na genotype a vírusovej záťaži u HIV-HCVsúčasne infikovaných pacientov pred liečbouŠtúdia NR15961
|
| Interferón alfa-2a
3 MIU
&
ribavirín 800 mg
48 týždňov
| Pegasys
180 µg
&
placebo
48 týždňov
| Pegasys
180 µg
&
ribavirín 800 mg
48 týždňov
|
Všetci pacienti
| 12 % (33/285)*
| 20 % (58/286) *
| 40 % (116/289) *
|
Genotyp 1
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
7 % (12/171)
19 % (8/42)
3% (4/129)
|
14 % (24/175)
38 % (17/45)
5 % (7/130)
|
29 % (51/176)
61 % (28/46)
18 % (23/130)
|
Genotyp 2-3
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
20 % (18/89)
27 % (8/30)
17 % (10/59)
|
36 % (32/90)
38 % (9/24)
35 % (23/66)
|
62% (59/95)
61 % (17/28)
63 % (42/67)
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; Vysoká vírusová záťaž = > 800 000 IU/ml
* Pegasys 180 µg, ribavirín 800 mg oproti Interferón alfa-2a 3 MIU, ribavirín 800 mg: Pomer pravdepodobnosti (95 % IS)=5,40 (3,42 – 8,54),… p-hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= <0,0001
* Pegasys 180 µg, ribavirín 800 mg oproti Pegasys 180 µg. Pomer pravdepodobnosti (95 % IS)=2,89 (1,93 – 4,32),… p- hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= <0,0001
* Interferón alfa-2a 3 MIU, ribavirín 800 mg oproti Pegasys 180 µg: Pomer pravdepodobnosti (95 % IS)=0,53 (0,33 –
0,85),… p-hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= <0,0084
Nasledujúca štúdia (NV18209) u pacientov s koinfekciou HCV genotyp 1 a HIV porovnávala liečbu Pegasysom 180 µg týždenne s dávkou ribavirínu 800 mg alebo s dávkou ribavirínu 1 000 mg (<75 kg telesnej hmotnosti)/1 200 mg (≥75 kg telesnej hmotnosti) denne počas 48 týždňov. Štúdia nebola dizajnovaná na preukázanie účinnosti. Bezpečnostné profily u obidvoch skupín s ribavirínom boli konzistentné so známym bezpečnostným profilom pri kombinovanej liečbe Pegasysom a ribavirínom
a nepoukazujú na žiadne relevantné rozdiely, okrem mierneho nárastu anémie v skupine s vyššou dávkou ribavínu.
HCV pacienti s normálnymi hladinami ALTV štúdii NR16071 náhodne vybratí HCV pacienti s normálnymi hodnotami ALT užívali Pegasys
180 µg/týždeň a ribavirín 800 mg/deň počas 24 alebo 48 týždňov. Potom nasledoval 24 týždňové obdobie bez liečby alebo pacienti boli bez liečby po dobu 72 týždňov. SVR popisované v liečebných ramenách tejto štúdie boli podobné zodpovedajúcim liečebným ramenám zo štúdie NV15942.
Pediatrická populácia
V riešiteľom sponzorovanej klinickej štúdii CHIPS (Chronic Hepatitis C International Paediatric Study) 65 pediatrických pacientov (6-18 rokov) s chronickou HCV infekciou boli pacienti liečení Pegasysom 100 μg/m2 s.c. raz týždenne a ribavirínom 15 mg/kg/deň 24 týždňov (genotypy 2 a 3) alebo 48 týždňov (všetky iné genotypy). Predbežné a obmedzené údaje bezpečnosti neukázali žiadny evidentný odklon od známeho profilu bezpečnosti pri kombinovanej liečbe u dospelých pacientov s chronickou HCV infekciou, ale, dôležité je, že nebol hlásený potenciálny nárast. Výsledky účinnosti boli podobné výsledkom hlásených u dospelých.
V štúdii NV17424 (PEDS-C) boli predtým neliečení pediatrickí pacienti vo veku 5 až 17 rokov (55 % vo veku < 12 rokov) s kompenzovanou chronickou hepatitídou C a detekovateľnou HCV RNA liečení Pegasysom v dávke180 μg/1,73 m2 plochy povrchu tela jedenkrát týždenne počas 48 týždňov s alebo bez ribavirínu v dávke 15 mg/kg/deň. Všetci pacienti boli po liečbe sledovaní počas 24 týždňov. Celkovo 55 pacientov bolo liečených úvodnou kombinovanou liečbou Pegasysom plus ribavirín, z nich 51 % bolo žien, 82 % belochov a 82 % bolo infikovaných vírusom HCV genotyp 1. Výsledky štúdie účinnosti u týchto pacientov sú zhrnuté v tabuľke 21.
Tabuľka 21: Pretrvávajúca virologická odpoveď v štúdii NV17424
| Pegasys
180 µg/1,73 m² x BSA +
ribavirín 15 mg/kg (N = 55)*
|
Všetky genotypy HCV**
| 29 (53 %)
|
HCV genotyp 1
| 21/45 (47 %)
|
HCV genotyp 2 a 3
| 8/10 (80 %)
|
*Výsledky naznačujú nedetegovateľnú HCV-RNA definovanú ako HCV RNA menej ako 50 IU/ml 24 týždňov po liečbe použitím AMPLICOR HCV testu v2.
**Plánované trvanie liečby bolo 48 týždňov bez ohľadu na genotyp
5.2 Farmakokinetické vlastnosti
Absorpcia
Po jednorazovej subkutánnej injekcii Pegasysu 180 mikrogramov zdravým jedincom sa merateľné sérové koncentrácie peginterferónu alfa-2a zistili v priebehu 3 až 6 hodín. Počas 24 hodín dosiahli namerané hladiny 80 % maximálnej koncentrácie v sére. Absorpcia Pegasysu je plynulá, pričom maximálne hladiny v sére sa dosiahnu 72 až 96 hodín po podaní. Absolútna biologická dostupnosť Pegasysu je 84 % a je podobná ako pri interferóne alfa-2a.
Distribúcia
Peginterferón alfa-2a sa nachádza najmä v krvnom obehu a extracelulárnej tekutine, čoho dôkazom je hodnota distribučného objemu v rovnovážnom stave (Vd) 6 - 14 litrov u ľudí po intravenóznom podaní. V štúdiách hmotnostnej rovnováhy, distribúcie látky v tkanivách a celotelovej autorádioluminografie vykonaných u potkanov sa zistilo, že okrem vysokej koncentrácie v krvi sa peginterferón alfa-2a dostáva do pečene, obličiek a kostnej drene.
Biotransformácia
Metabolizmus Pegasysu ešte nie je úplne objasnený, avšak štúdie na potkanoch naznačujú, že obličky sú hlavným exkrečným orgánom rádioaktívne označeného materiálu.
Eliminácia
U ľudí je hodnota systémového klírensu peginterferónu alfa-2a približne 100- násobne nižšia ako natívneho interferónu alfa-2a. Po intravenóznom podaní je terminálny polčas peginterferónu alfa-2a u zdravých osôb približne 60 – 80 hodín v porovnaní s 3 – 4 hodinami v prípade štandardného interferónu. Terminálny polčas po subkutánnom podaní pacientom je dlhší so strednou hodnotou 160 hodín (84 – 353 hodín). Terminálny polčas môže odrážať eliminačnú fázu látky, ale taktiež plynulú absorpciu Pegasysu.
Linearita/nelinearita
U zdravých osôb a u pacientov s chronickou hepatitídou B alebo C sa pri dávkovaní raz týždenne pozorovalo od dávky závislé zvyšovanie expozície voči Pegasysu.
U pacientov s chronickou hepatitídou B alebo C dochádza po 6 až 8 týždňoch podávania Pegasysu v dávke raz týždenne k dvoj- až trojnásobnému zvýšeniu sérových hladín peginterferónu alfa-2a
v porovnaní s podávaním jednorazovej dávky. Po 8-týždňovom podávaní Pegasysu raz týždenne nedochádza k ďalšej akumulácii. Po 48 týždňoch liečby je pomer medzi maximálnou a minimálnou hladinou približne 1,5 - 2. Sérové koncentrácie peginterferónu alfa-2a pretrvávajú celý 1 týždeň (168 hodín).
Pacienti s poruchou funkcie obličiek
Dysfunkcia obličiek je spojená s mierne zníženou hodnotou pomeru CL/F a predĺženým polčasom. U pacientov (n=3) CLcrea medzi 20 a 40 ml/min bola priemerná hodnota pomeru CL/F o 25 % nižšia ako u pacientov s normálnou funkciou obličiek. U dialyzovaných pacientov s ochorením obličiek
v terminálnej fáze sa zistilo 25 – 45 % zníženie klírensu, pričom dávky 135 mikrogramov u týchto pacientov vedú k podobnej expozícii ako dávky 180 mikrogramov u pacientov s normálnou funkciou
obličiek (pozri časť 4.2).
Pozrite si tiež Súhrn charakteristických vlastností lieku (SmPC) ribavirínu, ak sa Pegasys použije v kombinácii s ribavirínom.
Pohlavie
Farmakokinetika Pegasysu po podaní jednorazovej subkutánnej injekcie bola porovnateľná u zdravých jedincov mužského a ženského pohlavia.
Pediatrická populácia
V populačnej farmakokinetickej štúdii dostávalo 14 detí vo veku 2 až 8 rokov s CHC Pegasys v dávke: BSA dieťaťa x 180 µg/1,73 m2. Klírens Pegasysu u detí bol takmer 4-krát nižší ako klírens zaznamenaný u dospelých. Predpokladá sa, že priemerná expozícia (AUC) počas dávkovacieho intervalu je o 25 % až 70 % vyššia ako expozícia pozorovaná u dospelých, ktorí dostávajú fixnú dávku
180 µg.
Staršie osoby
U osôb starších ako 62 rokov sa zistila dlhšia absorpcia Pegasysu po jednorazovom podaní subkutánnej injekcie v dávke 180 mikrogramov, hoci stále bola plynulá v porovnaní s mladými zdravými osobami (tmax 115 hodín vs. 82 hodín, osoby staršie ako 62 rokov). Hodnota AUC bola mierne zvýšená (1 663 vs. 1 295 ng.hod/ml), avšak maximálne koncentrácie (9,1 vs. 10,3 ng/ml) boli podobné u osôb starších ako 62 rokov. Na základe expozície voči lieku, farmakodynamickej odpovedi a znášanlivosti je možné prehlásiť, že geriatrickí pacienti si nevyžadujú podávanie nižšej dávky Pegasysu (pozri časť 4.2).
Dysfunkcia pečene
Farmakokinetika Pegasysu u zdravých osôb bola podobná ako u pacientov s hepatitídou B alebo C.
U pacientov s cirhózou (stupeň A podľa Child-Pughovej klasifikácie) a pacientov bez cirhózy sa zistila porovnateľná expozícia a farmakokinetické profily.
Miesto podania
Subkutánne podávanie Pegasysu je nutné obmedziť na oblasť brucha a stehna, pretože stupeň absorpcie hodnotený na základe hodnôt AUC bol o 20 – 30 % vyšší po podaní injekcie do brucha a stehna. V štúdiách po podaní Pegasysu do ramena sa v porovnaní s podaním do brucha alebo stehna zistila znížená expozícia voči Pegasysu.
5.3 Predklinické údaje o bezpečnosti
Neklinické štúdie skúmajúce toxicitu Pegasysu boli limitované v dôsledku druhovej špecifickosti interferónov. Štúdie akútnej a chronickej toxicity sa vykonali u opíc cynomolgus, pričom nálezy pozorované u zvierat dostávajúcich peginterferón boli podobnej povahy ako nálezy vyvolané interferónom alfa-2a.
S Pegasysom sa nevykonali žiadne štúdie reprodukčnej toxicity. Tak ako pri iných interferónoch alfa, aj po podávaní peginterferónu alfa-2a samiciam opíc sa pozorovalo predĺženie menštruačného cyklu. Liečba interferónom alfa-2a viedla k štatisticky významnému zvýšeniu abortívneho účinku u opíc resus. Hoci sa u potomstva narodeného v termíne nezistili žiadne teratogénne účinky, nežiaduce účinky nie je možné vylúčiť u ľudí.
Pegasys plus ribavirín
Ak sa používa v kombinácii s ribavirínom, Pegasys nevyvoláva žiadne účinky u opíc, ktoré by predtým neboli pozorované pri podávaní jednotlivých liečiv v rámci monoterapie. Hlavnou zmenou v súvislosti s liečbou bola reverzibilná mierna až stredne ťažká anémia, závažnosť ktorej bola vyššia ako po podávaní jednotlivých liečiv v rámci monoterapie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
chlorid sodný polysorbát 80 benzylalkohol nátriumacetát kyselina octová
voda na injekcie
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti3 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v chladničke pri teplote 2°C – 8°C. Neuchovávajte v mrazničke.
Naplnenú injekčnú striekačku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia0,5 ml injekčného roztoku v naplnenej injekčnej striekačke (sklo typu I so silikónovou vrstvou na vnútornej strane), s piestom a čiapočkou (butylová guma s fluórpolymérovou vrstvou na vnútornej strane), 1 injekčná ihla. Injekčná striekačka je označená dielikmi, ktoré odpovedajú dávkam 135µg,
90 µg a 45 µg. Dostupné v balení po 1 naplnenej injekčnej striekačke.
6.6 Špeciálne opatrenia na likvidáciuInjekčný roztok je určený len na jednorazové použitie. Pred podaním sa má zrakom skontrolovať, či roztok neobsahuje tuhé čiastočky alebo či sa nezmenila jeho farba.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIRoche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/02/221/017
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 20. jún 2002
Dátum posledného predĺženia: 20. jún 2007
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Pegasys 135 mikrogramov injekčný roztok v naplnenej injekčnej striekačke
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá naplnená injekčná striekačka s 0,5 ml roztoku obsahuje 135 mikrogramov peginterferónu alfa-
2a*. Sila vyjadruje množstvo podielu interferónu alfa-2a v peginterferóne alfa-2a bez ohľadu na pegyláciu.
*Liečivo peginterferón alfa-2a je kovalentný konjugát bielkoviny interferónu alfa-2a vyrobený rekombinantnou DNA technológiou v Escherichia coli s bis -[monometoxypolyetylénglykolom].
Účinnosť tohto lieku sa nemá porovnávať s inými pegylovanými alebo nepegylovanými bielkovinami v tej istej terapeutickej skupine. Viac informácií, pozri časť 5.1.
Pomocná látka so známym účinkom: Benzylalkohol (10 mg/1 ml) Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok (injekcia) .
Roztok je číry, bezfarebný až svetložltý.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Chronická hepatitída B
Pegasys je indikovaný na liečbu chronickej hepatitídy B (CHB) s pozitívnym obalovým antigénom
hepatitídy B (HBeAg) alebo HBeAg negatívnej chronickej hepatitídy B u dospelých pacientov
s kompenzovaným ochorením pečene a s dôkazom vírusovej replikácie, zvýšenou hladinou ALT a histologicky overeným zápalom pečene a/alebo fibrózy (pozri časti 4.4 a 5.1).
Chronická hepatitída C
Dospelí pacienti
Pegasys je indikovaný na liečbu chronickej hepatitídy C (CHC) u dospelých s pozitívnym nálezom ribonukleovej kyseliny vírusu hepatitídy C (HCV-RNA) v sére. Toto zahŕňa pacientov
s kompenzovanou formou cirhózy pečene a/alebo súčasne infikovaných HIV vírusom s klinicky stabilným obrazom HIV infekcie (pozri časť 4.4).
Optimálny spôsob použitia Pegasysu u pacientov s chronickou hepatitídou C je kombinácia s ribavirínom. Kombinácia Pegasysu a ribavirínu je indikovaná na liečbu u predtým neliečených pacientov a u dospelých pacientov, u ktorých zlyhala predchádzajúca liečba interferónom alfa (pegylovaným alebo nepegylovaným) v monoterapii alebo v kombinovanej liečbe s ribavirínom.
Monoterapia je indikovaná najmä v prípade neznášanlivosti alebo kontraindikácie liečby ribavirínom.
Pegasys v kombinácii s ribavirínom je indikovaný na liečbu chronickej hepatitídy C u predtým neliečených detí a dospievajúcich vo veku 5 a viac rokov, u ktorých je prítomná pozitivita sérovej HCV-RNA.
Pri rozhodovaní, či začať v detstve s liečbou, je dôležité vziať do úvahy inhibíciu rastu indukovanú kombinovanou liečbou. Nie je isté, či je inhibícia rastu reverzibilná. Rozhodnutie o liečbe sa má urobiť individuálne pre každý prípad (pozri časť 4.4).
4.2 Dávkovanie a spôsob podávania
Liečbu Pegasysom má začať iba lekár, ktorý má skúsenosti s liečbou pacientov s hepatitídou B alebo
C.
Ak sa Pegasys bude podávať v kombinácii s ribavirínom, prečítajte si tiež súhrn charakteristických vlastností ribavirínu (SmPC).
Dávkovanie
Chronická hepatitída B – dospelí pacienti
Odporúčané dávkovanie a dĺžka liečby Pegasysom u HBeAg-pozitívnych a HBeAg-negatívnych pacientov s chronickou hepatitídou B je 180 mikrogramov raz týždenne počas 48 týždňov, subkutánne do brucha alebo do stehna.
Chronická hepatitída C - predtým neliečení dospelí pacienti
Odporúčaná dávka Pegasysu je 180 mikrogramov raz týždenne a podáva sa subkutánne do brucha alebo stehna v kombinácii s perorálnym ribavirínom alebo ako monoterapia.
Dávkovanie ribavirínu pri kombinovanej liečbe s Pegasysom sa uvádza v tabuľke 1. Dávka ribavirínu sa má užívať spolu s jedlom.
Dĺžka liečby
U pacientov s chronickou hepatitídou C závisí dĺžka kombinovanej liečby s ribavirínom od genotypu vírusu. Pacienti infikovaní HCV s genotypom 1, ktorí majú detegovateľnú HCV RNA v 4. týždni sa majú liečiť 48 týždňov bez ohľadu na vírusovú záťaž pred liečbou.
O liečbe v trvaní 24 týždňov sa môže uvažovať u pacientov infikovaných s
- genotypom 1 a nízkou vírusovou záťažou (LVL) na začiatku liečby ( ≤ 800 000 IU/ml) alebo
- genotypom 4,
ktorí sa stali HCV RNA negatívni v 4. týždni liečby a zostali HCV RNA negatívni v 24. týždni. Avšak celkove môže byť 24 týždňová liečba spojená s vyšším rizikom relapsu ako liečba trvajúca 48 týždňov (pozri časť 5.1). Pri rozhodovaní o dĺžke liečby sa má u týchto pacientov brať do úvahy tolerancia na
kombinovanú liečbu a ďalšie prognostické faktory, ako stupeň fibrózy. Ešte s väčšou opatrnosťou sa
má uvažovať o skrátení dĺžky trvania liečby u pacientov infikovaných s vírusom s genotypom 1 a vysokou vírusovou záťažou (>800 000 IU/ml) na začiatku liečby, ktorí sa stali HCV RNA negatívni v
4. týždni liečby a zostali negatívni v 24. týždni, pretože obmedzené údaje naznačujú, že to môže signifikantne negatívne ovplyvniť trvalú virologickú odpoveď.
Pacienti infikovaní HCV s genotypom alebo 3, ktorí majú detegovateľnú HCV RNA v 4. týždni, bez ohľadu na vírusovú záťaž pred liečbou majú byť liečení 24 týždňov. 16-týždňová liečba sa môže zvažovať iba u vybraných pacientov, infikovaných genotypom 2 alebo 3 s iniciálnou LVL (≤ 800 000
IU/ml), ktorí sa stanú HCV negatívni v 4. týždni liečby a zostávajú negatívni v 16. týždni. Všeobecne sa liečba trvajúca 16 týždňov môže spájať s nižšou možnosťou odpovede a je spojená s vyšším rizikom relapsu ako 24-týždňová liečba (pozri časť 5.1). U týchto pacientov sa má pri zvažovaní zmeny štandardnej 24 týždňovej liečby vziať do úvahy tolerancia kombinovanej liečby a prítomnosť
u pacientov infikovaných genotypom 2 alebo 3 s iniciálnou HVL (> 800 000 IU/ml), ktorí sa stanú v 4. týždni liečby HCV negatívni sa má zvažovať pozornejšie, nakoľko toto môže významne negatívne ovplyvniť trvalú virologickú odpoveď (pozri tabuľku 1).
Dostupné údaje o infikovaných pacientoch s genotypom 5 alebo 6 sú obmedzené; preto sa odporúča
48 týždňová kombinovaná liečba s 1 000 mg alebo 1 200 mg ribavirínu.
Tabuľka 1: Odporúčané dávkovanie pre kombinovanú liečbu HCV pacientovGenotyp
| Dávka Pegasysu
| Dávka ribavirínu
| Trvanie
|
Genotyp 1 LVL s
RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 24 týždňov alebo
48 týždňov
|
Genotyp 1 s HVL s
RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 48 týždňov
|
Genotyp 4 s RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 24 týždňov alebo
48 týždňov
|
Genotyp 1 alebo 4 bez
RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 48 týždňov
|
Genotyp 2alebo 3 bez
RVR**
| 180 mikrogramov
| 800 mg
| 24 týždňov
|
Genotyp 2 alebo 3
LVL s RVR**
| 180 mikrogramov
| 800 mg(a)
| 16 týždňov(a) alebo
24 týždňov
|
Genotyp 2 alebo 3
HVL s RVR**
| 180 mikrogramov
| 800 mg
| 24 týždňov
|
*RVR = rýchla virologická odpoveď (nedegovateľná HCV RNA) v 4. týždni a nedetegovateľná HCV RNA v 24. týždni
**RVR = rýchla virologická odpoveď (HCV RNA negativita) v 4. týždni
LVL = ≤ 800 000 IU/ml; HVL= > 800 000 IU/ml
(a) V súčasnosti nie je jasné, či vyššia dávka ribavirínu (napr. 1 000 /1 200 mg/deň podľa telesnej hmotnosti) vedie k vyššej trvalej virologickej odpovedi (SVR) než dávka 800 mg/deň, keď je liečba skrátená na 16 týždňov.
Konečný klinický účinok skrátenej 16 týždňovej liečby oproti 24 týždňovej liečbe nie je známy vzhľadom na potrebu opakovanej liečby u pacientov, ktorí neodpovedajú na liečbu a pacientov s relapsom ochorenia.
Odporúčaná dĺžka liečby Pegasysom v monoterapii je 48 týždňov.
Chronická hepatitída C - predtým liečení dospelí pacientiOdporúčaná dávka Pegasysu v kombinácii s ribavirínom je 180 µg raz týždenne podávaná subkutánne. Pacientom s telesnou hmotnosťou < 75 kg sa má podávať 1 000 mg ribavirínu denne a pacientom
s telesnou hmotnosťou ≥ 75 kg sa má podávať 1 200 mg ribavirínu denne bez ohľadu na genotyp.
U pacientov, ktorí majú v 12. týždni detegovateľné hladiny vírusu, sa má liečba ukončiť. Odporúčaná
celková dĺžka liečby je 48 týždňov. Ak sa zvažuje liečba u pacientov infikovaných vírusom
genotypu 1, ktorí neodpovedali na predchádzajúcu liečbu peginterferónom a ribavirínom, odporúčaná celková dĺžka liečby je 72 týždňov (pozri časť 5.1).
Súčasná infekcia vírusom HIV a HCV u dospelých pacientovOdporúčané dávkovanie Pegasysu v monoterapii alebo v kombinácii s ribavirínom je
180 mikrogramov raz za týždeň subkutánne počas 48 týždňov. Pre pacientov infikovaných HCV s genotypom 1 a s telesnou hmotnosťou <75 kg je dávka ribavirínu 1 000 mg denne a s telesnou hmotnosťou ≥75 kg je dávka 1 200 mg denne. Pre pacientov infikovaných HCV s iným genotypom ako genotyp 1 je dávka ribavirínu 800 mg denne. Dĺžka liečby kratšia ako 48 týždňov sa neskúmala.
Predikcia odpovede alebo chýbanie odpovede - predtým neliečení pacienti Ukázalo sa, že včasná virologická odpoveď v 12-tom týždni, ktorá je definovaná ako pokles vírusovej záťaže o 2 log alebo nedetekovateľné hladiny HCV RNA, predikuje pretrvávajúcu odpoveď (pozri tabuľky 2 a 12).
Tabuľka 2: Prediktívna hodnota virologickej odpovede v 12. týždni kombinovanej liečbyPegasysom pri odporúčanom dávkovacom režimeGenotyp
| Negatívna
| Pozitívna
|
Žiadna
odpoveď
do 12. Odpoveď Prediktívna týždňa nepretrváva hodnota
|
Odpoveď
do 12. Odpoveď Prediktívna týždňa pretrváva hodnota
|
Genotyp 1
(N = 569)
| 102 97 95 %
(97/102)
| 467 271 58 %
(271/467)
|
Genotyp 2 a 3
(N = 96)
| 3 3 100 %
(3/3)
| 93 81 87 %
(81/93)
|
Negatívna prediktívna hodnota na trvalú odpoveď u pacientov liečených Pegasysom v monoterapii
bola 98 %.
Podobná negatívna prediktívna hodnota sa pozorovala u súčasne HIV-HCV infikovaných pacientov liečených Pegasysom v monoterapii alebo v kombinácii s ribavirínom (100 % (130/130) alebo 98 % (83/85)). Pozitívne prediktívne hodnoty na úrovni 45 % (50/110) resp. 70 % (59/84) u súčasne HIV- HCV infikovaných pacientov sa pozorovali pri genotype 1 a genotype 2/3, ak títo dostávali kombinovanú liečbu.
Predikcia odpovede alebo chýbanie odpovede - predtým liečení pacientiU pacientov, ktorí neodpovedali na predchádzajúcu liečbu a boli opakovane liečení 48 alebo
72 týždňov, sa ukázalo, že potlačenie aktivity vírusu v 12. týždni (nedetegovateľná HCV RNA definovaná ako <50 IU/ml) je prediktívnym faktorom trvalej virologickej odpovede. Ak nebolo dosiahnuté potlačenie vírusovej aktivity v 12. týždni pri režime liečby 48 alebo 72 týždňov, je pravdepodobnosť nedosiahnutia trvalej virologickej odpovede pri 48-týždňovej liečbe 96 % (363 z
380) a pri 72-týždňovej liečbe 96 % (324 z 339). Ak bolo dosiahnuté potlačenie vírusovej aktivity v 12. týždni pri režime liečby 48 alebo 72 týždňov, je pravdepodobnosť dosiahnutia trvalej virologickej odpovede pri 48-týždňovej liečbe 35 % (20 z 57) a pri 72-týždňovej liečbe 57 % (57 zo
100).
Úprava dávkovania u dospelých pacientov v dôsledku nežiaducich reakciíVšeobecnePri nutnosti úpravy dávkovania v dôsledku stredne ťažkých až ťažkých nežiaducich reakcií (klinickej a/alebo laboratórnej povahy) je vhodné u dospelých pacientov znížiť začiatočnú dávku na
135 mikrogramov. V niektorých prípadoch môže byť potrebné znížiť dávkovanie na 90 mikrogramov alebo 45 mikrogramov. Po ústupe nežiaducich účinkov je možné zvážiť zvýšenie dávkovania až na
pôvodnú hodnotu (pozri časti 4.4 a 4.8).
Hematologické nežiaduce reakcie (pozri tiež tabuľku 3)Pri poklese počtu neutrofilov na < 750/mm3 u dospelých pacientov sa odporúča znížiť dávkovanie lieku. U pacientov s absolútnym počtom neutrofilov (ANC) < 500/mm3 sa liečba prerušuje až do obnovenia hodnôt ANC > 1000/mm3. Liečbu Pegasysom je možné opäť začať dávkou
90 mikrogramov a má sa sledovať počet neutrofilov. V tabuľke 7 je uvedený návod na zníženie dávky
upediatrických pacientov na základe hodnôt ANC.
Ak počet trombocytov klesne na < 50 000/mm3, má sa znížiť dávkovanie na 90 mikrogramov. Pri znížení počtu trombocytov na hodnotu < 25 000/mm3 sa odporúča liečbu ukončiť.
Pre liečbu farmakologicky podmienenej anémie u dospelých platia nasledovné špecifické odporúčania:
denná dávka ribavirínu sa má znížiť na 600 mg (200 mg ráno a 400 mg večer), ak nastane niektorá
z nasledujúcich situácií: (1) u pacienta bez závažného kardiovaskulárneho ochorenia dôjde k poklesu hodnôt hemoglobínu na < 10 g/dl a ≥ 8,5 g/dl alebo (2) u pacienta so stabilizovaným kardiovaskulárnym ochorením dôjde k poklesu hodnôt hemoglobínu ≥ 2 g/dl v priebehu ktorýchkoľvek 4 týždňov liečby. Návrat k pôvodnému dávkovaniu sa neodporúča. Liečba ribavirínom
sa ukončí, ak nastane niektorá z nasledujúcich situácií: (1) u pacienta bez závažného kardiovaskulárneho ochorenia dôjde k poklesu hodnôt hemoglobínu < 8,5 g/dl; (2) u pacienta so stabilizovaným kardiovaskulárnym ochorením sa hodnoty hemoglobínu udržujú < 12 g/dl napriek 4- týždňovej liečbe s redukovaným dávkovaním. Ak sa abnormality upravia, je možné obnoviť liečbu
ribavirínom v dennej dávke 600 mg. Ošetrujúci lekár môže zvážiť ďalšie zvýšenie dávkovania na
800 mg denne. Návrat k pôvodnému dávkovaniu sa neodporúča.
Tabuľka 3:Úprava dávkovania v dôsledku nežiaducich účinkov (ďalšie informácie pozri v texte vyššie)
| Znížiť
dávkovanie ribavirínu na
600 mg
| Vysadiť
ribavirín
| Znížiť dávkovanie
Pegasysu na
135/90/45 mikrogramov
| Vysadiť
Pegasys
| Vysadiť
kombinovanú liečbu
|
Absolútny počet neutrofilov
|
|
| < 750/mm3
| < 500/mm3
|
|
Počet trombocytov
|
|
| < 50 000/mm3
> 25 000/mm3
|
| < 25 000/mm3
|
Hemoglobín
- bez ochorenia srdca
| < 10 g/dl
a ≥ 8,5 g/dl
| < 8,5 g/dl
|
|
|
|
Hemoglobín
-
stabilizov ané ochorenie srdca
| pokles
o ≥ 2 g/dl počas
ľubovoľných
4 týždňov
| < 12 g/dl napriek
4 týždňovej liečbe
s redukovaným dávkovaním
|
|
|
|
Pri neznášanlivosti ribavirínu je možné pokračovať v monoterapii Pegasysom.
Funkcia pečeneU pacientov s chronickou hepatitídou C sa často vyskytuje kolísanie odchýlok pečeňových testov. U pacientov liečených Pegasysom vrátane pacientov s virologickou odpoveďou sa pozorovalo
zvýšenie hladín ALT nad východiskovú hodnotu (BL).
V klinických skúšaniach zameraných na chronickú hepatitídu C s dospelými pacientmi sa u 8 zo 451
pacientov dostávajúcich kombinovanú liečbu pozorovalo izolované zvýšenie ALT (≥ 10x ULN alebo
≥ 2x BL u pacientov s východiskovou hodnotou ALT ≥ 10x ULN), ktoré sa upravilo bez nutnosti
zmeny dávkovania. Ak je hodnota ALT trvale vyššia alebo naďalej stúpa, dávkovanie sa na začiatku
znižuje na 135 mikrogramov. Ak napriek zníženiu dávkovania hodnoty ALT naďalej stúpajú alebo ich sprevádza zvýšenie hladiny bilirubínu alebo známky dekompenzácie funkcie pečene, má sa liečba ukončiť (pozri časť 4.4). V tabuľke 7 je uvedený návod pre zníženie dávky pre pediatrických
pacientov na základe hladín ALT.
U pacientov s chronickou hepatitídou B nie je nezvyčajné prechodné zvýšenie hladín ALT, ktoré niekedy prekročí desaťnásobok hornej hranice normálnej hodnoty a môže odrážať imunitný klírens. Liečba by sa za normálnych okolností nemala začať, ak je hladina ALT viac než desaťkrát vyššia ako horná hranica normálnej hodnoty. Treba zvážiť pokračovanie liečby s častejším sledovaním funkcie pečene pri náhlom zvýšení hladín ALT. Ak sa dávka Pegasysu zníži alebo ak sa liek vysadí, pri poklese hladiny ALT sa liečba môže obnoviť (pozri časť 4.4).
Osobitné skupiny pacientov
Starší ľudia
Na začiatku liečby Pegasysom u starších pacientov nie je potrebná žiadna úprava odporúčaného dávkovania 180 mikrogramov raz týždenne (pozri časť 5.2).
Porucha funkcie obličiekU pacientov s ochorením obličiek v terminálnej fáze sa používa začiatočná dávka 135 mikrogramov (pozri časť 5.2 ). Bez ohľadu na začiatočnú dávku alebo stupeň poškodenia funkcie obličiek je potrebné pacientov sledovať a v prípade nežiaducich reakcií je nutné primerane znížiť dávkovanie Pegasysu počas liečebnej kúry.
Porucha funkcie pečeneUkázalo sa, že Pegasys je účinný a bezpečný u pacientov s kompenzovanou cirhózou (napr. A podľa
Child-Pughovej klasifikácie). Pegasys sa nehodnotil u pacientov s dekompenzovanou cirhózou (napr. B alebo C podľa Child-Pughovej klasifikácie alebo krvácajúce ezofageálne varixy) (pozri časť 4.3).
Podľa Child-Pughovej klasifikácie sa pacienti rozdeľujú do skupín A, B a C resp. s “miernou” “stredne ťažkou” a “ťažkou” poruchou funkcie , čomu zodpovedá skóre 5 - 6, 7 - 9 a 10 - 15.
Upravené hodnotenie Hodnotenie
| Stupeň abnormality
| Skóre
|
Encefalopatia
| Žiadny
Stupeň 1 - 2
Stupeň 3 – 4*
| 1
2
3
|
Ascites
| Žiadny
Mierny
Stredný
| 1
2
3
|
Hladina sérového bilirubínu (mg/dl)
v SI jednotkách = μmol/l
| < 2
2,0 - 3
> 3
< 34
34 - 51
> 51
| 1
2
3
1
2
3
|
Hladina sérového albumínu (g/dl)
| > 3,5
2,8 – 3,5
< 2,8
| 1
2
3
|
INR
| < 1,7
1,7 - 2,3
> 2,3
| 1
2
3
|
* Hodnotenie stupňa závažnosti podľa autorov Trey, Burns a Saunders (1966)
Pediatrická populáciaPegasys je kontraindikovaný u novorodencov a malých detí vo veku do 3 rokov z dôvodu prítomnosti
pomocnej látky benzylalkoholu (pozri časti 4.3 a 4.4).
Pre deti a dospievajúcich vo veku 5 až 17 rokov s chronickou hepatitídou C s povrchom tela (BSA) väčším ako 0,7 m2 sú odporúčané dávky Pegasysu a ribavirínu uvedené v tabuľke 4 a v tabuľke 5. Pre pediatrických pacientov sa odporúča použiť Pegasys v naplnených injekčných striekačkách. Použitie Pegasysom naplnených pier neumožňuje primeranú úpravu dávky pre týchto pacientov. Pacienti, ktorí začali liečbu pred svojimi 18-timi narodeninami, majú pokračovať v pediatrickom dávkovaní až do skončenia liečby.
Pegasys sa nesmie použiť u detí s povrchom tela (BSA) menším ako 0,71 m2, keďže pre túto subpopuláciu nie sú dostupné údaje.
 Dĺžka liečby
Dĺžka liečby
Dĺžka liečby Pegasysom v kombinácii s ribavirínom u pediatrických pacientov s chronickou hepatitídou C závisí od genotypu vírusu. Pacienti infikovaní vírusovými genotypom 2 alebo 3 majú
dostať 24 týždňovú liečbu, zatiaľ čo pacienti infikovaní iným genotypom majú dostať 48 týždňovú liečbu.
Pacienti, ktorí majú ešte detegovateľné hladiny HCV-RNA a to aj napriek počiatočnej 24 týždňovej liečbe, majú ukončiť liečbu, pretože je nepravdepodobné, že pokračovaním v liečbe budú schopní dosiahnuť trvalú virologickú odpoveď.
Tabuľka 4: Odporúčania na dávkovanie Pegasysu u pediatrických pacientov vo veku 5 až 17rokov Rozmedzie plochy povrchu tela (BSA) (m2)
| Týždenná dávka (mikrogramy)
|
0,71-0,0,74
| 65
|
0,75-1,08
| 90
|
1,09-1,51
| 135
|
> 1,51
| 180
|
Pre deti a dospievajúcich vo veku 5 až 17 rokov s chronickou hepatitídou C odporúčaná dávka
ribavirínu vychádza z telesnej hmotnosti pacienta s cieľovou dávkou 15 mg/kg/deň rozdelenou do dvoch denných dávok. V tabuľke 5 je uvedené dávkovanie za použitia 200 mg tabliet ribavirínu pre deti a dospievajúcich s hmotnosťou 23 kg a viac. Pacienti a ich opatrovatelia sa nesmú pokúšať rozlomiť 200 mg tablety.
Tabuľka 5: Odporúčania na dávkovanie ribavirínu u pediatrických pacientov vo veku 5 až 17rokov Telesná hmotnosť kg (lbs)
| Denná dávka ribavirínu
(pribl. 15 mg/kg/deň)
| Počet tabliet ribavirínu
|
23 – 33 (51-73)
| 400 mg/deň
| 1 x 200 mg tablety ráno
1 x 200 mg tablety večer
|
34 – 46 (75-101)
| 600 mg/deň
| 1 x 200 mg tablety ráno
2 x 200 mg tablety večer
|
47 – 59 (103-131)
| 800 mg/deň
| 2 x 200 mg tablety ráno
2 x 200 mg tablety večer
|
60 – 74 (132-163)
| 1 000 mg/deň
| 2 x 200 mg tablety ráno
3 x 200 mg tablety večer
|
≥ 75 (> 165)
| 1 200 mg/deň
| 3 x 200 mg tablety ráno
3 x 200 mg tablety večer
|
Úprava dávky u pediatrických pacientov kvôli nežiaducim reakciámU pediatrických pacientov je možné na základe toxicity (pozri tabuľku 6) urobiť až tri stupne modifikácie dávky pred zvážením prerušenia alebo vysadenia dávky.
Tabuľka 6: Odporúčaná úprava dávky Pegasysu u pediatrických pacientovZačiatočná dávka
(mikrogramy)
| 1. stupeň zníženia
(mikrogramy)
| 2. stupeň zníženia
(mikrogramy)
| 3. stupeň zníženia
(mikrogramy)
|
65
|
45
|
30
|
20
|
90
|
65
|
45
|
20
|
135
|
90
|
65
|
30
|
180
|
135
|
90
|
45
|
V prípade výskytu toxicity, ktorá môže súvisieť s podávaním Pegasysu a/alebo ribavirínu, sa môže
znížiť dávka jedného alebo obidvoch liekov. Okrem toho sa môže ribavirín alebo kombinovaná liečba Pegasys plus ribavirín vysadiť. Je dôležité poznamenať, že ribavirín sa nesmie nikdy podávať ako monoterapia. Odporúčania na úpravu dávky z dôvodu toxicity, o ktorej je známe, že má súvislosť
s podávaním Pegasysu a ktoré sú špecifické pre deti a dospievajúcich, sú uvedené v tabuľke 7. Pokiaľ nie je uvedené inak, v prípade všetkých ostatných toxických prejavov sa má postupovať podľa odporúčaní pre dospelých.
Tabuľka 7: Odporúčania na úpravu dávky Pegasysu z dôvodu toxicity u pediatrických pacientovToxicita
| Úprava dávky Pegasysu
|
Neutropénia
| 750-999 buniek/mm3: 1.-2. týždeň – okamžitá úprava 1. stupňa; 3.-48.
týždeň: žiadna úprava.
500-749 buniek/mm3: 1.-2. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte dávkou s úpravou 1. stupňa s kontrolou hodnoty leukocytov jedenkrát týždenne počas 3 nasledujúcich týždňov, aby ste sa ubezpečili, že ich počet je > 750 buniek/mm3; 3.-48. týždeň – okamžitá úprava 1. stupňa.
250-499 buniek/mm3: 1.-2. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte dávkou s úpravou 2. stupňa; 3.-48. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte
v dávkovaní s úpravou 1. stupňa.
< 250 buniek/mm3 (alebo febrilná neutropénia) liečbu vysaďte.
|
Zvýšená hladina
alanínaminotransaminázy
(ALT)
| V prípade pretrvávajúcich alebo narastajúcich zvýšení ≥ 5 ale < 10 x
ULN, znížte dávku s úpravou 1. stupňa a jedenkrát týždenne sledujte hladinu ALT na uistenie, že je stabilná alebo klesá
V prípade pretrvávajúcich hodnôt ALT ≥ 10 x ULN vysaďte liečbu.
|
ULN=horná hranica normy
U pediatrických pacientov je toxicita súvisiaca s liečbou ribavirínom, ako napríklad anémia, ktorá sa objaví počas liečby, riešiteľná znížením celkovej dávky. Stupne zníženia dávky sú uvedené v tabuľke
8.
Tabuľka 8: Odporúčania na úpravu dávky ribavirínu pre deti a dospievajúcichCelková dávka
(približne 15 mg/kg/deň)
| Jednokroková úprava dávky
(približne 7,5 mg/kg/deň)
|
Počet tabliet ribavirínu
|
400 mg/deň
| 200 mg/deň
| 1 x 200 mg tabliet ráno
|
600 mg/deň
|
400 mg/deň
| 1 x 200 mg tabliet ráno
1 x 200 mg tabliet večer
|
800 mg/deň
|
400 mg/deň
| 1 x 200 mg tabliet ráno
1 x 200 mg tabliet večer
|
1 000 mg/deň
|
600 mg/deň
| 1 x 200 mg tabliet ráno
2 x 200 mg tabliet večer
|
1 200 mg/deň
| 600 mg/deň
| 1 x 200 mg tabliet ráno
|


2 x 200 mg tabliet večer
Skúsenosti s Pegasysomna liečbu pediatrických pacientov s HCV vo veku od 3 do 5 rokov alebo tých,
ktorí v minulosti neboli adekvátne liečení, sú len obmedzené. Neexistujú žiadne údaje u pediatrických pacientov súčasne infikovaných vírusmi HCV a HIV alebo s poruchou funkcie obličiek.
Spôsob podaniaPegasys sa podáva subkutánne do brucha alebo stehna. V štúdiách s podaním Pegasysu do ramena
bola zistená znížená expozícia Pegasysom (pozri časť 5.2).
Pegasys je navrhnutý na podávanie samotným pacientom alebo opatrovateľom. Každú injekčnú liekovku má používať len jedna osoba a je určená len na jednorazové použitie.
Pre nezdravotníckych pracovníkov, ktorí podávajú tento liek, sa odporúča primerané školenie. Pacient musí postupovať presne podľa “Pokynov pre používateľa” vložených v škatuľke.
4.3 Kontraindikácie• Precitlivenosť na liečivo, na interferóny alfa alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
• Autoimunitná hepatitída
• Ťažká dysfunkcia pečene alebo dekompenzovaná cirhóza pečene
• Anamnéza ťažkého kardiovaskulárneho ochorenia vrátane nestabilného alebo nekontrolovaného
ochorenia srdca počas predchádzajúcich 6 mesiacov (pozri časť 4.4)
• HIV-HCV pacienti s cirhózou s Child-Pughovým skóre ≥6, okrem stavu, keď je cirhóza nepriamo spôsobená hyperbilirubinémiou vyvolanou liekmi ako atazanavir a indinavir
• Kombinácia s telbivudínom (pozri časť 4.5)
• Novorodenci a deti do 3 rokov vzhľadom na prítomnosť pomocnej látky – benzylalkoholu
(pozri časť 4.4 o benzylalkohole)
• Psychické poruchy, obvzvlášť závažná depresia , suicidálne myšlienky alebo pokus o samovraždu u pediatrických pacientov v súčasnosti alebo v anamnéze.
Ak sa Pegasys má použiť v kombinácii s ribavirínom, prečítajte si súhrn charakteristických vlastností
(SmPC) o ribaviríne, ktorý obsahuje kontraindikácie jeho použitia.
4.4 Osobitné upozornenia a opatrenia pri používaníPsychické poruchy a centrálny nervový systém (CNS): Počas liečby Pegasysom a aj po jej ukončení, najmä počas 6-mesačného sledovania po liečbe, sa pozorovali u niektorých pacientov závažné účinky na CNS, hlavne depresia, samovražedné predstavy a pokus o samovraždu. Pri použití alfa interferónov sa pozorovali ďalšie účinky na CNS s prejavmi ako je agresívne správanie (niekedy namierené proti iným osobám ako je myšlienka na vraždu), bipolárne poruchy, mánia, zmätenosť a poruchy vedomia. U všetkých pacientov majú byť prísne monitorované všetky znaky alebo symptómy psychických porúch. Ak sa objavia symptómy psychických porúch, ošetrujúci lekár musí vziať do úvahy možnú závažnosť týchto príznakov a zvážiť potrebu adekvátnej liečby. Ak psychiatrické symptómy pretrvávajú alebo sa zhoršujú, alebo ak sa spozorujú samovražedné predstavy, odporúča sa liečbu Pegasysom ukončiť a pacienta odporučiť do prislúchajúcej psychiatrickej starostlivosti a/alebo liečby.
Pacienti s už existujúcim psychiatrickým ochorením alebo s údajom o závažnom psychiatrickom ochorení v anamnéze: Ak sa rozhodne, že liečba Pegasysom je nutná u pacienta, ktorý má existujúce alebo v anamnéze prítomné závažné psychiatrické ochorenie, má sa liečba začať až po zaistení vhodnej individuálnej diagnostiky a liečby psychiatrického stavu.


Použitie Pegasysu u pediatrických pacientov s psychickými poruchami v súčasnosti alebo v anamnéze je kontraindikované (pozri časť 4.3).
Rast a vývoj (deti a dospievajúci): Úbytok hmotnosti a inhibícia rastu bola bežná v priebehu liečby
trvajúcej až 48 týždňov u pacientov vo veku 5 až 17 rokov (pozri časti 4.8 a 5.1).
2 roky po liečbe Pegasysom bolo 16 % pediatrických pacientov stále 15 percentilov alebo viac pod svojou východiskovou krivkou hmotnosti a 11 % zostalo 15 percentilov alebo viac pod svojou východiskovou krivkou výšky.
Individuálne posúdenie prínosu liečby a rizika u detíOčakávaný prínos liečby sa má starostlivo zvažovať berúc pritom do úvahy zistenia z klinických skúšaní týkajúce sa bezpečnosti pozorované u pediatrických pacientov (pozri časti 4.8 a 5.1).
- Je dôležité vziať do úvahy, že kombinovaná liečba viedla k inhibícii rastu, ktorej reverzibilita nie je istá.
- Toto riziko je potrebné zvážiť berúc do úvahy charakter ochorenia dieťaťa, akým je dôkaz o progresii ochorenia (najmä fibrózy), komorbidity, ktoré môžu negatívne ovplyvniť priebeh
ochorenia (napr. súčasná infekcia vírusom HIV), ako aj prognostické faktory odpovede (HCV
genotyp a vírusová záťaž).
Ak je to možné, dieťa sa má liečiťpo pubertálnej akcelerácii rastu, aby sa znížilo riziko inhibície rastu. Neexistujú žiadne údaje o dlhodobých účinkoch na pohlavné dozrievanie.
Ak sa Pegasys podáva v kombinácii s ribavirínom, prečítajte si súhrn charakteristických vlastností
(SmPC) ribavirínu.
Histológia pečene pred liečbouVšetci pacienti s chronickou hepatitídou C, ktorí sa zúčastnili štúdie, sa podrobili biopsii pečene, ale v určitých prípadoch (napr. u pacientov s genotypom 2 alebo 3) sa môže liečba nasadiť aj bez histologického dôkazu. Pri rozhodovaní o nutnosti biopsie pečene pred začiatkom liečby sa má postupovať podľa platných liečebných postupov.
U pacientov s normálnymi hodnotami ALT sa progresia do fibrózy v priemere vyskytuje s nižšou intenzitou ako u pacientov so zvýšenými hodnotami ALT. Toto musí byť zhodnotené spoločne s ostatnými kritériami ako HCV genotyp, vek pacienta, extrahepatálne prejavy, riziko prenosu atď., ktoré ovplyvňujú rozhodnutie liečiť alebo neliečiť.
Laboratórne vyšetrenia pred liečbou a počas nejPred začiatkom liečby Pegasysom sa u všetkých pacientov odporúča vykonať štandardné hematologické a biochemické laboratórne vyšetrenia.
Pred začiatkom liečby Pegasysom musia byť východiskové hodnoty sledovaných parametrov nasledovné:
- počet trombocytov ≥ 90 000/mm3
- absolútny počet neutrofilov ≥ 1 500/mm3
- primerane kontrolovaná funkcia štítnej žľazy (TSH a T4)
Hematologické vyšetrenia sa majú opakovať každé 2 - 4 týždne a biochemické vyšetrenia každé 4
týždne. Počas liečby sa má periodicky robiť doplnkové vyšetrenie.
V klinických štúdiách sa počas liečby Pegasysom pozorovalo zníženie počtu leukocytov (WBC) ako aj absolútneho počtu neutrofilov (ANC), ku ktorému obyčajne došlo počas prvých dvoch týždňov liečby (pozri časť 4.8). Progresívne znižovanie po 8 týždňoch liečby sa zistilo len v zriedkavých prípadoch. Pokles ANC bol obyčajne reverzibilný po znížení dávkovania alebo ukončení liečby (pozri časť 4.2), normálne hodnoty sa dosiahli u väčšiny pacientov za 8 týždňov a na základné hodnoty sa vrátili u všetkých pacientov približne po 16 týždňoch.
Liečbu Pegasysom sprevádzalo zníženie počtu trombocytov, ktorý sa vrátil na úroveň pred liečbou počas obdobia sledovania po liečbe (pozri časť 4.8). V niektorých prípadoch bola potrebná úprava dávkovania (pozri časť 4.2).
V klinických štúdiách sa u 15 % pacientov s chronickou hepatitídou C liečených Pegasysom
v kombinácii s ribavirínom pozoroval výskyt anémie (hemoglobín <10 g/dl). Frekvencia závisí na dĺžke trvania liečby a na dávke ribavirínu (pozri časť 4.8). U ženskej populácie je vyššie riziko vývoja anémie.
Pri podávaní Pegasysu v kombinácii s inými potenciálne myelosupresívnymi látkami je potrebná opatrnosť.
V literatúre sú hlásenia o výskyte pancytopénie a o útlme kostnej drene, ku ktorým došlo v priebehu 3 až 7 týždňov po podaní peginterferónu a ribavirínu podaného súbežne s azatioprinom. Táto myelotoxicita bola reverzibilná do 4 až 6 týždňov po vysadení antivirotickej terapie proti hepatitíde C a súčasne podávaného azatioprinu a neobnovila sa po opätovnom zavedení ktoréhokoľvek z týchto liečiv podávaných v monoterapii (pozri časť 4.5).
Použitie kombinovanej liečby Pegasysom a ribavirínom u pacientov s chronickou hepatitídou C,
u ktorých zlyhala predchádzajúca liečba, sa dostatočne nesledovalo u pacientov, ktorí predchádzajúcu liečbu predčasne ukončili kvôli hematologickým nežiaducim reakciám. Lekári, ktorí uvažujú o liečbe týchto pacientov, majú starostlivo zvážiť riziká opakovanej liečby oproti jej prínosom.
Endokrinný systém
Pri používaní interferónov alfa vrátane Pegasysu sa popísali poruchy funkcie štítnej žľazy, resp. zhoršenie predchádzajúcich ochorení štítnej žľazy. Pred začiatkom liečby Pegasysom sa majú vyšetriť hladiny TSH a T4. Liečbu Pegasysom je možné zahájiť alebo je možné v nej pokračovať, ak sa hodnoty TSH počas liečby udržia v normálnom rozmedzí. Počas liečebnej kúry sa majú vyšetriť hladiny TSH, ak sa u pacienta objavia klinické príznaky svedčiace o možnej poruche funkcie štítnej žľazy (pozri časť 4.8). Pri liečbe Pegasysom sa môže pozorovať hypoglykémia, hyperglykémia a diabetes mellitus (pozri časť 4.8). Pacienti, u ktorých sa tieto stavy nemôžu účinne kontrolovať liekmi, sa nemajú začať liečiť Pegasysom alebo Pegasysom v kombinácii s ribavirínom. U pacientov, u ktorých sa toto ochorenie rozvinulo počas liečby a nemôžu sa liečiť liekmi, má sa liečba Pegasysom alebo Pegasysom v kombinácii s ribavirínom ukončiť.
Kardiovaskulárny systém
Liečbu interferónmi alfa vrátane Pegasysu sprevádzala hypertenzia, supraventrikulárne arytmie, kongestívne srdcové zlyhanie, bolesť na hrudníku a infarkt myokardu. Odporúča sa, aby sa pacienti so srdcovými abnormalitami v predchorobí podrobili elektrokardiografickému vyšetreniu pred začiatkom liečby Pegasysom. Pri akomkoľvek zhoršení kardiovaskulárneho stavu sa musí liečba prerušiť resp. ukončiť. U pacientov s kardiovaskulárnym ochorením si môže anémia vyžiadať zníženie dávkovania
alebo vysadenie liečby ribavirínom (pozri časť 4.2).
Funkcia pečene
Liečba Pegasysom sa musí ukončiť u pacientov, u ktorých sa počas liečby objavia známky dekompenzácie pečene. Pri liečbe Pegasysom sa pozorovalo zvýšenie hladín ALT oproti východiskovej hodnote, ku ktorému došlo aj u pacientov s virologickou odpoveďou na liečbu. Ak napriek zníženiu dávkovania hodnota ALT naďalej stúpa a je klinicky významná resp. ju sprevádza zvýšenie hladiny priameho bilirubínu, liečba sa musí ukončiť (pozri časti 4.2 a 4.8).
V prípade chronickej hepatitídy B, na rozdiel od chronickej hepatitídy C, nie je nezvyčajné zhoršenie ochorenia počas liečby, ktoré je charakterizované prechodným a potenciálne významným zvýšením sérovej ALT. V klinických štúdiách s Pegasysom pri HBV sa pozorovalo výrazné zvýšenie hladiny transaminázy, sprevádzané miernymi zmenami v ďalších parametroch hepatálnej funkcie, pričom sa nedokázala dekompenzácia pečene. Približne v polovici prípadov zvýšenia ALT prekračujúceho desaťnásobok hornej hranice normálnej hodnoty sa dávkovanie Pegasysu znížilo alebo liek sa vysadil,
až kým neklesli hodnoty transaminázy, zatiaľ čo u zvyšku pacientov liečba ostala nezmenená. Vo všetkých prípadoch sa odporučilo častejšie sledovanie hepatálnej funkcie.
Precitlivenosť
V zriedkavých prípadoch sa počas liečby interferónom alfa môžu vyskytnúť závažné akútne reakcie
z precitlivenosti (napr. urtikária, angioedém, bronchokonstrikcia, anafylaxia). Ak sa vyskytnú, musí sa liečba ukončiť a okamžite zahájiť príslušná farmakoterapia. Prechodný exantém si nevyžaduje nutnosť prerušenia liečby.
Autoimunitné ochorenie
Popísal sa vznik autoprotilátok a autoimunitných porúch počas liečby interferónmi alfa. Zvýšené riziko môžu mať pacienti predisponovaní na rozvoj autoimunitných porúch. Pacientov, ktorí majú znaky alebo príznaky zlučiteľné s autoimunitnými poruchami, sa má starostlivo vyšetriť a potom prehodnotiť pomer prínosu a rizika pokračovania liečby interferónom (pozri tiež Endokrinný systém v častiach 4.4 a 4.8).
U pacientov s chronickou hepatitídou C liečených interferónom boli hlásené prípady Vogt-Koyanagi- Harada (VKH) syndrómu. Tento syndróm je granulomatózne zápalové ochorenie, ktoré postihuje oči, sluchový systém, meningy a kožu. Ak je podozrenie na VKH syndróm, má sa antivirotická liečba ukončiť a uvažovať o liečbe kortikoidmi (pozri časť 4.8).
Horúčka/infekcie
Zatiaľ čo horúčka môže byť spojená so syndrómom podobným chrípke, čo sa často uvádza pri liečbe interferónom, musia sa vylúčiť iné príčiny pretrvávajúcej horúčky, zvlášť závažné infekcie (bakteriálne, vírusové, plesňové), najmä u pacientov s neutropéniou. V priebehu liečby interferónmi alfa, vrátane Pegasysu sa zaznamenal vznik závažných infekcií (bakteriálnych, vírusových, plesňových) a sepsa. Okamžite sa má začať odpovedajúca liečba proti infekcii a má sa zvážiť prerušenie liečby.
Očné zmeny
Pri liečbe Pegasysom sa zriedkavo popísala retinopatia, vrátane krvácania do sietnice, vatových škvŕn, edému papily, neuropatie zrakového nervu a uzáveru retinálnej artérie alebo vény, ktorý môže viesť
k strate zraku. Všetci pacienti sa majú pred začiatkom liečby podrobiť očnému vyšetreniu. Každý pacient udávajúci zhoršenie alebo stratu zraku sa musí okamžite podrobiť kompletnému očnému vyšetreniu. Dospelí a pediatrickí pacienti s očnými poruchami v predchorobí (napr. diabetickou alebo hypertenznou retinopatiou), sa majú počas liečby Pegasysom podrobiť pravidelným očným
vyšetreniam. Liečba Pegasysom sa má ukončiť u pacientov s novovzniknutými alebo zhoršenými
poruchami zraku.
Pľúcne zmeny
Počas liečby Pegasysom sa opísali pľúcne zmeny vrátane dýchavice, pľúcnych infiltrátov, pneumónie a pneumonitídy. V prípade pretrvávajúcich alebo nevysvetlených pľúcnych infiltrátov alebo zhoršenia funkcie pľúc sa má liečba ukončiť.
Kožné poruchy
Liečba interferónmi alfa bola sprevádzaná exacerbáciou alebo rozvojom psoriázy a sarkoidózy. Pegasys sa musí opatrne používať u pacientov s psoriázou a v prípadoch vzniku resp. zhoršenia psoriatických lézií sa musí liečba ukončiť.
Transplantácia
Bezpečnosť a účinnosť liečby Pegasysom a ribavirínom sa u pacientov po transplantácii pečene a iných orgánov nehodnotila. Boli hlásené odvrhnutia transplantátov pečene a obličiek po liečbe Pegasysom samotným alebo po kombinovanej liečbe s ribavirínom.
Súčasná infekcia HIV-HCV
Prosím, pozrite si súhrny charakteristických vlastností pre antiretrovírusové lieky, ktoré sa užívajú súbežne s HCV liečbou pre porozumenie a zvládnutie toxických účinkov každého lieku a možnosti prekrývania sa toxických účinkov pri liečbe Pegasysom s ribavirínom alebo bez ribavirínu. V štúdii NR15961 u pacientov, ktorí boli súbežne liečení so stavudínom a interferónom s alebo bez ribavirínu, bol výskyt pankreatitídy a/alebo laktátovej acidózy 3 % (12/398).
U pacientov súčasne infikovaných HCV a HIV, ktorí dostávajú vysoko-účinnú liečbu anti- retrovírusovými látkami (HAART), môže byť vyššie riziko vzniku laktátovej acidózy. Preto je potrebná opatrnosť pri pridávaní kombinovanej liečby Pegasys a ribavirín k liečbe HAART (pozri SPC ribavirínu).
Súčasne infikovanípacienti s pokročilou infekciou a pokročilou cirhózou pečene liečení HAART môžu mať vyššie riziko dekompenzácie pečene a úmrtia, ak dostávajú ribavirín v kombinácii s interferónmi vrátane Pegasysu. Zmeny východiskových hodnôt u koinfikovaných pacientov s cirhózou, ktoré môžu byť spojené s dekompenzáciou pečene, zahŕňajú: zvýšený sérový bilirubín, znížený hemoglobín, zvýšenú alkalickú fosfatázu alebo znížený počet krvných doštičiek a liečbu didanozínom (ddI).
Súbežná liečba ribavirínom a zidovudínom sa neodporúča vzhľadom na zvýšené riziko vzniku anémie
(pozri časť 4.5).
Počas liečby pacienti s kombinovanou infekciou sa majú starostlivo sledovať na znaky a symptómy dekompenzácie pečene (vrátane ascitu encefalopatie, krvácania z varixov, poškodenej syntézy
v pečeni; napr. Childovo-Pughovo skóre 7 alebo vyššie). Childovo-Pughovo skóre môže byť ovplyvnené faktormi spojenými s liečbou (ako nepriama hyperbilirubinémia, znížený albumín) a nemusia nevyhnutne viesť k dekompenzácii pečene. Liečba Pegasysom sa má ihneď ukončiť u pacientov s dekompenzáciou pečene.
U pacientov súčasne infikovaných HCV a HIV, údaje o účinnosti a bezpečnosti sú obmedzené
u pacientov s počtom CD4 buniek nižším ako 200 buniek/µl. Opatrnosť je preto potrebná u pacientov s nízkym počtom CD4 buniek.
Dentálne a periodontálne poruchy
U pacientov, ktorí dostávajú Pegasys v kombinácii s ribavirínom, sa hlásili dentálne a periodontálne poruchy, ktoré môžu viesť k strate zubov. Navyše suché ústa môžu mať škodlivý účinok na zuby a mukózne membrány úst počas dlhotrvajúcej liečby Pegasysom v kombinácii s ribavirínom. Pacienti si majú dvakrát denne dôkladne čistiť zuby a majú mať pravidelné kontrolné vyšetrenie zubným
lekárom. Okrem toho u niektorých pacientov sa môže objaviť vracanie. Ak sa takáto reakcia vyskytne, má sa im odporučiť dôkladne si potom vypláchnuť ústa.
Použitie dlhodobej liečby peginterferónom v monoterapii (neschválené použitie)
V randomizovanej, kontrolovanej štúdii (HALT-C) uskutočnej v USA u pacientov infikovaných vírusom HCV s rozličným stupňom fibrózy, ktorí neodpovedali na liečbu, sa sledovala 3,5-ročná liečba Pegasysom v monoterapii v dávke 90 mikrogramov/týždeň, pričom sa nezistilo žiadne signifikantné zníženie výskytu progresie fibrózy alebo súvisiacich klinických príhod.
Pomocná látka
Pegasys obsahuje benzylakohol. Nesmie sa podávať predčasne narodeným deťom ani novorodencom. Môže spôsobiť toxické reakcie a anafylaktické reakcie u dojčiat a detí vo veku do 3 rokov.
4.5 Liekové a iné interakcie
Interakčné štúdie sa uskutočnili len u dospelých.
Podávanie Pegasysu zdravým mužským dobrovoľníkom v dávke 1 x 180 mikrogramov týždenne počas 4 týždňov nemalo žiadny vplyv na farmakokinetické profily mefenytoínu, dapsonu,
debrisochínu a tolbutamidu, čo poukazuje na to, že Pegasys neovplyvňuje in vivo metabolickú aktivitu izoenzýmov cytochrómu P450 3A4, 2C9, 2C19 a 2D6.
V rovnakej štúdii sa pozorovalo 25 % zvýšenie hodnoty AUC pre teofylín (marker aktivity cytochrómu P450 1A2), čo potvrdzuje, že Pegasys je inhibítorom aktivity cytochrómu P450 1A2. U pacientov liečených súbežne teofylínom a Pegasysom sa majú sledovať sérové koncentrácie teofylínu a vhodne upraviť jeho dávkovanie. Je pravdepodobné, že k maximálnej interakcii medzi teofylínom a Pegasysom dôjde po viac ako 4 týždňoch liečby Pegasysom.
Pacienti s izolovanou infekciou vírusom HCV a pacienti s izolovanou infekciou vírusom HBV
Vo farmakologickej štúdii dostávalo 24 HCV infikovaných pacientov súbežne udržiavaciu liečbu
metadonom (stredná dávka 95 mg, v rozmedzí od 30 mg do 150 mg), liečba s Pegasysom
180 mikrogramov, subkutánne raz týždenne počas 4 týždňov, bola spojená s priemernými hodnotami metadonu, ktoré boli 10 % až 15 % vyššie než východiskové hodnoty. Klinický význam tohto zistenia nie je známy, napriek tomu sa majú pacienti sledovať pre príznaky a symptómy metadonovej toxicity. Zvlášť sa majú sledovať pacienti, ktorí užívajú vysokú dávku metadonu, u ktorých je riziko predĺženia QT intervalu.
Ribavirín, keďže má inhibičný účinok na inozín-monofosfátdehydrogenázu, môže zasahovať do metabolizmu azatioprinu, čo eventuálne môže viesť ku kumulácii 6-metyltioinozín-monofosfátu (6- MTIMP), ktorý sa spája so vznikom myelotoxicity u pacientov liečených azatioprinom. Má sa vyhnúť použitiu peginterferónu alfa-2a a ribavirínu podaného súbežne s azatioprinom. V jednotlivých prípadoch, ak prínos podávania ribavirínu súčasne s azatioprinom oprávňuje podstúpiť možné riziko, odporúča sa dôkladne monitorovať hematologické parametre počas súbežného podávania azatioprinu so zreteľom odhaliť známky myelotoxicity. V prípade, že k nej dôjde, treba liečbu týmito liekmi ukončiť (pozri časť 4.4).
Výsledky z farmakokinetických podštúdií v rámci pilotnej štúdie fázy III nepreukázali žiadnu farmakokinetickú interakciu medzi lamivudínom a Pegasysom u pacientov s HBV alebo medzi Pegasysom a ribavirínom u pacientov s HCV.
V klinickom skúšaní bola skúmaná kombinácia telbivudínu 600 mg denne s pegylovaným interferónom alfa-2a, 180 mikrogramov raz týždenne podané subkutánne. Skúšanie ukázalo, že kombinácia je spojená so zvýšeným rizikom vzniku periférnej neuropatie. Mechanizmus vzniku týchto udalostí nie je známy; a tak kombinovaná liečba telbivudínom s inými interferónmi (pegylovanými alebo štandardnými) môže tiež znamenať nesmierne riziko. Okrem toho, prínos kombinovanej liečby telbivudínom s interferónom alfa (pegylovaným alebo štandardným) nie je v súčasnosti preukázaný. Preto je kombinácia Pegasysu s telbivudínom kontraindikovaná (pozri časť 4.3).
Pacienti súčasne infikovaní vírusmi HIV-HCV
U 47 HIV-HCV koinfikovaných pacientov, ktorí sa zúčastnili na 12-týždňovej farmakokinetickej časti
štúdie skúmajúcej účinok ribavirínu na vnútrobunkovú fosforyláciu niektorých inhibítorov nukleozidovej reverznej transkriptázy (lamivudín a zidovudín alebo stavudín) sa nepozoroval žiadny zjavný dôkaz o liekovej interakcii. Avšak v dôsledku vysokej variability boli intervaly spoľahlivosti dosť široké. Nezdá sa, že plazmatická expozícia ribavirínu je ovplyvnená súčasným podávaním inhibítorov nukleozidovej reverznej transkriptázy (NRTI).
Súčasné podávanie ribavirínu a didanozínu sa neodporúča. Expozícia didanozínu alebo jeho aktívnemu metabolitu (dideoxyadenozín 5´-trifosfát) sa zvyšuje in vitro ak sa didanozín podáva spolu s ribavirínom. Pri používaní ribavirínu sa popísali prípady zlyhania pečene s následkom smrti, ako aj periférna neuropatia, pankreatitída a symptomatická hyperlaktatémia/laktátová acidóza.
Keď bol zidovudín súčasťou režimu používaného na liečbu HIV, bolo hlásené zvýraznenie anémie spôsobenej ribavirínom. Presný mechanizmus zostáva nevysvetlený. Súčasné podávanie ribavirínu
kombinovaná antiretrovírusová liečba stanovená, má sa zvážiť nahradenie zidovudínu. Je to zvlášť
dôležité u pacientov, u ktorých zidovudín spôsobil anémiu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne alebo iba obmedzené údaje o použití peginterferónu alfa-2a u gravidných žien. Štúdie na zvieratách s peginterferónom alfa-2a preukázali reprodukčnú toxicitu (pozri časť 5.3) a nie je známe potenciálne riziko u ľudí. Liečba Pegasysom počas gravidity sa používa iba vtedy, ak jej úžitok pre matku prevýši jeho riziko pre plod.
Laktácia
Nie je známe, či sa peginterferón alfa-2a/jeho metabolity vylučujú do materského mlieka. Dojčenie sa má ukončiť pred začatím liečby pre možnosť vzniku nežiaducich reakcií u dojčených detí.
Fertilita
Nie sú k dispozícii žiadne údaje o účinkoch peginterferónu alfa-2a na fertilitu žien. Pri podávaní peginterferónu alfa-2a samiciam opíc sa pozorovalo predĺženie menštruačného cyklu (pozri časť 5.3).
Použitie s ribavirínom
U všetkých zvieracích druhov, ktoré boli vystavené ribavirínu, sa dokázali významné teratogénne a/alebo embryocídne účinky. Ribavirín je u gravidných žien kontraindikovaný. Je potrebná mimoriadna opatrnosť na zabránenie gravidity u pacientok alebo partneriek pacientov, ktorí užívajú Pegasys v kombinácii s ribavirínom. Pacientky v plodnom veku musia používať účinnú antikoncepciu počas liečby a ešte 4 mesiace po ukončení liečby. Pacienti alebo partnerky musia používať účinnú
antikoncepciu počas liečby a ešte 7 mesiacov po ukončení liečby. Prosím pozrite si SmPC ribavirínu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pegasys má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje Pacienti, ktorí trpia závratom, zmätenosťou, ospalosťou alebo únavou, sa majú vyvarovať vedeniu vozidiel
alebo obsluhovaniu strojov.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Chronická hepatitída C
Výskyt a závažnosť väčšiny nežiaducich reakcií u pacientov liečených Pegasysom je podobná ako u pacientov dostávajúcich interferón alfa-2a pozri tabuľku 9). Väčšina častých nežiaducich reakcií pozorovaných po Pegasyse 180 mikrogramov bola miernej až strednej intenzity, pričom ich bolo možné zvládnuť bez potreby zmeny dávkovania alebo ukončenia liečby.
Chronická hepatitída B
V klinických štúdiách, ktoré skúmali 48-týždňovú liečbu a 24-týždňové sledovanie po liečbe bol bezpečnostný profil Pegasysu pri chronickej hepatitíde B podobný ako v prípade chronickej hepatitídy C. Frekvencia výskytu väčšiny nežiaducich reakcií, s výnimkou pyrexie, bola výrazne nižšia v prípade CHB liečenej Pegasysom v monoterapii v porovnaní s HCV pacientami liečenými s Pegasysom v monoterapii (pozri tabuľku 9). Nežiaduce účinky malo 88 % pacientov liečených
Pegasysom v porovnaní s 53 % pacientov v porovnávacej skupine s lamivudínom, kým 6 % pacientov liečených Pegasysom a 4% pacientov liečených lamivudínom mali závažné nežiaduce účinky počas štúdií. Nežiaduce účinky alebo abnormálne laboratórne hodnoty viedli u 5 % pacientov k ukončeniu liečby v skupine liečenej Pegasysom, zatiaľ čo menej ako 1 % pacientov ukončilo liečbu v skupine liečenej lamivudínom z tých istých dôvodov. Percento pacientov s cirhózou, ktorí ukončili liečbu bolo podobné ako u pacientov v celkovej populácii v každej liečenej skupine.
Chronická hepatitída C u pacientov, ktorí neodpovedali na predchádzajúcu liečbu
U pacientov, ktorí neodpovedali na predchádzajúcu liečbu, bol bezpečnostný profil Pegasysu
v kombinácii s ribavirínom celkovo podobný ako u predtým neliečených pacientov. V klinickom skúšaní u pacientov, ktorí neodpovedali na predchádzajúcu liečbu pegylovaným interferónom
alfa-2b/ribavirínom, v ktorej boli pacienti podrobení buď 48-týždňovej, alebo 72-týždňovej liečbe, došlo kvôli nežiaducim udalostiam alebo laboratórnym odchýlkam k predčasnému ukončeniu liečby Pegasysom u 6 % pacientov a liečby ribavirínom u 7 % pacientov v skupine liečenej 48 týždňov a v skupine liečenej 72 týždňov z rovnakého dôvodu liečbu Pegasysom predčasne ukončilo 12 % pacientov a liečbu ribavirínom 13 % pacientov. Podobne aj u pacientov s cirhózou alebo prechodom do cirhózy sa predčasné ukončenie liečby Pegasysom a liečby ribavirínom vyskytovalo častejšie v skupine liečenej 72 týždňov (13 % a 15 %) než v skupine liečenej 48 týždňov (6 % a 6 %). Pacienti, ktorí kvôli hematologickej toxicite predčasne ukončili predchádzajúcu liečbu pegylovaným interferónom alfa-2b/ribavirínom, boli z účasti na tejto štúdii vylúčení.
V ďalšom klinickom skúšaní boli 48 týždňov liečení pacienti s pokročilou fibrózou alebo cirhózou (Ishakovo skóre 3 až 6), ktorí neodpovedali na predchádzajúcu liečbu a ktorí mali pred zaradením do štúdie počet trombocytov iba 50 000/mm3. Odchýlky laboratórnych hematologických parametrov pozorované počas prvých 20 týždňov štúdie zahŕňali anémiu (26 % pacientov malo hladinu hemoglobínu < 10 g/dl), neutropéniu (30 % pacientov malo ANC < 750/mm3) a trombocytopéniu
(13 % pacientov malo počet trombocytov < 50 000/mm3) (pozri časť 4.4).
Súčasná infekcia vírusom chronickej hepatitídy C a vírusom HIV
U pacientov súčasne infikovaných vírusmi HIV-HCV boli profily klinických nežiaducich reakcií pri liečbe Pegasysom samotným alebo v kombinácii s ribavirínom podobné ako profily u pacientov infikovaných len HCV. U HIV-HCV pacientov, ktorí dostávali Pegasys a ribavirín v kombinovanej liečbe, boli hlásené ďalšie nežiaduce účinky u ≥ 1 % až ≤ 2 % pacientov: hyperlaktacidémia/laktát acidóza, chrípka, pneumónia, psychická labilita, apatia, hučanie v ušiach, faryngolaryngeálna bolesť, zápal pery, získaná lipodystrofia a chromatúria. Liečba Pegasysom bola spojená s poklesom absolútneho počtu CD4+ buniek počas prvých 4 týždňov bez zníženia percenta CD4+ buniek. Pokles počtu CD4+ buniek bol po znížení dávky alebo po ukončení liečby reverzibilný. Používanie Pegasysu nemalo žiadny pozorovateľný negatívny vplyv na kontrolu HIV virémie počas liečby alebo následnom sledovaní pacientov. U koinfikovaných pacientov s počtom CD4+ buniek < 200/μl sú údaje
o bezpečnosti obmedzené.
Tabuľkový súhrn nežiaducich reakcií
V tabuľke 9 sú zhrnuté nežiaduce účinky hlásené u CHB alebo CHC pacientov pri liečbe Pegasysom
v monoterapii a u CHC pacientov liečených Pegasysom v kombinácii s ribavirínom. Nežiaduce účinky hlásené v klinických štúdiách sú zoradené do skupín podľa frekvencie a to nasledovne: veľmi časté
(≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až
< 1/1 000), veľmi zriedkavé (< 1/10 000). Frekvencia nežiaducich účinkov na základe spontánnych
hlásení vychádzajúcich zo skúseností po uvedení lieku na trh nie je známa (nemožno ju odhadnúť z dostupných údajov). V rámci jednotlivých skupín je frekvencia nežiaducich účinkov z hľadiska závažnosti usporiadaná v klesajúcom poradí.
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Infekcie a
nákazy
|
|
bronchitída,
infekcie horných dýchacích ciest, kandidóza
ústnej dutiny, herpes simplex, hubovité,
vírusové
a bakteriálne infekcie
|
pneumónia,
kožná infekcia
|
endokarditída,
zápal vonkajšieho ucha
|
|
sepsa
|
Benígne a
malígne nádory
|
|
|
neoplazma
pečene
|
|
|
|
Poruchy krvi
a lymfatického systému
|
|
trombocytopéni
a, anémia, lymfadenopatia
|
|
pancytopénia
|
aplastická
anémia
|
izolovaná
aplázia červených krviniek
|
Poruchy
imunitného systému
|
|
|
sarkoidóza,
tyroiditída
|
anafylaxia,
systémový lupus erythematosus, reumatoidná artritída
|
idiopatická
alebo tromboticko- trombocyto- penická purpura
|
odvrhnutie
transplantátu pečene
a obličiek, Vogt- Koyanagi-
Harada
ochorenie
|
Poruchy
endokrinnéh o systému
|
|
hypotyreóza,
hypertyreóza
|
diabetes
|
diabetická
ketoacidóza
|
|
|
Poruchy
metabolizmu a výživy
|
anorexia
|
|
dehydratácia
|
|
|
|
Psychické
poruchy
|
depresia*,
úzkosť, nespavosť*
|
agresia, zmeny
nálady, emočné poruchy nervozita, pokles libida
|
samovražedné
myšlienky, halucinácie
|
samovražda,
psychotická porucha
|
|
mánia,
bipolárne poruchy, myšlienky na vraždu
|
Poruchy
nervového systému
|
bolesť
hlavy, závrat*, zníženie
koncentrá-
cie
|
synkopa,
migréna, porucha pamäti slabosť,
hypoestézia,
hyperestézia, parestézia, tremor, porucha chuti, nočné mory, ospanlivosť
|
periférna neuropatia
|
kóma, kŕče, paréza tváre
|
|
cerebrálna ischémia
|
Poruchy oka
|
|
neostré videnie,
bolesť oka, zápal oka, xeroftalmia
|
krvácanie do
sietnice
|
zraková
neuropatia, papiloedém, poškodenie ciev sietnice, retinopatia, vred rohovky
|
strata zraku
|
serózne
odlúčenie sietnice
|
|
|
Tabuľka 9: Nežiaduce účinky hlásené v klinických skúšaniach a po uvedení lieku na trh pri monoterapii Pegasysom u pacientov s HBV alebo s HCV alebo v kombinácii s ribavirínom u HCV pacientov
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Poruchy
ucha a labyrintu
|
|
vertigo, bolesť
ucha
|
strata sluchu
|
|
|
|
Poruchy
srdca a srdcovej činnosti
|
|
tachykardia,
periférny edém, palpitácie,
|
|
infarkt
myokardu, kongestívne zlyhanie srdca, kardiomyopatia
, angína, arytmia, fibrilácia predsiene, perikarditída, supra - vertikulárna tachykardia
|
|
|
Poruchy ciev
|
|
sčervenanie
|
hypertenzia
|
krvácanie do
mozgu, vaskulitída
|
|
periférna
ischémia
|
Poruchy
dýchacej sústavy hrudníka
amediastína
|
dýchavica
|
námahová
dýchavica, krvácanie
z nosa, zápal nosohltana,
kongescia prínosných
dutín, nádcha,
kongescia nosovej sliznice, bolesť hrdla
|
sipot
|
intersticiálna pneumónia,
vrátane úmrtia, pľúcna embólia
|
|
|
Poruchy
gastrointesti nál-neho traktu
|
hnačka*,
nevoľnosť*, bolesť brucha*
|
vracanie,
dyspepsia, dysfágia, ulcerácia dutiny ústnej, krvácanie ďasien, glositída, stomatitída, plynatosť, sucho v ústach
|
gastrointesti-
nálne krvácanie
|
peptický vred,
pankreatitída
|
|
ischemická
kolitída
|
Poruchy
pečene a žlčových ciest
|
|
|
porucha
funkcie pečene
|
zlyhanie
pečene, cholangitída, stukovatenie
pečene
|
|
|
Poruchy
kože a podkožného tkaniva
|
alopécia,
dermatití- da, svrbenie, suchá koža
|
psoriáza,
urtikária, ekzém, vyrážka, zvýšené potenie, kožná porucha, fotosenzitivita, nočné potenie
|
|
|
Stevens-
Johnsonov syndróm, toxická epidermálna nekrolýza, angioedém, erythema multiforme
|
|
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Poruchy
kostrovej a svalovej sústavy a
spojivového
tkaniva
|
myalgia,
artralgia
|
bolesť chrbta,
artritída, svalová slabosť, bolesť
kostí, bolesť
šije, bolesť svalov a kostrového systému, svalové kŕče
|
|
myozitída
|
|
rabdomyo-lýza
|
Poruchy
obličiek a močo- vých ciest
|
|
|
|
renálna
insuficiencia
|
|
|
Poruchy
reprodukčné ho systému a prsníkov
|
|
impotencia
|
|
|
|
|
Celkové
poruchy a reakcie
v mieste podania
|
pyrexia,
zimnica* bolesť*, asténia, únava, reakcia
v mieste podania injekcie*, citlivosť*
|
bolesť na
hrudníku, príznaky podobné chrípke, malátnosť, letargia, návaly tepla, smäd
|
|
|
|
|
Laboratórne
a funkčné vyšetrenia
|
|
úbytok
hmotnosti
|
|
|
|
|
Úrazy,
otravy a komplikácie liečebného postupu
|
|
|
|
predávkovanie
liekom
|
|
|
*Tieto nežiaduce reakcie boli časté (
≥1/100 až < 1/10) u CHB pacientov liečených Pegasysom v monoterapii.
Popis vybraných nežiaducich reakciíLaboratórne hodnoty
Liečbu Pegasysom sprevádzali nasledovné odchýlky laboratórnych parametrov: zvýšenie ALT, zvýšenie bilirubínu, poruchy rovnováhy elektrolytov (hypokaliémia, hypokalciémia, hypofosfatémia), hyperglykémia, hypoglykémia a zvýšenie triglyceridov (pozri časť 4.4). U oboch spôsobov liečby, t.j. pri použití Pegasysu v monoterapii aj v kombinácii s ribavirínom sa u 2 % pacientov pozoroval vzostup hladín ALT, ktorý si vyžiadal úpravu dávkovania alebo ukončenie liečby.
Liečba Pegasysom bola spojená s poklesom hematologických parametrov (leukopénia, neutropénia, lymfopénia, trombocytopénia a pokles hemoglobínu), ktoré sa po úprave dávkovania obyčajne zlepšili a vrátili na úroveň spred liečby v priebehu 4 - 8 týždňov po ukončení liečby (pozri časti 4.2 a 4.4).
Mierna neutropénia (ANC: 0,749 – 0,5 x 109/l) sa pozorovala u 24 % (216/887) pacientov a ťažká neutropénia (ANC: < 0,5 x 109/l) u 5 % (41/887) pacientov, ktorí dostávali Pegasys v dávke
180 mikrogramov v kombinácii s ribavirínom v dávke 1 000 mg alebo 1 200 mg počas 48 týždňov.
Protilátky proti interferónu
U 1 – 5 % pacientov liečených Pegasysom sa zistila prítomnosť neutralizačných protilátok. Podobne ako v prípade ďalších interferónov, vyšší výskyt neutralizačných protilátok sa pozoroval aj pri
chronickej hepatitíde B. Avšak pri žiadnej z týchto chorôb to nesúviselo s nedostatočnou terapeutickou
odpoveďou.
Funkcia štítnej žľazyLiečbu Pegasysom sprevádzali klinicky významné odchýlky hodnôt parametrov štítnej žľazy, ktoré si vyžadovali klinický zásah (pozri časť 4.4). Výskyt pozorovaných odchýlok (4,9 %) u pacientov
liečených Pegasysom v kombinácii s ribavirínom (NV15801) je podobný ako u pacientov liečených
inými interferónmi.
Laboratórne hodnoty u pacientov súčasne infikovaných vírusmi HIV-HCVHoci hematologická toxicita neutropénie, trombocytopénie a anémie sa vyskytovala častejšie u HIV- HCV pacientov, väčšina prípadov sa dala zvládnuť úpravou dávkovania a použitím rastových faktorov a vzácne došlo k predčasnému ukončeniu liečby. Pokles hladín ANC pod 500 buniek/mm3 sa
pozoroval u 13 % a 11 % pacientov, ktorí dostávali Pegasys v monoterapii a v kombinácii v uvedenom poradí. Pokles počtu krvných doštičiek pod 50 000/mm3 sa pozoroval u 10 % a 8 % pacientov, ktorí dostávali Pegasys v monoterapii a v kombinácii v uvedenom poradí. Anémia (hemoglobín < 10 g/dl)
sa popísala u 7 % a 14 % pacientov liečených Pegasysom v monoterapii a v kombinácii v uvedenom
poradí.
Pediatrická populáciaChronická hepatitída CV klinickom skúšaní so 114 pediatrickými pacientmi (vo veku 5 až 17 rokov) liečenými samotným Pegasysom alebo v kombinácii s ribavirínom (pozri časť 5.1) boli úpravy dávky potrebné u približne jednej tretiny pacientov najčastejšie kvôli neutropénii a anémii. Vo všeobecnosti bol bezpečnostný profil pozorovaný u pediatrických pacientov podobný ako profil pozorovaný u dospelých. Vpediatrickej najrozšírenejšie nežiaduce reakcie u pacientov liečených kombinovanou liečbou Pegasysom a ribavirínom počas až 48 týždňov boli ochorenie podobné chrípke (91 %), bolesť hlavy (64 %), gastrointestinálne ochorenie (56 %) a reakcie v mieste podania injekcie (45 %). Úplný zoznam nežiaducich reakcií hlásených v tejto liečebnej skupine (n = 55) je uvedený v tabuľke 10. Sedem pacientov užívajúcich kombinovanú liečbu Pegasysom a ribavirínom počas 48 týždňov prerušilo
liečbu s bezpečnostných dôvodov (depresia, abnormálne hodnotenie psychického stavu, prechodná slepota, exudáty na sietnici , hyperglykémia, diabetes mellitus typu 1 a anémia). Väčšina nežiaducich reakcií zaznamenaných v štúdii bola mierna alebo stredne závažná. Závažné nežiaduce reakcie sa zaznamenali u 2 pacientov v skupine s kombinovanou liečbou Pegasysom plus ribavirín (hyperglykémia a cholecystektómia).
Tabuľka 10: Nežiaduce reakcie hlásené u pediatrických pacientov infikovaných vírusom HCVpripisované Pegasysu plus ribavirínu v štúdii NV17424Telový systém
| Veľmi časté
| Časté
|
Infekcie a nákazy
|
| infekčná mononukleóza,
streptokoková faryngitída, chrípka, vírusová gastroenteritída, kandidóza, gastroenteritída, zubný absces, hordeolum, infekcia močových ciest, zápal nosohltana
|
Poruchy krvi a lymfatického
systému
|
| anémia
|
Poruchy metabolizmu a výživy
| zníženie chute do jedla
| hyperglykémia, diabetes mellitus
typu 1
|
T
elový systém
|
V
eľmi časté
|
Č
asté
|
Psychické poruchy
|
insomnia
|
depresia, úzkosť, halucinácie,
nenormálne správanie, agresia, hnev, zníženie pozornosti/neusporiadaná hyperaktivita
|
Poruchy nervového systému
|
bolesť hlavy
|
závrat, porucha pozornosti, migréna
|
Poruchy oka
|
|
prechodná slepota, exudáty na
sietnici, zhoršenie videnia, podráždenie oka, bolesť oka, svrbenie oka
|
Poruchy ucha a labyrintu
|
|
bolesť ucha
|
Poruchy dýchacej sústavy, hrudníka
a mediastína
|
|
dyspnoe, epistaxa
|
Poruchy gastrointestinálneho traktu
|
gastrointestinálna porucha
|
bolesť v nadbrušku, stomatitída,
nevoľnosť, aftózna stomatitída, orálna porucha
|
Poruchy kože a
podkožného tkaniva
|
vyrážka, svrbenie, alopécia
|
opuch tváre, liekový exantém
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
|
muskuloskeletálna bolesť
|
bolesť chrbta, bolesť končatín
|
Poruchy obličiek a močových ciest
|
|
dyzúria, inkontinencia, porucha
močového traktu
|
Poruchy reprodukčného systému a
prsníkov
|
|
výtok z pošvy
|
Celkové poruchy a reakcie v mieste
podania
|
ochorenie podobné chrípke, reakcia
v mieste podania injekcie, iritabilita, únava
|
horúčka, hematóm v mieste podania
injekcie do žily, , bolesť
|
Laboratórne a funkčné vyšetrenia
|
|
abnormálny psychiatrický nález
|
Chirurgické a liečebné postupy
|
|
extrakcia zuba, cholecystektómia
|
Sociálne podmienky
|
|
problém s učením
|
U pediatrických pacientov sa pozorovala inhibícia rastu (pozri časť 4.4). V porovnaní
s východiskovým stavom sa u pediatrických pacientov po 48 týždňoch terapie kombinovanou liečbou
Pegasysom plus ribavirínom pediatrických pacientov preukázalo oneskorenie v náraste hmotnosti
a výšky. Počas liečby klesli percentily „hmotnosti vzhľadom na vek“ a percentily„výšky vzhľadom na vek“ v porovnaní s normálnou populáciou. Na konci 2-ročného sledovania po liečbe sa väčšina jedincov vrátila k východiskovým percentilom normálnej rastovej krivky pre hmotnosť a výšku (priemerný percentil hmotnosti bol 64 % na začiatku a 60 % 2 roky po liečbe; priemerný percentil výšky bol 54 % na začiatku a 56 % 2 roky po liečbe). Na konci liečby sa u 43 % jedincov znížil percentil hmotnosti o 15 percentilov alebo viac a u 25 % sa znížil percentil výšky o 15 percentilov alebo viac v porovnaní s normálnou rastovou krivkou. 2 roky po liečbe bolo 16 % osôb stále 15 percentilov alebo viac pod svojou východiskovou krivkou hmotnosti a 11 % 15 percentilov alebo viac pod svojou východiskovou krivkou výšky.
Laboratórne hodnotyZníženie hemoglobínu, počtu neutrofilov a trombocytov môže vyžadovať zníženie dávky alebo trvalé vysadenie liečby (pozri tabuľku 3 a tabuľku 7). Väčšina patologických zmien v laboratórnych
parametroch zaznamenaných počas klinického skúšania sa v krátkom čase po ukončení liečby vrátila
na východiskovú úroveň.
4.9 PredávkovanieOpísali sa prípady predávkovania v rozsahu od dvoch injekcií podaných počas 2 nasledujúcich dní
(namiesto týždenného intervalu) až po každodenné podávanie injekcií počas 1 týždňa (t.j.
1 260 mikrogramov/týždeň). U žiadneho z týchto pacientov sa neobjavili nezvyčajné resp. závažné alebo liečbu limitujúce udalosti. V klinických štúdiách pri karcinóme obličiek a chronickej myeloidnej leukémii sa podávali týždenné dávky až do 540 mikrogramov a 630 mikrogramov. Medzi toxické
prejavy limitujúce dávkovanie patrila únava, elevácia pečeňových enzýmov, neutropénia, trombocytopénia, čo zodpovedá interferónovej liečbe.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Imunostimulanciá, interferóny, ATC kód: L03A B11
Spôsob účinku
Konjugácia reagentu PEG (bis-monometoxypolyetylénglykol) s interferónom alfa-2a vedie k vzniku
pegylovaného interferónu alfa-2a (Pegasys). Pegasys in vitro vykazuje antivírusové a antiproliferatívne účinky, ktoré sú charakteristické pre interferón alfa-2a.
Interferón alfa-2a je konjugovaný s bis-[monometoxypolyetylénglykolom] v rozsahu substitúcie jedného mólu polyméru/mól bielkoviny. Priemerná molekulová hmotnosť je asi 60 000, z ktorej podiel bielkoviny tvorí približne 20 000.
Farmakodynamické účinky
U pacientov s hepatitídou C reagujúcich na liečbu Pegasysom 180 mikrogramov dochádza
k bifázickému poklesu hladín HCV RNA. Prvá fáza poklesu sa objavuje 24 až 36 hodín po prvej dávke Pegasysu. Po nej dochádza k druhej fáze poklesu, ktorá pretrváva počas nasledovných 4 - 16 týždňov u pacientov, ktorí dosiahnu pretrvávajúcu odpoveď na liečbu. Ribavirín nemá žiadny významný vplyv na začiatočnú vírusovú kinetiku počas prvých 4 až 6 týždňov u pacientov liečených kombináciou ribavirínu a pegylovaného interferónu alfa-2a alebo interferónu alfa.
Klinická účinnosť a bezpečnosť
Chronická hepatitída B
Na všetkých klinických skúšaniach sa zúčastnili pacienti s chronickou hepatitídou B, u ktorých sa zistila aktívna vírusová replikácia meraná ako HBV DNA, zvýšené hladiny ALT a biopsia pečene bola konzistentná s chronickou hepatitídou. V štúdii WV16240 sa zúčastnili pacienti, ktorí boli pozitívni na HBeAg, zatiaľ čo v štúdii WV16241 sa zúčastnili pacienti, ktorí boli negatívni na HBeAg a pozitívni na anti-HBe. V obidvoch štúdiách liečba trvala 48 týždňov a sledovanie po liečbe trvalo 24 týždňov. V obidvoch štúdiách sa porovnával Pegasys plus placebo vs. Pegasys plus lamivudín vs. lamivudín v monoterapii. Do týchto klinických skúšaní neboli zaradení pacienti s HBV-HIV koinfekciou.
Miery odpovedí na konci sledovania u týchto dvoch štúdií sú uvedené v tabuľke 11. V štúdii WV16240, primárne koncové ukazovatele na hodnotenie účinnosti boli HBeAg sérokonverzia a HBV- DNA pod 105 kópií/ml. V štúdii WV16241, primárne koncové ukazovatele na hodnotenie účinnosti boli normalizácia ALT a HBV-DNA pod 2 x 104 kópií/ml. HBV DNA sa merala pomocou testu COBAS AMPLICORTM HBV MONITOR (hranica detekcie 200 kópií/ml).
Celkove 283/1351 (21 %) pacientov malo pokročilú fibrózu alebo cirhózu, 85/1351 (6 %) malo cirhózu. Neboli rozdiely v miere odpovede medzi týmito pacientmi a tými bez pokročilej fibrózy alebo cirhózy.
Tabuľka 11: Sérologická, virologická a biochemická odpoveď pri chronickej hepatitíde B
|
HBeAg-pozitívni pacienti
Štúdia WV16240
|
HBeAg-negatívni / anti-HBe-pozitívni pacienti
Štúdia WV16241
|
Parameter odpovede
|
Pegasys
180 µg
&
placebo
(N = 271)
|
Pegasys
180 µg
&
lamivudín
100 mg
(N = 271)
|
lamivudín
100 mg
(N = 272)
|
Pegasys
180 µg
&
placebo
(N = 177)
|
Pegasys
180 µg
&
lamivudín
100 mg
(N = 179)
|
lamivudín
100 mg
(N = 181)
|
HBeAg
sérokonverzia
|
32 %#
|
27 %
|
19 %
|
N/A
|
N/A
|
N/A
|
HBV DNA
odpoveď*
|
32 %#
|
34 %
|
22 %
|
43 %#
|
44 %
|
29 %
|
ALT
normalizácia
|
41 %#
|
39 %
|
28 %
|
59 %#
|
60 %
|
44 %
|
HBsAg
sérokonverzia
|
3 %#
|
3 %
|
0 %
|
3 %
|
2 %
|
0 %
|
|
|
* Pre HBeAg-pozitívnych pacientov: HBV DNA < 105 kópií/ml
Pre HBeAg-negatívnych / anti-HBe-pozitívnych pacientov: HBV DNA < 2 x 104 kópií/ml
# p-hodnota (vs. lamivudín) ≤ 0,01 (stratifikovaný Cochran-Mantel-Haenszelov test)
Histologická odpoveď bola v každej štúdii vo všetkých troch liečebných skupinách podobná; avšak pacienti, u ktorých sa dokázala trvalá odpoveď 24 týždňov po ukončení liečby, s oveľa vyššou pravdepodobnosťou dosiahli tiež histologické zlepšenie.
Všetci pacienti, ktorí ukončili štúdie fázy III, boli vhodní na zaradenie do štúdie s dlhodobým sledovaním (WV16866). V skupine pacientov v štúdii WV16240, ktorí dostávali Pegasys
v monoterapii a boli zaradení do štúdie s dlhodobým sledovaním, stupeň trvalej HBeAg sérokonverzie
12 mesiacov po ukončení terapie bol 48 % (73/153). U pacientov, ktorí dostávali Pegasys
v monoterapii v štúdii WV16241, stupeň HBV DNA odpovede a normalizácie ALT 12 mesiacov po ukončení liečby bol 42 % (41/97) a 59 % (58/99).
Chronická hepatitída CPredpoklad odpovede na liečbuPozrite si časť 4.2 v tabuľke 2.
Závislosť odpovede na liečbu od dávky pri monoterapiiPri priamom porovnaní dávok 90 mikrogramov a 180 mikrogramov bola dávka 180 mikrogramov spojená s lepšou pretrvávajúcou virologickou odpoveďou na liečbu u pacientov s cirhózou, avšak
v štúdii s pacientmi bez cirhózy sa pri dávkach 135 mikrogramov a 180 mikrogramov dosiahli veľmi podobné výsledky.
Potvrdzujúce klinické štúdie u dospelých predtým neliečených pacientovVšetky klinické štúdie zahŕňali pacientov, ktorí predtým nedostávali interferón a u ktorých sa chronická hepatitída C potvrdila prítomnosťou detekovateľných hladín HCV RNA v sére, zvýšenými hladinami ALT (s výnimkou štúdie NR16071) a biopsiou pečene s nálezom chronickej hepatitídy. Štúdia NV15495 špecificky zahŕňala pacientov s diagnózou cirhózy (približne 80 %) alebo prechodu do cirhózy (približne 20 %), ktoré sa potvrdili histologicky. Do štúdie NR15961 sa zahrnuli len HIV- HCV koinfikovaní pacienti (pozri tabuľku 20). Títo pacienti mali stabilné HIV ochorenie a priemer počtu CD4 T-buniek bol okolo 500 buniek/μl.
Údaje o liečebných režimoch, dĺžke trvania liečby a výsledkoch štúdií u HCV monoinfikovaných pacientov a HIV-HCV koinfikovaných pacientov sa uvádzajú v tabuľkách 12, 13, 14 a v tabuľke 20. Virologická odpoveď na liečbu sa definovala ako nemerateľné hladiny HCV RNA pri vyšetrení COBAS AMPLICOR™ HCV Test, Version 2.0 (detekčný limit: 100 kópií/ml, čo zodpovedá
50 medzinárodným jednotkám/ml). Trvalá odpoveď sa definovala ako jedna negatívna vzorka približne 6 mesiacov po ukončení liečby.
Histologická odpoveď bola v každej štúdii vo všetkých troch liečebných skupinách podobná; avšak pacienti, u ktorých sa dokázala trvalá odpoveď 24 týždňov po ukončení liečby, s oveľa vyššou pravdepodobnosťou dosiahli tiež histologické zlepšenie.
Všetci pacienti, ktorí ukončili štúdie fázy III, boli vhodní na zaradenie do štúdie s dlhodobým sledovaním (WV16866). V skupine pacientov v štúdii WV16240, ktorí dostávali Pegasys
v monoterapii a boli zaradení do štúdie s dlhodobým sledovaním, stupeň trvalej HBeAg sérokonverzie
12 mesiacov po ukončení terapie bol 48 % (73/153). U pacientov, ktorí dostávali Pegasys
v monoterapii v štúdii WV16241, stupeň HBV DNA odpovede a normalizácie ALT 12 mesiacov po ukončení liečby bol 42 % (41/97) a 59 % (58/99).
Chronická hepatitída C Predpoklad odpovede na liečbu
Pozrite si časť 4.2 v tabuľke 2.
Závislosť odpovede na liečbu od dávky pri monoterapii
Pri priamom porovnaní dávok 90 mikrogramov a 180 mikrogramov bola dávka 180 mikrogramov spojená s lepšou pretrvávajúcou virologickou odpoveďou na liečbu u pacientov s cirhózou, avšak
v štúdii s pacientmi bez cirhózy sa pri dávkach 135 mikrogramov a 180 mikrogramov dosiahli veľmi podobné výsledky.
Potvrdzujúce klinické štúdie u dospelých predtým neliečených pacientov
Všetky klinické štúdie zahŕňali pacientov, ktorí predtým nedostávali interferón a u ktorých sa chronická hepatitída C potvrdila prítomnosťou detekovateľných hladín HCV RNA v sére, zvýšenými hladinami ALT (s výnimkou štúdie NR16071) a biopsiou pečene s nálezom chronickej hepatitídy. Štúdia NV15495 špecificky zahŕňala pacientov s diagnózou cirhózy (približne 80 %) alebo prechodu do cirhózy (približne 20 %), ktoré sa potvrdili histologicky. Do štúdie NR15961 sa zahrnuli len HIV- HCV koinfikovaní pacienti(pozri tabuľku 20). Títo pacienti mali stabilné HIV ochorenie a priemer počtu CD4 T-buniek bol okolo 500 buniek/μl.
Údaje o liečebných režimoch, dĺžke trvania liečby a výsledkoch štúdií u HCV monoinfikovaných
pacientov a HIV-HCV koinfikovaných pacientov sa uvádzajú v tabuľkách 12, 13, 14 a v tabuľke 20. Virologická odpoveď na liečbu sa definovala ako nemerateľné hladiny HCV RNA pri vyšetrení COBAS AMPLICOR™ HCV Test, Version 2.0 (detekčný limit: 100 kópií/ml, čo zodpovedá 50 medzinárodným jednotkám/ml). Trvalá odpoveď sa definovala ako jedna negatívna vzorka približne 6 mesiacov po ukončení liečby.
Tabuľka 12:Virologická odpoveď u HCV pacientov
|
Monoterapia Pegasysom
|
Kombinovaná liečba Pegasysom
|
pacienti s cirhózou aj bez nej
|
Pacienti s cirhózou
|
pacienti s cirhózou aj bez nej
|
Štúdia NV15496 + NV15497 + NV15801
|
Štúdia NV15495
|
Štúdia
NV15942
|
Štúdia NV15801
|
Pegasys
180 µg
(N = 701)
48 týždňov
|
interferón alfa-2a
6 MIU/3 MIU
&
3 MIU
(N = 478)
48 týždňov
|
Pegasys
180 µg
(N = 87)
48 týždňov
|
interferón alfa-2a
3 MIU
(N = 88)
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200
mg
(N = 436)
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
(N = 453)
48 týždňov
|
interferón alfa-2b
3 MIU
&
ribavirín
1000/1200
mg
(N = 444)
48 týždňov
|
Odpoveď
na konci liečby
|
55 - 69 %
|
22 - 28 %
|
44 %
|
14 %
|
68 %
|
69 %
|
52 %
|
Celková
trvalá odpoveď
|
28 - 39 %
|
11 - 19 %
|
30 %∗
|
8 %∗
|
63 %
|
54 %∗∗
|
45 %∗∗
|
∗ 95 % CI pre rozdiel: 11 % až 33 % p = 0,001 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
∗∗ 95 % CI pre rozdiel: 3 % až 16 % p = 0,003 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
Virologické odpovede na liečbu vo vzťahu ku genotypu a vírusovej záťaži pred liečbou u HCV monoinfikovaných pacientov liečených Pegasysom v kombinácii s ribavirínom a v závislosti na genotype, vírusovej záťaži pred liečbou a rýchlej virologickej odpovede v 4. týždni sú zhrnuté
v tabuľke 13 a v tabuľke 14. Výsledky štúdie NV15942 poskytujú racionálne podklady pre odporúčania liečebných režimov na základe genotypu, vírusovej záťaže na začiatku liečby a virologickej odpovede v 4. týždni (pozri tabuľky 1, 13 a 14).
Rozdiel medzi liečebnými režimami nebol vo všeobecnosti ovplyvnený prítomnosťou/neprítomnosťou cirhózy; preto tieto základné charakteristiky neovplyvňujú tieto odporúčania pre liečbu pre
genotypy 1, 2 alebo 3.
Tabuľka 13:Trvalá virologická odpoveď u HCV pacientov po kombinovanej liečbe Pegasysom a ribavirínom v závislosti na genotype a vírusovej záťaži pred liečbou
|
Štúdia NV15942
|
Štúdia NV15801
|
Pegasys
180 µg
&
ribavirín
800 mg
24 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
|
Pegasys
180 µg
&
ribavirín
800 mg
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Interferón alfa-
2b
3 MIU
&
ribavirín
1000/1200 mg
48 týždňov
|
Genotyp 1
Nízka
vírusová záťaž
Vysoká vírusová záťaž
|
29 %(29/101)
41 %(21/51)
16 %(8/50)
|
42 %(49/118) ∗
52 %(37/71)
26 %(12/47)
|
41 %(102/250) ∗
55 %(33/60)
36 %(69/190)
|
52 %(142/271) ∗
65 %(55/85)
47 %(87/186)
|
45 %(134/298)
53 %(61/115)
40 %(73/182)
|
36 %(103/285)
44 %(41/94)
33 %(62/189)
|
Genotyp 2/3
Nízka
vírusová záťaž
Vysoká vírusová záťaž
|
84 %(81/96)
85 %(29/34)
84 %(52/62)
|
81 %(117/144)
83 %(39/47)
80 %(78/97)
|
79 %(78/99)
88 %(29/33)
74 %(49/66)
|
80 %(123/153)
77 %(37/48)
82 %(86/105)
|
71 %(100/140)
76 %(28/37)
70 %(72/103)
|
61 %(88/145)
65 %(34/52)
58 %(54/93)
|
Genotyp 4
|
(0/5)
|
(8/12)
|
(5/8)
|
(9/11)
|
(10/13)
|
(5/11)
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; Vysoká vírusová záťaž = > 800 000 IU/ml
* Pegasys 180 µg & ribavirín 1000/1200 mg, 48 týždňov v porovnaní s Pegasysom 180 µg & ribavirínom 800 mg
48 týždňov: Odds Ratio (95 % CI) = 1,52 (1,07 až 2,17), p=0,020 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
* Pegasys 180 µg & ribavirín 1000/1200 mg, 48 týždňov v porovnaní s Pegasysom 180 µg & ribavirínom 1000/1200 mg,
24 týždňov: Odds Ratio (95 % CI) = 2,12 (1,30 až 3,46), p=0,002 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
Možnosť zvážiť skrátenie dĺžky trvania liečby na 24 týždňov u pacientov s genotypom 1 a 4 sa sledovala na podklade dosiahnutej trvalej virologickej odpovede u pacientov s rýchlou virologickou odpoveďou v 4. týždni v štúdiách NV15942 a ML17131 (pozri tabuľku 14).
Štúdia NV15942
| Štúdia ML17131
|
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Genotyp 1
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 90 % (28/31)
93 % (25/27)
75 % (3/4)
| 92 % (47/51)
96 % (26/27)
88 % (21/24)
| 77 % (59/77)
80 % (52/65)
58 % (7/12)
| Genotyp 1 nie RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 24 % (21/87)
27 % (12/44)
21 % (9/43)
| 43 % (95/220)
50 % (31/62)
41 % (64/158)
| -
-
-
| Genotyp 4 RVR
| (5/6)
| (5/5)
| 92 % (22/24)
| Genotyp 4 nie RVR
| (3/6)
| (4/6)
| -
|
|
|
Tabuľka 14:Trvalá virologická odpoveď v závislosti na rýchlej virologickej odpovedi v 4. týždni pre genotyp 1 a 4 po kombinovanej liečbe Pegasysom a ribavirínom u HCV pacientovNízka vírusová záťaž = ≤ 800 000 IU/ml; Vysoká vírusová záťaž = > 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedegovateľná HCV RNA) v 4. týždni a nedegovateľná HCV RNA v 24 týždni.
Údaje, i keď obmedzené, ukazujú, že skrátenie času na 24 týždňov, sa môže spájať s vysokým rizikom relapsu (pozri tabuľku 15).
Tabuľka 15: Relaps vo virologickej odpovedi na konci liečby u populácie s rýchlou virologickou odpoveďou
| Štúdia NV15942
| Štúdia NV15801
|
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Genotyp 1 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 6,7 % (2/30)
3,8 % (1/26)
25 % (1/4)
| 4,3 % (2/47)
0 % (0/25)
9,1 % (2/22)
| 0 % (0/24)
0 % (0/17)
0 % (0/7)
|
Genotyp 4 RVR
| (0/5)
| (0/5)
| 0 % (0/4)
|
Možnosť skrátenia liečby na 16 týždňov u pacientov genotypu 2 alebo 3 bola skúmaná na základe
trvalej virologickej odpovede pozorovanej u pacientov s rýchlou virologickou odpoveďou v 4. týždni v štúdii NV17317 (pozri tabuľku 16).
V štúdii NV17317 všetci pacienti infikovaní vírusovým genotypom 2 alebo 3 dostávali Pegasys 180ug subkutánne raz týždenne a ribavirín v dávke 800 mg a boli randomizovaní na liečbu počas 16 alebo 24 týždňov. Celková liečba počas 16 týždňov viedla ku nižšej trvalej virologickej odpovedi (65 %) než liečba počas 24 týždňov (76 %) (p<0,0001).
Trvalá virologická odpoveď dosiahnutá po 16. týždňoch liečby a po 24. týždňoch liečby sa sledovala retrospektívnou analýzou pacientov, ktorí boli HCV RNA negatívni v 4. týždni a mali iniciálne LVL (pozri tabuľku 16).
Tabuľka 16:Trvalá virologická odpoveď celkovo a na základe rýchlej virologickej odpovede v 4. týždni pre genotyp 2 alebo 3 po kombinovanej liečbe liekom Pegasysoms ribavirínom u HCV pacientovŠtúdia NV17317
|
a
| Pegasys 180 µg
&
ribavirín
800 mg
16 týždňov
| Pegasys 180 µg
&
ribavirín
800 mg
24 týždňov
| Rozdiel v liečbe
[95 %CI]
| p-hodnota
|
Genotyp 2 alebo 3
| 65 % (443/679)
| 76 % (478/630)
| -10,6 % [-15,5 %; -0,06 %]
| p<0,0001
|
Genotyp 2 alebo 3 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 82 % (378/461)
89 % (147/166)
78 % (231/295)
| 90 % (370/410)
94 % (141/150)
88 % (229/260)
| -8,2 % [-12,8 %; -3,7 %]
-5,4 % [-12 %; 0,9 %]
-9,7 % [-15,9 %;-3,6 %]
| p=0,0006
p=0,11
p=0,002
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž => 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedetegovateľné hladiny HCV RNA) v 4. týždni
V súčasnosti nie je jasné, či vyššia dávka ribavirínu (napr. 1 000/2 000 mg/deň podľa telesnej hmotnosti) vedie k vyššej trvalej virologickej odpovedi (SVR) než dávka 800 mg/deň, keď je liečba skrátená na 16 týždňov.
Údaje naznačujú, že skrátenie liečby na 16 týždňov sa môže spájať so zvýšeným rizikom relapsu
(pozri tabuľku 17).
Tabuľka 17: Relaps vo virologickej odpovedi po ukončení liečby u pacientov genotypu 2 alebo 3s rýchlou virologickou odpoveďou
|
Štúdia NV17317
|
|
Pegasys
180 µg
&
ribavirín
800 mg
16 týždňov
|
Pegasys
180 µg
&
ribavirín
800 mg
24 týždňov
|
Rozdiel v liečbe
[95 %CI]
|
p hodnota
|
Genotyp 2 alebo 3 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
15 % (67/439)
6 % (10/155)
20 % (57/284)
|
6 % (23/386)
1 % (2/141)
9 % (21/245)
|
9,3 % [5,2 %; 13,6 %]
5 % [0,6 % ; 10,3 %]
11,5 % [5,6 % ; 17,4 %]
|
p<0,0001
p=0,04
p=0,0002
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž = > 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedetegovateľné hladiny HCV RNA) v 4. týždni
Lepšia účinnosť Pegasysu v porovnaní s interferónom alfa-2a sa ukázala aj na histologickej odpovedi, vrátane pacientov s cirhózou a/alebo HIV-HCV koinfekciou.
Dospelí pacienti s chronickou hepatitídou C, ktorí neodpovedali na predchádzajúcu liečbu V štúdii MV17150 boli pacienti, ktorí neodpovedali na predchádzajú liečbu pegylovaným interferónom alfa-2b a ribavirínom, boli randomizovaní do štyroch rôznych liečebných skupín:
• Pegasys 360 µg/týždeň počas 12 týždňov a následne 180 µg/týždeň počas ďalších 60 týždňov;
• Pegasys 360 µg/týždeň počas 12 týždňov a následne 180 µg/týždeň počas ďalších 36 týždňov;
• Pegasys 180 µg/týždeň počas 72 týždňov;
• Pegasys 180 µg/týždeň počas 48 týždňov.
Všetci pacienti užívali ribavirín (1 000 alebo 1 200 mg/deň) v kombinácii s Pegasysom. Všetky
liečebné skupiny boli následne sledované počas 24-týždňového obdobia bez liečby.
Na základe viacnásobnej regresnej analýzy a súhrnnej skupinovej analýzy hodnotiacej vplyv dĺžky trvania liečby a podávania indukčnej dávky sa jednoznačne stanovilo, že liečba v trvaní 72 týždňov je primárnym faktorom dosiahnutia trvalej virologickej odpovede. Rozdiely v trvalej virologickej odpovedi (SVR) podmienené dĺžkou trvania liečby, demografickými ukazovateľmi a najlepšími odpoveďami na predchádzajúcu liečbu sú uvedené v tabuľke 18.
Tabuľka 18: Virologická odpoveď v 12. týždni (VR) a trvalá virologická odpoveď (SVR) u pacientov, ktorí neodpovedali na liečbu kombináciou peginterferónu alfa-2b a ribavirínu a ktorí dosiahli virologickú odpoveď v 12. týždni po liečbe kombináciou Pegasysu a ribavirínu
| Štúdia MV17150
|
|
|
| Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
72 alebo 48 týždňov (N = 942) pacienti s
VR v týždni 12 a
(N = 876)
| Pegasys 360/180
alebo 180 μg
&
ribavirín
1000/1200 mg
72 týždňov
(N = 473)
SVR u pacientov s VR v týždni 12 b (N = 100)
| Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
48 týždňov
(N = 469)
SVR u pacientov s VR v týždni 12 b (N = 57)
|
Celková trvalá odpoveď
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 18 % (157/876)
35 % (56/159)
14 % (97/686)
| 57 % (57/100)
63 % (22/35)
54 % (34/63)
| 35 % (20/57)
38 % (8/21)
32 % (11/34)
|
Genotyp 1/4
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 17 % (140/846)
35 % (54/154)
13 % (84/663)
| 55 % (52/94)
63 % (22/35)
52 % (30/58)
| 35 % (16/46)
37 % (7/19)
35 % (9/26)
|
Genotyp 2/3
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 58 % (15/26)
(2/5) (11/19)
| (4/5)
—
(3/4)
| (3/10)
(1/2) (1/7)
|
Prítomnosť cirhózy
Cirhóza
Neprítomnosť cirhózy
|
8 % (19/239)
22 % (137/633)
|
(6/13)
59 % (51/87)
|
(3/6)
34 % (17/50)
|
|
Štúdia MV17150
|
|
|
|
Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
72 alebo 48 týždňov (N = 942) pacienti s
VR v týždni 12 a
(N = 876)
|
Pegasys 360/180
alebo 180 μg
&
ribavirín
1000/1200 mg
72 týždňov
(N = 473)
SVR u pacientov s VR v týždni 12 b (N = 100)
|
Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
48 týždňov
(N = 469)
SVR u pacientov s VR v týždni 12 b (N = 57)
|
Najlepšia odpoveď počas predchádzajúcej liečby
Pokles u HCV RNA ≥2log10
Pokles u HCV RNA <2log10
Chýbanie najlepšej odpovede
|
28 % (34/121)
12 % (39/323)
19 % (84/432)
|
68 % (15/22)
64 % (16/25)
49 % (26/53)
|
(6/12) (5/14)
29 % (9/31)
|
Vysoká vírusová záťaž = > 800 000 IU/ml, nízka vírusová záťaž = ≤ 800 000 IU/ml;
a Pacienti, ktorí dosiahli potlačenie aktivity vírusu v 12. týždni (nedetegovateľná HCV RNA definovaná ako < 50 IU/ml) boli považovaní za pacientov s dosiahnutou virologickou odpoveďou v 12. týždni. Pacienti, ktorým chýbali výsledky HCV RNA
v 12. týždni boli vylúčení z analýzy.
b Pacienti, ktorí dosiahli potlačenie aktivity vírusu v 12. týždni, ale chýbali im výsledky HCV RNA na konci sledovania boli považovaní za pacientov, neodpovedajúcich na liečbu.
V štúdii HALT-C boli pacienti s chronickou hepatitídou C a pokročilou fibrózou alebo cirhózou, ktorí neodpovedali na predchádzajúcu liečbu interferónom alfa alebo pegylovaným interferónom alfa
v monoterapii alebo v kombinácii s ribavirínom, liečení Pegasysom 180 µg/týždeň a ribavirínom
1 000/1 200 mg denne. Pacienti, ktorí po 20 týždňoch liečby dosiahli nedetegovateľné hladiny
HCV RNA, pokračovali v kombinovanej liečbe Pegasysom a ribavirínom trvajúcej celkovo
48 týždňov a po ukončení liečby boli sledovaní 24 týždňov. Pravdepodobnosť trvalej virologickej odpovede sa líšila v závislosti od predchádzajúceho režimu liečby; pozri tabuľku 19.
 Tabuľka 19:Trvalá virologická odpoveď v štúdii HALT-C uvedená podľa predchádzajúceho režimu liečby u pacientov, ktorí naň neodpovedaliPredchádzajúca liečba Pegasys
Tabuľka 19:Trvalá virologická odpoveď v štúdii HALT-C uvedená podľa predchádzajúceho režimu liečby u pacientov, ktorí naň neodpovedaliPredchádzajúca liečba Pegasys 180 µg a
ribavirín 1 000/1 200 mg

počas 48 týždňov
Interferón 27 % (70/255)
Pegylovaný interferón 34 % (13/38)
Interferón a ribavirín 13 % (90/692)
Pegylovaný interferón a ribavirín 11 % (7/61) HIV-HCV koinfikovaní pacientiVirologické odpovede u pacientov, ktorí sú liečení s Pegasysom v monoterapii a s Pegasysom a ribavirínom v kombinácii v závislosti na genotype a vírusovej záťaži pred liečbou pre HIV-HCV
koinfikovaných pacientov sú zhrnuté nižšie v tabuľke 20.
Štúdia NR15961
|
| Interferón alfa-2a
3 MIU
&
ribavirín 800 mg
48 týždňov
| Pegasys
180 µg
&
placebo
48 týždňov
| Pegasys
180 µg
&
ribavirín 800 mg
48 týždňov
| Všetci pacienti
| 12 % (33/285)*
| 20 % (58/286) *
| 40 % (116/289) *
|
|
|
Tabuľka 20:Trvalá virologická odpoveď po liečbe Pegasysom v kombinácii s ribavirínom v závislosti na genotype a vírusovej záťaži u HIV-HCV súčasne infikovaných pacientov pred liečbou
Genotyp 1
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
7 % (12/171)
19 % (8/42)
3% (4/129)
|
14 % (24/175)
38 % (17/45)
5 % (7/130)
|
29 % (51/176)
61 % (28/46)
18 % (23/130)
|
Genotyp 2-3
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
20 % (18/89)
27 % (8/30)
17 % (10/59)
|
36 % (32/90)
38 % (9/24)
35 % (23/66)
|
62% (59/95)
61 % (17/28)
63 % (42/67)
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž = > 800 000 IU/ml
* Pegasys 180 µg & ribavirín 800 mg oproti Interferón alfa-2a 3 MIU, ribavirín 800 mg: Pomer pravdepodobnosti (95 % CI)=5,40 (3,42 – 8,54),… p-hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0001
* Pegasys 180 µg & ribavirín 800 mg oproti Pegasys 180 µg: Pomer pravdepodobnosti (95 % CI)=2,89 (1,93 – 4,32),… p- hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0001
* Interferón alfa-2a 3 MIU & ribavirín 800 mg oproti Pegasys 180 µg: Pomer pravdepodobnosti (95 % CI)=0,53 (0,33 –
0,85),… p-hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0084
Nasledujúca štúdia (NV18209) u pacientov s koinfekciou HCV genotyp 1 a HIV porovnávala liečbu Pegasysom 180 µg týždenne s dávkou ribavirínu 800 mg alebo s dávkou ribavirínu 1 000 mg (<75 kg telesnej hmotnosti)/1 200 mg (≥75 kg telesnej hmotnosti) denne počas 48 týždňov. Štúdia nebola dizajnovaná na preukázanie účinnosti. Bezpečnostné profily u obidvoch skupín s ribavirínom boli konzistentné so známym bezpečnostným profilom pri kombinovanej liečbe Pegasysom a ribavirínom
a nepoukazujú na žiadne relevantné rozdiely, okrem mierneho nárastu anémie v skupine s vyššou dávkou ribavínu.
HCV pacienti s normálnymi hladinami ALTV štúdii NR16071 náhodne vybratí HCV pacienti s normálnymi hodnotami ALT užívali Pegasys
180 µg/týždeň a ribavirín 800 mg/deň počas 24 alebo 48 týždňov. Potom nasledoval 24 týždňové obdobie bez liečby alebo pacienti boli bez liečby po dobu 72 týždňov. SVR popisované v liečebných ramenách tejto štúdie boli podobné zodpovedajúcim liečebným ramenám zo štúdie NV15942.
Pediatrická populáciaV riešiteľom sponzorovanej klinickej štúdii CHIPS (Chronic Hepatitis C International Paediatric Study) 65 pediatrických pacientov (6-18 rokov) s chronickou HCV infekciou boli pacienti liečení Pegasysom 100 μg/m2 s.c. raz týždenne a ribavirínom 15 mg/kg/deň 24 týždňov (genotypy 2 a 3) alebo 48 týždňov (všetky iné genotypy). Predbežné a obmedzené údaje bezpečnosti neukázali žiadny evidentný odklon od známeho profilu bezpečnosti pri kombinovanej liečbe u dospelých pacientov s chronickou HCV infekciou, ale, dôležité je, že nebol hlásený potenciálny nárast. Výsledky účinnosti boli podobné výsledkom hlásených u dospelých.
V štúdii NV17424 (PEDS-C) boli predtým neliečení pediatrickí pacienti vo veku 5 až 17 rokov (55 % vo veku < 12 rokov) s kompenzovanou chronickou hepatitídou C a detekovateľnou HCV RNA liečení Pegasysom v dávke180 μg x BSA/1,73 m2 jedenkrát týždenne počas 48 týždňov s alebo bez ribavirínu v dávke 15 mg/kg/deň . Všetci pacienti boli po liečbe sledovaní počas 24 týždňov. Celkovo 55 pacientov bolo liečených úvodnou kombinovanou liečbou Pegasysom plus ribaviríno, z nich 51 %
bolo žien, 82 % belochov a 82 % bolo infikovaných vírusom HCV genotyp 1. Výsledky štúdie účinnosti u týchto pacientov sú zhrnuté v tabuľke 21.
Tabuľka 21: Pretrvávajúca virologická odpoveď v štúdii NV17424
| Pegasys
180 µg x BSA/1,73 m² +
ribavirín 15 mg/kg (N = 55)*
|
Všetky genotypy HCV**
| 29 (53 %)
|
HCV genotyp 1
| 21/45 (47 %)
|
HCV genotyp 2 a 3
| 8/10 (80 %)
|
*Výsledky naznačujú nedetegovateľnú HCV-RNA definovanú ako HCV RNA menej ako 50 IU/ml 24 týždňov po liečbe použitím AMPLICOR HCV testu v2.
**Plánované trvanie liečby bolo 48 týždňov bez ohľadu na genotyp
5.2 Farmakokinetické vlastnosti
Absorpcia
Po jednorazovej subkutánnej injekcii Pegasysu 180 mikrogramov zdravým jedincom sa merateľné sérové koncentrácie peginterferónu alfa-2a zistili v priebehu 3 až 6 hodín. Počas 24 hodín dosiahli namerané hladiny 80 % maximálnej koncentrácie v sére. Absorpcia Pegasysu je plynulá, pričom maximálne hladiny v sére sa dosiahnu 72 až 96 hodín po podaní. Absolútna biologická dostupnosť Pegasysu je 84 % a je podobná ako pri interferóne alfa-2a.
Distribúcia
Peginterferón alfa-2a sa nachádza najmä v krvnom obehu a extracelulárnej tekutine, čoho dôkazom je hodnota distribučného objemu v rovnovážnom stave (Vd) 6 - 14 litrov u ľudí po intravenóznom podaní. V štúdiách hmotnostnej rovnováhy, distribúcie látky v tkanivách a celotelovej autorádioluminografie vykonaných u potkanov sa zistilo, že okrem vysokej koncentrácie v krvi sa peginterferón alfa-2a dostáva do pečene, obličiek a kostnej drene.
Biotransformácia
Metabolizmus Pegasysu ešte nie je úplne objasnený, avšak štúdie na potkanoch naznačujú, že obličky sú hlavným exkrečným orgánom rádioaktívne označeného materiálu.
Eliminácia
U ľudí je hodnota systémového klírensu peginterferónu alfa-2a približne 100- násobne nižšia ako natívneho interferónu alfa-2a. Po intravenóznom podaní je terminálny polčas peginterferónu alfa-2a u zdravých osôb približne 60 – 80 hodín v porovnaní s 3 – 4 hodinami v prípade štandardného interferónu. Terminálny polčas po subkutánnom podaní pacientom je dlhší so strednou hodnotou 160 hodín (84 – 353 hodín). Terminálny polčas môže odrážať eliminačnú fázu látky, ale taktiež plynulú absorpciu Pegasysu.
Linearita/nelinearita
U zdravých osôb a u pacientov s chronickou hepatitídou B alebo C sa pri dávkovaní raz týždenne pozorovalo od dávky závislé zvyšovanie expozície voči Pegasysu.
U pacientov s chronickou hepatitídou B alebo C dochádza po 6 až 8 týždňoch podávania Pegasysu v dávke raz týždenne k dvoj- až trojnásobnému zvýšeniu sérových hladín peginterferónu alfa-2a
v porovnaní s podávaním jednorazovej dávky. Po 8-týždňovom podávaní Pegasysu raz týždenne nedochádza k ďalšej akumulácii. Po 48 týždňoch liečby je pomer medzi maximálnou a minimálnou hladinou približne 1,5 - 2. Sérové koncentrácie peginterferónu alfa-2a pretrvávajú celý 1 týždeň (168 hodín).
Pacienti s poruchou funkcie obličiek
Dysfunkcia obličiek je spojená s mierne zníženou hodnotou pomeru CL/F a predĺženým polčasom. U pacientov (n=3) CLcrea medzi 20 a 40 ml/min bola priemerná hodnota pomeru CL/F o 25 % nižšia ako u pacientov s normálnou funkciou obličiek. U dialyzovaných pacientov s ochorením obličiek
v terminálnej fáze sa zistilo 25 – 45 % zníženie klírensu, pričom dávky 135 mikrogramov u týchto pacientov vedú k podobnej expozícii ako dávky 180 mikrogramov u pacientov s normálnou funkciou
obličiek (pozri časť 4.2).
Pozrite si tiež Súhrn charakteristických vlastností lieku (SmPC) ribavirínu, ak sa Pegasys použije v kombinácii s ribavirínom.
Pohlavie
Farmakokinetika Pegasysu po podaní jednorazovej subkutánnej injekcie bola porovnateľná u zdravých jedincov mužského a ženského pohlavia.
Pediatrická populácia
V populačnej farmakokinetickej štúdii (NR16141) dostávalo 14 detí vo veku 2 až 8 rokov s CHC Pegasys v monoterapii v dávke: 180 µg x BSA/1,73 m2. FK model vytvorený na základe tejto štúdie preukazuje lineárny vplyv BSA na zjavný klírens liečiva v rozmedzí skúmaného veku. Preto nižšie BSA dieťaťa, nižší klírens liečiva a vyššia výsledná expozícia. Predpokladá sa, že priemerná expozícia (AUC) počas dávkovacieho intervalu je o 25 % až 70 % vyššia ako expozícia pozorovaná u dospelých, ktorí dostávajú fixnú dávku 180 µg.
Staršie osoby
U osôb starších ako 62 rokov sa zistila dlhšia absorpcia Pegasysu po jednorazovom podaní subkutánnej injekcie v dávke 180 mikrogramov, hoci stále bola plynulá v porovnaní s mladými zdravými osobami (tmax 115 hodín vs. 82 hodín, osoby staršie ako 62 rokov). Hodnota AUC bola mierne zvýšená (1 663 vs. 1 295 ng.hod/ml), avšak maximálne koncentrácie (9,1 vs. 10,3 ng/ml) boli podobné u osôb starších ako 62 rokov. Na základe expozície voči lieku, farmakodynamickej odpovedi a znášanlivosti je možné prehlásiť, že geriatrickí pacienti si nevyžadujú podávanie nižšej dávky Pegasysu (pozri časť 4.2).
Dysfunkcia pečene
Farmakokinetika Pegasysu u zdravých osôb bola podobná ako u pacientov s hepatitídou B alebo C.
U pacientov s cirhózou (stupeň A podľa Child-Pughovej klasifikácie) a pacientov bez cirhózy sa zistila porovnateľná expozícia a farmakokinetické profily.
Miesto podania
Subkutánne podávanie Pegasysu je nutné obmedziť na oblasť brucha a stehna, pretože stupeň absorpcie hodnotený na základe hodnôt AUC bol o 20 – 30 % vyšší po podaní injekcie do brucha a stehna. V štúdiách po podaní Pegasysu do ramena sa v porovnaní s podaním do brucha alebo stehna zistila znížená expozícia voči Pegasysu.
5.3 Predklinické údaje o bezpečnosti
Neklinické štúdie skúmajúce toxicitu Pegasysu boli limitované v dôsledku druhovej špecifickosti interferónov. Štúdie akútnej a chronickej toxicity sa vykonali u opíc cynomolgus, pričom nálezy pozorované u zvierat dostávajúcich peginterferón boli podobnej povahy ako nálezy vyvolané interferónom alfa-2a.
S Pegasysom sa nevykonali žiadne štúdie reprodukčnej toxicity. Tak ako pri iných interferónoch alfa, aj po podávaní peginterferónu alfa-2a samiciam opíc sa pozorovalo predĺženie menštruačného cyklu. Liečba interferónom alfa-2a viedla k štatisticky významnému zvýšeniu abortívneho účinku u opíc resus. Hoci sa u potomstva narodeného v termíne nezistili žiadne teratogénne účinky, nežiaduce účinky nie je možné vylúčiť u ľudí.
Pegasys plus ribavirín
Ak sa používa v kombinácii s ribavirínom, Pegasys nevyvoláva žiadne účinky u opíc, ktoré by predtým neboli pozorované pri podávaní jednotlivých liečiv v rámci monoterapie. Hlavnou zmenou v súvislosti s liečbou bola reverzibilná mierna až stredne ťažká anémia, závažnosť ktorej bola vyššia ako po podávaní jednotlivých liečiv v rámci monoterapie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
chlorid sodný polysorbát 80 benzylalkoholnátriumacetát kyselina octová
voda na injekcie
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti3 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v chladničke pri teplote 2°C – 8°C. Neuchovávajte v mrazničke.
Naplnenú injekčnú striekačku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia0,5 ml injekčného roztoku v naplnenej injekčnej striekačke (sklo typu I so silikónovou vrstvou na vnútornej strane), s piestom a čiapočkou (butylová guma s fluórpolymérovou vrstvou na vnútornej strane), 1 injekčná ihla. Injekčná striekačka je označená dielikmi, ktoré odpovedajú dávkam 135µg,
90 µg a 45 µg. Dostupné v baleniach 1, 4 alebo 12 naplnených injekčných striekačiek. Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciuInjekčný roztok je určený len na jednorazové použitie. Pred podaním sa má zrakom skontrolovať, či roztok neobsahuje tuhé čiastočky alebo či sa nezmenila jeho farba.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIRoche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/02/221/005
EU/1/02/221/006
EU/1/02/221/009
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 20. jún 2002
Dátum posledného predĺženia: 20. jún 2007
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Pegasys 180 mikrogramov injekčný roztok v naplnenej injekčnej striekačke
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá naplnená injekčná striekačka s 0,5 ml roztoku obsahuje 180 mikrogramov peginterferónu alfa-
2a*. Sila vyjadruje množstvo podielu interferónu alfa-2a v peginterferóne alfa-2a bez ohľadu na pegyláciu.
*Liečivo peginterferón alfa-2a je kovalentný konjugát bielkoviny interferónu alfa-2a vyrobený rekombinantnou DNA technológiou v Escherichia coli s bis -[monometoxypolyetylénglykolom].
Účinnosť tohto lieku sa nemá porovnávať s inými pegylovanými alebo nepegylovanými bielkovinami v tej istej terapeutickej skupine. Viac informácií, pozri časť 5.1.
Pomocná látka so známym účinkom: Benzylalkohol (10 mg/1 ml) Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok (injekcia) .
Roztok je číry, bezfarebný až svetložltý.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Chronická hepatitída B
Pegasys je indikovaný na liečbu chronickej hepatitídy B (CHB) s pozitívnym obalovým antigénom
hepatitídy B (HBeAg) alebo HBeAg negatívnej chronickej hepatitídy B u dospelých pacientov
s kompenzovaným ochorením pečene a s dôkazom vírusovej replikácie, zvýšenou hladinou ALT a histologicky overeným zápalom pečene a/alebo fibrózy (pozri časti 4.4 a 5.1).
Chronická hepatitída C
Dospelí pacienti
Pegasys je indikovaný na liečbu chronickej hepatitídy C (CHC) u dospelých s pozitívnym nálezom ribonukleovej kyseliny vírusu hepatitídy C (HCV-RNA) v sére. Toto zahŕňa pacientov
s kompenzovanou formou cirhózy pečene a/alebo súčasne infikovaných HIV vírusom s klinicky stabilným obrazom HIV infekcie (pozri časť 4.4).
Optimálny spôsob použitia Pegasysu u pacientov s chronickou hepatitídou C je kombinácia s ribavirínom. Kombinácia Pegasysu a ribavirínu je indikovaná na liečbu u predtým neliečených pacientov a u dospelých pacientov, u ktorých zlyhala predchádzajúca liečba interferónom alfa (pegylovaným alebo nepegylovaným) v monoterapii alebo v kombinovanej liečbe s ribavirínom.
Monoterapia je indikovaná najmä v prípade neznášanlivosti alebo kontraindikácie liečby ribavirínom.
Pediatrickí pacienti vo veku 5 rokov a viac :
Pegasys v kombinácii s ribavirínom je indikovaný na liečbu chronickej hepatitídy C u predtým neliečených detí a dospievajúcich vo veku 5 a viac rokov, u ktorých je prítomná pozitivita sérovej HCV-RNA.
Pri rozhodovaní, či začať v detstve s liečbou, je dôležité vziať do úvahy inhibíciu rastu indukovanú kombinovanou liečbou. Nie je isté, či je inhibícia rastu reverzibilná. Rozhodnutie o liečbe sa má urobiť individuálne pre každyý prípad (pozri časť 4.4).
4.2 Dávkovanie a spôsob podávania
Liečbu Pegasysom má začať iba lekár, ktorý má skúsenosti s liečbou pacientov s hepatitídou B alebo
C.
Ak sa Pegasys bude podávať v kombinácii s ribavirínom, prečítajte si tiež súhrn charakteristických vlastností ribavirínu (SmPC).
Dávkovanie
Chronická hepatitída B – dospelí pacienti
Odporúčané dávkovanie a dĺžka liečby Pegasysom u HBeAg-pozitívnych a HBeAg-negatívnych pacientov s chronickou hepatitídou B je 180 mikrogramov raz týždenne počas 48 týždňov, subkutánne do brucha alebo do stehna.
Chronická hepatitída C - predtým neliečení dospelí pacienti
Odporúčaná dávka Pegasysu je 180 mikrogramov raz týždenne a podáva sa subkutánne do brucha alebo stehna v kombinácii s perorálnym ribavirínom alebo ako monoterapia.
Dávkovanie ribavirínu pri kombinovanej liečbe s Pegasysom sa uvádza v tabuľke 1. Dávka ribavirínu sa má užívať spolu s jedlom.
Dĺžka liečby
U pacientov s chronickou hepatitídou C závisí dĺžka kombinovanej liečby s ribavirínom od genotypu vírusu. Pacienti infikovaní HCV s genotypom 1, ktorí majú detegovateľnú HCV RNA v 4. týždni sa majú liečiť 48 týždňov bez ohľadu na vírusovú záťaž pred liečbou.
O liečbe v trvaní 24 týždňov sa môže uvažovať u pacientov infikovaných s
- genotypom 1 a nízkou vírusovou záťažou (LVL) na začiatku liečby ( ≤ 800 000 IU/ml) alebo
- genotypom 4,
ktorí sa stali HCV RNA negatívni v 4. týždni liečby a zostali HCV RNA negatívni v 24. týždni. Avšak celkove môže byť 24 týždňová liečba spojená s vyšším rizikom relapsu ako liečba trvajúca 48 týždňov (pozri časť 5.1). Pri rozhodovaní o dĺžke liečby sa má u týchto pacientov brať do úvahy tolerancia na
kombinovanú liečbu a ďalšie prognostické faktory, ako stupeň fibrózy. Ešte s väčšou opatrnosťou sa
má uvažovať o skrátení dĺžky trvania liečby u pacientov infikovaných s vírusom s genotypom 1 a vysokou vírusovou záťažou (>800 000 IU/ml) na začiatku liečby, ktorí sa stali HCV RNA negatívni v
4. týždni liečby a zostali negatívni v 24. týždni, pretože obmedzené údaje naznačujú, že to môže signifikantne negatívne ovplyvniť trvalú virologickú odpoveď.
Pacienti infikovaní HCV s genotypom 2 alebo 3, ktorí majú detegovateľnú HCV RNA v 4. týždni, bez ohľadu na vírusovú záťaž pred liečbou majú byť liečení 24 týždňov. 16-týždňová liečba sa môže zvažovať iba u vybraných pacientov, infikovaných genotypom 2 alebo 3 s iniciálnou LVL
(≤ 800 000 IU/ml), ktorí sa stanú HCV negatívni v 4. týždni liečby a zostávajú negatívni v 16. týždni. Všeobecne sa liečba trvajúca 16 týždňov môže spájať s nižšou možnosťou odpovede a je spojená s vyšším rizikom relapsu ako 24-týždňová liečba (pozri časť 5.1). U týchto pacientov sa má pri zvažovaní zmeny štandardnej 24 týždňovej liečby vziať do úvahy tolerancia kombinovanej liečby
a prítomnosť ďalších klinických alebo prognostických faktorov ako napr. stupeň fibrózy. Skrátenie
trvania liečby u pacientov infikovaných genotypom 2 alebo 3 s iniciálnou HVL (> 800 000 IU/ml), ktorí sa stanú v 4. týždni liečby HCV negatívni by sa má zvažovať pozornejšie, nakoľko toto môže významne negatívne ovplyvniť trvalú virologickú odpoveď (pozri tabuľku 1).
Dostupné údaje o infikovaných pacientoch s genotypom 5 alebo 6 sú obmedzené; preto sa odporúča
48 týždňová kombinovaná liečba s 1 000 mg alebo 1 200 mg ribavirínu.
Tabuľka 1:Odporúčané dávkovanie pre kombinovanú liečbu HCV pacientovGenotyp
| Dávka Pegasysu
| Dávka ribavirínu
| Trvanie
|
Genotyp 1 LVL s RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 24 týždňov alebo
48 týždňov
|
Genotyp 1 HVL s RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 48 týždňov
|
Genotyp 4 s RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 24 týždňov alebo
48 týždňov
|
Genotyp 1 alebo 4 bez
RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 48 týždňov
|
Genotyp 2 alebo 3. bez
RVR**
| 180 mikrogramov
| 800 mg
| 24 týždňov
|
Genotyp 2 alebo 3
LVL s RVR**
| 180 mikrogramov
| 800 mg(a)
| 16 týždňov(a) alebo
24 týždňov
|
Genotyp 2 alebo 3
HVL s RVR**
| 180 mikrogramov
| 800 mg
| 24 týždňov
|
*RVR = rýchla virologická odpoveď (nedegovateľná HCV RNA) v 4. týždni a nedetegovateľná HCV RNA v 24. týždni
**RVR = rýchla virologická odpoveď (HCV RNA negativita) v 4. týždni
LVL = ≤ 800 000 IU/ml; HVL= > 800 000 IU/ml
(a) V súčasnosti nie je jasné, či vyššia dávka ribavirínu (napr. 1 000 /1 200 mg/deň podľa telesnej hmotnosti) vedie k vyššej trvalej virologickej odpovedi (SVR) než dávka 800 mg/deň, keď je liečba skrátená na 16 týždňov.
Konečný klinický účinok skrátenej 16 týždňovej liečby oproti 24 týždňovej liečbe nie je známy vzhľadom na potrebu opakovanej liečby u pacientov, ktorí neodpovedajú na liečbu a pacientov s relapsom ochorenia.
Odporúčaná dĺžka liečby Pegasysom v monoterapii je 48 týždňov.
Chronická hepatitída C - predtým liečení dospelí pacientiOdporúčaná dávka Pegasysu v kombinácii s ribavirínom je 180 µg raz týždenne podávaná subkutánne. Pacientom s telesnou hmotnosťou < 75 kg sa má podávať 1 000 mg ribavirínu denne a pacientom
s telesnou hmotnosťou ≥ 75 kg sa má podávať 1 200 mg ribavirínu denne bez ohľadu na genotyp.
U pacientov, ktorí majú v 12. týždni detegovateľné hladiny vírusu, sa má liečba ukončiť. Odporúčaná
celková dĺžka liečby je 48 týždňov. Ak sa zvažuje liečba u pacientov infikovaných vírusom
genotypu 1, ktorí neodpovedali na predchádzajúcu liečbu peginterferónom a ribavirínom, odporúčaná celková dĺžka liečby je 72 týždňov (pozri časť 5.1).
Súčasná infekcia vírusom HIV a HCV u dospelých pacientovOdporúčané dávkovanie Pegasysu v monoterapii alebo v kombinácii s ribavirínom je
180 mikrogramov raz za týždeň subkutánne počas 48 týždňov. Pre pacientov infikovných HCV s genotypom 1 a s telesnou hmotnosťou <75 kg je dávka ribavirínu 1 000 mg denne a s telesnou hmotnosťou ≥75 kg je dávka 1 200 mg denne. Pre pacientov infikovaných HCV s iným genotypom ako genotyp 1 je dávka ribavirínu 800 mg denne. Dĺžka liečby kratšia ako 48 týždňov sa dostatočne neskúmala.
Predikcia odpovede alebo chýbanie odpovede - predtým neliečení pacienti Ukázalo sa, že včasná virologická odpoveď v 12-tom týždni, ktorá je definovaná ako pokles vírusovej záťaže o 2 log alebo nedetekovateľné hladiny HCV RNA, predikuje pretrvávajúcu odpoveď (pozri tabuľky 2 a 12).
Tabuľka 2:Prediktívna hodnota virologickej odpovede v 12. týždni kombinovanej liečbyPegasysom pri odporúčanom dávkovacom režimeGenotyp
| Negatívna
| Pozitívna
|
Žiadna
odpoveď
do 12. Odpoveď Prediktívna týždňa nepretrváva hodnota
|
Odpoveď
do 12. Odpoveď Prediktívna týždňa pretrváva hodnota
|
Genotyp 1 (N = 569)
| 102 97 95 %
(97/102)
| 467 271 58 %
(271/467)
|
Genotyp 2 a 3 (N = 96)
| 3 3 100 %
(3/3)
| 93 81 87 %
(81/93)
|
Negatívna prediktívna hodnota na trvalú odpoveď u pacientov liečených Pegasysom v monoterapii
bola 98 %.
Podobná negatívna prediktívna hodnota sa pozorovala u súčasne HIV-HCV infikovaných pacientov liečených Pegasysom v monoterapii alebo v kombinácii s ribavirínom (100 % (130/130) alebo 98 % (83/85)). Pozitívne prediktívne hodnoty na úrovni 45 % (50/110) resp. 70 % (59/84) u súčasne HIV- HCV infikovaných pacientov sa pozorovali pri genotype 1 a genotype 2/3, ak títo dostávali kombinovanú liečbu.
Predikcia odpovede alebo chýbanie odpovede - predtým liečení pacientiU pacientov, ktorí neodpovedali na predchádzajúcu liečbu a boli opakovane liečení 48 alebo
72 týždňov, sa ukázalo, že potlačenie aktivity vírusu v 12. týždni (nedetegovateľná HCV RNA definovaná ako <50 IU/ml) je prediktívnym faktorom trvalej virologickej odpovede. Ak nebolo dosiahnuté potlačenie vírusovej aktivity v 12. týždni pri režime liečby 48 alebo 72 týždňov, je pravdepodobnosť nedosiahnutia trvalej virologickej odpovede pri 48-týždňovej liečbe 96 % (363 z
380) a pri 72-týždňovej liečbe 96 % (324 z 339). Ak bolo dosiahnuté potlačenie vírusovej aktivity v 12. týždni pri režime liečby 48 alebo 72 týždňov, je pravdepodobnosť dosiahnutia trvalej
virologickej odpovede pri 48-týždňovej liečbe 35 % (20 z 57) a pri 72-týždňovej liečbe 57 % (57 zo
100).
Úprava dávkovania u dospelých pacientov v dôsledku nežiaducich reakciíVšeobecnePri nutnosti úpravy dávkovania v dôsledku stredne ťažkých až ťažkých nežiaducich reakcií (klinickej a/alebo laboratórnej povahy) je vhodné u dospelých pacientov znížiť začiatočnú dávku na
135 mikrogramov. V niektorých prípadoch môže byť potrebné znížiť dávkovanie na 90 mikrogramov alebo 45 mikrogramov. Po ústupe nežiaducich reakcií je možné zvážiť zvýšenie dávkovania až na pôvodnú hodnotu (pozri časti 4.4 a 4.8).
Hematologické nežiaduce reakcie (pozri tiež tabuľku 3)Pri poklese počtu neutrofilov na < 750/mm3 u dospelých pacientov sa odporúča znížiť dávkovanie lieku. U pacientov s absolútnym počtom neutrofilov (ANC) < 500/mm3 sa liečba prerušuje až do obnovenia hodnôt ANC > 1000/mm3. Liečbu Pegasysom je možné opäť začať dávkou
90 mikrogramov a má sa sledovať počet neutrofilov. V tabuľke 7 je uvedený návod na zníženie dávky
u pediatrických pacientov na základe hodnôt ANC.
Ak počet trombocytov klesne na < 50 000/mm3, má sa znížiť dávkovanie na 90 mikrogramov. Pri znížení počtu trombocytov na hodnotu < 25 000/ mm3 sa odporúča liečbu ukončiť.
Pre liečbu farmakologicky podmienenej anémie u dospelých platia nasledovné špecifické odporúčania:
denná dávka ribavirínu sa má znížiť na 600 mg (200 mg ráno a 400 mg večer), ak nastane niektorá
z nasledujúcich situácií: (1) u pacienta bez závažného kardiovaskulárneho ochorenia dôjde k poklesu hodnôt hemoglobínu na < 10 g/dl a ≥ 8,5 g/dl alebo (2) u pacienta so stabilizovaným kardiovaskulárnym ochorením dôjde k poklesu hodnôt hemoglobínu ≥ 2 g/dl v priebehu ktorýchkoľvek 4 týždňov liečby. Návrat k pôvodnému dávkovaniu sa neodporúča. Liečba ribavirínom
sa ukončí, ak nastane niektorá z nasledujúcich situácií: (1) u pacienta bez závažného kardiovaskulárneho ochorenia dôjde k poklesu hodnôt hemoglobínu < 8,5 g/dl alebo(2) u pacienta so stabilizovaným kardiovaskulárnym ochorením sa hodnoty hemoglobínu udržujú < 12 g/dl napriek 4- týždňovej liečbe s redukovaným dávkovaním. Ak sa abnormality upravia, je možné obnoviť liečbu
ribavirínom v dennej dávke 600 mg. Ošetrujúci lekár môže zvážiť ďalšie zvýšenie dávkovania na
800 mg denne. Návrat k pôvodnému dávkovaniu sa neodporúča.
| Znížiť
dávkovanie ribavirínu na
600 mg
| Vysadiť
ribavirín
| Znížiť dávkovanie
Pegasysu na
135/90/45 mikrogramov
| Vysadiť
Pegasys
| Vysadiť
kombinovanú liečbu
| Absolútny počet neutrofilov
|
|
| < 750/mm3
| < 500/mm3
|
| Počet
trombocytov
|
|
| < 50 000/mm3
> 25 000/mm3
|
| < 25 000/mm3
| Hemoglobín
- bez ochorenia srdca
| < 10 g/dl
a ≥ 8,5 g/dl
| < 8,5 g/dl
|
|
|
| Hemoglobín
-
stabilizov ané ochorenie srdca
| pokles
o ≥ 2 g/dl počas
ľubovoľných
4 týždňov
| < 12 g/dl
napriek
4 týždňovej liečbe
s redukovaným dávkovaním
|
|
|
|
|
|
Tabuľka 3: Úprava dávkovania v dôsledku nežiaducich účinkov (ďalšie informácie pozri v texte vyššie)Pri neznášanlivosti ribavirínu je možné pokračovať v monoterapii Pegasysom.
Funkcia pečeneU pacientov s chronickou hepatitídou C sa často vyskytuje kolísanie odchýlok pečeňových testov. U pacientov liečených Pegasysom vrátane pacientov s virologickou odpoveďou sa pozorovalo zvýšenie hladín ALT nad východiskovú hodnotu (BL).
V klinických skúšaniach zameraných na chronickú hepatitídu C s dospelými pacientmi sa u 8 zo 451
pacientov dostávajúcich kombinovanú liečbu pozorovalo izolované zvýšenie ALT (≥ 10x ULN alebo
≥ 2x BL u pacientov s východiskovou hodnotou ALT ≥ 10x ULN), ktoré sa upravilo bez nutnosti
zmeny dávkovania. Ak je hodnota ALT trvale vyššia alebo naďalej stúpa, dávkovanie sa na začiatku
znižuje na 135 mikrogramov. Ak napriek zníženiu dávkovania hodnoty ALT naďalej stúpajú alebo ich sprevádza zvýšenie hladiny bilirubínu alebo známky dekompenzácie funkcie pečene, má sa liečba ukončiť (pozri časť 4.4). V tabuľke 7 je uvedený návod pre zníženie dávky pre deti a dospievajúcich
na základe hladín ALT.
U pacientov s chronickou hepatitídou B nie je nezvyčajné prechodné zvýšenie hladín ALT, ktoré niekedy prekročí desaťnásobok hornej hranice normálnej hodnoty a môže odrážať imunitný klírens. Liečba by sa za normálnych okolností nemala začať, ak je hladina ALT viac než desaťkrát vyššia ako horná hranica jej normálnej hodnoty. Treba zvážiť pokračovanie liečby s častejším sledovaním funkcie pečene pri náhlom zvýšení hladín ALT. Ak sa dávka Pegasysu zníži, alebo ak sa liek vysadí, pri poklese hladiny ALT sa liečba môže obnoviť (pozri časť 4.4).
Osobitné skupiny pacientov
Starší ľudia
Na začiatku liečby Pegasysom u starších pacientov nie je potrebná žiadna úprava odporúčaného dávkovania 180 mikrogramov raz týždenne (pozri časť 5.2).
Porucha funkcie obličiekU pacientov s ochorením obličiek v terminálnej fáze sa používa začiatočná dávka 135 mikrogramov
(pozri časť 5.2 ). Bez ohľadu na začiatočnú dávku alebo stupeň poškodenia funkcie obličiek je potrebné pacientov sledovať a v prípade nežiaducich reakcií je nutné primerane znížiť dávkovanie Pegasysu počas liečebnej kúry.
Porucha funkcie pečeneUkázalo sa, že Pegasys je účinný a bezpečný u pacientov s kompenzovanou cirhózou (napr. A podľa
Child-Pughovej klasifikácie). Pegasys sa nehodnotil u pacientov s dekompenzovanou cirhózou (napr. B alebo C podľa Child-Pughovej klasifikácie alebo krvácajúce ezofageálne varixy) (pozri časť 4.3).
Podľa Child-Pughovej klasifikácie sa pacienti rozdeľujú do skupín A, B a C resp. s “miernou” “stredne ťažkou” a “ťažkou” poruchou funkcie , čomu zodpovedá skóre 5 - 6, 7 - 9 a 10 - 15.
Upravené hodnotenie Hodnotenie
| Stupeň abnormality
| Skóre
|
Encefalopatia
| Žiadny
Stupeň 1 - 2
Stupeň 3 – 4*
| 1
2
3
|
Ascites
| Žiadny
Mierny
Stredný
| 1
2
3
|
Hladina sérového bilirubínu (mg/dl)
v SI jednotkách = μmol/l
| < 2
2,0 - 3
> 3
< 34
34 - 51
> 51
| 1
2
3
1
2
3
|
Hladina sérového albumínu (g/dl)
| > 3,5
2,8 – 3,5
< 2,8
| 1
2
3
|
INR
| < 1,7
1,7 - 2,3
> 2,3
| 1
2
3
|
* Hodnotenie stupňa závažnosti podľa autorov Trey, Burns a Saunders (1966)
Pediatrická populáciaPegasys je kontraindikovaný u novorodencov a malých detí vo veku do 3 rokov z dôvodu prítomnosti
pomocnej látky benzylalkoholu (pozri časti 4.3 a 4.4).
Pre deti a dospievajúcich vo veku 5 až 17 rokov s chronickou hepatitídou C s povrchom tela (BSA) väčším ako 0,7 m2 sú odporúčané dávky Pegasysu a ribavirínu uvedené v tabuľke 4 a v tabuľke 5. Pre pediatrických pacientov sa odporúča použiť Pegasys v naplnených injekčných striekačkách. Použitie Pegasysom naplnených pier neumožňuje primeranú úpravu dávky pre týchto pacientov. Pacienti, ktorí začali liečbu pred svojimi 18-timi narodeninami, majú pokračovať v pediatrickom dávkovaní až do skončenia liečby.
Pegasys sa nesmie použiť u detí s povrchom tela (BSA) menším ako 0,71 m2, keďže pre túto subpopuláciu nie sú dostupné údaje.
Pre výpočet BSA sa odporúča používať Mostellerov vzorec:
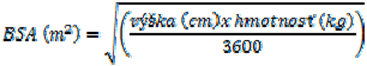 Dĺžka liečby
Dĺžka liečbyDĺžka liečby Pegasysom v kombinácii s ribavirínom u pediatrických pacientov s chronickou hepatitídou C závisí od genotypu vírusu. Pacienti infikovaní vírusovými genotypom 2 alebo 3 majú
dostať 24 týždňovú liečbu, zatiaľ čo pacienti infikovaní iným genotypom majú dostať 48 týždňovú
liečbu.
Pacienti, ktorí majú ešte detegovateľné hladiny HCV-RNA a to aj napriek počiatočnej 24 týždňovej liečbe, majú ukončiť liečbu, pretože je nepravdepodobné, že pokračovaním v liečbe budú schopní dosiahnuť trvalú virologickú odpoveď.
Tabuľka 4: Odporúčania na dávkovanie Pegasysu pre deti a dospievajúcich vo veku 5 až 17rokov Rozmedzie plochy povrchu tela (BSA) (m2)
| Týždenná dávka (mikrogramy)
|
0,71-0,074
| 65
|
0,75-1,08
| 90
|
1,09-1,51
| 135
|
> 1,51
| 180
|
Pre deti a dospievajúcich vo veku 5 až 17 rokov s chronickou hepatitídou C odporúčaná dávka
ribavirínu vychádza z telesnej hmotnosti pacienta s cieľovou dávkou 15 mg/kg/deň rozdelenou do dvoch denných dávok. V tabuľke 5 je uvedené dávkovanie za použitia 200 mg tabliet ribavirínu pre deti a dospievajúcich s hmotnosťou 23 kg a viac. Pacienti a ich opatrovatelia sa nesmú pokúšať rozlomiť 200 mg tablety.
Tabuľka 5: Odporúčania na dávkovanie ribavirínu upediatrických pacientov vo veku 5 až 17rokov Telesná hmotnosť kg (lbs)
| Denná dávka ribavirínu
(pribl. 15 mg/kg/deň)
| Počet tabliet ribavirínu
|
23 – 33 (51-73)
| 400 mg/deň
| 1 x 200 mg tablety ráno
1 x 200 mg tablety večer
|
34 – 46 (75-101)
| 600 mg/deň
| 1 x 200 mg tablety ráno
2 x 200 mg tablety večer
|
47 – 59 (103-131)
| 800 mg/deň
| 2 x 200 mg tablety ráno
2 x 200 mg tablety večer
|
60 – 74 (132-163)
| 1 000 mg/deň
| 2 x 200 mg tablety ráno
3 x 200 mg tablety večer
|
≥ 75 (> 165)
| 1 200 mg/deň
| 3 x 200 mg tablety ráno
3 x 200 mg tablety večer
|
Úprava dávky u pediatrických pacientov kvôli nežiaducim reakciám U pediatrických pacientov je možné na základe toxicity (pozri tabuľku 6) urobiť až tri stupne modifikácie dávky pred zvážením prerušenia alebo vysadenia dávky.
Tabuľka 6: Odporúčaná úprava dávky Pegasysu u pediatrických pacientovZačiatočná dávka
(mikrogramy)
| 1. stupeň zníženia
(mikrogramy)
| 2. stupeň zníženia
(mikrogramy)
| 3. stupeň zníženia
(mikrogramy)
|
65
| 45
| 30
| 20
|
90
| 65
| 45
| 20
|
135
| 90
| 65
| 30
|
180
| 135
| 90
| 45
|
V prípade výskytu toxicity, ktorá môže súvisieť s podávaním Pegasysu a/alebo ribavirínu, sa môže
znížiť dávka jedného alebo obidvoch liekov. Okrem toho sa môže ribavirín alebo kombinovaná liečba Pegasys plus ribavirín vysadiť. Je dôležité poznamenať, že ribavirín sa nesmie nikdy podávať ako monoterapia. Odporúčania na úpravu dávky z dôvodu toxicity, o ktorej je známe, že má súvislosť
s podávaním Pegasysu a ktoré sú špecifické pre pediatrickú populáciu, sú uvedené v tabuľke 7. Pokiaľ nie je uvedené inak, v prípade všetkých ostatných toxických prejavov sa má postupovať podľa odporúčaní pre dospelých.
Tabuľka 7: Odporúčania na úpravu dávky Pegasysu z dôvodu toxicity u pediatrických pacientovToxicita
| Úprava dávky Pegasysu
|
Neutropénia
| 750-999 buniek/mm3: 1.-2. týždeň – okamžitá úprava 1. stupňa; 3.-48.
týždeň: žiadna úprava.
500-749 buniek/mm3: 1.-2. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte dávkou s úpravou 1. stupňa s kontrolou hodnoty leukocytov jedenkrát týždenne počas 3 nasledujúcich týždňov, aby ste sa ubezpečili, že ich počet je > 750 buniek/mm3; 3.-48. týždeň – okamžitá úprava 1. stupňa.
250-499 buniek/mm3: 1.-2. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte dávkou s úpravou 2. stupňa; 3.-48. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte
v dávkovaní s úpravou 1. stupňa.
< 250 buniek/mm3 (alebo febrilná neutropénia) liečbu vysaďte.
|
Zvýšená hladina
alanínaminotransaminázy
(ALT)
| V prípade pretrvávajúcich alebo narastajúcich zvýšení ≥ 5 ale < 10 x
ULN, znížte dávku s úpravou 1. stupňa a jedenkrát týždenne sledujte hladinu ALT na uistenie, že je stabilná alebo klesá
V prípade pretrvávajúcich hodnôt ALT ≥ 10 x ULN vysaďte liečbu.
|
ULN=horná hranica normy
U pediatrických pacientov je toxicita súvisiaca s liečbou ribavirínom, ako napríklad anémia, ktorá sa objaví počas liečby, riešiteľná znížením celkovej dávky. Stupne zníženia dávky sú uvedené v tabuľke
8.
Tabuľka 8: Odporúčania na úpravu dávky ribavirínu u pediatrických pacientovCelková dávka
(približne 15 mg/kg/deň)
| Jednokroková úprava dávky
(približne 7,5 mg/kg/deň)
|
Počet tabliet ribavirínu
|
400 mg/deň
| 200 mg/deň
| 1 x 200 mg tabliet ráno
|
600 mg/deň
| 400 mg/deň
| 1 x 200 mg tabliet ráno
|

|
|
1 x 200 mg tabliet večer
|
800 mg/deň
|
400 mg/deň
|
1 x 200 mg tabliet ráno
1 x 200 mg tabliet večer
|
1 000 mg/deň
|
600 mg/deň
|
1 x 200 mg tabliet ráno
2 x 200 mg tabliet večer
|
1 200 mg/deň
|
600 mg/deň
|
1 x 200 mg tabliet ráno
2 x 200 mg tabliet večer
|
Skúsenosti s Pegasysom pri liečbe pediatrických pacientov s HCV vo veku od 3 do 5 rokov alebo tých,
ktorí v minulosti neboli adekvátne liečení, sú len obmedzené. Neexistujú žiadne údaje u pediatrických pacientov súčasne infikovaných vírusmi HCV a HIV alebo s poruchou funkcie obličiek.
Spôsob podaniaPegasys sa podáva subkutánne do brucha alebo stehna. V štúdiách s podaním Pegasysu do ramena
bola zistená znížená expozícia Pegasysom (pozri časť 5.2).
Pegasys je navrhnutý na podávanie samotným pacientom alebo opatrovateľom. Každú injekčnú liekovku má používať len jedna osoba a je určená len na jednorazové použitie.
Pre nezdravotníckych pracovníkov, ktorí podávajú tento liek, sa odporúča primerané školenie. Pacient musí postupovať presne podľa “Pokynov pre používateľa” vložených v škatuľke.
4.3 Kontraindikácie• Precitlivenosť na liečivo, na interferóny alfa alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
• Autoimunitná hepatitída
• Ťažká dysfunkcia pečene alebo dekompenzovaná cirhóza pečene
• Anamnéza ťažkého kardiovaskulárneho ochorenia vrátane nestabilného alebo nekontrolovaného
ochorenia srdca počas predchádzajúcich 6 mesiacov (pozri časť 4.4)
• HIV-HCV pacienti s cirhózou s Child-Pughovým skóre ≥6, okrem stavu, keď je cirhóza nepriamo spôsobená hyperbilirubinémiou vyvolanou liekmi ako atazanavir a indinavir
• Kombinácia s telbivudínom (pozri časť 4.5)
• Novorodenci a deti do 3 rokov vzhľadom na prítomnosť pomocnej látky – benzylalkoholu
(pozri časť 4.4 o benzylalkohole)
• Psychické poruchy, obvzvlášť závažná depresia , suicidálne myšlienky alebo pokus o samovraždu u pediatrických pacientov, v súčasnosti alebo v anamnéze.
Ak sa Pegasys má použiť v kombinácii s ribavirínom, prečítajte si súhrn charakteristických vlastností
(SmPC) ribavirínu, ktorý obsahuje kontraindikácie jeho použitia.
4.4 Osobitné upozornenia a opatrenia pri používaníPsychické poruchy a centrálny nervový systém (CNS): Počas liečby Pegasysom a aj po jej ukončení, najmä počas 6-mesačného sledovania po liečbe, sa pozorovali u niektorých pacientov závažné účinky na CNS, hlavne depresia, samovražedné predstavy a pokus o samovraždu. Pri použití alfa interferónov sa pozorovali ďalšie účinky na CNS s prejavmi ako je agresívne správanie (niekedy namierené proti iným osobám ako je myšlienka na vraždu), bipolárne poruchy, mánia, zmätenosť a poruchy vedomia. U všetkých pacientov majú byť prísne monitorované všetky znaky alebo symptómy psychických porúch. Ak sa objavia symptómy psychických porúch, ošetrujúci lekár musí vziať do úvahy možnú závažnosť týchto príznakov a zvážiť potrebu adekvátnej liečby. Ak psychiatrické symptómy pretrvávajú alebo sa zhoršujú, alebo ak sa spozorujú samovražedné predstavy, odporúča sa liečbu Pegasysom ukončiť a pacienta odporučiť do prislúchajúcej psychiatrickej starostlivosti a/alebo liečby.
 Pacienti s už existujúcim psychiatrickým ochorením alebo s údajom o závažnom psychiatrickom ochorení v anamnéze:
Pacienti s už existujúcim psychiatrickým ochorením alebo s údajom o závažnom psychiatrickom ochorení v anamnéze: Ak sa rozhodne, že liečba Pegasysom je nutná u pacienta, ktorý má existujúce alebo v anamnéze prítomné závažné psychiatrické ochorenie, má sa liečba začať až po zaistení vhodnej individuálnej diagnostiky a liečby psychiatrického stavu.Použitie Pegasysu u pediatrických pacientov s psychickými poruchami v súčasnosti alebo v anamnéze je kontraindikované (pozri časť
4.3).
Rast a vývoj (deti a dospievajúci): Úbytok hmotnosti a inhibícia rastu bola bežná v priebehu liečby trvajúcej až 48 týždňov u pacientov vo veku 5 až 17 rokov (pozri časti 4.8 a 5.1).
2 roky po liečbe Pegasysom bolo 16 % pediatrických pacientovstále 15 percentilov alebo viac pod svojou východiskovou krivkou hmotnosti a 11 % zostalo 15 percentilov alebo viac pod svojou východiskovou krivkou výšky.
Individuálne posúdenie prínosu liečby a rizika u detíOčakávaný prínos liečby sa má starostlivo zvažovať berúc pritom do úvahy zistenia z klinických skúšaní týkajúce sa bezpečnosti pozorované u pediatrických pacientov (pozri časti 4.8 a 5.1).
- Je dôležité vziať do úvahy, že kombinovaná liečba viedla k inhibícii rastu, ktorej reverzibilita nie je istá.
- Toto riziko je potrebné zvážiť berúc do úvahy charakter ochorenia dieťaťa, akým je dôkaz o progresii ochorenia (najmä fibrózy), komorbidity, ktoré môžu negatívne ovplyvniť priebeh ochorenia (napr. súčasná infekcia vírusom HIV), ako aj prognostické faktory odpovede (HCV
genotyp a vírusová záťaž).
Ak je to možné, dieťa sa má liečiťpo pubertálnej akcelerácii rastu, aby sa znížilo riziko inhibície rastu. Neexistujú žiadne údaje o dlhodobých účinkoch na pohlavné dozrievanie.
Ak sa Pegasys podáva v kombinácii s ribavirínom, prečítajte si súhrn charakteristických vlastností
(SmPC) ribavirínu.
Histológia pečene pred liečbouVšetci pacienti s chronickou hepatitídou C, ktorí sa zúčastnili štúdie, sa podrobili biopsii pečene, ale v určitých prípadoch (napr. u pacientov s genotypom 2 alebo 3) sa môže liečba nasadiť aj bez histologického dôkazu. Pri rozhodovaní o nutnosti biopsie pečene pred začiatkom liečby sa má postupovať podľa platných liečebných postupov.
U pacientov s normálnymi hodnotami ALT sa progresia do fibrózy v priemere vyskytuje s nižšou intenzitou ako u pacientov so zvýšenými hodnotami ALT. Toto musí byť zhodnotené spoločne s ostatnými kritériami ako HCV genotyp, vek pacienta, extrahepatálne prejavy, riziko prenosu atď., ktoré ovplyvňujú rozhodnutie liečiť alebo neliečiť.
Laboratórne vyšetrenia pred liečbou a počas nejPred začiatkom liečby Pegasysom sa u všetkých pacientov odporúča vykonať štandardné hematologické a biochemické laboratórne vyšetrenia.
Pred začiatkom liečby Pegasysom musia byť východiskové hodnoty sledovaných parametrov nasledovné:
- počet trombocytov ≥ 90 000/mm3
- absolútny počet neutrofilov ≥ 1 500/mm3
- primerane kontrolovaná funkcia štítnej žľazy (TSH a T4)
Hematologické vyšetrenia sa majú opakovať každé 2 - 4 týždne a biochemické vyšetrenia každé 4
týždne. Počas liečby sa má periodicky robiť doplnkové vyšetrenie.
V klinických štúdiách sa počas liečby Pegasysom pozorovalo zníženie počtu leukocytov (WBC) ako aj absolútneho počtu neutrofilov (ANC), ku ktorému obyčajne došlo počas prvých dvoch týždňov liečby (pozri časť 4.8). Progresívne znižovanie po 8 týždňoch liečby sa zistilo len v zriedkavých prípadoch. Pokles ANC bol obyčajne reverzibilný po znížení dávkovania alebo ukončení liečby (pozri časť 4.2),
normálne hodnoty sa dosiahli u väčšiny pacientov za 8 týždňov a na základné hodnoty sa vrátili u všetkých pacientov približne po 16 týždňoch.
Liečbu Pegasysom sprevádzalo zníženie počtu trombocytov, ktorý sa vrátil na úroveň pred liečbou počas obdobia sledovania po liečbe (pozri časť 4.8). V niektorých prípadoch bola potrebná úprava dávkovania (pozri časť 4.2).
V klinických štúdiách sa u 15 % pacientov s chronickou hepatitídou C liečených Pegasysom
v kombinácii s ribavirínom pozoroval výskyt anémie (hemoglobín <10 g/dl). Frekvencia závisí na dĺžke trvania liečby a na dávke ribavirínu (pozri časť 4.8). U ženskej populácie je vyššie riziko vývoja anémie.
Pri podávaní Pegasysu v kombinácii s inými potenciálne myelosupresívnymi látkami je potrebná opatrnosť.
V literatúre sú hlásenia o výskyte pancytopénie a o útlme kostnej drene, ku ktorým došlo v priebehu 3 až 7 týždňov po podaní peginterferónu a ribavirínu podaného súbežne s azatioprinom. Táto myelotoxicita bola reverzibilná do 4 až 6 týždňov po vysadení antivirotickej terapie proti hepatitíde C a súčasne podávaného azatioprinu a neobnovila sa po opätovnom zavedení ktoréhokoľvek z týchto liečiv podávaných v monoterapii (pozri časť 4.5).
Použitie kombinovanej liečby Pegasysom a ribavirínom u pacientov s chronickou hepatitídou C,
u ktorých zlyhala predchádzajúca liečba, sa dostatočne nesledovalo u pacientov, ktorí predchádzajúcu liečbu predčasne ukončili kvôli hematologickým nežiaducim reakciám. Lekári, ktorí uvažujú o liečbe týchto pacientov, majú starostlivo zvážiť riziká opakovanej liečby oproti jej prínosom.
Endokrinný systém
Pri používaní interferónov alfa vrátane Pegasysu sa popísali poruchy funkcie štítnej žľazy, resp. zhoršenie predchádzajúcich ochorení štítnej žľazy. Pred začiatkom liečby Pegasysom sa majú vyšetriť hladiny TSH a T4. Liečbu Pegasysom je možné zahájiť alebo je možné v nej pokračovať, ak sa hodnoty TSH počas liečby udržia v normálnom rozmedzí. Počas liečebnej kúry sa majú vyšetriť hladiny TSH, ak sa u pacienta objavia klinické príznaky svedčiace o možnej poruche funkcie štítnej
žľazy (pozri časť 4.8). Pri liečbe Pegasysom sa môže pozorovať hypoglykémia, hyperglykémia a diabetes mellitus (pozri časť 4.8). Pacienti, u ktorých sa tieto stavy nemôžu účinne kontrolovať liekmi, sa nemajú začať liečiť Pegasysom alebo Pegasysom v kombinácii s ribavirínom. U pacientov, u ktorých sa toto ochorenie rozvinulo počas liečby a nemôžu sa liečiť liekmi, má sa liečba Pegasysom alebo Pegasysom v kombinácii s ribavirínom ukončiť.
Kardiovaskulárny systém
Liečbu interferónmi alfa vrátane Pegasysu sprevádzala hypertenzia, supraventrikulárne arytmie, kongestívne srdcové zlyhanie, bolesť na hrudníku a infarkt myokardu. Odporúča sa, aby sa pacienti so srdcovými abnormalitami v predchorobí podrobili elektrokardiografickému vyšetreniu pred začiatkom liečby Pegasysom. Pri akomkoľvek zhoršení kardiovaskulárneho stavu sa musí liečba prerušiť resp. ukončiť. U pacientov s kardiovaskulárnym ochorením si môže anémia vyžiadať zníženie dávkovania alebo vysadenie liečby ribavirínom (pozri časť 4.2).
Funkcia pečene
Liečba Pegasysom sa musí ukončiť u pacientov, u ktorých sa počas liečby objavia známky dekompenzácie pečene. Pri liečbe Pegasysom sa pozorovalo zvýšenie hladín ALT oproti východiskovej hodnote, ku ktorému došlo aj u pacientov s virologickou odpoveďou na liečbu. Ak napriek zníženiu dávkovania hodnota ALT naďalej stúpa a je klinicky významná resp. ju sprevádza zvýšenie hladiny priameho bilirubínu, liečba sa musí ukončiť (pozri časti 4.2 a 4.8).
V prípade chronickej hepatitídy B, na rozdiel od chronickej hepatitídy C, nie je nezvyčajné zhoršenie ochorenia počas liečby, ktoré je charakterizované prechodným a potenciálne významným zvýšením sérovej ALT. V klinických štúdiách s Pegasysom pri HBV sa pozorovalo výrazné zvýšenie hladiny transaminázy, sprevádzané miernymi zmenami v ďalších parametroch hepatálnej funkcie, pričom sa
nedokázala dekompenzácia pečene. Približne v polovici prípadov zvýšenia ALT prekračujúceho desaťnásobok hornej hranice normálnej hodnoty sa dávkovanie Pegasysu znížilo alebo liek sa vysadil, až kým neklesli hodnoty transaminázy, zatiaľ čo u zvyšku pacientov liečba ostala nezmenená. Vo všetkých prípadoch sa odporučilo častejšie sledovanie hepatálnej funkcie.
Precitlivenosť
V zriedkavých prípadoch sa počas liečby interferónom alfa môžu vyskytnúť závažné akútne reakcie
z precitlivenosti (napr. urtikária, angioedém, bronchokonstrikcia, anafylaxia). Ak sa vyskytnú, musí sa liečba ukončiť a okamžite zahájiť príslušná farmakoterapia. Prechodný exantém si nevyžaduje nutnosť prerušenia liečby.
Autoimunitné ochorenie
Popísal sa vznik autoprotilátok a autoimunitných porúch počas liečby interferónmi alfa. Zvýšené riziko môžu mať pacienti predisponovaní na rozvoj autoimunitných porúch. Pacientov, ktorí majú znaky alebo príznaky zlučiteľné s autoimunitnými poruchami, sa má starostlivo vyšetriť a potom prehodnotiť pomer prínosu a rizika pokračovania liečby interferónom (pozri tiež Endokrinný systém v častiach 4.4 a 4.8).
U pacientov s chronickou hepatitídou C liečených interferónom boli hlásené prípady Vogt-Koyanagi- Harada (VKH) syndrómu. Tento syndróm je granulomatózne zápalové ochorenie, ktoré postihuje oči, sluchový systém, meningy a kožu. Ak je podozrenie na VKH syndróm, má sa antivirotická liečba ukončiť a uvažovať o liečbe kortikoidmi (pozri časť 4.8).
Horúčka/infekcie
Zatiaľ čo horúčka môže byť spojená so syndrómom podobným chrípke, čo sa často uvádza pri liečbe interferónom, musia sa vylúčiť iné príčiny pretrvávajúcej horúčky, zvlášť závažné infekcie (bakteriálne, vírusové, plesňové), najmä u pacientov s neutropéniou. V priebehu liečby interferónmi alfa, vrátane Pegasysu sa zaznamenal vznik závažných infekcií (bakteriálnych, vírusových, plesňových) a sepsa. Okamžite sa má začať odpovedajúca liečba proti infekcii a má sa zvážiť prerušenie liečby.
Očné zmeny
Pri liečbe Pegasysom sa zriedkavo popísala retinopatia, vrátane krvácania do sietnice, vatových škvŕn, edému papily, neuropatie zrakového nervu a uzáveru retinálnej artérie alebo vény, ktorý môže viesť
k strate zraku. Všetci pacienti sa majú pred začiatkom liečby podrobiť očnému vyšetreniu. Každý pacient udávajúci zhoršenie alebo stratu zraku sa musí okamžite podrobiť kompletnému očnému vyšetreniu. Dospelí a pediatrickí pacienti s očnými poruchami v predchorobí (napr. diabetickou alebo hypertenznou retinopatiou), sa majú počas liečby Pegasysom podrobiť pravidelným očným vyšetreniam. Liečba Pegasysom sa má ukončiť u pacientov s novovzniknutými alebo zhoršenými poruchami zraku.
Pľúcne zmeny
Počas liečby Pegasysom sa opísali pľúcne zmeny vrátane dýchavice, pľúcnych infiltrátov, pneumónie a pneumonitídy. V prípade pretrvávajúcich alebo nevysvetlených pľúcnych infiltrátov alebo zhoršenia funkcie pľúc sa má liečba ukončiť.
Kožné poruchy
Liečba interferónmi alfa bola sprevádzaná exacerbáciou alebo rozvojom psoriázy a sarkoidózy. Pegasys sa musí opatrne používať u pacientov s psoriázou a v prípadoch vzniku resp. zhoršenia psoriatických lézií sa musí liečba ukončiť.
Transplantácia
Bezpečnosť a účinnosť liečby Pegasysom a ribavirínom sa u pacientov po transplantácii pečene a iných orgánov nehodnotila. Boli hlásené odvrhnutia transplantátov pečene a obličiek po liečbe Pegasysom samotným alebo po kombinovanej liečbe s ribavirínom.
Súčasná infekcia HIV-HCV
Prosím, pozrite si súhrny charakteristických vlastností pre antiretrovírusové lieky, ktoré sa užívajú súbežne s HCV liečbou pre porozumenie a zvládnutie toxických účinkov každého lieku a možnosti prekrývania sa toxických účinkov pri liečbe Pegasysom s ribavirínom alebo bez ribavirínu. V štúdii NR15961 u pacientov, ktorí boli súbežne liečení so stavudínom a interferónom s alebo bez ribavirínu, bol výskyt pankreatitídy a/alebo laktátovej acidózy 3 % (12/398).
U pacientov súčasne infikovaných HCV a HIV, ktorí dostávajú vysoko-účinnú liečbu anti- retrovírusovými látkami (HAART), môže byť vyššie riziko vzniku laktátovej acidózy. Preto je potrebná opatrnosť pri pridávaní kombinovanej liečby Pegasys a ribavirín k liečbe HAART (pozri SmPC ribavirínu).
Súčasne infikovanípacienti s pokročilou infekciou a pokročilou cirhózou pečene liečení HAART môžu mať vyššie riziko dekompenzácie pečene a úmrtia, ak dostávajú ribavirín v kombinácii s interferónmi vrátane Pegasysu. Zmeny východiskových hodnôt u koinfikovaných pacientov s cirhózou, ktoré môžu byť spojené s dekompenzáciou pečene, zahŕňajú: zvýšený sérový bilirubín, znížený hemoglobín, zvýšenú alkalickú fosfatázu alebo znížený počet krvných doštičiek a liečbu didanozínom (ddI).
Súbežná liečba ribavirínom a zidovudínom sa neodporúča vzhľadom na zvýšené riziko vzniku anémie
(pozri časť 4.5).
Počas liečby pacienti s kombinovanou infekciou sa majú starostlivo sledovať na znaky a symptómy dekompenzácie pečene (vrátane ascitu encefalopatie, krvácania z varixov, poškodenej syntézy
v pečeni; napr. Childovo-Pughovo skóre 7 alebo vyššie). Childovo-Pughovo skóre môže byť ovplyvnené faktormi spojenými s liečbou (ako nepriama hyperbilirubinémia, znížený albumín) a nemusia nevyhnutne viesť k dekompenzácii pečene. Liečba Pegasysom sa má ihneď ukončiť u pacientov s dekompenzáciou pečene.
U pacientov súčasne infikovaných HCV a HIV, údaje o účinnosti a bezpečnosti sú obmedzené
u pacientov s počtom CD4 buniek nižším ako 200 buniek/µl. Opatrnosť je preto potrebná u pacientov s nízkym počtom CD4 buniek.
Dentálne a periodontálne poruchy
U pacientov, ktorí dostávajú Pegasys v kombinácii s ribavirínom, sa hlásili dentálne a periodontálne poruchy, ktoré môžu viesť k strate zubov. Navyše suché ústa môžu mať škodlivý účinok na zuby a mukózne membrány úst počas dlhotrvajúcej liečby Pegasysom v kombinácii s ribavirínom. Pacienti si majú dvakrát denne dôkladne čistiť zuby a majú mať pravidelné kontrolné vyšetrenie zubným
lekárom. Okrem toho u niektorých pacientov sa môže objaviť vracanie. Ak sa takáto reakcia vyskytne, má sa im odporučiť dôkladne si potom vypláchnuť ústa.
Použitie dlhodobej liečby peginterferónom v monoterapii (neschválené použitie)
V randomizovanej, kontrolovanej štúdii (HALT-C) uskutočnej v USA u pacientov infikovaných vírusom HCV s rozličným stupňom fibrózy, ktorí neodpovedali na liečbu, sa sledovala 3,5-ročná liečba Pegasysom v monoterapii v dávke 90 mikrogramov/týždeň, pričom sa nezistilo žiadne signifikantné zníženie výskytu progresie fibrózy alebo súvisiacich klinických príhod.
Pomocná látka
Pegasys obsahuje benzylakohol. Nesmie sa podávať predčasne narodeným deťom ani novorodencom. Môže spôsobiť toxické reakcie a anafylaktické reakcie u dojčiat a detí vo veku do 3 rokov.
4.5 Liekové a iné interakcie
Interakčné štúdie sa uskutočnili len u dospelých.
Podávanie Pegasysu zdravým mužským dobrovoľníkom v dávke 1 x 180 mikrogramov týždenne počas 4 týždňov nemalo žiadny vplyv na farmakokinetické profily mefenytoínu, dapsonu,
debrisochínu a tolbutamidu, čo poukazuje na to, že Pegasys neovplyvňuje in vivo metabolickú aktivitu izoenzýmov cytochrómu P450 3A4, 2C9, 2C19 a 2D6.
V rovnakej štúdii sa pozorovalo 25 % zvýšenie hodnoty AUC pre teofylín (marker aktivity cytochrómu P450 1A2), čo potvrdzuje, že Pegasys je inhibítorom aktivity cytochrómu P450 1A2. U pacientov liečených súbežne teofylínom a Pegasysom sa majú sledovať sérové koncentrácie teofylínu a vhodne upraviť jeho dávkovanie. Je pravdepodobné, že k maximálnej interakcii medzi teofylínom a Pegasysom dôjde po viac ako 4 týždňoch liečby Pegasysom.
Pacienti s izolovanou infekciou vírusom HCV a pacienti s izolovanou infekciou vírusom HBV
Vo farmakologickej štúdii dostávalo 24 HCV infikovaných pacientov súbežne udržiavaciu liečbu
metadonom (stredná dávka 95 mg, v rozmedzí od 30 mg do 150 mg), liečba s Pegasysom
180 mikrogramov, subkutánne raz týždenne počas 4 týždňov, bola spojená s priemernými hodnotami metadonu, ktoré boli 10 % až 15 % vyššie než východiskové hodnoty. Klinický význam tohto zistenia nie je známy, napriek tomu sa majú pacienti sledovať pre príznaky a symptómy metadonovej toxicity. Zvlášť sa majú sledovať pacienti, ktorí užívajú vysokú dávku metadonu, u ktorých je riziko predĺženia QT intervalu.
Ribavirín, keďže má inhibičný účinok na inozín-monofosfátdehydrogenázu, môže zasahovať do metabolizmu azatioprinu, čo eventuálne môže viesť ku kumulácii 6-metyltioinozín-monofosfátu (6- MTIMP), ktorý sa spája so vznikom myelotoxicity u pacientov liečených azatioprinom. Má sa vyhnúť použitiu peginterferónu alfa-2a a ribavirínu podaného súbežne s azatioprinom. V jednotlivých prípadoch, ak prínos podávania ribavirínu súčasne s azatioprinom oprávňuje podstúpiť možné riziko, odporúča sa dôkladne monitorovať hematologické parametre počas súbežného podávania azatioprinu so zreteľom odhaliť známky myelotoxicity − v prípade, že k nej dôjde, treba liečbu týmito liekmi ukončiť (pozri časť 4.4).
Výsledky z farmakokinetických podštúdií v rámci pilotnej štúdie fázy III nepreukázali žiadnu farmakokinetickú interakciu medzi lamivudínom a Pegasysom u pacientov s HBV alebo medzi Pegasysom a ribavirínom u pacientov s HCV.
V klinickom skúšaní bola skúmaná kombinácia telbivudínu 600 mg denne s pegylovaným interferónom alfa-2a, 180 mikrogramov raz týždenne podané subkutánne. Skúšanie ukázalo, že kombinácia je spojená so zvýšeným rizikom vzniku periférnej neuropatie. Mechanizmus vzniku týchto udalostí nie je známy; a tak kombinovaná liečba telbivudínom s inými interferónmi (pegylovanými alebo štandardnými) môže tiež znamenať nesmierne riziko. Okrem toho, prínos kombinovanej liečby telbivudínom s interferónom alfa (pegylovaným alebo štandardným) nie je v súčasnosti preukázaný. Preto je kombinácia Pegasysu s telbivudínom kontraindikovaná (pozri časť 4.3).
Pacienti súčasne infikovaní vírusmi HIV-HCV
U 47 HIV-HCV infikovaných pacientov, ktorí sa zúčastnili na 12-týždňovej farmakokinetickej časti
štúdie skúmajúcej účinok ribavirínu na vnútrobunkovú fosforyláciu niektorých inhibítorov nukleozidovej reverznej transkriptázy (lamivudín a zidovudín alebo stavudín) sa nepozoroval žiadny zjavný dôkaz o liekovej interakcii. Avšak v dôsledku vysokej variability boli intervaly spoľahlivosti dosť široké. Nezdá sa, že plazmatická expozícia ribavirínu je ovplyvnená súčasným podávaním inhibítorov nukleozidovej reverznej transkriptázy (NRTIs).
Súčasné podávanie ribavirínu a didanozínu sa neodporúča. Expozícia didanozínu alebo jeho
aktívnemu metabolitu (dideoxyadenozín 5´-trifosfát) sa zvyšuje in vitro, ak sa didanozín podáva spolu s ribavirínom. Pri používaní ribavirínu sa popísali hlásené prípady zlyhania pečene s následkom smrti, ako aj periférna neuropatia, pankreatitída a symptomatická hyperlaktatémia/laktátová acidóza.
Keď bol zidovudín súčasťou režimu používaného na liečbu HIV, bolo hlásené zvýraznenie anémie spôsobenej ribavirínom. Presný mechanizmus zostáva nevysvetlený. Súčasné podávanie ribavirínu
kombinovaná antiretrovírusová liečba stanovená, má sa zvážiť nahradenie zidovudínu. Je to zvlášť
dôležité u pacientov, u ktorých zidovudín spôsobil anémiu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne alebo iba obmedzené údaje o použití peginterferónu alfa-2a u gravidných žien. Štúdie na zvieratách s peginterferónom alfa-2a preukázali reprodukčnú toxicitu (pozri časť 5.3) a nie je známe potenciálne riziko u ľudí. Liečba Pegasysom počas gravidity sa používa iba vtedy, ak jej úžitok pre matku prevýši jeho riziko pre plod.
Laktácia
Nie je známe, či sa peginterferón alfa-2a/jeho metabolity vylučujú do materského mlieka. Dojčenie sa má ukončiť pred začatím liečby pre možnosť vzniku nežiaducich reakcií u dojčených detí.
Fertilita
Nie sú k dispozícii žiadne údaje o účinkoch peginterferónu alfa-2a na fertilitu žien. Pri podávaní peginterferónu alfa-2a samiciam opíc sa pozorovalo predĺženie menštruačného cyklu (pozri časť 5.3).
Použitie s ribavirínom
U všetkých zvieracích druhov, ktoré boli vystavené ribavirínu, sa dokázali významné teratogénne a/alebo embryocídne účinky. Ribavirín je u gravidných žien kontraindikovaný. Je potrebná mimoriadna opatrnosť na zabránenie gravidity u pacientok alebo partneriek pacientov, ktorí užívajú Pegasys v kombinácii s ribavirínom. Pacientky v plodnom veku musia používať účinnú antikoncepciu počas liečby a ešte 4 mesiace po ukončení liečby. Pacienti alebo partnerky musia používať účinnú
antikoncepciu počas liečby a ešte 7 mesiacov po ukončení liečby. Prosím pozrite si SmPC ribavirínu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pegasys má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti, ktorí trpia závratom, zmätenosťou, ospalosťou alebo únavou, sa majú vyvarovať vedeniu vozidiel
alebo obsluhovaniu strojov.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Chronická hepatitída C
Výskyt a závažnosť väčšiny nežiaducich reakcií u pacientov liečených Pegasysom je podobná ako u pacientov dostávajúcich interferón alfa-2a pozri tabuľku 9). Väčšina častých nežiaducich reakcií pozorovaných po Pegasyse 180 mikrogramov bola miernej až strednej intenzity, pričom ich bolo možné zvládnuť bez potreby zmeny dávkovania alebo ukončenia liečby.
Chronická hepatitída B
V klinických štúdiách, ktoré skúmali 48-týždňovú liečbu a 24-týždňové sledovanie po liečbe bol bezpečnostný profil Pegasysu pri chronickej hepatitíde B podobný ako v prípade chronickej hepatitídy C. Frekvencia výskytu väčšiny nežiaducich reakcií, s výnimkou pyrexie, bola výrazne nižšia v prípade CHB liečenej Pegasysom v monoterapii v porovnaní s HCV pacientami liečenými s Pegasysom v monoterapii (pozri tabuľku 9). Nežiaduce účinky malo 88 % pacientov liečených
Pegasysom v porovnaní s 53 % pacientov v porovnávacej skupine s lamivudínom, kým 6 % pacientov liečených Pegasysom a 4% pacientov liečených lamivudínom mali závažné nežiaduce účinky počas štúdií. Nežiaduce účinky alebo abnormálne laboratórne hodnoty viedli u 5 % pacientov k ukončeniu liečby v skupine liečenej Pegasysom, zatiaľ čo menej ako 1 % pacientov ukončilo liečbu v skupine liečenej lamivudínom z tých istých dôvodov. Percento pacientov s cirhózou, ktorí ukončili liečbu bolo podobné ako u pacientov v celkovej populácii v každej liečenej skupine.
Chronická hepatitída C u pacientov, ktorí neodpovedali na predchádzajúcu liečbu
U pacientov, ktorí neodpovedali na predchádzajúcu liečbu, bol bezpečnostný profil Pegasysu
v kombinácii s ribavirínom celkovo podobný ako u predtým neliečených pacientov. V klinickom skúšaní u pacientov, ktorí neodpovedali na predchádzajúcu liečbu pegylovaným interferónom
alfa-2b/ribavirínom, v ktorej boli pacienti podrobení buď 48-týždňovej, alebo 72-týždňovej liečbe, došlo kvôli nežiaducim udalostiam alebo laboratórnym odchýlkam k predčasnému ukončeniu liečby Pegasysom u 6 % pacientov a liečby ribavirínom u 7 % pacientov v skupine liečenej 48 týždňov a v skupine liečenej 72 týždňov z rovnakého dôvodu liečbu Pegasysom predčasne ukončilo 12 % pacientov a liečbu ribavirínom 13 % pacientov. Podobne aj u pacientov s cirhózou alebo prechodom do cirhózy sa predčasné ukončenie liečby Pegasysom a liečby ribavirínom vyskytovalo častejšie v skupine liečenej 72 týždňov (13 % a 15 %) než v skupine liečenej 48 týždňov (6 % a 6 %). Pacienti, ktorí kvôli hematologickej toxicite predčasne ukončili predchádzajúcu liečbu pegylovaným interferónom alfa-2b/ribavirínom, boli z účasti na tejto štúdii vylúčení.
V ďalšom klinickom skúšaní boli 48 týždňov liečení pacienti s pokročilou fibrózou alebo cirhózou (Ishakovo skóre 3 až 6), ktorí neodpovedali na predchádzajúcu liečbu a ktorí mali pred zaradením do štúdie počet trombocytov iba 50 000/mm3. Odchýlky laboratórnych hematologických parametrov pozorované počas prvých 20 týždňov štúdie zahŕňali anémiu (26 % pacientov malo hladinu hemoglobínu < 10 g/dl), neutropéniu (30 % pacientov malo ANC < 750/mm3) a trombocytopéniu
(13 % pacientov malo počet trombocytov < 50 000/mm3) (pozri časť 4.4).
Súčasná infekcia vírusom chronickej hepatitídy C a vírusom HIV
U pacientov súčasne infikovaných vírusmi HIV-HCV boli profily klinických nežiaducich reakcií pri liečbe Pegasysom samotným alebo v kombinácii s ribavirínom podobné ako profily u pacientov infikovaných len HCV. U HIV-HCV pacientov, ktorí dostávali Pegasys a ribavirín v kombinovanej liečbe, boli hlásené ďalšie nežiaduce účinky u ≥ 1 % až ≤ 2 % pacientov: hyperlaktacidémia/laktát acidóza, chrípka, pneumónia, psychická labilita, apatia, hučanie v ušiach, faryngolaryngeálna bolesť, zápal pery, získaná lipodystrofia a chromatúria. Liečba Pegasysom bola spojená s poklesom absolútneho počtu CD4+ buniek počas prvých 4 týždňov bez zníženia percenta CD4+ buniek. Pokles počtu CD4+ buniek bol po znížení dávky alebo po ukončení liečby reverzibilný. Používanie Pegasysu nemalo žiadny pozorovateľný negatívny vplyv na kontrolu HIV virémie počas liečby alebo následnom sledovaní pacientov. U koinfikovaných pacientov s počtom CD4+ buniek < 200/μl sú údaje
o bezpečnosti obmedzené.
Tabuľkový súhrn nežiaducich reakcií
V tabuľke 9 sú zhrnuté nežiaduce účinky hlásené u CHB alebo CHC pacientov pri liečbe Pegasysom
v monoterapii a u CHC pacientov liečených Pegasysom v kombinácii s ribavirínom. Nežiaduce účinky hlásené v klinických štúdiách sú zoradené do skupín podľa frekvencie a to nasledovne: veľmi časté
(≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až
< 1/1 000), veľmi zriedkavé (< 1/10 000). Frekvencia nežiaducich účinkov na základe spontánnych
hlásení vychádzajúcich zo skúseností po uvedení lieku na trh nie je známa (nemožno ju odhadnúť z dostupných údajov). V rámci jednotlivých skupín je frekvencia nežiaducich účinkov z hľadiska závažnosti usporiadaná v klesajúcom poradí.
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Infekcie a
nákazy
|
|
bronchitída,
infekcie horných dýchacích ciest, kandidóza
ústnej dutiny, herpes simplex, hubovité,
vírusové
a bakteriálne infekcie
|
pneumónia,
kožná infekcia
|
endokarditída,
zápal
vonkajšieho ucha
|
|
sepsa
|
Benígne a
malígne nádory
|
|
|
neoplazma
pečene
|
|
|
|
Poruchy krvi
a lymfatického systému
|
|
trombocytopéni
a, anémia, lymfadenopatia
|
|
pancytopénia
|
aplastická
anémia
|
izolovaná
aplázia červených krviniek
|
Poruchy
imunitného systému
|
|
|
sarkoidóza,
tyroiditída
|
anafylaxia,
systémový lupus erythematosus, reumatoidná artritída
|
idiopatická
alebo tromboticko- trombocyto- penická purpura
|
odvrhnutie
transplantá-tu pečene
a obličiek, Vogt- Koyanagi-
Harada
ochorenie
|
Poruchy
endokrinnéh o systému
|
|
hypotyreóza,
hypertyreóza
|
diabetes
|
diabetická
ketoacidóza
|
|
|
Poruchy
metabolizmu a výživy
|
anorexia
|
|
dehydratácia
|
|
|
|
Psychické
poruchy
|
depresia*,
úzkosť, nespavosť*
|
agresia, zmeny
nálady, emočné poruchy nervozita, pokles libida
|
samovražedn
é myšlienky, halucinácie
|
samovražda,
psychotická porucha
|
|
mánia,
bipolárne poruchy, myšlienky na vraždu
|
Poruchy
nervového systému
|
bolesť
hlavy, závrat*, zníženie
koncentrá-
cie
|
synkopa,
migréna, porucha pamäti slabosť,
hypoestézia,
hyperestézia, parestézia, tremor, porucha chuti, nočné mory, ospanlivosť
|
periférna neuropatia
|
kóma, kŕče, paréza tváre
|
|
cerebrálna ischémia
|
Poruchy oka
|
|
neostré videnie,
bolesť oka, zápal oka, xeroftalmia
|
krvácanie do
sietnice
|
zraková
neuropatia, papiloedém, poškodenie ciev sietnice, retinopatia, vred rohovky
|
strata zraku
|
serózne
odlúčenie sietnice
|
|
|
Tabuľka 9:Nežiaduce účinky hlásené v klinických skúšaniach a po uvedení lieku na trh pri monoterapii Pegasysom u pacientov s HBV alebo s HCV alebo v kombinácii s ribavirínom u HCV pacientov
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Poruchy
ucha a labyrintu
|
|
vertigo, bolesť
ucha
|
strata sluchu
|
|
|
|
Poruchy
srdca a srdcovej činnosti
|
|
tachykardia,
periférny edém, palpitácie,
|
|
infarkt
myokardu, kongestívne zlyhanie srdca, kardiomyopatia, angína, arytmia, fibrilácia predsiene, perikarditída, supra - vertikulárna tachykardia
|
|
|
Poruchy ciev
|
|
sčervenanie
|
hypertenzia
|
krvácanie do
mozgu, vaskulitída
|
|
periférna
ischémia
|
Poruchy
dýchacej sústavy hrudníka amediastína
|
dýchavica
|
námahová
dýchavica, krvácanie
z nosa, zápal nosohltana,
kongescia
prínosných dutín, nádcha, kongescia nosovej sliznice, bolesť hrdla
|
sipot
|
intersticiálna
pneumónia, vrátane úmrtia, pľúcna embólia
|
|
|
Poruchy
gastrointesti nál-neho traktu
|
hnačka*,
nevoľnosť*, bolesť brucha*
|
vracanie,
dyspepsia, dysfágia, ulcerácia dutiny ústnej, krvácanie ďasien, glositída, stomatitída, plynatosť, sucho v ústach
|
gastrointestin
álne krvácanie
|
peptický vred,
pankreatitída
|
|
ischemická
kolitída
|
Poruchy
pečene a žlčových ciest
|
|
|
porucha
funkcie pečene
|
zlyhanie pečene,
cholangitída, stukovatenie pečene
|
|
|
Poruchy
kože a podkožného tkaniva
|
alopécia,
dermatití- da, svrbenie, suchá koža
|
psoriáza,
urtikária, ekzém, vyrážka, zvýšené potenie, kožná porucha, fotosenzitivita, nočné potenie
|
|
|
Stevens-
Johnsonov syndróm, toxická epidermálna nekrolýza, angioedém, erythema multiforme
|
|
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Poruchy
kostrovej a svalovej sústavy a
spojivového
tkaniva
|
myalgia,
artralgia
|
bolesť chrbta,
artritída, svalová slabosť, bolesť
kostí, bolesť
šije, bolesť svalov a kostrového systému, svalové kŕče
|
|
myozitída
|
|
rabdomyo- lýza
|
Poruchy
obličiek a močo- vých ciest
|
|
|
|
renálna
insuficiencia
|
|
|
Poruchy
reprodukčné ho systému a prsníkov
|
|
impotencia
|
|
|
|
|
Celkové
poruchy a reakcie
v mieste podania
|
pyrexia,
zimnica* bolesť*, asténia, únava, reakcia
v mieste podania injekcie*, citlivosť*
|
bolesť na
hrudníku, príznaky podobné chrípke, malátnosť, letargia, návaly tepla, smäd
|
|
|
|
|
Laboratórne
a funkčné vyšetrenia
|
|
úbytok
hmotnosti
|
|
|
|
|
Úrazy,
otravy a komplikácie liečebného postupu
|
|
|
|
predávkovanie
liekom
|
|
|
*Tieto nežiaduce reakcie boli časté (
≥1/100 až < 1/10) u CHB pacientov liečených Pegasysom v monoterapii.
Popis vybraných nežiaducich reakciíLaboratórne hodnoty
Liečbu Pegasysom sprevádzali nasledovné odchýlky laboratórnych parametrov: zvýšenie ALT, zvýšenie bilirubínu, poruchy rovnováhy elektrolytov (hypokaliémia, hypokalciémia, hypofosfatémia), hyperglykémia, hypoglykémia a zvýšenie triglyceridov (pozri časť 4.4). U oboch spôsobov liečby, t.j. pri použití Pegasysu v monoterapii aj v kombinácii s ribavirínom sa u 2 % pacientov pozoroval vzostup hladín ALT, ktorý si vyžiadal úpravu dávkovania alebo ukončenie liečby.
Liečba Pegasysom bola spojená s poklesom hematologických parametrov (leukopénia, neutropénia, lymfopénia, trombocytopénia a pokles hemoglobínu), ktoré sa po úprave dávkovania obyčajne zlepšili a vrátili na úroveň spred liečby v priebehu 4 - 8 týždňov po ukončení liečby (pozri časti 4.2 a 4.4).
Mierna neutropénia (ANC: 0,749 – 0,5 x 109/l) sa pozorovala u 24 % (216/887) pacientov a ťažká neutropénia (ANC: < 0,5 x 109/l) u 5 % (41/887) pacientov, ktorí dostávali Pegasys v dávke
180 mikrogramov v kombinácii s ribavirínom v dávke 1 000 mg alebo 1 200 mg počas 48 týždňov.
Protilátky proti interferónu
U 1 – 5 % pacientov liečených Pegasysom sa zistila prítomnosť neutralizačných protilátok. Podobne ako v prípade ďalších interferónov, vyšší výskyt neutralizačných protilátok sa pozoroval aj pri
chronickej hepatitíde B. Avšak pri žiadnej z týchto chorôb to nesúviselo s nedostatočnou terapeutickou
odpoveďou.
Funkcia štítnej žľazyLiečbu Pegasysom sprevádzali klinicky významné odchýlky hodnôt parametrov štítnej žľazy, ktoré si vyžadovali klinický zásah (pozri časť 4.4). Výskyt pozorovaných odchýlok (4,9 %) u pacientov
liečených Pegasysom v kombinácii s ribavirínom (NV15801) je podobný ako u pacientov liečených
inými interferónmi.
Laboratórne hodnoty u pacientov súčasne infikovaných vírusmi HIV-HCVHoci hematologická toxicita neutropénie, trombocytopénie a anémie sa vyskytovala častejšie u HIV- HCV pacientov, väčšina prípadov sa dala zvládnuť úpravou dávkovania a použitím rastových faktorov a vzácne došlo k predčasnému ukončeniu liečby. Pokles hladín ANC pod 500 buniek/mm3 sa
pozoroval u 13 % a 11 % pacientov, ktorí dostávali Pegasys v monoterapii a v kombinácii v uvedenom poradí. Pokles počtu krvných doštičiek pod 50 000/mm3 sa pozoroval u 10 % a 8 % pacientov, ktorí dostávali Pegasys v monoterapii a v kombinácii v uvedenom poradí. Anémia (hemoglobín < 10 g/dl)
sa popísala u 7 % a 14 % pacientov liečených Pegasysom v monoterapii a v kombinácii v uvedenom
poradí.
Pediatrická populáciaChronická hepatitída CV klinickom skúšaní so 114 pediatrickými pacientmi (vo veku 5 až 17 rokov) liečenými samotným Pegasysom alebo v kombinácii s ribavirínom (pozri časť 5.1) boli úpravy dávky potrebné u približne jednej tretiny pacientov najčastejšie kvôli neutropénii a anémii. Vo všeobecnosti bol bezpečnostný profil pozorovaný u pediatrických pacientov podobný ako profil pozorovaný u dospelých. Vpediatrickej štúdii najrozšírenejšie nežiaduce reakcie u pacientov liečených kombinovanou liečbou Pegasysom a ribavirínom počas až 48 týždňov boli ochorenie podobné chrípke (91 %), bolesť hlavy (64 %), gastrointestinálne ochorenie (56 %) a reakcie v mieste podania injekcie (45 %). Úplný zoznam nežiaducich reakcií hlásených v tejto liečebnej skupine (n = 55) je uvedený v tabuľke 10. Sedem pacientov užívajúcich kombinovanú liečbu Pegasysom a ribavirínom počas 48 týždňov prerušilo
liečbu s bezpečnostných dôvodov (depresia, abnormálne hodnotenie psychického stavu, prechodná slepota, exudáty na sietnici, hyperglykémia, diabetes mellitus typu 1 a anémia). Väčšina nežiaducich reakcií zaznamenaných v štúdii bola mierna alebo stredne závažná. Závažné nežiaduce reakcie sa zaznamenali u 2 pacientov v skupine s kombinovanou liečbou Pegasysom plus ribavirín (hyperglykémia a cholecystektómia).
Tabuľka 10: Nežiaduce reakcie hlásené u pediatrických pacientov infikovaných vírusom HCVpripisované Pegasysu plus ribavirínu v štúdii NV17424Telový systém
| Veľmi časté
| Časté
|
Infekcie a nákazy
|
| infekčná mononukleóza,
streptokoková faryngitída, chrípka, vírusová gastroenteritída, kandidóza, gastroenteritída, zubný absces, hordeolum, infekcia močových ciest, zápal nosohltana
|
Poruchy krvi a lymfatického
systému
|
| anémia
|
Poruchy metabolizmu a výživy
| zníženie chute do jedla
| hyperglykémia, diabetes mellitus
typu 1
|
T
elový systém
|
V
eľmi časté
|
Č
asté
|
Psychické poruchy
|
insomnia
|
depresia, úzkosť, halucinácie,
nenormálne správanie, agresia, hnev, zníženie pozornosti/neusporiadaná hyperaktivita
|
Poruchy nervového systému
|
bolesť hlavy
|
závrat, porucha pozornosti, migréna
|
Poruchy oka
|
|
prechodná slepota, exudáty na
sietnici, zhoršenie videnia, podráždenie oka, bolesť oka, svrbenie oka
|
Poruchy ucha a labyrintu
|
|
bolesť ucha
|
Poruchy dýchacej sústavy, hrudníka
a mediastína
|
|
dyspnoe, epistaxa
|
Poruchy gastrointestinálneho traktu
|
gastrointestinálna porucha
|
bolesť v nadbrušku, stomatitída,
nevoľnosť, aftózna stomatitída, orálna porucha
|
Poruchy kože a
podkožného tkaniva
|
vyrážka, svrbenie, alopécia
|
opuch tváre, liekový exantém
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
|
muskuloskeletálna bolesť
|
bolesť chrbta, bolesť končatín
|
Poruchy obličiek a močových ciest
|
|
dyzúria, inkontinencia, porucha
močového traktu
|
Poruchy reprodukčného systému a
prsníkov
|
|
výtok z pošvy
|
Celkové poruchy a reakcie v mieste
podania
|
ochorenie podobné chrípke, reakcia
v mieste podania injekcie, iritabilita, únava
|
horúčka, hematóm v mieste podania
injekcie do žily, , bolesť
|
Laboratórne a funkčné vyšetrenia
|
|
abnormálny psychiatrický nález
|
Chirurgické a liečebné postupy
|
|
extrakcia zuba, cholecystektómia
|
Sociálne podmienky
|
|
problém s učením
|
U pediatrických pacientov sa pozorovala inhibícia rastu (pozri časť 4.4). V porovnaní
s východiskovým stavom sa u pediatrických pacientov po 48 týždňoch terapie kombinovanou liečbou
Pegasysom plus ribavirínom pediatrických pacientov preukázalo oneskorenie v náraste hmotnosti
a výšky. Počas liečby klesli percentily „hmotnosti vzhľadom na vek“ a percentily„výšky vzhľadom na vek“ v porovnaní s normálnou populáciou. Na konci 2-ročného sledovania po liečbe sa väčšina jedincov vrátila k východiskovým percentilom normálnej rastovej krivky pre hmotnosť a výšku (priemerný percentil hmotnosti bol 64 % na začiatku a 60 % 2 roky po liečbe; priemerný percentil výšky bol 54 % na začiatku a 56 % 2 roky po liečbe). Na konci liečby sa u 43 % jedincov znížil percentil hmotnosti o 15 percentilov alebo viac a u 25 % sa znížil percentil výšky o 15 percentilov alebo viac v porovnaní s normálnou rastovou krivkou. 2 roky po liečbe bolo 16 % osôb stále 15 percentilov alebo viac pod svojou východiskovou krivkou hmotnosti a 11 % 15 percentilov alebo viac pod svojou východiskovou krivkou výšky.
Laboratórne hodnotyZníženie hemoglobínu, počtu neutrofilov a trombocytov môže vyžadovať zníženie dávky alebo trvalé vysadenie liečby (pozri tabuľku 3 a tabuľku 7). Väčšina patologických zmien v laboratórnych
parametroch zaznamenaných počas klinického skúšania sa v krátkom čase po ukončení liečby vrátila
na východiskovú úroveň.
4.9 PredávkovanieOpísali sa prípady predávkovania v rozsahu od dvoch injekcií podaných počas 2 nasledujúcich dní
(namiesto týždenného intervalu) až po každodenné podávanie injekcií počas 1 týždňa (t.j.
1 260 mikrogramov/týždeň). U žiadneho z týchto pacientov sa neobjavili nezvyčajné resp. závažné alebo liečbu limitujúce udalosti. V klinických štúdiách pri karcinóme obličiek a chronickej myeloidnej leukémii sa podávali týždenné dávky až do 540 mikrogramov a 630 mikrogramov. Medzi toxické
prejavy limitujúce dávkovanie patrila únava, elevácia pečeňových enzýmov, neutropénia, trombocytopénia, čo zodpovedá interferónovej liečbe.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Imunostimulanciá, interferóny, ATC kód: L03A B11
Spôsob účinku
Konjugácia reagentu PEG (bis-monometoxypolyetylénglykol) s interferónom alfa-2a vedie k vzniku
pegylovaného interferónu alfa-2a (Pegasys). Pegasys in vitro vykazuje antivírusové a antiproliferatívne účinky, ktoré sú charakteristické pre interferón alfa-2a.
Interferón alfa-2a je konjugovaný s bis-[monometoxypolyetylénglykolom] v rozsahu substitúcie jedného mólu polyméru/mól bielkoviny. Priemerná molekulová hmotnosť je asi 60 000, z ktorej podiel bielkoviny tvorí približne 20 000.
Farmakodynamické účinky
U pacientov s hepatitídou C reagujúcich na liečbu Pegasysom 180 mikrogramov dochádza
k bifázickému poklesu hladín HCV RNA. Prvá fáza poklesu sa objavuje 24 až 36 hodín po prvej dávke Pegasysu. Po nej dochádza k druhej fáze poklesu, ktorá pretrváva počas nasledovných 4 - 16 týždňov u pacientov, ktorí dosiahnu pretrvávajúcu odpoveď na liečbu. Ribavirín nemá žiadny významný vplyv na začiatočnú vírusovú kinetiku počas prvých 4 až 6 týždňov u pacientov liečených kombináciou ribavirínu a pegylovaného interferónu alfa-2a alebo interferónu alfa.
Klinická účinnosť a bezpečnosť
Chronická hepatitída B
Na všetkých klinických skúšaniach sa zúčastnili pacienti s chronickou hepatitídou B, u ktorých sa zistila aktívna vírusová replikácia meraná ako HBV DNA, zvýšené hladiny ALT a biopsia pečene bola konzistentná s chronickou hepatitídou. V štúdii WV16240 sa zúčastnili pacienti, ktorí boli pozitívni na HBeAg, zatiaľ čo v štúdii WV16241 sa zúčastnili pacienti, ktorí boli negatívni na HBeAg a pozitívni na anti-HBe. V obidvoch štúdiách liečba trvala 48 týždňov a sledovanie po liečbe trvalo 24 týždňov. V obidvoch štúdiách sa porovnával Pegasys plus placebo vs. Pegasys plus lamivudín vs. lamivudín v monoterapii. Do týchto klinických skúšaní neboli zaradení pacienti s HBV-HIV koinfekciou.
Miery odpovedí na konci sledovania u týchto dvoch štúdií sú uvedené v tabuľke 11. V štúdii WV16240, primárne koncové ukazovatele na hodnotenie účinnosti boli HBeAg sérokonverzia a HBV- DNA pod 105 kópií/ml. V štúdii WV16241, primárne koncové ukazovatele na hodnotenie účinnosti boli normalizácia ALT a HBV-DNA pod 2 x 104 kópií/ml. HBV DNA sa merala pomocou testu COBAS AMPLICORTM HBV MONITOR (hranica detekcie 200 kópií/ml).
Celkove 283/1351 (21 %) pacientov malo pokročilú fibrózu alebo cirhózu, 85/1351 (6 %) malo cirhózu. Neboli rozdiely v miere odpovede medzi týmito pacientmi a tými bez pokročilej fibrózy alebo cirhózy.
Tabuľka 11: Sérologická, virologická a biochemická odpoveď pri chronickej hepatitíde B
|
HBeAg-pozitívni pacienti
Štúdia WV16240
|
HBeAg-negatívni / anti-HBe-pozitívni pacienti
Štúdia WV16241
|
Parameter odpovede
|
Pegasys
180 µg
&
placebo
(N = 271)
|
Pegasys
180 µg
&
lamivudín
100 mg
(N = 271)
|
lamivudín
100 mg
(N = 272)
|
Pegasys
180 µg
&
placebo
(N = 177)
|
Pegasys
180 µg
&
lamivudín
100 mg
(N = 179)
|
lamivudín
100 mg
(N = 181)
|
HBeAg
sérokonverzia
|
32 %#
|
27 %
|
19 %
|
N/A
|
N/A
|
N/A
|
HBV DNA
odpoveď*
|
32 %#
|
34 %
|
22 %
|
43 %#
|
44 %
|
29 %
|
ALT
normalizácia
|
41 %#
|
39 %
|
28 %
|
59 %#
|
60 %
|
44 %
|
HBsAg
sérokonverzia
|
3 %#
|
3 %
|
0 %
|
3 %
|
2 %
|
0 %
|
|
|
* Pre HBeAg-pozitívnych pacientov: HBV DNA < 105 kópií/ml
Pre HBeAg-negatívnych / anti-HBe-pozitívnych pacientov: HBV DNA < 2 x 104 kópií/ml
# p-hodnota (vs. lamivudín) ≤ 0,01 (stratifikovaný Cochran-Mantel-Haenszelov test)
Histologická odpoveď bola v každej štúdii vo všetkých troch liečebných skupinách podobná; avšak pacienti, u ktorých sa dokázala trvalá odpoveď 24 týždňov po ukončení liečby, s oveľa vyššou pravdepodobnosťou dosiahli tiež histologické zlepšenie.
Všetci pacienti, ktorí ukončili štúdie fázy III, boli vhodní na zaradenie do štúdie s dlhodobým sledovaním (WV16866). V skupine pacientov v štúdii WV16240, ktorí dostávali Pegasys
v monoterapii a boli zaradení do štúdie s dlhodobým sledovaním, stupeň trvalej HBeAg sérokonverzie
12 mesiacov po ukončení terapie bol 48 % (73/153). U pacientov, ktorí dostávali Pegasys
v monoterapii v štúdii WV16241, stupeň HBV DNA odpovede a normalizácie ALT 12 mesiacov po ukončení liečby bol 42 % (41/97) a 59 % (58/99).
Chronická hepatitída C Predpoklad odpovede na liečbuPozrite si časť 4.2 v tabuľke 2.
Závislosť odpovede na liečbu od dávky pri monoterapiiPri priamom porovnaní dávok 90 mikrogramov a 180 mikrogramov bola dávka 180 mikrogramov spojená s lepšou pretrvávajúcou virologickou odpoveďou na liečbu u pacientov s cirhózou, avšak
v štúdii s pacientmi bez cirhózy sa pri dávkach 135 mikrogramov a 180 mikrogramov dosiahli veľmi podobné výsledky.
Potvrdzujúce klinické štúdie u dospelých predtým neliečených pacientovVšetky klinické štúdie zahŕňali pacientov, ktorí predtým nedostávali interferón a u ktorých sa chronická hepatitída C potvrdila prítomnosťou detekovateľných hladín HCV RNA v sére, zvýšenými hladinami ALT (s výnimkou štúdie NR16071) a biopsiou pečene s nálezom chronickej hepatitídy.
Štúdia NV15495 špecificky zahŕňala pacientov s diagnózou cirhózy (približne 80 %) alebo prechodu
do cirhózy (približne 20 %), ktoré sa potvrdili histologicky. Do štúdie NR15961 sa zahrnuli len HIV- HCV koinfikovaní pacienti(pozri tabuľku 20). Títo pacienti mali stabilné HIV ochorenie a priemer počtu CD4 T-buniek bol okolo 500 buniek/μl.
Údaje o liečebných režimoch, dĺžke trvania liečby a výsledkoch štúdií u HCV monoinfikovaných
pacientov a HIV-HCV koinfikovaných pacientov sa uvádzajú v tabuľkách 12, 13, 14 a v tabuľke 20.
Virologická odpoveď na liečbu sa definovala ako nemerateľné hladiny HCV RNA pri vyšetrení COBAS AMPLICOR™ HCV Test, Version 2.0 (detekčný limit: 100 kópií/ml, čo zodpovedá 50 medzinárodným jednotkám/ml). Trvalá odpoveď sa definovala ako jedna negatívna vzorka približne 6 mesiacov po ukončení liečby.
Tabuľka 12:Virologická odpoveď u HCV pacientov
| Monoterapia Pegasysom
| Kombinovaná liečba Pegasysom
|
pacienti s cirhózou aj bez nej
| Pacienti s cirhózou
| pacienti s cirhózou aj bez nej
|
Štúdia NV15496 + NV15497 + NV15801
| Štúdia NV15495
| Štúdia
NV15942
| Štúdia NV15801
|
Pegasys
180 µg
(N = 701)
48 týždňov
| interferón alfa-2a
6 MIU/3 MIU
&
3 MIU
(N = 478)
48 týždňov
| Pegasys
180 µg
(N = 87)
48 týždňov
| interferón alfa-2a
3 MIU
(N = 88)
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200
mg
(N = 436)
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
(N = 453)
48 týždňov
| interferón alfa-2b
3 MIU
&
ribavirín
1000/1200
mg
(N = 444)
48 týždňov
|
Odpoveď
na konci liečby
|
55 - 69 %
|
22 - 28 %
|
44 %
|
14 %
|
68 %
|
69 %
|
52 %
|
Celková
trvalá odpoveď
|
28 - 39 %
|
11 - 19 %
|
30 %∗
|
8 %∗
|
63 %
|
54 %∗∗
|
45 %∗∗
|
∗ 95 % CI pre rozdiel: 11 % až 33 % p = 0,001 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
∗∗ 95 % CI pre rozdiel: 3 % až 16 % p = 0,003 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
Virologické odpovede na liečbu vo vzťahu ku genotypu a vírusovej záťaži pred liečbou u HCV monoinfikovaných pacientov liečených Pegasysom v kombinácii s ribavirínom a v závislosti na genotype, vírusovej záťaži pred liečbou a rýchlej virologickej odpovede v 4. týždni sú zhrnuté
v tabuľke 13 a v tabuľke 14. Výsledky štúdie NV15942 poskytujú racionálne podklady pre odporúčania liečebných režimov na základe genotypu, vírusovej záťaže na začiatku liečby a virologickej odpovede v 4. týždni (pozri tabuľky 1, 13 a 14).
Rozdiel medzi liečebnými režimami nebol vo všeobecnosti ovplyvnený prítomnosťou/neprítomnosťou cirhózy; preto tieto základné charakteristiky neovplyvňujú tieto odporúčania pre liečbu pre
genotypy 1, 2 alebo 3.
Tabuľka 13:Trvalá virologická odpoveď u HCV pacientov po kombinovanej liečbe Pegasysom a ribavirínom v závislosti na genotype a vírusovej záťaži pred liečbou
|
Štúdia NV15942
|
Štúdia NV15801
|
Pegasys
180 µg
&
ribavirín
800 mg
24 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
|
Pegasys
180 µg
&
ribavirín
800 mg
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Interferón alfa-
2b
3 MIU
&
ribavirín
1000/1200 mg
48 týždňov
|
Genotyp 1
Nízka
vírusová záťaž
Vysoká vírusová záťaž
|
29 %(29/101)
41 %(21/51)
16 %(8/50)
|
42 %(49/118) ∗
52 %(37/71)
26 %(12/47)
|
41 %(102/250) ∗
55 %(33/60)
36 %(69/190)
|
52 %(142/271) ∗
65 %(55/85)
47 %(87/186)
|
45 %(134/298)
53 %(61/115)
40 %(73/182)
|
36 %(103/285)
44 %(41/94)
33 %(62/189)
|
Genotyp 2/3
Nízka
vírusová záťaž
Vysoká vírusová záťaž
|
84 %(81/96)
85 %(29/34)
84 %(52/62)
|
81 %(117/144)
83 %(39/47)
80 %(78/97)
|
79 %(78/99)
88 %(29/33)
74 %(49/66)
|
80 %(123/153)
77 %(37/48)
82 %(86/105)
|
71 %(100/140)
76 %(28/37)
70 %(72/103)
|
61 %(88/145)
65 %(34/52)
58 %(54/93)
|
Genotyp 4
|
(0/5)
|
(8/12)
|
(5/8)
|
(9/11)
|
(10/13)
|
(5/11)
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; Vysoká vírusová záťaž = > 800 000 IU/ml
* Pegasys 180 µg & ribavirín 1000/1200 mg, 48 týždňov v porovnaní s Pegasysom 180 µg & ribavirínom 800 mg
48 týždňov: Odds Ratio (95 % CI) = 1,52 (1,07 až 2,17), p=0,020 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
* Pegasys 180 µg & ribavirín 1000/1200 mg, 48 týždňov v porovnaní s Pegasysom 180 µg & ribavirínom 1000/1200 mg,
24 týždňov: Odds Ratio (95 % CI) = 2,12 (1,30 až 3,46), p=0,002 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
Možnosť zvážiť skrátenie dĺžky trvania liečby na 24 týždňov u pacientov s genotypom 1 a 4 sa sledovala na podklade dosiahnutej trvalej virologickej odpovede u pacientov s rýchlou virologickou odpoveďou v 4. týždni v štúdiách NV15942 a ML17131 (pozri tabuľku 14).
Štúdia NV15942
| Štúdia ML17131
|
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Genotyp 1
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 90 % (28/31)
93 % (25/27)
75 % (3/4)
| 92 % (47/51)
96 % (26/27)
88 % (21/24)
| 77 % (59/77)
80 % (52/65)
58 % (7/12)
| Genotyp 1 nie RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 24 % (21/87)
27 % (12/44)
21 % (9/43)
| 43 % (95/220)
50 % (31/62)
41 % (64/158)
| -
-
-
| Genotyp 4 RVR
| (5/6)
| (5/5)
| 92 % (22/24)
| Genotyp 4 nie RVR
| (3/6)
| (4/6)
| -
|
|
|
Tabuľka 14:Trvalá virologická odpoveď v závislosti na rýchlej virologickej odpovedi v 4. týždni pre genotyp 1 a 4 po kombinovanej liečbe Pegasysom a ribavirínom u HCV pacientovNízka vírusová záťaž = ≤ 800 000 IU/ml; Vysoká vírusová záťaž = > 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedegovateľná HCV RNA) v 4. týždni a nedegovateľná HCV RNA v 24 týždni.
Údaje, i keď obmedzené, ukazujú, že skrátenie času na 24 týždňov, sa môže spájať s vysokým rizikom relapsu (pozri tabuľku 15).
Tabuľka 15:Relaps vo virologickej odpovedi na konci liečby u populácie s rýchlou virologickou odpoveďou
| Štúdia NV15942
| Štúdia NV15801
|
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Genotyp 1 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 6,7 % (2/30)
3,8 % (1/26)
25 % (1/4)
| 4,3 % (2/47)
0 % (0/25)
9,1 % (2/22)
| 0 % (0/24)
0 % (0/17)
0 % (0/7)
|
Genotyp 4 RVR
| (0/5)
| (0/5)
| 0 % (0/4)
|
Možnosť skrátenia liečby na 16 týždňov u pacientov genotypu 2 alebo 3 bola skúmaná na základe
trvalej virologickej odpovede pozorovanej u pacientov s rýchlou virologickou odpoveďou v 4. týždni v štúdii NV17317 (pozri tabuľku 16).
V štúdii NV17317 všetci pacienti infikovaní vírusovým genotypom 2 alebo 3 dostávali Pegasys 180ug subkutánne raz týždenne a ribavirín v dávke 800 mg a boli randomizovaní na liečbu počas 16 alebo 24 týždňov. Celková liečba počas 16 týždňov viedla ku nižšej trvalej virologickej odpovedi (65 %) než liečba počas 24 týždňov (76 %) (p<0,0001).
Trvalá virologická odpoveď dosiahnutá po 16. týždňoch liečby a po 24. týždňoch liečby sa sledovala retrospektívnou analýzou pacientov, ktorí boli HCV RNA negatívni v 4. týždni a mali iniciálne LVL (pozri tabuľku 16).
Tabuľka 16:Trvalá virologická odpoveď celkovo a na základe rýchlej virologickej odpovede v 4. týždni pre genotyp 2 alebo 3 po kombinovanej liečbe liekom Pegasysoms ribavirínom u HCV pacientovŠtúdia NV17317
|
a
| Pegasys 180 µg
&
ribavirín
800 mg
16 týždňov
| Pegasys 180 µg
&
ribavirín
800 mg
24 týždňov
| Rozdiel v liečbe
[95 %CI]
| p-hodnota
|
Genotyp 2 alebo 3
| 65 % (443/679)
| 76 % (478/630)
| -10,6 % [-15,5 %; -0,06 %]
| p<0,0001
|
Genotyp 2 alebo 3 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 82 % (378/461)
89 % (147/166)
78 % (231/295)
| 90 % (370/410)
94 % (141/150)
88 % (229/260)
| -8,2 % [-12,8 %; -3,7 %]
-5,4 % [-12 %; 0,9 %]
-9,7 % [-15,9 %;-3,6 %]
| p=0,0006
p=0,11
p=0,002
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž => 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedetegovateľné hladiny HCV RNA) v 4. týždni
V súčasnosti nie je jasné, či vyššia dávka ribavirínu (napr. 1 000/2 000 mg/deň podľa telesnej hmotnosti) vedie k vyššej trvalej virologickej odpovedi (SVR) než dávka 800 mg/deň, keď je liečba skrátená na 16 týždňov.
Údaje naznačujú, že skrátenie liečby na 16 týždňov sa môže spájať so zvýšeným rizikom relapsu
(pozri tabuľku 17).
Tabuľka 17:Relaps vo virologickej odpovedi po ukončení liečby u pacientov genotypu 2 alebo 3s rýchlou virologickou odpoveďou
|
Štúdia NV17317
|
|
Pegasys
180 µg
&
ribavirín
800 mg
16 týždňov
|
Pegasys
180 µg
&
ribavirín
800 mg
24 týždňov
|
Rozdiel v liečbe
[95 %CI]
|
p hodnota
|
Genotyp 2 alebo 3 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
15 % (67/439)
6 % (10/155)
20 % (57/284)
|
6 % (23/386)
1 % (2/141)
9 % (21/245)
|
9,3 % [5,2 %; 13,6 %]
5 % [0,6 % ; 10,3 %]
11,5 % [5,6 % ; 17,4 %]
|
p<0,0001
p=0,04
p=0,0002
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž = > 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedetegovateľné hladiny HCV RNA) v 4. týždni
Lepšia účinnosť Pegasysu v porovnaní s interferónom alfa-2a sa ukázala aj na histologickej odpovedi, vrátane pacientov s cirhózou a/alebo HIV-HCV koinfekciou.
Dospelí pacienti s chronickou hepatitídou C, ktorí neodpovedali na predchádzajúcu liečbu V štúdii MV17150 boli pacienti, ktorí neodpovedali na predchádzajú liečbu pegylovaným interferónom alfa-2b a ribavirínom, boli randomizovaní do štyroch rôznych liečebných skupín:
• Pegasys 360 µg/týždeň počas 12 týždňov a následne 180 µg/týždeň počas ďalších 60 týždňov;
• Pegasys 360 µg/týždeň počas 12 týždňov a následne 180 µg/týždeň počas ďalších 36 týždňov;
• Pegasys 180 µg/týždeň počas 72 týždňov;
• Pegasys 180 µg/týždeň počas 48 týždňov.
Všetci pacienti užívali ribavirín (1 000 alebo 1 200 mg/deň) v kombinácii s Pegasysom. Všetky
liečebné skupiny boli následne sledované počas 24-týždňového obdobia bez liečby.
Na základe viacnásobnej regresnej analýzy a súhrnnej skupinovej analýzy hodnotiacej vplyv dĺžky trvania liečby a podávania indukčnej dávky sa jednoznačne stanovilo, že liečba v trvaní 72 týždňov je primárnym faktorom dosiahnutia trvalej virologickej odpovede. Rozdiely v trvalej virologickej odpovedi (SVR) podmienené dĺžkou trvania liečby, demografickými ukazovateľmi a najlepšími odpoveďami na predchádzajúcu liečbu sú uvedené v tabuľke 18.
Tabuľka 18:Virologická odpoveď v 12. týždni (VR) a trvalá virologická odpoveď (SVR) u pacientov, ktorí neodpovedali na liečbu kombináciou peginterferónu alfa-2b a ribavirínu a ktorí dosiahli virologickú odpoveď v 12. týždni po liečbe kombináciou Pegasysu a ribavirínu
| Štúdia MV17150
|
|
|
| Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
72 alebo 48 týždňov (N = 942) pacienti s
VR v týždni 12 a
(N = 876)
| Pegasys 360/180
alebo 180 μg
&
ribavirín
1000/1200 mg
72 týždňov
(N = 473)
SVR u pacientov s VR v týždni 12 b (N = 100)
| Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
48 týždňov
(N = 469)
SVR u pacientov s VR v týždni 12 b (N = 57)
|
Celková trvalá odpoveď
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 18 % (157/876)
35 % (56/159)
14 % (97/686)
| 57 % (57/100)
63 % (22/35)
54 % (34/63)
| 35 % (20/57)
38 % (8/21)
32 % (11/34)
|
Genotyp 1/4
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 17 % (140/846)
35 % (54/154)
13 % (84/663)
| 55 % (52/94)
63 % (22/35)
52 % (30/58)
| 35 % (16/46)
37 % (7/19)
35 % (9/26)
|
Genotyp 2/3
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 58 % (15/26)
(2/5) (11/19)
| (4/5)
—
(3/4)
| (3/10)
(1/2) (1/7)
|
Prítomnosť cirhózy
Cirhóza
Neprítomnosť cirhózy
|
8 % (19/239)
22 % (137/633)
|
(6/13)
59 % (51/87)
|
(3/6)
34 % (17/50)
|
|
Štúdia MV17150
|
|
|
|
Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
72 alebo 48 týždňov (N = 942) pacienti s
VR v týždni 12 a
(N = 876)
|
Pegasys 360/180
alebo 180 μg
&
ribavirín
1000/1200 mg
72 týždňov
(N = 473)
SVR u pacientov s VR v týždni 12 b (N = 100)
|
Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
48 týždňov
(N = 469)
SVR u pacientov s VR v týždni 12 b (N = 57)
|
Najlepšia odpoveď počas predchádzajúcej liečby
Pokles u HCV RNA ≥2log10
Pokles u HCV RNA <2log10
Chýbanie najlepšej odpovede
|
28 % (34/121)
12 % (39/323)
19 % (84/432)
|
68 % (15/22)
64 % (16/25)
49 % (26/53)
|
(6/12) (5/14)
29 % (9/31)
|
Vysoká vírusová záťaž = > 800 000 IU/ml, nízka vírusová záťaž = ≤ 800 000 IU/ml;
a Pacienti, ktorí dosiahli potlačenie aktivity vírusu v 12. týždni (nedetegovateľná HCV RNA definovaná ako < 50 IU/ml) boli považovaní za pacientov s dosiahnutou virologickou odpoveďou v 12. týždni. Pacienti, ktorým chýbali výsledky HCV RNA
v 12. týždni boli vylúčení z analýzy.
b Pacienti, ktorí dosiahli potlačenie aktivity vírusu v 12. týždni, ale chýbali im výsledky HCV RNA na konci sledovania boli považovaní za pacientov, neodpovedajúcich na liečbu.
V štúdii HALT-C boli pacienti s chronickou hepatitídou C a pokročilou fibrózou alebo cirhózou, ktorí neodpovedali na predchádzajúcu liečbu interferónom alfa alebo pegylovaným interferónom alfa
v monoterapii alebo v kombinácii s ribavirínom, liečení Pegasysom 180 µg/týždeň a ribavirínom
1 000/1 200 mg denne. Pacienti, ktorí po 20 týždňoch liečby dosiahli nedetegovateľné hladiny
HCV RNA, pokračovali v kombinovanej liečbe Pegasysom a ribavirínom trvajúcej celkovo
48 týždňov a po ukončení liečby boli sledovaní 24 týždňov. Pravdepodobnosť trvalej virologickej odpovede sa líšila v závislosti od predchádzajúceho režimu liečby; pozri tabuľku 19.
 Tabuľka 19:Trvalá virologická odpoveď v štúdii HALT-C uvedená podľa predchádzajúceho režimu liečby u pacientov, ktorí naň neodpovedaliPredchádzajúca liečba Pegasys
Tabuľka 19:Trvalá virologická odpoveď v štúdii HALT-C uvedená podľa predchádzajúceho režimu liečby u pacientov, ktorí naň neodpovedaliPredchádzajúca liečba Pegasys 180 µg a
ribavirín 1 000/1 200 mg

počas 48 týždňov
Interferón 27 % (70/255)
Pegylovaný interferón 34 % (13/38)
Interferón a ribavirín 13 % (90/692)
Pegylovaný interferón a ribavirín 11 % (7/61) HIV-HCV koinfikovaní pacientiVirologické odpovede u pacientov, ktorí sú liečení s Pegasysom v monoterapii a s Pegasysom a ribavirínom v kombinácii v závislosti na genotype a vírusovej záťaži pred liečbou pre HIV-HCV
koinfikovaných pacientov sú zhrnuté nižšie v tabuľke 20.
Štúdia NR15961
|
| Interferón alfa-2a
3 MIU
&
ribavirín 800 mg
48 týždňov
| Pegasys
180 µg'
&
placebo
48 týždňov
| Pegasys
180 µg
&
ribavirín 800 mg
48 týždňov
| Všetci pacienti
| 12 % (33/285)*
| 20 % (58/286) *
| 40 % (116/289) *
|
|
|
Tabuľka 20:Trvalá virologická odpoveď po liečbe Pegasysom v kombinácii s ribavirínom v závislosti na genotype a vírusovej záťaži u HIV-HCV súčasne infikovaných pacientov pred liečbou
Genotyp 1
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
7 % (12/171)
19 % (8/42)
3% (4/129)
|
14 % (24/175)
38 % (17/45)
5 % (7/130)
|
29 % (51/176)
61 % (28/46)
18 % (23/130)
|
Genotyp 2-3
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
20 % (18/89)
27 % (8/30)
17 % (10/59)
|
36 % (32/90)
38 % (9/24)
35 % (23/66)
|
62% (59/95)
61 % (17/28)
63 % (42/67)
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž = > 800 000 IU/ml
* Pegasys 180 µg & ribavirín 800 mg oproti Interferón alfa-2a 3 MIU, ribavirín 800 mg: Pomer pravdepodobnosti (95 % CI)=5,40 (3,42 – 8,54),… p-hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0001
* Pegasys 180 µg & ribavirín 800 mg oproti Pegasys 180 µg: Pomer pravdepodobnosti (95 % CI)=2,89 (1,93 – 4,32),… p- hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0001
* Interferón alfa-2a 3 MIU & ribavirín 800 mg oproti Pegasys 180 µg: Pomer pravdepodobnosti (95 % CI)=0,53 (0,33 –
0,85),… p-hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0084
Nasledujúca štúdia (NV18209) u pacientov s koinfekciou HCV genotyp 1 a HIV porovnávala liečbu Pegasysom 180 µg týždenne s dávkou ribavirínu 800 mg alebo s dávkou ribavirínu 1 000 mg (<75 kg telesnej hmotnosti)/1 200 mg (≥75 kg telesnej hmotnosti) denne počas 48 týždňov. Štúdia nebola dizajnovaná na preukázanie účinnosti. Bezpečnostné profily u obidvoch skupín s ribavirínom boli konzistentné so známym bezpečnostným profilom pri kombinovanej liečbe Pegasysom a ribavirínom
a nepoukazujú na žiadne relevantné rozdiely, okrem mierneho nárastu anémie v skupine s vyššou dávkou ribavínu.
HCV pacienti s normálnymi hladinami ALTV štúdii NR16071 náhodne vybratí HCV pacienti s normálnymi hodnotami ALT užívali Pegasys
180 µg/týždeň a ribavirín 800 mg/deň počas 24 alebo 48 týždňov. Potom nasledoval 24 týždňové obdobie bez liečby alebo pacienti boli bez liečby po dobu 72 týždňov. SVR popisované v liečebných ramenách tejto štúdie boli podobné zodpovedajúcim liečebným ramenám zo štúdie NV15942.
Pediatrická populáciaV riešiteľom sponzorovanej klinickej štúdii CHIPS (Chronic Hepatitis C International Paediatric Study) 65 pediatrických pacientov (6-18 rokov) s chronickou HCV infekciou boli pacienti liečení Pegasysom 100 μg/m2 s.c. raz týždenne a ribavirínom 15 mg/kg/deň 24 týždňov (genotypy 2 a 3) alebo 48 týždňov (všetky iné genotypy). Predbežné a obmedzené údaje bezpečnosti neukázali žiadny evidentný odklon od známeho profilu bezpečnosti pri kombinovanej liečbe u dospelých pacientov s chronickou HCV infekciou, ale, dôležité je, že nebol hlásený potenciálny nárast. Výsledky účinnosti boli podobné výsledkom hlásených u dospelých.
V štúdii NV17424 (PEDS-C) boli predtým neliečenípediatrickí pacienti vo veku 5 až 17 rokov (55 % vo veku < 12 rokov) s kompenzovanou chronickou hepatitídou C a detekovateľnou HCV RNA liečení Pegasysom v dávke180 μg x BSA/1,73 m2 jedenkrát týždenne počas 48 týždňov s alebo bez ribavirínu v dávke 15 mg/kg/deň . Všetci pacienti boli po liečbe sledovaní počas 24 týždňov.Celkovo 55 pacientov bolo liečených úvodnou kombinovanou liečbou Pegasysom plus ribaviríno, z nich 51 %
bolo žien, 82 % belochov a 82 % bolo infikovaných vírusom HCV genotyp 1. Výsledky štúdie účinnosti pre týchto pacientov sú zhrnuté v tabuľke 21.
Tabuľka 21: Pretrvávajúca virologická odpoveď v štúdii NV17424
| Pegasys
180 µg x BSA/1,73 m² +
ribavirín 15 mg/kg (N = 55)*
|
Všetky genotypy HCV**
| 29 (53 %)
|
HCV genotyp 1
| 21/45 (47 %)
|
HCV genotyp 2 a 3
| 8/10 (80 %)
|
*Výsledky naznačujú nedetegovateľnú HCV-RNA definovanú ako HCV RNA menej ako 50 IU/ml 24 týždňov po liečbe použitím AMPLICOR HCV testu v2.
**Plánované trvanie liečby bolo 48 týždňov bez ohľadu na genotyp
5.2 Farmakokinetické vlastnosti
Absorpcia
Po jednorazovej subkutánnej injekcii Pegasysu 180 mikrogramov zdravým jedincom sa merateľné sérové koncentrácie peginterferónu alfa-2a zistili v priebehu 3 až 6 hodín. Počas 24 hodín dosiahli namerané hladiny 80 % maximálnej koncentrácie v sére. Absorpcia Pegasysu je plynulá, pričom maximálne hladiny v sére sa dosiahnu 72 až 96 hodín po podaní. Absolútna biologická dostupnosť Pegasysu je 84 % a je podobná ako pri interferóne alfa-2a.
Distribúcia
Peginterferón alfa-2a sa nachádza najmä v krvnom obehu a extracelulárnej tekutine, čoho dôkazom je hodnota distribučného objemu v rovnovážnom stave (Vd) 6 - 14 litrov u ľudí po intravenóznom podaní. V štúdiách hmotnostnej rovnováhy, distribúcie látky v tkanivách a celotelovej autorádioluminografie vykonaných u potkanov sa zistilo, že okrem vysokej koncentrácie v krvi sa peginterferón alfa-2a dostáva do pečene, obličiek a kostnej drene.
Biotransformácia
Metabolizmus Pegasysu ešte nie je úplne objasnený, avšak štúdie na potkanoch naznačujú, že obličky sú hlavným exkrečným orgánom rádioaktívne označeného materiálu.
Eliminácia
U ľudí je hodnota systémového klírensu peginterferónu alfa-2a približne 100- násobne nižšia ako natívneho interferónu alfa-2a. Po intravenóznom podaní je terminálny polčas peginterferónu alfa-2a u zdravých osôb približne 60 – 80 hodín v porovnaní s 3 – 4 hodinami v prípade štandardného interferónu. Terminálny polčas po subkutánnom podaní pacientom je dlhší so strednou hodnotou 160 hodín (84 – 353 hodín). Terminálny polčas môže odrážať eliminačnú fázu látky, ale taktiež plynulú absorpciu Pegasysu.
Linearita/nelinearita
U zdravých osôb a u pacientov s chronickou hepatitídou B alebo C sa pri dávkovaní raz týždenne pozorovalo od dávky závislé zvyšovanie expozície voči Pegasysu.
U pacientov s chronickou hepatitídou B alebo C dochádza po 6 až 8 týždňoch podávania Pegasysu v dávke raz týždenne k dvoj- až trojnásobnému zvýšeniu sérových hladín peginterferónu alfa-2a
v porovnaní s podávaním jednorazovej dávky. Po 8-týždňovom podávaní Pegasysu raz týždenne nedochádza k ďalšej akumulácii. Po 48 týždňoch liečby je pomer medzi maximálnou a minimálnou hladinou približne 1,5 - 2. Sérové koncentrácie peginterferónu alfa-2a pretrvávajú celý 1 týždeň (168 hodín).
Pacienti s poruchou funkcie obličiek
Dysfunkcia obličiek je spojená s mierne zníženou hodnotou pomeru CL/F a predĺženým polčasom. U pacientov (n=3) CLcrea medzi 20 a 40 ml/min bola priemerná hodnota pomeru CL/F o 25 % nižšia ako u pacientov s normálnou funkciou obličiek. U dialyzovaných pacientov s ochorením obličiek
v terminálnej fáze sa zistilo 25 – 45 % zníženie klírensu, pričom dávky 135 mikrogramov u týchto pacientov vedú k podobnej expozícii ako dávky 180 mikrogramov u pacientov s normálnou funkciou
obličiek (pozri časť 4.2).
Pozrite si tiež Súhrn charakteristických vlastností lieku (SmPC) ribavirínu, ak sa Pegasys použije v kombinácii s ribavirínom.
Pohlavie
Farmakokinetika Pegasysu po podaní jednorazovej subkutánnej injekcie bola porovnateľná u zdravých jedincov mužského a ženského pohlavia.
Pediatrická populácia
V populačnej farmakokinetickej štúdii (NR16141) dostávalo 14 detí vo veku 2 až 8 rokov s CHC Pegasys v monoterapii v dávke: 180 µg x BSA/1,73 m2. FK model vytvorený na základe tejto štúdie preukazuje lineárny vplyv BSA na zjavný klírens liečiva v rozmedzí skúmaného veku. Preto nižšie BSA dieťaťa, nižší klírens liečiva a vyššia výsledná expozícia. Predpokladá sa, že priemerná expozícia (AUC) počas dávkovacieho intervalu je o 25 % až 70 % vyššia ako expozícia pozorovaná u dospelých, ktorí dostávajú fixnú dávku 180 µg.
Staršie osoby
U osôb starších ako 62 rokov sa zistila dlhšia absorpcia Pegasysu po jednorazovom podaní subkutánnej injekcie v dávke 180 mikrogramov, hoci stále bola plynulá v porovnaní s mladými zdravými osobami (tmax 115 hodín vs. 82 hodín, osoby staršie ako 62 rokov). Hodnota AUC bola mierne zvýšená (1 663 vs. 1 295 ng.hod/ml), avšak maximálne koncentrácie (9,1 vs. 10,3 ng/ml) boli podobné u osôb starších ako 62 rokov. Na základe expozície voči lieku, farmakodynamickej odpovedi a znášanlivosti je možné prehlásiť, že geriatrickí pacienti si nevyžadujú podávanie nižšej dávky Pegasysu (pozri časť 4.2).
Dysfunkcia pečene
Farmakokinetika Pegasysu u zdravých osôb bola podobná ako u pacientov s hepatitídou B alebo C.
U pacientov s cirhózou (stupeň A podľa Child-Pughovej klasifikácie) a pacientov bez cirhózy sa zistila porovnateľná expozícia a farmakokinetické profily.
Miesto podania
Subkutánne podávanie Pegasysu je nutné obmedziť na oblasť brucha a stehna, pretože stupeň absorpcie hodnotený na základe hodnôt AUC bol o 20 – 30 % vyšší po podaní injekcie do brucha a stehna. V štúdiách po podaní Pegasysu do ramena sa v porovnaní s podaním do brucha alebo stehna zistila znížená expozícia voči Pegasysu.
5.3 Predklinické údaje o bezpečnosti
Neklinické štúdie skúmajúce toxicitu Pegasysu boli limitované v dôsledku druhovej špecifickosti interferónov. Štúdie akútnej a chronickej toxicity sa vykonali u opíc cynomolgus, pričom nálezy pozorované u zvierat dostávajúcich peginterferón boli podobnej povahy ako nálezy vyvolané interferónom alfa-2a.
S Pegasysom sa nevykonali žiadne štúdie reprodukčnej toxicity. Tak ako pri iných interferónoch alfa, aj po podávaní peginterferónu alfa-2a samiciam opíc sa pozorovalo predĺženie menštruačného cyklu. Liečba interferónom alfa-2a viedla k štatisticky významnému zvýšeniu abortívneho účinku u opíc resus. Hoci sa u potomstva narodeného v termíne nezistili žiadne teratogénne účinky, nežiaduce účinky nie je možné vylúčiť u ľudí.
Pegasys plus ribavirín
Ak sa používa v kombinácii s ribavirínom, Pegasys nevyvoláva žiadne účinky u opíc, ktoré by predtým neboli pozorované pri podávaní jednotlivých liečiv v rámci monoterapie. Hlavnou zmenou v súvislosti s liečbou bola reverzibilná mierna až stredne ťažká anémia, závažnosť ktorej bola vyššia ako po podávaní jednotlivých liečiv v rámci monoterapie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
chlorid sodný polysorbát 80
benzylalkohol nátriumacetát kyselina octová
voda na injekcie
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti3 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v chladničke pri teplote 2°C – 8°C. Neuchovávajte v mrazničke.
Naplnenú injekčnú striekačku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia0,5 ml injekčného roztoku v naplnenej injekčnej striekačke (sklo typu I so silikónovou vrstvou na vnútornej strane), s piestom a čiapočkou (butylová guma s fluórpolymérovou vrstvou na vnútornej strane), 1 injekčná ihla. Dostupné v baleniach 1, 4 alebo 12 naplnených injekčných striekačiek. Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciuInjekčný roztok je určený len na jednorazové použitie. Pred podaním sa má zrakom skontrolovať, či roztok neobsahuje tuhé čiastočky alebo či sa nezmenila jeho farba.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIRoche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/02/221/007
EU/1/02/221/008
EU/1/02/221/010
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 20. jún 2002
Dátum posledného predĺženia: 20. jún 2007
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Pegasys 135 mikrogramov injekčný roztok v naplnenom pere
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každé naplnené pero s 0,5 ml roztoku obsahuje 135 mikrogramov peginterferónu alfa-2a*. Sila vyjadruje množstvo podielu interferónu alfa-2a v peginterferóne alfa-2a bez ohľadu na pegyláciu.
*Liečivo peginterferón alfa-2a je kovalentný konjugát bielkoviny interferónu alfa-2a vyrobený rekombinantnou DNA technológiou v Escherichia coli s bis -[monometoxypolyetylénglykolom].
Účinnosť tohto lieku sa nemá porovnávať s inými pegylovanými alebo nepegylovanými bielkovinami v tej istej terapeutickej skupine. Viac informácií, pozri časť 5.1.
Pomocná látka so známym účinkom: Benzylalkohol (10 mg/1 ml) Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok (injekcia).
Roztok je číry, bezfarebný až svetložltý.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Chronická hepatitída B
Pegasys je indikovaný na liečbu chronickej hepatitídy B (CHB) s pozitívnym obalovým antigénom
hepatitídy B (HBeAg) alebo HBeAg negatívnej chronickej hepatitídy B u dospelých pacientov
s kompenzovaným ochorením pečene a s dôkazom vírusovej replikácie, zvýšenou hladinou ALT a histologicky overeným zápalom pečene a/alebo fibrózy (pozri časti 4.4 a 5.1).
Chronická hepatitída C
Dospelí pacienti
Pegasys je indikovaný na liečbu chronickej hepatitídy C (CHC) u dospelých s pozitívnym nálezom ribonukleovej kyseliny vírusu hepatitídy C (HCV-RNA) v sére. Toto zahŕňa pacientov
s kompenzovanou formou cirhózy pečene a/alebo súčasne infikovaných HIV vírusom s klinicky stabilným obrazom HIV infekcie (pozri časť 4.4).
Optimálny spôsob použitia Pegasysu u pacientov s chronickou hepatitídou C je kombinácia s ribavirínom. Kombinácia Pegasysu a ribavirínu je indikovaná na liečbu u predtým neliečených pacientov a u dospelých pacientov, u ktorých zlyhala predchádzajúca liečba interferónom alfa (pegylovaným alebo nepegylovaným) v monoterapii alebo v kombinovanej liečbe s ribavirínom.
Monoterapia je indikovaná najmä v prípade neznášanlivosti alebo kontraindikácie liečby ribavirínom.
Pediatrickí pacienti vo veku 5 rokov a viac :
Pegasys v kombinácii s ribavirínom je indikovaný na liečbu chronickej hepatitídy C u predtým neliečených detí a dospievajúcich vo veku 5 a viac rokov, u ktorých je prítomná pozitivita sérovej HCV-RNA.
Pri rozhodovaní, či začať v detstve s liečbou, je dôležité vziať do úvahy inhibíciu rastu indukovanú kombinovanou liečbou. Nie je isté, či je inhibícia rastu reverzibilná. Rozhodnutie o liečbe sa má urobiť individuálne pre každý prípad (pozri časť 4.4).
4.2 Dávkovanie a spôsob podávania
Liečbu Pegasysom má začať iba lekár, ktorý má skúsenosti s liečbou pacientov s hepatitídou B alebo
C.
Ak sa Pegasys bude podávať v kombinácii s ribavirínom, prečítajte si tiež súhrn charakteristických vlastností ribavirínu (SmPC).
Dávkovanie
Chronická hepatitída B – dospelí pacienti
Odporúčané dávkovanie a dĺžka liečby Pegasysom u HBeAg-pozitívnych a HBeAg-negatívnych pacientov s chronickou hepatitídou B je 180 mikrogramov raz týždenne počas 48 týždňov subkutánne do brucha alebo do stehna.
Chronická hepatitída C - predtým neliečení dospelí pacienti
Odporúčaná dávka Pegasysu je 180 mikrogramov raz týždenne a podáva sa subkutánne do brucha alebo stehna v kombinácii s perorálnym ribavirínom alebo ako monoterapia.
Dávkovanie ribavirínu pri kombinovanej liečbe s Pegasysom sa uvádza v tabuľke 1. Dávka ribavirínu sa má užívať spolu s jedlom.
Dĺžka liečby
U pacientov s chronickou hepatitídou C závisí dĺžka kombinovanej liečby s ribavirínom od genotypu vírusu. Pacienti infikovaní HCV s genotypom 1, ktorí majú detegovateľnú HCV RNA v 4. týždni, sa majú liečiť 48 týždňov bez ohľadu na vírusovú záťaž pred liečbou.
O liečbe v trvaní 24 týždňov sa môže uvažovať u pacientov infikovaných s
- genotypom 1 a nízkou vírusovou záťažou (LVL) na začiatku liečby (≤ 800 000 IU/ml) alebo
- genotypom 4,
ktorí sa stali HCV RNA negatívni v 4. týždni liečby a zostali HCV RNA negatívni v 24. týždni. Avšak celkove môže byť 24 týždňová liečba spojená s vyšším rizikom relapsu, ako liečba trvajúca 48
týždňov (pozri časť 5.1). Pri rozhodovaní o dĺžke liečby sa u týchto pacientov má brať do úvahy tolerancia na kombinovanú liečbu a ďalšie prognostické faktory, ako stupeň fibrózy. Ešte s väčšou
opatrnosťou sa má uvažovať o skrátení dĺžky trvania liečby u pacientov infikovaných vírusom s genotypom 1 a vysokou vírusovou záťažou (>800 000 IU/ml) na začiatku liečby, ktorí sa stali HCV
RNA negatívni v 4. týždni liečby a zostali negatívni v 24. týždni, pretože obmedzené údaje naznačujú, že môže to signifikantne negatívne ovplyvniť trvalú virologickú odpoveď.
Pacienti infikovaní HCV s genotypom 2 alebo 3, ktorí majú detegovateľnú HCV RNA v 4. týždni, bez ohľadu na vírusovú záťaž pred liečbou majú byť liečení 24 týždňov. 16-týždňová liečba sa môže zvažovať iba u vybraných pacientov, infikovaných genotypom 2 alebo 3 s iniciálnou LVL
(≤ 800 000 IU/ml), ktorí sa stanú HCV negatívni v 4. týždni liečby a zostávajú negatívni v 16. týždni. Všeobecne sa liečba trvajúca 16 týždňov môže spájať s nižšou možnosťou odpovede a je spojená s vyšším rizikom relapsu ako 24-týždňová liečba (pozri časť 5.1). U týchto pacientov sa má pri zvažovaní zmeny štandardnej 24 týždňovej liečby vziať do úvahy tolerancia kombinovanej liečby
a prítomnosť ďalších klinických alebo prognostických faktorov ako napr. stupeň fibrózy. Skrátenie
trvania liečby u pacientov infikovaných genotypom 2 alebo 3 s iniciálnou HVL (> 800 000 IU/ml), ktorí sa stanú v 4. týždni liečby HCV negatívni, sa má zvažovať pozornejšie, nakoľko toto môže významne negatívne ovplyvniť trvalú virologickú odpoveď (pozri tabuľku 1).
Dostupné údaje o infikovaných pacientoch s genotypom 5 alebo 6 sú obmedzené; preto sa odporúča
48 týždňová kombinovaná liečba s 1 000 mg alebo 1 200 mg ribavirínu.
Tabuľka 1:Odporúčané dávkovanie pre kombinovanú liečbu u HCV pacientovGenotyp
| Dávka Pegasysu
| Dávka ribavirínu
| Trvanie
|
Genotyp 1 LVL s
RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 24 týždňov alebo
48 týždňov
|
Genotyp 1 HVL s
RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 48 týždňov
|
Genotyp 4 s RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 24 týždňov alebo
48 týždňov
|
Genotyp 1 alebo 4 bez
RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 48 týždňov
|
Genotyp 2 alebo 3 bez
RVR**
| 180 mikrogramov
| 800 mg
| 24 týždňov
|
Genotyp 2 alebo 3
LVL s RVR**
| 180 mikrogramov
| 800 mg(a)
| 16 týždňov(a) alebo
24 týždňov
|
Genotyp 2 alebo 3
HVL s RVR**
| 180 mikrogramov
| 800 mg
| 24 týždňov
|
*RVR = rýchla virologická odpoveď (nedegovateľná HCV RNA) v 4. týždni a nedetegovateľná HCV RNA v 24. týždni
**RVR = rýchla virologická odpoveď (HCV RNA negativita) v 4. týždni
LVL = ≤ 800 000 IU/ml; HVL= > 800 000 IU/ml
(a) V súčasnosti nie je jasné, či vyššia dávka ribavirínu (napr. 1 000 /1 200 mg/deň podľa telesnej hmotnosti) vedie k vyššej trvalej virologickej odpovedi (SVR) než dávka 800 mg/deň, keď je liečba skrátená na 16 týždňov.
Konečný klinický účinok skrátenej 16 týždňovej liečby oproti 24 týždňovej liečbe nie je známy vzhľadom na potrebu opakovanej liečby u pacientov, ktorí neodpovedajú na liečbu a pacientov s relapsom ochorenia.
Odporúčaná dĺžka liečby Pegasysom v monoterapii je 48 týždňov.
Chronická hepatitída C - predtým liečení dospelí pacientiOdporúčaná dávka Pegasysu v kombinácii s ribavirínom je 180 µg raz týždenne podávaná subkutánne. Pacientom s telesnou hmotnosťou < 75 kg sa má podávať 1 000 mg ribavirínu denne a pacientom
s telesnou hmotnosťou ≥ 75 kg sa má podávať 1 200 mg ribavirínu denne bez ohľadu na genotyp.
U pacientov, ktorí majú v 12. týždni detegovateľné hladiny vírusu, sa má liečba ukončiť. Odporúčaná
celková dĺžka liečby je 48 týždňov. Ak sa zvažuje liečba u pacientov infikovaných vírusom
genotypu 1, ktorí neodpovedali na predchádzajúcu liečbu peginterferónom a ribavirínom, odporúčaná celková dĺžka liečby je 72 týždňov (pozri časť 5.1).
Súčasná infekcia vírusom HIV a HCV u dospelých pacientovOdporúčané dávkovanie Pegasysu v monoterapii alebo v kombinácii s ribavirínom je
180 mikrogramov raz za týždeň subkutánne počas 48 týždňov. Pre pacientov infikovných HCV s genotypom 1 a s telesnou hmotnosťou <75 kg je dávka ribavirínu 1 000 mg denne a s telesnou hmotnosťou ≥75 kg je dávka 1 200 mg denne. Pre pacientov infikovaných HCV s iným genotypom ako genotyp 1 je dávka ribavirínu 800 mg denne. Dĺžka liečby kratšia ako 48 týždňov sa dostatočne neskúmala.
Predikcia odpovede alebo chýbanie odpovede - predtým neliečení pacienti Ukázalo sa, že včasná virologická odpoveď v 12-tom týždni, ktorá je definovaná ako pokles vírusovej záťaže o 2 log alebo nedetekovateľné hladiny HCV RNA, predikuje pretrvávajúcu odpoveď (pozri tabuľky 2 a 12).
Tabuľka 2:Prediktívna hodnota virologickej odpovede v 12. týždni kombinovanej liečbyPegasysom pri odporúčanom dávkovacom režimeGenotyp
| Negatívna
| Pozitívna
|
Žiadna
odpoveď
do 12. Odpoveď Prediktívna týždňa nepretrváva hodnota
|
Odpoveď
do 12. Odpoveď Prediktívna týždňa pretrváva hodnota
|
Genotyp 1 (N = 569)
| 102 97 95 %
(97/102)
| 467 271 58 %
(271/467)
|
Genotyp 2 a 3 (N = 96)
| 3 3 100 %
(3/3)
| 93 81 87 %
(81/93)
|
Negatívna prediktívna hodnota na trvalú odpoveď u pacientov liečených Pegasysom v monoterapii
bola 98 %.
Podobná negatívna prediktívna hodnota sa pozorovala u súčasne HIV-HCV infikovaných pacientov liečených Pegasysom v monoterapii alebo v kombinácii s ribavirínom (100 % (130/130) alebo 98 % (83/85)). Pozitívne prediktívne hodnoty na úrovni 45 % (50/110) resp. 70 % (59/84) u súčasne HIV- HCV infikovaných pacientov sa pozorovali pri genotype 1 a genotype 2/3, ak títo dostávali kombinovanú liečbu.
Predikcia odpovede alebo chýbanie odpovede - predtým liečení pacientiU pacientov, ktorí neodpovedali na predchádzajúcu liečbu a boli opakovane liečení 48 alebo
72 týždňov, sa ukázalo, že potlačenie aktivity vírusu v 12. týždni (nedetegovateľná HCV RNA definovaná ako <50 IU/ml) je prediktívnym faktorom trvalej virologickej odpovede. Ak nebolo dosiahnuté potlačenie vírusovej aktivity v 12. týždni pri režime liečby 48 alebo 72 týždňov, je pravdepodobnosť nedosiahnutia trvalej virologickej odpovede pri 48-týždňovej liečbe 96 % (363 z
380) a pri 72-týždňovej liečbe 96 % (324 z 339). Ak bolo dosiahnuté potlačenie vírusovej aktivity v 12. týždni pri režime liečby 48 alebo 72 týždňov, je pravdepodobnosť dosiahnutia trvalej
virologickej odpovede pri 48-týždňovej liečbe 35 % (20 z 57) a pri 72-týždňovej liečbe 57 % (57 zo
100).
Úprava dávkovania u dospelých pacientov v dôsledku nežiaducich reakciíVšeobecnePri nutnosti úpravy dávkovania v dôsledku stredne ťažkých až ťažkých nežiaducich reakcií (klinickej a/alebo laboratórnej povahy) je vhodné u dospelých pacientov znížiť začiatočnú dávku na
135 mikrogramov. V niektorých prípadoch môže byť potrebné znížiť dávkovanie na 90 mikrogramov alebo 45 mikrogramov. Po ústupe nežiaducich reakcií je možné zvážiť zvýšenie dávkovania až na pôvodnú hodnotu (pozri časti 4.4 a 4.8).
Hematologické nežiaduce reakcie (pozri tiež tabuľku 3)Pri poklese počtu neutrofilov na < 750/mm3 u dospelých pacientov sa odporúča znížiť dávkovanie lieku. U pacientov s absolútnym počtom neutrofilov (ANC) < 500/mm3 sa liečba prerušuje až do obnovenia hodnôt ANC > 1000/mm3. Liečbu Pegasysom je možné opäť začať dávkou
90 mikrogramov a má sa sledovať počet neutrofilov. V tabuľke 7 je uvedený návod na zníženie dávky
u pediatrických pacientov na základe hodnôt ANC.
Ak počet trombocytov klesne na < 50 000/mm3, má sa znížiť dávkovanie na 90 mikrogramov. Pri znížení počtu trombocytov na hodnotu < 25 000/ mm3 sa odporúča liečbu ukončiť.
Pre liečbu farmakologicky podmienenej anémie u dospelých platia nasledovné špecifické odporúčania:
denná dávka ribavirínu sa má znížiť na 600 mg (200 mg ráno a 400 mg večer), ak nastane niektorá
z nasledujúcich situácií: (1) u pacienta bez závažného kardiovaskulárneho ochorenia dôjde k poklesu hodnôt hemoglobínu na < 10 g/dl a ≥ 8,5 g/dl alebo (2) u pacienta so stabilizovaným kardiovaskulárnym ochorením dôjde k poklesu hodnôt hemoglobínu ≥ 2 g/dl v priebehu ktorýchkoľvek 4 týždňov liečby. Návrat k pôvodnému dávkovaniu sa neodporúča. Liečba ribavirínom
sa ukončí, ak nastane niektorá z nasledujúcich situácií: (1) u pacienta bez závažného kardiovaskulárneho ochorenia dôjde k poklesu hodnôt hemoglobínu < 8,5 g/dl alebo(2) u pacienta so stabilizovaným kardiovaskulárnym ochorením sa hodnoty hemoglobínu udržujú < 12 g/dl napriek 4- týždňovej liečbe s redukovaným dávkovaním. Ak sa abnormality upravia, je možné obnoviť liečbu
ribavirínom v dennej dávke 600 mg. Ošetrujúci lekár môže zvážiť ďalšie zvýšenie dávkovania na
800 mg denne. Návrat k pôvodnému dávkovaniu sa neodporúča.
| Znížiť
dávkovanie ribavirínu na
600 mg
| Vysadiť
ribavirín
| Znížiť dávkovanie
Pegasysu na
135/90/45 mikrogramov
| Vysadiť
Pegasys
| Vysadiť
kombinovanú liečbu
| Absolútny počet neutrofilov
|
|
| < 750/mm3
| < 500/mm3
|
| Počet
trombocytov
|
|
| < 50 000/mm3
> 25 000/mm3
|
| < 25 000/mm3
| Hemoglobín
- bez ochorenia srdca
| < 10 g/dl
a ≥ 8,5 g/dl
| < 8,5 g/dl
|
|
|
| Hemoglobín
-
stabilizov ané ochorenie srdca
| pokles
o ≥ 2 g/dl počas
ľubovoľných
4 týždňov
| < 12 g/dl
napriek
4 týždňovej liečbe
s redukovaným dávkovaním
|
|
|
|
|
|
Tabuľka 3:Úprava dávkovania v dôsledku nežiaducich účinkov (ďalšie informácie pozri v texte vyššie)Pri neznášanlivosti ribavirínu je možné pokračovať v monoterapii Pegasysom.
Funkcia pečeneU pacientov s chronickou hepatitídou C sa často vyskytuje kolísanie odchýlok pečeňových testov. U pacientov liečených Pegasysom vrátane pacientov s virologickou odpoveďou sa pozorovalo zvýšenie hladín ALT nad východiskovú hodnotu (BL).
V klinických skúšaniach zameraných na chronickú hepatitídu C s dospelými pacientmi sa u 8 zo 451
pacientov dostávajúcich kombinovanú liečbu pozorovalo izolované zvýšenie ALT (≥ 10x ULN alebo
≥ 2x BL u pacientov s východiskovou hodnotou ALT ≥ 10x ULN), ktoré sa upravilo bez nutnosti
zmeny dávkovania. Ak je hodnota ALT trvale vyššia alebo naďalej stúpa, dávkovanie sa na začiatku
znižuje na 135 mikrogramov. Ak napriek zníženiu dávkovania hodnoty ALT naďalej stúpajú alebo ich sprevádza zvýšenie hladiny bilirubínu alebo známky dekompenzácie funkcie pečene, má sa liečba ukončiť (pozri časť 4.4). V tabuľke 7 je uvedený návod pre zníženie dávky pre pediatrických
pacientov na základe hladín ALT.
U pacientov s chronickou hepatitídou B nie je nezvyčajné prechodné zvýšenie hladín ALT, ktoré niekedy prekročí desaťnásobok hornej hranice normálnej hodnoty a môže odrážať imunitný klírens. Liečba by sa za normálnych okolností nemala začať, ak je hladina ALT viac než desaťkrát vyššia ako horná hranica jej normálnej hodnoty. Treba zvážiť pokračovanie liečby s častejším sledovaním funkcie pečene pri náhlom zvýšení hladín ALT. Ak sa dávka Pegasysu zníži, alebo ak sa liek vysadí, pri poklese hladiny ALT sa liečba môže obnoviť (pozri časť 4.4).
Osobitné skupiny pacientov
Starší ľudia
Na začiatku liečby Pegasysom u starších pacientov nie je potrebná žiadna úprava odporúčaného dávkovania 180 mikrogramov raz týždenne (pozri časť 5.2).
Porucha funkcie obličiekU pacientov s ochorením obličiek v terminálnej fáze sa používa začiatočná dávka 135 mikrogramov
(pozri časť 5.2 ). Bez ohľadu na začiatočnú dávku alebo stupeň poškodenia funkcie obličiek je potrebné pacientov sledovať a v prípade nežiaducich reakcií je nutné primerane znížiť dávkovanie Pegasysu počas liečebnej kúry.
Porucha funkcie pečeneUkázalo sa, že Pegasys je účinný a bezpečný u pacientov s kompenzovanou cirhózou (napr. A podľa
Child-Pughovej klasifikácie). Pegasys sa nehodnotil u pacientov s dekompenzovanou cirhózou (napr. B alebo C podľa Child-Pughovej klasifikácie alebo krvácajúce ezofageálne varixy) (pozri časť 4.3).
Podľa Child-Pughovej klasifikácie sa pacienti rozdeľujú do skupín A, B a C resp. s “miernou” “stredne ťažkou” a “ťažkou” poruchou funkcie , čomu zodpovedá skóre 5 - 6, 7 - 9 a 10 - 15.
Upravené hodnotenie Hodnotenie
| Stupeň abnormality
| Skóre
|
Encefalopatia
| Žiadny
Stupeň 1 - 2
Stupeň 3 – 4*
| 1
2
3
|
Ascites
| Žiadny
Mierny
Stredný
| 1
2
3
|
Hladina sérového bilirubínu (mg/dl)
v SI jednotkách = μmol/l
| < 2
2,0 - 3
> 3
< 34
34 - 51
> 51
| 1
2
3
1
2
3
|
Hladina sérového albumínu (g/dl)
| > 3,5
2,8 – 3,5
< 2,8
| 1
2
3
|
INR
| < 1,7
1,7 - 2,3
> 2,3
| 1
2
3
|
* Hodnotenie stupňa závažnosti podľa autorov Trey, Burns a Saunders (1966)
Pediatrická populáciaPegasys je kontraindikovaný u novorodencov a malých detí vo veku do 3 rokov z dôvodu prítomnosti
pomocnej látky benzylalkoholu (pozri časti 4.3 a 4.4).
Pre deti a dospievajúcich vo veku 5 až 17 rokov s chronickou hepatitídou C s povrchom tela (BSA) väčším ako 0,7 m2 sú odporúčané dávky Pegasysu a ribavirínu uvedené v tabuľke 4 a v tabuľke 5. Pre deti a dospievajúcich sa odporúča použiť Pegasys v naplnených injekčných striekačkách. Použitie Pegasysom naplnených pier neumožňuje primeranú úpravu dávky pre týchto pacientov. Pacienti, ktorí začali liečbu pred svojimi 18-timi narodeninami, majú pokračovať v pediatrickom dávkovaní až do skončenia liečby.
Pegasys sa nesmie použiť u detí s povrchom tela (BSA) menším ako 0,71 m2, keďže pre túto subpopuláciu nie sú dostupné údaje.
Pre výpočet BSA sa odporúča používať Mostellerov vzorec:
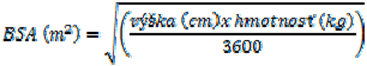 Dĺžka liečby
Dĺžka liečbyDĺžka liečby Pegasysom v kombinácii s ribavirínom u pediatrických pacientov s chronickou hepatitídou C závisí od genotypu vírusu. Pacienti infikovaní vírusovými genotypom 2 alebo 3 majú
dostať 24 týždňovú liečbu, zatiaľ čo pacienti infikovaní iným genotypom majú dostať 48 týždňovú
liečbu.
Pacienti, ktorí majú ešte detegovateľné hladiny HCV-RNA a to aj napriek počiatočnej 24 týždňovej liečbe, majú ukončiť liečbu, pretože je nepravdepodobné, že pokračovaním v liečbe budú schopní dosiahnuť trvalú virologickú odpoveď.
Tabuľka 4: Odporúčania na dávkovanie Pegasysu u pediatrických pacientov vo veku 5 až 17rokov Rozmedzie plochy povrchu tela (BSA) (m2)
| Týždenná dávka (mikrogramy)
|
0,71-0,74
| 65
|
0,75-1,08
| 90
|
1,09-1,51
| 135
|
> 1,51
| 180
|
Pre deti a dospievajúcich vo veku 5 až 17 rokov s chronickou hepatitídou C odporúčaná dávka
ribavirínu vychádza z telesnej hmotnosti pacienta s cieľovou dávkou 15 mg/kg/deň rozdelenou do dvoch denných dávok. V tabuľke 5 je uvedené dávkovanie za použitia 200 mg tabliet ribavirínu pre deti a dospievajúcich s hmotnosťou 23 kg a viac. Pacienti a ich opatrovatelia sa nesmú pokúšať rozlomiť 200 mg tablety.
Tabuľka 5: Odporúčania na dávkovanie ribavirínu u pediatrických pacientov vo veku 5 až 17rokov Telesná hmotnosť kg (lbs)
| Denná dávka ribavirínu
(pribl. 15 mg/kg/deň)
| Počet tabliet ribavirínu
|
23 – 33 (51-73)
| 400 mg/deň
| 1 x 200 mg tablety ráno
1 x 200 mg tablety večer
|
34 – 46 (75-101)
| 600 mg/deň
| 1 x 200 mg tablety ráno
2 x 200 mg tablety večer
|
47 – 59 (103-131)
| 800 mg/deň
| 2 x 200 mg tablety ráno
2 x 200 mg tablety večer
|
60 – 74 (132-163)
| 1 000 mg/deň
| 2 x 200 mg tablety ráno
3 x 200 mg tablety večer
|
≥ 75 (> 165)
| 1 200 mg/deň
| 3 x 200 mg tablety ráno
3 x 200 mg tablety večer
|
Úprava dávky u pediatrických pacientov kvôli nežiaducim reakciám U pediatrických pacientov je možné na základe toxicity (pozri tabuľku 6) urobiť až tri stupne modifikácie dávky pred zvážením prerušenia alebo vysadenia dávky.
Tabuľka 6: Odporúčaná úprava dávky Pegasysu u pediatrických pacientovZačiatočná dávka
(mikrogramy)
| 1. stupeň zníženia
(mikrogramy)
| 2. stupeň zníženia
(mikrogramy)
| 3. stupeň zníženia
(mikrogramy)
|
65
| 45
| 30
| 20
|
90
| 65
| 45
| 20
|
135
| 90
| 65
| 30
|
180
| 135
| 90
| 45
|
V prípade výskytu toxicity, ktorá môže súvisieť s podávaním Pegasysu a/alebo ribavirínu, sa môže
znížiť dávka jedného alebo obidvoch liekov. Okrem toho sa môže ribavirín alebo kombinovaná liečba Pegasys plus ribavirín vysadiť. Je dôležité poznamenať, že ribavirín sa nesmie nikdy podávať ako monoterapia. Odporúčania na úpravu dávky z dôvodu toxicity, o ktorej je známe, že má súvislosť
s podávaním Pegasysu a ktoré sú špecifické pre pediatrickú populáciu, sú uvedené v tabuľke 7. Pokiaľ nie je uvedené inak, v prípade všetkých ostatných toxických prejavov sa má postupovať podľa odporúčaní pre dospelých.
Tabuľka 7: Odporúčania na úpravu dávky Pegasysu z dôvodu toxicity u pediatrických pacientovToxicita
| Úprava dávky Pegasysu
|
Neutropénia
| 750-999 buniek/mm3: 1.-2. týždeň – okamžitá úprava 1. stupňa; 3.-48.
týždeň: žiadna úprava.
500-749 buniek/mm3: 1.-2. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte dávkou s úpravou 1. stupňa s kontrolou hodnoty leukocytov jedenkrát týždenne počas 3 nasledujúcich týždňov, aby ste sa ubezpečili, že ich počet je > 750 buniek/mm3; 3.-48. týždeň – okamžitá úprava 1. stupňa.
250-499 buniek/mm3: 1.-2. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte dávkou s úpravou 2. stupňa; 3.-48. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte
v dávkovaní s úpravou 1. stupňa.
< 250 buniek/mm3 (alebo febrilná neutropénia) liečbu vysaďte.
|
Zvýšená hladina
alanínaminotransaminázy
(ALT)
| V prípade pretrvávajúcich alebo narastajúcich zvýšení ≥ 5 ale < 10 x
ULN, znížte dávku s úpravou 1. stupňa a jedenkrát týždenne sledujte hladinu ALT na uistenie, že je stabilná alebo klesá
V prípade pretrvávajúcich hodnôt ALT ≥ 10 x ULN vysaďte liečbu.
|
ULN=horná hranica normy
U pediatrických pacientov je toxicita súvisiaca s liečbou ribavirínom, ako napríklad anémia, ktorá sa objaví počas liečby, riešiteľná znížením celkovej dávky. Stupne zníženia dávky sú uvedené v tabuľke
8.
Tabuľka 8: Odporúčania na úpravu dávky ribavirínu u pediatrických pacientovCelková dávka
(približne 15 mg/kg/deň)
| Jednokroková úprava dávky
(približne 7,5 mg/kg/deň)
|
Počet tabliet ribavirínu
|
400 mg/deň
| 200 mg/deň
| 1 x 200 mg tabliet ráno
|
600 mg/deň
| 400 mg/deň
| 1 x 200 mg tabliet ráno
|

|
|
1 x 200 mg tabliet večer
|
800 mg/deň
|
400 mg/deň
|
1 x 200 mg tabliet ráno
1 x 200 mg tabliet večer
|
1 000 mg/deň
|
600 mg/deň
|
1 x 200 mg tabliet ráno
2 x 200 mg tabliet večer
|
1 200 mg/deň
|
600 mg/deň
|
1 x 200 mg tabliet ráno
2 x 200 mg tabliet večer
|
Skúsenosti s Pegasysom pri liečbe pediatrických pacientov s HCV vo veku od 3 do 5 rokov alebo tých,
ktorí v minulosti neboli adekvátne liečení, sú len obmedzené. Neexistujú žiadne údaje u pediatrických pacientov súčasne infikovaných vírusmi HCV a HIV alebo s poruchou funkcie obličiek.
Spôsob podaniaPegasys sa podáva subkutánne do brucha alebo stehna. V štúdiách s podaním Pegasysu do ramena
bola zistená znížená expozícia Pegasysom (pozri časť 5.2).
Pegasys je navrhnutý na podávanie samotným pacientom alebo opatrovateľom. Každú injekčnú liekovku má používať len jedna osoba a je určená len na jednorazové použitie.
Pre nezdravotníckych pracovníkov, ktorí podávajú tento liek, sa odporúča primerané školenie. Pacient musí postupovať presne podľa “Pokynov pre používateľa” vložených v škatuľke.
4.3 Kontraindikácie• Precitlivenosť na liečivo, na interferóny alfa alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
• Autoimunitná hepatitída
• Ťažká dysfunkcia pečene alebo dekompenzovaná cirhóza pečene
• Anamnéza ťažkého kardiovaskulárneho ochorenia vrátane nestabilného alebo nekontrolovaného
ochorenia srdca počas predchádzajúcich 6 mesiacov (pozri časť 4.4)
• HIV-HCV pacienti s cirhózou s Child-Pughovým skóre ≥6, okrem stavu, keď je cirhóza nepriamo spôsobená hyperbilirubinémiou vyvolanou liekmi ako atazanavir a indinavir
• Kombinácia s telbivudínom (pozri časť 4.5)•Novorodenci a deti do 3 rokov vzhľadom na prítomnosť pomocnej látky – benzylalkoholu (pozri časť 4.4 o benzylalkohole)
• Psychické poruchy, obvzvlášť závažná depresia , suicidálne myšlienky alebo pokus o samovraždu u pediatrických pacientov v súčasnosti alebo v anamnéze.
Ak sa Pegasys má použiť v kombinácii s ribavirínom, prečítajte si súhrn charakteristických vlastností
(SmPC) ribavirínu, ktorý obsahuje kontraindikácie jeho použitia.
4.4 Osobitné upozornenia a opatrenia pri používaníPsychické poruchy a centrálny nervový systém (CNS): Počas liečby Pegasysom a aj po jej ukončení, najmä počas 6-mesačného sledovania po liečbe, sa pozorovali u niektorých pacientov závažné účinky na CNS, hlavne depresia, samovražedné predstavy a pokus o samovraždu. Pri použití alfa interferónov sa pozorovali ďalšie účinky na CNS s prejavmi ako je agresívne správanie (niekedy namierené proti iným osobám ako je myšlienka na vraždu), bipolárne poruchy, mánia, zmätenosť a poruchy vedomia. U všetkých pacientov majú byť prísne monitorované všetky znaky alebo symptómy psychických porúch.. Ak sa objavia symptómy psychických porúch, ošetrujúci lekár musí vziať do úvahy možnú závažnosť týchto príznakov a zvážiť potrebu adekvátnej liečby. Ak psychiatrické symptómy pretrvávajú alebo sa zhoršujú, alebo ak sa spozorujú samovražedné predstavy, odporúča sa liečbu Pegasysom ukončiť a pacienta odporučiť do prislúchajúcej psychiatrickej starostlivosti a/alebo liečby.

 Pacienti s už existujúcim psychiatrickým ochorením alebo s údajom o závažnom psychiatrickom ochorení v anamnéze:
Pacienti s už existujúcim psychiatrickým ochorením alebo s údajom o závažnom psychiatrickom ochorení v anamnéze: Ak sa rozhodne, že liečba Pegasysom je nutná u pacienta, ktorý má existujúce alebo v anamnéze prítomné závažné psychiatrické ochorenie, má sa liečba začať až po zaistení vhodnej individuálnej diagnostiky a liečby psychiatrického stavu.
Použitie Pegasysu u pediatrických pacientov s psychickými poruchami v súčasnosti alebo v anamnéze je kontraindikované (pozri časť 4.3).
Rast a vývoj (deti a dospievajúci): Úbytok hmotnosti a inhibícia rastu bola bežná v priebehu liečby
trvajúcej až 48 týždňov u pacientov vo veku 5 až 17 rokov (pozri časti 4.8 a 5.1).
2 roky po liečbe Pegasysom bolo 16 % pediatrických pacientov stále 15 percentilov alebo viac pod svojou východiskovou krivkou hmotnosti a 11 % zostalo 15 percentilov alebo viac pod svojou východiskovou krivkou výšky.
Individuálne posúdenie prínosu liečby a rizika u detíOčakávaný prínos liečby sa má starostlivo zvažovať berúc pritom do úvahy zistenia z klinických skúšaní týkajúce sa bezpečnosti pozorované u pediatrických pacientov (pozri časti 4.8 a 5.1).
- Je dôležité vziať do úvahy, že kombinovaná liečba viedla k inhibícii rastu, ktorej reverzibilita nie je istá.
- Toto riziko je potrebné zvážiť berúc do úvahy charakter ochorenia dieťaťa, akým je dôkaz o progresii ochorenia (najmä fibrózy), komorbidity, ktoré môžu negatívne ovplyvniť priebeh
ochorenia (napr. súčasná infekcia vírusom HIV), ako aj prognostické faktory odpovede (HCV
genotyp a vírusová záťaž).
Ak je to možné, dieťa sa má liečiťpo pubertálnej akcelerácii rastu, aby sa znížilo riziko inhibície rastu. Neexistujú žiadne údaje o dlhodobých účinkoch na pohlavné dozrievanie.
Ak sa Pegasys podáva v kombinácii s ribavirínom, prečítajte si súhrn charakteristických vlastností
(SmPC) ribavirínu.
Histológia pečene pred liečbouVšetci pacienti s chronickou hepatitídou C, ktorí sa zúčastnili štúdie, sa podrobili biopsii pečene, ale v určitých prípadoch (napr. u pacientov s genotypom 2 alebo 3) sa môže liečba nasadiť aj bez histologického dôkazu. Pri rozhodovaní o nutnosti biopsie pečene pred začiatkom liečby sa má postupovať podľa platných liečebných postupov.
U pacientov s normálnymi hodnotami ALT sa progresia do fibrózy v priemere vyskytuje s nižšou intenzitou ako u pacientov so zvýšenými hodnotami ALT. Toto musí byť zhodnotené spoločne s ostatnými kritériami ako HCV genotyp, vek pacienta, extrahepatálne prejavy, riziko prenosu atď., ktoré ovplyvňujú rozhodnutie liečiť alebo neliečiť.
Laboratórne vyšetrenia pred liečbou a počas nejPred začiatkom liečby Pegasysom sa u všetkých pacientov odporúča vykonať štandardné hematologické a biochemické laboratórne vyšetrenia.
Pred začiatkom liečby Pegasysom musia byť východiskové hodnoty sledovaných parametrov nasledovné:
- počet trombocytov ≥ 90 000/mm3
- absolútny počet neutrofilov ≥ 1 500/mm3
- primerane kontrolovaná funkcia štítnej žľazy (TSH a T4)
Hematologické vyšetrenia sa majú opakovať každé 2 - 4 týždne a biochemické vyšetrenia každé 4
týždne. Počas liečby sa má periodicky robiť doplnkové vyšetrenie.
V klinických štúdiách sa počas liečby Pegasysom pozorovalo zníženie počtu leukocytov (WBC) ako aj absolútneho počtu neutrofilov (ANC), ku ktorému obyčajne došlo počas prvých dvoch týždňov liečby (pozri časť 4.8). Progresívne znižovanie po 8 týždňoch liečby sa zistilo len v zriedkavých prípadoch.
Pokles ANC bol obyčajne reverzibilný po znížení dávkovania alebo ukončení liečby (pozri časť 4.2), normálne hodnoty sa dosiahli u väčšiny pacientov za 8 týždňov a na základné hodnoty sa vrátili u všetkých pacientov približne po 16 týždňoch.
Liečbu Pegasysom sprevádzalo zníženie počtu trombocytov, ktorý sa vrátil na úroveň pred liečbou počas obdobia sledovania po liečbe (pozri časť 4.8). V niektorých prípadoch bola potrebná úprava dávkovania (pozri časť 4.2).
V klinických štúdiách sa u 15 % pacientov s chronickou hepatitídou C liečených Pegasysom
v kombinácii s ribavirínom pozoroval výskyt anémie (hemoglobín <10 g/dl). Frekvencia závisí na dĺžke trvania liečby a na dávke ribavirínu (pozri časť 4.8). U ženskej populácie je vyššie riziko vývoja anémie.
Pri podávaní Pegasysu v kombinácii s inými potenciálne myelosupresívnymi látkami je potrebná opatrnosť.
V literatúre sú hlásenia o výskyte pancytopénie a o útlme kostnej drene, ku ktorým došlo v priebehu 3 až 7 týždňov po podaní peginterferónu a ribavirínu podaného súbežne s azatioprinom. Táto myelotoxicita bola reverzibilná do 4 až 6 týždňov po vysadení antivirotickej terapie proti hepatitíde C a súčasne podávaného azatioprinu a neobnovila sa po opätovnom zavedení ktoréhokoľvek z týchto liečiv podávaných v monoterapii (pozri časť 4.5).
Použitie kombinovanej liečby Pegasysom a ribavirínom u pacientov s chronickou hepatitídou C,
u ktorých zlyhala predchádzajúca liečba, sa dostatočne nesledovalo u pacientov, ktorí predchádzajúcu liečbu predčasne ukončili kvôli hematologickým nežiaducim reakciám. Lekári, ktorí uvažujú o liečbe týchto pacientov, majú starostlivo zvážiť riziká opakovanej liečby oproti jej prínosom.
Endokrinný systém
Pri používaní interferónov alfa vrátane Pegasysu sa popísali poruchy funkcie štítnej žľazy, resp. zhoršenie predchádzajúcich ochorení štítnej žľazy. Pred začiatkom liečby Pegasysom sa majú vyšetriť hladiny TSH a T4. Liečbu Pegasysom je možné zahájiť alebo je možné v nej pokračovať, ak sa hodnoty TSH počas liečby udržia v normálnom rozmedzí. Počas liečebnej kúry sa majú vyšetriť hladiny TSH, ak sa u pacienta objavia klinické príznaky svedčiace o možnej poruche funkcie štítnej žľazy (pozri časť 4.8). Pri liečbe Pegasysom sa môže pozorovať hypoglykémia, hyperglykémia a diabetes mellitus (pozri časť 4.8). Pacienti, u ktorých sa tieto stavy nemôžu účinne kontrolovať liekmi, sa nemajú začať liečiť Pegasysom alebo Pegasysom v kombinácii s ribavirínom. U pacientov, u ktorých sa toto ochorenie rozvinulo počas liečby a nemôžu sa liečiť liekmi, má sa liečba Pegasysom alebo Pegasysom v kombinácii s ribavirínom ukončiť.
Kardiovaskulárny systém
Liečbu interferónmi alfa vrátane Pegasysu sprevádzala hypertenzia, supraventrikulárne arytmie, kongestívne srdcové zlyhanie, bolesť na hrudníku a infarkt myokardu. Odporúča sa, aby sa pacienti so srdcovými abnormalitami v predchorobí podrobili elektrokardiografickému vyšetreniu pred začiatkom liečby Pegasysom. Pri akomkoľvek zhoršení kardiovaskulárneho stavu sa musí liečba prerušiť resp. ukončiť. U pacientov s kardiovaskulárnym ochorením si môže anémia vyžiadať zníženie dávkovania alebo vysadenie liečby ribavirínom (pozri časť 4.2).
Funkcia pečene
Liečba Pegasysom sa musí ukončiť u pacientov, u ktorých sa počas liečby objavia známky dekompenzácie pečene. Pri liečbe Pegasysom sa pozorovalo zvýšenie hladín ALT oproti východiskovej hodnote, ku ktorému došlo aj u pacientov s virologickou odpoveďou na liečbu. Ak napriek zníženiu dávkovania hodnota ALT naďalej stúpa a je klinicky významná resp. ju sprevádza zvýšenie hladiny priameho bilirubínu, liečba sa musí ukončiť (pozri časti 4.2 a 4.8).
V prípade chronickej hepatitídy B, na rozdiel od chronickej hepatitídy C, nie je nezvyčajné zhoršenie ochorenia počas liečby, ktoré je charakterizované prechodným a potenciálne významným zvýšením sérovej ALT. V klinických štúdiách s Pegasysom pri HBV sa pozorovalo výrazné zvýšenie hladiny
transaminázy, sprevádzané miernymi zmenami v ďalších parametroch hepatálnej funkcie, pričom sa nedokázala dekompenzácia pečene. Približne v polovici prípadov zvýšenia ALT prekračujúceho desaťnásobok hornej hranice normálnej hodnoty sa dávkovanie Pegasysu znížilo alebo liek sa vysadil, až kým neklesli hodnoty transaminázy, zatiaľ čo u zvyšku pacientov liečba ostala nezmenená. Vo všetkých prípadoch sa odporučilo častejšie sledovanie hepatálnej funkcie.
Precitlivenosť
V zriedkavých prípadoch sa počas liečby interferónom alfa môžu vyskytnúť závažné akútne reakcie
z precitlivenosti (napr. urtikária, angioedém, bronchokonstrikcia, anafylaxia). Ak sa vyskytnú, musí sa liečba ukončiť a okamžite zahájiť príslušná farmakoterapia. Prechodný exantém si nevyžaduje nutnosť prerušenia liečby.
Autoimunitné ochorenie
Popísal sa vznik autoprotilátok a autoimunitných porúch počas liečby interferónmi alfa. Zvýšené riziko môžu mať pacienti predisponovaní na rozvoj autoimunitných porúch. Pacientov, ktorí majú znaky alebo príznaky zlučiteľné s autoimunitnými poruchami, sa má starostlivo vyšetriť a potom prehodnotiť pomer prínosu a rizika pokračovania liečby interferónom (pozri tiež Endokrinný systém v častiach 4.4 a 4.8).
U pacientov s chronickou hepatitídou C liečených interferónom boli hlásené prípady Vogt-Koyanagi- Harada (VKH) syndrómu. Tento syndróm je granulomatózne zápalové ochorenie, ktoré postihuje oči, sluchový systém, meningy a kožu. Ak je podozrenie na VKH syndróm, má sa antivirotická liečba ukončiť a uvažovať o liečbe kortikoidmi (pozri časť 4.8).
Horúčka/infekcie
Zatiaľ čo horúčka môže byť spojená so syndrómom podobným chrípke, čo sa často uvádza pri liečbe interferónom, musia sa vylúčiť iné príčiny pretrvávajúcej horúčky, zvlášť závažné infekcie (bakteriálne, vírusové, plesňové), najmä u pacientov s neutropéniou. V priebehu liečby interferónmi alfa, vrátane Pegasysu sa zaznamenal vznik závažných infekcií (bakteriálnych, vírusových, plesňových) a sepsa. Okamžite sa má začať odpovedajúca liečba proti infekcii a má sa zvážiť
prerušenie liečby.
Očné zmeny
Pri liečbe Pegasysom sa zriedkavo popísala retinopatia, vrátane krvácania do sietnice, vatových škvŕn, edému papily, neuropatie zrakového nervu a uzáveru retinálnej artérie alebo vény, ktorý môže viesť
k strate zraku. Všetci pacienti sa majú pred začiatkom liečby podrobiť očnému vyšetreniu. Každý pacient udávajúci zhoršenie alebo stratu zraku sa musí okamžite podrobiť kompletnému očnému vyšetreniu. Dospelí a pediatrickí pacienti s očnými poruchami v predchorobí (napr. diabetickou alebo hypertenznou retinopatiou), sa majú počas liečby Pegasysom podrobiť pravidelným očným vyšetreniam. Liečba Pegasysom sa má ukončiť u pacientov s novovzniknutými alebo zhoršenými poruchami zraku.
Pľúcne zmeny
Počas liečby Pegasysom sa opísali pľúcne zmeny vrátane dýchavice, pľúcnych infiltrátov, pneumónie a pneumonitídy. V prípade pretrvávajúcich alebo nevysvetlených pľúcnych infiltrátov alebo zhoršenia funkcie pľúc sa má liečba ukončiť.
Kožné poruchy
Liečba interferónmi alfa bola sprevádzaná exacerbáciou alebo rozvojom psoriázy a sarkoidózy. Pegasys sa musí opatrne používať u pacientov s psoriázou a v prípadoch vzniku resp. zhoršenia psoriatických lézií sa musí liečba ukončiť.
Transplantácia
Bezpečnosť a účinnosť liečby Pegasysom a ribavirínom sa u pacientov po transplantácii pečene a iných orgánov nehodnotila. Boli hlásené odvrhnutia transplantátov pečene a obličiek po liečbe Pegasysom samotným alebo po kombinovanej liečbe s ribavirínom.
Súčasná infekcia HIV-HCV
Prosím, pozrite si súhrny charakteristických vlastností pre antiretrovírusové lieky, ktoré sa užívajú súbežne s HCV liečbou pre porozumenie a zvládnutie toxických účinkov každého lieku a možnosti prekrývania sa toxických účinkov pri liečbe Pegasysom s ribavirínom alebo bez ribavirínu. V štúdii NR15961 u pacientov, ktorí boli súbežne liečení so stavudínom a interferónom s alebo bez ribavirínu, bol výskyt pankreatitídy a/alebo laktátovej acidózy 3 % (12/398).
U pacientov súčasne infikovaných HCV a HIV, ktorí dostávajú vysoko-účinnú liečbu anti- retrovírusovými látkami (HAART), môže byť vyššie riziko vzniku laktátovej acidózy. Preto je potrebná opatrnosť pri pridávaní kombinovanej liečby Pegasys a ribavirín k liečbe HAART (pozri SPC ribavirínu).
Súčasne infikovanípacienti s pokročilou infekciou a pokročilou cirhózou pečene liečení HAART môžu mať vyššie riziko dekompenzácie pečene a úmrtia, ak dostávajú ribavirín v kombinácii s interferónmi vrátane Pegasysu. Zmeny východiskových hodnôt u koinfikovaných pacientov s cirhózou, ktoré môžu byť spojené s dekompenzáciou pečene, zahŕňajú: zvýšený sérový bilirubín, znížený hemoglobín, zvýšenú alkalickú fosfatázu alebo znížený počet krvných doštičiek a liečbu didanozínom (ddI).
Súbežná liečba ribavirínom a zidovudínom sa neodporúča vzhľadom na zvýšené riziko vzniku anémie
(pozri časť 4.5).
Počas liečby pacienti s kombinovanou infekciou sa majú starostlivo sledovať na znaky a symptómy dekompenzácie pečene (vrátane ascitu encefalopatie, krvácania z varixov, poškodenej syntézy
v pečeni; napr. Childovo-Pughovo skóre 7 alebo vyššie). Childovo-Pughovo skóre môže byť ovplyvnené faktormi spojenými s liečbou (ako nepriama hyperbilirubinémia, znížený albumín) a nemusia nevyhnutne viesť k dekompenzácii pečene. Liečba Pegasysom sa má ihneď ukončiť u pacientov s dekompenzáciou pečene.
U pacientov súčasne infikovaných HCV a HIV, údaje o účinnosti a bezpečnosti sú obmedzené
u pacientov s počtom CD4 buniek nižším ako 200 buniek/µl. Opatrnosť je preto potrebná u pacientov s nízkym počtom CD4 buniek.
Dentálne a periodontálne poruchy
U pacientov, ktorí dostávajú Pegasys v kombinácii s ribavirínom, sa hlásili dentálne a periodontálne poruchy, ktoré môžu viesť k strate zubov. Navyše suché ústa môžu mať škodlivý účinok na zuby a mukózne membrány úst počas dlhotrvajúcej liečby Pegasysom v kombinácii s ribavirínom. Pacienti si majú dvakrát denne dôkladne čistiť zuby a majú mať pravidelné kontrolné vyšetrenie zubným
lekárom. Okrem toho u niektorých pacientov sa môže objaviť vracanie. Ak sa takáto reakcia vyskytne, má sa im odporučiť dôkladne si potom vypláchnuť ústa.
Použitie dlhodobej liečby peginterferónom v monoterapii (neschválené použitie)
V randomizovanej, kontrolovanej štúdii (HALT-C) uskutočnej v USA u pacientov infikovaných vírusom HCV s rozličným stupňom fibrózy, ktorí neodpovedali na liečbu, sa sledovala 3,5-ročná liečba Pegasysom v monoterapii v dávke 90 mikrogramov/týždeň, pričom sa nezistilo žiadne signifikantné zníženie výskytu progresie fibrózy alebo súvisiacich klinických príhod.
Pomocná látka
Pegasys obsahuje benzylakohol. Nesmie sa podávať predčasne narodeným deťom ani novorodencom. Môže spôsobiť toxické reakcie a anafylaktické reakcie u dojčiat a detí vo veku do 3 rokov.
4.5 Liekové a iné interakcie
Interakčné štúdie sa uskutočnili len u dospelých.
Podávanie Pegasysu zdravým mužským dobrovoľníkom v dávke 1 x 180 mikrogramov týždenne počas 4 týždňov nemalo žiadny vplyv na farmakokinetické profily mefenytoínu, dapsonu,
debrisochínu a tolbutamidu, čo poukazuje na to, že Pegasys neovplyvňuje in vivo metabolickú aktivitu izoenzýmov cytochrómu P450 3A4, 2C9, 2C19 a 2D6.
V rovnakej štúdii sa pozorovalo 25 % zvýšenie hodnoty AUC pre teofylín (marker aktivity cytochrómu P450 1A2), čo potvrdzuje, že Pegasys je inhibítorom aktivity cytochrómu P450 1A2. U pacientov liečených súbežne teofylínom a Pegasysom sa majú sledovať sérové koncentrácie teofylínu a vhodne upraviť jeho dávkovanie. Je pravdepodobné, že k maximálnej interakcii medzi teofylínom a Pegasysom dôjde po viac ako 4 týždňoch liečby Pegasysom.
Pacienti s izolovanou infekciou vírusom HCV a pacienti s izolovanou infekciou vírusom HBV
Vo farmakologickej štúdii dostávalo 24 HCV infikovaných pacientov súbežne udržiavaciu liečbu
metadonom (stredná dávka 95 mg, v rozmedzí od 30 mg do 150 mg), liečba s Pegasysom
180 mikrogramov, subkutánne raz týždenne počas 4 týždňov, bola spojená s priemernými hodnotami metadonu, ktoré boli 10 % až 15 % vyššie než východiskové hodnoty. Klinický význam tohto zistenia nie je známy, napriek tomu sa majú pacienti sledovať pre príznaky a symptómy metadonovej toxicity. Zvlášť sa majú sledovať pacienti, ktorí užívajú vysokú dávku metadonu, u ktorých je riziko predĺženia QT intervalu.
Ribavirín, keďže má inhibičný účinok na inozín-monofosfátdehydrogenázu, môže zasahovať do metabolizmu azatioprinu, čo eventuálne môže viesť ku kumulácii 6-metyltioinozín-monofosfátu (6- MTIMP), ktorý sa spája so vznikom myelotoxicity u pacientov liečených azatioprinom. Má sa vyhnúť použitiu peginterferónu alfa-2a a ribavirínu podaného súbežne s azatioprinom. V jednotlivých prípadoch, ak prínos podávania ribavirínu súčasne s azatioprinom oprávňuje podstúpiť možné riziko, odporúča sa dôkladne monitorovať hematologické parametre počas súbežného podávania azatioprinu so zreteľom odhaliť známky myelotoxicity − v prípade, že k nej dôjde, treba liečbu týmito liekmi ukončiť (pozri časť 4.4).
Výsledky z farmakokinetických podštúdií v rámci pilotnej štúdie fázy III nepreukázali žiadnu farmakokinetickú interakciu medzi lamivudínom a Pegasysom u pacientov s HBV alebo medzi Pegasysom a ribavirínom u pacientov s HCV.
V klinickom skúšaní bola skúmaná kombinácia telbivudínu 600 mg denne s pegylovaným interferónom alfa-2a, 180 mikrogramov raz týždenne podané subkutánne. Skúšanie ukázalo, že kombinácia je spojená so zvýšeným rizikom vzniku periférnej neuropatie. Mechanizmus vzniku týchto udalostí nie je známy; a tak kombinovaná liečba telbivudínom s inými interferónmi (pegylovanými alebo štandardnými) môže tiež znamenať nesmierne riziko. Okrem toho, prínos kombinovanej liečby telbivudínom s interferónom alfa (pegylovaným alebo štandardným) nie je v súčasnosti preukázaný. Preto je kombinácia Pegasysu s telbivudínom kontraindikovaná (pozri časť 4.3).
Pacienti súčasne infikovaní vírusmi HIV-HCV
U 47 HIV-HCV infikovaných pacientov, ktorí sa zúčastnili na 12-týždňovej farmakokinetickej časti
štúdie skúmajúcej účinok ribavirínu na vnútrobunkovú fosforyláciu niektorých inhibítorov nukleozidovej reverznej transkriptázy (lamivudín a zidovudín alebo stavudín) sa nepozoroval žiadny zjavný dôkaz o liekovej interakcii. Avšak v dôsledku vysokej variability boli intervaly spoľahlivosti dosť široké. Nezdá sa, že plazmatická expozícia ribavirínu je ovplyvnená súčasným podávaním inhibítorov nukleozidovej reverznej transkriptázy (NRTIs).
Súčasné podávanie ribavirínu a didanozínu sa neodporúča. Expozícia didanozínu alebo jeho
aktívnemu metabolitu (dideoxyadenozín 5´-trifosfát) sa zvyšuje in vitro, ak sa didanozín podáva spolu s ribavirínom. Pri používaní ribavirínu sa popísali hlásené prípady zlyhania pečene s následkom smrti, ako aj periférna neuropatia, pankreatitída a symptomatická hyperlaktatémia/laktátová acidóza.
Keď bol zidovudín súčasťou režimu používaného na liečbu HIV, bolo hlásené zvýraznenie anémie spôsobenej ribavirínom. Presný mechanizmus zostáva nevysvetlený. Súčasné podávanie ribavirínu
kombinovaná antiretrovírusová liečba stanovená, má sa zvážiť nahradenie zidovudínu. Je to zvlášť
dôležité u pacientov, u ktorých zidovudín spôsobil anémiu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne alebo iba obmedzené údaje o použití peginterferónu alfa-2a u gravidných žien. Štúdie na zvieratách s peginterferónom alfa-2a preukázali reprodukčnú toxicitu (pozri časť 5.3) a nie je známe potenciálne riziko u ľudí. Liečba Pegasysom počas gravidity sa používa iba vtedy, ak jej úžitok pre matku prevýši jeho riziko pre plod.
Laktácia
Nie je známe, či sa peginterferón alfa-2a/jeho metabolity vylučujú do materského mlieka. Dojčenie sa má ukončiť pred začatím liečby pre možnosť vzniku nežiaducich reakcií u dojčených detí.
Fertilita
Nie sú k dispozícii žiadne údaje o účinkoch peginterferónu alfa-2a na fertilitu žien. Pri podávaní peginterferónu alfa-2a samiciam opíc sa pozorovalo predĺženie menštruačného cyklu (pozri časť 5.3).
Použitie s ribavirínom
U všetkých zvieracích druhov, ktoré boli vystavené ribavirínu, sa dokázali významné teratogénne a/alebo embryocídne účinky. Ribavirín je u gravidných žien kontraindikovaný. Je potrebná mimoriadna opatrnosť na zabránenie gravidity u pacientok alebo partneriek pacientov, ktorí užívajú Pegasys v kombinácii s ribavirínom. Pacientky v plodnom veku musia používať účinnú antikoncepciu počas liečby a ešte 4 mesiace po ukončení liečby. Pacienti alebo partnerky musia používať účinnú
antikoncepciu počas liečby a ešte 7 mesiacov po ukončení liečby. Prosím pozrite si SmPC ribavirínu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pegasys má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti, ktorí trpia závratom, zmätenosťou, ospalosťou alebo únavou, sa majú vyvarovať vedeniu vozidiel
alebo obsluhovaniu strojov.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Chronická hepatitída C
Výskyt a závažnosť väčšiny nežiaducich reakcií u pacientov liečených Pegasysom je podobná ako u pacientov dostávajúcich interferón alfa-2a pozri tabuľku 9). Väčšina častých nežiaducich reakcií pozorovaných po Pegasyse 180 mikrogramov bola miernej až strednej intenzity, pričom ich bolo možné zvládnuť bez potreby zmeny dávkovania alebo ukončenia liečby.
Chronická hepatitída B
V klinických štúdiách, ktoré skúmali 48-týždňovú liečbu a 24-týždňové sledovanie po liečbe bol bezpečnostný profil Pegasysu pri chronickej hepatitíde B podobný ako v prípade chronickej hepatitídy C. Frekvencia výskytu väčšiny nežiaducich reakcií, s výnimkou pyrexie, bola výrazne nižšia v prípade CHB liečenej Pegasysom v monoterapii v porovnaní s HCV pacientami liečenými s Pegasysom v monoterapii (pozri tabuľku 9). Nežiaduce účinky malo 88 % pacientov liečených
Pegasysom v porovnaní s 53 % pacientov v porovnávacej skupine s lamivudínom, kým 6 % pacientov liečených Pegasysom a 4% pacientov liečených lamivudínom mali závažné nežiaduce účinky počas štúdií. Nežiaduce účinky alebo abnormálne laboratórne hodnoty viedli u 5 % pacientov k ukončeniu liečby v skupine liečenej Pegasysom, zatiaľ čo menej ako 1 % pacientov ukončilo liečbu v skupine liečenej lamivudínom z tých istých dôvodov. Percento pacientov s cirhózou, ktorí ukončili liečbu bolo podobné ako u pacientov v celkovej populácii v každej liečenej skupine.
Chronická hepatitída C u pacientov, ktorí neodpovedali na predchádzajúcu liečbu
U pacientov, ktorí neodpovedali na predchádzajúcu liečbu, bol bezpečnostný profil Pegasysu
v kombinácii s ribavirínom celkovo podobný ako u predtým neliečených pacientov. V klinickom skúšaní u pacientov, ktorí neodpovedali na predchádzajúcu liečbu pegylovaným interferónom
alfa-2b/ribavirínom, v ktorej boli pacienti podrobení buď 48-týždňovej, alebo 72-týždňovej liečbe, došlo kvôli nežiaducim udalostiam alebo laboratórnym odchýlkam k predčasnému ukončeniu liečby Pegasysom u 6 % pacientov a liečby ribavirínom u 7 % pacientov v skupine liečenej 48 týždňov a v skupine liečenej 72 týždňov z rovnakého dôvodu liečbu Pegasysom predčasne ukončilo 12 % pacientov a liečbu ribavirínom 13 % pacientov. Podobne aj u pacientov s cirhózou alebo prechodom do cirhózy sa predčasné ukončenie liečby Pegasysom a liečby ribavirínom vyskytovalo častejšie v skupine liečenej 72 týždňov (13 % a 15 %) než v skupine liečenej 48 týždňov (6 % a 6 %). Pacienti, ktorí kvôli hematologickej toxicite predčasne ukončili predchádzajúcu liečbu pegylovaným interferónom alfa-2b/ribavirínom, boli z účasti na tejto štúdii vylúčení.
V ďalšom klinickom skúšaní boli 48 týždňov liečení pacienti s pokročilou fibrózou alebo cirhózou (Ishakovo skóre 3 až 6), ktorí neodpovedali na predchádzajúcu liečbu a ktorí mali pred zaradením do štúdie počet trombocytov iba 50 000/mm3. Odchýlky laboratórnych hematologických parametrov pozorované počas prvých 20 týždňov štúdie zahŕňali anémiu (26 % pacientov malo hladinu hemoglobínu < 10 g/dl), neutropéniu (30 % pacientov malo ANC < 750/mm3) a trombocytopéniu
(13 % pacientov malo počet trombocytov < 50 000/mm3) (pozri časť 4.4).
Súčasná infekcia vírusom chronickej hepatitídy C a vírusom HIV
U pacientov súčasne infikovaných vírusmi HIV-HCV boli profily klinických nežiaducich reakcií pri liečbe Pegasysom samotným alebo v kombinácii s ribavirínom podobné ako profily u pacientov infikovaných len HCV. U HIV-HCV pacientov, ktorí dostávali Pegasys a ribavirín v kombinovanej liečbe, boli hlásené ďalšie nežiaduce účinky u ≥ 1 % až ≤ 2 % pacientov: hyperlaktacidémia/laktát acidóza, chrípka, pneumónia, psychická labilita, apatia, hučanie v ušiach, faryngolaryngeálna bolesť, zápal pery, získaná lipodystrofia a chromatúria. Liečba Pegasysom bola spojená s poklesom absolútneho počtu CD4+ buniek počas prvých 4 týždňov bez zníženia percenta CD4+ buniek. Pokles počtu CD4+ buniek bol po znížení dávky alebo po ukončení liečby reverzibilný. Používanie Pegasysu nemalo žiadny pozorovateľný negatívny vplyv na kontrolu HIV virémie počas liečby alebo následnom sledovaní pacientov. U koinfikovaných pacientov s počtom CD4+ buniek < 200/μl sú údaje
o bezpečnosti obmedzené.
Tabuľkový súhrn nežiaducich reakcií
V tabuľke 9 sú zhrnuté nežiaduce účinky hlásené u CHB alebo CHC pacientov pri liečbe Pegasysom
v monoterapii a u CHC pacientov liečených Pegasysom v kombinácii s ribavirínom. Nežiaduce účinky hlásené v klinických štúdiách sú zoradené do skupín podľa frekvencie a to nasledovne: veľmi časté
(≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až
< 1/1 000), veľmi zriedkavé (< 1/10 000). Frekvencia nežiaducich účinkov na základe spontánnych
hlásení vychádzajúcich zo skúseností po uvedení lieku na trh nie je známa (nemožno ju odhadnúť z dostupných údajov). V rámci jednotlivých skupín je frekvencia nežiaducich účinkov z hľadiska závažnosti usporiadaná v klesajúcom poradí.
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Infekcie a
nákazy
|
|
bronchitída,
infekcie horných dýchacích ciest, kandidóza
ústnej dutiny, herpes simplex, hubovité,
vírusové
a bakteriálne infekcie
|
pneumónia,
kožná infekcia
|
endokarditída,
zápal
vonkajšieho ucha
|
|
sepsa
|
Benígne a
malígne nádory
|
|
|
neoplazma
pečene
|
|
|
|
Poruchy krvi
a lymfatického systému
|
|
trombocytopéni
a, anémia, lymfadenopatia
|
|
pancytopénia
|
aplastická
anémia
|
izolovaná
aplázia červených krviniek
|
Poruchy
imunitného systému
|
|
|
sarkoidóza,
tyroiditída
|
anafylaxia,
systémový lupus erythematosus, reumatoidná artritída
|
idiopatická
alebo tromboticko- trombocyto- penická purpura
|
odvrhnutie
transplantá-tu pečene
a obličiek, Vogt- Koyanagi-
Harada
ochorenie
|
Poruchy
endokrinnéh o systému
|
|
hypotyreóza,
hypertyreóza
|
diabetes
|
diabetická
ketoacidóza
|
|
|
Poruchy
metabolizmu a výživy
|
anorexia
|
|
dehydratácia
|
|
|
|
Psychické
poruchy
|
depresia*,
úzkosť, nespavosť*
|
agresia, zmeny
nálady, emočné poruchy nervozita, pokles libida
|
samovražedn
é myšlienky, halucinácie
|
samovražda,
psychotická porucha
|
|
mánia,
bipolárne poruchy, myšlienky na vraždu
|
Poruchy
nervového systému
|
bolesť
hlavy, závrat*, zníženie
koncentrá-
cie
|
synkopa,
migréna, porucha pamäti slabosť,
hypoestézia,
hyperestézia, parestézia, tremor, porucha chuti, nočné mory, ospanlivosť
|
periférna neuropatia
|
kóma, kŕče, paréza tváre
|
|
cerebrálna ischémia
|
Poruchy oka
|
|
neostré videnie,
bolesť oka, zápal oka, xeroftalmia
|
krvácanie do
sietnice
|
zraková
neuropatia, papiloedém, poškodenie ciev sietnice, retinopatia, vred rohovky
|
strata zraku
|
serózne
odlúčenie sietnice
|
|
|
Tabuľka 9: Nežiaduce účinky hlásené v klinických skúšaniach a po uvedení lieku na trh pri monoterapii Pegasysom u pacientov s HBV alebo s HCV alebo v kombinácii s ribavirínom u HCV pacientov
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Poruchy
ucha a labyrintu
|
|
vertigo, bolesť
ucha
|
strata sluchu
|
|
|
|
Poruchy
srdca a srdcovej činnosti
|
|
tachykardia,
periférny edém, palpitácie,
|
|
infarkt
myokardu, kongestívne zlyhanie srdca, kardiomyopatia, angína, arytmia, fibrilácia predsiene, perikarditída, supra - vertikulárna tachykardia
|
|
|
Poruchy ciev
|
|
sčervenanie
|
hypertenzia
|
krvácanie do
mozgu, vaskulitída
|
|
periférna
ischémia
|
Poruchy
dýchacej sústavy hrudníka amediastína
|
dýchavica
|
námahová
dýchavica, krvácanie
z nosa, zápal nosohltana,
kongescia
prínosných dutín, nádcha, kongescia nosovej sliznice, bolesť hrdla
|
sipot
|
intersticiálna
pneumónia, vrátane úmrtia, pľúcna embólia
|
|
|
Poruchy
gastrointesti nál-neho traktu
|
hnačka*,
nevoľnosť*, bolesť brucha*
|
vracanie,
dyspepsia, dysfágia, ulcerácia dutiny ústnej, krvácanie ďasien, glositída, stomatitída, plynatosť, sucho v ústach
|
gastrointestin
álne krvácanie
|
peptický vred,
pankreatitída
|
|
ischemická
kolitída
|
Poruchy
pečene a žlčových ciest
|
|
|
porucha
funkcie pečene
|
zlyhanie pečene,
cholangitída, stukovatenie pečene
|
|
|
Poruchy
kože a podkožného tkaniva
|
alopécia,
dermatití- da, svrbenie, suchá koža
|
psoriáza,
urtikária, ekzém, vyrážka, zvýšené potenie, kožná porucha, fotosenzitivita, nočné potenie
|
|
|
Stevens-
Johnsonov syndróm, toxická epidermálna nekrolýza, angioedém, erythema multiforme
|
|
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Poruchy
kostrovej a svalovej sústavy a
spojivového
tkaniva
|
myalgia,
artralgia
|
bolesť chrbta,
artritída, svalová slabosť, bolesť
kostí, bolesť
šije, bolesť svalov a kostrového systému, svalové kŕče
|
|
myozitída
|
|
rabdomyo- lýza
|
Poruchy
obličiek a močo- vých ciest
|
|
|
|
renálna
insuficiencia
|
|
|
Poruchy
reprodukčné ho systému a prsníkov
|
|
impotencia
|
|
|
|
|
Celkové
poruchy a reakcie
v mieste podania
|
pyrexia,
zimnica* bolesť*, asténia, únava, reakcia
v mieste podania injekcie*, citlivosť*
|
bolesť na
hrudníku, príznaky podobné chrípke, malátnosť, letargia, návaly tepla, smäd
|
|
|
|
|
Laboratórne
a funkčné vyšetrenia
|
|
úbytok
hmotnosti
|
|
|
|
|
Úrazy,
otravy a komplikácie liečebného postupu
|
|
|
|
predávkovanie
liekom
|
|
|
*Tieto nežiaduce reakcie boli časté (
≥1/100 až < 1/10) u CHB pacientov liečených Pegasysom v monoterapii.
Popis vybraných nežiaducich reakciíLaboratórne hodnoty
Liečbu Pegasysom sprevádzali nasledovné odchýlky laboratórnych parametrov: zvýšenie ALT, zvýšenie bilirubínu, poruchy rovnováhy elektrolytov (hypokaliémia, hypokalciémia, hypofosfatémia), hyperglykémia, hypoglykémia a zvýšenie triglyceridov (pozri časť 4.4). U oboch spôsobov liečby, t.j. pri použití Pegasysu v monoterapii aj v kombinácii s ribavirínom sa u 2 % pacientov pozoroval vzostup hladín ALT, ktorý si vyžiadal úpravu dávkovania alebo ukončenie liečby.
Liečba Pegasysom bola spojená s poklesom hematologických parametrov (leukopénia, neutropénia, lymfopénia, trombocytopénia a pokles hemoglobínu), ktoré sa po úprave dávkovania obyčajne zlepšili a vrátili na úroveň spred liečby v priebehu 4 - 8 týždňov po ukončení liečby (pozri časti 4.2 a 4.4).
Mierna neutropénia (ANC: 0,749 – 0,5 x 109/l) sa pozorovala u 24 % (216/887) pacientov a ťažká neutropénia (ANC: < 0,5 x 109/l) u 5 % (41/887) pacientov, ktorí dostávali Pegasys v dávke
180 mikrogramov v kombinácii s ribavirínom v dávke 1 000 mg alebo 1 200 mg počas 48 týždňov.
Protilátky proti interferónu
U 1 – 5 % pacientov liečených Pegasysom sa zistila prítomnosť neutralizačných protilátok. Podobne ako v prípade ďalších interferónov, vyšší výskyt neutralizačných protilátok sa pozoroval aj pri
chronickej hepatitíde B. Avšak pri žiadnej z týchto chorôb to nesúviselo s nedostatočnou terapeutickou
odpoveďou.
Funkcia štítnej žľazyLiečbu Pegasysom sprevádzali klinicky významné odchýlky hodnôt parametrov štítnej žľazy, ktoré si vyžadovali klinický zásah (pozri časť 4.4). Výskyt pozorovaných odchýlok (4,9 %) u pacientov
liečených Pegasysom v kombinácii s ribavirínom (NV15801) je podobný ako u pacientov liečených
inými interferónmi.
Laboratórne hodnoty u pacientov súčasne infikovaných vírusmi HIV-HCVHoci hematologická toxicita neutropénie, trombocytopénie a anémie sa vyskytovala častejšie u HIV- HCV pacientov, väčšina prípadov sa dala zvládnuť úpravou dávkovania a použitím rastových faktorov a vzácne došlo k predčasnému ukončeniu liečby. Pokles hladín ANC pod 500 buniek/mm3 sa
pozoroval u 13 % a 11 % pacientov, ktorí dostávali Pegasys v monoterapii a v kombinácii v uvedenom poradí. Pokles počtu krvných doštičiek pod 50 000/mm3 sa pozoroval u 10 % a 8 % pacientov, ktorí dostávali Pegasys v monoterapii a v kombinácii v uvedenom poradí. Anémia (hemoglobín < 10 g/dl)
sa popísala u 7 % a 14 % pacientov liečených Pegasysom v monoterapii a v kombinácii v uvedenom
poradí.
Pediatrická populáciaChronická hepatitída CV klinickom skúšaní so 114 pediatrickými pacientmi (vo veku 5 až 17 rokov) liečenými samotným Pegasysom alebo v kombinácii s ribavirínom (pozri časť 5.1) boli úpravy dávky potrebné u približne jednej tretiny pacientov najčastejšie kvôli neutropénii a anémii. Vo všeobecnosti bol bezpečnostný profil pozorovaný u pediatrických pacientov podobný ako profil pozorovaný u dospelých. V štúdii pediatrických pacientov najrozšírenejšie nežiaduce reakcie u pacientov liečených kombinovanou liečbou Pegasysom a ribavirínom počas až 48 týždňov boli ochorenie podobné chrípke (91 %), bolesť hlavy (64 %), gastrointestinálne ochorenie (56 %) a reakcie v mieste podania injekcie (45 %). Úplný zoznam nežiaducich reakcií hlásených v tejto liečebnej skupine (n = 55) je uvedený v tabuľke 10. Sedem pacientov užívajúcich kombinovanú liečbu Pegasysom a ribavirínom počas 48 týždňov prerušilo liečbu s bezpečnostných dôvodov (depresia, abnormálne hodnotenie psychického stavu, prechodná slepota, exudáty na sietnici , hyperglykémia, diabetes mellitus typu 1 a anémia). Väčšina nežiaducich reakcií zaznamenaných v štúdii bola mierna alebo stredne závažná. Závažné nežiaduce reakcie sa zaznamenali u 2 pacientov v skupine s kombinovanou liečbou Pegasysom plus ribavirín (hyperglykémia a cholecystektómia).
Tabuľka 10: Nežiaduce reakcie hlásené u pediatrických pacientov infikovaných vírusom HCVpripisované Pegasysu plus ribavirínu v štúdii NV17424Telový systém
| Veľmi časté
| Časté
|
Infekcie a nákazy
|
| infekčná mononukleóza,
streptokoková faryngitída, chrípka, vírusová gastroenteritída, kandidóza, gastroenteritída, zubný absces, hordeolum, infekcia močových ciest, zápal nosohltana
|
Poruchy krvi a lymfatického
systému
|
| anémia
|
Poruchy metabolizmu a výživy
| zníženie chute do jedla
| hyperglykémia, diabetes mellitus
typu 1
|
T
elový systém
|
V
eľmi časté
|
Č
asté
|
Psychické poruchy
|
insomnia
|
depresia, úzkosť, halucinácie,
nenormálne správanie, agresia, hnev, zníženie pozornosti/neusporiadaná hyperaktivita
|
Poruchy nervového systému
|
bolesť hlavy
|
závrat, porucha pozornosti, migréna
|
Poruchy oka
|
|
prechodná slepota, exudáty na
sietnici, zhoršenie videnia, podráždenie oka, bolesť oka, svrbenie oka
|
Poruchy ucha a labyrintu
|
|
bolesť ucha
|
Poruchy dýchacej sústavy, hrudníka
a mediastína
|
|
dyspnoe, epistaxa
|
Poruchy gastrointestinálneho traktu
|
gastrointestinálna porucha
|
bolesť v nadbrušku, stomatitída,
nevoľnosť, aftózna stomatitída, orálna porucha
|
Poruchy kože a
podkožného tkaniva
|
vyrážka, svrbenie, alopécia
|
opuch tváre, liekový exantém
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
|
muskuloskeletálna bolesť
|
bolesť chrbta, bolesť končatín
|
Poruchy obličiek a močových ciest
|
|
dyzúria, inkontinencia, porucha
močového traktu
|
Poruchy reprodukčného systému a
prsníkov
|
|
výtok z pošvy
|
Celkové poruchy a reakcie v mieste
podania
|
ochorenie podobné chrípke, reakcia
v mieste podania injekcie, iritabilita, únava
|
horúčka, hematóm v mieste podania
injekcie do žily, , bolesť
|
Laboratórne a funkčné vyšetrenia
|
|
abnormálny psychiatrický nález
|
Chirurgické a liečebné postupy
|
|
extrakcia zuba, cholecystektómia
|
Sociálne podmienky
|
|
problém s učením
|
U pediatrických pacientov sa pozorovala inhibícia rastu (pozri časť 4.4). V porovnaní
s východiskovým stavom sa u pediatrických pacientov po 48 týždňoch terapie kombinovanou liečbou
Pegasysom plus ribavirínom pediatrických pacientov preukázalo oneskorenie v náraste hmotnosti
a výšky. Počas liečby klesli percentily „hmotnosti vzhľadom na vek“ a percentily„výšky vzhľadom na vek“ v porovnaní s normálnou populáciou. Na konci 2-ročného sledovania po liečbe sa väčšina jedincov vrátila k východiskovým percentilom normálnej rastovej krivky pre hmotnosť a výšku (priemerný percentil hmotnosti bol 64 % na začiatku a 60 % 2 roky po liečbe; priemerný percentil výšky bol 54 % na začiatku a 56 % 2 roky po liečbe). Na konci liečby sa u 43 % jedincov znížil percentil hmotnosti o 15 percentilov alebo viac a u 25 % sa znížil percentil výšky o 15 percentilov alebo viac v porovnaní s normálnou rastovou krivkou. 2 roky po liečbe bolo 16 % osôb stále 15 percentilov alebo viac pod svojou východiskovou krivkou hmotnosti a 11 % 15 percentilov alebo viac pod svojou východiskovou krivkou výšky.
Laboratórne hodnotyZníženie hemoglobínu, počtu neutrofilov a trombocytov môže vyžadovať zníženie dávky alebo trvalé vysadenie liečby (pozri tabuľku 3 a tabuľku 7). Väčšina patologických zmien v laboratórnych
parametroch zaznamenaných počas klinického skúšania sa v krátkom čase po ukončení liečby vrátila
na východiskovú úroveň.
4.9 PredávkovanieOpísali sa prípady predávkovania v rozsahu od dvoch injekcií podaných počas 2 nasledujúcich dní
(namiesto týždenného intervalu) až po každodenné podávanie injekcií počas 1 týždňa (t.j.
1 260 mikrogramov/týždeň). U žiadneho z týchto pacientov sa neobjavili nezvyčajné resp. závažné alebo liečbu limitujúce udalosti. V klinických štúdiách pri karcinóme obličiek a chronickej myeloidnej leukémii sa podávali týždenné dávky až do 540 mikrogramov a 630 mikrogramov. Medzi toxické
prejavy limitujúce dávkovanie patrila únava, elevácia pečeňových enzýmov, neutropénia, trombocytopénia, čo zodpovedá interferónovej liečbe.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Imunostimulanciá, interferóny, ATC kód: L03A B11
Spôsob účinku
Konjugácia reagentu PEG (bis-monometoxypolyetylénglykol) s interferónom alfa-2a vedie k vzniku
pegylovaného interferónu alfa-2a (Pegasys). Pegasys in vitro vykazuje antivírusové a antiproliferatívne účinky, ktoré sú charakteristické pre interferón alfa-2a.
Interferón alfa-2a je konjugovaný s bis-[monometoxypolyetylénglykolom] v rozsahu substitúcie jedného mólu polyméru/mól bielkoviny. Priemerná molekulová hmotnosť je asi 60 000, z ktorej podiel bielkoviny tvorí približne 20 000.
Farmakodynamické účinky
U pacientov s hepatitídou C reagujúcich na liečbu Pegasysom 180 mikrogramov dochádza
k bifázickému poklesu hladín HCV RNA. Prvá fáza poklesu sa objavuje 24 až 36 hodín po prvej dávke Pegasysu. Po nej dochádza k druhej fáze poklesu, ktorá pretrváva počas nasledovných 4 - 16 týždňov u pacientov, ktorí dosiahnu pretrvávajúcu odpoveď na liečbu. Ribavirín nemá žiadny významný vplyv na začiatočnú vírusovú kinetiku počas prvých 4 až 6 týždňov u pacientov liečených kombináciou ribavirínu a pegylovaného interferónu alfa-2a alebo interferónu alfa.
Klinická účinnosť a bezpečnosť
Chronická hepatitída B
Na všetkých klinických skúšaniach sa zúčastnili pacienti s chronickou hepatitídou B, u ktorých sa zistila aktívna vírusová replikácia meraná ako HBV DNA, zvýšené hladiny ALT a biopsia pečene bola konzistentná s chronickou hepatitídou. V štúdii WV16240 sa zúčastnili pacienti, ktorí boli pozitívni na HBeAg, zatiaľ čo v štúdii WV16241 sa zúčastnili pacienti, ktorí boli negatívni na HBeAg a pozitívni na anti-HBe. V obidvoch štúdiách liečba trvala 48 týždňov a sledovanie po liečbe trvalo 24 týždňov. V obidvoch štúdiách sa porovnával Pegasys plus placebo vs. Pegasys plus lamivudín vs. lamivudín v monoterapii. Do týchto klinických skúšaní neboli zaradení pacienti s HBV-HIV koinfekciou.
Miery odpovedí na konci sledovania u týchto dvoch štúdií sú uvedené v tabuľke 11. V štúdii WV16240, primárne koncové ukazovatele na hodnotenie účinnosti boli HBeAg sérokonverzia a HBV- DNA pod 105 kópií/ml. V štúdii WV16241, primárne koncové ukazovatele na hodnotenie účinnosti boli normalizácia ALT a HBV-DNA pod 2 x 104 kópií/ml. HBV DNA sa merala pomocou testu COBAS AMPLICORTM HBV MONITOR (hranica detekcie 200 kópií/ml).
Celkove 283/1351 (21 %) pacientov malo pokročilú fibrózu alebo cirhózu, 85/1351 (6 %) malo cirhózu. Neboli rozdiely v miere odpovede medzi týmito pacientmi a tými bez pokročilej fibrózy alebo cirhózy.
Tabuľka 11:Sérologická, virologická a biochemická odpoveď pri chronickej hepatitíde B
|
HBeAg-pozitívni pacienti
Štúdia WV16240
|
HBeAg-negatívni / anti-HBe-pozitívni pacienti
Štúdia WV16241
|
Parameter odpovede
|
Pegasys
180 µg
&
placebo
(N = 271)
|
Pegasys
180 µg
&
lamivudín
100 mg
(N = 271)
|
lamivudín
100 mg
(N = 272)
|
Pegasys
180 µg
&
placebo
(N = 177)
|
Pegasys
180 µg
&
lamivudín
100 mg
(N = 179)
|
lamivudín
100 mg
(N = 181)
|
HBeAg
sérokonverzia
|
32 %#
|
27 %
|
19 %
|
N/A
|
N/A
|
N/A
|
HBV DNA
odpoveď*
|
32 %#
|
34 %
|
22 %
|
43 %#
|
44 %
|
29 %
|
ALT
normalizácia
|
41 %#
|
39 %
|
28 %
|
59 %#
|
60 %
|
44 %
|
HBsAg
sérokonverzia
|
3 %#
|
3 %
|
0 %
|
3 %
|
2 %
|
0 %
|
|
|
* Pre HBeAg-pozitívnych pacientov: HBV DNA < 105 kópií/ml
Pre HBeAg-negatívnych / anti-HBe-pozitívnych pacientov: HBV DNA < 2 x 104 kópií/ml
# p-hodnota (vs. lamivudín) ≤ 0,01 (stratifikovaný Cochran-Mantel-Haenszelov test)
Histologická odpoveď bola v každej štúdii vo všetkých troch liečebných skupinách podobná; avšak pacienti, u ktorých sa dokázala trvalá odpoveď 24 týždňov po ukončení liečby, s oveľa vyššou pravdepodobnosťou dosiahli tiež histologické zlepšenie.
Všetci pacienti, ktorí ukončili štúdie fázy III, boli vhodní na zaradenie do štúdie s dlhodobým sledovaním (WV16866). V skupine pacientov v štúdii WV16240, ktorí dostávali Pegasys
v monoterapii a boli zaradení do štúdie s dlhodobým sledovaním, stupeň trvalej HBeAg sérokonverzie
12 mesiacov po ukončení terapie bol 48 % (73/153). U pacientov, ktorí dostávali Pegasys
v monoterapii v štúdii WV16241, stupeň HBV DNA odpovede a normalizácie ALT 12 mesiacov po ukončení liečby bol 42 % (41/97) a 59 % (58/99).
Chronická hepatitída C Predpoklad odpovede na liečbuPozrite si časť 4.2 v tabuľke 2.
Závislosť odpovede na liečbu od dávky pri monoterapiiPri priamom porovnaní dávok 90 mikrogramov a 180 mikrogramov bola dávka 180 mikrogramov spojená s lepšou pretrvávajúcou virologickou odpoveďou na liečbu u pacientov s cirhózou, avšak
v štúdii s pacientmi bez cirhózy sa pri dávkach 135 mikrogramov a 180 mikrogramov dosiahli veľmi podobné výsledky.
Potvrdzujúce klinické štúdie u dospelých predtým neliečených pacientovVšetky klinické štúdie zahŕňali pacientov, ktorí predtým nedostávali interferón a u ktorých sa chronická hepatitída C potvrdila prítomnosťou detekovateľných hladín HCV RNA v sére, zvýšenými hladinami ALT (s výnimkou štúdie NR16071) a biopsiou pečene s nálezom chronickej hepatitídy.
Štúdia NV15495 špecificky zahŕňala pacientov s diagnózou cirhózy (približne 80 %) alebo prechodu
do cirhózy (približne 20 %), ktoré sa potvrdili histologicky. Do štúdie NR15961 sa zahrnuli len HIV- HCV koinfikovaní pacienti(pozri tabuľku 20). Títo pacienti mali stabilné HIV ochorenie a priemer počtu CD4 T-buniek bol okolo 500 buniek/μl.
Údaje o liečebných režimoch, dĺžke trvania liečby a výsledkoch štúdií u HCV monoinfikovaných
pacientov a HIV-HCV koinfikovaných pacientov sa uvádzajú v tabuľkách 12, 13, 14 a v tabuľke 20.
Virologická odpoveď na liečbu sa definovala ako nemerateľné hladiny HCV RNA pri vyšetrení COBAS AMPLICOR™ HCV Test, Version 2.0 (detekčný limit: 100 kópií/ml, čo zodpovedá 50 medzinárodným jednotkám/ml). Trvalá odpoveď sa definovala ako jedna negatívna vzorka približne 6 mesiacov po ukončení liečby.
Tabuľka 12:Virologická odpoveď u HCV pacientov
| Monoterapia Pegasysom
| Kombinovaná liečba Pegasysom
|
pacienti s cirhózou aj bez nej
| Pacienti s cirhózou
| pacienti s cirhózou aj bez nej
|
Štúdia NV15496 + NV15497 + NV15801
| Štúdia NV15495
| Štúdia
NV15942
| Štúdia NV15801
|
Pegasys
180 µg
(N = 701)
48 týždňov
| interferón alfa-2a
6 MIU/3 MIU
&
3 MIU
(N = 478)
48 týždňov
| Pegasys
180 µg
(N = 87)
48 týždňov
| interferón alfa-2a
3 MIU
(N = 88)
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200
mg
(N = 436)
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
(N = 453)
48 týždňov
| interferón alfa-2b
3 MIU
&
ribavirín
1000/1200
mg
(N = 444)
48 týždňov
|
Odpoveď
na konci liečby
|
55 - 69 %
|
22 - 28 %
|
44 %
|
14 %
|
68 %
|
69 %
|
52 %
|
Celková
trvalá odpoveď
|
28 - 39 %
|
11 - 19 %
|
30 %∗
|
8 %∗
|
63 %
|
54 %∗∗
|
45 %∗∗
|
∗ 95 % CI pre rozdiel: 11 % až 33 % p = 0,001 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
∗∗ 95 % CI pre rozdiel: 3 % až 16 % p = 0,003 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
Virologické odpovede na liečbu vo vzťahu ku genotypu a vírusovej záťaži pred liečbou u HCV monoinfikovaných pacientov liečených Pegasysom v kombinácii s ribavirínom a v závislosti na genotype, vírusovej záťaži pred liečbou a rýchlej virologickej odpovede v 4. týždni sú zhrnuté
v tabuľke 13 a v tabuľke 14. Výsledky štúdie NV15942 poskytujú racionálne podklady pre odporúčania liečebných režimov na základe genotypu, vírusovej záťaže na začiatku liečby a virologickej odpovede v 4. týždni (pozri tabuľky 1, 13 a 14).
Rozdiel medzi liečebnými režimami nebol vo všeobecnosti ovplyvnený prítomnosťou/neprítomnosťou cirhózy; preto tieto základné charakteristiky neovplyvňujú tieto odporúčania pre liečbu pre
genotypy 1, 2 alebo 3.
Tabuľka 13:Trvalá virologická odpoveď u HCV pacientov po kombinovanej liečbe Pegasysom a ribavirínom v závislosti na genotype a vírusovej záťaži pred liečbou
|
Štúdia NV15942
|
Štúdia NV15801
|
Pegasys
180 µg
&
ribavirín
800 mg
24 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
|
Pegasys
180 µg
&
ribavirín
800 mg
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Interferón alfa-
2b
3 MIU
&
ribavirín
1000/1200 mg
48 týždňov
|
Genotyp 1
Nízka
vírusová záťaž
Vysoká vírusová záťaž
|
29 %(29/101)
41 %(21/51)
16 %(8/50)
|
42 %(49/118) ∗
52 %(37/71)
26 %(12/47)
|
41 %(102/250) ∗
55 %(33/60)
36 %(69/190)
|
52 %(142/271) ∗
65 %(55/85)
47 %(87/186)
|
45 %(134/298)
53 %(61/115)
40 %(73/182)
|
36 %(103/285)
44 %(41/94)
33 %(62/189)
|
Genotyp 2/3
Nízka
vírusová záťaž
Vysoká vírusová záťaž
|
84 %(81/96)
85 %(29/34)
84 %(52/62)
|
81 %(117/144)
83 %(39/47)
80 %(78/97)
|
79 %(78/99)
88 %(29/33)
74 %(49/66)
|
80 %(123/153)
77 %(37/48)
82 %(86/105)
|
71 %(100/140)
76 %(28/37)
70 %(72/103)
|
61 %(88/145)
65 %(34/52)
58 %(54/93)
|
Genotyp 4
|
(0/5)
|
(8/12)
|
(5/8)
|
(9/11)
|
(10/13)
|
(5/11)
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; Vysoká vírusová záťaž = > 800 000 IU/ml
* Pegasys 180 µg & ribavirín 1000/1200 mg, 48 týždňov v porovnaní s Pegasysom 180 µg & ribavirínom 800 mg
48 týždňov: Odds Ratio (95 % CI) = 1,52 (1,07 až 2,17), p=0,020 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
* Pegasys 180 µg & ribavirín 1000/1200 mg, 48 týždňov v porovnaní s Pegasysom 180 µg & ribavirínom 1000/1200 mg,
24 týždňov: Odds Ratio (95 % CI) = 2,12 (1,30 až 3,46), p=0,002 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
Možnosť zvážiť skrátenie dĺžky trvania liečby na 24 týždňov u pacientov s genotypom 1 a 4 sa sledovala na podklade dosiahnutej trvalej virologickej odpovede u pacientov s rýchlou virologickou odpoveďou v 4. týždni v štúdiách NV15942 a ML17131 (pozri tabuľku 14).
Štúdia NV15942
| Štúdia ML17131
|
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Genotyp 1
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 90 % (28/31)
93 % (25/27)
75 % (3/4)
| 92 % (47/51)
96 % (26/27)
88 % (21/24)
| 77 % (59/77)
80 % (52/65)
58 % (7/12)
| Genotyp 1 nie RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 24 % (21/87)
27 % (12/44)
21 % (9/43)
| 43 % (95/220)
50 % (31/62)
41 % (64/158)
| -
-
-
| Genotyp 4 RVR
| (5/6)
| (5/5)
| 92 % (22/24)
| Genotyp 4 nie RVR
| (3/6)
| (4/6)
| -
|
|
|
Tabuľka 14: Trvalá virologická odpoveď v závislosti na rýchlej virologickej odpovedi v 4. týždni pre genotyp 1 a 4 po kombinovanej liečbe Pegasysom a ribavirínom u HCV pacientovNízka vírusová záťaž = ≤ 800 000 IU/ml; Vysoká vírusová záťaž = > 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedegovateľná HCV RNA) v 4. týždni a nedegovateľná HCV RNA v 24 týždni.
Údaje, i keď obmedzené, ukazujú, že skrátenie času na 24 týždňov, sa môže spájať s vysokým rizikom relapsu (pozri tabuľku 15).
Tabuľka 15:Relaps vo virologickej odpovedi na konci liečby u populácie s rýchlou virologickou odpoveďou
| Štúdia NV15942
| Štúdia NV15801
|
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Genotyp 1 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 6,7 % (2/30)
3,8 % (1/26)
25 % (1/4)
| 4,3 % (2/47)
0 % (0/25)
9,1 % (2/22)
| 0 % (0/24)
0 % (0/17)
0 % (0/7)
|
Genotyp 4 RVR
| (0/5)
| (0/5)
| 0 % (0/4)
|
Možnosť skrátenia liečby na 16 týždňov u pacientov genotypu 2 alebo 3 bola skúmaná na základe
trvalej virologickej odpovede pozorovanej u pacientov s rýchlou virologickou odpoveďou v 4. týždni v štúdii NV17317 (pozri tabuľku 16).
V štúdii NV17317 všetci pacienti infikovaní vírusovým genotypom 2 alebo 3 dostávali Pegasys 180ug subkutánne raz týždenne a ribavirín v dávke 800 mg a boli randomizovaní na liečbu počas 16 alebo 24 týždňov. Celková liečba počas 16 týždňov viedla ku nižšej trvalej virologickej odpovedi (65 %) než liečba počas 24 týždňov (76 %) (p<0,0001).
Trvalá virologická odpoveď dosiahnutá po 16. týždňoch liečby a po 24. týždňoch liečby sa sledovala retrospektívnou analýzou pacientov, ktorí boli HCV RNA negatívni v 4. týždni a mali iniciálne LVL (pozri tabuľku 16).
Tabuľka 16:Trvalá virologická odpoveď celkovo a na základe rýchlej virologickej odpovede v 4. týždni pre genotyp 2 alebo 3 po kombinovanej liečbe liekom Pegasysoms ribavirínom u HCV pacientovŠtúdia NV17317
|
a
| Pegasys 180 µg
&
ribavirín
800 mg
16 týždňov
| Pegasys 180 µg
&
ribavirín
800 mg
24 týždňov
| Rozdiel v liečbe
[95 %CI]
| p-hodnota
|
Genotyp 2 alebo 3
| 65 % (443/679)
| 76 % (478/630)
| -10,6 % [-15,5 %; -0,06 %]
| p<0,0001
|
Genotyp 2 alebo 3 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 82 % (378/461)
89 % (147/166)
78 % (231/295)
| 90 % (370/410)
94 % (141/150)
88 % (229/260)
| -8,2 % [-12,8 %; -3,7 %]
-5,4 % [-12 %; 0,9 %]
-9,7 % [-15,9 %;-3,6 %]
| p=0,0006
p=0,11
p=0,002
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž => 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedetegovateľné hladiny HCV RNA) v 4. týždni
V súčasnosti nie je jasné, či vyššia dávka ribavirínu (napr. 1 000/2 000 mg/deň podľa telesnej hmotnosti) vedie k vyššej trvalej virologickej odpovedi (SVR) než dávka 800 mg/deň, keď je liečba skrátená na 16 týždňov.
Údaje naznačujú, že skrátenie liečby na 16 týždňov sa môže spájať so zvýšeným rizikom relapsu
(pozri tabuľku 17).
Tabuľka 17: Relaps vo virologickej odpovedi po ukončení liečby u pacientov genotypu 2 alebo 3s rýchlou virologickou odpoveďou
|
Štúdia NV17317
|
|
Pegasys
180 µg
&
ribavirín
800 mg
16 týždňov
|
Pegasys
180 µg
&
ribavirín
800 mg
24 týždňov
|
Rozdiel v liečbe
[95 %CI]
|
p hodnota
|
Genotyp 2 alebo 3 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
15 % (67/439)
6 % (10/155)
20 % (57/284)
|
6 % (23/386)
1 % (2/141)
9 % (21/245)
|
9,3 % [5,2 %; 13,6 %]
5 % [0,6 % ; 10,3 %]
11,5 % [5,6 % ; 17,4 %]
|
p<0,0001
p=0,04
p=0,0002
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž = > 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedetegovateľné hladiny HCV RNA) v 4. týždni
Lepšia účinnosť Pegasysu v porovnaní s interferónom alfa-2a sa ukázala aj na histologickej odpovedi, vrátane pacientov s cirhózou a/alebo HIV-HCV koinfekciou.
Dospelí pacienti s chronickou hepatitídou C, ktorí neodpovedali na predchádzajúcu liečbu V štúdii MV17150 boli pacienti, ktorí neodpovedali na predchádzajú liečbu pegylovaným interferónom alfa-2b a ribavirínom, boli randomizovaní do štyroch rôznych liečebných skupín:
• Pegasys 360 µg/týždeň počas 12 týždňov a následne 180 µg/týždeň počas ďalších 60 týždňov;
• Pegasys 360 µg/týždeň počas 12 týždňov a následne 180 µg/týždeň počas ďalších 36 týždňov;
• Pegasys 180 µg/týždeň počas 72 týždňov;
• Pegasys 180 µg/týždeň počas 48 týždňov.
Všetci pacienti užívali ribavirín (1 000 alebo 1 200 mg/deň) v kombinácii s Pegasysom. Všetky
liečebné skupiny boli následne sledované počas 24-týždňového obdobia bez liečby.
Na základe viacnásobnej regresnej analýzy a súhrnnej skupinovej analýzy hodnotiacej vplyv dĺžky trvania liečby a podávania indukčnej dávky sa jednoznačne stanovilo, že liečba v trvaní 72 týždňov je primárnym faktorom dosiahnutia trvalej virologickej odpovede. Rozdiely v trvalej virologickej odpovedi (SVR) podmienené dĺžkou trvania liečby, demografickými ukazovateľmi a najlepšími odpoveďami na predchádzajúcu liečbu sú uvedené v tabuľke 18.
Tabuľka 18: Virologická odpoveď v 12. týždni (VR) a trvalá virologická odpoveď (SVR) u pacientov, ktorí neodpovedali na liečbu kombináciou peginterferónu alfa-2b a ribavirínu a ktorí dosiahli virologickú odpoveď v 12. týždni po liečbe kombináciou Pegasysu a ribavirínu
| Štúdia MV17150
|
|
|
| Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
72 alebo 48 týždňov (N = 942) pacienti s
VR v týždni 12 a
(N = 876)
| Pegasys 360/180
alebo 180 μg
&
ribavirín
1000/1200 mg
72 týždňov
(N = 473)
SVR u pacientov s VR v týždni 12 b (N = 100)
| Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
48 týždňov
(N = 469)
SVR u pacientov s VR v týždni 12 b (N = 57)
|
Celková trvalá odpoveď
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 18 % (157/876)
35 % (56/159)
14 % (97/686)
| 57 % (57/100)
63 % (22/35)
54 % (34/63)
| 35 % (20/57)
38 % (8/21)
32 % (11/34)
|
Genotyp 1/4
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 17 % (140/846)
35 % (54/154)
13 % (84/663)
| 55 % (52/94)
63 % (22/35)
52 % (30/58)
| 35 % (16/46)
37 % (7/19)
35 % (9/26)
|
Genotyp 2/3
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 58 % (15/26)
(2/5) (11/19)
| (4/5)
—
(3/4)
| (3/10)
(1/2) (1/7)
|
Prítomnosť cirhózy
Cirhóza
Neprítomnosť cirhózy
|
8 % (19/239)
22 % (137/633)
|
(6/13)
59 % (51/87)
|
(3/6)
34 % (17/50)
|
|
Štúdia MV17150
|
|
|
|
Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
72 alebo 48 týždňov (N = 942) pacienti s
VR v týždni 12 a
(N = 876)
|
Pegasys 360/180
alebo 180 μg
&
ribavirín
1000/1200 mg
72 týždňov
(N = 473)
SVR u pacientov s VR v týždni 12 b (N = 100)
|
Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
48 týždňov
(N = 469)
SVR u pacientov s VR v týždni 12 b (N = 57)
|
Najlepšia odpoveď počas predchádzajúcej liečby
Pokles u HCV RNA ≥2log10
Pokles u HCV RNA <2log10
Chýbanie najlepšej odpovede
|
28 % (34/121)
12 % (39/323)
19 % (84/432)
|
68 % (15/22)
64 % (16/25)
49 % (26/53)
|
(6/12) (5/14)
29 % (9/31)
|
Vysoká vírusová záťaž = > 800 000 IU/ml, nízka vírusová záťaž = ≤ 800 000 IU/ml;
a Pacienti, ktorí dosiahli potlačenie aktivity vírusu v 12. týždni (nedetegovateľná HCV RNA definovaná ako < 50 IU/ml) boli považovaní za pacientov s dosiahnutou virologickou odpoveďou v 12. týždni. Pacienti, ktorým chýbali výsledky HCV RNA
v
12. týždni boli vylúčení z analýzy.
b Pacienti, ktorí dosiahli potlačenie aktivity vírusu v 12. týždni, ale chýbali im výsledky HCV RNA na konci sledovania boli považovaní za pacientov, neodpovedajúcich na liečbu.
V štúdii HALT-C boli pacienti s chronickou hepatitídou C a pokročilou fibrózou alebo cirhózou, ktorí neodpovedali na predchádzajúcu liečbu interferónom alfa alebo pegylovaným interferónom alfa
v monoterapii alebo v kombinácii s ribavirínom, liečení Pegasysom 180 µg/týždeň a ribavirínom
1 000/1 200 mg denne. Pacienti, ktorí po 20 týždňoch liečby dosiahli nedetegovateľné hladiny
HCV RNA, pokračovali v kombinovanej liečbe Pegasysom a ribavirínom trvajúcej celkovo
48 týždňov a po ukončení liečby boli sledovaní 24 týždňov. Pravdepodobnosť trvalej virologickej odpovede sa líšila v závislosti od predchádzajúceho režimu liečby; pozri tabuľku 19.
Tabuľka 19:Trvalá virologická odpoveď v štúdii HALT-C uvedená podľa predchádzajúceho režimu liečby u pacientov, ktorí naňneodpovedali Predchádzajúca liečba Pegasys 180 µg a
 ribavirín
ribavirín 1 000/1 200 mg počas 48 týždňov
Interferón 27 % (70/255)
Pegylovaný interferón 34 % (13/38)
Interferón a ribavirín 13 % (90/692)
Pegylovaný interferón a ribavirín 11 % (7/61) HIV-HCV koinfikovaní pacientiVirologické odpovede u pacientov, ktorí sú liečení s Pegasysom v monoterapii a s Pegasysom a ribavirínom v kombinácii v závislosti na genotype a vírusovej záťaži pred liečbou pre HIV-HCV koinfikovaných pacientov sú zhrnuté nižšie v tabuľke 20.
Tabuľka 20:Trvalá virologická odpoveď po liečbe Pegasysom v kombinácii s ribavirínom v závislosti na genotype a vírusovej záťaži u HIV-HCV súčasne infikovaných pacientov pred liečbouŠtúdia NR15961
|
| Interferón alfa-2a
3 MIU
&
ribavirín 800 mg
48 týždňov
| Pegasys
180 µg
&
placebo
48 týždňov
| Pegasys
180 µg
&
ribavirín 800 mg
48 týždňov
|
Všetci pacienti
| 12 % (33/285)*
| 20 % (58/286) *
| 40 % (116/289) *
|
Genotyp 1
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
7 % (12/171)
19 % (8/42)
3% (4/129)
|
14 % (24/175)
38 % (17/45)
5 % (7/130)
|
29 % (51/176)
61 % (28/46)
18 % (23/130)
|
Genotyp 2-3
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
20 % (18/89)
27 % (8/30)
17 % (10/59)
|
36 % (32/90)
38 % (9/24)
35 % (23/66)
|
62% (59/95)
61 % (17/28)
63 % (42/67)
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž = > 800 000 IU/ml
* Pegasys 180 µg & ribavirín 800 mg oproti Interferón alfa-2a 3 MIU, ribavirín 800 mg: Pomer pravdepodobnosti (95 % CI)=5,40 (3,42 – 8,54),… p-hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0001
* Pegasys 180 µg & ribavirín 800 mg oproti Pegasys 180 µg: Pomer pravdepodobnosti (95 % CI)=2,89 (1,93 – 4,32),… p- hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0001
* Interferón alfa-2a 3 MIU & ribavirín 800 mg oproti Pegasys 180 µg: Pomer pravdepodobnosti (95 % CI)=0,53 (0,33 –
0,85),… p-hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0084
Nasledujúca štúdia (NV18209) u pacientov s koinfekciou HCV genotyp 1 a HIV porovnávala liečbu Pegasysom 180 µg týždenne s dávkou ribavirínu 800 mg alebo s dávkou ribavirínu 1 000 mg (<75 kg telesnej hmotnosti)/1 200 mg (≥75 kg telesnej hmotnosti) denne počas 48 týždňov. Štúdia nebola dizajnovaná na preukázanie účinnosti. Bezpečnostné profily u obidvoch skupín s ribavirínom boli konzistentné so známym bezpečnostným profilom pri kombinovanej liečbe Pegasysom a ribavirínom
a nepoukazujú na žiadne relevantné rozdiely, okrem mierneho nárastu anémie v skupine s vyššou dávkou ribavínu.
HCV pacienti s normálnymi hladinami ALTV štúdii NR16071 náhodne vybratí HCV pacienti s normálnymi hodnotami ALT užívali Pegasys
180 µg/týždeň a ribavirín 800 mg/deň počas 24 alebo 48 týždňov. Potom nasledoval 24 týždňové obdobie bez liečby alebo pacienti boli bez liečby po dobu 72 týždňov. SVR popisované v liečebných ramenách tejto štúdie boli podobné zodpovedajúcim liečebným ramenám zo štúdie NV15942.
Deti a dospievajúciV riešiteľom sponzorovanej klinickej štúdii CHIPS (Chronic Hepatitis C International Paediatric Study) 65 pediatrických pacientov (6-18 rokov) s chronickou HCV infekciou boli pacienti liečení Pegasysom 100 μg/m2 s.c. raz týždenne a ribavirínom 15 mg/kg/deň 24 týždňov (genotypy 2 a 3) alebo 48 týždňov (všetky iné genotypy). Predbežné a obmedzené údaje bezpečnosti neukázali žiadny evidentný odklon od známeho profilu bezpečnosti pri kombinovanej liečbe u dospelých pacientov s chronickou HCV infekciou, ale, dôležité je, že nebol hlásený potenciálny nárast. Výsledky účinnosti boli podobné výsledkom hlásených u dospelých.
V štúdii NV17424 (PEDS-C) boli predtým neliečení pediatrickí pacienti vo veku 5 až 17 rokov (55 % vo veku < 12 rokov) s kompenzovanou chronickou hepatitídou C a detekovateľnou HCV RNA liečení Pegasysom v dávke180 μg x BSA/1,73 m2 jedenkrát týždenne počas 48 týždňov s alebo bez ribavirínu v dávke 15 mg/kg/deň . Všetci pacienti boli po liečbe sledovaní počas 24 týždňov. Celkovo 55 pacientov bolo liečených úvodnou kombinovanou liečbou Pegasysom plus ribaviríno, z nich 51 %
bolo žien, 82 % belochov a 82 % bolo infikovaných vírusom HCV genotyp 1. Výsledky štúdie účinnosti u týchto pacientov sú zhrnuté v tabuľke 21.
Tabuľka 21: Pretrvávajúca virologická odpoveď v štúdii NV17424
| Pegasys
180 µg x BSA/1,73 m² +
ribavirín 15 mg/kg (N = 55)*
|
Všetky genotypy HCV**
| 29 (53 %)
|
HCV genotyp 1
| 21/45 (47 %)
|
HCV genotyp 2 a 3
| 8/10 (80 %)
|
*Výsledky naznačujú nedetegovateľnú HCV-RNA definovanú ako HCV RNA menej ako 50 IU/ml 24 týždňov po liečbe použitím AMPLICOR HCV testu v2.
**Plánované trvanie liečby bolo 48 týždňov bez ohľadu na genotyp
5.2 Farmakokinetické vlastnosti
Absorpcia
Po jednorazovej subkutánnej injekcii Pegasysu 180 mikrogramov zdravým jedincom sa merateľné sérové koncentrácie peginterferónu alfa-2a zistili v priebehu 3 až 6 hodín. Počas 24 hodín dosiahli namerané hladiny 80 % maximálnej koncentrácie v sére. Absorpcia Pegasysu je plynulá, pričom maximálne hladiny v sére sa dosiahnu 72 až 96 hodín po podaní. Absolútna biologická dostupnosť Pegasysu je 84 % a je podobná ako pri interferóne alfa-2a.
Distribúcia
Peginterferón alfa-2a sa nachádza najmä v krvnom obehu a extracelulárnej tekutine, čoho dôkazom je hodnota distribučného objemu v rovnovážnom stave (Vd) 6 - 14 litrov u ľudí po intravenóznom podaní. V štúdiách hmotnostnej rovnováhy, distribúcie látky v tkanivách a celotelovej autorádioluminografie vykonaných u potkanov sa zistilo, že okrem vysokej koncentrácie v krvi sa peginterferón alfa-2a dostáva do pečene, obličiek a kostnej drene.
Biotransformácia
Metabolizmus Pegasysu ešte nie je úplne objasnený, avšak štúdie na potkanoch naznačujú, že obličky sú hlavným exkrečným orgánom rádioaktívne označeného materiálu.
Eliminácia
U ľudí je hodnota systémového klírensu peginterferónu alfa-2a približne 100- násobne nižšia ako natívneho interferónu alfa-2a. Po intravenóznom podaní je terminálny polčas peginterferónu alfa-2a u zdravých osôb približne 60 – 80 hodín v porovnaní s 3 – 4 hodinami v prípade štandardného interferónu. Terminálny polčas po subkutánnom podaní pacientom je dlhší so strednou hodnotou 160 hodín (84 – 353 hodín). Terminálny polčas môže odrážať eliminačnú fázu látky, ale taktiež plynulú absorpciu Pegasysu.
Linearita/nelinearita
U zdravých osôb a u pacientov s chronickou hepatitídou B alebo C sa pri dávkovaní raz týždenne pozorovalo od dávky závislé zvyšovanie expozície voči Pegasysu.
U pacientov s chronickou hepatitídou B alebo C dochádza po 6 až 8 týždňoch podávania Pegasysu v dávke raz týždenne k dvoj- až trojnásobnému zvýšeniu sérových hladín peginterferónu alfa-2a
v porovnaní s podávaním jednorazovej dávky. Po 8-týždňovom podávaní Pegasysu raz týždenne nedochádza k ďalšej akumulácii. Po 48 týždňoch liečby je pomer medzi maximálnou a minimálnou hladinou približne 1,5 - 2. Sérové koncentrácie peginterferónu alfa-2a pretrvávajú celý 1 týždeň (168 hodín).
Pacienti s poruchou funkcie obličiek
Dysfunkcia obličiek je spojená s mierne zníženou hodnotou pomeru CL/F a predĺženým polčasom. U pacientov (n=3) CLcrea medzi 20 a 40 ml/min bola priemerná hodnota pomeru CL/F o 25 % nižšia ako u pacientov s normálnou funkciou obličiek. U dialyzovaných pacientov s ochorením obličiek
v terminálnej fáze sa zistilo 25 – 45 % zníženie klírensu, pričom dávky 135 mikrogramov u týchto pacientov vedú k podobnej expozícii ako dávky 180 mikrogramov u pacientov s normálnou funkciou
obličiek (pozri časť 4.2).
Pozrite si tiež Súhrn charakteristických vlastností lieku (SmPC) ribavirínu, ak sa Pegasys použije v kombinácii s ribavirínom.
Pohlavie
Farmakokinetika Pegasysu po podaní jednorazovej subkutánnej injekcie bola porovnateľná u zdravých jedincov mužského a ženského pohlavia.
Pediatrická populácia
V populačnej farmakokinetickej štúdii (NR16141) dostávalo 14 detí vo veku 2 až 8 rokov s CHC Pegasys v monoterapii v dávke: 180 µg x BSA/1,73 m2. FK model vytvorený na základe tejto štúdie preukazuje lineárny vplyv BSA na zjavný klírens liečiva v rozmedzí skúmaného veku. Preto nižšie BSA dieťaťa, nižší klírens liečiva a vyššia výsledná expozícia. Predpokladá sa, že priemerná expozícia (AUC) počas dávkovacieho intervalu je o 25 % až 70 % vyššia ako expozícia pozorovaná u dospelých, ktorí dostávajú fixnú dávku 180 µg.
Staršie osoby
U osôb starších ako 62 rokov sa zistila dlhšia absorpcia Pegasysu po jednorazovom podaní subkutánnej injekcie v dávke 180 mikrogramov, hoci stále bola plynulá v porovnaní s mladými zdravými osobami (tmax 115 hodín vs. 82 hodín, osoby staršie ako 62 rokov). Hodnota AUC bola mierne zvýšená (1 663 vs. 1 295 ng.hod/ml), avšak maximálne koncentrácie (9,1 vs. 10,3 ng/ml) boli podobné u osôb starších ako 62 rokov. Na základe expozície voči lieku, farmakodynamickej odpovedi a znášanlivosti je možné prehlásiť, že geriatrickí pacienti si nevyžadujú podávanie nižšej dávky Pegasysu (pozri časť 4.2).
Dysfunkcia pečene
Farmakokinetika Pegasysu u zdravých osôb bola podobná ako u pacientov s hepatitídou B alebo C.
U pacientov s cirhózou (stupeň A podľa Child-Pughovej klasifikácie) a pacientov bez cirhózy sa zistila porovnateľná expozícia a farmakokinetické profily.
Miesto podania
Subkutánne podávanie Pegasysu je nutné obmedziť na oblasť brucha a stehna, pretože stupeň absorpcie hodnotený na základe hodnôt AUC bol o 20 – 30 % vyšší po podaní injekcie do brucha a stehna. V štúdiách po podaní Pegasysu do ramena sa v porovnaní s podaním do brucha alebo stehna zistila znížená expozícia voči Pegasysu.
5.3 Predklinické údaje o bezpečnosti
Neklinické štúdie skúmajúce toxicitu Pegasysu boli limitované v dôsledku druhovej špecifickosti interferónov. Štúdie akútnej a chronickej toxicity sa vykonali u opíc cynomolgus, pričom nálezy pozorované u zvierat dostávajúcich peginterferón boli podobnej povahy ako nálezy vyvolané interferónom alfa-2a.
S Pegasysom sa nevykonali žiadne štúdie reprodukčnej toxicity. Tak ako pri iných interferónoch alfa, aj po podávaní peginterferónu alfa-2a samiciam opíc sa pozorovalo predĺženie menštruačného cyklu. Liečba interferónom alfa-2a viedla k štatisticky významnému zvýšeniu abortívneho účinku u opíc resus. Hoci sa u potomstva narodeného v termíne nezistili žiadne teratogénne účinky, nežiaduce účinky nie je možné vylúčiť u ľudí.
Pegasys plus ribavirín
Ak sa používa v kombinácii s ribavirínom, Pegasys nevyvoláva žiadne účinky u opíc, ktoré by predtým neboli pozorované pri podávaní jednotlivých liečiv v rámci monoterapie. Hlavnou zmenou
v súvislosti s liečbou bola reverzibilná mierna až stredne ťažká anémia, závažnosť ktorej bola vyššia
ako po podávaní jednotlivých liečiv v rámci monoterapie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
chlorid sodný
benzylalkoholnátriumacetát kyselina octová
voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke pri teplote 2°C – 8°C. Neuchovávajte v mrazničke. Naplnené pero uchovávajte vo vonkajšom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
0,5 ml injekčného roztoku v naplnenej injekčnej striekačke (sklo typu I so silikónovou vrstvou)
s pevnou ihlou (z nehrdzavejúcej ocele), piestom (butylová guma s fluórorezinovou vrstvou) a krytom na ihlu (polyizoprén) v naplnenom pere.
Dostupné v baleniach 1, 4 alebo 12 naplnených pier. Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu
Injekčný roztok je určený len na jednorazové použitie. Pred podaním sa má zrakom skontrolovať, či roztok neobsahuje tuhé čiastočky alebo či sa nezmenila jeho farba.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Úplný návod na prípravu a podanie Pegasysu v naplnenom pere je uvedený v písomnej informácii pre používateľov.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Roche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
8. REGISTRAČNÉ ČÍSLA
EU/1/02/221/011
EU/1/02/221/012
EU/1/02/221/013
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 20. jún 2002
Dátum posledného predĺženia: 20. jún 2007
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Pegasys 180 mikrogramov injekčný roztok v naplnenom pere
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každé naplnené pero s 0,5 ml roztoku obsahuje 180 mikrogramov peginterferónu alfa-2a*. Sila vyjadruje množstvo podielu interferónu alfa-2a v peginterferóne alfa-2a bez ohľadu na pegyláciu.
*Liečivo peginterferón alfa-2a je kovalentný konjugát bielkoviny interferónu alfa-2a vyrobený rekombinantnou DNA technológiou v Escherichia coli s bis -[monometoxypolyetylénglykolom].
Účinnosť tohto lieku sa nemá porovnávať s inými pegylovanými alebo nepegylovanými bielkovinami v tej istej terapeutickej skupine. Viac informácií, pozri časť 5.1.
Pomocná látka so známym účinkom: Benzylalkohol (10 mg/1 ml) Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok (injekcia).
Roztok je číry, bezfarebný až svetložltý.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Chronická hepatitída B
Pegasys je indikovaný na liečbu chronickej hepatitídy B (CHB) s pozitívnym obalovým antigénom
hepatitídy B (HBeAg) alebo HBeAg negatívnej chronickej hepatitídy B u dospelých pacientov
s kompenzovaným ochorením pečene a s dôkazom vírusovej replikácie, zvýšenou hladinou ALT a histologicky overeným zápalom pečene a/alebo fibrózy (pozri časti 4.4 a 5.1).
Chronická hepatitída C
Dospelí pacienti
Pegasys je indikovaný na liečbu chronickej hepatitídy C (CHC) u dospelých s pozitívnym nálezom ribonukleovej kyseliny vírusu hepatitídy C (HCV-RNA) v sére. Toto zahŕňa pacientov
s kompenzovanou formou cirhózy pečene a/alebo súčasne infikovaných HIV vírusom s klinicky stabilným obrazom HIV infekcie (pozri časť 4.4).
Optimálny spôsob použitia Pegasysu u pacientov s chronickou hepatitídou C je kombinácia s ribavirínom. Kombinácia Pegasysu a ribavirínu je indikovaná na liečbu u predtým neliečených pacientov a u dospelých pacientov, u ktorých zlyhala predchádzajúca liečba interferónom alfa (pegylovaným alebo nepegylovaným) v monoterapii alebo v kombinovanej liečbe s ribavirínom.
Monoterapia je indikovaná najmä v prípade neznášanlivosti alebo kontraindikácie liečby ribavirínom.
Pediatrickí pacienti vo veku 5 rokov a viac :
Pegasys v kombinácii s ribavirínom je indikovaný na liečbu chronickej hepatitídy C u predtým neliečených detí a dospievajúcich vo veku 5 a viac rokov, u ktorých je prítomná pozitivita sérovej HCV-RNA.
Pri rozhodovaní, či začať v detstve s liečbou, je dôležité vziať do úvahy inhibíciu rastu indukovanú kombinovanou liečbou. Nie je isté, či je inhibícia rastu reverzibilná. Rozhodnutie o liečbe sa má urobiť individuálne pre každý prípad (pozri časť 4.4).
4.2 Dávkovanie a spôsob podávania
Liečbu Pegasysom má začať iba lekár, ktorý má skúsenosti s liečbou pacientov s hepatitídou B alebo
C.
Ak sa Pegasys bude podávať v kombinácii s ribavirínom, prečítajte si tiež súhrn charakteristických vlastností ribavirínu (SmPC).
Dávkovanie
Chronická hepatitída B – dospelí pacienti
Odporúčané dávkovanie a dĺžka liečby Pegasysom u HBeAg-pozitívnych a HBeAg-negatívnych pacientov s chronickou hepatitídou B je 180 mikrogramov raz týždenne počas 48 týždňov subkutánne do brucha alebo do stehna.
Chronická hepatitída C - predtým neliečení dospelí pacienti
Odporúčaná dávka Pegasysu je 180 mikrogramov raz týždenne a podáva sa subkutánne do brucha alebo stehna v kombinácii s perorálnym ribavirínom alebo ako monoterapia.
Dávkovanie ribavirínu pri kombinovanej liečbe s Pegasysom sa uvádza v tabuľke 1. Dávka ribavirínu sa má užívať spolu s jedlom.
Dĺžka liečby
U pacientov s chronickou hepatitídou C závisí dĺžka kombinovanej liečby s ribavirínom od genotypu vírusu. Pacienti infikovaní HCV s genotypom 1, ktorí majú detegovateľnú HCV RNA v 4. týždni, sa majú liečiť 48 týždňov bez ohľadu na vírusovú záťaž pred liečbou.
O liečbe v trvaní 24 týždňov sa môže uvažovať u pacientov infikovaných s
- genotypom 1 a nízkou vírusovou záťažou (LVL) na začiatku liečby (≤ 800 000 IU/ml) alebo
- genotypom 4,
ktorí sa stali HCV RNA negatívni v 4. týždni liečby a zostali HCV RNA negatívni v 24. týždni. Avšak celkove môže byť 24 týždňová liečba spojená s vyšším rizikom relapsu, ako liečba trvajúca 48
týždňov (pozri časť 5.1). Pri rozhodovaní o dĺžke liečby sa u týchto pacientov má brať do úvahy tolerancia na kombinovanú liečbu a ďalšie prognostické faktory, ako stupeň fibrózy. Ešte s väčšou
opatrnosťou sa má uvažovať o skrátení dĺžky trvania liečby u pacientov infikovaných vírusom s genotypom 1 a vysokou vírusovou záťažou (>800 000 IU/ml) na začiatku liečby, ktorí sa stali HCV
RNA negatívni v 4. týždni liečby a zostali negatívni v 24. týždni, pretože obmedzené údaje naznačujú, že môže to signifikantne negatívne ovplyvniť trvalú virologickú odpoveď.
Pacienti infikovaní HCV s genotypom 2 alebo 3, ktorí majú detegovateľnú HCV RNA v 4. týždni, bez ohľadu na vírusovú záťaž pred liečbou majú byť liečení 24 týždňov. 16-týždňová liečba sa môže zvažovať iba u vybraných pacientov, infikovaných genotypom 2 alebo 3 s iniciálnou LVL
(≤ 800 000 IU/ml), ktorí sa stanú HCV negatívni v 4. týždni liečby a zostávajú negatívni v 16. týždni. Všeobecne sa liečba trvajúca 16 týždňov môže spájať s nižšou možnosťou odpovede a je spojená s vyšším rizikom relapsu ako 24-týždňová liečba (pozri časť 5.1). U týchto pacientov sa má pri zvažovaní zmeny štandardnej 24 týždňovej liečby vziať do úvahy tolerancia kombinovanej liečby
a prítomnosť ďalších klinických alebo prognostických faktorov ako napr. stupeň fibrózy. Skrátenie
trvania liečby u pacientov infikovaných genotypom 2 alebo 3 s iniciálnou HVL (> 800 000 IU/ml), ktorí sa stanú v 4. týždni liečby HCV negatívni, sa má zvažovať pozornejšie, nakoľko toto môže významne negatívne ovplyvniť trvalú virologickú odpoveď (pozri tabuľku 1).
Dostupné údaje o infikovaných pacientoch s genotypom 5 alebo 6 sú obmedzené; preto sa odporúča
48 týždňová kombinovaná liečba s 1 000 mg alebo 1 200 mg ribavirínu.
Tabuľka 1:Odporúčané dávkovanie pre kombinovanú liečbu u HCV pacientovGenotyp
| Dávka Pegasysu
| Dávka ribavirínu
| Trvanie
|
Genotyp 1 LVL s
RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 24 týždňov alebo
48 týždňov
|
Genotyp 1 HVL s
RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 48 týždňov
|
Genotyp 4 s RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 24 týždňov alebo
48 týždňov
|
Genotyp 1 alebo 4 bez
RVR*
| 180 mikrogramov
| < 75 kg = 1000 mg
≥ 75 kg = 1200 mg
| 48 týždňov
|
Genotyp 2 alebo 3 bez
RVR**
| 180 mikrogramov
| 800 mg
| 24 týždňov
|
Genotyp 2 alebo 3
LVL s RVR**
| 180 mikrogramov
| 800 mg(a)
| 16 týždňov(a) alebo
24 týždňov
|
Genotyp 2 alebo 3
HVL s RVR**
| 180 mikrogramov
| 800 mg
| 24 týždňov
|
*RVR = rýchla virologická odpoveď (nedegovateľná HCV RNA) v 4. týždni a nedetegovateľná HCV RNA v 24. týždni
**RVR = rýchla virologická odpoveď (HCV RNA negativita) v 4. týždni
LVL = ≤ 800 000 IU/ml; HVL= > 800 000 IU/ml
(a) V súčasnosti nie je jasné, či vyššia dávka ribavirínu (napr. 1 000 /1 200 mg/deň podľa telesnej hmotnosti) vedie k vyššej trvalej virologickej odpovedi (SVR) než dávka 800 mg/deň, keď je liečba skrátená na 16 týždňov.
Konečný klinický účinok skrátenej 16 týždňovej liečby oproti 24 týždňovej liečbe nie je známy vzhľadom na potrebu opakovanej liečby u pacientov, ktorí neodpovedajú na liečbu a pacientov s relapsom ochorenia.
Odporúčaná dĺžka liečby Pegasysom v monoterapii je 48 týždňov.
Chronická hepatitída C - predtým liečení dospelí pacientiOdporúčaná dávka Pegasysu v kombinácii s ribavirínom je 180 µg raz týždenne podávaná subkutánne. Pacientom s telesnou hmotnosťou < 75 kg sa má podávať 1 000 mg ribavirínu denne a pacientom
s telesnou hmotnosťou ≥ 75 kg sa má podávať 1 200 mg ribavirínu denne bez ohľadu na genotyp.
U pacientov, ktorí majú v 12. týždni detegovateľné hladiny vírusu, sa má liečba ukončiť. Odporúčaná
celková dĺžka liečby je 48 týždňov. Ak sa zvažuje liečba u pacientov infikovaných vírusom
genotypu 1, ktorí neodpovedali na predchádzajúcu liečbu peginterferónom a ribavirínom, odporúčaná celková dĺžka liečby je 72 týždňov (pozri časť 5.1).
Súčasná infekcia vírusom HIV a HCV u dospelých pacientovOdporúčané dávkovanie Pegasysu v monoterapii alebo v kombinácii s ribavirínom je
180 mikrogramov raz za týždeň subkutánne počas 48 týždňov. Pre pacientov infikovných HCV s genotypom 1 a s telesnou hmotnosťou <75 kg je dávka ribavirínu 1 000 mg denne a s telesnou hmotnosťou ≥75 kg je dávka 1 200 mg denne. Pre pacientov infikovaných HCV s iným genotypom ako genotyp 1 je dávka ribavirínu 800 mg denne. Dĺžka liečby kratšia ako 48 týždňov sa dostatočne neskúmala.
Predikcia odpovede alebo chýbanie odpovede - predtým neliečení pacienti Ukázalo sa, že včasná virologická odpoveď v 12-tom týždni, ktorá je definovaná ako pokles vírusovej záťaže o 2 log alebo nedetekovateľné hladiny HCV RNA, predikuje pretrvávajúcu odpoveď (pozri tabuľky 2 a 12).
Tabuľka 2:Prediktívna hodnota virologickej odpovede v 12. týždni kombinovanej liečbyPegasysom pri odporúčanom dávkovacom režimeGenotyp
| Negatívna
| Pozitívna
|
Žiadna
odpoveď
do 12. Odpoveď Prediktívna týždňa nepretrváva hodnota
|
Odpoveď
do 12. Odpoveď Prediktívna týždňa pretrváva hodnota
|
Genotyp 1 (N = 569)
| 102 97 95 %
(97/102)
| 467 271 58 %
(271/467)
|
Genotyp 2 a 3 (N = 96)
| 3 3 100 %
(3/3)
| 93 81 87 %
(81/93)
|
Negatívna prediktívna hodnota na trvalú odpoveď u pacientov liečených Pegasysom v monoterapii
bola 98 %.
Podobná negatívna prediktívna hodnota sa pozorovala u súčasne HIV-HCV infikovaných pacientov liečených Pegasysom v monoterapii alebo v kombinácii s ribavirínom (100 % (130/130) alebo 98 % (83/85)). Pozitívne prediktívne hodnoty na úrovni 45 % (50/110) resp. 70 % (59/84) u súčasne HIV- HCV infikovaných pacientov sa pozorovali pri genotype 1 a genotype 2/3, ak títo dostávali kombinovanú liečbu.
Predikcia odpovede alebo chýbanie odpovede - predtým liečení pacientiU pacientov, ktorí neodpovedali na predchádzajúcu liečbu a boli opakovane liečení 48 alebo
72 týždňov, sa ukázalo, že potlačenie aktivity vírusu v 12. týždni (nedetegovateľná HCV RNA definovaná ako <50 IU/ml) je prediktívnym faktorom trvalej virologickej odpovede. Ak nebolo dosiahnuté potlačenie vírusovej aktivity v 12. týždni pri režime liečby 48 alebo 72 týždňov, je pravdepodobnosť nedosiahnutia trvalej virologickej odpovede pri 48-týždňovej liečbe 96 % (363 z
380) a pri 72-týždňovej liečbe 96 % (324 z 339). Ak bolo dosiahnuté potlačenie vírusovej aktivity v 12. týždni pri režime liečby 48 alebo 72 týždňov, je pravdepodobnosť dosiahnutia trvalej
virologickej odpovede pri 48-týždňovej liečbe 35 % (20 z 57) a pri 72-týždňovej liečbe 57 % (57 zo
100).
Úprava dávkovania u dospelých pacientov v dôsledku nežiaducich reakciíVšeobecnePri nutnosti úpravy dávkovania v dôsledku stredne ťažkých až ťažkých nežiaducich reakcií (klinickej a/alebo laboratórnej povahy) je vhodné u dospelých pacientov znížiť začiatočnú dávku na
135 mikrogramov. V niektorých prípadoch môže byť potrebné znížiť dávkovanie na 90 mikrogramov alebo 45 mikrogramov. Po ústupe nežiaducich reakcií je možné zvážiť zvýšenie dávkovania až na pôvodnú hodnotu (pozri časti 4.4 a 4.8).
Hematologické nežiaduce reakcie (pozri tiež tabuľku 3)Pri poklese počtu neutrofilov na < 750/mm3 u dospelých pacientov sa odporúča znížiť dávkovanie lieku. U pacientov s absolútnym počtom neutrofilov (ANC) < 500/mm3 sa liečba prerušuje až do obnovenia hodnôt ANC > 1000/mm3. Liečbu Pegasysom je možné opäť začať dávkou
90 mikrogramov a má sa sledovať počet neutrofilov. V tabuľke 7 je uvedený návod na zníženie dávky
u pediatrických pacientov na základe hodnôt ANC.
Ak počet trombocytov klesne na < 50 000/mm3, má sa znížiť dávkovanie na 90 mikrogramov. Pri znížení počtu trombocytov na hodnotu < 25 000/ mm3 sa odporúča liečbu ukončiť.
Pre liečbu farmakologicky podmienenej anémie u dospelých platia nasledovné špecifické odporúčania:
denná dávka ribavirínu sa má znížiť na 600 mg (200 mg ráno a 400 mg večer), ak nastane niektorá
z nasledujúcich situácií: (1) u pacienta bez závažného kardiovaskulárneho ochorenia dôjde k poklesu hodnôt hemoglobínu na < 10 g/dl a ≥ 8,5 g/dl alebo (2) u pacienta so stabilizovaným kardiovaskulárnym ochorením dôjde k poklesu hodnôt hemoglobínu ≥ 2 g/dl v priebehu ktorýchkoľvek 4 týždňov liečby. Návrat k pôvodnému dávkovaniu sa neodporúča. Liečba ribavirínom
sa ukončí, ak nastane niektorá z nasledujúcich situácií: (1) u pacienta bez závažného kardiovaskulárneho ochorenia dôjde k poklesu hodnôt hemoglobínu < 8,5 g/dl alebo(2) u pacienta so stabilizovaným kardiovaskulárnym ochorením sa hodnoty hemoglobínu udržujú < 12 g/dl napriek 4- týždňovej liečbe s redukovaným dávkovaním. Ak sa abnormality upravia, je možné obnoviť liečbu
ribavirínom v dennej dávke 600 mg. Ošetrujúci lekár môže zvážiť ďalšie zvýšenie dávkovania na
800 mg denne. Návrat k pôvodnému dávkovaniu sa neodporúča.
| Znížiť
dávkovanie ribavirínu na
600 mg
| Vysadiť
ribavirín
| Znížiť dávkovanie
Pegasysu na
135/90/45 mikrogramov
| Vysadiť
Pegasys
| Vysadiť
kombinovanú liečbu
| Absolútny počet neutrofilov
|
|
| < 750/mm3
| < 500/mm3
|
| Počet
trombocytov
|
|
| < 50 000/mm3
> 25 000/mm3
|
| < 25 000/mm3
| Hemoglobín
- bez ochorenia srdca
| < 10 g/dl
a ≥ 8,5 g/dl
| < 8,5 g/dl
|
|
|
| Hemoglobín
-
stabilizov ané ochorenie srdca
| pokles
o ≥ 2 g/dl počas
ľubovoľných
4 týždňov
| < 12 g/dl
napriek
4 týždňovej liečbe
s redukovaným dávkovaním
|
|
|
|
|
|
Tabuľka 3:Úprava dávkovania v dôsledku nežiaducich účinkov (ďalšie informácie pozri v texte vyššie)Pri neznášanlivosti ribavirínu je možné pokračovať v monoterapii Pegasysom.
Funkcia pečeneU pacientov s chronickou hepatitídou C sa často vyskytuje kolísanie odchýlok pečeňových testov. U pacientov liečených Pegasysom vrátane pacientov s virologickou odpoveďou sa pozorovalo zvýšenie hladín ALT nad východiskovú hodnotu (BL).
V klinických skúšaniach zameraných na chronickú hepatitídu C s dospelými pacientmi sa u 8 zo 451
pacientov dostávajúcich kombinovanú liečbu pozorovalo izolované zvýšenie ALT (≥ 10x ULN alebo
≥ 2x BL u pacientov s východiskovou hodnotou ALT ≥ 10x ULN), ktoré sa upravilo bez nutnosti
zmeny dávkovania. Ak je hodnota ALT trvale vyššia alebo naďalej stúpa, dávkovanie sa na začiatku
znižuje na 135 mikrogramov. Ak napriek zníženiu dávkovania hodnoty ALT naďalej stúpajú alebo ich sprevádza zvýšenie hladiny bilirubínu alebo známky dekompenzácie funkcie pečene, má sa liečba ukončiť (pozri časť 4.4). V tabuľke 7 je uvedený návod pre zníženie dávky pre pediatrických
pacientov na základe hladín ALT.
U pacientov s chronickou hepatitídou B nie je nezvyčajné prechodné zvýšenie hladín ALT, ktoré niekedy prekročí desaťnásobok hornej hranice normálnej hodnoty a môže odrážať imunitný klírens. Liečba by sa za normálnych okolností nemala začať, ak je hladina ALT viac než desaťkrát vyššia ako horná hranica jej normálnej hodnoty. Treba zvážiť pokračovanie liečby s častejším sledovaním funkcie pečene pri náhlom zvýšení hladín ALT. Ak sa dávka Pegasysu zníži, alebo ak sa liek vysadí, pri poklese hladiny ALT sa liečba môže obnoviť (pozri časť 4.4).
Osobitné skupiny pacientov
Starší ľudia
Na začiatku liečby Pegasysom u starších pacientov nie je potrebná žiadna úprava odporúčaného dávkovania 180 mikrogramov raz týždenne (pozri časť 5.2).
Porucha funkcie obličiekU pacientov s ochorením obličiek v terminálnej fáze sa používa začiatočná dávka 135 mikrogramov
(pozri časť 5.2 ). Bez ohľadu na začiatočnú dávku alebo stupeň poškodenia funkcie obličiek je potrebné pacientov sledovať a v prípade nežiaducich reakcií je nutné primerane znížiť dávkovanie Pegasysu počas liečebnej kúry.
Porucha funkcie pečeneUkázalo sa, že Pegasys je účinný a bezpečný u pacientov s kompenzovanou cirhózou (napr. A podľa
Child-Pughovej klasifikácie). Pegasys sa nehodnotil u pacientov s dekompenzovanou cirhózou (napr. B alebo C podľa Child-Pughovej klasifikácie alebo krvácajúce ezofageálne varixy) (pozri časť 4.3).
Podľa Child-Pughovej klasifikácie sa pacienti rozdeľujú do skupín A, B a C resp. s “miernou” “stredne ťažkou” a “ťažkou” poruchou funkcie , čomu zodpovedá skóre 5 - 6, 7 - 9 a 10 - 15.
Upravené hodnotenie Hodnotenie
| Stupeň abnormality
| Skóre
|
Encefalopatia
| Žiadny
Stupeň 1 - 2
Stupeň 3 – 4*
| 1
2
3
|
Ascites
| Žiadny
Mierny
Stredný
| 1
2
3
|
Hladina sérového bilirubínu (mg/dl)
v SI jednotkách = μmol/l
| < 2
2,0 - 3
> 3
< 34
34 - 51
> 51
| 1
2
3
1
2
3
|
Hladina sérového albumínu (g/dl)
| > 3,5
2,8 – 3,5
< 2,8
| 1
2
3
|
INR
| < 1,7
1,7 - 2,3
> 2,3
| 1
2
3
|
* Hodnotenie stupňa závažnosti podľa autorov Trey, Burns a Saunders (1966)
Pediatrická pouláciaPegasys je kontraindikovaný u novorodencov a malých detí vo veku do 3 rokov z dôvodu prítomnosti
pomocnej látky benzylalkoholu (pozri časti 4.3 a 4.4).
Pre deti a dospievajúcich vo veku 5 až 17 rokov s chronickou hepatitídou C s povrchom tela (BSA) väčším ako 0,7 m2 sú odporúčané dávky Pegasysu a ribavirínu uvedené v tabuľke 4 a v tabuľke 5. Pre pediatrických pacientov sa odporúča použiť Pegasys v naplnených injekčných striekačkách. Použitie Pegasysom naplnených pier neumožňuje primeranú úprava dávky pre týchto pacientov. Pacienti, ktorí začali liečbu pred svojimi 18-timi narodeninami, majú pokračovať v pediatrickom dávkovaní až do skončenia liečby.
Pegasys sa nesmie použiť u detí s povrchom tela (BSA) menším ako 0,71 m2, keďže pre túto subpopuláciu nie sú dostupné údaje.
Pre výpočet BSA sa odporúča používať Mostellerov vzorec:
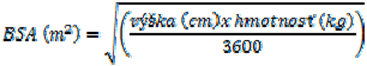 Dĺžka liečby
Dĺžka liečbyDĺžka liečby Pegasysom v kombinácii s ribavirínom u pediatrických pacientov s chronickou hepatitídou C závisí od genotypu vírusu. Pacienti infikovaní vírusovými genotypom 2 alebo 3 majú
dostať 24 týždňovú liečbu, zatiaľ čo pacienti infikovaní iným genotypom majú dostať 48 týždňovú
liečbu.
Pacienti, ktorí majú ešte detegovateľné hladiny HCV-RNA a to aj napriek počiatočnej 24 týždňovej liečbe, majú ukončiť liečbu, pretože je nepravdepodobné, že pokračovaním v liečbe budú schopní dosiahnuť trvalú virologickú odpoveď.
Tabuľka 4: Odporúčania na dávkovanie Pegasysu pre pediatrických pacientov vo veku 5 až 17rokov Rozmedzie plochy povrchu tela (BSA) (m2)
| Týždenná dávka (mikrogramy)
|
0,71-0,74
| 65
|
0,75-1,08
| 90
|
1,09-1,51
| 135
|
> 1,51
| 180
|
Pre deti a dospievajúcich vo veku 5 až 17 rokov s chronickou hepatitídou C odporúčaná dávka
ribavirínu vychádza z telesnej hmotnosti pacienta s cieľovou dávkou 15 mg/kg/deň rozdelenou do dvoch denných dávok. V tabuľke 5 je uvedené dávkovanie za použitia 200 mg tabliet ribavirínu pre deti a dospievajúcich s hmotnosťou 23 kg a viac. Pacienti a ich opatrovatelia sa nesmú pokúšať rozlomiť 200 mg tablety.
Tabuľka 5: Odporúčania pre dávkovanie ribavirínu pre pediatrických pacientov vo veku 5 až 17rokov Telesná hmotnosť kg (lbs)
| Denná dávka ribavirínu
(pribl. 15 mg/kg/deň)
| Počet tabliet ribavirínu
|
23 – 33 (51-73)
| 400 mg/deň
| 1 x 200 mg tablety ráno
1 x 200 mg tablety večer
|
34 – 46 (75-101)
| 600 mg/deň
| 1 x 200 mg tablety ráno
2 x 200 mg tablety večer
|
47 – 59 (103-131)
| 800 mg/deň
| 2 x 200 mg tablety ráno
2 x 200 mg tablety večer
|
60 – 74 (132-163)
| 1 000 mg/deň
| 2 x 200 mg tablety ráno
3 x 200 mg tablety večer
|
≥ 75 (> 165)
| 1 200 mg/deň
| 3 x 200 mg tablety ráno
3 x 200 mg tablety večer
|
Úprava dávky u pediatrických pacientov kvôli nežiaducim reakciám U pediatrických pacientov je možné na základe toxicity (pozri tabuľku 6) urobiť až tri stupne modifikácie dávky pred zvážením prerušenia alebo vysadenia dávky.
Tabuľka 6: Odporúčaná úprava dávky Pegasysu u pediatrických pacientovZačiatočná dávka
(mikrogramy)
| 1. stupeň zníženia
(mikrogramy)
| 2. stupeň zníženia
(mikrogramy)
| 3. stupeň zníženia
(mikrogramy)
|
65
| 45
| 30
| 20
|
90
| 65
| 45
| 20
|
135
| 90
| 65
| 30
|
180
| 135
| 90
| 45
|
V prípade výskytu toxicity, ktorá môže súvisieť s podávaním Pegasysu a/alebo ribavirínu, sa môže
znížiť dávka jedného alebo obidvoch liekov. Okrem toho sa môže ribavirín alebo kombinovaná liečba Pegasys plus ribavirín vysadiť. Je dôležité poznamenať, že ribavirín sa nesmie nikdy podávať ako monoterapia. Odporúčania na úpravu dávky z dôvodu toxicity, o ktorej je známe, že má súvislosť
s podávaním Pegasysu a ktoré sú špecifické pre pediatrickú populáciu, sú uvedené v tabuľke 7. Pokiaľ nie je uvedené inak, v prípade všetkých ostatných toxických prejavov sa má postupovať podľa odporúčaní pre dospelých.
Tabuľka 7: Odporúčania na úpravu dávky Pegasysu z dôvodu toxicity u pediatrických pacientovToxicita
| Úprava dávky Pegasysu
|
Neutropénia
| 750-999 buniek/mm3: 1.-2. týždeň – okamžitá úprava 1. stupňa; 3.-48.
týždeň: žiadna úprava.
500-749 buniek/mm3: 1.-2. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte dávkou s úpravou 1. stupňa s kontrolou hodnoty leukocytov jedenkrát týždenne počas 3 nasledujúcich týždňov, aby ste sa ubezpečili, že ich počet je > 750 buniek/mm3; 3.-48. týždeň – okamžitá úprava 1. stupňa.
250-499 buniek/mm3: 1.-2. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte dávkou s úpravou 2. stupňa; 3.-48. týždeň – prerušte podávanie dávky až pokiaľ ich hodnota nebude > 750 buniek/mm3, potom pokračujte
v dávkovaní s úpravou 1. stupňa.
< 250 buniek/mm3 (alebo febrilná neutropénia) liečbu vysaďte.
|
Zvýšená hladina
alanínaminotransaminázy
(ALT)
| V prípade pretrvávajúcich alebo narastajúcich zvýšení ≥ 5 ale < 10 x
ULN, znížte dávku s úpravou 1. stupňa a jedenkrát týždenne sledujte hladinu ALT na uistenie, že je stabilná alebo klesá
V prípade pretrvávajúcich hodnôt ALT ≥ 10 x ULN vysaďte liečbu.
|
ULN=horná hranica normy
U pediatrických pacientov je toxicita súvisiaca s liečbou ribavirínom, ako napríklad anémia, ktorá sa objaví počas liečby, riešiteľná znížením celkovej dávky. Stupne zníženia dávky sú uvedené v tabuľke
8.
Tabuľka 8: Odporúčania na úpravu dávky ribavirínu u pediatrických pacientovCelková dávka
(približne 15 mg/kg/deň)
| Jednokroková úprava dávky
(približne 7,5 mg/kg/deň)
|
Počet tabliet ribavirínu
|
400 mg/deň
| 200 mg/deň
| 1 x 200 mg tabliet ráno
|
600 mg/deň
| 400 mg/deň
| 1 x 200 mg tabliet ráno
|

|
|
1 x 200 mg tabliet večer
|
800 mg/deň
|
400 mg/deň
|
1 x 200 mg tabliet ráno
1 x 200 mg tabliet večer
|
1 000 mg/deň
|
600 mg/deň
|
1 x 200 mg tabliet ráno
2 x 200 mg tabliet večer
|
1 200 mg/deň
|
600 mg/deň
|
1 x 200 mg tabliet ráno
2 x 200 mg tabliet večer
|
Skúsenosti s Pegasysom pri liečbe pediatrických pacientov s HCV vo veku od 3 do 5 rokov alebo tých,
ktorí v minulosti neboli adekvátne liečení, sú len obmedzené. Neexistujú žiadne údaje u pediatrických pacientov súčasne infikovaných vírusmi HCV a HIV alebo s poruchou funkcie obličiek.
Spôsob podaniaPegasys sa podáva subkutánne do brucha alebo stehna. V štúdiách s podaním Pegasysu do ramena
bola zistená znížená expozícia Pegasysom (pozri časť 5.2).
Pegasys je navrhnutý na podávanie samotným pacientom alebo opatrovateľom. Každú injekčnú liekovku má používať len jedna osoba a je určená len na jednorazové použitie.
Pre nezdravotníckych pracovníkov, ktorí podávajú tento liek, sa odporúča primerané školenie. Pacient musí postupovať presne podľa “Pokynov pre používateľa” vložených v škatuľke.
4.3 Kontraindikácie• Precitlivenosť na liečivo, na interferóny alfa alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
• Autoimunitná hepatitída
• Ťažká dysfunkcia pečene alebo dekompenzovaná cirhóza pečene
• Anamnéza ťažkého kardiovaskulárneho ochorenia vrátane nestabilného alebo nekontrolovaného
ochorenia srdca počas predchádzajúcich 6 mesiacov (pozri časť 4.4)
• HIV-HCV pacienti s cirhózou s Child-Pughovým skóre ≥6, okrem stavu, keď je cirhóza nepriamo spôsobená hyperbilirubinémiou vyvolanou liekmi ako atazanavir a indinavir
• Kombinácia s telbivudínom (pozri časť 4.5)
• Novorodenci a deti do 3 rokov vzhľadom na prítomnosť pomocnej látky – benzylalkoholu
(pozri časť 4.4 o benzylalkohole)
• Psychické poruchy, obvzvlášť závažná depresia, suicidálne myšlienky alebo pokus o samovraždu u pediatrických pacientov v súčasnosti alebo v anamnéze.
Ak sa Pegasys má použiť v kombinácii s ribavirínom, prečítajte si súhrn charakteristických vlastností
(SmPC) ribavirínu, ktorý obsahuje kontraindikácie jeho použitia.
4.4 Osobitné upozornenia a opatrenia pri používaníPsychické poruchy a centrálny nervový systém (CNS): Počas liečby Pegasysom a aj po jej ukončení, najmä počas 6-mesačného sledovania po liečbe, sa pozorovali u niektorých pacientov závažné účinky na CNS, hlavne depresia, samovražedné predstavy a pokus o samovraždu. Pri použití alfa interferónov sa pozorovali ďalšie účinky na CNS s prejavmi ako je agresívne správanie (niekedy namierené proti iným osobám ako je myšlienka na vraždu), bipolárne poruchy, mánia, zmätenosť a poruchy vedomia. U všetkých pacientov majú byť prísne monitorované všetky znaky alebo symptómy psychických porúch. Ak sa objavia symptómy psychických porúch, ošetrujúci lekár musí vziať do úvahy možnú závažnosť týchto príznakov a zvážiť potrebu adekvátnej liečby. Ak psychiatrické symptómy pretrvávajú alebo sa zhoršujú, alebo ak sa spozorujú samovražedné predstavy, odporúča sa liečbu Pegasysom ukončiť a pacienta odporučiť do prislúchajúcej psychiatrickej starostlivosti a/alebo liečby.

 Pacienti s už existujúcim psychiatrickým ochorením alebo s údajom o závažnom psychiatrickom ochorení v anamnéze:
Pacienti s už existujúcim psychiatrickým ochorením alebo s údajom o závažnom psychiatrickom ochorení v anamnéze: Ak sa rozhodne, že liečba Pegasysom je nutná u pacienta, ktorý má existujúce alebo v anamnéze prítomné závažné psychiatrické ochorenie, má sa liečba začať až po zaistení vhodnej individuálnej diagnostiky a liečby psychiatrického stavu.
Použitie Pegasysu u pediatrických pacientov s psychickými poruchami v súčasnosti alebo v anamnéze je kontraindikované (pozri časť 4.3).
Rast a vývoj (deti a dospievajúci): Úbytok hmotnosti a inhibícia rastu bola bežná v priebehu liečby
trvajúcej až 48 týždňov u pacientov vo veku 5 až 17 rokov (pozri časti 4.8 a 5.1).
2 roky po liečbe Pegasysom bolo 16 % pediatrických pacientov stále 15 percentilov alebo viac pod svojou východiskovou krivkou hmotnosti a 11 % zostalo 15 percentilov alebo viac pod svojou východiskovou krivkou výšky.
Individuálne posúdenie prínosu liečby a rizika u detíOčakávaný prínos liečby sa má starostlivo zvažovať berúc pritom do úvahy zistenia z klinických skúšaní týkajúce sa bezpečnosti pozorované u pediatrických pacientov (pozri časti 4.8 a 5.1).
- Je dôležité vziať do úvahy, že kombinovaná liečba viedla k inhibícii rastu, ktorej reverzibilita nie je istá.
- Toto riziko je potrebné zvážiť berúc do úvahy charakter ochorenia dieťaťa, akým je dôkaz o progresii ochorenia (najmä fibrózy), komorbidity, ktoré môžu negatívne ovplyvniť priebeh
ochorenia (napr. súčasná infekcia vírusom HIV), ako aj prognostické faktory odpovede (HCV
genotyp a vírusová záťaž).
Ak je to možné, dieťa sa má liečiťpo pubertálnej akcelerácii rastu, aby sa znížilo riziko inhibície rastu. Neexistujú žiadne údaje o dlhodobých účinkoch na pohlavné dozrievanie.
Ak sa Pegasys podáva v kombinácii s ribavirínom, prečítajte si súhrn charakteristických vlastností
(SmPC) ribavirínu.
Histológia pečene pred liečbouVšetci pacienti s chronickou hepatitídou C, ktorí sa zúčastnili štúdie, sa podrobili biopsii pečene, ale v určitých prípadoch (napr. u pacientov s genotypom 2 alebo 3) sa môže liečba nasadiť aj bez histologického dôkazu. Pri rozhodovaní o nutnosti biopsie pečene pred začiatkom liečby sa má postupovať podľa platných liečebných postupov.
U pacientov s normálnymi hodnotami ALT sa progresia do fibrózy v priemere vyskytuje s nižšou intenzitou ako u pacientov so zvýšenými hodnotami ALT. Toto musí byť zhodnotené spoločne s ostatnými kritériami ako HCV genotyp, vek pacienta, extrahepatálne prejavy, riziko prenosu atď., ktoré ovplyvňujú rozhodnutie liečiť alebo neliečiť.
Laboratórne vyšetrenia pred liečbou a počas nejPred začiatkom liečby Pegasysom sa u všetkých pacientov odporúča vykonať štandardné hematologické a biochemické laboratórne vyšetrenia.
Pred začiatkom liečby Pegasysom musia byť východiskové hodnoty sledovaných parametrov nasledovné:
- počet trombocytov ≥ 90 000/mm3
- absolútny počet neutrofilov ≥ 1 500/mm3
- primerane kontrolovaná funkcia štítnej žľazy (TSH a T4)
Hematologické vyšetrenia sa majú opakovať každé 2 - 4 týždne a biochemické vyšetrenia každé 4
týždne. Počas liečby sa má periodicky robiť doplnkové vyšetrenie.
V klinických štúdiách sa počas liečby Pegasysom pozorovalo zníženie počtu leukocytov (WBC) ako aj absolútneho počtu neutrofilov (ANC), ku ktorému obyčajne došlo počas prvých dvoch týždňov liečby (pozri časť 4.8). Progresívne znižovanie po 8 týždňoch liečby sa zistilo len v zriedkavých prípadoch.
Pokles ANC bol obyčajne reverzibilný po znížení dávkovania alebo ukončení liečby (pozri časť 4.2), normálne hodnoty sa dosiahli u väčšiny pacientov za 8 týždňov a na základné hodnoty sa vrátili u všetkých pacientov približne po 16 týždňoch.
Liečbu Pegasysom sprevádzalo zníženie počtu trombocytov, ktorý sa vrátil na úroveň pred liečbou počas obdobia sledovania po liečbe (pozri časť 4.8). V niektorých prípadoch bola potrebná úprava dávkovania (pozri časť 4.2).
V klinických štúdiách sa u 15 % pacientov s chronickou hepatitídou C liečených Pegasysom
v kombinácii s ribavirínom pozoroval výskyt anémie (hemoglobín <10 g/dl). Frekvencia závisí na dĺžke trvania liečby a na dávke ribavirínu (pozri časť 4.8). U ženskej populácie je vyššie riziko vývoja anémie.
Pri podávaní Pegasysu v kombinácii s inými potenciálne myelosupresívnymi látkami je potrebná opatrnosť.
V literatúre sú hlásenia o výskyte pancytopénie a o útlme kostnej drene, ku ktorým došlo v priebehu 3 až 7 týždňov po podaní peginterferónu a ribavirínu podaného súbežne s azatioprinom. Táto myelotoxicita bola reverzibilná do 4 až 6 týždňov po vysadení antivirotickej terapie proti hepatitíde C a súčasne podávaného azatioprinu a neobnovila sa po opätovnom zavedení ktoréhokoľvek z týchto liečiv podávaných v monoterapii (pozri časť 4.5).
Použitie kombinovanej liečby Pegasysom a ribavirínom u pacientov s chronickou hepatitídou C,
u ktorých zlyhala predchádzajúca liečba, sa dostatočne nesledovalo u pacientov, ktorí predchádzajúcu liečbu predčasne ukončili kvôli hematologickým nežiaducim reakciám. Lekári, ktorí uvažujú o liečbe týchto pacientov, majú starostlivo zvážiť riziká opakovanej liečby oproti jej prínosom.
Endokrinný systém
Pri používaní interferónov alfa vrátane Pegasysu sa popísali poruchy funkcie štítnej žľazy, resp. zhoršenie predchádzajúcich ochorení štítnej žľazy. Pred začiatkom liečby Pegasysom sa majú vyšetriť hladiny TSH a T4. Liečbu Pegasysom je možné zahájiť alebo je možné v nej pokračovať, ak sa hodnoty TSH počas liečby udržia v normálnom rozmedzí. Počas liečebnej kúry sa majú vyšetriť hladiny TSH, ak sa u pacienta objavia klinické príznaky svedčiace o možnej poruche funkcie štítnej žľazy (pozri časť 4.8). Pri liečbe Pegasysom sa môže pozorovať hypoglykémia, hyperglykémia a diabetes mellitus (pozri časť 4.8). Pacienti, u ktorých sa tieto stavy nemôžu účinne kontrolovať liekmi, sa nemajú začať liečiť Pegasysom alebo Pegasysom v kombinácii s ribavirínom. U pacientov, u ktorých sa toto ochorenie rozvinulo počas liečby a nemôžu sa liečiť liekmi, má sa liečba Pegasysom alebo Pegasysom v kombinácii s ribavirínom ukončiť.
Kardiovaskulárny systém
Liečbu interferónmi alfa vrátane Pegasysu sprevádzala hypertenzia, supraventrikulárne arytmie, kongestívne srdcové zlyhanie, bolesť na hrudníku a infarkt myokardu. Odporúča sa, aby sa pacienti so srdcovými abnormalitami v predchorobí podrobili elektrokardiografickému vyšetreniu pred začiatkom liečby Pegasysom. Pri akomkoľvek zhoršení kardiovaskulárneho stavu sa musí liečba prerušiť resp. ukončiť. U pacientov s kardiovaskulárnym ochorením si môže anémia vyžiadať zníženie dávkovania alebo vysadenie liečby ribavirínom (pozri časť 4.2).
Funkcia pečene
Liečba Pegasysom sa musí ukončiť u pacientov, u ktorých sa počas liečby objavia známky dekompenzácie pečene. Pri liečbe Pegasysom sa pozorovalo zvýšenie hladín ALT oproti východiskovej hodnote, ku ktorému došlo aj u pacientov s virologickou odpoveďou na liečbu. Ak napriek zníženiu dávkovania hodnota ALT naďalej stúpa a je klinicky významná resp. ju sprevádza zvýšenie hladiny priameho bilirubínu, liečba sa musí ukončiť (pozri časti 4.2 a 4.8).
V prípade chronickej hepatitídy B, na rozdiel od chronickej hepatitídy C, nie je nezvyčajné zhoršenie ochorenia počas liečby, ktoré je charakterizované prechodným a potenciálne významným zvýšením sérovej ALT. V klinických štúdiách s Pegasysom pri HBV sa pozorovalo výrazné zvýšenie hladiny
transaminázy, sprevádzané miernymi zmenami v ďalších parametroch hepatálnej funkcie, pričom sa nedokázala dekompenzácia pečene. Približne v polovici prípadov zvýšenia ALT prekračujúceho desaťnásobok hornej hranice normálnej hodnoty sa dávkovanie Pegasysu znížilo alebo liek sa vysadil, až kým neklesli hodnoty transaminázy, zatiaľ čo u zvyšku pacientov liečba ostala nezmenená. Vo všetkých prípadoch sa odporučilo častejšie sledovanie hepatálnej funkcie.
Precitlivenosť
V zriedkavých prípadoch sa počas liečby interferónom alfa môžu vyskytnúť závažné akútne reakcie
z precitlivenosti (napr. urtikária, angioedém, bronchokonstrikcia, anafylaxia). Ak sa vyskytnú, musí sa liečba ukončiť a okamžite zahájiť príslušná farmakoterapia. Prechodný exantém si nevyžaduje nutnosť prerušenia liečby.
Autoimunitné ochorenie
Popísal sa vznik autoprotilátok a autoimunitných porúch počas liečby interferónmi alfa. Zvýšené riziko môžu mať pacienti predisponovaní na rozvoj autoimunitných porúch. Pacientov, ktorí majú znaky alebo príznaky zlučiteľné s autoimunitnými poruchami, sa má starostlivo vyšetriť a potom prehodnotiť pomer prínosu a rizika pokračovania liečby interferónom (pozri tiež Endokrinný systém v častiach 4.4 a 4.8).
U pacientov s chronickou hepatitídou C liečených interferónom boli hlásené prípady Vogt-Koyanagi- Harada (VKH) syndrómu. Tento syndróm je granulomatózne zápalové ochorenie, ktoré postihuje oči, sluchový systém, meningy a kožu. Ak je podozrenie na VKH syndróm, má sa antivirotická liečba ukončiť a uvažovať o liečbe kortikoidmi (pozri časť 4.8).
Horúčka/infekcie
Zatiaľ čo horúčka môže byť spojená so syndrómom podobným chrípke, čo sa často uvádza pri liečbe interferónom, musia sa vylúčiť iné príčiny pretrvávajúcej horúčky, zvlášť závažné infekcie (bakteriálne, vírusové, plesňové), najmä u pacientov s neutropéniou. V priebehu liečby interferónmi alfa, vrátane Pegasysu sa zaznamenal vznik závažných infekcií (bakteriálnych, vírusových, plesňových) a sepsa. Okamžite sa má začať odpovedajúca liečba proti infekcii a má sa zvážiť
prerušenie liečby.
Očné zmeny
Pri liečbe Pegasysom sa zriedkavo popísala retinopatia, vrátane krvácania do sietnice, vatových škvŕn, edému papily, neuropatie zrakového nervu a uzáveru retinálnej artérie alebo vény, ktorý môže viesť
k strate zraku. Všetci pacienti sa majú pred začiatkom liečby podrobiť očnému vyšetreniu. Každý pacient udávajúci zhoršenie alebo stratu zraku sa musí okamžite podrobiť kompletnému očnému vyšetreniu. Dospelí a pediatrickí pacienti s očnými poruchami v predchorobí (napr. diabetickou alebo hypertenznou retinopatiou), sa majú počas liečby Pegasysom podrobiť pravidelným očným vyšetreniam. Liečba Pegasysom sa má ukončiť u pacientov s novovzniknutými alebo zhoršenými poruchami zraku.
Pľúcne zmeny
Počas liečby Pegasysom sa opísali pľúcne zmeny vrátane dýchavice, pľúcnych infiltrátov, pneumónie a pneumonitídy. V prípade pretrvávajúcich alebo nevysvetlených pľúcnych infiltrátov alebo zhoršenia funkcie pľúc sa má liečba ukončiť.
Kožné poruchy
Liečba interferónmi alfa bola sprevádzaná exacerbáciou alebo rozvojom psoriázy a sarkoidózy. Pegasys sa musí opatrne používať u pacientov s psoriázou a v prípadoch vzniku resp. zhoršenia psoriatických lézií sa musí liečba ukončiť.
Transplantácia
Bezpečnosť a účinnosť liečby Pegasysom a ribavirínom sa u pacientov po transplantácii pečene a iných orgánov nehodnotila. Boli hlásené odvrhnutia transplantátov pečene a obličiek po liečbe Pegasysom samotným alebo po kombinovanej liečbe s ribavirínom.
Súčasná infekcia HIV-HCV
Prosím, pozrite si súhrny charakteristických vlastností pre antiretrovírusové lieky, ktoré sa užívajú súbežne s HCV liečbou pre porozumenie a zvládnutie toxických účinkov každého lieku a možnosti prekrývania sa toxických účinkov pri liečbe Pegasysom s ribavirínom alebo bez ribavirínu. V štúdii NR15961 u pacientov, ktorí boli súbežne liečení so stavudínom a interferónom s alebo bez ribavirínu, bol výskyt pankreatitídy a/alebo laktátovej acidózy 3 % (12/398).
U pacientov súčasne infikovaných HCV a HIV, ktorí dostávajú vysoko-účinnú liečbu anti- retrovírusovými látkami (HAART), môže byť vyššie riziko vzniku laktátovej acidózy. Preto je potrebná opatrnosť pri pridávaní kombinovanej liečby Pegasys a ribavirín k liečbe HAART (pozri SPC ribavirínu).
Súčasne infikovanípacienti s pokročilou infekciou a pokročilou cirhózou pečene liečení HAART môžu mať vyššie riziko dekompenzácie pečene a úmrtia, ak dostávajú ribavirín v kombinácii s interferónmi vrátane Pegasysu. Zmeny východiskových hodnôt u koinfikovaných pacientov s cirhózou, ktoré môžu byť spojené s dekompenzáciou pečene, zahŕňajú: zvýšený sérový bilirubín, znížený hemoglobín, zvýšenú alkalickú fosfatázu alebo znížený počet krvných doštičiek a liečbu didanozínom (ddI).
Súbežná liečba ribavirínom a zidovudínom sa neodporúča vzhľadom na zvýšené riziko vzniku anémie
(pozri časť 4.5).
Počas liečby pacienti s kombinovanou infekciou sa majú starostlivo sledovať na znaky a symptómy dekompenzácie pečene (vrátane ascitu encefalopatie, krvácania z varixov, poškodenej syntézy
v pečeni; napr. Childovo-Pughovo skóre 7 alebo vyššie). Childovo-Pughovo skóre môže byť ovplyvnené faktormi spojenými s liečbou (ako nepriama hyperbilirubinémia, znížený albumín) a nemusia nevyhnutne viesť k dekompenzácii pečene. Liečba Pegasysom sa má ihneď ukončiť u pacientov s dekompenzáciou pečene.
U pacientov súčasne infikovaných HCV a HIV, údaje o účinnosti a bezpečnosti sú obmedzené
u pacientov s počtom CD4 buniek nižším ako 200 buniek/µl. Opatrnosť je preto potrebná u pacientov s nízkym počtom CD4 buniek.
Dentálne a periodontálne poruchy
U pacientov, ktorí dostávajú Pegasys v kombinácii s ribavirínom, sa hlásili dentálne a periodontálne poruchy, ktoré môžu viesť k strate zubov. Navyše suché ústa môžu mať škodlivý účinok na zuby a mukózne membrány úst počas dlhotrvajúcej liečby Pegasysom v kombinácii s ribavirínom. Pacienti si majú dvakrát denne dôkladne čistiť zuby a majú mať pravidelné kontrolné vyšetrenie zubným
lekárom. Okrem toho u niektorých pacientov sa môže objaviť vracanie. Ak sa takáto reakcia vyskytne, má sa im odporučiť dôkladne si potom vypláchnuť ústa.
Použitie dlhodobej liečby peginterferónom v monoterapii (neschválené použitie)
V randomizovanej, kontrolovanej štúdii (HALT-C) uskutočnej v USA u pacientov infikovaných vírusom HCV s rozličným stupňom fibrózy, ktorí neodpovedali na liečbu, sa sledovala 3,5-ročná liečba Pegasysom v monoterapii v dávke 90 mikrogramov/týždeň, pričom sa nezistilo žiadne signifikantné zníženie výskytu progresie fibrózy alebo súvisiacich klinických príhod.
Pomocná látka
Pegasys obsahuje benzylakohol. Nesmie sa podávať predčasne narodeným deťom ani novorodencom. Môže spôsobiť toxické reakcie a anafylaktické reakcie u dojčiat a detí vo veku do 3 rokov.
4.5 Liekové a iné interakcie
Interakčné štúdie sa uskutočnili len u dospelých.
Podávanie Pegasysu zdravým mužským dobrovoľníkom v dávke 1 x 180 mikrogramov týždenne počas 4 týždňov nemalo žiadny vplyv na farmakokinetické profily mefenytoínu, dapsonu,
debrisochínu a tolbutamidu, čo poukazuje na to, že Pegasys neovplyvňuje in vivo metabolickú aktivitu izoenzýmov cytochrómu P450 3A4, 2C9, 2C19 a 2D6.
V rovnakej štúdii sa pozorovalo 25 % zvýšenie hodnoty AUC pre teofylín (marker aktivity cytochrómu P450 1A2), čo potvrdzuje, že Pegasys je inhibítorom aktivity cytochrómu P450 1A2. U pacientov liečených súbežne teofylínom a Pegasysom sa majú sledovať sérové koncentrácie teofylínu a vhodne upraviť jeho dávkovanie. Je pravdepodobné, že k maximálnej interakcii medzi teofylínom a Pegasysom dôjde po viac ako 4 týždňoch liečby Pegasysom.
Pacienti s izolovanou infekciou vírusom HCV a pacienti s izolovanou infekciou vírusom HBV
Vo farmakologickej štúdii dostávalo 24 HCV infikovaných pacientov súbežne udržiavaciu liečbu
metadonom (stredná dávka 95 mg, v rozmedzí od 30 mg do 150 mg), liečba s Pegasysom
180 mikrogramov, subkutánne raz týždenne počas 4 týždňov, bola spojená s priemernými hodnotami metadonu, ktoré boli 10 % až 15 % vyššie než východiskové hodnoty. Klinický význam tohto zistenia nie je známy, napriek tomu sa majú pacienti sledovať pre príznaky a symptómy metadonovej toxicity. Zvlášť sa majú sledovať pacienti, ktorí užívajú vysokú dávku metadonu, u ktorých je riziko predĺženia QT intervalu.
Ribavirín, keďže má inhibičný účinok na inozín-monofosfátdehydrogenázu, môže zasahovať do metabolizmu azatioprinu, čo eventuálne môže viesť ku kumulácii 6-metyltioinozín-monofosfátu (6- MTIMP), ktorý sa spája so vznikom myelotoxicity u pacientov liečených azatioprinom. Má sa vyhnúť použitiu peginterferónu alfa-2a a ribavirínu podaného súbežne s azatioprinom. V jednotlivých prípadoch, ak prínos podávania ribavirínu súčasne s azatioprinom oprávňuje podstúpiť možné riziko, odporúča sa dôkladne monitorovať hematologické parametre počas súbežného podávania azatioprinu so zreteľom odhaliť známky myelotoxicity − v prípade, že k nej dôjde, treba liečbu týmito liekmi ukončiť (pozri časť 4.4).
Výsledky z farmakokinetických podštúdií v rámci pilotnej štúdie fázy III nepreukázali žiadnu farmakokinetickú interakciu medzi lamivudínom a Pegasysom u pacientov s HBV alebo medzi Pegasysom a ribavirínom u pacientov s HCV.
V klinickom skúšaní bola skúmaná kombinácia telbivudínu 600 mg denne s pegylovaným interferónom alfa-2a, 180 mikrogramov raz týždenne podané subkutánne. Skúšanie ukázalo, že kombinácia je spojená so zvýšeným rizikom vzniku periférnej neuropatie. Mechanizmus vzniku týchto udalostí nie je známy; a tak kombinovaná liečba telbivudínom s inými interferónmi (pegylovanými alebo štandardnými) môže tiež znamenať nesmierne riziko. Okrem toho, prínos kombinovanej liečby telbivudínom s interferónom alfa (pegylovaným alebo štandardným) nie je v súčasnosti preukázaný. Preto je kombinácia Pegasysu s telbivudínom kontraindikovaná (pozri časť 4.3).
Pacienti súčasne infikovaní vírusmi HIV-HCV
U 47 HIV-HCV infikovaných pacientov, ktorí sa zúčastnili na 12-týždňovej farmakokinetickej časti
štúdie skúmajúcej účinok ribavirínu na vnútrobunkovú fosforyláciu niektorých inhibítorov nukleozidovej reverznej transkriptázy (lamivudín a zidovudín alebo stavudín) sa nepozoroval žiadny zjavný dôkaz o liekovej interakcii. Avšak v dôsledku vysokej variability boli intervaly spoľahlivosti dosť široké. Nezdá sa, že plazmatická expozícia ribavirínu je ovplyvnená súčasným podávaním inhibítorov nukleozidovej reverznej transkriptázy (NRTIs).
Súčasné podávanie ribavirínu a didanozínu sa neodporúča. Expozícia didanozínu alebo jeho
aktívnemu metabolitu (dideoxyadenozín 5´-trifosfát) sa zvyšuje in vitro, ak sa didanozín podáva spolu s ribavirínom. Pri používaní ribavirínu sa popísali hlásené prípady zlyhania pečene s následkom smrti, ako aj periférna neuropatia, pankreatitída a symptomatická hyperlaktatémia/laktátová acidóza.
Keď bol zidovudín súčasťou režimu používaného na liečbu HIV, bolo hlásené zvýraznenie anémie spôsobenej ribavirínom. Presný mechanizmus zostáva nevysvetlený. Súčasné podávanie ribavirínu
kombinovaná antiretrovírusová liečba stanovená, má sa zvážiť nahradenie zidovudínu. Je to zvlášť
dôležité u pacientov, u ktorých zidovudín spôsobil anémiu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne alebo iba obmedzené údaje o použití peginterferónu alfa-2a u gravidných žien. Štúdie na zvieratách s peginterferónom alfa-2a preukázali reprodukčnú toxicitu (pozri časť 5.3) a nie je známe potenciálne riziko u ľudí. Liečba Pegasysom počas gravidity sa používa iba vtedy, ak jej úžitok pre matku prevýši jeho riziko pre plod.
Laktácia
Nie je známe, či sa peginterferón alfa-2a/jeho metabolity vylučujú do materského mlieka. Dojčenie sa má ukončiť pred začatím liečby pre možnosť vzniku nežiaducich reakcií u dojčených detí.
Fertilita
Nie sú k dispozícii žiadne údaje o účinkoch peginterferónu alfa-2a na fertilitu žien. Pri podávaní peginterferónu alfa-2a samiciam opíc sa pozorovalo predĺženie menštruačného cyklu (pozri časť 5.3).
Použitie s ribavirínom
U všetkých zvieracích druhov, ktoré boli vystavené ribavirínu, sa dokázali významné teratogénne a/alebo embryocídne účinky. Ribavirín je u gravidných žien kontraindikovaný. Je potrebná mimoriadna opatrnosť na zabránenie gravidity u pacientok alebo partneriek pacientov, ktorí užívajú Pegasys v kombinácii s ribavirínom. Pacientky v plodnom veku musia používať účinnú antikoncepciu počas liečby a ešte 4 mesiace po ukončení liečby. Pacienti alebo partnerky musia používať účinnú
antikoncepciu počas liečby a ešte 7 mesiacov po ukončení liečby. Prosím pozrite si SmPC ribavirínu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pegasys má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti, ktorí trpia závratom, zmätenosťou, ospalosťou alebo únavou, sa majú vyvarovať vedeniu vozidiel
alebo obsluhovaniu strojov.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Chronická hepatitída C
Výskyt a závažnosť väčšiny nežiaducich reakcií u pacientov liečených Pegasysom je podobná ako u pacientov dostávajúcich interferón alfa-2a pozri tabuľku 9). Väčšina častých nežiaducich reakcií pozorovaných po Pegasyse 180 mikrogramov bola miernej až strednej intenzity, pričom ich bolo možné zvládnuť bez potreby zmeny dávkovania alebo ukončenia liečby.
Chronická hepatitída B
V klinických štúdiách, ktoré skúmali 48-týždňovú liečbu a 24-týždňové sledovanie po liečbe bol bezpečnostný profil Pegasysu pri chronickej hepatitíde B podobný ako v prípade chronickej hepatitídy C. Frekvencia výskytu väčšiny nežiaducich reakcií, s výnimkou pyrexie, bola výrazne nižšia v prípade CHB liečenej Pegasysom v monoterapii v porovnaní s HCV pacientami liečenými s Pegasysom v monoterapii (pozri tabuľku 9). Nežiaduce účinky malo 88 % pacientov liečených
Pegasysom v porovnaní s 53 % pacientov v porovnávacej skupine s lamivudínom, kým 6 % pacientov liečených Pegasysom a 4% pacientov liečených lamivudínom mali závažné nežiaduce účinky počas štúdií. Nežiaduce účinky alebo abnormálne laboratórne hodnoty viedli u 5 % pacientov k ukončeniu liečby v skupine liečenej Pegasysom, zatiaľ čo menej ako 1 % pacientov ukončilo liečbu v skupine liečenej lamivudínom z tých istých dôvodov. Percento pacientov s cirhózou, ktorí ukončili liečbu bolo podobné ako u pacientov v celkovej populácii v každej liečenej skupine.
Chronická hepatitída C u pacientov, ktorí neodpovedali na predchádzajúcu liečbu
U pacientov, ktorí neodpovedali na predchádzajúcu liečbu, bol bezpečnostný profil Pegasysu
v kombinácii s ribavirínom celkovo podobný ako u predtým neliečených pacientov. V klinickom skúšaní u pacientov, ktorí neodpovedali na predchádzajúcu liečbu pegylovaným interferónom
alfa-2b/ribavirínom, v ktorej boli pacienti podrobení buď 48-týždňovej, alebo 72-týždňovej liečbe, došlo kvôli nežiaducim udalostiam alebo laboratórnym odchýlkam k predčasnému ukončeniu liečby Pegasysom u 6 % pacientov a liečby ribavirínom u 7 % pacientov v skupine liečenej 48 týždňov a v skupine liečenej 72 týždňov z rovnakého dôvodu liečbu Pegasysom predčasne ukončilo 12 % pacientov a liečbu ribavirínom 13 % pacientov. Podobne aj u pacientov s cirhózou alebo prechodom do cirhózy sa predčasné ukončenie liečby Pegasysom a liečby ribavirínom vyskytovalo častejšie v skupine liečenej 72 týždňov (13 % a 15 %) než v skupine liečenej 48 týždňov (6 % a 6 %). Pacienti, ktorí kvôli hematologickej toxicite predčasne ukončili predchádzajúcu liečbu pegylovaným interferónom alfa-2b/ribavirínom, boli z účasti na tejto štúdii vylúčení.
V ďalšom klinickom skúšaní boli 48 týždňov liečení pacienti s pokročilou fibrózou alebo cirhózou (Ishakovo skóre 3 až 6), ktorí neodpovedali na predchádzajúcu liečbu a ktorí mali pred zaradením do štúdie počet trombocytov iba 50 000/mm3. Odchýlky laboratórnych hematologických parametrov pozorované počas prvých 20 týždňov štúdie zahŕňali anémiu (26 % pacientov malo hladinu hemoglobínu < 10 g/dl), neutropéniu (30 % pacientov malo ANC < 750/mm3) a trombocytopéniu
(13 % pacientov malo počet trombocytov < 50 000/mm3) (pozri časť 4.4).
Súčasná infekcia vírusom chronickej hepatitídy C a vírusom HIV
U pacientov súčasne infikovaných vírusmi HIV-HCV boli profily klinických nežiaducich reakcií pri liečbe Pegasysom samotným alebo v kombinácii s ribavirínom podobné ako profily u pacientov infikovaných len HCV. U HIV-HCV pacientov, ktorí dostávali Pegasys a ribavirín v kombinovanej liečbe, boli hlásené ďalšie nežiaduce účinky u ≥ 1 % až ≤ 2 % pacientov: hyperlaktacidémia/laktát acidóza, chrípka, pneumónia, psychická labilita, apatia, hučanie v ušiach, faryngolaryngeálna bolesť, zápal pery, získaná lipodystrofia a chromatúria. Liečba Pegasysom bola spojená s poklesom absolútneho počtu CD4+ buniek počas prvých 4 týždňov bez zníženia percenta CD4+ buniek. Pokles počtu CD4+ buniek bol po znížení dávky alebo po ukončení liečby reverzibilný. Používanie Pegasysu nemalo žiadny pozorovateľný negatívny vplyv na kontrolu HIV virémie počas liečby alebo následnom sledovaní pacientov. U koinfikovaných pacientov s počtom CD4+ buniek < 200/μl sú údaje
o bezpečnosti obmedzené.
Tabuľkový súhrn nežiaducich reakcií
V tabuľke 9 sú zhrnuté nežiaduce účinky hlásené u CHB alebo CHC pacientov pri liečbe Pegasysom
v monoterapii a u CHC pacientov liečených Pegasysom v kombinácii s ribavirínom. Nežiaduce účinky hlásené v klinických štúdiách sú zoradené do skupín podľa frekvencie a to nasledovne: veľmi časté
(≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až
< 1/1 000), veľmi zriedkavé (< 1/10 000). Frekvencia nežiaducich účinkov na základe spontánnych
hlásení vychádzajúcich zo skúseností po uvedení lieku na trh nie je známa (nemožno ju odhadnúť z dostupných údajov). V rámci jednotlivých skupín je frekvencia nežiaducich účinkov z hľadiska závažnosti usporiadaná v klesajúcom poradí.
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Infekcie a
nákazy
|
|
bronchitída,
infekcie horných dýchacích ciest, kandidóza
ústnej dutiny, herpes simplex, hubovité,
vírusové
a bakteriálne infekcie
|
pneumónia,
kožná infekcia
|
endokarditída,
zápal
vonkajšieho ucha
|
|
sepsa
|
Benígne a
malígne nádory
|
|
|
neoplazma
pečene
|
|
|
|
Poruchy krvi
a lymfatického systému
|
|
trombocytopéni
a, anémia, lymfadenopatia
|
|
pancytopénia
|
aplastická
anémia
|
izolovaná
aplázia červených krviniek
|
Poruchy
imunitného systému
|
|
|
sarkoidóza,
tyroiditída
|
anafylaxia,
systémový lupus erythematosus, reumatoidná artritída
|
idiopatická
alebo tromboticko- trombocyto- penická purpura
|
odvrhnutie
transplantá-tu pečene
a obličiek, Vogt- Koyanagi-
Harada
ochorenie
|
Poruchy
endokrinnéh o systému
|
|
hypotyreóza,
hypertyreóza
|
diabetes
|
diabetická
ketoacidóza
|
|
|
Poruchy
metabolizmu a výživy
|
anorexia
|
|
dehydratácia
|
|
|
|
Psychické
poruchy
|
depresia*,
úzkosť, nespavosť*
|
agresia, zmeny
nálady, emočné poruchy nervozita, pokles libida
|
samovražedn
é myšlienky, halucinácie
|
samovražda,
psychotická porucha
|
|
mánia,
bipolárne poruchy, myšlienky na vraždu
|
Poruchy
nervového systému
|
bolesť
hlavy, závrat*, zníženie
koncentrá-
cie
|
synkopa,
migréna, porucha pamäti slabosť,
hypoestézia,
hyperestézia, parestézia, tremor, porucha chuti, nočné mory, ospanlivosť
|
periférna neuropatia
|
kóma, kŕče, paréza tváre
|
|
cerebrálna ischémia
|
Poruchy oka
|
|
neostré videnie,
bolesť oka, zápal oka, xeroftalmia
|
krvácanie do
sietnice
|
zraková
neuropatia, papiloedém, poškodenie ciev sietnice, retinopatia, vred rohovky
|
strata zraku
|
serózne
odlúčenie sietnice
|
|
|
Tabuľka 9:Nežiaduce účinky hlásené v klinických skúšaniach a po uvedení lieku na trh pri monoterapii Pegasysom u pacientov s HBV alebo s HCV alebo v kombinácii s ribavirínom u HCV pacientov
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Poruchy
ucha a labyrintu
|
|
vertigo, bolesť
ucha
|
strata sluchu
|
|
|
|
Poruchy
srdca a srdcovej činnosti
|
|
tachykardia,
periférny edém, palpitácie,
|
|
infarkt
myokardu, kongestívne zlyhanie srdca, kardiomyopatia, angína, arytmia, fibrilácia predsiene, perikarditída, supra - vertikulárna tachykardia
|
|
|
Poruchy ciev
|
|
sčervenanie
|
hypertenzia
|
krvácanie do
mozgu, vaskulitída
|
|
periférna
ischémia
|
Poruchy
dýchacej sústavy hrudníka amediastína
|
dýchavica
|
námahová
dýchavica, krvácanie
z nosa, zápal nosohltana,
kongescia
prínosných dutín, nádcha, kongescia nosovej sliznice, bolesť hrdla
|
sipot
|
intersticiálna
pneumónia, vrátane úmrtia, pľúcna embólia
|
|
|
Poruchy
gastrointesti nál-neho traktu
|
hnačka*,
nevoľnosť*, bolesť brucha*
|
vracanie,
dyspepsia, dysfágia, ulcerácia dutiny ústnej, krvácanie ďasien, glositída, stomatitída, plynatosť, sucho v ústach
|
gastrointestin
álne krvácanie
|
peptický vred,
pankreatitída
|
|
ischemická
kolitída
|
Poruchy
pečene a žlčových ciest
|
|
|
porucha
funkcie pečene
|
zlyhanie pečene,
cholangitída, stukovatenie pečene
|
|
|
Poruchy
kože a podkožného tkaniva
|
alopécia,
dermatití- da, svrbenie, suchá koža
|
psoriáza,
urtikária, ekzém, vyrážka, zvýšené potenie, kožná porucha, fotosenzitivita, nočné potenie
|
|
|
Stevens-
Johnsonov syndróm, toxická epidermálna nekrolýza, angioedém, erythema multiforme
|
|
Telový systém
|
Veľmi
časté
|
Č
asté
|
Menej časté
|
Z
riedkavé
|
Veľmi zriedkavé
|
Frekvencia nie je známa
|
Poruchy
kostrovej a svalovej sústavy a
spojivového
tkaniva
|
myalgia,
artralgia
|
bolesť chrbta,
artritída, svalová slabosť, bolesť
kostí, bolesť
šije, bolesť svalov a kostrového systému, svalové kŕče
|
|
myozitída
|
|
rabdomyo- lýza
|
Poruchy
obličiek a močo- vých ciest
|
|
|
|
renálna
insuficiencia
|
|
|
Poruchy
reprodukčné ho systému a prsníkov
|
|
impotencia
|
|
|
|
|
Celkové
poruchy a reakcie
v mieste podania
|
pyrexia,
zimnica* bolesť*, asténia, únava, reakcia
v mieste podania injekcie*, citlivosť*
|
bolesť na
hrudníku, príznaky podobné chrípke, malátnosť, letargia, návaly tepla, smäd
|
|
|
|
|
Laboratórne
a funkčné vyšetrenia
|
|
úbytok
hmotnosti
|
|
|
|
|
Úrazy,
otravy a komplikácie liečebného postupu
|
|
|
|
predávkovanie
liekom
|
|
|
*Tieto nežiaduce reakcie boli časté (
≥1/100 až < 1/10) u CHB pacientov liečených Pegasysom v monoterapii.
Popis vybraných nežiaducich reakciíLaboratórne hodnoty
Liečbu Pegasysom sprevádzali nasledovné odchýlky laboratórnych parametrov: zvýšenie ALT, zvýšenie bilirubínu, poruchy rovnováhy elektrolytov (hypokaliémia, hypokalciémia, hypofosfatémia), hyperglykémia, hypoglykémia a zvýšenie triglyceridov (pozri časť 4.4). U oboch spôsobov liečby, t.j. pri použití Pegasysu v monoterapii aj v kombinácii s ribavirínom sa u 2 % pacientov pozoroval vzostup hladín ALT, ktorý si vyžiadal úpravu dávkovania alebo ukončenie liečby.
Liečba Pegasysom bola spojená s poklesom hematologických parametrov (leukopénia, neutropénia, lymfopénia, trombocytopénia a pokles hemoglobínu), ktoré sa po úprave dávkovania obyčajne zlepšili a vrátili na úroveň spred liečby v priebehu 4 - 8 týždňov po ukončení liečby (pozri časti 4.2 a 4.4).
Mierna neutropénia (ANC: 0,749 – 0,5 x 109/l) sa pozorovala u 24 % (216/887) pacientov a ťažká neutropénia (ANC: < 0,5 x 109/l) u 5 % (41/887) pacientov, ktorí dostávali Pegasys v dávke
180 mikrogramov v kombinácii s ribavirínom v dávke 1 000 mg alebo 1 200 mg počas 48 týždňov.
Protilátky proti interferónu
U 1 – 5 % pacientov liečených Pegasysom sa zistila prítomnosť neutralizačných protilátok. Podobne ako v prípade ďalších interferónov, vyšší výskyt neutralizačných protilátok sa pozoroval aj pri
chronickej hepatitíde B. Avšak pri žiadnej z týchto chorôb to nesúviselo s nedostatočnou terapeutickou
odpoveďou.
Funkcia štítnej žľazyLiečbu Pegasysom sprevádzali klinicky významné odchýlky hodnôt parametrov štítnej žľazy, ktoré si vyžadovali klinický zásah (pozri časť 4.4). Výskyt pozorovaných odchýlok (4,9 %) u pacientov
liečených Pegasysom v kombinácii s ribavirínom (NV15801) je podobný ako u pacientov liečených
inými interferónmi.
Laboratórne hodnoty u pacientov súčasne infikovaných vírusmi HIV-HCVHoci hematologická toxicita neutropénie, trombocytopénie a anémie sa vyskytovala častejšie u HIV- HCV pacientov, väčšina prípadov sa dala zvládnuť úpravou dávkovania a použitím rastových faktorov a vzácne došlo k predčasnému ukončeniu liečby. Pokles hladín ANC pod 500 buniek/mm3 sa
pozoroval u 13 % a 11 % pacientov, ktorí dostávali Pegasys v monoterapii a v kombinácii v uvedenom poradí. Pokles počtu krvných doštičiek pod 50 000/mm3 sa pozoroval u 10 % a 8 % pacientov, ktorí dostávali Pegasys v monoterapii a v kombinácii v uvedenom poradí. Anémia (hemoglobín < 10 g/dl)
sa popísala u 7 % a 14 % pacientov liečených Pegasysom v monoterapii a v kombinácii v uvedenom
poradí.
Pediatrická populáciaChronická hepatitída CV klinickom skúšaní so 114 pediatrickými pacientmi (vo veku 5 až 17 rokov) liečenými samotným Pegasysom alebo v kombinácii s ribavirínom (pozri časť 5.1) boli úpravy dávky potrebné u približne jednej tretiny pacientov najčastejšie kvôli neutropénii a anémii. Vo všeobecnosti bol bezpečnostný profil pozorovaný u pediatrických pacientov podobný ako profil pozorovaný u dospelých.
V pediatrickej štúdii najrozšírenejšie nežiaduce reakcie u pacientov liečených kombinovanou liečbou Pegasysom a ribavirínom počas až 48 týždňov boli ochorenie podobné chrípke (91 %), bolesť hlavy (64 %), gastrointestinálne ochorenie (56 %) a reakcie v mieste podania injekcie (45 %). Úplný zoznam nežiaducich reakcií hlásených v tejto liečebnej skupine (n = 55) je uvedený v tabuľke 10. Sedem pacientov užívajúcich kombinovanú liečbu Pegasysom a ribavirínom počas 48 týždňov prerušilo
liečbu s bezpečnostných dôvodov (depresia, abnormálne hodnotenie psychického stavu, prechodná slepota, exudáty na sietnici , hyperglykémia, diabetes mellitus typu 1 a anémia). Väčšina nežiaducich
reakcií zaznamenaných v štúdii bola mierna alebo stredne závažná. Závažné nežiaduce reakcie sa zaznamenali u 2 pacientov v skupine s kombinovanou liečbou Pegasysom plus ribavirín (hyperglykémia a cholecystektómia).
Tabuľka 10: Nežiaduce reakcie hlásené u pediatrických pacientov infikovaných vírusom HCVpripisované Pegasysu plus ribavirínu v štúdii NV17424Telový systém
| Veľmi časté
| Časté
|
Infekcie a nákazy
|
| infekčná mononukleóza,
streptokoková faryngitída, chrípka, vírusová gastroenteritída, kandidóza, gastroenteritída, zubný absces, hordeolum, infekcia močových ciest, zápal nosohltana
|
Poruchy krvi a lymfatického
systému
|
| anémia
|
Poruchy metabolizmu a výživy
| zníženie chute do jedla
| hyperglykémia, diabetes mellitus
typu 1
|
T
elový systém
|
V
eľmi časté
|
Č
asté
|
Psychické poruchy
|
insomnia
|
depresia, úzkosť, halucinácie,
nenormálne správanie, agresia, hnev, zníženie pozornosti/neusporiadaná hyperaktivita
|
Poruchy nervového systému
|
bolesť hlavy
|
závrat, porucha pozornosti, migréna
|
Poruchy oka
|
|
prechodná slepota, exudáty na
sietnici, zhoršenie videnia, podráždenie oka, bolesť oka, svrbenie oka
|
Poruchy ucha a labyrintu
|
|
bolesť ucha
|
Poruchy dýchacej sústavy, hrudníka
a mediastína
|
|
dyspnoe, epistaxa
|
Poruchy gastrointestinálneho traktu
|
gastrointestinálna porucha
|
bolesť v nadbrušku, stomatitída,
nevoľnosť, aftózna stomatitída, orálna porucha
|
Poruchy kože a
podkožného tkaniva
|
vyrážka, svrbenie, alopécia
|
opuch tváre, liekový exantém
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
|
muskuloskeletálna bolesť
|
bolesť chrbta, bolesť končatín
|
Poruchy obličiek a močových ciest
|
|
dyzúria, inkontinencia, porucha
močového traktu
|
Poruchy reprodukčného systému a
prsníkov
|
|
výtok z pošvy
|
Celkové poruchy a reakcie v mieste
podania
|
ochorenie podobné chrípke, reakcia
v mieste podania injekcie, iritabilita, únava
|
horúčka, hematóm v mieste podania
injekcie do žily, , bolesť
|
Laboratórne a funkčné vyšetrenia
|
|
abnormálny psychiatrický nález
|
Chirurgické a liečebné postupy
|
|
extrakcia zuba, cholecystektómia
|
Sociálne podmienky
|
|
problém s učením
|
U pediatrických pacientov sa pozorovala inhibícia rastu (pozri časť 4.4). V porovnaní
s východiskovým stavom sa u pediatrických pacientov po 48 týždňoch terapie kombinovanou liečbou
Pegasysom plus ribavirínom pediatrických pacientov preukázalo oneskorenie v náraste hmotnosti
a výšky. Počas liečby klesli percentily „hmotnosti vzhľadom na vek“ a percentily„výšky vzhľadom na vek“ v porovnaní s normálnou populáciou. Na konci 2-ročného sledovania po liečbe sa väčšina jedincov vrátila k východiskovým percentilom normálnej rastovej krivky pre hmotnosť a výšku (priemerný percentil hmotnosti bol 64 % na začiatku a 60 % 2 roky po liečbe; priemerný percentil výšky bol 54 % na začiatku a 56 % 2 roky po liečbe). Na konci liečby sa u 43 % jedincov znížil percentil hmotnosti o 15 percentilov alebo viac a u 25 % sa znížil percentil výšky o 15 percentilov alebo viac v porovnaní s normálnou rastovou krivkou. 2 roky po liečbe bolo 16 % osôb stále 15 percentilov alebo viac pod svojou východiskovou krivkou hmotnosti a 11 % 15 percentilov alebo viac pod svojou východiskovou krivkou výšky.
Laboratórne hodnotyZníženie koncetrácie hemoglobínu, počtu neutrofilov a trombocytov môže vyžadovať zníženie dávky alebo trvalé vysadenie liečby (pozri tabuľku 3 a tabuľku 7). Väčšina patologických zmien
v laboratórnych parametroch zaznamenaných počas klinického skúšania sa v krátkom čase po
vysadení liečby vrátila na východiskovú úroveň.
4.9 PredávkovanieOpísali sa prípady predávkovania v rozsahu od dvoch injekcií podaných počas 2 nasledujúcich dní
(namiesto týždenného intervalu) až po každodenné podávanie injekcií počas 1 týždňa (t.j.
1 260 mikrogramov/týždeň). U žiadneho z týchto pacientov sa neobjavili nezvyčajné resp. závažné alebo liečbu limitujúce udalosti. V klinických štúdiách pri karcinóme obličiek a chronickej myeloidnej leukémii sa podávali týždenné dávky až do 540 mikrogramov a 630 mikrogramov. Medzi toxické
prejavy limitujúce dávkovanie patrila únava, elevácia pečeňových enzýmov, neutropénia, trombocytopénia, čo zodpovedá interferónovej liečbe.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Imunostimulanciá, interferóny, ATC kód: L03A B11
Spôsob účinku
Konjugácia reagentu PEG (bis-monometoxypolyetylénglykol) s interferónom alfa-2a vedie k vzniku
pegylovaného interferónu alfa-2a (Pegasys). Pegasys in vitro vykazuje antivírusové a antiproliferatívne účinky, ktoré sú charakteristické pre interferón alfa-2a.
Interferón alfa-2a je konjugovaný s bis-[monometoxypolyetylénglykolom] v rozsahu substitúcie jedného mólu polyméru/mól bielkoviny. Priemerná molekulová hmotnosť je asi 60 000, z ktorej podiel bielkoviny tvorí približne 20 000.
Farmakodynamické účinky
U pacientov s hepatitídou C reagujúcich na liečbu Pegasysom 180 mikrogramov dochádza
k bifázickému poklesu hladín HCV RNA. Prvá fáza poklesu sa objavuje 24 až 36 hodín po prvej dávke Pegasysu. Po nej dochádza k druhej fáze poklesu, ktorá pretrváva počas nasledovných 4 - 16 týždňov u pacientov, ktorí dosiahnu pretrvávajúcu odpoveď na liečbu. Ribavirín nemá žiadny významný vplyv na začiatočnú vírusovú kinetiku počas prvých 4 až 6 týždňov u pacientov liečených kombináciou ribavirínu a pegylovaného interferónu alfa-2a alebo interferónu alfa.
Klinická účinnosť a bezpečnosť
Chronická hepatitída B
Na všetkých klinických skúšaniach sa zúčastnili pacienti s chronickou hepatitídou B, u ktorých sa zistila aktívna vírusová replikácia meraná ako HBV DNA, zvýšené hladiny ALT a biopsia pečene bola konzistentná s chronickou hepatitídou. V štúdii WV16240 sa zúčastnili pacienti, ktorí boli pozitívni na HBeAg, zatiaľ čo v štúdii WV16241 sa zúčastnili pacienti, ktorí boli negatívni na HBeAg a pozitívni na anti-HBe. V obidvoch štúdiách liečba trvala 48 týždňov a sledovanie po liečbe trvalo 24 týždňov. V obidvoch štúdiách sa porovnával Pegasys plus placebo vs. Pegasys plus lamivudín vs. lamivudín v monoterapii. Do týchto klinických skúšaní neboli zaradení pacienti s HBV-HIV koinfekciou.
Miery odpovedí na konci sledovania u týchto dvoch štúdií sú uvedené v tabuľke 11. V štúdii WV16240, primárne koncové ukazovatele na hodnotenie účinnosti boli HBeAg sérokonverzia a HBV- DNA pod 105 kópií/ml. V štúdii WV16241, primárne koncové ukazovatele na hodnotenie účinnosti boli normalizácia ALT a HBV-DNA pod 2 x 104 kópií/ml. HBV DNA sa merala pomocou testu COBAS AMPLICORTM HBV MONITOR (hranica detekcie 200 kópií/ml).
Celkove 283/1351 (21 %) pacientov malo pokročilú fibrózu alebo cirhózu, 85/1351 (6 %) malo cirhózu. Neboli rozdiely v miere odpovede medzi týmito pacientmi a tými bez pokročilej fibrózy alebo cirhózy.
Tabuľka 11: Sérologická, virologická a biochemická odpoveď pri chronickej hepatitíde B
|
HBeAg-pozitívni pacienti
Štúdia WV16240
|
HBeAg-negatívni / anti-HBe-pozitívni pacienti
Štúdia WV16241
|
Parameter odpovede
|
Pegasys
180 µg
&
placebo
(N = 271)
|
Pegasys
180 µg
&
lamivudín
100 mg
(N = 271)
|
lamivudín
100 mg
(N = 272)
|
Pegasys
180 µg
&
placebo
(N = 177)
|
Pegasys
180 µg
&
lamivudín
100 mg
(N = 179)
|
lamivudín
100 mg
(N = 181)
|
HBeAg
sérokonverzia
|
32 %#
|
27 %
|
19 %
|
N/A
|
N/A
|
N/A
|
HBV DNA
odpoveď*
|
32 %#
|
34 %
|
22 %
|
43 %#
|
44 %
|
29 %
|
ALT
normalizácia
|
41 %#
|
39 %
|
28 %
|
59 %#
|
60 %
|
44 %
|
HBsAg
sérokonverzia
|
3 %#
|
3 %
|
0 %
|
3 %
|
2 %
|
0 %
|
|
|
* Pre HBeAg-pozitívnych pacientov: HBV DNA < 105 kópií/ml
Pre HBeAg-negatívnych / anti-HBe-pozitívnych pacientov: HBV DNA < 2 x 104 kópií/ml
# p-hodnota (vs. lamivudín) ≤ 0,01 (stratifikovaný Cochran-Mantel-Haenszelov test)
Histologická odpoveď bola v každej štúdii vo všetkých troch liečebných skupinách podobná; avšak pacienti, u ktorých sa dokázala trvalá odpoveď 24 týždňov po ukončení liečby, s oveľa vyššou pravdepodobnosťou dosiahli tiež histologické zlepšenie.
Všetci pacienti, ktorí ukončili štúdie fázy III, boli vhodní na zaradenie do štúdie s dlhodobým sledovaním (WV16866). V skupine pacientov v štúdii WV16240, ktorí dostávali Pegasys
v monoterapii a boli zaradení do štúdie s dlhodobým sledovaním, stupeň trvalej HBeAg sérokonverzie
12 mesiacov po ukončení terapie bol 48 % (73/153). U pacientov, ktorí dostávali Pegasys
v monoterapii v štúdii WV16241, stupeň HBV DNA odpovede a normalizácie ALT 12 mesiacov po ukončení liečby bol 42 % (41/97) a 59 % (58/99).
Chronická hepatitída C Predpoklad odpovede na liečbuPozrite si časť 4.2 v tabuľke 2.
Závislosť odpovede na liečbu od dávky pri monoterapiiPri priamom porovnaní dávok 90 mikrogramov a 180 mikrogramov bola dávka 180 mikrogramov spojená s lepšou pretrvávajúcou virologickou odpoveďou na liečbu u pacientov s cirhózou, avšak
v štúdii s pacientmi bez cirhózy sa pri dávkach 135 mikrogramov a 180 mikrogramov dosiahli veľmi podobné výsledky.
Potvrdzujúce klinické štúdie u dospelých predtým neliečených pacientovVšetky klinické štúdie zahŕňali pacientov, ktorí predtým nedostávali interferón a u ktorých sa chronická hepatitída C potvrdila prítomnosťou detekovateľných hladín HCV RNA v sére, zvýšenými hladinami ALT (s výnimkou štúdie NR16071) a biopsiou pečene s nálezom chronickej hepatitídy.
Štúdia NV15495 špecificky zahŕňala pacientov s diagnózou cirhózy (približne 80 %) alebo prechodu
do cirhózy (približne 20 %), ktoré sa potvrdili histologicky. Do štúdie NR15961 sa zahrnuli len HIV- HCV koinfikovaní pacienti(pozri tabuľku 20). Títo pacienti mali stabilné HIV ochorenie a priemer počtu CD4 T-buniek bol okolo 500 buniek/μl.
Údaje o liečebných režimoch, dĺžke trvania liečby a výsledkoch štúdií u HCV monoinfikovaných
pacientov a HIV-HCV koinfikovaných pacientov sa uvádzajú v tabuľkách 12, 13, 14 a v tabuľke 20.
Virologická odpoveď na liečbu sa definovala ako nemerateľné hladiny HCV RNA pri vyšetrení COBAS AMPLICOR™ HCV Test, Version 2.0 (detekčný limit: 100 kópií/ml, čo zodpovedá 50 medzinárodným jednotkám/ml). Trvalá odpoveď sa definovala ako jedna negatívna vzorka približne 6 mesiacov po ukončení liečby.
Tabuľka 12:Virologická odpoveď u HCV pacientov
| Monoterapia Pegasysom
| Kombinovaná liečba Pegasysom
|
pacienti s cirhózou aj bez nej
| Pacienti s cirhózou
| pacienti s cirhózou aj bez nej
|
Štúdia NV15496 + NV15497 + NV15801
| Štúdia NV15495
| Štúdia
NV15942
| Štúdia NV15801
|
Pegasys
180 µg
(N = 701)
48 týždňov
| interferón alfa-2a
6 MIU/3 MIU
&
3 MIU
(N = 478)
48 týždňov
| Pegasys
180 µg
(N = 87)
48 týždňov
| interferón alfa-2a
3 MIU
(N = 88)
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200
mg
(N = 436)
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
(N = 453)
48 týždňov
| interferón alfa-2b
3 MIU
&
ribavirín
1000/1200
mg
(N = 444)
48 týždňov
|
Odpoveď
na konci liečby
|
55 - 69 %
|
22 - 28 %
|
44 %
|
14 %
|
68 %
|
69 %
|
52 %
|
Celková
trvalá odpoveď
|
28 - 39 %
|
11 - 19 %
|
30 %∗
|
8 %∗
|
63 %
|
54 %∗∗
|
45 %∗∗
|
∗ 95 % CI pre rozdiel: 11 % až 33 % p = 0,001 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
∗∗ 95 % CI pre rozdiel: 3 % až 16 % p = 0,003 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
Virologické odpovede na liečbu vo vzťahu ku genotypu a vírusovej záťaži pred liečbou u HCV monoinfikovaných pacientov liečených Pegasysom v kombinácii s ribavirínom a v závislosti na genotype, vírusovej záťaži pred liečbou a rýchlej virologickej odpovede v 4. týždni sú zhrnuté
v tabuľke 13 a v tabuľke 14. Výsledky štúdie NV15942 poskytujú racionálne podklady pre odporúčania liečebných režimov na základe genotypu, vírusovej záťaže na začiatku liečby a virologickej odpovede v 4. týždni (pozri tabuľky 1, 13 a 14).
Rozdiel medzi liečebnými režimami nebol vo všeobecnosti ovplyvnený prítomnosťou/neprítomnosťou cirhózy; preto tieto základné charakteristiky neovplyvňujú tieto odporúčania pre liečbu pre
genotypy 1, 2 alebo 3.
Tabuľka 13:Trvalá virologická odpoveď u HCV pacientov po kombinovanej liečbe Pegasysom a ribavirínom v závislosti na genotype a vírusovej záťaži pred liečbou
|
Štúdia NV15942
|
Štúdia NV15801
|
Pegasys
180 µg
&
ribavirín
800 mg
24 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
|
Pegasys
180 µg
&
ribavirín
800 mg
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Interferón alfa-
2b
3 MIU
&
ribavirín
1000/1200 mg
48 týždňov
|
Genotyp 1
Nízka
vírusová záťaž
Vysoká vírusová záťaž
|
29 %(29/101)
41 %(21/51)
16 %(8/50)
|
42 %(49/118) ∗
52 %(37/71)
26 %(12/47)
|
41 %(102/250) ∗
55 %(33/60)
36 %(69/190)
|
52 %(142/271) ∗
65 %(55/85)
47 %(87/186)
|
45 %(134/298)
53 %(61/115)
40 %(73/182)
|
36 %(103/285)
44 %(41/94)
33 %(62/189)
|
Genotyp 2/3
Nízka
vírusová záťaž
Vysoká vírusová záťaž
|
84 %(81/96)
85 %(29/34)
84 %(52/62)
|
81 %(117/144)
83 %(39/47)
80 %(78/97)
|
79 %(78/99)
88 %(29/33)
74 %(49/66)
|
80 %(123/153)
77 %(37/48)
82 %(86/105)
|
71 %(100/140)
76 %(28/37)
70 %(72/103)
|
61 %(88/145)
65 %(34/52)
58 %(54/93)
|
Genotyp 4
|
(0/5)
|
(8/12)
|
(5/8)
|
(9/11)
|
(10/13)
|
(5/11)
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; Vysoká vírusová záťaž = > 800 000 IU/ml
* Pegasys 180 µg & ribavirín 1000/1200 mg, 48 týždňov v porovnaní s Pegasysom 180 µg & ribavirínom 800 mg
48 týždňov: Odds Ratio (95 % CI) = 1,52 (1,07 až 2,17), p=0,020 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
* Pegasys 180 µg & ribavirín 1000/1200 mg, 48 týždňov v porovnaní s Pegasysom 180 µg & ribavirínom 1000/1200 mg,
24 týždňov: Odds Ratio (95 % CI) = 2,12 (1,30 až 3,46), p=0,002 (podľa stratifikovaného Cochran-Mantel-Haenszelovho testu)
Možnosť zvážiť skrátenie dĺžky trvania liečby na 24 týždňov u pacientov s genotypom 1 a 4 sa sledovala na podklade dosiahnutej trvalej virologickej odpovede u pacientov s rýchlou virologickou odpoveďou v 4. týždni v štúdiách NV15942 a ML17131 (pozri tabuľku 14).
Štúdia NV15942
| Štúdia ML17131
|
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Genotyp 1
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 90 % (28/31)
93 % (25/27)
75 % (3/4)
| 92 % (47/51)
96 % (26/27)
88 % (21/24)
| 77 % (59/77)
80 % (52/65)
58 % (7/12)
| Genotyp 1 nie RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 24 % (21/87)
27 % (12/44)
21 % (9/43)
| 43 % (95/220)
50 % (31/62)
41 % (64/158)
| -
-
-
| Genotyp 4 RVR
| (5/6)
| (5/5)
| 92 % (22/24)
| Genotyp 4 nie RVR
| (3/6)
| (4/6)
| -
|
|
|
Tabuľka 14:Trvalá virologická odpoveď v závislosti na rýchlej virologickej odpovedi v 4. týždni pre genotyp 1 a 4 po kombinovanej liečbe Pegasysom a ribavirínom u HCV pacientovNízka vírusová záťaž = ≤ 800 000 IU/ml; Vysoká vírusová záťaž = > 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedegovateľná HCV RNA) v 4. týždni a nedegovateľná HCV RNA v 24 týždni.
Údaje, i keď obmedzené, ukazujú, že skrátenie času na 24 týždňov, sa môže spájať s vysokým rizikom relapsu (pozri tabuľku 15).
Tabuľka 15:Relaps vo virologickej odpovedi na konci liečby u populácie s rýchlou virologickou odpoveďou
| Štúdia NV15942
| Štúdia NV15801
|
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
24 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
| Pegasys
180 µg
&
ribavirín
1000/1200 mg
48 týždňov
|
Genotyp 1 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 6,7 % (2/30)
3,8 % (1/26)
25 % (1/4)
| 4,3 % (2/47)
0 % (0/25)
9,1 % (2/22)
| 0 % (0/24)
0 % (0/17)
0 % (0/7)
|
Genotyp 4 RVR
| (0/5)
| (0/5)
| 0 % (0/4)
|
Možnosť skrátenia liečby na 16 týždňov u pacientov genotypu 2 alebo 3 bola skúmaná na základe
trvalej virologickej odpovede pozorovanej u pacientov s rýchlou virologickou odpoveďou v 4. týždni v štúdii NV17317 (pozri tabuľku 16).
V štúdii NV17317 všetci pacienti infikovaní vírusovým genotypom 2 alebo 3 dostávali Pegasys 180ug subkutánne raz týždenne a ribavirín v dávke 800 mg a boli randomizovaní na liečbu počas 16 alebo 24 týždňov. Celková liečba počas 16 týždňov viedla ku nižšej trvalej virologickej odpovedi (65 %) než liečba počas 24 týždňov (76 %) (p<0,0001).
Trvalá virologická odpoveď dosiahnutá po 16. týždňoch liečby a po 24. týždňoch liečby sa sledovala retrospektívnou analýzou pacientov, ktorí boli HCV RNA negatívni v 4. týždni a mali iniciálne LVL (pozri tabuľku 16).
Tabuľka 16:Trvalá virologická odpoveď celkovo a na základe rýchlej virologickej odpovede v 4. týždni pre genotyp 2 alebo 3 po kombinovanej liečbe liekom Pegasysoms ribavirínom u HCV pacientovŠtúdia NV17317
|
a
| Pegasys 180 µg
&
ribavirín
800 mg
16 týždňov
| Pegasys 180 µg
&
ribavirín
800 mg
24 týždňov
| Rozdiel v liečbe
[95 %CI]
| p-hodnota
|
Genotyp 2 alebo 3
| 65 % (443/679)
| 76 % (478/630)
| -10,6 % [-15,5 %; -0,06 %]
| p<0,0001
|
Genotyp 2 alebo 3 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 82 % (378/461)
89 % (147/166)
78 % (231/295)
| 90 % (370/410)
94 % (141/150)
88 % (229/260)
| -8,2 % [-12,8 %; -3,7 %]
-5,4 % [-12 %; 0,9 %]
-9,7 % [-15,9 %;-3,6 %]
| p=0,0006
p=0,11
p=0,002
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž => 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedetegovateľné hladiny HCV RNA) v 4. týždni
V súčasnosti nie je jasné, či vyššia dávka ribavirínu (napr. 1 000/2 000 mg/deň podľa telesnej hmotnosti) vedie k vyššej trvalej virologickej odpovedi (SVR) než dávka 800 mg/deň, keď je liečba skrátená na 16 týždňov.
Údaje naznačujú, že skrátenie liečby na 16 týždňov sa môže spájať so zvýšeným rizikom relapsu
(pozri tabuľku 17).
Tabuľka 17:Relaps vo virologickej odpovedi po ukončení liečby u pacientov genotypu 2 alebo 3s rýchlou virologickou odpoveďou
|
Štúdia NV17317
|
|
Pegasys
180 µg
&
ribavirín
800 mg
16 týždňov
|
Pegasys
180 µg
&
ribavirín
800 mg
24 týždňov
|
Rozdiel v liečbe
[95 %CI]
|
p hodnota
|
Genotyp 2 alebo 3 RVR
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
15 % (67/439)
6 % (10/155)
20 % (57/284)
|
6 % (23/386)
1 % (2/141)
9 % (21/245)
|
9,3 % [5,2 %; 13,6 %]
5 % [0,6 % ; 10,3 %]
11,5 % [5,6 % ; 17,4 %]
|
p<0,0001
p=0,04
p=0,0002
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž = > 800 000 IU/ml
RVR = rýchla virologická odpoveď (nedetegovateľné hladiny HCV RNA) v 4. týždni
Lepšia účinnosť Pegasysu v porovnaní s interferónom alfa-2a sa ukázala aj na histologickej odpovedi, vrátane pacientov s cirhózou a/alebo HIV-HCV koinfekciou.
Dospelí pacienti s chronickou hepatitídou C, ktorí neodpovedali na predchádzajúcu liečbu V štúdii MV17150 boli pacienti, ktorí neodpovedali na predchádzajú liečbu pegylovaným interferónom alfa-2b a ribavirínom, boli randomizovaní do štyroch rôznych liečebných skupín:
• Pegasys 360 µg/týždeň počas 12 týždňov a následne 180 µg/týždeň počas ďalších 60 týždňov;
• Pegasys 360 µg/týždeň počas 12 týždňov a následne 180 µg/týždeň počas ďalších 36 týždňov;
• Pegasys 180 µg/týždeň počas 72 týždňov;
• Pegasys 180 µg/týždeň počas 48 týždňov.
Všetci pacienti užívali ribavirín (1 000 alebo 1 200 mg/deň) v kombinácii s Pegasysom. Všetky
liečebné skupiny boli následne sledované počas 24-týždňového obdobia bez liečby.
Na základe viacnásobnej regresnej analýzy a súhrnnej skupinovej analýzy hodnotiacej vplyv dĺžky trvania liečby a podávania indukčnej dávky sa jednoznačne stanovilo, že liečba v trvaní 72 týždňov je primárnym faktorom dosiahnutia trvalej virologickej odpovede. Rozdiely v trvalej virologickej odpovedi (SVR) podmienené dĺžkou trvania liečby, demografickými ukazovateľmi a najlepšími odpoveďami na predchádzajúcu liečbu sú uvedené v tabuľke 18.
Tabuľka 18:Virologická odpoveď v 12. týždni (VR) a trvalá virologická odpoveď (SVR) u pacientov, ktorí neodpovedali na liečbu kombináciou peginterferónu alfa-2b a ribavirínu a ktorí dosiahli virologickú odpoveď v 12. týždni po liečbe kombináciou Pegasysu a ribavirínu
| Štúdia MV17150
|
|
|
| Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
72 alebo 48 týždňov (N = 942) pacienti s
VR v týždni 12 a
(N = 876)
| Pegasys 360/180
alebo 180 μg
&
ribavirín
1000/1200 mg
72 týždňov
(N = 473)
SVR u pacientov s VR v týždni 12 b (N = 100)
| Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
48 týždňov
(N = 469)
SVR u pacientov s VR v týždni 12 b (N = 57)
|
Celková trvalá odpoveď
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 18 % (157/876)
35 % (56/159)
14 % (97/686)
| 57 % (57/100)
63 % (22/35)
54 % (34/63)
| 35 % (20/57)
38 % (8/21)
32 % (11/34)
|
Genotyp 1/4
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 17 % (140/846)
35 % (54/154)
13 % (84/663)
| 55 % (52/94)
63 % (22/35)
52 % (30/58)
| 35 % (16/46)
37 % (7/19)
35 % (9/26)
|
Genotyp 2/3
Nízka vírusová záťaž
Vysoká vírusová záťaž
| 58 % (15/26)
(2/5) (11/19)
| (4/5)
—
(3/4)
| (3/10)
(1/2) (1/7)
|
Prítomnosť cirhózy
Cirhóza
Neprítomnosť cirhózy
|
8 % (19/239)
22 % (137/633)
|
(6/13)
59 % (51/87)
|
(3/6)
34 % (17/50)
|
|
Štúdia MV17150
|
|
|
|
Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
72 alebo 48 týždňov (N = 942) pacienti s
VR v týždni 12 a
(N = 876)
|
Pegasys 360/180
alebo 180 μg
&
ribavirín
1000/1200 mg
72 týždňov
(N = 473)
SVR u pacientov s VR v týždni 12 b (N = 100)
|
Pegasys 360/180 alebo
180 μg
&
ribavirín
1000/1200 mg
48 týždňov
(N = 469)
SVR u pacientov s VR v týždni 12 b (N = 57)
|
Najlepšia odpoveď počas predchádzajúcej liečby
Pokles u HCV RNA ≥2log10
Pokles u HCV RNA <2log10
Chýbanie najlepšej odpovede
|
28 % (34/121)
12 % (39/323)
19 % (84/432)
|
68 % (15/22)
64 % (16/25)
49 % (26/53)
|
(6/12) (5/14)
29 % (9/31)
|
Vysoká vírusová záťaž = > 800 000 IU/ml, nízka vírusová záťaž = ≤ 800 000 IU/ml;
a Pacienti, ktorí dosiahli potlačenie aktivity vírusu v 12. týždni (nedetegovateľná HCV RNA definovaná ako < 50 IU/ml) boli považovaní za pacientov s dosiahnutou virologickou odpoveďou v 12. týždni. Pacienti, ktorým chýbali výsledky HCV RNA
v 12. týždni boli vylúčení z analýzy.
b Pacienti, ktorí dosiahli potlačenie aktivity vírusu v 12. týždni, ale chýbali im výsledky HCV RNA na konci sledovania boli považovaní za pacientov, neodpovedajúcich na liečbu.
V štúdii HALT-C boli pacienti s chronickou hepatitídou C a pokročilou fibrózou alebo cirhózou, ktorí neodpovedali na predchádzajúcu liečbu interferónom alfa alebo pegylovaným interferónom alfa
v monoterapii alebo v kombinácii s ribavirínom, liečení Pegasysom 180 µg/týždeň a ribavirínom
1 000/1 200 mg denne. Pacienti, ktorí po 20 týždňoch liečby dosiahli nedetegovateľné hladiny
HCV RNA, pokračovali v kombinovanej liečbe Pegasysom a ribavirínom trvajúcej celkovo
48 týždňov a po ukončení liečby boli sledovaní 24 týždňov. Pravdepodobnosť trvalej virologickej odpovede sa líšila v závislosti od predchádzajúceho režimu liečby; pozri tabuľku 19.
 Tabuľka 19:Trvalá virologická odpoveď v štúdii HALT-C uvedená podľa predchádzajúceho režimu liečby u pacientov, ktorí naň neodpovedaliPredchádzajúca liečba Pegasys
Tabuľka 19:Trvalá virologická odpoveď v štúdii HALT-C uvedená podľa predchádzajúceho režimu liečby u pacientov, ktorí naň neodpovedaliPredchádzajúca liečba Pegasys 180 µg a
ribavirín 1 000/1 200 mg

počas 48 týždňov
Interferón 27 % (70/255)
Pegylovaný interferón 34 % (13/38)
Interferón a ribavirín 13 % (90/692)
Pegylovaný interferón a ribavirín 11 % (7/61) HIV-HCV koinfikovaní pacientiVirologické odpovede u pacientov, ktorí sú liečení s Pegasysom v monoterapii a s Pegasysom a ribavirínom v kombinácii v závislosti na genotype a vírusovej záťaži pred liečbou pre HIV-HCV
koinfikovaných pacientov sú zhrnuté nižšie v tabuľke 20.
Štúdia NR15961
|
| Interferón alfa-2a
3 MIU
&
ribavirín 800 mg
48 týždňov
| Pegasys
180 µg
&
placebo
48 týždňov
| Pegasys
180 µg
&
ribavirín 800 mg
48 týždňov
| Všetci pacienti
| 12 % (33/285)*
| 20 % (58/286) *
| 40 % (116/289) *
|
|
|
Tabuľka 20:Trvalá virologická odpoveď po liečbe Pegasysom v kombinácii s ribavirínom v závislosti na genotype a vírusovej záťaži u HIV-HCV súčasne infikovaných pacientov pred liečbou
Genotyp 1
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
7 % (12/171)
19 % (8/42)
3% (4/129)
|
14 % (24/175)
38 % (17/45)
5 % (7/130)
|
29 % (51/176)
61 % (28/46)
18 % (23/130)
|
Genotyp 2-3
Nízka vírusová záťaž
Vysoká vírusová záťaž
|
20 % (18/89)
27 % (8/30)
17 % (10/59)
|
36 % (32/90)
38 % (9/24)
35 % (23/66)
|
62% (59/95)
61 % (17/28)
63 % (42/67)
|
Nízka vírusová záťaž = ≤ 800 000 IU/ml; vysoká vírusová záťaž = > 800 000 IU/ml
* Pegasys 180 µg & ribavirín 800 mg oproti Interferón alfa-2a 3 MIU, ribavirín 800 mg: Pomer pravdepodobnosti (95 % CI)=5,40 (3,42 – 8,54),… p-hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0001
* Pegasys 180 µg & ribavirín 800 mg oproti Pegasys 180 µg: Pomer pravdepodobnosti (95 % CI)=2,89 (1,93 – 4,32),… p- hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0001
* Interferón alfa-2a 3 MIU & ribavirín 800 mg oproti Pegasys 180 µg: Pomer pravdepodobnosti (95 % CI)=0,53 (0,33 –
0,85),… p-hodnota (stratifikovaný Cochran-Mantel-Haenszelov test)= < 0,0084
Nasledujúca štúdia (NV18209) u pacientov s koinfekciou HCV genotyp 1 a HIV porovnávala liečbu Pegasysom 180 µg týždenne s dávkou ribavirínu 800 mg alebo s dávkou ribavirínu 1 000 mg (<75 kg telesnej hmotnosti)/1 200 mg (≥75 kg telesnej hmotnosti) denne počas 48 týždňov. Štúdia nebola dizajnovaná na preukázanie účinnosti. Bezpečnostné profily u obidvoch skupín s ribavirínom boli konzistentné so známym bezpečnostným profilom pri kombinovanej liečbe Pegasysom a ribavirínom
a nepoukazujú na žiadne relevantné rozdiely, okrem mierneho nárastu anémie v skupine s vyššou dávkou ribavínu.
HCV pacienti s normálnymi hladinami ALTV štúdii NR16071 náhodne vybratí HCV pacienti s normálnymi hodnotami ALT užívali Pegasys
180 µg/týždeň a ribavirín 800 mg/deň počas 24 alebo 48 týždňov. Potom nasledoval 24 týždňové obdobie bez liečby alebo pacienti boli bez liečby po dobu 72 týždňov. SVR popisované v liečebných ramenách tejto štúdie boli podobné zodpovedajúcim liečebným ramenám zo štúdie NV15942.
Pediatrická populácia
V riešiteľom sponzorovanej klinickej štúdii CHIPS (Chronic Hepatitis C International Paediatric Study) 65 pediatrických pacientov (6-18 rokov) s chronickou HCV infekciou boli pacienti liečení Pegasysom 100 μg/m2 s.c. raz týždenne a ribavirínom 15 mg/kg/deň 24 týždňov (genotypy 2 a 3) alebo 48 týždňov (všetky iné genotypy). Predbežné a obmedzené údaje bezpečnosti neukázali žiadny evidentný odklon od známeho profilu bezpečnosti pri kombinovanej liečbe u dospelých pacientov s chronickou HCV infekciou, ale, dôležité je, že nebol hlásený potenciálny nárast. Výsledky účinnosti boli podobné výsledkom hlásených u dospelých.
V štúdii NV17424 (PEDS-C) boli predtým neliečení pediatrickí pacienti vo veku 5 až 17 rokov (55 % vo veku < 12 rokov) s kompenzovanou chronickou hepatitídou C a detekovateľnou HCV RNA liečení Pegasysom v dávke180 μg x BSA/1,73 m2 jedenkrát týždenne počas 48 týždňov s alebo bez ribavirínu v dávke 15 mg/kg/deň . Všetci pacienti boli po liečbe sledovaní počas 24 týždňov. Celkovo 55 pacientov bolo liečených úvodnou kombinovanou liečbou Pegasysom plus ribaviríno, z nich 51 %
bolo žien, 82 % belochov a 82 % bolo infikovaných vírusom HCV genotyp 1. Výsledky štúdie účinnosti u týchto pacientov sú zhrnuté v tabuľke 21.
Tabuľka 21: Pretrvávajúca virologická odpoveď v štúdii NV17424
| Pegasys
180 µg x BSA/1,73 m² +
ribavirín 15 mg/kg (N = 55)*
|
Všetky genotypy HCV**
| 29 (53 %)
|
HCV genotyp 1
| 21/45 (47 %)
|
HCV genotyp 2 a 3
| 8/10 (80 %)
|
*Výsledky naznačujú nedetegovateľnú HCV-RNA definovanú ako HCV RNA menej ako 50 IU/ml 24 týždňov po liečbe použitím AMPLICOR HCV testu v2.
**Plánované trvanie liečby bolo 48 týždňov bez ohľadu na genotyp
5.2 Farmakokinetické vlastnosti
Absorpcia
Po jednorazovej subkutánnej injekcii Pegasysu 180 mikrogramov zdravým jedincom sa merateľné sérové koncentrácie peginterferónu alfa-2a zistili v priebehu 3 až 6 hodín. Počas 24 hodín dosiahli namerané hladiny 80 % maximálnej koncentrácie v sére. Absorpcia Pegasysu je plynulá, pričom maximálne hladiny v sére sa dosiahnu 72 až 96 hodín po podaní. Absolútna biologická dostupnosť Pegasysu je 84 % a je podobná ako pri interferóne alfa-2a.
Distribúcia
Peginterferón alfa-2a sa nachádza najmä v krvnom obehu a extracelulárnej tekutine, čoho dôkazom je hodnota distribučného objemu v rovnovážnom stave (Vd) 6 - 14 litrov u ľudí po intravenóznom podaní. V štúdiách hmotnostnej rovnováhy, distribúcie látky v tkanivách a celotelovej autorádioluminografie vykonaných u potkanov sa zistilo, že okrem vysokej koncentrácie v krvi sa peginterferón alfa-2a dostáva do pečene, obličiek a kostnej drene.
Biotransformácia
Metabolizmus Pegasysu ešte nie je úplne objasnený, avšak štúdie na potkanoch naznačujú, že obličky sú hlavným exkrečným orgánom rádioaktívne označeného materiálu.
Eliminácia
U ľudí je hodnota systémového klírensu peginterferónu alfa-2a približne 100- násobne nižšia ako natívneho interferónu alfa-2a. Po intravenóznom podaní je terminálny polčas peginterferónu alfa-2a u zdravých osôb približne 60 – 80 hodín v porovnaní s 3 – 4 hodinami v prípade štandardného interferónu. Terminálny polčas po subkutánnom podaní pacientom je dlhší so strednou hodnotou 160 hodín (84 – 353 hodín). Terminálny polčas môže odrážať eliminačnú fázu látky, ale taktiež plynulú absorpciu Pegasysu.
Linearita/nelinearita
U zdravých osôb a u pacientov s chronickou hepatitídou B alebo C sa pri dávkovaní raz týždenne pozorovalo od dávky závislé zvyšovanie expozície voči Pegasysu.
U pacientov s chronickou hepatitídou B alebo C dochádza po 6 až 8 týždňoch podávania Pegasysu v dávke raz týždenne k dvoj- až trojnásobnému zvýšeniu sérových hladín peginterferónu alfa-2a
v porovnaní s podávaním jednorazovej dávky. Po 8-týždňovom podávaní Pegasysu raz týždenne nedochádza k ďalšej akumulácii. Po 48 týždňoch liečby je pomer medzi maximálnou a minimálnou hladinou približne 1,5 - 2. Sérové koncentrácie peginterferónu alfa-2a pretrvávajú celý 1 týždeň (168 hodín).
Pacienti s poruchou funkcie obličiek
Dysfunkcia obličiek je spojená s mierne zníženou hodnotou pomeru CL/F a predĺženým polčasom. U pacientov (n=3) CLcrea medzi 20 a 40 ml/min bola priemerná hodnota pomeru CL/F o 25 % nižšia ako u pacientov s normálnou funkciou obličiek. U dialyzovaných pacientov s ochorením obličiek
v terminálnej fáze sa zistilo 25 – 45 % zníženie klírensu, pričom dávky 135 mikrogramov u týchto pacientov vedú k podobnej expozícii ako dávky 180 mikrogramov u pacientov s normálnou funkciou
obličiek (pozri časť 4.2).
Pozrite si tiež Súhrn charakteristických vlastností lieku (SPC) ribavirínu, ak sa Pegasys použije v kombinácii s ribavirínom.
Pohlavie
Farmakokinetika Pegasysu po podaní jednorazovej subkutánnej injekcie bola porovnateľná u zdravých jedincov mužského a ženského pohlavia.
Pediatrická populácia
V populačnej farmakokinetickej štúdii (NR16141) dostávalo 14 detí vo veku 2 až 8 rokov s CHC Pegasys v monoterapii v dávke: 180 µg x BSA/1,73 m2. FK model vytvorený na základe tejto štúdie preukazuje lineárny vplyv BSA na zjavný klírens liečiva v rozmedzí skúmaného veku. Preto nižšie BSA dieťaťa, nižší klírens liečiva a vyššia výsledná expozícia. Predpokladá sa, že priemerná expozícia (AUC) počas dávkovacieho intervalu je o 25 % až 70 % vyššia ako expozícia pozorovaná u dospelých, ktorí dostávajú fixnú dávku 180 µg.
Staršie osoby
U osôb starších ako 62 rokov sa zistila dlhšia absorpcia Pegasysu po jednorazovom podaní subkutánnej injekcie v dávke 180 mikrogramov, hoci stále bola plynulá v porovnaní s mladými zdravými osobami (tmax 115 hodín vs. 82 hodín, osoby staršie ako 62 rokov). Hodnota AUC bola mierne zvýšená (1 663 vs. 1 295 ng.hod/ml), avšak maximálne koncentrácie (9,1 vs. 10,3 ng/ml) boli podobné u osôb starších ako 62 rokov. Na základe expozície voči lieku, farmakodynamickej odpovedi a znášanlivosti je možné prehlásiť, že geriatrickí pacienti si nevyžadujú podávanie nižšej dávky Pegasysu (pozri časť 4.2).
Dysfunkcia pečene
Farmakokinetika Pegasysu u zdravých osôb bola podobná ako u pacientov s hepatitídou B alebo C.
U pacientov s cirhózou (stupeň A podľa Child-Pughovej klasifikácie) a pacientov bez cirhózy sa zistila porovnateľná expozícia a farmakokinetické profily.
Miesto podania
Subkutánne podávanie Pegasysu je nutné obmedziť na oblasť brucha a stehna, pretože stupeň absorpcie hodnotený na základe hodnôt AUC bol o 20 – 30 % vyšší po podaní injekcie do brucha a stehna. V štúdiách po podaní Pegasysu do ramena sa v porovnaní s podaním do brucha alebo stehna zistila znížená expozícia voči Pegasysu.
5.3 Predklinické údaje o bezpečnosti
Neklinické štúdie skúmajúce toxicitu Pegasysu boli limitované v dôsledku druhovej špecifickosti interferónov. Štúdie akútnej a chronickej toxicity sa vykonali u opíc cynomolgus, pričom nálezy pozorované u zvierat dostávajúcich peginterferón boli podobnej povahy ako nálezy vyvolané interferónom alfa-2a.
S Pegasysom sa nevykonali žiadne štúdie reprodukčnej toxicity. Tak ako pri iných interferónoch alfa, aj po podávaní peginterferónu alfa-2a samiciam opíc sa pozorovalo predĺženie menštruačného cyklu. Liečba interferónom alfa-2a viedla k štatisticky významnému zvýšeniu abortívneho účinku u opíc resus. Hoci sa u potomstva narodeného v termíne nezistili žiadne teratogénne účinky, nežiaduce účinky nie je možné vylúčiť u ľudí.
Pegasys plus ribavirín
Ak sa používa v kombinácii s ribavirínom, Pegasys nevyvoláva žiadne účinky u opíc, ktoré by predtým neboli pozorované pri podávaní jednotlivých liečiv v rámci monoterapie. Hlavnou zmenou v súvislosti s liečbou bola reverzibilná mierna až stredne ťažká anémia, závažnosť ktorej bola vyššia ako po podávaní jednotlivých liečiv v rámci monoterapie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
chlorid sodný polysorbát 80 benzylalkoholnátriumacetát kyselina octová
voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke pri teplote 2°C – 8°C. Neuchovávajte v mrazničke. Naplnené pero uchovávajte vo vonkajšom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
0,5 ml injekčného roztoku v naplnenej injekčnej striekačke (sklo typu I so silikónovou vrstvou)
s pevnou ihlou (z nehrdzavejúcej ocele), piestom (butylová guma s fluórorezinovou vrstvou) a krytom na ihlu (polyizoprén) v naplnenom pere.
Dostupné v baleniach 1, 4 alebo 12 naplnených pier. Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu
Injekčný roztok je určený len na jednorazové použitie. Pred podaním sa má zrakom skontrolovať, či roztok neobsahuje tuhé čiastočky alebo či sa nezmenila jeho farba.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
Úplný návod na prípravu a podanie Pegasysu v naplnenom pere je uvedený v písomnej informácii pre používateľov.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Roche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
8. REGISTRAČNÉ ČÍSLA
EU/1/02/221/014
EU/1/02/221/015
EU/1/02/221/016
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 20. jún 2002
Dátum posledného predĺženia: 20. jún 2007
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.