
kvôli nedostatočnému účinku, je možné pri ďalšej epizóde BTP odporučiť dve vstreknutia s obsahom 100 mikrogramov (jedno do každej nosnej dierky). Ak je táto dávka
neúčinná, pacientovi možno predpísať fľašu PecFentu 400 mikrogramov/vstreknutie a pri
ďalšej epizóde bolesti im odporučiť prechod na jedno vstreknutie s obsahom 400 mikrogramov.
Ak je táto dávka neúčinná, pacientovi možno odporučiť zvýšenie dávky na dve
400 mikrogramové vstreknutia (jedno do každej nosnej dierky).
· Od začiatku liečby sa majú pacienti dôkladne sledovať a dávka sa má titrovať až do dosiahnutia
a potvrdenia účinnej dávky po dobu dvoch po sebe nasledujúcich liečených epizódach BTP.
Titrácia u pacientov prechádzajúcich medzi liekmi s okamžitým uvoľňovaním obsahujúcimi fentanyl Vo farmakokinetickom profile liekov s okamžitým uvoľňovaním obsahujúcich fentanyl môžu byť podstatné rozdiely, ktoré majú za následok klinicky významné rozdiely v rýchlosti a rozsahu absorpcie fentanylu.
Preto pri prechádzaní medzi liekmi s okamžitým uvoľňovaním obsahujúcimi fentanyl, ktoré sú indikované na liečbu prelomovej bolesti, vrátane intranazálnych liekových foriem, je nevyhnutné u pacientov titrovať nový liek odznova a nepokračovať s rovnakou dávkou nového lieku.
U
držiavacia liečba
Po dosiahnutí účinnej dávky počas titrácie majú pacienti pokračovať v užívaní tejto dávky do maximálne 4 dávok za deň.
Opätovná úprava dávky
Všeobecne sa má udržiavacia dávka PecFentu zvýšiť len ak súčasná dávka nedosiahne adekvátnu
liečbu BTP pri niekoľkých po sebe nasledujúcich epizódach.
Prehodnotenie dávky základnej opioidnej liečby sa môže vyžadovať u pacientov so stále sa
objavujúcimi viac ako štyrmi epizódami BTP za 24 hodín.
Ak sú nežiaduce reakcie netolerovateľné alebo pretrvávajú, dávka sa má znížiť alebo sa má liečba
PecFentom nahradiť iným analgetikom.
Ukončenie liečby
PecFent sa má vysadiť okamžite, ak pacient už nepociťuje epizódy prelomovej bolesti. Liečba pretrvávajúcej základnej bolesti sa má zachovať tak, ako bola predpísaná.
Ak sa vyžaduje ukončenie opioidnej liečby, lekár musí pacienta dôkladne sledovať, keďže je nevyhnutné postupné znižovanie dávky opioidu titráciou, aby sa zabránilo možným prudkým abstinenčným reakciám.
Osobitné populácie
Staršie osoby (starší ako 65 rokov)
V klinickom programe PecFentu bolo 104 (26,1 %) pacientov vo veku viac ako 60 rokov, 67 (16,8 %)
vo veku viac ako 65 rokov a 15 (3,8 %) vo veku viac ako 75 rokov. Neobjavil sa náznak toho, že by boli starší pacienti titrovaní na nižšie dávky alebo že by sa u nich vyskytlo viac nežiaducich reakcií. Napriek tomu je vzhľadom na dôležitosť obličkových a pečeňových funkcií v metabolizme a klírense fentanylu potrebná dodatočná starostlivosť pri použití PecFentu u starších pacientov. U starších pacientov nie sú k dispozícii žiadne údaje o farmakokinetike PecFentu.
Porucha funkcie pečene a obličiek
PecFent sa má podávať s opatrnosťou pacientom so stredne závažnou alebo závažnou poruchou funkcie pečene alebo obličiek (pozri časť 4.4).
Pediatrická populácia
Bezpečnosť a účinnosť PecFentu u detí vo veku menej ako 18 rokov neboli doteraz stanovené.
K dispozícii nie sú žiadne údaje.
Spôsob podávania
PecFent je určený len na nazálne použitie.
Fľaša sa musí vyňať z detského bezpečnostného obalu bezprostredne pred použitím a odstrániť ochranné viečko. Fľaša sa musí pred prvým použitím naplniť tak, že sa umiestni do zvislej polohy a dýza sa končekmi prstov jednoducho stláča a uvoľňuje z ktorejkoľvek strany, kým sa na políčku odčítavania neobjaví zelená čiarka (mala by sa objaviť po štyroch vstreknutiach).
Fľaškana2vstreknutia:
Fľašku na 2 vstreknutia nemožno opakovane naplniť, a keď sa použijú obe dávky alebo ak od naplnenia uplynulo viac ako 5 dní, fľašku a jej obsah treba zlikvidovať tak, ako je uvedené v časti 6.6.
Fľaškana8vstreknutí:
Ak sa liek nepoužíval počas 5 dní, fľašu treba jedným odstreknutím znovu napumpovať.
Pacientom treba odporúčať, aby na určenom mieste na štítku detského bezpečnostného obalu napísali
dátum prvého použitia.
Pri použití PecFentu sa dávkovač umiestni na krátku vzdialenosť (asi 1 cm) do nosnej dierky a jemne nasmeruje na nosovú priehradku. Potom sa vstrekne tak, že sa končekmi prstov stlačí a uvoľní ktorákoľvek strana dávkovača. Bude počuť jasné cvaknutie a číslo zobrazované na políčku odčítavania sa zvýši o jedno.
Pacienti musia byť poučení, že možno nebudú cítiť podanie vstreknutia a majú sa preto spoľahnúť na počuteľné cvaknutie a zvyšujúce sa číslo na políčku odčítavania, ktoré potvrdia, že vstreknutie sa podalo.
Kvapky roztokovej aerodisperzie PecFent v nose sformujú gél. Pacienti musia byť poučení, aby si ihneď po podaní PecFentu nečistili nos.
Ochranné viečko sa má umiestniť späť po každom použití a fľaša sa má za účelom bezpečného
uchovávania vrátiť do detského bezpečnostného obalu.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Pacienti bez udržiavacej liečby opioidmi, kvôli zvýšenému riziku útlmu dýchania. Závažná respiračná depresia alebo závažné obštrukčné ochorenia pľúc.
Liečba akútnej bolesti okrem prelomovej bolesti.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pacienti a ich opatrovatelia musia byť poučení o tom, že PecFent obsahuje liečivo v množstve, ktoré môže byť fatálne pre dieťa.
Aby sa minimalizovali riziká nežiaducich reakcií súvisiace s opioidmi a aby sa identifikovala účinná dávka, je nevyhnutné, aby boli pacienti počas titračného procesu starostlivo monitorovaní zdravotnými pracovníkmi.
Je dôležité, aby sa dlhodobo pôsobiaca opioidná liečba používaná na liečbu pretrvávajúcej bolesti pacienta stabilizovala pred začiatkom liečby PecFentom.
Respiračnádepresia
S použitím fentanylu súvisí riziko klinicky významnej respiračnej depresie. U pacientov s bolesťou, ktorí dostávajú chronickú opioidnú liečbu, sa vyvinie tolerancia na respiračnú depresiu a tak je riziko vzniku respiračnej depresie u týchto pacientov znížené. Súbežné použitie liečiv s tlmivým účinkom na centrálny nervový systém môže zvyšovať riziko respiračnej depresie (pozri časť 4.5).
Chronicképľúcneochorenie
U pacientov s chronickými obštrukčnými chorobami pľúc môže fentanyl spôsobiť závažnejšie nežiaduce reakcie. U týchto pacientov môžu opioidy znižovať respiračný pohon a zvyšovať
rezistenciu dýchacích ciest.
Zvýšenýintrakraniálnytlak
PecFent sa musí použiť s mimoriadnou opatrnosťou pacientom, ktorí môžu byť obzvlášť citliví na
intrakraniálne účinky retencie CO2, ako sú účinky s evidenciou zvýšeného intrakraniálneho tlaku alebo porušené vedomie. Opioidy môžu maskovať klinický priebeh pacienta s úrazom hlavy a smú sa použiť len ak je to klinicky oprávnené.
Ochorenie srdca
Fentanyl môže spôsobiť bradykardiu. Pacienti s predchádzajúcou alebo už existujúcou bradyarytmiou majú preto užívať PecFent s opatrnosťou.
Porucha
funkcie
pečene
a
obličiek
Okrem toho sa musí PecFent použiť s opatrnosťou u pacientov s poruchou funkcie pečene alebo obličiek. Vplyv poškodenia pečene a obličiek na farmakokinetiku lieku sa nehodnotil; po intravenóznom podaní sa však ukázalo, že je klírens fentanylu pri poruche funkcie pečene a obličiek zmenený kvôli zmenám metabolického klírensu a plazmatických proteínov. Preto sa počas procesu titrácie musí postupovať obzvlášť starostlivo u pacientov so stredne závažnou až závažnou poruchou funkcie pečene alebo obličiek.
Použitie lieku sa má starostlivo zvážiť u pacientov s hypovolémiou a hypotenziou.
Potenciálzneužitiaatolerancie
Tolerancia a fyzická a/alebo psychologická závislosť sa môže vyvinúť po opakovanom podaní
opioidov ako je fentanyl. Iatrogénny návyk po terapeutickom použití opioidov je však zriedkavý.
Športovci musia byť informovaní o tom, že liečba fentanylom môže viesť k pozitívnym dopingovým testom.
Serotonínový syndróm
Pri súbežnom podávaní PecFentu s liekmi, ktoré ovplyvňujú serotonínergické neurotransmiterové systémy, sa odporúča opatrnosť.
Pri súbežnom používaní so serotonínergickými liekmi, ako sú napríklad selektívne inhibítory spätného
vychytávania serotonínu (SSRI) a inhibítory spätného vychytávania serotonínu a norepinefrínu
(SNRI), a s liekmi zhoršujúcimi metabolizmus serotonínu (vrátane inhibítorov monoamínooxidázy
[IMAO]), môže dôjsť k rozvoju serotonínového syndrómu potenciálne ohrozujúceho život. K tomu
môže dochádzať v rámci odporúčanej dávky (pozri časť 4.5).
Serotonínový syndróm môže zahŕňať zmeny duševného stavu (napríklad agitáciu, halucinácie, kómu), autonómnu nestabilitu (napríklad tachykardiu, nestabilný krvný tlak, hypertermiu), neuromuskulárne anomálie (napríklad hyperreflexiu, poruchu koordinácie, stuhnutosť) a/alebo gastrointestinálne symptómy (napríklad nevoľnosť, vracanie, hnačku).
Ak existuje podozrenie na serotonínový syndróm, liečba PecFentom sa má ukončiť.
Spôsob podávania
PecFent je určený len na nazálne podanie a nesmie sa podať nijakou inou cestou. Vzhľadom na fyzikálno-chemické vlastnosti pomocných látok obsiahnutých v lieku je obzvlášť nutné, aby sa zabránilo intravenóznej a intraarteriálnej injekcii.
Ochorenia nosa
Ak sa u pacienta počas používania PecFentu objavia opakované epizódy krvácania z nosa alebo
nepríjemný pocit v nose, má sa zvážiť iný spôsob podania liečby prelomovej bolesti.
Pomocné látky PecFentu
PecFent obsahuje propylparahydroxybenzoát (E216). Propylparahydroxybenzoát môže spôsobovať alergické reakcie (môžu byť oneskorené) a výnimočne bronchospazmus (ak sa liek podal nesprávne).
4.5 Liekové a iné interakcie
Fentanyl sa metabolizuje hlavne systémom ľudského izoenzýmu cytochrómu P450 3A4 (CYP3A4), preto sa môžu objaviť potenciálne interakcie, ak sa PecFent podá súbežne s inými liekmi, ktoré ovplyvňujú aktivitu CYP3A4. Súbežné podanie liekov indukujúcich aktivitu 3A4 môže znižovať účinnosť PecFentu. Súbežné použitie PecFentu a silných inhibítorov CYP3A4 (napr. ritonavir, ketokonazol, itrakonazol, troleandomycín, klaritromycín alebo nelfinavir) alebo stredne silných inhibítorov CYP3A4 (napr. amprenavir, aprepitant, diltiazem, erytromycín, flukonazol, fosamprenavir, grapefruitový džús a verapamil) môže viesť k zvýšeným koncentráciám fentanylu
v plazme, čo potenciálne spôsobuje závažné nežiaduce liekové reakcie vrátane fatálnej respiračnej depresie. Pacienti užívajúci PecFent súbežne so stredne silnými alebo silnými inhibítormi CYP3A4 sa
majú starostlivo monitorovať po dlhšiu dobu. Zvýšenie dávky sa musí uskutočňovať opatrne.
Súbežné použitie iných liekov s tlmivým účinkom na centrálny nervový systém, vrátane iných opioidov, sedatív alebo hypnotík, celkových anestetík, fenotiazínov, trankvilizérov, relaxancií kostrového svalstva, sedatívnych antihistaminík a alkoholu môže viesť k aditívnym depresívnym účinkom.
Serotonínergické lieky:
Súbežné podávanie fentanylu s nejakým serotonínergickým liekom, napríklad so selektívnym
inhibítorom spätného vychytávania serotonínu (SSRI) alebo inhibítorom spätného vychytávania serotonínu a norepinefrínu (SNRI) alebo inhibítorom monoaminooxidázy (IMAO), môže zvyšovať riziko vzniku serotonínového syndrómu, čo je stav potenciálne ohrozujúci život.
Používanie PecFentu sa neodporúča u pacientov, ktorí v predošlých 14 dňoch užívali inhibítory monoaminooxidázy (MAO), pretože bola hlásená závažná a nepredvídateľná potenciácia opioidných analgetík inhibítormi MAO.
Súbežné používanie parciálnych opioidných agonistov/antagonistov (napr. buprenorfín, nalbufín, pentazocín) sa neodporúča. Majú vysokú afinitu k opioidným receptorom s relatívne nízkou vnútornou aktivitou a preto čiastočne antagonizujú analgetický účinok fentanylu a môžu u pacientov závislých na opioidoch indukovať abstinenčné symptómy.
Ukázalo sa, že súbežné použitie nazálne podávaného oxymetazolínu znižuje absorpciu PecFentu (pozri časť 5.2). Súbežné použitie nazálne podávaných vazokonstrikčných dekongestív sa preto počas titrácie neodporúča, keďže to môže viesť k titrácii pacientov na dávku, ktorá je vyššia ako sa vyžaduje. Udržiavacia liečba PecFentom môže byť tiež menej účinná u pacientov s nádchou, ak sa podáva súbežne s nazálnym vazokonstrikčným dekongestívom. Ak sa to stane, pacient musí byť poučený tak, aby prerušil liečbu dekongestívom.
Súbežné použitie PecFentu a iných liekov (okrem oxymetazolínu) podaných nosom sa v klinických štúdiách nehodnotilo. Podaniu iných nazálne podávaných liekov sa má predísť do 15 minút po podaní PecFentu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití fentanylu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Potenciálne riziko pre ľudí nie je známe. PecFent má byť užívaný počas gravidity iba v nevyhnutných prípadoch.
Po dlhodobej liečbe môže fentanyl spôsobiť abstinenčné príznaky u novorodenca. Odporúča sa fentanyl počas pôrodu a rodenia (vrátane cisárskeho zákroku) nepoužívať, pretože prechádza placentou a môže spôsobiť respiračnú depresiu plodu. Ak sa PecFent podá, pre dieťa musí byť k okamžitej dispozícii antidotum.
Laktácia
Fentanyl prechádza do materského mlieka a môže spôsobiť útlm a respiračnú depresiu dojčeného dieťaťa. Fentanyl nemajú užívať dojčiace ženy a dojčenie sa nemá znovu začať, kým neuplynie aspoň
5 dní po poslednom podaní fentanylu.
Fertilita
Nie sú k dispozícii klinické údaje o účinkoch fentanylu na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Opioidné analgetiká môžu poškodzovať mentálnu a/alebo fyzickú schopnosť, ktorá sa vyžaduje pre
vedenie vozidla alebo obsluhu strojov.
Pacienti musia byť poučení, aby neviedli vozidlo a neobsluhovali stroje, ak sa objaví somnolencia, závraty alebo poruchy videnia alebo iné nežiaduce reakcie, ktoré môžu zhoršiť ich schopnosť viesť vozidlo a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
S PecFentom možno očakávať typické opioidné nežiaduce reakcie. Intenzita týchto reakcií často vymizne alebo sa zníži počas nepretržitého používania lieku, keď sa pacient titruje na najvhodnejšiu dávku. Najzávažnejšie nežiaduce reakcie sú však respiračná depresia (potenciálne vedie k apnoe alebo respiračnej zástave), obehová depresia, hypotenzia a šok a u všetkých pacientov sa musia tieto reakcie monitorovať.
Klinické štúdie s PecFentom boli naplánované na hodnotenie bezpečnosti a účinnosti liečby BTP a všetci pacienti užívali na ich pretrvávajúcu bolesť tiež základnú opioidnú liečbu, ako morfín s pomalým uvoľňovaním alebo transdermálny fentanyl. Preto nie je možné s istotou oddeliť účinky samotného PecFentu.
Tabuľkovýzoznamnežiaducichreakcií
Nasledovné nežiaduce reakcie boli hlásené s PecFentom a/alebo inými zlúčeninami obsahujúcimi fentanyl počas klinických štúdií a z postmarketingových skúseností, (frekvencie sú definované ako veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé
(≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000); neznáme (z dostupných údajov)).
Časté Menej časté Neznáme
Infekcie a nákazy Pneumónia Nazofaryngitída Faryngitída Rinitída
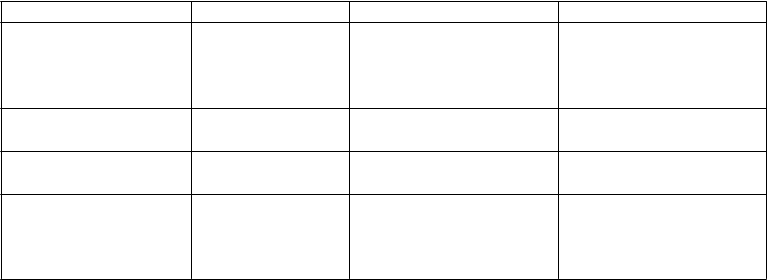
Poruchy krvi a lymfatického systému Poruchy imunitného systému
Poruchy metabolizmu a výživy
Neutropénia
Precitlivenosť
Dehydratácia Hyperglykémia Znížená chuť do jedla Zvýšená chuť do jedla
Č
asté Menej časté Neznáme
Psychické poruchy Dezorientácia Zneužitie lieku Delírium Halucinácia Stav zmätenosti Depresia
Deficit pozornosti/porucha
hyperaktivity
Strach
Euforická nálada
Nervozita
Nespavosť
Poruchy nervového systému
Poruchy ucha a labyrintu Poruchy srdca a srdcovej činnosti
Porucha chuti Závrat Somnolencia Bolesť hlavy
Strata vedomia
Znížená hladina vedomia
Konvulzia Strata chuti Strata čuchu
Poškodenie pamäti
Porucha čuchu
Porucha reči Sedácia Letargia Tremor Vertigo
Cyanóza
Poruchy ciev Kardiovaskulárna nedostatočnosť Lymfedém Hypotenzia Návaly horúčavy
Červenanie
Poruchy dýchacej sústavy, hrudníka a mediastína
Epistaxa Rinorea Nepríjemný pocit v nose
Obštrukcia horných dýchacích ciest Faryngolaryngeálna bolesť
Rinalgia
Porucha nazálnej sliznice
Kašeľ
Dyspnoe Kýchanie Kongescia horných dýchacích ciest Kongescia nosa
Intranazálna hypestézia Podráždenie hrdla Postnazálne kvapkanie Sucho v nose
Respiračná depresia
Č
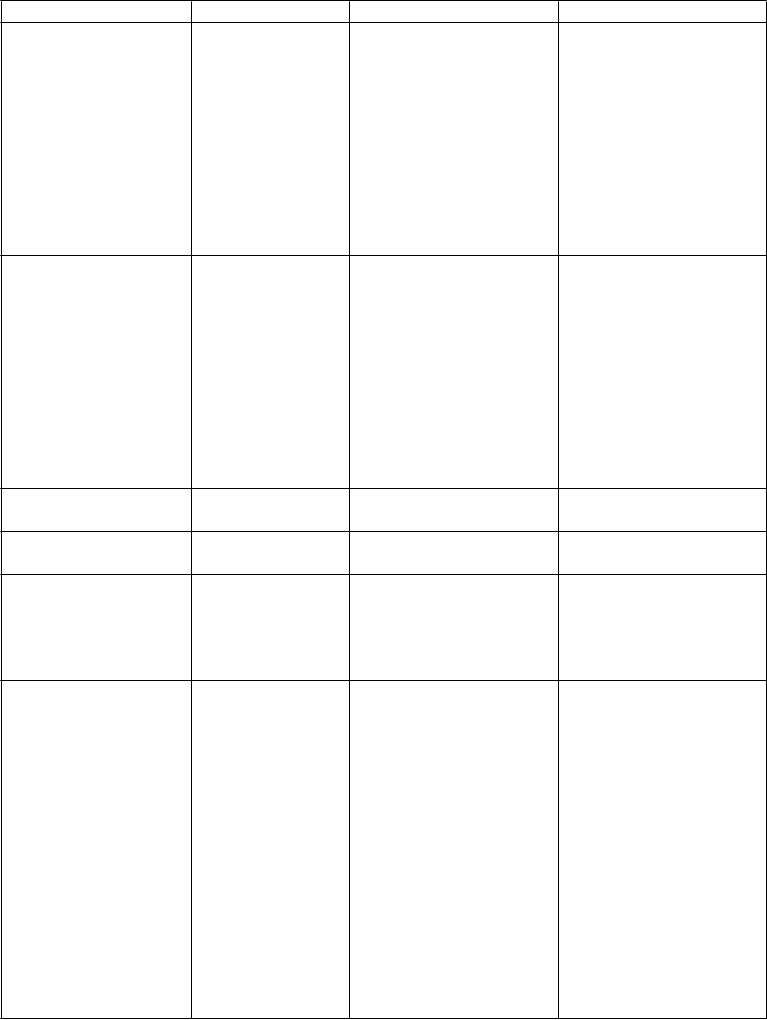
asté Menej časté Neznáme
Poruchy gastrointestinálneho traktu
Dávenie Nauzea Zápcha
Perforácia čriev Peritonitída Orálna hypestézia Orálna parestézia Hnačka
Napínanie na vracanie
Bolesť brucha Porucha jazyka Ústne vredy Dyspepsia Sucho v ústach
Poruchy kože a podkožného tkaniva Poruchy kostrovej a svalovej sústavy a spojivového tkaniva Poruchy obličiek a močových ciest
Poruchy reprodukčného systému a prsníkov Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Úrazy, otravy a komplikácie liečebného postupu
Svrbenie Hyperhidróza Urtikária Artralgia Šklbanie svalov
Anúria Dyzúria Proteinúria
Oneskorenie močenia
Krvácanie do pošvy
Bolesť hrudníka nesúvisiaca so srdcom Asténia
Zimnica Opuch tváre Periférny edém Porucha chôdze Pyrexia
Únava
Celková nevoľnosť
Smäd
Znížený počet krvných doštičiek
Zvýšená telesná hmotnosť
Pád
Úmyselné zneužitie lieku
Chyba liečby
Abstinenčný syndróm*

*Pozri nasledujúcu časť uvedenú nižšie
PopisvybranýchnežiaducichreakciíU transmukozálneho fentanylu boli pozorované príznaky opiátového abstinenčného syndrómu ako nevoľnosť, vracanie, hnačka, úzkosť, zimnica, tremor a potenie.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
Očakáva sa, že symptómy predávkovania fentanylom nazálnou cestou budú v podstate podobné ako pri intravenóznom fentanyle a iných opioidov, a sú rozšírením jeho farmakologických účinkov
s respiračnou depresiou ako najzávažnejším významným účinkom.
Okamžité zvládnutie predávkovania opioidmi zahŕňa zabezpečenie priechodných dýchacích ciest, fyzická a verbálna stimulácia pacienta, zhodnotenie hladiny vedomia, ventilačného a cirkulačného stavu a asistované dýchanie (podpora dýchania), ak je to potrebné.
Na liečbu predávkovania (náhodné požitie) u osoby, ktorá ešte opioidy neužívala, sa má zabezpečiť intravenózny prístup a podať naloxón alebo iné opioidné antagonisty podľa klinickej indikácie. Trvanie respiračnej depresie po predávkovaní môže byť dlhšie ako účinok opioidného antagonistu (napr. polčas naloxónu je v rozmedzí od 30 min do 81 minút) a môže sa vyžadovať opakované podanie. Podrobné informácie o takom použití nájdete v súhrne charakteristických vlastností jednotlivých antagonistov opioidov.
Za účelom liečby predávkovania pacientov, ktorí sú liečení opioidmi, sa má zabezpečiť intravenózny prístup. Rozvážne použitie naloxónu alebo iných opioidných antagonistov môže byť oprávnené
v niektorých prípadoch, ale spája sa s rizikom vyvolania akútneho abstinenčného syndrómu.
Je nutné poznamenať, že aj keď sa pozorovali štatisticky významné nárasty hladín Cmax po druhej dávke PecFentu podanej buď jednu alebo dve hodiny po začiatočnej dávke, tento nárast sa nepovažuje za dostatočne veľký na to, aby naznačoval, že sa objaví klinicky významná kumulácia alebo
nadmerná expozícia, čo zabezpečuje široké bezpečnostné rozhranie pre odporúčaný interval dávok štyroch hodín.
Napriek tomu, že sa po použití PecFentu nezaznamenal vplyv stuhnutosti svalov na respiráciu, je to po podaní fentanylu a iných opioidov možné. V prípade výskytu sa má zvládnuť použitím podpory dýchania, opioidným antagonistom a ako posledná možnosť neuromuskulárnou blokujúcou látkou.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Analgetiká; opioidné analgetiká, deriváty fenylpiperidínu; ATC kód: N02AB03.
Mechanizmusúčinku
Fentanyl je opioidné analgetikum, ktoré pôsobí hlavne na opioidný µ-receptor. Jeho primárnym terapeutickým účinkom je analgézia a sedácia. Sekundárne farmakologické účinky sú respiračná depresia, bradykardia, hypotermia, zápcha, mióza, fyzická závislosť a eufória.
Farmakodynamickéúčinky
Dvojito zaslepená, randomizovaná, placebom kontrolovaná skrížená štúdia sa uskutočnila so 114 pacientmi, u ktorých sa vyskytli v priemere 1 až 4 epizódy prelomovej bolesti (BTP) za deň, zatiaľ čo dostávali udržiavaciu opioidnú liečbu, pacienti boli zaradení do začiatočnej titračnej nezaslepenej fázy za účelom identifikácie účinnej dávky PecFentu (štúdia CP043). Pacienti, ktorí vstúpili do dvojito zaslepenej fázy, si liečili až 10 epizód BTP buď PecFentom (7 epizód) alebo placebom (3 epizódy)
v náhodnom poradí.
Len 7 (6,1 %) pacientov z tých, ktorí boli zaradení do titračnej fázy, nebolo možné titrovať na účinnú dávku kvôli nedostatku účinnosti a 6 (5,3 %) pacientov od štúdie odstúpilo kvôli nežiaducim príhodám.
Primárne hodnotiace kritérium bolo porovnanie medzi celkovým rozdielom intenzity bolesti 30 minút po podaní (SPID30), čo predstavovalo 6,57 v skupine epizód liečených PecFentom v porovnaní so
4,45 v skupine s placebom (p<0,0001). SPID v skupine epizód liečených PecFentom sa tiež významne
líšil od placeba pri 10, 15, 45 a 60 minútach po podaní lieku.
Priemerné skóre intenzity bolesti (73 pacientov) pre všetky epizódy liečené PecFentom (459 epizód) boli v porovnaní s epizódami liečenými placebom (200 epizód) významne nižšie pri 5, 10, 15, 30, 45 a 60 minútach po podaní lieku (pozri obrázok 1).
Obrázok 1: Priemerné (± SE) skóre intenzity bolesti v každom časovom bode (populácia mITT)
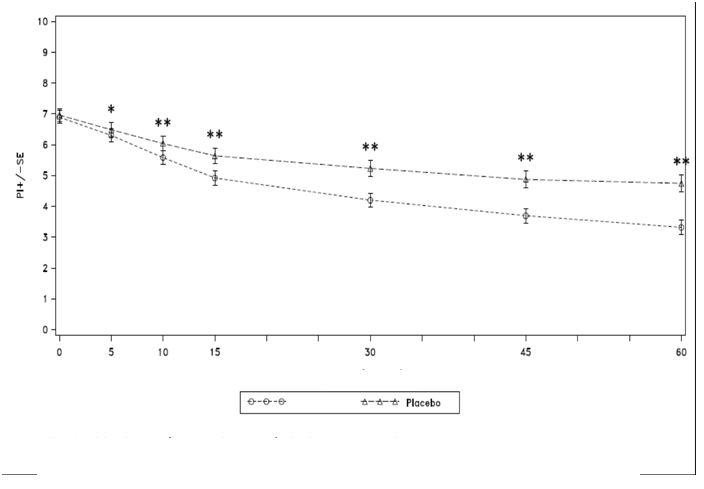
čas (minúty)
PecFentPoznámka: Skóre intenzity bolesti (priemer hodnôt účastníkov štúdie) po podaní PecFentu alebo placeba
*Významný rozdiel zistený pri hodnote alfa ≤ 0,05 medzi PecFentom a placebom v danom časovom bode.
** Významný rozdiel zistený pri hodnote alfa ≤ 0,01 medzi PecFentom a placebom v danom časovom bode.
Vyššiu účinnosť PecFentu v porovnaní s placebom podporili údaje zo sekundárnych koncových ukazovateľov, vrátane počtu BTP epizód s klinicky významným uvoľnením bolesti, definovaným ako zníženie skóre intenzity bolesti o minimálne 2 body (obrázok 2).
Obrázok 2: Klinicky významné uvoľnenie bolesti – PecFent oproti placebu: % epizód pacientov so
znížením intenzity bolesti o ≥ 2 body
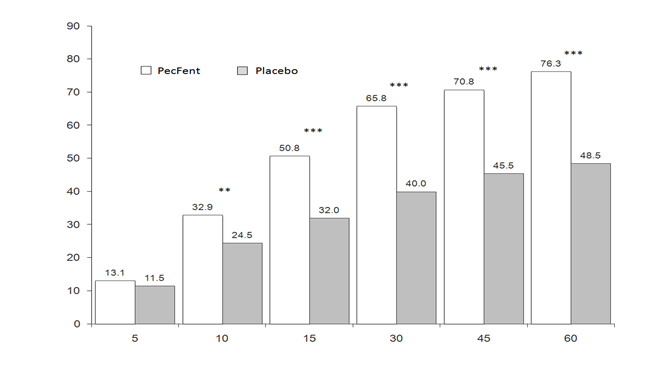 *
* P=0,011 oproti placebo
*
*
* P<0,0001 oproti placebu
Č
a
s od podania dávky (minúty)
*
* P=0,011 oproti placebo
*
*
* P<0,0001 oproti placebu
Č
a
s od podania dávky (minúty)
PecFent sa ukázal byť nadradený morfínsulfátu s okamžitým uvoľňovaním (immediate-release
morphine sulfate, IRMS) v dvojito zaslepenej, randomizovanej, komparátorom kontrolovanej štúdii
(štúdia 044) s podobným dizajnom ako štúdia 043, uskutočnenej s pacientmi s prelomovou nádorovou
bolesťou, ktorí tolerovali opioidy so stálymi dávkami a v pravidelných intervaloch.
Nadradenosť sa ukázala v primárnom hodnotiacom kritériu, rozdiel v intenzite bolesti do 15 minút, ktorá bola 3,02 u pacientov liečených PecFentom v porovnaní s 2,69 u pacientov liečených IRMS (p=0,0396).'
V dlhodobej, nezaslepenej štúdii bezpečnosti (štúdia 045) bolo do 16-týždňovej liečebnej fázy zaradených 355 pacientov. Počas tejto fázy sa liečilo PecFentom 42 227 epizód prelomovej nádorovej bolesti (BTP). Sto týchto pacientov pokračovalo v liečbe do 26 mesiacov v predĺženej fáze. Z 355 pacientov liečených v nezaslepenej liečebnej fáze si 90 % nevyžadovalo zvýšenie dávky.
V randomizovanej, placebom kontrolovanej štúdii (CP043) si 9,4 % z 459 BTP epizód liečených PecFentom u 73 pacientov vyžadovalo použitie ďalších (záchranných) liekov v priebehu 60 minút po podaní dávky. Počas dlhodobej, nezaslepenej štúdie (CP045) to bolo 6,0 % z 42 227 epizód u 355 pacientov liečených PecFentom počas až 159 dní liečby.
5.2 Farmakokinetické vlastnosti
Všeobecnýúvod
Fentanyl je vysoko lipofilný a môže sa absorbovať veľmi rýchlo nazálnou sliznicou a pomalšie gastrointestinálnou cestou. Podlieha metabolizmu prvého prechodu pečeňou a intestinálnemu
metabolizmu a metabolity neprispievajú k terapeutickým účinkom fentanylu.
Na prispôsobenie dodania a absorpcie fentanylu využíva PecFent nazálny dodávací systém PecSys. PecSys umožňuje, aby sa liek vstrekol do frontálnej časti nosovej dutiny vo forme jemnej hmly kvapiek, ktoré pri dotyku s vápnikovými iónmi prítomnými v nosovej sliznici vytvoria gél. Fentanyl sa z gélu difúziou uvoľňuje a absorbuje nosovou sliznicou; táto gélom modulovaná absorpcia fentanylu obmedzuje maximálnu plazmatickú koncentráciu (Cmax), zatiaľ čo umožňuje dosiahnuť skorý čas do maximálnej koncentrácie (Tmax).
A
bsorpcia
Vo farmakokinetickej štúdii porovnávajúcej PecFent (100, 200, 400 a 800 mikrogramov)
s perorálnym transmukozálnym fentanyl citrátom (OTFC, 200 mikrogramov) sa ukázalo, že sa po podaní jednej dávky PecFentu intranazálnou cestou fentanyl rýchlo absorbuje, pričom stredná hodnota
Tmax bola v rozmedzí od 15 do 21 minút (Tmax pre OTFC je približne 90 minút). Rôznorodosť farmakokinetiky fentanylu bola značná po liečbe oboma, PecFentom aj OTFC. Relatívna
biodostupnosť fentanylu z PecFentu v porovnaní s OTFC 200 mikrogramov bola približne 120%.
Hlavné farmakokinetické parametre sú uvedené v nasledujúcej tabuľke. Farmakokinetické parametre dospelých jedincov užívajúcich PecFent a OTFC
F
armakokinetické
P
ec
F
ent OTFC
parametre
(
priemer (%CV))
100
mi
krogramov
200
mi
krogramov
400
mi
krogramov
800
mi
krogramov
200
mi
krogramov
Tmax (hod)* 0,33 (0,08-
1,50)
0,25 (0,17-

1,60)
0,35 (0,25-
0,75)
0,34 (0,17-
3,00)
1,50 (0,50-
8,00)

Cmax (pg/ml) 351,5 (51,3) 780,8 (48,4) 1552,1 (26,2) 2844,0 (56,0) 317,4 (29,9) AUC (pg.hod/ml) 2460,5 (17,9) 4359,9 (29,8) 7513,4 (26,7) 17272 (48,9) 3735,0 (32,8) t1/2 (hod) 21,9 (13,6) 24,9 (51,3) 15,0 (24,7) 24,9 (92,5) 18,6 (31,4)
*Údaje pre Tmax sú uvedené ako stredné hodnoty (rozpätie).
Krivky pre každú hladinu dávky sú podobného tvaru; zvyšujúce sa hladiny dávky vedú k vyšším hladinám fentanylu v plazme. Úmernosť s dávkou bola dokázaná pre Cmax a plochu pod krivkou (AUC) v dávkovacom rozpätí 100 mikrogramov až 800 mikrogramov (pozri Obrázok 3). V prípade
prechodu z iného fentanyl obsahujúceho lieku na BTP na PecFent sa vyžaduje nezávislá titrácia dávky
s PecFentom, keďže sa biodostupnosť liekov významne líši.
Obrázok 3: Priemerné plazmatické koncentrácie fentanylu po podaní jednej dávky PecFentu a OTFC
zdravým jedincom
PecFent 100 µg dávka
PecFent 200 µg dávka
PecFent 400 µg dávka
PecFent 800 µg dávka
OTFC 200 µg dávka
čas (hodiny)
Farmakokinetická štúdia sa uskutočnila za účelom hodnotenia absorpcie a tolerability jednej dávky
PecFentu u pacientov so sezónnou alergickou nádchou spôsobenou peľom. Porovnané boli stavy
vyvolané, akútne vyvolané (nádchové), ako aj akútne vyvolané a potom liečené oxymetazolínom.
Nezistil sa žiadny klinicky významný účinok akútnej nádchy na Cmax, Tmax alebo na celkovú expozíciu fentanylu v porovnaní s nevyvolaným a akútne vyvolaným stavom. Po liečbe stavu akútnej nádchy oxymetazolínom bolo zistené zníženie hodnôt Cmax a expozície, zvýšenie hodnôt Tmax, ktoré boli štatisticky, a pravdepodobne aj klinicky, významné.
Distribúcia
Fentanyl je vysoko lipofilný a dobre sa distribuuje mimo cievny systém. Má veľký zdanlivý
distribučný objem. Údaje na zvieratách ukázali, že po absorpcii sa fentanyl rýchlo distribuuje do mozgu, srdca, pľúc, obličiek a sleziny. Potom nasleduje pomalšia redistribúcia do svalov a tuku.
Väzba fentanylu na plazmatické proteíny je 80-85 %. Hlavným proteínom viažucim fentanyl je kyslý alfa-1-glykoproteín, ale albumín a lipoproteíny tiež prispievajú určitou mierou. Voľná frakcia fentanylu sa zvyšuje pri acidóze.
Biotransformácia
Po nazálnom podaní PecFentu neboli metabolické dráhy v klinických štúdiách charakterizované. Fentanyl sa pomocou izoformy cytochrómu CYP3A4 metabolizuje v pečeni na norfentanyl. Norfentanyl nie je v štúdiách so zvieratami farmakologicky aktívny. Viac ako 90% sa eliminuje biotransformáciou na N-dealkylované a hydroxylované neaktívne metabolity.
Eliminácia
Dispozícia fentanylu po intranazálnom podaní PecFentu nebola charakterizovaná v štúdii hmotnostnej rovnováhy (mass balance). Menej ako 7% podanej dávky fentanylu sa vylučuje v nezmenenej forme
močom a len asi 1% v nezmenenej forme stolicou. Metabolity sa vylučujú hlavne močom, kým vylučovanie stolicou je menej významné.
Celkový plazmatický klírens fentanylu po intravenóznom podaní je približne 42 l/hod. Linearita/nelinearita
Proporcionalita s dávkou sa pre Cmax a AUC dokázala v dávkovom rozpätí 100 mikrogramov až
800 mikrogramov.
Účinok poškodenia pečene alebo obličiek na farmakokinetiku PecFentu sa neštudoval.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
Štúdie embryo-fetálnej vývojovej toxicity, ktoré sa uskutočnili s potkanmi a králikmi, neodhalili žiadne látkou vyvolané malformácie alebo vývojové zmeny, keď sa liek podal v období organogenézy.
V štúdii fertility a skorého embryonického vývoja u potkanov sa pozoroval samcami sprostredkovaný účinok pri vysokých dávkach (300 µg/kg/deň, s.c.), ktorý je konzistentný so sedatívnymi účinkami fentanylu v štúdiách so zvieratami.
V štúdiách pred- a post-natálneho vývoja u potkanov bol stupeň prežitia potomkov významne znížený pri dávkach spôsobujúcich materskú toxicitu. Ďalšie nálezy u potomstva F1 pri dávkach toxických pre matku boli oneskorený fyzický vývoj, zmyslové funkcie, reflexy a správanie. Tieto účinky môžu byť nepriamymi účinkami spôsobenými zmenenou materskou starostlivosťou a/alebo zníženým stupňom laktácie alebo priamym účinkom fentanylu na potomkov.
Karcinogénne štúdie (26-týždňové dermálne biologické testovanie na Tg.AC transgénových myšiach; dvojročná subkutánna štúdia karcinogenicity na potkanoch) s fentanylom nevyvolali žiadne zistenia naznačujúce onkogénny potenciál. Vyhodnotenie vzoriek rezov mozgu zo štúdie karcinogenity vykonávanej na potkanoch odhalilo lézie na mozgu zvierat, ktorým sa podávali vysoké dávky fentanyl citrátu. Význam týchto nálezov pre ľudí je neznámy.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Pektín (E440) Manitol (E421) Fenyletylalkohol
Propylparahydroxybenzoát (E216) Sacharóza
Kyselina chlorovodíková (0,36%) alebo hydroxid sodný (na úpravu pH)
Čistená voda
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
Fľaškana2vstreknutia: 18 mesiacov
Po naplnení použite do 5 dní.
Fľaškana8vstreknutí: 3 roky
Po prvom použití: 60 dní
6.4 Špeciálne upozornenia na uchovávanie Uchovávajte pri teplote neprevyšujúcej 25 °C. Neuchovávajte v mrazničke.
Fľašu uchovávajte v detskom bezpečnostnom obale na ochranu pred svetlom.
Fľašu uchovávajte v detskom bezpečnostnom obale vždy, aj keď sa liek spotreboval.
6.5 Druh obalu a obsah balenia
Fľaša (číre sklo typu I) s nasadeným dávkovacím rozprašovačom so zabudovaným zvukovým počítadlom dávky a s ochranným viečkom (biele nepriehľadné viečko pre fľašku na 2 vstreknutia
a priesvitné viečko pre fľašku na 8 vstreknutí). V oboch prípadoch je liekzabalený v mušli podobnom detskom bezpečnostnom obale.
Fľašky obsahujú:
0,95 ml, čo zabezpečuje dodanie 2 plných vstreknutí
alebo
1,55 ml, čo zabezpečuje dodanie 8 plných vstreknutí.
Fľaše v detskom bezpečnostnom obale sú dodávané v škatuliach obsahujúcich:
v prípade fľašky na 2 vstreknutia: 1 fľašku;
v prípade fľašky na 8 vstreknutí: 1, 4 alebo 12 fľašiek.
Na trh nemusia byť uvedené všetky prevedenia alebo veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Čiastočne použité fľašky PecFent môžu obsahovať dostatok lieku, ktorý môže byť pre dieťa škodlivý alebo ohrozujúci život. Dokonca aj keď vo fľaške zostalo málo lieku alebo v nej nezostal žiadny liek, PecFent sa musí správne zlikvidovať podľa nasledujúcich krokov:
o Pacienti a opatrovatelia musia byť poučení, aby správne zlikvidovali všetky nepoužité, čiastočne použité alebo použité fľašky PecFent. Pacienta treba poučiť, ako to správne urobiť.
o Ak zostanú vo fľaške akékoľvek nechcené terapeutické vstreky, pacienta treba poučiť, aby ich
vypustil nasledovne:
Fľaškana2vstreknutia:
o Nasmerovať vstrek preč od seba (a akýchkoľvek iných osôb) a vypúšťať zostávajúcu aerodisperziu až kým sa v políčku odčítavania neobjaví červené číslo „2“ a vo fľaške nezostanú žiadne plné terapeutické vstreky.
o Keď sa na počítadle objaví „2“, pacient má pokračovať v stláčaní na miestach uchopenia (bude tam zvýšený odpor) celkovo štyrikrát, aby vytlačil všetok zvyšný liek z fľašky.
o Po vypustení 2 terapeutických vstrekov nebude pacient počuť kliknutie a počítadlo nebude pokračovať v počítaní ďalej za „2“; ďalšie vypustené vstreky nebudú úplné vstreky a nemajú sa používať terapeuticky.
Fľaškana8vstreknutí:
o Nasmerovať vstrek mimo seba (a akýchkoľvek iných osôb) a vypúšťať zostávajúcu aerodisperziu, pokiaľ sa v políčku odčítavania neobjaví červené číslo „8“ a pokiaľ vo fľaške nezostane viac plných terapeutických vstrekov.
o Keď sa na počítadle objaví „8“, pacient má pokračovať v stláčaní na miestach uchopenia (bude tam zvýšený odpor) celkovo štyrikrát, aby vytlačil všetok zvyšný liek z fľašky.
o Po vypustení 8 terapeutických vstrekov nebude pacient počuť kliknutie a počítadlo nebude pokračovať v počítaní ďalej za „8“, ďalšie vypustené vstreky nebudú úplné vstreky a nemajú sa používať terapeuticky.
Ako náhle nie je PecFent viac potrebný, pacienti a členovia domácnosti musia byť poučení, aby čo najskôr systematicky znehodnocovali akékoľvek fľaše, ktoré im po predpísaní ostali, a to tak, že ich umiestnia naspäť do detského bezpečnostného obalu a zlikvidujú v súlade s národnými požiadavkami alebo vrátia do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Archimedes Development Ltd
Albert Einstein Centre
Nottingham Science and Technology Park, University Boulevard
Nottingham
NG7 2TN
Veľká Británia
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
EU/1/10/644/007
EU/1/10/644/001
EU/1/10/644/002
EU/1/10/644/005
EU/1/10/644/003
EU/1/10/644/004
EU/1/10/644/006
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 31. augusta 2010
Dátum posledného predĺženia registrácie: 17 júl 2015
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.