
ranným liekom.
Nie sú k dispozícii žiadne klinické údaje o užívaní berotralstatu u pacientov s HAE s normálnou aktivitou inhibítora C1 esterázy (C1-INH).
Nie sú k dispozícii údaje o užívaní berotralstatu u pacientov s hmotnosťou nižšou ako 40 kg, má sa preto predchádzať užívaniu berotralstatu u týchto pacientov.
Predĺženie intervalu QT
U pacientov so stredne závažnou alebo závažnou poruchou funkcie pečene sa môžu rozvinúť zvýšené
sérové koncentrácie berotralstatu, ktoré súvisia s rizikom predĺženého intervalu QT. Má sa
predchádzať užívaniu berotralstatu u týchto pacientov.
Pacienti so závažnou poruchou funkcie obličiek môžu byť vystavení riziku predĺženia intervalu QT. Užívaniu berotralstatu u týchto pacientov je vhodnejšie sa vyhnúť. Ak je liečba nevyhnutná, má sa zvážiť primerané monitorovanie (napr. EKG).
Nie sú k dispozícii žiadne údaje o užívaní berotralstatu u pacientov s nezávislými rizikovými faktormi na predĺženie intervalu QT, ako sú poruchy rovnováhy elektrolytov, známe už existujúce predĺženie intervalu QT (buď získané, alebo vrodené), pokročilý vek (pozri časť 4.2) alebo súbežné užívanie iných liekov, o ktorých je známe, že predlžujú interval QT. Užívaniu berotralstatu u týchto pacientov je vhodnejšie sa vyhnúť. Ak je liečba nevyhnutná, má sa zvážiť primerané monitorovanie (napr.
EKG).
Ženy vo fertilnom veku
Berotralstat môže znižovať účinnosť perorálnej hormonálnej antikoncepcie vyžadujúcej CYP2C9 na
premenu proliečiva na aktívny metabolit, ako je dezogestrel. Z tohto dôvodu ženy, ktoré užívajú ako antikoncepciu len dezogestrel, majú prejsť na alternatívnu metódu účinnej antikoncepcie, ako je
bariérová metóda, progesterón vo forme injekcie alebo kombinovaná perorálna hormonálna antikoncepcia (pozri časť 4.5).
4.5 Liekové a iné interakcie
Berotralstat je substrátom P-glykoproteínu (P-gp) a proteínu rezistencie proti rakovine prsníka (breast cancer resistance protein, BCRP).
Účinky iných liekov na berotralstat
Inhibítory P-gp a BCRP
Cyklosporín, inhibítor P-gp a BCRP, zvýšil maximálnu koncentráciu (Cmax) berotralstatu v ustálenom stave o 25 % a AUC berotralstatu o 55 %. Expozícia berotralstatu sa môže zvýšiť pri súbežnom podávaní inhibítorov P-gp a BCRP, úprava dávkovania však nie je potrebná. V prípade súbežného podávania inhibítorov P-gp a BCRP sa odporúča dôkladné monitorovanie nežiaducich udalostí.
Induktory P-gp a BCRP
Berotralstat je substrátom P-gp a BCRP. Induktory P-gp a BCRP (napr. rifampicín, ľubovník bodkovaný) môžu znížiť plazmovú koncentráciu berotralstatu, čo vedie k zníženej účinnosti berotralstatu. Užívanie induktorov P-gp s berotralstatom sa neodporúča.
Účinky berotralstatu na iné lieky
Substráty CYP3A4
Berotralstat je stredne silný inhibítor CYP3A4, ktorý zvyšuje Cmax a AUC perorálneho midazolamu o 45 % a 124 % v uvedenom poradí, a Cmax a AUC amlodipínu o 45 % a 77 % v uvedenom poradí. Súbežné podávanie môže zvýšiť koncentrácie iných liekov, ktoré sú substráty CYP3A4. Pozrite si súhrn charakteristických vlastností lieku pre súbežne podávané lieky, ktoré sú metabolizované
prevažne prostredníctvom CYP3A4, najmä liekov s úzkym terapeutickým indexom (napr. cyklosporín, fentanyl). Je možné, že bude nutná úprava dávkovania týchto liekov (pozri časť 5.2).
Substráty CYP2D6
Berotralstat je stredne silný inhibítor CYP2D6, ktorý zvyšuje Cmax a AUC dexometrofánu o 196 % a
177 % v uvedenom poradí, a Cmax a AUC dezipramínu o 64 % a 87 % v uvedenom poradí. Súbežné
podávanie môže zvýšiť expozíciu iných liekov, ktoré sú substráty CYP2D6. Pozrite si súhrn
charakteristických vlastností lieku pre súbežne podávané lieky, ktoré sú metabolizované prevažne prostredníctvom CYP2D6, najmä liekov s úzkym terapeutickým indexom (napr. tioridazín, pimozid) alebo liekov, pre ktoré informácie týkajúce sa predpisovania odporúčajú terapeutické monitorovanie (napr. tricyklické antidepresíva). Je možné, že sa bude vyžadovať úprava dávkovania týchto liekov (pozri časť 5.2).
Substráty CYP2C9
Berotralstat je slabý inhibítor CYP2C9, ktorý zvyšuje Cmax a AUC tolbutamidu o 19 % a 73 %
v uvedenom poradí. Pri súbežnom užívaní liekov, ktoré sú metabolizované prevažne prostredníctvom
CYP2C9 (napr. tolbutamid), sa úprava dávkovania neodporúča (pozri časť 5.2).
Substráty CYP2C19
Berotralstat nie je inhibítor CYP2C19, pretože Cmax a AUC omeprazolu sa zvýšili iba o 21 % a 24 % v uvedenom poradí. Pri súbežnom užívaní liekov, ktoré sú metabolizované prevažne prostredníctvom CYP2C19 (napr. omeprazol), sa úprava dávkovania neodporúča (pozri časť 5.2).
Substráty P-gp
Berotralstat je slabý inhibítor P-gp, ktorý zvyšuje Cmax a AUC substrátu P-gp digoxínu o 58 % a 48 % v uvedenom poradí. Pozrite si súhrn charakteristických vlastností lieku pre súbežne podávané lieky, ktoré sú substráty P-gp, najmä liekov s úzkym terapeutickým indexom (napr. digoxín) alebo liekov, pre ktoré informácie týkajúce sa predpisovania odporúčajú terapeutické monitorovanie (napr. dabigatran). Je možné, že sa bude vyžadovať úprava dávkovania týchto liekov (pozri časť 5.2).
Perorálne antikoncepčné prípravky
Nevykonala sa štúdia o podávaní berotralstatu počas užívania perorálnych antikoncepčných prípravkov. Berotralstat ako mierny inhibítor CYP3A4 môže zvýšiť koncentráciu perorálnych antikoncepčných prípravkov metabolizovaných prostredníctvom CYP3A4. Berotralstat ako mierny inhibítor CYP2C9 môže znižovať účinnosť hormonálnych antikoncepčných prípravkov vyžadujúcich CYP2C9 na premenu proliečiva na aktívny metabolit, ako je dezogestrel. Z tohto dôvodu ženy, ktoré užívajú ako antikoncepciu len dezogestrel, majú prejsť na alternatívnu metódu účinnej antikoncepcie, napr. bariérovú metódu, progesterón vo forme injekcie alebo kombinovanú perorálnu hormonálnu antikoncepciu (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Ženy vo fertilnom veku
Ženy vo fertilnom veku musia počas liečby s berotralstatom a aspoň 1 mesiac po podaní poslednej
dávky používať účinnú antikoncepciu. Používanie berotralstatu sa neodporúča u žien vo fertilnom veku, ktoré nepoužívajú antikoncepciu (pozri časť 4.4).
Gravidita
Nie sú k dispozícii žiadne údaje alebo je k dispozícii iba obmedzené množstvo údajov o použití
berotralstatu u gravidných žien. Štúdie reprodukčnej toxicity na zvieratách sú nedostatočné (pozri časť
5.3).
Užívanie berotralstatu počas gravidity sa neodporúča.
Dojčenie
Dostupné farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie berotralstatu do
mlieka (pozri časť 5.3).
Riziko pre dojčené dieťa nie je možné vylúčiť.
Rozhodnutie o tom, či sa má dojčenie prerušiť alebo sa má ukončiť/prerušiť liečba liekom Orladeyo, sa musí prijať po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
V štúdiách vykonaných na zvieratách sa nepozoroval žiadny účinok berotralstatu na fertilitu (pozri
časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek Orladeyo nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať
stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Najčastejšie nežiaduce reakcie sú bolesť brucha (všetky miesta) (hlásená u 21 % pacientov), hnačka
(hlásená u 15 % pacientov) a bolesť hlavy (hlásená u 13 % pacientov). Gastrointestinálne udalosti boli hlásené najmä v prvých 1 – 3 mesiacoch užívania lieku Orladeyo (medián dňa nástupu bolesti brucha bol 66. deň a hnačky 45. deň) a odzneli bez podania lieku, zatiaľ čo liečba liekom Orladeyo pokračovala. Takmer všetky udalosti (99 %) bolesti brucha boli mierne alebo stredne závažné,
pričom medián trvania bol 3,5 dňa (95 % interval spoľahlivosti 2 – 8 dní). Takmer všetky udalosti (98 %) hnačky boli mierne alebo stredne závažné, pričom medián trvania bol 3,2 dňa (95 % interval spoľahlivosti 2 – 8 dní).
Tabuľkový zoznam nežiaducich reakciíBezpečnosť lieku Orladeyo bola hodnotená v dlhodobých klinických štúdiách u pacientov s HAE (tak
v nekontrolovaných, otvorených, ako aj placebom kontrolovaných, zaslepených), na ktorých sa zúčastnilo 381 pacientov. Nižšie sú uvedené nežiaduce reakcie podľa triedy orgánových systémov databázy MedDRA a frekvencie. Frekvencie sú definované ako: veľmi časté (≥ 1/10), časté (≥ 1/100 až <1/10), menej časté (≥ 1/1 000 až <1/100), zriedkavé (≥ 1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie uvedené v poradí podľa klesajúcej závažnosti.
Tabuľka 1: Nežiaduce reakcie pozorované v klinických štúdiáchTrieda orgánových systémov
| Frekvencia
| Nežiaduce reakcie
|
Poruchy nervového systému
| Veľmi časté
| Bolesť hlavya
|
Poruchy gastrointestinálneho traktu
| Veľmi časté
| Bolesť bruchab, hnačkac
|
Časté
| Vracanie, gastroezofagálny reflux, nadúvanie
|
Poruchy kože a podkožného tkaniva
| Časté
| Vyrážka
|
Laboratórne a funkčné
vyšetreniad
| Časté
| Zvýšená hodnota ALT, zvýšená hodnota
AST
|
a Zahŕňa tieto udalosti: bolesť hlavy, sínusovú bolesť hlavy
b Zahŕňa tieto udalosti: bolesť brucha, abdominálny diskomfort, bolesť hornej časti brucha, bolesť
spodnej časti brucha, epigastrický diskomfort, citlivosť brucha
c Zahŕňa tieto udalosti: hnačku, mäkkú stolicu, častú stolicu
d Zvýšené hodnoty testu funkcie pečene (LFT), ktoré sa vo všeobecnosti zlepšili po prerušení alebo bez prerušenia užívania berotralstatu, sa pozorovali u niektorých pacientov, najmä u tých, ktorí prerušili androgénovú liečbu do 14 dní od začatia liečby liekom Orladeyo. Má sa predchádzať náhlemu prerušeniu užívania androgénov tesne pred začatím užívania lieku Orladeyo.
Pediatrická populáciaBezpečnosť lieku Orladeyo bola hodnotená v klinických štúdiách v podskupine 28 dospievajúcich
pacientov vo veku od 12 do < 18 rokov a s hmotnosťou najmenej 40 kg. Bezpečnostný profil bol podobný profilu, ktorý sa pozoroval u dospelých.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
národné
|
centrum
|
hlásenia
|
uvedené
|
|
|
akékoľvek podozrenia na nežiaduce reakcie na
v
Prílohe V.
4.9 Predávkovanie
V klinických štúdiách nebol hlásený žiadny prípad predávkovania. Nie sú k dispozícii žiadne informácie na identifikáciu potenciálnych prejavov a príznakov predávkovania. Ak sa príznaky objavia, odporúča sa symptomatická liečba. Nie je k dispozícii žiadne antidotum.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Iné hematologické liečivá, liečivá na dedičný angioedém, ATC kód: B06AC06
Mechanizmus účinku
Berotralstat je inhibítor plazmatického kalikreínu. Plazmatický kalikreín je serínová proteáza, ktorá štiepi vysokomolekulárny kininogén (HMWK), pričom sa uvoľňuje bradykinín, čo je silný vazodilatátor, ktorý zvyšuje vaskulárnu permeabilitu. U pacientov s HAE je v dôsledku nedostatku alebo dysfunkcie C1-INH zhoršená normálna regulácia aktivity plazmatického kalikreínu, čo vedie
k nekontrolovaným zvýšeniam aktivity plazmatického kalikreínu a k uvoľneniu bradykinínu, čo vedie k záchvatom HAE vo forme opuchu (angioedém).
Elektrofyziológia srdca
Pri Cmax berotralstatu v ustálenom stave pri odporúčanej dávke 150 mg raz denne sa priemerný
korigovaný interval QT zvýšil o 3,4 ms (90 % horná hranica intervalu spoľahlivosti 6,8 ms), čo je
menej ako prahová hodnota 10 ms vzbudzujúca obavy. Pri supraterapeutickej dávke 450 mg raz denne boli expozície v ustálenom stave 4-násobne vyššie ako pri odporúčanej dávke 150 mg a korigovaný interval QT sa zvýšil priemerne o 21,9 ms.
Klinická účinnosť a bezpečnosť
Účinnosť berotralstatu bola skúmaná v multicentrickej, randomizovanej dvojito zaslepenej, placebom
kontrolovanej štúdii s paralelnými skupinami NCT 03485911.
Štúdia NCT 03485911
Táto štúdia zahŕňala 120 pacientov (114 dospelých a 6 detí vo veku od 12 rokov) s typom I alebo II HAE, ktorí mali aspoň dva záchvaty potvrdené skúšajúcim počas prvých 8 týždňov spúšťacieho obdobia štúdie a užili aspoň jednu dávku študijnej liečby. Deväť pacientov bolo vo veku ≥ 65 rokov. Pacienti boli randomizovaní do 1 z 3 paralelných liečebných skupín, statifikovaní podľa východiskovej miery záchvatov v pomere 1 : 1 : 1 (berotralstat 110 mg, berotralstat 150 mg alebo placebo podávané perorálne s jedlom raz denne) počas 24-týždňového liečebného obdobia.
Celkovo 81 pacientov dostalo najmenej jednu dávku berotralstatu počas 24-týždňového liečebného obdobia. Zo všetkých pacientov bolo 66 % žien a 93 % belochov s priemerným vekom 41,6 roka. Anamnéza záchvatov laryngálneho angioedému bola hlásená pri 74 % pacientov a 75 % hlásilo predchádzajúcu dlhodobú profylaxiu. Medián miery záchvatov počas prospektívneho spúšťacieho obdobia štúdie (východisková miera záchvatov) bol 2,9 záchvatu za mesiac. 70 % zo zúčastnených pacientov malo východiskovú mieru záchvatov ≥ 2 záchvaty za mesiac.
Pacienti prerušili užívanie iných profylaktických liekov na HAE pred zapojením sa do štúdie, všetci pacienti však mohli užívať záchranné lieky na liečbu náhlych záchvatov HAE.
U pacientov liečených berotralstatom bolo 51,4 % náhlych záchvatov liečených pomocou C1-INH (pozri časť 4.4). Súbežné užívanie C1-INH a berotralstatu neviedlo k žiadnym identifikovateľným nežiaducim reakciám.
Užívanie lieku Orladeyo v dávke 150 mg viedlo k štatisticky a klinicky významnému zníženiu miery záchvatov HAE v porovnaní s placebom počas 24 týždňov v primárnom ukazovateli u populácii so zámerom liečiť (ITT), ako je uvedené v tabuľke 2. Percentuálne zníženie miery záchvatov HAE bolo výraznejšie pri lieku Orladeyo v dávke 150 mg v porovnaní s placebom, bez ohľadu na mieru záchvatov počas spúšťacieho obdobia štúdie.
Tabuľka 2: Zníženie miery záchvatov HAE v populácii ITT liečenej berotralstatom v dávke
150 mg
Výsledok
|
Berotralstat 150 mg
(n = 40)
|
Placebo
(n = 40a)
|
Miera za 28
dní
|
Percentuálne zníženie oproti placebu
(95 % interval
spoľahlivosti)
|
Hodnota p
|
Miera za
28 dní
|
Miera záchvatov HAE
|
1,31
|
44,2 % (23,0; 59,5)
|
< 0,001
|
2,35
|
a Jeden pacient v analýze ITT bol randomizovaný do skupiny s placebom, ale nebol liečený.
Zníženie miery záchvatov sa zachovalo počas 24 týždňov, ako je uvedené v grafe 1.
Graf 1: Miera záchvatov HAE za mesiac počas 24 týždňov liečby berotralstatom v dávke 150 mg(n = 40) alebo placebom (n = 40)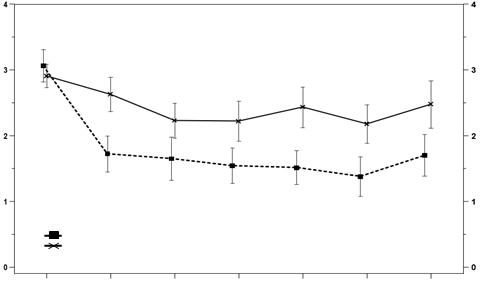
berotralstat 150 mg
placebo
Východisková
| 1
| 2
| 3
| 4
| 5
| 6
|
hodnota
|
|
|
|
|
|
|
|
|
| Mesiac
|
|
|
|
berotralstat 150 mg N = 40
| 37
| 37
| 37
| 37
| 37
| 37
|
placebo N = 39
| 39
| 38
| 37
| 36
| 34
| 34
|
SEM; štandardná chyba priemeru
Z pacientov užívajúcich 150 mg berotralstatu malo 58 % ≥ 50 % zníženie miery záchvatov HAE
v porovnaní s východiskovým údajom oproti 25 % pacientov liečených placebom.
Liek Orladeyo 150 mg znížil mieru záchvatov HAE, ktoré si vyžadujú liečbu akútnych záchvatov so štandardnou starostlivosťou, o 49,2 % (95 % interval spoľahlivosti: 25,5 %, 65,4 %) v porovnaní
s placebom (miera za 28 dní: 1,04 vs. 2,05).
Kvalita života súvisiaca so zdravímPacienti užívajúci berotralstat 150 mg dosiahli celkové zlepšenie skóre v dotazníku kvality života s angioedémom (AE-QoL), ako aj zlepšenie v skóre jednotlivých domén (funkčná, únava/nálada, strach/zahanbenie a výživa) v porovnaní so skupinou s placebom, ako je uvedené v tabuľke 3. Zníženie o 6 bodov sa považuje za klinicky významné zlepšenie. Najvýraznejšie zlepšenie sa pozorovalo vo funkčnom skóre.
Tabuľka 3: Zmena v skóre AE-QoL* – berotralstat v porovnaní s placebom v 24. týždni
|
Priemerná zmena (SE) metódou LS od východiskovej hodnoty v 24. týždni
|
Priemerný rozdiel metódou LS oproti placebu (95 % interval spoľahlivosti)
|
Berotralstat
150 mg
|
Placebo
|
Celkové skóre AE-QoL
|
-14,6 (2,6)
|
-9,7 (2,6)
|
-4,90
(-12,23; 2,43)
|
Funkčné skóre
|
-19,5 (3,4)
|
-10,4 (3,4)
|
-9,10
(-18,58; 0,38)
|
Skóre únavy/nálady
|
-11,3 (3,2)
|
-9,2 (3,3)
|
-2,16
(-11,35, 7,03)
|
'
Skóre strachu/zahanbenia
|
-15,4 (3,2)
|
-10,5 (3,3)
|
-4,96
(-14,05, 4,13)
|
Výživové skóre
|
-8,8 (3,0)
|
-6,1 (3,1)
|
-2,68
(-11,27; 5,92)
|
AE-QoL = dotazník kvality života s angioedémom; CI = interval spoľahlivosti; LS = najmenšie štvorce; SE = štandardná chyba
*Nižšie skóre naznačujú zlepšenú kvalitu života (nižšiu mieru zhoršenia)
Pediatrická populáciaV oboch štúdiách bola hodnotená bezpečnosť a účinnosť lieku Orladeyo u 28 dospievajúcich
pacientov vo veku od 12 do < 18 rokov. Bezpečnostný profil a miera záchvatov v štúdii boli podobné ako v prípade dospelých pacientov.
Bezpečnosť a účinnosť berotralstatu u pediatrických pacientov mladších ako 12 rokov neboli stanovené.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s liekom Orladeyo
v jednej alebo vo viacerých podskupinách pediatrickej populácie pri liečbe hereditárneho angioedému na prevenciu záchvatov u pacientov s hereditárnym angioedémom (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpciaPo perorálnom podaní berotralstatu v dávke 150 mg raz denne je Cmax a plocha pod krivkou
v dávkovacom intervale (AUCtau) 158 ng/ml (rozsah: 110 až 234 ng/ml) a 2 770 ng*h/ml v uvedenom
poradí (rozsah: 1 880 až 3 790 ng*h/ml). Farmakokinetika berotralstatu u pacientov s HAE je podobná
ako u zdravých ľudí.
Expozícia berotralstatu (Cmax a AUC) sa zvyšuje viac než úmerne s dávkou a ustálený stav sa dosiahne do 6 až 12 dní.
Vplyv jedlaPo podaní berotralstatu s jedlom s vysokým obsahom tuku neboli pozorované žiadne rozdiely v Cmax a AUC. Hodnota mediánu tmax sa však oneskorila o 3 hodiny, a to z 2 hodín (nalačno) na 5 hodín (s jedlom, rozsah: 1 až 8 hodín). Berotralstat sa má podávať s jedlom, aby sa minimalizovali gastrointestinálne nežiaduce udalosti.
DistribúciaVäzba na plazmatické proteíny je približne 99 %. Po podaní jednorazovej 300 mg dávky rádioaktívne
značeného berotralstatu bol pomer v krvi a plazme približne 0,92. V ustálenom stave bol pre berotralstat 150 mg podávaný raz denne geometrický priemer (%CV) Vd/F 3123 l (40 %).
Biotransformácia
Berotralstat je metabolizovaný prostredníctvom CYP2D6 a CYP3A4 s pomalým obratom in vitro. Po
podaní jednorazovej perorálnej 300 mg dávky rádioaktívne označeného berotralstatu predstavoval berotralstat 34 % celkovej rádioaktivity plazmy, pričom išlo o 8 metabolitov a každý predstavoval od
1,8 do 7,8 % celkovej rádioaktivity. Štruktúry 5 z 8 metabolitov sú známe. Nie je známe, či je niektorý metabolit farmakologicky aktívny.
Berotralstat v dávke 150 mg podávaný raz denne je stredne silný inhibítor CYP2D6 a CYP3A4 a slabý inhibítor CYP2C9. Berotralstat nie je inhibítor CYP2C19.
Berotralstat je pri dvojnásobne odporúčanej dávke slabým inhibítorom P-gp a nie je inhibítorom
BCRP.
Eliminácia
Po podaní jednorazovej dávky 150 mg bol medián polčasu berotralstatu približne 93 hodín (rozsah: 39
až 152 hodín).
Po podaní jednorazovej perorálnej 300 mg dávky rádioaktívne označeného berotralstatu sa približne
9 % vylúčilo močom (3,4 % v nezmenenej podobe; rozsah 1,8 až 4,7 %) a 79 % sa vylúčilo stolicou. Dodatočné analýzy ukázali, že približne 50 % frakcie získanej zo stolice predstavoval berotralstat v nezmenej podobe.
Osobitné populácie pacientov
Analýzy farmakokinetiky v populácii preukázali, že vek, pohlavie a rasa nemali významný vplyv na
farmakokinetiku berotralstatu. Telesná hmotnosť sa identifikovala ako kovariát opisujúci variabilitu klírensu a distribučného objemu, čo vedie k vyššej expozícii (AUC a Cmax) u pacientov s nižšou hmotnosťou. Tento rozdiel sa však nepovažuje za klinicky relevantný a neodporúča sa úprava dávkovania pre žiadnu z týchto demografických charakteristík.
Pediatrická populácia
Na základe analýz farmakokinetiky v populácii, ktorá zahŕňala pediatrických pacientov vo veku od 12 do < 18 rokov s hmotnosťou najmenej 40 kg, bola expozícia v ustálenom stave po perorálnom podaní berotralstatu v dávke 150 mg raz denne mierne vyššia (vyššia o 29 %) než expozícia u dospelých
s odhadovaným geometrickým priemerom (CV %) AUCtau 2 515 (38,6) ng*h/ml. Tento rozdiel sa
však nepovažuje za klinicky relevantný a neodporúča sa úprava dávkovania u pediatrických pacientov
vo veku od 12 do < 18 rokov s hmotnosťou od 40 kg.
Porucha funkcie obličiek
Farmakokinetika jednorazovej 200 mg perorálnej dávky berotralstatu sa skúmala u pacientov so závažnou poruchou funkcie obličiek (odhadované GFR nižšie než 30 ml/min). Pri porovnaní súbežnej kohorty s normálnou funkciou obličiek (GFR vyššie než 90 ml/min) sa Cmax zvýšila o 39 %, zatiaľ čo v AUC nebol zistený žiadny rozdiel. V prípade pacientov s miernou alebo stredne závažnou poruchou funkcie obličiek nie je potrebná úprava dávkovania. Pacienti so závažnou poruchou funkcie obličiek môžu byť vystavení riziku predĺženia intervalu QT. Užívaniu berotralstatu u týchto pacientov je vhodnejšie sa vyhnúť.
Nevykonala sa štúdia o farmakokinetike berotralstatu u pacientov so zlyhaním obličiek, ktorí potrebujú hemodialýzu. Vzhľadom na to, že sa berotralstat vo vysokej miere viaže na plazmatické proteíny, nie je pravdepodobné, že by sa hemodialýzou odstránil.
Porucha funkcie pečene
Farmakokinetika jednorazovej 150 mg perorálnej dávky berotralstatu sa skúmala u pacientov
s miernou, stredne závažnou a závažnou poruchou funkcie pečene (trieda A, B alebo C podľa Childa- Pugha). Farmakokinetika berotralstatu sa nezmenila u pacientov s miernou poruchou funkcie pečene
v porovnaní s pacientmi s normálnou funkciou pečene. U pacientov so stredne závažným zhoršením
funkcie pečene sa Cmax zvýšila o 77 %, zatiaľ čo AUC0-inf sa zvýšila o 78 %. U pacientov so závažným zhoršením funkcie pečene sa Cmax zvýšila o 27 %, zatiaľ čo AUC0-inf sa znížila o 6 %. Odhadované zvýšenie priemerného intervalu QTcF u pacientov so stredne závažnou až závažnou poruchou funkcie pečene bolo do 8,8 ms (2-stranná 90 % UB 13,1 ms). Má sa predchádzať užívaniu berotralstatu
u pacientov s mierne závažnou alebo závažnou poruchou funkcie pečene (trieda B alebo C podľa
Childa-Pugha).
Starší pacienti
Berotralstat sa neskúmal u pacientov starších ako 75 rokov, neočakáva sa však, že vek má vplyv na expozíciu berotralstatu.
5.3 Predklinické údaje o bezpečnosti
V neklinických štúdiách chronickej toxicity po opakovanej dávke sa pozorovala fosfolipidóza (prítomnosť penových vakuolizovaných makrofágov) v pečeni potkanov (elektrónovou mikroskopiou) a predpokladá sa jej prítomnosť v pečeni, tenkom čreve, pľúcach, slezine a lymfatickom tkanive u potkanov a opíc, a to v klinicky relevantných expozíciách. Klinický význam týchto zistení nie je známy.
Skeletálna myofibrilná degenerácia/nekróza sa pozorovala v 2-ročnej (celoživotnej) štúdii u potkanov. Expozícia pri hladine bez pozorovaného nepriaznivého účinku (NOAEL) pre tieto zistenia u potkanov bola 4,5-násobkom expozície dosiahnutej (na základe AUC) pri klinickej dávke 150 mg berotralstatu.
Neklinické údaje získané na základe obvyklých štúdií genotoxicity neodhalili žiadne osobitné riziko pre ľudí.
V 6-mesačnej štúdii u transgénnych myší Tg rasH2 sa nezaznamenal žiadny nárast nádorov. Expozícia v tejto štúdii karcinogenity u myší bola 10-násobkom expozície dosiahnutej (na základe AUC) pri klinickej dávke 150 mg berotralstatu.
Zriedkavé stromálne sarkómy endometria a nediferencované sarkómy kože boli zistené v 2-ročnej (celoživotnej) štúdii u potkanov, ktorým bol podaný berotralstat pri expozícii, ktorá bola 4,5- násobkom expozície dosiahnutej (na základe AUC) pri klinickej dávke 150 mg berotralstatu. Tieto zistenia nie sú presvedčivé, keďže incidencia je mierne vyššia ako v kontrolných skupinách. Klinický význam týchto zistení nie je známy.
Berotralstat prechádza u potkanov a králikov cez placentárnu bariéru. Štúdia embryo-fetálneho vývoja vykonaná na gravidných potkanoch, ktorým bol podávaný berotralstat pri expozícii, ktorá bola 9,7- násobkom expozície dosiahnutej (na základe AUC) pri klinickej dávke 150 mg berotralstatu, neodhalila žiadny dôkaz o poškodení vyvíjajúceho sa plodu. Druhá štúdia embryo-fetálneho vývoja na relevantných druhoch nehlodavcov nebola vykonaná.
Berotralstat bol zistený v plazme mláďat potkanov v 14. deň laktácie v koncentrácii zodpovedajúcej približne 5 % koncentrácii v materskej plazme.
Berotralstat nemal žiadne účinky na párenie alebo fertilitu u samcov a samíc potkanov pri dávke, ktorá bola 2,9-násobkom klinickej dávky 150 mg berotralstatu na základe mg/m2.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Náplň kapsuly
krospovidón (typ A)
stearát horečnatý
koloidný bezvodý oxid kremičitý
škrob, predželatinizovaný
Obal kapsuly
želatína
oxid titaničitý (E 171)
indigotín (E 132)
čierny oxid železitý (E 172)
červený oxid železitý (E 172)
Tlačiarenská farba
čierny oxid železitý (E 172)
hydroxid draselný šelak
propylénglykol (E 1520)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Hliníkové blistre PCTFE/PVC v škatuli so 7 kapsulami v jednom blistri
Veľkosť balenia: 28 alebo 98 tvrdých kapsúl
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
BioCryst Ireland Limited
Block 4, Harcourt Centre, Harcourt Road, DUBLIN 2, D02HW77
Írsko
Tel: +353 (0) 1 963 1067
E-mail: safety@biocryst.com
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
EU/1/21/1544/001
EU/1/21/1544/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na webovej stránke Európskej agentúry pre lieky http://www.ema.europa.eu.