
znych podskupinách pediatrickej populácie alebo iný od bezpečnostného profilu u dospelých pacientov.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieNáhodné požitie nitizinónu jedincami s normálnou stravou s neobmedzeným prívodom tyrozínu a fenylalanínu spôsobí zvýšenie hladín tyrozínu. Zvýšená hladina tyrozínu sa spája s toxicitou pre oči, pokožku a nervový systém. Obmedzenie príjmu tyrozínu a fenylalanínu v strave má obmedziť toxicitu spájanú s týmto typom tyrozinémie. Informácie o špecifickej liečbe predávkovania nie sú k dispozícii.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Iné liečivá ovplyvňujúce tráviaci trakt a metabolizmus, Rôzne liečivá ovplyvňujúce tráviaci trakt a metabolizmus, ATC kód: A16A X04.
Mechanizmus
účinku
Biochemický defekt pri hereditárnej tyrozinémii typu 1 (HT-1) je deficiencia fumarylacetoacetáthydrolázy, ktorá je posledným enzýmom v katabolizme tyrozínu. Nitizinón je
kompetitívnym inhibítorom 4-hydroxyfenylpyruvátdioxygenázy, enzýmu, ktorý predchádza
fumarylacetoacetáthydroláze v katabolizme tyrozínu. Inhibíciou normálneho katabolizmu tyrozínu u pacientov s HT-1 zabraňuje nitizinón akumulácii toxických intermediárnych metabolitov maleylacetoacetátu a fumarylacetoacetátu. U pacientov s HT-1 sa tieto metabolity menia na toxické metabolity sukcinylacetón a sukcinylacetoacetát. Sukcinylacetón inhibuje syntézu porfyrínu a to vedie k akumulácii 5-aminolevulinátu.
Farmakodynamické účinkyLiečba nitizinónom vedie k normalizácii porfyrínového metabolizmu s normálnou aktivitou erytrocytárnej porfobilinogén-syntázy a 5-aminolevulinátu v moči, zníženiu vylučovania
sukcinylacetónu do moču, zvýšenej plazmatickej koncentrácii tyrozínu a zvýšenej exkrécii fenolových
kyselín do moču. Dáta z dostupných klinických štúdií ukazujú, že u viac ako 90 % pacientov sa počas prvého týždňa liečby normalizovala hladina sukcinylacetónu v moči. V prípade, že je dávkovanie nitizinónu správne nastavené, nemá byť v moči alebo plazme detegovateľný sukcinylacetón.
KlinickáúčinnosťabezpečnosťPri porovnávaní dát s historickými záznamami sa zistilo, že pri liečbe nitizinónom spolu s diétnymi obmedzeniami je pravdepodobnosť prežitia vyššia pri všetkých HT-1 fenotypochnitizinónu. Vidíme to v nasledujúcej tabuľke:
Vek pri začatí liečby alebo
určení diagnózy
| Pravdepodobnosť prežívania
|
Liečba nitizinónom
| Diétne obmedzenia
|
5 rokov
| 10 rokov
| 5 rokov
| 10 rokov
|
< 2 mesiace
| 82
| --
| 28
| --
|
> 2 - 6 mesiacov
| 95
| 95
| 51
| 34
|
> 6 mesiacov
| 92
| 86
| 93
| 59
|
Zistilo sa, že liečba nitizinónom znižuje riziko rozvoja hepatocelulárneho karcinómu (2,3- až 3,7-krát) v
porovnaní s historickými dátami, keď liečba spočívala len v diétnych obmedzeniach. Taktiež sa potvrdilo, že skoré začatie liečby ešte viac znižuje riziko rozvoja hepatocelulárneho karcinómu (13,5-krát, keď je liečba začatá pred 12. mesiacom života).
5.2 Farmakokinetické vlastnostiNevykonali sa formálne štúdie zaoberajúce sa absorpciou, distribúciou, metabolizmom a elimináciou nitizinónu. Po podaní jednej dávky nitizinónu (1 mg/kg telesnej hmotnosti) desiatim zdravým mužským dobrovoľníkom bol plazmatický polčas nitizinónu 54 hodín (rozmedzie od 39 až 86 hodín). V skupine
207 pacientov s HT-1 sa vykonala populačná farmakokinetická analýza. Klírens a plazmatický polčas sa určili na 0,0956 l/kg telesnej hmotnosti/deň, resp. 52,1 hodín.
In vitro štúdie s použitím ľudských pečeňových mikrozómov a P450 enzýmov získaných z cDNA
ukázali znížený CYP 3A4-sprostredkovaný metabolizmus.
5.3 Predklinické údaje o bezpečnostiNitizinón vykazuje embryo-fetálnu toxicitu na myšiach a králikoch pri klinicky významných dávkach. U králikov nitizinón indukuje dávkovo závislé zvýšenie malformácií (umbilikálna hernia a gastroschíza) pri dávkach 2,5-krát vyšších ako maximálna doporučená dávka pre človeka
(2 mg/kg/deň).
Štúdie pre a postnatálneho vývoja u myší ukázali štatisticky významné skrátené prežívanie a znížený rast mláďat po odstavení pri expozícii dávkam 125- a 25-krát vyšším, ako je maximálna odporučená dávka pre človeka. Tento efekt na prežívanie mláďat sa začal prejavovať pri dávke od 5 mg/kg/deň
s tendenciou k negatívnemu efektu. U potkanov v dôsledku expozície cez materské mlieko zníženie
hmotnosti u mláďat a výskyt korneálne lézie.
V in vitro výskumoch sa nedokázal mutagénny účinok, ale slabá klastogénna aktivita. Nedokázala sa in vivo genotoxicita (analýza mikronuklea u myší a analýza syntézy DNA v myšacej pečeni mimo rozvrhu). Nerobila sa žiadna štúdia karcinogenity.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly
predželatinovaný škrob (kukuričný)
Obal kapsuly želatína
oxid titaničitý (E 171)
Potlač
čierny oxid železitý (E 172)
šelak propylénglykol
hydroxid amónny.
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
18 mesiacov.
Počas použiteľnosti lieku pacient môže po dobu 2 mesiacov uchovávať kapsuly pri teplote neprevyšujúcej 25 °C, potom však liek musí byť zlikvidovaný.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C).
6.5 Druh obalu a obsah balenia
Polyetylénová fľaša s vysokou hustotou s poistným polyetylénovým uzáverom s nízkou hustotou, obsahuje 60 kapsúl.
Jedno balenie obsahuje 1 fľašu.
6.6 Špeciálne opatrenia na likvidáciu
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Swedish Orphan Biovitrum International AB SE-112 76 Stockholm
Švédsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/04/303/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21/02/2005
Dátum posledného predĺženia registrácie: 21/02/2010
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Orfadin 5 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá kapsula obsahuje 5 mg nitizinónu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tvrdá kapsula.
Biele matné kapsuly (6 x 16 mm) s vytlačeným čiernym nápisom „NTBC 5mg“ na tele kapsuly. Kapsuly obsahujú prášok bielej až šedobielej farby.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba dospelých a pediatrických (v každom veku) pacientov s potvrdenou diagnózou hereditárnej tyrozinémie typu 1 (HT-1) v kombinácii s obmedzením tyrozínu a fenylalanínu v diéte.
4.2 Dávkovanie a spôsob podávania
Liečbu nitizinónom má začať a sledovať lekár skúsený v liečbe pacientov s HT-1. Dávkovanie
Liečba všetkých genotypových foriem ochorenia má začať čo najskôr, aby sa zvýšilo celkové prežívanie
a predišlo komplikáciám ako napr. zlyhaniu pečene, nádoru pečene a ochoreniu obličiek.
V kombinácii s liečbou nitizinónom je potrebná diéta, ktorá neobsahuje fenylalanín a tyrozín a následne monitorovanie hladín aminokyselín v plazme (pozri časti 4.4 a 4.8).
Odporúčaná iniciálna dávka v detskej a dospelej populácii je 1 mg/kg hmotnosti/deň rozdelená do dvoch dávok podaných perorálne. Dávkovanie nitizinónu má byť prispôsobené individuálnym potrebám každého pacienta.
Úprava dávkovania
Počas pravidelného monitorovania je potrebné sledovať hladinu sukcinylacetónu v moči, hodnoty hepatálnych testov a hladinu alfa-fetoproteínu (pozri časť 4.4). Ak je mesiac po začatí liečby nitizinónom v moči stále detegovateľný sukcinylacetón, dávka sa má zvýšiť na 1,5 mg/kg telesnej hmotnosti/deň, rozdelená do dvoch dávok. Na základe zhodnotenia všetkých biochemických parametrov bude možno potrebná dávka 2 mg/kg telesnej hmotnosti/deň. Táto dávka má byť maximálnou dávkou pre všetkých pacientov.
Ak je biochemická odpoveď uspokojivá, dávkovanie sa má upraviť len podľa zvýšenia telesnej
hmotnosti.
Počas začatia liečby alebo pri zhoršení stavu je nevyhnutné podrobnejšie sledovať všetky dostupné biochemické parametre (napr. plazmatické hladiny sukcinylacetónu, hladinu 5-aminolevulinátu (ALA) v moči a aktivitu erytrocytárnej porfobilinogén (PBG)-syntázy).
Osobitné populácie
Pre starších ľudí alebo pacientov s narušenou funkciou obličiek alebo pečene sa neudávajú žiadne špecifické odporúčania.
Pediatrická populácia
Odporúčania dávky v mg/kg telesnej hmotnosti sú rovnaké u detí a u dospelých.
Spôsob podávania
Kapsula sa môže tesne pred užitím otvoriť a jej obsah rozpustiť v malom množstve vody alebo tekutej
výživy.
Orfadin je tiež dostupný ako 4 mg/ml perorálna suspenzia pre pediatrických pacientov, ktorí majú problémy s prehĺtaním kapsúl.
Ak sa liečba nitizinónom začína s jedlom, odporúča sa, aby sa vykonávala pravidelne, pozri časť 4.5.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Matky užívajúce nitizinón nesmú dojčiť (pozri časti 4.6 a 5.3).
4.4 Osobitné upozornenia a opatrenia pri používaní
Monitorovanie hladín tyrozínu v plazme
Pred začatím liečby sa odporúča vyšetrenie očného pozadia. Ak sa u pacienta počas liečby vyskytnú zrakové poruchy, má byť bez meškania vyšetrený oftalmológom. Pacient má dodržiavať diétny režim a
majú sa merať plazmatické koncentrácie tyrozínu. Ak sa plazmatické hladiny tyrozínu zvýšia nad
500 mikromol/l, má sa znížiť prívod tyrozínu a fenylalanínu v diéte. Neodporúča sa znižovať plazmatickú koncentráciu tyrozínu redukciou dávok nitizinónu, alebo jeho vysadením, keďže metabolický defekt môže spôsobiť zhoršenie klinického stavu pacienta.
Monitorovaniepečene
Funcia pečene má byť pravidelne monitorovaná pomocou pečeňových testov a zobrazovacích metód. Odporúča sa sledovať aj koncentrácie alfa-fetoproteínu v sére. Zvýšenie sérovej koncentrácie
alfa-fetoproteínu môže byť signálom nedostatočnej liečby. U pacientov so zvyšujúcou sa hladinou
alfa-fetoproteínu alebo výskytom uzlín v pečeni je dôležité sledovať možný výskyt malignity v pečeni.
Monitorovanie trombocytov a leukocytov
Odporúča sa pravidelne sledovať hladiny trombocytov a leukocytov, keďže sa vyskytli prípady
reverzibilnej trombocytopénie a leukopénie počas klinického hodnotenia.
Kontrolné návštevy sa majú vykonávať každých 6 mesiacov. Kratšie intervaly medzi návštevami sa odporúčajú v prípade nežiaducich účinkov.
4.5 Liekové a iné interakcie
Nerobili sa žiadne formálne interakčné štúdie s inými liekmi.
Nitizinón sa in vitro metabolizuje prostredníctvom CYP 3A4 a preto bude možno potrebné prispôsobiť
dávkovanie, ak pacient spolu s nitizinónom užíva inhibítory, alebo induktory tohto enzýmu.
Na základe výskumov in vitro sa neočakáva inhibícia metabolizmu sprostredkovaná CYP 1A2, 2C9,
2C19, 2D6, 2E1 alebo 3A4.
Neboli uskutočnené žiadne formálne štúdie interakcií tvrdých kapsúl Orfadinu s jedlom. Nitizinón bol však podávaný s jedlom pri získavaní údajov o účinnosti a bezpečnosti. Preto sa v prípade, ak liečba nitizinónom v tvrdých kapsulách Orfadinu prebieha od začiatku s jedlom, odporúča v tomto pravidelne pokračovať, pozri časť 4.2.
4.6 Fertilita, gravidita a laktácia
G
r
avidita
Nie sú k dispozícii dostatočné údaje o použití nitizinónu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko u ľudí. Orfadin sa nemá používať počas gravidity, pokiaľ klinický stav ženy nevyžaduje liečbu nitizinónom.
Laktácia
Nie je známe, či je nitizinón vylučovaný do materského mlieka. Štúdie na zvieratách preukázali nepriaznivé postnatálne účinky nitizinónu po expozícii v materskom mlieku. Z tohto dôvodu matky, ktoré užívajú nitizinón nesmú dojčiť, keďže nemožno vylúčiť riziko pre dojčené dieťa (pozri časti 4.3 a
5.3).
Fertilita
Nie sú k dispozícii žiadne údaje o vplyve nitizinónu na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Orfadin má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Nežiaduce reakcie týkajúce sa očí (pozri časť 4.8) môžu ovplyvniť zrak. Ak dôjde k ovplyvneniu zraku, pacient nesmie viesť vozidlá ani obsluhovať stroje, až kým tento účinok neustúpi.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Na základe jeho mechanizmu pôsobenia, nitizinón zvyšuje hladiny tyrozínu u všetkých pacientov liečených nitizinónom. Nežiaduce reakcie týkajúce sa očí, ako je konjuktivitída, zákal rohovky, keratitída, fotofóbia a bolesť očí, súvisiace so zvýšenými hladinami tyrozínu sú preto bežné. Medzi ďalšie časté nežiaduce reakcie patria trombocytopénia, leukopénia a granulocytopénia. Menej často sa môže vyskytovať exfoliatívna dermatitída.
Tabuľkovýzoznamnežiaducichreakcií
Nežiaduce reakcie rozdelené nižšie podľa triedy orgánových systémov MedDRA a celkovej frekvencie sú založené na údajoch z klinického skúšania a používania po uvedení na trh. Frekvencie sa popisujú ako veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/10 00 až <1/100), zriedkavé
(≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (častosť sa nedá odhadnúť z
dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
O
rgánové systémy podľa
MedDRA
|
F
r
ekvencia
|
N
ežiaduca reakcia
|
Poruchy krvi a lymfatického
systému
|
Časté
|
Trombocytopénia,
leukopénia, granulocytopénia
|
Menej časté
|
Leukocytóza
|
Poruchy oka
|
Časté
|
Konjunktivitída, zákal
rohovky, keratitída,
fotofóbia, bolesť oka
|
Menej časté
|
Blefaritída
|
Poruchy kože a podkožného
tkaniva
|
Menej časté
|
Exfoliatívna dermatitída,
erytematózna vyrážka, pruritus
|
Laboratórne a funkčné
vyšetrenia
|
Veľmi časté
|
Zvýšené hladiny tyrozínu
|
O
pis vybraných nežiaducich reakcií
Liečba nitizinónom vedie k zvýšeným hladinám tyrozínu. Pri zvýšených hladinách tyrozínu sa vyskytujú nežiaduce reakcie súvisiace s očami, ako sú napríklad zákaly rohovky a hyperkeratotické
lézie. Obmedzenie tyrozínu a fenylalanínu v potrave má limitovať toxicitu pri tomto type tyrozinémie
znižovaním hladín tyrozínu (pozri časť 4.4).
V klinických štúdiách bola granulocytopénia len menej často závažná (< 0,5x109/l) a nebola spojená s infekciami. Nežiaduce reakcie ovplyvňujúce triedu orgánových systémov MedDRA „Poruchy krvi
a lymfatického systému“ ustúpili počas pokračujúcej liečby nitizinónom.
Pediatrická populáciaBezpečnostný profil je založený hlavne na pediatrickej populácii, pretože liečba nitizinónom sa má
začať čo najskôr po stanovení diagnózy hereditárnej tyrozinémie typu 1 (HT-1). Na základe údajov
z klinickej štúdie a údajov po uvedení na trh neexistujú žiadne indikácie, že bezpečnostný profil je iný v rôznych podskupinách pediatrickej populácie alebo iný od bezpečnostného profilu u dospelých pacientov.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieNáhodné požitie nitizinónu jedincami s normálnou stravou s neobmedzeným prívodom tyrozínu a fenylalanínu spôsobí zvýšenie hladín tyrozínu. Zvýšená hladina tyrozínu sa spája s toxicitou pre oči, pokožku a nervový systém. Obmedzenie príjmu tyrozínu a fenylalanínu v strave má obmedziť toxicitu spájanú s týmto typom tyrozinémie. Informácie o špecifickej liečbe predávkovania nie sú k dispozícii.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Iné liečivá ovplyvňujúce tráviaci trakt a metabolizmus, Rôzne liečivá ovplyvňujúce tráviaci trakt a metabolizmus, ATC kód: A16A X04.
Mechanizmus
účinku
Biochemický defekt pri hereditárnej tyrozinémii typu 1 (HT-1) je deficiencia fumarylacetoacetáthydrolázy, ktorá je posledným enzýmom v katabolizme tyrozínu. Nitizinón je
kompetitívnym inhibítorom 4-hydroxyfenylpyruvátdioxygenázy, enzýmu, ktorý predchádza
fumarylacetoacetáthydroláze v katabolizme tyrozínu. Inhibíciou normálneho katabolizmu tyrozínu u pacientov s HT-1 zabraňuje nitizinón akumulácii toxických intermediárnych metabolitov maleylacetoacetátu a fumarylacetoacetátu. U pacientov s HT-1 sa tieto metabolity menia na toxické metabolity sukcinylacetón a sukcinylacetoacetát. Sukcinylacetón inhibuje syntézu porfyrínu a to vedie k akumulácii 5-aminolevulinátu.
FarmakodynamickéúčinkyLiečba nitizinónom vedie k normalizácii porfyrínového metabolizmu s normálnou aktivitou erytrocytárnej porfobilinogén-syntázy a 5-aminolevulinátu v moči, zníženiu vylučovania
sukcinylacetónu do moču, zvýšenej plazmatickej koncentrácii tyrozínu a zvýšenej exkrécii fenolových
kyselín do moču. Dáta z dostupných klinických štúdií ukazujú, že u viac ako 90 % pacientov sa počas prvého týždňa liečby normalizovala hladina sukcinylacetónu v moči. V prípade, že je dávkovanie nitizinónu správne nastavené, nemá byť v moči alebo plazme detegovateľný sukcinylacetón.
KlinickáúčinnosťabezpečnosťPri porovnávaní dát s historickými záznamami sa zistilo, že pri liečbe nitizinónom spolu s diétnymi obmedzeniami je pravdepodobnosť prežitia vyššia pri všetkých HT-1 fenotypochnitizinónu. Vidíme to v nasledujúcej tabuľke:
Vek pri začatí liečby alebo
určení diagnózy
| Pravdepodobnosť prežívania
|
Liečba nitizinónom
| Diétne obmedzenia
|
5 rokov
| 10 rokov
| 5 rokov
| 10 rokov
|
< 2 mesiace
| 82
| --
| 28
| --
|
> 2 - 6 mesiacov
| 95
| 95
| 51
| 34
|
> 6 mesiacov
| 92
| 86
| 93
| 59
|
Zistilo sa, že liečba nitizinónom znižuje riziko rozvoja hepatocelulárneho karcinómu (2,3- až 3,7-krát) v
porovnaní s historickými dátami, keď liečba spočívala len v diétnych obmedzeniach. Taktiež sa potvrdilo, že skoré začatie liečby ešte viac znižuje riziko rozvoja hepatocelulárneho karcinómu (13,5-krát, keď je liečba začatá pred 12. mesiacom života).
5.2 Farmakokinetické vlastnostiNevykonali sa formálne štúdie zaoberajúce sa absorpciou, distribúciou, metabolizmom a elimináciou nitizinónu. Po podaní jednej dávky nitizinónu (1 mg/kg telesnej hmotnosti) desiatim zdravým mužským dobrovoľníkom bol plazmatický polčas nitizinónu 54 hodín (rozmedzie od 39 až 86 hodín). V skupine
207 pacientov s HT-1 sa vykonala populačná farmakokinetická analýza. Klírens a plazmatický polčas sa určili na 0,0956 l/kg telesnej hmotnosti/deň, resp. 52,1 hodín.
In vitro štúdie s použitím ľudských pečeňových mikrozómov a P450 enzýmov získaných z cDNA
ukázali znížený CYP 3A4-sprostredkovaný metabolizmus.
5.3 Predklinické údaje o bezpečnostiNitizinón vykazuje embryo-fetálnu toxicitu na myšiach a králikoch pri klinicky významných dávkach. U králikov nitizinón indukuje dávkovo závislé zvýšenie malformácií (umbilikálna hernia a gastroschíza) pri dávkach 2,5-krát vyšších ako maximálna doporučená dávka pre človeka
(2 mg/kg/deň).
Štúdie pre a postnatálneho vývoja u myší ukázali štatisticky významné skrátené prežívanie a znížený rast mláďat po odstavení pri expozícii dávkam 125- a 25-krát vyšším, ako je maximálna odporučená dávka pre človeka. Tento efekt na prežívanie mláďat sa začal prejavovať pri dávke od 5 mg/kg/deň
s tendenciou k negatívnemu efektu. U potkanov v dôsledku expozície cez materské mlieko zníženie
hmotnosti u mláďat a výskyt korneálne lézie.
V in vitro výskumoch sa nedokázal mutagénny účinok, ale slabá klastogénna aktivita. Nedokázala sa in vivo genotoxicita (analýza mikronuklea u myší a analýza syntézy DNA v myšacej pečeni mimo rozvrhu). Nerobila sa žiadna štúdia karcinogenity.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly
predželatinovaný škrob (kukuričný)
Obal kapsuly želatína
oxid titaničitý (E 171)
Potlač
čierny oxid železitý (E 172)
šelak propylénglykol
hydroxid amónny.
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
18 mesiacov.
Počas použiteľnosti lieku pacient môže po dobu 2 mesiacov uchovávať kapsuly pri teplote
neprevyšujúcej 25 °C, potom však liek musí byť zlikvidovaný.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C).
6.5 Druh obalu a obsah balenia
Polyetylénová fľaša s vysokou hustotou s poistným polyetylénovým uzáverom s nízkou hustotou, obsahuje 60 kapsúl.
Jedno balenie obsahuje 1 fľašu.
6.6 Špeciálne opatrenia na likvidáciu
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Swedish Orphan Biovitrum International AB SE-112 76 Stockholm
Švédsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/04/303/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21/02/2005
Dátum posledného predĺženia registrácie: 21/02/2010
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.1. NÁZOV LIEKUOrfadin 10 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá kapsula obsahuje 10 mg nitizinónu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMATvrdá kapsula.
Biele matné kapsuly (6 x 16 mm) s vytlačeným čiernym nápisom „NTBC 10mg“ na tele kapsuly.
Kapsuly obsahujú prášok bielej až šedobielej farby.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieLiečba dospelých a pediatrických (v každom veku) pacientov s potvrdenou diagnózou hereditárnej tyrozinémie typu 1 (HT-1) v kombinácii s obmedzením tyrozínu a fenylalanínu v diéte.
4.2 Dávkovanie a spôsob podávaniaLiečbu nitizinónom má začať a sledovať lekár skúsený v liečbe pacientov s HT-1.
DávkovanieLiečba všetkých genotypových foriem ochorenia má začať čo najskôr, aby sa zvýšilo celkové prežívanie
a predišlo komplikáciám ako napr. zlyhaniu pečene, nádoru pečene a ochoreniu obličiek.
V kombinácii s liečbou nitizinónom je potrebná diéta, ktorá neobsahuje fenylalanín a tyrozín a následne
monitorovanie hladín aminokyselín v plazme (pozri časti 4.4 a 4.8).
Odporúčaná iniciálna dávka v detskej a dospelej populácii je 1 mg/kg hmotnosti/deň rozdelená do dvoch dávok podaných perorálne. Dávkovanie nitizinónu má byť prispôsobené individuálnym potrebám každého pacienta.
Úprava dávkovaniaPočas pravidelného monitorovania je potrebné sledovať hladinu sukcinylacetónu v moči, hodnoty hepatálnych testov a hladinu alfa
-fetoproteínu (pozri časť 4.4). Ak je mesiac po začatí liečby nitizinónom v moči stále detegovateľný sukcinylacetón, dávka sa má zvýšiť na 1,5 mg/kg telesnej hmotnosti/deň, rozdelená do dvoch dávok. Na základe zhodnotenia všetkých biochemických parametrov bude možno potrebná dávka 2 mg/kg telesnej hmotnosti/deň. Táto dávka má byť maximálnou dávkou pre všetkých pacientov.
Ak je biochemická odpoveď uspokojivá, dávkovanie sa má upraviť len podľa zvýšenia telesnej
hmotnosti.
Počas začatia liečby alebo pri zhoršení stavu je nevyhnutné podrobnejšie sledovať všetky dostupné biochemické parametre (napr. plazmatické hladiny sukcinylacetónu, hladinu 5
-aminolevulinátu (ALA) v moči a aktivitu erytrocytárnej porfobilinogén (PBG)
-syntázy).
Osobitné populáciePre starších ľudí alebo pacientov s narušenou funkciou obličiek alebo pečene sa neudávajú žiadne špecifické odporúčania.
Pediatrická populáciaOdporúčania dávky v mg/kg telesnej hmotnosti sú rovnaké u detí a u dospelých.
Spôsob podávaniaKapsula sa môže tesne pred užitím otvoriť a jej obsah rozpustiť v malom množstve vody alebo tekutej
výživy.
Orfadin je tiež dostupný ako 4 mg/ml perorálna suspenzia pre pediatrických pacientov, ktorí majú problémy s prehĺtaním kapsúl.
Ak sa liečba nitizinónom začína s jedlom, odporúča sa, aby sa vykonávala pravidelne, pozri časť 4.5.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Matky užívajúce nitizinón nesmú dojčiť (pozri časti 4.6 a 5.3).
4.4 Osobitné upozornenia a opatrenia pri používaníMonitorovanie hladín tyrozínu v plazmePred začatím liečby sa odporúča vyšetrenie očného pozadia. Ak sa u pacienta počas liečby vyskytnú
zrakové poruchy, má byť bez meškania vyšetrený oftalmológom. Pacient má dodržiavať diétny režim a majú sa merať plazmatické koncentrácie tyrozínu. Ak sa plazmatické hladiny tyrozínu zvýšia nad
500 mikromol/l, má sa znížiť prívod tyrozínu a fenylalanínu v diéte. Neodporúča sa znižovať plazmatickú koncentráciu tyrozínu redukciou dávok nitizinónu, alebo jeho vysadením, keďže
metabolický defekt môže spôsobiť zhoršenie klinického stavu pacienta.
MonitorovaniepečeneFuncia pečene má byť pravidelne monitorovaná pomocou pečeňových testov a zobrazovacích metód. Odporúča sa sledovať aj koncentrácie alfa
-fetoproteínu v sére. Zvýšenie sérovej koncentrácie
alfa
-fetoproteínu môže byť signálom nedostatočnej liečby. U pacientov so zvyšujúcou sa hladinou
alfa
-fetoproteínu alebo výskytom uzlín v pečeni je dôležité sledovať možný výskyt malignity v pečeni.
Monitorovanie trombocytov a leukocytovOdporúča sa pravidelne sledovať hladiny trombocytov a leukocytov, keďže sa vyskytli prípady
reverzibilnej trombocytopénie a leukopénie počas klinického hodnotenia.
Kontrolné návštevy sa majú vykonávať každých 6 mesiacov. Kratšie intervaly medzi návštevami sa odporúčajú v prípade nežiaducich účinkov.
4.5 Liekové a iné interakcieNerobili sa žiadne formálne interakčné štúdie s inými liekmi.
Nitizinón sa
in vitro metabolizuje prostredníctvom CYP 3A4 a preto bude možno potrebné prispôsobiť
dávkovanie, ak pacient spolu s nitizinónom užíva inhibítory, alebo induktory tohto enzýmu.
Na základe výskumov
in vitro sa neočakáva inhibícia metabolizmu sprostredkovaná CYP 1A2, 2C9,
2C19, 2D6, 2E1 alebo 3A4.
Neboli uskutočnené žiadne formálne štúdie interakcií tvrdých kapsúl Orfadinu s jedlom. Nitizinón bol však podávaný s jedlom pri získavaní údajov o účinnosti a bezpečnosti. Preto sa v prípade, ak liečba nitizinónom v tvrdých kapsulách Orfadinu prebieha od začiatku s jedlom, odporúča v tomto pravidelne pokračovať, pozri časť 4.2.
4.6 Fertilita, gravidita a laktáciaGraviditaNie sú k dispozícii dostatočné údaje o použití nitizinónu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko u ľudí. Orfadin sa nemá používať počas gravidity, pokiaľ klinický stav ženy nevyžaduje liečbu nitizinónom.
LaktáciaNie je známe, či je nitizinón vylučovaný do materského mlieka. Štúdie na zvieratách preukázali nepriaznivé postnatálne účinky nitizinónu po expozícii v materskom mlieku. Z tohto dôvodu matky, ktoré užívajú nitizinón nesmú dojčiť, keďže nemožno vylúčiť riziko pre dojčené dieťa (pozri časti 4.3 a
5.3).
FertilitaNie sú k dispozícii žiadne údaje o vplyve nitizinónu na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeOrfadin má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Nežiaduce reakcie týkajúce sa očí (pozri časť 4.8) môžu ovplyvniť zrak. Ak dôjde k ovplyvneniu zraku, pacient nesmie viesť vozidlá ani obsluhovať stroje, až kým tento účinok neustúpi.
4.8 Nežiaduce účinkySúhrnbezpečnostnéhoprofiluNa základe jeho mechanizmu pôsobenia, nitizinón zvyšuje hladiny tyrozínu u všetkých pacientov liečených nitizinónom. Nežiaduce reakcie týkajúce sa očí, ako je konjuktivitída, zákal rohovky, keratitída, fotofóbia a bolesť očí, súvisiace so zvýšenými hladinami tyrozínu sú preto bežné. Medzi ďalšie časté nežiaduce reakcie patria trombocytopénia, leukopénia a granulocytopénia. Menej často sa môže vyskytovať exfoliatívna dermatitída.
TabuľkovýzoznamnežiaducichreakciíNežiaduce reakcie rozdelené nižšie podľa triedy orgánových systémov MedDRA a celkovej frekvencie sú založené na údajoch z klinického skúšania a používania po uvedení na trh. Frekvencie sa popisujú ako veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/10 00 až <1/100), zriedkavé
(≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (častosť sa nedá odhadnúť z
dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
O
rgánové systémy podľa
MedDRA
|
F
r
ekvencia
|
N
ežiaduca reakcia
|
Poruchy krvi a lymfatického
systému
|
Časté
|
Trombocytopénia,
leukopénia, granulocytopénia
|
Menej časté
|
Leukocytóza
|
Poruchy oka
|
Časté
|
Konjunktivitída, zákal
rohovky, keratitída,
fotofóbia, bolesť oka
|
Menej časté
|
Blefaritída
|
Poruchy kože a podkožného
tkaniva
|
Menej časté
|
Exfoliatívna dermatitída,
erytematózna vyrážka, pruritus
|
Laboratórne a funkčné
vyšetrenia
|
Veľmi časté
|
Zvýšené hladiny tyrozínu
|
O
pis vybraných nežiaducich reakcií
Liečba nitizinónom vedie k zvýšeným hladinám tyrozínu. Pri zvýšených hladinách tyrozínu sa vyskytujú nežiaduce reakcie súvisiace s očami, ako sú napríklad zákaly rohovky a hyperkeratotické
lézie. Obmedzenie tyrozínu a fenylalanínu v potrave má limitovať toxicitu pri tomto type tyrozinémie
znižovaním hladín tyrozínu (pozri časť 4.4).
V klinických štúdiách bola granulocytopénia len menej často závažná (< 0,5x109/l) a nebola spojená s infekciami. Nežiaduce reakcie ovplyvňujúce triedu orgánových systémov MedDRA „Poruchy krvi
a lymfatického systému“ ustúpili počas pokračujúcej liečby nitizinónom.
Pediatrická populáciaBezpečnostný profil je založený hlavne na pediatrickej populácii, pretože liečba nitizinónom sa má
začať čo najskôr po stanovení diagnózy hereditárnej tyrozinémie typu 1 (HT-1). Na základe údajov
z klinickej štúdie a údajov po uvedení na trh neexistujú žiadne indikácie, že bezpečnostný profil je iný v rôznych podskupinách pediatrickej populácie alebo iný od bezpečnostného profilu u dospelých pacientov.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieNáhodné požitie nitizinónu jedincami s normálnou stravou s neobmedzeným prívodom tyrozínu a fenylalanínu spôsobí zvýšenie hladín tyrozínu. Zvýšená hladina tyrozínu sa spája s toxicitou pre oči, pokožku a nervový systém. Obmedzenie príjmu tyrozínu a fenylalanínu v strave má obmedziť toxicitu spájanú s týmto typom tyrozinémie. Informácie o špecifickej liečbe predávkovania nie sú k dispozícii.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Iné liečivá ovplyvňujúce tráviaci trakt a metabolizmus, Rôzne liečivá ovplyvňujúce tráviaci trakt a metabolizmus, ATC kód: A16A X04.
Mechanizmus
účinku
Biochemický defekt pri hereditárnej tyrozinémii typu 1 (HT-1) je deficiencia fumarylacetoacetáthydrolázy, ktorá je posledným enzýmom v katabolizme tyrozínu. Nitizinón je
kompetitívnym inhibítorom 4-hydroxyfenylpyruvátdioxygenázy, enzýmu, ktorý predchádza
fumarylacetoacetáthydroláze v katabolizme tyrozínu. Inhibíciou normálneho katabolizmu tyrozínu u pacientov s HT-1 zabraňuje nitizinón akumulácii toxických intermediárnych metabolitov maleylacetoacetátu a fumarylacetoacetátu. U pacientov s HT-1 sa tieto metabolity menia na toxické metabolity sukcinylacetón a sukcinylacetoacetát. Sukcinylacetón inhibuje syntézu porfyrínu a to vedie k akumulácii 5-aminolevulinátu.
FarmakodynamickéúčinkyLiečba nitizinónom vedie k normalizácii porfyrínového metabolizmu s normálnou aktivitou
erytrocytárnej porfobilinogén-syntázy a 5-aminolevulinátu v moči, zníženiu vylučovania sukcinylacetónu do moču, zvýšenej plazmatickej koncentrácii tyrozínu a zvýšenej exkrécii fenolových kyselín do moču. Dáta z dostupných klinických štúdií ukazujú, že u viac ako 90 % pacientov sa počas prvého týždňa liečby normalizovala hladina sukcinylacetónu v moči. V prípade, že je dávkovanie nitizinónu správne nastavené, nemá byť v moči alebo plazme detegovateľný sukcinylacetón.
KlinickáúčinnosťabezpečnosťPri porovnávaní dát s historickými záznamami sa zistilo, že pri liečbe nitizinónom spolu s diétnymi obmedzeniami je pravdepodobnosť prežitia vyššia pri všetkých HT-1 fenotypochnitizinónu. Vidíme to v nasledujúcej tabuľke:
Vek pri začatí liečby alebo
určení diagnózy
| Pravdepodobnosť prežívania
|
Liečba nitizinónom
| Diétne obmedzenia
|
5 rokov
| 10 rokov
| 5 rokov
| 10 rokov
|
< 2 mesiace
| 82
| --
| 28
| --
|
> 2 - 6 mesiacov
| 95
| 95
| 51
| 34
|
> 6 mesiacov
| 92
| 86
| 93
| 59
|
Zistilo sa, že liečba nitizinónom znižuje riziko rozvoja hepatocelulárneho karcinómu (2,3- až 3,7-krát) v
porovnaní s historickými dátami, keď liečba spočívala len v diétnych obmedzeniach. Taktiež sa potvrdilo, že skoré začatie liečby ešte viac znižuje riziko rozvoja hepatocelulárneho karcinómu (13,5-krát, keď je liečba začatá pred 12. mesiacom života).
5.2 Farmakokinetické vlastnostiNevykonali sa formálne štúdie zaoberajúce sa absorpciou, distribúciou, metabolizmom a elimináciou nitizinónu. Po podaní jednej dávky nitizinónu (1 mg/kg telesnej hmotnosti) desiatim zdravým mužským dobrovoľníkom bol plazmatický polčas nitizinónu 54 hodín (rozmedzie od 39 až 86 hodín). V skupine
207 pacientov s HT-1 sa vykonala populačná farmakokinetická analýza. Klírens a plazmatický polčas sa určili na 0,0956 l/kg telesnej hmotnosti/deň, resp. 52,1 hodín.
In vitro štúdie s použitím ľudských pečeňových mikrozómov a P450 enzýmov získaných z cDNA
ukázali znížený CYP 3A4-sprostredkovaný metabolizmus.
5.3 Predklinické údaje o bezpečnostiNitizinón vykazuje embryo-fetálnu toxicitu na myšiach a králikoch pri klinicky významných dávkach. U králikov nitizinón indukuje dávkovo závislé zvýšenie malformácií (umbilikálna hernia a gastroschíza) pri dávkach 2,5-krát vyšších ako maximálna doporučená dávka pre človeka
(2 mg/kg/deň).
Štúdie pre a postnatálneho vývoja u myší ukázali štatisticky významné skrátené prežívanie a znížený rast mláďat po odstavení pri expozícii dávkam 125- a 25-krát vyšším, ako je maximálna odporučená dávka pre človeka. Tento efekt na prežívanie mláďat sa začal prejavovať pri dávke od 5 mg/kg/deň
s tendenciou k negatívnemu efektu. U potkanov v dôsledku expozície cez materské mlieko zníženie
hmotnosti u mláďat a výskyt korneálne lézie.
V in vitro výskumoch sa nedokázal mutagénny účinok, ale slabá klastogénna aktivita. Nedokázala sa in vivo genotoxicita (analýza mikronuklea u myší a analýza syntézy DNA v myšacej pečeni mimo rozvrhu). Nerobila sa žiadna štúdia karcinogenity.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly
predželatinovaný škrob (kukuričný)
Obal kapsuly želatína
oxid titaničitý (E 171)
Potlač
čierny oxid železitý (E 172)
šelak propylénglykol
hydroxid amónny.
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
18 mesiacov.
Počas použiteľnosti lieku pacient môže po dobu 2 mesiacov uchovávať kapsuly pri teplote
neprevyšujúcej 25 °C, potom však liek musí byť zlikvidovaný.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C).
6.5 Druh obalu a obsah balenia
Polyetylénová fľaša s vysokou hustotou s poistným polyetylénovým uzáverom s nízkou hustotou, obsahuje 60 kapsúl.
Jedno balenie obsahuje 1 fľašu.
6.6 Špeciálne opatrenia na likvidáciu
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Swedish Orphan Biovitrum International AB SE-112 76 Stockholm
Švédsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/04/303/003
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21/02/2005
Dátum posledného predĺženia registrácie: 21/02/2010
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.1. NÁZOV LIEKUOrfadin 20 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá kapsula obsahuje 20 mg nitizinónu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMATvrdá kapsula.
Biele matné kapsuly (6 x 16 mm) s vytlačeným čiernym nápisom „NTBC 20mg“ na tele kapsuly.
Kapsuly obsahujú prášok bielej až šedobielej farby.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieLiečba dospelých a pediatrických (v každom veku) pacientov s potvrdenou diagnózou hereditárnej tyrozinémie typu 1 (HT-1) v kombinácii s obmedzením tyrozínu a fenylalanínu v diéte.
4.2 Dávkovanie a spôsob podávaniaLiečbu nitizinónom má začať a sledovať lekár skúsený v liečbe pacientov s HT-1.
DávkovanieLiečba všetkých genotypových foriem ochorenia má začať čo najskôr, aby sa zvýšilo celkové prežívanie
a predišlo komplikáciám ako napr. zlyhaniu pečene, nádoru pečene a ochoreniu obličiek.
V kombinácii s liečbou nitizinónom je potrebná diéta, ktorá neobsahuje fenylalanín a tyrozín a následne
monitorovanie hladín aminokyselín v plazme (pozri časti 4.4 a 4.8).
Odporúčaná iniciálna dávka v detskej a dospelej populácii je 1 mg/kg hmotnosti/deň rozdelená do dvoch dávok podaných perorálne. Dávkovanie nitizinónu má byť prispôsobené individuálnym potrebám každého pacienta.
Úprava dávkovaniaPočas pravidelného monitorovania je potrebné sledovať hladinu sukcinylacetónu v moči, hodnoty hepatálnych testov a hladinu alfa
-fetoproteínu (pozri časť 4.4). Ak je mesiac po začatí liečby nitizinónom v moči stále detegovateľný sukcinylacetón, dávka sa má zvýšiť na 1,5 mg/kg telesnej hmotnosti/deň, rozdelená do dvoch dávok. Na základe zhodnotenia všetkých biochemických parametrov bude možno potrebná dávka 2 mg/kg telesnej hmotnosti/deň. Táto dávka má byť maximálnou dávkou pre všetkých pacientov.
Ak je biochemická odpoveď uspokojivá, dávkovanie sa má upraviť len podľa zvýšenia telesnej
hmotnosti.
Počas začatia liečby alebo pri zhoršení stavu je nevyhnutné podrobnejšie sledovať všetky dostupné biochemické parametre (napr. plazmatické hladiny sukcinylacetónu, hladinu 5
-aminolevulinátu (ALA) v moči a aktivitu erytrocytárnej porfobilinogén (PBG)
-syntázy).
Osobitné populáciePre starších ľudí alebo pacientov s narušenou funkciou obličiek alebo pečene sa neudávajú žiadne špecifické odporúčania.
Pediatrická populáciaOdporúčania dávky v mg/kg telesnej hmotnosti sú rovnaké u detí a u dospelých.
Spôsob podávaniaKapsula sa môže tesne pred užitím otvoriť a jej obsah rozpustiť v malom množstve vody alebo tekutej výživy.
Orfadin je tiež dostupný ako 4 mg/ml perorálna suspenzia pre pediatrických pacientov, ktorí majú problémy s prehĺtaním kapsúl.
Ak sa liečba nitizinónom začína s jedlom, odporúča sa, aby sa vykonávala pravidelne, pozri časť 4.5.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Matky užívajúce nitizinón nesmú dojčiť (pozri časti 4.6 a 5.3).
4.4 Osobitné upozornenia a opatrenia pri používaníMonitorovanie hladín tyrozínu v plazmePred začatím liečby sa odporúča vyšetrenie očného pozadia. Ak sa u pacienta počas liečby vyskytnú zrakové poruchy, má byť bez meškania vyšetrený oftalmológom. Pacient má dodržiavať diétny režim a
majú sa merať plazmatické koncentrácie tyrozínu. Ak sa plazmatické hladiny tyrozínu zvýšia nad
500 mikromol/l, má sa znížiť prívod tyrozínu a fenylalanínu v diéte. Neodporúča sa znižovať plazmatickú koncentráciu tyrozínu redukciou dávok nitizinónu, alebo jeho vysadením, keďže metabolický defekt môže spôsobiť zhoršenie klinického stavu pacienta.
MonitorovaniepečeneFuncia pečene má byť pravidelne monitorovaná pomocou pečeňových testov a zobrazovacích metód. Odporúča sa sledovať aj koncentrácie alfa
-fetoproteínu v sére. Zvýšenie sérovej koncentrácie
alfa
-fetoproteínu môže byť signálom nedostatočnej liečby. U pacientov so zvyšujúcou sa hladinou
alfa
-fetoproteínu alebo výskytom uzlín v pečeni je dôležité sledovať možný výskyt malignity v pečeni.
Monitorovanie trombocytov a leukocytovOdporúča sa pravidelne sledovať hladiny trombocytov a leukocytov, keďže sa vyskytli prípady reverzibilnej trombocytopénie a leukopénie počas klinického hodnotenia.
Kontrolné návštevy sa majú vykonávať každých 6 mesiacov. Kratšie intervaly medzi návštevami sa odporúčajú v prípade nežiaducich účinkov.
4.5 Liekové a iné interakcieNerobili sa žiadne formálne interakčné štúdie s inými liekmi.
Nitizinón sa
in vitro metabolizuje prostredníctvom CYP 3A4 a preto bude možno potrebné prispôsobiť
dávkovanie, ak pacient spolu s nitizinónom užíva inhibítory, alebo induktory tohto enzýmu.
Na základe výskumov
in vitro sa neočakáva inhibícia metabolizmu sprostredkovaná CYP 1A2, 2C9,
2C19, 2D6, 2E1 alebo 3A4.
Neboli uskutočnené žiadne formálne štúdie interakcií tvrdých kapsúl Orfadinu s jedlom. Nitizinón bol však podávaný s jedlom pri získavaní údajov o účinnosti a bezpečnosti. Preto sa v prípade, ak liečba nitizinónom v tvrdých kapsulách Orfadinu prebieha od začiatku s jedlom, odporúča v tomto pravidelne pokračovať, pozri časť 4.2.
4.6 Fertilita, gravidita a laktáciaGraviditaNie sú k dispozícii dostatočné údaje o použití nitizinónu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko u ľudí. Orfadin sa nemá používať počas gravidity, pokiaľ klinický stav ženy nevyžaduje liečbu nitizinónom.
LaktáciaNie je známe, či je nitizinón vylučovaný do materského mlieka. Štúdie na zvieratách preukázali nepriaznivé postnatálne účinky nitizinónu po expozícii v materskom mlieku. Z tohto dôvodu matky, ktoré užívajú nitizinón nesmú dojčiť, keďže nemožno vylúčiť riziko pre dojčené dieťa (pozri časti 4.3 a
5.3).
FertilitaNie sú k dispozícii žiadne údaje o vplyve nitizinónu na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeOrfadin má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Nežiaduce reakcie týkajúce sa očí (pozri časť 4.8) môžu ovplyvniť zrak. Ak dôjde k ovplyvneniu zraku, pacient nesmie viesť vozidlá ani obsluhovať stroje, až kým tento účinok neustúpi.
4.8 Nežiaduce účinkySúhrnbezpečnostnéhoprofiluNa základe jeho mechanizmu pôsobenia, nitizinón zvyšuje hladiny tyrozínu u všetkých pacientov liečených nitizinónom. Nežiaduce reakcie týkajúce sa očí, ako je konjuktivitída, zákal rohovky, keratitída, fotofóbia a bolesť očí, súvisiace so zvýšenými hladinami tyrozínu sú preto bežné. Medzi ďalšie časté nežiaduce reakcie patria trombocytopénia, leukopénia a granulocytopénia. Menej často sa môže vyskytovať exfoliatívna dermatitída.
Tabuľkovýzoznam nežiaducich reakciíNežiaduce reakcie rozdelené nižšie podľa triedy orgánových systémov MedDRA a celkovej frekvencie sú založené na údajoch z klinického skúšania a používania po uvedení na trh. Frekvencie sa popisujú ako veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/10 00 až <1/100), zriedkavé
(≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (častosť sa nedá odhadnúť z
dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
O
rgánové systémy podľa
MedDRA
|
F
r
ekvencia
|
N
ežiaduca reakcia
|
Poruchy krvi a lymfatického
systému
|
Časté
|
Trombocytopénia,
leukopénia, granulocytopénia
|
Menej časté
|
Leukocytóza
|
Poruchy oka
|
Časté
|
Konjunktivitída, zákal
rohovky, keratitída, fotofóbia, bolesť oka
|
Menej časté
|
Blefaritída
|
Poruchy kože a podkožného
tkaniva
|
Menej časté
|
Exfoliatívna dermatitída,
erytematózna vyrážka, pruritus
|
Laboratórne a funkčné
vyšetrenia
|
Veľmi časté
|
Zvýšené hladiny tyrozínu
|
O
pis vybraných nežiaducich reakcií
Liečba nitizinónom vedie k zvýšeným hladinám tyrozínu. Pri zvýšených hladinách tyrozínu sa vyskytujú nežiaduce reakcie súvisiace s očami, ako sú napríklad zákaly rohovky a hyperkeratotické
lézie. Obmedzenie tyrozínu a fenylalanínu v potrave má limitovať toxicitu pri tomto type tyrozinémie
znižovaním hladín tyrozínu (pozri časť 4.4).
V klinických štúdiách bola granulocytopénia len menej často závažná (< 0,5x109/l) a nebola spojená s infekciami. Nežiaduce reakcie ovplyvňujúce triedu orgánových systémov MedDRA „Poruchy krvi
a lymfatického systému“ ustúpili počas pokračujúcej liečby nitizinónom.
Pediatrická populáciaBezpečnostný profil je založený hlavne na pediatrickej populácii, pretože liečba nitizinónom sa má
začať čo najskôr po stanovení diagnózy hereditárnej tyrozinémie typu 1 (HT-1). Na základe údajov
z klinickej štúdie a údajov po uvedení na trh neexistujú žiadne indikácie, že bezpečnostný profil je iný v rôznych podskupinách pediatrickej populácie alebo iný od bezpečnostného profilu u dospelých pacientov.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieNáhodné požitie nitizinónu jedincami s normálnou stravou s neobmedzeným prívodom tyrozínu a fenylalanínu spôsobí zvýšenie hladín tyrozínu. Zvýšená hladina tyrozínu sa spája s toxicitou pre oči, pokožku a nervový systém. Obmedzenie príjmu tyrozínu a fenylalanínu v strave má obmedziť toxicitu spájanú s týmto typom tyrozinémie. Informácie o špecifickej liečbe predávkovania nie sú k dispozícii.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Iné liečivá ovplyvňujúce tráviaci trakt a metabolizmus, Rôzne liečivá ovplyvňujúce tráviaci trakt a metabolizmus, ATC kód: A16A X04.
Mechanizmus
účinku
Biochemický defekt pri hereditárnej tyrozinémii typu 1 (HT-1) je deficiencia fumarylacetoacetáthydrolázy, ktorá je posledným enzýmom v katabolizme tyrozínu. Nitizinón je
kompetitívnym inhibítorom 4-hydroxyfenylpyruvátdioxygenázy, enzýmu, ktorý predchádza
fumarylacetoacetáthydroláze v katabolizme tyrozínu. Inhibíciou normálneho katabolizmu tyrozínu u pacientov s HT-1 zabraňuje nitizinón akumulácii toxických intermediárnych metabolitov maleylacetoacetátu a fumarylacetoacetátu. U pacientov s HT-1 sa tieto metabolity menia na toxické metabolity sukcinylacetón a sukcinylacetoacetát. Sukcinylacetón inhibuje syntézu porfyrínu a to vedie k akumulácii 5-aminolevulinátu.
FarmakodynamickéúčinkyLiečba nitizinónom vedie k normalizácii porfyrínového metabolizmu s normálnou aktivitou
erytrocytárnej porfobilinogén-syntázy a 5-aminolevulinátu v moči, zníženiu vylučovania sukcinylacetónu do moču, zvýšenej plazmatickej koncentrácii tyrozínu a zvýšenej exkrécii fenolových kyselín do moču. Dáta z dostupných klinických štúdií ukazujú, že u viac ako 90 % pacientov sa počas prvého týždňa liečby normalizovala hladina sukcinylacetónu v moči. V prípade, že je dávkovanie nitizinónu správne nastavené, nemá byť v moči alebo plazme detegovateľný sukcinylacetón.
KlinickáúčinnosťabezpečnosťPri porovnávaní dát s historickými záznamami sa zistilo, že pri liečbe nitizinónom spolu s diétnymi obmedzeniami je pravdepodobnosť prežitia vyššia pri všetkých HT-1 fenotypochnitizinónu. Vidíme to v nasledujúcej tabuľke:
Vek pri začatí liečby alebo
určení diagnózy
| Pravdepodobnosť prežívania
|
Liečba nitizinónom
| Diétne obmedzenia
|
5 rokov
| 10 rokov
| 5 rokov
| 10 rokov
|
< 2 mesiace
| 82
| --
| 28
| --
|
> 2 - 6 mesiacov
| 95
| 95
| 51
| 34
|
> 6 mesiacov
| 92
| 86
| 93
| 59
|
Zistilo sa, že liečba nitizinónom znižuje riziko rozvoja hepatocelulárneho karcinómu (2,3- až 3,7-krát) v
porovnaní s historickými dátami, keď liečba spočívala len v diétnych obmedzeniach. Taktiež sa potvrdilo, že skoré začatie liečby ešte viac znižuje riziko rozvoja hepatocelulárneho karcinómu (13,5-krát, keď je liečba začatá pred 12. mesiacom života).
5.2 Farmakokinetické vlastnostiNevykonali sa formálne štúdie zaoberajúce sa absorpciou, distribúciou, metabolizmom a elimináciou nitizinónu. Po podaní jednej dávky nitizinónu (1 mg/kg telesnej hmotnosti) desiatim zdravým mužským dobrovoľníkom bol plazmatický polčas nitizinónu 54 hodín (rozmedzie od 39 až 86 hodín). V skupine
207 pacientov s HT-1 sa vykonala populačná farmakokinetická analýza. Klírens a plazmatický polčas sa určili na 0,0956 l/kg telesnej hmotnosti/deň, resp. 52,1 hodín.
In vitro štúdie s použitím ľudských pečeňových mikrozómov a P450 enzýmov získaných z cDNA
ukázali znížený CYP 3A4-sprostredkovaný metabolizmus.
5.3 Predklinické údaje o bezpečnostiNitizinón vykazuje embryo-fetálnu toxicitu na myšiach a králikoch pri klinicky významných dávkach. U králikov nitizinón indukuje dávkovo závislé zvýšenie malformácií (umbilikálna hernia a gastroschíza) pri dávkach 2,5-krát vyšších ako maximálna doporučená dávka pre človeka
(2 mg/kg/deň).
Štúdie pre a postnatálneho vývoja u myší ukázali štatisticky významné skrátené prežívanie a znížený rast mláďat po odstavení pri expozícii dávkam 125- a 25-krát vyšším, ako je maximálna odporučená dávka pre človeka. Tento efekt na prežívanie mláďat sa začal prejavovať pri dávke od 5 mg/kg/deň
s tendenciou k negatívnemu efektu. U potkanov v dôsledku expozície cez materské mlieko zníženie
hmotnosti u mláďat a výskyt korneálne lézie.
V in vitro výskumoch sa nedokázal mutagénny účinok, ale slabá klastogénna aktivita. Nedokázala sa in vivo genotoxicita (analýza mikronuklea u myší a analýza syntézy DNA v myšacej pečeni mimo rozvrhu). Nerobila sa žiadna štúdia karcinogenity.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly
predželatinovaný škrob (kukuričný)
Obal kapsuly želatína
oxid titaničitý (E 171)
Potlač
čierny oxid železitý (E 172)
šelak propylénglykol
hydroxid amónny.
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
18 mesiacov.
Počas použiteľnosti lieku pacient môže po dobu 2 mesiacov uchovávať kapsuly pri teplote
neprevyšujúcej 25 °C, potom však liek musí byť zlikvidovaný.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C).
6.5 Druh obalu a obsah balenia
Polyetylénová fľaša s vysokou hustotou s poistným polyetylénovým uzáverom s nízkou hustotou, obsahuje 60 kapsúl.
Jedno balenie obsahuje 1 fľašu.
6.6 Špeciálne opatrenia na likvidáciu'
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Swedish Orphan Biovitrum International AB SE-112 76 Stockholm
Švédsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/04/303/004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21/02/2005
Dátum posledného predĺženia registrácie: 21/02/2010
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.1. NÁZOV LIEKUOrfadin 4 mg/ml perorálna suspenzia
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE1 ml obsahuje 4 mg nitizinónu.
Pomocné látky soznámymúčinkom:Každý ml obsahuje:
sodík 0,7 mg (0,03 mmol)
glycerol 500 mg benzoát sodný 1 mg
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMAPerorálna suspenzia.
Biela, mierne viskózna nepriesvitná suspenzia.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieLiečba dospelých a pediatrických (v každom veku) pacientov s potvrdenou diagnózou hereditárnej tyrozinémie typu 1 (HT-1) v kombinácii s obmedzením tyrozínu a fenylalanínu v diéte.
4.2 Dávkovanie a spôsob podávaniaLiečbu nitizinónom má začať a sledovať lekár skúsený v liečbe pacientov s HT-1.
DávkovanieLiečba všetkých genotypových foriem ochorenia má začať čo najskôr, aby sa zvýšilo celkové prežívanie
a predišlo komplikáciám ako napr. zlyhaniu pečene, nádoru pečene a ochoreniu obličiek.
V kombinácii s liečbou nitizinónom je potrebná diéta, ktorá neobsahuje fenylalanín a tyrozín a následne
monitorovanie hladín aminokyselín v plazme (pozri časti 4.4 a 4.8).
Odporúčaná iniciálna dávka v detskej a dospelej populácii je 1 mg/kg hmotnosti/deň rozdelená do dvoch dávok podaných perorálne. Dávkovanie nitizinónu má byť prispôsobené individuálnym potrebám každého pacienta.
Úprava dávkovaniaPočas pravidelného monitorovania je potrebné sledovať hladinu sukcinylacetónu v moči, hodnoty
hepatálnych testov a hladinu alfa
-fetoproteínu (pozri časť 4.4). Ak je mesiac po začatí liečby nitizinónom v moči stále detegovateľný sukcinylacetón, dávka sa má zvýšiť na 1,5 mg/kg telesnej hmotnosti/deň, rozdelená do dvoch dávok. Na základe zhodnotenia všetkých biochemických parametrov bude možno potrebná dávka 2 mg/kg telesnej hmotnosti/deň. Táto dávka má byť maximálnou dávkou pre všetkých pacientov.
Ak je biochemická odpoveď uspokojivá, dávkovanie sa má upraviť len podľa zvýšenia telesnej
hmotnosti.
Počas začatia liečby alebo pri zhoršení stavu je nevyhnutné podrobnejšie sledovať všetky dostupné biochemické parametre (napr. plazmatické hladiny sukcinylacetónu, hladinu 5
-aminolevulinátu (ALA) v moči a aktivitu erytrocytárnej porfobilinogén (PBG)
-syntázy).
Osobitné populáciePre starších ľudí alebo pacientov s narušenou funkciou obličiek alebo pečene sa neudávajú žiadne
špecifické odporúčania.
Pediatrická populáciaOdporúčania dávky v mg/kg telesnej hmotnosti sú rovnaké u detí a u dospelých.
Spôsob podávaniaSuspenzia sa podáva cez ústa pacienta pomocou perorálnej striekačky bez zriedenia. Striekačky
s objemom 1 ml, 3 ml a 5 ml, ktoré sú súčasťou balenia, sú určené na odmeranie dávky v ml v súlade s predpísaným dávkovaním. Perorálne striekačky sú odstupňované po 0,01 ml, 0,1 ml a 0,2 ml.
V tabuľke nižšie je uvedená konverzia dávok (mg/ml) pre tri veľkosti perorálnych striekačiek.
3-ml
perorálna striekačka (s dielikmi po 0,1 ml)
| Dávka
Orfadinu
| mg
| ml
| 4,5
| 1,1
| 5,0
| 1,3
| 5,5
| 1,4
| 6,0
| 1,5
| 6,5
| 1,6
| 7,0
| 1,8
| 7,5
| 1,9
| 8,0
| 2,0
| 8,5
| 2,1
| 9,0
| 2,3
| 9,5
| 2,4
| 10,0
| 2,5
| 10,5
| 2,6
| 11,0
| 2,8
| 11,5
| 2,9
| 12,0
| 3,0
|
|
|
5-ml
perorálna striekačka (s dielikmi po 0,2 ml)
| Dávka
Orfadinu
| mg
| ml
| 13,0
| 3,2
| 14,0
| 3,6
| 15,0
| 3,8
| 16,0
| 4,0
| 17,0
| 4,2
| 18,0
| 4,6
| 19,0
| 4,8
| 20,0
| 5,0
|
|
|
Tabuľky konverzie dávok pre príslušné tri veľkosti perorálnych striekačiek:
1-ml
perorálna striekačka (s dielikmi po
0,01 ml)
| Dávka
Orfadinu
|
mg
| ml
|
1,00
| 0,25
|
1,25
| 0,31
|
1,50
| 0,38
|
1,75
| 0,44
|
2,00
| 0,50
|
2,25
| 0,56
|
2,50
| 0,63
|
2,75
| 0,69
|
3,00
| 0,75
|
3,25
| 0,81
|
3,50
| 0,88
|
3,75
| 0,94
|
4,00
| 1,00
|
Dôležité informácie o návode na použitie:Pred každým podaním je potrebné opätovné premiešanie intenzívnym pretrepávaním. Pred opätovným premiešaním môže liek perorálnej suspenzie s nitizinónom vyzerať ako pevná hmota s mierne
opalizujúcim supernatantom. Dávka sa má natiahnuť a podať okamžite po opätovnom premiešaní.
Je dôležité dôkladne dodržiavať pokyny na prípravu a podanie dávky uvedené v časti 6.6, aby sa zaručila presnosť dávkovania.
Odporúča sa, aby zdravotnícky pracovník poučil pacienta alebo opatrovateľa o tom, ako používať
perorálne striekačky na zaistenie podania správnej dávky, a tiež o tom, že predpis je uvedený v ml.
Orfadin je tiež dostupný v 2 mg, 5 mg, 10 mg a 20 mg kapsulách, ak sa to považuje za vhodnejšie pre pacienta.
Perorálnu suspenziu sa odporúča užívať s jedlom, pozri časť 4.5.
Opatrenia pred manipuláciou alebo podaním liekuK perorálnej striekačke sa nemá pripájať žiadna ihla, intravenózna hadička ani žiadne iné zariadenie na
parenterálne podávanie.
Orfadin je určený iba na perorálne používanie.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Matky užívajúce nitizinón nesmú dojčiť (pozri časti 4.6 a 5.3).
4.4 Osobitné upozornenia a opatrenia pri používaníMonitorovanie hladín tyrozínu v plazmePred začatím liečby sa odporúča vyšetrenie očného pozadia. Ak sa u pacienta počas liečby vyskytnú
zrakové poruchy, má byť bez meškania vyšetrený oftalmológom. Pacient má dodržiavať diétny režim a
majú sa merať plazmatické koncentrácie tyrozínu. Ak sa plazmatické hladiny tyrozínu zvýšia nad
500 mikromol/l, má sa znížiť prívod tyrozínu a fenylalanínu v diéte. Neodporúča sa znižovať plazmatickú koncentráciu tyrozínu redukciou dávok nitizinónu, alebo jeho vysadením, keďže
metabolický defekt môže spôsobiť zhoršenie klinického stavu pacienta.
MonitorovaniepečeneFuncia pečene má byť pravidelne monitorovaná pomocou pečeňových testov a zobrazovacích metód. Odporúča sa sledovať aj koncentrácie alfa
-fetoproteínu v sére. Zvýšenie sérovej koncentrácie
alfa
-fetoproteínu môže byť signálom nedostatočnej liečby. U pacientov so zvyšujúcou sa hladinou
alfa
-fetoproteínu alebo výskytom uzlín v pečeni je dôležité sledovať možný výskyt malignity v pečeni.
Monitorovanie trombocytov a leukocytovOdporúča sa pravidelne sledovať hladiny trombocytov a leukocytov, keďže sa vyskytli prípady reverzibilnej trombocytopénie a leukopénie počas klinického hodnotenia.
Kontrolné návštevy sa majú vykonávať každých 6 mesiacov. Kratšie intervaly medzi návštevami sa odporúčajú v prípade nežiaducich účinkov.
Pomocnélátkysoznámymúčinkom:GlycerolKaždý ml obsahuje 500 mg. Dávka 20 ml perorálnej suspenzie (10 g glycerolu) alebo viac môže
spôsobiť bolesť hlavy, žalúdočné ťažkosti a hnačku.
SodíkKaždý ml obsahuje 0,7 mg (0,03 mmol).
Benzoát sodnýKaždý ml obsahuje 1 mg. Zvýšená hladina bilirubínu po jeho dislokácii z albumínu, ktorú spôsobuje kyselina benzoová a jej soli, môže zhoršovať žltačku u nedonosených a riadne donosených
novorodencov so žltačkou a spôsobiť jadrový ikterus (usadeniny nekonjugovaného bilirubínu
v mozgovom tkanive). Preto je veľmi dôležité dôkladné sledovanie plazmatických hladín bilirubínu
u novorodeneckých pacientov. Pred začatím liečby sa má merať hladina bilirubínu: v prípade značne zvýšených plazmatických hladín bilirubínu, najmä u nedonosených pacientov s rizikovými faktormi ako acidóza a nízka hladina albumínu, sa má zvážiť liečba náležite odváženým kusom kapsuly Orfadinu namiesto perorálnej suspenzie, až kým sa neznormalizujú plazmatické hladiny nekonjugovaného bilirubínu.
4.5 Liekové a iné interakcieNerobili sa žiadne formálne interakčné štúdie s inými liekmi.
Nitizinón sa
in vitro metabolizuje prostredníctvom CYP 3A4 a preto bude možno potrebné prispôsobiť
dávkovanie, ak pacient spolu s nitizinónom užíva inhibítory, alebo induktory tohto enzýmu.
Na základe výskumov
in vitro sa neočakáva inhibícia metabolizmu sprostredkovaná CYP 1A2, 2C9,
2C19, 2D6, 2E1 alebo 3A4.
Jedlo nemá vplyv na biologickú dostupnosť perorálnej suspenzie s nitizinónom, no užívanie spolu
s jedlom znižuje mieru absorpcie a následne vedie k menšiemu kolísaniu sérových koncentrácií v rámci
intervalu dávkovania. Preto sa odporúča užívať perorálnu suspenziu s jedlom, pozri časť 4.2.
4.6 Fertilita, gravidita a laktáciaGraviditaNie sú k dispozícii dostatočné údaje o použití nitizinónu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko u ľudí. Orfadin sa nemá používať počas gravidity, pokiaľ klinický stav ženy nevyžaduje liečbu nitizinónom.
LaktáciaNie je známe, či je nitizinón vylučovaný do materského mlieka. Štúdie na zvieratách preukázali nepriaznivé postnatálne účinky nitizinónu po expozícii v materskom mlieku. Z tohto dôvodu matky, ktoré užívajú nitizinón nesmú dojčiť, keďže nemožno vylúčiť riziko pre dojčené dieťa (pozri časti 4.3 a
5.3).
FertilitaNie sú k dispozícii žiadne údaje o vplyve nitizinónu na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeOrfadin má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Nežiaduce reakcie týkajúce sa očí (pozri časť 4.8) môžu ovplyvniť zrak. Ak dôjde k ovplyvneniu zraku, pacient nesmie viesť vozidlá ani obsluhovať stroje, až kým tento účinok neustúpi.
4.8 Nežiaduce účinkySúhrnbezpečnostnéhoprofiluNa základe jeho mechanizmu pôsobenia, nitizinón zvyšuje hladiny tyrozínu u všetkých pacientov liečených nitizinónom. Nežiaduce reakcie týkajúce sa očí, ako je konjuktivitída, zákal rohovky, keratitída, fotofóbia a bolesť očí, súvisiace so zvýšenými hladinami tyrozínu sú preto bežné. Medzi ďalšie časté nežiaduce reakcie patria trombocytopénia, leukopénia a granulocytopénia. Menej často sa môže vyskytovať exfoliatívna dermatitída.
TabuľkovýzoznamnežiaducichreakciíNežiaduce reakcie rozdelené nižšie podľa triedy orgánových systémov MedDRA a celkovej frekvencie sú založené na údajoch z klinického skúšania a používania po uvedení na trh. Frekvencie sa popisujú ako veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/10 00 až <1/100), zriedkavé
(≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (častosť sa nedá odhadnúť z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí
klesajúcej závažnosti.
O
rgánové systémy podľa
MedDRA
|
F
r
ekvencia
|
N
ežiaduca reakcia
|
Poruchy krvi a lymfatického
systému
|
Časté
|
Trombocytopénia,
leukopénia, granulocytopénia
|
Menej časté
|
Leukocytóza
|
Poruchy oka
|
Časté
|
Konjunktivitída, zákal
rohovky, keratitída,
fotofóbia, bolesť oka
|
Menej časté
|
Blefaritída
|
Poruchy kože a podkožného
tkaniva
|
Menej časté
|
Exfoliatívna dermatitída,
erytematózna vyrážka, pruritus
|
Laboratórne a funkčné
vyšetrenia
|
Veľmi časté
|
Zvýšené hladiny tyrozínu
|
O
pis vybraných nežiaducich reakcií
Liečba nitizinónom vedie k zvýšeným hladinám tyrozínu. Pri zvýšených hladinách tyrozínu sa vyskytujú nežiaduce reakcie súvisiace s očami, ako sú napríklad zákaly rohovky a hyperkeratotické
lézie. Obmedzenie tyrozínu a fenylalanínu v potrave má limitovať toxicitu pri tomto type tyrozinémie
znižovaním hladín tyrozínu (pozri časť 4.4).
V klinických štúdiách bola granulocytopénia len menej často závažná (< 0,5x109/l) a nebola spojená s infekciami. Nežiaduce reakcie ovplyvňujúce triedu orgánových systémov MedDRA „Poruchy krvi
a lymfatického systému“ ustúpili počas pokračujúcej liečby nitizinónom.
Pediatrická populáciaBezpečnostný profil je založený hlavne na pediatrickej populácii, pretože liečba nitizinónom sa má
začať čo najskôr po stanovení diagnózy hereditárnej tyrozinémie typu 1 (HT-1). Na základe údajov
z klinickej štúdie a údajov po uvedení na trh neexistujú žiadne indikácie, že bezpečnostný profil je iný v rôznych podskupinách pediatrickej populácie alebo iný od bezpečnostného profilu u dospelých pacientov.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieNáhodné požitie nitizinónu jedincami s normálnou stravou s neobmedzeným prívodom tyrozínu a fenylalanínu spôsobí zvýšenie hladín tyrozínu. Zvýšená hladina tyrozínu sa spája s toxicitou pre oči, pokožku a nervový systém. Obmedzenie príjmu tyrozínu a fenylalanínu v strave má obmedziť toxicitu spájanú s týmto typom tyrozinémie. Informácie o špecifickej liečbe predávkovania nie sú k dispozícii.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Iné liečivá ovplyvňujúce tráviaci trakt a metabolizmus, Rôzne liečivá ovplyvňujúce tráviaci trakt a metabolizmus, ATC kód: A16A X04.
Mechanizmus
účinku
Biochemický defekt pri hereditárnej tyrozinémii typu 1 (HT-1) je deficiencia fumarylacetoacetáthydrolázy, ktorá je posledným enzýmom v katabolizme tyrozínu. Nitizinón je
kompetitívnym inhibítorom 4-hydroxyfenylpyruvátdioxygenázy, enzýmu, ktorý predchádza
fumarylacetoacetáthydroláze v katabolizme tyrozínu. Inhibíciou normálneho katabolizmu tyrozínu u pacientov s HT-1 zabraňuje nitizinón akumulácii toxických intermediárnych metabolitov maleylacetoacetátu a fumarylacetoacetátu. U pacientov s HT-1 sa tieto metabolity menia na toxické metabolity sukcinylacetón a sukcinylacetoacetát. Sukcinylacetón inhibuje syntézu porfyrínu a to vedie k akumulácii 5-aminolevulinátu.
FarmakodynamickéúčinkyLiečba nitizinónom vedie k normalizácii porfyrínového metabolizmu s normálnou aktivitou erytrocytárnej porfobilinogén-syntázy a 5-aminolevulinátu v moči, zníženiu vylučovania
sukcinylacetónu do moču, zvýšenej plazmatickej koncentrácii tyrozínu a zvýšenej exkrécii fenolových
kyselín do moču. Dáta z dostupných klinických štúdií ukazujú, že u viac ako 90 % pacientov sa počas prvého týždňa liečby normalizovala hladina sukcinylacetónu v moči. V prípade, že je dávkovanie nitizinónu správne nastavené, nemá byť v moči alebo plazme detegovateľný sukcinylacetón.
KlinickáúčinnosťabezpečnosťPri porovnávaní dát s historickými záznamami sa zistilo, že pri liečbe nitizinónom spolu s diétnymi obmedzeniami je pravdepodobnosť prežitia vyššia pri všetkých HT-1 fenotypochnitizinónu. Vidíme to v nasledujúcej tabuľke:
Vek pri začatí liečby alebo
určení diagnózy
| Pravdepodobnosť prežívania
|
Liečba nitizinónom
| Diétne obmedzenia
|
5 rokov
| 10 rokov
| 5 rokov
| 10 rokov
|
< 2 mesiace
| 82
| --
| 28
| --
|
> 2 - 6 mesiacov
| 95
| 95
| 51
| 34
|
> 6 mesiacov
| 92
| 86
| 93
| 59
|
Zistilo sa, že liečba nitizinónom znižuje riziko rozvoja hepatocelulárneho karcinómu (2,3- až 3,7-krát) v
porovnaní s historickými dátami, keď liečba spočívala len v diétnych obmedzeniach. Taktiež sa potvrdilo, že skoré začatie liečby ešte viac znižuje riziko rozvoja hepatocelulárneho karcinómu (13,5-krát, keď je liečba začatá pred 12. mesiacom života).
5.2 Farmakokinetické vlastnostiNevykonali sa formálne štúdie zaoberajúce sa absorpciou, distribúciou, metabolizmom a elimináciou nitizinónu. Po podaní jednej dávky nitizinónu (1 mg/kg telesnej hmotnosti) desiatim zdravým mužským dobrovoľníkom bol plazmatický polčas nitizinónu 54 hodín (rozmedzie od 39 až 86 hodín). V skupine
207 pacientov s HT-1 sa vykonala populačná farmakokinetická analýza. Klírens a plazmatický polčas sa určili na 0,0956 l/kg telesnej hmotnosti/deň, resp. 52,1 hodín.
In vitro štúdie s použitím ľudských pečeňových mikrozómov a P450 enzýmov získaných z cDNA
ukázali znížený CYP 3A4-sprostredkovaný metabolizmus.
5.3 Predklinické údaje o bezpečnostiNitizinón vykazuje embryo-fetálnu toxicitu na myšiach a králikoch pri klinicky významných dávkach. U králikov nitizinón indukuje dávkovo závislé zvýšenie malformácií (umbilikálna hernia a gastroschíza) pri dávkach 2,5-krát vyšších ako maximálna doporučená dávka pre človeka
(2 mg/kg/deň).
Štúdie pre a postnatálneho vývoja u myší ukázali štatisticky významné skrátené prežívanie a znížený rast mláďat po odstavení pri expozícii dávkam 125- a 25-krát vyšším, ako je maximálna odporučená dávka pre človeka. Tento efekt na prežívanie mláďat sa začal prejavovať pri dávke od 5 mg/kg/deň
s tendenciou k negatívnemu efektu. U potkanov v dôsledku expozície cez materské mlieko zníženie
hmotnosti u mláďat a výskyt korneálne lézie.
V in vitro výskumoch sa nedokázal mutagénny účinok, ale slabá klastogénna aktivita. Nedokázala sa in vivo genotoxicita (analýza mikronuklea u myší a analýza syntézy DNA v myšacej pečeni mimo rozvrhu). Nerobila sa žiadna štúdia karcinogenity.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
hydroxypropylmetylcelulóza glycerol
polysorbát 80
benzoát sodný (E211) monohydrát kyseliny citrónovej citrát sodný
jahodová príchuť (umelá)
čistená voda
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
Po prvom otvorení sa z hľadiska použiteľnosti zachováva stabilita počas obdobia 2 mesiacov pri teplote neprevyšujúcej 25 °C, po tomto období sa liek musí zlikvidovať.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Uchovávajte vo zvislej polohe.
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Hnedá sklenená fľaša s objemom 100 ml (typu III) s bielym detským bezpečnostným uzáverom so závitom z HDPE, zabraňujúcim neoprávnenej manipulácii. 1 fľaša obsahuje 90 ml perorálnej suspenzie.
1 balenie obsahuje 1 fľašu, 1 adaptér na fľašu z LDPE a 3 polypropylénové (PP) perorálne striekačky
(1 ml, 3 ml a 5 ml).
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pred každým použitím je potrebné opätovné premiešanie intenzívnym pretrepávaním. Pred opätovným premiešaním môže liek vyzerať ako pevná hmota s mierne opalizujúcim supernatantom. Dávka sa má natiahnuť a podať okamžite po opätovnom premiešaní. Je dôležité dôkladne dodržiavať pokyny na prípravu a podanie dávky uvedené nižšie, aby sa zaručila presnosť dávkovania.
T
ri perorálne striekačky (1 ml, 3 ml a 5 ml) sa dodávajú na presné odmeranie predpísanej dávky. Odporúča sa, aby zdravotnícky pracovník poučil pacienta alebo opatrovateľa o tom, ako používať perorálne striekačky na zaistenie podania správnej dávky.
A
k
o pripraviťnovúfľašuliekunaprvépoužitie:Pred užitím prvej dávky je potrebné fľašu intenzívne pretrepať, pretože pri dlhodobomskladovaní čiastočky vytvoria naspodku fľaše pevnú hmotu.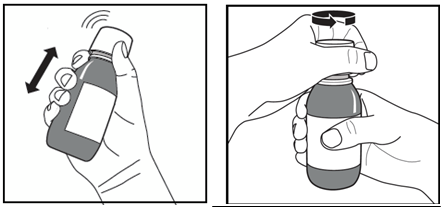
Obrázok A. Obrázok B. Obrázok C.
1. Treba vybrať fľašu z chladničky a na štítku na fľaši uviesť dátum, kedy bola fľaša vybratá
z chladničky.
2. Fľašu treba intenzívne pretrepávať
minimálne 20 sekúnd, až kým sa pevná hmota v dolnej
časti fľaše úplne nerozpustí (obrázok A).
3. Detský bezpečnostný uzáver so závitom treba otvoriť tak, že ho silne zatlačíte nadol a otočíte proti smeru hodinových ručičiek (obrázok B).
4. Otvorenú fľašu treba položiť vo zvislej polohe na stôl a zatlačiť plastový adaptér pevne do hrdla
fľaše tak ďaleko, ako sa dá (obrázok C). Fľašu treba uzatvoriť detským bezpečnostným
uzáverom so závitom.
Ďalšie pokyny o dávkovaní si prečítajte v nasledujúcich pokynoch: „Ako pripraviť dávku lieku“.
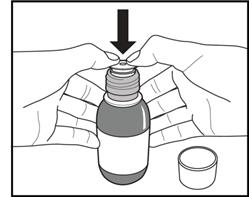
Ako pripraviťdávkulieku: Obrázok D. Obrázok E. Obrázok F.
1. Fľašu treba intenzívne pretrepávať
minimálne 5 sekúnd (obrázok D).
2. Potom treba okamžite otvoriť fľašu otvorením detského bezpečnostného uzáveru so závitom.
3. Piest treba zatlačiť do vnútra perorálnej striekačky úplne nadol.
4. Fľašu treba držať vo zvislej polohe a perorálnu striekačku zasunúť pevne do otvoru adaptéra na vrchnej strane fľaše (obrázok E).
5. Fľašu treba opatrne otočiť hore dnom so zasunutou perorálnou striekačkou (obrázok F).
6. Na natiahnutie predpísanej dávky (ml) treba potiahnuť piest
pomaly nadol, až kým horný okraj čierneho krúžka nebude presne zarovnaný s čiarou označujúcou dávku (obrázok F). Ak sú vo vnútri naplnenej perorálnej striekačky viditeľné akékoľvek vzduchové bubliny, piest treba zatlačiť naspäť, až kým sa nevytlačia vzduchové bubliny. Potom treba potiahnuť piest znovu
nadol, až kým horný okraj čierneho kruhu nebude presne zarovnaný s čiarou označujúcou
dávku.
7. Fľašu treba znovu otočiť do zvislej polohy a perorálnu striekačku treba vytiahnuť jemným otáčaním z fľaše.
8. Dávka sa má podať do úst okamžite (bez zriedenia), aby sa zabránilo zasušeniu v perorálnej
striekačke. Perorálna striekačka sa má vyprázdňovať
pomaly, aby mohol pacient prehĺtať. Pri rýchlom vytlačení lieku sa môže dusiť.
9. Okamžite po použití treba vrátiť späť detský bezpečnostný uzáver so závitom. Adaptér fľaše sa
nemá odstraňovať.
10. Fľašu možno uchovávať pri teplote neprevyšujúcej 25 °C alebo v chladničke.
ČisteniePerorálnu striekačku treba
okamžite umyť vodou. Valec a piest treba oddeliť a obidve časti opláchnuť vodou. Treba vytriasť zvyšnú vodu a rozobratú perorálnu striekačku nechať uschnúť,
kým sa znova neposkladá na ďalšie dávkovanie.
LikvidáciaNepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIISwedish Orphan Biovitrum International AB SE-112 76 Stockholm
Švédsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/04/303/005
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21/02/2005
Dátum posledného predĺženia registrácie: 21/02/2010
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.