
u (napr. 96 % betablokátory, 33 % blokátory kalciových kanálov diltiazem a verapamil a 4 % digoxín), nepozorovali žiadne klinicky významné nežiaduce reakcie (pozri časť 4.5).
V priebehu podštúdie s Holterovým monitorovaním v štúdii PLATO sa ventrikulárne pauzy trvajúce
≥ 3 sekundy vyskytli u väčšieho počtu pacientov užívajúcich tikagrelor ako pacientov užívajúcich klopidogrel v akútnej fáze ich AKS. Nárast počtu ventrikulárnych páuz pri tikagrelore, odhalených
Holterovým monitorovaním, bol u pacientov s chronickým srdcovým zlyhávaním (CHF) vyšší ako
u celkového počtu pacientov v štúdii počas akútnej fázy AKS, avšak nie po 1 mesiaci liečby tikagrelorom alebo v porovnaní s klopidogrelom. Z tejto nerovnováhy však u tejto skupiny pacientov nevyplývali žiadne nežiaduce klinické dôsledky (vrátane synkopy alebo zavedenia kardiostimulátora) (pozri časť 5.1).
D
y
spnoe
U pacientov liečených tikagrelorom bolo hlásené dyspnoe. Dyspnoe je zvyčajne miernej až stredne ťažkej intenzity a často ustúpi bez potreby ukončenia liečby. Absolútne riziko výskytu dyspnoe pri
užívaní tikagreloru môže byť vyššie u pacientov s astmou/chronickou obštrukčnou chorobou pľúc
(CHOCHP). Tikagrelor sa má používať opatrne u pacientov s astmou a/alebo CHOCHP v anamnéze. Mechanizmus nie je objasnený. Ak pacient hlási nové, dlhotrvajúce alebo zhoršené dyspnoe, dyspnoe sa má dôkladne vyšetriť a pri neznášanlivosti sa má liečba tikagrelorom ukončiť. Pre ďalšie informácie pozri časť 4.8.
Centrálnespánkovéapnoe
Po uvedení lieku na trh bolo u pacientov užívajúcich tikagrelor hlásené centrálne spánkové apnoe vrátane Cheynovho-Stokesovho dýchania. Pri podozrení na centrálne spánkové apnoe sa má zvážiť
ďalšie klinické zhodnotenie.
Zvýšeniekreatinínu
Počas liečby tikagrelorom sa môžu zvýšiť hladiny kreatinínu. Mechanizmus nie je objasnený. Funkcia obličiek sa má kontrolovať v súlade s bežnou lekárskou praxou. U pacientov s AKS sa tiež odporúča
skontrolovať funkciu obličiek jeden mesiac po začatí liečby tikagrelorom s venovaním osobitnej pozornosti pacientom vo veku ≥ 75 rokov, pacientom so stredne ťažkou/ťažkou poruchou funkcie
obličiek a pacientom súbežne liečeným blokátorom receptora angiotenzínu (ARB).
Zvýšeniekyselinymočovej
Počas liečby tikagrelorom sa môže objaviť hyperurikémia (pozri časť 4.8). U pacientov
s hyperurikémiou alebo dnovou artritídou v anamnéze sa odporúča opatrnosť. Ako preventívne opatrenie je potrebné zabrániť použitiu tikagreloru u pacientov s urátovou nefropatiou.
Trombotickátrombocytopenickápurpura(TTP)
Trombotická trombocytopenická purpura (TTP) bola po užívaní tikagreloru hlásená veľmi zriedkavo. Charakterizuje ju trombocytopénia a mikroangiopatická hemolytická anémia sprevádzaná buď
neurologickými príznakmi, renálnou dysfunkciou alebo horúčkou. TTP je stav, ktorý je potenciálne fatálny a vyžaduje si okamžitú liečbu vrátane plazmaferézy.
Interferenciasfunkčnýmitestamikrvnýchdoštičiekpoužívanýminadiagnostikuheparínomindukovanejtrombocytopénie(HIT)
V teste heparínom indukovanej aktivácie krvných doštičiek (heparin induced platelet activation, HIPA), ktorý sa používa na diagnostiku HIT, protidoštičkový faktor 4/protilátky proti heparínu v sére
pacienta aktivujú za prítomnosti heparínu krvné doštičky zdravých darcov.
U pacientov, ktorým bol podaný tikagrelor, sa zaznamenali falošne negatívne výsledky funkčného testu krvných doštičiek na HIT (vrátane HIPA testu, a nielen jeho). Súvisí to s inhibíciou P2Y12-
receptora na krvných doštičkách zdravých darcov v teste spôsobenou tikagrelorom v sére/plazme pacienta. Na interpretáciu funkčných HIT testov krvných doštičiek je potrebná informácia o súbežnej
liečbe tikagrelorom.
U pacientov, u ktorých sa vyvinula HIT, je potrebné zhodnotiť pomer prínosu a rizika pri pokračovaní v liečbe tikagrelorom, pričom je potrebné vziať do úvahy protrombotický stav HIT a tiež zvýšené
riziko krvácania pri súbežnej liečbe antikoagulanciami a tikagrelorom.
Iné
Na základe vzťahu zaznamenaného v štúdii PLATO medzi udržiavacou dávkou ASA a relatívnou účinnosťou tikagreloru v porovnaní s klopidogrelom sa súbežné podávanie tikagreloru a vysokej
udržiavacej dávky ASA (> 300 mg) neodporúča (pozri časť 5.1).
Predčasnéukončenieliečby
Predčasné ukončenie akejkoľvek protidoštičkovej liečby, vrátane tikagreloru, môže viesť k zvýšenému riziku kardiovaskulárnej (KV) smrti, IM alebo cievnej mozgovej príhody v dôsledku základného
ochorenia pacienta. Preto sa treba vyhnúť predčasnému ukončeniu liečby.
Pomocné
l
átky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t.j. v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Tikagrelor je predovšetkým substrátom CYP3A4 a miernym inhibítorom CYP3A4. Tikagrelor je tiež substrátom P-glykoproteínu (P-gp) a slabým inhibítorom P-gp a môže zvyšovať expozíciu substrátom P-gp.
Účinkyliekovainýchproduktovnatikagrelor
I nhi bít ory CYP3A4
• Silné inhibítory CYP3A4 – pri súbežnom podávaní ketokonazolu a tikagreloru sa Cmax tikagreloru zvýšila 2,4-násobne a AUC 7,3-násobne. Cmax aktívneho metabolitu sa znížila o 89 % a AUC o 56 %. Dá sa predpokladať, že účinky iných silných inhibítorov CYP3A4
(klaritromycín, nefazodón, ritonavir a atazanavir) sú podobné a preto je súbežné použitie silných inhibítorov CYP3A4 s tikagrelorom kontraindikované (pozri časť 4.3).
• Stredne silné inhibítory CYP3A4 – pri súbežnom podávaní diltiazemu a tikagreloru sa Cmax
tikagreloru zvýšila o 69 % a AUC 2,7-násobne a v prípade aktívneho metabolitu došlo
k zníženiu Cmax o 38 % a AUC ostala nezmenená. Tikagrelor nemal žiadny vplyv na hladiny diltiazemu v plazme. Podobný účinok možno predpokladať aj u iných stredne silných inhibítorov CYP3A4 (napr. amprenavir, aprepitant, erytromycín a flukonazol) a tiež ich možno podávať súbežne s tikagrelorom.
• Pri dennej konzumácii väčšieho množstva grapefruitovej šťavy (3 x 200 ml) sa pozorovalo 2-
násobné zvýšenie expozície tikagreloru. Neočakáva sa, že rozsah tejto zvýšenej expozície bude klinicky významný pre väčšinu pacientov.
Induktory CYP3A4
Pri súbežnom podávaní rifampicínu a tikagreloru sa Cmax tikagreloru znížila o 73 % a AUC o 86 %. Cmax aktívneho metabolitu ostala nezmenená a AUC sa znížila o 46 %. Dá sa predpokladať, že aj
ďalšie induktory CYP3A4 (napr. fenytoín, karbamazepín a fenobarbital) znižujú expozíciu tikagreloru.
Súbežné podávanie tikagreloru so silnými induktormi CYP3A4 môže znižovať expozíciu a účinnosť
tikagreloru, preto sa má zabrániť ich súbežnému použitiu s tikagrelorom.
Cyk l osporí n (inhibítor P-gp a CYP3A4)
Pri súbežnom podávaní cyklosporínu (600 mg) a tikagreloru sa Cmax tikagreloru zvýšila 2,3-násobne
a AUC 2,8-násobne. V prítomnosti cyklosporínu sa AUC aktívneho metabolitu zvýšila o 32 % a Cmax
sa znížila o 15 %.
K dispozícii nie sú žiadne údaje týkajúce sa súbežného podávania tikagreloru a ďalších liečiv, ktoré sú tiež silnými inhibítormi P-gp a stredne silnými inhibítormi CYP3A4 (napr. verapamil, chinidín), ktoré takisto môžu zvyšovať expozíciu tikagreloru. Ak sa takejto kombinácii nie je možné vyhnúť, ich súbežné použitie si vyžaduje opatrnosť.
I né
Klinické štúdie farmakologických interakcií preukázali, že súbežné podávanie tikagreloru
s heparínom, enoxaparínom a ASA alebo dezmopresínom v porovnaní s podávaním samotného tikagreloru nemalo žiadny vplyv na farmakokinetiku tikagreloru alebo jeho aktívneho metabolitu, alebo na agregáciu krvných doštičiek indukovanú ADP. Ak je to klinicky indikované, lieky ovplyvňujúce hemostázu sa majú v kombinácii s tikagrelorom používať s opatrnosťou.
Oneskorená a znížená expozícia perorálnym inhibítorom P2Y12, vrátane tikagreloru a jeho aktívnemu metabolitu, sa pozorovala u pacientov s AKS liečených morfínom (35 % zníženie expozície tikagreloru). Táto interakcia môže súvisieť so zníženou gastrointestinálnou motilitou a vzťahovať sa aj na iné opioidy. Klinický význam nie je známy, ale údaje naznačujú možnosť zníženej účinnosti tikagreloru u pacientov, ktorým sa súbežne podáva tikagrelor a morfín. U pacientov s AKS, u ktorých
nie je možné prerušiť podávanie morfínu a rýchla inhibícia P2Y12 sa považuje za nevyhnutnú, sa má zvážiť použitie parenterálneho inhibítora P2Y12.
Účinkytikagrelorunainélieky
Lie či vá met abol izov ané prost redníct vom CYP3A4
• Simvastatín – pri súbežnom podávaní tikagreloru a simvastatínu sa Cmax simvastatínu zvýšila o 81 % a AUC o 56 %, Cmax kyseliny simvastatínovej sa zvýšila o 64 % a AUC o 52 %,
v niektorých jednotlivých prípadoch boli zvýšenia 2- až 3-násobné. Súbežné podávanie
tikagreloru so simvastatínom v dávkach vyšších ako 40 mg denne môže spôsobiť nežiaduce reakcie simvastatínu a potenciálny prínos tejto kombinácie je potrebné zvážiť. Simvastatín
nemal žiadny vplyv na hladiny tikagreloru v plazme. Tikagrelor môže mať podobný účinok na
lovastatín. Súbežné použitie tikagreloru so simvastatínom alebo lovastatínom v dávkach vyšších
ako 40 mg sa neodporúča.
• Atorvastatín – pri súbežnom podávaní atorvastatínu a tikagreloru sa Cmax kyseliny atorvastatínovej zvýšila o 23 % a AUC o 36 %. Podobné zvýšenia AUC a Cmax sa pozorovali u všetkých metabolitov kyseliny atorvastatínovej. Tieto zvýšenia sa nepovažujú za klinicky významné.
• Podobný účinok na iné statíny metabolizované prostredníctvom CYP3A4 nemožno vylúčiť.
U pacientov dostávajúcich tikagrelor v štúdii PLATO, ktorí užívali rôzne statíny, nevznikli
v súvislosti s bezpečnosťou statínov žiadne obavy u 93 % pacientov v kohorte štúdie PLATO
užívajúcej tieto lieky.
Tikagrelor je miernym inhibítorom CYP3A4. Súbežné podávanie tikagreloru a substrátov CYP3A4 s úzkym terapeutickým indexom (napr. cisaprid alebo námeľové alkaloidy) sa neodporúča, keďže tikagrelor môže zvyšovať expozíciu týchto liekov.
Substráty P-gp (vr átane di goxí nu, cy kl osporí nu)
Pri súbežnom podávaní tikagreloru sa Cmax digoxínu zvýšila o 75 % a AUC o 28 %. Priemerné hladiny digoxínu pred podaním ďalšej dávky sa pri súbežnom podávaní s tikagrelorom zvýšili približne
o 30 %, v niektorých jednotlivých prípadoch maximálne až na 2-násobok. V prítomnosti digoxínu nebola ovplyvnená Cmax a AUC tikagreloru a jeho aktívneho metabolitu. Pri podávaní P-gp- dependentných liečiv s úzkym terapeutickým indexom, ako je digoxín, súbežne s tikagrelorom sa preto odporúča náležité klinické a/alebo laboratórne monitorovanie.
Nebol pozorovaný žiadny vplyv tikagreloru na hladinu cyklosporínu v krvi. Vplyv tikagreloru na ďalšie substráty P-gp sa neskúmal.
Lie či vá met abol izov ané CYP2C9
Súbežné podávanie tikagreloru a tolbutamidu neviedlo k zmenám plazmatických hladín žiadneho
z liečiv, čo naznačuje, že tikagrelor nie je inhibítorom CYP2C9 a nie je pravdepodobné, že by spôsoboval zmeny v metabolizme sprostredkovanom CYP2C9 u liečiv, akými sú warfarín
a tolbutamid.
Rosuvast at í n
Tikagrelor môže ovplyvniť vylučovanie rosuvastatínu obličkami, a tým zvýšiť riziko kumulácie rosuvastatínu. Aj keď presný mechanizmus nie je známy, v niektorých prípadoch súbežné podávanie tikagreloru a rosuvastatínu viedlo k zníženej funkcii obličiek, zvýšeniu hladiny kreatínfosfokinázy
a rabdomyolýze.
Peror ál ne kont raceptí va
Pri súbežnom podávaní tikagreloru a levonorgestrelu a etinylestradiolu sa expozícia etinylestradiolu zvýšila približne o 20 %, ale k zmenám vo farmakokinetike levonorgestrelu nedošlo. Pri súbežnom
podávaní levonorgestrelu a etinylestradiolu s tikagrelorom sa nepredpokladá žiadny klinicky
významný vplyv na účinnosť perorálnych kontraceptív.
Lie či vá, kt oré vyv ol ávaj ú brady kardiu
Pri súbežnom podávaní tikagreloru s liekmi, o ktorých je známe, že vyvolávajú bradykardiu, je potrebná opatrnosť vzhľadom na pozorované prípady zväčša asymptomatickej ventrikulárnej pauzy a
bradykardie (pozri časť 4.4). V štúdii PLATO sa však po súbežnom podaní s jedným alebo viacerými
liekmi, o ktorých je známe, že vyvolávajú bradykardiu (napr. 96 % betablokátory, 33 % blokátory kalciových kanálov diltiazem a verapamil a 4 % digoxín) nepozorovali žiadne klinicky významné nežiaduce reakcie.
Ďal šia súbež ná l ieč ba
V klinických štúdiách sa tikagrelor bežne podával spolu s ASA, inhibítormi protónovej pumpy, statínmi, betablokátormi, inhibítormi enzýmu konvertujúceho angiotenzín (ACE) a s blokátormi receptorov angiotenzínu dlhodobo, ak si to súbežné ochorenia vyžadovali a tiež s heparínom, nízkomolekulovým heparínom a intravenóznymi inhibítormi GpIIb/IIIa pri krátkodobom podávaní (pozri časť 5.1). Nepozorovali sa žiadne klinicky významné nežiaduce interakcie s týmito liečivami.
Súbežné podávanie tikagreloru s heparínom, enoxaparínom alebo dezmopresínom nemalo žiadny vplyv na aktivovaný parciálny tromboplastínový čas (aPTT), aktivovaný koagulačný čas (ACT) alebo na testy faktora Xa. Pri súbežnom podávaní tikagreloru s liekmi, o ktorých je známe, že ovplyvňujú hemostázu, je však potrebné postupovať s opatrnosťou pre možné farmakodynamické interakcie.
Vzhľadom na hlásenia abnormalít kožného krvácania pri SSRI (napr. paroxetín, sertralín a citalopram) sa pri súbežnom podávaní tikagreloru so SSRI odporúča opatrnosť, pretože to môže zvýšiť riziko krvácania.
4.6 Fertilita, gravidita a laktácia
Ženyvreprodukčnomveku
Ženy v reprodukčnom veku majú počas liečby tikagrelorom používať vhodné antikoncepčné metódy na zabránenie gravidity.
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití tikagreloru u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Tikagrelor sa neodporúča užívať počas gravidity.
Dojčenie
Dostupné farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie tikagreloru a jeho aktívnych metabolitov do mlieka (pozri časť 5.3). Riziko u novorodencov/dojčiat nemôže byť vylúčené. Rozhodnutie, či ukončiť dojčenie alebo či ukončiť/prerušiť liečbu tikagrelorom sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Tikagrelor nemal žiadny vplyv na fertilitu samcov alebo samíc zvierat (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Tikagrelor nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Počas liečby tikagrelorom sa hlásili závrat a zmätenosť. Pacienti, u ktorých sa objavia tieto príznaky, majú byť preto pri vedení vozidiel alebo obsluhe strojov opatrní.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Bezpečnostný profil tikagreloru sa hodnotil v dvoch rozsiahlych skúšaniach fázy 3 (PLATO
a PEGASUS), ktoré zahŕňali viac ako 39 000 pacientov (pozri časť 5.1).
V štúdii PLATO bol pri tikagrelore vyšší výskyt pacientov, ktorí ukončili liečbu pre nežiaduce udalosti, ako pri klopidogrele (7,4 % oproti 5,4 %). V štúdii PEGASUS bol pri tikagrelore vyšší výskyt pacientov, ktorí ukončili liečbu pre nežiaduce udalosti, v porovnaní s liečbou samotnou ASA (16,1 % pre 60 mg tikagreloru s ASA oproti 8,5 % pre liečbu samotnou ASA). Najčastejšie hlásenými nežiaducimi reakciami u pacientov liečených tikagrelorom boli krvácanie a dyspnoe (pozri časť 4.4).
TabuľkovýzoznamnežiaducichreakciíV klinických štúdiách s tikagrelorom alebo v období po uvedení lieku na trh sa zistili a hlásili nasledujúce nežiaduce reakcie (tabuľka 1).
Nežiaduce reakcie sú uvedené podľa tried orgánových systémov (TOS) MedDRA. V rámci každej
TOS sú nežiaduce reakcie usporiadané podľa kategórie frekvencie. Kategórie frekvencie sú definované podľa nasledovných pravidiel: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000
až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme
(z dostupných údajov).
Tabuľka 1 Nežiaduce reakcie podľa frekvencie a triedy orgánových systémov (TOS)TOS
| Veľmi časté
| Časté
| Menej časté
| Neznáme
|
Benígne a malígne
nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy)
|
|
| krvácanie nádorua
|
|
Poruchy krvi a
lymfatického
systému
| Krvácavá
poruchab
|
|
| Trombotická trombocytopenická purpurac
|
Poruchy
imunitného systému
|
|
| Precitlivenosť
vrátane angioedémuc
|
|
Poruchy
metabolizmu
a výživy
| hyperurikémiad
| dna/dnová
artritída
|
|
|
Psychické
poruchy
|
|
| zmätenosť
|
|
Poruchy nervového
systému
|
| závrat, synkopa,
bolesť hlavy
| Intrakraniálne
krvácaniem
|
|
Poruchy oka
|
|
| krvácanie do okae
|
|
Poruchy ucha
a labyrintu
|
| vertigo
| krvácanie do ucha
|
|
Poruchy ciev
|
| hypotenzia
|
|
|
Poruchy
dýchacej sústavy, hrudníka a mediastína
| dyspnoe
| krvácanie do dýchacích ciestf
|
|
|
Poruchy
gastrointestinálneho
traktu
|
|
gastrointestináln
e krvácanieg, hnačka, nauzea, dyspepsia, zápcha
|
retroperitoneálne
krvácanie
|
|
Poruchy kože a podkožného tkaniva
|
|
podkožné alebo
kožné krvá- canieh, vyrážka, pruritus
|
|
|
Poruchy kostrovej a
svalovej sústavy a spojivového tkaniva
|
|
|
krvácanie do
svalui
|
|
Poruchy
obličiek a močových ciest
|
|
krvácanie do močových ciestj
|
|
|
Poruchy
reprodukčného systému a prsníkov
|
|
|
krvácanie do
reprodukčného
systémuk
|
|
Laboratórne a
funkčné vyšetrenia
|
|
zvýšený kreatinín v krvid
|
|
|
Úrazy, otravy
a komplikácie liečebného postupu
|
|
krvácanie po
zákroku, poúrazové krvácaniel
|
|
|
|
|
a napr. krvácanie z nádoru močového mechúra, nádoru žalúdka, nádoru hrubého čreva
b napr. zvýšený sklon k tvorbe krvných podliatin, spontánny hematóm, hemoragická diatéza
c Identifikované v období po uvedení lieku na trh.
d Frekvencie odvodené z laboratórnych pozorovaní (Zvýšenia kyseliny močovej na ˃ horná hranica normálu
oproti východiskovej hodnote nižšej alebo v rámci referenčného rozmedzia. Zvýšenia kreatinínu ˃ 50 %
oproti východiskovej hodnote.), a nie neprepočítané frekvencie hlásených nežiaducich udalostí.
e napr. krvácanie do spojovky, sietnice, vnútroočné krvácanie
f napr. epistaxa, hemoptýza
g napr. krvácanie ďasien, rektálne krvácanie, krvácanie žalúdkového vredu
h napr. ekchymóza, krvácanie do kože, petechie
i napr. hemartróza, krvácanie do svalu
j napr. hematúria, hemoragická cystitída
k napr. vaginálne krvácanie, hematospermia, postmenopauzálne krvácanie
l napr. kontúzia, poúrazový hematóm, poúrazové krvácanie
m napr. spontánne, súvisiace s liečebným postupom alebo traumatické intrakraniálne krvácanie
Popisvybranýchnežiaducichreakcií Krv ácani e Zistenia týkajúce sa krvácania v štúdii PLATOV tabuľke 2 sú uvedené celkové výsledky miery krvácania v štúdii PLATO.
T
abuľka 2 Analýza všetkých krvácavých príhod, Kaplanov-Meierov odhad v 12.mesiaci
(
štúdia PLATO)
|
ti
kagrelor 90 mg
dvakrát denne
N=
9235
|
klopidogrel
N=
9186
|
p-
hodnota
*
|
Veľké krvácania podľa PLATO celkovo
|
11,6
|
11,2
|
0,4336
|
Veľké fatálne/život ohrozujúce krvácania podľa PLATO
|
5,8
|
5,8
|
0,6988
|
Veľké krvácania podľa PLATO nesúvisiace s
CABG
|
4,5
|
3,8
|
0,0264
|
Veľké krvácania podľa PLATO nesúvisiace s
liečebným postupom
|
3,1
|
2,3
|
0,0058
|
Veľké + malé krvácania podľa PLATO
celkovo
|
16,1
|
14,6
|
0,0084
|
Veľké + malé krvácania podľa PLATO
nesúvisiace s liečebným postupom
|
5,9
|
4,3
|
<0,0001
|
Veľké krvácania definované podľa kritérií
TIMI
|
7,9
|
7,7
|
0,5669
|
Veľké + malé krvácania definované podľa kritérií TIMI
|
11,4
|
10,9
|
0,3272
|
Definície kategórií krvácania:
Veľké fatálne/život ohrozujúce krvácanie: Klinicky zjavné krvácanie s poklesom hemoglobínu o viac ako
50 g/l alebo s transfúziou ≥ 4 jednotiek erytrocytov
alebo fatálne
alebo intrakraniálne alebo intraperikardiálne krvácanie s tamponádou srdca;
alebo hypovolemickým šokom alebo ťažkou hypotenziou vyžadujúcou si podanie vazopresorov alebo chirurgickú intervenciu.
Veľké iné: Klinicky zjavné krvácanie s poklesom hemoglobínu o 30 až 50 g/l alebo s transfúziou 2 až 3
jednotiek erytrocytov; alebo významne vysiľujúce krvácanie.
Malé krvácanie: Vyžaduje si lekársky zásah na zastavenie alebo zvládnutie krvácania.
Veľké krvácanie podľa TIMI: Klinicky zjavné krvácanie s poklesom hemoglobínu > 50 g/l
alebointrakraniálne krvácanie.
Malé krvácanie podľa TIMI: Klinicky zjavné krvácanie s poklesom hemoglobínu o 30 až 50 g/l.
*
p-hodnota vypočítaná na základe Coxovho modelu proporcionálneho rizika s liečebnou skupinou ako jedinou vysvetľujúcou premennou.
Tikagrelor a klopidogrel sa neodlišovali vo výskyte veľkého fatálneho/život ohrozujúceho krvácania podľa definície PLATO, veľkého krvácania podľa definície PLATO celkovo, veľkého krvácania podľa kritérií TIMI alebo malého krvácania podľa kritérií TIMI (tabuľka 2). V porovnaní s klopidogrelom sa však pri tikagrelore vyskytlo spolu viac veľkých a malých krvácaní podľa definície PLATO. Niekoľko pacientov v štúdii PLATO malo fatálne krvácania: 20 (0,2 %) pri tikagrelore a 23 (0,3 %) pri klopidogrele (pozri časť 4.4).
Vek, pohlavie, hmotnosť, rasa, geografické územie, súbežné ochorenia, súbežná liečba a anamnéza pacienta, vrátane prekonanej cievnej mozgovej príhody alebo prekonaného prechodného ischemického záchvatu, neboli prediktívne z hľadiska celkového výskytu krvácaní, ani z hľadiska výskytu veľkého krvácania podľa definície PLATO nesúvisiaceho s liečebným postupom. Preto pre žiaden podtyp krvácania nebola konkrétna skupina identifikovaná ako riziková.
Krvácanie súvisiace s CABG:
V štúdii PLATO sa u 42 % z 1 584 pacientov (12 % kohorty), ktorí podstúpili koronárny artériový by– pass (CABG), vyskytlo veľké fatálne/život ohrozujúce krvácanie podľa definície PLATO, bez rozdielu medzi liečebnými skupinami. Fatálne krvácanie súvisiace s CABG sa vyskytlo v každej liečebnej skupine u 6 pacientov (pozri časť 4.4).
Krvácanie nesúvisiace s CABG a krvácanie nesúvisiace s liečebným postupom:
Tikagrelor a klopidogrel sa neodlišovali vo výskyte veľkého fatálneho/život ohrozujúceho krvácania nesúvisiaceho s CABG podľa definície PLATO, ale výskyt veľkého krvácania podľa definície PLATO celkovo, veľkého krvácania podľa kritérií TIMI a výskyt veľkého a malého krvácania podľa kritérií TIMI bol častejší pri tikagrelore. Rovnako, po vylúčení všetkých krvácaní súvisiacich s liečebným postupom, sa viac krvácaní vyskytlo pri tikagrelore ako pri klopidogrele (tabuľka 2). Ukončenie liečby pre krvácanie nesúvisiace s liečebným postupom bolo častejšie pri tikagrelore (2,9 %) ako pri klopidogrele (1,2 %; p< 0,001).
Intrakraniálne krvácanie:
V skupine s tikagrelorom sa vyskytlo viac intrakraniálnych krvácaní nesúvisiacich s liečebným postupom (n = 27 krvácaní u 26 pacientov, 0,3 %) ako v skupine s klopidogrelom (n = 14 krvácaní,
0,2 %), z ktorých bolo fatálnych 11 v skupine s tikagrelorom a 1 v skupine s klopidogrelom.
V celkovom výskyte fatálnych krvácaní nebol žiadny rozdiel.
Zistenia týkajúce sa krvácania v štúdii PEGASUSV tabuľke 3 sú uvedené celkové výsledky udalostí súvisiacich s krvácaním v štúdii PEGASUS.
Tabuľka 3 Analýza všetkých krvácavých príhod, Kaplanov-Meierov odhad v 36. mesiaci (štúdiaPEGASUS)
| tikagrelor 60 mg dvakrát denne + ASA N=6 958
| Samotná
ASA
N=6 996
|
|
Koncový ukazovateľ bezpečnosti
|
KM%
| Pomer rizika
(95 % IS)
|
KM %
|
p-hodnota
|
Kategórie krvácania podľa kritérií TIMI
|
Veľké krvácania podľa TIMI
| 2,3
| 2,32 (1,68; 3,21)
| 1,1
| <0,0001
|
Fatálne
| 0,3
| 1,00 (0,44; 2,27)
| 0,3
| 1,0000
|
ICH
| 0,6
| 1,33 (0,77; 2,31)
| 0,5
| 0,3130
|
Iné veľké krvácania podľa
TIMI
| 1,6
| 3,61 (2,31; 5,65)
| 0,5
| <0,0001
|
Veľké alebo malé krvácania podľa
TIMI
| 3,4
| 2,54 (1,93; 3,35)
| 1,4
| <0,0001
|
Veľké alebo malé krvácania alebo krvácania vyžadujúce lekársku starostlivosť podľa TIMI
| 16,6
| 2,64 (2,35; 2,97)
| 7,0
| <0,0001
|
Kategórie krvácania podľa definície PLATO
|
Veľké krvácania podľa PLATO
| 3,5
| 2,57 (1,95; 3,37)
| 1,4
| <0,0001
|
Fatálne/život ohrozujúce
| 2,4
| 2,38 (1,73; 3,26)
| 1,1
| <0,0001
|
Iné veľké krvácania podľa
PLATO
| 1,1
| 3,37 (1,95; 5,83)
| 0,3
| <0,0001
|
Veľké alebo malé krvácania podľa
PLATO
| 15,2
| 2,71 (2,40; 3,08)
| 6,2
| <0,0001
|
Definície kategórií krvácania:
Veľké krvácanie podľa TIMI: Fatálne krvácanie, ALEBO akékoľvek intrakraniálne krvácanie, ALEBO klinicky zjavné prejavy hemorágie spojené s poklesom hemoglobínu (Hgb) ≥ 50 g/l, alebo 15 % pokles hematokritu (Hct) v prípade nedostupnosti údajov o Hgb.
Fatálne krvácanie: Krvácavá príhoda, ktorá viedla priamo k smrti v priebehu 7 dní.
ICH: Intrakraniálne krvácanie.
Iné veľké krvácanie podľa TIMI: Veľké non-fatálne krvácanie podľa TIMI iné než ICH.
Malé krvácanie podľa TIMI: Klinicky zjavné krvácanie s poklesom hemoglobínu o 30 – 50 g/l. Krvácanie vyžadujúce lekársku starostlivosť podľa TIMI: Vyžadujúce zásah, ALEBO vedúce k hospitalizácii, ALEBO vyžadujúce vyšetrenie.
Veľké fatálne/život ohrozujúce krvácanie podľa PLATO: Fatálne krvácanie, ALEBO akékoľvek
intrakraniálne krvácanie, ALEBO intraperikardiálne krvácanie s tamponádou srdca, ALEBO s hypovolemickým šokom alebo ťažkou hypotenziou vyžadujúcou podanie vazopresorov/inotropík alebo chirurgickú intervenciu, ALEBO klinicky zjavné krvácanie s poklesom hemoglobínu ˃ 50 g/l alebo s transfúziou ≥ 4 jednotiek erytrocytov.
Iné veľké krvácanie podľa PLATO: Významne vysiľujúce krvácanie, ALEBO klinicky zjavné krvácanie
s poklesom hemoglobínu o 30 – 50 g/l alebo s transfúziou 2 – 3 jednotiek erytrocytov.
Malé krvácanie podľa PLATO: Vyžaduje si lekársky zásah na zastavenie alebo zvládnutie krvácania.
V štúdii PEGASUS bol výskyt veľkého krvácania podľa kritérií TIMI pri tikagrelore v dávke 60 mg
dvakrát denne vyšší ako pri samotnej ASA. Nepozorovalo sa zvýšené riziko fatálneho krvácania a pozorovalo sa len mierne zvýšenie výskytu intrakraniálneho krvácania v porovnaní s liečbou samotnou ASA. V štúdii sa vyskytlo niekoľko fatálnych krvácavých príhod, 11 (0,3 %) pri 60 mg tikagreloru a 12 (0,3 %) pri liečbe samotnou ASA. Pozorované zvýšené riziko výskytu veľkého krvácania podľa kritérií TIMI pri 60 mg tikagreloru bolo zapríčinené predovšetkým vyššou frekvenciou výskytu iného veľkého krvácania podľa kritérií TIMI zastúpeného udalosťami
v gastrointestinálnej TOS.
Podobne zvýšený výskyt ako pri veľkom krvácaní podľa kritérií TIMI bol pozorovaný aj pri kategóriách krvácania zahŕňajúcich veľké alebo malé krvácania podľa kritérií TIMI, veľké krvácania podľa definície PLATO a veľké alebo malé krvácania podľa definície PLATO (pozri tabuľku 3). Ukončenie liečby pre krvácanie bolo častejšie pri 60 mg tikagreloru (6,2 %) v porovnaní s liečbou samotnou ASA (1,5 %). Väčšina týchto krvácaní bola menej závažná (klasifikované ako krvácania vyžadujúce lekársku starostlivosť podľa kritérií TIMI), napr. epistaxa, tvorba krvných podliatin a hematómov.
Profil krvácania pri 60 mg tikagreloru bol pre udalosti veľkého krvácania podľa kritérií TIMI, veľkého alebo malého krvácania podľa kritérií TIMI a veľkého krvácania podľa definície PLATO konzistentný v rámci viacerých vopred definovaných podskupín (napr. podľa veku, pohlavia, hmotnosti, rasy, geografického regiónu, súbežných ochorení, súbežnej liečby a anamnézy).
Intrakraniálne krvácanie:
Pre 60 mg tikagreloru a liečbu samotnou ASA sa hlásili podobné miery výskytu spontánneho intrakraniálneho krvácania (n = 13, 0,2 % v oboch liečebných skupinách). Pri liečbe 60 mg tikagreloru (n = 15, 0,2 %) v porovnaní s liečbou samotnou ASA (n = 10, 0,1 %) sa preukázalo mierne zvýšenie výskytu poúrazového intrakraniálneho krvácania a intrakraniálneho krvácania súvisiaceho s liečebným postupom. Pri 60 mg tikagreloru sa vyskytlo 6 fatálnych prípadov intrakraniálneho krvácania a pri liečbe samotnou ASA 5 prípadov. Výskyt intrakraniálneho krvácania bol v oboch liečebných
skupinách nízky vzhľadom na to, že populácia štúdie sa vyznačovala významnou mierou komorbidity
a KV rizikových faktorov.
Dyspnoe
Pacienti liečení tikagrelorom hlásili dyspnoe, pocit sťaženého dýchania. V štúdii PLATO nežiaduce udalosti týkajúce sa dyspnoe (dyspnoe, kľudové dyspnoe, námahové dyspnoe, paroxyzmálne nočné dyspnoe a nočné dyspnoe) hlásili u 13,8 % pacientov liečených s tikagrelorom a u 7,8 % pacientov liečených s klopidogrelom. V štúdii PLATO u 2,2 % pacientov užívajúcich tikagrelor a u 0,6 % pacientov užívajúcich klopidogrel skúšajúci považovali dyspnoe za príčinne súvisiace s liečbou a málo
prípadov bolo závažných (0,14 % tikagrelor; 0,02 % klopidogrel) (pozri časť 4.4). Väčšina hlásených príznakov dyspnoe bola miernej až stredne ťažkej intenzity a väčšinou sa hlásili ako jedna epizóda krátko po začatí liečby.
V porovnaní s klopidogrelom bolo u pacientov s astmou/CHOCHP, ktorí boli liečení tikagrelorom, zvýšené riziko výskytu nezávažného dyspnoe (3,29 % v prípade tikagreloru oproti 0,53 % v prípade klopidogrelu) a závažného dyspnoe (0,38 % v prípade tikagreloru oproti 0,0 % v prípade klopidogrelu). V absolútnom vyjadrení bolo toto riziko vyššie ako v celej populácii pacientov v štúdii PLATO. Tikagrelor sa musí užívať s opatrnosťou u pacientov s anamnézou astmy a/alebo CHOCHP (pozri časť 4.4).
Približne 30 % všetkých prípadov dyspnoe sa upravilo v priebehu 7 dní. Štúdie PLATO sa zúčastnili pacienti s kongestívnym srdcovým zlyhaním, CHOCHP alebo astmou pred začatím skúšania; títo pacienti a starší pacienti hlásili najčastejšie dyspnoe. Kvôli dyspnoe sa liečba tikagrelorom ukončila u 0,9 % pacientov a liečba klopidogrelom u 0,1 % pacientov. Vyšší výskyt dyspnoe pri tikagrelore nesúvisí s novým alebo zhoršujúcim sa srdcovým alebo pľúcnym ochorením (pozri časť 4.4). Tikagrelor nemá vplyv na výsledky testov funkcie pľúc.
V štúdii PEGASUS sa dyspnoe hlásilo u 14,2 % pacientov užívajúcich tikagrelor v dávke 60 mg dvakrát denne a u 5,5 % pacientov užívajúcich samotnú ASA. Rovnako ako v štúdii PLATO, väčšina hlásených prípadov dyspnoe bola miernej až stredne ťažkej intenzity (pozri časť 4.4). Pacienti, ktorí hlásili dýchavičnosť boli starší a mali na začiatku štúdie častejšie dýchavičnosť, CHOCHP alebo astmu.
Vyše tre ni a Zvýšenie kyseliny močovej: V štúdii PLATO došlo k zvýšeniu kyseliny močovej v sére nad hornú hranicu normálu u 22 % pacientov dostávajúcich tikagrelor, v porovnaní s 13 % pacientov
dostávajúcich klopidogrel. V štúdii PEGASUS boli príslušné hodnoty 9,1 % pre 90 mg tikagreloru,
8,8 % pre 60 mg tikagreloru a 5,5 % pre placebo. Priemerná hladina kyseliny močovej v sére sa pri tikagrelore zvýšila približne o 15 % v porovnaní so zvýšením približne o 7,5 % pri klopidogrele a po
ukončení liečby sa znížila približne o 7 % v prípade tikagreloru, v prípade klopidogrelu sa však žiadne
zníženie nezistilo. V štúdii PEGASUS sa zistilo reverzibilné zvýšenie priemerných hladín kyseliny močovej v sére o 6,3 % pre 90 mg tikagreloru a 5,6 % pre 60 mg tikagreloru, v porovnaní s 1,5 % znížením v skupine s placebom. V štúdii PLATO bola frekvencia dnovej artritídy 0,2 % pri tikagrelore oproti 0,1 % pri klopidogrele. V štúdii PEGASUS boli príslušné hodnoty frekvencie dny/dnovej artritídy 1,6 % pre 90 mg tikagreloru, 1,5 % pre 60 mg tikagreloru a 1,1 % pre placebo.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieTikagrelor je v jednorazových dávkach až do 900 mg dobre znášaný. Gastrointestinálna toxicita bola limitujúcim faktorom dávky v štúdii zameranej na zvyšovanie jednorazovej dávky. Iné klinicky významné nežiaduce reakcie, ktoré sa môžu vyskytnúť pri predávkovaní, zahŕňajú dyspnoe a ventrikulárne pauzy (pozri časť 4.8).
V prípade predávkovania sa môžu objaviť vyššie uvedené potenciálne nežiaduce reakcie a je potrebné zvážiť monitorovanie EKG.
V súčasnosti nie je známe žiadne antidotum na zvrátenie účinkov tikagreloru a tikagrelor nie je dialyzovateľný (pozri časť 5.2). Liečba predávkovania sa má riadiť štandardnou lokálnou lekárskou praxou. Predpokladaným účinkom nadmerných dávok tikagreloru je predĺžené trvanie rizika krvácania, ktoré súvisí s inhibíciou krvných doštičiek. Transfúzia krvných doštičiek pravdepodobne
nepredstavuje klinický prínos pre pacientov s krvácaním (pozri časť 4.4). Ak dôjde ku krvácaniu, je potrebné prijať ďalšie príslušné podporné opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antitrombotiká, antiagreganciá trombocytov okrem heparínu, ATC kód:
B01AC24.
Mechanizmusúčinku
Orebriton obsahuje tikagrelor, liečivo patriace podľa chemickej štruktúry do skupiny cyklopentyltriazolopyrimidínov (CPTP), ktorý je perorálnym, priamo pôsobiacim, selektívnym antagonistom, reverzibilne sa viažucim na receptor P2Y12, ktorý zabraňuje aktivácii a agregácii krvných doštičiek sprostredkovanej ADP a závislej na P2Y12. Tikagrelor nezabraňuje väzbe ADP, ale po naviazaní na receptor P2Y12 zabraňuje signálnej transdukcii indukovanej ADP. Vzhľadom na to,
že krvné doštičky sa podieľajú na vzniku a/alebo vývoji trombotických komplikácií aterosklerotických ochorení, preukázalo sa, že inhibícia funkcie krvných doštičiek znižuje riziko kardiovaskulárnych príhod, ako je smrť, IM alebo cievna mozgová príhoda.
Tikagrelor tiež zvyšuje lokálne hladiny endogénneho adenozínu inhibíciou rovnovážnych nukleozidových transportérov-1 (ENT-1).
Zistilo sa, že tikagrelor u zdravých dobrovoľníkov a pacientov s AKS zvýrazňuje nasledujúce účinky indukované adenozínom: vazodilatácia (merané zvýšením koronárneho prietoku krvi u zdravých dobrovoľníkov a pacientov s AKS; bolesť hlavy), inhibícia funkcie krvných doštičiek (v celej ľudskej krvi in vitro) a dyspnoe. Súvislosť medzi pozorovanými zvýšeniami adenozínu a klinickými výsledkami (napr. morbidita-mortalita) však nebola jasne vysvetlená.
Farmakodynamickéúčinky
Nást up úči nku
Tikagrelor u pacientov so stabilnou koronárnou artériovou chorobou (CAD) užívajúcich ASA
vykazuje rýchly nástup farmakologického účinku, čo sa preukázalo priemernou inhibíciou agregácie krvných doštičiek (IPA) tikagrelorom približne 41 % po 0,5 hodiny od podania nárazovej dávky
180 mg, s maximálnym účinkom na IPA 89 % po 2 – 4 hodinách od podania dávky a tento účinok
pretrvával 2 – 8 hodín. U 90 % pacientov bol finálny rozsah IPA po 2 hodinách od podania dávky
> 70 %.
Odzni evanie úči nku
Pri plánovanom zákroku CABG existuje zvýšené riziko krvácania pre tikagrelor oproti klopidogrelu, pokiaľ je liečba ukončená v kratšej dobe ako 96 hodín pred zákrokom.
Údaj e t ýk aj úce s a pre chodu na i nú li eč bu
Prechod z liečby klopidogrelom v dávke 75 mg na tikagrelor v dávke 90 mg dvakrát denne má za následok absolútne zvýšenie IPA o 26,4 % a prechod z liečby tikagrelorom na klopidogrel má za následok absolútne zníženie IPA o 24,5 %. Pacientov možno prestaviť z liečby klopidogrelom na tikagrelor bez akéhokoľvek prerušenia protidoštičkového účinku (pozri časť 4.2).
Klinickáúčinnosťabezpečnosť
Klinický dôkaz účinnosti a bezpečnosti tikagreloru je odvodený z dvoch skúšaní fázy 3:
• Štúdia PLATO [PLATelet Inhibition and Patient Outcomes], porovnávajúca tikagrelor oproti
klopidogrelu, oba podávané v kombinácii s ASA a ďalšou štandardnou liečbou.
• Štúdia PEGASUS TIMI-54 [PrEvention with TicaGrelor of SecondAry Thrombotic Events in High-RiSk AcUte Coronary Syndrome Patients], porovnávajúca tikagrelor v kombinácii s ASA oproti liečbe samotnou ASA.
Št údi a PLATO (akútny k oronárny sy ndróm)
Do štúdie PLATO bolo zahrnutých 18 624 pacientov, u ktorých v priebehu uplynulých 24 hodín došlo
k nástupu príznakov nestabilnej anginy pectoris (unstable angina, UA), infarktu myokardu bez elevácie ST segmentu (NSTEMI) alebo infarktu myokardu s eleváciou ST segmentu (STEMI), a ktorí spočiatku dostávali medikamentóznu liečbu alebo sa u nich vykonala perkutánna koronárna intervencia (PCI) alebo CABG.
Klinická účinnosť
Pri dennom podávaní ASA preukázal tikagrelor v dávke 90 mg dvakrát denne v prevencii výskytu združeného koncového ukazovateľa KV smrti, IM alebo cievnej mozgovej príhody, lepší účinok ako
klopidogrel v dávke 75 mg denne, na tomto rozdiele sa podieľal najmä výskyt KV smrti a IM. Pacienti
dostali 300 mg nárazovú dávku klopidogrelu (prípadne 600 mg v prípade PCI) alebo 180 mg tikagreloru.
Výsledok liečby sa prejavil skoro (zníženie absolútneho rizika [ARR] 0,6 % a zníženie relatívneho rizika [RRR] 12 % po 30 dňoch) a účinok liečby ostal rovnaký po celé obdobie 12 mesiacov, ARR/rok bolo 1,9 % a RRR 16 %. To naznačuje, že je vhodné liečiť pacientov tikagrelorom 90 mg dvakrát denne až 12 mesiacov (pozri časť 4.2). Liečbou 54 pacientov s AKS tikagrelorom namiesto klopidogrelu sa zabráni 1 aterotrombotickej príhode; liečbou 91 pacientov tikagrelorom namiesto klopidogrelu sa zabráni 1 KV smrti (pozri obrázok 1 a tabuľku 4).
Účinok liečby tikagrelorom sa oproti klopidogrelu ukazuje ako konzistentný v rámci rôznych podskupín pacientov, vrátane členenia podľa hmotnosti, pohlavia, diabetu v anamnéze, prechodného ischemického záchvatu alebo nehemoragickej cievnej mozgovej príhody alebo revaskularizácie, súbežnej liečby zahŕňajúcej liečbu heparínmi, inhibítormi GpIIb/IIIa a inhibítormi protónovej pumpy (pozri časť 4.5), podľa finálnej diagnózy príhody (STEMI, NSTEMI alebo UA) a podľa zámeru liečebného postupu pri randomizácii (invazívny alebo medikamentózny).
Pozorovala sa málo významná súčinnosť liečby a geografického územia, pričom podľa pomeru rizika (HR) pre primárny koncový ukazovateľ zo svetového hľadiska vychádza priaznivejšie účinok tikagreloru s výnimkou Severnej Ameriky, kde vychádza priaznivejšie účinok klopidogrelu, ktorá predstavovala približne 10 % celkovej skúmanej populácie (p-hodnota interakcie = 0,045). Výskumné analýzy poukázali na možnú súvislosť s dávkou ASA tak, že znížená účinnosť tikagreloru sa pozorovala pri zvyšujúcich sa dávkach ASA. Pri dlhodobom podávaní ASA s tikagrelorom má byť rozmedzie dennej dávky 75 – 150 mg (pozri časť 4.2 a 4.4).
Obrázok 1 vyjadruje odhad rizika prvého výskytu akejkoľvek udalosti zahrnutej do združeného koncového ukazovateľa účinnosti.
Obrázok 1 Analýza primárneho klinického združeného koncového ukazovateľa KV smrti, IM
a cievnej mozgovej príhody (štúdia PLATO)
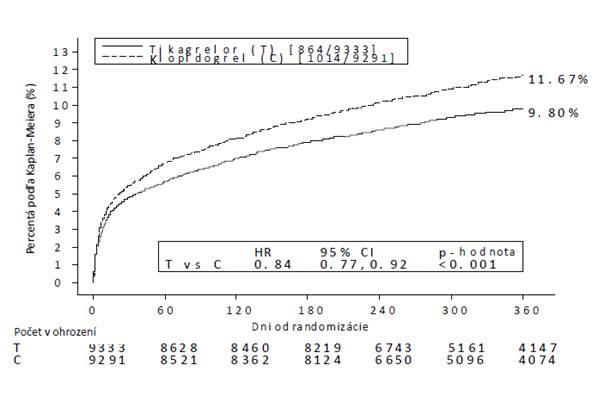
Tikagrelor v porovnaní s klopidogrelom znížil výskyt primárneho združeného koncového ukazovateľa
rovnako u pacientov s UA/NSTEMI ako aj u pacientov so STEMI (tabuľka 4). Liečbu tikagrelorom
90 mg dvakrát denne spolu s nízkou dávkou ASA možno teda použiť u pacientov s AKS (nestabilná angina pectoris, infarkt myokardu bez elevácie ST segmentu [NSTEMI] alebo infarkt myokardu
s eleváciou ST segmentu [STEMI]); vrátane pacientov, ktorí dostávajú medikamentóznu liečbu
a pacientov, u ktorých sa vykonala perkutánna koronárna intervencia (PCI) alebo koronárny artériový
by-pass (CABG).
Tabuľka 4 Analýza primárnych a sekundárnych koncových ukazovateľov účinnosti (štúdiaPLATO)
| tikagrelor
90 mg
dvakrát
denne (% pacientov s udalosťou)
N=9333
| klopidogrel
75 mg
jedenkrát
denne (% pacientov s udalosťou) N=9291
|
ARRa
(%/rok)
|
RRRa (%) (95% IS)
|
p-hodnota
|
KV smrť/IM
(s vylúčením tichého IM) alebo cievna mozgová príhoda
|
9,3
|
10,9
|
1,9
|
16 (8; 23)
|
0,0003
|
So zámerom invazívneho zákroku
| 8,5
| 10,0
| 1,7
| 16 (6; 25)
| 0,0025
|
So zámerom medikamentóznej liečby
| 11,3
| 13,2'
| 2,3
| 15 (0,3; 27)
| 0,0444d
|
KV smrť
| 3,8
| 4,8
| 1,1
| 21 (9; 31)
| 0,0013
|
IM (s vylúčením tichého IM)b
|
5,4
|
6,4
|
1,1
|
16 (5; 25)
|
0,0045
|
Cievna mozgová príhoda
|
1,3
|
1,1
|
-0,2
|
-17 (-52; 9)
|
0,2249
|
Úmrtnosť zo
všetkých príčin, IM (s vylúčením tichého IM) alebo cievna mozgová príhoda
|
9,7
|
11,5
|
2,1
|
16 (8; 23)
|
0,0001
|
KV smrť, IM celkovo,
cievna mozgová príhoda, SRI, RI, TIA alebo iná ATEc
|
13,8
|
15,7
|
2,1
|
12 (5; 19)
|
0,0006
|
Úmrtnosť zo všetkých
príčin
|
4,3
|
5,4
|
1,4
|
22 (11; 31)
|
0,0003d
|
Dokázaná trombóza
stentu
|
1,2
|
1,7
|
0,6
|
32 (8; 49)
|
0.0123d
|
a ARR = zníženie absolútneho rizika; RRR = zníženie relatívneho rizika = (1 − pomer rizika) x 100 %.
Hodnoty s negatívnym RRR naznačujú zvýšenie relatívneho rizika.
b S vylúčením tichého IM.
c SRI = ťažká rekurentná ischémia (serious recurrent ischaemia); RI = rekurentná ischémia (recurrent ischaemia); TIA = prechodný ischemický záchvat (transient ischaemic attack); ATE = arteriálna trombotická príhoda. IM celkovo zahŕňa tichý IM, s dátumom udalosti určeným ako dátum, kedy bol zistený.
d Nominálna hladina významnosti (significance value); všetky ostatné sú formálne štatisticky významné
podľa vopred definovaného hierarchického testovania.
Genetická podštúdia štúdie PLATOGenotypizáciou CYP2C19 a ABCB1 u 10 285 pacientov v štúdii PLATO sa zistili súvislosti medzi skupinami genotypu a výsledkami štúdie PLATO. Lepší účinok tikagreloru oproti klopidogrelu
v znížení výskytu závažných KV príhod nebol významne ovplyvnený genotypom CYP2C19 alebo
ABCB1 pacienta. Podobne ako v celej štúdii PLATO sa celkový výskyt veľkých krvácaní podľa definície PLATO pri tikagrelore a klopidogrele neodlišoval, bez ohľadu na genotyp CYP2C19 alebo
ABCB1. Výskyt veľkých krvácaní podľa definície PLATO nesúvisiacich s CABG bol pri tikagrelore
v porovnaní s klopidogrelom zvýšený u pacientov s jednou alebo viacerými nefunkčnými alelami
CYP2C19, ale podobný ako pri klopidogrele u pacientov bez nefunkčnej alely.
Združený ukazovateľ účinnosti a bezpečnostiZdružený ukazovateľ účinnosti a bezpečnosti (KV smrť, IM, cievna mozgová príhoda alebo veľké krvácanie podľa definície PLATO celkovo) naznačuje, že klinický prínos účinnosti tikagreloru
v porovnaní s klopidogrelom nie je anulovaný udalosťami súvisiacimi s veľkým krvácaním (ARR
1,4 %, RRR 8 %, HR 0,92; p = 0,0257) v priebehu 12 mesiacov od AKS.
Klinická bezpečnosťPodštúdia s Holterovým monitorovaním:
Na sledovanie výskytu ventrikulárnych páuz a iných epizód arytmií počas štúdie PLATO skúšajúci
vykonali Holterovo monitorovanie u podskupiny takmer 3 000 pacientov, z ktorých približne 2 000
malo záznam aj v akútnej fáze ich AKS a aj po jednom mesiaci. Primárnym sledovaným
ukazovateľom bol výskyt ventrikulárnych páuz ≥ 3 sekundy. Ventrikulárne pauzy sa u pacientov
v akútnej fáze vyskytovali častejšie pri tikagrelore (6,0 %) ako pri klopidogrele (3,5 %); a po 1 mesiaci to bolo 2,2 % pri tikagrelore a 1,6 % pri klopidogrele (pozri časť 4.4). Nárast výskytu ventrikulárnych páuz v akútnej fáze AKS bol v skupine s tikagrelorom výraznejší u pacientov s chronickým srdcovým zlyhávaním (CHF) v anamnéze (9,2 % oproti 5,4 % u pacientov bez CHF v anamnéze; v skupine
s klopidogrelom to bolo 4,0 % u pacientov s CHF v anamnéze oproti 3,6 % u pacientov bez CHF
v anamnéze). Tento rozdiel sa po 1 mesiaci nevyskytoval: 2,0 % oproti 2,1 % pri tikagrelore pre pacientov s a bez CHF v anamnéze a 3,8 % oproti 1,4 % pri klopidogrele. Tento rozdiel nesúvisel so žiadnymi nežiaducimi klinickými dôsledkami (vrátane zavedenia kardiostimulátora) v tejto populácii pacientov.
Št údi a PEGASUS (anamnéza i nf arkt u myokardu) Štúdia PEGASUS TIMI-54 bola medzinárodná, multicentrická, randomizovaná, dvojito zaslepená, placebom kontrolovaná štúdia s paralelnou skupinou a s dĺžkou určenou počtom udalostí potrebných
pre štatistické vyhodnotenie (event-driven), zahŕňajúca 21 162 pacientov, ktorá hodnotila prevenciu
aterotrombotických príhod pri tikagrelore podávanom v 2 dávkach (buď 90 mg dvakrát denne alebo
60 mg dvakrát denne) v kombinácii s nízkou dávkou ASA (75 – 150 mg), v porovnaní s liečbou samotnou ASA u pacientov s IM v anamnéze a ďalšími rizikovými faktormi aterotrombózy.
Pacienti boli vhodní na zaradenie do štúdie, ak boli vo veku 50 rokov alebo starší, mali IM v anamnéze (1 až 3 roky pred randomizáciou) a mali aspoň jeden z nasledujúcich rizikových faktorov aterotrombózy: vek ≥ 65 rokov, diabetes mellitus vyžadujúci liečbu, druhý predchádzajúci IM, potvrdenú CAD postihujúcu viaceré cievy alebo chronickú dysfunkciu obličiek v non-terminálnom štádiu.
Pacienti neboli vhodní na zaradenie do štúdie, ak sa u nich počas obdobia štúdie plánoval použiť antagonista receptorov P2Y12, dipyridamol, cilostazol alebo antikoagulačná liečba; ak mali krvácavú poruchu alebo ischemickú cievnu mozgovú príhodu alebo intrakraniálne krvácanie v anamnéze, nádor centrálneho nervového systému alebo abnormalitu intrakraniálnych ciev; ak mali v priebehu predchádzajúcich 6 mesiacov gastrointestinálne krvácanie alebo veľký chirurgický zákrok v priebehu predchádzajúcich 30 dní.
Klinická účinnosťObrázok 2 Analýza primárneho klinického združeného koncového ukazovateľa KV smrti, IMa cievnej mozgovej príhody (štúdia PEGASUS)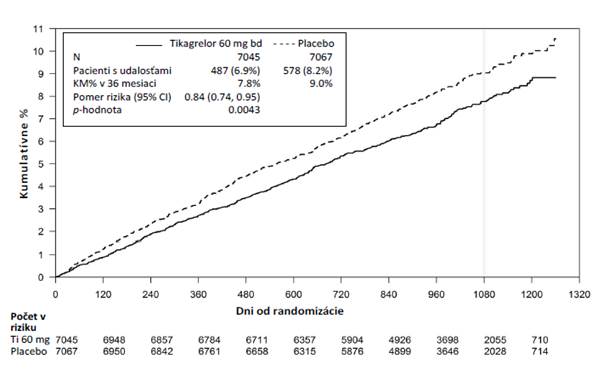
T
abuľka 5 – Analýza primárnych a sekundárnych koncových ukazovateľov účinnosti (štúdia
P
EGA
SUS)
|
t
ikagrelor 60 mg dvakrát denne
+
ASA, N=7 045
|
s
a
m
ot
ná ASA N=7 067
|
p
-
h
o
dn
o
t
a
|
Charakteristika
|
Pac
ienti s
udalosťami
|
K
M %
|
H
R (95% IS)
|
Pacienti s
udalosťami
|
K
M %
|
Primárny koncový ukazovateľ
|
Združený pre KV smrť/IM/cievnu mozgovú príhodu
|
487 (6,9%)
|
7,8%
|
0,84 (0,74; 0,95)
|
578 (8,2%)
|
9,0%
|
0,0043 (s)
|
KV smrť
|
174 (2,5%)
|
2,9%
|
0,83 (0,68; 1,01)
|
210 (3,0%)
|
3,4%
|
0,0676
|
IM
|
285 (4,0%)
|
4,5%
|
0,84 (0,72; 0,98)
|
338 (4,8%)
|
5,2%
|
0,0314
|
Cievna mozgová príhoda
|
91 (1,3%)
|
1,5%
|
0,75 (0,57; 0,98)
|
122 (1,7%)
|
1,9%
|
0,0337
|
Sekundárny koncový ukazovateľ
|
KV smrť
|
174 (2,5%)
|
2,9%
|
0,83 (0,68; 1,01)
|
210 (3,0%)
|
3,4%
|
-
|
Úmrtnosť zo všetkých príčin
|
289 (4,1%)
|
4,7%
|
0,89 (0,76; 1,04)
|
326 (4,6%)
|
5,2%
|
-
|
Pomer rizika (HR) a
p-hodnota sú vypočítané osobitne pre tikagrelor oproti liečbe samotnou ASA na základe
Coxovho modelu proporcionálneho rizika s liečebnou skupinou ako jedinou vysvetľujúcou premennou. Percentá KM vypočítané po 36 mesiacoch.
Poznámka: počty prvých udalostí pre zložky KV smrť, IM a cievna mozgová príhoda sú skutočné počty prvých udalostí pre každú zo zložiek a nesčítavajú sa do počtu udalostí v združenom koncovom ukazovateli.
(s) Predstavuje štatistickú významnosť (significance).
IS = interval spoľahlivosti; KV = kardiovaskulárna; HR = pomer rizika; KM = Kaplanov-Meierov odhad; IM =
infarkt myokardu; N = počet pacientov.
Oba režimy s tikagrelorom, 60 mg dvakrát denne a 90 mg dvakrát denne, v kombinácii s ASA preukázali lepší účinok v prevencii aterotrombotických príhod v porovnaní so samotnou ASA (združený koncový ukazovateľ: KV smrť, IM a cievna mozgová príhoda), s konzistentným účinkom liečby počas celého obdobia štúdie a dosiahnutím RRR 16 % a ARR 1,27 % pre 60 mg tikagreloru
a RRR 15 % a ARR 1,19 % pre 90 mg tikagreloru.
Hoci bol profil účinnosti 90 mg a 60 mg dávky podobný, bolo dokázané, že nižšia dávka je lepšie znášaná a má lepší bezpečnostný profil v súvislosti s rizikom krvácania a dyspnoe. Preto sa na prevenciu aterotrombotických príhod (KV smrť, IM a cievna mozgová príhoda) u pacientov s IM v anamnéze a vysokým rizikom aterotrombotickej príhody odporúča iba tikagrelor 60 mg dvakrát denne podávaný súbežne s ASA.
V porovnaní so samotnou ASA, tikagrelor v dávke 60 mg dvakrát denne významne znížil primárny združený koncový ukazovateľ KV smrti, IM a cievnej mozgovej príhody. Každá zo zložiek prispela k zníženiu primárneho združeného koncového ukazovateľa (RRR KV smrti 17 %, RRR IM 16 %
a RRR cievnej mozgovej príhody 25 %).
RRR pre združený koncový ukazovateľ od 1. do 360. dňa (RRR 17 %) a od 361. dňa ďalej (RRR
16 %) bolo podobné. K dispozícii sú obmedzené údaje o účinnosti a bezpečnosti tikagreloru pri
predĺženej liečbe trvajúcej viac ako 3 roky.
Nebol nájdený žiadny dôkaz o prínose (neprišlo k zníženiu primárneho koncového ukazovateľa zloženého z KV úmrtia, infarktu myokardu a cievnej mozgovej príhody, ale zvýšeniu závažného krvácania), pri užívaní tikagreloru 60 mg dvakrát denne u klinicky stabilných pacientov > 2 roky od infarktu myokardu alebo viac ako jeden rok po ukončení predchádzajúcej liečby inhibítorom receptora ADP (pozri tiež časť 4.2).
Klinická bezpečnosť
Počet prerušení liečby s tikagrelorom 60 mg kvôli krvácaniu a dýchavičnosti bol vyšší u pacientov
> 75 rokov (42 %) ako u mladších pacientov (rozmedzie: 23-31 %), s rozdielom v porovnaní
s placebom vyšším ako 10 % (42 % vs. 29 %), u pacientov > 75 rokov.
Pediatrickápopulácia
V randomizovanej, dvojito zaslepenej štúdii fázy III s paralelnými skupinami (HESTIA 3) bolo
193 pediatrických pacientov (vo veku od 2 rokov do menej ako 18 rokov) s kosáčikovitou anémiou randomizovaných na užívanie placeba alebo tikagreloru v dávkach od 15 mg do 45 mg dvakrát denne v závislosti od telesnej hmotnosti. Tikagrelor viedol k strednej hodnote inhibície krvných doštičiek
35 % pred podaním dávky a 56 % inhibícii krvných doštičiek 2 hodiny po podaní dávky v rovnovážnom stave.
V porovnaní s placebom sa nezaznamenal žiadny klinický prínos tikagreloru v miere výskytu vazookluzívnych kríz.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s referenčným liekom obsahujúcim tikagrelor vo všetkých podskupinách pediatrickej populácie s akútnym koronárnym syndrómom (AKS) a infarktom myokardu (IM) v anamnéze (informácie o použití
v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Farmakokinetika tikagreloru je lineárna a expozícia tikagreloru a aktívnemu metabolitu (AR-
C124910XX) je približne úmerná dávke až po dávku 1 260 mg.
Absorpcia
K absorpcii tikagreloru dochádza rýchlo, s mediánom tmax približne 1,5 hodiny. Tvorba hlavného cirkulujúceho metabolitu AR-C124910XX (tiež aktívneho) z tikagreloru je rýchla s mediánom tmax približne 2,5 hodín. Po perorálnom podaní jednorazovej dávky tikagreloru 90 mg nalačno zdravým dobrovoľníkom je Cmax 529 ng/ml a AUC 3 451 ng*h/ml. Pomer metabolit/pôvodné liečivo pre Cmax je
0,28 a pre AUC 0,42. Farmakokinetika tikagreloru a AR-C124910XX u pacientov s IM v anamnéze bola vo všeobecnosti podobná farmakokinetike v populácii s AKS. Na základe populačnej
farmakokinetickej analýzy štúdie PEGASUS bol medián Cmax tikagreloru v rovnovážnom stave
391 ng/ml a AUC 3 801 ng*h/ml pre dávku 60 mg tikagreloru. Pre dávku 90 mg tikagreloru bola Cmax
v rovnovážnom stave 627 ng/ml a AUC 6 255 ng*h/ml.
Priemerná absolútna biologická dostupnosť tikagreloru sa odhadla na 36 %. Príjem potravy s vysokým obsahom tukov mal za následok zvýšenie AUC tikagreloru o 21 % a zníženie Cmax aktívneho metabolitu o 22 %, na Cmax tikagreloru a na AUC aktívneho metabolitu však nemal žiadny vplyv. Tieto malé zmeny sa považujú za klinicky minimálne významné, preto sa tikagrelor môže užívať s jedlom alebo bez jedla. Tikagrelor ako aj jeho aktívny metabolit sú substrátmi P-gp.
Tikagrelor, vo forme rozdrvených tabliet zmiešaných s vodou, podávaný perorálne alebo nazogastrickou sondou do žalúdka má porovnateľnú biologickú dostupnosť s celými tabletami
s ohľadom na AUC a Cmax tikagreloru a aktívneho metabolitu. Úvodná expozícia (0,5 a 1 hodinu po podaní dávky) po podaní rozdrvených tabliet tikagreloru zmiešaných s vodou bola vyššia v porovnaní
s celými tabletami, pričom neskôr (o 2 až 48 hodín) bol koncentračný profil vo všeobecnosti identický.
Distribučný objem tikagreloru v rovnovážnom stave je 87,5 l. Tikagrelor a aktívny metabolit sa vo veľkej miere viaže na bielkoviny ľudskej plazmy (> 99,0 %).
Biotransformácia
CYP3A4 je hlavným enzýmom zodpovedným za metabolizmus tikagreloru a tvorbu aktívneho metabolitu a ich interakcie s inými substrátmi CYP3A sú v rozmedzí od aktivácie po inhibíciu.
Hlavným metabolitom tikagreloru je AR-C124910XX, ktorý je na základe dôkazu jeho väzby na doštičkový receptor P2Y12 pre ADP v podmienkach in vitro tiež aktívny. Systémová expozícia aktívnemu metabolitu predstavuje približne 30 – 40 % systémovej expozície tikagreloru.
Eliminácia
Primárnou cestou eliminácie tikagreloru je metabolizácia v pečeni. V prípade podávania rádioizotopom značeného tikagreloru sa zachytí v priemere približne 84 % rádioizotopom značenej
dávky (57,8 % v stolici, 26,5 % v moči). Detegované množstvá tikagreloru a aktívneho metabolitu
v moči v obidvoch prípadoch predstavovali menej ako 1 % dávky. Primárnou cestou eliminácie
aktívneho metabolitu je s najväčšou pravdepodobnosťou biliárna sekrécia. Priemerná hodnota t1/2 pre
tikagrelor bola približne 7 hodín a pre aktívny metabolit 8,5 hodín.
Osobitnéskupinypacientov
St arší pacienti
U starších osôb (≥ 75 rokov) s AKS v porovnaní s mladšími pacientmi sa farmakokinetickou analýzou populácie zistilo zvýšenie expozície tikagreloru (približne 25 % pre Cmax aj AUC) a aktívnemu metabolitu. Tieto rozdiely sa nepovažujú za klinicky významné (pozri časť 4.2).
Pedi at ri ck á popul áci a
K dispozícii je iba obmedzené množstvo údajov u detí s kosáčikovitou anémiou (pozri časti 4.2 a 5.1).
V štúdii HESTIA 3 sa pacientom vo veku od 2 rokov do menej ako 18 rokov s telesnou hmotnosťou
≥12 až ≤24 kg podával tikagrelor vo forme dispergovateľných 15 mg tabliet určených deťom v dávke
15 mg dvakrát denne, s telesnou hmotnosťou >24 až ≤48 kg v dávke 30 mg dvakrát denne a s telesnou hmotnosťou >48 kg v dávke 45 mg dvakrát denne. Na základe farmakokinetickej analýzy populácie bola priemerná hodnota AUC v rozmedzí od 1 095 ng*h/ml do 1 458 ng*h/ml a priemerná hodnota Cmax v rozmedzí od 143 ng/ml do 206 ng/ml v rovnovážnom stave.
Pohlavie
U žien sa v porovnaní s mužmi zaznamenalo zvýšenie expozície tikagreloru a aktívnemu metabolitu. Tieto rozdiely sa nepovažujú za klinicky významné.
Porucha f unkc ie obl i či ek
U pacientov s ťažkou poruchou funkcie obličiek (klírens kreatinínu < 30 ml/min) v porovnaní
s osobami s normálnou funkciou obličiek bola expozícia tikagreloru približne o 20 % nižšia
a expozícia aktívnemu metabolitu približne o 17 % vyššia.
U pacientov v terminálnom štádiu renálneho ochorenia na hemodialýze bola hodnota AUC po podaní
90 mg tikagreloru v deň bez dialýzy o 38 % vyššia a Cmax o 51 % vyššia v porovnaní s osobami
s normálnou renálnou funkciou. Podobné zvýšenie expozície sa pozorovalo po podaní tikagreloru bezprostredne pred dialýzou (49 % a 61 %, v uvedenom poradí), čo svedčí o tom, že tikagrelor nie je
dialyzovateľný. Expozícia aktívneho metabolitu sa zvýšila v menšej miere (AUC 13-14 % a Cmax 17-
36 %). Vplyv tikagreloru na inhibíciu agregácie krvných doštičiek (IPA) nezávisel od dialýzy
u pacientov v terminálnom štádiu renálneho ochorenia a bol podobný ako u pacientov s normálnou renálnou funkciou (pozri časť 4.2).
Porucha f unkc ie peče ne
Cmax tikagreloru bola o 12 % a AUC o 23 % vyššia u pacientov s miernou poruchou funkcie pečene
v porovnaní s kontrolnými zdravými osobami, účinok tikagreloru na IPA bol však u oboch skupín
podobný. U pacientov s miernou poruchou funkcie pečene nie je potrebná žiadna úprava dávky. Tikagrelor sa neskúmal u pacientov s ťažkou poruchou funkcie pečene a nie sú k dispozícii farmakokinetické údaje u pacientov so stredne ťažkou poruchou funkcie pečene. U pacientov, ktorí mali stredne závažné alebo závažné východiskové zvýšenie jedného alebo viacerých vyšetrení funkcie pečene, boli plazmatické koncentrácie tikagreloru v priemere podobné alebo mierne vyššie
v porovnaní s pacientmi bez východiskových zvýšení. U pacientov so stredne ťažkou poruchou funkcie pečene sa neodporúča žiadna úprava dávky (pozri časti 4.2 a 4.4).
Etnick á prí sl ušnosť
Priemerná biologická dostupnosť je u pacientov ázijského pôvodu o 39 % vyššia ako u belochov. Biologická dostupnosť tikagreloru u pacientov, ktorí uviedli černošský pôvod bola o 18 % nižšia ako u belochov, v klinických farmakologických štúdiách bola expozícia (Cmax a AUC) tikagreloru
u Japoncov približne o 40 % (o 20 % po úprave podľa telesnej hmotnosti) vyššia ako u belochov. Expozícia u pacientov, ktorí uviedli hispánsky alebo latinskoamerický pôvod bola podobná ako
u belochov.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje týkajúce sa tikagreloru a jeho hlavného metabolitu nepreukázali neprijateľné riziko nežiaducich účinkov u ľudí na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po jednorazovom a opakovanom podávaní a genotoxického potenciálu.
Pri klinicky relevantných hladinách expozície sa pozorovalo gastrointestinálne podráždenie
u niekoľkých druhov zvierat (pozri časť 4.8).
Pri vysokých dávkach tikagreloru sa u samíc potkanov preukázal zvýšený výskyt nádorov maternice (adenokarcinómov) a zvýšený výskyt adenómov pečene. Pravdepodobným mechanizmom vzniku nádorov maternice je hormonálna nerovnováha, ktorá u potkanov môže viesť k vzniku nádorov. Pravdepodobným mechanizmom vzniku adenómov pečene je indukcia enzýmov v pečeni špecifických pre hlodavce. Relevantnosť týchto zistení týkajúcich sa karcinogenity sa preto považuje za nepravdepodobnú pre ľudí.
U potkanov sa pozorovali menej významné vývinové anomálie pri dávkach toxických pre matku (bezpečnostný pomer 5,1). U králikov sa pozorovalo mierne oneskorenie dozrievania pečene a vývoja skeletu plodu u samíc, ktorým boli podávané vysoké dávky, bez známok materskej toxicity (bezpečnostný pomer 4,5).
Štúdie na potkanoch a králikoch preukázali reprodukčnú toxicitu s mierne zníženým nárastom telesnej hmotnosti brezivých samíc a so zníženou životaschopnosťou a zníženou pôrodnou hmotnosťou mláďat s oneskoreným rastom. Tikagrelor spôsoboval nepravidelné cykly (najmä predĺžené cykly) u samíc potkanov, nemal však vplyv na celkovú fertilitu samcov a samíc potkanov. Farmakokinetické štúdie s rádioizotopom značeným tikagrelorom preukázali, že pôvodné liečivo a jeho metabolity sa u potkanov vylučujú do materského mlieka (pozri časť 4.6).
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety manitol (E421)
dihydrát hydrogenfosforečnanu vápenatého (E341)
sodná soľ karboxymetylškrobu hypromelóza
stearát horečnatý (E470b)
O
bal tablety
hypromelóza
oxid titaničitý (E171)
makrogol
žltý oxid železitý (E172)
mastenec (E553b)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Škatuľa obsahujúca priehľadný PVC-PVDC/Al blister s 10 alebo 14 filmom obalenými tabletami.
Veľkosť balenia 10, 14, 28, 30, 56, 60, 100 alebo 168 filmom obalených tabliet. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Zentiva, k.s., U kabelovny 130, Dolní Měcholupy, 102 37 Praha 10, Česká republika
8. REGISTRAČNÉ ČÍSLO
16/0047/22-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
Dátum posledného predĺženia registrácie:
10. DÁTUM REVÍZIE TEXTU
02/2022