
ukončení dopaminergnej terapie boli hlásené príznaky naznačujúce neuroleptický malígny syndróm (pozri časť 4.2).
Augmentácia
Hlásenia v literatúre naznačujú, že liečba iných indikácií dopamínergnými liekmi môže viesť k augmentácii. Augmentácia hovorí o skoršom začiatku príznakov večer (alebo aj poobede), zvýšeniu príznakov a rozšíreniu sa príznakov aj na iné končatiny.
Augmentácia sa špecificky sledovala hlavne v kontrolovaných klinických štúdiách trvajúcich viac ako
26 týždňov. Augmentácia sa pozorovala u 11,8% pacientov v skupine užívajúcej pramipexol (N=152)
a u 9,4% pacientov v skupine užívajúcej placebo (N=149). Kaplanova-Maierova analýza času nástupu augmentácie neukázala žiadny významý rozdiel medzi skupinou užívajúcou pramipexol a skupinou užívajúcou placebo.
4.5 Liekové a iné interakcie
Väzbanaplazmatickébielkoviny
U ľudí je pozorovaná malá biotransformácia a veľmi nízka (<20%) väzba pramipexolu na plazmatické bielkoviny. Preto je interakcia s inými liekmi pôsobiacimi na väzbu na plazmatické bielkoviny alebo na vylučovanie biotransformáciou nepravdepodobná. Pretože anticholínergiká sa vylučujú prevažne biotransformáciou, možnosť interakcie je obmedzená, hoci sa interakcia s anticholínergikami neskúmala. Neexistujú farmakokinetické interakcie so selegilínom ani levodopou.
Inhibítory/kompetítoryaktívnehorenálnehovylučovania
Cimetidín znižuje renálny klírens pramipexolu približne o 34%, pravdepodobne inhibíciou
katiónového vylučovacieho transportného systému renálnych tubulov. Preto lieky, ktoré sú inhibítormi tohto aktívneho renálneho vylučovania alebo sa vylučujú touto cestou, ako sú cimetidín,
amantadín, mexiletín, zidovudín, cisplatina, chinín a prokainamid môžu vzájomne reagovať s pramipexolom, čo má za následok zníženie klírensu pramipexolu.Ak sa tieto lieky podávajú súčasne, má sa zvážiť zníženie dávky pramipexolu.
Kombináciaslevodopou
Ak sa Oprymea podáva v kombinácii s levodopou, odporúča sa pri zvyšovaní dávky Oprymey znížiť dávku levodopy a dávkovanie ďalších antiparkinsoník sa má udržiavať konštantné.
Kvôli možným aditívnym vedľajším účinkom sa vyžaduje opatrnosť u pacientov užívajúcich iné sedatívne lieky alebo alkohol v kombinácii s pramipexolom.
Antipsychotiká
Treba sa vyhýbať súčasnému podávaniu antipsychotík s pramipexolom (pozri časť 4.4), napr. ak je možné očakávať antagonistický účinok.
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí sa neskúmal vplyv na priebeh gravidity a laktácie. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre gravidnú samicu (pozri časť
5.3). Oprymea sa nemá používať počas gravidity ak to nie je vyslovene nevyhnutné, t.j. ak možný prínos opodstatní možné riziko pre plod.
Laktácia
Keďže liečba pramipexolom inhibuje vylučovanie prolaktínu u ľudí, možno očakávať inhibíciu laktácie.Vylučovanie pramipexolu do materského mlieka u žien sa neskúmalo. U potkanov bola
koncentrácia rádioaktívne označeného liečiva vyššia v materskom mlieku ako v plazme. Pre chýbajúce údaje u ľudí sa Oprymea nemá užívať počas dojčenia. Ak je však jej užívanie nevyhnuté, dojčenie sa má prerušiť.
Fertilita
Neboli vykonané žiadne štúdie o vplyve na fertilitu u ľudí. V štúdiách na zvieratách, pramipexol ovplyvnil estrálne cykly a znížil fertilitu samičiek, tak ako sa očakávalo u dopamínového agonistu. Tieto štúdie nepreukázali priame alebo nepriame škodlivé účinky vzhľadom na samčiu fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Oprymea môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Môžu sa objaviť halucinácie alebo somnolencia.
Pacienti liečení Oprymeou, u ktorých sa vyskytne somnolencia a/alebo epizódy náhleho upadnutia do spánku, musia byť informovaní o tom, že nesmú viesť vozidlá alebo vykonávať činnosti, kde zníženie pozornosti môže znamenať riziko vážneho zranenia alebo smrti pacienta alebo jeho okolie (napr. obsluhovanie strojov) až dovtedy, kým neprekonajú takéto rekurentné epizódy a somnolenciu (pozri aj časti 4.4, 4.5 a 4.8).
4.8 Nežiaduce účinky
Očakávanénežiaduceúčinky
Pri užívaní Oprymea sa predpokladajú nasledovné nežiaduce účinky: neobvyklé sny, amnézia, príznaky poruchy správania-impulzívne a kompulzívne správanie, ako zvýšená chuť do jedla, patologické nakupovanie, hypersexualita a patologické hráčstvo; srdcové zlyhanie, stav zmätenosti, zápcha, ilúzie, závraty, dyskinéza, dyspnoe, únava, halucinácie, bolesť hlavy, štikútka, hyperkinéza, hyperfágia, hypotenzia, neprimeraná sekrécia antidiuretického hormónu, nespavosť, poruchy libida, nauzea, paranoja; periférny edém, pneumónia, svrbenie, vyrážka a iná hypersenzitivita, nepokoj, somnolencia, náhle nutkanie na spanie, synkopa, poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť, vracanie, zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti.
Z analýzy združených placebom kontrolovaných štúdií vyplýva, že pri porovnaní celkovo 1
923 pacientov užívajúcich pramipexol a 1 354 pacientov užívajúcich placebo boli nežiaduce účinky často hlásené u obidvoch skupín. 63 % pacientov užívajúcich pramipexol a 52 % pacientov užívajúcich placebo hlásili aspoň jeden nežiaduci účinok.
Tabuľky 1 a 2 zobrazujú frekvenciu výskytu nežiaducich účinkov pri placebom kontrolovaných klinických štúdiách. Nežiaduce účinky lieku uvedené v týchto tabuľkách sú tie, ktoré sa objavili u
0,1 alebo viac % pacientov liečených pramipexolom a boli hlásené signifikantne častejšie u pacientov užívajúcich pramipexol než u pacientov užívajúcich placebo alebo ak udalosť bola posúdená ako klinický relevantná. V každom prípade väčšina nežiaducich účinkov lieku bola mierna až stredne
závažná, zvyčajne sa začali na začiatku liečby a väčšinou mali tendenciu vymiznúť, dokonca aj pri
pokračujúcej liečbe.
V systéme orgánovej klasifikácie sú nežiaduce účinky evidované podľa výskytu (počet pacientov, u ktorého sa očakáva výskyt reakcie) použitím nasledujúcich kategórií: veľmi časté (≥ 1/10); časté (≥
1/100, < 1/10); menej časté (≥ 1/1 000, < 1/100); zriedkavé (≥ 1/10 000, < 1/1 000); veľmi zriedkavé
(< 1/10 000).
Parkinsonovachoroba,najčastejšienežiaduceúčinky
Najčastejšie hlásené nežiaduce účinky (≥5%) u pacientov s Parkinsonovou chorobou boli nauzea, dyskinéza, hypotenzia, závrat, ospanlivosť, nespavosť, zápcha, halucinácie, bolesť hlavy a únava, a boli hlásené častejšie pri liečbe pramipexolom ako pri liečbe placebom. Výskyt ospanlivosti sa zvyšuje pri dávkach vyšších ako 1,5 mg/deň (pozri časť 4.2). Častejšími nežiaducimi účinkami v

kombinácii s levodopou boli dyskinézy. Na začiatku liečby sa môže objaviť hypotenzia, najmä ak je pramipexol titrovaný príliš rýchlo.
Tabuľka 1: Parkinsonova choroba
Systém orgánovej klasifikácie Nežiaduci účinok
Infekcie a nákazy
Menej časté pneumónia
Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy
Časté abnormálne sny, príznaky poruchy správania-impulzívne a kompulzívne správanie, zmätenosť, halucinácie, nespavosť
Menej časté nadmerné prejedanie sa1, chorobné nakupovanie, delúzie, hyperfágia1, hypersexualita, poruchy libida, paranoja, patologické hráčstvo, nepokoj, delírium
Zriedkavé mánia
Poruchy nervového systému
Veľmi časté závraty, dyskinéza, somnolencia
Časté bolesť hlavy
Menej časté amnézia, hyperkinéza, epizódy náhleho spánku, synkopa
Poruchy oka
Časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava, periférny opuch
Laborátórne a funkčné vyšetrenia
Časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla
Menej časté zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže to byť aj menej. Presné stanovenie frekvencie výskytu nie je môžné, keďže nežiaduci účinok sa nevyskytol v databáze 2 762 pacientov
klinickej štúdie, ktorí trpeli Parkinsonovou chorobou a boli liečení pramipexolom.
Ináindikácia,najčastejšienežiaduceúčinkyNajčastejšie hlásené (≥ 5 %) nežiaduce účinky u pacientov s inou indikáciou liečených pramipexolom boli nauzea, bolesť hlavy, závraty a únava. Nauzea a únava boli častejšie hlásené u žien liečených s pramipexolom (20,8 %, respektíve 10,5 %) v porovnaní s mužmi (6,7 % respektíve 7,3 %).
Tabuľka 2: Iná indikácia
Systém orgánovej klasifikácie Nežiaduci účinok
Infekcie a nákazy
Menej časté pneumónia
1Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy
Časté abnormálne sny, nespavosť
Menej časté impulzívne a kompulzívne správanie ako je nadmerné prejedanie sa, chorobné nakupovanie, hypersexualita a patologické hráčstvo
1; zmätenosť, delúzie
1, halucinácie, hyperfágia
1, poruchy libida, paranoja
1, nepokoj, mánia1, delírium1
Poruchy nervového systému
Časté závraty, bolesť hlavy, ospanlivosť
Menej časté amnézia
1, dyskinéza, hyperkinéza
1, epizódy náhleho spánku, synkopa
Poruchy oka
Menej časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmezenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Menej časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava
Menej časté periférny opuch
Laborátórne a funkčné vyšetrenia
Menej časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže byť aj menej. Presné stanovenie frekvencie výskytu nie je môžné, keďže nežiaduci účinok sa nevyskytol v databáze 1 395 pacientov
klinickej štúdie, s inými indikáciami, ktorí boli liečení pramipexolom.
OspanlivosťPramipexol je spojený so somnolenciou (8,6 %), nadmerná spavosť počas dňa s epizódami náhleho upadnutia do spánku je menej častá (0,1 %). Pozri tiež časť 4.4.
PoruchylibidaPramipexol sa môže spájať s poruchami libida (zvýšené (0,1%) alebo znížené (0,4%) libido).
Poruchykontrolyimpulzov
U pacientov liečených dopamínovými agonistmi vrátane Oprymeou sa môže vyskytnúť patologické hráčstvo, zvýšené libido, hypersexualita, chorobné míňanie alebo nakupovanie, nenásytné jedenie a chorobné jedenie (pozri časť 4.4).
V prierezovej, retrospektívnej štúdii typu case-control zahŕňajúcej 3 090 pacientov s Parkinsonovou chorobou, 13,6% všetkých pacientov užívajúcich dopaminergnú a nedopaminergnú liečbu malo príznaky poruchy impulzívneho správania za posledných 6 mesiacov. Pozorovali sa prejavy vrátane patologického hráčstva, chorobného nakupovania, zvýšenej chuti do jedla a kompulzívneho sexuálneho správania (hypersexualita). Možné nezávislé rizikové faktory poruchy impulzívneho správania zahŕňali dopaminergnú liečbu a vyššie dávky dopaminergnej liečby, nižší vek (≤65 rokov), slobodný a pacientom uvedené hráčstvo v rodinnej anamnéze.
Srdcovézlyhanie
V klinických štúdiách a na základe skúseností po uvedení lieku na trh bolo u pacientov liečených pramipexolom hlásené srdcové zlyhanie. Vo farmakoepidemiologickej štúdii sa užívanie pramipexolu spájalo so zvýšeným rizikom výskytu srdcového zlyhania v porovnaní s pacientami, ktorí neužívali pramipexol (zistená miera rizika 1,86; 95 % Cl, 1,21-2,85).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
So závažným predávkovaním nie sú klinické skúsenosti. Očakávané nežiaduce účinky by súviseli s farmakodynamickým profilom dopamínových agonistov, vrátane nauzey, vracania, hyperkinézy, halucinácií, nepokoja a hypotenzie. Pre predávkovanie dopamínovými agonistami nie je stanovená protilátka. Ak sa vyskytnú príznaky stimulácie centrálneho nervového systému, môže byť indikované podanie neuroleptík. Zvládnutie predávkovania môže vyžadovať všeobecné podporné opatrenia spolu s výplachom žalúdka, intravenóznym podaním tekutín, podaním aktívneho uhlia a monitorovaním EKG.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiparkinsonikum, agonisty dopamínu, ATC kód: N04BC05. Mechanizmusúčinku
Pramipexol je dopamínový agonista, ktorý sa viaže s veľkou selektívnosťou a špecifickosťou na dopamínové receptory podtriedy D2 a má prednostnú afinitu k D3 receptorom. Má plnú vnútornú aktivitu.
Pramipexol zmierňuje parkinsonovský motorický deficit stimuláciou dopamínových receptorov v striate. Pokusy na zvieratách ukázali, že pramipexol inhibuje syntézu dopamínu, jeho vylučovanie a premenu.
Farmakodynamickéúčinky
U zdravých dobrovoľníkov sa pozorovalo zníženie sekrécie prolaktínu v závislosti od dávky.
Klinická účinnosťa bezpečnosťpriParkinsonovejchorobe
U pacientov užívajúcich pramipexol sa zmiernili príznaky a symptómy idiopatickej Parkinsonovej
choroby. Kontrolované klinické štúdie zahrňovali približne 1 800 pacientov v štádiu I–IV podľa Hoehna a Yahra. Okrem nich bolo približne 1 000 pacientov v pokročilejších štádiách, ktorí užívali súčasne levodopu a mali motorické komplikácie.
Pri ranej a pokročilej Parkinsonovej chorobe bola účinnosť pramipexolu v kontrolovaných klinických štúdiách udržiavaná na rovnakej úrovni po dobu približne 6 mesiacov. V otvorených pokračujúcich štúdiách trvajúcich viac ako 3 roky sa nezaznamenali znaky klesajúcej účinnosti.
V kontrolovanej dvojročnej dvojito zaslepenej štúdii, začatie liečby pramipexolom výrazne oddialilo nástup motorických komplikácií a znížilo ich výskyt v porovnaní so začatím liečby levodopou. Toto oddialenie nástupu motorických komplikácií pri pramipexole vyrovnáva výraznejšie zlepšenie motorických funkcií pri levodope (merané ako stredná hodnota zmeny v UPDRS škále). Celkový výskyt halucinácií a somnolencie bol všeobecne vyšší vo fáze zvyšovania dávky v skupine užívajúcej pramipexol. Avšak počas udržiavacej fázy sa výrazný rozdiel nezaznamenal. Tieto skutočnosti sa majú
zvážiť, keď sa u pacientov s Parkinsonovou chorobou začína liečba pramipexolom.
Detiadospievajúci
Európska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií pre pramipexol
s ohľadom na všetky vekové podskupiny detí a dospievajúcich s Parkinsonovou chorobou (pozri čať
4.2 pre informáciu o pediatrickom použití).
Klinická účinnosťabezpečnosťpriTourettovomsyndróme
Účinnosť pramipexolu (0,0625-0,5 mg/deň) u pediatrických pacientov s Tourettovým syndrómom vo
veku 6-17 rokov sa hodnotila v 6-týždňovej, dvojito zaslepenej, randomizovanej, placebom
kontrolovanej štúdii s flexibilnou dávkou lieku. Celkovo sa randomizovalo 63 pacientov (43 užívalo pramipexol, 20 placebo). Primárny cieľový výsledok bola zmena základných hodnôt celkového skóre tikov (TTS) podľa Yaleovej celkovej škály závažnosti tikov (YGTSS). Nepozoroval sa žiaden rozdiel medzi skupinou užívajúcou pramipexol a skupinou užívajúcou placebo, či už v primárnom cieľovom výsledku alebo v ktoromkoľvek sekundárnom cieľovom výsledku účinnosti lieku vrátane celkového skóre YGTSS, celkového obrazu pacienta o zlepšení stavu (PGI-I), celkového klinického obrazu o zlepšení stavu (CGI-I) alebo celkového klinického obrazu o závažnosti choroby (CGI-S). Nežiaduce udalosti, ktoré sa vyskytli aspoň u 5% pacientov v skupine užívajúcej pramipexol a ktoré boli častejšie u pacientov užívajúcich pramipexol ako u pacientov užívajúcich placebo, boli: bolesti hlavy (27,9%, placebo 25,0%), ospanlivosť (7,0%, placebo 5,0%), nauzea (18,6%, placebo 10,0%), vracanie (11,6%, placebo 0,0%), bolesť v hornej časti brucha (7,0%, placebo 5,0%), ortostatická hypotenzia (9,3%, placebo 5,0%), myalgia (9,3%;placebo 5,0%), poruchy spánku (7,0%, placebo 5,0%), dyspnoe (7,0%, placebo 0,0%) a infekcie horných dýchacích ciest (7,0%; placebo 5,0%). Ostatné významné nežiaduce udalosti u pacientov užívajúcich pramipexol, vedúce k prerušeniu podávania sledovaného lieku, bol stav zmätenosti, poruchy reči a zhoršujúci sa stav (pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorbcia
Pramipexol sa po perorálnom podaní absorbuje rýchlo a úplne. Absolútna biologická dostupnosť je
vyššia ako 90% a maximálne plazmatické koncentrácie sa objavujú po 1 až 3 hodinách. Súčasné podanie s jedlom neznižovalo množstvo absorbovaného pramipexolu, ale znižovalo rýchlosť absorpcie. Pramipexol preukazuje lineárnu kinetiku a malý rozdiel v plazmatických hladinách medzi jednotlivými pacientmi.
Distribúcia
U ľudí je väzba pramipexolu na bielkoviny veľmi nízka (<20%) a distribučný objem je rozsiahly
(400 l). Vysoké koncentrácie v mozgovom tkanive sa pozorovali u potkanov (približne 8-násobok koncentrácie v plazme).
Biotransformácia
Pramipexol sa u ľudí metabolizuje len v malom rozsahu.
Eliminácia
Hlavnou cestou vylučovania je renálna exkrécia nezmeneného pramipexolu. Približne 90% dávky označenej 14C sa vylúči obličkami a menej ako 2% sa nachádza v stolici. Celkový klírens pramipexolu je približne 500 ml/min a renálny klírens je približne 400 ml/min. Eliminačný polčas (t¹/2) kolíše od
8 hodín u mladých do 12 hodín u starších pacientov.
5.3 Predklinické údaje o bezpečnosti
Štúdie toxicity po opakovanom podaní ukázali, že pramipexol má vplyv prevažne na funkcie CNS a ženského reprodukčného systému, pravdepodobne v dôsledku svojho zvýšeného farmakodynamického účinku.
U miniprasiat sa zaznamenalo zníženie diastolického i systolického tlaku a pokles tepovej frekvencie.
Sklon k hypotenznému účinku sa zaznamenal u opíc.
U potkanov a králikov boli sledované možné účinky pramipexolu na reprodukčnú funkciu. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre gravidné samice. V dôsledku výberu živočíšnych druhov a obmedzených sledovaných parametrov, nežiaduce účinky pramipexolu na graviditu a mužskú fertilitu neboli plne objasnené.
U potkanov sa pozorovalo oneskorenie pohlavného vývoja (t.j. oddelenie predkožky a vaginálneho vchodu). Relevantnosť týchto zistení pre ľudí nie je známa.
Pramipexol nebol genotoxický. V štúdii karcinogenity sa u samcov potkanov rozvinula hyperplázia Leydigových buniek a adenómy, ktoré sa vysvetľujú inhibičným účinkom pramipexolu na prolaktín. Tento nález nie je klinicky relevantný pre človeka. Rovnaká štúdia tiež preukázala, že pri dávkach pramipexolu 2 mg/kg (vo forme soli) a vyšších sa u albínskych potkanov pozorovala degenerácia sietnice. Tento posledný nález sa však nepozoroval u pigmentovaných potkanov, ako ani pri dvojročnej štúdii karcinogenity u albínskych myší či iných sledovaných živočíšnych druhov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol
Kukuričný škrob
Predželatinovaný kukuričný škrob
Povidón K25
Bezvodý koloidný oxid kremičitý
Magnéziumstearát
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
Blister (ALU/ALU fólia): 20, 30, 60, 90 alebo 100 tabliet, v škatuľke. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky na likvidáciu.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
KRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Slovinsko
8. REGISTRAČNÉ ČÍSLA
20 tabliet: EU/1/08/469/006
30 tabliet: EU/1/08/469/007
60 tabliet: EU/1/08/469/008
90 tabliet: EU/1/08/469/009
100 tabliet: EU/1/08/469/010
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12. septembra 2008
Dátum posledného predĺženia registrácie: 09. apríl 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Oprymea 0,35 mg tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá tableta obsahuje 0,35 mg pramipexolu (čo zodpovedá 0,5 mg monohydrate pramipexoliumdichloridu).
Prosím, venujte pozornosť:
Dávky pramipexolu, ktoré sú uvedené v literatúre, sa vzťahujú na pramipexol vo forme soli. Preto budú dávky uvádzané pre bázu pramipexolu, ako aj pre soľ pramipexolu (v zátvorkách).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tableta.
Biele, oválne, so skosenými hranami, s deliacimi ryhami na oboch stranách a s vyrazeným kódom
“P8” na oboch poloviciach jednej strany tablety. Tableta sa môže rozdeliť na rovnaké polovice.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Oprymea je určená na liečbu príznakov a symptómov idiopatickej Parkinsonovej choroby, buď samostatne (bez levodopy) alebo v kombinácii s levodopou, t.j. v priebehu choroby, vrátane jej neskorých štádií, keď účinok levodopy slabne alebo sa stáva nepravidelný a objavujú sa výkyvy liečebného účinku (end of dose – na konci dávkovacieho intervalu alebo striedanie stavov „on-off“).
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Parkinsonovachoroba
Denná dávka sa podáva rozdelená na tri rovnaké časti.
Začiatok liečby:
Dávka sa má zvyšovať postupne, každých 5–7 dní, so začiatočnou dávkou 0,264 mg bázy (0,375 mg soli) denne. Potrebná dávka sa má titrovať tak, aby došlo k maximálnemu liečebnému efektu, za predpokladu, že sa u pacientov neprejavia netolerovateľné nežiaduce účinky.
Vzostupne – dávkovacia schéma Oprymea
Týždeň Dávka
(mg bázy)
Celková denná dávka
(mg bázy)
Dávka
(mg soli)
Celková denná dávka
(mg soli)
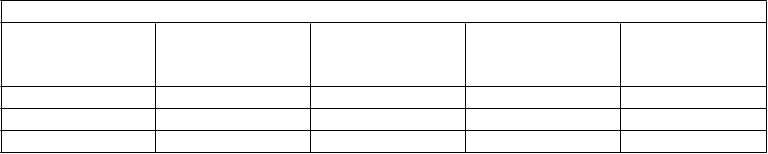
1 3 x 0,088 0,264 3 x 0,125 0,375
2 3 x 0,18 0,54 3 x 0,25 0,75
3 3 x 0,35 1,1 3 x 0,5 1,50
Ak je potrebné ďalšie zvyšovanie dennej dávky, má sa zvyšovať po 0,54 mg bázy (0,75 mg soli) v
týždňových intervaloch až do maximálnej dennej dávky 3,3 mg bázy (4,5 mg soli).
Treba však poznamenať, že pri dávkach vyšších ako 1,5 mg/deň sa zvyšuje výskyt somnolencie (pozri časť 4.8).
Udržiavacia liečba:
Individuálna dávka má byť v rozmedzí od 0,264 mg bázy (0,375 mg soli) maximálne do 3,3 mg bázy (4,5 mg soli) denne. Pri zvyšovaní dávky v troch pivotných štúdiách sa účinnosť pozorovala po dosiahnutí dennej dávky 1,1 mg bázy (1,5 mg soli). Ďalšia úprava dávkovania má byť založená na klinickej odpovedi a na výskyte nežiaducich účinkov. V klinických štúdiách bolo približne 5% pacientov liečených dávkami menšími ako 1,1 mg bázy (1,5 mg soli). Pri pokročilej Parkinsonovej chorobe môžu byť dávky vyššie ako 1,1 mg bázy (1,5 mg soli) denne užitočné u pacientov, u ktorých sa predpokladá redukcia dávok levodopy. Odporúča sa, aby sa dávkovanie levodopy znižovalo tak počas zvyšovania dávky ako aj pri udržiavacej liečbe Oprymeou, v závislosti od odpovede jednotlivých pacientov (pozri časť 4.5).
Prerušenieliečby:
Náhle prerušenie dopaminergnej terapie môže viesť k rozvoju neuroleptického malígneho syndrómu. Postupne sa má znižovať dávka pramipexolu po 0,54 mg bázy (0,75 mg soli) denne až do dosiahnutia dennej dávky zredukovanej na 0,54 mg bázy (0,75 mg soli). Potom sa dávka znižuje po 0,264 mg bázy (0,375 mg soli) denne (pozri časť 4.4).
Pacienti s poruchou funkcieobličiek:
Vylučovanie pramipexolu závisí od funkcie obličiek. Pre začiatokliečby sa navrhuje nasledovná schéma dávkovania:
U pacientov s klírensom kreatinínu nad 50 ml/min sa nevyžaduje zníženie dennej dávky alebo frekvencie dávkovania.
U pacientov s hodnotami klírensu kreatinínu medzi 20 a 50 ml/min sa má počiatočná denná dávka Oprymey podávať rozdelená na dve časti, začínajúc pri 0,088 mg bázy (0,125 mg soli) dvakrát denne (0,176 mg bázy/0,25 mg soli denne). Maximálna denná dávka 1,57 mg bázy pramipexolu (2,25 mg soli) sa nemá prekročiť.
Pacientom s klírensom kreatinínu nižším ako 20 ml/min sa má denná dávka Oprymey podávať jednorazovo, v dávke začínajúcej od 0,088 mg bázy (0,125 mg soli) denne. Maximálna denná dávka
1,1 mg bázy pramipexolu (1,5 mg soli) sa nemá prekročiť.
Ak počas udržiavacej terapie dôjde k poklesu funkcie obličiek, denná dávka Oprymey sa má znížiť percentuálne v rovnakom rozsahu, ako sa znížil klírens kreatinínu, t.j. ak sa klírens kreatinínu znížil o 30 %, potom redukujte dennú dávku Oprymey o 30%. Ak je klírens kreatinínu medzi 20
a 50 ml/min, denná dávka môže byť rozdelená na dve časti, a ak je klírens kreatinínu nižší ako
20 ml/min, denná dávka sa podáva jednorazovo.
Pacienti s poruchou funkcie pečene
Úprava dávky u pacientov so zlyhaním pečene pravdepodobne nie je nevyhnutná, pretože približne
90 % absorbovaného liečiva sa vylučuje obličkami. Možný vplyv insuficiencie pečene na farmakokinetiku Oprymey sa však neskúmal.
Pediatrická populácia
Bezpečnosť a účinnosť Oprymey u detí do 18 rokov sa nesledovala. Nie je žiadne opodstatnenie pre používanie Oprymey u detí s Parkinsonovou chorobou.
Tourettov syndróm
Pediatrická populácia
Užívanie Oprymey u detí a dospievajúcich do 18 rokov sa neodporúča, keďže účinnosť a bezpečnosť
sa v tejto populácii nestanovila. Oprymea sa nemá používať u detí alebo dospievajúcich s Tourettovým
syndrómom kvôli negatívnemu pomeru prínos–riziko pre toto ochorenie (pozri časť 5.1).
Spôsobpodávania
Tablety sa užívajú perorálne, zapíjajú sa vodou, môžu sa užívať s jedlom alebo bez neho.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pri predpisovaní tabliet Oprymea pacientom s Parkinsonovou chorobou a s poruchou funkcie obličiek sa odporúča znížené dávkovanie podľa časti 4.2.
Halucinácie
Pri liečbe dopamínovými agonistami a levodopou sú známym nežiaducim účinkom halucinácie. Pacienti majú byť informovaní, že sa môžu objaviť (prevažne vizuálne) halucinácie.
Dyskinéza
Pri pokročilej Parkinsonovej chorobe sa pri kombinovanej liečbe s levodopou môžu počas začiatočnej titrácie dávky Oprymey objaviť dyskinézy. Ak sa objavia, dávka levodopy sa má znížiť.
Epizódynáhlehospánkuasomnolencia
Pramipexol sa spája so somnolenciou a epizódami náhleho upadnutia do spánku, obzvlášť u pacientov
s Parkinsonovou chorobou. Menej často sa zaznamenalo náhle upadnutie do spánku počas bežných denných aktivít, niekedy bez toho, aby si to pacient uvedomil alebo pocítil varovné príznaky. Pacienti o tom musia byť informovaní a oboznámení s tým, že počas užívania Oprymey musia byť opatrní počas vedenia vozidiel alebo pri obsluhe strojov. Pacienti, ktorí už mali problémy so somnolenciou a/alebo epizódami náhleho upadnutia do spánku, nesmú viesť vozidlá alebo obsluhovať stroje. Okrem toho je potrebné zvážiť zníženie dávky alebo ukončenie liečby. Keď pacienti užívajú v kombinácii s pramipexolom aj ďalšie sedatívne lieky alebo alkohol musia byť oboznámení s tým, že majú byť opatrní, kvôli možným aditívnym vedľajším účinkom (pozri časti 4.5 4.7 a 4.8).
Poruchykontrolyimpulzov
Pacienti majú byť pravidelne monitorovaní z dôvodu vývoja porúch kontroly impulzov. Pacienti a opatrovatelia majú byť upovedomení, že u pacientov liečených dopamínovými agonistmi vrátane pramipexolu sa môžu vyskytnúť behaviorálne symptómy porúch kontroly impulzov zahŕňajúce patologické hráčstvo, zvýšené libido, hypersexualitu, chorobné míňanie alebo nakupovanie, nenásytné jedenie a chorobné jedenie. Ak sa vyvinú takéto symptómy, má sa zvážiť zníženie dávky/postupné vysadenie lieku.
Mániaadelírium
Má sa pravidelne sledovať, či sa u pacientov nevyvinie mánia a delírium. Pacienti a ošetrovatelia sa majú informovať, že u pacientov liečených pramipexolom sa môže vyskytnúť mánia a delírium. Ak sa vyvinú tieto príznaky, má sa zvážiť zníženie dávky/postupné prerušenie liečby.
Pacientispsychotickýmiporuchami
Pacienti s psychotickými poruchami majú byť liečení agonistami dopamínu len vtedy, ak očakávaný
prínos prevýši možné riziká.
Je nutné vyvarovať sa súčasného podávania pramipexolu a antipsychotických liekov (pozri časť 4.5). Oftalmologickésledovanie
Odporúča sa oftalmologické sledovanie v pravidelných intervaloch alebo aj v prípade výskytu porúch
zraku.
Závažnékardiovaskulárneochorenie
V prípade závažného kardiovaskulárneho ochorenia sa má zvýšiť starostlivosť. Odporúča sa sledovať krvný tlak, najmä na začiatku liečby, vzhľadom na všeobecné riziko posturálnej hypotenzie spojenej s dopaminergnou liečbou.
Neuroleptickýmalígnysyndróm
Po náhlom ukončení dopaminergnej terapie boli hlásené príznaky naznačujúce neuroleptický malígny syndróm (pozri časť 4.2).
Augmentácia
Hlásenia v literatúre naznačujú, že liečba iných indikácií dopamínergnými liekmi môže viesť k augmentácii. Augmentácia hovorí o skoršom začiatku príznakov večer (alebo aj poobede), zvýšeniu príznakov a rozšíreniu sa príznakov aj na iné končatiny.
Augmentácia sa špecificky sledovala hlavne v kontrolovaných klinických štúdiách trvajúcich viac ako
26 týždňov. Augmentácia sa pozorovala u 11,8% pacientov v skupine užívajúcej pramipexol (N=152)
a u 9,4% pacientov v skupine užívajúcej placebo (N=149). Kaplanova-Maierova analýza času nástupu augmentácie neukázala žiadny významý rozdiel medzi skupinou užívajúcou pramipexol a skupinou užívajúcou placebo.
4.5 Liekové a iné interakcie
Väzbanaplazmatickébielkoviny
U ľudí je pozorovaná malá biotransformácia a veľmi nízka (<20%) väzba pramipexolu na plazmatické bielkoviny. Preto je interakcia s inými liekmi pôsobiacimi na väzbu na plazmatické bielkoviny alebo na vylučovanie biotransformáciou nepravdepodobná. Pretože anticholínergiká sa vylučujú prevažne biotransformáciou, možnosť interakcie je obmedzená, hoci sa interakcia s anticholínergikami neskúmala. Neexistujú farmakokinetické interakcie so selegilínom ani levodopou.
Inhibítory/kompetítoryaktívnehorenálnehovylučovania
Cimetidín znižuje renálny klírens pramipexolu približne o 34%, pravdepodobne inhibíciou
katiónového vylučovacieho transportného systému renálnych tubulov. Preto lieky, ktoré sú inhibítormi tohto aktívneho renálneho vylučovania alebo sa vylučujú touto cestou, ako sú cimetidín,
amantadín, mexiletín, zidovudín, cisplatina, chinín a prokainamid môžu vzájomne reagovať s pramipexolom, čo má za následok zníženie klírensu pramipexolu.Ak sa tieto lieky podávajú súčasne, má sa zvážiť zníženie dávky pramipexolu.
Kombináciaslevodopou
Ak sa Oprymea podáva v kombinácii s levodopou, odporúča sa pri zvyšovaní dávky Oprymey znížiť dávku levodopy a dávkovanie ďalších antiparkinsoník sa má udržiavať konštantné.
Kvôli možným aditívnym vedľajším účinkom sa vyžaduje opatrnosť u pacientov užívajúcich iné sedatívne lieky alebo alkohol v kombinácii s pramipexolom.
Antipsychotiká
Treba sa vyhýbať súčasnému podávaniu antipsychotík s pramipexolom (pozri časť 4.4), napr. ak je možné očakávať antagonistický účinok.
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí sa neskúmal vplyv na priebeh gravidity a laktácie. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre gravidnú samicu (pozri časť
5.3). Oprymea sa nemá používať počas gravidity ak to nie je vyslovene nevyhnutné, t.j. ak možný prínos opodstatní možné riziko pre plod.
Laktácia
Keďže liečba pramipexolom inhibuje vylučovanie prolaktínu u ľudí, možno očakávať inhibíciu laktácie.Vylučovanie pramipexolu do materského mlieka u žien sa neskúmalo. U potkanov bola
koncentrácia rádioaktívne označeného liečiva vyššia v materskom mlieku ako v plazme. Pre chýbajúce údaje u ľudí sa Oprymea nemá užívať počas dojčenia. Ak je však jej užívanie nevyhnuté, dojčenie sa má prerušiť.
Fertilita
Neboli vykonané žiadne štúdie o vplyve na fertilitu u ľudí. V štúdiách na zvieratách, pramipexol ovplyvnil estrálne cykly a znížil fertilitu samičiek, tak ako sa očakávalo u dopamínového agonistu. Tieto štúdie nepreukázali priame alebo nepriame škodlivé účinky vzhľadom na samčiu fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Oprymea môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Môžu sa objaviť halucinácie alebo somnolencia.
Pacienti liečení Oprymeou, u ktorých sa vyskytne somnolencia a/alebo epizódy náhleho upadnutia do spánku, musia byť informovaní o tom, že nesmú viesť vozidlá alebo vykonávať činnosti, kde zníženie pozornosti môže znamenať riziko vážneho zranenia alebo smrti pacienta alebo jeho okolie (napr. obsluhovanie strojov) až dovtedy, kým neprekonajú takéto rekurentné epizódy a somnolenciu (pozri aj časti 4.4, 4.5 a 4.8).
4.8 Nežiaduce účinky
Očakávanénežiaduceúčinky
Pri užívaní Oprymea sa predpokladajú nasledovné nežiaduce účinky: neobvyklé sny, amnézia, príznaky poruchy správania-impulzívne a kompulzívne správanie, ako zvýšená chuť do jedla, patologické nakupovanie, hypersexualita a patologické hráčstvo; srdcové zlyhanie, stav zmätenosti, zápcha, ilúzie, závraty, dyskinéza, dyspnoe, únava, halucinácie, bolesť hlavy, štikútka, hyperkinéza, hyperfágia, hypotenzia, neprimeraná sekrécia antidiuretického hormónu, nespavosť, poruchy libida, nauzea, paranoja; periférny edém, pneumónia, svrbenie, vyrážka a iná hypersenzitivita, nepokoj, somnolencia, náhle nutkanie na spanie, synkopa, poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť, vracanie, zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti.
Z analýzy združených placebom kontrolovaných štúdií vyplýva, že pri porovnaní celkovo 1
923 pacientov užívajúcich pramipexol a 1 354 pacientov užívajúcich placebo boli nežiaduce účinky často hlásené u obidvoch skupín. 63 % pacientov užívajúcich pramipexol a 52 % pacientov užívajúcich placebo hlásili aspoň jeden nežiaduci účinok.
Tabuľky 1 a 2 zobrazujú frekvenciu výskytu nežiaducich účinkov pri placebom kontrolovaných klinických štúdiách. Nežiaduce účinky lieku uvedené v týchto tabuľkách sú tie, ktoré sa objavili u
0,1 alebo viac % pacientov liečených pramipexolom a boli hlásené signifikantne častejšie u pacientov užívajúcich pramipexol než u pacientov užívajúcich placebo alebo ak udalosť bola posúdená ako klinický relevantná. V každom prípade väčšina nežiaducich účinkov lieku bola mierna až stredne
závažná, zvyčajne sa začali na začiatku liečby a väčšinou mali tendenciu vymiznúť, dokonca aj pri
pokračujúcej liečbe.
V systéme orgánovej klasifikácie sú nežiaduce účinky evidované podľa výskytu (počet pacientov, u ktorého sa očakáva výskyt reakcie) použitím nasledujúcich kategórií: veľmi časté (≥ 1/10); časté (≥
1/100, < 1/10); menej časté (≥ 1/1 000, < 1/100); zriedkavé (≥ 1/10 000, < 1/1 000); veľmi zriedkavé
(< 1/10 000).
Parkinsonovachoroba,najčastejšienežiaduceúčinky
Najčastejšie hlásené nežiaduce účinky (≥5%) u pacientov s Parkinsonovou chorobou boli nauzea, dyskinéza, hypotenzia, závrat, ospanlivosť, nespavosť, zápcha, halucinácie, bolesť hlavy a únava, a boli hlásené častejšie pri liečbe pramipexolom ako pri liečbe placebom. Výskyt ospanlivosti sa zvyšuje pri dávkach vyšších ako 1,5 mg/deň (pozri časť 4.2). Častejšími nežiaducimi účinkami v


kombinácii s levodopou boli dyskinézy. Na začiatku liečby sa môže objaviť hypotenzia, najmä ak je pramipexol titrovaný príliš rýchlo.
Tabuľka 1: Parkinsonova choroba
Systém orgánovej klasifikácie Nežiaduci účinok
Infekcie a nákazy
Menej časté pneumónia
Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy
Časté abnormálne sny, príznaky poruchy správania-impulzívne a kompulzívne správanie, zmätenosť, halucinácie, nespavosť
Menej časté nadmerné prejedanie sa1, chorobné nakupovanie, delúzie, hyperfágia1, hypersexualita, poruchy libida, paranoja, patologické hráčstvo, nepokoj, delírium
Zriedkavé mánia
Poruchy nervového systému
Veľmi časté závraty, dyskinéza, somnolencia
Časté bolesť hlavy
Menej časté amnézia, hyperkinéza, epizódy náhleho spánku, synkopa
Poruchy oka
Časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava, periférny opuch
Laborátórne a funkčné vyšetrenia
Časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla
Menej časté zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže to byť aj menej. Presné stanovenie frekvencie výskytu nie je môžné, keďže nežiaduci účinok sa nevyskytol v databáze 2 762 pacientov
klinickej štúdie, ktorí trpeli Parkinsonovou chorobou a boli liečení pramipexolom.
Ináindikácia,najčastejšienežiaduceúčinkyNajčastejšie hlásené (≥ 5 %) nežiaduce účinky u pacientov s inou indikáciou liečených pramipexolom boli nauzea, bolesť hlavy, závraty a únava. Nauzea a únava boli častejšie hlásené u žien liečených s pramipexolom (20,8 %, respektíve 10,5 %) v porovnaní s mužmi (6,7 % respektíve 7,3 %).
Tabuľka 2: Iná indikácia
Systém orgánovej klasifikácie Nežiaduci účinok
Infekcie a nákazy
Menej časté pneumónia
1Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy

Časté abnormálne sny, nespavosť
Menej časté impulzívne a kompulzívne správanie ako je nadmerné prejedanie sa, chorobné nakupovanie, hypersexualita a patologické hráčstvo
1; zmätenosť, delúzie
1, halucinácie, hyperfágia
1, poruchy libida, paranoja
1, nepokoj, mánia1, delírium1
Poruchy nervového systému
Časté závraty, bolesť hlavy, ospanlivosť
Menej časté amnézia
1, dyskinéza, hyperkinéza
1, epizódy náhleho spánku, synkopa
Poruchy oka
Menej časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmezenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Menej časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava
Menej časté periférny opuch
Laborátórne a funkčné vyšetrenia
Menej časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže byť aj menej. Presné stanovenie frekvencie výskytu nie je môžné, keďže nežiaduci účinok sa nevyskytol v databáze 1 395 pacientov
klinickej štúdie, s inými indikáciami, ktorí boli liečení pramipexolom.
OspanlivosťPramipexol je spojený so somnolenciou (8,6 %), nadmerná spavosť počas dňa s epizódami náhleho upadnutia do spánku je menej častá (0,1 %). Pozri tiež časť 4.4.
PoruchylibidaPramipexol sa môže spájať s poruchami libida (zvýšené (0,1%) alebo znížené (0,4%) libido).
Poruchykontrolyimpulzov
U pacientov liečených dopamínovými agonistmi vrátane Oprymeou sa môže vyskytnúť patologické hráčstvo, zvýšené libido, hypersexualita, chorobné míňanie alebo nakupovanie, nenásytné jedenie a chorobné jedenie (pozri časť 4.4).
V prierezovej, retrospektívnej štúdii typu case-control zahŕňajúcej 3 090 pacientov s Parkinsonovou chorobou, 13,6% všetkých pacientov užívajúcich dopaminergnú a nedopaminergnú liečbu malo príznaky poruchy impulzívneho správania za posledných 6 mesiacov. Pozorovali sa prejavy vrátane patologického hráčstva, chorobného nakupovania, zvýšenej chuti do jedla a kompulzívneho sexuálneho správania (hypersexualita). Možné nezávislé rizikové faktory poruchy impulzívneho správania zahŕňali dopaminergnú liečbu a vyššie dávky dopaminergnej liečby, nižší vek (≤65 rokov), slobodný a pacientom uvedené hráčstvo v rodinnej anamnéze.
Srdcovézlyhanie
V klinických štúdiách a na základe skúseností po uvedení lieku na trh bolo u pacientov liečených pramipexolom hlásené srdcové zlyhanie. Vo farmakoepidemiologickej štúdii sa užívanie pramipexolu spájalo so zvýšeným rizikom výskytu srdcového zlyhania v porovnaní s pacientami, ktorí neužívali pramipexol (zistená miera rizika 1,86; 95 % Cl, 1,21-2,85).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
So závažným predávkovaním nie sú klinické skúsenosti. Očakávané nežiaduce účinky by súviseli s farmakodynamickým profilom dopamínových agonistov, vrátane nauzey, vracania, hyperkinézy, halucinácií, nepokoja a hypotenzie. Pre predávkovanie dopamínovými agonistami nie je stanovená protilátka. Ak sa vyskytnú príznaky stimulácie centrálneho nervového systému, môže byť indikované podanie neuroleptík. Zvládnutie predávkovania môže vyžadovať všeobecné podporné opatrenia spolu s výplachom žalúdka, intravenóznym podaním tekutín, podaním aktívneho uhlia a monitorovaním EKG.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiparkinsonikum, agonisty dopamínu, ATC kód: N04BC05. Mechanizmusúčinku
Pramipexol je dopamínový agonista, ktorý sa viaže s veľkou selektívnosťou a špecifickosťou na dopamínové receptory podtriedy D2 a má prednostnú afinitu k D3 receptorom. Má plnú vnútornú aktivitu.
Pramipexol zmierňuje parkinsonovský motorický deficit stimuláciou dopamínových receptorov v striate. Pokusy na zvieratách ukázali, že pramipexol inhibuje syntézu dopamínu, jeho vylučovanie a premenu.
Farmakodynamickéúčinky
U zdravých dobrovoľníkov sa pozorovalo zníženie sekrécie prolaktínu v závislosti od dávky.
Klinická účinnosťabezpečnosťpriParkinsonovejchorobe
U pacientov užívajúcich pramipexol sa zmiernili príznaky a symptómy idiopatickej Parkinsonovej
choroby. Kontrolované klinické štúdie zahrňovali približne 1 800 pacientov v štádiu I–IV podľa Hoehna a Yahra. Okrem nich bolo približne 1 000 pacientov v pokročilejších štádiách, ktorí užívali súčasne levodopu a mali motorické komplikácie.
Pri ranej a pokročilej Parkinsonovej chorobe bola účinnosť pramipexolu v kontrolovaných klinických štúdiách udržiavaná na rovnakej úrovni po dobu približne 6 mesiacov. V otvorených pokračujúcich štúdiách trvajúcich viac ako 3 roky sa nezaznamenali znaky klesajúcej účinnosti.
V kontrolovanej dvojročnej dvojito zaslepenej štúdii, začatie liečby pramipexolom výrazne oddialilo nástup motorických komplikácií a znížilo ich výskyt v porovnaní so začatím liečby levodopou. Toto oddialenie nástupu motorických komplikácií pri pramipexole vyrovnáva výraznejšie zlepšenie motorických funkcií pri levodope (merané ako stredná hodnota zmeny v UPDRS škále). Celkový výskyt halucinácií a somnolencie bol všeobecne vyšší vo fáze zvyšovania dávky v skupine užívajúcej pramipexol. Avšak počas udržiavacej fázy sa výrazný rozdiel nezaznamenal. Tieto skutočnosti sa majú
zvážiť, keď sa u pacientov s Parkinsonovou chorobou začína liečba pramipexolom.
Detiadospievajúci
Európska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií pre pramipexol
s ohľadom na všetky vekové podskupiny detí a dospievajúcich s Parkinsonovou chorobou (pozri čať
4.2 pre informáciu o pediatrickom použití).
Klinická účinnosťabezpečnosťpriTourettovomsyndróme
Účinnosť pramipexolu (0,0625-0,5 mg/deň) u pediatrických pacientov s Tourettovým syndrómom vo
veku 6-17 rokov sa hodnotila v 6-týždňovej, dvojito zaslepenej, randomizovanej, placebom
kontrolovanej štúdii s flexibilnou dávkou lieku. Celkovo sa randomizovalo 63 pacientov (43 užívalo pramipexol, 20 placebo). Primárny cieľový výsledok bola zmena základných hodnôt celkového skóre tikov (TTS) podľa Yaleovej celkovej škály závažnosti tikov (YGTSS). Nepozoroval sa žiaden rozdiel medzi skupinou užívajúcou pramipexol a skupinou užívajúcou placebo, či už v primárnom cieľovom výsledku alebo v ktoromkoľvek sekundárnom cieľovom výsledku účinnosti lieku vrátane celkového skóre YGTSS, celkového obrazu pacienta o zlepšení stavu (PGI-I), celkového klinického obrazu o zlepšení stavu (CGI-I) alebo celkového klinického obrazu o závažnosti choroby (CGI-S). Nežiaduce udalosti, ktoré sa vyskytli aspoň u 5% pacientov v skupine užívajúcej pramipexol a ktoré boli častejšie u pacientov užívajúcich pramipexol ako u pacientov užívajúcich placebo, boli: bolesti hlavy (27,9%, placebo 25,0%), ospanlivosť (7,0%, placebo 5,0%), nauzea (18,6%, placebo 10,0%), vracanie (11,6%, placebo 0,0%), bolesť v hornej časti brucha (7,0%, placebo 5,0%), ortostatická hypotenzia (9,3%, placebo 5,0%), myalgia (9,3%;placebo 5,0%), poruchy spánku (7,0%, placebo 5,0%), dyspnoe (7,0%, placebo 0,0%) a infekcie horných dýchacích ciest (7,0%; placebo 5,0%). Ostatné významné nežiaduce udalosti u pacientov užívajúcich pramipexol, vedúce k prerušeniu podávania sledovaného lieku, bol stav zmätenosti, poruchy reči a zhoršujúci sa stav (pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorbcia
Pramipexol sa po perorálnom podaní absorbuje rýchlo a úplne. Absolútna biologická dostupnosť je
vyššia ako 90% a maximálne plazmatické koncentrácie sa objavujú po 1 až 3 hodinách. Súčasné podanie s jedlom neznižovalo množstvo absorbovaného pramipexolu, ale znižovalo rýchlosť absorpcie. Pramipexol preukazuje lineárnu kinetiku a malý rozdiel v plazmatických hladinách medzi jednotlivými pacientmi.
Distribúcia
U ľudí je väzba pramipexolu na bielkoviny veľmi nízka (<20%) a distribučný objem je rozsiahly
(400 l). Vysoké koncentrácie v mozgovom tkanive sa pozorovali u potkanov (približne 8-násobok koncentrácie v plazme).
Biotransformácia
Pramipexol sa u ľudí metabolizuje len v malom rozsahu.
Eliminácia
Hlavnou cestou vylučovania je renálna exkrécia nezmeneného pramipexolu. Približne 90% dávky označenej 14C sa vylúči obličkami a menej ako 2% sa nachádza v stolici. Celkový klírens pramipexolu je približne 500 ml/min a renálny klírens je približne 400 ml/min. Eliminačný polčas (t¹/2) kolíše od
8 hodín u mladých do 12 hodín u starších pacientov.
5.3 Predklinické údaje o bezpečnosti
Štúdie toxicity po opakovanom podaní ukázali, že pramipexol má vplyv prevažne na funkcie CNS a ženského reprodukčného systému, pravdepodobne v dôsledku svojho zvýšeného farmakodynamického účinku.
U miniprasiat sa zaznamenalo zníženie diastolického i systolického tlaku a pokles tepovej frekvencie.
Sklon k hypotenznému účinku sa zaznamenal u opíc.
U potkanov a králikov boli sledované možné účinky pramipexolu na reprodukčnú funkciu. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre gravidné samice. V dôsledku výberu živočíšnych druhov a obmedzených sledovaných parametrov, nežiaduce účinky pramipexolu na graviditu a mužskú fertilitu neboli plne objasnené.
U potkanov sa pozorovalo oneskorenie pohlavného vývoja (t.j. oddelenie predkožky a vaginálneho vchodu). Relevantnosť týchto zistení pre ľudí nie je známa.
Pramipexol nebol genotoxický. V štúdii karcinogenity sa u samcov potkanov rozvinula hyperplázia Leydigových buniek a adenómy, ktoré sa vysvetľujú inhibičným účinkom pramipexolu na prolaktín. Tento nález nie je klinicky relevantný pre človeka. Rovnaká štúdia tiež preukázala, že pri dávkach pramipexolu 2 mg/kg (vo forme soli) a vyšších sa u albínskych potkanov pozorovala degenerácia sietnice. Tento posledný nález sa však nepozoroval u pigmentovaných potkanov, ako ani pri dvojročnej štúdii karcinogenity u albínskych myší či iných sledovaných živočíšnych druhov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol
Kukuričný škrob
Predželatinovaný kukuričný škrob
Povidón K25
Bezvodý koloidný oxid kremičitý
Magnéziumstearát
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
Blister (ALU/ALU fólia): 20, 30, 60, 90 alebo 100 tabliet, v škatuľke. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky na likvidáciu.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
KRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Slovinsko
8. REGISTRAČNÉ ČÍSLA
20 tabliet: EU/1/08/469/011
30 tabliet: EU/1/08/469/012
60 tabliet: EU/1/08/469/013
90 tabliet: EU/1/08/469/014
100 tabliet: EU/1/08/469/015
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12. septembra 2008
Dátum posledného predĺženia registrácie: 09. apríl 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Oprymea 0,7 mg tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá tableta obsahuje 0,7 mg pramipexolu (čo zodpovedá 1 mg monohydrate pramipexoliumdichloridu).
Prosím, venujte pozornosť:
Dávky pramipexolu, ktoré sú uvedené v literatúre, sa vzťahujú na pramipexol vo forme soli. Preto budú dávky uvádzané pre bázu pramipexolu, ako aj pre soľ pramipexolu (v zátvorkách).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tableta.
Biele, okrúhle, so skosenými hranami, s deliacimi ryhami na oboch stranách a s vyrazeným kódom
“P9” na oboch poloviciach jednej strany tablety. Tableta sa môže rozdeliť na rovnaké polovice.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Oprymea je určená na liečbu príznakov a symptómov idiopatickej Parkinsonovej choroby, buď samostatne (bez levodopy) alebo v kombinácii s levodopou, t.j. v priebehu choroby, vrátane jej neskorých štádií, keď účinok levodopy slabne alebo sa stáva nepravidelný a objavujú sa výkyvy liečebného účinku (end of dose – na konci dávkovacieho intervalu alebo striedanie stavov „on-off“).
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Parkinsonovachoroba
Denná dávka sa podáva rozdelená na tri rovnaké časti.
Začiatok liečby:
Dávka sa má zvyšovať postupne, každých 5–7 dní, so začiatočnou dávkou 0,264 mg bázy (0,375 mg soli) denne. Potrebná dávka sa má titrovať tak, aby došlo k maximálnemu liečebnému efektu, za predpokladu, že sa u pacientov neprejavia netolerovateľné nežiaduce účinky.
Vzostupne – dávkovacia schéma Oprymea
Týždeň Dávka
(mg bázy)
Celková denná dávka
(mg bázy)
Dávka
(mg soli)
Celková denná dávka
(mg soli)

1 3 x 0,088 0,264 3 x 0,125 0,375
2 3 x 0,18 0,54 3 x 0,25 0,75
3 3 x 0,35 1,1 3 x 0,5 1,50
Ak je potrebné ďalšie zvyšovanie dennej dávky, má sa zvyšovať po 0,54 mg bázy (0,75 mg soli) v
týždňových intervaloch až do maximálnej dennej dávky 3,3 mg bázy (4,5 mg soli).
Treba však poznamenať, že pri dávkach vyšších ako 1,5 mg/deň sa zvyšuje výskyt somnolencie (pozri časť 4.8).
Udržiavacia liečba:
Individuálna dávka má byť v rozmedzí od 0,264 mg bázy (0,375 mg soli) maximálne do 3,3 mg bázy (4,5 mg soli) denne. Pri zvyšovaní dávky v troch pivotných štúdiách sa účinnosť pozorovala po dosiahnutí dennej dávky 1,1 mg bázy (1,5 mg soli). Ďalšia úprava dávkovania má byť založená na klinickej odpovedi a na výskyte nežiaducich účinkov. V klinických štúdiách bolo približne 5% pacientov liečených dávkami menšími ako 1,1 mg bázy (1,5 mg soli). Pri pokročilej Parkinsonovej chorobe môžu byť dávky vyššie ako 1,1 mg bázy (1,5 mg soli) denne užitočné u pacientov, u ktorých sa predpokladá redukcia dávok levodopy. Odporúča sa, aby sa dávkovanie levodopy znižovalo tak počas zvyšovania dávky ako aj pri udržiavacej liečbe Oprymeou, v závislosti od odpovede jednotlivých pacientov (pozri časť 4.5).
Prerušenieliečby:
Náhle prerušenie dopaminergnej terapie môže viesť k rozvoju neuroleptického malígneho syndrómu. Postupne sa má znižovať dávka pramipexolu po 0,54 mg bázy (0,75 mg soli) denne až do dosiahnutia dennej dávky zredukovanej na 0,54 mg bázy (0,75 mg soli). Potom sa dávka znižuje po 0,264 mg bázy (0,375 mg soli) denne (pozri časť 4.4).
Pacienti s poruchou funkcieobličiek:
Vylučovanie pramipexolu závisí od funkcie obličiek. Pre začiatokliečby sa navrhuje nasledovná schéma dávkovania:
U pacientov s klírensom kreatinínu nad 50 ml/min sa nevyžaduje zníženie dennej dávky alebo frekvencie dávkovania.
U pacientov s hodnotami klírensu kreatinínu medzi 20 a 50 ml/min sa má počiatočná denná dávka Oprymey podávať rozdelená na dve časti, začínajúc pri 0,088 mg bázy (0,125 mg soli) dvakrát denne (0,176 mg bázy/0,25 mg soli denne). Maximálna denná dávka 1,57 mg bázy pramipexolu (2,25 mg soli) sa nemá prekročiť.
Pacientom s klírensom kreatinínu nižším ako 20 ml/min sa má denná dávka Oprymey podávať jednorazovo, v dávke začínajúcej od 0,088 mg bázy (0,125 mg soli) denne. Maximálna denná dávka
1,1 mg bázy pramipexolu (1,5 mg soli) sa nemá prekročiť.
Ak počas udržiavacej terapie dôjde k poklesu funkcie obličiek, denná dávka Oprymey sa má znížiť percentuálne v rovnakom rozsahu, ako sa znížil klírens kreatinínu, t.j. ak sa klírens kreatinínu znížil o 30 %, potom redukujte dennú dávku Oprymey o 30%. Ak je klírens kreatinínu medzi 20
a 50 ml/min, denná dávka môže byť rozdelená na dve časti, a ak je klírens kreatinínu nižší ako
20 ml/min, denná dávka sa podáva jednorazovo.
Pacienti s poruchou funkcie pečene
Úprava dávky u pacientov so zlyhaním pečene pravdepodobne nie je nevyhnutná, pretože približne
90 % absorbovaného liečiva sa vylučuje obličkami. Možný vplyv insuficiencie pečene na farmakokinetiku Oprymey sa však neskúmal.
Pediatrická populácia
Bezpečnosť a účinnosť Oprymey u detí do 18 rokov sa nesledovala. Nie je žiadne opodstatnenie pre používanie Oprymey u detí s Parkinsonovou chorobou.
Tourettov syndróm
Pediatrická populácia
Užívanie Oprymey u detí a dospievajúcich do 18 rokov sa neodporúča, keďže účinnosť a bezpečnosť
sa v tejto populácii nestanovila. Oprymea sa nemá používať u detí alebo dospievajúcich s Tourettovým
syndrómom kvôli negatívnemu pomeru prínos–riziko pre toto ochorenie (pozri časť 5.1).
Spôsobpodávania
Tablety sa užívajú perorálne, zapíjajú sa vodou, môžu sa užívať s jedlom alebo bez neho.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pri predpisovaní tabliet Oprymea pacientom s Parkinsonovou chorobou a s poruchou funkcie obličiek sa odporúča znížené dávkovanie podľa časti 4.2.
Halucinácie
Pri liečbe dopamínovými agonistami a levodopou sú známym nežiaducim účinkom halucinácie. Pacienti majú byť informovaní, že sa môžu objaviť (prevažne vizuálne) halucinácie.
Dyskinéza
Pri pokročilej Parkinsonovej chorobe sa pri kombinovanej liečbe s levodopou môžu počas začiatočnej titrácie dávky Oprymey objaviť dyskinézy. Ak sa objavia, dávka levodopy sa má znížiť.
Epizódynáhlehospánkuasomnolencia
Pramipexol sa spája so somnolenciou a epizódami náhleho upadnutia do spánku, obzvlášť u pacientov
s Parkinsonovou chorobou. Menej často sa zaznamenalo náhle upadnutie do spánku počas bežných denných aktivít, niekedy bez toho, aby si to pacient uvedomil alebo pocítil varovné príznaky. Pacienti o tom musia byť informovaní a oboznámení s tým, že počas užívania Oprymey musia byť opatrní počas vedenia vozidiel alebo pri obsluhe strojov. Pacienti, ktorí už mali problémy so somnolenciou a/alebo epizódami náhleho upadnutia do spánku, nesmú viesť vozidlá alebo obsluhovať stroje. Okrem toho je potrebné zvážiť zníženie dávky alebo ukončenie liečby. Keď pacienti užívajú v kombinácii s pramipexolom aj ďalšie sedatívne lieky alebo alkohol musia byť oboznámení s tým, že majú byť opatrní, kvôli možným aditívnym vedľajším účinkom (pozri časti 4.5 4.7 a 4.8).
Poruchykontrolyimpulzov
Pacienti majú byť pravidelne monitorovaní z dôvodu vývoja porúch kontroly impulzov. Pacienti a opatrovatelia majú byť upovedomení, že u pacientov liečených dopamínovými agonistmi vrátane pramipexolu sa môžu vyskytnúť behaviorálne symptómy porúch kontroly impulzov zahŕňajúce patologické hráčstvo, zvýšené libido, hypersexualitu, chorobné míňanie alebo nakupovanie, nenásytné jedenie a chorobné jedenie. Ak sa vyvinú takéto symptómy, má sa zvážiť zníženie dávky/postupné vysadenie lieku.
Mániaadelírium
Má sa pravidelne sledovať, či sa u pacientov nevyvinie mánia a delírium. Pacienti a ošetrovatelia sa majú informovať, že u pacientov liečených pramipexolom sa môže vyskytnúť mánia a delírium. Ak sa vyvinú tieto príznaky, má sa zvážiť zníženie dávky/postupné prerušenie liečby.
Pacientispsychotickýmiporuchami
Pacienti s psychotickými poruchami majú byť liečení agonistami dopamínu len vtedy, ak očakávaný
prínos prevýši možné riziká.
Je nutné vyvarovať sa súčasného podávania pramipexolu a antipsychotických liekov (pozri časť 4.5). Oftalmologickésledovanie
Odporúča sa oftalmologické sledovanie v pravidelných intervaloch alebo aj v prípade výskytu porúch
zraku.
Závažnékardiovaskulárneochorenie
V prípade závažného kardiovaskulárneho ochorenia sa má zvýšiť starostlivosť. Odporúča sa sledovať krvný tlak, najmä na začiatku liečby, vzhľadom na všeobecné riziko posturálnej hypotenzie spojenej s dopaminergnou liečbou.
Neuroleptickýmalígnysyndróm
Po náhlom ukončení dopaminergnej terapie boli hlásené príznaky naznačujúce neuroleptický malígny syndróm (pozri časť 4.2).
Augmentácia
Hlásenia v literatúre naznačujú, že liečba iných indikácií dopamínergnými liekmi môže viesť k augmentácii. Augmentácia hovorí o skoršom začiatku príznakov večer (alebo aj poobede), zvýšeniu príznakov a rozšíreniu sa príznakov aj na iné končatiny.
Augmentácia sa špecificky sledovala hlavne v kontrolovaných klinických štúdiách trvajúcich viac ako
26 týždňov. Augmentácia sa pozorovala u 11,8% pacientov v skupine užívajúcej pramipexol (N=152)
a u 9,4% pacientov v skupine užívajúcej placebo (N=149). Kaplanova-Maierova analýza času nástupu augmentácie neukázala žiadny významý rozdiel medzi skupinou užívajúcou pramipexol a skupinou užívajúcou placebo.
4.5 Liekové a iné interakcie
Väzbanaplazmatickébielkoviny
U ľudí je pozorovaná malá biotransformácia a veľmi nízka (<20%) väzba pramipexolu na plazmatické bielkoviny. Preto je interakcia s inými liekmi pôsobiacimi na väzbu na plazmatické bielkoviny alebo na vylučovanie biotransformáciou nepravdepodobná. Pretože anticholínergiká sa vylučujú prevažne biotransformáciou, možnosť interakcie je obmedzená, hoci sa interakcia s anticholínergikami neskúmala. Neexistujú farmakokinetické interakcie so selegilínom ani levodopou.
Inhibítory/kompetítoryaktívnehorenálnehovylučovania
Cimetidín znižuje renálny klírens pramipexolu približne o 34%, pravdepodobne inhibíciou
katiónového vylučovacieho transportného systému renálnych tubulov. Preto lieky, ktoré sú inhibítormi tohto aktívneho renálneho vylučovania alebo sa vylučujú touto cestou, ako sú cimetidín,
amantadín, mexiletín, zidovudín, cisplatina, chinín a prokainamid môžu vzájomne reagovať s pramipexolom, čo má za následok zníženie klírensu pramipexolu.Ak sa tieto lieky podávajú súčasne, má sa zvážiť zníženie dávky pramipexolu.
Kombináciaslevodopou
Ak sa Oprymea podáva v kombinácii s levodopou, odporúča sa pri zvyšovaní dávky Oprymey znížiť dávku levodopy a dávkovanie ďalších antiparkinsoník sa má udržiavať konštantné.
Kvôli možným aditívnym vedľajším účinkom sa vyžaduje opatrnosť u pacientov užívajúcich iné sedatívne lieky alebo alkohol v kombinácii s pramipexolom.
Antipsychotiká
Treba sa vyhýbať súčasnému podávaniu antipsychotík s pramipexolom (pozri časť 4.4), napr. ak je možné očakávať antagonistický účinok.
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí sa neskúmal vplyv na priebeh gravidity a laktácie. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre gravidnú samicu (pozri časť
5.3). Oprymea sa nemá používať počas gravidity ak to nie je vyslovene nevyhnutné, t.j. ak možný prínos opodstatní možné riziko pre plod.
Laktácia
Keďže liečba pramipexolom inhibuje vylučovanie prolaktínu u ľudí, možno očakávať inhibíciu laktácie.Vylučovanie pramipexolu do materského mlieka u žien sa neskúmalo. U potkanov bola
koncentrácia rádioaktívne označeného liečiva vyššia v materskom mlieku ako v plazme. Pre chýbajúce údaje u ľudí sa Oprymea nemá užívať počas dojčenia. Ak je však jej užívanie nevyhnuté, dojčenie sa má prerušiť.
Fertilita
Neboli vykonané žiadne štúdie o vplyve na fertilitu u ľudí. V štúdiách na zvieratách, pramipexol ovplyvnil estrálne cykly a znížil fertilitu samičiek, tak ako sa očakávalo u dopamínového agonistu. Tieto štúdie nepreukázali priame alebo nepriame škodlivé účinky vzhľadom na samčiu fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Oprymea môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Môžu sa objaviť halucinácie alebo somnolencia.
Pacienti liečení Oprymeou, u ktorých sa vyskytne somnolencia a/alebo epizódy náhleho upadnutia do spánku, musia byť informovaní o tom, že nesmú viesť vozidlá alebo vykonávať činnosti, kde zníženie pozornosti môže znamenať riziko vážneho zranenia alebo smrti pacienta alebo jeho okolie (napr. obsluhovanie strojov) až dovtedy, kým neprekonajú takéto rekurentné epizódy a somnolenciu (pozri aj časti 4.4, 4.5 a 4.8).
4.8 Nežiaduce účinky
Očakávanénežiaduceúčinky
Pri užívaní Oprymea sa predpokladajú nasledovné nežiaduce účinky: neobvyklé sny, amnézia, príznaky poruchy správania-impulzívne a kompulzívne správanie, ako zvýšená chuť do jedla, patologické nakupovanie, hypersexualita a patologické hráčstvo; srdcové zlyhanie, stav zmätenosti, zápcha, ilúzie, závraty, dyskinéza, dyspnoe, únava, halucinácie, bolesť hlavy, štikútka, hyperkinéza, hyperfágia, hypotenzia, neprimeraná sekrécia antidiuretického hormónu, nespavosť, poruchy libida, nauzea, paranoja; periférny edém, pneumónia, svrbenie, vyrážka a iná hypersenzitivita, nepokoj, somnolencia, náhle nutkanie na spanie, synkopa, poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť, vracanie, zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti.
Z analýzy združených placebom kontrolovaných štúdií vyplýva, že pri porovnaní celkovo 1
923 pacientov užívajúcich pramipexol a 1 354 pacientov užívajúcich placebo boli nežiaduce účinky často hlásené u obidvoch skupín. 63 % pacientov užívajúcich pramipexol a 52 % pacientov užívajúcich placebo hlásili aspoň jeden nežiaduci účinok.
Tabuľky 1 a 2 zobrazujú frekvenciu výskytu nežiaducich účinkov pri placebom kontrolovaných klinických štúdiách. Nežiaduce účinky lieku uvedené v týchto tabuľkách sú tie, ktoré sa objavili u
0,1 alebo viac % pacientov liečených pramipexolom a boli hlásené signifikantne častejšie u pacientov užívajúcich pramipexol než u pacientov užívajúcich placebo alebo ak udalosť bola posúdená ako klinický relevantná. V každom prípade väčšina nežiaducich účinkov lieku bola mierna až stredne
závažná, zvyčajne sa začali na začiatku liečby a väčšinou mali tendenciu vymiznúť, dokonca aj pri
pokračujúcej liečbe.
V systéme orgánovej klasifikácie sú nežiaduce účinky evidované podľa výskytu (počet pacientov, u ktorého sa očakáva výskyt reakcie) použitím nasledujúcich kategórií: veľmi časté (≥ 1/10); časté (≥
1/100, < 1/10); menej časté (≥ 1/1 000, < 1/100); zriedkavé (≥ 1/10 000, < 1/1 000); veľmi zriedkavé
(< 1/10 000).
Parkinsonovachoroba,najčastejšienežiaduceúčinky
Najčastejšie hlásené nežiaduce účinky (≥5%) u pacientov s Parkinsonovou chorobou boli nauzea, dyskinéza, hypotenzia, závrat, ospanlivosť, nespavosť, zápcha, halucinácie, bolesť hlavy a únava, a boli hlásené častejšie pri liečbe pramipexolom ako pri liečbe placebom. Výskyt ospanlivosti sa zvyšuje pri dávkach vyšších ako 1,5 mg/deň (pozri časť 4.2). Častejšími nežiaducimi účinkami v


kombinácii s levodopou boli dyskinézy. Na začiatku liečby sa môže objaviť hypotenzia, najmä ak je pramipexol titrovaný príliš rýchlo.
Tabuľka 1: Parkinsonova choroba
Systém orgánovej klasifikácie Nežiaduci účinok
Infekcie a nákazy
Menej časté pneumónia
Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy
Časté abnormálne sny, príznaky poruchy správania-impulzívne a kompulzívne správanie, zmätenosť, halucinácie, nespavosť
Menej časté nadmerné prejedanie sa1, chorobné nakupovanie, delúzie, hyperfágia1, hypersexualita, poruchy libida, paranoja, patologické hráčstvo, nepokoj, delírium
Zriedkavé mánia
Poruchy nervového systému
Veľmi časté závraty, dyskinéza, somnolencia
Časté bolesť hlavy
Menej časté amnézia, hyperkinéza, epizódy náhleho spánku, synkopa
Poruchy oka
Časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava, periférny opuch
Laborátórne a funkčné vyšetrenia
Časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla
Menej časté zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže to byť aj menej. Presné stanovenie frekvencie výskytu nie je môžné, keďže nežiaduci účinok sa nevyskytol v databáze 2 762 pacientov
klinickej štúdie, ktorí trpeli Parkinsonovou chorobou a boli liečení pramipexolom.
Ináindikácia,najčastejšienežiaduceúčinkyNajčastejšie hlásené (≥ 5 %) nežiaduce účinky u pacientov s inou indikáciou liečených pramipexolom boli nauzea, bolesť hlavy, závraty a únava. Nauzea a únava boli častejšie hlásené u žien liečených s pramipexolom (20,8 %, respektíve 10,5 %) v porovnaní s mužmi (6,7 % respektíve 7,3 %).
Tabuľka 2: Iná indikácia
Systém orgánovej klasifikácie Nežiaduci účinok
Infekcie a nákazy
Menej časté pneumónia
1Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy

Časté abnormálne sny, nespavosť
Menej časté impulzívne a kompulzívne správanie ako je nadmerné prejedanie sa, chorobné nakupovanie, hypersexualita a patologické hráčstvo
1; zmätenosť, delúzie
1, halucinácie, hyperfágia
1, poruchy libida, paranoja
1, nepokoj, mánia1, delírium1
Poruchy nervového systému
Časté závraty, bolesť hlavy, ospanlivosť
Menej časté amnézia
1, dyskinéza, hyperkinéza
1, epizódy náhleho spánku, synkopa
Poruchy oka
Menej časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmezenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Menej časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava
Menej časté periférny opuch
Laborátórne a funkčné vyšetrenia
Menej časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže byť aj menej. Presné stanovenie frekvencie výskytu nie je môžné, keďže nežiaduci účinok sa nevyskytol v databáze 1 395 pacientov
klinickej štúdie, s inými indikáciami, ktorí boli liečení pramipexolom.
OspanlivosťPramipexol je spojený so somnolenciou (8,6 %), nadmerná spavosť počas dňa s epizódami náhleho upadnutia do spánku je menej častá (0,1 %). Pozri tiež časť 4.4.
PoruchylibidaPramipexol sa môže spájať s poruchami libida (zvýšené (0,1%) alebo znížené (0,4%) libido).
Poruchykontrolyimpulzov
U pacientov liečených dopamínovými agonistmi vrátane Oprymeou sa môže vyskytnúť patologické hráčstvo, zvýšené libido, hypersexualita, chorobné míňanie alebo nakupovanie, nenásytné jedenie a chorobné jedenie (pozri časť 4.4).
V prierezovej, retrospektívnej štúdii typu case-control zahŕňajúcej 3 090 pacientov s Parkinsonovou chorobou, 13,6% všetkých pacientov užívajúcich dopaminergnú a nedopaminergnú liečbu malo príznaky poruchy impulzívneho správania za posledných 6 mesiacov. Pozorovali sa prejavy vrátane patologického hráčstva, chorobného nakupovania, zvýšenej chuti do jedla a kompulzívneho sexuálneho správania (hypersexualita). Možné nezávislé rizikové faktory poruchy impulzívneho správania zahŕňali dopaminergnú liečbu a vyššie dávky dopaminergnej liečby, nižší vek (≤65 rokov), slobodný a pacientom uvedené hráčstvo v rodinnej anamnéze.
Srdcovézlyhanie
V klinických štúdiách a na základe skúseností po uvedení lieku na trh bolo u pacientov liečených pramipexolom hlásené srdcové zlyhanie. Vo farmakoepidemiologickej štúdii sa užívanie pramipexolu spájalo so zvýšeným rizikom výskytu srdcového zlyhania v porovnaní s pacientami, ktorí neužívali pramipexol (zistená miera rizika 1,86; 95 % Cl, 1,21-2,85).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
So závažným predávkovaním nie sú klinické skúsenosti. Očakávané nežiaduce účinky by súviseli s farmakodynamickým profilom dopamínových agonistov, vrátane nauzey, vracania, hyperkinézy, halucinácií, nepokoja a hypotenzie. Pre predávkovanie dopamínovými agonistami nie je stanovená protilátka. Ak sa vyskytnú príznaky stimulácie centrálneho nervového systému, môže byť indikované podanie neuroleptík. Zvládnutie predávkovania môže vyžadovať všeobecné podporné opatrenia spolu s výplachom žalúdka, intravenóznym podaním tekutín, podaním aktívneho uhlia a monitorovaním EKG.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiparkinsonikum, agonisty dopamínu, ATC kód: N04BC05. Mechanizmusúčinku
Pramipexol je dopamínový agonista, ktorý sa viaže s veľkou selektívnosťou a špecifickosťou na dopamínové receptory podtriedy D2 a má prednostnú afinitu k D3 receptorom. Má plnú vnútornú aktivitu.
Pramipexol zmierňuje parkinsonovský motorický deficit stimuláciou dopamínových receptorov v striate. Pokusy na zvieratách ukázali, že pramipexol inhibuje syntézu dopamínu, jeho vylučovanie a premenu.
Farmakodynamickéúčinky
U zdravých dobrovoľníkov sa pozorovalo zníženie sekrécie prolaktínu v závislosti od dávky.
Klinická účinnosťabezpečnosť priParkinsonovejchorobe
U pacientov užívajúcich pramipexol sa zmiernili príznaky a symptómy idiopatickej Parkinsonovej
choroby. Kontrolované klinické štúdie zahrňovali približne 1 800 pacientov v štádiu I–IV podľa Hoehna a Yahra. Okrem nich bolo približne 1 000 pacientov v pokročilejších štádiách, ktorí užívali súčasne levodopu a mali motorické komplikácie.
Pri ranej a pokročilej Parkinsonovej chorobe bola účinnosť pramipexolu v kontrolovaných klinických štúdiách udržiavaná na rovnakej úrovni po dobu približne 6 mesiacov. V otvorených pokračujúcich štúdiách trvajúcich viac ako 3 roky sa nezaznamenali znaky klesajúcej účinnosti.
V kontrolovanej dvojročnej dvojito zaslepenej štúdii, začatie liečby pramipexolom výrazne oddialilo nástup motorických komplikácií a znížilo ich výskyt v porovnaní so začatím liečby levodopou. Toto oddialenie nástupu motorických komplikácií pri pramipexole vyrovnáva výraznejšie zlepšenie motorických funkcií pri levodope (merané ako stredná hodnota zmeny v UPDRS škále). Celkový výskyt halucinácií a somnolencie bol všeobecne vyšší vo fáze zvyšovania dávky v skupine užívajúcej pramipexol. Avšak počas udržiavacej fázy sa výrazný rozdiel nezaznamenal. Tieto skutočnosti sa majú
zvážiť, keď sa u pacientov s Parkinsonovou chorobou začína liečba pramipexolom.
Detiadospievajúci
Európska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií pre pramipexol
s ohľadom na všetky vekové podskupiny detí a dospievajúcich s Parkinsonovou chorobou (pozri čať
4.2 pre informáciu o pediatrickom použití).
Klinická účinnosťabezpečnosťpriTourettovomsyndróme
Účinnosť pramipexolu (0,0625-0,5 mg/deň) u pediatrických pacientov s Tourettovým syndrómom vo
veku 6-17 rokov sa hodnotila v 6-týždňovej, dvojito zaslepenej, randomizovanej, placebom
kontrolovanej štúdii s flexibilnou dávkou lieku. Celkovo sa randomizovalo 63 pacientov (43 užívalo pramipexol, 20 placebo). Primárny cieľový výsledok bola zmena základných hodnôt celkového skóre tikov (TTS) podľa Yaleovej celkovej škály závažnosti tikov (YGTSS). Nepozoroval sa žiaden rozdiel medzi skupinou užívajúcou pramipexol a skupinou užívajúcou placebo, či už v primárnom cieľovom výsledku alebo v ktoromkoľvek sekundárnom cieľovom výsledku účinnosti lieku vrátane celkového skóre YGTSS, celkového obrazu pacienta o zlepšení stavu (PGI-I), celkového klinického obrazu o zlepšení stavu (CGI-I) alebo celkového klinického obrazu o závažnosti choroby (CGI-S). Nežiaduce udalosti, ktoré sa vyskytli aspoň u 5% pacientov v skupine užívajúcej pramipexol a ktoré boli častejšie u pacientov užívajúcich pramipexol ako u pacientov užívajúcich placebo, boli: bolesti hlavy (27,9%, placebo 25,0%), ospanlivosť (7,0%, placebo 5,0%), nauzea (18,6%, placebo 10,0%), vracanie (11,6%, placebo 0,0%), bolesť v hornej časti brucha (7,0%, placebo 5,0%), ortostatická hypotenzia (9,3%, placebo 5,0%), myalgia (9,3%;placebo 5,0%), poruchy spánku (7,0%, placebo 5,0%), dyspnoe (7,0%, placebo 0,0%) a infekcie horných dýchacích ciest (7,0%; placebo 5,0%). Ostatné významné nežiaduce udalosti u pacientov užívajúcich pramipexol, vedúce k prerušeniu podávania sledovaného lieku, bol stav zmätenosti, poruchy reči a zhoršujúci sa stav (pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorbcia
Pramipexol sa po perorálnom podaní absorbuje rýchlo a úplne. Absolútna biologická dostupnosť je
vyššia ako 90 % a maximálne plazmatické koncentrácie sa objavujú po 1 až 3 hodinách. Súčasné podanie s jedlom neznižovalo množstvo absorbovaného pramipexolu, ale znižovalo rýchlosť absorpcie. Pramipexol preukazuje lineárnu kinetiku a malý rozdiel v plazmatických hladinách medzi jednotlivými pacientmi.
Distribúcia
U ľudí je väzba pramipexolu na bielkoviny veľmi nízka (<20 %) a distribučný objem je rozsiahly
(400 l). Vysoké koncentrácie v mozgovom tkanive sa pozorovali u potkanov (približne 8-násobok koncentrácie v plazme).
Biotransformácia
Pramipexol sa u ľudí metabolizuje len v malom rozsahu.
Eliminácia
Hlavnou cestou vylučovania je renálna exkrécia nezmeneného pramipexolu. Približne 90 % dávky označenej 14C sa vylúči obličkami a menej ako 2% sa nachádza v stolici. Celkový klírens pramipexolu je približne 500 ml/min a renálny klírens je približne 400 ml/min. Eliminačný polčas (t¹/2) kolíše od
8 hodín u mladých do 12 hodín u starších pacientov.
5.3 Predklinické údaje o bezpečnosti
Štúdie toxicity po opakovanom podaní ukázali, že pramipexol má vplyv prevažne na funkcie CNS a ženského reprodukčného systému, pravdepodobne v dôsledku svojho zvýšeného farmakodynamického účinku.
U miniprasiat sa zaznamenalo zníženie diastolického i systolického tlaku a pokles tepovej frekvencie.
Sklon k hypotenznému účinku sa zaznamenal u opíc.
U potkanov a králikov boli sledované možné účinky pramipexolu na reprodukčnú funkciu. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre gravidné samice. V dôsledku výberu živočíšnych druhov a obmedzených sledovaných parametrov, nežiaduce účinky pramipexolu na graviditu a mužskú fertilitu neboli plne objasnené.
U potkanov sa pozorovalo oneskorenie pohlavného vývoja (t.j. oddelenie predkožky a vaginálneho vchodu). Relevantnosť týchto zistení pre ľudí nie je známa.
Pramipexol nebol genotoxický. V štúdii karcinogenity sa u samcov potkanov rozvinula hyperplázia Leydigových buniek a adenómy, ktoré sa vysvetľujú inhibičným účinkom pramipexolu na prolaktín. Tento nález nie je klinicky relevantný pre človeka. Rovnaká štúdia tiež preukázala, že pri dávkach pramipexolu 2 mg/kg (vo forme soli) a vyšších sa u albínskych potkanov pozorovala degenerácia sietnice. Tento posledný nález sa však nepozoroval u pigmentovaných potkanov, ako ani pri dvojročnej štúdii karcinogenity u albínskych myší či iných sledovaných živočíšnych druhov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol
Kukuričný škrob
Predželatinovaný kukuričný škrob
Povidón K25
Bezvodý koloidný oxid kremičitý
Magnéziumstearát
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
Blister (ALU/ALU fólia): 20, 30, 60, 90 alebo 100 tabliet, v škatuľke. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky na likvidáciu.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
KRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Slovinsko
8. REGISTRAČNÉ ČÍSLA
20 tabliet: EU/1/08/469/016
30 tabliet: EU/1/08/469/017
60 tabliet: EU/1/08/469/018
90 tabliet: EU/1/08/469/019
100 tabliet: EU/1/08/469/020
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12. septembra 2008
Dátum posledného predĺženia registrácie: 09. apríl 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Oprymea 1,1 mg tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá tableta obsahuje 1,1 mg pramipexolu (čo zodpovedá 1,5 mg monohydrate pramipexoliumdichloridu).
Prosím, venujte pozornosť:
Dávky pramipexolu, ktoré sú uvedené v literatúre, sa vzťahujú na pramipexol vo forme soli. Preto budú dávky uvádzané pre bázu pramipexolu, ako aj pre soľ pramipexolu (v zátvorkách).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tableta.
Biele, okrúhle, so skosenými hranami, s deliacimi ryhami na oboch stranách. Tableta sa môže rozdeliť na rovnaké polovice.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Oprymea je určená na liečbu príznakov a symptómov idiopatickej Parkinsonovej choroby, buď samostatne (bez levodopy) alebo v kombinácii s levodopou, t.j. v priebehu choroby, vrátane jej neskorých štádií, keď účinok levodopy slabne alebo sa stáva nepravidelný a objavujú sa výkyvy liečebného účinku (end of dose – na konci dávkovacieho intervalu alebo striedanie stavov „on-off“).
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Parkinsonovachoroba
Denná dávka sa podáva rozdelená na tri rovnaké časti.
Začiatok liečby:
Dávka sa má zvyšovať postupne, každých 5–7 dní, so začiatočnou dávkou 0,264 mg bázy (0,375 mg soli) denne. Potrebná dávka sa má titrovať tak, aby došlo k maximálnemu liečebnému efektu, za predpokladu, že sa u pacientov neprejavia netolerovateľné nežiaduce účinky.
Vzostupne – dávkovacia schéma Oprymea
Týždeň Dávka
(mg bázy)
Celková denná dávka
(mg bázy)
Dávka
(mg soli)
Celková denná dávka
(mg soli)

1 3 x 0,088 0,264 3 x 0,125 0,375
2 3 x 0,18 0,54 3 x 0,25 0,75
3 3 x 0,35 1,1 3 x 0,5 1,50
Ak je potrebné ďalšie zvyšovanie dennej dávky, má sa zvyšovať po 0,54 mg bázy (0,75 mg soli) v
týždňových intervaloch až do maximálnej dennej dávky 3,3 mg bázy (4,5 mg soli).
Treba však poznamenať, že pri dávkach vyšších ako 1,5 mg/deň sa zvyšuje výskyt somnolencie (pozri časť 4.8).
Udržiavacia liečba:
Individuálna dávka má byť v rozmedzí od 0,264 mg bázy (0,375 mg soli) maximálne do 3,3 mg bázy (4,5 mg soli) denne. Pri zvyšovaní dávky v troch pivotných štúdiách sa účinnosť pozorovala po dosiahnutí dennej dávky 1,1 mg bázy (1,5 mg soli). Ďalšia úprava dávkovania má byť založená na klinickej odpovedi a na výskyte nežiaducich účinkov. V klinických štúdiách bolo približne 5% pacientov liečených dávkami menšími ako 1,1 mg bázy (1,5 mg soli). Pri pokročilej Parkinsonovej chorobe môžu byť dávky vyššie ako 1,1 mg bázy (1,5 mg soli) denne užitočné u pacientov, u ktorých sa predpokladá redukcia dávok levodopy. Odporúča sa, aby sa dávkovanie levodopy znižovalo tak počas zvyšovania dávky ako aj pri udržiavacej liečbe Oprymeou, v závislosti od odpovede jednotlivých pacientov (pozri časť 4.5).
Prerušenieliečby:
Náhle prerušenie dopaminergnej terapie môže viesť k rozvoju neuroleptického malígneho syndrómu. Postupne sa má znižovať dávka pramipexolu po 0,54 mg bázy (0,75 mg soli) denne až do dosiahnutia dennej dávky zredukovanej na 0,54 mg bázy (0,75 mg soli). Potom sa dávka znižuje po 0,264 mg bázy (0,375 mg soli) denne (pozri časť 4.4).
Pacienti s poruchou funkcieobličiek:
Vylučovanie pramipexolu závisí od funkcie obličiek. Pre začiatokliečby sa navrhuje nasledovná schéma dávkovania:
U pacientov s klírensom kreatinínu nad 50 ml/min sa nevyžaduje zníženie dennej dávky alebo frekvencie dávkovania.
U pacientov s hodnotami klírensu kreatinínu medzi 20 a 50 ml/min sa má počiatočná denná dávka Oprymey podávať rozdelená na dve časti, začínajúc pri 0,088 mg bázy (0,125 mg soli) dvakrát denne (0,176 mg bázy/0,25 mg soli denne). Maximálna denná dávka 1,57 mg bázy pramipexolu (2,25 mg soli) sa nemá prekročiť.
Pacientom s klírensom kreatinínu nižším ako 20 ml/min sa má denná dávka Oprymey podávať jednorazovo, v dávke začínajúcej od 0,088 mg bázy (0,125 mg soli) denne. Maximálna denná dávka
1,1 mg bázy pramipexolu (1,5 mg soli) sa nemá prekročiť.
Ak počas udržiavacej terapie dôjde k poklesu funkcie obličiek, denná dávka Oprymey sa má znížiť percentuálne v rovnakom rozsahu, ako sa znížil klírens kreatinínu, t.j. ak sa klírens kreatinínu znížil o 30 %, potom redukujte dennú dávku Oprymey o 30%. Ak je klírens kreatinínu medzi 20
a 50 ml/min, denná dávka môže byť rozdelená na dve časti, a ak je klírens kreatinínu nižší ako
20 ml/min, denná dávka sa podáva jednorazovo.
Pacienti s poruchou funkcie pečene
Úprava dávky u pacientov so zlyhaním pečene pravdepodobne nie je nevyhnutná, pretože približne
90 % absorbovaného liečiva sa vylučuje obličkami. Možný vplyv insuficiencie pečene na farmakokinetiku Oprymey sa však neskúmal.
Pediatrická populácia
Bezpečnosť a účinnosť Oprymey u detí do 18 rokov sa nesledovala. Nie je žiadne opodstatnenie pre používanie Oprymey u detí s Parkinsonovou chorobou.
Tourettov syndróm
Pediatrická populácia
Užívanie Oprymey u detí a dospievajúcich do 18 rokov sa neodporúča, keďže účinnosť a bezpečnosť
sa v tejto populácii nestanovila. Oprymea sa nemá používať u detí alebo dospievajúcich s Tourettovým
syndrómom kvôli negatívnemu pomeru prínos–riziko pre toto ochorenie (pozri časť 5.1).
Spôsobpodávania
Tablety sa užívajú perorálne, zapíjajú sa vodou, môžu sa užívať s jedlom alebo bez neho.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pri predpisovaní tabliet Oprymea pacientom s Parkinsonovou chorobou a s poruchou funkcie obličiek sa odporúča znížené dávkovanie podľa časti 4.2.
Halucinácie
Pri liečbe dopamínovými agonistami a levodopou sú známym nežiaducim účinkom halucinácie. Pacienti majú byť informovaní, že sa môžu objaviť (prevažne vizuálne) halucinácie.
Dyskinéza
Pri pokročilej Parkinsonovej chorobe sa pri kombinovanej liečbe s levodopou môžu počas začiatočnej titrácie dávky Oprymey objaviť dyskinézy. Ak sa objavia, dávka levodopy sa má znížiť.
Epizódynáhlehospánkuasomnolencia
Pramipexol sa spája so somnolenciou a epizódami náhleho upadnutia do spánku, obzvlášť u pacientov
s Parkinsonovou chorobou. Menej často sa zaznamenalo náhle upadnutie do spánku počas bežných denných aktivít, niekedy bez toho, aby si to pacient uvedomil alebo pocítil varovné príznaky. Pacienti o tom musia byť informovaní a oboznámení s tým, že počas užívania Oprymey musia byť opatrní počas vedenia vozidiel alebo pri obsluhe strojov. Pacienti, ktorí už mali problémy so somnolenciou a/alebo epizódami náhleho upadnutia do spánku, nesmú viesť vozidlá alebo obsluhovať stroje. Okrem toho je potrebné zvážiť zníženie dávky alebo ukončenie liečby. Keď pacienti užívajú v kombinácii s pramipexolom aj ďalšie sedatívne lieky alebo alkohol musia byť oboznámení s tým, že majú byť opatrní, kvôli možným aditívnym vedľajším účinkom (pozri časti 4.5 4.7 a 4.8).
Poruchykontrolyimpulzov
Pacienti majú byť pravidelne monitorovaní z dôvodu vývoja porúch kontroly impulzov. Pacienti a opatrovatelia majú byť upovedomení, že u pacientov liečených dopamínovými agonistmi vrátane pramipexolu sa môžu vyskytnúť behaviorálne symptómy porúch kontroly impulzov zahŕňajúce patologické hráčstvo, zvýšené libido, hypersexualitu, chorobné míňanie alebo nakupovanie, nenásytné jedenie a chorobné jedenie. Ak sa vyvinú takéto symptómy, má sa zvážiť zníženie dávky/postupné vysadenie lieku.
Mániaadelírium
Má sa pravidelne sledovať, či sa u pacientov nevyvinie mánia a delírium. Pacienti a ošetrovatelia sa majú informovať, že u pacientov liečených pramipexolom sa môže vyskytnúť mánia a delírium. Ak sa vyvinú tieto príznaky, má sa zvážiť zníženie dávky/postupné prerušenie liečby.
Pacientispsychotickýmiporuchami
Pacienti s psychotickými poruchami majú byť liečení agonistami dopamínu len vtedy, ak očakávaný
prínos prevýši možné riziká.
Je nutné vyvarovať sa súčasného podávania pramipexolu a antipsychotických liekov (pozri časť 4.5). Oftalmologickésledovanie
Odporúča sa oftalmologické sledovanie v pravidelných intervaloch alebo aj v prípade výskytu porúch
zraku.
Závažnékardiovaskulárneochorenie
V prípade závažného kardiovaskulárneho ochorenia sa má zvýšiť starostlivosť. Odporúča sa sledovať krvný tlak, najmä na začiatku liečby, vzhľadom na všeobecné riziko posturálnej hypotenzie spojenej s dopaminergnou liečbou.
Neuroleptickýmalígnysyndróm
Po náhlom ukončení dopaminergnej terapie boli hlásené príznaky naznačujúce neuroleptický malígny syndróm (pozri časť 4.2).
Augmentácia
Hlásenia v literatúre naznačujú, že liečba iných indikácií dopamínergnými liekmi môže viesť k augmentácii. Augmentácia hovorí o skoršom začiatku príznakov večer (alebo aj poobede), zvýšeniu príznakov a rozšíreniu sa príznakov aj na iné končatiny.
Augmentácia sa špecificky sledovala hlavne v kontrolovaných klinických štúdiách trvajúcich viac ako
26 týždňov. Augmentácia sa pozorovala u 11,8% pacientov v skupine užívajúcej pramipexol (N=152)
a u 9,4% pacientov v skupine užívajúcej placebo (N=149). Kaplanova-Maierova analýza času nástupu augmentácie neukázala žiadny významý rozdiel medzi skupinou užívajúcou pramipexol a skupinou užívajúcou placebo.
4.5 Liekové a iné interakcie
Väzbanaplazmatickébielkoviny
U ľudí je pozorovaná malá biotransformácia a veľmi nízka (<20%) väzba pramipexolu na plazmatické bielkoviny. Preto je interakcia s inými liekmi pôsobiacimi na väzbu na plazmatické bielkoviny alebo na vylučovanie biotransformáciou nepravdepodobná. Pretože anticholínergiká sa vylučujú prevažne biotransformáciou, možnosť interakcie je obmedzená, hoci sa interakcia s anticholínergikami neskúmala. Neexistujú farmakokinetické interakcie so selegilínom ani levodopou.
Inhibítory/kompetítoryaktívnehorenálnehovylučovania
Cimetidín znižuje renálny klírens pramipexolu približne o 34 %, pravdepodobne inhibíciou katiónového vylučovacieho transportného systému renálnych tubulov. Preto lieky, ktoré sú inhibítormi tohto aktívneho renálneho vylučovania alebo sa vylučujú touto cestou, ako sú cimetidín,
amantadín, mexiletín, zidovudín, cisplatina, chinín a prokainamid môžu vzájomne reagovať s pramipexolom, čo má za následok zníženie klírensu pramipexolu.Ak sa tieto lieky podávajú súčasne, má sa zvážiť zníženie dávky pramipexolu.
Kombináciaslevodopou
Ak sa Oprymea podáva v kombinácii s levodopou, odporúča sa pri zvyšovaní dávky Oprymey znížiť dávku levodopy a dávkovanie ďalších antiparkinsoník sa má udržiavať konštantné.
Kvôli možným aditívnym vedľajším účinkom sa vyžaduje opatrnosť u pacientov užívajúcich iné sedatívne lieky alebo alkohol v kombinácii s pramipexolom.
Antipsychotiká
Treba sa vyhýbať súčasnému podávaniu antipsychotík s pramipexolom (pozri časť 4.4), napr. ak je možné očakávať antagonistický účinok.
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí sa neskúmal vplyv na priebeh gravidity a laktácie. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre gravidnú samicu (pozri časť
5.3). Oprymea sa nemá používať počas gravidity ak to nie je vyslovene nevyhnutné, t.j. ak možný prínos opodstatní možné riziko pre plod.
Laktácia
Keďže liečba pramipexolom inhibuje vylučovanie prolaktínu u ľudí, možno očakávať inhibíciu laktácie.Vylučovanie pramipexolu do materského mlieka u žien sa neskúmalo. U potkanov bola
koncentrácia rádioaktívne označeného liečiva vyššia v materskom mlieku ako v plazme. Pre chýbajúce údaje u ľudí sa Oprymea nemá užívať počas dojčenia. Ak je však jej užívanie nevyhnuté, dojčenie sa má prerušiť.
Fertilita
Neboli vykonané žiadne štúdie o vplyve na fertilitu u ľudí. V štúdiách na zvieratách, pramipexol ovplyvnil estrálne cykly a znížil fertilitu samičiek, tak ako sa očakávalo u dopamínového agonistu. Tieto štúdie nepreukázali priame alebo nepriame škodlivé účinky vzhľadom na samčiu fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Oprymea môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Môžu sa objaviť halucinácie alebo somnolencia.
Pacienti liečení Oprymeou, u ktorých sa vyskytne somnolencia a/alebo epizódy náhleho upadnutia do spánku, musia byť informovaní o tom, že nesmú viesť vozidlá alebo vykonávať činnosti, kde zníženie pozornosti môže znamenať riziko vážneho zranenia alebo smrti pacienta alebo jeho okolie (napr. obsluhovanie strojov) až dovtedy, kým neprekonajú takéto rekurentné epizódy a somnolenciu (pozri aj časti 4.4, 4.5 a 4.8).
4.8 Nežiaduce účinky
Očakávanénežiaduceúčinky
Pri užívaní Oprymea sa predpokladajú nasledovné nežiaduce účinky: neobvyklé sny, amnézia, príznaky poruchy správania-impulzívne a kompulzívne správanie, ako zvýšená chuť do jedla, patologické nakupovanie, hypersexualita a patologické hráčstvo; srdcové zlyhanie, stav zmätenosti, zápcha, ilúzie, závraty, dyskinéza, dyspnoe, únava, halucinácie, bolesť hlavy, štikútka, hyperkinéza, hyperfágia, hypotenzia, neprimeraná sekrécia antidiuretického hormónu, nespavosť, poruchy libida, nauzea, paranoja; periférny edém, pneumónia, svrbenie, vyrážka a iná hypersenzitivita, nepokoj, somnolencia, náhle nutkanie na spanie, synkopa, poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť, vracanie, zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti.
Z analýzy združených placebom kontrolovaných štúdií vyplýva, že pri porovnaní celkovo 1
923 pacientov užívajúcich pramipexol a 1 354 pacientov užívajúcich placebo boli nežiaduce účinky často hlásené u obidvoch skupín. 63 % pacientov užívajúcich pramipexol a 52 % pacientov užívajúcich placebo hlásili aspoň jeden nežiaduci účinok.
Tabuľky 1 a 2 zobrazujú frekvenciu výskytu nežiaducich účinkov pri placebom kontrolovaných klinických štúdiách. Nežiaduce účinky lieku uvedené v týchto tabuľkách sú tie, ktoré sa objavili u
0,1 alebo viac % pacientov liečených pramipexolom a boli hlásené signifikantne častejšie u pacientov užívajúcich pramipexol než u pacientov užívajúcich placebo alebo ak udalosť bola posúdená ako klinický relevantná. V každom prípade väčšina nežiaducich účinkov lieku bola mierna až stredne
závažná, zvyčajne sa začali na začiatku liečby a väčšinou mali tendenciu vymiznúť, dokonca aj pri
pokračujúcej liečbe.
V systéme orgánovej klasifikácie sú nežiaduce účinky evidované podľa výskytu (počet pacientov, u ktorého sa očakáva výskyt reakcie) použitím nasledujúcich kategórií: veľmi časté (≥ 1/10); časté (≥
1/100, < 1/10); menej časté (≥ 1/1 000, < 1/100); zriedkavé (≥ 1/10 000, < 1/1 000); veľmi zriedkavé
(< 1/10 000).
Parkinsonovachoroba,najčastejšienežiaduceúčinky
Najčastejšie hlásené nežiaduce účinky (≥5%) u pacientov s Parkinsonovou chorobou boli nauzea, dyskinéza, hypotenzia, závrat, ospanlivosť, nespavosť, zápcha, halucinácie, bolesť hlavy a únava, a boli hlásené častejšie pri liečbe pramipexolom ako pri liečbe placebom. Výskyt ospanlivosti sa zvyšuje pri dávkach vyšších ako 1,5 mg/deň (pozri časť 4.2). Častejšími nežiaducimi účinkami v


kombinácii s levodopou boli dyskinézy. Na začiatku liečby sa môže objaviť hypotenzia, najmä ak je pramipexol titrovaný príliš rýchlo.
Tabuľka 1: Parkinsonova choroba
Systém orgánovej klasifikácie Nežiaduci účinok
Infekcie a nákazy
Menej časté pneumónia
Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy
Časté abnormálne sny, príznaky poruchy správania-impulzívne a kompulzívne správanie, zmätenosť, halucinácie, nespavosť
Menej časté nadmerné prejedanie sa1, chorobné nakupovanie, delúzie, hyperfágia1, hypersexualita, poruchy libida, paranoja, patologické hráčstvo, nepokoj, delírium
Zriedkavé mánia
Poruchy nervového systému
Veľmi časté závraty, dyskinéza, somnolencia
Časté bolesť hlavy
Menej časté amnézia, hyperkinéza, epizódy náhleho spánku, synkopa
Poruchy oka
Časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava, periférny opuch
Laborátórne a funkčné vyšetrenia
Časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla
Menej časté zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže to byť aj menej. Presné stanovenie frekvencie výskytu nie je môžné, keďže nežiaduci účinok sa nevyskytol v databáze 2 762 pacientov
klinickej štúdie, ktorí trpeli Parkinsonovou chorobou a boli liečení pramipexolom.
Ináindikácia,najčastejšienežiaduceúčinkyNajčastejšie hlásené (≥ 5 %) nežiaduce účinky u pacientov s inou indikáciou liečených pramipexolom boli nauzea, bolesť hlavy, závraty a únava. Nauzea a únava boli častejšie hlásené u žien liečených s pramipexolom (20,8 %, respektíve 10,5 %) v porovnaní s mužmi (6,7 % respektíve 7,3 %).
Tabuľka 2: Iná indikácia
Systém orgánovej klasifikácie Nežiaduci účinok
Infekcie a nákazy
Menej časté pneumónia
1Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy

Časté abnormálne sny, nespavosť
Menej časté impulzívne a kompulzívne správanie ako je nadmerné prejedanie sa, chorobné nakupovanie, hypersexualita a patologické hráčstvo
1; zmätenosť, delúzie
1, halucinácie, hyperfágia
1, poruchy libida, paranoja
1, nepokoj, mánia1, delírium1
Poruchy nervového systému
Časté závraty, bolesť hlavy, ospanlivosť
Menej časté amnézia
1, dyskinéza, hyperkinéza
1, epizódy náhleho spánku, synkopa
Poruchy oka
Menej časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmezenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Menej časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava
Menej časté periférny opuch
Laborátórne a funkčné vyšetrenia
Menej časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže byť aj menej. Presné stanovenie frekvencie výskytu nie je môžné, keďže nežiaduci účinok sa nevyskytol v databáze 1 395 pacientov
klinickej štúdie, s inými indikáciami, ktorí boli liečení pramipexolom.
OspanlivosťPramipexol je spojený so somnolenciou (8,6 %), nadmerná spavosť počas dňa s epizódami náhleho upadnutia do spánku je menej častá (0,1 %). Pozri tiež časť 4.4.
PoruchylibidaPramipexol sa môže spájať s poruchami libida (zvýšené (0,1%) alebo znížené (0,4%) libido).
Poruchykontrolyimpulzov
U pacientov liečených dopamínovými agonistmi vrátane Oprymeou sa môže vyskytnúť patologické hráčstvo, zvýšené libido, hypersexualita, chorobné míňanie alebo nakupovanie, nenásytné jedenie a chorobné jedenie (pozri časť 4.4).
V prierezovej, retrospektívnej štúdii typu case-control zahŕňajúcej 3 090 pacientov s Parkinsonovou chorobou, 13,6% všetkých pacientov užívajúcich dopaminergnú a nedopaminergnú liečbu malo príznaky poruchy impulzívneho správania za posledných 6 mesiacov. Pozorovali sa prejavy vrátane patologického hráčstva, chorobného nakupovania, zvýšenej chuti do jedla a kompulzívneho sexuálneho správania (hypersexualita). Možné nezávislé rizikové faktory poruchy impulzívneho správania zahŕňali dopaminergnú liečbu a vyššie dávky dopaminergnej liečby, nižší vek (≤65 rokov), slobodný a pacientom uvedené hráčstvo v rodinnej anamnéze.
Srdcovézlyhanie
V klinických štúdiách a na základe skúseností po uvedení lieku na trh bolo u pacientov liečených pramipexolom hlásené srdcové zlyhanie. Vo farmakoepidemiologickej štúdii sa užívanie pramipexolu spájalo so zvýšeným rizikom výskytu srdcového zlyhania v porovnaní s pacientami, ktorí neužívali pramipexol (zistená miera rizika 1,86; 95 % Cl, 1,21-2,85).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
So závažným predávkovaním nie sú klinické skúsenosti. Očakávané nežiaduce účinky by súviseli s farmakodynamickým profilom dopamínových agonistov, vrátane nauzey, vracania, hyperkinézy, halucinácií, nepokoja a hypotenzie. Pre predávkovanie dopamínovými agonistami nie je stanovená protilátka. Ak sa vyskytnú príznaky stimulácie centrálneho nervového systému, môže byť indikované podanie neuroleptík. Zvládnutie predávkovania môže vyžadovať všeobecné podporné opatrenia spolu s výplachom žalúdka, intravenóznym podaním tekutín, podaním aktívneho uhlia a monitorovaním EKG.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiparkinsonikum, agonisty dopamínu, ATC kód: N04BC05. Mechanizmusúčinku
Pramipexol je dopamínový agonista, ktorý sa viaže s veľkou selektívnosťou a špecifickosťou na dopamínové receptory podtriedy D2 a má prednostnú afinitu k D3 receptorom. Má plnú vnútornú aktivitu.
Pramipexol zmierňuje parkinsonovský motorický deficit stimuláciou dopamínových receptorov v striate. Pokusy na zvieratách ukázali, že pramipexol inhibuje syntézu dopamínu, jeho vylučovanie a premenu.
Farmakodynamickéúčinky
U zdravých dobrovoľníkov sa pozorovalo zníženie sekrécie prolaktínu v závislosti od dávky.
Klinická účinnosťabezpečnosťpriParkinsonovejchorobe
U pacientov užívajúcich pramipexol sa zmiernili príznaky a symptómy idiopatickej Parkinsonovej
choroby. Kontrolované klinické štúdie zahrňovali približne 1 800 pacientov v štádiu I–IV podľa Hoehna a Yahra. Okrem nich bolo približne 1 000 pacientov v pokročilejších štádiách, ktorí užívali súčasne levodopu a mali motorické komplikácie.
Pri ranej a pokročilej Parkinsonovej chorobe bola účinnosť pramipexolu v kontrolovaných klinických štúdiách udržiavaná na rovnakej úrovni po dobu približne 6 mesiacov. V otvorených pokračujúcich štúdiách trvajúcich viac ako 3 roky sa nezaznamenali znaky klesajúcej účinnosti.
V kontrolovanej dvojročnej dvojito zaslepenej štúdii, začatie liečby pramipexolom výrazne oddialilo nástup motorických komplikácií a znížilo ich výskyt v porovnaní so začatím liečby levodopou. Toto oddialenie nástupu motorických komplikácií pri pramipexole vyrovnáva výraznejšie zlepšenie motorických funkcií pri levodope (merané ako stredná hodnota zmeny v UPDRS škále). Celkový výskyt halucinácií a somnolencie bol všeobecne vyšší vo fáze zvyšovania dávky v skupine užívajúcej pramipexol. Avšak počas udržiavacej fázy sa výrazný rozdiel nezaznamenal. Tieto skutočnosti sa majú
zvážiť, keď sa u pacientov s Parkinsonovou chorobou začína liečba pramipexolom.
Detiadospievajúci
Európska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií pre pramipexol
s ohľadom na všetky vekové podskupiny detí a dospievajúcich s Parkinsonovou chorobou (pozri čať
4.2 pre informáciu o pediatrickom použití).
Klinická účinnosťabezpečnosťpriTourettovomsyndróme
Účinnosť pramipexolu (0,0625-0,5 mg/deň) u pediatrických pacientov s Tourettovým syndrómom vo
veku 6-17 rokov sa hodnotila v 6-týždňovej, dvojito zaslepenej, randomizovanej, placebom
kontrolovanej štúdii s flexibilnou dávkou lieku. Celkovo sa randomizovalo 63 pacientov (43 užívalo pramipexol, 20 placebo). Primárny cieľový výsledok bola zmena základných hodnôt celkového skóre tikov (TTS) podľa Yaleovej celkovej škály závažnosti tikov (YGTSS). Nepozoroval sa žiaden rozdiel medzi skupinou užívajúcou pramipexol a skupinou užívajúcou placebo, či už v primárnom cieľovom výsledku alebo v ktoromkoľvek sekundárnom cieľovom výsledku účinnosti lieku vrátane celkového skóre YGTSS, celkového obrazu pacienta o zlepšení stavu (PGI-I), celkového klinického obrazu o zlepšení stavu (CGI-I) alebo celkového klinického obrazu o závažnosti choroby (CGI-S). Nežiaduce udalosti, ktoré sa vyskytli aspoň u 5% pacientov v skupine užívajúcej pramipexol a ktoré boli častejšie u pacientov užívajúcich pramipexol ako u pacientov užívajúcich placebo, boli: bolesti hlavy (27,9%, placebo 25,0%), ospanlivosť (7,0%, placebo 5,0%), nauzea (18,6%, placebo 10,0%), vracanie (11,6%, placebo 0,0%), bolesť v hornej časti brucha (7,0%, placebo 5,0%), ortostatická hypotenzia (9,3%, placebo 5,0%), myalgia (9,3%;placebo 5,0%), poruchy spánku (7,0%, placebo 5,0%), dyspnoe (7,0%, placebo 0,0%) a infekcie horných dýchacích ciest (7,0%; placebo 5,0%). Ostatné významné nežiaduce udalosti u pacientov užívajúcich pramipexol, vedúce k prerušeniu podávania sledovaného lieku, bol stav zmätenosti, poruchy reči a zhoršujúci sa stav (pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorbcia
Pramipexol sa po perorálnom podaní absorbuje rýchlo a úplne. Absolútna biologická dostupnosť je
vyššia ako 90 % a maximálne plazmatické koncentrácie sa objavujú po 1 až 3 hodinách. Súčasné podanie s jedlom neznižovalo množstvo absorbovaného pramipexolu, ale znižovalo rýchlosť absorpcie. Pramipexol preukazuje lineárnu kinetiku a malý rozdiel v plazmatických hladinách medzi jednotlivými pacientmi.
Distribúcia
U ľudí je väzba pramipexolu na bielkoviny veľmi nízka (<20%) a distribučný objem je rozsiahly
(400 l). Vysoké koncentrácie v mozgovom tkanive sa pozorovali u potkanov (približne 8-násobok koncentrácie v plazme).
Biotransformácia
Pramipexol sa u ľudí metabolizuje len v malom rozsahu.
Eliminácia
Hlavnou cestou vylučovania je renálna exkrécia nezmeneného pramipexolu. Približne 90 % dávky označenej 14C sa vylúči obličkami a menej ako 2% sa nachádza v stolici. Celkový klírens pramipexolu je približne 500 ml/min a renálny klírens je približne 400 ml/min. Eliminačný polčas (t¹/2) kolíše od
8 hodín u mladých do 12 hodín u starších pacientov.
5.3 Predklinické údaje o bezpečnosti
Štúdie toxicity po opakovanom podaní ukázali, že pramipexol má vplyv prevažne na funkcie CNS a ženského reprodukčného systému, pravdepodobne v dôsledku svojho zvýšeného farmakodynamického účinku.
U miniprasiat sa zaznamenalo zníženie diastolického i systolického tlaku a pokles tepovej frekvencie.
Sklon k hypotenznému účinku sa zaznamenal u opíc.
U potkanov a králikov boli sledované možné účinky pramipexolu na reprodukčnú funkciu. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre gravidné samice. V dôsledku výberu živočíšnych druhov a obmedzených sledovaných parametrov, nežiaduce účinky pramipexolu na graviditu a mužskú fertilitu neboli plne objasnené.
U potkanov sa pozorovalo oneskorenie pohlavného vývoja (t.j. oddelenie predkožky a vaginálneho vchodu). Relevantnosť týchto zistení pre ľudí nie je známa.
Pramipexol nebol genotoxický. V štúdii karcinogenity sa u samcov potkanov rozvinula hyperplázia Leydigových buniek a adenómy, ktoré sa vysvetľujú inhibičným účinkom pramipexolu na prolaktín. Tento nález nie je klinicky relevantný pre človeka. Rovnaká štúdia tiež preukázala, že pri dávkach pramipexolu 2 mg/kg (vo forme soli) a vyšších sa u albínskych potkanov pozorovala degenerácia sietnice. Tento posledný nález sa však nepozoroval u pigmentovaných potkanov, ako ani pri dvojročnej štúdii karcinogenity u albínskych myší či iných sledovaných živočíšnych druhov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol
Kukuričný škrob
Predželatinovaný kukuričný škrob
Povidón K25
Bezvodý koloidný oxid kremičitý
Magnéziumstearát
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
Blister (ALU/ALU fólia): 20, 30, 60, 90 alebo 100 tabliet, v škatuľke. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky na likvidáciu.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
KRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Slovinsko
8. REGISTRAČNÉ ČÍSLA
20 tabliet: EU/1/08/469/021
30 tabliet: EU/1/08/469/022
60 tabliet: EU/1/08/469/023
90 tabliet: EU/1/08/469/024
100 tabliet: EU/1/08/469/025
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12. septembra 2008
Dátum posledného predĺženia registrácie: 09. apríl 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Oprymea 0,26 mg tablety s predĺženým uvoľňovaním
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá tableta s predĺženým uvoľňovaním obsahuje 0,26 mg pramipexolu (čo zodpovedá 0,375 mg monohydrátu pramipexoliumdichloridu).
Prosím, venujte pozornosť:Dávky pramipexolu, ktoré sú uvedené v literatúre, sa vzťahujú na pramipexol vo forme soli. Preto budú dávky uvádzané pre bázu pramipexolu, ako aj pre soľ pramipexolu (v zátvorkách).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMATableta s predĺženým uvoľňovaním.
Biele alebo takmer biele, okrúhle (priemer 10 mm), mierne bikonvexné tablety s vyrazeným P1 na jednej strane, so skosenými hranami a možnými škvrnami.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieOprymea je určená u dospelých na liečbu prejavov a symptómov idiopatickej Parkinsonovej choroby, samotná (bez levodopy) alebo v kombinácii s levodopou, t.j. počas priebehu choroby k neskorým štádiám, keď účinok levodopy slabne alebo sa stáva nepravidelný a objavujú sa výkyvy liečebného efektu (dosiahnutie hornej hranice dávky alebo striedanie stavov „on-off“).
4.2 Dávkovanie a spôsob podávaniaDávkovanie
Oprymea tablety s predĺženým uvoľňovaním predstavujú perorálnu formu pramipexolu, ktorá sa
podáva raz denne.
Začiatok liečbyDávka sa má zvyšovať postupne, každých 5–7 dní, so začiatočnou dávkou 0,26 mg bázy (0,375 mg soli) denne. Potrebná dávka sa má titrovať tak, aby došlo k maximálnemu liečebnému efektu za predpokladu, že sa u pacienta neprejavia netolerovateľné nežiaduce účinky.
Vzostupná dávkovacia schéma Oprymea tabliet s predĺženým uvoľňovaním
Týždeň Denná dávka (mg bázy) Denná dávka (mg soli)

1 0,26 0,375
2 0,52 0,75
3 1,05 1,5
Ak je potrebné ďalšie zvyšovanie dennej dávky, má sa zvyšovať po 0,52 mg bázy (0,75 mg soli) v
týždňových intervaloch až do maximálnej dennej dávky 3,15 mg bázy (4,5 mg soli) denne.
Treba však poznamenať, že pri dávkach vyšších ako 1,05 mg bázy (1,5 mg soli) denne sa zvyšuje výskyt somnolencie (pozri časť 4.8).
Pacienti, ktorí už užívajú tablety Oprymey môžu byť okamžite prestavení na Oprymeu tablety s predĺženým uvoľňovaním, pri rovnakej dennej dávke. Po prestavení na Oprymeu tablety
s predĺženým uvoľňovaním, sa dávka môže upraviť v závislosti od terapeutickej reakcie pacienta
(pozri časť 5.1).
Udržiavacia liečba
Individuálna dávka pramipexolu má byť v rozmedzí od 0,26 mg bázy (0,375 mg soli) do maximálne
3,15 mg bázy (4,5 mg soli) denne. Pri zvyšovaní dávky v úvodných štúdiách sa účinnosť pozorovala pri čiatočnej dennej dávke 1,05 mg bázy (1,5 mg soli). Ďalšia úprava dávkovania má byť založená na klinickej reakcii a na výskyte nežiaducich reakcií. V klinických štúdiách približne 5% pacientov bolo liečených dávkami menšími ako 1,05 mg bázy (1,5 mg soli). Pri pokročilej Parkinsonovej chorobe môžu byť dávky pramipexolu vyššie ako 1,05 mg bázy (1,5 mg soli) denne užitočné pre pacientov, kde sa plánuje znižovanie dávok levodopy. Odporúča sa, aby sa dávka levodopy znižovala tak počas zvyšovania dávky, ako aj pri udržiavacej liečbe s Oprymeou v závislosti od reakcie jednotlivých pacientov (pozri časť 4.5).
Vynechaniedávky
Keď pacient zabudne užiť dávku, majú sa tablety Oprymey s predĺženým uvoľňovaním užiť do 12
hodín po stanovenom čase. Po 12 hodinách sa má vynechaná dávka vypustiť a nasledujúca dávka sa má užiť ďalší deň v príslušnom čase.
Prerušenieliečby
Náhle prerušenie dopamínovej terapie môže viesť k rozvoju neuroleptického malígneho syndrómu. Postupne sa má znižovať dávka pramipexolu po 0,52 mg bázy (0,75 mg soli) denne do dosiahnutia dennej dávky zníženej na 0,52 mg bázy (0,75 mg soli). Potom sa dávka znižuje po 0,26 mg bázy (0,375 mg soli) denne (pozri časť 4.4)
Pacienti s poruchou funkcie obličiek
Vylučovanie pramipexolu závisí od funkcie obličiek. Pre začiatok liečby sa navrhuje nasledovná schéma dávkovania:
U pacientov s klírensom kreatinínu nad 50 ml/min sa nevyžaduje zníženie dennej dávky alebo frekvencie dávkovania.
U pacientov s hodnotami klírensu kreatinínu medzi 30 a 50 ml/min sa má liečba začať podávaním 0,26 mg Oprymea tabliet s predĺženým uvoľňovaním obdeň. Pred zvyšovaním na denné dávkovanie po jednom týždni treba dôkladne vyhodnotiť terapeutickú reakciu a znášanlivosť lieku. Ak je potrebné ďalšie zvýšenie dávky, dávky sa majú zvyšovať o 0,26 mg bázy pramipexolu v týždenných intervaloch až po maximálnu dávku 1,57 mg bázy pramipexolu (2,25 mg soli) denne.
Liečba pacientov Oprymea tabletami s predĺženým uvoľňovaním, ktorí majú klírens kreatinínu nižší ako 30 ml/min sa neodporúča, kedže o tejto skupine pacientov nie sú dostupné žiadne údaje. Preto sa má zvážit užívanie Oprymea tabliet.
Ak sa počas udržiavacej terapie zníži funkcia obličiek, majú sa rešpektovať vyššie uvedené odporúčania.
Pacienti s poruchou funkcie pečene
Úprava dávky u pacientov so zlyhaním pečene pravdepodobne nie je potrebná, keďže približne 90% absorbovaného liečiva sa vylučuje obličkami. V každom prípade sa neskúmal možný vplyv insuficiencie pečene na farmakokinetiku Oprymey.
Pediatrická populácia
Bezpečnosť a účinnosť Oprymey u detí do 18 rokov sa nesledovala. Nie je žiadne opodstatnenie pre používanie Oprymea tabliet s predĺženým uvoľňovaním v pediatrickej populácii s Parkinsonovou chorobou.
Spôso
b
podávania
Tablety sa majú prehĺtať celé s vodou a nesmú sa rozhrýzť, rozdeliť alebo rozdrviť. Tablety sa môžu užívať buď s jedlom alebo bez jedla a majú sa užívať každý deň v rovnakom čase.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pri predpisovaní Oprymey pacientom s Parkinsonovou chorobou a s poškodením obličiek sa odporúča znížené dávkovanie podľa časti 4.2.
Halucinácie
Pri liečbe dopamínovými agonistmi a levodopou sú známym nežiaducim účinkom halucinácie. Pacienti majú byť informovaní, že sa môžu objaviť (prevažne vizuálne) halucinácie.
Dyskinéza
Pri pokročilej Parkinsonovej chorobe sa pri kombinácii s levodopou môže počas začiatočnej titrácie dávky Oprymey objaviť dyskinéza. Ak sa objaví, dávka levodopy sa má znížiť.
Epizódynáhlehospánkuasomnolencie
Pramipexol bol spájaný so somnolenciou a epizódami náhleho spánku, najmä u pacientov s Parkinsonovou chorobou. Menej často bol zaznamenaný náhly spánok počas bežných denných aktivít, niekedy bez toho, aby si to pacient uvedomil alebo pocítil varovné príznaky. Pacienti musia byť informovaní a má sa im odporučiť zvýšená opatrnosť pri vedení vozidiel a obsluhe strojov počas
liečby Oprymeou. Pacienti, u ktorých sa vyskytla somnolencia a/alebo náhly spánok, sa musia vyvarovať vedeniu vozidla alebo obsluhy strojov. Okrem toho sa môže zvážiť zníženie dávky alebo ukončenie liečby. Kvôli možným vedľajším účinkom sa má odporučiť zvýšená obozretnosť, najmä keď pacienti užívajú v kombinácii s pramipexolom ďalšie sedatívne lieky alebo alkohol (pozri časti
4.5, 4.7 a 4.8).
Poruchykontrolyimpulzov
Pacienti majú byť pravidelne monitorovaní z dôvodu vývoja porúch kontroly impulzov. Pacienti a
opatrovatelia majú byť upovedomení, že u pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môžu vyskytnúť behaviorálne symptómy porúch kontroly impulzov zahŕňajúce patologické hráčstvo, zvýšené libido, hypersexualitu, chorobné míňanie alebo nakupovanie, prejedanie sa a chorobne nutkavé jedenie. Ak sa vyvinú takéto symptómy, má sa zvážiť zníženie dávky/postupné vysadenie lieku.
Mániaadelírium
Má sa pravidelne sledovať, či sa u pacientov nevyvinie mánia a delírium. Pacienti a ošetrovatelia sa majú informovať, že u pacientov liečených pramipexolom sa môže vyskytnúť mánia a delírium. Ak sa vyvinú tieto príznaky, má sa zvážiť zníženie dávky/postupné prerušenie liečby.
Pacientis psychotickýmiporuchami
Pacienti s psychotickými poruchami majú byť liečení agonistmi dopamínu len vtedy, ak očakávaný prínos prevýši riziko. Je nutné vyvarovať sa súčasnému podávaniu pramipexolu s antipsychotickými liekmi (pozri časť 4.5).
Oftalmologickésledovania
V pravidelných intervaloch sa odporúča oftalmologické sledovanie alebo v prípade výskytu poruchy zraku.
Závažnékardiovaskulárneochorenia
V prípade závažného kardiovaskulárneho ochorenia má byť zvýšená starostlivosť. Odporúča sa sledovať krvný tlak, najmä na začiatku liečby, vzhľadom na všeobecné riziko posturálnej hypotenzie
spojenej s dopaminergnou liečbou.
Neuroleptickýmalígnysyndróm
Po náhlom ukončení dopaminergnej terapie boli hlásené príznaky naznačujúce neuroleptický malígny
syndróm (pozri časť 4.2).
4.5 Liekové a iné interakcie
Väzbanaplazmatickébielkoviny
U ľudí sa pozorovala nízka biotransformácia a veľmi nízka (<20%) väzba pramipexolu na plazmatické bielkoviny. Preto je interakcia s inými liekmi pôsobiacimi na väzbu na plazmatické bielkoviny alebo
na vylučovanie biotransformáciou nepravdepodobná. Pretože anticholinergiká sa vylučujú prevažne biotransformáciou, možnosť interakcie je obmedzená, hoci sa interakcia s anticholinergikami neskúmala. Neexistujú farmakokinetické interakcie so selegilínom ani levodopou.
Inhibítory/kompetítoryaktívnehorenálnehovylučovania
Cimetidín znižuje renálny klírens pramipexolu približne o 34%, pravdepodobne inhibíciou katiónového vylučovacieho transportného systému renálnych tubulov. Preto lieky, ktoré sú inhibítory tohto aktívneho renálneho vylučovania alebo sa vylučujú touto cestou ako sú cimetidín, amantadín, mexiletín, zidovudín, cisplatina, chinín a prokainamid môžu vzájomne reagovať s pramipexolom, čo má za následok zníženie klírensu pramipexolu. Ak sa tieto lieky podávajú súčasne s Oprymeou, má sa zvážiť zníženie dávky pramipexolu.
Kombináciaslevodopou
Ak sa Oprymea podáva v kombinácii s levodopou, odporúča sa pri zvyšovaní dávky Oprymey zníženie dávky levodopy a dávka ďalších antiparkinsoník sa má udržiavať konštantná.
Kvôli možným vedľajším účinkom sa vyžaduje opatrnosť u pacientov užívajúcich iné sedatívne lieky alebo alkohol v kombinácii s pramipexolom (pozri časti 4.4, 4.7 a 4.8).
Antipsychotiká
Treba sa vyhýbať súčasnému podávaniu antipsychotík s pramipexolom (pozri časť 4.4), napr. ak je možné očakávať antagonistický učinok.
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí sa nepozoroval vplyv na priebeh gravidity a laktácie. Pramipexol nebol teratogénny u potkanov
a králikov, ale bol embryotoxický u potkanov pri toxických dávkach podaných gravidnej samici (pozri časť 5.3). Oprymea sa nemá používať počas gravidity, len ak je to výslovne nevyhnutné, t.j. ak možný prínos preváži možné riziko na plod.
Laktácia
Pretože liečba pramipexolom inhibuje vylučovanie prolaktínu u ľudí, možno očakávať aj inhibíciu laktácie. Vylučovanie pramipexolu do materského mlieka u žien sa neskúmalo. U potkanov bola koncentrácia rádioaktívne označeného liečiva vyššia v materskom mlieku ako v plazme.
Pre chýbajúce údaje u ľudí sa Oprymea nemá užívať počas dojčenia. Ak je však jeho užívanie nevyhnuté, dojčenie sa má prerušiť.
Fertilita
Neboli vykonané žiadne štúdie o vplyve na fertilitu u ľudí. V štúdiách na zvieratách, pramipexol
ovplyvnil estrálne cykly a znížil fertilitu samičiek, tak ako sa očakávalo u dopamínového agonistu. Tieto štúdie nepreukázali priame alebo nepriame škodlivé účinky vzhľadom na samčiu fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Oprymea môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje.

Môžu sa objaviť halucinácie alebo somnolencia.
Pacienti liečení Oprymeou a u ktorých sa vyskytla somnolencia a/alebo epizódy náhleho spánku, musia byť informovaní, že nemajú viesť vozidlá alebo sa zaoberať činnosťami, kde by im alebo ostatným, nedostatok pozornosti mohol priniesť riziko vážneho zranenia alebo smrti (napr. obsluhovanie strojov), kým nebudú vedieť zvládať rekurentné epizódy a somnolenciu (pozri aj časti
4.4, 4.5 a 4.8).
4.8 Nežiaduce účinkyOčakávanénežiaducereakciePri užívaní Oprymey sa predpokladajú nasledovné nežiaduce účinky: neobvyklé sny, amnézia, príznaky poruchy správania - impulzívne a kompulzívne správanie, ako zvýšená chuť do jedla, patologické nakupovanie, hypersexualita a patologické hráčstvo; srdcové zlyhanie, stav zmätenosti, zápcha, ilúzie, závraty, dyskinéza, dyspnoe, únava, halucinácie, bolesť hlavy, štikútka, hyperkinéza, hyprefágia, hypotenzia, neprimerané vylučovanie antidiuretického hormónu, nespavosť, poruchy libida, nauzea, paranoja; periférny edém, pneumónia, svrbenie, vyrážka a iná hypersenzitivita, nepokoj, somnolencia, náhle nutkanie na spanie, synkopa, poruchy videnia zahŕňajúce dvojité videnie,
rozmazané videnie a obmezenú zrakovú ostrosť, vracanie, zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti.
Z analýzy združených placebom kontrolovaných štúdií vyplýva, že pri porovnaní celkovo 1 778 pacientov s Parkinsonovou chorobou užívajúcich pramipexol a 1 297 pacientov užívajúcich placebo boli v oboch skupinách často hlásené nežiaduce reakcie. 67% pacientov užívajúcich pramipexol a 54% pacientov užívajúcich placebo nahlásilo aspoň jednu nežiaducu reakciu.
Nežiaduce reakcie uvedené v tabuľke nižšie sú také, ktoré sa vyskytli u 0,1% alebo viacerých pacientov liečených pramipexolom a boli hlásené podstatne častejšie u pacientov užívajúcich pramipexol než placebo alebo také ktoré sa pokladali za klinicky významné. Väčšina nežiaducich reakcií bola mierna až stredná, zvyčajne sa objavili na začiatku liečby a väčšina vyzmizla v priebehu liečby.
V systéme orgánovej klasifikácie sú nežiaduce reakcie evidované podľa názvu frekvencie (počet pacientov, u ktorého sa očakáva výskyt reakcie) použitím nasledujúcich kategórií: veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až
<1/1 000); veľmi zriedkavé (<1/10 000).
Najčastejšie hlásené (³5%) nežiaduce reakcie u pacientov s Parkinsonovou chorobou, ktoré boli častejšie pri liečbe pramipexolom ako placebe, boli nauzea, dyskinéza, hypotenzia, závraty, somnolencia, nespavosť, zápcha, halucinácie, bolesť hlavy a únava. Výskyt somnolencie sa zvyšuje pri dávkach vyšších ako 1,5 mg soli pramipexolu denne (pozri časť 4.2). Častejším nežiaducim účinkom v kombinácii s levodopou bola dyskinéza. Na začiatku liečby sa môže objaviť hypotenzia hlavne, ak je pramipexol titrovaný príliš rýchlo.
Systém orgánovej klasifikácie Nežiaduca reakcia
Infekcie a nákazy
Menej časté pneumónia
Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy
Časté abnormálne sny, príznaky poruchy správania-impulzívne a kompulzívne správanie, zmätenosť, halucinácie, nespavosť
Menej časté nadmerné prejedanie sa1, chorobné nakupovanie, delúzie, hyperfágia1, hypersexualita, poruchy libida, paranoja,
patologické hráčstvo, nepokoj, delírium
Zriedkavé mánia
Poruchy nervového systému
Veľmi časté závraty, dyskinéza, somnolencia
Časté bolesť hlavy
Menej časté amnézia, hyperkinéza, epizódy náhleho spánku, synkopa
Poruchy oka
Časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava, periférny opuch
Laborátórne a funkčné vyšetrenia
Časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla
Menej časté zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže to byť aj menej. Presné stanovenie frekvencie výskytu nie je možné, keďže nežiaduci účinok sa nevyskytol v databáze 2 762 pacientov
klinickej štúdie, ktorí trpeli Parkinsonovou chorobou a boli liečení pramipexolom.
SomnolenciaPramipexol sa často spája so somnolenciou a v menej častých prípadoch sa spája s nadmernou somnolenciou počas dňa a s epizódami náhleho nutkania na spanie (pozri tiež časť 4.4).
PoruchylibidaPramipexol sa môže menej často spájať s poruchami libida (zvýšenie alebo zníženie).
Poruchykontrolyimpulzov
U pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môže vyskytnúť patologické hráčstvo, zvýšené libido, hypersexualita, chorobné míňanie alebo nakupovanie, nenásytné jedenie a chorobné jedenie (pozri časť 4.4).
V prierezovej retrospektívnej štúdii typu case-control, ktorá zahrňala 3 090 pacientov s Parkinsonovou chorobou, 13,6% všetkých pacientov, ktorí dostávali dopaminergnú a non-dopaminergnú liečbu malo za posledných 6 mesiacov príznaky impulzívneho správania. Sledované prejavy zahŕňajú patologické hráčstvo, patologické nakupovanie, zvýšenú chuť do jedla a kompulzívne sexuálne správanie (hypersexualitu). Možné nezávislé rizikové faktory impulzívneho správania zahŕňali dopaminergnú liečbu a vyššie dávky dopaminergnej liečby, nižší vek (≤65 rokov), slobodný stav a pacientom
uvedené hráčstvo v rodinnej anamnéze.
SrdcovézlyhanieV klinických štúdiách a na základe skúseností po uvedení lieku na trh u pacientov liečených pramipexolom bolo hlásené srdcové zlyhanie. Vo farmakoepidemiologickej štúdii sa užívanie pramipexolu spájalo so zvýšeným rizikom výskytu srdcového zlyhania v porovnaní s pacientami, ktoríneužívali pramipexol (zistená miera rizika 1,86; 95 % Cl, 1,21-2,85).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
Príznaky
So závažným predávkovaním nie sú klinické skúsenosti. Očakávané nežiaduce účinky môžu byť tie, ktoré súvisia s farmakodynamickým profilom dopamínových agonistov vrátane nauzey, vracania, hyperkinézy, halucinácií, nepokoja a hypotenzie.
Liečba
Nie je stanovená protilátka na predávkovanie dopamínovými agonistmi. Ak sa vyskytnú prejavy stimulácie centrálneho nervového systému, môže byť indikované podanie neuroleptík. Zvládnutie predávkovania môže vyžadovať všeobecné podporné prostriedky zahŕňajúce výplach žalúdka, intravenózne podávanie tekutín, podávanie aktívneho uhlia a monitorovanie EKG.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiparkinsoniká, agonisty dopamínu, ATC kód: N04BC05. Mechanizmusúčinku
Pramipexol je dopamínový agonist, ktorý sa viaže s veľkou selektívnosťou a špecifickosťou na dopamínové receptory podtriedy D2 a má prednostnú afinitu k D3 receptorom a má plnú vnútornú aktivitu.
Pramipexol zmierňuje parkinsonovský motorický deficit stimuláciou dopamínových receptorov v striate. Pokusy na zvieratách ukázali, že pramipexol inhibuje syntézu dopamínu, jeho vylučovanie a premenu.
Farmakodynamickéúčinky
U zdravých dobrovoľníkov sa pozoroval od dávky zavislý pokles prolaktínu. V klinickej štúdii so zdravými dobrovoľníkmi, kde boli pramipexol tablety s predlženým uvoľňovaním titrované rýchlejšie (každé 3 dni) ako bolo odporúčané až do 3,15 mg bázy pramipexolu (4,5 mg soli) denne, sa pozorovalo zvýšenie krvného tlaku a tepovej frekvencie. Takýto účinok sa nepozoroval u pacientov v štúdii.
Klinickáúčinnosťa bezpečnosťpriParkinsonovejchorobe
U pacientov užívajúcich pramipexol sa zmiernili prejavy a symptómy idiopatickej Parkinsonovej choroby. Placebom kontrolované klinické štúdie zahrňali približne 1 800 pacientov liečených pramipexolom v štádiách I-V podľa Hoehna a Yahra. Okrem nich približne 1 000 pacientov
v pokročilejších štádiách choroby dostávalo súčasne levodopu a trpeli motorickými komplikáciami.
Pri rannej a pokročilej Parkinsonovej chorobe bola účinnosť pramipexolu v kontrolovaných klinických štúdiách udržiavaná na rovnakej úrovni po dobu približne 6 mesiacov. V otvorených pokračovacích štúdiách trvajúcich viac ako 3 roky sa nezaznamenali znaky klesajúcej účinnosti. V kontrolovanej dvojročnej dvojito zaslepenej štúdii začiatok liečby pramipexolom v porovnaní so začatím liečby levodopou výrazne oddialil nástup motorických komplikácií a znížil ich výskyt. Toto oddialenie motorických komplikácií pri pramipexole má vyrovnať vyššie zlepšenie motorických funkcií
s levodopou (merané ako stredná hodnota zmeny v UPDRS škále). Celkový výskyt halucinácií
a somnolencie bol všeobecne vyšší vo fáze zvyšovania v skupine užívajúcej pramipexol. Avšak počas udržiavacej fázy sa výrazný rozdiel nezaznamenal. Tieto skutočnosti sa majú zvážiť, keď sa
u pacientov s Parkinsonovou chorobou začína liečba pramipexolom.
Bezpečnosť a účinnosť tabliet s predĺženým uvoľňovaním s pramipexolom pri liečbe Parkinsonovej chororby sa hodnotila v nadnárodnom vývojovom programe lieku, ktorý pozostával z troch randomizovaných kontrolovaných štúdií. Dve štúdie prebehli u pacientov v ranom štádiu Parkinsonovej choroby a jedna štúdia prebehla u pacientov v pokročilom štádiu Parkinsonovej choroby.
Výhoda pramipexolu- tabliet s predĺženým uvoľňovaním oproti placebu sa preukázala po 18 týždňoch liečby na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (CGI-I a PGI-I responder rates) konečnom stave účinnosti dvojito slepej placebom kontrolovanej štúdie, ktorá zahŕňala celkovo
539 pacientov s Parkinsonovou chrobou v ranom štádiu. Zachovanie účinnosti sa preukázalo u pacientov liečených 33 týždňov. Pramipexol tablety s predĺženým uvoľňovaním boli non-inferiórne voči pramipexolu v tabletách s okamžitým uvoľňovaním, ako to bolo vyhodnotené v 33 týždni podľa UPDRS škály časti II+III.
V dvojito zaslepenej placebom kontrolovanej štúdii, ktorá zahŕňala celkovo 517 pacientov
s Parkinsonovou chorobou v pokročilom štádiu, ktorí súčasne užívali levodopu, sa po 18 týždňoch liečby, preukázala výhoda pramipexol tabliet s predĺženým uvoľňovaním voči placebu na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (off-time) konečnom stave účinnosti.
Účinnosť a znášanlivosť okamžitého prestavenia z pramipexolu- tabliet na pramipexol tablety
s predĺženým uvoľňovaním pri tej istej dennej dávke sa hodnotili v dvojito zaslepenej klinickej štúdii
u pacientov s Parkinsonovou chorobou v ranom štádiu.
Účinnosť sa udržala u 87 zo 103 pacientov, ktorí prešli na pramipexol tablety s predĺženým uvoľňovaním. Z týchto 87 pacientov, 82,8% nezmenilo svoju dávku, 13,8% zvýšilo a 3,4% znížilo svoju dávku.
U polovicie zo 16 pacientov, ktorí nesplnili kritérium udržania účinnosti podľa škály UPDRS časť
II+III, sa zmena základnej línie nepovažovala za klinický významnú.
Iba jeden pacient, ktorý prešiel na pramipexol tablety s predĺženým uvoľňovaním zaznamenal
nežiaducu udalosť spojenú s užívaním lieku, čo viedlo k ukončeniu liečby.
Pediatrickápopulácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s pramipexolom vo všetkých podskupinách pediatrickej populácie pre Parkinsonovu chorobu ( informácie o použití
v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorbcia
Pramipexol sa po perorálnom podaní úplne absorbuje. Absolútna biologická dostupnosť je vyššia ako
90%.
Vo fáze I klinickej štúdie, v ktorej sa hodnotili pramipexol tablety s okamžitým uvoľňovaním a s tablety predĺženým uvoľňovaním užívané nalačno, boli minimálne a maximálne plazmatické koncentrácie (Cmin, Cmax) a plocha pod krivkou (AUC) rovnaké pri tej istej dennej dávke pramipexolu tabliet s predĺženým uvoľňovaním podávaných raz denne a pramipexol tabliet podávaných trikrát denne.
Podávanie pramipexolu tabliet s predĺženým uvoľňovaním raz denne spôsobuje menej časté výkyvy plazmatickej koncentrácie pramipexolu v priebehu 24 hodín v porovnaní s podávaním pramipexolu tabliet s okamžitým uvolňovaním trikrát denne.
Maximálne plazmatické koncentrácie sa objavia približne 6 hodín po podaní pramipexol tabliet
s predĺženým uvoľňovaním raz denne. Rovnovážny stav plochy pod krivkou sa dosiahne najneskôr po
5 dňoch súvislého užívania.
Súčasné podávanie s jedlom vo všeobecnosti neovplyvňuje biologickú dostupnosť pramipexolu. Konzumácia potravín s vysokým obsahom tuku zvyšuje u zdravých dobrovoľníkov plazmatickú
koncentráciu (Cmax) asi o 24% po podaní jednej dávky a asi o 20% po podaní opakovanej dávky
a spôsobuje asi 2-hodinové oneskorenie v dosiahnutí maximálnej koncentrácie. Celkovú plochu pod
krivkou (AUC) neovplyvnil príjem potravy. Zvýšená Cmax sa nepovažuje za klinicky významnú. Vo fáze III klinických štúdií, ktoré určovali bezpečnosť a účinnosť pramipexolu tabliet s predĺženým uvoľňovaním, boli pacienti poučení, aby užívali skúšaný liek bez ohľadu na konzumované potraviny.
Keďže telesná hmotnosť nemá žiadny dopad na AUC, nezistil sa žiaden vplyv na distribučný objem a tým aj na maximálnu koncentráciu Cmax.Telesná hmotnosť znížená o 30 kg viedie k zvýšeniu Cmax o 45%. Vo fáze III klinických štúdií pacientov s Parkinsonovou chorobou nebol zistený žiadny klinicky význymný vplyv telesnej hmotnosti na terapeutický účinok a znášanlivosť pramipexolu tabliet s predĺženým uvoľňovaním.
Pramipexol preukazuje lineárnu kinetiku a malú variabilitu plazmatických hladín medzi jednotlivými pacientami.
Distribúcia
U ľudí je väzba pramipexolu na bielkoviny veľmi nízka (<20%) a distribučný objem je rozsiahly (400 l). Vysoké koncentrácie v mozgovom tkanive sa pozorovali u potkanov (približne 8-násobok koncentrácie v plazme).
Biotransformácia
Pramipexol sa u ľudí metabolizuje len v malom rozsahu.
Eliminácia
Hlavnou cestou vylučovania je renálna exkrécia nezmeneného pramipexolu. Približne 90% dávky označenej 14C sa vylúči obličkami a menej ako 2% sa nachádza v stolici. Celkový klírens pramipexolu je približne 500 ml/min a renálny klírens je približne 400 ml/min. Eliminačný polčas (t½) kolíše od
8 hodín u mladých do 12 hodín u starších pacientov.
5.3 Predklinické údaje o bezpečnosti
Štúdie toxicity po opakovanom podaní ukázali, že pramipexol má vplyv prevažne na funkcie CNS a ženského reprodukčného systému, pravdepodobne v dôsledku svojho zvýšeného farmakodynamického účinku.
U miniprasiat bolo zaznamenané zníženie diastolického i systolického tlaku a pokles tepovej frekvencie a sklon k hypotenznému účinku sa zaznamenal u opíc.
U potkanov a králikov boli zistené možné účinky pramipexolu na reprodukčnú funkciu. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre matku. V dôsledku výberu živočíšnych druhov a obmedzenia sledovaných parametrov neboli nežiaduce účinky pramipexolu na graviditu a mužskú fertilitu plne objasnené.
U potkanov sa pozorovalo oneskorenie pohlavného vývoja (t.j. oddelenie predkožky a vaginálneho vchodu). Relevantnosť týchto zistení pre ľudí nie je známa.
Pramipexol nebol genotoxický. V štúdii karcinogenity sa u samcov potkanov rozvinula hyperplázia Leydigových buniek a adenómy, ktoré sa vysvetľujú inhibičným účinkom pramipexolu na prolaktín. Tento nález nie je klinicky relevantný pre človeka. Rovnaká štúdia tiež preukázala, že pri dávkach pramipexolu 2 mg/kg (vo forme soli) a vyšších sa u albínskych potkanov pozorovala degenerácia sietnice. Tento posledný nález sa však nepozoroval u pigmentovaných potkanov, ako ani pri dvojročnej štúdii karcinogenity u albínskych myší či iných sledovaných živočíšnych druhov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
hypromelóza kukuričný škrob
bezvodý koloidný oxid kremičitý
magnéziumstearát
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky pri uchovávaní.
6.5 Druh obalu a obsah baleniaBlister (OPA/ALU/vysušovadlo/PE-ALU fólia): 10, 30, 90 alebo 100 tabliet s predĺženým uvoľňovaním, v škatuľke.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky na likvidáciu.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIKRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Slovinsko
8. REGISTRAČNÉ ČÍSLA10 tabliet s predĺženým uvoľňovaním: EU/1/08/469/026
30 tabliet s predĺženým uvoľňovaním: EU/1/08/469/027
90 tabliet s predĺženým uvoľňovaním: EU/1/08/469/028
100 tabliet s predĺženým uvoľňovaním: EU/1/08/469/029
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12. septembra 2008
Dátum posledného predĺženia registrácie: 09. apríl 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Oprymea 0,52 mg tablety s predĺženým uvoľňovaním
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá tableta s predĺženým uvoľňovaním obsahuje 0,52 mg pramipexolu (čo zodpovedá 0,75 mg monohydrátu pramipexoliumdichloridu).
Prosím, venujte pozornosť:Dávky pramipexolu, ktoré sú uvedené v literatúre, sa vzťahujú na pramipexol vo forme soli. Preto budú dávky uvádzané pre bázu pramipexolu, ako aj pre soľ pramipexolu (v zátvorkách).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMATableta s predĺženým uvoľňovaním.
Biele alebo takmer biele, okrúhle (priemer 10 mm), mierne bikonvexné tablety s vyrazeným P2 na jednej strane, so skosenými hranami a možnými škvrnami.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieOprymea je určená u dospelých na liečbu prejavov a symptómov idiopatickej Parkinsonovej choroby, samotná (bez levodopy) alebo v kombinácii s levodopou, t.j. počas priebehu choroby k neskorým štádiám, keď účinok levodopy slabne alebo sa stáva nepravidelný a objavujú sa výkyvy liečebného efektu (dosiahnutie hornej hranice dávky alebo striedanie stavov „on-off“).
4.2 Dávkovanie a spôsob podávaniaDávkovanie
Oprymea tablety s predĺženým uvoľňovaním predstavujú perorálnu formu pramipexolu, ktorá sa
podáva raz denne.
Začiatok liečbyDávka sa má zvyšovať postupne, každých 5–7 dní, so začiatočnou dávkou 0,26 mg bázy (0,375 mg soli) denne. Potrebná dávka sa má titrovať tak, aby došlo k maximálnemu liečebnému efektu za predpokladu, že sa u pacienta neprejavia netolerovateľné nežiaduce účinky.
Vzostupná dávkovacia schéma Oprymea tabliet s predĺženým uvoľňovaním
Týždeň Denná dávka (mg bázy) Denná dávka (mg soli)

1 0,26 0,375
2 0,52 0,75
3 1,05 1,5
Ak je potrebné ďalšie zvyšovanie dennej dávky, má sa zvyšovať po 0,52 mg bázy (0,75 mg soli) v
týždňových intervaloch až do maximálnej dennej dávky 3,15 mg bázy (4,5 mg soli) denne.
Treba však poznamenať, že pri dávkach vyšších ako 1,05 mg bázy (1,5 mg soli) denne sa zvyšuje výskyt somnolencie (pozri časť 4.8).
Pacienti, ktorí už užívajú tablety Oprymey môžu byť okamžite prestavení na Oprymeu tablety s predĺženým uvoľňovaním, pri rovnakej dennej dávke. Po prestavení na Oprymeu tablety
s predĺženým uvoľňovaním, sa dávka môže upraviť v závislosti od terapeutickej reakcie pacienta
(pozri časť 5.1).
Udržiavacia liečba
Individuálna dávka pramipexolu má byť v rozmedzí od 0,26 mg bázy (0,375 mg soli) do maximálne
3,15 mg bázy (4,5 mg soli) denne. Pri zvyšovaní dávky v úvodných štúdiách sa účinnosť pozorovala pri čiatočnej dennej dávke 1,05 mg bázy (1,5 mg soli). Ďalšia úprava dávkovania má byť založená na klinickej reakcii a na výskyte nežiaducich reakcií. V klinických štúdiách približne 5% pacientov bolo liečených dávkami menšími ako 1,05 mg bázy (1,5 mg soli). Pri pokročilej Parkinsonovej chorobe môžu byť dávky pramipexolu vyššie ako 1,05 mg bázy (1,5 mg soli) denne užitočné pre pacientov, kde sa plánuje znižovanie dávok levodopy. Odporúča sa, aby sa dávka levodopy znižovala tak počas zvyšovania dávky, ako aj pri udržiavacej liečbe s Oprymeou v závislosti od reakcie jednotlivých pacientov (pozri časť 4.5).
Vynechaniedávky
Keď pacient zabudne užiť dávku, majú sa tablety Oprymey s predĺženým uvoľňovaním užiť do 12
hodín po stanovenom čase. Po 12 hodinách sa má vynechaná dávka vypustiť a nasledujúca dávka sa má užiť ďalší deň v príslušnom čase.
Prerušenieliečby
Náhle prerušenie dopamínovej terapie môže viesť k rozvoju neuroleptického malígneho syndrómu. Postupne sa má znižovať dávka pramipexolu po 0,52 mg bázy (0,75 mg soli) denne do dosiahnutia dennej dávky zníženej na 0,52 mg bázy (0,75 mg soli). Potom sa dávka znižuje po 0,26 mg bázy (0,375 mg soli) denne (pozri časť 4.4)
Pacienti s poruchou funkcie obličiek
Vylučovanie pramipexolu závisí od funkcie obličiek. Pre začiatok liečby sa navrhuje nasledovná schéma dávkovania:
U pacientov s klírensom kreatinínu nad 50 ml/min sa nevyžaduje zníženie dennej dávky alebo frekvencie dávkovania.
U pacientov s hodnotami klírensu kreatinínu medzi 30 a 50 ml/min sa má liečba začať podávaním 0,26 mg Oprymea tabliet s predĺženým uvoľňovaním obdeň. Pred zvyšovaním na denné dávkovanie po jednom týždni treba dôkladne vyhodnotiť terapeutickú reakciu a znášanlivosť lieku. Ak je potrebné ďalšie zvýšenie dávky, dávky sa majú zvyšovať o 0,26 mg bázy pramipexolu v týždenných intervaloch až po maximálnu dávku 1,57 mg bázy pramipexolu (2,25 mg soli) denne.
Liečba pacientov Oprymea tabletami s predĺženým uvoľňovaním, ktorí majú klírens kreatinínu nižší ako 30 ml/min sa neodporúča, kedže o tejto skupine pacientov nie sú dostupné žiadne údaje. Preto sa má zvážit užívanie Oprymea tabliet.
Ak sa počas udržiavacej terapie zníži funkcia obličiek, majú sa rešpektovať vyššie uvedené odporúčania.
Pacienti s poruchou funkcie pečene
Úprava dávky u pacientov so zlyhaním pečene pravdepodobne nie je potrebná, keďže približne 90% absorbovaného liečiva sa vylučuje obličkami. V každom prípade sa neskúmal možný vplyv insuficiencie pečene na farmakokinetiku Oprymey.
Pediatrická populácia
Bezpečnosť a účinnosť Oprymey u detí do 18 rokov sa nesledovala. Nie je žiadne opodstatnenie pre používanie Oprymea tabliet s predĺženým uvoľňovaním v pediatrickej populácii s Parkinsonovou chorobou.
Spôso
b
podávania
Tablety sa majú prehĺtať celé s vodou a nesmú sa rozhrýzť, rozdeliť alebo rozdrviť. Tablety sa môžu užívať buď s jedlom alebo bez jedla a majú sa užívať každý deň v rovnakom čase.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pri predpisovaní Oprymey pacientom s Parkinsonovou chorobou a s poškodením obličiek sa odporúča znížené dávkovanie podľa časti 4.2.
Halucinácie
Pri liečbe dopamínovými agonistmi a levodopou sú známym nežiaducim účinkom halucinácie. Pacienti majú byť informovaní, že sa môžu objaviť (prevažne vizuálne) halucinácie.
Dyskinéza
Pri pokročilej Parkinsonovej chorobe sa pri kombinácii s levodopou môže počas začiatočnej titrácie dávky Oprymey objaviť dyskinéza. Ak sa objaví, dávka levodopy sa má znížiť.
Epizódynáhlehospánkuasomnolencie
Pramipexol bol spájaný so somnolenciou a epizódami náhleho spánku, najmä u pacientov s Parkinsonovou chorobou. Menej často bol zaznamenaný náhly spánok počas bežných denných aktivít, niekedy bez toho, aby si to pacient uvedomil alebo pocítil varovné príznaky. Pacienti musia byť informovaní a má sa im odporučiť zvýšená opatrnosť pri vedení vozidiel a obsluhe strojov počas
liečby Oprymeou. Pacienti, u ktorých sa vyskytla somnolencia a/alebo náhly spánok, sa musia vyvarovať vedeniu vozidla alebo obsluhy strojov. Okrem toho sa môže zvážiť zníženie dávky alebo ukončenie liečby. Kvôli možným vedľajším účinkom sa má odporučiť zvýšená obozretnosť, najmä keď pacienti užívajú v kombinácii s pramipexolom ďalšie sedatívne lieky alebo alkohol (pozri časti
4.5, 4.7 a 4.8).
Poruchykontrolyimpulzov
Pacienti majú byť pravidelne monitorovaní z dôvodu vývoja porúch kontroly impulzov. Pacienti a
opatrovatelia majú byť upovedomení, že u pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môžu vyskytnúť behaviorálne symptómy porúch kontroly impulzov zahŕňajúce patologické hráčstvo, zvýšené libido, hypersexualitu, chorobné míňanie alebo nakupovanie, prejedanie sa a chorobné nutkavé jedenie. Ak sa vyvinú takéto symptómy, má sa zvážiť zníženie dávky/postupné vysadenie lieku.
Mániaadelírium
Má sa pravidelne sledovať, či sa u pacientov nevyvinie mánia a delírium. Pacienti a ošetrovatelia sa majú informovať, že u pacientov liečených pramipexolom sa môže vyskytnúť mánia a delírium. Ak sa vyvinú tieto príznaky, má sa zvážiť zníženie dávky/postupné prerušenie liečby.
Pacientis psychotickýmiporuchami
Pacienti s psychotickými poruchami majú byť liečení agonistmi dopamínu len vtedy, ak očakávaný prínos prevýši riziko. Je nutné vyvarovať sa súčasnému podávaniu pramipexolu s antipsychotickými liekmi (pozri časť 4.5).
Oftalmologickésledovania
V pravidelných intervaloch sa odporúča oftalmologické sledovanie alebo v prípade výskytu poruchy zraku.
Závažnékardiovaskulárneochorenia
V prípade závažného kardiovaskulárneho ochorenia má byť zvýšená starostlivosť. Odporúča sa sledovať krvný tlak, najmä na začiatku liečby, vzhľadom na všeobecné riziko posturálnej hypotenzie
spojenej s dopaminergnou liečbou.
Neuroleptickýmalígnysyndróm
Po náhlom ukončení dopaminergnej terapie boli hlásené príznaky naznačujúce neuroleptický malígny
syndróm (pozri časť 4.2).
4.5 Liekové a iné interakcie
Väzbanaplazmatickébielkoviny
U ľudí sa pozorovala nízka biotransformácia a veľmi nízka (<20%) väzba pramipexolu na plazmatické bielkoviny. Preto je interakcia s inými liekmi pôsobiacimi na väzbu na plazmatické bielkoviny alebo
na vylučovanie biotransformáciou nepravdepodobná. Pretože anticholinergiká sa vylučujú prevažne biotransformáciou, možnosť interakcie je obmedzená, hoci sa interakcia s anticholinergikami neskúmala. Neexistujú farmakokinetické interakcie so selegilínom ani levodopou.
Inhibítory/kompetítoryaktívnehorenálnehovylučovania
Cimetidín znižuje renálny klírens pramipexolu približne o 34%, pravdepodobne inhibíciou katiónového vylučovacieho transportného systému renálnych tubulov. Preto lieky, ktoré sú inhibítory tohto aktívneho renálneho vylučovania alebo sa vylučujú touto cestou ako sú cimetidín, amantadín, mexiletín, zidovudín, cisplatina, chinín a prokainamid môžu vzájomne reagovať s pramipexolom, čo má za následok zníženie klírensu pramipexolu. Ak sa tieto lieky podávajú súčasne s Oprymeou, má sa zvážiť zníženie dávky pramipexolu.
Kombináciaslevodopou
Ak sa Oprymea podáva v kombinácii s levodopou, odporúča sa pri zvyšovaní dávky Oprymey zníženie dávky levodopy a dávka ďalších antiparkinsoník sa má udržiavať konštantná.
Kvôli možným vedľajším účinkom sa vyžaduje opatrnosť u pacientov užívajúcich iné sedatívne lieky alebo alkohol v kombinácii s pramipexolom (pozri časti 4.4, 4.7 a 4.8).
Antipsychotiká
Treba sa vyhýbať súčasnému podávaniu antipsychotík s pramipexolom (pozri časť 4.4), napr. ak je možné očakávať antagonistický učinok.
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí sa nepozoroval vplyv na priebeh gravidity a laktácie. Pramipexol nebol teratogénny u potkanov
a králikov, ale bol embryotoxický u potkanov pri toxických dávkach podaných gravidnej samici (pozri časť 5.3). Oprymea sa nemá používať počas gravidity, len ak je to výslovne nevyhnutné, t.j. ak možný prínos preváži možné riziko na plod.
Laktácia
Pretože liečba pramipexolom inhibuje vylučovanie prolaktínu u ľudí, možno očakávať aj inhibíciu laktácie. Vylučovanie pramipexolu do materského mlieka u žien sa neskúmalo. U potkanov bola koncentrácia rádioaktívne označeného liečiva vyššia v materskom mlieku ako v plazme.
Pre chýbajúce údaje u ľudí sa Oprymea nemá užívať počas dojčenia. Ak je však jeho užívanie nevyhnuté, dojčenie sa má prerušiť.
Fertilita
Neboli vykonané žiadne štúdie o vplyve na fertilitu u ľudí. V štúdiách na zvieratách, pramipexol
ovplyvnil estrálne cykly a znížil fertilitu samičiek, tak ako sa očakávalo u dopamínového agonistu. Tieto štúdie nepreukázali priame alebo nepriame škodlivé účinky vzhľadom na samčiu fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Oprymea môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje.

Môžu sa objaviť halucinácie alebo somnolencia.
Pacienti liečení Oprymeou a u ktorých sa vyskytla somnolencia a/alebo epizódy náhleho spánku, musia byť informovaní, že nemajú viesť vozidlá alebo sa zaoberať činnosťami, kde by im alebo ostatným, nedostatok pozornosti mohol priniesť riziko vážneho zranenia alebo smrti (napr. obsluhovanie strojov), kým nebudú vedieť zvládať rekurentné epizódy a somnolenciu (pozri aj časti
4.4, 4.5 a 4.8).
4.8 Nežiaduce účinkyOčakávanénežiaducereakciePri užívaní Oprymey sa predpokladajú nasledovné nežiaduce účinky: neobvyklé sny, amnézia, príznaky poruchy správania - impulzívne a kompulzívne správanie, ako zvýšená chuť do jedla, patologické nakupovanie, hypersexualita a patologické hráčstvo; srdcové zlyhanie, stav zmätenosti, zápcha, ilúzie, závraty, dyskinéza, dyspnoe, únava, halucinácie, bolesť hlavy, štikútka, hyperkinéza, hyprefágia, hypotenzia, neprimerané vylučovanie antidiuretického hormónu, nespavosť, poruchy libida, nauzea, paranoja; periférny edém, pneumónia, svrbenie, vyrážka a iná hypersenzitivita, nepokoj, somnolencia, náhle nutkanie na spanie, synkopa, poruchy videnia zahŕňajúce dvojité videnie,
rozmazané videnie a obmezenú zrakovú ostrosť, vracanie, zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti.
Z analýzy združených placebom kontrolovaných štúdií vyplýva, že pri porovnaní celkovo 1 778 pacientov s Parkinsonovou chorobou užívajúcich pramipexol a 1 297 pacientov užívajúcich placebo boli v oboch skupinách často hlásené nežiaduce reakcie. 67% pacientov užívajúcich pramipexol a 54% pacientov užívajúcich placebo nahlásilo aspoň jednu nežiaducu reakciu.
Nežiaduce reakcie uvedené v tabuľke nižšie sú také, ktoré sa vyskytli u 0,1% alebo viacerých pacientov liečených pramipexolom a boli hlásené podstatne častejšie u pacientov užívajúcich pramipexol než placebo alebo také ktoré sa pokladali za klinicky významné. Väčšina nežiaducich účinkov bola mierna až stredná, zvyčajne sa objavili na začiatku liečby a väčšina vyzmizla v priebehu liečby.
V systéme orgánovej klasifikácie sú nežiaduce reakcie evidované podľa názvu frekvencie (počet pacientov, u ktorého sa očakáva výskyt reakcie) použitím nasledujúcich kategórií: veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až
<1/1 000); veľmi zriedkavé (<1/10 000).
Najčastejšie hlásené (³5%) nežiaduce reakcie u pacientov s Parkinsonovou chorobou, ktoré boli častejšie pri liečbe pramipexolom ako placebe, boli nauzea, dyskinéza, hypotenzia, závraty, somnolencia, nespavosť, zápcha, halucinácie, bolesť hlavy a únava. Výskyt somnolencie sa zvyšuje pri dávkach vyšších ako 1,5 mg soli pramipexolu denne (pozri časť 4.2). Častejším nežiaducim účinkom v kombinácii s levodopou bola dyskinéza. Na začiatku liečby sa môže objaviť hypotenzia hlavne, ak je pramipexol titrovaný príliš rýchlo.
Systém orgánovej klasifikácie Nežiaduca reakcia
Infekcie a nákazy
Menej časté pneumónia
Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy
Časté abnormálne sny, príznaky poruchy správania-impulzívne a kompulzívne správanie, zmätenosť, halucinácie, nespavosť
Menej časté nadmerné prejedanie sa1, chorobné nakupovanie, delúzie, hyperfágia1, hypersexualita, poruchy libida, paranoja,
patologické hráčstvo, nepokoj, delírium
Zriedkavé mánia

Poruchy nervového systému
Veľmi časté závraty, dyskinéza, somnolencia
Časté bolesť hlavy
Menej časté amnézia, hyperkinéza, epizódy náhleho spánku, synkopa
Poruchy oka
Časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava, periférny opuch
Laborátórne a funkčné vyšetrenia
Časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla
Menej časté zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže to byť aj menej. Presné stanovenie frekvencie výskytu nie je možné, keďže nežiaduci účinok sa nevyskytol v databáze 2 762 pacientov
klinickej štúdie, ktorí trpeli Parkinsonovou chorobou a boli liečení pramipexolom.
SomnolenciaPramipexol sa často spája so somnolenciou a v menej častých prípadoch sa spája s nadmernou somnolenciou počas dňa a s epizódami náhleho nutkania na spanie (pozri tiež časť 4.4).
PoruchylibidaPramipexol sa môže menej často spájať s poruchami libida (zvýšenie alebo zníženie).
Poruchykontrolyimpulzov
U pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môže vyskytnúť patologické hráčstvo, zvýšené libido, hypersexualita, chorobné míňanie alebo nakupovanie, nenásytné jedenie a chorobné jedenie (pozri časť 4.4).
V prierezovej retrospektívnej štúdii typu case-control, ktorá zahrňala 3 090 pacientov s Parkinsonovou chorobou, 13,6% všetkých pacientov, ktorí dostávali dopaminergnú a non-dopaminergnú liečbu malo za posledných 6 mesiacov príznaky impulzívneho správania. Sledované prejavy zahŕňajú patologické hráčstvo, patologické nakupovanie, zvýšenú chuť do jedla a kompulzívne sexuálne správanie (hypersexualitu). Možné nezávislé rizikové faktory impulzívneho správania zahŕňali dopaminergnú liečbu a vyššie dávky dopaminergnej liečby, nižší vek (≤65 rokov), slobodný stav a pacientom
uvedené hráčstvo v rodinnej anamnéze.
SrdcovézlyhanieV klinických štúdiách a na základe skúseností po uvedení lieku na trh u pacientov liečených pramipexolom bolo hlásené srdcové zlyhanie. Vo farmakoepidemiologickej štúdii sa užívanie pramipexolu spájalo so zvýšeným rizikom výskytu srdcového zlyhania v porovnaní s pacientami, ktoríneužívali pramipexol (zistená miera rizika 1,86; 95 % Cl, 1,21-2,85).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
Príznaky
So závažným predávkovaním nie sú klinické skúsenosti. Očakávané nežiaduce účinky môžu byť tie, ktoré súvisia s farmakodynamickým profilom dopamínových agonistov vrátane nauzey, vracania, hyperkinézy, halucinácií, nepokoja a hypotenzie.
Liečba
Nie je stanovená protilátka na predávkovanie dopamínovými agonistmi. Ak sa vyskytnú prejavy stimulácie centrálneho nervového systému, môže byť indikované podanie neuroleptík. Zvládnutie predávkovania môže vyžadovať všeobecné podporné prostriedky zahŕňajúce výplach žalúdka, intravenózne podávanie tekutín, podávanie aktívneho uhlia a monitorovanie EKG.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiparkinsoniká, agonisty dopamínu, ATC kód: N04BC05. Mechanizmusúčinku
Pramipexol je dopamínový agonist, ktorý sa viaže s veľkou selektívnosťou a špecifickosťou na dopamínové receptory podtriedy D2 a má prednostnú afinitu k D3 receptorom a má plnú vnútornú aktivitu.
Pramipexol zmierňuje parkinsonovský motorický deficit stimuláciou dopamínových receptorov v striate. Pokusy na zvieratách ukázali, že pramipexol inhibuje syntézu dopamínu, jeho vylučovanie a premenu.
Farmakodynamickéúčinky
U zdravých dobrovoľníkov sa pozoroval od dávky zavislý pokles prolaktínu. V klinickej štúdii so zdravými dobrovoľníkmi, kde boli pramipexol tablety s predlženým uvoľňovaním titrované rýchlejšie (každé 3 dni) ako bolo odporúčané až do 3,15 mg bázy pramipexolu (4,5 mg soli) denne, sa pozorovalo zvýšenie krvného tlaku a tepovej frekvencie. Takýto účinok sa nepozoroval u pacientov v štúdii.
Klinickáúčinnosťa bezpečnosťpriParkinsonovejchorobe
U pacientov užívajúcich pramipexol sa zmiernili prejavy a symptómy idiopatickej Parkinsonovej choroby. Placebom kontrolované klinické štúdie zahrňali približne 1 800 pacientov liečených pramipexolom v štádiách I-V podľa Hoehna a Yahra. Okrem nich približne 1 000 pacientov
v pokročilejších štádiách choroby dostávalo súčasne levodopu a trpeli motorickými komplikáciami.
Pri rannej a pokročilej Parkinsonovej chorobe bola účinnosť pramipexolu v kontrolovaných klinických štúdiách udržiavaná na rovnakej úrovni po dobu približne 6 mesiacov. V otvorených pokračovacích štúdiách trvajúcich viac ako 3 roky sa nezaznamenali znaky klesajúcej účinnosti. V kontrolovanej dvojročnej dvojito zaslepenej štúdii začiatok liečby pramipexolom v porovnaní so začatím liečby levodopou výrazne oddialil nástup motorických komplikácií a znížil ich výskyt. Toto oddialenie motorických komplikácií pri pramipexole má vyrovnať vyššie zlepšenie motorických funkcií
s levodopou (merané ako stredná hodnota zmeny v UPDRS škále). Celkový výskyt halucinácií
a somnolencie bol všeobecne vyšší vo fáze zvyšovania v skupine užívajúcej pramipexol. Avšak počas udržiavacej fázy sa výrazný rozdiel nezaznamenal. Tieto skutočnosti sa majú zvážiť, keď sa
u pacientov s Parkinsonovou chorobou začína liečba pramipexolom.
Bezpečnosť a účinnosť tabliet s predĺženým uvoľňovaním s pramipexolom pri liečbe Parkinsonovej chororby sa hodnotila v nadnárodnom vývojovom programe lieku, ktorý pozostával z troch randomizovaných kontrolovaných štúdií. Dve štúdie prebehli u pacientov v ranom štádiu Parkinsonovej choroby a jedna štúdia prebehla u pacientov v pokročilom štádiu Parkinsonovej choroby.
Výhoda pramipexolu - tabliet s predĺženým uvoľňovaním oproti placebu sa preukázala po 18 týždňoch liečby na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (CGI-I a PGI-I responder rates) konečnom stave účinnosti dvojito slepej placebom kontrolovanej štúdie, ktorá zahŕňala celkovo
539 pacientov s Parkinsonovou chrobou v ranom štádiu. Zachovanie účinnosti sa preukázalo u pacientov liečených 33 týždňov. Pramipexol tablety s predĺženým uvoľňovaním boli non-inferiórne voči pramipexolu v tabletách s okamžitým uvoľňovaním, ako to bolo vyhodnotené v 33 týždni podľa UPDRS škály časti II+III.
V dvojito zaslepenej placebom kontrolovanej štúdii, ktorá zahŕňala celkovo 517 pacientov
s Parkinsonovou chorobou v pokročilom štádiu, ktorí súčasne užívali levodopu, sa po 18 týždňoch liečby, preukázala výhoda pramipexol tabliet s predĺženým uvoľňovaním voči placebu na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (off-time) konečnom stave účinnosti.
Účinnosť a znášanlivosť okamžitého prestavenia z pramipexolu - tabliet na pramipexol tablety
s predĺženým uvoľňovaním pri tej istej dennej dávke sa hodnotili v dvojito zaslepenej klinickej štúdii
u pacientov s Parkinsonovou chorobou v ranom štádiu.
Účinnosť sa udržala u 87 zo 103 pacientov, ktorí prešli na pramipexol tablety s predĺženým uvoľňovaním. Z týchto 87 pacientov, 82,8% nezmenilo svoju dávku, 13,8% zvýšilo a 3,4% znížilo svoju dávku.
U polovicie zo 16 pacientov, ktorí nesplnili kritérium udržania účinnosti podľa škály UPDRS časť
II+III, sa zmena základnej línie nepovažovala za klinický významnú.
Iba jeden pacient, ktorý prešiel na pramipexol tablety s predĺženým uvoľňovaním sa zaznamenal
nežiaducu udalosť spojenú s užívaním lieku, čo viedlo k ukončeniu liečby.
Pediatrickápopulácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s pramipexolom vo všetkých podskupinách pediatrickej populácie pre Parkinsonovu chorobu ( informácie o použití
v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorbcia
Pramipexol sa po perorálnom podaní úplne absorbuje. Absolútna biologická dostupnosť je vyššia ako
90%.
Vo fáze I klinickej štúdie, v ktorej sa hodnotili pramipexol tablety s okamžitým uvoľňovaním a s tablety predĺženým uvoľňovaním užívané nalačno boli minimálne a maximálne plazmatické koncentrácie (Cmin, Cmax) a plocha pod krivkou (AUC) rovnaké, pri tej istej dennej dávke pramipexolu tabliet s predĺženým uvoľňovaním podávaných raz denne a pramipexol tabliet podávaných trikrát denne.
Podávanie pramipexolu tabliet s predĺženým uvoľňovaním raz denne spôsobuje menej časté výkyvy plazmatickej koncentrácie pramipexolu v priebehu 24 hodín v porovnaní s podávaním pramipexolu tabliet s okamžitým uvolňovaním trikrát denne.
Maximálne plazmatické koncentrácie sa objavia približne 6 hodín po podaní pramipexol tabliet
s predĺženým uvoľňovaním raz denne. Rovnovážny stav plochy pod krivkou sa dosiahne najneskôr po
5 dňoch súvislého užívania.
Súčasné podávanie s jedlom vo všeobecnosti neovplyvňuje biologickú dostupnosť pramipexolu. Konzumácia potravín s vysokým obsahom tuku zvyšuje u zdravých dobrovoľníkov plazmatickú
koncentráciu (Cmax) asi o 24% po podaní jednej dávky a asi o 20% po podaní opakovanej dávky
a spôsobuje asi 2-hodinové oneskorenie v dosiahnutí maximálnej koncentrácie. Celkovú plochu pod
krivkou (AUC) neovplyvnil príjem potravy. Zvýšená Cmax sa nepovažuje za klinicky významnú. Vo fáze III klinických štúdií, ktoré určovali bezpečnosť a účinnosť pramipexol tabliet s predĺženým uvoľňovaním, boli pacienti poučení, aby užívali skúšaný liek bez ohľadu na konzumované potraviny.
Keďže telesná hmotnosť nemá žiadny dopad na AUC, nezistil sa žiaden vplyv na distribučný objem a tým aj na maximálnu koncentráciu Cmax.Telesná hmotnosť znížená o 30 kg viedie k zvýšeniu Cmax o 45%. Vo fáze III klinických štúdií pacientov s Parkinsonovou chorobou nebol zistený žiadny klinicky význymný vplyv telesnej hmotnosti na terapeutický účinok a znášanlivosť pramipexolu tabliet s predĺženým uvoľňovaním.
Pramipexol preukazuje lineárnu kinetiku a malú variabilitu plazmatických hladín medzi jednotlivými pacientami.
Distribúcia
U ľudí je väzba pramipexolu na bielkoviny veľmi nízka (<20%) a distribučný objem je rozsiahly (400 l). Vysoké koncentrácie v mozgovom tkanive sa pozorovali u potkanov (približne 8-násobok koncentrácie v plazme).
Biotransformácia
Pramipexol sa u ľudí metabolizuje len v malom rozsahu.
Eliminácia
Hlavnou cestou vylučovania je renálna exkrécia nezmeneného pramipexolu. Približne 90% dávky označenej 14C sa vylúči obličkami a menej ako 2% sa nachádza v stolici. Celkový klírens pramipexolu je približne 500 ml/min a renálny klírens je približne 400 ml/min. Eliminačný polčas (t½) kolíše od
8 hodín u mladých do 12 hodín u starších pacientov.
5.3 Predklinické údaje o bezpečnosti
Štúdie toxicity po opakovanom podaní ukázali, že pramipexol má vplyv prevažne na funkcie CNS a ženského reprodukčného systému, pravdepodobne v dôsledku svojho zvýšeného farmakodynamického účinku.
U miniprasiat bolo zaznamenané zníženie diastolického i systolického tlaku a pokles tepovej frekvencie a sklon k hypotenznému účinku sa zaznamenal u opíc.
U potkanov a králikov boli zistené možné účinky pramipexolu na reprodukčnú funkciu. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre matku. V dôsledku výberu živočíšnych druhov a obmedzenia sledovaných parametrov neboli nežiaduce účinky pramipexolu na graviditu a mužskú fertilitu plne objasnené.
U potkanov sa pozorovalo oneskorenie pohlavného vývoja (t.j. oddelenie predkožky a vaginálneho vchodu). Relevantnosť týchto zistení pre ľudí nie je známa.
Pramipexol nebol genotoxický. V štúdii karcinogenity sa u samcov potkanov rozvinula hyperplázia Leydigových buniek a adenómy, ktoré sa vysvetľujú inhibičným účinkom pramipexolu na prolaktín. Tento nález nie je klinicky relevantný pre človeka. Rovnaká štúdia tiež preukázala, že pri dávkach pramipexolu 2 mg/kg (vo forme soli) a vyšších sa u albínskych potkanov pozorovala degenerácia sietnice. Tento posledný nález sa však nepozoroval u pigmentovaných potkanov, ako ani pri dvojročnej štúdii karcinogenity u albínskych myší či iných sledovaných živočíšnych druhov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
hypromelóza kukuričný škrob
bezvodý koloidný oxid kremičitý
magnéziumstearát
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky pri uchovávaní.
6.5 Druh obalu a obsah baleniaBlister (OPA/ALU/vysušovadlo/PE-ALU fólia): 10, 30, 90 alebo 100 tabliet s predĺženým uvoľňovaním, v škatuľke.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky na likvidáciu.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIKRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Slovinsko
8. REGISTRAČNÉ ČÍSLA10 tabliet s predĺženým uvoľňovaním: EU/1/08/469/030
30 tabliet s predĺženým uvoľňovaním: EU/1/08/469/031
90 tabliet s predĺženým uvoľňovaním: EU/1/08/469/032
100 tabliet s predĺženým uvoľňovaním: EU/1/08/469/033
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12. septembra 2008
Dátum posledného predĺženia registrácie: 09. apríl 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Oprymea 1,05 mg tablety s predĺženým uvoľňovaním
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá tableta s predĺženým uvoľňovaním obsahuje 1,05 mg pramipexolu (čo zodpovedá 1,5 mg monohydrátu pramipexoliumdichloridu).
Prosím, venujte pozornosť:Dávky pramipexolu, ktoré sú uvedené v literatúre, sa vzťahujú na pramipexol vo forme soli. Preto budú dávky uvádzané pre bázu pramipexolu, ako aj pre soľ pramipexolu (v zátvorkách).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMATableta s predĺženým uvoľňovaním.
Biele alebo takmer biele, okrúhle (priemer 10 mm), mierne bikonvexné tablety s vyrazeným P3 na jednej strane, so skosenými hranami a možnými škvrnami.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieOprymea je určená u dospelých na liečbu prejavov a symptómov idiopatickej Parkinsonovej choroby, samotná (bez levodopy) alebo v kombinácii s levodopou, t.j. počas priebehu choroby k neskorým štádiám, keď účinok levodopy slabne alebo sa stáva nepravidelný a objavujú sa výkyvy liečebného efektu (dosiahnutie hornej hranice dávky alebo striedanie stavov „on-off“).
4.2 Dávkovanie a spôsob podávaniaDávkovanie
Oprymea tablety s predĺženým uvoľňovaním predstavujú perorálnu formu pramipexolu, ktorá sa
podáva raz denne.
Začiatok liečbyDávka sa má zvyšovať postupne, každých 5–7 dní, so začiatočnou dávkou 0,26 mg bázy (0,375 mg soli) denne. Potrebná dávka sa má titrovať tak, aby došlo k maximálnemu liečebnému efektu za predpokladu, že sa u pacienta neprejavia netolerovateľné nežiaduce účinky.
Vzostupná dávkovacia schéma Oprymea tabliet s predĺženým uvoľňovaním
Týždeň Denná dávka (mg bázy) Denná dávka (mg soli)

1 0,26 0,375
2 0,52 0,75
3 1,05 1,5
Ak je potrebné ďalšie zvyšovanie dennej dávky, má sa zvyšovať po 0,52 mg bázy (0,75 mg soli) v
týždňových intervaloch až do maximálnej dennej dávky 3,15 mg bázy (4,5 mg soli) denne.
Treba však poznamenať, že pri dávkach vyšších ako 1,05 mg bázy (1,5 mg soli) denne sa zvyšuje výskyt somnolencie (pozri časť 4.8).
Pacienti, ktorí už užívajú tablety Oprymey môžu byť okamžite prestavení na Oprymeu tablety s predĺženým uvoľňovaním, pri rovnakej dennej dávke. Po prestavení na Oprymeu tablety
s predĺženým uvoľňovaním, sa dávka môže upraviť v závislosti od terapeutickej reakcie pacienta
(pozri časť 5.1).
Udržiavacia liečba
Individuálna dávka pramipexolu má byť v rozmedzí od 0,26 mg bázy (0,375 mg soli) do maximálne
3,15 mg bázy (4,5 mg soli) denne. Pri zvyšovaní dávky v úvodných štúdiách sa účinnosť pozorovala pri čiatočnej dennej dávke 1,05 mg bázy (1,5 mg soli). Ďalšia úprava dávkovania má byť založená na klinickej reakcii a na výskyte nežiaducich reakcií. V klinických štúdiách približne 5% pacientov bolo liečených dávkami menšími ako 1,05 mg bázy (1,5 mg soli). Pri pokročilej Parkinsonovej chorobe môžu byť dávky pramipexolu vyššie ako 1,05 mg bázy (1,5 mg soli) denne užitočné pre pacientov, kde sa plánuje znižovanie dávok levodopy. Odporúča sa, aby sa dávka levodopy znižovala tak počas zvyšovania dávky, ako aj pri udržiavacej liečbe s Oprymeou v závislosti od reakcie jednotlivých pacientov (pozri časť 4.5).
Vynechaniedávky
Keď pacient zabudne užiť dávku, majú sa tablety Oprymey s predĺženým uvoľňovaním užiť do 12
hodín po stanovenom čase. Po 12 hodinách sa má vynechaná dávka vypustiť a nasledujúca dávka sa má užiť ďalší deň v príslušnom čase.
Prerušenieliečby
Náhle prerušenie dopamínovej terapie môže viesť k rozvoju neuroleptického malígneho syndrómu. Postupne sa má znižovať dávka pramipexolu po 0,52 mg bázy (0,75 mg soli) denne do dosiahnutia dennej dávky zníženej na 0,52 mg bázy (0,75 mg soli). Potom sa dávka znižuje po 0,26 mg bázy (0,375 mg soli) denne (pozri časť 4.4)
Pacienti s poruchou funkcie obličiek
Vylučovanie pramipexolu závisí od funkcie obličiek. Pre začiatok liečby sa navrhuje nasledovná schéma dávkovania:
U pacientov s klírensom kreatinínu nad 50 ml/min sa nevyžaduje zníženie dennej dávky alebo frekvencie dávkovania.
U pacientov s hodnotami klírensu kreatinínu medzi 30 a 50 ml/min sa má liečba začať podávaním 0,26 mg Oprymea tabliet s predĺženým uvoľňovaním obdeň. Pred zvyšovaním na denné dávkovanie po jednom týždni treba dôkladne vyhodnotiť terapeutickú reakciu a znášanlivosť lieku. Ak je potrebné ďalšie zvýšenie dávky, dávky sa majú zvyšovať o 0,26 mg bázy pramipexolu v týždenných intervaloch až po maximálnu dávku 1,57 mg bázy pramipexolu (2,25 mg soli) denne.
Liečba pacientov Oprymea tabletami s predĺženým uvoľňovaním, ktorí majú klírens kreatinínu nižší ako 30 ml/min sa neodporúča, kedže o tejto skupine pacientov nie sú dostupné žiadne údaje. Preto sa má zvážit užívanie Oprymea tabliet.
Ak sa počas udržiavacej terapie zníži funkcia obličiek, majú sa rešpektovať vyššie uvedené odporúčania.
Pacienti s poruchou funkcie pečene
Úprava dávky u pacientov so zlyhaním pečene pravdepodobne nie je potrebná, keďže približne 90% absorbovaného liečiva sa vylučuje obličkami. V každom prípade sa neskúmal možný vplyv insuficiencie pečene na farmakokinetiku Oprymey.
Pediatrická populácia
Bezpečnosť a účinnosť Oprymey u detí do 18 rokov sa nesledovala. Nie je žiadne opodstatnenie pre používanie Oprymea tabliet s predĺženým uvoľňovaním v pediatrickej populácii s Parkinsonovou chorobou.
Spôso
b
podávania
Tablety sa majú prehĺtať celé s vodou a nesmú sa rozhrýzť, rozdeliť alebo rozdrviť. Tablety sa môžu užívať buď s jedlom alebo bez jedla a majú sa užívať každý deň v rovnakom čase.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pri predpisovaní Oprymey pacientom s Parkinsonovou chorobou a s poškodením obličiek sa odporúča znížené dávkovanie podľa časti 4.2.
Halucinácie
Pri liečbe dopamínovými agonistmi a levodopou sú známym nežiaducim účinkom halucinácie. Pacienti majú byť informovaní, že sa môžu objaviť (prevažne vizuálne) halucinácie.
Dyskinéza
Pri pokročilej Parkinsonovej chorobe sa pri kombinácii s levodopou môže počas začiatočnej titrácie dávky Oprymey objaviť dyskinéza. Ak sa objaví, dávka levodopy sa má znížiť.
Epizódynáhlehospánkuasomnolencie
Pramipexol bol spájaný so somnolenciou a epizódami náhleho spánku, najmä u pacientov s Parkinsonovou chorobou. Menej často bol zaznamenaný náhly spánok počas bežných denných aktivít, niekedy bez toho, aby si to pacient uvedomil alebo pocítil varovné príznaky. Pacienti musia byť informovaní a má sa im odporučiť zvýšená opatrnosť pri vedení vozidiel a obsluhe strojov počas
liečby Oprymeou. Pacienti, u ktorých sa vyskytla somnolencia a/alebo náhly spánok, sa musia vyvarovať vedeniu vozidla alebo obsluhy strojov. Okrem toho sa môže zvážiť zníženie dávky alebo ukončenie liečby. Kvôli možným vedľajším účinkom sa má odporučiť zvýšená obozretnosť, najmä keď pacienti užívajú v kombinácii s pramipexolom ďalšie sedatívne lieky alebo alkohol (pozri časti
4.5, 4.7 a 4.8).
Poruchykontrolyimpulzov
Pacienti majú byť pravidelne monitorovaní z dôvodu vývoja porúch kontroly impulzov. Pacienti a
opatrovatelia majú byť upovedomení, že u pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môžu vyskytnúť behaviorálne symptómy porúch kontroly impulzov zahŕňajúce patologické hráčstvo, zvýšené libido, hypersexualitu, chorobné míňanie alebo nakupovanie, prejedanie sa a chorobné nutkavé jedenie. Ak sa vyvinú takéto symptómy, má sa zvážiť zníženie dávky/postupné vysadenie lieku.
Mániaadelírium
Má sa pravidelne sledovať, či sa u pacientov nevyvinie mánia a delírium. Pacienti a ošetrovatelia sa majú informovať, že u pacientov liečených pramipexolom sa môže vyskytnúť mánia a delírium. Ak sa vyvinú tieto príznaky, má sa zvážiť zníženie dávky/postupné prerušenie liečby.
Pacientis psychotickýmiporuchami
Pacienti s psychotickými poruchami majú byť liečení agonistmi dopamínu len vtedy, ak očakávaný prínos prevýši riziko. Je nutné vyvarovať sa súčasnému podávaniu pramipexolu s antipsychotickými liekmi (pozri časť 4.5).
Oftalmologickésledovania
V pravidelných intervaloch sa odporúča oftalmologické sledovanie alebo v prípade výskytu poruchy zraku.
Závažnékardiovaskulárneochorenia
V prípade závažného kardiovaskulárneho ochorenia má byť zvýšená starostlivosť. Odporúča sa sledovať krvný tlak, najmä na začiatku liečby, vzhľadom na všeobecné riziko posturálnej hypotenzie
spojenej s dopaminergnou liečbou.
Neuroleptickýmalígnysyndróm
Po náhlom ukončení dopaminergnej terapie boli hlásené príznaky naznačujúce neuroleptický malígny
syndróm (pozri časť 4.2).
4.5 Liekové a iné interakcie
Väzbanaplazmatickébielkoviny
U ľudí sa pozorovala nízka biotransformácia a veľmi nízka (<20%) väzba pramipexolu na plazmatické bielkoviny. Preto je interakcia s inými liekmi pôsobiacimi na väzbu na plazmatické bielkoviny alebo
na vylučovanie biotransformáciou nepravdepodobná. Pretože anticholinergiká sa vylučujú prevažne biotransformáciou, možnosť interakcie je obmedzená, hoci sa interakcia s anticholinergikami neskúmala. Neexistujú farmakokinetické interakcie so selegilínom ani levodopou.
Inhibítory/kompetítoryaktívnehorenálnehovylučovania
Cimetidín znižuje renálny klírens pramipexolu približne o 34%, pravdepodobne inhibíciou katiónového vylučovacieho transportného systému renálnych tubulov. Preto lieky, ktoré sú inhibítory tohto aktívneho renálneho vylučovania alebo sa vylučujú touto cestou ako sú cimetidín, amantadín, mexiletín, zidovudín, cisplatina, chinín a prokainamid môžu vzájomne reagovať s pramipexolom, čo má za následok zníženie klírensu pramipexolu. Ak sa tieto lieky podávajú súčasne s Oprymeou, má sa zvážiť zníženie dávky pramipexolu.
Kombináciaslevodopou
Ak sa Oprymea podáva v kombinácii s levodopou, odporúča sa pri zvyšovaní dávky Oprymey zníženie dávky levodopy a dávka ďalších antiparkinsoník sa má udržiavať konštantná.
Kvôli možným vedľajším účinkom sa vyžaduje opatrnosť u pacientov užívajúcich iné sedatívne lieky alebo alkohol v kombinácii s pramipexolom (pozri časti 4.4, 4.7 a 4.8).
Antipsychotiká
Treba sa vyhýbať súčasnému podávaniu antipsychotík s pramipexolom (pozri časť 4.4), napr. ak je možné očakávať antagonistický učinok.
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí sa nepozoroval vplyv na priebeh gravidity a laktácie. Pramipexol nebol teratogénny u potkanov
a králikov, ale bol embryotoxický u potkanov pri toxických dávkach podaných gravidnej samici (pozri časť 5.3). Oprymea sa nemá používať počas gravidity, len ak je to výslovne nevyhnutné, t.j. ak možný prínos preváži možné riziko na plod.
Laktácia
Pretože liečba pramipexolom inhibuje vylučovanie prolaktínu u ľudí, možno očakávať aj inhibíciu laktácie. Vylučovanie pramipexolu do materského mlieka u žien sa neskúmalo. U potkanov bola koncentrácia rádioaktívne označeného liečiva vyššia v materskom mlieku ako v plazme.
Pre chýbajúce údaje u ľudí sa Oprymea nemá užívať počas dojčenia. Ak je však jeho užívanie nevyhnuté, dojčenie sa má prerušiť.
Fertilita
Neboli vykonané žiadne štúdie o vplyve na fertilitu u ľudí. V štúdiách na zvieratách, pramipexol
ovplyvnil estrálne cykly a znížil fertilitu samičiek, tak ako sa očakávalo u dopamínového agonistu. Tieto štúdie nepreukázali priame alebo nepriame škodlivé účinky vzhľadom na samčiu fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Oprymea môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje.

Môžu sa objaviť halucinácie alebo somnolencia.
Pacienti liečení Oprymeou a u ktorých sa vyskytla somnolencia a/alebo epizódy náhleho spánku, musia byť informovaní, že nemajú viesť vozidlá alebo sa zaoberať činnosťami, kde by im alebo ostaným, nedostatok pozornosti mohol priniesť riziko vážneho zranenia alebo smrti (napr. obsluhovanie strojov), kým nebudú vedieť zvládať rekurentné epizódy a somnolenciu (pozri aj časti
4.4, 4.5 a 4.8).
4.8 Nežiaduce účinkyOčakávanénežiaducereakciePri užívaní Oprymey sa predpokladajú nasledovné nežiaduce účinky: neobvyklé sny, amnézia, príznaky poruchy správania - impulzívne a kompulzívne správanie, ako zvýšená chuť do jedla, patologické nakupovanie, hypersexualita a patologické hráčstvo; srdcové zlyhanie, stav zmätenosti, zápcha, ilúzie, závraty, dyskinéza, dyspnoe, únava, halucinácie, bolesť hlavy, štikútka, hyperkinéza, hyprefágia, hypotenzia, neprimerané vylučovanie antidiuretického hormónu, nespavosť, poruchy libida, nauzea, paranoja; periférny edém, pneumónia, svrbenie, vyrážka a iná hypersenzitivita, nepokoj, somnolencia, náhle nutkanie na spanie, synkopa, poruchy videnia zahŕňajúce dvojité videnie,
rozmazané videnie a obmezenú zrakovú ostrosť, vracanie, zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti.
Z analýzy združených placebom kontrolovaných štúdií vyplýva, že pri porovnaní celkovo 1 778 pacientov s Parkinsonovou chorobou užívajúcich pramipexol a 1 297 pacientov užívajúcich placebo boli v oboch skupinách často hlásené nežiaduce reakcie. 67% pacientov užívajúcich pramipexol a 54% pacientov užívajúcich placebo nahlásilo aspoň jednu nežiaducu reakciu.
Nežiaduce reakcie uvedené v tabuľke nižšie sú také, ktoré sa vyskytli u 0,1% alebo viacerých pacientov liečených pramipexolom a boli hlásené podstatne častejšie u pacientov užívajúcich pramipexol než placebo alebo také ktoré sa pokladali za klinicky významné. Väčšina nežiaducich reakcií bola mierna až stredná, zvyčajne sa objavili na začiatku liečby a väčšina vyzmizla v priebehu liečby.
V systéme orgánovej klasifikácie sú nežiaduce reakcie evidované podľa názvu frekvencie (počet pacientov, u ktorého sa očakáva výskyt reakcie) použitím nasledujúcich kategórií: veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až
<1/1 000); veľmi zriedkavé (<1/10 000).
Najčastejšie hlásené (³5%) nežiaduce reakcie u pacientov s Parkinsonovou chorobou, ktoré boli častejšie pri liečbe pramipexolom ako placebe, boli nauzea, dyskinéza, hypotenzia, závraty, somnolencia, nespavosť, zápcha, halucinácie, bolesť hlavy a únava. Výskyt somnolencie sa zvyšuje pri dávkach vyšších ako 1,5 mg soli pramipexolu denne (pozri časť 4.2). Častejším nežiaducim účinkom v kombinácii s levodopou bola dyskinéza. Na začiatku liečby sa môže objaviť hypotenzia hlavne, ak je pramipexol titrovaný príliš rýchlo.
Systém orgánovej klasifikácie Nežiaduca reakcia
Infekcie a nákazy
Menej časté pneumónia
Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy
Časté abnormálne sny, príznaky poruchy správania-impulzívne a kompulzívne správanie, zmätenosť, halucinácie, nespavosť
Menej časté nadmerné prejedanie sa1, chorobné nakupovanie, delúzie, hyperfágia1, hypersexualita, poruchy libida, paranoja,
patologické hráčstvo, nepokoj, delírium
Zriedkavé mánia

Poruchy nervového systému
Veľmi časté závraty, dyskinéza, somnolencia
Časté bolesť hlavy
Menej časté amnézia, hyperkinéza, epizódy náhleho spánku, synkopa
Poruchy oka
Časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava, periférny opuch
Laborátórne a funkčné vyšetrenia
Časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla
Menej časté zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže to byť aj menej. Presné stanovenie frekvencie výskytu nie je možné, keďže nežiaduci účinok sa nevyskytol v databáze 2 762 pacientov
klinickej štúdie, ktorí trpeli Parkinsonovou chorobou a boli liečení pramipexolom.
SomnolenciaPramipexol sa často spája so somnolenciou a v menej častých prípadoch sa spája s nadmernou somnolenciou počas dňa a s epizódami náhleho nutkania na spanie (pozri tiež časť 4.4).
PoruchylibidaPramipexol sa môže menej často spájať s poruchami libida (zvýšenie alebo zníženie).
Poruchykontrolyimpulzov
U pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môže vyskytnúť patologické hráčstvo, zvýšené libido, hypersexualita, chorobné míňanie alebo nakupovanie, nenásytné jedenie a chorobné jedenie (pozri časť 4.4).
V prierezovej retrospektívnej štúdii typu case-control, ktorá zahrňala 3 090 pacientov s Parkinsonovou chorobou, 13,6% všetkých pacientov, ktorí dostávali dopaminergnú a non-dopaminergnú liečbu malo za posledných 6 mesiacov príznaky impulzívneho správania. Sledované prejavy zahŕňajú patologické hráčstvo, patologické nakupovanie, zvýšenú chuť do jedla a kompulzívne sexuálne správanie (hypersexualitu). Možné nezávislé rizikové faktory impulzívneho správania zahŕňali dopaminergnú liečbu a vyššie dávky dopaminergnej liečby, nižší vek (≤65 rokov), slobodný stav a pacientom
uvedené hráčstvo v rodinnej anamnéze.
SrdcovézlyhanieV klinických štúdiách a na základe skúseností po uvedení lieku na trh u pacientov liečených pramipexolom bolo hlásené srdcové zlyhanie. Vo farmakoepidemiologickej štúdii sa užívanie pramipexolu spájalo so zvýšeným rizikom výskytu srdcového zlyhania v porovnaní s pacientami, ktoríneužívali pramipexol (zistená miera rizika 1,86; 95 % Cl, 1,21-2,85).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
Príznaky
So závažným predávkovaním nie sú klinické skúsenosti. Očakávané nežiaduce účinky môžu byť tie, ktoré súvisia s farmakodynamickým profilom dopamínových agonistov vrátane nauzey, vracania, hyperkinézy, halucinácií, nepokoja a hypotenzie.
Liečba
Nie je stanovená protilátka na predávkovanie dopamínovými agonistmi. Ak sa vyskytnú prejavy stimulácie centrálneho nervového systému, môže byť indikované podanie neuroleptík. Zvládnutie predávkovania môže vyžadovať všeobecné podporné prostriedky zahŕňajúce výplach žalúdka, intravenózne podávanie tekutín, podávanie aktívneho uhlia a monitorovanie EKG.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiparkinsoniká, agonisty dopamínu, ATC kód: N04BC05. Mechanizmusúčinku
Pramipexol je dopamínový agonist, ktorý sa viaže s veľkou selektívnosťou a špecifickosťou na dopamínové receptory podtriedy D2 a má prednostnú afinitu k D3 receptorom a má plnú vnútornú aktivitu.
Pramipexol zmierňuje parkinsonovský motorický deficit stimuláciou dopamínových receptorov v striate. Pokusy na zvieratách ukázali, že pramipexol inhibuje syntézu dopamínu, jeho vylučovanie a premenu.
Farmakodynamickéúčinky
U zdravých dobrovoľníkov sa pozoroval od dávky zavislý pokles prolaktínu. V klinickej štúdii so zdravými dobrovoľníkmi, kde boli pramipexol tablety s predlženým uvoľňovaním titrované rýchlejšie (každé 3 dni) ako bolo odporúčané až do 3,15 mg bázy pramipexolu (4,5 mg soli) denne, sa pozorovalo zvýšenie krvného tlaku a tepovej frekvencie. Takýto účinok sa nepozoroval u pacientov v štúdii.
Klinickáúčinnosťa bezpečnosťpriParkinsonovejchorobe
U pacientov užívajúcich pramipexol sa zmiernili prejavy a symptómy idiopatickej Parkinsonovej choroby. Placebom kontrolované klinické štúdie zahrňali približne 1 800 pacientov liečených pramipexolom v štádiách I-V podľa Hoehna a Yahra. Okrem nich približne 1 000 pacientov
v pokročilejších štádiách choroby dostávalo súčasne levodopu a trpeli motorickými komplikáciami.
Pri rannej a pokročilej Parkinsonovej chorobe bola účinnosť pramipexolu v kontrolovaných klinických štúdiách udržiavaná na rovnakej úrovni po dobu približne 6 mesiacov. V otvorených pokračovacích štúdiách trvajúcich viac ako 3 roky sa nezaznamenali znaky klesajúcej účinnosti. V kontrolovanej dvojročnej dvojito zaslepenej štúdii začiatok liečby pramipexolom v porovnaní so začatím liečby levodopou výrazne oddialil nástup motorických komplikácií a znížil ich výskyt. Toto oddialenie motorických komplikácií pri pramipexole má vyrovnať vyššie zlepšenie motorických funkcií
s levodopou (merané ako stredná hodnota zmeny v UPDRS škále). Celkový výskyt halucinácií
a somnolencie bol všeobecne vyšší vo fáze zvyšovania v skupine užívajúcej pramipexol. Avšak počas udržiavacej fázy sa výrazný rozdiel nezaznamenal. Tieto skutočnosti sa majú zvážiť, keď sa
u pacientov s Parkinsonovou chorobou začína liečba pramipexolom.
Bezpečnosť a účinnosť tabliet s predĺženým uvoľňovaním s pramipexolom pri liečbe Parkinsonovej chororby sa hodnotila v nadnárodnom vývojovom programe lieku, ktorý pozostával z troch randomizovaných kontrolovaných štúdií. Dve štúdie prebehli u pacientov v ranom štádiu Parkinsonovej choroby a jedna štúdia prebehla u pacientov v pokročilom štádiu Parkinsonovej choroby.
Výhoda pramipexolu - tabliet s predĺženým uvoľňovaním oproti placebu sa preukázala po 18 týždňoch liečby na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (CGI-I a PGI-I responder rates) konečnom stave účinnosti dvojito slepej placebom kontrolovanej štúdie, ktorá zahŕňala celkovo
539 pacientov s Parkinsonovou chrobou v ranom štádiu. Zachovanie účinnosti sa preukázalo u pacientov liečených 33 týždňov. Pramipexol tablety s predĺženým uvoľňovaním boli non-inferiórne voči pramipexolu v tabletách s okamžitým uvoľňovaním, ako to bolo vyhodnotené v 33 týždni podľa UPDRS škály časti II+III.
V dvojito zaslepenej placebom kontrolovanej štúdii, ktorá zahŕňala celkovo 517 pacientov
s Parkinsonovou chorobou v pokročilom štádiu, ktorí súčasne užívali levodopu, sa po 18 týždňoch liečby, preukázala výhoda pramipexol tabliet s predĺženým uvoľňovaním voči placebu na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (off-time) konečnom stave účinnosti.
Účinnosť a znášanlivosť okamžitého prestavenia z pramipexolu - tabliet na pramipexol tablety
s predĺženým uvoľňovaním pri tej istej dennej dávke sa hodnotili v dvojito zaslepenej klinickej štúdii
u pacientov s Parkinsonovou chorobou v ranom štádiu.
Účinnosť sa udržala u 87 zo 103 pacientov, ktorí prešli na pramipexol tablety s predĺženým uvoľňovaním. Z týchto 87 pacientov, 82,8% nezmenilo svoju dávku, 13,8% zvýšilo a 3,4% znížilo svoju dávku.
U polovicie zo 16 pacientov, ktorí nesplnili kritérium udržania účinnosti podľa škály UPDRS časť
II+III, sa zmena základnej línie nepovažovala za klinický významnú.
Iba jeden pacient, ktorý prešiel na pramipexol tablety s predĺženým uvoľňovaním sa zaznamenal
nežiaducu reakciu spojenú s užívaním lieku, čo viedlo k ukončeniu liečby.
Pediatrickápopulácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s pramipexolom vo všetkých podskupinách pediatrickej populácie pre Parkinsonovu chorobu ( informácie o použití
v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorbcia
Pramipexol sa po perorálnom podaní úplne absorbuje. Absolútna biologická dostupnosť je vyššia ako
90%.
Vo fáze I klinickej štúdie, v ktorej sa hodnotili pramipexol tablety s okamžitým uvoľňovaním a s tablety predĺženým uvoľňovaním užívané nalačno boli minimálne a maximálne plazmatické koncentrácie (Cmin, Cmax) a plocha pod krivkou (AUC) rovnaké, pri tej istej dennej dávke pramipexolu tabliet s predĺženým uvoľňovaním podávaných raz denne a pramipexol tabliet podávaných trikrát denne.
Podávanie pramipexolu tabliet s predĺženým uvoľňovaním raz denne spôsobuje menej časté výkyvy plazmatickej koncentrácie pramipexolu v priebehu 24 hodín v porovnaní s podávaním pramipexolu tabliet s okamžitým uvolňovaním trikrát denne.
Maximálne plazmatické koncentrácie sa objavia približne 6 hodín po podaní pramipexol tabliet
s predĺženým uvoľňovaním raz denne. Rovnovážny stav plochy pod krivkou sa dosiahne najneskôr po
5 dňoch súvislého užívania.
Súčasné podávanie s jedlom vo všeobecnosti neovplyvňuje biologickú dostupnosť pramipexolu. Konzumácia potravín s vysokým obsahom tuku zvyšuje u zdravých dobrovoľníkov plazmatickú
koncentráciu (Cmax) asi o 24% po podaní jednej dávky a asi o 20% po podaní opakovanej dávky
a spôsobuje asi 2-hodinové oneskorenie v dosiahnutí maximálnej koncentrácie. Celkovú plochu pod
krivkou (AUC) neovplyvnil príjem potravy. Zvýšená Cmax sa nepovažuje za klinicky významnú. Vo fáze III klinických štúdií, ktoré určovali bezpečnosť a účinnosť pramipexolu tabliet s predĺženým uvoľňovaním, boli pacienti poučení, aby užívali skúšaný liek bez ohľadu na konzumované potraviny.
Keďže telesná hmotnosť nemá žiadny dopad na AUC, nezistil sa žiaden vplyv na distribučný objem a tým aj na maximálnu koncentráciu Cmax.Telesná hmotnosť znížená o 30 kg viedie k zvýšeniu Cmax o 45%. Vo fáze III klinických štúdií pacientov s Parkinsonovou chorobou nebol zistený žiadny klinicky význymný vplyv telesnej hmotnosti na terapeutický účinok a znášanlivosť pramipexolu tabliet s predĺženým uvoľňovaním.
Pramipexol preukazuje lineárnu kinetiku a malú variabilitu plazmatických hladín medzi jednotlivými pacientami.
Distribúcia
U ľudí je väzba pramipexolu na bielkoviny veľmi nízka (<20%) a distribučný objem je rozsiahly (400 l). Vysoké koncentrácie v mozgovom tkanive sa pozorovali u potkanov (približne 8-násobok koncentrácie v plazme).
Biotransformácia
Pramipexol sa u ľudí metabolizuje len v malom rozsahu.
Eliminácia
Hlavnou cestou vylučovania je renálna exkrécia nezmeneného pramipexolu. Približne 90% dávky označenej 14C sa vylúči obličkami a menej ako 2% sa nachádza v stolici. Celkový klírens pramipexolu je približne 500 ml/min a renálny klírens je približne 400 ml/min. Eliminačný polčas (t½) kolíše od
8 hodín u mladých do 12 hodín u starších pacientov.
5.3 Predklinické údaje o bezpečnosti
Štúdie toxicity po opakovanom podaní ukázali, že pramipexol má vplyv prevažne na funkcie CNS a ženského reprodukčného systému, pravdepodobne v dôsledku svojho zvýšeného farmakodynamického účinku.
U miniprasiat bolo zaznamenané zníženie diastolického i systolického tlaku a pokles tepovej frekvencie a sklon k hypotenznému účinku sa zaznamenal u opíc.
U potkanov a králikov boli zistené možné účinky pramipexolu na reprodukčnú funkciu. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre matku. V dôsledku výberu živočíšnych druhov a obmedzenia sledovaných parametrov neboli nežiaduce účinky pramipexolu na graviditu a mužskú fertilitu plne objasnené.
U potkanov sa pozorovalo oneskorenie pohlavného vývoja (t.j. oddelenie predkožky a vaginálneho vchodu). Relevantnosť týchto zistení pre ľudí nie je známa.
Pramipexol nebol genotoxický. V štúdii karcinogenity sa u samcov potkanov rozvinula hyperplázia Leydigových buniek a adenómy, ktoré sa vysvetľujú inhibičným účinkom pramipexolu na prolaktín. Tento nález nie je klinicky relevantný pre človeka. Rovnaká štúdia tiež preukázala, že pri dávkach pramipexolu 2 mg/kg (vo forme soli) a vyšších sa u albínskych potkanov pozorovala degenerácia sietnice. Tento posledný nález sa však nepozoroval u pigmentovaných potkanov, ako ani pri dvojročnej štúdii karcinogenity u albínskych myší či iných sledovaných živočíšnych druhov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
hypromelóza kukuričný škrob
bezvodý koloidný oxid kremičitý
magnéziumstearát
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky pri uchovávaní.
6.5 Druh obalu a obsah baleniaBlister (OPA/ALU/vysušovadlo/PE-ALU fólia): 10, 30, 90 alebo 100 tabliet s predĺženým uvoľňovaním, v škatuľke.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky na likvidáciu.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIKRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Slovinsko
8. REGISTRAČNÉ ČÍSLA10 tabliet s predĺženým uvoľňovaním: EU/1/08/469/034
30 tabliet s predĺženým uvoľňovaním: EU/1/08/469/035
90 tabliet s predĺženým uvoľňovaním: EU/1/08/469/036
100 tabliet s predĺženým uvoľňovaním: EU/1/08/469/037
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12. septembra 2008
Dátum posledného predĺženia registrácie: 09. apríl 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Oprymea 1,57 mg tablety s predĺženým uvoľňovaním
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá tableta s predĺženým uvoľňovaním obsahuje 1,57 mg pramipexolu (čo zodpovedá 2,25 mg monohydrátu pramipexoliumdichloridu).
Prosím, venujte pozornosť:Dávky pramipexolu, ktoré sú uvedené v literatúre, sa vzťahujú na pramipexol vo forme soli. Preto budú dávky uvádzané pre bázu pramipexolu, ako aj pre soľ pramipexolu (v zátvorkách).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMATableta s predĺženým uvoľňovaním.
Biele alebo takmer biele, okrúhle (priemer 10 mm), mierne bikonvexné tablety s vyrazeným P12 na jednej strane, so skosenými hranami a možnými škvrnami.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieOprymea je určená u dospelých na liečbu prejavov a symptómov idiopatickej Parkinsonovej choroby, samotná (bez levodopy) alebo v kombinácii s levodopou, t.j. počas priebehu choroby k neskorým štádiám, keď účinok levodopy slabne alebo sa stáva nepravidelný a objavujú sa výkyvy liečebného efektu (dosiahnutie hornej hranice dávky alebo striedanie stavov „on-off“).
4.2 Dávkovanie a spôsob podávaniaDávkovanie
Oprymea tablety s predĺženým uvoľňovaním predstavujú perorálnu formu pramipexolu, ktorá sa
podáva raz denne.
Začiatok liečbyDávka sa má zvyšovať postupne, každých 5–7 dní, so začiatočnou dávkou 0,26 mg bázy (0,375 mg soli) denne. Potrebná dávka sa má titrovať tak, aby došlo k maximálnemu liečebnému efektu za predpokladu, že sa u pacienta neprejavia netolerovateľné nežiaduce účinky.
Vzostupná dávkovacia schéma Oprymea tabliet s predĺženým uvoľňovaním
Týždeň Denná dávka (mg bázy) Denná dávka (mg soli)

1 0,26 0,375
2 0,52 0,75
3 1,05 1,5
Ak je potrebné ďalšie zvyšovanie dennej dávky, má sa zvyšovať po 0,52 mg bázy (0,75 mg soli) v
týždňových intervaloch až do maximálnej dennej dávky 3,15 mg bázy (4,5 mg soli) denne.
Treba však poznamenať, že pri dávkach vyšších ako 1,05 mg bázy (1,5 mg soli) denne sa zvyšuje výskyt somnolencie (pozri časť 4.8).
Pacienti, ktorí už užívajú tablety Oprymey môžu byť okamžite prestavení na Oprymeu tablety s predĺženým uvoľňovaním, pri rovnakej dennej dávke. Po prestavení na Oprymeu tablety
s predĺženým uvoľňovaním, sa dávka môže upraviť v závislosti od terapeutickej reakcie pacienta
(pozri časť 5.1).
Udržiavacia liečba
Individuálna dávka pramipexolu má byť v rozmedzí od 0,26 mg bázy (0,375 mg soli) do maximálne
3,15 mg bázy (4,5 mg soli) denne. Pri zvyšovaní dávky v úvodných štúdiách sa účinnosť pozorovala pri čiatočnej dennej dávke 1,05 mg bázy (1,5 mg soli). Ďalšia úprava dávkovania má byť založená na klinickej reakcii a na výskyte nežiaducich reakcií. V klinických štúdiách približne 5% pacientov bolo liečených dávkami menšími ako 1,05 mg bázy (1,5 mg soli). Pri pokročilej Parkinsonovej chorobe môžu byť dávky pramipexolu vyššie ako 1,05 mg bázy (1,5 mg soli) denne užitočné pre pacientov, kde sa plánuje znižovanie dávok levodopy. Odporúča sa, aby sa dávka levodopy znižovala tak počas zvyšovania dávky, ako aj pri udržiavacej liečbe s Oprymeou v závislosti od reakcie jednotlivých pacientov (pozri časť 4.5).
Vynechaniedávky
Keď pacient zabudne užiť dávku, majú sa tablety Oprymey s predĺženým uvoľňovaním užiť do 12
hodín po stanovenom čase. Po 12 hodinách sa má vynechaná dávka vypustiť a nasledujúca dávka sa má užiť ďalší deň v príslušnom čase.
Prerušenieliečby
Náhle prerušenie dopamínovej terapie môže viesť k rozvoju neuroleptického malígneho syndrómu. Postupne sa má znižovať dávka pramipexolu po 0,52 mg bázy (0,75 mg soli) denne do dosiahnutia dennej dávky zníženej na 0,52 mg bázy (0,75 mg soli). Potom sa dávka znižuje po 0,26 mg bázy (0,375 mg soli) denne (pozri časť 4.4)
Pacienti s poruchou funkcie obličiek
Vylučovanie pramipexolu závisí od funkcie obličiek. Pre začiatok liečby sa navrhuje nasledovná schéma dávkovania:
U pacientov s klírensom kreatinínu nad 50 ml/min sa nevyžaduje zníženie dennej dávky alebo frekvencie dávkovania.
U pacientov s hodnotami klírensu kreatinínu medzi 30 a 50 ml/min sa má liečba začať podávaním 0,26 mg Oprymea tabliet s predĺženým uvoľňovaním obdeň. Pred zvyšovaním na denné dávkovanie po jednom týždni treba dôkladne vyhodnotiť terapeutickú reakciu a znášanlivosť lieku. Ak je potrebné ďalšie zvýšenie dávky, dávky sa majú zvyšovať o 0,26 mg bázy pramipexolu v týždenných intervaloch až po maximálnu dávku 1,57 mg bázy pramipexolu (2,25 mg soli) denne.
Liečba pacientov Oprymea tabletami s predĺženým uvoľňovaním, ktorí majú klírens kreatinínu nižší ako 30 ml/min sa neodporúča, kedže o tejto skupine pacientov nie sú dostupné žiadne údaje. Preto sa má zvážit užívanie Oprymea tabliet.
Ak sa počas udržiavacej terapie zníži funkcia obličiek, majú sa rešpektovať vyššie uvedené odporúčania.
Pacienti s poruchou funkcie pečene
Úprava dávky u pacientov so zlyhaním pečene pravdepodobne nie je potrebná, keďže približne 90% absorbovaného liečiva sa vylučuje obličkami. V každom prípade sa neskúmal možný vplyv insuficiencie pečene na farmakokinetiku Oprymey.
Pediatrická populácia
Bezpečnosť a účinnosť Oprymey u detí do 18 rokov sa nesledovala. Nie je žiadne opodstatnenie pre používanie Oprymea tabliet s predĺženým uvoľňovaním v pediatrickej populácii s Parkinsonovou chorobou.
Spôso
b
podávania
Tablety sa majú prehĺtať celé s vodou a nesmú sa rozhrýzť, rozdeliť alebo rozdrviť. Tablety sa môžu užívať buď s jedlom alebo bez jedla a majú sa užívať každý deň v rovnakom čase.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pri predpisovaní Oprymey pacientom s Parkinsonovou chorobou a s poškodením obličiek sa odporúča znížené dávkovanie podľa časti 4.2.
Halucinácie
Pri liečbe dopamínovými agonistmi a levodopou sú známym nežiaducim účinkom halucinácie. Pacienti majú byť informovaní, že sa môžu objaviť (prevažne vizuálne) halucinácie.
Dyskinéza
Pri pokročilej Parkinsonovej chorobe sa pri kombinácii s levodopou môže počas začiatočnej titrácie dávky Oprymey objaviť dyskinéza. Ak sa objaví, dávka levodopy sa má znížiť.
Epizódynáhlehospánkuasomnolencie
Pramipexol bol spájaný so somnolenciou a epizódami náhleho spánku, najmä u pacientov s Parkinsonovou chorobou. Menej často bol zaznamenaný náhly spánok počas bežných denných aktivít, niekedy bez toho, aby si to pacient uvedomil alebo pocítil varovné príznaky. Pacienti musia byť informovaní a má sa im odporučiť zvýšená opatrnosť pri vedení vozidiel a obsluhe strojov počas
liečby Oprymeou. Pacienti, u ktorých sa vyskytla somnolencia a/alebo náhly spánok, sa musia vyvarovať vedeniu vozidla alebo obsluhy strojov. Okrem toho sa môže zvážiť zníženie dávky alebo ukončenie liečby. Kvôli možným vedľajším účinkom sa má odporučiť zvýšená obozretnosť, najmä keď pacienti užívajú v kombinácii s pramipexolom ďalšie sedatívne lieky alebo alkohol (pozri časti
4.5, 4.7 a 4.8).
Poruchykontrolyimpulzov
Pacienti majú byť pravidelne monitorovaní z dôvodu vývoja porúch kontroly impulzov. Pacienti a
opatrovatelia majú byť upovedomení, že u pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môžu vyskytnúť behaviorálne symptómy porúch kontroly impulzov zahŕňajúce patologické hráčstvo, zvýšené libido, hypersexualitu, chorobné míňanie alebo nakupovanie,prejedanie sa a chorobné nutkavé jedenie. Ak sa vyvinú takéto symptómy, má sa zvážiť zníženie dávky/postupné vysadenie lieku.
Mániaadelírium
Má sa pravidelne sledovať, či sa u pacientov nevyvinie mánia a delírium. Pacienti a ošetrovatelia sa majú informovať, že u pacientov liečených pramipexolom sa môže vyskytnúť mánia a delírium. Ak sa vyvinú tieto príznaky, má sa zvážiť zníženie dávky/postupné prerušenie liečby
Pacientis psychotickýmiporuchami
Pacienti s psychotickými poruchami majú byť liečení agonistmi dopamínu len vtedy, ak očakávaný prínos prevýši riziko. Je nutné vyvarovať sa súčasnému podávaniu pramipexolu s antipsychotickými liekmi (pozri časť 4.5).
Oftalmologickésledovania
V pravidelných intervaloch sa odporúča oftalmologické sledovanie alebo v prípade výskytu poruchy zraku.
Závažnékardiovaskulárneochorenia
V prípade závažného kardiovaskulárneho ochorenia má byť zvýšená starostlivosť. Odporúča sa sledovať krvný tlak, najmä na začiatku liečby, vzhľadom na všeobecné riziko posturálnej hypotenzie
spojenej s dopaminergnou liečbou.
Neuroleptickýmalígnysyndróm
Po náhlom ukončení dopaminergnej terapie boli hlásené príznaky naznačujúce neuroleptický malígny
syndróm (pozri časť 4.2).
4.5 Liekové a iné interakcie
Väzbanaplazmatickébielkoviny
U ľudí sa pozorovala nízka biotransformácia a veľmi nízka (<20%) väzba pramipexolu na plazmatické bielkoviny. Preto je interakcia s inými liekmi pôsobiacimi na väzbu na plazmatické bielkoviny alebo
na vylučovanie biotransformáciou nepravdepodobná. Pretože anticholinergiká sa vylučujú prevažne biotransformáciou, možnosť interakcie je obmedzená, hoci sa interakcia s anticholinergikami neskúmala. Neexistujú farmakokinetické interakcie so selegilínom ani levodopou.
Inhibítory/kompetítoryaktívnehorenálnehovylučovania
Cimetidín znižuje renálny klírens pramipexolu približne o 34%, pravdepodobne inhibíciou katiónového vylučovacieho transportného systému renálnych tubulov. Preto lieky, ktoré sú inhibítory tohto aktívneho renálneho vylučovania alebo sa vylučujú touto cestou ako sú cimetidín, amantadín, mexiletín, zidovudín, cisplatina, chinín a prokainamid môžu vzájomne reagovať s pramipexolom, čo má za následok zníženie klírensu pramipexolu. Ak sa tieto lieky podávajú súčasne s Oprymeou, má sa zvážiť zníženie dávky pramipexolu.
Kombináciaslevodopou
Ak sa Oprymea podáva v kombinácii s levodopou, odporúča sa pri zvyšovaní dávky Oprymey zníženie dávky levodopy a dávka ďalších antiparkinsoník sa má udržiavať konštantná.
Kvôli možným vedľajším účinkom sa vyžaduje opatrnosť u pacientov užívajúcich iné sedatívne lieky alebo alkohol v kombinácii s pramipexolom (pozri časti 4.4, 4.7 a 4.8).
Antipsychotiká
Treba sa vyhýbať súčasnému podávaniu antipsychotík s pramipexolom (pozri časť 4.4), napr. ak je možné očakávať antagonistický učinok.
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí sa nepozoroval vplyv na priebeh gravidity a laktácie. Pramipexol nebol teratogénny u potkanov
a králikov, ale bol embryotoxický u potkanov pri toxických dávkach podaných gravidnej samici (pozri časť 5.3). Oprymea sa nemá používať počas gravidity, len ak je to výslovne nevyhnutné, t.j. ak možný prínos preváži možné riziko na plod.
Laktácia
Pretože liečba pramipexolom inhibuje vylučovanie prolaktínu u ľudí, možno očakávať aj inhibíciu laktácie. Vylučovanie pramipexolu do materského mlieka u žien sa neskúmalo. U potkanov bola koncentrácia rádioaktívne označeného liečiva vyššia v materskom mlieku ako v plazme.
Pre chýbajúce údaje u ľudí sa Oprymea nemá užívať počas dojčenia. Ak je však jeho užívanie nevyhnuté, dojčenie sa má prerušiť.
Fertilita
Neboli vykonané žiadne štúdie o vplyve na fertilitu u ľudí. V štúdiách na zvieratách, pramipexol
ovplyvnil estrálne cykly a znížil fertilitu samičiek, tak ako sa očakávalo u dopamínového agonistu. Tieto štúdie nepreukázali priame alebo nepriame škodlivé účinky vzhľadom na samčiu fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Oprymea môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje.

Môžu sa objaviť halucinácie alebo somnolencia.
Pacienti liečení Oprymeou a u ktorých sa vyskytla somnolencia a/alebo epizódy náhleho spánku, musia byť informovaní, že nemajú viesť vozidlá alebo sa zaoberať činnosťami, kde by im alebo ostatným, nedostatok pozornosti mohol priniesť riziko vážneho zranenia alebo smrti (napr. obsluhovanie strojov), kým nebudú vedieť zvládať rekurentné epizódy a somnolenciu (pozri aj časti
4.4, 4.5 a 4.8).
4.8 Nežiaduce účinkyOčakávanénežiaducereakciePri užívaní Oprymey sa predpokladajú nasledovné nežiaduce účinky: neobvyklé sny, amnézia, príznaky poruchy správania - impulzívne a kompulzívne správanie, ako zvýšená chuť do jedla, patologické nakupovanie, hypersexualita a patologické hráčstvo; srdcové zlyhanie, stav zmätenosti, zápcha, ilúzie, závraty, dyskinéza, dyspnoe, únava, halucinácie, bolesť hlavy, štikútka, hyperkinéza, hyprefágia, hypotenzia, neprimerané vylučovanie antidiuretického hormónu, nespavosť, poruchy libida, nauzea, paranoja; periférny edém, pneumónia, svrbenie, vyrážka a iná hypersenzitivita, nepokoj, somnolencia, náhle nutkanie na spanie, synkopa, poruchy videnia zahŕňajúce dvojité videnie,
rozmazané videnie a obmezenú zrakovú ostrosť, vracanie, zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti.
Z analýzy združených placebom kontrolovaných štúdií vyplýva, že pri porovnaní celkovo 1 778 pacientov s Parkinsonovou chorobou užívajúcich pramipexol a 1 297 pacientov užívajúcich placebo boli v oboch skupinách často hlásené nežiaduce reakcie. 67% pacientov užívajúcich pramipexol a 54% pacientov užívajúcich placebo nahlásilo aspoň jednu nežiaducu reakciu.
Nežiaduce reakcie uvedené v tabuľke nižšie sú také, ktoré sa vyskytli u 0,1% alebo viacerých pacientov liečených pramipexolom a boli hlásené podstatne častejšie u pacientov užívajúcich pramipexol než placebo alebo také ktoré sa pokladali za klinicky významné. Väčšina nežiaducich reakcií bola mierna až stredná, zvyčajne sa objavili na začiatku liečby a väčšina vyzmizla v priebehu liečby.
V systéme orgánovej klasifikácie sú nežiaduce reakcie evidované podľa názvu frekvencie (počet pacientov, u ktorého sa očakáva výskyt reakcie) použitím nasledujúcich kategórií: veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až
<1/1 000); veľmi zriedkavé (<1/10 000).
Najčastejšie hlásené (³5%) nežiaduce reakcie u pacientov s Parkinsonovou chorobou, ktoré boli častejšie pri liečbe pramipexolom ako placebe, boli nauzea, dyskinéza, hypotenzia, závraty, somnolencia, nespavosť, zápcha, halucinácie, bolesť hlavy a únava. Výskyt somnolencie sa zvyšuje pri dávkach vyšších ako 1,5 mg soli pramipexolu denne (pozri časť 4.2). Častejším nežiaducim účinkom v kombinácii s levodopou bola dyskinéza. Na začiatku liečby sa môže objaviť hypotenzia hlavne, ak je pramipexol titrovaný príliš rýchlo.
Systém orgánovej klasifikácie Nežiaduca reakcia
Infekcie a nákazy
Menej časté pneumónia
Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy
Časté abnormálne sny, príznaky poruchy správania-impulzívne a kompulzívne správanie, zmätenosť, halucinácie, nespavosť
Menej časté nadmerné prejedanie sa1, chorobné nakupovanie, delúzie, hyperfágia1, hypersexualita, poruchy libida, paranoja,
patologické hráčstvo, nepokoj, delírium
Zriedkavé mánia

Poruchy nervového systému
Veľmi časté závraty, dyskinéza, somnolencia
Časté bolesť hlavy
Menej časté amnézia, hyperkinéza, epizódy náhleho spánku, synkopa
Poruchy oka
Časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava, periférny opuch
Laborátórne a funkčné vyšetrenia
Časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla
Menej časté zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže to byť aj menej. Presné stanovenie frekvencie výskytu nie je možné, keďže nežiaduci účinok sa nevyskytol v databáze 2 762 pacientov
klinickej štúdie, ktorí trpeli Parkinsonovou chorobou a boli liečení pramipexolom.
SomnolenciaPramipexol sa často spája so somnolenciou a v menej častých prípadoch sa spája s nadmernou somnolenciou počas dňa a s epizódami náhleho nutkania na spanie (pozri tiež časť 4.4).
PoruchylibidaPramipexol sa môže menej často spájať s poruchami libida (zvýšenie alebo zníženie).
Poruchykontrolyimpulzov
U pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môže vyskytnúť patologické hráčstvo, zvýšené libido, hypersexualita, chorobné míňanie alebo nakupovanie, nenásytné jedenie a chorobné jedenie (pozri časť 4.4).
V prierezovej retrospektívnej štúdii typu case-control, ktorá zahrňala 3 090 pacientov s Parkinsonovou chorobou, 13,6% všetkých pacientov, ktorí dostávali dopaminergnú a non-dopaminergnú liečbu malo za posledných 6 mesiacov príznaky impulzívneho správania. Sledované prejavy zahŕňajú patologické hráčstvo, patologické nakupovanie, zvýšenú chuť do jedla a kompulzívne sexuálne správanie (hypersexualitu). Možné nezávislé rizikové faktory impulzívneho správania zahŕňali dopaminergnú liečbu a vyššie dávky dopaminergnej liečby, nižší vek (≤65 rokov), slobodný stav a pacientom
uvedené hráčstvo v rodinnej anamnéze.
SrdcovézlyhanieV klinických štúdiách a na základe skúseností po uvedení lieku na trh u pacientov liečených pramipexolom bolo hlásené srdcové zlyhanie. Vo farmakoepidemiologickej štúdii sa užívanie pramipexolu spájalo so zvýšeným rizikom výskytu srdcového zlyhania v porovnaní s pacientami, ktoríneužívali pramipexol (zistená miera rizika 1,86; 95 % Cl, 1,21-2,85).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
Príznaky
So závažným predávkovaním nie sú klinické skúsenosti. Očakávané nežiaduce účinky môžu byť tie, ktoré súvisia s farmakodynamickým profilom dopamínových agonistov vrátane nauzey, vracania, hyperkinézy, halucinácií, nepokoja a hypotenzie.
Liečba
Nie je stanovená protilátka na predávkovanie dopamínovými agonistmi. Ak sa vyskytnú prejavy stimulácie centrálneho nervového systému, môže byť indikované podanie neuroleptík. Zvládnutie predávkovania môže vyžadovať všeobecné podporné prostriedky zahŕňajúce výplach žalúdka, intravenózne podávanie tekutín, podávanie aktívneho uhlia a monitorovanie EKG.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiparkinsoniká, agonisty dopamínu, ATC kód: N04BC05. Mechanizmusúčinku
Pramipexol je dopamínový agonist, ktorý sa viaže s veľkou selektívnosťou a špecifickosťou na dopamínové receptory podtriedy D2 a má prednostnú afinitu k D3 receptorom a má plnú vnútornú aktivitu.
Pramipexol zmierňuje parkinsonovský motorický deficit stimuláciou dopamínových receptorov v striate. Pokusy na zvieratách ukázali, že pramipexol inhibuje syntézu dopamínu, jeho vylučovanie a premenu.
Farmakodynamickéúčinky
U zdravých dobrovoľníkov sa pozoroval od dávky zavislý pokles prolaktínu. V klinickej štúdii so zdravými dobrovoľníkmi, kde boli pramipexol tablety s predlženým uvoľňovaním titrované rýchlejšie (každé 3 dni) ako bolo odporúčané až do 3,15 mg bázy pramipexolu (4,5 mg soli) denne, sa pozorovalo zvýšenie krvného tlaku a tepovej frekvencie. Takýto účinok sa nepozoroval u pacientov v štúdii.
Klinickáúčinnosťa bezpečnosťpriParkinsonovejchorobe
U pacientov užívajúcich pramipexol sa zmiernili prejavy a symptómy idiopatickej Parkinsonovej choroby. Placebom kontrolované klinické štúdie zahrňali približne 1 800 pacientov liečených pramipexolom v štádiách I-V podľa Hoehna a Yahra. Okrem nich približne 1 000 pacientov
v pokročilejších štádiách choroby dostávalo súčasne levodopu a trpeli motorickými komplikáciami.
Pri rannej a pokročilej Parkinsonovej chorobe bola účinnosť pramipexolu v kontrolovaných klinických štúdiách udržiavaná na rovnakej úrovni po dobu približne 6 mesiacov. V otvorených pokračovacích štúdiách trvajúcich viac ako 3 roky sa nezaznamenali znaky klesajúcej účinnosti. V kontrolovanej dvojročnej dvojito zaslepenej štúdii začiatok liečby pramipexolom v porovnaní so začatím liečby levodopou výrazne oddialil nástup motorických komplikácií a znížil ich výskyt. Toto oddialenie motorických komplikácií pri pramipexole má vyrovnať vyššie zlepšenie motorických funkcií
s levodopou (merané ako stredná hodnota zmeny v UPDRS škále). Celkový výskyt halucinácií
a somnolencie bol všeobecne vyšší vo fáze zvyšovania v skupine užívajúcej pramipexol. Avšak počas udržiavacej fázy sa výrazný rozdiel nezaznamenal. Tieto skutočnosti sa majú zvážiť, keď sa
u pacientov s Parkinsonovou chorobou začína liečba pramipexolom.
Bezpečnosť a účinnosť tabliet s predĺženým uvoľňovaním s pramipexolom pri liečbe Parkinsonovej chororby sa hodnotila v nadnárodnom vývojovom programe lieku, ktorý pozostával z troch randomizovaných kontrolovaných štúdií. Dve štúdie prebehli u pacientov v ranom štádiu Parkinsonovej choroby a jedna štúdia prebehla u pacientov v pokročilom štádiu Parkinsonovej choroby.
Výhoda pramipexolu - tabliet s predĺženým uvoľňovaním oproti placebu sa preukázala po 18 týždňoch liečby na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (CGI-I a PGI-I responder rates) konečnom stave účinnosti dvojito slepej placebom kontrolovanej štúdie, ktorá zahŕňala celkovo
539 pacientov s Parkinsonovou chrobou v ranom štádiu. Zachovanie účinnosti sa preukázalo u pacientov liečených 33 týždňov. Pramipexol tablety s predĺženým uvoľňovaním boli non-inferiórne voči pramipexolu v tabletách s okamžitým uvoľňovaním, ako to bolo vyhodnotené v 33 týždni podľa UPDRS škály časti II+III.
V dvojito zaslepenej placebom kontrolovanej štúdii, ktorá zahŕňala celkovo 517 pacientov
s Parkinsonovou chorobou v pokročilom štádiu, ktorí súčasne užívali levodopu, sa po 18 týždňoch liečby, preukázala výhoda pramipexol tabliet s predĺženým uvoľňovaním voči placebu na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (off-time) konečnom stave účinnosti.
Účinnosť a znášanlivosť okamžitého prestavenia z pramipexolu - tabliet na pramipexol tablety
s predĺženým uvoľňovaním pri tej istej dennej dávke sa hodnotili v dvojito zaslepenej klinickej štúdii
u pacientov s Parkinsonovou chorobou v ranom štádiu.
Účinnosť sa udržala u 87 zo 103 pacientov, ktorí prešli na pramipexol tablety s predĺženým uvoľňovaním. Z týchto 87 pacientov, 82,8% nezmenilo svoju dávku, 13,8% zvýšilo a 3,4% znížilo svoju dávku.
U polovicie zo 16 pacientov, ktorí nesplnili kritérium udržania účinnosti podľa škály UPDRS časť
II+III, sa zmena základnej línie nepovažovala za klinický významnú.
Iba jeden pacient, ktorý prešiel na pramipexol tablety s predĺženým uvoľňovaním sa zaznamenal
nežiaducu udalosť spojenú s užívaním lieku, čo viedlo k ukončeniu liečby.
Pediatrickápopulácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s pramipexolom vo všetkých podskupinách pediatrickej populácie pre Parkinsonovu chorobu ( informácie o použití
v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorbcia
Pramipexol sa po perorálnom podaní úplne absorbuje. Absolútna biologická dostupnosť je vyššia ako
90%.
Vo fáze I klinickej štúdie, v ktorej sa hodnotili pramipexol tablety s okamžitým uvoľňovaním a s tablety predĺženým uvoľňovaním užívané nalačno boli minimálne a maximálne plazmatické koncentrácie (Cmin, Cmax) a plocha pod krivkou (AUC) rovnaké pri tej istej dennej dávke pramipexol tabliet s predĺženým uvoľňovaním podávaných raz denne a pramipexol tabliet podávaných trikrát denne.
Podávanie pramipexolu tabliet s predĺženým uvoľňovaním raz denne spôsobuje menej časté výkyvy plazmatickej koncentrácie pramipexolu v priebehu 24 hodín v porovnaní s podávaním pramipexolu tabliet s okamžitým uvolňovaním trikrát denne.
Maximálne plazmatické koncentrácie sa objavia približne 6 hodín po podaní pramipexol tabliet
s predĺženým uvoľňovaním raz denne. Rovnovážny stav plochy pod krivkou sa dosiahne najneskôr po
5 dňoch súvislého užívania.
Súčasné podávanie s jedlom vo všeobecnosti neovplyvňuje biologickú dostupnosť pramipexolu. Konzumácia potravín s vysokým obsahom tuku zvyšuje u zdravých dobrovoľníkov plazmatickú
koncentráciu (Cmax) asi o 24% po podaní jednej dávky a asi o 20% po podaní opakovanej dávky
a spôsobuje asi 2-hodinové oneskorenie v dosiahnutí maximálnej koncentrácie. Celkovú plochu pod
krivkou (AUC) neovplyvnil príjem potravy. Zvýšená Cmax sa nepovažuje za klinicky významnú. Vo fáze III klinických štúdií, ktoré určovali bezpečnosť a účinnosť pramipexolu tabliet s predĺženým uvoľňovaním, boli pacienti poučení, aby užívali skúšaný liek bez ohľadu na konzumované potraviny.
Keďže telesná hmotnosť nemá žiadny dopad na AUC, nezistil sa žiaden vplyv na distribučný objem a tým aj na maximálnu koncentráciu Cmax.Telesná hmotnosť znížená o 30 kg viedie k zvýšeniu Cmax o 45%. Vo fáze III klinických štúdií pacientov s Parkinsonovou chorobou nebol zistený žiadny klinicky význymný vplyv telesnej hmotnosti na terapeutický účinok a znášanlivosť pramipexolu tabliet s predĺženým uvoľňovaním.
Pramipexol preukazuje lineárnu kinetiku a malú variabilitu plazmatických hladín medzi jednotlivými pacientami.
Distribúcia
U ľudí je väzba pramipexolu na bielkoviny veľmi nízka (<20%) a distribučný objem je rozsiahly (400 l). Vysoké koncentrácie v mozgovom tkanive sa pozorovali u potkanov (približne 8-násobok koncentrácie v plazme).
Biotransformácia
Pramipexol sa u ľudí metabolizuje len v malom rozsahu.
Eliminácia
Hlavnou cestou vylučovania je renálna exkrécia nezmeneného pramipexolu. Približne 90% dávky označenej 14C sa vylúči obličkami a menej ako 2% sa nachádza v stolici. Celkový klírens pramipexolu je približne 500 ml/min a renálny klírens je približne 400 ml/min. Eliminačný polčas (t½) kolíše od
8 hodín u mladých do 12 hodín u starších pacientov.
5.3 Predklinické údaje o bezpečnosti
Štúdie toxicity po opakovanom podaní ukázali, že pramipexol má vplyv prevažne na funkcie CNS a ženského reprodukčného systému, pravdepodobne v dôsledku svojho zvýšeného farmakodynamického účinku.
U miniprasiat bolo zaznamenané zníženie diastolického i systolického tlaku a pokles tepovej frekvencie a sklon k hypotenznému účinku sa zaznamenal u opíc.
U potkanov a králikov boli zistené možné účinky pramipexolu na reprodukčnú funkciu. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre matku. V dôsledku výberu živočíšnych druhov a obmedzenia sledovaných parametrov neboli nežiaduce účinky pramipexolu na graviditu a mužskú fertilitu plne objasnené.
U potkanov sa pozorovalo oneskorenie pohlavného vývoja (t.j. oddelenie predkožky a vaginálneho vchodu). Relevantnosť týchto zistení pre ľudí nie je známa.
Pramipexol nebol genotoxický. V štúdii karcinogenity sa u samcov potkanov rozvinula hyperplázia Leydigových buniek a adenómy, ktoré sa vysvetľujú inhibičným účinkom pramipexolu na prolaktín. Tento nález nie je klinicky relevantný pre človeka. Rovnaká štúdia tiež preukázala, že pri dávkach pramipexolu 2 mg/kg (vo forme soli) a vyšších sa u albínskych potkanov pozorovala degenerácia sietnice. Tento posledný nález sa však nepozoroval u pigmentovaných potkanov, ako ani pri dvojročnej štúdii karcinogenity u albínskych myší či iných sledovaných živočíšnych druhov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
hyproemlóza kukuričný škrob
bezvodý koloidný oxid kremičitý
magnéziumstearát
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky pri uchovávaní.
6.5 Druh obalu a obsah baleniaBlister (OPA/ALU/vysušovadlo/PE-ALU fólia): 10, 30, 90 alebo 100 tabliet s predĺženým uvoľňovaním, v škatuľke.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky na likvidáciu.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIKRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Slovinsko
8. REGISTRAČNÉ ČÍSLA10 tabliet s predĺženým uvoľňovaním: EU/1/08/469/038
30 tabliet s predĺženým uvoľňovaním: EU/1/08/469/039
90 tabliet s predĺženým uvoľňovaním: EU/1/08/469/040
100 tabliet s predĺženým uvoľňovaním: EU/1/08/469/041
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12. septembra 2008
Dátum posledného predĺženia registrácie: 09. apríl 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Oprymea 2,1 mg tablety s predĺženým uvoľňovaním
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá tableta s predĺženým uvoľňovaním obsahuje 2,1 mg pramipexolu (čo zodpovedá 3 mg monohydrátu pramipexoliumdichloridu).
Prosím, venujte pozornosť:Dávky pramipexolu, ktoré sú uvedené v literatúre, sa vzťahujú na pramipexol vo forme soli. Preto budú dávky uvádzané pre bázu pramipexolu, ako aj pre soľ pramipexolu (v zátvorkách).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMATableta s predĺženým uvoľňovaním.
Biele alebo takmer biele, okrúhle (priemer 10 mm), mierne bikonvexné tablety s vyrazeným P4 na jednej strane, so skosenými hranami a možnými škvrnami.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieOprymea je určená u dospelých na liečbu prejavov a symptómov idiopatickej Parkinsonovej choroby, samotná (bez levodopy) alebo v kombinácii s levodopou, t.j. počas priebehu choroby k neskorým štádiám, keď účinok levodopy slabne alebo sa stáva nepravidelný a objavujú sa výkyvy liečebného efektu (dosiahnutie hornej hranice dávky alebo striedanie stavov „on-off“).
4.2 Dávkovanie a spôsob podávaniaDávkovanie
Oprymea tablety s predĺženým uvoľňovaním predstavujú perorálnu formu pramipexolu, ktorá sa
podáva raz denne.
Začiatok liečbyDávka sa má zvyšovať postupne, každých 5–7 dní, so začiatočnou dávkou 0,26 mg bázy (0,375 mg soli) denne. Potrebná dávka sa má titrovať tak, aby došlo k maximálnemu liečebnému efektu za predpokladu, že sa u pacienta neprejavia netolerovateľné nežiaduce účinky.
Vzostupná dávkovacia schéma Oprymea tabliet s predĺženým uvoľňovaním
Týždeň Denná dávka (mg bázy) Denná dávka (mg soli)

1 0,26 0,375
2 0,52 0,75
3 1,05 1,5
Ak je potrebné ďalšie zvyšovanie dennej dávky, má sa zvyšovať po 0,52 mg bázy (0,75 mg soli) v
týždňových intervaloch až do maximálnej dennej dávky 3,15 mg bázy (4,5 mg soli) denne.
Treba však poznamenať, že pri dávkach vyšších ako 1,05 mg bázy (1,5 mg soli) denne sa zvyšuje výskyt somnolencie (pozri časť 4.8).
Pacienti, ktorí už užívajú tablety Oprymey môžu byť okamžite prestavení na Oprymeu tablety s predĺženým uvoľňovaním, pri rovnakej dennej dávke. Po prestavení na Oprymeu tablety
s predĺženým uvoľňovaním, sa dávka môže upraviť v závislosti od terapeutickej reakcie pacienta
(pozri časť 5.1).
Udržiavacia liečba
Individuálna dávka pramipexolu má byť v rozmedzí od 0,26 mg bázy (0,375 mg soli) do maximálne
3,15 mg bázy (4,5 mg soli) denne. Pri zvyšovaní dávky v úvodných štúdiách sa účinnosť pozorovala pri počiatočnej dennej dávke 1,05 mg bázy (1,5 mg soli). Ďalšia úprava dávkovania by mala byť založená na klinickej reakcii a na výskyte nežiaducich reakcií. V klinických štúdiách približne 5% pacientov bolo liečených dávkami menšími než 1,05 mg bázy (1,5 mg soli). Pri pokročilej Parkinsonovej chorobe môžu byť dávky pramipexolu vyššie ako 1,05 mg bázy (1,5 mg soli) denne užitočné pre pacientov, kde sa plánuje znižovanie dávok levodopy. Odporúča sa, aby sa dávka levodopy znižovala tak počas zvyšovania dávky, ako aj pri udržiavacej liečbe s Oprymeou v závislosti od reakcie jednotlivých pacientov (pozri časť 4.5).'
Vynechaniedávky
Keď pacient zabudne užiť dávku, majú sa tablety Oprymey s predĺženým uvoľňovaním užiť do 12
hodín po stanovenom čase. Po 12 hodinách sa má vynechaná dávka vypustiť a nasledujúca dávka sa má užiť ďalší deň v príslušnom čase.
Prerušenieliečby
Náhle prerušenie dopamínovej terapie môže viesť k rozvoju neuroleptického malígneho syndrómu. Postupne sa má znižovať dávka pramipexolu po 0,52 mg bázy (0,75 mg soli) denne do dosiahnutia dennej dávky zníženej na 0,52 mg bázy (0,75 mg soli). Potom sa dávka znižuje po 0,26 mg bázy (0,375 mg soli) denne (pozri časť 4.4)
Pacienti s poškodením funkcie obličiek
Vylučovanie pramipexolu závisí od funkcie obličiek. Pre začiatok liečby sa navrhuje nasledovná schéma dávkovania:
U pacientov s klírensom kreatinínu nad 50 ml/min sa nevyžaduje zníženie dennej dávky alebo frekvencie dávkovania.
U pacientov s hodnotami klírensu kreatinínu medzi 30 a 50 ml/min sa má liečba začať podávaním 0,26 mg Oprymea tabliet s predĺženým uvoľňovaním obdeň. Pred zvyšovaním na denné dávkovanie po jednom týždni treba dôkladne vyhodnotiť terapeutickú reakciu a znášanlivosť lieku. Ak je potrebné ďalšie zvýšenie dávky, dávky sa majú zvyšovať o 0,26 mg bázy pramipexolu v týždenných intervaloch až po maximálnu dávku 1,57 mg bázy pramipexolu (2,25 mg soli) denne.
Liečba pacientov Oprymea tabletami s predĺženým uvoľňovaním, ktorí majú klírens kreatinínu nižší ako 30 ml/min sa neodporúča, kedže o tejto skupine pacientov nie sú dostupné žiadne údaje. Preto sa má zvážit užívanie Oprymea tabliet.
Ak sa počas udržiavacej terapie zníži funkcia obličiek, majú sa rešpektovať vyššie uvedené odporúčania.
Pacienti s poškodením funkcie pečene
Úprava dávky u pacientov so zlyhaním pečene pravdepodobne nie je potrebná, keďže približne 90% absorbovaného liečiva sa vylučuje obličkami. V každom prípade sa neskúmal možný vplyv insuficiencie pečene na farmakokinetiku Oprymey.
Pediatrická populácia
Bezpečnosť a účinnosť Oprymey u detí do 18 rokov sa nesledovala. Nie je žiadne opodstatnenie pre používanie Oprymea tabliet s predĺženým uvoľňovaním v pediatrickej populácii s Parkinsonovou chorobou.
Spôso
b
podávania
Tablety sa majú prehĺtať celé s vodou a nesmú sa rozhrýzť, rozdeliť alebo rozdrviť. Tablety sa môžu užívať buď s jedlom alebo bez jedla a majú sa užívať každý deň v rovnakom čase.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pri predpisovaní Oprymey pacientom s Parkinsonovou chorobou a s poškodením obličiek sa odporúča znížené dávkovanie podľa časti 4.2.
Halucinácie
Pri liečbe dopamínovými agonistmi a levodopou sú známym nežiaducim účinkom halucinácie. Pacienti majú byť informovaní, že sa môžu objaviť (prevažne vizuálne) halucinácie.
Dyskinéza
Pri pokročilej Parkinsonovej chorobe sa pri kombinácii s levodopou môže počas začiatočnej titrácie dávky Oprymey objaviť dyskinéza. Ak sa objaví, dávka levodopy sa má znížiť.
Epizódynáhlehospánkuasomnolencie
Pramipexol bol spájaný so somnolenciou a epizódami náhleho spánku, najmä u pacientov s Parkinsonovou chorobou. Menej často bol zaznamenaný náhly spánok počas bežných denných aktivít, niekedy bez toho, aby si to pacient uvedomil alebo pocítil varovné príznaky. Pacienti musia byť informovaní a má sa im odporučiť zvýšená opatrnosť pri vedení vozidiel a obsluhe strojov počas
liečby Oprymeou. Pacienti, u ktorých sa vyskytla somnolencia a/alebo náhly spánok, sa musia vyvarovať vedeniu vozidla alebo obsluhy strojov. Okrem toho sa môže zvážiť zníženie dávky alebo ukončenie liečby. Kvôli možným vedľajším účinkom sa má odporučiť zvýšená obozretnosť, najmä keď pacienti užívajú v kombinácii s pramipexolom ďalšie sedatívne lieky alebo alkohol (pozri časti
4.5, 4.7 a 4.8).
Poruchykontrolyimpulzov
Pacienti majú byť pravidelne monitorovaní z dôvodu vývoja porúch kontroly impulzov. Pacienti a
opatrovatelia majú byť upovedomení, že u pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môžu vyskytnúť behaviorálne symptómy porúch kontroly impulzov zahŕňajúce patologické hráčstvo, zvýšené libido, hypersexualitu, chorobné míňanie alebo nakupovanie, prejedanie sa a chorobné nutkavé jedenie. Ak sa vyvinú takéto symptómy, má sa zvážiť zníženie dávky/postupné vysadenie lieku.
Mániaadelírium
Má sa pravidelne sledovať, či sa u pacientov nevyvinie mánia a delírium. Pacienti a ošetrovatelia sa majú informovať, že u pacientov liečených pramipexolom sa môže vyskytnúť mánia a delírium. Ak sa vyvinú tieto príznaky, má sa zvážiť zníženie dávky/postupné prerušenie liečby.
Pacientis psychotickýmiporuchami
Pacienti s psychotickými poruchami majú byť liečení agonistmi dopamínu len vtedy, ak očakávaný prínos prevýši riziko. Je nutné vyvarovať sa súčasnému podávaniu pramipexolu s antipsychotickými liekmi (pozri časť 4.5).
Oftalmologickésledovania
V pravidelných intervaloch sa odporúča oftalmologické sledovanie alebo v prípade výskytu poruchy zraku.
Závažnékardiovaskulárneochorenia
V prípade závažného kardiovaskulárneho ochorenia má byť zvýšená starostlivosť. Odporúča sa sledovať krvný tlak, najmä na začiatku liečby, vzhľadom na všeobecné riziko posturálnej hypotenzie
spojenej s dopaminergnou liečbou.
Neuroleptickýmalígnysyndróm
Po náhlom ukončení dopaminergnej terapie boli hlásené príznaky naznačujúce neuroleptický malígny
syndróm (pozri časť 4.2).
4.5 Liekové a iné interakcie
Väzbanaplazmatickébielkoviny
U ľudí sa pozorovala nízka biotransformácia a veľmi nízka (<20%) väzba pramipexolu na plazmatické bielkoviny. Preto je interakcia s inými liekmi pôsobiacimi na väzbu na plazmatické bielkoviny alebo
na vylučovanie biotransformáciou nepravdepodobná. Pretože anticholinergiká sa vylučujú prevažne biotransformáciou, možnosť interakcie je obmedzená, hoci sa interakcia s anticholinergikami neskúmala. Neexistujú farmakokinetické interakcie so selegilínom ani levodopou.
Inhibítory/kompetítoryaktívnehorenálnehovylučovania
Cimetidín znižuje renálny klírens pramipexolu približne o 34%, pravdepodobne inhibíciou katiónového vylučovacieho transportného systému renálnych tubulov. Preto lieky, ktoré sú inhibítory tohto aktívneho renálneho vylučovania alebo sa vylučujú touto cestou ako sú cimetidín, amantadín, mexiletín, zidovudín, cisplatina, chinín a prokainamid môžu vzájomne reagovať s pramipexolom, čo má za následok zníženie klírensu pramipexolu. Ak sa tieto lieky podávajú súčasne s Oprymeou, má sa zvážiť zníženie dávky pramipexolu.
Kombináciaslevodopou
Ak sa Oprymea podáva v kombinácii s levodopou, odporúča sa pri zvyšovaní dávky Oprymey zníženie dávky levodopy a dávka ďalších antiparkinsoník sa má udržiavať konštantná.
Kvôli možným vedľajším účinkom sa vyžaduje opatrnosť u pacientov užívajúcich iné sedatívne lieky alebo alkohol v kombinácii s pramipexolom (pozri časti 4.4, 4.7 a 4.8).
Antipsychotiká
Treba sa vyhýbať súčasnému podávaniu antipsychotík s pramipexolom (pozri časť 4.4), napr. ak je možné očakávať antagonistický učinok.
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí sa nepozoroval vplyv na priebeh gravidity a laktácie. Pramipexol nebol teratogénny u potkanov
a králikov, ale bol embryotoxický u potkanov pri toxických dávkach podaných gravidnej samici (pozri časť 5.3). Oprymea sa nemá používať počas gravidity, len ak je to výslovne nevyhnutné, t.j. ak možný prínos preváži možné riziko na plod.
Laktácia
Pretože liečba pramipexolom inhibuje vylučovanie prolaktínu u ľudí, možno očakávať aj inhibíciu laktácie. Vylučovanie pramipexolu do materského mlieka u žien sa neskúmalo. U potkanov bola koncentrácia rádioaktívne označeného liečiva vyššia v materskom mlieku ako v plazme.
Pre chýbajúce údaje u ľudí sa Oprymea nemá užívať počas dojčenia. Ak je však jeho užívanie nevyhnuté, dojčenie sa má prerušiť.
Fertilita
Neboli vykonané žiadne štúdie o vplyve na fertilitu u ľudí. V štúdiách na zvieratách, pramipexol
ovplyvnil estrálne cykly a znížil fertilitu samičiek, tak ako sa očakávalo u dopamínového agonistu. Tieto štúdie nepreukázali priame alebo nepriame škodlivé účinky vzhľadom na samčiu fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Oprymea môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje.

Môžu sa objaviť halucinácie alebo somnolencia.
Pacienti liečení Oprymeou a u ktorých sa vyskytla somnolencia a/alebo epizódy náhleho spánku, musia byť informovaní, že nemajú viesť vozidlá alebo sa zaoberať činnosťami, kde by im alebo ostatným, nedostatok pozornosti mohol priniesť riziko vážneho zranenia alebo smrti (napr. obsluhovanie strojov), kým nebudú vedieť zvládať rekurentné epizódy a somnolenciu (pozri aj časti
4.4, 4.5 a 4.8).
4.8 Nežiaduce účinkyOčakávanénežiaducereakciePri užívaní Oprymey sa predpokladajú nasledovné nežiaduce účinky: neobvyklé sny, amnézia, príznaky poruchy správania - impulzívne a kompulzívne správanie, ako zvýšená chuť do jedla, patologické nakupovanie, hypersexualita a patologické hráčstvo; srdcové zlyhanie, stav zmätenosti, zápcha, ilúzie, závraty, dyskinéza, dyspnoe, únava, halucinácie, bolesť hlavy, štikútka, hyperkinéza, hyprefágia, hypotenzia, neprimerané vylučovanie antidiuretického hormónu, nespavosť, poruchy libida, nauzea, paranoja; periférny edém, pneumónia, svrbenie, vyrážka a iná hypersenzitivita, nepokoj, somnolencia, náhle nutkanie na spanie, synkopa, poruchy videnia zahŕňajúce dvojité videnie,
rozmazané videnie a obmezenú zrakovú ostrosť, vracanie, zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti.
Z analýzy združených placebom kontrolovaných štúdií vyplýva, že pri porovnaní celkovo 1 778 pacientov s Parkinsonovou chorobou užívajúcich pramipexol a 1 297 pacientov užívajúcich placebo boli v oboch skupinách často hlásené nežiaduce reakcie. 67% pacientov užívajúcich pramipexol a 54% pacientov užívajúcich placebo nahlásilo aspoň jednu nežiaducu reakciu.
Nežiaduce reakcie uvedené v tabuľke nižšie sú také, ktoré sa vyskytli u 0,1% alebo viacerých pacientov liečených pramipexolom a boli hlásené podstatne častejšie u pacientov užívajúcich pramipexol než placebo alebo také ktoré sa pokladali za klinicky významné. Väčšina nežiaducich reakcií bola mierna až stredná, zvyčajne sa objavili na začiatku liečby a väčšina vyzmizla v priebehu liečby.
V systéme orgánovej klasifikácie sú nežiaduce reakcie evidované podľa názvu frekvencie (počet pacientov, u ktorého sa očakáva výskyt reakcie) použitím nasledujúcich kategórií: veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až
<1/1 000); veľmi zriedkavé (<1/10 000).
Najčastejšie hlásené (³5%) nežiaduce reakcie u pacientov s Parkinsonovou chorobou, ktoré boli častejšie pri liečbe pramipexolom ako placebe, boli nauzea, dyskinéza, hypotenzia, závraty, somnolencia, nespavosť, zápcha, halucinácie, bolesť hlavy a únava. Výskyt somnolencie sa zvyšuje pri dávkach vyšších ako 1,5 mg soli pramipexolu denne (pozri časť 4.2). Častejším nežiaducim účinkom v kombinácii s levodopou bola dyskinéza. Na začiatku liečby sa môže objaviť hypotenzia hlavne, ak je pramipexol titrovaný príliš rýchlo.
Systém orgánovej klasifikácie Nežiaduca reakcia
Infekcie a nákazy
Menej časté pneumónia
Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy
Časté abnormálne sny, príznaky poruchy správania-impulzívne a kompulzívne správanie, zmätenosť, halucinácie, nespavosť
Menej časté nadmerné prejedanie sa1, chorobné nakupovanie, delúzie, hyperfágia1, hypersexualita, poruchy libida, paranoja,
patologické hráčstvo, nepokoj, delírium
Zriedkavé mánia

Poruchy nervového systému
Veľmi časté závraty, dyskinéza, somnolencia
Časté bolesť hlavy
Menej časté amnézia, hyperkinéza, epizódy náhleho spánku, synkopa
Poruchy oka
Časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava, periférny opuch
Laborátórne a funkčné vyšetrenia
Časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla
Menej časté zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže to byť aj menej. Presné stanovenie frekvencie výskytu nie je možné, keďže nežiaduci účinok sa nevyskytol v databáze 2 762 pacientov
klinickej štúdie, ktorí trpeli Parkinsonovou chorobou a boli liečení pramipexolom.
SomnolenciaPramipexol sa často spája so somnolenciou a v menej častých prípadoch sa spája s nadmernou somnolenciou počas dňa a s epizódami náhleho nutkania na spanie (pozri tiež časť 4.4).
PoruchylibidaPramipexol sa môže menej často spájať s poruchami libida (zvýšenie alebo zníženie).
Poruchykontrolyimpulzov
U pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môže vyskytnúť patologické hráčstvo, zvýšené libido, hypersexualita, chorobné míňanie alebo nakupovanie, nenásytné jedenie a chorobné jedenie (pozri časť 4.4).
V prierezovej retrospektívnej štúdii typu case-control, ktorá zahrňala 3 090 pacientov s Parkinsonovou chorobou, 13,6% všetkých pacientov, ktorí dostávali dopaminergnú a non-dopaminergnú liečbu malo za posledných 6 mesiacov príznaky impulzívneho správania. Sledované prejavy zahŕňajú patologické hráčstvo, patologické nakupovanie, zvýšenú chuť do jedla a kompulzívne sexuálne správanie (hypersexualitu). Možné nezávislé rizikové faktory impulzívneho správania zahŕňali dopaminergnú liečbu a vyššie dávky dopaminergnej liečby, nižší vek (≤65 rokov), slobodný stav a pacientom
uvedené hráčstvo v rodinnej anamnéze.
SrdcovézlyhanieV klinických štúdiách a na základe skúseností po uvedení lieku na trh u pacientov liečených pramipexolom bolo hlásené srdcové zlyhanie. Vo farmakoepidemiologickej štúdii sa užívanie pramipexolu spájalo so zvýšeným rizikom výskytu srdcového zlyhania v porovnaní s pacientami, ktoríneužívali pramipexol (zistená miera rizika 1,86; 95 % Cl, 1,21-2,85).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
Príznaky
So závažným predávkovaním nie sú klinické skúsenosti. Očakávané nežiaduce účinky môžu byť tie, ktoré súvisia s farmakodynamickým profilom dopamínových agonistov vrátane nauzey, vracania, hyperkinézy, halucinácií, nepokoja a hypotenzie.
Liečba
Nie je stanovená protilátka na predávkovanie dopamínovými agonistmi. Ak sa vyskytnú prejavy stimulácie centrálneho nervového systému, môže byť indikované podanie neuroleptík. Zvládnutie predávkovania môže vyžadovať všeobecné podporné prostriedky zahŕňajúce výplach žalúdka, intravenózne podávanie tekutín, podávanie aktívneho uhlia a monitorovanie EKG.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiparkinsoniká, agonisty dopamínu, ATC kód: N04BC05. Mechanizmusúčinku
Pramipexol je dopamínový agonist, ktorý sa viaže s veľkou selektívnosťou a špecifickosťou na dopamínové receptory podtriedy D2 a má prednostnú afinitu k D3 receptorom a má plnú vnútornú aktivitu.
Pramipexol zmierňuje parkinsonovský motorický deficit stimuláciou dopamínových receptorov v striate. Pokusy na zvieratách ukázali, že pramipexol inhibuje syntézu dopamínu, jeho vylučovanie a premenu.
Farmakodynamickéúčinky
U zdravých dobrovoľníkov sa pozoroval od dávky zavislý pokles prolaktínu. V klinickej štúdii so zdravými dobrovoľníkmi, kde boli pramipexol tablety s predlženým uvoľňovaním titrované rýchlejšie (každé 3 dni) ako bolo odporúčané až do 3,15 mg bázy pramipexolu (4,5 mg soli) denne, sa pozorovalo zvýšenie krvného tlaku a tepovej frekvencie. Takýto účinok sa nepozoroval u pacientov v štúdii.
Klinickáúčinnosťa bezpečnosť priParkinsonovejchorobe
U pacientov užívajúcich pramipexol sa zmiernili prejavy a symptómy idiopatickej Parkinsonovej choroby. Placebom kontrolované klinické štúdie zahrňali približne 1 800 pacientov liečených pramipexolom v štádiách I-V podľa Hoehna a Yahra. Okrem nich približne 1 000 pacientov
v pokročilejších štádiách choroby dostávalo súčasne levodopu a trpeli motorickými komplikáciami.
Pri rannej a pokročilej Parkinsonovej chorobe bola účinnosť pramipexolu v kontrolovaných klinických štúdiách udržiavaná na rovnakej úrovni po dobu približne 6 mesiacov. V otvorených pokračovacích štúdiách trvajúcich viac ako 3 roky sa nezaznamenali znaky klesajúcej účinnosti. V kontrolovanej dvojročnej dvojito zaslepenej štúdii začiatok liečby pramipexolom v porovnaní so začatím liečby levodopou výrazne oddialil nástup motorických komplikácií a znížil ich výskyt. Toto oddialenie motorických komplikácií pri pramipexole má vyrovnať vyššie zlepšenie motorických funkcií
s levodopou (merané ako stredná hodnota zmeny v UPDRS škále). Celkový výskyt halucinácií
a somnolencie bol všeobecne vyšší vo fáze zvyšovania v skupine užívajúcej pramipexol. Avšak počas udržiavacej fázy sa výrazný rozdiel nezaznamenal. Tieto skutočnosti sa majú zvážiť, keď sa
u pacientov s Parkinsonovou chorobou začína liečba pramipexolom.
Bezpečnosť a účinnosť tabliet s predĺženým uvoľňovaním s pramipexolom pri liečbe Parkinsonovej chororby sa hodnotila v nadnárodnom vývojovom programe lieku, ktorý pozostával z troch randomizovaných kontrolovaných štúdií. Dve štúdie prebehli u pacientov v ranom štádiu Parkinsonovej choroby a jedna štúdia prebehla u pacientov v pokročilom štádiu Parkinsonovej choroby.
Výhoda pramipexolu - tabliet s predĺženým uvoľňovaním oproti placebu sa preukázala po 18 týždňoch liečby na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (CGI-I a PGI-I responder rates) konečnom stave účinnosti dvojito slepej placebom kontrolovanej štúdie, ktorá zahŕňala celkovo
539 pacientov s Parkinsonovou chrobou v ranom štádiu. Zachovanie účinnosti sa preukázalo u pacientov liečených 33 týždňov. Pramipexol tablety s predĺženým uvoľňovaním boli non-inferiórne voči pramipexolu v tabletách s okamžitým uvoľňovaním, ako to bolo vyhodnotené v 33 týždni podľa UPDRS škály časti II+III.
V dvojito zaslepenej placebom kontrolovanej štúdii, ktorá zahŕňala celkovo 517 pacientov
s Parkinsonovou chorobou v pokročilom štádiu, ktorí súčasne užívali levodopu, sa po 18 týždňoch liečby, preukázala výhoda pramipexol tabliet s predĺženým uvoľňovaním voči placebu na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (off-time) konečnom stave účinnosti.
Účinnosť a znášanlivosť okamžitého prestavenia z pramipexolu - tabliet na pramipexol tablety
s predĺženým uvoľňovaním pri tej istej dennej dávke sa hodnotili v dvojito zaslepenej klinickej štúdii
u pacientov s Parkinsonovou chorobou v ranom štádiu.
Účinnosť sa udržala u 87 zo 103 pacientov, ktorí prešli na pramipexol tablety s predĺženým uvoľňovaním. Z týchto 87 pacientov, 82,8% nezmenilo svoju dávku, 13,8% zvýšilo a 3,4% znížilo svoju dávku.
U polovicie zo 16 pacientov, ktorí nesplnili kritérium udržania účinnosti podľa škály UPDRS časť
II+III, sa zmena základnej línie nepovažovala za klinický významnú.
Iba jeden pacient, ktorý prešiel na pramipexol tablety s predĺženým uvoľňovaním sa zaznamenal
nežiaducu reakciu spojenú s užívaním lieku, čo viedlo k ukončeniu liečby.
Pediatrickápopulácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s pramipexolom vo všetkých podskupinách pediatrickej populácie pre Parkinsonovu chorobu (informácie o použití
v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorbcia
Pramipexol sa po perorálnom podaní úplne absorbuje. Absolútna biologická dostupnosť je vyššia ako
90%.
Vo fáze I klinickej štúdie, v ktorej sa hodnotili pramipexol tablety s okamžitým uvoľňovaním a s tablety predĺženým uvoľňovaním užívané nalačno boli minimálne a maximálne plazmatické koncentrácie (Cmin, Cmax) a plocha pod krivkou (AUC) rovnaké, pri tej istej dennej dávke pramipexolu tabliet s predĺženým uvoľňovaním podávaných raz denne a pramipexol tabliet podávaných trikrát denne.
Podávanie pramipexolu tabliet s predĺženým uvoľňovaním raz denne spôsobuje menej časté výkyvy plazmatickej koncentrácie pramipexolu v priebehu 24 hodín v porovnaní s podávaním pramipexolu tabliet s okamžitým uvolňovaním trikrát denne.
Maximálne plazmatické koncentrácie sa objavia približne 6 hodín po podaní pramipexol tabliet
s predĺženým uvoľňovaním raz denne. Rovnovážny stav plochy pod krivkou sa dosiahne najneskôr po
5 dňoch súvislého užívania.
Súčasné podávanie s jedlom vo všeobecnosti neovplyvňuje biologickú dostupnosť pramipexolu. Konzumácia potravín s vysokým obsahom tuku zvyšuje u zdravých dobrovoľníkov plazmatickú
koncentráciu (Cmax) asi o 24% po podaní jednej dávky a asi o 20% po podaní opakovanej dávky
a spôsobuje asi 2-hodinové oneskorenie v dosiahnutí maximálnej koncentrácie. Celkovú plochu pod
krivkou (AUC) neovplyvnil príjem potravy. Zvýšená Cmax sa nepovažuje za klinicky významnú. Vo fáze III klinických štúdií, ktoré určovali bezpečnosť a účinnosť pramipexolu tabliet s predĺženým uvoľňovaním, boli pacienti poučení, aby užívali skúšaný liek bez ohľadu na konzumované potraviny.
Keďže telesná hmotnosť nemá žiadny dopad na AUC, nezistil sa žiaden vplyv na distribučný objem a tým aj na maximálnu koncentráciu Cmax.Telesná hmotnosť znížená o 30 kg viedie k zvýšeniu Cmax o 45%. Vo fáze III klinických štúdií pacientov s Parkinsonovou chorobou nebol zistený žiadny klinicky význymný vplyv telesnej hmotnosti na terapeutický účinok a znášanlivosť pramipexolu tabliet s predĺženým uvoľňovaním.
Pramipexol preukazuje lineárnu kinetiku a malú variabilitu plazmatických hladín medzi jednotlivými pacientami.
Distribúcia
U ľudí je väzba pramipexolu na bielkoviny veľmi nízka (<20%) a distribučný objem je rozsiahly (400 l). Vysoké koncentrácie v mozgovom tkanive sa pozorovali u potkanov (približne 8-násobok koncentrácie v plazme).
Biotransformácia
Pramipexol sa u ľudí metabolizuje len v malom rozsahu.
Eliminácia
Hlavnou cestou vylučovania je renálna exkrécia nezmeneného pramipexolu. Približne 90% dávky označenej 14C sa vylúči obličkami a menej ako 2% sa nachádza v stolici. Celkový klírens pramipexolu je približne 500 ml/min a renálny klírens je približne 400 ml/min. Eliminačný polčas (t½) kolíše od
8 hodín u mladých do 12 hodín u starších pacientov.
5.3 Predklinické údaje o bezpečnosti
Štúdie toxicity po opakovanom podaní ukázali, že pramipexol má vplyv prevažne na funkcie CNS a ženského reprodukčného systému, pravdepodobne v dôsledku svojho zvýšeného farmakodynamického účinku.
U miniprasiat bolo zaznamenané zníženie diastolického i systolického tlaku a pokles tepovej frekvencie a sklon k hypotenznému účinku sa zaznamenal u opíc.
U potkanov a králikov boli zistené možné účinky pramipexolu na reprodukčnú funkciu. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre matku. V dôsledku výberu živočíšnych druhov a obmedzenia sledovaných parametrov neboli nežiaduce účinky pramipexolu na graviditu a mužskú fertilitu plne objasnené.
U potkanov sa pozorovalo oneskorenie pohlavného vývoja (t.j. oddelenie predkožky a vaginálneho vchodu). Relevantnosť týchto zistení pre ľudí nie je známa.
Pramipexol nebol genotoxický. V štúdii karcinogenity sa u samcov potkanov rozvinula hyperplázia Leydigových buniek a adenómy, ktoré sa vysvetľujú inhibičným účinkom pramipexolu na prolaktín. Tento nález nie je klinicky relevantný pre človeka. Rovnaká štúdia tiež preukázala, že pri dávkach pramipexolu 2 mg/kg (vo forme soli) a vyšších sa u albínskych potkanov pozorovala degenerácia sietnice. Tento posledný nález sa však nepozoroval u pigmentovaných potkanov, ako ani pri dvojročnej štúdii karcinogenity u albínskych myší či iných sledovaných živočíšnych druhov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
hypromelóza kukuričný škrob
bezvodý koloidný oxid kremičitý
magnéziumstearát
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky pri uchovávaní.
6.5 Druh obalu a obsah baleniaBlister (OPA/ALU/vysušovadlo/PE-ALU fólia): 10, 30, 90 alebo 100 tabliet s predĺženým uvoľňovaním, v škatuľke.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky na likvidáciu.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIKRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Slovinsko
8. REGISTRAČNÉ ČÍSLA10 tabliet s predĺženým uvoľňovaním: EU/1/08/469/042
30 tabliet s predĺženým uvoľňovaním: EU/1/08/469/043
90 tabliet s predĺženým uvoľňovaním: EU/1/08/469/044
100 tabliet s predĺženým uvoľňovaním: EU/1/08/469/045
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12. septembra 2008
Dátum posledného predĺženia registrácie: 09. apríl 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Oprymea 2,62 mg tablety s predĺženým uvoľňovaním
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá tableta s predĺženým uvoľňovaním obsahuje 2,62 mg pramipexolu (čo zodpovedá 3,75 mg monohydrátu pramipexoliumdichloridu).
Prosím, venujte pozornosť:Dávky pramipexolu, ktoré sú uvedené v literatúre, sa vzťahujú na pramipexol vo forme soli. Preto budú dávky uvádzané pre bázu pramipexolu, ako aj pre soľ pramipexolu (v zátvorkách).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMATableta s predĺženým uvoľňovaním.
Biele alebo takmer biele, okrúhle (priemer 10 mm), mierne bikonvexné tablety s vyrazeným P13 na jednej strane a 262 na druhej strane, so skosenými hranami a možnými škvrnami.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieOprymea je určená u dospelých na liečbu prejavov a symptómov idiopatickej Parkinsonovej choroby, samotná (bez levodopy) alebo v kombinácii s levodopou, t.j. počas priebehu choroby k neskorým štádiám, keď účinok levodopy slabne alebo sa stáva nepravidelný a objavujú sa výkyvy liečebného efektu (dosiahnutie hornej hranice dávky alebo striedanie stavov „on-off“).
4.2 Dávkovanie a spôsob podávaniaDávkovanie
Oprymea tablety s predĺženým uvoľňovaním predstavujú perorálnu formu pramipexolu, ktorá sa
podáva raz denne.
Začiatok liečbyDávka sa má zvyšovať postupne, každých 5–7 dní, so začiatočnou dávkou 0,26 mg bázy (0,375 mg soli) denne. Potrebná dávka sa má titrovať tak, aby došlo k maximálnemu liečebnému efektu za predpokladu, že sa u pacienta neprejavia netolerovateľné nežiaduce účinky.
Vzostupná dávkovacia schéma Oprymea tabliet s predĺženým uvoľňovaním
Týždeň Denná dávka (mg bázy) Denná dávka (mg soli)

1 0,26 0,375
2 0,52 0,75
3 1,05 1,5
Ak je potrebné ďalšie zvyšovanie dennej dávky, má sa zvyšovať po 0,52 mg bázy (0,75 mg soli) v
týždňových intervaloch až do maximálnej dennej dávky 3,15 mg bázy (4,5 mg soli) denne.
Treba však poznamenať, že pri dávkach vyšších ako 1,05 mg bázy (1,5 mg soli) denne sa zvyšuje výskyt somnolencie (pozri časť 4.8).
Pacienti, ktorí už užívajú tablety Oprymey môžu byť okamžite prestavení na Oprymeu tablety s predĺženým uvoľňovaním, pri rovnakej dennej dávke. Po prestavení na Oprymeu tablety
s predĺženým uvoľňovaním, sa dávka môže upraviť v závislosti od terapeutickej reakcie pacienta
(pozri časť 5.1).
Udržiavacia liečba
Individuálna dávka pramipexolu má byť v rozmedzí od 0,26 mg bázy (0,375 mg soli) do maximálne
3,15 mg bázy (4,5 mg soli) denne. Pri zvyšovaní dávky v úvodných štúdiách sa účinnosť pozorovala pri počiatočnej dennej dávke 1,05 mg bázy (1,5 mg soli). Ďalšia úprava dávkovania má byť založená na klinickej reakcii a na výskyte nežiaducich reakcií. V klinických štúdiách približne 5% pacientov bolo liečených dávkami menšími ako 1,05 mg bázy (1,5 mg soli). Pri pokročilej Parkinsonovej chorobe môžu byť dávky pramipexolu vyššie ako 1,05 mg bázy (1,5 mg soli) denne užitočné pre pacientov, kde sa plánuje znižovanie dávok levodopy. Odporúča sa, aby sa dávka levodopy znižovala tak počas zvyšovania dávky, ako aj pri udržiavacej liečbe s Oprymeou v závislosti od reakcie jednotlivých pacientov (pozri časť 4.5).
Vynechaniedávky
Keď pacient zabudne užiť dávku, majú sa tablety Oprymey s predĺženým uvoľňovaním užiť do 12
hodín po stanovenom čase. Po 12 hodinách sa má vynechaná dávka vypustiť a nasledujúca dávka sa má užiť ďalší deň v príslušnom čase.
Prerušenieliečby
Náhle prerušenie dopamínovej terapie môže viesť k rozvoju neuroleptického malígneho syndrómu. Postupne sa má znižovať dávka pramipexolu po 0,52 mg bázy (0,75 mg soli) denne do dosiahnutia dennej dávky zníženej na 0,52 mg bázy (0,75 mg soli). Potom sa dávka znižuje po 0,26 mg bázy (0,375 mg soli) denne (pozri časť 4.4)
Pacienti s poruchou funkcie obličiek
Vylučovanie pramipexolu závisí od funkcie obličiek. Pre začiatok liečby sa navrhuje nasledovná schéma dávkovania:
U pacientov s klírensom kreatinínu nad 50 ml/min sa nevyžaduje zníženie dennej dávky alebo frekvencie dávkovania.
U pacientov s hodnotami klírensu kreatinínu medzi 30 a 50 ml/min sa má liečba začať podávaním 0,26 mg Oprymea tabliet s predĺženým uvoľňovaním obdeň. Pred zvyšovaním na denné dávkovanie po jednom týždni treba dôkladne vyhodnotiť terapeutickú reakciu a znášanlivosť lieku. Ak je potrebné ďalšie zvýšenie dávky, dávky sa majú zvyšovať o 0,26 mg bázy pramipexolu v týždenných intervaloch až po maximálnu dávku 1,57 mg bázy pramipexolu (2,25 mg soli) denne.
Liečba pacientov Oprymea tabletami s predĺženým uvoľňovaním, ktorí majú klírens kreatinínu nižší ako 30 ml/min sa neodporúča, kedže o tejto skupine pacientov nie sú dostupné žiadne údaje. Preto sa má zvážit užívanie Oprymea tabliet.
Ak sa počas udržiavacej terapie zníži funkcia obličiek, majú sa rešpektovať vyššie uvedené odporúčania.
Pacienti s poruchou funkcie pečene
Úprava dávky u pacientov so zlyhaním pečene pravdepodobne nie je potrebná, keďže približne 90% absorbovaného liečiva sa vylučuje obličkami. V každom prípade sa neskúmal možný vplyv insuficiencie pečene na farmakokinetiku Oprymey.
Pediatrická populácia
Bezpečnosť a účinnosť Oprymey u detí do 18 rokov sa nesledovala. Nie je žiadne opodstatnenie pre používanie Oprymea tabliet s predĺženým uvoľňovaním v pediatrickej populácii s Parkinsonovou chorobou.
Spôso
b
podávania
Tablety sa majú prehĺtať celé s vodou a nesmú sa rozhrýzť, rozdeliť alebo rozdrviť. Tablety sa môžu užívať buď s jedlom alebo bez jedla a majú sa užívať každý deň v rovnakom čase.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pri predpisovaní Oprymey pacientom s Parkinsonovou chorobou a s poškodením obličiek sa odporúča znížené dávkovanie podľa časti 4.2.
Halucinácie
Pri liečbe dopamínovými agonistmi a levodopou sú známym nežiaducim účinkom halucinácie. Pacienti majú byť informovaní, že sa môžu objaviť (prevažne vizuálne) halucinácie.
Dyskinéza
Pri pokročilej Parkinsonovej chorobe sa pri kombinácii s levodopou môže počas začiatočnej titrácie dávky Oprymey objaviť dyskinéza. Ak sa objaví, dávka levodopy sa má znížiť.
Epizódynáhlehospánkuasomnolencie
Pramipexol bol spájaný so somnolenciou a epizódami náhleho spánku, najmä u pacientov s Parkinsonovou chorobou. Menej často bol zaznamenaný náhly spánok počas bežných denných aktivít, niekedy bez toho, aby si to pacient uvedomil alebo pocítil varovné príznaky. Pacienti musia byť informovaní a má sa im odporučiť zvýšená opatrnosť pri vedení vozidiel a obsluhe strojov počas
liečby Oprymeou. Pacienti, u ktorých sa vyskytla somnolencia a/alebo náhly spánok, sa musia vyvarovať vedeniu vozidla alebo obsluhy strojov. Okrem toho sa môže zvážiť zníženie dávky alebo ukončenie liečby. Kvôli možným vedľajším účinkom sa má odporučiť zvýšená obozretnosť, najmä keď pacienti užívajú v kombinácii s pramipexolom ďalšie sedatívne lieky alebo alkohol (pozri časti
4.5, 4.7 a 4.8).
Poruchykontrolyimpulzov
Pacienti majú byť pravidelne monitorovaní z dôvodu vývoja porúch kontroly impulzov. Pacienti a
opatrovatelia majú byť upovedomení, že u pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môžu vyskytnúť behaviorálne symptómy porúch kontroly impulzov zahŕňajúce patologické hráčstvo, zvýšené libido, hypersexualitu, chorobné míňanie alebo nakupovanie, prejedanie sa a chorobné nutkavé jedenie. Ak sa vyvinú takéto symptómy, má sa zvážiť zníženie dávky/postupné vysadenie lieku.
Mániaadelírium
Má sa pravidelne sledovať, či sa u pacientov nevyvinie mánia a delírium. Pacienti a ošetrovatelia sa majú informovať, že u pacientov liečených pramipexolom sa môže vyskytnúť mánia a delírium. Ak sa vyvinú tieto príznaky, má sa zvážiť zníženie dávky/postupné prerušenie liečby.
Pacientis psychotickýmiporuchami
Pacienti s psychotickými poruchami majú byť liečení agonistmi dopamínu len vtedy, ak očakávaný prínos prevýši riziko. Je nutné vyvarovať sa súčasnému podávaniu pramipexolu s antipsychotickými liekmi (pozri časť 4.5).
Oftalmologickésledovania
V pravidelných intervaloch sa odporúča oftalmologické sledovanie alebo v prípade výskytu poruchy zraku.
Závažnékardiovaskulárneochorenia
V prípade závažného kardiovaskulárneho ochorenia má byť zvýšená starostlivosť. Odporúča sa sledovať krvný tlak, najmä na začiatku liečby, vzhľadom na všeobecné riziko posturálnej hypotenzie
spojenej s dopaminergnou liečbou.
Neuroleptickýmalígnysyndróm
Po náhlom ukončení dopaminergnej terapie boli hlásené príznaky naznačujúce neuroleptický malígny
syndróm (pozri časť 4.2).
4.5 Liekové a iné interakcie
Väzbanaplazmatickébielkoviny
U ľudí sa pozorovala nízka biotransformácia a veľmi nízka (<20%) väzba pramipexolu na plazmatické bielkoviny. Preto je interakcia s inými liekmi pôsobiacimi na väzbu na plazmatické bielkoviny alebo
na vylučovanie biotransformáciou nepravdepodobná. Pretože anticholinergiká sa vylučujú prevažne biotransformáciou, možnosť interakcie je obmedzená, hoci sa interakcia s anticholinergikami neskúmala. Neexistujú farmakokinetické interakcie so selegilínom ani levodopou.
Inhibítory/kompetítoryaktívnehorenálnehovylučovania
Cimetidín znižuje renálny klírens pramipexolu približne o 34%, pravdepodobne inhibíciou katiónového vylučovacieho transportného systému renálnych tubulov. Preto lieky, ktoré sú inhibítory tohto aktívneho renálneho vylučovania alebo sa vylučujú touto cestou ako sú cimetidín, amantadín, mexiletín, zidovudín, cisplatina, chinín a prokainamid môžu vzájomne reagovať s pramipexolom, čo má za následok zníženie klírensu pramipexolu. Ak sa tieto lieky podávajú súčasne s Oprymeou, má sa zvážiť zníženie dávky pramipexolu.
Kombináciaslevodopou
Ak sa Oprymea podáva v kombinácii s levodopou, odporúča sa pri zvyšovaní dávky Oprymey zníženie dávky levodopy a dávka ďalších antiparkinsoník sa má udržiavať konštantná.
Kvôli možným vedľajším účinkom sa vyžaduje opatrnosť u pacientov užívajúcich iné sedatívne lieky alebo alkohol v kombinácii s pramipexolom (pozri časti 4.4, 4.7 a 4.8).
Antipsychotiká
Treba sa vyhýbať súčasnému podávaniu antipsychotík s pramipexolom (pozri časť 4.4), napr. ak je možné očakávať antagonistický učinok.
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí sa nepozoroval vplyv na priebeh gravidity a laktácie. Pramipexol nebol teratogénny u potkanov
a králikov, ale bol embryotoxický u potkanov pri toxických dávkach podaných gravidnej samici (pozri časť 5.3). Oprymea sa nemá používať počas gravidity, len ak je to výslovne nevyhnutné, t.j. ak možný prínos preváži možné riziko na plod.
Laktácia
Pretože liečba pramipexolom inhibuje vylučovanie prolaktínu u ľudí, možno očakávať aj inhibíciu laktácie. Vylučovanie pramipexolu do materského mlieka u žien sa neskúmalo. U potkanov bola koncentrácia rádioaktívne označeného liečiva vyššia v materskom mlieku ako v plazme.
Pre chýbajúce údaje u ľudí sa Oprymea nemá užívať počas dojčenia. Ak je však jeho užívanie nevyhnuté, dojčenie sa má prerušiť.
Fertilita
Neboli vykonané žiadne štúdie o vplyve na fertilitu u ľudí. V štúdiách na zvieratách, pramipexol
ovplyvnil estrálne cykly a znížil fertilitu samičiek, tak ako sa očakávalo u dopamínového agonistu. Tieto štúdie nepreukázali priame alebo nepriame škodlivé účinky vzhľadom na samčiu fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Oprymea môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje.

Môžu sa objaviť halucinácie alebo somnolencia.
Pacienti liečení Oprymeou a u ktorých sa vyskytla somnolencia a/alebo epizódy náhleho spánku, musia byť informovaní, že nemajú viesť vozidlá alebo sa zaoberať činnosťami, kde by im alebo ostatným, nedostatok pozornosti mohol priniesť riziko vážneho zranenia alebo smrti (napr. obsluhovanie strojov), kým nebudú vedieť zvládať rekurentné epizódy a somnolenciu (pozri aj časti
4.4, 4.5 a 4.8).
4.8 Nežiaduce účinkyOčakávanénežiaducereakciePri užívaní Oprymey sa predpokladajú nasledovné nežiaduce účinky: neobvyklé sny, amnézia, príznaky poruchy správania - impulzívne a kompulzívne správanie, ako zvýšená chuť do jedla, patologické nakupovanie, hypersexualita a patologické hráčstvo; srdcové zlyhanie, stav zmätenosti, zápcha, delírium, ilúzie, závraty, dyskinéza, dyspnoe, únava, halucinácie, bolesť hlavy, štikútka, hyperkinéza, hyprefágia, hypotenzia, neprimerané vylučovanie antidiuretického hormónu, nespavosť, poruchy libida, mánia, nauzea, paranoja; periférny edém, pneumónia, svrbenie, vyrážka a iná hypersenzitivita, nepokoj, somnolencia, náhle nutkanie na spanie, synkopa, poruchy videnia
zahŕňajúce dvojité videnie, rozmazané videnie a obmezenú zrakovú ostrosť, vracanie, zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti.
Z analýzy združených placebom kontrolovaných štúdií vyplýva, že pri porovnaní celkovo 1 778 pacientov s Parkinsonovou chorobou užívajúcich pramipexol a 1 297 pacientov užívajúcich placebo boli v oboch skupinách často hlásené nežiaduce reakcie. 67% pacientov užívajúcich pramipexol a 54% pacientov užívajúcich placebo nahlásilo aspoň jednu nežiaducu reakciu.
Nežiaduce reakcie uvedené v tabuľke nižšie sú také, ktoré sa vyskytli u 0,1% alebo viacerých pacientov liečených pramipexolom a boli hlásené podstatne častejšie u pacientov užívajúcich pramipexol než placebo alebo také ktoré sa pokladali za klinicky významné. Väčšina nežiaducich reakcií bola mierna až stredná, zvyčajne sa objavili na začiatku liečby a väčšina vyzmizla v priebehu liečby.
V systéme orgánovej klasifikácie sú nežiaduce reakcie evidované podľa názvu frekvencie (počet pacientov, u ktorého sa očakáva výskyt reakcie) použitím nasledujúcich kategórií: veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až
<1/1 000); veľmi zriedkavé (<1/10 000).
Najčastejšie hlásené (³5%) nežiaduce reakcie u pacientov s Parkinsonovou chorobou, ktoré boli častejšie pri liečbe pramipexolom ako placebe, boli nauzea, dyskinéza, hypotenzia, závraty, somnolencia, nespavosť, zápcha, halucinácie, bolesť hlavy a únava. Výskyt somnolencie sa zvyšuje pri dávkach vyšších ako 1,5 mg soli pramipexolu denne (pozri časť 4.2). Častejším nežiaducim účinkom v kombinácii s levodopou bola dyskinéza. Na začiatku liečby sa môže objaviť hypotenzia hlavne, ak je pramipexol titrovaný príliš rýchlo.
Systém orgánovej klasifikácie Nežiaduca reakcia
Infekcie a nákazy
Menej časté pneumónia
Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy
Časté abnormálne sny, príznaky poruchy správania-impulzívne a kompulzívne správanie, zmätenosť, halucinácie, nespavosť
Menej časté nadmerné prejedanie sa1, chorobné nakupovanie, delúzie, hyperfágia1, hypersexualita, poruchy libida, paranoja,
patologické hráčstvo, nepokoj, delírium
Zriedkavé mánia

Poruchy nervového systému
Veľmi časté závraty, dyskinéza, somnolencia
Časté bolesť hlavy
Menej časté amnézia, hyperkinéza, epizódy náhleho spánku, synkopa
Poruchy oka
Časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava, periférny opuch
Laborátórne a funkčné vyšetrenia
Časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla
Menej časté zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže to byť aj menej. Presné stanovenie frekvencie výskytu nie je možné, keďže nežiaduci účinok sa nevyskytol v databáze 2 762 pacientov
klinickej štúdie, ktorí trpeli Parkinsonovou chorobou a boli liečení pramipexolom.
SomnolenciaPramipexol sa často spája so somnolenciou a v menej častých prípadoch sa spája s nadmernou somnolenciou počas dňa a s epizódami náhleho nutkania na spanie (pozri tiež časť 4.4).
PoruchylibidaPramipexol sa môže menej často spájať s poruchami libida (zvýšenie alebo zníženie).
Poruchykontrolyimpulzov
U pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môže vyskytnúť patologické hráčstvo, zvýšené libido, hypersexualita, chorobné míňanie alebo nakupovanie, nenásytné jedenie a chorobné jedenie (pozri časť 4.4).
V prierezovej retrospektívnej štúdii typu case-control, ktorá zahrňala 3 090 pacientov s Parkinsonovou chorobou, 13,6% všetkých pacientov, ktorí dostávali dopaminergnú a non-dopaminergnú liečbu malo za posledných 6 mesiacov príznaky impulzívneho správania. Sledované prejavy zahŕňajú patologické hráčstvo, patologické nakupovanie, zvýšenú chuť do jedla a kompulzívne sexuálne správanie (hypersexualitu). Možné nezávislé rizikové faktory impulzívneho správania zahŕňali dopaminergnú liečbu a vyššie dávky dopaminergnej liečby, nižší vek (≤65 rokov), slobodný stav a pacientom
uvedené hráčstvo v rodinnej anamnéze.
SrdcovézlyhanieV klinických štúdiách a na základe skúseností po uvedení lieku na trh u pacientov liečených pramipexolom bolo hlásené srdcové zlyhanie. Vo farmakoepidemiologickej štúdii sa užívanie pramipexolu spájalo so zvýšeným rizikom výskytu srdcového zlyhania v porovnaní s pacientami, ktoríneužívali pramipexol (zistená miera rizika 1,86; 95 % Cl, 1,21-2,85).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
Príznaky
So závažným predávkovaním nie sú klinické skúsenosti. Očakávané nežiaduce účinky môžu byť tie, ktoré súvisia s farmakodynamickým profilom dopamínových agonistov vrátane nauzey, vracania, hyperkinézy, halucinácií, nepokoja a hypotenzie.
Liečba
Nie je stanovená protilátka na predávkovanie dopamínovými agonistmi. Ak sa vyskytnú prejavy stimulácie centrálneho nervového systému, môže byť indikované podanie neuroleptík. Zvládnutie predávkovania môže vyžadovať všeobecné podporné prostriedky zahŕňajúce výplach žalúdka, intravenózne podávanie tekutín, podávanie aktívneho uhlia a monitorovanie EKG.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiparkinsoniká, agonisty dopamínu, ATC kód: N04BC05. Mechanizmusúčinku
Pramipexol je dopamínový agonist, ktorý sa viaže s veľkou selektívnosťou a špecifickosťou na dopamínové receptory podtriedy D2 a má prednostnú afinitu k D3 receptorom a má plnú vnútornú aktivitu.
Pramipexol zmierňuje parkinsonovský motorický deficit stimuláciou dopamínových receptorov v striate. Pokusy na zvieratách ukázali, že pramipexol inhibuje syntézu dopamínu, jeho vylučovanie a premenu.
Farmakodynamickéúčinky
U zdravých dobrovoľníkov sa pozoroval od dávky zavislý pokles prolaktínu. V klinickej štúdii so zdravými dobrovoľníkmi, kde boli pramipexol tablety s predlženým uvoľňovaním titrované rýchlejšie (každé 3 dni) ako bolo odporúčané až do 3,15 mg bázy pramipexolu (4,5 mg soli) denne, sa pozorovalo zvýšenie krvného tlaku a tepovej frekvencie. Takýto účinok sa nepozoroval u pacientov v štúdii.
Klinickáúčinnosťa bezpečnosťpriParkinsonovejchorobe
U pacientov užívajúcich pramipexol sa zmiernili prejavy a symptómy idiopatickej Parkinsonovej choroby. Placebom kontrolované klinické štúdie zahrňali približne 1 800 pacientov liečených pramipexolom v štádiách I-V podľa Hoehna a Yahra. Okrem nich približne 1 000 pacientov
v pokročilejších štádiách choroby dostávalo súčasne levodopu a trpeli motorickými komplikáciami.
Pri rannej a pokročilej Parkinsonovej chorobe bola účinnosť pramipexolu v kontrolovaných klinických štúdiách udržiavaná na rovnakej úrovni po dobu približne 6 mesiacov. V otvorených pokračovacích štúdiách trvajúcich viac ako 3 roky sa nezaznamenali znaky klesajúcej účinnosti. V kontrolovanej dvojročnej dvojito zaslepenej štúdii začiatok liečby pramipexolom v porovnaní so začatím liečby levodopou výrazne oddialil nástup motorických komplikácií a znížil ich výskyt. Toto oddialenie motorických komplikácií pri pramipexole má vyrovnať vyššie zlepšenie motorických funkcií
s levodopou (merané ako stredná hodnota zmeny v UPDRS škále). Celkový výskyt halucinácií
a somnolencie bol všeobecne vyšší vo fáze zvyšovania v skupine užívajúcej pramipexol. Avšak počas udržiavacej fázy sa výrazný rozdiel nezaznamenal. Tieto skutočnosti sa majú zvážiť, keď sa
u pacientov s Parkinsonovou chorobou začína liečba pramipexolom.
Bezpečnosť a účinnosť tabliet s predĺženým uvoľňovaním s pramipexolom pri liečbe Parkinsonovej chororby sa hodnotila v nadnárodnom vývojovom programe lieku, ktorý pozostával z troch randomizovaných kontrolovaných štúdií. Dve štúdie prebehli u pacientov v ranom štádiu Parkinsonovej choroby a jedna štúdia prebehla u pacientov v pokročilom štádiu Parkinsonovej choroby.
Výhoda pramipexolu - tabliet s predĺženým uvoľňovaním oproti placebu sa preukázala po 18 týždňoch liečby na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (CGI-I a PGI-I responder rates) konečnom stave účinnosti dvojito slepej placebom kontrolovanej štúdie, ktorá zahŕňala celkovo
539 pacientov s Parkinsonovou chrobou v ranom štádiu. Zachovanie účinnosti sa preukázalo u pacientov liečených 33 týždňov. Pramipexol tablety s predĺženým uvoľňovaním boli non-inferiórne voči pramipexolu v tabletách s okamžitým uvoľňovaním, ako to bolo vyhodnotené v 33 týždni podľa UPDRS škály časti II+III.
V dvojito zaslepenej placebom kontrolovanej štúdii, ktorá zahŕňala celkovo 517 pacientov
s Parkinsonovou chorobou v pokročilom štádiu, ktorí súčasne užívali levodopu, sa po 18 týždňoch liečby, preukázala výhoda pramipexol tabliet s predĺženým uvoľňovaním voči placebu na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (off-time) konečnom stave účinnosti.
Účinnosť a znášanlivosť okamžitého prestavenia z pramipexolu - tabliet na pramipexol tablety
s predĺženým uvoľňovaním pri tej istej dennej dávke sa hodnotili v dvojito zaslepenej klinickej štúdii
u pacientov s Parkinsonovou chorobou v ranom štádiu.
Účinnosť sa udržala u 87 zo 103 pacientov, ktorí prešli na pramipexol tablety s predĺženým uvoľňovaním. Z týchto 87 pacientov, 82,8% nezmenilo svoju dávku, 13,8% zvýšilo a 3,4% znížilo svoju dávku.
U polovicie zo 16 pacientov, ktorí nesplnili kritérium udržania účinnosti podľa škály UPDRS časť
II+III, sa zmena základnej línie nepovažovala za klinický významnú.
Iba jeden pacient, ktorý prešiel na pramipexol tablety s predĺženým uvoľňovaním zaznamenal
nežiaducu reakciu spojenú s užívaním lieku, čo viedlo k ukončeniu liečby.
Pediatrickápopulácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s pramipexolom vo všetkých podskupinách pediatrickej populácie pre Parkinsonovu chorobu (informácie o použití
v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorbcia
Pramipexol sa po perorálnom podaní úplne absorbuje. Absolútna biologická dostupnosť je vyššia ako
90%.
Vo fáze I klinickej štúdie, v ktorej sa hodnotili pramipexol tablety s okamžitým uvoľňovaním a s tablety predĺženým uvoľňovaním užívané nalačno boli minimálne a maximálne plazmatické koncentrácie (Cmin, Cmax) a plocha pod krivkou (AUC) rovnaké, pri tej istej dennej dávke pramipexolu tabliet s predĺženým uvoľňovaním podávaných raz denne a pramipexol tabliet podávaných trikrát denne.
Podávanie pramipexolu tabliet s predĺženým uvoľňovaním raz denne spôsobuje menej časté výkyvy plazmatickej koncentrácie pramipexolu v priebehu 24 hodín v porovnaní s podávaním pramipexolu tabliet s okamžitým uvolňovaním trikrát denne.
Maximálne plazmatické koncentrácie sa objavia približne 6 hodín po podaní pramipexol tabliet
s predĺženým uvoľňovaním raz denne. Rovnovážny stav plochy pod krivkou sa dosiahne najneskôr po
5 dňoch súvislého užívania.
Súčasné podávanie s jedlom vo všeobecnosti neovplyvňuje biologickú dostupnosť pramipexolu. Konzumácia potravín s vysokým obsahom tuku zvyšuje u zdravých dobrovoľníkov plazmatickú
koncentráciu (Cmax) asi o 24% po podaní jednej dávky a asi o 20% po podaní opakovanej dávky
a spôsobuje asi 2-hodinové oneskorenie v dosiahnutí maximálnej koncentrácie. Celkovú plochu pod
krivkou (AUC) neovplyvnil príjem potravy. Zvýšená Cmax sa nepovažuje za klinicky významnú. Vo fáze III klinických štúdií, ktoré určovali bezpečnosť a účinnosť pramipexolu tabliet s predĺženým uvoľňovaním, boli pacienti poučení, aby užívali skúšaný liek bez ohľadu na konzumované potraviny.
Keďže telesná hmotnosť nemá žiadny dopad na AUC, nezistil sa žiaden vplyv na distribučný objem a tým aj na maximálnu koncentráciu Cmax.Telesná hmotnosť znížená o 30 kg viedie k zvýšeniu Cmax o 45%. Vo fáze III klinických štúdií pacientov s Parkinsonovou chorobou nebol zistený žiadny klinicky význymný vplyv telesnej hmotnosti na terapeutický účinok a znášanlivosť pramipexolu tabliet s predĺženým uvoľňovaním.
Pramipexol preukazuje lineárnu kinetiku a malú variabilitu plazmatických hladín medzi jednotlivými pacientami.
Distribúcia
U ľudí je väzba pramipexolu na bielkoviny veľmi nízka (<20%) a distribučný objem je rozsiahly (400 l). Vysoké koncentrácie v mozgovom tkanive sa pozorovali u potkanov (približne 8-násobok koncentrácie v plazme).
Biotransformácia
Pramipexol sa u ľudí metabolizuje len v malom rozsahu.
Eliminácia
Hlavnou cestou vylučovania je renálna exkrécia nezmeneného pramipexolu. Približne 90% dávky označenej 14C sa vylúči obličkami a menej ako 2% sa nachádza v stolici. Celkový klírens pramipexolu je približne 500 ml/min a renálny klírens je približne 400 ml/min. Eliminačný polčas (t½) kolíše od
8 hodín u mladých do 12 hodín u starších pacientov.
5.3 Predklinické údaje o bezpečnosti
Štúdie toxicity po opakovanom podaní ukázali, že pramipexol má vplyv prevažne na funkcie CNS a ženského reprodukčného systému, pravdepodobne v dôsledku svojho zvýšeného farmakodynamického účinku.
U miniprasiat bolo zaznamenané zníženie diastolického i systolického tlaku a pokles tepovej frekvencie a sklon k hypotenznému účinku sa zaznamenal u opíc.
U potkanov a králikov boli zistené možné účinky pramipexolu na reprodukčnú funkciu. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre matku. V dôsledku výberu živočíšnych druhov a obmedzenia sledovaných parametrov neboli nežiaduce účinky pramipexolu na graviditu a mužskú fertilitu plne objasnené.
U potkanov sa pozorovalo oneskorenie pohlavného vývoja (t.j. oddelenie predkožky a vaginálneho vchodu). Relevantnosť týchto zistení pre ľudí nie je známa.
Pramipexol nebol genotoxický. V štúdii karcinogenity sa u samcov potkanov rozvinula hyperplázia Leydigových buniek a adenómy, ktoré sa vysvetľujú inhibičným účinkom pramipexolu na prolaktín. Tento nález nie je klinicky relevantný pre človeka. Rovnaká štúdia tiež preukázala, že pri dávkach pramipexolu 2 mg/kg (vo forme soli) a vyšších sa u albínskych potkanov pozorovala degenerácia sietnice. Tento posledný nález sa však nepozoroval u pigmentovaných potkanov, ako ani pri dvojročnej štúdii karcinogenity u albínskych myší či iných sledovaných živočíšnych druhov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
hypromelóza kukuričný škrob
bezvodý koloidný oxid kremičitý
magnéziumstearát
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky pri uchovávaní.
6.5 Druh obalu a obsah baleniaBlister (OPA/ALU/vysušovadlo/PE-ALU fólia): 10, 30, 90 alebo 100 tabliet s predĺženým uvoľňovaním, v škatuľke.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky na likvidáciu.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIKRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Slovinsko
8. REGISTRAČNÉ ČÍSLA10 tabliet s predĺženým uvoľňovaním: EU/1/08/469/046
30 tabliet s predĺženým uvoľňovaním: EU/1/08/469/047
90 tabliet s predĺženým uvoľňovaním: EU/1/08/469/048
100 tabliet s predĺženým uvoľňovaním: EU/1/08/469/049
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12. septembra 2008
Dátum posledného predĺženia registrácie: 09. apríl 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Oprymea 3,15 mg tablety s predĺženým uvoľňovaním
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá tableta s predĺženým uvoľňovaním obsahuje 3,15 mg pramipexolu (čo zodpovedá 4,5 mg monohydrátu pramipexoliumdichloridu).
Prosím, venujte pozornosť:Dávky pramipexolu, ktoré sú uvedené v literatúre, sa vzťahujú na pramipexol vo forme soli. Preto budú dávky uvádzané pre bázu pramipexolu, ako aj pre soľ pramipexolu (v zátvorkách).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMATableta s predĺženým uvoľňovaním.
Biele alebo takmer biele, okrúhle (priemer 10 mm), mierne bikonvexné tablety s vyrazeným P5 na jednej strane a 315 na druhej strane, so skosenými hranami a možnými škvrnami.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieOprymea je určená u dospelých na liečbu prejavov a symptómov idiopatickej Parkinsonovej choroby, samotná (bez levodopy) alebo v kombinácii s levodopou, t.j. počas priebehu choroby k neskorým štádiám, keď účinok levodopy slabne alebo sa stáva nepravidelný a objavujú sa výkyvy liečebného efektu (dosiahnutie hornej hranice dávky alebo striedanie stavov „on-off“).
4.2 Dávkovanie a spôsob podávaniaDávkovanie
Oprymea tablety s predĺženým uvoľňovaním predstavujú perorálnu formu pramipexolu, ktorá sa
podáva raz denne.
Začiatok liečbyDávka sa má zvyšovať postupne, každých 5–7 dní, so začiatočnou dávkou 0,26 mg bázy (0,375 mg soli) denne. Potrebná dávka sa má titrovať tak, aby došlo k maximálnemu liečebnému efektu za predpokladu, že sa u pacienta neprejavia netolerovateľné nežiaduce účinky.
Vzostupná dávkovacia schéma Oprymea tabliet s predĺženým uvoľňovaním
Týždeň Denná dávka (mg bázy) Denná dávka (mg soli)

1 0,26 0,375
2 0,52 0,75
3 1,05 1,5
Ak je potrebné ďalšie zvyšovanie dennej dávky, má sa zvyšovať po 0,52 mg bázy (0,75 mg soli) v
týždňových intervaloch až do maximálnej dennej dávky 3,15 mg bázy (4,5 mg soli) denne.
Treba však poznamenať, že pri dávkach vyšších ako 1,05 mg bázy (1,5 mg soli) denne sa zvyšuje výskyt somnolencie (pozri časť 4.8).
Pacienti, ktorí už užívajú tablety Oprymey môžu byť okamžite prestavení na Oprymeu tablety s predĺženým uvoľňovaním, pri rovnakej dennej dávke. Po prestavení na Oprymeu tablety
s predĺženým uvoľňovaním, sa dávka môže upraviť v závislosti od terapeutickej reakcie pacienta
(pozri časť 5.1).
Udržiavacia liečba
Individuálna dávka pramipexolu má byť v rozmedzí od 0,26 mg bázy (0,375 mg soli) do maximálne
3,15 mg bázy (4,5 mg soli) denne. Pri zvyšovaní dávky v úvodných štúdiách sa účinnosť pozorovala pri počiatočnej dennej dávke 1,05 mg bázy (1,5 mg soli). Ďalšia úprava dávkovania má byť založená na klinickej reakcii a na výskyte nežiaducich reakcií. V klinických štúdiách približne 5% pacientov bolo liečených dávkami menšími ako 1,05 mg bázy (1,5 mg soli). Pri pokročilej Parkinsonovej chorobe môžu byť dávky pramipexolu vyššie ako 1,05 mg bázy (1,5 mg soli) denne užitočné pre pacientov, kde sa plánuje znižovanie dávok levodopy. Odporúča sa, aby sa dávka levodopy znižovala tak počas zvyšovania dávky, ako aj pri udržiavacej liečbe s Oprymeou v závislosti od reakcie jednotlivých pacientov (pozri časť 4.5).
Vynechaniedávky
Keď pacient zabudne užiť dávku, majú sa tablety Oprymey s predĺženým uvoľňovaním užiť do 12
hodín po stanovenom čase. Po 12 hodinách sa má vynechaná dávka vypustiť a nasledujúca dávka sa má užiť ďalší deň v príslušnom čase.
Prerušenieliečby
Náhle prerušenie dopamínovej terapie môže viesť k rozvoju neuroleptického malígneho syndrómu. Postupne sa má znižovať dávka pramipexolu po 0,52 mg bázy (0,75 mg soli) denne do dosiahnutia dennej dávky zníženej na 0,52 mg bázy (0,75 mg soli). Potom sa dávka znižuje po 0,26 mg bázy (0,375 mg soli) denne (pozri časť 4.4)
Pacienti s poruchou funkcie obličiek
Vylučovanie pramipexolu závisí od funkcie obličiek. Pre začiatok liečby sa navrhuje nasledovná schéma dávkovania:
U pacientov s klírensom kreatinínu nad 50 ml/min sa nevyžaduje zníženie dennej dávky alebo frekvencie dávkovania.
U pacientov s hodnotami klírensu kreatinínu medzi 30 a 50 ml/min sa má liečba začať podávaním 0,26 mg Oprymea tabliet s predĺženým uvoľňovaním obdeň. Pred zvyšovaním na denné dávkovanie po jednom týždni treba dôkladne vyhodnotiť terapeutickú reakciu a znášanlivosť lieku. Ak je potrebné ďalšie zvýšenie dávky, dávky sa majú zvyšovať o 0,26 mg bázy pramipexolu v týždenných intervaloch až po maximálnu dávku 1,57 mg bázy pramipexolu (2,25 mg soli) denne.
Liečba pacientov Oprymea tabletami s predĺženým uvoľňovaním, ktorí majú klírens kreatinínu nižší ako 30 ml/min sa neodporúča, kedže o tejto skupine pacientov nie sú dostupné žiadne údaje. Preto sa má zvážit užívanie Oprymea tabliet.
Ak sa počas udržiavacej terapie zníži funkcia obličiek, majú sa rešpektovať vyššie uvedené odporúčania.
Pacienti s poruchou funkcie pečene
Úprava dávky u pacientov so zlyhaním pečene pravdepodobne nie je potrebná, keďže približne 90% absorbovaného liečiva sa vylučuje obličkami. V každom prípade sa neskúmal možný vplyv insuficiencie pečene na farmakokinetiku Oprymey.
Pediatrická populácia
Bezpečnosť a účinnosť Oprymey u detí do 18 rokov sa nesledovala. Nie je žiadne opodstatnenie pre používanie Oprymea tabliet s predĺženým uvoľňovaním v pediatrickej populácii s Parkinsonovou chorobou.
Spôso
b
podávania
Tablety sa majú prehĺtať celé s vodou a nesmú sa rozhrýzť, rozdeliť alebo rozdrviť. Tablety sa môžu užívať buď s jedlom alebo bez jedla a majú sa užívať každý deň v rovnakom čase.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pri predpisovaní Oprymey pacientom s Parkinsonovou chorobou a s poškodením obličiek sa odporúča znížené dávkovanie podľa časti 4.2.
Halucinácie
Pri liečbe dopamínovými agonistmi a levodopou sú známym nežiaducim účinkom halucinácie. Pacienti majú byť informovaní, že sa môžu objaviť (prevažne vizuálne) halucinácie.
Dyskinéza
Pri pokročilej Parkinsonovej chorobe sa pri kombinácii s levodopou môže počas začiatočnej titrácie dávky Oprymey objaviť dyskinéza. Ak sa objaví, dávka levodopy sa má znížiť.
Epizódynáhlehospánkuasomnolencie
Pramipexol bol spájaný so somnolenciou a epizódami náhleho spánku, najmä u pacientov s Parkinsonovou chorobou. Menej často bol zaznamenaný náhly spánok počas bežných denných aktivít, niekedy bez toho, aby si to pacient uvedomil alebo pocítil varovné príznaky. Pacienti musia byť informovaní a má sa im odporučiť zvýšená opatrnosť pri vedení vozidiel a obsluhe strojov počas
liečby Oprymeou. Pacienti, u ktorých sa vyskytla somnolencia a/alebo náhly spánok, sa musia vyvarovať vedeniu vozidla alebo obsluhy strojov. Okrem toho sa môže zvážiť zníženie dávky alebo ukončenie liečby. Kvôli možným vedľajším účinkom sa má odporučiť zvýšená obozretnosť, najmä keď pacienti užívajú v kombinácii s pramipexolom ďalšie sedatívne lieky alebo alkohol (pozri časti
4.5, 4.7 a 4.8).
Poruchykontrolyimpulzov
Pacienti majú byť pravidelne monitorovaní z dôvodu vývoja porúch kontroly impulzov. Pacienti a
opatrovatelia majú byť upovedomení, že u pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môžu vyskytnúť behaviorálne symptómy porúch kontroly impulzov zahŕňajúce patologické hráčstvo, zvýšené libido, hypersexualitu, chorobné míňanie alebo nakupovanie, prejedanie sa a chorobné nutkavé jedenie. Ak sa vyvinú takéto symptómy, má sa zvážiť zníženie dávky/postupné vysadenie lieku.
Mániaadelírium
Má sa pravidelne sledovať, či sa u pacientov nevyvinie mánia a delírium. Pacienti a ošetrovatelia sa majú informovať, že u pacientov liečených pramipexolom sa môže vyskytnúť mánia a delírium. Ak sa vyvinú tieto príznaky, má sa zvážiť zníženie dávky/postupné prerušenie liečby.
Pacientis psychotickými poruchami
Pacienti s psychotickými poruchami majú byť liečení agonistmi dopamínu len vtedy, ak očakávaný prínos prevýši riziko. Je nutné vyvarovať sa súčasnému podávaniu pramipexolu s antipsychotickými liekmi (pozri časť 4.5).
Oftalmologickésledovania
V pravidelných intervaloch sa odporúča oftalmologické sledovanie alebo v prípade výskytu poruchy zraku.
Závažnékardiovaskulárneochorenia
V prípade závažného kardiovaskulárneho ochorenia má byť zvýšená starostlivosť. Odporúča sa sledovať krvný tlak, najmä na začiatku liečby, vzhľadom na všeobecné riziko posturálnej hypotenzie
spojenej s dopaminergnou liečbou.
Neuroleptickýmalígnysyndróm
Po náhlom ukončení dopaminergnej terapie boli hlásené príznaky naznačujúce neuroleptický malígny
syndróm (pozri časť 4.2).
4.5 Liekové a iné interakcie
Väzbanaplazmatickébielkoviny
U ľudí sa pozorovala nízka biotransformácia a veľmi nízka (<20%) väzba pramipexolu na plazmatické bielkoviny. Preto je interakcia s inými liekmi pôsobiacimi na väzbu na plazmatické bielkoviny alebo
na vylučovanie biotransformáciou nepravdepodobná. Pretože anticholinergiká sa vylučujú prevažne biotransformáciou, možnosť interakcie je obmedzená, hoci sa interakcia s anticholinergikami neskúmala. Neexistujú farmakokinetické interakcie so selegilínom ani levodopou.
Inhibítory/kompetítoryaktívnehorenálnehovylučovania
Cimetidín znižuje renálny klírens pramipexolu približne o 34%, pravdepodobne inhibíciou katiónového vylučovacieho transportného systému renálnych tubulov. Preto lieky, ktoré sú inhibítory tohto aktívneho renálneho vylučovania alebo sa vylučujú touto cestou ako sú cimetidín, amantadín, mexiletín, zidovudín, cisplatina, chinín a prokainamid môžu vzájomne reagovať s pramipexolom, čo má za následok zníženie klírensu pramipexolu. Ak sa tieto lieky podávajú súčasne s Oprymeou, má sa zvážiť zníženie dávky pramipexolu.
Kombináciaslevodopou
Ak sa Oprymea podáva v kombinácii s levodopou, odporúča sa pri zvyšovaní dávky Oprymey zníženie dávky levodopy a dávka ďalších antiparkinsoník sa má udržiavať konštantná.
Kvôli možným vedľajším účinkom sa vyžaduje opatrnosť u pacientov užívajúcich iné sedatívne lieky alebo alkohol v kombinácii s pramipexolom (pozri časti 4.4, 4.7 a 4.8).
Antipsychotiká
Treba sa vyhýbať súčasnému podávaniu antipsychotík s pramipexolom (pozri časť 4.4), napr. ak je možné očakávať antagonistický učinok.
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí sa nepozoroval vplyv na priebeh gravidity a laktácie. Pramipexol nebol teratogénny u potkanov
a králikov, ale bol embryotoxický u potkanov pri toxických dávkach podaných gravidnej samici (pozri časť 5.3). Oprymea sa nemá používať počas gravidity, len ak je to výslovne nevyhnutné, t.j. ak možný prínos preváži možné riziko na plod.
Laktácia
Pretože liečba pramipexolom inhibuje vylučovanie prolaktínu u ľudí, možno očakávať aj inhibíciu laktácie. Vylučovanie pramipexolu do materského mlieka u žien sa neskúmalo. U potkanov bola koncentrácia rádioaktívne označeného liečiva vyššia v materskom mlieku ako v plazme.
Pre chýbajúce údaje u ľudí sa Oprymea nemá užívať počas dojčenia. Ak je však jeho užívanie nevyhnuté, dojčenie sa má prerušiť.
Fertilita
Neboli vykonané žiadne štúdie o vplyve na fertilitu u ľudí. V štúdiách na zvieratách, pramipexol
ovplyvnil estrálne cykly a znížil fertilitu samičiek, tak ako sa očakávalo u dopamínového agonistu. Tieto štúdie nepreukázali priame alebo nepriame škodlivé účinky vzhľadom na samčiu fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Oprymea môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje.

Môžu sa objaviť halucinácie alebo somnolencia.
Pacienti liečení Oprymeou a u ktorých sa vyskytla somnolencia a/alebo epizódy náhleho spánku, musia byť informovaní, že nemajú viesť vozidlá alebo sa zaoberať činnosťami, kde by im alebo ostatným, nedostatok pozornosti mohol priniesť riziko vážneho zranenia alebo smrti (napr. obsluhovanie strojov), kým nebudú vedieť zvládať rekurentné epizódy a somnolenciu (pozri aj časti
4.4, 4.5 a 4.8).
4.8 Nežiaduce účinkyOčakávanénežiaducereakciePri užívaní Oprymey sa predpokladajú nasledovné nežiaduce účinky: neobvyklé sny, amnézia, príznaky poruchy správania - impulzívne a kompulzívne správanie, ako zvýšená chuť do jedla, patologické nakupovanie, hypersexualita a patologické hráčstvo; srdcové zlyhanie, stav zmätenosti, zápcha, delírium, ilúzie, závraty, dyskinéza, dyspnoe, únava, halucinácie, bolesť hlavy, štikútka, hyperkinéza, hyprefágia, hypotenzia, neprimerané vylučovanie antidiuretického hormónu, nespavosť, poruchy libida, mánia, nauzea, paranoja; periférny edém, pneumónia, svrbenie, vyrážka a iná hypersenzitivita, nepokoj, somnolencia, náhle nutkanie na spanie, synkopa, poruchy videnia
zahŕňajúce dvojité videnie, rozmazané videnie a obmezenú zrakovú ostrosť, vracanie, zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti.
Z analýzy združených placebom kontrolovaných štúdií vyplýva, že pri porovnaní celkovo 1 778 pacientov s Parkinsonovou chorobou užívajúcich pramipexol a 1 297 pacientov užívajúcich placebo boli v oboch skupinách často hlásené nežiaduce reakcie. 67% pacientov užívajúcich pramipexol a 54% pacientov užívajúcich placebo nahlásilo aspoň jednu nežiaducu reakciu.
Nežiaduce reakcie uvedené v tabuľke nižšie sú také, ktoré sa vyskytli u 0,1% alebo viacerých pacientov liečených pramipexolom a boli hlásené podstatne častejšie u pacientov užívajúcich pramipexol než placebo alebo také ktoré sa pokladali za klinicky významné. Väčšina nežiaducich reakcií bola mierna až stredná, zvyčajne sa objavili na začiatku liečby a väčšina vyzmizla v priebehu liečby.
V systéme orgánovej klasifikácie sú nežiaduce reakcie evidované podľa názvu frekvencie (počet pacientov, u ktorého sa očakáva výskyt reakcie) použitím nasledujúcich kategórií: veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až
<1/1 000); veľmi zriedkavé (<1/10 000).
Najčastejšie hlásené (³5%) nežiaduce reakcie u pacientov s Parkinsonovou chorobou, ktoré boli častejšie pri liečbe pramipexolom ako placebe, boli nauzea, dyskinéza, hypotenzia, závraty, somnolencia, nespavosť, zápcha, halucinácie, bolesť hlavy a únava. Výskyt somnolencie sa zvyšuje pri dávkach vyšších ako 1,5 mg soli pramipexolu denne (pozri časť 4.2). Častejším nežiaducim účinkom v kombinácii s levodopou bola dyskinéza. Na začiatku liečby sa môže objaviť hypotenzia hlavne, ak je pramipexol titrovaný príliš rýchlo.
Systém orgánovej klasifikácie Nežiaduca reakcia
Infekcie a nákazy
Menej časté pneumónia
Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy
Časté abnormálne sny, príznaky poruchy správania-impulzívne a kompulzívne správanie, zmätenosť, halucinácie, nespavosť
Menej časté nadmerné prejedanie sa1, chorobné nakupovanie, delúzie, hyperfágia1, hypersexualita, poruchy libida, paranoja,
patologické hráčstvo, nepokoj, delírium
Zriedkavé mánia

Poruchy nervového systému
Veľmi časté závraty, dyskinéza, somnolencia
Časté bolesť hlavy
Menej časté amnézia, hyperkinéza, epizódy náhleho spánku, synkopa
Poruchy oka
Časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava, periférny opuch
Laborátórne a funkčné vyšetrenia
Časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla
Menej časté zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže to byť aj menej. Presné stanovenie frekvencie výskytu nie je možné, keďže nežiaduci účinok sa nevyskytol v databáze 2 762 pacientov
klinickej štúdie, ktorí trpeli Parkinsonovou chorobou a boli liečení pramipexolom.
SomnolenciaPramipexol sa často spája so somnolenciou a v menej častých prípadoch sa spája s nadmernou somnolenciou počas dňa a s epizódami náhleho nutkania na spanie (pozri tiež časť 4.4).
PoruchylibidaPramipexol sa môže menej často spájať s poruchami libida (zvýšenie alebo zníženie).
Poruchykontrolyimpulzov
U pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môže vyskytnúť patologické hráčstvo, zvýšené libido, hypersexualita, chorobné míňanie alebo nakupovanie, nenásytné jedenie a chorobné jedenie (pozri časť 4.4).
V prierezovej retrospektívnej štúdii typu case-control, ktorá zahrňala 3 090 pacientov s Parkinsonovou chorobou, 13,6% všetkých pacientov, ktorí dostávali dopaminergnú a non-dopaminergnú liečbu malo za posledných 6 mesiacov príznaky impulzívneho správania. Sledované prejavy zahŕňajú patologické hráčstvo, patologické nakupovanie, zvýšenú chuť do jedla a kompulzívne sexuálne správanie (hypersexualitu). Možné nezávislé rizikové faktory impulzívneho správania zahŕňali dopaminergnú liečbu a vyššie dávky dopaminergnej liečby, nižší vek (≤65 rokov), slobodný stav a pacientom
uvedené hráčstvo v rodinnej anamnéze.
SrdcovézlyhanieV klinických štúdiách a na základe skúseností po uvedení lieku na trh u pacientov liečených pramipexolom bolo hlásené srdcové zlyhanie. Vo farmakoepidemiologickej štúdii sa užívanie pramipexolu spájalo so zvýšeným rizikom výskytu srdcového zlyhania v porovnaní s pacientami, ktoríneužívali pramipexol (zistená miera rizika 1,86; 95 % Cl, 1,21-2,85).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
Príznaky
So závažným predávkovaním nie sú klinické skúsenosti. Očakávané nežiaduce účinky môžu byť tie, ktoré súvisia s farmakodynamickým profilom dopamínových agonistov vrátane nauzey, vracania, hyperkinézy, halucinácií, nepokoja a hypotenzie.
Liečba
Nie je stanovená protilátka na predávkovanie dopamínovými agonistmi. Ak sa vyskytnú prejavy stimulácie centrálneho nervového systému, môže byť indikované podanie neuroleptík. Zvládnutie predávkovania môže vyžadovať všeobecné podporné prostriedky zahŕňajúce výplach žalúdka, intravenózne podávanie tekutín, podávanie aktívneho uhlia a monitorovanie EKG.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiparkinsoniká, agonisty dopamínu, ATC kód: N04BC05. Mechanizmusúčinku
Pramipexol je dopamínový agonist, ktorý sa viaže s veľkou selektívnosťou a špecifickosťou na dopamínové receptory podtriedy D2 a má prednostnú afinitu k D3 receptorom a má plnú vnútornú aktivitu.
Pramipexol zmierňuje parkinsonovský motorický deficit stimuláciou dopamínových receptorov v striate. Pokusy na zvieratách ukázali, že pramipexol inhibuje syntézu dopamínu, jeho vylučovanie a premenu.
Farmakodynamickéúčinky
U zdravých dobrovoľníkov sa pozoroval od dávky zavislý pokles prolaktínu. V klinickej štúdii so zdravými dobrovoľníkmi, kde boli pramipexol tablety s predlženým uvoľňovaním titrované rýchlejšie (každé 3 dni) ako bolo odporúčané až do 3,15 mg bázy pramipexolu (4,5 mg soli) denne, sa pozorovalo zvýšenie krvného tlaku a tepovej frekvencie. Takýto účinok sa nepozoroval u pacientov v štúdii.
Klinickáúčinnosťa bezpečnosťpriParkinsonovejchorobe
U pacientov užívajúcich pramipexol sa zmiernili prejavy a symptómy idiopatickej Parkinsonovej choroby. Placebom kontrolované klinické štúdie zahrňali približne 1 800 pacientov liečených pramipexolom v štádiách I-V podľa Hoehna a Yahra. Okrem nich približne 1 000 pacientov
v pokročilejších štádiách choroby dostávalo súčasne levodopu a trpeli motorickými komplikáciami.
Pri rannej a pokročilej Parkinsonovej chorobe bola účinnosť pramipexolu v kontrolovaných klinických štúdiách udržiavaná na rovnakej úrovni po dobu približne 6 mesiacov. V otvorených pokračovacích štúdiách trvajúcich viac ako 3 roky sa nezaznamenali znaky klesajúcej účinnosti. V kontrolovanej dvojročnej dvojito zaslepenej štúdii začiatok liečby pramipexolom v porovnaní so začatím liečby levodopou výrazne oddialil nástup motorických komplikácií a znížil ich výskyt. Toto oddialenie motorických komplikácií pri pramipexole má vyrovnať vyššie zlepšenie motorických funkcií
s levodopou (merané ako stredná hodnota zmeny v UPDRS škále). Celkový výskyt halucinácií
a somnolencie bol všeobecne vyšší vo fáze zvyšovania v skupine užívajúcej pramipexol. Avšak počas udržiavacej fázy sa výrazný rozdiel nezaznamenal. Tieto skutočnosti sa majú zvážiť, keď sa
u pacientov s Parkinsonovou chorobou začína liečba pramipexolom.
Bezpečnosť a účinnosť tabliet s predĺženým uvoľňovaním s pramipexolom pri liečbe Parkinsonovej chororby sa hodnotila v nadnárodnom vývojovom programe lieku, ktorý pozostával z troch randomizovaných kontrolovaných štúdií. Dve štúdie prebehli u pacientov v ranom štádiu Parkinsonovej choroby a jedna štúdia prebehla u pacientov v pokročilom štádiu Parkinsonovej choroby.
Výhoda pramipexolu - tabliet s predĺženým uvoľňovaním oproti placebu sa preukázala po 18 týždňoch liečby na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (CGI-I a PGI-I responder rates) konečnom stave účinnosti dvojito slepej placebom kontrolovanej štúdie, ktorá zahŕňala celkovo
539 pacientov s Parkinsonovou chrobou v ranom štádiu. Zachovanie účinnosti sa preukázalo u pacientov liečených 33 týždňov. Pramipexol tablety s predĺženým uvoľňovaním boli non-inferiórne voči pramipexolu v tabletách s okamžitým uvoľňovaním, ako to bolo vyhodnotené v 33 týždni podľa UPDRS škály časti II+III.
V dvojito zaslepenej placebom kontrolovanej štúdii, ktorá zahŕňala celkovo 517 pacientov
s Parkinsonovou chorobou v pokročilom štádiu, ktorí súčasne užívali levodopu, sa po 18 týždňoch liečby, preukázala výhoda pramipexol tabliet s predĺženým uvoľňovaním voči placebu na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (off-time) konečnom stave účinnosti.
Účinnosť a znášanlivosť okamžitého prestavenia z pramipexolu - tabliet na pramipexol tablety
s predĺženým uvoľňovaním pri tej istej dennej dávke sa hodnotili v dvojito zaslepenej klinickej štúdii
u pacientov s Parkinsonovou chorobou v ranom štádiu.
Účinnosť sa udržala u 87 zo 103 pacientov, ktorí prešli na pramipexol tablety s predĺženým uvoľňovaním. Z týchto 87 pacientov, 82,8% nezmenilo svoju dávku, 13,8% zvýšilo a 3,4% znížilo svoju dávku.
U polovicie zo 16 pacientov, ktorí nesplnili kritérium udržania účinnosti podľa škály UPDRS časť
II+III, sa zmena základnej línie nepovažovala za klinický významnú.
Iba jeden pacient, ktorý prešiel na pramipexol tablety s predĺženým uvoľňovaním sa zaznamenal
nežiaducu reakciu spojenú s užívaním lieku, čo viedlo k ukončeniu liečby.
Pediatrickápopulácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s pramipexolom vo všetkých podskupinách pediatrickej populácie pre Parkinsonovu chorobu (informácie o použití
v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorbcia
Pramipexol sa po perorálnom podaní úplne absorbuje. Absolútna biologická dostupnosť je vyššia ako
90%.
Vo fáze I klinickej štúdie, v ktorej sa hodnotili pramipexol tablety s okamžitým uvoľňovaním a s tablety predĺženým uvoľňovaním užívané nalačno boli minimálne a maximálne plazmatické koncentrácie (Cmin, Cmax) a plocha pod krivkou (AUC) rovnaké, pri tej istej dennej dávke pramipexolu tabliet s predĺženým uvoľňovaním podávaných raz denne a pramipexol tabliet podávaných trikrát denne.
Podávanie pramipexolu tabliet s predĺženým uvoľňovaním raz denne spôsobuje menej časté výkyvy plazmatickej koncentrácie pramipexolu v priebehu 24 hodín v porovnaní s podávaním pramipexolu tabliet s okamžitým uvolňovaním trikrát denne.
Maximálne plazmatické koncentrácie sa objavia približne 6 hodín po podaní pramipexol tabliet
s predĺženým uvoľňovaním raz denne. Rovnovážny stav plochy pod krivkou sa dosiahne najneskôr po
5 dňoch súvislého užívania.
Súčasné podávanie s jedlom vo všeobecnosti neovplyvňuje biologickú dostupnosť pramipexolu. Konzumácia potravín s vysokým obsahom tuku zvyšuje u zdravých dobrovoľníkov plazmatickú
koncentráciu (Cmax) asi o 24% po podaní jednej dávky a asi o 20% po podaní opakovanej dávky
a spôsobuje asi 2-hodinové oneskorenie v dosiahnutí maximálnej koncentrácie. Celkovú plochu pod
krivkou (AUC) neovplyvnil príjem potravy. Zvýšená Cmax sa nepovažuje za klinicky významnú. Vo fáze III klinických štúdií, ktoré určovali bezpečnosť a účinnosť pramipexolu tabliet s predĺženým uvoľňovaním, boli pacienti poučení, aby užívali skúšaný liek bez ohľadu na konzumované potraviny.
Keďže telesná hmotnosť nemá žiadny dopad na AUC, nezistil sa žiaden vplyv na distribučný objem a tým aj na maximálnu koncentráciu Cmax.Telesná hmotnosť znížená o 30 kg viedie k zvýšeniu Cmax o 45%. Vo fáze III klinických štúdií pacientov s Parkinsonovou chorobou nebol zistený žiadny klinicky význymný vplyv telesnej hmotnosti na terapeutický účinok a znášanlivosť pramipexolu tabliet s predĺženým uvoľňovaním.
Pramipexol preukazuje lineárnu kinetiku a malú variabilitu plazmatických hladín medzi jednotlivými pacientami.
Distribúcia
U ľudí je väzba pramipexolu na bielkoviny veľmi nízka (<20%) a distribučný objem je rozsiahly (400 l). Vysoké koncentrácie v mozgovom tkanive sa pozorovali u potkanov (približne 8-násobok koncentrácie v plazme).
Biotransformácia
Pramipexol sa u ľudí metabolizuje len v malom rozsahu.
Eliminácia
Hlavnou cestou vylučovania je renálna exkrécia nezmeneného pramipexolu. Približne 90% dávky označenej 14C sa vylúči obličkami a menej ako 2% sa nachádza v stolici. Celkový klírens pramipexolu je približne 500 ml/min a renálny klírens je približne 400 ml/min. Eliminačný polčas (t½) kolíše od
8 hodín u mladých do 12 hodín u starších pacientov.
5.3 Predklinické údaje o bezpečnosti
Štúdie toxicity po opakovanom podaní ukázali, že pramipexol má vplyv prevažne na funkcie CNS a ženského reprodukčného systému, pravdepodobne v dôsledku svojho zvýšeného farmakodynamického účinku.
U miniprasiat bolo zaznamenané zníženie diastolického i systolického tlaku a pokles tepovej frekvencie a sklon k hypotenznému účinku sa zaznamenal u opíc.
U potkanov a králikov boli zistené možné účinky pramipexolu na reprodukčnú funkciu. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre matku. V dôsledku výberu živočíšnych druhov a obmedzenia sledovaných parametrov neboli nežiaduce účinky pramipexolu na graviditu a mužskú fertilitu plne objasnené.
U potkanov sa pozorovalo oneskorenie pohlavného vývoja (t.j. oddelenie predkožky a vaginálneho vchodu). Relevantnosť týchto zistení pre ľudí nie je známa.
Pramipexol nebol genotoxický. V štúdii karcinogenity sa u samcov potkanov rozvinula hyperplázia Leydigových buniek a adenómy, ktoré sa vysvetľujú inhibičným účinkom pramipexolu na prolaktín. Tento nález nie je klinicky relevantný pre človeka. Rovnaká štúdia tiež preukázala, že pri dávkach pramipexolu 2 mg/kg (vo forme soli) a vyšších sa u albínskych potkanov pozorovala degenerácia sietnice. Tento posledný nález sa však nepozoroval u pigmentovaných potkanov, ako ani pri dvojročnej štúdii karcinogenity u albínskych myší či iných sledovaných živočíšnych druhov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
hypromelóza kukuričný škrob
bezvodý koloidný oxid kremičitý
magnéziumstearát
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky pri uchovávaní.
6.5 Druh obalu a obsah baleniaBlister (OPA/ALU/vysušovadlo/PE-ALU fólia): 10, 30, 90 alebo 100 tabliet s predĺženým uvoľňovaním, v škatuľke.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky na likvidáciu.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIKRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Slovinsko
8. REGISTRAČNÉ ČÍSLA10 tabliet s predĺženým uvoľňovaním: EU/1/08/469/050
30 tabliet s predĺženým uvoľňovaním: EU/1/08/469/051
90 tabliet s predĺženým uvoľňovaním: EU/1/08/469/052
100 tabliet s predĺženým uvoľňovaním: EU/1/08/469/053
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12. septembra 2008
Dátum posledného predĺženia registrácie: 09. apríl 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Balenie
na
počiatočnú
liečbu
Oprymea 0,26 mg tablety s predĺženým uvoľňovaním
Oprymea 0,52 mg tablety s predĺženým uvoľňovaním
Oprymea 1,05 mg tablety s predĺženým uvoľňovaním
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEOprymea0,26 mgtabletyspredĺženýmuvoľňovanímKaždá tableta s predĺženým uvoľňovaním obsahuje 0,26 mg pramipexolu (čo zodpovedá 0,375 mg monohydrátu pramipexoliumdichloridu).
Oprymea0,52 mgtabletyspredĺženýmuvoľňovanímKaždá tableta s predĺženým uvoľňovaním obsahuje 0,52 mg pramipexolu (čo zodpovedá 0,75 mg monohydrátu pramipexoliumdichloridu).
Oprymea1,05 mgtabletyspredĺženýmuvoľňovanímKaždá tableta s predĺženým uvoľňovaním obsahuje 1,05 mg pramipexolu (čo zodpovedá 1,5 mg monohydrátu pramipexoliumdichloridu).
Prosím, venujte pozornosť:Dávky pramipexolu, ktoré sú uvedené v literatúre, sa vzťahujú na pramipexol vo forme soli.
Preto budú dávky uvádzané pre bázu pramipexolu, ako aj pre soľ pramipexolu (v zátvorkách). Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMATableta s predĺženým uvoľňovaním.
0,26 mg: Biele alebo takmer biele, okrúhle (priemer 10 mm), mierne bikonvexné tablety s vyrazeným
P1 na jednej strane, so skosenými hranami a možnými škvrnami.
0,52mg: Biele alebo takmer biele, okrúhle (priemer 10 mm), mierne bikonvexné tablety s vyrazeným
P2 na jednej strane, so skosenými hranami a možnými škvrnami.
1,05 mg: Biele alebo takmer biele, okrúhle (priemer 10 mm), mierne bikonvexné tablety s vyrazeným
P3 na jednej strane, so skosenými hranami a možnými škvrnami.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieOprymea je určená u dospelých na liečbu prejavov a symptómov idiopatickej Parkinsonovej choroby, samotná (bez levodopy) alebo v kombinácii s levodopou, t.j. počas priebehu choroby k neskorým štádiám, keď účinok levodopy slabne alebo sa stáva nepravidelný a objavujú sa výkyvy liečebného efektu (dosiahnutie hornej hranice dávky alebo striedanie stavov „on-off“).
4.2 Dávkovanie a spôsob podávaniaDávkovanie
Oprymea tablety s predĺženým uvoľňovaním predstavujú perorálnu formu pramipexolu, ktorá sa
podáva raz denne.
Začiatok liečby
Dávka sa má zvyšovať postupne, každých 5–7 dní, so začiatočnou dávkou 0,26 mg bázy (0,375 mg soli) denne. Potrebná dávka sa má titrovať tak, aby došlo k maximálnemu liečebnému efektu za predpokladu, že sa u pacienta neprejavia netolerovateľné nežiaduce účinky.
Vzostupná dávkovacia schéma Oprymea tabliet s predĺženým uvoľňovaním
Týždeň Denná dávka (mg bázy) Denná dávka (mg soli)
1 0,26 0,375
2 0,52 0,75
3 1,05 1,5
Ak je potrebné ďalšie zvyšovanie dennej dávky, má sa zvyšovať po 0,52 mg bázy (0,75 mg soli) v
týždňových intervaloch až do maximálnej dennej dávky 3,15 mg bázy (4,5 mg soli) denne.
Treba však poznamenať, že pri dávkach vyšších ako 1,05 mg bázy (1,5 mg soli) denne sa zvyšuje výskyt somnolencie (pozri časť 4.8).
Pacienti, ktorí už užívajú tablety Oprymey môžu byť okamžite prestavení na Oprymeu tablety s predĺženým uvoľňovaním, pri rovnakej dennej dávke. Po prestavení na Oprymeu tablety
s predĺženým uvoľňovaním, sa dávka môže upraviť v závislosti od terapeutickej reakcie pacienta
(pozri časť 5.1).
Udržiavacia liečbaIndividuálna dávka pramipexolu má byť v rozmedzí od 0,26 mg bázy (0,375 mg soli) do maximálne
3,15 mg bázy (4,5 mg soli) denne. Pri zvyšovaní dávky v úvodných štúdiách sa účinnosť pozorovala pri čiatočnej dennej dávke 1,05 mg bázy (1,5 mg soli). Ďalšia úprava dávkovania má byť založená na klinickej reakcii a na výskyte nežiaducich reakcií. V klinických štúdiách približne 5% pacientov bolo liečených dávkami menšími ako 1,05 mg bázy (1,5 mg soli). Pri pokročilej Parkinsonovej chorobe môžu byť dávky pramipexolu vyššie ako 1,05 mg bázy (1,5 mg soli) denne užitočné pre pacientov, kde sa plánuje znižovanie dávok levodopy. Odporúča sa, aby sa dávka levodopy znižovala tak počas zvyšovania dávky, ako aj pri udržiavacej liečbe s Oprymeou v závislosti od reakcie jednotlivých pacientov (pozri časť 4.5).
VynechaniedávkyKeď pacient zabudne užiť dávku, majú sa tablety Oprymey s predĺženým uvoľňovaním užiť do 12 hodín po stanovenom čase. Po 12 hodinách sa má vynechaná dávka vypustiť a nasledujúca dávka sa má užiť ďalší deň v príslušnom čase.
PrerušenieliečbyNáhle prerušenie dopamínovej terapie môže viesť k rozvoju neuroleptického malígneho syndrómu. Postupne sa má znižovať dávka pramipexolu po 0,52 mg bázy (0,75 mg soli) denne do dosiahnutia dennej dávky zníženej na 0,52 mg bázy (0,75 mg soli). Potom sa dávka znižuje po 0,26 mg bázy (0,375 mg soli) denne (pozri časť 4.4)
Pacienti s poruchou funkcie obličiekVylučovanie pramipexolu závisí od funkcie obličiek. Pre začiatok liečby sa navrhuje nasledovná schéma dávkovania:
U pacientov s klírensom kreatinínu nad 50 ml/min sa nevyžaduje zníženie dennej dávky alebo frekvencie dávkovania.
U pacientov s hodnotami klírensu kreatinínu medzi 30 a 50 ml/min sa má liečba začať podávaním 0,26 mg Oprymea tabliet s predĺženým uvoľňovaním obdeň. Pred zvyšovaním na denné dávkovanie po jednom týždni treba dôkladne vyhodnotiť terapeutickú reakciu a znášanlivosť lieku. Ak je potrebné ďalšie zvýšenie dávky, dávky sa majú zvyšovať o 0,26 mg bázy pramipexolu v týždenných intervaloch až po maximálnu dávku 1,57 mg bázy pramipexolu (2,25 mg soli) denne.
Liečba pacientov Oprymea tabletami s predĺženým uvoľňovaním, ktorí majú klírens kreatinínu nižší
ako 30 ml/min sa neodporúča, kedže o tejto skupine pacientov nie sú dostupné žiadne údaje. Preto sa má zvážit užívanie Oprymea tabliet.
Ak sa počas udržiavacej terapie zníži funkcia obličiek, majú sa rešpektovať vyššie uvedené odporúčania.
Pacienti s poruchou funkcie pečene
Úprava dávky u pacientov so zlyhaním pečene pravdepodobne nie je potrebná, keďže približne 90% absorbovaného liečiva sa vylučuje obličkami. V každom prípade sa neskúmal možný vplyv insuficiencie pečene na farmakokinetiku Oprymey.
Pediatrická populácia
Bezpečnosť a účinnosť Oprymey u detí do 18 rokov sa nesledovala. Nie je žiadne opodstatnenie pre používanie Oprymea tabliet s predĺženým uvoľňovaním v pediatrickej populácii s Parkinsonovou chorobou.
Spôsobpodávania
Tablety sa majú prehĺtať celé s vodou a nesmú sa rozhrýzť, rozdeliť alebo rozdrviť. Tablety sa môžu
užívať buď s jedlom alebo bez jedla a majú sa užívať každý deň v rovnakom čase.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pri predpisovaní Oprymey pacientom s Parkinsonovou chorobou a s poškodením obličiek sa odporúča znížené dávkovanie podľa časti 4.2.
Halucinácie
Pri liečbe dopamínovými agonistmi a levodopou sú známym nežiaducim účinkom halucinácie.
Pacienti majú byť informovaní, že sa môžu objaviť (prevažne vizuálne) halucinácie.
Dyskinéza
Pri pokročilej Parkinsonovej chorobe sa pri kombinácii s levodopou môže počas začiatočnej titrácie dávky Oprymey objaviť dyskinéza. Ak sa objaví, dávka levodopy sa má znížiť.
Epizódynáhlehospánkuasomnolencie
Pramipexol bol spájaný so somnolenciou a epizódami náhleho spánku, najmä u pacientov s Parkinsonovou chorobou. Menej často bol zaznamenaný náhly spánok počas bežných denných aktivít, niekedy bez toho, aby si to pacient uvedomil alebo pocítil varovné príznaky. Pacienti musia byť informovaní a má sa im odporučiť zvýšená opatrnosť pri vedení vozidiel a obsluhe strojov počas
liečby Oprymeou. Pacienti, u ktorých sa vyskytla somnolencia a/alebo náhly spánok, sa musia vyvarovať vedeniu vozidla alebo obsluhy strojov. Okrem toho sa môže zvážiť zníženie dávky alebo ukončenie liečby. Kvôli možným vedľajším účinkom sa má odporučiť zvýšená obozretnosť, najmä keď pacienti užívajú v kombinácii s pramipexolom ďalšie sedatívne lieky alebo alkohol (pozri časti
4.5, 4.7 a 4.8).
Poruchykontrolyimpulzov
Pacienti majú byť pravidelne monitorovaní z dôvodu vývoja porúch kontroly impulzov. Pacienti a opatrovatelia majú byť upovedomení, že u pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môžu vyskytnúť behaviorálne symptómy porúch kontroly impulzov zahŕňajúce patologické hráčstvo, zvýšené libido, hypersexualitu, chorobné míňanie alebo nakupovanie, prejedanie sa a chorobne nutkavé jedenie. Ak sa vyvinú takéto symptómy, má sa zvážiť zníženie dávky/postupné vysadenie lieku.
Mániaadelírium
Má sa pravidelne sledovať, či sa u pacientov nevyvinie mánia a delírium. Pacienti a ošetrovatelia sa majú informovať, že u pacientov liečených pramipexolom sa môže vyskytnúť mánia a delírium. Ak sa vyvinú tieto príznaky, má sa zvážiť zníženie dávky/postupné prerušenie liečby.
Pacientis psychotickýmiporuchami
Pacienti s psychotickými poruchami majú byť liečení agonistmi dopamínu len vtedy, ak očakávaný prínos prevýši riziko. Je nutné vyvarovať sa súčasnému podávaniu pramipexolu s antipsychotickými liekmi (pozri časť 4.5).
Oftalmologickésledovania
V pravidelných intervaloch sa odporúča oftalmologické sledovanie alebo v prípade výskytu poruchy
zraku.
Závažnékardiovaskulárneochorenia
V prípade závažného kardiovaskulárneho ochorenia má byť zvýšená starostlivosť. Odporúča sa sledovať krvný tlak, najmä na začiatku liečby, vzhľadom na všeobecné riziko posturálnej hypotenzie spojenej s dopaminergnou liečbou.
Neuroleptickýmalígnysyndróm
Po náhlom ukončení dopaminergnej terapie boli hlásené príznaky naznačujúce neuroleptický malígny syndróm (pozri časť 4.2).
4.5 Liekové a iné interakcie
Väzbanaplazmatickébielkoviny
U ľudí sa pozorovala nízka biotransformácia a veľmi nízka (<20%) väzba pramipexolu na plazmatické bielkoviny. Preto je interakcia s inými liekmi pôsobiacimi na väzbu na plazmatické bielkoviny alebo
na vylučovanie biotransformáciou nepravdepodobná. Pretože anticholinergiká sa vylučujú prevažne
biotransformáciou, možnosť interakcie je obmedzená, hoci sa interakcia s anticholinergikami neskúmala. Neexistujú farmakokinetické interakcie so selegilínom ani levodopou.
Inhibítory/kompetítoryaktívnehorenálnehovylučovania
Cimetidín znižuje renálny klírens pramipexolu približne o 34%, pravdepodobne inhibíciou katiónového vylučovacieho transportného systému renálnych tubulov. Preto lieky, ktoré sú inhibítory tohto aktívneho renálneho vylučovania alebo sa vylučujú touto cestou ako sú cimetidín, amantadín, mexiletín, zidovudín, cisplatina, chinín a prokainamid môžu vzájomne reagovať s pramipexolom, čo má za následok zníženie klírensu pramipexolu. Ak sa tieto lieky podávajú súčasne s Oprymeou, má sa zvážiť zníženie dávky pramipexolu.
Kombináciaslevodopou
Ak sa Oprymea podáva v kombinácii s levodopou, odporúča sa pri zvyšovaní dávky Oprymey
zníženie dávky levodopy a dávka ďalších antiparkinsoník sa má udržiavať konštantná.
Kvôli možným vedľajším účinkom sa vyžaduje opatrnosť u pacientov užívajúcich iné sedatívne lieky alebo alkohol v kombinácii s pramipexolom (pozri časti 4.4, 4.7 a 4.8).
Antipsychotiká
Treba sa vyhýbať súčasnému podávaniu antipsychotík s pramipexolom (pozri časť 4.4), napr. ak je
možné očakávať antagonistický učinok.
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí sa nepozoroval vplyv na priebeh gravidity a laktácie. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri toxických dávkach podaných gravidnej samici (pozri časť 5.3). Oprymea sa nemá používať počas gravidity, len ak je to výslovne nevyhnutné, t.j. ak možný prínos preváži možné riziko na plod.
Laktácia
Pretože liečba pramipexolom inhibuje vylučovanie prolaktínu u ľudí, možno očakávať aj inhibíciu laktácie. Vylučovanie pramipexolu do materského mlieka u žien sa neskúmalo. U potkanov bola koncentrácia rádioaktívne označeného liečiva vyššia v materskom mlieku ako v plazme.
Pre chýbajúce údaje u ľudí sa Oprymea nemá užívať počas dojčenia. Ak je však jeho užívanie nevyhnuté, dojčenie sa má prerušiť.
Fertilita
Neboli vykonané žiadne štúdie o vplyve na fertilitu u ľudí. V štúdiách na zvieratách, pramipexol ovplyvnil estrálne cykly a znížil fertilitu samičiek, tak ako sa očakávalo u dopamínového agonistu. Tieto štúdie nepreukázali priame alebo nepriame škodlivé účinky vzhľadom na samčiu fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Oprymea môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Môžu sa objaviť halucinácie alebo somnolencia.
Pacienti liečení Oprymeou a u ktorých sa vyskytla somnolencia a/alebo epizódy náhleho spánku, musia byť informovaní, že nemajú viesť vozidlá alebo sa zaoberať činnosťami, kde by im alebo ostatným, nedostatok pozornosti mohol priniesť riziko vážneho zranenia alebo smrti (napr. obsluhovanie strojov), kým nebudú vedieť zvládať rekurentné epizódy a somnolenciu (pozri aj časti
4.4, 4.5 a 4.8).
4.8 Nežiaduce účinky
Očakávanénežiaducereakcie
Pri užívaní Oprymey sa predpokladajú nasledovné nežiaduce účinky: neobvyklé sny, amnézia, príznaky poruchy správania - impulzívne a kompulzívne správanie, ako zvýšená chuť do jedla, patologické nakupovanie, hypersexualita a patologické hráčstvo; srdcové zlyhanie, stav zmätenosti, zápcha, ilúzie, závraty, dyskinéza, dyspnoe, únava, halucinácie, bolesť hlavy, štikútka, hyperkinéza, hyprefágia, hypotenzia, neprimerané vylučovanie antidiuretického hormónu, nespavosť, poruchy libida, nauzea, paranoja; periférny edém, pneumónia, svrbenie, vyrážka a iná hypersenzitivita, nepokoj, somnolencia, náhle nutkanie na spanie, synkopa, poruchy videnia zahŕňajúce dvojité videnie,
rozmazané videnie a obmezenú zrakovú ostrosť, vracanie, zníženie telesnej hmotnosti vrátane zníženej chuti do jedla, zvýšenie telesnej hmotnosti.
Z analýzy združených placebom kontrolovaných štúdií vyplýva, že pri porovnaní celkovo 1 778 pacientov s Parkinsonovou chorobou užívajúcich pramipexol a 1 297 pacientov užívajúcich placebo boli v oboch skupinách často hlásené nežiaduce reakcie. 67% pacientov užívajúcich pramipexol a 54% pacientov užívajúcich placebo nahlásilo aspoň jednu nežiaducu reakciu.
Nežiaduce reakcie uvedené v tabuľke nižšie sú také, ktoré sa vyskytli u 0,1% alebo viacerých pacientov liečených pramipexolom a boli hlásené podstatne častejšie u pacientov užívajúcich pramipexol než placebo alebo také ktoré sa pokladali za klinicky významné. Väčšina nežiaducich reakcií bola mierna až stredná, zvyčajne sa objavili na začiatku liečby a väčšina vyzmizla v priebehu liečby.
V systéme orgánovej klasifikácie sú nežiaduce reakcie evidované podľa názvu frekvencie (počet pacientov, u ktorého sa očakáva výskyt reakcie) použitím nasledujúcich kategórií: veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až
<1/1 000); veľmi zriedkavé (<1/10 000).
Najčastejšie hlásené (³5%) nežiaduce reakcie u pacientov s Parkinsonovou chorobou, ktoré boli častejšie pri liečbe pramipexolom ako placebe, boli nauzea, dyskinéza, hypotenzia, závraty, somnolencia, nespavosť, zápcha, halucinácie, bolesť hlavy a únava. Výskyt somnolencie sa zvyšuje

pri dávkach vyšších ako 1,5 mg soli pramipexolu denne (pozri časť 4.2). Častejším nežiaducim účinkom v kombinácii s levodopou bola dyskinéza. Na začiatku liečby sa môže objaviť hypotenzia hlavne, ak je pramipexol titrovaný príliš rýchlo.
Systém orgánovej klasifikácie Nežiaduca reakcia
Infekcie a nákazy
Menej časté pneumónia
Poruchy endokrinného systému
Menej časté neprimeraná sekrécia antidiuretického hormónu1
Psychické poruchy
Časté abnormálne sny, príznaky poruchy správania-impulzívne a kompulzívne správanie, zmätenosť, halucinácie, nespavosť
Menej časté nadmerné prejedanie sa1, chorobné nakupovanie, delúzie, hyperfágia1, hypersexualita, poruchy libida, paranoja, patologické hráčstvo, nepokoj, delírium
Zriedkavé mánia
Poruchy nervového systému
Veľmi časté závraty, dyskinéza, somnolencia
Časté bolesť hlavy
Menej časté amnézia, hyperkinéza, epizódy náhleho spánku, synkopa
Poruchy oka
Časté poruchy videnia zahŕňajúce dvojité videnie, rozmazané videnie a obmedzenú zrakovú ostrosť
Poruchy srdca a srdcovej činnosti
Menej časté srdcové zlyhanie1
Poruchy ciev
Časté hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, štikútka
Poruchy gastrointestinálneho traktu
Veľmi časté nauzea
Časté zápcha, vracanie
Poruchy kože a podkožného tkaniva
Menej časté precitlivenosť, svrbenie, vyrážka
Celkové poruchy a reakcie v mieste podania
Časté únava, periférny opuch
Laborátórne a funkčné vyšetrenia
Časté zníženie telesnej hmotnosti vrátane zníženej chuti do jedla
Menej časté zvýšenie telesnej hmotnosti
1 Tento nežiaduci účinok sa zistil na základe skúseností po uvedení lieku na trh. S 95% istotou nie je kategória frekvencie výskytu vyššia ako menej častá, ale môže to byť aj menej. Presné stanovenie frekvencie výskytu nie je možné, keďže nežiaduci účinok sa nevyskytol v databáze 2 762 pacientov
klinickej štúdie, ktorí trpeli Parkinsonovou chorobou a boli liečení pramipexolom.
SomnolenciaPramipexol sa často spája so somnolenciou a v menej častých prípadoch sa spája s nadmernou somnolenciou počas dňa a s epizódami náhleho nutkania na spanie (pozri tiež časť 4.4).
PoruchylibidaPramipexol sa môže menej často spájať s poruchami libida (zvýšenie alebo zníženie).
Poruchykontrolyimpulzov
U pacientov liečených dopamínovými agonistmi vrátane Oprymey sa môže vyskytnúť patologické hráčstvo, zvýšené libido, hypersexualita, chorobné míňanie alebo nakupovanie, nenásytné jedenie a chorobné jedenie (pozri časť 4.4).
V prierezovej retrospektívnej štúdii typu case-control, ktorá zahrňala 3 090 pacientov s Parkinsonovou chorobou, 13,6% všetkých pacientov, ktorí dostávali dopaminergnú a non-dopaminergnú liečbu malo za posledných 6 mesiacov príznaky impulzívneho správania. Sledované prejavy zahŕňajú patologické hráčstvo, patologické nakupovanie, zvýšenú chuť do jedla a kompulzívne sexuálne správanie (hypersexualitu). Možné nezávislé rizikové faktory impulzívneho správania zahŕňali dopaminergnú liečbu a vyššie dávky dopaminergnej liečby, nižší vek (≤65 rokov), slobodný stav a pacientom
uvedené hráčstvo v rodinnej anamnéze.
Srdcovézlyhanie
V klinických štúdiách a na základe skúseností po uvedení lieku na trh u pacientov liečených pramipexolom bolo hlásené srdcové zlyhanie. Vo farmakoepidemiologickej štúdii sa užívanie pramipexolu spájalo so zvýšeným rizikom výskytu srdcového zlyhania v porovnaní s pacientami, ktoríneužívali pramipexol (zistená miera rizika 1,86; 95 % Cl, 1,21-2,85).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
Príznaky
So závažným predávkovaním nie sú klinické skúsenosti. Očakávané nežiaduce účinky môžu byť tie,
ktoré súvisia s farmakodynamickým profilom dopamínových agonistov vrátane nauzey, vracania, hyperkinézy, halucinácií, nepokoja a hypotenzie.
Liečba
Nie je stanovená protilátka na predávkovanie dopamínovými agonistmi. Ak sa vyskytnú prejavy stimulácie centrálneho nervového systému, môže byť indikované podanie neuroleptík. Zvládnutie predávkovania môže vyžadovať všeobecné podporné prostriedky zahŕňajúce výplach žalúdka, intravenózne podávanie tekutín, podávanie aktívneho uhlia a monitorovanie EKG.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiparkinsoniká, agonisty dopamínu, ATC kód: N04BC05. Mechanizmusúčinku
Pramipexol je dopamínový agonist, ktorý sa viaže s veľkou selektívnosťou a špecifickosťou na
dopamínové receptory podtriedy D2 a má prednostnú afinitu k D3 receptorom a má plnú vnútornú aktivitu.
Pramipexol zmierňuje parkinsonovský motorický deficit stimuláciou dopamínových receptorov v striate. Pokusy na zvieratách ukázali, že pramipexol inhibuje syntézu dopamínu, jeho vylučovanie a premenu.
Farmakodynamickéúčinky
U zdravých dobrovoľníkov sa pozoroval od dávky zavislý pokles prolaktínu. V klinickej štúdii so
zdravými dobrovoľníkmi, kde boli pramipexol tablety s predlženým uvoľňovaním titrované rýchlejšie (každé 3 dni) ako bolo odporúčané až do 3,15 mg bázy pramipexolu (4,5 mg soli) denne, sa pozorovalo zvýšenie krvného tlaku a tepovej frekvencie. Takýto účinok sa nepozoroval u pacientov v štúdii.
Klinickáúčinnosťa bezpečnosťpriParkinsonovejchorobe
U pacientov užívajúcich pramipexol sa zmiernili prejavy a symptómy idiopatickej Parkinsonovej choroby. Placebom kontrolované klinické štúdie zahrňali približne 1 800 pacientov liečených pramipexolom v štádiách I-V podľa Hoehna a Yahra. Okrem nich približne 1 000 pacientov
v pokročilejších štádiách choroby dostávalo súčasne levodopu a trpeli motorickými komplikáciami.
Pri rannej a pokročilej Parkinsonovej chorobe bola účinnosť pramipexolu v kontrolovaných klinických štúdiách udržiavaná na rovnakej úrovni po dobu približne 6 mesiacov. V otvorených pokračovacích štúdiách trvajúcich viac ako 3 roky sa nezaznamenali znaky klesajúcej účinnosti. V kontrolovanej dvojročnej dvojito zaslepenej štúdii začiatok liečby pramipexolom v porovnaní so začatím liečby levodopou výrazne oddialil nástup motorických komplikácií a znížil ich výskyt. Toto oddialenie motorických komplikácií pri pramipexole má vyrovnať vyššie zlepšenie motorických funkcií
s levodopou (merané ako stredná hodnota zmeny v UPDRS škále). Celkový výskyt halucinácií
a somnolencie bol všeobecne vyšší vo fáze zvyšovania v skupine užívajúcej pramipexol. Avšak počas udržiavacej fázy sa výrazný rozdiel nezaznamenal. Tieto skutočnosti sa majú zvážiť, keď sa
u pacientov s Parkinsonovou chorobou začína liečba pramipexolom.
Bezpečnosť a účinnosť tabliet s predĺženým uvoľňovaním s pramipexolom pri liečbe Parkinsonovej chororby sa hodnotila v nadnárodnom vývojovom programe lieku, ktorý pozostával z troch randomizovaných kontrolovaných štúdií. Dve štúdie prebehli u pacientov v ranom štádiu Parkinsonovej choroby a jedna štúdia prebehla u pacientov v pokročilom štádiu Parkinsonovej choroby.
Výhoda pramipexolu- tabliet s predĺženým uvoľňovaním oproti placebu sa preukázala po 18 týždňoch liečby na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (CGI-I a PGI-I responder rates) konečnom stave účinnosti dvojito slepej placebom kontrolovanej štúdie, ktorá zahŕňala celkovo
539 pacientov s Parkinsonovou chrobou v ranom štádiu. Zachovanie účinnosti sa preukázalo u pacientov liečených 33 týždňov. Pramipexol tablety s predĺženým uvoľňovaním boli non-inferiórne voči pramipexolu v tabletách s okamžitým uvoľňovaním, ako to bolo vyhodnotené v 33 týždni podľa UPDRS škály časti II+III.
V dvojito zaslepenej placebom kontrolovanej štúdii, ktorá zahŕňala celkovo 517 pacientov
s Parkinsonovou chorobou v pokročilom štádiu, ktorí súčasne užívali levodopu, sa po 18 týždňoch liečby, preukázala výhoda pramipexol tabliet s predĺženým uvoľňovaním voči placebu na primárnom (UPDRS škály časti II+III) aj kľúčovom sekundárnom (off-time) konečnom stave účinnosti.
Účinnosť a znášanlivosť okamžitého prestavenia z pramipexolu- tabliet na pramipexol tablety
s predĺženým uvoľňovaním pri tej istej dennej dávke sa hodnotili v dvojito zaslepenej klinickej štúdii u pacientov s Parkinsonovou chorobou v ranom štádiu.
Účinnosť sa udržala u 87 zo 103 pacientov, ktorí prešli na pramipexol tablety s predĺženým uvoľňovaním. Z týchto 87 pacientov, 82,8% nezmenilo svoju dávku, 13,8% zvýšilo a 3,4% znížilo svoju dávku.
U polovicie zo 16 pacientov, ktorí nesplnili kritérium udržania účinnosti podľa škály UPDRS časť
II+III, sa zmena základnej línie nepovažovala za klinický významnú.
Iba jeden pacient, ktorý prešiel na pramipexol tablety s predĺženým uvoľňovaním zaznamenal nežiaducu udalosť spojenú s užívaním lieku, čo viedlo k ukončeniu liečby.
Pediatrickápopulácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s pramipexolom
vo všetkých podskupinách pediatrickej populácie pre Parkinsonovu chorobu ( informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorbcia
Pramipexol sa po perorálnom podaní úplne absorbuje. Absolútna biologická dostupnosť je vyššia ako
90%.
Vo fáze I klinickej štúdie, v ktorej sa hodnotili pramipexol tablety s okamžitým uvoľňovaním a s tablety predĺženým uvoľňovaním užívané nalačno, boli minimálne a maximálne plazmatické koncentrácie (Cmin, Cmax) a plocha pod krivkou (AUC) rovnaké pri tej istej dennej dávke pramipexolu tabliet s predĺženým uvoľňovaním podávaných raz denne a pramipexol tabliet podávaných trikrát denne.
Podávanie pramipexolu tabliet s predĺženým uvoľňovaním raz denne spôsobuje menej časté výkyvy plazmatickej koncentrácie pramipexolu v priebehu 24 hodín v porovnaní s podávaním pramipexolu tabliet s okamžitým uvolňovaním trikrát denne.
Maximálne plazmatické koncentrácie sa objavia približne 6 hodín po podaní pramipexol tabliet
s predĺženým uvoľňovaním raz denne. Rovnovážny stav plochy pod krivkou sa dosiahne najneskôr po
5 dňoch súvislého užívania.
Súčasné podávanie s jedlom vo všeobecnosti neovplyvňuje biologickú dostupnosť pramipexolu. Konzumácia potravín s vysokým obsahom tuku zvyšuje u zdravých dobrovoľníkov plazmatickú koncentráciu (Cmax) asi o 24% po podaní jednej dávky a asi o 20% po podaní opakovanej dávky
a spôsobuje asi 2-hodinové oneskorenie v dosiahnutí maximálnej koncentrácie. Celkovú plochu pod
krivkou (AUC) neovplyvnil príjem potravy. Zvýšená Cmax sa nepovažuje za klinicky významnú. Vo fáze III klinických štúdií, ktoré určovali bezpečnosť a účinnosť pramipexolu tabliet s predĺženým uvoľňovaním, boli pacienti poučení, aby užívali skúšaný liek bez ohľadu na konzumované potraviny.
Keďže telesná hmotnosť nemá žiadny dopad na AUC, nezistil sa žiaden vplyv na distribučný objem a tým aj na maximálnu koncentráciu Cmax.Telesná hmotnosť znížená o 30 kg viedie k zvýšeniu Cmax o 45%. Vo fáze III klinických štúdií pacientov s Parkinsonovou chorobou nebol zistený žiadny klinicky význymný vplyv telesnej hmotnosti na terapeutický účinok a znášanlivosť pramipexolu tabliet s predĺženým uvoľňovaním.
Pramipexol preukazuje lineárnu kinetiku a malú variabilitu plazmatických hladín medzi jednotlivými pacientami.
Distribúcia
U ľudí je väzba pramipexolu na bielkoviny veľmi nízka (<20%) a distribučný objem je rozsiahly (400 l). Vysoké koncentrácie v mozgovom tkanive sa pozorovali u potkanov (približne 8-násobok koncentrácie v plazme).
Biotransformácia
Pramipexol sa u ľudí metabolizuje len v malom rozsahu.
Eliminácia
Hlavnou cestou vylučovania je renálna exkrécia nezmeneného pramipexolu. Približne 90% dávky označenej 14C sa vylúči obličkami a menej ako 2% sa nachádza v stolici. Celkový klírens pramipexolu je približne 500 ml/min a renálny klírens je približne 400 ml/min. Eliminačný polčas (t½) kolíše od
8 hodín u mladých do 12 hodín u starších pacientov.
5.3 Predklinické údaje o bezpečnosti
Štúdie toxicity po opakovanom podaní ukázali, že pramipexol má vplyv prevažne na funkcie CNS a ženského reprodukčného systému, pravdepodobne v dôsledku svojho zvýšeného farmakodynamického účinku.
U miniprasiat bolo zaznamenané zníženie diastolického i systolického tlaku a pokles tepovej frekvencie a sklon k hypotenznému účinku sa zaznamenal u opíc.
U potkanov a králikov boli zistené možné účinky pramipexolu na reprodukčnú funkciu. Pramipexol nebol teratogénny u potkanov a králikov, ale bol embryotoxický u potkanov pri dávkach toxických pre matku. V dôsledku výberu živočíšnych druhov a obmedzenia sledovaných parametrov neboli
nežiaduce účinky pramipexolu na graviditu a mužskú fertilitu plne objasnené.
U potkanov sa pozorovalo oneskorenie pohlavného vývoja (t.j. oddelenie predkožky a vaginálneho vchodu). Relevantnosť týchto zistení pre ľudí nie je známa.
Pramipexol nebol genotoxický. V štúdii karcinogenity sa u samcov potkanov rozvinula hyperplázia Leydigových buniek a adenómy, ktoré sa vysvetľujú inhibičným účinkom pramipexolu na prolaktín. Tento nález nie je klinicky relevantný pre človeka. Rovnaká štúdia tiež preukázala, že pri dávkach pramipexolu 2 mg/kg (vo forme soli) a vyšších sa u albínskych potkanov pozorovala degenerácia sietnice. Tento posledný nález sa však nepozoroval u pigmentovaných potkanov, ako ani pri dvojročnej štúdii karcinogenity u albínskych myší či iných sledovaných živočíšnych druhov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
hypromelóza kukuričný škrob
bezvodý koloidný oxid kremičitý magnéziumstearát
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky pri uchovávaní.
6.5 Druh obalu a obsah balenia
Trojtýždňovébalenienapočiatočnúliečbu
Blister (OPA/Alu/vysušovadlo/PE-Alu fólia): 21 tabliet s predĺženým uvoľňovaním (3 blistre obsahujúce 7 tabliet):
- 7 tabliet s predĺženým uvoľňovaním Oprymea 0,26 mg
- 7 tabliet s predĺženým uvoľňovaním Oprymea 0,52 mg
- 7 tabliet s predĺženým uvoľňovaním Oprymea1,05 mg
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky na likvidáciu.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
KRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Slovinsko
8. REGISTRAČNÉ ČÍSLA
21 tabliet s predĺženým uvoľňovaním: EU/1/08/469/054
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12. septembra 2008
Dátum posledného predĺženia registrácie: 09. apríl 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
..