
parametrov a zvýšenia hladín prolaktínu (pozri časti 4.8 a 5.1).
Orodispergovateľná tableta Olanzapin Teva obsahuje laktózu.Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
Olanzapin Teva orodispergovateľné tablety obsahuje sacharózu. Pacienti so zriedkavými dedičnými problémami intolerancie fruktózy, glukózo-galaktózovou malabsorpciou alebo nedostatkom sacharózo-isomaltázy nesmú užívať tento liek.
Orodispergovateľná tableta Olanzapin Teva obsahuje aspartám, ktorý je zdrojom fenylalanínu. Môže byť škodlivý pre osoby s fenylketonúriou.
4.5 Liekové a iné interakcie
Štúdie sledujúce interakcie boli uskutočnené len u dospelých. Možnéinterakcieovplyvňujúceolanzapín
Vzhľadom na fakt, že olanzapín je metabolizovaný izoenzýmom CYP1A2, látky, ktoré špecificky indukujú alebo inhibujú tento izoenzým, môžu ovplyvniť farmakokinetiku olanzapínu.
IndukciaCYP1A2
Fajčenie a karbamazepín môžu indukovať metabolizmus olanzapínu, čo môže následne viesť ku zníženiu koncentrácie olanzapínu. Pozorovali sa zanedbateľné, prípadne len mierne zvýšené hodnoty klírensu olanzapínu. Hoci klinický dopad je pravdepodobne minimálny, odporúča sa klinické monitorovanie a v nevyhnutných prípadoch je možné zvážiť zvýšenie dávok olanzapínu (pozri časť
4.2).
InhibíciaCYP1A2
Preukázalo sa, že fluvoxamín, špecifický inhibítor CYP1A2, významne spomaľuje metabolizmus olanzapínu. Priemerné zvýšenie maximálnej koncentrácie (Cmax) olanzapínu fluvoxamínom bolo 54% u žien nefajčiarok a 77% u mužov fajčiarov. Priemerné zvýšenie plochy pod krivkou koncentrácie (AUC) olanzapínu bolo 52% u žien nefajčiarok a 108% u mužov fajčiarov. U pacientov užívajúcich fluvoxamín, prípadne iný inhibítor CYP1A2, ako napr. ciprofloxacín, sa má zvážiť zníženie počiatočnej dávky olanzapínu. Pri zahájení liečby inhibítorom CYP1A2 sa má zvážiť zníženie dávok olanzapínu.
Zníženiebiologickejdostupnosti
Aktívne uhlie znižuje biologickú dostupnosť olanzapínu po perorálnom podaní o 50 až 60%, preto sa má užívať minimálne 2 hodiny pred, resp. po podaní olanzapínu.
Fluoxetín (inhibítor CYP2D6), jednorazové dávky antacida (s obsahom hliníka, horčíka) alebo cimetidín, nemali signifikantný vplyv na farmakokinetiku olanzapínu.
Možnéovplyvnenieúčinkuinýchliekovolanzapínom
Olanzapín môže antagonizovať účinky priamych a nepriamych agonistov dopamínu.
Olanzapín in vitro neinhibuje hlavné izoenzýmy CYP450 (napr. 1A2, 2D6, 2C9, 2C19, 3A4). Neočakávajú sa preto žiadne osobitné interakcie, čo dokazujú aj in vivo štúdie, ktoré nepreukázali inhibíciu metabolizmu nasledovných aktívnych látok: tricyklických antidepresív (reprezentujúcich prevažne CYP2D6 cestu metabolizácie), warfarínu (CYP2C9), teofylínu (CYP1A2) alebo diazepamu (CYP3A4 a 2C19).
Olanzapín nevykazoval žiadnu interakciu so súbežne podávaným lítiom alebo biperidenom. Monitorovanie terapeutických plazmatických hladín valproátu neukázalo, že by pri zahájení prídavnej
medikácie olanzapínom bola požadovaná úprava dávkovania valproátu.
VšeobecnáCNSaktivita
Opatrnosť je potrebná u pacientov konzumujúcich alkohol alebo užívajúcich lieky, ktoré môžu spôsobiť depresiu centrálneho nervového systému.
Súbežné užívanie olanzapínu s antiparkinsonikami u pacientov s Parkinsonovou chorobou a demenciou sa neodporúča (pozri časť 4.4).
QTcinterval
Opatrnosť je potrebná, ak sa olanzapín podáva súbežne s liekmi, ktoré predlžujú QTc interval (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Gravidita
U gravidných žien sa nevykonali žiadne primerané a dobre kontrolované štúdie. Pacientky je potrebné poučiť o nutnosti informovania svojich lekárov vtedy, ak počas liečby olanzapínom otehotnejú alebo plánujú tehotenstvo. Avšak, vzhľadom na obmedzené skúsenosti u človeka sa má olanzapín podávať počas gravidity len vtedy, ak jeho potenciálny prínos pre matku prevýši možné riziko pre plod.
U novorodencov, ktorí boli vystavení počas tretieho trimestra gravidity antipsychotikám (vrátane olanzapínu), existuje riziko vzniku nežiaducich reakcií zahŕňajúcich extrapyramídové príznaky a/alebo príznaky z vysadenia lieku, ktoré sa môžu líšiť v závažnosti a trvaní. Boli hlásené agitácia, hypertónia, hypotónia, tremor, somnolencia, respiračná tieseň alebo ťažkosti pri kŕmení. Preto majú byť novorodenci starostlivo sledovaní.
Laktácia
V štúdii sa u zdravých dojčiacich žien olanzapín vylučoval do materského mlieka. Priemerná expozícia dieťaťa (mg/kg) v rovnovážnom stave bola odhadnutá na 1,8% z dávky olanzapínu podanej matke (mg/kg). Pacientky majú byť poučené o tom, že počas liečby olanzapínom nesmú dojčiť svoje dieťa.
Fertilita
Účinky na fertilitu nie sú známe (pozri časť 5.3 s predklinickými infomáciami).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Nakoľko olanzapín môže spôsobiť ospalosť a závraty, pacienti musia byť opatrní pri obsluhe strojov, vrátane vedenia motorových vozidiel.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Dospelí
Najčastejšie hlásené nežiaduce reakcie (pozorované u ≥ 1% pacientov) spojené s užívaním olanzapínu v klinických štúdiách boli ospalosť, nárast telesnej hmotnosti, eozinofília, zvýšenie hladiny prolaktínu, cholesterolu, glukózy a triglyceridov (pozri časť 4.4), glukozúria, zvýšená chuť do jedla, závrat, akatízia, parkinsonizmus, leukopénia a neutropénia (pozri časť 4.4), dyskinéza, ortostatická
hypotenzia, anticholinergné účinky, prechodné asymptomatické zvýšenie pečeňových aminotransferáz (pozri časť 4.4), vyrážka, asténia, únava, horúčka, artralgia, zvýšená hladina alkalickej fosfatázy, vysoká hladina gama glutamyltransferázy, vysoká hladina kyseliny močovej, vysoká hladina kreatín- fosfokinázy a edém.
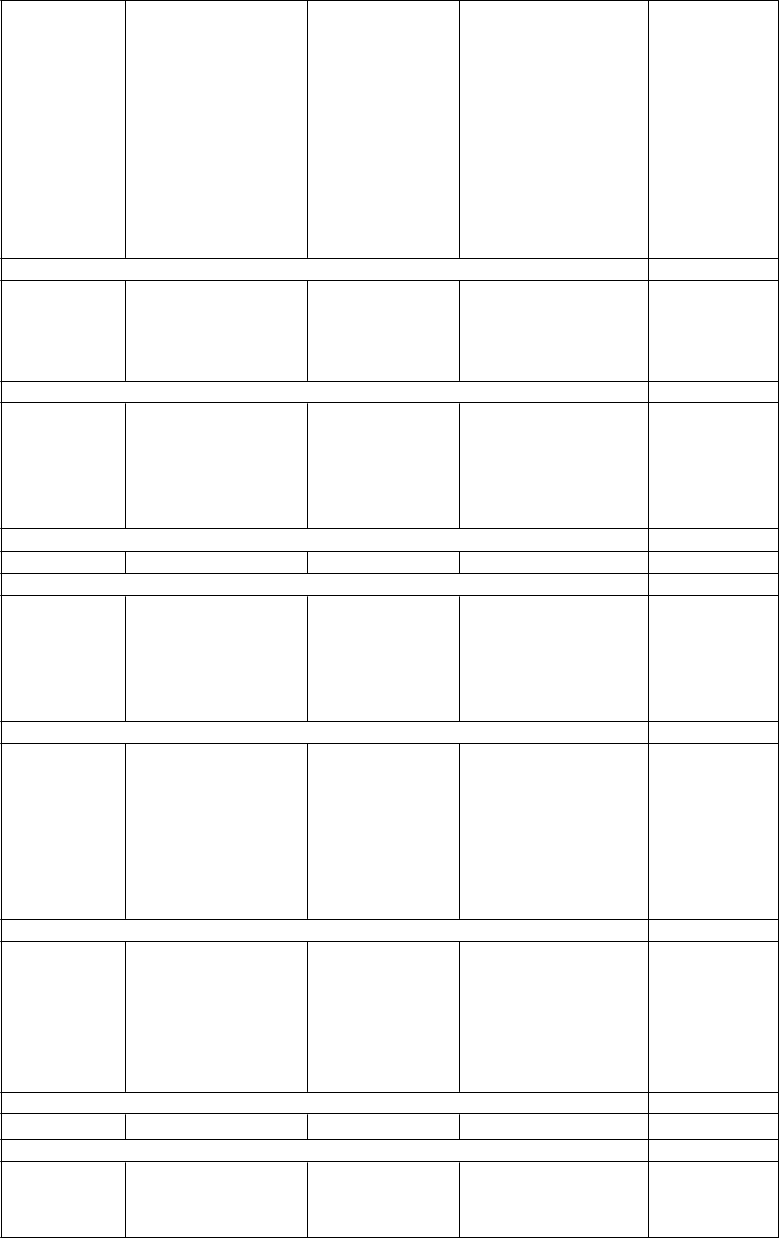
Tabuľkanežiaducichreakcií
V nasledujúcej tabuľke sú uvedené nežiaduce reakcie a laboratórne vyšetrenia získané zo spontánnych hlásení a z klinických štúdií. V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti. Frekvencia je definovaná nasledovne: Veľmi časté (≥1/10), časté
(≥ 1/100 až < 1/10), menej časté (≥ 0.1/1 000 až < 1/100), zriedkavé (≥ 0.01/10 000 až < 0.1/1000), veľmi zriedkavé ((< 0.01/10 000), neznáme (nemôžu byť stanovené z dostupných údajov).
Veľmi časté Časté Menej časté Zriedkavé Neznáme
Poruchy krvi a lymfatického systému
Eozinofília
Leukopénia10
Neutropénia10
Poruchy imunitného systému
Poruchy metabolizmu a výživy
Hypersenzitivita11
Trombocytopénia11
Zvýšenie telesnej hmotnosti1
Zvýšené hladiny cholesterolu2,3
Zvýšené hladiny glukózy 4
Zvýšené hladiny triglyceridov2,5
Glukozúria
Zvýšená chuť do jedla
Vznik alebo exacerbácia diabetu príležitostne spojená s ketoacidózou alebo kómou, vrátane niekoľkých fatálnych prípadov (pozri časť 4.4)11
Hypotermia12
 Poruchy nervového systému
Ospalosť
Poruchy nervového systému
Ospalosť Závrat
Akatízia6
Parkinsonizmus6
Dyskinéza6
Poruchy srdca a srdcovej činnostiPoruchy ciev Ortostatická hypotenzia10
Záchvaty, pričom väčšinou bol hlásený ich výskyt v anamnéze alebo rizikové faktory pre ich vznik11
Dystónia (vrátane kruhových pohybov očných gúľ) 11
Tardívna dyskinéza11
Amnézia9
Dyzartria
Bradykardia Predĺženie QTc (pozri časť 4.4)
Tromboembólia (vrátane pľúcnej embólie a hlbokej žilovej trombózy) (pozri časť 4.4)
Neuroleptický malígny syndróm (pozri časť 4.4)12
Symptómy z vysadenia7, 12
Ventrikulárna tachykardia/fibrilácia
, náhle úmrtie (pozri časť 4.4)11
Poruchy dýchacej sústavy, hrudníka a mediastína
Epistaxa9
Poruchy gastrointestinálneho traktu Mierne, prechodné anticholinergné účinky vrátane zápchy a sucha v ústach
Poruchy pečene a žlčových ciest Prechodné, asymptomatické zvýšenie pečeňových aminotransferáz (ALT, AST), hlavne na začiatku liečby (pozri časť 4.4)
Poruchy kože a podkožného tkaniva
Abdominálna distenzia9
Pankreatitída11
Hepatitída (vrátane hepatocelulárneho, cholestatického alebo zmiešaného poškodenia)11
Vyrážka Fotosenzitívna reakcia Alopécia
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Artralgia9 Rabdomyolýza11
Poruchy obličiek a močových ciest
Reakcia na liek
s eozinofíliou
a systémovými príznakmi (DRESS)
Inkontinencia moču,
retencia moču, Oneskorené močenie11
Stavy v gravidite, v šestonedelí a perinatálnom období
Poruchy reprodukčného systému a prsníkov
Abstinenčný syndróm novorodenca (pozri časť
4.6)
Erektilná dysfunkcia u mužov,
znížené libido u mužov a žien
Amenorea, zväčšenie pŕs, galaktorea u žien, gynekomastia
/zväčšenie prsníkov u mužov
Priapizmus12
Celkové poruchy a reakcie v mieste podania
Asténia Únava Edém Horúčka10
Laboratórne a funkčné vyšetrenia

Zvýšené hladiny prolaktínu8
Zvýšená hladina alkalickej fosfatázy10
Vysoká hladina kreatín-fosfokinázy11
Vysoká hladina gama glutamyltransferázy1
0 Vysoká hladina
Zvýšený celkový bilirubín

kyseliny močovej10
1 Klinicky signifikantný nárast telesnej hmotnosti sa pozoroval vo všetkých kategóriách východiskovej hodnoty indexu telesnej hmotnosti (Body Mass Index - BMI). Po krátkodobej liečbe (medián trvania
47 dní) bol nárast telesnej hmotnosti ≥ 7% pôvodnej telesnej hmotnosti veľmi častý (22,2%), ≥ 15%
častý (4,2%) a ≥ 25% menej častý (0,8%). Zvýšenie telesnej hmotnosti o ≥ 7%, ≥ 15% a ≥ 25% pôvodnej telesnej hmotnosti bolo veľmi časté (64,4%, 31,7% a 12,3%) u pacientov s dlhodobou expozíciou (minimálne 48 týždňov).
2 Priemerné zvýšenia lipidových hodnôt nalačno (celkový cholesterol, LDL cholesterol a triglyceridy)
boli vyššie u pacientov bez predtým dokázanej lipidovej dysregulácie.
3 Pozorované pri normálnych hladinách nalačno na začiatku (< 5,17 mmol/l), ktoré sa zvýšili na hladinu vysokú (≥ 6,2 mmol/l). Zmeny celkového cholesterolu nalačno z východiskovej hraničnej hodnoty (≥ 5,17 - < 6,2 mmol/l) na hodnotu vysokú (≥ 6,2 mmol/l) boli veľmi časté.
4 Pozorované pri normálnych východiskových hladinách nalačno (< 5,56 mmol/l), ktoré sa zvýšili na hladinu vysokú (≥ 7 mmol/l). Zmeny glukózy nalačno z východiskovej hraničnej hodnoty (≥ 5,56 -
< 7 mmol/l) na hodnotu vysokú (≥ 7 mmol/l) boli veľmi časté.
5 Pozorované pri normálnych hladinách nalačno na začiatku (< 1,69 mmol/l), ktoré sa zvýšili na hladinu vysokú (≥ 2,26 mmol/l). Zmeny triglyceridov nalačno z východiskovej hraničnej hodnoty (≥ 1,69 mmol/l - < 2,26 mmol/l) na hodnotu vysokú (≥ 2,26 mmol/l) boli veľmi časté.
6
V klinických štúdiách bol výskyt parkinsonizmu a dystónie u pacientov liečených olanzapínom
početne vyšší, ale štatisticky sa signifikantne nelíšil od placeba. U pacientov užívajúcich olanzapín bola, v porovnaní s titrovanými dávkami haloperidolu, menšia incidencia parkinsonizmu, akatízie
a dystónie. Vzhľadom na nedostatok podrobných informácií o akútnych a neskorých extrapyramídových príznakoch v osobnej anamnéze, nie je možné v súčasnosti dôjsť k záveru, či olanzapín spôsobuje menej často tardívne dyskinézy a/alebo ďalšie neskoré extrapyramídové syndrómy.
7 Akútne symptómy, ako sú potenie, nespavosť, tremor, úzkosť, nauzea a vracanie, boli hlásené po náhlom skončení liečby olanzapínom.
8 V klinických štúdiách trvajúcich do 12 týždňov prekročili koncentrácie plazmatického prolaktínu hornú hranicu normálneho rozmedzia u približne 30% pacientov liečených olanzapínom s normálnou počiatočnou hladinou prolaktínu. U väčšiny týchto pacientov boli zvýšenia väčšinou mierne a ostali pod dvojnásobkom hornej hranice normálneho rozmedzia.
9 Nežiaduca príhoda, pozorovaná v klinických skúšaniach v Integrovanej olanzapínovej databáze.
10 Vyhodnotené na základe nameraných hodnôt z klinických skúšaní v Integrovanej olanzapínovej databáze.
11 Nežiaduca príhoda pozorovaná zo spontánnych post-marketingových hlásení, s frekvenciou určenou pomocou Integrovanej olanzapínovej databázy.
12 Nežiaduca príhoda pozorovaná zo spontánnych post-marketingových hlásení , s frekvenciou odhadnutou pri hornom limite 95 % intervalu spoľahlivosti pomocou Integrovanej olanzapínovej databázy.
Dlhodobáexpozícia(aspoň48týždňov)Pomer pacientov, u ktorých sa vyskytli nežiaduce, klinicky signifikantné zmeny týkajúce sa hmotnostného prírastku, glukózy, celkového/LDL/HDL cholesterolu alebo triglyceridov sa časom zvýšil. U dospelých pacientov, ktorí absolvovali 9-12 mesačnú terapiu, sa rýchlosť zvýšenia priemernej hladiny krvnej glukózy spomalila približne po 6 mesiacoch.
Ďalšieinformácieozvláštnychpopuláciách
V klinických štúdiách u starších pacientov s demenciou bola pri liečbe olanzapínom v porovnaní
s placebom vyššia incidencia úmrtí a cerebrovaskulárnych nežiaducich reakcií (pozri tiež časť 4.4). Veľmi časté nežiaduce reakcie pri užívaní olanzapínu u tejto skupiny pacientov boli abnormálna chôdza a pády. Často boli pozorované pneumónia, zvýšená telesná teplota, letargia, erytém, zrakové halucinácie a inkontinencia moču.
V klinických štúdiách u pacientov s liekmi vyvolanou psychózou (dopamínovým agonistom) súvisiacou s Parkinsonovou chorobou, boli veľmi často a s vyššou frekvenciou ako u placeba zaznamenané zhoršenie parkinsonovskej symptomatiky a halucinácie.
V jednej klinickej štúdii u pacientov v manickej fáze bipolárnej poruchy bola pri liečbe valproátom v kombinácii s olanzapínom incidencia neutropénie 4,1%; potenciálne prispievajúcim faktorom by mohli byť vysoké plazmatické hladiny valproátu. Súbežné podanie olanzapínu s lítiom alebo valproátom viedlo ku zvýšeniu výskytu (³ 10%) tremoru, suchosti v ústach, zvýšenej chuti do jedla a k nárastu telesnej hmotnosti. Často boli zaznamenané aj poruchy reči. Počas liečby olanzapínom
v kombinácii s lítiom alebo divalproexom došlo v akútnej fáze liečby (do 6 týždňov) k nárastu telesnej hmotnosti o ³ 7% v porovnaní s počiatočnou hodnotou u 17,4% pacientov. Dlhodobá liečba olanzapínom (do 12 mesiacov) na prevenciu rekurencie u pacientov s bipolárnou poruchou bola spojená so zvýšením telesnej hmotnosti o ³ 7% v porovnaní s počiatočnou hodnotou u 39,9% pacientov.
PediatrickápopuláciaOlanzapín nie je indikovaný na liečbu detí a dospievajúcich pacientov do 18 rokov. Hoci sa neuskutočnili žiadne klinické štúdie porovnávajúce dospievajúcich pacientov s dospelými, údaje získané zo štúdií s dospievajúcimi pacientami boli porovnané s údajmi získanými zo štúdií
s dospelými pacientami.

V nasledujúcej tabuľke sú uvedené nežiaduce reakcie hlásené s vyššou frekvenciou u dospievajúcich pacientov (vo veku 13 – 17 rokov) ako u dospelých pacientov alebo nežiaduce reakcie, ktoré boli zistené len počas krátkodobých klinických štúdií u dospievajúcich pacientov. Zdá sa, že klinicky významný prírastok na hmotnosti (≥ 7%) sa vyskytuje častejšie u dospievajúcich v porovnaní s dospelými pri porovnateľných expozíciách. Výška hmotnostného prírastku a pomer adolescentných pacientov, u ktorých bol klinicky signifikantný hmotnostný prírastok, bol vyšší pri dlhodobej expozícii (aspoň 24 týždňov) ako pri krátkodobej expozícii.
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti. Frekvencia je definovaná nasledovne: Veľmi časté (³1/10), časté (≥ 1/100 až < 1/10).
Poruchy metabolizmu a výživyVeľmi časté: Hmotnostný prírastok13, zvýšená hladina triglyceridov14, zvýšená chuť do jedla.
Časté: Zvýšená hladina cholesterolu15
Poruchy nervového systémuVeľmi časté: Útlm (vrátane: hypersomnie, letargie, somnolencie).
Poruchy gastrointestinálneho traktu Časté
Časté: Suchosť v ústach.
Poruchy pečene a žlčových ciestVeľmi časté: Zvýšenie pečeňových aminotransferáz (ALT/AST; pozri časť 4.4).
VyšetreniaVeľmi časté: Zníženie celkového bilirubínu, zvýšenie GMT, zvýšenie plazmatickej hladiny prolaktínu16.
13 Po krátkodobej liečbe (medián trvania 22 dní) sa nárast hmotnosti o ≥ 7% v porovnaní s počiatočnou telesnou hmotnosťou (kg) vyskytoval veľmi často (40,6%), o ≥ 15% v porovnaní s počiatočnou telesnou hmotnosťou často (7,1%) a ≥ 25% často (2,5%). Pri dlhodobej expozícii (aspoň 24 týždňov)
89,4% pribralo ≥ 7%, 55,3% pribralo ≥ 15% a 29,1% pribralo ≥ 25% pôvodnej telesnej hmotnosti.
14 Pozorované pri normálnych počiatočných hladinách nalačno (< 1,016 mmol/l), ktoré sa zvýšili na
≥ 1,467 mmol/l a zmeny triglyceridov nalačno z hraničnej počiatočnej hodnoty (≥ 1,016 mmol/l -
< 1,467 mmol/l) na ≥ 1,467 mmol/l.
15 Zmeny hladín celkového cholesterolu nalačno z normálnej počiatočnej hodnoty (< 4,39 mmol/l) na
≥ 5,17 mmol/l sa vyskytovali často. Zmeny hladín celkového cholesterolu nalačno z hraničnej počiatočnej hodnoty (≥ 4,39 - < 5,17 mmol/l) na ≥ 5,17 mmol/l sa vyskytovali veľmi často.
16 Zvýšenie plazmatickej hladiny prolaktínu bolo hlásené u 47,4% dospievajúcich pacientov.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieObjektívneasubjektívnepríznakyMedzi veľmi časté príznaky (výskyt > 10%) príznaky predávkovania patrí tachykardia, agitácia/agresivita, dyzartria, rôzne extrapyramídové príznaky a nižší stupeň vedomia od útlmu až po kómu.
K ďalším zdravotne významným dôsledkom predávkovania patria delírium, kŕče, kóma, možný neuroleptický malígny syndróm, útlm dýchania, aspirácia, hypertenzia alebo hypotenzia, srdcová arytmia (< 2% prípadov predávkovania) a zástava dýchania a činnosti srdca. Smrteľné prípady sa vyskytli už po akútnom predávkovaní dávkou 450 mg, ale takisto bolo popísané prežitie po akútnom predávkovaní dávkou približne 2 g perorálneho olanzapínu.
LiečbaPre olanzapín neexistuje žiadne špecifické antidotum. Neodporúča sa vyvolávanie vracania. Môžu byť indikované štandardné postupy používané pri liečbe predávkovania (tj. výplach žalúdka, podanie aktívneho uhlia). Ukázalo sa, že súbežné podanie aktívneho uhlia znižuje biologickú dostupnosť olanzapínu po perorálnom podaní o 50-60%.
Podľa klinického stavu sa má zahájiť symptomatická liečba a monitorovanie vitálnych funkcií, vrátane liečby hypotenzie, cirkulačného šoku a podpory respiračných funkcií. Nepoužívajte adrenalín,
dopamín či iné sympatomimetiká s agonistickou aktivitou na b-receptoroch, keďže beta stimulácia môže viesť ku zhoršeniu hypotenzie. Monitorovanie kardiovaskulárnych parametrov je nevyhnutné kvôli diagnostike možných porúch srdcového rytmu. Pacient má byť až do zotavenia pod stálou
lekárskou kontrolou a majú byť sledované aj jeho vitálne funkcie.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: psycholeptiká, diazepíny, oxazepíny, tiazepíny a oxepíny, ATC kód: N05A H03.
Farmakodinamycké účinky
Olanzapín je antipsychotická, antimanická a náladu stabilizujúca látka, ktorá vykazuje široký profil farmakologických účinkov na viaceré receptorové systémy.
V predklinických štúdiách preukázal olanzapín afinitu k radu receptorov (Ki; < 100 nM) - k serotonínovým 5HT2A/2C, 5HT3, 5HT6; dopamínovým D1, D2, D3, D4, D5; cholinergným muskarínovým M1-M5; a1-adrenergným; a histamínovým H1 receptorom. Behaviorálne štúdie na zvieratách preukázali antagonistické pôsobenie olanzapínu na 5HT, dopamínové a cholínergné
receptory, čo je v súlade s väzbovým profilom látky. Olanzapín vykazoval in vitro väčšiu afinitu
k serotonínovým 5HT2 receptorom než k dopamínovým D2 a vyššiu 5HT2 ako D2 aktivitu na in vivo modeloch. Elektrofyziologické štúdie ukázali, že olanzapín selektívne znižuje aktivitu mezolimbických (A10) dopaminergných neurónov bez výraznejšej interakcie so striatálnymi (A9) dráhami ovládajúcimi motoriku. Olanzapín znižoval podmienenú reakciu úniku, čo je test na zistenie antipsychotického účinku, v dávkach, ktoré ešte nevyvolávajú katalepsiu, účinok naznačujúci motorické vedľajšie účinky. Na rozdiel od niektorých iných antipsychotík, olanzapín zvyšuje reaktivitu v „anxiolytickom“ teste.
V štúdii s jednorazovou perorálnou dávkou (10 mg) a sledovaním pomocou pozitrónovej emisnej tomografie (PET) u zdravých dobrovoľníkov obsadzoval olanzapín viac 5HT2A receptory ako dopamínové D2 receptory. Navyše, v zobrazovacej štúdii Single Photon Emission Computed Tomography (SPECT) bola miera obsadzovania D2 receptorov u schizofrenických pacientov odpovedajúcich na olanzapín nižšia ako u pacientov odpovedajúcich na iné antipsychotiká a pacientov odpovedajúcich na risperidón, zatiaľ čo u pacientov odpovedajúcich na klozapín bola porovnateľná.
Klinická účinnosť
V dvoch z dvoch placebo kontrolovaných a dvoch z troch porovnávacích kontrolovaných štúdií s viac ako 2 900 schizofrenickými pacientami s pozitívnymi i negatívnymi symptómami vykazoval olanzapín štatisticky významne väčšie zlepšenie ako u negatívnych, tak aj u pozitívnych symptómov.
V medzinárodnej, dvojito zaslepenej, porovnávacej štúdii zahŕňajúcej 1 481 pacientov so schizofréniou, schizoafektívnymi a príbuznými poruchami a s rôznymi stupňami pridružených depresívnych symptómov (priemerné východiskové skóre 16,6 škály MADRS /the Montgomery- Asberg Depression Rating Scale/) preukázala prospektívna sekundárna analýza zmenu skóre od východiskovej po konečnú hodnotu štatisticky významné zlepšenie (p=0,001) v prospech olanzapínu (-6,0) oproti haloperidolu (-3,1).
U pacientov s manickou alebo zmiešanou epizódou bipolárnej poruchy preukázal olanzapín v znížení manických symptómov za 3 týždne vyššiu účinnosť ako placebo a valproát semisodium (divalproex). Olanzapín taktiež preukázal porovnateľnú účinnosť s haloperidolom v zmysle podielu pacientov
v symptomatickej remisii mánie a depresie po 6 a 12 týždňoch. V štúdii kombinovanej terapie
u pacientov liečených lítiom alebo valproátom po dobu minimálne 2 týždne viedlo pridanie olanzapínu v dávke 10 mg (v kombinácii s lítiom alebo valproátom) ku väčšej redukcii symptómov mánie ako tomu bolo pri liečbe lítiom alebo valproátom v rámci monoterapie za 6 týždňov.
V 12-mesačnej štúdii prevencie rekurencie u pacientov s manickou epizódou, ktorí dosiahli remisiu pri liečbe olanzapínom a boli potom randomizovaní na užívanie olanzapínu alebo placeba, preukázal olanzapín voči placebu v primárnom koncovom bode rekurencie bipolárnej poruchy štatisticky významnú nadradenosť. Olanzapín taktiež vykázal v porovnaní s placebom štatisticky významnú výhodu buď z hľadiska prevencie rekurencie mánie alebo prevencie rekurencie depresie.
V druhej 12-mesačnej štúdii prevencie rekurencie u pacientov s manickou epizódou, ktorí dosiahli remisiu pri liečbe kombináciou olanzapínu a lítia a boli potom randomizovaní na užívanie samotného olanzapínu alebo lítia, nebol olanzapín v primárnom parametre rekurencie bipolárnej poruchy štatisticky podradený voči lítiu (olanzapín 30,0%, lítium 38,3%; p = 0,055).
V 18-mesačnej štúdii s kombinovanou liečbou u pacientov s manickou alebo zmiešanou epizódou, ktorí boli stabilizovaní pri liečbe olanzapínom spolu so stabilizátorom nálady (lítium alebo valproát), nebola dlhodobá kombinovaná liečba olanzapínom spolu s lítiom alebo valproátom štatisticky významne superiorná voči liečbe samotným lítiom alebo valproátom v predĺžení doby do rekurencie bipolárnej poruchy definovanej podľa syndrómových (diagnostických) kritérií.
Pediatrickápopulácia
Kontrolované údaje o účinnosti s dospievajúcimi (vo veku 13 až 17 rokov) sú obmedzené na štúdie s perorálnym olanzapínom pri liečbe schizofrénie (6 týždňov) a mánie v súvislosti s bipolárnou poruchou typu I (3 týždne), ktoré zahŕňali menej ako 200 dospievajúcich. Olanzapín sa podával vo flexibilnej dávke od 2,5 mg až do 20 mg denne. Počas liečby olanzapínom sa zvýšila hmotnosť
u dospievajúcich podstatne viac ako u dospelých. Rozsah zmien celkového cholesterolu nalačno, LDL
cholesterolu, triglyceridov a prolaktínu (pozri časti 4.4 a 4.8) bol väčší u dospievajúcich ako
u dospelých. Nie sú k dispozícii kontrolované údaje o pretrvávaní účinku a niúdaje o dlhodobej bezpečnosti sú obmedzené (pozri časti 4.4 a 4.8). Informácie o dlhodobej bezpečnosti sú primárne obmedzené na otvorené nekontrolované dáta.
5.2 Farmakokinetické vlastnosti
Absorpcia
Orodispergovateľná tableta olanzapínu je bioekvivalentná filmom obalenej tablete olanzapínu,
s podobnou rýchlosťou a rozsahom vstrebávania. Orodispergovateľné tablety olanzapínu je možné užívať ako náhradu filmom obalených tabliet olanzapínu.
Distribúcia
V koncentračnom rozmedzí 7 až asi 1 000 ng/ml je väzba olanzapínu na plazmatické bielkoviny približne 93%. Olanzapín sa v plazme viaže na albumín a α1-kyslý glykoproteín.
Biotransformácia
Olanzapín sa po perorálnom podaní dobre vstrebáva a dosahuje maximálne koncentrácie v plazme
za 5 až 8 hodín. Vstrebávanie nie je ovplyvnené jedlom. Absolútna perorálna biologická dostupnosť vo vzťahu k intravenóznemu podaniu nebola stanovená.
Olanzapín sa metabolizuje v pečeni konjugáciou a oxidáciou. Hlavným metabolitom v obehu je 10-N- glukuronid, ktorý neprestupuje hematoencefalickou bariérou. Cytochrómy P450-CYP1A2 a P450- CYP2D6 prispievajú k tvorbe metabolitov N-desmetylu a 2-hydroxymetylu, vykazujúcich in vivo významne nižšiu farmakologickú aktivitu ako olanzapín v štúdiách na zvieratách. Prevažná časť famakologickej aktivity je spôsobená pôvodným olanzapínom.
Eliminácia
Po perorálnom podaní, priemerný terminálny polčas vylučovania olanzapínu sa u zdravých jedincov líšil podľa veku a pohlavia.
U zdravých starších jedincov (nad 65 rokov) sa v porovnaní s mladšími jedincami priemerný polčas vylučovania predĺžil (51,8 oproti 33,8 hod) a klírens sa znížil (17,5 oproti 18,2 l/hod). Farmakokinetické odchýlky pozorované u starších jedincov sú v medziach odchýlok mladších jedincov. U 44 schizofrenických pacientov starších ako 65 rokov sa pri dávkach 5-20 mg/deň nepozoroval zvýšený výskyt nežiaducich účinkov.
Priemerný polčas vylučovania u žien sa oproti mužom predĺžil (36,7 oproti 32,3 hod) a klírens sa znížil (18,9 oproti 27,3 l/hod). Napriek tomu vykazuje olanzapín (5-20 mg) porovnateľný bezpečnostný profil tak u žien (n=467) ako aj u mužov (n=869).
Poškodenie obličiek
U pacientov s poškodením funkcie obličiek (klírens kreatinínu < 10 ml/min) v porovnaní so zdravými jedincami nespôsobovala významný rozdiel priemerného polčasu eliminácie (37,7 oproti32,4 hod) alebo klírensu (21,2 oproti 25,0 l/hod). Štúdia rovnováhy ukázala, že približne 57% olanzapínu označeného rádioaktívnym izotopom sa vylučuje do moča vo forme metabolitov.
Fajčiari
U fajčiarov s miernym poškodením pečene, v porovnaní so zdravými nefajčiarmi, sa priemerný polčas vylučovania (39,3 hod) predĺžil a klírens (18,0 l/hod) sa znížil (48,8 hod resp. 14,1 l/hod).
U nefajčiarov oproti fajčiarom (ženy i muži) sa priemerný polčas vylučovania predĺžil (38,6 oproti
30,4 hod) a klírens znížil (18,6 oproti 27,7 l/hod).
Plazmatický klírens olanzapínu je nižší u starších ako u mladších jedincov, u žien ako u mužov
a u nefajčiarov oproti fajčiarom. Avšak závažnosť vplyvu veku, pohlavia alebo fajčenia na klírens
a polčas vylučovania olanzapínu sú malé v porovnaní s celkovou variabilitou medzi jednotlivcami.
V klinickej štúdii neboli žiadne rozdiely farmakokinetických parametrov medzi belochmi, Japoncami a Číňanmi.
Pediatrickápopulácia
Dospievajúci (vek 13 až 17 rokov): Farmakokinetika olanzapínu je podobná u dospievajúcich a dospelých. V klinických štúdiách bola priemerná expozícia olanzapínu približne o 27% vyššia
u dospievajúcich. Demografické rozdiely medzi dospievajúcimi a dospelými zahŕňali nižšiu priemernú telesnú hmotnosť a menší počet fajčiarov medzi dospievajúcimi. Tieto faktory možno prispeli k vyššej priemernej expozícii pozorovanej u dospievajúcich.
5.3 Predklinické údaje o bezpečnosti
Akútnatoxicita(pojednorazovompodaní)
Príznaky toxicity po perorálnom podaní hlodavcom obsahovali silnú neuroleptickú zložku: hypoaktivitu, kómu, tras, klonické kŕče, slinenie a pokles telesnej hmotnosti. Stredná letálna dávka u myší bola 210 mg/kg a u krýs 175 mg/kg. Psi tolerovali jednorazovú dávku až do100 mg/kg
s nulovou mortalitou. Medzi klinické príznaky patril útlm, ataxia, tras, zrýchlený pulz, sťažené dýchanie, mióza a anorexia. U opíc vyvolala jednorazová perorálna dávka do 100 mg/kg vyčerpanosť a vyššie dávky čiastočné bezvedomie.
Toxicitapoopakovanompodaní
Medzi hlavné prejavy toxicity pozorované v 3-mesačnej štúdii u myší a 1-ročnej štúdii u potkanov a psov patril útlm CNS, anticholínergné účinky a ochorenia periférnej krvi.
Na útlm CNS sa vyvinula tolerancia. Pri vysokých dávkach poklesli parametre rastu. Reverzibilné účinky spojené so zvýšenou hladinou prolaktínu u krýs zahŕňali pokles hmotnosti ovárií a uteru
a morfologické zmeny vaginálneho epitelu a prsných žliaz.
Hematologickátoxicita
U všetkých druhov boli pozorované účinky na hematologické ukazovatele, vrátane na dávke závislom poklese počtu leukocytov v krvi u myší a nešpecifickom poklese leukocytov v krvi u krýs; cytotoxický účinok na kostnú dreň sa však nedokázal. U niekoľkých psov, ktorým sa podávalo 8 alebo
10 mg/kg/deň (celková expozícia olanzapínu [AUC] je 12- až 15-krát vyššia než pri podaní dávky
12 mg človeku), sa vyvinula reverzibilná neutropénia, trombocytopénia alebo anémia. U psov
s cytopéniou sa nepozorovali žiadne nepriaznivé účinky na progenitorové a proliferujúce bunky kostnej drene.
Reprodukčnátoxicita
Olanzapín nemá žiadny teratogénne účinky. U samcov potkanov sa pozoroval pokles libida ako dôsledok sedácie. Estrálne cykly boli ovplyvnené dávkou 1,1 mg/kg (čo je 3-násobok maximálnej dávky u človeka) a reprodukčné parametre boli u potkanov ovplyvnené dávkou 3 mg/kg (čo je
9-násobok maximálnej dávky u človeka). U potomstva potkanov, ktorým sa podával olanzapín, sa pozorovalo oneskorenie fetálneho vývoja a prechodný pokles aktivity.
Mutagenita
Olanzapín nemal mutanogénne ani klastogénne účinky v žiadnom zo štandardných testov, vrátane testov bakteriálnych mutácií in vivo a in vitro testov na cicavcoch.
Karcinogenita
Na základe výsledkov štúdií na myšiach a potkanoch sa zistilo, že olanzapín nie je karcinogénny.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
manitol (E421) aspartám (E951) magnéziumstearát krospovidón typ B
monohydrát laktózy hydroxypropylcelulóza
Citrón [aromatický prípravok (y), maltodextrín, sacharóza, arabská guma (E414), triacetát glycerolu
(E1518) a alfa-tokoferol (E307)]
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v pôvodnom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah baleniaHliníkové blistre z OPA/hliníka/PVC v škatuliach obsahujúcich 28, 30, 35, 50, 56, 70 a 98
orodispergovateľných tabliet v jednej škatuli.
Na trh nemusia byť uvedené všetky veľkosti balenia .
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIITeva B.V., Swensweg 5, 2031GA Haarlem, Holandsko
8. REGISTRAČNÉ ČÍSLOEU/1/07/427/027 – Olanzapin Teva – 10 mg – orodispergovateľné tablety – 28 tabliet v škatuli. EU/1/07/427/028 – Olanzapin Teva – 10 mg – orodispergovateľné tablety – 30 tabliet v škatuli. EU/1/07/427/045 – Olanzapin Teva – 10 mg – orodispergovateľné tablety – 35 tabliet v škatuli. EU/1/07/427/029 – Olanzapin Teva – 10 mg – orodispergovateľné tablety – 50 tabliet v škatuli. EU/1/07/427/030 – Olanzapin Teva – 10 mg – orodispergovateľné tablety – 56 tabliet v škatuli. EU/1/07/427/055 – Olanzapin Teva – 10 mg – orodispergovateľné tablety – 70 tabliet v škatuli. EU/1/07/427/065 – Olanzapin Teva – 10 mg– orodispergovateľné tablety – 98 tabliet v škatuli.
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12/12/2007
Dátum prvého predĺženia registrácie: 12/12/2012
10. DÁTUM REVÍZIE TEXTU{MM/RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry
(EMA)
http://www.ema.europa.eu/.
1
. NÁZOV LIEKU
Olanzapin Teva 15 mg orodispergovateľné tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Každá 15 mg orodispergovateľná tableta obsahuje 15 mg olanzapínu. Pomocné látky so známym účinkom:
Každá 15 mg orodispergovateľná tableta obsahuje 142,5 mg laktózy (vo forme monohydrátu), 0,7875
mg sacharózy a 6,75 mg aspartámu (E951). Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Orodispergovateľná tableta
Žltá, okrúhla, bikonvexná tableta, s priemerom 11 mm.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Dospelí
Olanzapín je indikovaný na liečbu schizofrénie.
Olanzapín je účinný pri udržaní klinického zlepšenia počas pokračujúcej terapie u pacientov, ktorí na začiatku liečby odpovedali zlepšením.
Olanzapín je indikovaný na liečbu stredne ťažkých až ťažkých manických epizód.
Olanzapín je indikovaný na prevenciu rekurencie u pacientov s bipolárnou poruchou, u ktorých liečba manickej epizódy olanzapínom bola účinná (pozri časť 5.1).
4.2 Dávkovanie a spôsob podávania
Dospelí
Schizofrénia: Odporúčaná počiatočná dávka olanzapínu je 10 mg/deň.
Manická epizóda: Počiatočná dávka je 15 mg v jednej dávke denne v monoterapii alebo 10 mg denne pri kombinovanej terapii (pozri časť 5.1).
Prevencia rekurencie bipolárnej poruchy: Odporúčaná počiatočná dávka je 10 mg/deň. U pacientov, ktorí boli v manickej epizóde liečení olanzapínom, pokračujte pre prevenciu rekurencie v terapii rovnakou dávkou. Pokiaľ sa objaví nová manická, zmiešaná alebo depresívna epizóda, liečba olanzapínom má pokračovať (s optimalizáciou dávky podľa potreby) s prídavnou terapiou príznakov poruchy nálady podľa klinickej indikácie.
V priebehu liečby schizofrénie, manických epizód a prevencie rekurencie bipolárnej poruchy môže byť denné dávkovanie následne prispôsobované na základe individuálneho klinického stavu
v rozmedzí 5-20 mg/deň. Zvýšenie na vyššiu ako odporúčanú počiatočnú dávku sa odporúča len po patričnom opätovnom klinickom zhodnotení a nemá sa spravidla objaviť v intervaloch kratších ako
24 hodín. Olanzapín môže byť podávaný bez ohľadu na jedlo, pretože absorpcia nie je ovplyvňovaná potravou. Pri vysadzovaní olanzapínu sa má zvážiť postupné znižovanie dávky.
Olanzapin Teva orodispergovateľná tableta sa má vložiť do úst, kde sa rýchlo rozpustí v slinách, takže sa dá ľahko prehltnúť. Vybrať túto orodispergovateľnú tabletu z úst bez porušenia je obtiažne. Keďže orodispergovateľná tableta je krehká, má sa užiť bezprostredne po otvorení blistra. Prípadne sa môže bezprostredne pred podaním rozpustiť v plnom pohári vody alebo iného vhodného nápoja (pomarančová šťava, jablková šťava, mlieko alebo káva).
Orodispergovateľná tableta olanzapínu je bioekvivalentná obalenej tablete olanzapínu, s podobnou rýchlosťou a rozsahom vstrebávania. Dávkovanie a frekvencia podávania sú rovnaké ako u obalenej tablety olanzapínu. Orodispergovateľné tablety olanzapínu je možné užívať ako náhradu obalených tabliet olanzapínu.
Osobitné skupiny
Starší pacienti pacienti
Podanie nižšej počiatočnej dávky (5 mg/deň) nie je zvyčajne indikované, avšak malo by sa zvážiť u pacientov vo veku 65 rokov a viac, ak to ich klinický stav vyžaduje (pozri časť 4.4).
Pacienti s poškodením funkcie obličiek a/alebo pečene
U týchto pacientov je vhodné zvážiť nižšiu počiatočnú dávku (5 mg). V prípade mierneho poškodenia pečene (cirhóza, Child-Pugh trieda A alebo B) má byť počiatočná dávka 5 mg a zvyšovať sa má len so
zvýšenou opatrnosťou.
Fajčiari
Nefajčiarom, v porovnaní s fajčiarmi, nie je zvyčajne potrebné upravovať počiatočnú dávku
a dávkovacie rozpätie. Metabolizmus olanzapínu sa môže fajčením indukovať. Odporúča sa ho klinicky sledovať a ak je to potrebné, zvážiť zvýšenie dávky olanzapínu. (pozri časť 4.5)
Pri prítomnosti viac ako jedného faktora, ktorý môže spomaľovať metabolizmus (ženské pohlavie, vyšší vek, nefajčiar) sa má zvážiť zníženie počiatočnej dávky. Zvyšovanie dávky u týchto osôb, ak je indikované, má byť opatrné.
V prípadoch, v ktorých sa považuje za nevyhnutné zvýšenie dávky o 2,5 mg, sa majú použiť filmom obalené tablety Olanzapin Teva.
(Pozri časti 4.5 a 5.2).
Pediatrická populácia
Olanzapín sa neodporúča používať u detí a dospievajúcich vo veku do 18 rokov kvôli nedostatočným údajom o bezpečnosti a účinnosti. Vyšší stupeň prírastku na hmotnosti, zmien lipidov a prolaktínu boli hlásené v krátkodobých štúdiách u dospievajúcich pacientov v porovnaní so štúdiami s dospelými
pacientmi (pozri časti 4.4, 4.8, 5.1 a 5.2).
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Pacienti so známym rizikom glaukómu s úzkym uhlom.
4.4 Osobitné upozornenia a opatrenia pri používaní
Počas antipsychotickej liečby môže trvať niekoľko dní až týždňov, kým dôjde k zlepšeniu klinického stavu pacienta. V tomto období musia byť pacienti podrobení starostlivej kontrole.
Psychózasúvisiacasdemencioua/aleboporuchysprávania
Olanzapín sa neodporúča používať u pacientov s psychózou a/alebo s poruchami správania súvisiacimi s demenciou z dôvodu zvýšenej mortality a rizika cerebrovaskulárnych príhod. V placebom kontrolovaných klinických štúdiách (trvanie 6-12 týždňov) u starších pacientov (priemerný vek 78 rokov) s psychózou súvisiacou s demenciou a/alebo poruchami správania bola u pacientov liečených olanzapínom 2-násobná incidencia úmrtia v porovnaní s pacientami užívajúcimi placebo (3,5% vs.
1,5%). Vyššia incidencia úmrtia nesúvisela s dávkou olanzapínu (priemerná denná dávka 4,4 mg) alebo s dĺžkou liečby. Rizikové faktory, ktoré sa môžu podieľať na zvýšenej mortalite u tejto skupiny pacientov, sú vek nad 65 rokov, dysfágia, sedácia, malnutrícia a dehydratácia, pľúcne ochorenia (napr. pneumónia s alebo bez aspirácie) alebo súčasné užívanie benzodiazepínov. Vyššia incidencia úmrtia u pacientov liečených olanzapínom v porovnaní s pacientami užívajúcimi placebo bola však od týchto rizikových faktorov nezávislá.
V rovnakých klinických štúdiách boli hlásené cerebrovaskulárne nežiaduce príhody (CVAE napr. mozgová porážka, tranzitórny ischemický atak), vrátane úmrtí. U pacientov liečených olanzapínom bol v porovnaní s pacientami užívajúcimi placebo 3-násobný nárast CVAE (1,3% vs. 0,4%).
U všetkých pacientov liečených olanzapínom alebo placebom, u ktorých sa vyskytla cerebrovaskulárna príhoda, boli už predtým prítomné rizikové faktory. Vek > 75 rokov
a vaskulárna/zmiešaná demencia boli zistené ako rizikové faktory pre CVAE v súvislosti s liečbou olanzapínom. Účinnosť olanzapínu v týchto štúdiách nebola stanovená.
Parkinsonovachoroba
Neodporúča sa použitie olanzapínu na liečbu psychózy súvisiacej s podávaním dopamínového agonistu u pacientov s Parkinsonovou chorobou. V klinických štúdiách boli veľmi často a s vyššou frekvenciou ako u placeba zaznamenané zhoršenie parkinsonovskej symptomatiky a halucinácie (pozri časť 4.8), pričom olanzapín nebol v liečení psychotických príznakov účinnejší ako placebo. V týchto štúdiách museli mať pacienti na začiatku štúdie stabilnú najnižšiu účinnú dávku antiparkinsonika (dopamínový agonista) a rovnaké antiparkinsonikum im bolo podávané v rovnakej dávke po celú zostávajúcu dobu štúdie. Počiatočná dávka olanzapínu bola 2,5 mg/deň a podľa uváženia
vyšetrujúceho lekára bola titrovaná do maximálnej dávky 15 mg/deň.
Neuroleptickýmalígnysyndróm(NMS)
NMS je potenciálne život ohrozujúci stav, ktorý sa objavil v súvislosti s podávaním antipsychotík. Zriedkavé prípady označené ako NMS sa rovnako vyskytli v súvislosti s olanzapínom. Klinické prejavy NMS sú hyperpyrexia, svalová rigidita, zmenený duševný stav a príznaky autonómnej instability (nepravidelný pulz alebo tlak krvi, tachykardia, potenie a srdcová dysrytmia). Ďalšími príznakmi môžu byť zvýšená hladina kreatínfosfokinázy, myoglobinúria (rabdomyolýza) a akútne renálne zlyhanie. Ak sa u pacienta vyvinú znaky a príznaky, ktoré naznačujú prítomnosť NMS, alebo ak má vysokú horúčku nevysvetleného pôvodu bez ďalších klinických známok NMS, musia sa vysadiť všetky antipsychotiká vrátane olanzapínu.
Hyperglykémiaadiabetes
Menej často bola hlásená hyperglykémia a/alebo exacerbácia preexistujúceho diabetu, príležitostne spojená s ketoacidózou alebo kómou, v niekoľkých prípadoch vedúcou aj k úmrtiam pacientov(pozri časť 4.8). V niektorých prípadoch tomu predchádzalo zvýšenie telesnej hmotnosti, čo mohlo byť predispozičným faktorom. Odporúča sa príslušné klinické monitorovanie s využitím zavedených smerníc pre antipsychotickú liečbu, napr. meranie hladiny glukózy v krvi na začiatku liečby, 12 týždňov po začatí liečby olanzapínom a následne v ročných intervaloch. U pacientov liečených akýmkoľvek antipsychotikom vrátane olanzapínu majú byť sledované príznaky a symptómy hyperglykémie (akými sú napríklad polydipsia, polyúria, polyfágia a slabosť) a pacienti s diabetom a pacienti s rizikovými faktormi pre vývoj diabetu majú byť pravidelne sledovaní kvôli možnému zhoršovaniu sa glukózovej regulácie. Hmotnosť sa má sledovať pravidelne, napr. na začiatku, po 4, 8 a
12 týždňoch liečby olanzapínom a následne každého štvrť roka.
Zmenylipidov
Nežiaduce zmeny lipidov sa pozorovali u pacientov liečených olanzapínom v placebom kontrolovaných klinických štúdiách (pozri časť 4.8). Zmeny lipidov sa majú liečiť tak, ako je to klinicky vhodné, najmä u pacientov s dyslipidémiou a u pacientov s rizikovými faktormi pre vývoj porúch lipidového spektra. U pacientov liečených akýmkoľvek antipsychotikom vrátane olanzapínu majú byť pravidelne sledované lipidy s využitím zavedených smerníc pre antipsychotickú liečbu, napr.
na začiatku, po 12 týždňoch liečby olanzapínom a následne každých 5 rokov.
Anticholinergnýúčinok
Aj keď olanzapín in vitro prejavil anticholinergný účinok, skúsenosti z klinických štúdií odhalili nízky výskyt s tým súvisiacich príhod. Keďže sú však klinické skúsenosti s podávaním olanzapínu
pacientom s inými súbežnými ochoreniami obmedzené, pri predpisovaní pacientom s hypertrofiou prostaty alebo paralytickým ileom a podobnými stavmi sa odporúča postupovať opatrne.
Funkciapečene
Často, najmä na začiatku liečby, bolo pozorované prechodné asymptomatické zvýšenie hladiny pečeňových aminotransferáz, alanín transferáz (ALT) a aspartát transferáz (AST). Zvýšená opatrnosť a ďalšie sledovanie je potrebné u pacientov so zvýšenými hodnotami ALT a/alebo AST, u pacientov so znakmi a príznakmi poškodenia pečene, u pacientov s preexistujúcimi stavmi spojenými
s obmedzenou funkčnou rezervou pečene a u pacientov liečených potenciálne hepatotoxickými liekmi. Ak sa u pacientov diagnostikuje hepatitída (vrátane hepatocelulárneho, cholestatického alebo zmiešaného poškodenia pečene), má sa liečba olanzapínom ukončiť.
Neutropénia
Opatrnosť je potrebná u pacientov so zníženým počtom leukocytov a/alebo neutrofilov z akéhokoľvek dôvodu, u pacientov užívajúcich lieky, o ktorých je známe, že spôsobujú neutropéniu, u pacientov
s anamnézou liekmi navodeného útlmu/toxicity kostnej drene alebo útlmom kostnej drene spôsobeným súbežným ochorením, radiačnou terapiou alebo chemoterapiou, u pacientov
s hypereozinofíliou alebo s myeloproliferatívnou chorobou. Neutropénia bola často hlásená pri súbežnom užívaní olanzapínu a valproátu (pozri časť 4.8).
Ukončenieliečby
Pri náhlom ukončení liečby olanzapínom boli zriedkavo (≥ 0,01 % a < 0,1 %) hlásené akútne príznaky ako potenie, nespavosť, tras, úzkosť, nevoľnosť alebo vracanie.
QTinterval
V klinických štúdiách bolo u pacientov liečených olanzapínom klinicky významné predĺženie QTc intervalu (korekcia QT podľa Fridericii [QTcF] ≥500 milisekúnd [msec] kedykoľvek po vstupnom vyšetrení u pacientov so vstupnou hodnotou QTcF<500 msec) menej časté (0,1% až 1%), bez signifikantných rozdielov v sprievodných kardiálnych príhodách v porovnaní s placebom. Je však potrebná opatrnosť, ak sa olanzapín predpisuje s liekom predlžujúcim QTc interval, najmä u starších pacientov, u pacientov s vrodeným syndrómom predĺženého QT, s kongestívnou srdcovou nedostatočnosťou, hypertrofiou srdca, hypokaliémiou alebo hypomagneziémiou.
Tromboembólia
Časová súvislosť liečby olanzapínom a venóznej tromboembólie (VTE) bola hlásená menej často (≥
0,1 % a < 1 %). Príčinná súvislosť medzi výskytom venóznej tromboembólie a liečbou olanzapínom nebola stanovená. Napriek tomu, keďže sú u pacientov so schizofréniou často prítomné získané rizikové faktory venóznej tromboembólie, je nutné brať do úvahy všetky možné rizikové faktory VTE, napr. imobilizácia pacientov, a vykonať preventívne opatrenia.
CelkovýúčinoknaCNS
Vzhľadom na primárny účinok olanzapínu na CNS je potrebná opatrnosť pri súbežnom užívaní s inými centrálne pôsobiacimi liekmi či alkoholom. Pretože pôsobí in vitro ako dopamínový antagonista, môže olanzapín antagonizovať účinky priamych a nepriamych agonistov dopamínu.
Záchvaty
Olanzapín sa má používať opatrne u pacientov so záchvatmi v anamnéze alebo u tých, ktorí sú vystavení faktorom, ktoré môžu znižovať prah pre záchvaty. U pacientov liečených olanzapínom boli záchvaty hlásené menej často. Vo väčšine týchto prípadov boli v anamnéze prítomné záchvaty alebo iné rizikové faktory.
Tardívnadyskinéza
V ročných alebo kratších porovnávacích štúdiách bol olanzapín štatisticky významne menej často spojený so vznikom dyskinézy vyvolanej liečbou. Napriek tomu riziko tardívnej dyskinézy pri
dlhodobom užívaní narastá, a preto, ak sa u pacienta, ktorý je liečený olanzapínom, objavia znaky alebo príznaky tardívnej dyskinézy, sa má zvážiť zníženie dávky alebo vysadenie liečby. Tieto prejavy sa môžu prechodne zhoršiť alebo aj objaviť po prerušení liečby.
PosturálnahypotenziaV klinických štúdiách olanzapínu sa zriedka u starších pacientov pozorovala posturálna hypotenzia. U pacientov starších ako 65 rokov sa odporúča pravidelne merať krvný tlak.
NáhlasrdcovásmrťV postmarketingovom sledovaní olanzapínu boli nahlásené prípady náhlej srdcovej smrti u pacientov liečených olanzapínom. V retrospektívnej observačnej kohortnej štúdii bolo riziko predpokladanej náhlej srdcovej smrti u pacientov liečených olanzapínom približne dvojnásobné oproti pacientom,
ktorí neužívali antipsychotiká. V danej štúdii bolo riziko pri použití olanzapínu porovnateľné s rizikom použitia atypických antipsychotík spojených do jednej analýzy.
PediatrickápopuláciaOlanzapín nie je indikovaný na liečbu detí a dospievajúcich. Štúdie s pacientami vo veku 13-17 rokov preukázali rozličné nežiaduce reakcie, vrátane zvýšenia telesnej hmotnosti, zmien metabolických parametrov a zvýšenia hladín prolaktínu (pozri časti 4.8 a 5.1).
Orodispergovateľná tableta Olanzapin Teva obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
Olanzapin Teva orodispergovateľné tablety obsahuje sacharózu. Pacienti so zriedkavými dedičnými problémami intolerancie fruktózy, glukózo-galaktózovou malabsorpciou alebo nedostatkom sacharózo-isomaltázy nesmú užívať tento liek.

Olanzapin Teva orodispergovateľné tablety obsahuje aspartám, ktorý je zdrojom fenylalanínu. Môže
byť škodlivý pre osoby s fenylketonúriou.
4.5 Liekové a iné interakcieŠtúdie sledujúce interakcie boli uskutočnené len u dospelých.
MožnéinterakcieovplyvňujúceolanzapínVzhľadom na fakt, že olanzapín je metabolizovaný izoenzýmom CYP1A2, látky, ktoré špecificky indukujú alebo inhibujú tento izoenzým, môžu ovplyvniť farmakokinetiku olanzapínu.
IndukciaCYP1A2Fajčenie a karbamazepín môžu indukovať metabolizmus olanzapínu, čo môže následne viesť ku zníženiu koncentrácie olanzapínu. Pozorovali sa zanedbateľné, prípadne len mierne zvýšené hodnoty klírensu olanzapínu. Hoci klinický dopad je pravdepodobne minimálny, odporúča sa klinické monitorovanie a v nevyhnutných prípadoch je možné zvážiť zvýšenie dávok olanzapínu (pozri časť
4.2).
InhibíciaCYP1A2Preukázalo sa, že fluvoxamín, špecifický inhibítor CYP1A2, významne spomaľuje metabolizmus olanzapínu. Priemerné zvýšenie maximálnej koncentrácie (Cmax) olanzapínu fluvoxamínom bolo 54% u žien nefajčiarok a 77% u mužov fajčiarov. Priemerné zvýšenie plochy pod krivkou koncentrácie (AUC) olanzapínu bolo 52% u žien nefajčiarok a 108% u mužov fajčiarov. U pacientov užívajúcich fluvoxamín, prípadne iný inhibítor CYP1A2, ako napr. ciprofloxacín, sa má zvážiť zníženie počiatočnej dávky olanzapínu. Pri zahájení liečby inhibítorom CYP1A2 sa má zvážiť zníženie dávok olanzapínu.
ZníženiebiologickejdostupnostiAktívne uhlie znižuje biologickú dostupnosť olanzapínu po perorálnom podaní o 50 až 60%, preto sa má užívať minimálne 2 hodiny pred, resp. po podaní olanzapínu.
Fluoxetín (inhibítor CYP2D6), jednorazové dávky antacida (s obsahom hliníka, horčíka) alebo cimetidín, nemali signifikantný vplyv na farmakokinetiku olanzapínu.
Možnéovplyvnenieúčinkuinýchliekovolanzapínom
Olanzapín môže antagonizovať účinky priamych a nepriamych agonistov dopamínu.
Olanzapín in vitro neinhibuje hlavné izoenzýmy CYP450 (napr. 1A2, 2D6, 2C9, 2C19, 3A4). Neočakávajú sa preto žiadne osobitné interakcie, čo dokazujú aj in vivo štúdie, ktoré nepreukázali inhibíciu metabolizmu nasledovných aktívnych látok: tricyklických antidepresív (reprezentujúcich prevažne CYP2D6 cestu metabolizácie), warfarínu (CYP2C9), teofylínu (CYP1A2) alebo diazepamu (CYP3A4 a 2C19).
Olanzapín nevykazoval žiadnu interakciu so súbežne podávaným lítiom alebo biperidenom. Monitorovanie terapeutických plazmatických hladín valproátu neukázalo, že by pri zahájení prídavnej
medikácie olanzapínom bola požadovaná úprava dávkovania valproátu.
VšeobecnáCNSaktivita
Opatrnosť je potrebná u pacientov konzumujúcich alkohol alebo užívajúcich lieky, ktoré môžu spôsobiť depresiu centrálneho nervového systému.
Súbežné užívanie olanzapínu s antiparkinsonikami u pacientov s Parkinsonovou chorobou a demenciou sa neodporúča (pozri časť 4.4).
QTcinterval
Opatrnosť je potrebná, ak sa olanzapín podáva súbežne s liekmi, ktoré predlžujú QTc interval (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Gravidita
U gravidných žien sa nevykonali žiadne primerané a dobre kontrolované štúdie. Pacientky je potrebné poučiť o nutnosti informovania svojich lekárov vtedy, ak počas liečby olanzapínom otehotnejú alebo plánujú tehotenstvo. Avšak, vzhľadom na obmedzené skúsenosti u človeka sa má olanzapín podávať počas gravidity len vtedy, ak jeho potenciálny prínos pre matku prevýši možné riziko pre plod.
U novorodencov, ktorí boli vystavení počas tretieho trimestra gravidity antipsychotikám (vrátane olanzapínu), existuje riziko vzniku nežiaducich reakcií zahŕňajúcich extrapyramídové príznaky a/alebo príznaky z vysadenia lieku, ktoré sa môžu líšiť v závažnosti a trvaní. Boli hlásené agitácia, hypertónia, hypotónia, tremor, somnolencia, respiračná tieseň alebo ťažkosti pri kŕmení. Preto majú byť novorodenci starostlivo sledovaní.
Laktácia
V štúdii sa u zdravých dojčiacich žien olanzapín vylučoval do materského mlieka. Priemerná expozícia dieťaťa (mg/kg) v rovnovážnom stave bola odhadnutá na 1,8% z dávky olanzapínu podanej matke (mg/kg). Pacientky majú byť poučené o tom, že počas liečby olanzapínom nesmú dojčiť svoje dieťa.
Fertilita
Účinky na fertilitu nie sú známe (pozri časť 5.3 s predklinickými infomáciami).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Nakoľko olanzapín môže spôsobiť ospalosť a závraty, pacienti musia byť opatrní pri obsluhe strojov, vrátane vedenia motorových vozidiel.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Dospelí
Najčastejšie hlásené nežiaduce reakcie (pozorované u ≥ 1% pacientov) spojené s užívaním olanzapínu v klinických štúdiách boli ospalosť, nárast telesnej hmotnosti, eozinofília, zvýšenie hladiny prolaktínu, cholesterolu, glukózy a triglyceridov (pozri časť 4.4), glukozúria, zvýšená chuť do jedla, závrat, akatízia, parkinsonizmus, leukopénia a neutropénia (pozri časť 4.4), dyskinéza, ortostatická
hypotenzia, anticholinergné účinky, prechodné asymptomatické zvýšenie pečeňových aminotransferáz (pozri časť 4.4), vyrážka, asténia, únava, horúčka, artralgia, zvýšená hladina alkalickej fosfatázy, vysoká hladina gama glutamyltransferázy, vysoká hladina kyseliny močovej, vysoká hladina kreatín- fosfokinázy a edém.
Tabuľkanežiaducichreakcií
V nasledujúcej tabuľke sú uvedené nežiaduce reakcie a laboratórne vyšetrenia získané zo spontánnych hlásení a z klinických štúdií. V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti. Frekvencia je definovaná nasledovne: Veľmi časté (≥1/10), časté
(≥ 1/100 až < 1/10), menej časté (≥ 0.1/1 000 až < 1/100), zriedkavé (≥ 0.01/10 000 až < 0.1/1000), veľmi zriedkavé (< 0.01/10 000), neznáme (nemôžu byť stanovené z dostupných údajov).
Veľmi časté Časté Menej časté Zriedkavé Neznáme
Poruchy krvi a lymfatického systému
Eozinofília
Leukopénia10
Neutropénia10
Poruchy imunitného systému
Poruchy metabolizmu a výživy
Hypersenzitiv ita11
Trombocytopénia11
Zvýšenie telesnej hmotnosti1
Zvýšené hladiny cholesterolu2,3
Zvýšené hladiny glukózy 4
Zvýšené hladiny triglyceridov2,5
Glukozúria Zvýšená chuť do jedla
Vznik alebo exacerbácia diabetu príležitostne spojená s ketoacidózou alebo kómou, vrátane niekoľkých fatálnych prípadov (pozri časť 4.4) 11
Hypotermia12
 Poruchy nervového systému
Poruchy nervového systému
Ospalosť Závrat
Akatízia6
Parkinsonizmus6
Dyskinéza6
Záchvaty, pričom väčšinou bol hlásený ich
výskyt v anamnéze alebo rizikové faktory
Neuroleptický malígny syndróm (pozri časť
4.4)12
Symptóm y z vysadenia7,12
pre ich vznik11
Dystónia (vrátane kruhových pohybov očných gúľ) 11
Tardívna dyskinéza11
Amnézia9
Poruchy srdca a srdcovej činnosti
Poruchy ciev Ortostatická hypotenzia10
Dyzardia
Bradykardia Predĺženie QTc (pozri časť 4.4)
Tromboembólia (vrátane pľúcnej embólie a hlbokej žilovej trombózy) (pozri časť 4.4)
Ventrikulárna tachykardia/fibrilácia, náhle úmrtie (pozri časť 4.4) 11
Poruchy dýchacej sústavy, hrudníka a mediastína
Epistaxa9
Poruchy gastrointestinálneho traktu Mierne, prechodné anticholinergné účinky vrátane
zápchy a sucha v
ústach
Poruchy pečene a žlčových ciest Prechodné, asymptomatické zvýšenie pečeňových aminotransferáz (ALT, AST), hlavne na začiatku liečby (pozri časť 4.4)
Poruchy kože a podkožného tkaniva
Abdominálna distenzia9
Pankreatitída11
Hepatitída (vrátane hepatocelulárneho, cholestatického alebo zmiešaného poškodenia) 11
Vyrážka Fotosenzitívna reakcia Alopécia
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Artralgia9 Rabdomyolýza11
Poruchy obličiek a močových ciest
Reakcia na liek
s eozinofíliou
a systémovým i príznakmi (DRESS)
Inkontinencia moču,
retencia moču
Oneskorené močenie11
Stavy v gravidite, v šestonedelí a perinatálnom období
Poruchy reprodukčného systému a prsníkov
Abstinenčný syndróm novorodenca (pozri
časť 4.6)
Erektilná dysfunkcia u mužov
Znížené libido u mužov a žien
Amenorea Zväčšenie prsníkov Galaktorea u žien
Gynekomasti a/ zväčšenie prsníkov u mužov
Priapizmus12
Celkové poruchy a reakcie v mieste podania
Asténia Únava Edém Horúčka10
Laboratórne a funkčné vyšetrenia
Zvýšené hladiny prolaktínu8
Zvýšená hladina alkalickej fosfatázy10
Vysoká hladina kreatín-fosfokinázy11
Vysoká hladina gama glutamyltransferázy10
Vysoká hladina kyseliny močovej10
Zvýšený celkový bilirubín

1 Klinicky signifikantný nárast telesnej hmotnosti sa pozoroval vo všetkých kategóriách východiskovej hodnoty indexu telesnej hmotnosti (Body Mass Index - BMI). Po krátkodobej liečbe (medián trvania
47 dní) bol nárast telesnej hmotnosti ≥ 7% pôvodnej telesnej hmotnosti veľmi častý (22,2%), ≥ 15% častý (4,2%) a ≥ 25% menej častý (0,8%). Zvýšenie telesnej hmotnosti o ≥ 7%, ≥ 15% a ≥ 25% pôvodnej telesnej hmotnosti bolo veľmi časté (64,4%, 31,7% a 12,3%) u pacientov s dlhodobou
expozíciou (minimálne 48 týždňov).
2 Priemerné zvýšenia lipidových hodnôt nalačno (celkový cholesterol, LDL cholesterol a triglyceridy)
boli vyššie u pacientov bez predtým dokázanej lipidovej dysregulácie.
3 Pozorované pri normálnych hladinách nalačno na začiatku (< 5,17 mmol/l), ktoré sa zvýšili na hladinu vysokú (≥ 6,2 mmol/l). Zmeny celkového cholesterolu nalačno z východiskovej hraničnej hodnoty (≥ 5,17 - < 6,2 mmol/l) na hodnotu vysokú (≥ 6,2 mmol/l) boli veľmi časté.
4 Pozorované pri normálnych východiskových hladinách nalačno (< 5,56 mmol/l), ktoré sa zvýšili na hladinu vysokú (≥ 7 mmol/l). Zmeny glukózy nalačno z východiskovej hraničnej hodnoty (≥ 5,56 -
< 7 mmol/l) na hodnotu vysokú (≥ 7 mmol/l) boli veľmi časté.
5 Pozorované pri normálnych hladinách nalačno na začiatku (< 1,69 mmol/l), ktoré sa zvýšili na hladinu vysokú (≥ 2,26 mmol/l). Zmeny triglyceridov nalačno z východiskovej hraničnej hodnoty (≥ 1,69 mmol/l - < 2,26 mmol/l) na hodnotu vysokú (≥ 2,26 mmol/l) boli veľmi časté.
6
V klinických štúdiách bol výskyt parkinsonizmu a dystónie u pacientov liečených olanzapínom
početne vyšší, ale štatisticky sa signifikantne nelíšil od placeba. U pacientov užívajúcich olanzapín bola, v porovnaní s titrovanými dávkami haloperidolu, menšia incidencia parkinsonizmu, akatízie
a dystónie. Vzhľadom na nedostatok podrobných informácií o akútnych a neskorých extrapyramídových príznakoch v osobnej anamnéze, nie je možné v súčasnosti dôjsť k záveru, či olanzapín spôsobuje menej často tardívne dyskinézy a/alebo ďalšie neskoré extrapyramídové syndrómy.
7 Akútne symptómy, ako sú potenie, nespavosť, tremor, úzkosť, nauzea a vracanie, boli hlásené po náhlom skončení liečby olanzapínom.
8 V klinických štúdiách trvajúcich do 12 týždňov prekročili koncentrácie plazmatického prolaktínu hornú hranicu normálneho rozmedzia u približne 30% pacientov liečených olanzapínom s normálnou počiatočnou hladinou prolaktínu. U väčšiny týchto pacientov boli zvýšenia väčšinou mierne a ostali pod dvojnásobkom hornej hranice normálneho rozmedzia.
9 Nežiaduca príhoda, pozorovaná v klinických skúšaniach v Integrovanej olanzapínovej databáze.
10 Vyhodnotené na základe nameraných hodnôt z klinických skúšaní v Integrovanej olanzapínovej databáze.
11 Nežiaduca príhoda pozorovaná zo spontánnych post-marketingových hlásení, s frekvenciou určenou pomocou Integrovanej olanzapínovej databázy.
12 Nežiaduca príhoda pozorovaná zo spontánnych post-marketingových hlásení , s frekvenciou odhadnutou pri hornom limite 95 % intervalu spoľahlivosti pomocou Integrovanej olanzapínovej databázy.
Dlhodobáexpozícia(aspoň48týždňov)
Pomer pacientov, u ktorých sa vyskytli nežiaduce, klinicky signifikantné zmeny týkajúce sa hmotnostného prírastku, glukózy, celkového/LDL/HDL cholesterolu alebo triglyceridov sa časom zvýšil. U dospelých pacientov, ktorí absolvovali 9-12 mesačnú terapiu, sa rýchlosť zvýšenia priemernej hladiny krvnej glukózy spomalila približne po 6 mesiacoch.
Ďalšieinformácieozvláštnychpopuláciách
V klinických štúdiách u starších pacientov s demenciou bola pri liečbe olanzapínom v porovnaní
s placebom vyššia incidencia úmrtí a cerebrovaskulárnych nežiaducich reakcií (pozri tiež časť 4.4). Veľmi časté nežiaduce reakcie pri užívaní olanzapínu u tejto skupiny pacientov boli abnormálna chôdza a pády. Často boli pozorované pneumónia, zvýšená telesná teplota, letargia, erytém, zrakové halucinácie a inkontinencia moču.
V klinických štúdiách u pacientov s liekmi vyvolanou psychózou (dopamínovým agonistom) súvisiacou s Parkinsonovou chorobou, boli veľmi často a s vyššou frekvenciou ako u placeba zaznamenané zhoršenie parkinsonovskej symptomatiky a halucinácie.
V jednej klinickej štúdii u pacientov v manickej fáze bipolárnej poruchy bola pri liečbe valproátom v kombinácii s olanzapínom incidencia neutropénie 4,1%; potenciálne prispievajúcim faktorom by mohli byť vysoké plazmatické hladiny valproátu. Súbežné podanie olanzapínu s lítiom alebo valproátom viedlo ku zvýšeniu výskytu (³ 10%) tremoru, suchosti v ústach, zvýšenej chuti do jedla a k nárastu telesnej hmotnosti. Často boli zaznamenané aj poruchy reči. Počas liečby olanzapínom
v kombinácii s lítiom alebo divalproexom došlo v akútnej fáze liečby (do 6 týždňov) k nárastu telesnej hmotnosti o ³ 7% v porovnaní s počiatočnou hodnotou u 17,4% pacientov. Dlhodobá liečba olanzapínom (do 12 mesiacov) na prevenciu rekurencie u pacientov s bipolárnou poruchou bola spojená so zvýšením telesnej hmotnosti o ³ 7% v porovnaní s počiatočnou hodnotou u 39,9% pacientov.
Pediatrická
populácia
Olanzapín nie je indikovaný na liečbu detí a dospievajúcich pacientov do 18 rokov. Hoci sa neuskutočnili žiadne klinické štúdie porovnávajúce dospievajúcich pacientov s dospelými, údaje získané zo štúdií s dospievajúcimi pacientami boli porovnané s údajmi získanými zo štúdií
s dospelými pacientami.
V nasledujúcej tabuľke sú uvedené nežiaduce reakcie hlásené s vyššou frekvenciou
u dospievajúcich pacientov (vo veku 13 – 17 rokov) ako u dospelých pacientov alebo nežiaduce reakcie, ktoré boli zistené len počas krátkodobých klinických štúdií u dospievajúcich pacientov. Zdá sa, že klinicky významný prírastok na hmotnosti (≥ 7%) sa vyskytuje častejšie
u dospievajúcich v porovnaní s dospelými pri porovnateľných expozíciách. Výška hmotnostného prírastku a pomer adolescentných pacientov, u ktorých bol klinicky signifikantný hmotnostný prírastok, bol vyšší pri dlhodobej expozícii (aspoň 24 týždňov) ako pri krátkodobej expozícii.
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti. Frekvencia je definovaná nasledovne: Veľmi časté (³1/10), časté (≥ 1/100 až < 1/10).
Poruchy metabolizmu a výživyVeľmi časté: Hmotnostný prírastok13, zvýšená hladina triglyceridov14, zvýšená chuť do jedla.
Časté: Zvýšená hladina cholesterolu15
Poruchy nervového systémuVeľmi časté: Útlm (vrátane: hypersomnie, letargie, somnolencie).
Poruchy gastrointestinálneho traktu Časté:
Časté: Suchosť v ústach.
Poruchy pečene a žlčových ciestVeľmi časté: Zvýšenie pečeňových aminotransferáz (ALT/AST; pozri časť 4.4).
VyšetreniaVeľmi časté: Zníženie celkového bilirubínu, zvýšenie GMT, zvýšenie plazmatickej hladiny prolaktínu16.
13 Po krátkodobej liečbe (medián trvania 22 dní) sa nárast hmotnosti o ³ 7% v porovnaní s počiatočnou
telesnou hmotnosťou (kg) vyskytoval veľmi často (40,6%), o ³ 15% v porovnaní s počiatočnou telesnou hmotnosťou často (7,1%) a ≥ 25% často (2,5%). Pri dlhodobej expozícii (aspoň 24 týždňov)
89,4% pribralo ≥ 7%, 55,3% pribralo ≥ 15% a 29,1% pribralo ≥ 25% pôvodnej telesnej hmotnosti.
14 Pozorované pri normálnych počiatočných hladinách nalačno (< 1,016 mmol/l), ktoré sa zvýšili na
≥ 1,467 mmol/l a zmeny triglyceridov nalačno z hraničnej počiatočnej hodnoty (≥ 1,016 mmol/l -
< 1,467 mmol/l) na ≥ 1,467 mmol/l.
15 Zmeny hladín celkového cholesterolu nalačno z normálnej počiatočnej hodnoty (< 4,39 mmol/l) na
≥ 5,17 mmol/l sa vyskytovali často. Zmeny hladín celkového cholesterolu nalačno z hraničnej počiatočnej hodnoty (≥ 4,39 - < 5,17 mmol/l) na ≥ 5,17 mmol/l sa vyskytovali veľmi často.
16 Zvýšenie plazmatickej hladiny prolaktínu bolo hlásené u 47,4% dospievajúcich pacientov.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieObjektívneasubjektívnepríznakyMedzi veľmi časté príznaky (výskyt > 10%) príznaky predávkovania patrí tachykardia, agitácia/agresivita, dyzartria, rôzne extrapyramídové príznaky a nižší stupeň vedomia od útlmu až po kómu.
K ďalším zdravotne významným dôsledkom predávkovania patria delírium, kŕče, kóma, možný neuroleptický malígny syndróm, útlm dýchania, aspirácia, hypertenzia alebo hypotenzia, srdcová arytmia (< 2% prípadov predávkovania) a zástava dýchania a činnosti srdca. Smrteľné prípady sa vyskytli už po akútnom predávkovaní dávkou 450 mg, ale takisto bolo popísané prežitie po akútnom predávkovaní dávkou približne 2 g perorálneho olanzapínu.
Liečba
Pre olanzapín neexistuje žiadne špecifické antidotum. Neodporúča sa vyvolávanie vracania. Môžu byť indikované štandardné postupy používané pri liečbe predávkovania (tj. výplach žalúdka, podanie aktívneho uhlia). Ukázalo sa, že súbežné podanie aktívneho uhlia znižuje biologickú dostupnosť olanzapínu po perorálnom podaní o 50-60%.
Podľa klinického stavu sa má zahájiť symptomatická liečba a monitorovanie vitálnych funkcií, vrátane liečby hypotenzie, cirkulačného šoku a podpory respiračných funkcií. Nepoužívajte adrenalín,
dopamín či iné sympatomimetiká s agonistickou aktivitou na b-receptoroch, keďže beta stimulácia môže viesť ku zhoršeniu hypotenzie. Monitorovanie kardiovaskulárnych parametrov je nevyhnutné kvôli diagnostike možných porúch srdcového rytmu. Pacient má byť až do zotavenia pod stálou lekárskou kontrolou a majú byť sledované aj jeho vitálne funkcie.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: psycholeptiká, diazepíny, oxazepíny, tiazepíny a oxepíny, ATC kód: N05A H03.
Farmakodinamycké účinky
Olanzapín je antipsychotická, antimanická a náladu stabilizujúca látka, ktorá vykazuje široký profil farmakologických účinkov na viaceré receptorové systémy.
V predklinických štúdiách preukázal olanzapín afinitu k radu receptorov (Ki; < 100 nM) - k serotonínovým 5HT2A/2C, 5HT3, 5HT6; dopamínovým D1, D2, D3, D4, D5; cholinergným muskarínovým M1-M5; a1-adrenergným; a histamínovým H1 receptorom. Behaviorálne štúdie na zvieratách preukázali antagonistické pôsobenie olanzapínu na 5HT, dopamínové a cholínergné receptory, čo je v súlade s väzbovým profilom látky. Olanzapín vykazoval in vitro väčšiu afinitu
k serotonínovým 5HT2 receptorom než k dopamínovým D2 a vyššiu 5HT2 ako D2 aktivitu na in vivo modeloch. Elektrofyziologické štúdie ukázali, že olanzapín selektívne znižuje aktivitu mezolimbických (A10) dopaminergných neurónov bez výraznejšej interakcie so striatálnymi (A9) dráhami ovládajúcimi motoriku. Olanzapín znižoval podmienenú reakciu úniku, čo je test na zistenie antipsychotického účinku, v dávkach, ktoré ešte nevyvolávajú katalepsiu, účinok naznačujúci motorické vedľajšie účinky. Na rozdiel od niektorých iných antipsychotík, olanzapín zvyšuje reaktivitu v „anxiolytickom“ teste.
V štúdii s jednorazovou perorálnou dávkou (10 mg) a sledovaním pomocou pozitrónovej emisnej tomografie (PET) u zdravých dobrovoľníkov obsadzoval olanzapín viac 5HT2A receptory ako dopamínové D2 receptory. Navyše, v zobrazovacej štúdii Single Photon Emission Computed Tomography (SPECT) bola miera obsadzovania D2 receptorov u schizofrenických pacientov odpovedajúcich na olanzapín nižšia ako u pacientov odpovedajúcich na iné antipsychotiká a pacientov odpovedajúcich na risperidón, zatiaľ čo u pacientov odpovedajúcich na klozapín bola porovnateľná.
Klinická účinnosť
V dvoch z dvoch placebo kontrolovaných a dvoch z troch porovnávacích kontrolovaných štúdií s viac ako 2 900 schizofrenickými pacientami s pozitívnymi i negatívnymi symptómami vykazoval olanzapín štatisticky významne väčšie zlepšenie ako u negatívnych, tak aj u pozitívnych symptómov.
V medzinárodnej, dvojito zaslepenej, porovnávacej štúdii zahŕňajúcej 1 481 pacientov so schizofréniou, schizoafektívnymi a príbuznými poruchami a s rôznymi stupňami pridružených
depresívnych symptómov (priemerné východiskové skóre 16,6 škály MADRS /the Montgomery- Asberg Depression Rating Scale/) preukázala prospektívna sekundárna analýza zmenu skóre od východiskovej po konečnú hodnotu štatisticky významné zlepšenie (p=0,001) v prospech olanzapínu (-6,0) oproti haloperidolu (-3,1).
U pacientov s manickou alebo zmiešanou epizódou bipolárnej poruchy preukázal olanzapín v znížení manických symptómov za 3 týždne vyššiu účinnosť ako placebo a valproát semisodium (divalproex). Olanzapín taktiež preukázal porovnateľnú účinnosť s haloperidolom v zmysle podielu pacientov
v symptomatickej remisii mánie a depresie po 6 a 12 týždňoch. V štúdii kombinovanej terapie
u pacientov liečených lítiom alebo valproátom po dobu minimálne 2 týždne viedlo pridanie olanzapínu v dávke 10 mg (v kombinácii s lítiom alebo valproátom) ku väčšej redukcii symptómov mánie ako tomu bolo pri liečbe lítiom alebo valproátom v rámci monoterapie za 6 týždňov.
V 12-mesačnej štúdii prevencie rekurencie u pacientov s manickou epizódou, ktorí dosiahli remisiu pri liečbe olanzapínom a boli potom randomizovaní na užívanie olanzapínu alebo placeba, preukázal olanzapín voči placebu v primárnom koncovom bode rekurencie bipolárnej poruchy štatisticky významnú nadradenosť. Olanzapín taktiež vykázal v porovnaní s placebom štatisticky významnú výhodu buď z hľadiska prevencie rekurencie mánie alebo prevencie rekurencie depresie.
V druhej 12-mesačnej štúdii prevencie rekurencie u pacientov s manickou epizódou, ktorí dosiahli remisiu pri liečbe kombináciou olanzapínu a lítia a boli potom randomizovaní na užívanie samotného olanzapínu alebo lítia, nebol olanzapín v primárnom parametre rekurencie bipolárnej poruchy štatisticky podradený voči lítiu (olanzapín 30,0%, lítium 38,3%; p = 0,055).
V 18-mesačnej štúdii s kombinovanou liečbou u pacientov s manickou alebo zmiešanou epizódou, ktorí boli stabilizovaní pri liečbe olanzapínom spolu so stabilizátorom nálady (lítium alebo valproát), nebola dlhodobá kombinovaná liečba olanzapínom spolu s lítiom alebo valproátom štatisticky významne superiorná voči liečbe samotným lítiom alebo valproátom v predĺžení doby do rekurencie bipolárnej poruchy definovanej podľa syndrómových (diagnostických) kritérií.
Pediatrickápopulácia
Skúsenosti s dospievajúcimi (vo veku 13 až 17 rokov) sú obmedzené na údaje o krátkodobej účinnosti v prípade schizofrénie (6 týždňov) a mánie v súvislosti s bipolárnou poruchou I (3 týždne), ktoré zahŕňali menej ako 200 dospievajúcich. Olanzapín sa podával vo flexibilnej dávke od 2,5 mg až do
20 mg denne. Počas liečby olanzapínom sa zvýšila hmotnosť u dospievajúcich podstatne viac ako u dospelých. Rozsah zmien celkového cholesterolu nalačno, LDL cholesterolu, triglyceridov
a prolaktínu (pozri časti 4.4 a 4.8) bol väčší u dospievajúcich ako u dospelých. Nie sú k dispozícii údaje o pretrvávaní účinku a údaje o dlhodobej bezpečnosti sú obmedzené (pozri časti 4.4 a 4.8).
5.2 Farmakokinetické vlastnosti
Absorpcia
Orodispergovateľná tableta olanzapínu je bioekvivalentná filmom obalenej tablete olanzapínu,
s podobnou rýchlosťou a rozsahom vstrebávania. Orodispergovateľné tablety olanzapínu je možné užívať ako náhradu filmom obalených tabliet olanzapínu.
Distribúcia
V koncentračnom rozmedzí 7 až asi 1 000 ng/ml je väzba olanzapínu na plazmatické bielkoviny približne 93%. Olanzapín sa v plazme viaže na albumín a α1-kyslý glykoproteín.
Biotransformácia
Olanzapín sa po perorálnom podaní dobre vstrebáva a dosahuje maximálne koncentrácie v plazme
za 5 až 8 hodín. Vstrebávanie nie je ovplyvnené jedlom. Absolútna perorálna biologická dostupnosť vo vzťahu k intravenóznemu podaniu nebola stanovená.
Olanzapín sa metabolizuje v pečeni konjugáciou a oxidáciou. Hlavným metabolitom v obehu je 10-N- glukuronid, ktorý neprestupuje hematoencefalickou bariérou. Cytochrómy P450-CYP1A2 a P450- CYP2D6 prispievajú k tvorbe metabolitov N-desmetylu a 2-hydroxymetylu, vykazujúcich in vivo
významne nižšiu farmakologickú aktivitu ako olanzapín v štúdiách na zvieratách. Prevažná časť famakologickej aktivity je spôsobená pôvodným olanzapínom.
Eliminácia
Po perorálnom podaní, priemerný terminálny polčas vylučovania olanzapínu sa u zdravých jedincov líšil podľa veku a pohlavia.
U zdravých starších jedincov (nad 65 rokov) sa v porovnaní s mladšími jedincami priemerný polčas vylučovania predĺžil (51,8 oproti 33,8 hod) a klírens sa znížil (17,5 oproti 18,2 l/hod). Farmakokinetické odchýlky pozorované u starších jedincov sú v medziach odchýlok mladších jedincov. U 44 schizofrenických pacientov starších ako 65 rokov sa pri dávkach 5-20 mg/deň nepozoroval zvýšený výskyt nežiaducich účinkov.
Priemerný polčas vylučovania u žien sa oproti mužom predĺžil (36,7 oproti 32,3 hod) a klírens sa znížil (18,9 oproti 27,3 l/hod). Napriek tomu vykazuje olanzapín (5-20 mg) porovnateľný bezpečnostný profil tak u žien (n=467) ako aj u mužov (n=869).
Poškodenie obličiek
U pacientov s poškodením funkcie obličiek (klírens kreatinínu < 10 ml/min) v porovnaní so zdravými jedincami nespôsobovala významný rozdiel priemerného polčasu eliminácie (37,7 oproti32,4 hod) alebo klírensu (21,2 oproti 25,0 l/hod). Štúdia rovnováhy ukázala, že približne 57% olanzapínu označeného rádioaktívnym izotopom sa vylučuje do moča vo forme metabolitov.
Fajčiari
U fajčiarov s miernym poškodením pečene, v porovnaní so zdravými nefajčiarmi, sa priemerný polčas vylučovania (39,3 hod) predĺžil a klírens (18,0 l/hod) sa znížil (48,8 hod resp. 14,1 l/hod).
U nefajčiarov oproti fajčiarom (ženy i muži) sa priemerný polčas vylučovania predĺžil (38,6 oproti
30,4 hod) a klírens znížil (18,6 oproti 27,7 l/hod).
Plazmatický klírens olanzapínu je nižší u starších ako u mladších jedincov, u žien ako u mužov
a u nefajčiarov oproti fajčiarom. Avšak závažnosť vplyvu veku, pohlavia alebo fajčenia na klírens
a polčas vylučovania olanzapínu sú malé v porovnaní s celkovou variabilitou medzi jednotlivcami.
V klinickej štúdii neboli žiadne rozdiely farmakokinetických parametrov medzi belochmi, Japoncami a Číňanmi.
Pediatrickápopulácia
Dospievajúci (vek 13 až 17 rokov): Farmakokinetika olanzapínu je podobná u dospievajúcich a dospelých. V klinických štúdiách bola priemerná expozícia olanzapínu približne o 27% vyššia
u dospievajúcich. Demografické rozdiely medzi dospievajúcimi a dospelými zahŕňali nižšiu priemernú telesnú hmotnosť a menší počet fajčiarov medzi dospievajúcimi. Tieto faktory možno prispeli k vyššej priemernej expozícii pozorovanej u dospievajúcich.
5.3 Predklinické údaje o bezpečnosti
Akútnatoxicita(pojednorazovompodaní)
Príznaky toxicity po perorálnom podaní hlodavcom obsahovali silnú neuroleptickú zložku: hypoaktivitu, kómu, tras, klonické kŕče, slinenie a pokles telesnej hmotnosti. Stredná letálna dávka u myší bola 210 mg/kg a u krýs 175 mg/kg. Psi tolerovali jednorazovú dávku až do100 mg/kg
s nulovou mortalitou. Medzi klinické príznaky patril útlm, ataxia, tras, zrýchlený pulz, sťažené dýchanie, mióza a anorexia. U opíc vyvolala jednorazová perorálna dávka do 100 mg/kg vyčerpanosť a vyššie dávky čiastočné bezvedomie.
Toxicitapoopakovanompodaní
Medzi hlavné prejavy toxicity pozorované v 3-mesačnej štúdii u myší a 1-ročnej štúdii u potkanov a psov patril útlm CNS, anticholínergné účinky a ochorenia periférnej krvi.
Na útlm CNS sa vyvinula tolerancia. Pri vysokých dávkach poklesli parametre rastu. Reverzibilné účinky spojené so zvýšenou hladinou prolaktínu u krýs zahŕňali pokles hmotnosti ovárií a uteru
a morfologické zmeny vaginálneho epitelu a prsných žliaz.
Hematologickátoxicita
U všetkých druhov boli pozorované účinky na hematologické ukazovatele, vrátane na dávke závislom poklese počtu leukocytov v krvi u myší a nešpecifickom poklese leukocytov v krvi u krýs; cytotoxický účinok na kostnú dreň sa však nedokázal. U niekoľkých psov, ktorým sa podávalo 8 alebo
10 mg/kg/deň (celková expozícia olanzapínu [AUC] je 12- až 15-krát vyššia než pri podaní dávky
12 mg človeku), sa vyvinula reverzibilná neutropénia, trombocytopénia alebo anémia. U psov
s cytopéniou sa nepozorovali žiadne nepriaznivé účinky na progenitorové a proliferujúce bunky kostnej drene.
Reprodukčnátoxicita
Olanzapín nemá žiadny teratogénne účinky. U samcov potkanov sa pozoroval pokles libida ako dôsledok sedácie. Estrálne cykly boli ovplyvnené dávkou 1,1 mg/kg (čo je 3-násobok maximálnej dávky u človeka) a reprodukčné parametre boli u potkanov ovplyvnené dávkou 3 mg/kg (čo je
9-násobok maximálnej dávky u človeka). U potomstva potkanov, ktorým sa podával olanzapín, sa pozorovalo oneskorenie fetálneho vývoja a prechodný pokles aktivity.
Mutagenita
Olanzapín nemal mutanogénne ani klastogénne účinky v žiadnom zo štandardných testov, vrátane testov bakteriálnych mutácií in vivo a in vitro testov na cicavcoch.
Karcinogenita
Na základe výsledkov štúdií na myšiach a potkanoch sa zistilo, že olanzapín nie je karcinogénny.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
manitol (E421) aspartám (E951) magnéziumstearát krospovidón typ B monohydrát laktózy hydroxypropylcelulóza
Citrón [aromatický prípravok (y), maltodextrín, sacharóza, arabská guma (E414), triacetát glycerolu
(E1518) a alfa-tokoferol (E307)]
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
Hliníkové blistre z OPA/hliníka/PVC v škatuliach obsahujúcich 28, 30, 35, 50, 56, 70 a 98
orodispergovateľných tabliet v jednej škatuli.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIITeva B.V., Swensweg 5, 2031GA Haarlem, Holandsko
8. REGISTRAČNÉ ČÍSLOEU/1/07/427/031 – Olanzapin Teva – 15 mg – orodispergovateľné tablety – 28 tabliet v škatuli. EU/1/07/427/032 – Olanzapin Teva – 15 mg – orodispergovateľné tablety – 30 tabliet v škatuli. EU/1/07/427/046 – Olanzapin Teva – 15 mg – orodispergovateľné tablety – 35 tabliet v škatuli. EU/1/07/427/033 – Olanzapin Teva – 15 mg – orodispergovateľné tablety – 50 tabliet v škatuli. EU/1/07/427/034 – Olanzapin Teva – 15 mg – orodispergovateľné tablety – 56 tabliet v škatuli. EU/1/07/427/056 – Olanzapin Teva – 15 mg – orodispergovateľné tablety – 70 tabliet v škatuli. EU/1/07/427/066 – Olanzapin Teva – 15 mg – orodispergovateľné tablety – 98 tabliet v škatuli.
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12/12/2007
Dátum prvého predĺženia registrácie: 12/12/2012
10. DÁTUM REVÍZIE TEXTU{MM/RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry
(EMA)
http://www.ema.europa.eu/.
1
. NÁZOV LIEKU
Olanzapin Teva 20 mg orodispergovateľné tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Každá 20 mg orodispergovateľná tableta obsahuje 20 mg olanzapínu. Pomocné látky so známym účinkom:
Každá orodispergovateľná tableta obsahuje 190,0 mg laktózy (vo forme monohydrátu), 1,05 mg
sacharózy a 9,0 mg aspartámu (E951).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Orodispergovateľná tableta
Žltá, okrúhla, bikonvexná tableta, s priemerom 12 mm..
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Dospelí
Olanzapín je indikovaný na liečbu schizofrénie.
Olanzapín je účinný pri udržaní klinického zlepšenia počas pokračujúcej terapie u pacientov, ktorí na začiatku liečby odpovedali zlepšením.
Olanzapín je indikovaný na liečbu stredne ťažkých až ťažkých manických epizód.
Olanzapín je indikovaný na prevenciu rekurencie u pacientov s bipolárnou poruchou, u ktorých liečba manickej epizódy olanzapínom bola účinná (pozri časť 5.1).
4.2 Dávkovanie a spôsob podávania
Dospelí
Schizofrénia: Odporúčaná počiatočná dávka olanzapínu je 10 mg/deň.
Manická epizóda: Počiatočná dávka je 15 mg v jednej dávke denne v monoterapii alebo 10 mg denne pri kombinovanej terapii (pozri časť 5.1).
Prevencia rekurencie bipolárnej poruchy: Odporúčaná počiatočná dávka je 10 mg/deň. U pacientov, ktorí boli v manickej epizóde liečení olanzapínom, pokračujte pre prevenciu rekurencie v terapii rovnakou dávkou. Pokiaľ sa objaví nová manická, zmiešaná alebo depresívna epizóda, liečba olanzapínom má pokračovať (s optimalizáciou dávky podľa potreby) s prídavnou terapiou príznakov poruchy nálady podľa klinickej indikácie.
V priebehu liečby schizofrénie, manických epizód a prevencie rekurencie bipolárnej poruchy môže byť denné dávkovanie následne prispôsobované na základe individuálneho klinického stavu
v rozmedzí 5-20 mg/deň. Zvýšenie na vyššiu ako odporúčanú počiatočnú dávku sa odporúča len po patričnom opätovnom klinickom zhodnotení a nemá sa spravidla objaviť v intervaloch kratších ako
24 hodín. Olanzapín môže byť podávaný bez ohľadu na jedlo, pretože absorpcia nie je ovplyvňovaná potravou. Pri vysadzovaní olanzapínu sa má zvážiť postupné znižovanie dávky.
Olanzapin Teva orodispergovateľná tableta sa má vložiť do úst, kde sa rýchlo rozpustí v slinách, takže
sa dá ľahko prehltnúť. Vybrať túto orodispergovateľnú tabletu z úst bez porušenia je obtiažne. Keďže orodispergovateľná tableta je krehká, má sa užiť bezprostredne po otvorení blistra. Prípadne sa môže bezprostredne pred podaním rozpustiť v plnom pohári vody alebo iného vhodného nápoja (pomarančová šťava, jablková šťava, mlieko alebo káva).
Orodispergovateľná tableta olanzapínu je bioekvivalentná obalenej tablete olanzapínu, s podobnou rýchlosťou a rozsahom vstrebávania. Dávkovanie a frekvencia podávania sú rovnaké ako u obalenej tablety olanzapínu. Orodispergovateľné tablety olanzapínu je možné užívať ako náhradu obalených tabliet olanzapínu.
Osobitné skupiny
Starší pacienti
Podanie nižšej počiatočnej dávky (5 mg/deň) nie je zvyčajne indikované, avšak malo by sa zvážiť u pacientov vo veku 65 rokov a viac, ak to ich klinický stav vyžaduje (pozri časť 4.4).
Pacienti s poškodením funkcie obličiek a/alebo pečene
U týchto pacientov je vhodné zvážiť nižšiu počiatočnú dávku (5 mg). V prípade mierneho poškodenia pečene (cirhóza, Child-Pugh trieda A alebo B) má byť počiatočná dávka 5 mg a zvyšovať sa má len so
zvýšenou opatrnosťou.
Fajčiari
Nefajčiarom, v porovnaní s fajčiarmi, nie je zvyčajne potrebné upravovať počiatočnú dávku
a dávkovacie rozpätie. Metabolizmus olanzapínu sa môže fajčením indukovať. Odporúča sa ho klinicky sledovať a ak je to potrebné, zvážiť zvýšenie dávky olanzapínu. (pozri časť 4.5)
Pri prítomnosti viac ako jedného faktora, ktorý môže spomaľovať metabolizmus (ženské pohlavie, vyšší vek, nefajčiar) sa má zvážiť zníženie počiatočnej dávky. Zvyšovanie dávky u týchto osôb, ak je indikované, má byť opatrné.
V prípadoch, v ktorých sa považuje za nevyhnutné zvýšenie dávky o 2,5 mg, sa majú použiť filmom obalené tablety Olanzapin Teva.
(Pozri časti 4.5 a 5.2).
Pediatrická populácia
Olanzapín sa neodporúča používať u detí a dospievajúcich vo veku do 18 rokov kvôli nedostatočným údajom o bezpečnosti a účinnosti. Vyšší stupeň prírastku na hmotnosti, zmien lipidov a prolaktínu boli hlásené v krátkodobých štúdiách u dospievajúcich pacientov v porovnaní so štúdiami s dospelými pacientmi (pozri časti 4.4, 4.8, 5.1 a 5.2).
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Pacienti so známym rizikom glaukómu s úzkym uhlom.
4.4 Osobitné upozornenia a opatrenia pri používaní
Počas antipsychotickej liečby môže trvať niekoľko dní až týždňov, kým dôjde k zlepšeniu klinického stavu pacienta. V tomto období musia byť pacienti podrobení starostlivej kontrole.'
Psychózasúvisiacasdemencioua/aleboporuchysprávania
Olanzapín sa neodporúča používať u pacientov s psychózou a/alebo s poruchami správania súvisiacimi s demenciou z dôvodu zvýšenej mortality a rizika cerebrovaskulárnych príhod. V placebom kontrolovaných klinických štúdiách (trvanie 6-12 týždňov) u starších pacientov (priemerný vek 78 rokov) s psychózou súvisiacou s demenciou a/alebo poruchami správania bola u pacientov liečených olanzapínom 2-násobná incidencia úmrtia v porovnaní s pacientami užívajúcimi placebo (3,5% vs.
1,5%). Vyššia incidencia úmrtia nesúvisela s dávkou olanzapínu (priemerná denná dávka 4,4 mg)
alebo s dĺžkou liečby. Rizikové faktory, ktoré sa môžu podieľať na zvýšenej mortalite u tejto skupiny
pacientov, sú vek nad 65 rokov, dysfágia, sedácia, malnutrícia a dehydratácia, pľúcne ochorenia (napr. pneumónia s alebo bez aspirácie) alebo súčasné užívanie benzodiazepínov. Vyššia incidencia úmrtia u pacientov liečených olanzapínom v porovnaní s pacientami užívajúcimi placebo bola však od týchto rizikových faktorov nezávislá.
V rovnakých klinických štúdiách boli hlásené cerebrovaskulárne nežiaduce príhody (CVAE napr. mozgová porážka, tranzitórny ischemický atak), vrátane úmrtí. U pacientov liečených olanzapínom bol v porovnaní s pacientami užívajúcimi placebo 3-násobný nárast CVAE (1,3% vs. 0,4%).
U všetkých pacientov liečených olanzapínom alebo placebom, u ktorých sa vyskytla cerebrovaskulárna príhoda, boli už predtým prítomné rizikové faktory. Vek > 75 rokov
a vaskulárna/zmiešaná demencia boli zistené ako rizikové faktory pre CVAE v súvislosti s liečbou olanzapínom. Účinnosť olanzapínu v týchto štúdiách nebola stanovená.
Parkinsonovachoroba
Neodporúča sa použitie olanzapínu na liečbu psychózy súvisiacej s podávaním dopamínového agonistu u pacientov s Parkinsonovou chorobou. V klinických štúdiách boli veľmi často a s vyššou frekvenciou ako u placeba zaznamenané zhoršenie parkinsonovskej symptomatiky a halucinácie (pozri časť 4.8), pričom olanzapín nebol v liečení psychotických príznakov účinnejší ako placebo. V týchto štúdiách museli mať pacienti na začiatku štúdie stabilnú najnižšiu účinnú dávku antiparkinsonika (dopamínový agonista) a rovnaké antiparkinsonikum im bolo podávané v rovnakej dávke po celú zostávajúcu dobu štúdie. Počiatočná dávka olanzapínu bola 2,5 mg/deň a podľa uváženia
vyšetrujúceho lekára bola titrovaná do maximálnej dávky 15 mg/deň.
Neuroleptickýmalígnysyndróm(NMS)
NMS je potenciálne život ohrozujúci stav, ktorý sa objavil v súvislosti s podávaním antipsychotík. Zriedkavé prípady označené ako NMS sa rovnako vyskytli v súvislosti s olanzapínom. Klinické prejavy NMS sú hyperpyrexia, svalová rigidita, zmenený duševný stav a príznaky autonómnej instability (nepravidelný pulz alebo tlak krvi, tachykardia, potenie a srdcová dysrytmia). Ďalšími príznakmi môžu byť zvýšená hladina kreatínfosfokinázy, myoglobinúria (rabdomyolýza) a akútne
renálne zlyhanie. Ak sa u pacienta vyvinú znaky a príznaky, ktoré naznačujú prítomnosť NMS, alebo
ak má vysokú horúčku nevysvetleného pôvodu bez ďalších klinických známok NMS, musia sa vysadiť všetky antipsychotiká vrátane olanzapínu.
Hyperglykémiaadiabetes
Menej často bola hlásená hyperglykémia a/alebo exacerbácia preexistujúceho diabetu, príležitostne spojená s ketoacidózou alebo kómou, v niekoľkých prípadoch vedúcou aj k úmrtiam pacientov(pozri časť 4.8). V niektorých prípadoch tomu predchádzalo zvýšenie telesnej hmotnosti, čo mohlo byť predispozičným faktorom. Odporúča sa príslušné klinické monitorovanie s využitím zavedených smerníc pre antipsychotickú liečbu, napr. meranie hladiny glukózy v krvi na začiatku liečby, 12 týždňov po začatí liečby olanzapínom a následne v ročných intervaloch. U pacientov liečených akýmkoľvek antipsychotikom vrátane olanzapínu majú byť sledované príznaky a symptómy hyperglykémie (akými sú napríklad polydipsia, polyúria, polyfágia a slabosť) a pacienti s diabetom a pacienti s rizikovými faktormi pre vývoj diabetu majú byť pravidelne sledovaní kvôli možnému zhoršovaniu sa glukózovej regulácie. Hmotnosť sa má sledovať pravidelne, napr. na začiatku, po 4, 8 a
12 týždňoch liečby olanzapínom a následne každého štvrť roka.
Zmenylipidov
Nežiaduce zmeny lipidov sa pozorovali u pacientov liečených olanzapínom v placebom kontrolovaných klinických štúdiách (pozri časť 4.8). Zmeny lipidov sa majú liečiť tak, ako je to klinicky vhodné, najmä u pacientov s dyslipidémiou a u pacientov s rizikovými faktormi pre vývoj porúch lipidového spektra. U pacientov liečených akýmkoľvek antipsychotikom vrátane olanzapínu majú byť pravidelne sledované lipidy s využitím zavedených smerníc pre antipsychotickú liečbu, napr. na začiatku, po 12 týždňoch liečby olanzapínom a následne každých 5 rokov.
Anticholinergnýúčinok
Aj keď olanzapín in vitro prejavil anticholinergný účinok, skúsenosti z klinických štúdií odhalili nízky výskyt s tým súvisiacich príhod. Keďže sú však klinické skúsenosti s podávaním olanzapínu
pacientom s inými súbežnými ochoreniami obmedzené, pri predpisovaní pacientom s hypertrofiou prostaty alebo paralytickým ileom a podobnými stavmi sa odporúča postupovať opatrne.
Funkcia
pečene
Často, najmä na začiatku liečby, bolo pozorované prechodné asymptomatické zvýšenie hladiny pečeňových aminotransferáz, alanín transferáz (ALT) a aspartát transferáz (AST). Zvýšená opatrnosť a ďalšie sledovanie je potrebné u pacientov so zvýšenými hodnotami ALT a/alebo AST, u pacientov so znakmi a príznakmi poškodenia pečene, u pacientov s preexistujúcimi stavmi spojenými
s obmedzenou funkčnou rezervou pečene a u pacientov liečených potenciálne hepatotoxickými liekmi. Ak sa u pacientov diagnostikuje hepatitída (vrátane hepatocelulárneho, cholestatického alebo
zmiešaného poškodenia pečene), má sa liečba olanzapínom ukončiť.
Neutropénia
Opatrnosť je potrebná u pacientov so zníženým počtom leukocytov a/alebo neutrofilov z akéhokoľvek dôvodu, u pacientov užívajúcich lieky, o ktorých je známe, že spôsobujú neutropéniu, u pacientov
s anamnézou liekmi navodeného útlmu/toxicity kostnej drene alebo útlmom kostnej drene spôsobeným súbežným ochorením, radiačnou terapiou alebo chemoterapiou, u pacientov
s hypereozinofíliou alebo s myeloproliferatívnou chorobou. Neutropénia bola často hlásená pri súbežnom užívaní olanzapínu a valproátu (pozri časť 4.8).
Ukončenieliečby
Pri náhlom ukončení liečby olanzapínom boli zriedkavo (≥ 0,01 % a < 0,1 %) hlásené akútne príznaky ako potenie, nespavosť, tras, úzkosť, nevoľnosť alebo vracanie.
QTinterval
V klinických štúdiách bolo u pacientov liečených olanzapínom klinicky významné predĺženie QTc intervalu (korekcia QT podľa Fridericii [QTcF] ≥500 milisekúnd [msec] kedykoľvek po vstupnom vyšetrení u pacientov so vstupnou hodnotou QTcF<500 msec) menej časté (0,1% až 1%), bez signifikantných rozdielov v sprievodných kardiálnych príhodách v porovnaní s placebom. Je však potrebná opatrnosť, ak sa olanzapín predpisuje s liekom predlžujúcim QTc interval, najmä u starších pacientov, u pacientov s vrodeným syndrómom predĺženého QT, s kongestívnou srdcovou nedostatočnosťou, hypertrofiou srdca, hypokaliémiou alebo hypomagneziémiou.
Tromboembólia
Časová súvislosť liečby olanzapínom a venóznej tromboembólie (VTE) bola hlásená menej často (≥
0,1 % a < 1 %). Príčinná súvislosť medzi výskytom venóznej tromboembólie a liečbou olanzapínom nebola stanovená. Napriek tomu, keďže sú u pacientov so schizofréniou často prítomné získané rizikové faktory venóznej tromboembólie, je nutné brať do úvahy všetky možné rizikové faktory VTE, napr. imobilizácia pacientov, a vykonať preventívne opatrenia.
CelkovýúčinoknaCNS
Vzhľadom na primárny účinok olanzapínu na CNS je potrebná opatrnosť pri súbežnom užívaní s inými centrálne pôsobiacimi liekmi či alkoholom. Pretože pôsobí in vitro ako dopamínový antagonista, môže olanzapín antagonizovať účinky priamych a nepriamych agonistov dopamínu.
Záchvaty
Olanzapín sa má používať opatrne u pacientov so záchvatmi v anamnéze alebo u tých, ktorí sú vystavení faktorom, ktoré môžu znižovať prah pre záchvaty. U pacientov liečených olanzapínom boli záchvaty hlásené menej často. Vo väčšine týchto prípadov boli v anamnéze prítomné záchvaty alebo iné rizikové faktory.
Tardívnadyskinéza
V ročných alebo kratších porovnávacích štúdiách bol olanzapín štatisticky významne menej často spojený so vznikom dyskinézy vyvolanej liečbou. Napriek tomu riziko tardívnej dyskinézy pri dlhodobom užívaní narastá, a preto, ak sa u pacienta, ktorý je liečený olanzapínom, objavia znaky alebo príznaky tardívnej dyskinézy, sa má zvážiť zníženie dávky alebo vysadenie liečby. Tieto prejavy sa môžu prechodne zhoršiť alebo aj objaviť po prerušení liečby.
Posturálnahypotenzia
V klinických štúdiách olanzapínu sa zriedka u starších pacientov pozorovala posturálna hypotenzia. U pacientov starších ako 65 rokov sa odporúča pravidelne merať krvný tlak.
Náhla
srdcová
smrť
V postmarketingovom sledovaní olanzapínu boli nahlásené prípady náhlej srdcovej smrti u pacientov liečených olanzapínom. V retrospektívnej observačnej kohortnej štúdii bolo riziko predpokladanej náhlej srdcovej smrti u pacientov liečených olanzapínom približne dvojnásobné oproti pacientom,
ktorí neužívali antipsychotiká. V danej štúdii bolo riziko pri použití olanzapínu porovnateľné s rizikom použitia atypických antipsychotík spojených do jednej analýzy.
PediatrickápopuláciaOlanzapín nie je indikovaný na liečbu detí a dospievajúcich. Štúdie s pacientami vo veku 13-17 rokov preukázali rozličné nežiaduce reakcie, vrátane zvýšenia telesnej hmotnosti, zmien metabolických parametrov a zvýšenia hladín prolaktínu (pozri časti 4.8 a 5.1).
Orodispergovateľná tableta Olanzapin Teva obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
Olanzapin Teva orodispergovateľné tablety obsahuje sacharózu. Pacienti so zriedkavými dedičnými problémami intolerancie fruktózy, glukózo-galaktózovou malabsorpciou alebo nedostatkom sacharózo-isomaltázy nesmú užívať tento liek.

Olanzapin Teva orodispergovateľné tablety obsahuje aspartám, ktorý je zdrojom fenylalanínu. Môže
byť škodlivý pre osoby s fenylketonúriou.
4.5 Liekové a iné interakcieŠtúdie sledujúce interakcie boli uskutočnené len u dospelých.
MožnéinterakcieovplyvňujúceolanzapínVzhľadom na fakt, že olanzapín je metabolizovaný izoenzýmom CYP1A2, látky, ktoré špecificky indukujú alebo inhibujú tento izoenzým, môžu ovplyvniť farmakokinetiku olanzapínu.
IndukciaCYP1A2Fajčenie a karbamazepín môžu indukovať metabolizmus olanzapínu, čo môže následne viesť ku zníženiu koncentrácie olanzapínu. Pozorovali sa zanedbateľné, prípadne len mierne zvýšené hodnoty klírensu olanzapínu. Hoci klinický dopad je pravdepodobne minimálny, odporúča sa klinické monitorovanie a v nevyhnutných prípadoch je možné zvážiť zvýšenie dávok olanzapínu (pozri časť
4.2).
InhibíciaCYP1A2Preukázalo sa, že fluvoxamín, špecifický inhibítor CYP1A2, významne spomaľuje metabolizmus olanzapínu. Priemerné zvýšenie maximálnej koncentrácie (Cmax) olanzapínu fluvoxamínom bolo 54% u žien nefajčiarok a 77% u mužov fajčiarov. Priemerné zvýšenie plochy pod krivkou koncentrácie (AUC) olanzapínu bolo 52% u žien nefajčiarok a 108% u mužov fajčiarov. U pacientov užívajúcich fluvoxamín, prípadne iný inhibítor CYP1A2, ako napr. ciprofloxacín, sa má zvážiť zníženie počiatočnej dávky olanzapínu. Pri zahájení liečby inhibítorom CYP1A2 sa má zvážiť zníženie dávok olanzapínu.
ZníženiebiologickejdostupnostiAktívne uhlie znižuje biologickú dostupnosť olanzapínu po perorálnom podaní o 50 až 60%, preto sa má užívať minimálne 2 hodiny pred, resp. po podaní olanzapínu.
Fluoxetín (inhibítor CYP2D6), jednorazové dávky antacida (s obsahom hliníka, horčíka) alebo cimetidín, nemali signifikantný vplyv na farmakokinetiku olanzapínu.
MožnéovplyvnenieúčinkuinýchliekovolanzapínomOlanzapín môže antagonizovať účinky priamych a nepriamych agonistov dopamínu.
Olanzapín in vitro neinhibuje hlavné izoenzýmy CYP450 (napr. 1A2, 2D6, 2C9, 2C19, 3A4). Neočakávajú sa preto žiadne osobitné interakcie, čo dokazujú aj in vivo štúdie, ktoré nepreukázali inhibíciu metabolizmu nasledovných aktívnych látok: tricyklických antidepresív (reprezentujúcich prevažne CYP2D6 cestu metabolizácie), warfarínu (CYP2C9), teofylínu (CYP1A2) alebo diazepamu (CYP3A4 a 2C19).
Olanzapín nevykazoval žiadnu interakciu so súbežne podávaným lítiom alebo biperidenom. Monitorovanie terapeutických plazmatických hladín valproátu neukázalo, že by pri zahájení prídavnej
medikácie olanzapínom bola požadovaná úprava dávkovania valproátu.
VšeobencáCNSaktivita
Opatrnosť je potrebná u pacientov konzumujúcich alkohol alebo užívajúcich lieky, ktoré môžu spôsobiť depresiu centrálneho nervového systému.
Súbežné užívanie olanzapínu s antiparkinsonikami u pacientov s Parkinsonovou chorobou a demenciou sa neodporúča (pozri časť 4.4).
QTcinterval
Opatrnosť je potrebná, ak sa olanzapín podáva súbežne s liekmi, ktoré predlžujú QTc interval (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Gravidita
U gravidných žien sa nevykonali žiadne primerané a dobre kontrolované štúdie. Pacientky je potrebné poučiť o nutnosti informovania svojich lekárov vtedy, ak počas liečby olanzapínom otehotnejú alebo plánujú tehotenstvo. Avšak, vzhľadom na obmedzené skúsenosti u človeka sa má olanzapín podávať počas gravidity len vtedy, ak jeho potenciálny prínos pre matku prevýši možné riziko pre plod.
U novorodencov, ktorí boli vystavení počas tretieho trimestra gravidity antipsychotikám (vrátane olanzapínu), existuje riziko vzniku nežiaducich reakcií zahŕňajúcich extrapyramídové príznaky a/alebo príznaky z vysadenia lieku, ktoré sa môžu líšiť v závažnosti a trvaní. Boli hlásené agitácia, hypertónia, hypotónia, tremor, somnolencia, respiračná tieseň alebo ťažkosti pri kŕmení. Preto majú byť novorodenci starostlivo sledovaní.
Laktácia
V štúdii sa u zdravých dojčiacich žien olanzapín vylučoval do materského mlieka. Priemerná expozícia dieťaťa (mg/kg) v rovnovážnom stave bola odhadnutá na 1,8% z dávky olanzapínu podanej matke (mg/kg). Pacientky majú byť poučené o tom, že počas liečby olanzapínom nesmú dojčiť svoje dieťa.
Fertilita
Účinky na fertilitu nie sú známe (pozri časť 5.3 s predklinickými infomáciami).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Nakoľko olanzapín môže spôsobiť ospalosť a závraty, pacienti musia byť opatrní pri obsluhe strojov, vrátane vedenia motorových vozidiel.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Dospelí
Najčastejšie hlásené nežiaduce reakcie (pozorované u ≥ 1% pacientov) spojené s užívaním olanzapínu v klinických štúdiách boli ospalosť, nárast telesnej hmotnosti, eozinofília, zvýšenie hladiny prolaktínu, cholesterolu, glukózy a triglyceridov (pozri časť 4.4), glukozúria, zvýšená chuť do jedla, závrat, akatízia, parkinsonizmus, leukopénia a neutropénia (pozri časť 4.4), dyskinéza, ortostatická
hypotenzia, anticholinergné účinky, prechodné asymptomatické zvýšenie pečeňových aminotransferáz (pozri časť 4.4), vyrážka, asténia, únava, horúčka, artralgia, zvýšená hladina alkalickej fosfatázy, vysoká hladina gama glutamyltransferázy, vysoká hladina kyseliny močovej, vysoká hladina kreatín- fosfokinázy a edém.
Tabuľkanežiaducichreakcií
V nasledujúcej tabuľke sú uvedené nežiaduce reakcie a laboratórne vyšetrenia získané zo spontánnych hlásení a z klinických štúdií. V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti. Frekvencia je definovaná nasledovne: Veľmi časté (≥1/10), časté
(≥ 1/100 až < 1/10), menej časté (≥ 0.1/1 000 až < 1/100), zriedkavé (≥ 0.01/10 000 až < 0.1/1000), veľmi zriedkavé (< 0.01/10 000), neznáme (nemôžu byť stanovené z dostupných údajov).
Veľmi časté Časté Menej časté Zriedkavé Neznáme
Poruchy krvi a lymfatického systému
Eozinofília
Leukopénia10
Neutropénia10
Poruchy imunitného systému
Poruchy metabolizmu a výživy
Hypersenzitivita11
Trombocytopénia11
Zvýšenie telesnej hmotnosti1
Zvýšené hladiny cholesterolu2,3
Zvýšené hladiny glukózy 4
Zvýšené hladiny triglyceridov2,5
Glukozúria
Zvýšená chuť do jedla
Vznik alebo exacerbácia diabetu príležitostne spojená s ketoacidózou alebo kómou, vrátane
niekoľkých fatálnych prípadov (pozri časť
4.4) 11
Hypotermia12
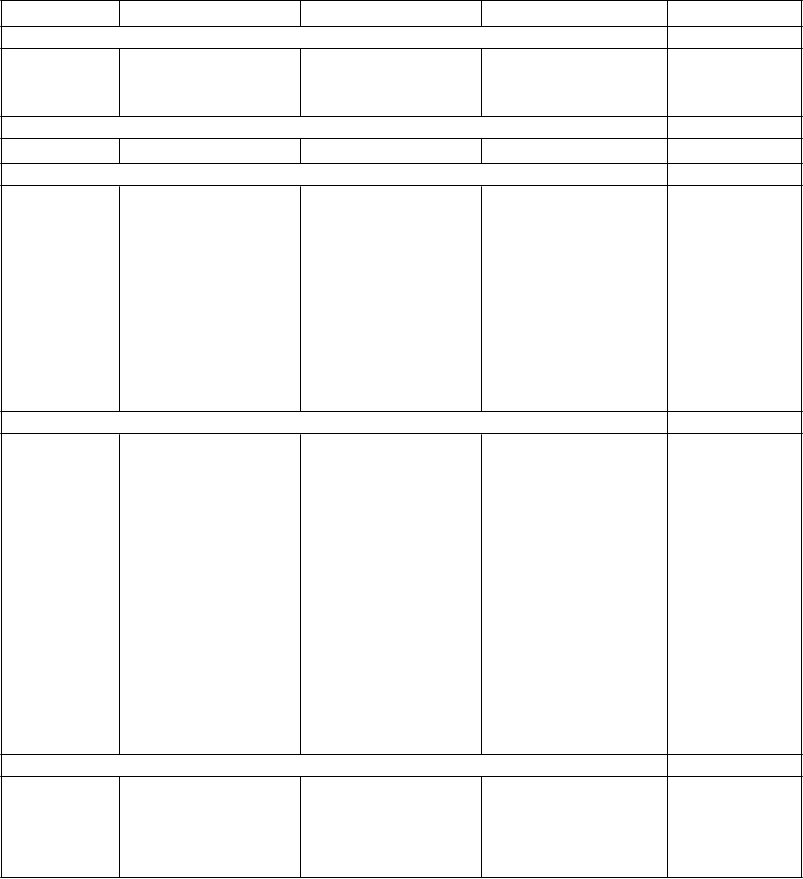 Poruchy nervového systému
Poruchy nervového systému
Ospalosť Závrat
Akatízia6
Parkinsonizmus6
Dyskinéza6
Poruchy srdca a srdcovej činnostiZáchvaty, pričom väčšinou bol hlásený ich výskyt v anamnéze alebo rizikové faktory pre ich vznik11
Dystónia (vrátane kruhových pohybov očných gúľ) 11
Tardívna dyskinéza11
Amnézia9
Dyzardia
Bradykardia Predĺženie QTc (pozri časť 4.4)
Neuroleptický malígny syndróm (pozri časť 4.4) Symptómy z vysadenia7,12
Ventrikulárna tachykardia/fibrilácia, náhle úmrtie (pozri časť 4.4) 11
Poruchy ciev Ortostatická hypotenzia10
Tromboembólia (vrátane pľúcnej embólie a hlbokej žilovej trombózy) (pozri časť 4.4)
Poruchy dýchacej sústavy, hrudníka a mediastína
Epistaxa9
Poruchy gastrointestinálneho traktu Mierne, prechodné anticholinergné
účinky vrátane
zápchy a sucha v ústach
Poruchy pečene a žlčových ciest
Prechodné, asymptomatické zvýšenie pečeňových aminotransferáz (ALT, AST), hlavne na začiatku liečby (pozri časť 4.4)
Poruchy kože a podkožného tkaniva
Abdominálna distenzia9
Pankreatitída11
Hepatitída (vrátane hepatocelulárneho, cholestatického alebo zmiešaného poškodenia) 11
Vyrážka Fotosenzitívna reakcia Alopécia
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Artralgia9 Rabdomyolýza11
Poruchy obličiek a močových ciest
Reakcia na liek
s eozinofíliou
a systémovými príznakmi (DRESS)
Inkontinencia moču, retencia moču Oneskorené močenie11
Stavy v gravidite, v šestonedelí a perinatálnom období
Poruchy reprodukčného systému a prsníkov
Abstinenčný syndróm novorodenca (pozri časť 4.6)
Erektilná dysfunkcia u mužov
Znížené libido u mužov a žien
Amenorea Zväčšenie prsníkov Galaktorea u žien Gynekomastia/ zväčšenie
prsníkov u mužov
Priapizmus12
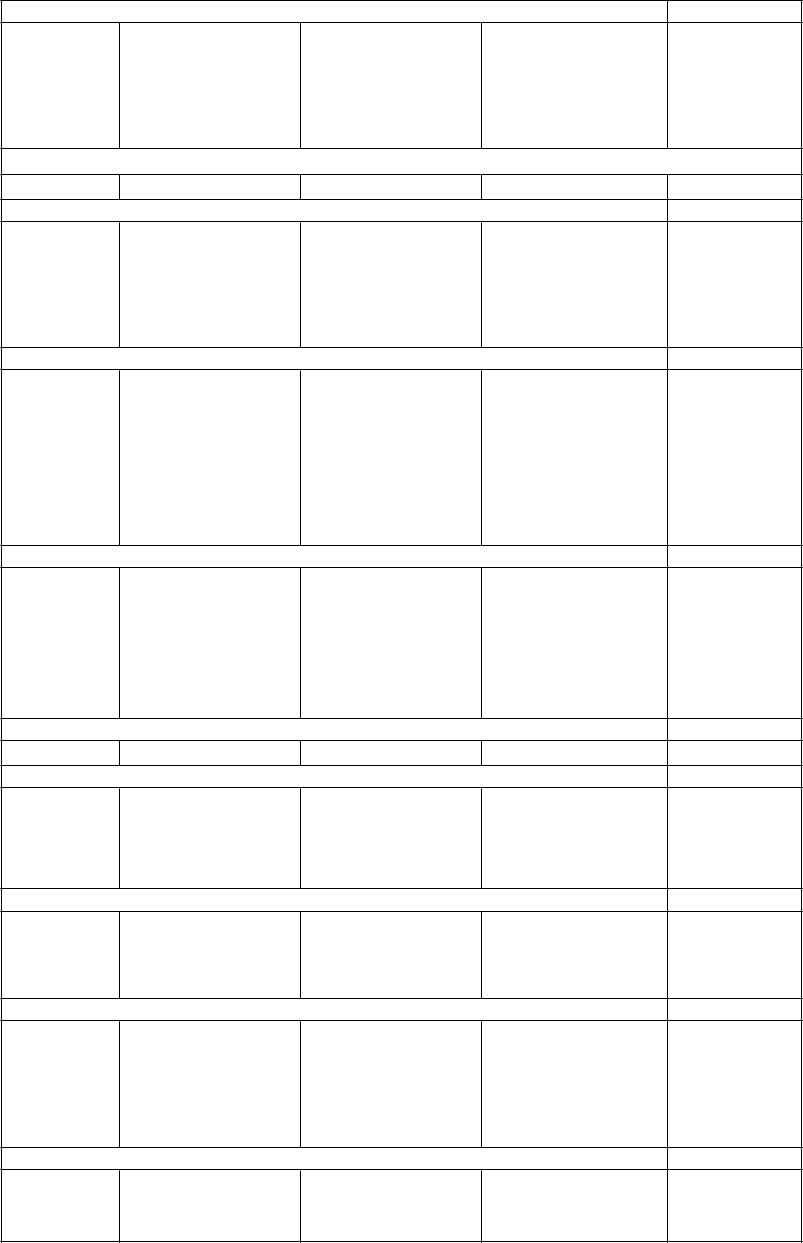 Celkové poruchy a reakcie v mieste podania
Celkové poruchy a reakcie v mieste podania
Asténia Únava Edém
Horúčka10
Laboratórne a funkčné vyšetrenia
Zvýšené hladiny prolaktínu8
Zvýšená hladina alkalickej fosfatázy10
Vysoká hladina kreatín-fosfokinázy11
Vysoká hladina gama glutamyltransferázy10
Vysoká hladina kyseliny močovej10
Zvýšený celkový bilirubín
1 Klinicky signifikantný nárast telesnej hmotnosti sa pozoroval vo všetkých kategóriách východiskovej hodnoty indexu telesnej hmotnosti (Body Mass Index - BMI). Po krátkodobej liečbe (medián trvania
47 dní) bol nárast telesnej hmotnosti ≥ 7% pôvodnej telesnej hmotnosti veľmi častý (22,2%), ≥ 15% častý (4,2%) a ≥ 25% menej častý (0,8%). Zvýšenie telesnej hmotnosti o ≥ 7%, ≥ 15% a ≥ 25% pôvodnej telesnej hmotnosti bolo veľmi časté (64,4%, 31,7% a 12,3%) u pacientov s dlhodobou expozíciou (minimálne 48 týždňov).
2 Priemerné zvýšenia lipidových hodnôt nalačno (celkový cholesterol, LDL cholesterol a triglyceridy)
boli vyššie u pacientov bez predtým dokázanej lipidovej dysregulácie.
3 Pozorované pri normálnych hladinách nalačno na začiatku (< 5,17 mmol/l), ktoré sa zvýšili na hladinu vysokú (≥ 6,2 mmol/l). Zmeny celkového cholesterolu nalačno z východiskovej hraničnej hodnoty (≥ 5,17 - < 6,2 mmol/l) na hodnotu vysokú (≥ 6,2 mmol/l) boli veľmi časté.
4 Pozorované pri normálnych východiskových hladinách nalačno (< 5,56 mmol/l), ktoré sa zvýšili na hladinu vysokú (≥ 7 mmol/l). Zmeny glukózy nalačno z východiskovej hraničnej hodnoty (≥ 5,56 -
< 7 mmol/l) na hodnotu vysokú (≥ 7 mmol/l) boli veľmi časté.
5 Pozorované pri normálnych hladinách nalačno na začiatku (< 1,69 mmol/l), ktoré sa zvýšili na hladinu vysokú (≥ 2,26 mmol/l). Zmeny triglyceridov nalačno z východiskovej hraničnej hodnoty (≥ 1,69 mmol/l - < 2,26 mmol/l) na hodnotu vysokú (≥ 2,26 mmol/l) boli veľmi časté.
6
V klinických štúdiách bol výskyt parkinsonizmu a dystónie u pacientov liečených olanzapínom
početne vyšší, ale štatisticky sa signifikantne nelíšil od placeba. U pacientov užívajúcich olanzapín bola, v porovnaní s titrovanými dávkami haloperidolu, menšia incidencia parkinsonizmu, akatízie
a dystónie. Vzhľadom na nedostatok podrobných informácií o akútnych a neskorých extrapyramídových príznakoch v osobnej anamnéze, nie je možné v súčasnosti dôjsť k záveru, či olanzapín spôsobuje menej často tardívne dyskinézy a/alebo ďalšie neskoré extrapyramídové syndrómy.
7 Akútne symptómy, ako sú potenie, nespavosť, tremor, úzkosť, nauzea a vracanie, boli hlásené po náhlom skončení liečby olanzapínom.
8 V klinických štúdiách trvajúcich do 12 týždňov prekročili koncentrácie plazmatického prolaktínu hornú hranicu normálneho rozmedzia u približne 30% pacientov liečených olanzapínom s normálnou počiatočnou hladinou prolaktínu. U väčšiny týchto pacientov boli zvýšenia väčšinou mierne a ostali pod dvojnásobkom hornej hranice normálneho rozmedzia.
9 Nežiaduca príhoda, pozorovaná v klinických skúšaniach v Integrovanej olanzapínovej databáze.
10 Vyhodnotené na základe nameraných hodnôt z klinických skúšaní v Integrovanej olanzapínovej databáze.
11 Nežiaduca príhoda pozorovaná zo spontánnych post-marketingových hlásení, s frekvenciou určenou pomocou Integrovanej olanzapínovej databázy.
12 Nežiaduca príhoda pozorovaná zo spontánnych post-marketingových hlásení , s frekvenciou odhadnutou pri hornom limite 95 % intervalu spoľahlivosti pomocou Integrovanej olanzapínovej databázy.
Dlhodobáexpozícia(aspoň48týždňov)Pomer pacientov, u ktorých sa vyskytli nežiaduce, klinicky signifikantné zmeny týkajúce sa hmotnostného prírastku, glukózy, celkového/LDL/HDL cholesterolu alebo triglyceridov sa časom zvýšil. U dospelých pacientov, ktorí absolvovali 9-12 mesačnú terapiu, sa rýchlosť zvýšenia priemernej hladiny krvnej glukózy spomalila približne po 6 mesiacoch.
ĎalšieinformácieozvláštnychpopuláciáchV klinických štúdiách u starších pacientov s demenciou bola pri liečbe olanzapínom v porovnaní
s placebom vyššia incidencia úmrtí a cerebrovaskulárnych nežiaducich reakcií (pozri tiež časť 4.4). Veľmi časté nežiaduce reakcie pri užívaní olanzapínu u tejto skupiny pacientov boli abnormálna chôdza a pády. Často boli pozorované pneumónia, zvýšená telesná teplota, letargia, erytém, zrakové halucinácie a inkontinencia moču.
V klinických štúdiách u pacientov s liekmi vyvolanou psychózou (dopamínovým agonistom) súvisiacou s Parkinsonovou chorobou, boli veľmi často a s vyššou frekvenciou ako u placeba zaznamenané zhoršenie parkinsonovskej symptomatiky a halucinácie.
V jednej klinickej štúdii u pacientov v manickej fáze bipolárnej poruchy bola pri liečbe valproátom v kombinácii s olanzapínom incidencia neutropénie 4,1%; potenciálne prispievajúcim faktorom by mohli byť vysoké plazmatické hladiny valproátu. Súbežné podanie olanzapínu s lítiom alebo valproátom viedlo ku zvýšeniu výskytu (³ 10%) tremoru, suchosti v ústach, zvýšenej chuti do jedla a k nárastu telesnej hmotnosti. Často boli zaznamenané aj poruchy reči. Počas liečby olanzapínom
v kombinácii s lítiom alebo divalproexom došlo v akútnej fáze liečby (do 6 týždňov) k nárastu telesnej hmotnosti o ³ 7% v porovnaní s počiatočnou hodnotou u 17,4% pacientov. Dlhodobá liečba olanzapínom (do 12 mesiacov) na prevenciu rekurencie u pacientov s bipolárnou poruchou bola spojená so zvýšením telesnej hmotnosti o ³ 7% v porovnaní s počiatočnou hodnotou u 39,9% pacientov.
PediatrickápopuláciaOlanzapín nie je indikovaný na liečbu detí a dospievajúcich pacientov do 18 rokov. Hoci sa neuskutočnili žiadne klinické štúdie porovnávajúce dospievajúcich pacientov s dospelými, údaje získané zo štúdií s dospievajúcimi pacientami boli porovnané s údajmi získanými zo štúdií
s dospelými pacientami.
V nasledujúcej tabuľke sú uvedené nežiaduce reakcie hlásené s vyššou frekvenciou

u dospievajúcich pacientov (vo veku 13 – 17 rokov) ako u dospelých pacientov alebo nežiaduce reakcie, ktoré boli zistené len počas krátkodobých klinických štúdií u dospievajúcich pacientov. Zdá sa, že klinicky významný prírastok na hmotnosti (≥ 7%) sa vyskytuje častejšie
u dospievajúcich v porovnaní s dospelými pri porovnateľných expozíciách. Výška hmotnostného prírastku a pomer adolescentných pacientov, u ktorých bol klinicky signifikantný hmotnostný prírastok, bol vyšší pri dlhodobej expozícii (aspoň 24 týždňov) ako pri krátkodobej expozícii.
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti. Frekvencia je definovaná nasledovne: Veľmi časté (³1/10), časté (≥ 1/100 až < 1/10).
Poruchy metabolizmu a výživy
Veľmi časté: Hmotnostný prírastok13, zvýšená hladina triglyceridov14, zvýšená chuť do jedla.
Časté: Zvýšená hladina cholesterolu15
Poruchy nervového systémuVeľmi časté: Útlm (vrátane: hypersomnie, letargie, somnolencie).
Poruchy gastrointestinálneho traktu Časté:
Časté: Suchosť v ústach.
Poruchy pečene a žlčových ciestVeľmi časté: Zvýšenie pečeňových aminotransferáz (ALT/AST; pozri časť 4.4).
VyšetreniaVeľmi časté: Zníženie celkového bilirubínu, zvýšenie GMT, zvýšenie plazmatickej hladiny prolaktínu16.
13 Po krátkodobej liečbe (medián trvania 22 dní) sa nárast hmotnosti o ³ 7% v porovnaní s počiatočnou
telesnou hmotnosťou (kg) vyskytoval veľmi často (40,6%), o ³ 15% v porovnaní s počiatočnou telesnou hmotnosťou často (7,1%) a ≥ 25% často (2,5%). Pri dlhodobej expozícii (aspoň 24 týždňov)
89,4% pribralo ≥ 7%, 55,3% pribralo ≥ 15% a 29,1% pribralo ≥ 25% pôvodnej telesnej hmotnosti.
14 Pozorované pri normálnych počiatočných hladinách nalačno (< 1,016 mmol/l), ktoré sa zvýšili na
≥ 1,467 mmol/l a zmeny triglyceridov nalačno z hraničnej počiatočnej hodnoty (≥ 1,016 mmol/l -
< 1,467 mmol/l) na ≥ 1,467 mmol/l.
15 Zmeny hladín celkového cholesterolu nalačno z normálnej počiatočnej hodnoty (< 4,39 mmol/l) na
≥ 5,17 mmol/l sa vyskytovali často. Zmeny hladín celkového cholesterolu nalačno z hraničnej počiatočnej hodnoty (≥ 4,39 - < 5,17 mmol/l) na ≥ 5,17 mmol/l sa vyskytovali veľmi často.
16 Zvýšenie plazmatickej hladiny prolaktínu bolo hlásené u 47,4% dospievajúcich pacientov.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieObjektívneasubjektívnepríznakyMedzi veľmi časté príznaky (výskyt > 10%) príznaky predávkovania patrí tachykardia, agitácia/agresivita, dyzartria, rôzne extrapyramídové príznaky a nižší stupeň vedomia od útlmu až po kómu.
K ďalším zdravotne významným dôsledkom predávkovania patria delírium, kŕče, kóma, možný neuroleptický malígny syndróm, útlm dýchania, aspirácia, hypertenzia alebo hypotenzia, srdcová arytmia (< 2% prípadov predávkovania) a zástava dýchania a činnosti srdca. Smrteľné prípady sa vyskytli už po akútnom predávkovaní dávkou 450 mg, ale takisto bolo popísané prežitie po akútnom predávkovaní dávkou približne 2 g perorálneho olanzapínu.
LiečbaPre olanzapín neexistuje žiadne špecifické antidotum. Neodporúča sa vyvolávanie vracania. Môžu byť indikované štandardné postupy používané pri liečbe predávkovania (tj. výplach žalúdka, podanie aktívneho uhlia). Ukázalo sa, že súbežné podanie aktívneho uhlia znižuje biologickú dostupnosť olanzapínu po perorálnom podaní o 50-60%.
Podľa klinického stavu sa má zahájiť symptomatická liečba a monitorovanie vitálnych funkcií, vrátane liečby hypotenzie, cirkulačného šoku a podpory respiračných funkcií. Nepoužívajte adrenalín,
dopamín či iné sympatomimetiká s agonistickou aktivitou na b-receptoroch, keďže beta stimulácia môže viesť ku zhoršeniu hypotenzie. Monitorovanie kardiovaskulárnych parametrov je nevyhnutné
kvôli diagnostike možných porúch srdcového rytmu. Pacient má byť až do zotavenia pod stálou lekárskou kontrolou a majú byť sledované aj jeho vitálne funkcie.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: psycholeptiká, diazepíny, oxazepíny, tiazepíny a oxepíny. ATC kód: N05A H03.
Farmakodinamyckéúčinky
Olanzapín je antipsychotická, antimanická a náladu stabilizujúca látka, ktorá vykazuje široký profil farmakologických účinkov na viaceré receptorové systémy.
V predklinických štúdiách preukázal olanzapín afinitu k radu receptorov (Ki; < 100 nM) - k serotonínovým 5HT2A/2C, 5HT3, 5HT6; dopamínovým D1, D2, D3, D4, D5; cholinergným muskarínovým M1-M5; a1-adrenergným; a histamínovým H1 receptorom. Behaviorálne štúdie na zvieratách preukázali antagonistické pôsobenie olanzapínu na 5HT, dopamínové a cholínergné receptory, čo je v súlade s väzbovým profilom látky. Olanzapín vykazoval in vitro väčšiu afinitu
k serotonínovým 5HT2 receptorom než k dopamínovým D2 a vyššiu 5HT2 ako D2 aktivitu na in vivo modeloch. Elektrofyziologické štúdie ukázali, že olanzapín selektívne znižuje aktivitu mezolimbických (A10) dopaminergných neurónov bez výraznejšej interakcie so striatálnymi (A9) dráhami ovládajúcimi motoriku. Olanzapín znižoval podmienenú reakciu úniku, čo je test na zistenie antipsychotického účinku, v dávkach, ktoré ešte nevyvolávajú katalepsiu, účinok naznačujúci motorické vedľajšie účinky. Na rozdiel od niektorých iných antipsychotík, olanzapín zvyšuje reaktivitu v „anxiolytickom“ teste.
V štúdii s jednorazovou perorálnou dávkou (10 mg) a sledovaním pomocou pozitrónovej emisnej tomografie (PET) u zdravých dobrovoľníkov obsadzoval olanzapín viac 5HT2A receptory ako dopamínové D2 receptory. Navyše, v zobrazovacej štúdii Single Photon Emission Computed Tomography (SPECT) bola miera obsadzovania D2 receptorov u schizofrenických pacientov odpovedajúcich na olanzapín nižšia ako u pacientov odpovedajúcich na iné antipsychotiká a pacientov odpovedajúcich na risperidón, zatiaľ čo u pacientov odpovedajúcich na klozapín bola porovnateľná.
Klinickáúčinnosť
V dvoch z dvoch placebo kontrolovaných a dvoch z troch porovnávacích kontrolovaných štúdií s viac ako 2 900 schizofrenickými pacientami s pozitívnymi i negatívnymi symptómami vykazoval olanzapín štatisticky významne väčšie zlepšenie ako u negatívnych, tak aj u pozitívnych symptómov.
V medzinárodnej, dvojito zaslepenej, porovnávacej štúdii zahŕňajúcej 1 481 pacientov so schizofréniou, schizoafektívnymi a príbuznými poruchami a s rôznymi stupňami pridružených depresívnych symptómov (priemerné východiskové skóre 16,6 škály MADRS /the Montgomery- Asberg Depression Rating Scale/) preukázala prospektívna sekundárna analýza zmenu skóre od východiskovej po konečnú hodnotu štatisticky významné zlepšenie (p=0,001) v prospech olanzapínu (-6,0) oproti haloperidolu (-3,1).
U pacientov s manickou alebo zmiešanou epizódou bipolárnej poruchy preukázal olanzapín v znížení manických symptómov za 3 týždne vyššiu účinnosť ako placebo a valproát semisodium (divalproex). Olanzapín taktiež preukázal porovnateľnú účinnosť s haloperidolom v zmysle podielu pacientov
v symptomatickej remisii mánie a depresie po 6 a 12 týždňoch. V štúdii kombinovanej terapie
u pacientov liečených lítiom alebo valproátom po dobu minimálne 2 týždne viedlo pridanie olanzapínu v dávke 10 mg (v kombinácii s lítiom alebo valproátom) ku väčšej redukcii symptómov mánie ako tomu bolo pri liečbe lítiom alebo valproátom v rámci monoterapie za 6 týždňov.
V 12-mesačnej štúdii prevencie rekurencie u pacientov s manickou epizódou, ktorí dosiahli remisiu pri liečbe olanzapínom a boli potom randomizovaní na užívanie olanzapínu alebo placeba, preukázal olanzapín voči placebu v primárnom koncovom bode rekurencie bipolárnej poruchy štatisticky
významnú nadradenosť. Olanzapín taktiež vykázal v porovnaní s placebom štatisticky významnú výhodu buď z hľadiska prevencie rekurencie mánie alebo prevencie rekurencie depresie.
V druhej 12-mesačnej štúdii prevencie rekurencie u pacientov s manickou epizódou, ktorí dosiahli remisiu pri liečbe kombináciou olanzapínu a lítia a boli potom randomizovaní na užívanie samotného olanzapínu alebo lítia, nebol olanzapín v primárnom parametre rekurencie bipolárnej poruchy štatisticky podradený voči lítiu (olanzapín 30,0%, lítium 38,3%; p = 0,055).
V 18-mesačnej štúdii s kombinovanou liečbou u pacientov s manickou alebo zmiešanou epizódou, ktorí boli stabilizovaní pri liečbe olanzapínom spolu so stabilizátorom nálady (lítium alebo valproát), nebola dlhodobá kombinovaná liečba olanzapínom spolu s lítiom alebo valproátom štatisticky významne superiorná voči liečbe samotným lítiom alebo valproátom v predĺžení doby do rekurencie bipolárnej poruchy definovanej podľa syndrómových (diagnostických) kritérií.
Pediatrickápopulácia
Kontrolované údaje o účinnosti s dospievajúcimi (vo veku 13 až 17 rokov) sú obmedzené na štúdie s perorálnym olanzapínom pri liečbe schizofrénie (6 týždňov) a mánie v súvislosti s bipolárnou poruchou typu I (3 týždne), ktoré zahŕňali menej ako 200 dospievajúcich. Olanzapín sa podával vo flexibilnej dávke od 2,5 mg až do 20 mg denne. Počas liečby olanzapínom sa zvýšila hmotnosť
u dospievajúcich podstatne viac ako u dospelých. Rozsah zmien celkového cholesterolu nalačno, LDL
cholesterolu, triglyceridov a prolaktínu (pozri časti 4.4 a 4.8) bol väčší u dospievajúcich ako
u dospelých. Nie sú k dispozícii kontrolované údaje o pretrvávaní účinku ani údaje o dlhodobej bezpečnosti (pozri časti 4.4 a 4.8). Informácie o dlhodobej bezpečnosti sú primárne obmedzené na otvorené nekontrolované dáta.
5.2 Farmakokinetické vlastnosti
Absorpcia
Orodispergovateľná tableta olanzapínu je bioekvivalentná filmom obalenej tablete olanzapínu,
s podobnou rýchlosťou a rozsahom vstrebávania. Orodispergovateľné tablety olanzapínu je možné užívať ako náhradu filmom obalených tabliet olanzapínu.
Distribúcia
V koncentračnom rozmedzí 7 až asi 1 000 ng/ml je väzba olanzapínu na plazmatické bielkoviny približne 93%. Olanzapín sa v plazme viaže na albumín a α1-kyslý glykoproteín.
Biotransformácia
Olanzapín sa po perorálnom podaní dobre vstrebáva a dosahuje maximálne koncentrácie v plazme
za 5 až 8 hodín. Vstrebávanie nie je ovplyvnené jedlom. Absolútna perorálna biologická dostupnosť vo vzťahu k intravenóznemu podaniu nebola stanovená.
Olanzapín sa metabolizuje v pečeni konjugáciou a oxidáciou. Hlavným metabolitom v obehu je 10-N- glukuronid, ktorý neprestupuje hematoencefalickou bariérou. Cytochrómy P450-CYP1A2 a P450- CYP2D6 prispievajú k tvorbe metabolitov N-desmetylu a 2-hydroxymetylu, vykazujúcich in vivo významne nižšiu farmakologickú aktivitu ako olanzapín v štúdiách na zvieratách. Prevažná časť famakologickej aktivity je spôsobená pôvodným olanzapínom.
Eliminácia
Po perorálnom podaní, priemerný terminálny polčas vylučovania olanzapínu sa u zdravých jedincov líšil podľa veku a pohlavia.
U zdravých starších jedincov (nad 65 rokov) sa v porovnaní s mladšími jedincami priemerný polčas vylučovania predĺžil (51,8 oproti 33,8 hod) a klírens sa znížil (17,5 oproti 18,2 l/hod). Farmakokinetické odchýlky pozorované u starších jedincov sú v medziach odchýlok mladších jedincov. U 44 schizofrenických pacientov starších ako 65 rokov sa pri dávkach 5-20 mg/deň nepozoroval zvýšený výskyt nežiaducich účinkov.
Priemerný polčas vylučovania u žien sa oproti mužom predĺžil (36,7 oproti 32,3 hod) a klírens sa znížil (18,9 oproti 27,3 l/hod). Napriek tomu vykazuje olanzapín (5-20 mg) porovnateľný bezpečnostný profil tak u žien (n=467) ako aj u mužov (n=869).
Poškodenieobličiek
U pacientov s poškodením funkcie obličiek (klírens kreatinínu < 10 ml/min) v porovnaní so zdravými jedincami nespôsobovala významný rozdiel priemerného polčasu eliminácie (37,7 oproti32,4 hod) alebo klírensu (21,2 oproti 25,0 l/hod). Štúdia rovnováhy ukázala, že približne 57% olanzapínu označeného rádioaktívnym izotopom sa vylučuje do moča vo forme metabolitov.
Fajčiari
U fajčiarov s miernym poškodením pečene, v porovnaní so zdravými nefajčiarmi, sa priemerný polčas vylučovania (39,3 hod) predĺžil a klírens (18,0 l/hod) sa znížil (48,8 hod resp. 14,1 l/hod).
U nefajčiarov oproti fajčiarom (ženy i muži) sa priemerný polčas vylučovania predĺžil (38,6 oproti
30,4 hod) a klírens znížil (18,6 oproti 27,7 l/hod).
Plazmatický klírens olanzapínu je nižší u starších ako u mladších jedincov, u žien ako u mužov
a u nefajčiarov oproti fajčiarom. Avšak závažnosť vplyvu veku, pohlavia alebo fajčenia na klírens
a polčas vylučovania olanzapínu sú malé v porovnaní s celkovou variabilitou medzi jednotlivcami.
V klinickej štúdii neboli žiadne rozdiely farmakokinetických parametrov medzi belochmi, Japoncami a Číňanmi.
Pediatrickápopulácia
Dospievajúci (vek 13 až 17 rokov): Farmakokinetika olanzapínu je podobná u dospievajúcich a dospelých. V klinických štúdiách bola priemerná expozícia olanzapínu približne o 27% vyššia
u dospievajúcich. Demografické rozdiely medzi dospievajúcimi a dospelými zahŕňali nižšiu priemernú telesnú hmotnosť a menší počet fajčiarov medzi dospievajúcimi. Tieto faktory možno prispeli k vyššej priemernej expozícii pozorovanej u dospievajúcich.
5.3 Predklinické údaje o bezpečnosti
Akútnatoxicita(pojednorazovompodaní)
Príznaky toxicity po perorálnom podaní hlodavcom obsahovali silnú neuroleptickú zložku: hypoaktivitu, kómu, tras, klonické kŕče, slinenie a pokles telesnej hmotnosti. Stredná letálna dávka u myší bola 210 mg/kg a u krýs 175 mg/kg. Psi tolerovali jednorazovú dávku až do100 mg/kg
s nulovou mortalitou. Medzi klinické príznaky patril útlm, ataxia, tras, zrýchlený pulz, sťažené dýchanie, mióza a anorexia. U opíc vyvolala jednorazová perorálna dávka do 100 mg/kg vyčerpanosť a vyššie dávky čiastočné bezvedomie.
Toxicitapoopakovanompodaní
Medzi hlavné prejavy toxicity pozorované v 3-mesačnej štúdii u myší a 1-ročnej štúdii u potkanov a psov patril útlm CNS, anticholínergné účinky a ochorenia periférnej krvi.
Na útlm CNS sa vyvinula tolerancia. Pri vysokých dávkach poklesli parametre rastu. Reverzibilné účinky spojené so zvýšenou hladinou prolaktínu u krýs zahŕňali pokles hmotnosti ovárií a uteru
a morfologické zmeny vaginálneho epitelu a prsných žliaz.
Hematologickátoxicita
U všetkých druhov boli pozorované účinky na hematologické ukazovatele, vrátane na dávke závislom poklese počtu leukocytov v krvi u myší a nešpecifickom poklese leukocytov v krvi u krýs; cytotoxický účinok na kostnú dreň sa však nedokázal. U niekoľkých psov, ktorým sa podávalo 8 alebo
10 mg/kg/deň (celková expozícia olanzapínu [AUC] je 12- až 15-krát vyššia než pri podaní dávky
12 mg človeku), sa vyvinula reverzibilná neutropénia, trombocytopénia alebo anémia. U psov
s cytopéniou sa nepozorovali žiadne nepriaznivé účinky na progenitorové a proliferujúce bunky kostnej drene.
Reprodukčnátoxicita
Olanzapín nemá žiadny teratogénne účinky. U samcov potkanov sa pozoroval pokles libida ako dôsledok sedácie. Estrálne cykly boli ovplyvnené dávkou 1,1 mg/kg (čo je 3-násobok maximálnej dávky u človeka) a reprodukčné parametre boli u potkanov ovplyvnené dávkou 3 mg/kg (čo je
9-násobok maximálnej dávky u človeka). U potomstva potkanov, ktorým sa podával olanzapín, sa pozorovalo oneskorenie fetálneho vývoja a prechodný pokles aktivity.
Mutagenita
Olanzapín nemal mutanogénne ani klastogénne účinky v žiadnom zo štandardných testov, vrátane testov bakteriálnych mutácií in vivo a in vitro testov na cicavcoch.
Karcinogenita
Na základe výsledkov štúdií na myšiach a potkanoch sa zistilo, že olanzapín nie je karcinogénny.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
manitol (E421) aspartám (E951) magnéziumstearát krospovidón typ B monohydrát laktózy hydroxypropylcelulóza
Citrón [aromatický prípravok (y), maltodextrín, sacharóza, arabská guma (E414), triacetát glycerolu
(E1518) a alfa-tokoferol (E307)]
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
Hliníkové blistre z OPA/hliníka/PVC v škatuliach obsahujúcich 28, 30, 35, 56, 70 a 98
orodispergovateľných tabliet v jednej škatuli.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Teva B.V., Swensweg 5, 2031GA Haarlem, Holandsko
8. REGISTRAČNÉ ČÍSLO
EU/1/07/427/035 – Olanzapin Teva – 20 mg – orodispergovateľné tablety – 28 tabliet v škatuli. EU/1/07/427/036 – Olanzapin Teva – 20 mg – orodispergovateľné tablety – 30 tabliet v škatuli.
EU/1/07/427/047 – Olanzapin Teva – 20 mg – orodispergovateľné tablety – 35 tabliet v škatuli. EU/1/07/427/037 – Olanzapin Teva – 20 mg – orodispergovateľné tablety – 56 tabliet v škatuli. EU/1/07/427/057 – Olanzapin Teva – 20 mg – orodispergovateľné tablety – 70 tabliet v škatuli. EU/1/07/427/067 – Olanzapin Teva – 20 mg – orodispergovateľné tablety – 98 tabliet v škatuli.
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 12/12/2007
Dátum prvého predĺženia registrácie: 12/12/2012
10. DÁTUM REVÍZIE TEXTU
{MM/RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry
(