>
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie- Liečba krvácania a perioperačná profylaxia krvácania pri získanom deficite protrombínového komplexu koagulačných faktorov ako je nedostatok spôsobený liečbou antagonistami vitamínu K alebo v prípade predávkovania antagonistami vitamínu K, kedy sa vyžaduje rýchla korekcia tohto nedostatku.
- Liečba krvácania a perioperačná profylaxia krvácania pri vrodenom deficite koagulačných faktorov II a X závislých od vitamínu K, ak produkt obsahujúci purifikovaný špecifický koagulačný faktor nie je dostupný.
4.2 Dávkovanie a spôsob podávaniaDávkovanieNižšie uvedená schéma dávkovania je len všeobecná. Liečba sa začína pod dohľadom lekára, ktorý má skúsenosti s liečbou koagulačných porúch. Dávkovanie a dĺžka substitučnej terapie závisia od závažnosti ochorenia, od miesta a rozsahu krvácania a od pacientovho klinického stavu.
Množstvo a frekvencia podávania sa prepočítavajú podľa individuálneho stavu pacienta. Intervaly medzi dávkami sa musia prispôsobiť u každého pacienta individuálne podľa rôznych polčasov cirkulujúcich koagulačných faktorov v protrombínovom komplexe (pozri časť 5.2). Individuálne potreby dávkovania sa môžu stanoviť len na základe pravidelného sledovania individuálnych plazmatických hladín koagulačných faktorov alebo celkových testov hladín protrombínového komplexu (protrombínový čas, INR) a kontinuálneho sledovania klinického stavu pacienta.
V prípade rozsiahlych chirurgických zákrokov je podrobné monitorovanie substitučnej terapie pomocou stanovenia koagulácie nevyhnutné (stanovenie špecifických koagulačných faktorov a/alebo celkové testy na hladiny protrombínového komplexu).
Krvácanie a perioperačná profylaxia krvácania počas liečby antagonistami vitamínu K:Dávka závisí od INR pred liečbou a cieľovej hodnoty INR. V nasledovnej tabuľke sú uvedené približné dávky (mg/kg telesnej hmotnosti nariedeného lieku) potrebné na normalizáciu INR (≤ 1,2 počas 1 hodiny) pri rôznych iniciálnych hodnotách INR.
Iniciálne INR
| 2 – 2,5
| 2,5 - 3
| 3 – 3,5
| > 3,5
|
Približná dávka*(ml Octaplexu/kg telesnej hmotnosti)
| 0,9 – 1,3
| 1,3 – 1,6
| 1,6 – 1,9
| > 1,9
|
* - jednotlivá dávka nesmie prekročiť 3 000 IU (120 ml Octaplexu).
Korekcia antagonistov vitamínu K spôsobená poruchou hemostázy pretrváva približne 6-8 hodín. Avšak účinky vitamínu K, ak sa podáva simultánne, sa obvykle dosahujú do 4-6 hodín. Preto opakovaná liečba ľudským protrombínovým komplexom obvykle nie je potrebná, ak sa podáva vitamín K.
Keďže tieto odporúčania sú empirické a obnova a dĺžka účinku môžu byť rôzne, potrebné je monitorovanie INR počas liečby.
Krvácanie a perioperačná profylaxia pri vrodenom deficite koagulačných faktorov II a X závislých na vitamíne K, kedy produkt so špecifickým koagulačným faktorom nie je dostupný:Vypočítané požadované dávkovanie na liečbu je založené na empirických zisteniach, že približne 1 IU faktora II alebo X na kg telesnej hmotnosti zvýši plazmatickú aktivitu faktora II alebo X o 0,02 resp. 0,017 IU/ml.
Dávka podávaného špecifického faktora sa vyjadruje v medzinárodných jednotkách (IU), ktoré zodpovedajú súčasným WHO štandardom pre každý faktor. Plazmatická aktivita špecifického koagulačného faktora sa vyjadruje v percentách (pomerne k normálnej plazme) alebo v medzinárodných jednotkách (pomerne k medzinárodným štandardom pre špecifický koagulačný faktor).
Jedna medzinárodná jednotka (IU) aktivity koagulačného faktora je ekvivalentná množstvu v jednom ml normálnej ľudskej plazmy.
Napríklad, výpočet potrebnej dávky faktora X sa zakladá na empirických zisteniach, že 1 medzinárodná jednotka (IU) faktora X na kg telesnej hmotnosti zvýši plazmatickú aktivitu faktora X o 0,017 IU/ml. Odporúčané dávkovanie sa počíta s použitím nasledujúceho vzorca:
Potrebné jednotky = telesná hmotnosť (kg) x požadované zvýšenie faktora X (IU/ml) x 59kde 59 (ml/kg) je recipročná hodnota odhadovaného obnovenia.
Potrebné dávky pre faktor II:
Potrebné jednotky = telesná hmotnosť (kg) x požadované zvýšenie faktora II (IU/ml) x 50Ak je známa individuálna obnova, hodnoty sa použijú na výpočet.
Spôsob podávaniaPokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6. Octaplex sa podáva intravenózne. Infúzia začína rýchlosťou 1 ml/minútu a pokračuje 2 – 3 ml za minútu za aseptických podmienok.
4.3 Kontraindikácie- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Známa alergia na heparín alebo heparínom indukovaná trombocytopénia v anamnéze.
4.4 Osobitné upozornenia a opatrenia pri používaníPotrebné je poradiť sa so špecialistom, ktorý má skúsenosti s liečbou koagulačných porúch.
U pacientov so získaným deficitom koagulačných faktorov závislých od vitamínu K (napr. ako indukovaných liečbou antagonistami vitamínu K), sa má Octaplex použiť len vtedy, ak je potrebná rýchla korekcia hladín protrombínového komplexu- ako silné krvácanie alebo úrazová chirurgia. V ostatných prípadoch je obvykle postačujúce znížiť dávky antagonistov vitamínu K a/alebo podávať vitamín K.
Pacienti užívajúci antagonisty vitamínu K môžu mať prebiehajúci hyperkoagulačný stav a infúzia koncentrátu protrombínového komplexu to môže ešte zhoršiť.
Pri vrodenom nedostatku faktorov závislých od vitamínu K sa má používať špecifický koagulačný faktor, ak je dostupný.
Ak sa vyskytne alergická alebo anafylaktická reakcia, infúzia sa musí ihneď prerušiť. V prípade šoku sa majú zaviesť štandardné protišokové opatrenia.
Štandardné opatrenia na prevenciu infekcií, ktoré vychádzajú z použitia liekov pripravovaných z ľudskej krvi alebo plazmy, zahŕňajú selekciu darcov, skríning individuálnych darcov a kontrolu poolu plazmy na špecifické markery infekcie a účinné výrobné procesy na inaktiváciu/elimináciu vírusov.
Napriek tomu, pri používaní liekov pripravených z ľudskej krvi alebo plazmy, nemožno úplne vylúčiť možnosť prenosu infekčných agensov. Platí to aj pre neznáme vírusy a ostatné známe aj neznáme patogény.
Opatrenia sú účinné proti obaleným vírusom ako je HIV, HBV a HCV. Opatrenia môžu byť obmedzene účinné proti neobaleným vírusom ako je HAV alebo parvovírus B19. Infekcia parvovírusom B19 môže byť závažná u tehotných žien (infekcia plodu) a u pacientov s imunodeficienciou alebo zvýšenou erytropoézou (napr. hemolytická anémia).
Pri každom podaní dávky Octaplexu pacientovi sa dôrazne odporúča vždy zaznamenať názov a číslo šarže lieku, aby sa viedli záznamy o použitých šaržách u jednotlivých pacientov.
Odporúča sa vhodná vakcinácia (hepatitída A a B) u pacientov, ktorí pravidelne/opakovane dostávajú protrombínový komplex formou produktov z ľudskej plazmy.
Existuje riziko trombózy alebo diseminovanej intravaskulárnej koagulácie, ak sú pacienti s vrodeným alebo získaným nedostatkom liečení ľudským protrombínovým komplexom, zvlášť pri opakovanom podávaní. Pacientov, ktorí dostávajú ľudský protrombínový komplex, treba starostlivo monitorovať na znaky alebo symptómy intravaskulárnej koagulácie alebo trombózy. Kvôli riziku tromboembolických komplikácií sa odporúča starostlivé monitorovanie pri podávaní ľudského protrombínového komplexu pacientom s anamnézou koronárnej choroby srdca, pacientom s ochorením pečene, peri a postoperačným pacientom, novorodencom alebo pacientom s rizikom tromboembolickej príhody alebo diseminovanej intravaskulárnej koagulácie. V prípade každej z týchto situácií treba zvážiť pomer prínosu z liečby a možného rizika týchto komplikácií.
Dosiaľ nie sú dostupné údaje o používaní Octaplexu v prípade perinatálneho krvácania v dôsledku nedostatku vitamínu K u novorodencov.
Octaplex obsahuje 150 - 250 mg sodíka na injekčnú liekovku. Musí sa to vziať do úvahy u pacientov s kontrolovanou diétou na obsah sodíka.
4.5 Liekové a iné interakcieLieky s ľudským protrombínovým komplexom neutralizujú účinok antagonistov vitamínu K, ale interakcie s inými liekmi nie sú známe.
Interferencia s biologickými testami:
Ak sa vykonávajú testy na zrážanie citlivé na heparín u pacientov dostávajúcich vysoké dávky ľudského protrombínového komplexu, prítomnosť heparínu (ako súčasť podávaného produktu) sa musí vziať do úvahy.
4.6 Fertilita, gravidita a laktáciaBezpečnosť používania ľudského protrombínového komplexu počas gravidity a laktácie sa neskúmala.
Štúdie na zvieratách nie sú vhodné na posúdenie bezpečnosti s ohľadom na graviditu, embryonálny/fetálny vývoj, pôrod alebo postnatálny vývoj. Ľudský protrombínový komplex má byť preto počas gravidity a laktácie používaný, len ak je to prísne indikované.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinkyPoruchy imunitného systému:· Substitučná terapia môže zriedkavo (³ 1/10 000 až < 1/1 000) viesť ku tvorbe cirkulačných protilátok inhibujúcich jeden alebo viacero faktorov ľudského protrombínového komplexu. Ak sa vyskytnú takéto inhibítory, stav sa prejaví slabšou klinickou odpoveďou.
· Alergické alebo anafylaktické reakcie a zvýšenie telesnej teploty sa nepozorovali počas klinických štúdií s Octaplexom, ale zriedkavo sa môžu objaviť (³ 1/10 000 až < 1/1 000).
Celkové poruchy a reakcie v mieste podania:· Zvýšenie telesnej teploty sa nepozorovalo, ale zriedkavo sa môže objaviť (³ 1/10 000 až < 1/1 000).
Poruchy ciev:· Existuje riziko tromboembolických príhod po podaní ľudského protrombínového komplexu (pozri časť 4.4).
Poruchy nervového systému:· Zriedkavo sa môže objaviť bolesť hlavy (³ 1/10 000 až < 1/1 000).
Laboratórne a funkčné vyšetrenia:· Zriedkavo sa pozorovalo prechodné zvýšenie pečeňových transamináz (³ 1/10 000 až < 1/1 000).
Iné:Octaplex obsahuje heparín. Preto sa môže v zriedkavých prípadoch pozorovať náhly, alergiou vyvolaný pokles počtu trombocytov v krvi pod 100 000/µl alebo 50 % z počiatočného počtu (trombocytopénia typu II). U pacientov, ktorí doteraz neboli precitlivení na heparín, môže dôjsť k tomuto poklesu počtu trombocytov 6 až 14 dní po začatí liečby. U pacientov, u ktorých sa už vyskytla precitlivenosť na heparín, môže dôjsť k tomuto poklesu v priebehu niekoľkých hodín.
Liečba Octaplexom sa musí u pacientov s touto alergickou reakciou okamžite ukončiť. Títo pacienti nesmú v budúcnosti dostávať lieky obsahujúce heparín.
Pre bezpečnosť s ohľadom na prenosné infekčné agensy, pozri časť 4.4.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 PredávkovaniePoužitie vysokých dávok ľudského protrombínového komplexu sa spájalo s prípadmi infarktu myokardu, diseminovanej intravaskulárnej koagulácie, venóznej trombózy a pľúcnej embólie. Preto, v prípade predávkovania, je zvýšené riziko rozvoja tromboembolických komplikácií alebo diseminovanej intravaskulárnej koagulácie.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antihemoragikum, koagulačné faktory, ATC kód: B02BD01.
Koagulačné faktory II, VII, IX a X, ktoré sa syntetizujú v pečeni pomocou vitamínu K, sa všeobecne nazývajú protrombínový komplex.
Faktor VII je zymogén aktívneho serínového proteázového faktora VIIa, ktorý vonkajšou cestou začína koaguláciu krvi. Prepojenie komplexu faktor-faktor VIIa aktivuje koagulačné faktory X a IX, čím sa tvoria faktory IXa a Xa. S ďalšou aktiváciou koagulačnej kaskády sa protrombín (faktor II) aktivuje a transformuje na trombín. Účinkom trombínu sa fibrinogén mení na fibrín, ktorý spôsobí tvorbu zrazenín. Normálna tvorba trombínu je tiež vitálne dôležitá pre funkciu krvných doštičiek ako súčasť primárnej hemostázy.
V ojedinelých prípadoch ťažký deficit faktora VII vedie ku zníženej tvorbe trombínu a tendencii ku krvácaniu v dôsledku poruchy tvorby fibrínu a poruchy primárnej hemostázy. Izolovaný nedostatok faktora IX je jedným z klasických typov hemofílie (hemofília typu B). Izolovaný nedostatok faktora II alebo X je veľmi zriedkavý, ale pri závažných formách môže spôsobiť tendenciu krvácania podobnú ako je pri klasickej hemofílii.
Získaný deficit koagulačných faktorov závislých od vitamínu K sa vyskytuje počas liečby antagonistami vitamínu K. Ak sa deficit stane závažným, môže to viesť k závažnému sklonu ku krvácaniu charakterizovanému retroperitoneálnym alebo cerebrovaskulárnym krvácaním častejšie ako hemorágiou do svalov alebo kĺbov. Závažná hepatálna insuficiencia tiež spôsobuje značné zníženie hladín koagulačných faktorov závislých od vitamínu K s tendenciou klinického krvácania, ktoré je však častejšie komplexné v dôsledku simultánne prebiehajúcej nízkostupňovej intravaskulárnej koagulácie, nízkych hladín krvných doštičiek, nedostatku inhibítorov koagulácie a poruchy fibrinolýzy.
Podanie ľudského protrombínového komplexu spôsobí zvýšenie plazmatických hladín koagulačných faktorov závislých od vitamínu K, a tým sa dočasne upraví koagulačnú poruchu u pacientov s nedostatkom jedného alebo viacerých z týchto faktorov.
5.2 Farmakokinetické vlastnostiRozsahy plazmatických polčasov sú nasledovné:
Koagulačný faktor
| Polčas
|
Faktor II
| 48 – 60 hodín
|
Faktor VII
| 1,5 – 6 hodín
|
Faktor IX
| 20 – 24 hodín
|
Faktor X
| 24 – 48 hodín
|
Octaplex sa podáva intravenózne, a preto je ihneď dostupný v organizme.
5.3 Predklinické údaje o bezpečnostiNie sú k dispozícii žiadne relevantné predklinické údaje s ohľadom na klinickú bezpečnosť, okrem údajov uvedených v iných častiach tohto SPC.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látokPrášok:Heparín: 0,2 ‑ 0,5 IU/IU FIX
Dihydrát citronanu sodného
Rozpúšťadlo: Voda na injekciu
6.2 InkompatibilityTento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v čsti 6.6.
6.3 Čas použiteľnosti2 roky
Chemická a fyzikálna stabilita lieku pripraveného na použitie bola preukázaná po dobu najviac 8 hodín pri teplote +25 °C.'
Z mikrobiologického hľadiska, ak spôsob otvorenia/rekonštituovania nezabráni riziku mikrobiálnej kontaminácie, liek sa má použiť okamžite. Ak sa nepoužije okamžite, za dobu a podmienky uchovávania lieku pripraveného na použitie pred jeho použitím zodpovedá používateľ.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote neprevyšujúcej 25 °C.
Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah baleniaJedno balenie Octaplexu obsahuje:
- Prášok je v injekčnej liekovke (sklo typ I) s halobutylovou gumovou zátkou a odlomiteľným Al krytom.
- 40 ml vody na injekciu je v injekčnej liekovke (sklo typ I) s halobutylovou gumovou zátkou a odlomiteľným Al krytom.
- jedna transfer súprava Mix2Vial™.
6.6 Pokyny na použitie a zaobchádzanie s liekom a likvidáciuČítajte pozorne všetky inštrukcie a dôsledne ich dodržiavajte!
Počas celého postupu uvedeného nižšie sa musia zachovať aseptické podmienky!
Liek sa rýchlo rozpúšťa pri izbovej teplote.
Roztok musí byť číry a mierne opalizujúci. Nepoužívajte roztoky, ktoré sú zakalené alebo obsahujú usadeniny. Rekonštituované lieky treba pred podaním vizuálne skontrolovať, či neobsahujú čiastočky alebo nie sú zafarbené.
Po rekonštitúcii sa roztok musí ihneď použiť.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Návod na rekonštitúciu:1. V prípade potreby nechajte rozpúšťadlo (voda na injekciu) a prášok uzavretý v injekčnej liekovke dosiahnuť izbovú teplotu. Túto teplotu treba dodržiavať počas celého procesu rekonštitúcie.
Ak sa na zohrievanie používa vodný kúpeľ, treba dbať, aby nedošlo ku kontaktu vody a krytu injekčných liekoviek alebo gumenej zátky. Teplota vodného kúpeľa nemá presiahnuť 37 °C.
2. Odstráňte kryt z injekčnej liekovky s práškom a z injekčnej liekovky s vodou a gumové zátky vyčistite alkoholovým tampónom.
3.
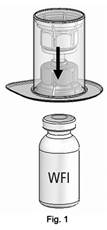
Odlepte uzáver vonkajšieho balenia zariadenia Mix2Vial
TM.Položte injekčnú liekovku s rozpúšťadlom na rovný povrch a pevne ju podržte. Umiestnite modrú časť zariadenia Mix2Vial™ na hornú časť injekčnej liekovky s rozpúšťadlom a zatlačte pevne nadol, až kým nezacvakne (obrázok 1). Držte injekčnú liekovku a opatrne odstráňte vonkajší obal zo zariadenia Mix2Vial
TM, pričom dávajte pozor, aby zariadenie Mix2Vial
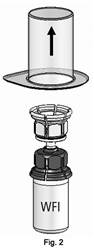
TM zostalo pevne pripevnené k injekčnej liekovke (obrázok 2).
4. Položte injekčnú liekovku s práškom na rovný povrch a pevne ju podržte. Vezmite injekčnú liekovku s rozpúšťadlom s pripojeným zariadením Mix2Vial™ a prevráťte ju hore dnom. Umiestnite transparentnú časť na hornú časť injekčnej liekovky s práškom a zatlačte pevne nadol, až kým nezacvakne (obr. 3). Rozpúšťadlo pretečie automaticky do injekčnej liekovky s práškom.
| 
|
5. S obomi injekčnými liekovkami, stále pripojenými, jemne premiešajte injekčnú liekovku s práškom, až kým sa liek nerozpustí.
Octaplex sa pri izbovej teplote rozpúšťa rýchlo na bezfarebný až bledo modrý roztok. Rozskrutkujte zariadenie Mix2Vial™ na dve časti (obr. 4).
Zlikvidujte prázdnu injekčnú liekovku s rozpúšťadlom s modrou časťou zariadenia Mix2Vial™.
| 
|
Ak sa prášok úplne nerozpustí alebo sa vytvoria zrazeniny, liek sa nesmie použiť.
Pokyny na infúziu:Ako preventívne opatrenie je potrebné pred podaním a počas infúzie skontrolovať pulz pacienta. Ak sa vyskytne značné zvýšenie pulzu, rýchlosť podávania infúzie sa musí spomaliť alebo sa musí podávanie prerušiť.
1. Nasaďte injekčnú striekačku 40 ml na transparentnú časť zariadenia Mix2Vial™. Otočte injekčnú liekovku hore dnom a natiahnite roztok do injekčnej striekačky.
Po prenesení roztoku pevne podržte piest injekčnej striekačky (držte ho smerom nadol) a odstráňte injekčnú striekačku zo zariadenia Mix2Vial™. Zlikvidujte zariadenie Mix2Vial™ a prázdnu injekčnú liekovku.
2. Dezinfikujte miesto aplikácie alkoholovým tampónom.
3. Vstreknite roztok pomaly intravenózne: na úvod je rýchlosť 1 ml/minútu, potom nesmie prekročiť 2 – 3 ml/minútu.
Do injekčnej striekačky sa nesmie dostať žiadna krv kvôli riziku tvorby fibrínových zrazenín. Zariadenie Mix2Vial™ je určené iba na jedno použitie.
7. Držiteľ rozhodnutia o registrácii:
Octapharma (IP) Limited
The Zenith Building
26 Spring Gardens
Manchester M2 1AB
Veľká Británia
8. Registračné číslo
75/0205/16-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU
07/2016