
; 50 000/mm3
alebo pokiaľ sa počet trombocytov neupraví
na ≥ 50 000/mm3, je potrebné prehodnotiť podanie konsolidačnej liečby a vykonať BMA na opätovné posúdenie stavu pacienta.
Perzistentná neutropénia · Ak sa počet neutrofilov neupraví do 14 dní odo dňa plánovaného začiatku konsolidačnej fázy na viac ako
500/mm3 (14 dní po hematologickom zotavení po predchádzajúcom cykle), ukončite podávanie lieku
MYLOTARG (nepodávajte MYLOTARG v konsolidačných

cykloch).
Skratky: AML = akútna myeloblastová leukémia; AraC = cytarabín; BMA = aspirácia kostnej drene, DNR = daunorubicín.
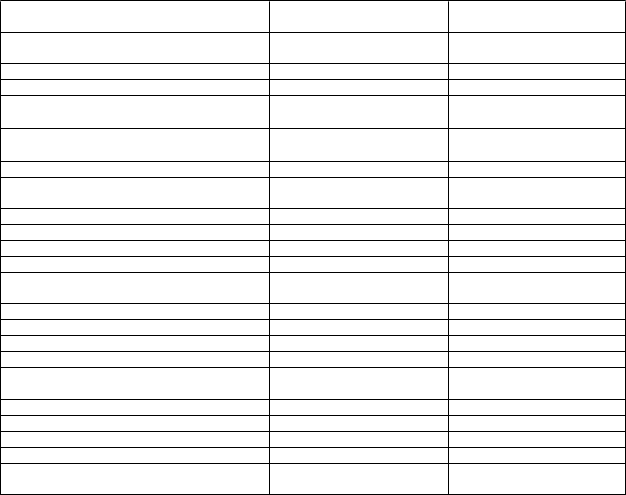
Tabuľka 4. Úpravy dávkovania pri nehematologických toxicitách
Nehematologické toxicity Úpravy dávkovania
VOD/SOS Ukončite podávanie lieku MYLOTARG (pozri časť 4.4).
Hladina celkového bilirubínu
> 2 × ULN a hladina AST
a/alebo ALT > 2,5 × ULN
Odložte podanie lieku MYLOTARG do úpravy hladiny celkového bilirubínu na ≤ 2 × ULN a hladiny AST a ALT na ≤ 2,5 × ULN pred podaním každej dávky.
Zvážte vynechanie plánovanej dávky, ak je oneskorená viac ako 2 dni medzi sekvenčnými infúziami.

Reakcie súvisiace s infúziou Prerušte infúziu a v závislosti od závažnosti príznakov začnite zodpovedajúci lekársky manažment. Pacienti musia byť monitorovaní do kým prejavy a príznaky úplne nevymiznú a infúzia môže pokračovať.
Pri závažných alebo život ohrozujúcich reakciách na infúziu zvážte trvalé ukončenie liečby (pozri časť 4.4).
Iné závažné alebo život ohrozujúce nehematologické toxicity
Odložte liečbu liekom MYLOTARG do zotavenia na nie horší ako mierny stupeň závažnosti.
Zvážte vynechanie plánovanej dávky, ak je oneskorená viac ako 2 dni medzi sekvenčnými infúziami.
Skratky: ALT = alanínaminotransferáza; AST = aspartátaminotransferáza; SOS = sínusoidný obštrukčný syndróm; ULN = horná hranica normy; VOD = venookluzívna choroba.
Špeciálnepopulácie
Použitie u pacientov s poruchou funkcie pečene
U pacientov s poruchou funkcie pečene definovanou ako hladina celkového bilirubínu ≤ 2 × horná hranica normy (ULN) a hladina aspartátaminotransferázy (AST)/alanínaminotransferázy (ALT) ≤ 2,5 × ULN sa nevyžaduje žiadna úprava počiatočnej dávky. Odložte podanie lieku MYLOTARG do úpravy hladiny celkového bilirubínu na ≤ 2 × ULN a hladiny AST a ALT na ≤ 2,5 × ULN pred podaním každej dávky (pozri tabuľku 4 a časti 4.4 a 5.2).
Použitie u pacientov s poruchou funkcie obličiek
U pacientov s miernou až stredne závažnou poruchou funkcie obličiek nie je potrebná žiadna úprava dávkovania. Liek MYLOTARG nebol študovaný u pacientov so závažnou poruchou funkcie obličiek. Liek MYLOTARG nie je vylučovaný obličkami, farmakokinetika u pacientov so závažnou poruchou funkcie obličiek nie je známa (pozri časť 5.2).
Staršie osoby
U starších osôb (≥ 65 rokov) nie je potrebná žiadna úprava dávkovania (pozri časť 5.2).
Pediatrická populácia
Bezpečnosť a účinnosť lieku MYLOTARG u pacientov mladších ako 15 rokov nebola stanovená.
V súčasnosti dostupné údaje sú opísané v častiach 4.8, 5.1 a 5.2, ale neumožňujú uviesť odporúčania na dávkovanie.
Spôsob podávania
Liek MYLOTARG je určený na intravenózne použitie a musí byť pred podaním rekonštituovaný a zriedený
(pozri časť 6.6). Rekonštituovaný a zriedený roztok sa má podávať intravenózne infúziou počas 2 hodín
za podrobného klinického monitorovania zahŕňajúceho monitorovanie pulzu, krvného tlaku a teploty. Liek
MYLOTARG sa nesmie podávať vo forme pretlakovej infúzie (tzv. i.v. push) ani intravenóznej bolusovej injekcie (pozri časť 6.6).
Pokyny na rekonštitúciu a riedenie lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Hepatotoxicita vrátanevenookluzívnejchorobypečene/sínusoidnéhoobštrukčnéhosyndrómu(VOD/SOS)
U pacientov liečených liekom MYLOTARG bola hlásená hepatotoxicita vrátane život ohrozujúceho
a niekedy smrteľného zlyhania pečene a VOD/SOS (pozri časť 4.8).
Na základe analýzy možných rizikových faktorov majú dospelí pacienti, ktorým bol podávaný liek MYLOTARG ako monoterapia buď pred alebo po transplantácii hematopoetických kmeňových buniek (HSCT), a pacienti so strednou alebo závažnou poruchou funkcie pečene zvýšené riziko rozvoja VOD (pozri časť 4.8).
Kvôli riziku VOD/SOS je potrebné pozorne sledovať prejavy a príznaky VOD/SOS. Môže medzi ne patriť zvýšenie hladiny ALT, AST, celkového bilirubínu a alkalickej fosfatázy, ktoré je potrebné sledovať
pred každou dávkou lieku MYLOTARG, hepatomegália (ktorá môže byť bolestivá), rýchly prírastok
hmotnosti a ascites. Monitorovanie iba hladiny celkového bilirubínu nemusí identifikovať všetkých pacientov, ktorým hrozí riziko VOD/SOS. U pacientov, u ktorých sa objavia abnormálne výsledky pečeňových testov, sa odporúča častejšie monitorovanie hodnôt pečeňových testov a klinických prejavov
a príznakov hepatotoxicity. U pacientov, ktorí pokračujú s HSCT, sa počas obdobia po HSCT podľa potreby odporúča podrobné sledovanie výsledkov pečeňových testov. Nezistila sa žiadna definitívna súvislosť medzi
VOD a časom HSCT vo vzťahu k vyšším dávkam lieku MYLOTARG pri monoterapii, avšak štúdia ALFA-
0701 odporúča, aby medzi poslednou dávkou lieku MYLOTARG a HSCT uplynuli 2 mesiace.
Manažment prejavov alebo príznakov hepatálnej toxicity môže vyžadovať prerušenie dávky alebo ukončenie podávania lieku MYLOTARG (pozri časť 4.2). U pacientov, u ktorých dôjde k VOD/SOS, musí byť podávanie lieku MYLOTARG ukončené a pacienti musia byť liečení podľa štandardnej lekárskej praxe.
Reakcie súvisiacesinfúziou(vrátaneanafylaxie)
V klinických štúdiách boli hlásené reakcie súvisiace s infúziou vrátane anafylaxie (pozri časť 4.8).
Po uvedení lieku na trh boli hlásené smrteľné reakcie na infúziu. Prejavy a príznaky reakcií súvisiacich
s infúziou môžu zahŕňať horúčku a zimnicu a menej často hypotenziu, tachykardiu a respiračné príznaky, ktoré sa môžu vyskytnúť počas prvých 24 hodín po podaní. Infúzia lieku MYLOTARG musí byť podávaná
za podrobného klinického monitorovania zahŕňajúceho monitorovanie pulzu, krvného tlaku a teploty.
1 hodinu pred podaním dávky lieku MYLOTARG sa odporúča premedikácia kortikosteroidmi, antihistaminikami a acetaminofénom (alebo paracetamolom) (pozri časť 4.2). V prípade rozvoja závažných
reakcií u pacientov, obzvlášť dýchavičnosti, bronchospazmu alebo klinicky významnej hypotenzie, je
potrebné infúziu ihneď prerušiť. Pacientov je potrebné monitorovať do úplného vymiznutia prejavov a príznakov. U pacientov, u ktorých sa rozvinú prejavy alebo príznaky anafylaxie vrátane závažných respiračných príznakov alebo klinicky významnej hypotenzie je potrebné dôkladne zvážiť ukončenie liečby (pozri časť 4.2).
Myelosupresia
V klinických štúdiách boli hlásené neutropénia, trombocytopénia, anémia, leukopénia, febrilná neutropénia,
lymfopénia a pancytopénia, z ktorých niektoré boli život ohrozujúce alebo smrteľné (pozri časť 4.8). Komplikácie súvisiace s neutropéniou môžu zahŕňať infekcie a komplikácie súvisiace s trombocytopéniou krvácavé/hemoragické reakcie. Boli hlásené infekcie a krvácavé/hemoragické reakcie, z ktorých niektoré boli život ohrozujúce alebo smrteľné.
Pred každou dávkou lieku MYLOTARG je potrebné vyšetriť úplný krvný obraz. Počas liečby je potrebné u pacientov sledovať prejavy a príznaky infekcie, krvácania/hemorágie alebo iných následkov myelosupresie. Počas liečby a po liečbe je indikované bežné klinické a laboratórne kontrolné testovanie.
Manažment pacientov so závažnou infekciou, krvácaním/hemorágiou alebo inými následkami myelosupresie vrátane závažnej neutropénie alebo perzistentnej trombocytopénie môže vyžadovať odloženie dávky alebo trvalé ukončenie podávania lieku MYLOTARG (pozri časť 4.2).
Syndróm nádorovéhorozpadu(TLS,tumorlysissyndrome)
V klinických štúdiách bol hlásený TLS (pozri časť 4.8). Po uvedení lieku na trh boli hlásené smrteľné
prípady TLS komplikovaného akútnym zlyhaním obličiek. U pacientov s AML s hyperleukocytózou je
pred podaním lieku MYLOTARG potrebné za účelom zníženia rizika vyvolania TLS zvážiť leukoredukciu s hydroxymočovinou alebo pomocou leukaferézy, aby sa počet periférnych leukocytov znížil na menej ako
30 000/mm3 (pozri časť 4.2).
U pacientov je potrebné sledovať prejavy a príznaky TLS a liečiť ich podľa štandardnej lekárskej praxe. Na prevenciu vzniku hyperurikémie súvisiacej s rozpadom nádoru musia byť prijaté primerané opatrenia, ako je hydratácia, podávanie antihyperurikemických liekov (napr. alopurinolu) alebo iných liekov na liečbu hyperurikémie (napr. rasburikázy).
AML snepriaznivoucytogenetikou
Účinnosť lieku MYLOTARG sa preukázala u AML pacientov s priaznivou a so stredne nepriaznivou
cytogenetikou, s neistotou ohľadom miery účinku u pacientov s nepriaznivou cytogenetikou (pozri časť 5.1). U pacientov, u ktorých sa novo diagnostikovaná de novo AML lieči liekom MYLOTARG v kombinácii
s daunorubicínom a cytarabínom, je nutné po získaní výsledkov cytogenetických testov zvážiť, či
potenciálny prospech z pokračovania v liečbe liekom MYLOTARG, prevažuje nad rizikami pre daného pacienta (pozri časť 5.1).
Antikoncepcia
Ženám vo fertilnom veku alebo partnerom žien vo fertilnom veku je potrebné odporučiť, aby počas liečby
liekom MYLOTARG používali 2 metódy účinnej antikoncepcie najmenej 7 mesiacov (ženy) alebo 4 mesiace
(muži) po poslednej dávke (pozri časť 4.6).
4.5 Liekové a iné interakcie
S liekom MYLOTARG neboli vykonané žiadne klinické štúdie na liekové interakcie. Pre dostupné údaje z in vitro štúdií pozri časť 5.2.
4.6 Fertilita, gravidita a laktácia
Ženy vofertilnomveku/antikoncepciaumužovažien
Ženy vo fertilnom veku musia byť poučené, aby sa počas užívania lieku MYLOTARG vyhli tehotenstvu.
Ženy vo fertilnom veku alebo partneri žien vo fertilnom veku musia byť poučení, aby počas liečby liekom MYLOTARG používali 2 metódy účinnej antikoncepcie najmenej 7 mesiacov (ženy) alebo 4 mesiace (muži) po poslednej dávke.
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití gemtuzumab ozogamicínu
u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3).
Liek MYLOTARG sa nesmie používať počas gravidity, pokiaľ potenciálny prínos pre matku neprevažuje nad potenciálnymi rizikami pre plod. Gravidné ženy alebo pacientky, ktoré otehotnejú počas užívania gemtuzumab ozogamicínu alebo liečení pacienti mužského pohlavia, ktorí sú partnermi gravidných žien, musia byť oboznámení s potenciálnym rizikom pre plod.
Dojčenie
Nie sú k dispozícii žiadne informácie o prítomnosti gemtuzumab ozogamicínu alebo jeho metabolitov
v ľudskom mlieku, účinkoch na dojčené dieťa ani účinkoch na tvorbu mlieka. Kvôli možným nežiaducim reakciám u dojčených detí nesmú ženy počas liečby liekom MYLOTARG a aspoň 1 mesiac po poslednej dávke dojčiť (pozri časť 5.3).
Fertilita
Nie sú k dispozícii žiadne informácie o fertilite u pacientov. Na základe neklinických nálezov môže byť
liečbou gemtuzumab ozogamicínom narušená fertilita u mužov a žien (pozri časť 5.3). Muži aj ženy majú pred liečbou vyhľadať poradenstvo ohľadom zachovania fertility.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek MYLOTARG má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti musia byť poučení, že počas liečby liekom MYLOTARG môžu pociťovať únavu, závrat a bolesť hlavy (pozri časť 4.8). Preto je potrebná pri vedení vozidiel alebo obsluhe strojov opatrnosť.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Celkový bezpečnostný profil lieku MYLOTARG je založený na údajoch od pacientov s akútnou
myeloblastovou leukémiou zo štúdie s kombinovanou liečbou ALFA-0701, štúdií s monoterapiou a zo skúseností po uvedení lieku na trh. V štúdii s kombinovanou liečbou údaje o bezpečnosti pozostávajúce z vybraných nežiaducich účinkov vyskytujúcich sa počas liečby (TEAE), ktoré boli považované za
najdôležitejšie pre pochopenie bezpečnostného profilu lieku MYLOTARG, pozostávali z krvácaní a VOD
všetkých stupňov a závažných infekcií. Všetky tieto TEAE boli stanovené ako nežiaduce liekové reakcie.
Z dôvodu tohto obmedzeného súboru údajov sú laboratórne údaje zo štúdie s kombinovanou liečbou uvedené v Tabuľke 5. Informácie o nežiaducich reakciách lieku zo štúdií s monoterapiou a skúseností po uvedení
lieku na trh sú uvedené v Tabuľke 6 s cieľom poskytnúť úplnú charakterizáciu nežiaducich reakcií.
V štúdii s kombinovanou liečbou ALFA-0701 boli klinicky významné závažné nežiaduce reakcie hepatotoxicita vrátane VOD/SOS (3,8 %), krvácanie (9,9 %), závažná infekcia (41,2 %) a syndróm nádorového rozpadu (1,5 %). V štúdiách s monoterapiou patrili medzi klinicky významné závažné nežiaduce reakcie aj reakcie súvisiace s infúziou (2,5 %), trombocytopénia (21,7 %) a neutropénia (34,3 %).
Najčastejšie nežiaduce reakcie (> 30 %) v štúdii s kombinovanou liečbou boli krvácanie a infekcia.
V štúdiách s monoterapiou zahŕňali najčastejšie nežiaduce reakcie (> 30 %) pyrexiu, nauzeu, infekciu, zimnicu, krvácanie, vracanie, trombocytopéniu, únavu, bolesť hlavy, stomatitídu, hnačku, bolesť brucha a neutropéniu.
Najčastejšie nežiaduce reakcie (≥ 1 %), ktoré viedli k trvalému ukončeniu liečby v štúdii s kombinovanou liečbou, boli trombocytopénia, VOD, krvácanie a infekcia. Najčastejšie nežiaduce reakcie (≥ 1 %), ktoré viedli k trvalému ukončeniu liečby v štúdiách s monoterapou, boli infekcia, krvácanie, multiorgánové zlyhanie a VOD.
Tabuľkový zoznamnežiaducichreakciíNežiaduce reakcie sú uvedené podľa triedy orgánových systémov (SOC) a kategórií frekvencie definovaných
pomocou nasledujúcej konvencie: veľmi časté (³ 1/10), časté (³ 1/100 až < 1/10), menej časté (³ 1/1 000
až < 1/100), zriedkavé (³ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V každej skupine frekvencie sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
 Tabuľka 5. Vybrané** nežiaduce reakcie u pacientov, ktorí dostávali liek MYLOTARG v štúdii s kombinovanou liečbou (ALFA-0701)
Tabuľka 5. Vybrané** nežiaduce reakcie u pacientov, ktorí dostávali liek MYLOTARG v štúdii s kombinovanou liečbou (ALFA-0701)
Tried
a orgánových systémov
Fr
ekvencia
MYLOTARG + daunorubicín
+ cytarabín (N = 131)
daunorubicín
+ cytarabín (N = 137)
Preferovan
ý termín
Infekcie a nákazy
Veľmi časté
Všetky stupne
%
Stupeň 3/4
%
Všetky stupne
%
Stupeň 3/4
%
Infekcia*a 77,9 76,3 77,4 74,4
Poruchy ciev
Veľmi časté
Krvácanie*b 90,1 20,6 78,1 8,8
Poruchy pečene a žlčových ciest
Časté
Venookluzívna choroba pečene*c
Laboratórne a funkčné vyšetrenia
***
Veľmi časté
4,6 2,3 1,5 1,5
Znížená hladina hemoglobínu 100 86,2 100 89,7
Znížený počet trombocytov 100 100 100 100
Znížený počet leukocytov 100 100 99,3 99,3
Znížený počet (absolútny)
lymfocytov
98,5 90,7 97,8 89,6
Znížený počet neutrofilov 97,7 96,1 98,5 97,0
Hyperglykémia 92,0 19,2 91,1 17,8
Zvýšená hladina aspartátaminotransferázy (AST)
89,2 14,0 73,9 9,0
Predĺžený protrombínový čas 84,8 3,3 89,1 0
Predĺžený aktivovaný parciálny tromboplastínový čas
Zvýšená hladina alkalickej fosfatázy
Zvýšená hladina alanínaminotransferázy (ALT)
80,0 6,4 57,5 5,5
79,7 13,3 68,9 5,3
78,3 10,9 81,3 15,7
Zvýšená hladina bilirubínu v krvi 51,6 7,1 50,8 3,8
Hyperurikémia 32,5 2,6 28,5 0
Skratky: N = počet pacientov; PT = preferovaný termín.
*Vrátane smrteľného následku.
**V tejto štúdii s novodiagnostikovanou AML boli zozbierané iba vybrané údaje o bezpečnosti.
***Frekvencia je založená na laboratórnych hodnotách (stupeň podľa NCI CTCAE v4.03).
a. Infekcia zahŕňa sepsu a bakteriémiu (53,4 %), mykotickú infekciu (15,3 %), infekciu dolných dýchacích ciest (5,3 %), bakteriálnu infekciu (9,2 %), gastrointestinálnu infekciu (8,4 %), infekciu kože (2,3 %) a iné infekcie (28,4 %).
b. Krvácanie zahŕňa krvácanie do centrálneho nervového systému (3,1 %), krvácanie do hornej časti gastrointestinálneho traktu (33,6 %), krvácanie do dolnej časti gastrointestinálneho traktu (17,6 %), krvácanie do podkožia (60,3 %), iné krvácanie (64,9 %) a krvácanie z nosa (62,6 %).
c. Venookluzívna choroba pečene zahŕňa nasledujúce hlásené PT: venookluzívna choroba a venookluzívna choroba pečene*.
 Tabuľka 6. Nežiaduce reakcie u pacientov, ktorí dostávali liek MYLOTARG v štúdiách s monoterapiou
***
, a nežiaduce reakcie hlásené po uvedení na trh
Tabuľka 6. Nežiaduce reakcie u pacientov, ktorí dostávali liek MYLOTARG v štúdiách s monoterapiou
***
, a nežiaduce reakcie hlásené po uvedení na trh
Tried
a orgánových systémov
Frekvencia
Preferovan
ý termín
Infekcie a nákazy
Veľmi časté
Všetky stupne
%
Stupeň 3/4
%
Infekcia*a 68,2 32,8
Poruchy krvi a lymfatického systému
Veľmi časté
Febrilná neutropénia 19,1 11,6
Trombocytopéniab 48,4 48,0
Neutropéniac 30,3 29,2
Anémiad 27,1 24,2
Leukopéniae 26,7 26,7
Časté
Pancytopéniaf 5,0 4,3
Lymfopéniag 3,6 3,2
Poruchy imunitného systému
Časté
Reakcia súvisiaca s infúziouh 7,6 3,6
Poruchy metabolizmu a výživy
Veľmi časté
Hyperglykémiai 11,2 6,9
Znížená chuť do jedla 27,1 6,1
Časté
Syndróm nádorového rozpadu** 2,5 1,8
Poruchy nervového systému
Veľmi časté
Bolesť hlavy 38,3 12,3
Poruchy srdca a srdcovej činnosti
Veľmi časté
Tachykardiaj 13,0 4,3
Poruchy ciev
Veľmi časté
Krvácanie*k 67,1 23,8
Hypotenzial 20,2 14,8
Hypertenziam 17,3 10,5
Poruchy dýchacej sústavy, hrudníka a mediastína
Veľmi časté
Dyspnoen 27,4 12,6
Neznáme
Intersticiálna pneumónia*
Poruchy gastrointestinálneho traktu
Veľmi časté
Vracanie 60,6 33,6
Hnačka 33,9 14,8
Bolesť bruchao 33,2 7,2
Nevoľnosť 71,1 39,3
Stomatitídap 36,1 12,3
Zápcha 25,3 5,0
Časté
Ascites 2,9 0,4
Dyspepsia 8,7 1,1
Ezofagitída 1,8 0,7
Neznáme
Neutropenická kolitída*
Poruchy pečene a žlčových ciest
Veľmi časté
Zvýšené hladiny transaminázq 24,5 18,8
Hyperbilirubinémiar 13,0 10,5
Časté
Tried
a orgánových systémov
Frekvencia
Preferovan
ý termín
Všetky stupne
%
Stupeň 3/4
%
Venookluzívna choroba pečene*s 2,9 1,1
Hepatomegália 2,5 0,7
Žltačka 2,2 1,1
Abnormálna funkcia pečenet 2,5 1,4
Zvýšená hladina gamma- glutamyltransferázy
Menej časté
1,8 0,7
Zlyhanie pečene*# 0,4 0,4
Buddov-Chiariho syndróm# 0,4 0,4
Poruchy kože a podkožného tkaniva
Veľmi časté
Vyrážkau 19,9 5,8
Časté
Erytémv 9,4 2,2
Pruritus 5,4 0,4
Poruchy obličiek a močových ciest
Neznáme
Hemoragická cystitída*
Celkové poruchy a reakcie v mieste podania
Veľmi časté
Pyrexiaw 82,7 52,3
Edémx 21,3 3,2
Únavay 41,2 11,2
Zimnica 67,9 17,3
Časté
Multiorgánové zlyhanie* 2,2 1,8
Laboratórne a funkčné vyšetrenia
Veľmi časté
Zvýšená hladina laktátdehydrogenázy v krvi
Časté
Zvýšená hladina alkalickej fosfatázy v krvi
*Vrátane smrteľného následku.
16,6 7,2
8,7 6,1

**Vrátane smrteľných nežiaducich reakcií po uvedení lieku na trh.
***Liek MYLOTARG v liečbe relapsujúcej AML (9 mg/m2).
#Jednotlivé prípady.
Skratka: PT = preferované termíny.
a. Infekcia zahŕňa sepsu a bakteriémiu (25,6 %), mykotickú infekciu (10,5 %), infekciu dolných dýchacích ciest (13,0 %), infekciu horných dýchacích ciest (4,3 %), bakteriálnu infekciu (3,6 %), vírusovú infekciu (24,2 %), gastrointestinálnu infekciu (3,3 %), infekciu kože (7,9 %) a iné infekcie (19,5 %). Po uvedení lieku na trh boli taktiež hlásené (kategória frekvencie neznáma) mykotické infekcie pľúc vrátane pľúcnej mykózy a pneumónie spôsobenej
mikroorganizmom Pneumocystis jirovecii* a bakteriálne infekcie vrátane infekcie baktériou Stenotrophomonas.
b. Trombocytopénia zahŕňa nasledujúce hlásené PT: znížený počet trombocytov a trombocytopéniu*.
c. Neutropénia zahŕňa nasledujúce hlásené PT: neutropéniu, granulocytopéniu a znížený počet neutrofilov.
d. Anémia zahŕňa nasledujúce hlásené PT: anémiu a zníženú hladinu hemoglobínu.
e. Leukopénia zahŕňa nasledujúce hlásené PT: leukopéniu a znížený počet leukocytov.
f. Pancytopénia zahŕňa nasledujúce hlásené PT: pancytopéniu a zlyhanie kostnej drene.
g. Lymfopénia zahŕňa nasledujúce hlásené PT: lymfopéniu a znížený počet lymfocytov.
h. Reakcia súvisiaca s infúziou zahŕňa nasledujúce hlásené PT: reakciu súvisiacu s infúziou, urtikáriu, precitlivenosť, bronchospazmus, precitlivenosť na lieky a urtikáriu v mieste vpichu#.
i. Hyperglykémia zahŕňa nasledujúce hlásené PT: hyperglykémiu a zvýšenú hladinu glukózy v krvi#.
j. Tachykardia zahŕňa nasledujúce hlásené PT: tachykardiu, sínusovú tachykardiu, zrýchlenú frekvenciu srdca#
a supraventrikulárnu tachykardiu#.
k. Krvácanie zahŕňa krvácanie do centrálneho nervového systému (5,1 %), krvácanie do hornej časti gastrointestinálneho traktu (21,3 %), krvácanie do dolnej časti gastrointestinálneho traktu (15,2 %), krvácanie do podkožia (28,5 %), iné krvácanie (32,9 %) a krvácanie z nosa (28,5 %).
l. Hypotenzia zahŕňa nasledujúce hlásené PT: hypotenziu a znížený krvný tlak.
m. Hypertenzia zahŕňa nasledujúce hlásené PT: hypertenziu a zvýšený krvný tlak.
n. Dýchavičnosť zahŕňa nasledujúce hlásené PT: dýchavičnosť a námahovú dýchavičnosť.
o. Bolesť brucha zahŕňa nasledujúce hlásené PT: bolesť brucha, bolesť v hypogastriu, bolesť v epigastriu, brušný diskomfort a citlivosť brucha.
Tried
a orgánových systémov
Frekvencia
Preferovan
ý termín
Všetky stupne
 %
Stupeň 3/4
%
%
Stupeň 3/4
%
p. Stomatitída zahŕňa nasledujúce hlásené PT: zápal slizníc, orofaryngeálnu bolesť, stomatitídu, ulceráciu v ústnej dutine, bolesť ústnej dutiny, pľuzgiere na sliznici úst, aftóznu stomatitídu, ulceráciu jazyka, bolesť jazyka, orálny
slizničný erytém, glositídu# a orofaryngeálne pľuzgiere#.
q. Zvýšené hladiny transamináz zahŕňajú nasledujúce hlásené PT: zvýšené hladiny transamináz, hepatocelulárne poškodenie, zvýšenú hladinu alanínaminotransferázy, zvýšenú hladinu aspartátaminotransferázy a zvýšené hladiny pečeňových enzýmov.
r. Hyperbilirubinémia zahŕňa nasledujúce hlásené PT: zvýšenú hladinu bilirubínu v krvi a hyperbilirubinémiu.
s. Venookluzívna choroba pečene zahŕňa nasledujúce hlásené PT: venookluzívnu chorobu a venookluzívnu chorobu pečene*#.
t. Abnormálna funkcia pečene zahŕňa nasledujúce hlásené PT: abnormálne výsledky pečeňových testov a abnormálna
funkcia pečene.
u. Vyrážka zahŕňa nasledujúce hlásené PT: vyrážku, dermatitídu#, alergickú dermatitídu#, bulóznu dermatitídu, kontaktnú dermatitídu, exfoliatívnu dermatitídu#, liekový kožný výsev, alergický pruritus# a erytematóznu vyrážku#, makulárnu vyrážku#, makulopapulárnu vyrážku, papulárnu vyrážku, pruritickú vyrážku, vezikulárnu vyrážku#.
v. Erytém zahŕňa nasledujúce hlásené PT: erytém v mieste zavedenia katétra, erytém a erytém v mieste infúzie#.
w. Pyrexia zahŕňa nasledujúce hlásené PT: pyrexiu, zvýšenú telesnú teplotu a hypertermiu.
x. Edém zahŕňa nasledujúce hlásené PT: edém, edém tváre, periférny edém, opuch tváre, generalizovaný edém a periorbitálny edém.
y. Únava zahŕňa nasledujúce hlásené PT: únavu, asténiu, letargiu a malátnosť.
Opisvybranýchnežiaducichreakcií
Hepatotoxicita vrátane VOD/SOS pečene
V štúdii s kombinovanou liečbou boli zaznamenané prípady VOD a laboratórne odchýlky pečeňových testov. Ďalšia charakterizácia hepatotoxických nežiaducich reakcií je poskytnutá zo štúdií s monoterapiou.
V štúdii s kombinovanou liečbou (N = 131) bola VOD hlásená u 6 (4,6 %) pacientov počas alebo po liečbe,
2 (1,5 %) z týchto reakcií boli smrteľné (pozri tabuľku 5). K piatim (3,8 %) týmto VOD reakciám došlo do 28 dní od akejkoľvek dávky gemtuzumab ozogamicínu. Jedna udalosť VOD sa vyskytla po viac ako
28 dňoch od poslednej dávky gemtuzumab ozogamicínu a jedna z týchto udalostí sa vyskytla niekoľko dní
po začatí prípravného režimu pred HSCT. Medián času od poslednej dávky gemtuzumab ozogamicínu
do začiatku VOD bol 9 dní (rozsah: 2 – 298 dní). VOD bola taktiež hlásená aj u 2 pacientov, ktorí dostávali liek MYLOTARG ako následnú liečbu po relapse AML po chemoterapii v kontrolnom ramene štúdie s
kombinovanou liečbou. Obaja títo pacienti mali VOD viac ako 28 dní po poslednej dávke gemtuzumab
ozogamicínu. Jeden z týchto pacientov mal VOD 25 dní po následnej HSCT.
Na základe analýzy možných rizikových faktorov bola u dospelých pacientov, ktorým bol podávaný liek MYLOTARG ako monoterapia, a pacientov, ktorí podstúpili HSCT pred expozíciou gemtuzumab ozogamicínu, 2,6-násobne vyššia pravdepodobnosť (95 % CI: 1,448; 4,769) rozvoja VOD v porovnaní
s pacientmi, ktorí nepodstúpili HSCT pred liečbou gemtuzumab ozogamicínom. U pacientov, ktorí podstúpili
HSCT po liečbe gemtuzumab ozogamicínom, bola 2,9-násobne vyššia pravdepodobnosť (95 % CI:
1,502; 5,636) rozvoja VOD v porovnaní s pacientmi, ktorí nepodstúpili HSCT po liečbe s gemtuzumab ozogamicínom. U pacientov so strednou/závažnou poruchou funkcie pečene pri vstupe do štúdie bola 8,7-
krát vyššia pravdepodobnosť (95 % CI: 1,879; 39,862) rozvoja VOD v porovnaní s pacientmi
bez strednej/závažnej poruchy funkcie pečene pri vstupe do štúdie.
Pacienti musia byť sledovaní na hepatotoxicitu, ako je odporúčané v časti 4.4. Manažment prejavov alebo príznakov hepatálnej toxicity môže vyžadovať prerušenie dávky alebo ukončenie podávania lieku MYLOTARG (pozri časť 4.2).
Myelosupresia
V štúdii s kombinovanou liečbou u pacientov s predtým neliečenou de novo AML, ktorí boli liečení frakcionovanými dávkami gemtuzumab ozogamicínu v kombinácii s chemoterapiou, bolo pozorované zníženie počtu leukocytov stupňa 3/4 u 131 (100 %) pacientov, zníženie počtu neutrofilov stupňa 3/4 u 124 (96,1 %) pacientov a zníženie počtu trombocytov stupňa 3/4 u 131 (100 %) pacientov.
Počas indukčnej fázy sa u 109 (83,2 %) pacientov vrátil počet trombocytov na hodnotu 50 000/mm3
a u 99 (75,6 %) sa vrátil na hodnotu 100 000/mm3. Medián času obnovy počtu trombocytov na hodnotu
50 000/mm3 bol 34 dní a na hodnotu 100 000/mm3 35 dní. Počas konsolidačnej fázy 1 sa
u 92 (94,8 %) pacientov vrátil počet trombocytov na hodnotu 50 000/mm3 a u 71 (73,2 %) sa vrátil na hodnotu 100 000/mm3. Medián času obnovy počtu trombocytov na hodnotu 50 000/mm3 bol 32 dní a na hodnotu 100 000/mm3 35 dní. Počas konsolidačnej fázy 2 sa u 80 (97,6 %) pacientov vrátil počet trombocytov na hodnotu 50 000/mm3 a u 70 (85,4 %) sa vrátil na hodnotu 100 000/mm3. Medián času obnovy počtu trombocytov na hodnotu 50 000/mm3 bol 36,5 dní a na hodnotu 100 000/mm3 43 dní.
U 22 (20,4 %) pacientov s odpoveďou (CR a neúplná obnova počtu trombocytov [CRp]) sa vyskytla trombocytopénia s počtom trombocytov < 50 000/mm3 pretrvávajúca 45 dní po zahájení liečby. Počet pacientov s pretrvávajúcou trombocytopéniou zostal podobný v priebehu liečebných fáz (8 [7,4 %] pacientov v indukčnej fáze a 8 [8,5 %] pacientov v konsolidačnej fáze 1 a 10 [13,2 %] pacientov v konsolidačnej
fáze 2).
Počas indukčnej fázy bol u 121 (92,4 %) pacientov zdokumentovaný návrat absolútneho počtu neutrofilov (ANC – absolute neutrophil count) na 500/mm3 a u 118 (90,1 %) na 1 000/mm3. Medián času obnovy počtu neutrofilov na ANC 500/mm3 a 1 000/mm3 bol 25 dní. Počas konsolidačnej fázy 1 liečby sa u 94
(96,9 %) pacientov vrátil počet neutrofilov na hodnotu 500/mm3 a u 91 (94 %) pacientov sa vrátil na hodnotu
1 000/mm3. Medián času obnovy ANC na hodnotu 500/mm3 bol 21 dní a na hodnotu 1 000/mm3 25 dní. Počas konsolidačnej fázy 2 liečby sa u 80 (97,6 %) pacientov vrátil počet neutrofilov na hodnotu 500/mm3
a u 79 (96,3 %) pacientov sa vrátil na hodnotu 1 000/mm3. Medián času obnovy neutrofilov na hodnotu
ANC 500/mm3 bol 22 dní a na hodnotu 1 000/mm3 27 dní.
V štúdii s kombinovanou liečbou malo 102 (77,9 %) pacientov s de novo AML liečených frakcionovanými dávkami gemtuzumab ozogamicínu v kombinácii s chemoterapiou (N = 131) závažné infekcie (stupeň ≥ 3) akejkoľvek príčiny. Úmrtie súvisiace s liečbou v dôsledku septického šoku bolo hlásené
u 2 (1,5 %) pacientov. Smrteľná závažná infekcia bola hlásená u 2 (1,53 %) pacientov v ramene lieku
MYLOTARG a u 4 (2,92 %) pacientov v kontrolnom ramene.
V štúdii s kombinovanou liečbou (N = 131) boli krvácavé/hemoragické reakcie všetkých stupňov hlásené u 118 (90,1 %) a krvácavé/hemoragické príhody stupňa 3/4 u 27 (20,6 %) pacientov. Najčastejšími krvácavými/hemoragickými reakciami stupňa 3 boli epistaxa (1,5 %), hemoptýza (3,1 %) a hematúria
(2,3 %). Krvácavé/hemoragické reakcie stupňa 4 boli hlásené u 4 (3,1 %) pacientov (gastrointestinálne krvácanie, krvácanie a pľúcne alveolárne krvácanie [2 pacienti]). Smrteľné krvácavé/hemoragické reakcie
boli hlásené u 3 (2,3 %) pacientov (cerebrálny hematóm, intrakraniálny hematóm a subdurálny hematóm).
Manažment pacientov so závažnou infekciou, krvácaním/hemorágiou alebo inými následkami myelosupresie vrátane závažnej neutropénie alebo perzistentnej trombocytopénie môže vyžadovať odloženie dávky alebo trvalé ukončenie podávania lieku MYLOTARG (pozri časti 4.2 a 4.4).
Imunogenicita
Tak ako pri všetkých terapeutických proteínoch, aj tu existuje možnosť imunogenity.
V klinických štúdiách lieku MYLOTARG u pacientov s relapsujúcou alebo refraktérnou AML bola imunogenicita lieku MYLOTARG hodnotená pomocou 2 enzýmovo viazaných imunosorbentných testov (ELISA).
U pacientov v štúdiách fázy 2 sa nezačali tvoriť protilátky proti lieku (ADA, antidrug antibodies) a iba
u 2 pacientov v štúdii fázy 1 sa začali tvoriť protilátky proti komplexu kalicheamicín-spojovacia molekula, 1 z týchto účastníkov štúdie mal znížené plazmatické koncentrácie hP67.6. Celkovo bola incidencia tvorby ADA po liečbe liekom MYLOTARG < 1 % v rámci 4 klinických štúdií s údajmi o ADA. V dôsledku obmedzeného počtu pacientov s pozitívnymi ADA nie je možné vyvodiť definitívne závery medzi prítomnosťou protilátok a možným vplyvom na účinnosť a bezpečnosť.
Detekcia ADA je vysoko závislá od senzitivity a špecifickosti testu. Incidencia pozitivity protilátok v teste môže byť ovplyvnená viacerými faktormi vrátane metodológie testu, koncentrácií gemtuzumab ozogamicínu v obehu, zaobchádzania so vzorkami, času odberu vzoriek, sprievodných terapií,a základnej choroby.
Z týchto dôvodov môže byť porovnanie výskytu protilátok proti gemtuzumab ozogamicínu s výskytom protilátok proti iným liekom zavádzajúce.
Pediatrická populáciaBezpečnosť a účinnosť lieku MYLOTARG u detí a dospievajúcich mladších ako 15 rokov nebola stanovená
(pozri časť 4.2).
V dokončenej randomizovanej pediatrickej štúdii fázy 3 AAML0531 (pozri časť 5.1) skúmajúcej gemtuzumab ozogamicín v kombinácii s intenzívnou liečbou prvej línie u novodiagnostikovaných detí
a mladých dospelých s de novo AML vo veku 0 až 29 rokov bol bezpečnostný profil podobný tomu, ktorý bol pozorovaný v iných štúdiách skúmajúcich gemtuzumab ozogamicín v kombinácii s intenzívnou
chemoterapiou u dospelých pacientov s de novo AML. Avšak optimálna dávka gemtuzumab ozogamicínu pre pediatrických pacientov nebola stanovená, keďže v štúdii AAML0531 bol počas druhého intenzifikačného obdobia u väčšej časti pacientov v ramene s gemtuzumab ozogamicínom zaznamenaný
predĺžený čas obnovy počtu neutrofilov (> 59 dní) v porovnaní s porovnávacím ramenom (12,0 % oproti
6,3 %) a viac pacientov zomrelo počas remisie (4,2 % oproti 2,4 %).
Hlásenie podozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie

pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNeboli hlásené žiadne prípady predávkovania liekom MYLOTARG v klinickej praxi. Jednorazové dávky u dospelých vyššie ako 9 mg/m2 neboli testované. Liečba predávkovania liekom MYLOTARG má pozostávať zo všeobecných podporných opatrení.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antineoplastické látky, monoklonálne protilátky, ATC kód: L01XC05
Mechanizmus účinkuGemtuzumab ozogamicín je ADC namierený proti CD33. Gemtuzumab je humanizovaná protilátka
imunoglobulínovej triedy G podtypu 4 (IgG4), ktorá špecificky rozpoznáva ľudský antigén CD33. Protilátka sa špecificky viaže na antigén CD33, adhezívny proteín závislý od kyseliny sialovej, ktorý sa nachádza
na povrchu myeloidných leukemických blastov a nezrelých normálnych buniek myelomonocytového pôvodu, ale nie na normálnych krvotvorných kmeňových bunkách. Malá molekula, N-acetyl-gama-
kalicheamicín, je cytotoxický polosyntetický prírodný produkt. N-acetyl-gama-kalicheamicín je kovalentne naviazaný na protilátku pomocou spojovacej molekuly AcBut (kyselina 4-(4-acetylfenoxy)-butánová). Neklinické údaje naznačujú, že protinádorová aktivita gemtuzumab ozogamicínu je spôsobená väzbou ADC na nádorové bunky exprimujúce CD33 s následnou internalizáciou komplexu ADC-CD33 a uvoľnením
N-acetyl-gama-kalicheamicíndimetylhydrazidu vo vnútri bunky hydrolytickým štiepením spojovacej molekuly. Aktivácia N-acetyl-gama-kalicheamicíndimetylhydrazidu indukuje zlomy v dvojvláknovej DNA a následne zastavenie bunkového cyklu a apoptotickú bunkovú smrť.
Predpokladá sa, že na maximálne dodanie kalicheamicínu do leukemických blastových buniek je potrebná saturácia vysokého percenta antigénnych miest CD33. Viaceré monoterapeutické štúdie merali saturáciu
cieľa (CD33) po podaní lieku MYLOTARG u pacientov s relapsujúcou a refraktérnou AML. Vo všetkých štúdiách bola pozorovaná takmer maximálna periférna saturácia CD33 po každom podaní lieku MYLOTARG na úrovni dávky 2 mg/m² a vyšších dávok, čo naznačuje, že nízka dávka gemtuzumab ozogamicínu je dostatočná na vyviazanie všetkých dostupných miest CD33.
Klinická účinnosťabezpečnosť
Štúdia ALFA-0701 u predtým neliečených pacientov s de novo AML
Účinnosť a bezpečnosť lieku MYLOTARG boli hodnotené v multicentrickej, randomizovanej, otvorenej štúdii fázy 3 porovnávajúcej pridanie lieku MYLOTARG k štandardnému chemoterapeutickému indukčnému režimu pozostávajúcemu z daunorubicínu a cytarabínu (DA) v porovnaní so samotným DA.
Do štúdie boli zaradení pacienti vo veku 50 až 70 rokov s predtým neliečenou de novo AML (štúdia ALFA-
0701). Pacienti s akútnou promyelocytovou leukémiou (APL, AML3) a pacienti s AML, ktorá vznikla na podklade myelodysplastického syndrómu (MDS) alebo pacienti so sekundárnou AML boli zo štúdie vylúčení.
Primárnym cieľom bolo prežívanie bez príhody (EFS). Sekundárne ciele zahŕňali CR a CRp, prežívanie bez relapsu (RFS), celkové prežívanie (OS) a bezpečnosť kombinácie DA s alebo bez lieku MYLOTARG.
Celkovo bolo v tejto štúdii randomizovaných 271 pacientov, 135 bolo liečených indukčnou liečbou 3 + 7 DA
plus 3 frakcionované 3 mg/m2 dávky lieku MYLOTARG a 136 bolo liečených samotnou kombináciou 3 + 7
DA (pozri časť 4.2). Druhá fáza indukčnej liečby s DA, ale bez lieku MYLOTARG bola povolená
bez ohľadu na rameno randomizácie. Pacientom v obidvoch ramenách, ktorým nebola podaná druhá fáza indukčnej liečby a nedosiahli CR po indukcii, mohla byť podaná záchranná fáza pozostávajúca z idarubicínu, AraC a faktora stimulujúceho kolónie granulocytov (G-CSF).
Pacienti v CR alebo CRp dostali konsolidačnú liečbu v 2 fázach, ktorá zahŕňala DNR a AraC s alebo
bez lieku MYLOTARG podľa ich počiatočnej randomizácie. Pacienti, ktorí dosiahli remisiu, boli tiež vhodní na alogénnu transplantáciu. Medzi poslednou dávkou lieku MYLOTARG a transplantáciou bol odporúčaný interval najmenej 2 mesiace.
Celkovo bol medián veku pacientov 62 rokov (rozsah 50 až 70 rokov) a väčšina pacientov (87,8 %) mala vstupný výkonnostný stav podľa Eastern Cooperative Oncology Group (ECOG PS) 0 až 1. Vstupné charakteristiky boli v liečebných ramenách podobné s výnimkou pohlavia, keďže vyššie percento mužov bolo zaradených do ramena lieku MYLOTARG (54,8 %) ako do ramena len s DA (44,1 %). Celkovo bola u 59,0 % pacientov podľa klasifikácie rizika podľa National Comprehensive Cancer Network (NCCN)
a u 65,3 % pacientov podľa klasifikácie rizika podľa European LeukaemiaNet (ELN) 2010 zdokumentovaná
priaznivá/stredne riziková choroba. Expresia CD33 na AML blastoch určená prietokovou cytometriou harmonizovanou z miestnych laboratórnych výsledkov bola celkovo stanovená u 194/271 (71,6 %) pacientov. U niekoľkých pacientov (13,7 %) bola expresia CD33 nízka (menej ako 30 % blastov).
Štúdia splnila svoj primárny cieľ preukázať, že pridanie lieku MYLOTARG vo frakcionovaných dávkach
(3 mg/m2 × 3) k štandardnej indukčnej chemoterapii u pacientov s predtým neliečenou de novo AML viedlo k štatisticky významnému a klinicky významnému zlepšeniu EFS. Medián EFS bol v ramene lieku
MYLOTARG 17,3 mesiaca (95 % CI: 13,4; 30,0) oproti 9,5 mesiacom (95 % CI: 8,1; 12,0) v ramene len
s DA; miera rizika (HR) 0,562 (95 % CI: 0,415; 0,762); 2-stranná hodnota p = 0,0002 podľa log-rank testu. Údaje o účinnosti zo štúdie ALFA-0701 sú zhrnuté v tabuľke 7 a Kaplan-Meierova krivka pre EFS je zobrazená na obrázku 1.
Tabuľka 7. Údaje o účinnosti zo štúdie ALFA-0701 (populácia s mITT)
MYLOTARG +
daunorubicín + cytarabín daunorubicín + cytarabín
Prežívanie bez príhody (podľa
investigátora) N = 135 N = 136
Počet príhod, n (%) 73 (54,1) 102 (75,0) Medián EFS v mesiacoch [95 % CI]a, 17,3 [13,4; 30,0] 9,5 [8,1; 12,0]
Pravdepodobnosť 2-ročného EFS [95 % CI]b
Pravdepodobnosť 3-ročného EFS [95 % CI]b
42,1 [32,9; 51,0] 18,2 [11,1; 26,7]
39,8 [30,2; 49,3] 13,6 [5,8; 24,8]
Miera rizika [95 % CI]c 0,562 [0,415; 0,762]
p-hodnotad 0,0002
Prežívanie bez relapsu (podľa investigátora) N = 110 N = 100Počet príhod, n (%) 49 (44,5) 66 (66,0) Medián RFS v mesiacoch [95 % CI]a 28,0 [16,3; NE] 11,4 [10,0; 14,4] Miera rizika [95 % CI]c 0,526 [0,362; 0,764]
p-hodnotad 0,0006
Celkové prežívanie N = 135 N = 136Počet úmrtí, n (%) 80 (59,3) 88 (64,7) Medián OS v mesiacoch [95 % CI]a 27,5 [21,4; 45,6] 21,8 [15,5; 27,4] Miera rizika [95 % CI]c 0,807 [0,596; 1,093]
p-hodnotad 0,1646
Miera odpovede (podľa investigátora) N = 135 N = 136Celková odpoveď % [95 % CI]e 81,5 [73,89; 87,64] 73,5 [65,28; 80,72] CR 70,4 69,9
CRp 11,1 3,7
Rozdiel rizík [95 % CI]f 7,95 [-3,79; 19,85]
p-hodnotag 0,1457
Na základe primárnej definície EFS: dátumy príhod (zlyhanie indukcie, relaps alebo smrť) stanovené na základe hodnotenia investigátora.
Populácia s mITT zahŕňala všetkých pacientov, ktorí boli randomizovaní, pokiaľ nebol stiahnutý súhlas pred začiatkom liečby, a ktorí boli analyzovaní podľa úvodného ramena randomizácie.
Skratky: CR = úplná remisia; CRp = úplná remisia s neúplnou obnovou počtu trombocytov; CI = interval spoľahlivosti; EFS = prežívanie bez príhody; mITT = modifikovaný úmysel liečiť; n = počet; N = počet; NE = neodhadnuteľné;
OS = celkové prežívanie; RFS = prežívanie bez relapsu.
a. Medián bol odhadnutý Kaplan-Meierovou metódou; CI je založený na Brookmeyer-Crowleyho metóde s log-log transformáciou.
b. Odhadnutá z Kaplan-Meierovej krivky. Pravdepodobnosť (%) bola vypočítaná metódou „product-limit“; CI bol vypočítaný
z log-log transformácie pravdepodobnosti prežitia použitím normálnej aproximácie a Greenwoodovho vzorca.
c. Na základe Coxovho modelu proporcionálnych rizík v porovnaní s liečbou daunorubicínom + cytarabínom.
d. 2-stranná p-hodnota podľa log-rank testu.
e. Odpoveď definovaná ako CR + CRp.
f. Rozdiel celkovej odpovede; CI na základe metódy Santnera a Snella.
g. Na základe Fisherovho exaktného testu.
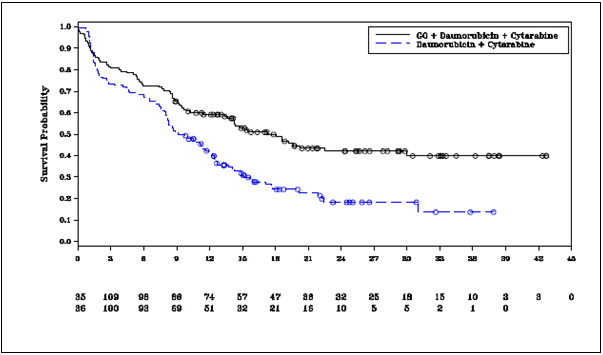 Obrázok 1. Kaplan-Meierova krivka prežívania bez príhod na základe hodnotenia investigátora zo štúdie ALFA
Obrázok 1. Kaplan-Meierova krivka prežívania bez príhod na základe hodnotenia investigátora zo štúdie ALFA-
0701 (populácia s mITT)Skratky: C = cytarabín; D = daunorubicín; GO = gemtuzumab ozogamicín; mITT = modifikovaný úmysel liečiť.
Použitie u pacientov s AML s nepriaznivou cytogenetikouPodľa analýz podskupín zo štúdie ALFA-0701 nezlepšilo pridanie lieku MYLOTARG k štandardnej kombinovanej chemoterapii EFS v podskupine pacientov s nepriaznivou cytogenetikou (HR 1,11; 95 % CI:
0,63; 1,95). EFS a OS analyzované podľa klasifikácie cytogenetického rizika a podľa klasifikácie cytogenetického/molekulárneho rizika sú uvedené nižšie, v Tabuľke 8 a Tabuľke 9.
Tabuľka 8. Prežívanie bez príhody vyhodnocované investigátorom podľa klasifikácie AML rizika zo štúdie ALFA-0701 (populácia mITT)
MYLOTARG + daunorubicín + cytarabín
daunorubicín +
cytarabín
 Cytogenetika (priaznivá/stredne nepriaznivá), N 94 95
Cytogenetika (priaznivá/stredne nepriaznivá), N 94 95
Počet príhod, n (%) 44 (46,8) 68 (71,6) Medián EFS v mesiacoch [95 % CI]a 22,5 [15,5; NE] 11,6 [8,3;13,7] Miera rizika [95 % CI]b 0,460 [0,313; 0,676]
p-hodnotac < 0,0001
Cytogenetika (nepriaznivá), N 27 30Počet príhod, n (%) 23 (85,2) 26 (86,7) Medián EFS v mesiacoch [95 % CI]a 4,5 [1,1; 7,4] 2,8 [1,6; 8,7] Miera rizika [95 % CI]b 1,111 [0,633; 1,949]'
p-hodnotac 0,7151
ELN (priaznivé/stredne nepriaznivé), N 86 91Počet príhod, n (%) 40 (46,5) 63 (69,2) Medián EFS v mesiacoch [95 % CI]a 22,5 [15,5; NE] 12,2 [8,5; 14,3] Miera rizika [95 % CI]b 0,485 [0,325; 0,724]
p-hodnotac 0,0003
EL
N (nepriaznivé), N 37 36
Počet príhod, n (%) 27 (73,0) 32 (88,9) Medián EFS v mesiacoch [95 % CI]a 7,4 [3,7; 14,3] 4,0 [1,7; 8,6] Miera rizika [95 % CI]b 0,720 [0,430; 1,205]
p-hodnotac 0,2091
Skúšanie ALFA-0701 nebolo navrhnuté na prospektívne vyhodnocovanie prospešnosti lieku MYLOTARG v podskupinách. Analýzy sú prezentované len na opisné účely.
Na základe primárnej definície EFS: dátumy príhod (zlyhanie indukcie, relaps alebo smrť) stanovené na základe hodnotenia investigátora.
Populácia s mITT zahŕňala všetkých pacientov, ktorí boli randomizovaní, pokiaľ nebol stiahnutý súhlas pred začiatkom liečby, a ktorí boli analyzovaní podľa úvodného ramena randomizácie.
Skratky: AML = akútna myeloblastová leukémia; CI = interval spoľahlivosti; EFS = prežívanie bez príhody; ELN = European
LeukaemiaNet; mITT = modifikovaný úmysel liečiť; n = počet; N = počet; NE = neodhadnuteľné.
a. Medián bol odhadnutý Kaplan-Meierovou metódou; CI je založený na Brookmeyer-Crowleyho metóde s log-log transformáciou.
b. Na základe Coxovho modelu proporcionálnych rizík v porovnaní s liečbou daunorubicínom + cytarabínom.
c. 2-stranná p-hodnota podľa log-rank testu.
Tabuľka 9. Celkové prežívanie podľa klasifikácie AML rizika zo štúdie ALFA-0701 (populáciamITT)
 MYLOTARG + daunorubicín + cytarabín
daunorubicín +
cytarabín
MYLOTARG + daunorubicín + cytarabín
daunorubicín +
cytarabín
Cytogenetika (priaznivá/stredne nepriaznivá), N 94 95
Počet úmrtí, n (%) 51 (54,3) 57 (60,0) Medián OS v mesiacoch [95 % CI]a 38,6 [24,4; NE] 26,0 [18,9; 39,7] Miera rizika [95 % CI]b 0,747 [0,511; 1,091]
p-hodnotac 0,1288
Cytogenetika (nepriaznivá), N 27 30
Počet úmrtí, n (%) 24 (88,9) 24 (80,0) Medián OS v mesiacoch [95 % CI]a 12,0 [4,2; 14,2] 13,5 [9,4; 27,3] Miera rizika [95 % CI]b 1,553 [0,878; 2,748]
p-hodnotac 0,1267
ELN (priaznivé/stredne nepriaznivé), N 86 91
Počet úmrtí, n (%) 44 (51,2) 53 (58,2) Medián OS v mesiacoch [95 % CI]a 45,6 [25,5; NE] 26,9 [19,3; 46,5] Miera rizika [95 % CI]b 0,730 [0,489; 1,089]
p-hodnotac 0,1216
ELN (nepriaznivé), N 37 36
Počet úmrtí, n (%) 31 (83,8) 29 (80,6) Medián OS v mesiacoch [95 % CI]a 13,2 [7,0; 18,5] 13,5 [10,8; 19,8] Miera rizika [95 % CI]b 1,124 [0,677; 1,867]
p-hodnotac 0,6487
Skúšanie ALFA-0701 nebolo navrhnuté na prospektívne vyhodnocovanie prospešnosti lieku MYLOTARG v podskupinách. Analýzy sú prezentované len na opisné účely.
Populácia s mITT zahŕňala všetkých pacientov, ktorí boli randomizovaní, pokiaľ nebol stiahnutý súhlas pred začiatkom liečby, a ktorí boli analyzovaní podľa úvodného ramena randomizácie.
Skratky: AML = akútna myeloblastová leukémia; CI = interval spoľahlivosti; ELN = European LeukaemiaNet;
mITT = modifikovaný úmysel liečiť; n = počet; N = počet; NE = neodhadnuteľné; OS = celkové prežívanie
a. Medián bol odhadnutý Kaplan-Meierovou metódou; CI je založený na Brookmeyer-Crowleyho metóde s log-log transformáciou.
b. Na základe Coxovho modelu proporcionálnych rizík v porovnaní s liečbou daunorubicínom + cytarabínom.
c. 2-stranná p-hodnota podľa log-rank testu.
Pediatrickápopulácia
Pediatrická štúdia
V randomizovanej štúdii (COG AAML0531), ktorá hodnotila samotnú štandardnú chemoterapiu alebo štandardnú chemoterapiu v kombinácii s liekom MYLOTARG u 1 022 novodiagnostikovaných detí (94,3 %
pacientov vo veku < 18 rokov) a mladých dospelých (5,7 % pacientov), boli pacienti s de novo AML
náhodne zaradení buď do skupiny liečenej štandardnou chemoterapiou skladajúcou sa z 5 cyklov alebo
do skupiny liečenej rovnakou chemoterapiou s 2 dávkami lieku MYLOTARG (3 mg/m2/dávka) podanými jedenkrát v indukčnom cykle 1 a jedenkrát v intenzifikačnom cykle 2. Medián veku pacientov bol 9,7 rokov
(rozsah: 0,003 – 29,8 roka). Štúdia preukázala, že pridanie lieku MYLOTARG k intenzívnej chemoterapii
zlepšilo EFS (3 ročné: 53,1 % oproti 46,9 %; HR 0,83; 95 % CI: 0,70; 0,99, p = 0,04) pri de novo AML
v dôsledku zníženého rizika relapsu s tendenciou k dlhšiemu OS v ramene lieku MYLOTARG, ktoré nebolo štatisticky významné (3 ročné: 69,4 % oproti 65,4 %; HR 0,91; 95 % CI: 0,74; 1,13; p = 0,39). Tiež sa však
zistilo, že zvýšená toxicita (úmrtnosť z dôvodu toxicity po remisii) bola pozorovaná u pacientov s AML
nízkeho rizika, čo bolo pripísané dlhodobej neutropénii, ktorá sa vyskytla po podaní gemtuzumab ozogamicínu počas intenzifikačného cyklu 2 (pozri časti 4.2 a 4.8). Optimálna dávka gemtuzumab
ozogamicínu pre pediatrických pacientov nebola preto stanovená (pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Gemtuzumab ozogamicín je konjugát protilátky a liečiva (ADC) skladajúci sa z monoklonálnej protilátky namierenej proti CD33 (hP67.6), ktorá je kovalentne naviazaná na cytotoxickú látku N-acetyl-gama- kalicheamicín. Farmakokinetika (PK) gemtuzumab ozogamicínu je opísaná zmeraním PK charakteristík protilátky (hP67.6), ako aj celkových a nekonjugovaných derivátov kalicheamicínu. Vzhľadom na to, že protilátka hP67.6 je zodpovedná za cieľovú selektivitu voči intaktnej molekule a že dávky gemtuzumab ozogamicínu sú uvádzané v miligramoch proteínu (hP67.6), výsledky koncentrácie hP67.6 sú uvádzané ako primárne PK miery. Potom čo sa gemtuzumab ozogamicín naviaže na cieľovú molekulu, internalizuje sa
a N-acetyl-kalicheamicín je uvoľňovaný hydrolytickým štiepením. Stanovenie PK parametrov pre nekonjugovaný kalicheamicín bolo obmedzené kvôli nízkym systémovým koncentráciám.
Žiadne PK klinické údaje neboli zhromaždené pri použití frakcionovaného režimu, PK bola však simulovaná pomocou modelu populačnej PK. Hoci pri frakcionovanom režime dávkovania je celková dávka polovičná
v porovnaní s pôvodným režimom dávkovania (9 oproti 18 mg/m2), z dôvodu nelineárnej PK je predpokladané celkové AUC hP67.6 v priebehu liečby 25 % hodnoty AUC pri pôvodnom režime dávkovania
9 mg/m2 a Cmax je 24 % hodnoty Cmax pri pôvodnom režime dávkovania. Pokiaľ sa gemtuzumab ozogamicín podáva v 1., 4. a 7. deň v dávke 3 mg/m2, predpokladá sa, že Cmax hP67.6, ktorá by sa dosiahla na konci
infúzie, bude po prvej dávke 0,38 mg/l a zvýši sa na 0,63 mg/l po tretej dávke.
Distribúcia
In vitro je väzba N-acetyl-gama-kalicheamicíndimetylhydrazidu na proteíny ľudskej plazmy približne 97 %.
In vitro je N-acetyl-gama-kalicheamicíndimetylhydrazid substrátom P-glykoproteínu (P-gp). U pacientov bol celkový distribučný objem protilátky hP67.6 (súčet V1 [10 l] a V2 [15 l]) približne 25 l.
Biotransformácia
Predpokladá sa, že primárna metabolická dráha gemtuzumab ozogamicínu je hydrolytické uvoľňovanie N-
acetyl-gama-kalicheamicíndimetylhydrazidu. In vitro štúdie preukázali, že N-acetyl-gama- kalicheamicíndimetylhydrazid je extenzívne metabolizovaný primárne neenzymatickou redukciou disulfidovej časti. Predpokladá sa, že aktivita (cytotoxicita) výsledných metabolitov je významne oslabená. U pacientov boli plazmatické hladiny nekonjugovaného kalicheamicínu obvykle nízke s predpokladanou priemernou hodnotou Cmax po tretej dávke 1,5 ng/ml.
Interakcie sinýmiliekmi
Vplyv iných liekov na gemtuzumab ozogamicín
In vitro je N-acetyl-gama-kalicheamicíndimetylhydrazid primárne metabolizovaný neenzymatickou redukciou. Preto nie je pravdepodobné, že by súčasné podávanie gemtuzumab ozogamicínu s inhibítormi alebo induktormi cytochrómu P450 (CYP) alebo uridíndifosfátglukuronosyltransferáz (UGT) metabolizujúcich lieky menilo expozíciu N-acetyl-gama-kalicheamicíndimetylhydrazidu.
Na základe analýz populačnej farmakokinetiky (PK) sa nepredpokladá, že kombinácia gemtuzumab ozogamicínu s hydroxymočovinou, DNR a AraC spôsobuje klinicky významné zmeny v PK hP67.6 alebo nekonjugovaného kalicheamicínu.
Vplyv gemtuzumab ozogamicínu na iné lieky
Vplyv na substráty CYP
In vitro mali N-acetyl-gama-kalicheamicíndimetylhydrazid a gemtuzumab ozogamicín nízky potenciál
inhibovať aktivity CYP1A2, CYP2A6 (testované len s gemtuzumab ozogamicínom), CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 a CYP3A4/5 v klinicky významných koncentráciách. In vitro mali N-acetyl-
gama-kalicheamicíndimetylhydrazid a gemtuzumab ozogamicín nízky potenciál indukovať aktivity
CYP1A2, CYP2B6 a CYP3A4 v klinicky významných koncentráciách.
Vplyv na substráty UGT
In vitro mal N-acetyl-gama-kalicheamicíndimetylhydrazid nízky potenciál inhibovať aktivity UGT1A1,
UGT1A4, UGT1A6, UGT1A9 a UGT2B7 v klinicky významných koncentráciách.
Vplyv na substráty prenášačov liekov
In vitro mal N-acetyl-gama-kalicheamicíndimetylhydrazid nízky potenciál inhibovať aktivity P-gp, proteínu
zodpovedného za rezistenciu pri karcinóme prsníka (BCRP), pumpy na export žlčových solí (BSEP), proteínu asociovaného s multiliekovou rezistenciou (MRP) 2, multiliekového a toxínového extrúzneho
proteínu (MATE)1 a MATE2K, prenášačov organických aniónov (OAT)1 a OAT3, prenášačov organických
katiónov (OCT)1 a OCT2 a polypeptidov prenášajúcich organické anióny (OATP)1B1 a OATP1B3
v klinicky významných koncentráciách.
Vplyv na súbežne podávané chemoterapeutické látky
Na základe analýz populačnej farmakokinetiky (PK) sa nepredpokladá, že kombinácia gemtuzumab
ozogamicínu s DNR a AraC spôsobuje klinicky významné zmeny vo PK týchto látok.
Eliminácia
Na základe analýz populačnej PK bola predpokladaná hodnota klírensu (CL) hP67.6 z plazmy bezprostredne
po prvej dávke 3 l/h a neskôr 0,3 l/h. Predpokladá sa, že u obvyklého pacienta, ktorému je podávaný
MYLOTARG v odporúčanej dávke (3 mg/m2), je konečný plazmatický polčas (t½) hP67.6 približne
160 hodín.
Farmakokinetika ušpeciálnychskupínúčastníkovalebopacientov
Vek, rasa a pohlavie
Na základe analýzy populačnej PK vek, rasa ani pohlavie významne neovplyvňovali dispozíciu gemtuzumab ozogamicínu.
Porucha funkcie pečene
U pacientov s poruchou funkcie pečene sa neuskutočnili žiadne formálne PK štúdie s gemtuzumab ozogamicínom.
Na základe analýzy populačnej PK sa nepredpokladá, že klírens gemtuzumab ozogamicínu (protilátka hP67.6 a nekonjugovaný kalicheamicín) je ovplyvnený miernou poruchou funkcie pečene definovanou pracovnou skupinou National Cancer Institute Organ Dysfunction Working Group (NCI ODWG). Analýza zahŕňala 406 pacientov s nasledujúcimi kategóriami poruchy funkcie pečene podľa NCI ODWG: mierna (B1, n = 58 a B2, n = 19), stredná (C, n = 6) a normálna funkcia pečene (n = 322) (pozri časť 4.2).
Porucha funkcie obličiek
U pacientov s poruchou funkcie obličiek sa neuskutočnili žiadne formálne PK štúdie s gemtuzumab ozogamicínom.
Na základe analýzy populačnej PK u 406 pacientov bol klírens gemtuzumab ozogamicínu u pacientov s miernou poruchou funkcie obličiek (klírens kreatinínu [CLcr] 60 – 89 ml/min, n = 149) alebo stredne závažnou poruchou funkcie obličiek (CLcr 30 – 59 ml/min, n = 47) podobný ako u pacientov s normálnou funkciou obličiek (CLcr ≥ 90 ml/min, n = 209). PK gemtuzumab ozogamicínu nebola študovaná u pacientov so závažnou poruchou funkcie obličiek.
Pediatrická populácia
Výsledky populačného modelovania ukázali, že PK správanie gemtuzumab ozogamicínu (protilátky hP67.6 a nekonjugovaného kalicheamicínu) je podobné u dospelých a pediatrických pacientov s AML po režime dávkovania 9 mg/m2.
5.3 Predklinické údaje o bezpečnosti
Toxicita poopakovanompodaní
Hlavné toxické účinky sa vyskytli v pečeni, kostnej dreni a lymfatických orgánoch, hematologických
parametroch (znížený celkový objem erytrocytov a počet leukocytov, hlavne lymfocytov), obličkách, oku a samčích a samičích reprodukčných orgánoch. Účinky na pečeň, obličky a samčie reprodukčné orgány
u potkanov a na lymfatické tkanivá u opíc (u potkanov približne pri 18-násobku a u opíc približne pri 36- násobku klinickej expozície u ľudí po tretej ľudskej dávke 3 mg/m2 na základe AUC168) boli ireverzibilné. Účinky na samičie reprodukčné orgány a oči u opíc boli nežiaduce v 12-týždňovej štúdii (približne pri 193- násobku, respektíve 322-násobku klinickej expozície u ľudí po tretej ľudskej dávke 3 mg/m2 na základe AUC168). Relevancia ireverzibilných nálezov u zvierat pre ľudí je nejasná. Účinky na nervový systém neboli pozorované u zvierat po podaní lieku MYLOTARG. Zmeny v nervovom systéme boli identifikované
u potkanov s inými konjugátmi protilátok a kalicheamicínu.
Genotoxicita
Bolo zistené, že gemtuzumab ozogamicín je klastogénny. Toto zistenie je v súlade so známou indukciou
DNA zlomov kalicheamicínom a inými enediynovými protinádorovými antibiotikami. Bolo zistené, že
N-acetyl-gama-kalicheamicíndimetylhydrazid (uvoľnený cytotoxín) je mutagénny a klastogénny.
Karcinogenicita
Formálne štúdie karcinogenicity s gemtuzumab ozogamicínom neboli vykonané. V štúdiách toxicity sa
u potkanov vyvinuli predneoplastické lézie (minimálna až mierna hyperplázia oválnych buniek) v pečeni pri približne 54-násobku klinickej expozície u ľudí po tretej ľudskej dávke 3 mg/m2 na základe AUC168.
U opíc sa nepozorovali žiadne predneoplastické ani neoplastické lézie do približne 115-násobku klinickej expozície u ľudí po tretej ľudskej dávke 3 mg/m2 na základe AUC168. Relevancia týchto nálezov u zvierat pre ľudí je nejasná.
Reprodukčná toxicita
V štúdii fertility na samiciach potkanov boli pozorované trochu nižšie počty žltých teliesok a zvýšená
embryoletalita v prítomnosti maternálnej toxicity (pri približne 9,7-násobku klinickej expozície u ľudí po tretej ľudskej dávke 3 mg/m2 na základe AUC168). Účinky na reprodukčný trakt samičiek opíc sa pozorovali v 12-týždňovej štúdii (atrofia vaječníkov, vajcovodov, maternice a krčka maternice; pri približne
193-násobku klinickej expozície u ľudí po tretej ľudskej dávke 3 mg/m2).
V štúdii mužskej fertility zahŕňali účinky na reprodukciu samcov nižšie počty spermatogónií
a spermatocytov, pokles počtu spermatidov v semenníkoch a spermií v nadsemenníkoch, vakuolizáciu jadier spermatidov a/alebo prítomnosť obrovských buniek. Ďalšie nálezy zahŕňali účinky na semenníky, nadsemenníky a prsnú žľazu, ako aj na fertilitu. Pokiaľ sa samce potkanov znova párili po 9 týždňoch
bez podávania lieku, účinky na spermie a fertilitu boli horšie, ale došlo k čiastočnej obnove počtu spermatogónií a spermatocytov v semenníkoch z nižších hodnôt. Účinky na reprodukčné orgány samcov potkanov boli čiastočne reverzibilné alebo ireverzibilné (pozri časť 4.6). Účinky na reprodukčný trakt samcov (semenníky, nadsemenníky, semenníkové vezikuly) u opíc sa pozorovali pri približne 66-násobku klinickej expozície u ľudí po tretej ľudskej dávke 3 mg/m2.
V štúdii embryofetálnej toxicity boli pozorované nižšia telesná hmotnosť plodu, vyššia incidencia zvlnených rebier u plodu a nižšia incidencia skeletálnej osifikácie plodu. Zvýšená embryoletalita a fetálne morfologické anomálie zahŕňali malformácie prstov, absenciu aortálneho oblúka, anomálie dlhých kostí predných
končatín, deformovanú lopatku, absenciu vertebrálneho centra a zrastenie segmentov sterna. Zvýšená embryoletalita bola taktiež pozorovaná v prítomnosti maternálnej toxicity. Najnižšia dávka
s embryofetálnymi účinkami korelovala s 9,7-násobkom klinickej expozície u ľudí po tretej ľudskej dávke
3 mg/m2 na základe AUC168 (pozri časť 4.6).
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Dextran 40
Sacharóza
Chlorid sodný
Monohydrát dihydrogenfosforečnanu sodného
Bezvodý hydrogenfosforečnan sodný
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
Neotvorená injekčná liekovka
5 rokov
Rekonštituovaný azriedenýroztok
Po rekonštitúcii a zriedení musí byť roztok chránený pred svetlom a musí sa okamžite použiť. Pokiaľ
nemôže byť liek okamžite použitý, môže sa zriedený roztok uchovávať až 18 hodín od úvodného prepichnutia injekčnej liekovky v chladničke (2 °C – 8 °C) a maximálne 6 hodín pri izbovej teplote
(do 25 °C). Táto doba zahŕňa čas potrebný na rekonštitúciu, riedenie a podávanie.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Injekčnú liekovku uchovávajte v pôvodnom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii a riedení, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Injekčná liekovka z jantárového skla typu I s butylovou gumovou zátkou, zapečatením po okrajoch a ľahko otvárateľným viečkom obsahujúca 5 mg gemtuzumab ozogamicínu.
Každé balenie obsahuje 1 injekčnú liekovku.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pri postupoch rekonštitúcie a riedenia použite vhodnú aseptickú techniku. Liek MYLOTARG je citlivý na svetlo a musí byť počas rekonštitúcie, riedenia a podávania chránený pred ultrafialovým svetlom.
Rekonštitúcia
· Vypočítajte požadovanú dávku (mg) lieku MYLOTARG.
· Pred rekonštitúciou nechajte injekčnú liekovku približne 5 minút temperovať na izbovú teplotu
(do 25 °C). Každú injekčnú liekovku s obsahom 5 mg rekonštituujte s 5 ml vody na injekciu, aby ste získali roztok gemtuzumab ozogamicínu s koncentráciou 1 mg/ml na jednorazové použitie.
· Injekčnú liekovku jemne otáčajte, aby sa uľahčilo rozpúšťanie. Nepretrepávajte.
· Skontrolujte, či rekonštituovaný roztok neobsahuje častice a či nezmenil farbu. Rekonštituovaný roztok môže obsahovať malé biele až sivobiele, nepriehľadné až priesvitné a amorfné až vláknité častice.
· Liek MYLOTARG neobsahuje žiadne bakteriostatické konzervačné látky.
· Pokiaľ sa rekonštituovaný roztok nemôže použiť okamžite, môže sa až 6 hodín uchovávať v pôvodnej injekčnej liekovke v chladničke (2 °C – 8 °C) a maximálne 3 hodiny pri izbovej teplote (do 25 °C).
Chráňte pred svetlom a neuchovávajte v mrazničke.
Riedenie
· Vypočítajte požadovaný objem rekonštituovaného roztoku potrebný na získanie príslušnej dávky
na základe plochy telesného povrchu pacienta. Toto množstvo natiahnite z injekčnej liekovky pomocou injekčnej striekačky. Injekčné liekovky s liekom Mylotarg obsahujú 5 mg lieku bez preplnenia. Po rekonštituovaní podľa návodu na koncentráciu 1 mg/ml je extraktovateľný obsah injekčnej liekovky 4,5 mg (4,5 ml). Chráňte pred svetlom. Akýkoľvek nepoužitý rekonštituovaný roztok v injekčnej liekovke zlikvidujte.
· Dávky sa musia zmiešať na koncentráciu v rozmedzí 0,075 mg/ml až 0,234 mg/ml podľa nasledujúceho návodu:
o Dávky nižšie ako 3,9 mg sa musia pripraviť na podávanie injekčnou striekačkou. Pridajte rekonštituovaný roztok lieku MYLOTARG do injekčnej striekačky s injekčným roztokom chloridu sodného s koncentráciou 9 mg/ml (0,9 %) do výslednej koncentrácie 0,075 mg/ml až
0,234 mg/ml. Chráňte pred svetlom.
o Dávky väčšie alebo rovné 3,9 mg sa majú riediť v injekčnej striekačke alebo v IV vrecku vo vhodnom objeme injekčného roztoku chloridu sodného s koncentráciou 9 mg/ml (0,9 %), aby sa dosiahla výsledná koncentrácia 0,075 mg/ml až 0,234 mg/ml. Chráňte pred svetlom.
· Jemne prevráťte infúzny vak, aby ste premiešali zriedený roztok. Nepretrepávajte.
· Po zriedení s injekčným roztokom chloridu sodného s koncentráciou 9 mg/ml (0,9 %) sa musí roztok lieku MYLOTARG okamžite infúzne podať. Pokiaľ nemôže byť použitý okamžite, uchovávajte ho pri izbovej teplote (do 25 °C) maximálne 6 hodín. Táto doba zahŕňa 2 hodiny na podávanie infúzie a, ak je
to potrebné, 1 hodinu, počas ktorej sa schladený zriedený roztok zohreje na izbovú teplotu (do 25 °C).
Zriedený roztok sa môže uchovávať v chladničke, pri 2 °C až 8 °C maximálne 12 hodín. Chráňte pred svetlom a neuchovávajte v mrazničke.
· Odporúča sa, aby bol infúzny vak vyrobený z polyvinylchloridu (PVC) s bis-(2-etylhexyl)-ftalátom
(DEHP) alebo polyolefínom (polypropylén a/alebo polyetylén).
Podávanie
· Zriedený roztok musí byť prefiltrovaný. Pri infúzii lieku MYLOTARG sa musí použiť in-line filter
slabo viažuci bielkoviny s pórmi s priemerom 0,2 μm vyrobený z polyétersulfónu (PES).
· Pri podávaní dávok injekčnou striekačkou sa musia použiť infúzne linky malého vnútorného priemeru s in-line filtrom slabo viažucim bielkoviny s pórmi s priemerom 0,2 μm vyrobeným z polyétersulfónu (PES).
· Počas infúzie musia byť intravenózny vak alebo injekčné striekačky chránené pred svetlom krytom neprepúšťajúcim svetlo (ani ultrafialové svetlo). Infúzna linka nemusí byť chránená pred svetlom.
· Zriedený roztok podávajte infúzne 2 hodiny. Odporúča sa použiť infúzne linky vyrobené z PVC (s alebo bez obsahu DEHP) alebo polyetylénu.
Liek MYLOTARG sa nesmie miešať ani podávať ako infúzia s inými liekmi. Pre informácie o riedení, uchovávaní a infúznom podávaní pozri tiež časť 6.3.
LikvidáciaMusia sa použiť postupy likvidácie toxického odpadu predpísané pre protinádorové lieky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIPfizer Limited
Ramsgate Road
Sandwich, Kent CT13 9NJ Spojené kráľovstvo
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/18/1277/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
(EMEA)
http://www.emea.europa.eu/.