hličitanu (veľká komora)
Natrii chloridum (chlorid sodný)
| 6,453 g
|
Natrii hydrogenocarbonas (hydrogénuhličitan sodný)
| 3,104 g
|
Na+
| 147.37 mmol
|
Cl ˉ
| 110,42 mmol
|
HCO3 ˉ
| 36.95 mmol
|
PO ZMIEŠANÍ
1000ml roztoku multiBic 2 mmol/l draslíka pripraveného na použitie:
Natrii chloridum (chlorid sodný)
| 6,136 g
|
Kalii chloridum (chlorid draselný)
| 0,1491 g
|
Natrii hydrogenocarbonas (hydrogénuhličitan sodný)
| 2,940 g
|
Calcii chloridum dihydricum (dihydrát chloridu vápenatého)
| 0,2205 g
|
Magnesii chloridum hexahydricum (hexahydrát chloridu horečnatého)
| 0,1017 g
|
Glucosum anhydricum (glukóza) /ako glucosum monohydricum (monohydrát glukózy)/
| 1,0 g 1,1 g
|
Na+
| 140,0 mmol
|
K+
| 2,0 mmol
|
Ca++
| 1,50 mmol
|
Mg++
| 0,50 mmol
|
Cl ˉ
| 111,0 mmol
|
HCO3 ˉ
| 35,0 mmol
|
Glukóza
| 5,55 mmol
|
Pomocné látky, pozri časť 6.1
3. LIEKOVÁ FORMA Roztok na hemofiltráciu. Číry bezfarebný roztok.
Teoretická osmolarita
| 296 mosmol/l
|
pH ≈
| 7,40
|
4. KLINICKÉ ÚDAJE 4.1. Terapeutické indikácie Hemofiltrácia sa používa u pacientov s akútnym zlyhaním obličiek, ktoré si vyžaduje nepretržitú hemofiltráciu.
4.2. Dávkovanie a spôsob podávania Hemofiltrácia u pacientov s akútnym zlyhaním obličiek, vrátane predpísania náhradných roztokov, sa musí vykonávať pod dozorom lekára so skúsenosťami s touto liečbou.
Pri akútnom zlyhaní obličiek sa ošetrenie vykonáva počas obmedzenej doby a preruší sa, keď sa funkcia obličiek úplne obnoví.
multiBic 2 mmol/l draslíka je určený výhradne na intravenóznu infúziu.
Roztok pripravený na použitie sa podáva infúzne do mimotelového obehu pomocou dávkovacej pumpy.
Pretože krvné sérum je pri hemofiltrácii odfiltrované, filtrovaný objem zmenšený o potrebnú ultrafiltračnú tekutinu, sa musí nahradiť hemofiltračným roztokom.
Rýchlosť filtrácie je predpísaná ošetrujúcim lekárom v závislosti na klinickom stave a hmotnosti pacienta. Pokiaľ nie je predpísané inak, celková rýchlosť filtrácie 800 až 1400 ml/h je vhodná u dospelých na to, aby odstránila odpadové látky metabolizmu v závislosti na stave metabolizmu pacienta. Odporúčaná maximálna rýchlosť filtrácie je 75 l denne.
Neexistujú žiadne klinické skúsenosti s používaním a dávkovaním tohto roztoku u detí.
Pokyny týkajúce sa použitia lieku pozri časť 6.6.
4.3. Kontraindikácie Kontraindikácie závislé od roztoku:
- Hypokaliémia
- Metabolická alkalóza
Kontraindikácia závislá od hemofiltrácie v dôsledku samotného technického postupu:
- Zlyhanie obličiek so zvýšeným hyperkatabolizmom v takých prípadoch, v ktorých už nie je možné hemofiltráciou odstrániť urenické symptómy.
- Nedostatočný prietok krvi z cievneho vstupu.
- Ak existuje vysoké riziko krvácania kvôli systémovej antikoagulácii.
4.4. Osobitné upozornenia a opatrenia pri použití Pred hemofiltráciou a počas nej musí byť pravidelne kontrolovaná koncentrácia draslíka v sére. U pacienta sa musí vziať do úvahy stav draslíka a jeho vývoj počas hemofiltrácie. Ak je prítomná hypokaliémia, alebo existuje tendencia jej vzniku, môže byť potrebná substitúcia draslíka a/alebo môže byť potrebná zámena za roztok s vyššou koncentráciou draslíka.
Ak existuje tendencia vzniku hyperkaliémie, môže byť indikovaná zvýšená rýchlosť filtrácie a/alebo môže byť potrebná zámena za roztok s nižšou koncentráciou draslíka, ako aj obvyklé opatrenia intenzívnej medicíny.
Okrem toho pred hemofiltráciou a počas nej sa majú monitorovať nasledujúce parametre: hladina sodíka, vápnika, horčíka, fosfátov, glukózy v sére, acido-bázická rovnováha, hladiny močoviny kreatinínu, hmotnosť tela a rovnováha tekutín (aby sa včas rozpoznala hyper- a dehydratácia).
Pred použitím musí byť vak s roztokom dôkladne skontrolovaný, ako je podrobne popísané v časti 6.6.. Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Hemofiltračný roztok musí byť pred infúziou zohriaty pomocou vhodného zariadenia približne na teplotu tela a za žiadnych okolností nesmie byť infúzne podaný, ak je teplota nižšia ako je izbová teplota.
Nepoužívajte pred zmiešaním oboch roztokov.
4.5. LIEKOVÉ A INÉ INTERAKCIE Správne dávkovanie náhradných roztokov a prísne monitorovanie klinických chemických parametrov a vitálnych znakov zabráni interakcii s inými liekmi. Je potrebné vziať do úvahy nasledovné interakcie:
- Náhrady elektrolytov, parenterálna výživa a iné infúzie, ktoré sa obvykle podávajú pri intenzívnej starostlivosti ovplyvňujú zloženie séra a stav tekutín pacienta. Toto je nutné zvážiť pri predpisovaní hemofiltračnej liečby.
- Hemofiltračná liečba môže znižovať koncentráciu liekov v krvi, hlavne liekov s nízkou schopnosťou viazať proteíny, s malým distribučným objemom, s molekulárnou hmotnosťou pod hodnotou, pri ktorej sa zastavuje hemofilter a lieky, ktoré sa absorbujú do hemofiltra. U týchto liekov je potrebné upraviť ich dávkovanie.
- Toxický účinok digitálisu môže byť prekrytý hyperkaliémiou, hypermagnéziou a hypokalciémiou. Úprava hladiny týchto elektrolytov hemofiltráciou môže odhaliť príznaky a symptómy otravy digitálisom, napr. srdcovú arytmiu.
4.6. Gravidita a laktácia V súčasnosti nie sú k dispozícii žiadne klinické štúdie. Náhradný roztok pufrovaný hydrogénuhličitanom sa môže používať len po zhodnotení možných rizík a prínosov pre matku a dieťa.
4.7. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje Neaplikovateľné.
4.8. Nežiaduce účinky Nežiaduce reakcie, ako napríklad nauzea, vracanie, svalové kŕče, hypotenzia a hypertenzia, môžu vznikať v dôsledku samotného režimu ošetrenia, alebo môžu byť vyvolané náhradným roztokom. Obyčajne je tolerancia hemofiltračného roztoku pufrovaného hydrogénuhličitanom dobrá. Je však možné očakávať nasledovné vedľajšie účinky liečby: hyper- alebo hypohydratácia, elektrolytická nerovnováha (napr. hypokaliémia), hypofosfatémia, hypoglykémia a metabolická alkalóza.
4.9. Predávkovanie Po použití odporúčaných dávok neboli hlásené žiadne nepriaznivé, mimoriadne reakcie, okrem toho je možné podávanie roztoku kedykoľvek prerušiť. Ak nie je rovnováha tekutín presne vypočítaná a monitorovaná, môže vzniknúť hyperhydratácia alebo dehydratácia spolu s pridruženými reakciami obehu. Môžu sa prejaviť zmenami tlaku krvi, centrálneho venózneho tlaku, pulzu a pulmonárneho arteriárneho tlaku. V prípadoch hyperhydratácie môže dôjsť ku kongestívnemu srdcovému zlyhaniu a/alebo prekrveniu pľúc. V prípadoch hyperhydratácie sa má ultrafiltrácia zvýšiť a rýchlosť a objem náhradného roztoku podávaného infúziou sa má zredukovať. V prípadoch značnej dehydratácie sa má ultrafiltrácia znížiť alebo prerušiť a objem náhradného roztoku podávaného infúzne sa má vhodne zvýšiť. Nadmerná liečba môže viesť k poruchám koncentrácie elektrolytov a acidobázickej rovnováhy, napr. môže dôjsť k predávkovaniu hydrogénuhličitanom, ak sa použije na infúziu/podá nevhodne veľký objem náhradného roztoku. To by mohlo prípadne viesť k metabolickej alkalóze, zníženiu ionizovaného vápnika alebo k tetanii.
5. FARMAKOLOGICKÉ VLASTNOSTI 5.1. Farmakodynamické vlastnosti Farmakoterapeutická skupina: roztok na hemofiltráciu. ATC kód: B05Z B hemofiltráty
Základné princípy hemofiltrácie:
Počas nepretržitej hemofiltrácie sa voda, rozpustené látky ako uremické toxíny, elektrolyty a hydrogénuhličitan odstraňujú z krvi ultrafiltráciou. Ultrafiltrát sa nahrádza náhradným roztokom (roztok pre hemofiltráciu) s vyrovnaným zložením elektrolytov a pufra.
Hemofiltračný roztok pripravený na použitie je náhradný roztok pufrovaný hydrogénuhličitanom určený na intravenózne podanie, pri liečbe akútneho zlyhania obličiek akéhokoľvek pôvodu nepretržitou hemofiltráciou. Elektrolyty Na
+, K
+, Mg
2+, Ca
2+, Cl
-, a hydrogénuhličitan sú veľmi dôležité na udržiavanie a úpravu homeostázy tekutín a elektrolytov (objem krvi, osmotická rovnováha, acidobázická rovnováha).
5.2. Farmakokinetické vlastnosti Roztok pripravený na použitie sa môže podávať len intravenózne.
Distribúcia elektrolytov a hydrogénuhličitanu sa reguluje v súlade s požiadavkami, metabolickým stavom a reziduálnou funkciou obličiek. Aktívne látky náhradného roztoku sa nemetabolizujú, s výnimkou glukózy. Odstraňovanie vody a elektrolytov závisí od požiadaviek bunky, metabolických podmienok, reziduálnej funkcie obličiek a od straty tekutín inými cestami (napr. črevo, pľúca, koža).
5.3. Predklinické údaje o bezpečnosti Neexistujú žiadne predklinické údaje relevantné pre predpisujúceho lekára.
6. FARMACEUTICKÉ INFORMÁCIE 6.1. Zoznam pomocných látok V malej komore A: Voda na injekciu (aqua ad iniectabilia), kyselina chlorovodíková 25% (acidum hydrochloricum 25%). Vo veľkej komore B: Voda na injekciu (aqua ad iniectabilia), oxid uhličitý (carbonei dioxidum).
6.2. Inkompatibility Pretože nie sú dostupné údaje o kompatibilite, tento liek sa nesmie zmiešavať s inými liekmi. Ak sa pridáva do náhradného roztoku, musí sa tak urobiť až po zhodnotení kompatibility s náhradným roztokom a až po dôkladnom zmiešaní obidvoch komôr roztoku. '
6.3. Čas použiteľnosti
|
Čas použiteľnosti:
| 2 roky
|
Čas použiteľnosti po otvorení :
| -
|
Čas použiteľnosti po zmiešaní:
| 48 hodín
|
Z mikrobiologického hľadiska, keď sa roztok pripojí na hemofiltračný obvod, musí sa okamžite použiť. Za inú dobu uchovávania a podmienky použiteľnosti zodpovedá používateľ.
6.4. Špeciálne upozornenia na uchovávanie Uchovávajte pri teplote vyššej ako 4°C.
6.5. Druh obalu a obsah balenia Vak s dvomi komorami: 4,75 l (alkalický roztok hydrogénuhličitanu) + 0,25 l (roztok kyslého elektrolytu s glukózou ) = 5,0 l (roztoku na použitie) Fólia použitá na vak je vyrobená z polyetylén tereftalátu, ktorý je potiahnutý oxidom kremíka (SiOx) ako plynovou bariérou, polyamidom a polypropylénom - syntetickou vysoko elastickou zmesou.
Vonkajší obal: Dvojkomorový vak je zabalený do fólie vyrobenej z polyolefínu – syntetickej vysoko elastickej zmesi.
2 vaky po 5000 ml (papierová krabica)
6.6. Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom Hemofiltračný roztok sa podáva v nasledujúcich krokoch: .
1. Odstránenie vrchného obalu a dôsledná kontrola hemofiltračného vaku.
Vonkajší obal sa má odstrániť až tesne pred podaním.
Plastové vaky môžu byť niekedy poškodené počas prepravy od výrobcu do dialyzačnej kliniky alebo v rámci samotnej kliniky. To môže viesť ku kontaminácii a rastu mikróbov alebo húb v hemofiltračnom roztoku. Preto je nevyhnutná dôsledná vizuálna kontrola vaku pred pripojením a roztoku pred použitím. S ohľadom na možnú kontamináciu sa musí venovať mimoriadna pozornosť dokonca i tomu najmenšiemu poškodeniu uzáveru a zvaru švu ako aj rohom vaku.
Roztok môže byť použitý, len ak je číry a bezfarebný a ak vak i konektory sú nepoškodené a neporušené.
V prípade pochybností rozhodne o použití hemofiltračného roztoku ošetrujúci lekár.
2. Zmiešanie dvoch komôr.
Dvojkomorový vak -roztok hydrogénuhličitanu a elektrolyty s glukózou zmiešajte tesne pred použitím, aby sa získal roztok na použitie. Zmiešaný roztok je číry a bezfarebný.
Po zmiešaní oboch komôr skontrolujte, či je šev kompletne otvorený, či je roztok číry a bezfarebný
a či obal neprepúšťa tekutinu.

A) B) C)
| | | | | | | |
| |  |
|
| |
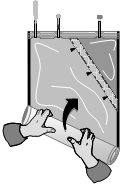
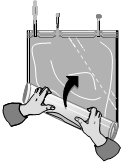
...až kým sa šev medzi oboma komorami otvorí po celej svojej dĺžke a roztoky z oboch komôr sa zmiešajú
|
|
| |
Začnite rolovať vak s roztokom od rohu oproti malej komore...
|
|
| |
|
|
3. Roztok pripravený na použitie
Akékoľvek pridanie do náhradného roztoku sa má vykonávať len po tom, čo bol náhradný roztok dôkladne zmiešaný (pozri tiež 6.2). Po tomto pridaní sa náhradný roztok znovu dôkladne zamieša a až potom sa môže začať s podávaním infúzie.
Roztok pripravený na použitie sa musí použiť okamžite, najneskôr do 48 hodín po zmiešaní.
Ak nie je predpísané inak, roztok pripravený na použitie musí byť ohriaty tesne pred infúziou na teplotu 36,5 °C – 38,0°C. Presná teplota sa musí zvoliť v závislosti na klinických požiadavkách a použitom technickom zariadení.
Hemofiltračný roztok je určený na jednorazové použitie.
Čiastočne použité a poškodené vaky je nutné znehodnotiť.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII Fresenius Medical Care Deutschland GmbH 61346 Bad Homburg v.d.H SRN
8. REGISTRAČNÉ ČÍSLO 87/0482/05-S
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE Dátum registrácie: 23.12.2005
Dátum predĺženia registrácie: 26.11.2007
10. DÁTUM REVÍZIE TEXTU September 2009