ín pred instiláciou, počas nej a po nej. Močový mechúr musí byť pred instiláciou vyprázdnený. Mitomycín sa zavádza do močového mechúra prostredníctvom katétra a pri nízkom tlaku. Dĺžka individuálnej instilácie má byť 1 – 2 hodiny. Počas tejto doby roztoká má mať dostatočný kontakt s celým povrchom sliznice močového mechúra. Preto má byť pacient čo najviac mobilizovaný. Po 2 hodinách má pacient vymočiť instilovaný roztok, prednostne v sediacej polohe.
Pokyny na rekonštitúciu a riedenie lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
• Precitlivenosť na liečivo (liečivá) alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
• Dojčenie
• Perforácia steny močového mechúra
• Cystitída
4.4 Osobitné upozornenia a opatrenia pri používaní
Ak dôjde k cystitíde, treba podať symptomatickú liečbu miestnymi protizápalovými liekmi a analgetikami. Vo väčšine prípadov možno s liečbou mitomycínom pokračovať, ak je nutné zníženými dávkami. Boli hlásené ojedinelé prípady alergickej (eozinofilnej) cystitídy, ktoré si vynútili prerušenie liečby (pozri časť 4.8).
Extravazácia po intravezikálnom podaníPríznaky extravazácie po intravezikálnom podaní mitomycínu sa môžu objaviť hneď po aplikácii alebo o niekoľko týždňov alebo mesiacov neskôr. Nemusí byť jasné, či k extravázácii dochádzalo z dôvodu nepovšimnutej perforácie, stenčeného
muscularis propria alebo nesprávneho podania lieku.
Prvé príznaky sa prejavujú ako bolesť v panvovej alebo abdominálnej oblasti, ktorá je odolná voči jednoduchej analgézii. Vo väčšine prípadov sa ako dôsledok extravazácie pozorovala nekróza (tukového) tkaniva v okolitej oblasti. Hlásila sa tiež perforácia močového mechúra alebo rozvoj fistuly a/alebo abscesu (pozri časť 4.8).
Lekári majú vziať do úvahy možnosť, že došlo k extravazácii, ak sa pacient sťažuje na bolesť v panvovej alebo abdominálnej oblasti, aby sa zabránilo závažným následkom.
Všeobecná hygiena pre pacientaPo močení sa odporúča umyť si ruky a oblasť genitálií. To sa týka hlavne prvých močení po podaní mitomycínu.
Mitomycín je mutagénna a potenciálne karcinogénna látka pre ľudí. Treba sa vyhýbať kontaktu s pokožkou a sliznicami.
Toxické účinky na kostnú dreňKvôli toxickým účinkom mitomycínu na kostnú dreň iné modality myelotoxickej liečby (najmä iné cytostatiká, žiarenie) treba podávať s osobitnou opatrnosťou, za účelom minimalizácie rizika aditívnej myelosupresie.
Dlhodobá liečba môže viesť ku kumulatívnemu toxickému účinku na kostnú dreň. Útlm kostnej drene sa môže prejaviť iba s oneskorením; k najvýraznejšiemu prejavu dochádza po 4 6 týždňoch, akumuláciou po predĺženom používaní, a preto si často vyžaduje individuálnu úpravu dávkovania.
U pacientov súčasne liečených intravenózne mitomycínom a inými antineoplastikami bol hlásený výskyt akútnej leukémie (v niektorých prípadoch po preleukemickej fáze) a myelodysplastického syndrómu.
V prípade pľúcnych príznakov, ktoré nemožno pripísať základnému ochoreniu, liečbu treba okamžite zastaviť. Pľúcna toxicita sa dá dobre liečiť steroidmi.
Liečbu treba tiež okamžite zastaviť, ak sa vyskytnú príznaky hemolýzy alebo náznaky dysfunkcie obličiek (nefrotoxicity). Výskyt hemolyticko-uremického syndrómu (HUS; nevratné zlyhanie obličiek, mikroangiopatická hemolytická anémia [MAHA syndróm] a trombocytopénia) je obyčajne smrteľný.
V intravenóznych dávkach > 30 mg mitomycínu/m² telesného povrchu bola pozorovaná mikroangiopaticko-hemolytická anémia. Odporúča sa pozorné sledovanie funkcie obličiek. Doteraz sa nepozorovali žiadne prípady MAHA po intravezikálnom použití mitomycínu.
Nové poznatky nasvedčujú, že môže byť vhodný liečebný cyklus na odstránenie imunitných komplexov, o ktorých sa zdá, že pri nástupe príznakov hrajú významnú úlohu prostredníctvom imunoadsorpcie stafylokokového proteínu A na stĺpcoch.
Staršie osobyStarší pacienti majú často zníženú fyziologickú funkciu, útlm kostnej drene, ktoré môžu mať predĺžené trvanie, takže u tejto populácie podávajte mitomycín zvlášť opatrne a zároveň dôkladne sledujte pacientov stav.
4.5 Liekové a iné interakcie
Možná interakcia počas systémovej liečbyMožné sú myelotoxické interakcie s inými liečebnými modalitami toxickými pre kostnú dreň (najmä inými cytotoxickými liekmi, žiarením).
Kombinácia s vinka alkaloidmi alebo bleomycínom môže zvýšiť pľúcnu toxicitu.
Zvýšené riziko hemolyticko-uremického syndrómu bolo hlásené u pacientov dostávajúcich súčasne intravenózny mitomycín a 5fluórouracil alebo tamoxifén.
Pri pokusoch na zvieratách viedlo podanie pyridoxínium chloridu (vitamínu B
6) k strate účinku mitomycínu.
V spojení s liečbou mitomycínom sa nemá očkovať žiadnymi živými vakcínami, keďže to môže viesť k zvýšenému riziku infekcie živou vakcínou.
Mitomycín môže zosilniť kardiotoxicitu doxorubicínu.
4.6 Fertilita, gravidita a laktácia
GraviditaNie sú k dispozícii údaje o použití mitomycínu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Mitomycín má mutagénny, teratogénny a karcinogénny účinok a preto môže narušiť vývoj embrya.
Žena nesmie otehotnieť počas liečby mitomycínom. V prípade otehotnenia počas liečby musí byť poskytnuté genetické poradenstvo.
DojčeniePredpokladá sa, že sa mitomycín vylučuje do ľudského mlieka. Vzhľadom k svojím dokázaným mutagénnym, teratogénnym a karcinogénnym účinkom, počas liečby liekom Mitomycin medac sa dojčenie musí prerušiť (pozri časť 4.3).
FertilitaŽeny vo fertilnom veku musia používať účinnú antikoncepciu alebo pohlavne abstinovať počas chemoterapie a počas 6 mesiacov po jej ukončení.
Mitomycín je genotoxický. Mužom liečeným mitomycínom sa preto odporúča nesplodiť dieťa počas liečby a do 6 mesiacov po jej ukončení, a poradiť sa o konzervácii spermy pred začiatkom liečby, vzhľadom k možnosti ireverzibilnej neplodnosti spôsobenej liečbou mitomycínom.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
I v prípade keď sa používa podľa návodu, tento liek môže spôsobiť nauzeu a vracanie a tým zhoršiť reakčný čas do takej miery, že sa zníži schopnosť viesť vozidlá a obsluhovať stroje. Toto platí ešte viac pri súbežnej konzumácii alkoholu.
4.8 Nežiaduce účinky
Prehľad nežiaducich účinkov je uvedený nižšie podľa triedy orgánových systémov a frekvencie výskytu. Frekvencie výskytu uvedené nižšie sú definované ako: Veľmi časté (³ 1/10), časté (³ 1/100 až < 1/10), menej časté (³ 1/1 000 až < 1/100), zriedkavé (³ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000) alebo neznáme (z dostupných údajov).
Možné nežiaduce reakcie počas intravezikálnej liečbyNežiaduce reakcie môžu byť výsledkom podania roztoku na intravezikálnu instiláciu, alebo hlbokej resekcie.
Najčastejšími nežiaducimi reakciami intravezikálne podaného mitomycínu sú kožné alergické reakcie vo forme miestneho exantému (napr. kontaktná dermatitída, tiež vo forme dlaňového alebo chodidlového erytému) a cystitída.
Poruchy kože a podkožného tkaniva
| Časté
Alergické kožné vyrážky, kontaktná dermatitída, palmárno-plantárny erytém, svrbenie
Zriedkavé
Generalizovaný exantém
|
Poruchy obličiek a močových ciest
| Časté
Cystitída (možno hemoragická), dyzúria, noktúria, polakiúria, hematúria, miestne podráždenie steny močového mechúra
Veľmi zriedkavé alebo neznáme
Nekrotizujúca cystitída, alergická (eozinofilná) cystitída, stenóza eferentnej časti močových ciest, znížená kapacita močového mechúra, zvápenatenie steny močového mechúra, fibróza steny močového mechúra, perforácia močového mechúra
Neznáme
v prípade extravazácie:
perforácia močového mechúra, nekróza (tukového) tkaniva v okolitej oblasti, vezikálna fistula, abscesy
|
Po intravezikálnom podaní sa do systémového obehu dostane len malé množstvo mitomycínu. Napriek tomu boli vo veľmi zriedkavých prípadoch hlásené nasledovné systémové nežiaduce účinky:
Možné systémové nežiaduce účinky, ku ktorým dochádza
veľmi zriedkavo po intravezikálnom podaní:
Poruchy krvi a lymfatického systému
| Leukocytopénia, trombocytopénia
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| Intersticiálna choroba pľúc
|
Poruchy gastrointestinálneho traktu
| Nauzea, vracanie, hnačka
|
Poruchy pečene a žlčových ciest
| Zvýšená hladina transamináz
|
Poruchy kože a podkožného tkaniva
| Aloplécia
|
Poruchy obličiek a močových ciest
| Porucha funkcie obličiek
|
Celkové poruchy a reakcie v mieste podania
| Horúčka
|
Možné nežiaduce reakcie počas systémovej liečbyNajčastejšími nežiaducimi reakciami mitomycínu podaného systémovo sú gastrointestinálne príznaky ako nauzea a vracanie, a útlm kostnej drene s leukopéniou a prevažne dominantnou trombocytopéniou. K takémuto útlmu kostnej drene dochádza až u 65 % pacientov.
Až u 10 % pacientov sa musí počítať so závažnou orgánovou toxicitou vo forme intersticiálneho zápalu pľúc alebo nefrotoxicity.
Mitomycín je potenciálne hepatotoxický.
Poruchy krvi a lymfatického systému
| Veľmi časté
Útlm kostnej drene, leukopénia, trombocytopénia
Zriedkavé
Hemolytická anémia, trombotická mikroangiopatia (TMA) vrátane trombotickej trombocytopenickej purpury (TTP)
Neznáme
Anémia
|
Infekcie a nákazy
| Zriedkavé
Život ohrozujúca infekcia, sepsa
Neznáme
Infekcia
|
Poruchy imunitného systému
| Veľmi zriedkavé
Ťažká alergická reakcia
|
Poruchy srdca a srdcovej činnosti
| Zriedkavé
Zlyhanie srdca po predchádzajúcej liečbe antracyklínmi
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| Časté
Intersticiálny zápal pľúc, dyspnoe, kašeľ, dýchavičnosť
Zriedkavé
Pľúcna hypertenzia, pľúcna venookluzívna choroba
|
Poruchy gastrointestinálneho traktu
| Veľmi časté
Nauzea, vracanie
Menej časté
Mukozitída, stomatitída, hnačka, anorexia
|
Poruchy pečene a žlčových ciest
| Zriedkavé
Porucha funkcie pečene, zvýšené hladiny transamináz, žltačka, venookluzívna choroba pečene
|
Poruchy kože a podkožného tkaniva
| Časté
Exantém, alergické kožné vyrážky, kontaktná dermatitída, palmárno-plantárny erytém
Menej časté
Aloplécia
Zriedkavé
Generalizovaný exantém
|
Poruchy obličiek a močových ciest
| Časté
Porucha funkcie obličiek, zvýšenie hladiny sérového kreatinínu, glomerulopatia, nefrotoxicita
Zriedkavé
Hemolyticko-uremický syndróm (HUS; často fatálny), mikroangiopaticko-hemolytická anémia (MAHA syndróm)
|
Celkové poruchy a reakcie v mieste podania
| Časté
Po extravazácii: Celulitída, nekróza tkaniva
Menej časté
Horúčka
|
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 Predávkovanie
V prípade predávkovania sa musí počítať so závažnou myelotoxicitou alebo dokonca s myeloftízou, ktorej plne rozvinutý klinický účinok sa dostaví iba po približne 2 týždňoch.
Doba, za ktorú počet leukocytov klesne na najnižšiu hodnotu, môže trvať 4 týždne. Preto, ak je podozrenie na predávkovanie, treba podrobne sledovať hematologické parametre počas dlhšej doby.
Doteraz však neboli hlásené žiadne prípady predávkovania mitomycínom intravezikálnym podaním.
Keďže nie je dostupné žiadne účinné antidotum, pri každom podaní treba byť maximálne opatrný.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Cytostatiká, cytotoxické antibiotiká a podobné liečivá, iné cytotoxické antibiotiká, ATC kód: L01DC03
Antibiotikum mitomycín je cytostatický liek zo skupiny alkylačných látok.
Mechanizmus účinkuMitomycín je antibiotikum s antineoplastickým účinkom, izolované zo
Streptomyces caespitosus. Nachádza sa v inaktívnej forme. K aktivácii na trifunkčnú alkylačnú látku dochádza rýchlo buď pri fyziologickej hodnote pH v prítomnosti NADPH v sére, alebo intracelulárne, prakticky vo všetkých telesných bunkách s výnimkou mozgu, keďže mitomycín neprekonáva hematoencefalickú bariéru. Všetky tri alkylačné radikály pochádzajú z chinónovej, aziridínovej a uretánovej skupiny. Mechanizmus účinku sa zakladá prevažne na alkylácii DNA (v menšej miere RNA), so zodpovedajúcou inhibíciou syntézy DNA. Stupeň poškodenia DNA koreluje s klinickým účinkom a je nižší u rezistentných buniek ako u citlivých buniek. Ako aj v u iných alkylačných látok, proliferujúce bunky sú poškodené do väčšej miery ako tie, ktoré sú v kľudovej fáze (G0) bunkového cyklu. Dodatočne sa uvoľňujú voľné peroxidové radikály, najmä v prípade vyšších dávok, čo vedie k zlomom v DNA. Uvoľňovanie peroxidových radikálov je spojené s orgánovo špecifickou kombináciou nežiaducich reakcií. '
5.2 Farmakokinetické vlastnosti
AbsorpciaPo intravezikálnom podaní sa len malá časť mitomycínu dostane do séra. Maximálne plazmatické hladiny 0,05 µg/ml sa zistili 40 minút po intravezikálnej instilácii 40 mg mitomycínu. To je výrazne nižšia hladina ako 0,4 µg/ml mitomycínu v sére, v prípade ktorej je známe, že spôsobuje myelosupresiu. Systémový účinok sa však nedá úplne vylúčiť.
Po intravenóznom podaní mitomycínu v dávke 10 – 20 mg/m² sa zistili maximálne plazmatické hladiny 0,4 – 3,2 μg/ml.
DistribúciaBiologický polčas je krátky, 40 až 50 minút. Sérové hladiny klesajú biexponenciálne, prudko do prvých 45 minút a potom klesajú pomalšie.
Po približne 3 hodinách sú sérové hladiny zvyčajne nižšie ako limit detekcie.
Biotransformácia a elimináciaHlavným miestom metabolizmu a eliminácie po systémovom podaní je pečeň. Preto sa vysoké koncentrácie mitomycínu zistili v žlčníku. Pokiaľ ide o elimináciu, renálna exkrécia hrá len malú úlohu.
5.3 Predklinické údaje o bezpečnosti
V štúdiách na zvieratách mal mitomycín toxický účinok na všetky proliferujúce tkanivá, predovšetkým na bunky kostnej drene a gastrointestinálnej sliznice, a spermatogenéza bola inhibovaná.
Mitomycín má mutagénne, karcinogénne a teratogénne vlastnosti, ktoré sa dajú preukázať na vhodných experimentálnych modeloch.
Ak sa podá mimo žily, alebo v prípade extravazácie do okolitého tkaniva, mitomycín spôsobuje závažnú nekrózu.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok na roztok na intravezikálne použitie: Močovina
Rozpúšťadlo pre intravezikálny roztok: Chlorid sodný a voda na injekcie.
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Mitomycin medac, injekčné liekovky so 40 mg mitomycínu a instilačnou súpravou1 rok
Po rekonštitúcii sa má liek použiť okamžite.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 25°C. Uchovávajte injekčnú liekovku vo vonkajšom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Mitomycin medac sa nachádza v injekčnej liekovke z priesvitného skla (typ I) s brómbutylovou gumovou zátkou potiahnutou fluoropolymérom a s hliníkovým odklápacím uzáverom.
Balenia s 1 injekčnou liekovkou (50 ml), 1 PVC vreckom s objemom 40 ml obsahujúcim 0,9 % roztok chloridu sodného, katétrami.
Balenia so 4 injekčnými liekovkami (50 ml), 4 PVC vreckami s objemom 40 ml obsahujúcimi 0,9 % roztok chloridu sodného, katétrami.
Balenia s 5 injekčnými liekovkami (50 ml), 5 PVC vreckami s objemom 40 ml obsahujúcimi 0,9 % roztok chloridu sodného, katétrami.
Balenia s 1 injekčnou liekovkou (50 ml), 1 PVC vreckom s objemom 40 ml obsahujúcim 0,9 % roztok chloridu sodného.
Balenia so 4 injekčnými liekovkami (50 ml), 4 PVC vreckami s objemom 40 ml obsahujúcimi 0,9 % roztok chloridu sodného.
Balenia s 5 injekčnými liekovkami (50 ml), 5 PVC vreckami s objemom 40 ml obsahujúcimi 0,9 % roztok chloridu sodného.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pred začatím rekonštitúcie lieku má byť k dispozícii katéter s kužeľovitou prípojkou.
Rozpusťte obsah jednej injekčnej liekovky Mitomycinu medac (zodpovedajúce 40 mg mitomycínu) v 40 ml sterilného injekčného roztoku chloridu sodného 9 mg/ml (0,9 %). Obsah injekčnej liekovky sa musí rozpustiť a vytvoriť modrofialový číry roztok do 2 minút.
Môžu sa použiť iba číre roztoky.
Obsah injekčných liekoviek je určený iba na jedno použitie/jeden vstup. Nepoužitý roztok sa musí zlikvidovať.
Chráňte rekonštituovaný roztok pred svetlom.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Návod na použitie rozpúšťadla na intravezikálny roztok (instilačná súprava)Obr. 1 – 8:
(1)

Roztrhnite ochranný kryt, ale neodstráňte ho úplne! Toto ochráni špičku instilačného zariadenia pred kontamináciou až do poslednej chvíle.
(2)

Odstráňte viečka z injekčnej liekovky a z instilačného zariadenia. Rozložte vak na odpad.
(3)

Umiestnite injekčnú liekovku na pevný povrch (napr. stôl) a pevne zatlačte konektor instilačného systému priamo na injekčnú liekovku.
(4)

Uistite sa, či ste trikrát úplne otočili injekčnou liekovkou.
(5)

Zlomením otvorte mechanizmus v rúrke konektora opakovaným ohýbaním dopredu a dozadu. Tak sa dosiahne spojenie. Počas tohto procesu držte rúrku, nie injekčnú liekovku!
(6)

Načerpajte tekutinu do injekčnej liekovky, ale nenaplňte ju úplne. Ak tekutina netečie, znova trikrát otočte injekčnou liekovkou druhým smerom, aby sa prepážka úplne perforovala. Tento krok opakujte dovtedy, kým tekutina nezačne tiecť.
(7)
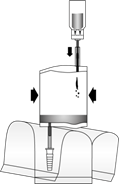
Prevráťte celé zariadenie. Načerpajte vzduch z instilačného systému do injekčnej liekovky vo vrchnej časti a natiahnite rekonštituovaný roztok mitomycínu do instilačného systému. Neodstraňujte injekčnú liekovku.
(8)
Držte instilačné zariadenie vo zvislej polohe. Teraz úplne odstráňte ochranný kryt. Pripojte katéter na instilačné zariadenie. Teraz odlomte tesniaci mechanizmus v trubicovej časti ohýbaním dozadu a dopredu a instilujte roztok do močového mechúra. Po ukončení instilácie uvoľnite katéter pretlačením vzduchu.
Nechajte instilačný systém stlačený a dajte ho spolu s katétrom do vaku na odpad.
7.DRŽITEĽ ROZHODNUTIA O REGISTRÁCIImedac Gesellschaft für klinische Spezialpräparate mbH
Theaterstr. 6
22880 Wedel
Nemecko
Tel.: +49 4103 8006-0
Fax: +49 4103 8006-100
8.REGISTRAČNÉ ČÍSLO44/0271/16-S
9.DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 22. jún 2016
Dátum posledného predĺženia registrácie: 28. októbra 2020
10.DÁTUM REVÍZIE TEXTU01/2021