
rných dýchacích ciest.
Závrat,somnolencia,stratavedomia,zmätenosťamentálnepoškodenie
Liečba pregabalínom sa dáva do súvisu so závratom a somnolenciou, ktoré mohli zvýšiť výskyt náhodných zranení (pádom) u staršej populácie. Existujú tiež hlásenia po uvedení lieku na trh o strate vedomia, zmätenosti a mentálnom poškodení. Preto pacientom sa má poradiť, aby boli opatrní, pokým sa neoboznámia s možnými účinkami lieku.
Účinkyspojenésvidením
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní dávkovania. V klinických štúdiách, v ktorých bolo zahrnuté aj oftalmologické vyšetrenie, bol výskyt zníženia zrakovej ostrosti a zmien zorného poľa väčší u pacientov liečených pregabalínom ako
u pacientov liečených placebom; výskyt zmien na očnom pozadí bol väčší u pacientov liečených placebom (pozri časť 5.1).
Po uvedení lieku na trh boli tiež hlásené nežiaduce reakcie na zrak, vrátane straty zraku, rozmazaného videnia alebo iných zmien zrakovej ostrosti, z ktorých mnohé boli prechodné. Prerušenie liečby pregabalínom môže viesť k vymiznutiu alebo zlepšeniu týchto zrakových príznakov.
Renálnezlyhávanie
Boli hlásené prípady renálneho zlyhávania a v niektorých prípadoch prerušenie liečby pregabalínom viedlo k reverzibilite tejto nežiaducej reakcie.
Vysadeniesúčasnepodávaných antiepileptík
Nie sú dostatočné údaje týkajúce sa vysadenia súčasne podávaných antiepileptík, akonáhle sa po pridaní pregabalínu dosiahne kontrola záchvatu tak, aby bolo možné podávať pregabalín
v monoterapii.
Abstinenčnépríznaky
Po ukončení krátkodobej a dlhodobej liečby pregabalínom boli u niektorých pacientov pozorované abstinenčné príznaky. Uvádzajú sa nasledujúce účinky: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, nervozita, depresia, bolesť, kŕče, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tom informovaný na začiatku liečby.
Počas užívania pregabalínu alebo krátko po ukončení liečby pregabalínom sa môžu vyskytnúť kŕče vrátane epileptických záchvatov a záchvatov typu grand mal.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť abstinenčných príznakov môžu byť závislé od dávky.
Kongestívnesrdcovézlyhávanie
Po uvedení lieku na trh boli hlásené prípady kongestívneho srdcového zlyhávania u niektorých pacientov dostávajúcich pregabalín. Tieto reakcie sú najčastejšie pozorované u starších pacientov
s kardiovaskulárnymi ochoreniami počas liečby pregabalínom na neuropatickú indikáciu. Pregabalín sa má u týchto pacientov podávať s opatrnosťou. Ukončenie podávania pregabalínu môže viesť
k odozneniu reakcie.
Liečbacentrálnejneuropatickejbolestivdôsledkupoškodeniamiechy
Pri liečbe centrálnej neuropatickej bolesti v dôsledku poškodenia miechy sa zaznamenal zvýšený výskyt nežiaducich reakcií všeobecne, nežiaducich reakcií centrálnej nervovej sústavy a zvlášť somnolencie. Môže sa to pripísať aditívnemu účinku sprievodnej liečby (napr. spazmolytikami) potrebnej pri tomto ochorení. Toto sa má zvážiť pri predpisovaní pregabalínu pri tomto ochorení.
Samovražednémyšlienkyasprávanie
Samovražedné myšlienky a správanie boli hlásené u pacientov liečených antiepileptikami pri niekoľkých indikáciách. Meta-analýza randomizovaných placebom kontrolovaných štúdií antiepileptík tiež ukázala málo zvýšené riziko samovražedných myšlienok a správania. Mechanizmus tohto rizika nie je známy a dostupné údaje nevylučujú možnosť zvýšeného rizika u pregabalínu.
Pacienti majú byť preto sledovaní kvôli znakom samovražedných myšlienok a správania a má sa u nich zvážiť vhodná liečba. Pacienti (a ich opatrovatelia) majú byť upozornení, aby vyhľadali lekársku pomoc, ak sa znaky samovražedných myšlienok alebo správania objavia.
Zhoršenáfunkciadolnéhotráviacehotraktu
Po uvedení lieku na trh boli hlásené prípady týkajúce sa zhoršenej funkcie dolného tráviaceho traktu (napr. intestinálna obštrukcia, paralytický ileus, obstipácia), keď sa pregabalín podával spolu s liekmi, ktoré môžu spôsobovať obstipáciu, ako sú napr. opioidné analgetiká. Keď sa bude pregabalín užívať
v kombinácii s opioidmi, môžu sa zvážiť opatrenia na predchádzanie obstipácii (zvlášť u žien a starších pacientov).
Zneužitie,
sklon
k
nadmernému
užívaniu
liekov
alebozávislosť
Boli hlásené prípady zneužitia, nadmerného užívania liekov a závislosti. Treba byť opatrný
u pacientov s anamnézou nadmerného užívania návykových látok a u takýchto pacientov majú byť sledované príznaky zneužitia pregabalínu, nadmerného užívania alebo závislosti (boli hlásené rozvoj tolerancie, zvýšovanie dávky, správanie vedúce k užitiu lieku).
Encefalopatia
Boli hlásené prípady encefalopatie, hlavne u pacientov s pridruženými stavmi, ktoré môžu vyvolať encefalopatiu.
Intolerancialaktózy
Lyrica obsahuje monohydrát laktózy. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, laponského deficitu laktázy alebo glukózo-galaktózovej malabsorpcie, nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Pretože pregabalín sa vylučuje prevažne v nezmenenej forme močom, podlieha zanedbateľnému metabolizmu u ľudí (< 2 % dávky zachytenej v moči vo forme metabolitov), neinhibuje liekový metabolizmus in vitro a neviaže sa na plazmatické proteíny, je nepravdepodobné, že by spôsobil alebo bol sám subjektom farmakokinetických interakcií.
In vivo štúdieapopulačnáfarmakokinetickáanalýza
Podobne, v in vivo štúdiách sa nepozorovali žiadne klinicky relevantné farmakokinetické interakcie medzi pregabalínom a fenytoínom, karbamazepínom, kyselinou valproovou, lamotrigínom, gabapentínom, lorazepamom, oxykodónom alebo etanolom. Populačná farmakokinetická analýza ukázala, že perorálne antidiabetiká, diuretiká, inzulín, fenobarbital, tiagabín a topiramát nemali klinicky významný účinok na klírens pregabalínu.
Perorálnekontraceptíva,noretisteróna/aleboetinylestradiol
Súbežné podávanie pregabalínu s perorálnymi kontraceptívami noretisterónom a/alebo etinylestradiolom nemá vplyv na farmakokinetiku v rovnovážnom stave žiadnej z týchto látok.
Liekyovplyvňujúcecentrálnynervovýsystém
Pregabalín môže zosilňovať účinky etanolu a lorazepamu. Opakované perorálne dávky pregabalínu podávané súbežne s oxykodónom, lorazepamom alebo etanolom v kontrolovaných klinických štúdiách neviedli ku klinicky významným účinkom na dýchanie. Po uvedení lieku na trh existujú hlásenia
o respiračnom zlyhaní a kóme u pacientov užívajúcich pregabalín a iné lieky utlmujúce centrálny nerovový systém (CNS). Ukazuje sa, že pregabalín má aditívny efekt pri poškodení kognitívnej
a hrubej motorickej funkcie spôsobenej oxykodónom.
Interakcieastaršieosoby
Žiadne špecifické štúdie farmakodynamických interakcií sa nevykonali u starších dobrovoľníkov. Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Ženyvreprodukčnomveku/Antikoncepciaumužovažien
Keďže potenciálne riziko pre ľudí nie je známe, ženy vo fertilnom veku musia používať účinnú antikoncepciu.
Gravidita
Nie sú k dispozícii dostatočné údaje o použití pregabalínu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko pre ľudí.
Lyrica sa má užívať počas gravidity iba v nevyhnutných prípadoch (ak prínos pre matku jednoznačne preváži potenciálne riziko pre plod).
Dojčenie
Pregabalín sa vylučuje do ľudského materského mlieka (pozri časť 5.2). Účinok pregabalínu na novorodencov/dojčatá nie je známy. Rozhodnutie, či ukončiť dojčenie alebo ukončiť liečbu pregabalínom, sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú k dispozícii klinické údaje o účinkoch pregabalínu na ženskú fertilitu.
V klinickom skúšaní hodnotiacom účinok pregabalínu na pohyblivosť spermií boli zdraví muži vystavení pregabalínu v dávke 600 mg/deň. Po 3 mesiacoch liečby sa nezistili žiadne účinky na pohyblivosť spermií.
Štúdia fertility na samičkách potkanov preukázala nežiaduce účinky na reprodukciu. Štúdie fertility na samčekoch potkanov preukázali nežiaduce účinky na reprodukciu a vývin. Klinický význam týchto zistení nie je známy (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Lyrica môže mať malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Lyrica môže vyvolať závraty a ospalosť, a preto môže ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje. Pacientom treba poradiť, aby neviedli vozidlá, neobsluhovali zložité stroje alebo sa nezapájali do iných potenciálne nebezpečných činností, pokiaľ nie je isté, či tento liek neovplyvňuje ich schopnosť vykonávať uvedené činnosti.
4.8 Nežiaduce účinky
Klinický program s pregabalínom zahrňoval viac ako 8 900 pacientov užívajúcich pregabalín,
z ktorých viac ako 5 600 bolo zaradených v dvojito-slepých placebom kontrolovaných štúdiách. Najčastejšie hlásenými nežiaducimi reakciami boli závraty a somnolencia. Nežiaduce reakcie boli zvyčajne ľahkej až strednej intenzity. Vo všetkých kontrolovaných štúdiách boli nežiaduce reakcie príčinou prerušenia liečby u 12 % pacientov užívajúcich pregabalín a u 5 % pacientov užívajúcich placebo. Najčastejšími nežiaducimi reakciami vedúcimi k prerušeniu liečby v skupinách
s pregabalínom boli závraty a somnolencia.
V tabuľke 2 nižšie sú všetky nežiaduce reakcie, ktoré sa vyskytli častejšie než pri placebe a viac než u jedného pacienta, zoradené podľa triedy a frekvencie (veľmi časté (³ 1/10); časté (³ 1/100 až
< 1/10); menej časté (³ 1/1 000 až < 1/100); zriedkavé (³ 1/10 000 až < 1/1 000); veľmi zriedkavé
(< 1/10 000), neznáme (nedá sa odhadnúť z dostupných údajov)).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Uvedené nežiaduce reakcie môžu tiež súvisieť so základným ochorením a/alebo sprievodnou liečbou. Pri liečbe centrálnej neuropatickej bolesti v dôsledku poškodenia miechy sa zaznamenal zvýšený
výskyt nežiaducich reakcií všeobecne, CNS nežiaducich reakcií a zvlášť somnolencie (pozri časť 4.4).
Ďalšie reakcie hlásené na základe skúseností po uvedení lieku na trh sú zaradené v zozname nižšie kurzívou.
 Tabuľka 2 Nežiaduce liekové reakcie pregabalínu
Trieda orgánových
systémov
Nežiaduce reakcie lieku
Infekcie a nákazy
Tabuľka 2 Nežiaduce liekové reakcie pregabalínu
Trieda orgánových
systémov
Nežiaduce reakcie lieku
Infekcie a nákazy
Časté Nazofaryngitída
Poruchy krvi a lymfatického systému Menej časté Neutropénia
Poruchy imunitného systémuMenej časté
hypersenzitivitaZriedkavé
angioedém, alergická reakciaPoruchy metabolizmu a výživyČasté zvýšená chuť do jedla Menej časté anorexia, hypoglykémia
Psychické poruchyČasté euforická nálada, zmätenosť, iritabilita, dezorientácia, insomnia,
pokles libida
Menej časté halucinácie, panický atak, nepokoj, agitovanosť, depresia, depresívna nálada, povznášajúca nálada,
agresivita, kolísanie nálady, depersonalizácia, ťažkosti s vyhľadávaním slov, abnormálne sny, vzostup libida, anorgazmia, apatia
Zriedkavé strata zábran
Poruchy nervového systémuVeľmi časté závraty, somnolencia, bolesť hlavy
Časté ataxia, porucha koordinácie, tremor, dyzartria, amnézia, poruchy pamäti, porucha koncentrácie, parestézia, hypestézia, sedácia, porucha rovnováhy, letargia
Menej časté synkopa, stupor, myoklonus,
strata vedomia, psychomotorická hyperaktivita, dyskinéza, posturálne závraty, intenčný tremor, nystagmus, kognitívne poruchy,
mentálne poškodenie, porucha reči, hyporeflexia, hyperestézia, pocit pálenia, strata chuti,
nevoľnosťZriedkavé
kŕče, parosmia, hypokinéza, dysgrafia
Poruchy okaČasté zahmlené videnie, diplopia
Menej časté strata periférneho videnia, poruchy videnia, opuch očí, defekty
v zornom poli, zníženie zrakovej ostrosti, bolesti oka, astenopia, fotopsia, suché oči, zvýšená lakrimácia, podráždenie očí
Zriedkavé
strata zraku, keratitída, oscilopsia, porušené hĺbkové videnie, mydriáza, strabizmus, porušená zraková ostrosť
Poruchy ucha a labyrintuČasté Vertigo Menej časté Hyperakúzia
Poruchy srdca a srdcovej činnostiMenej časté tachykardia, AV blokáda 1. stupňa, sínusová bradykardia,
kongestívne srdcové zlyhávanieZriedkavé
predĺženie QT, sínusová tachykardia, sínusová arytmia
Poruchy cievMenej časté hypotenzia, hypertenzia, návaly horúčavy, sčervenenie, periférny pocit chladu
Poruchy dýchacej sústavy, hrudníka a mediastínaMenej časté dyspnoe, epistaxa, kašeľ, upchatie nosa, rinitída, chrápanie, suchý nos
Zriedkavé
pľúcny edém, zovreté hrdlo
Trieda orgánových
systémov
Nežiaduce reakcie lieku
Poruchy gastrointestinálneho traktu
Časté vracanie, nauzea, obstipácia, hnačka, flatulencia, abdominálna distenzia, sucho v ústach
Menej časté gastroezofageálna refluxová choroba, zvýšená salivácia, znížená citlivosť v ústach
Zriedkavé ascites, pankreatitída, opuchnutý jazyk, dysfágia
Poruchy pečene a žlčových ciest
Menej časté
Zriedkavé
Veľmi zriedkavé
zvýšené hladiny pečeňových enzýmov*
žltačka
zlyhanie pečene, hepatitída
Poruchy kože a podkožného tkaniva
Menej časté papulózny exantém, žihľavka, hyperhidróza,
pruritusZriedkavé
Stevensov-Johnsonov syndróm, studený pot
,Poruchy kostrovej a svalovej sústavy a spojivového tkanivaČasté svalové kŕče, artralgia, bolesti chrbta, bolesti v končatinách, cervikálny spazmus

Menej časté opuch kĺbov, myalgia, svalové zášklby, bolesť šije, svalová stuhnutosť
Zriedkavé rabdomyolýza
Poruchy obličiek a močových ciestMenej časté močová inkontinencia, dyzúria
Zriedkavé renálne zlyhanie, oligúria
, retencia močuPoruchy reprodukčného systému a prsníkovČasté erektilná dysfunkcia
Menej časté sexuálna dysfunkcia, oneskorená ejakulácia, dysmenorea, bolesť prsníkov
Zriedkavé amenorea, výtok z prsníkov, zväčšenie prsníkov
, gynekomastiaCelkové poruchy a reakcie v mieste podaniaČasté periférny edém, edém, abnormálna chôdza, padanie, pocit opitosti, abnormálny pocit, únava
Menej časté generalizovaný edém,
edém tváre, pocit napätia na hrudníku, bolesť, pyrexia, smäd, triaška, asténia
Laboratórne a funkčné vyšetreniaČasté zvýšená hmotnosť
Menej časté zvýšená kreatínfosfokináza v krvi, zvýšená glukóza v krvi, znížený počet trombocytov, zvýšený kreatinín v krvi, znížený draslík v krvi, znížená hmotnosť
Zriedkavé znížený počet leukocytov v krvi
* Zvýšená hladina alanínaminotransferázy, zvýšená hladina aspartátaminotransferázy (AST).
Po ukončení krátkodobej a dlhodobej liečby pregabalínom sa u niektorých pacientov pozorovali abstinenčné príznaky. Uvádzajú sa nasledujúce reakcie: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, kŕče, nervozita, depresia, bolesť
, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tejto skutočnosti informovaný na začiatku liečby.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť abstinenčných príznakov môžu byť závislé od dávky.
PediatrickápopuláciaBezpečnostný profil pregabalínu pozorovaný v troch pediatrických štúdiách s pacientmi s parciálnymi záchvatmi s alebo bez sekundárnej generalizácie (12-týždňová štúdia účinnosti a bezpečnosti
u pacientov s výskytom parciálnych záchvatov, n = 295; štúdie farmakokinetiky a znášanlivosti, n =
65; a 1-ročná otvorená nadväzujúca štúdia bezpečnosti, n = 54) bol podobný bezpečnostnému profilu,
ktorý sa pozoroval v štúdiách u dospelých pacientov s epilepsiou. Najčastejšie nežiaduce udalosti pozorované v 12-týždňovej štúdii s liečbou pregabalínom boli ospalosť, pyrexia, infekcia horných dýchacích ciest, zvýšená chuť do jedla, zvýšená telesná hmotnosť a nazofaryngitída (pozri časti 4.2,
5.1 a 5.2).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePo uvedení lieku na trh najčastejšie hlásené nežiaduce reakcie pozorované po predávkovaní pregabalínom zahŕňali ospalosť, stavy zmätenosti, agitovanosť a nepokoj. Boli hlásené aj záchvaty.
V zriedkavých prípadoch bola hlásená kóma.
Liečba predávkovania pregabalínom musí zahrňovať štandardné podporné opatrenia a môže zahrňovať podľa potreby aj hemodialýzu (pozri časť 4.2 Tabuľka 1).
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antiepileptikum, iné antiepileptiká, ATC kód: N03AX16
Liečivo pregabalín je analógom gamaaminomaslovej kyseliny [(S)-3-(aminometyl)-5-metylhexánová kyselina].
MechanizmusúčinkuPregabalín sa viaže na auxiliárne podjednotky (a2-d proteíny) napäťovo ovládaných kalciových kanálov v centrálnom nervovom systéme.
KlinickáúčinnosťabezpečnosťNeuropatická bolesťÚčinnosť bola dokázaná v klinických skúšaniach u diabetickej neuropatie, postherpetickej neuralgie a poškodenia miechy. Účinnosť sa neštudovala na ostatných modeloch neuropatickej bolesti.
Pregabalín sa študoval v 10 kontrolovaných klinických skúšaniach v trvaní až do 13 týždňov
s dávkovaním dvakrát denne (BID) a až do 8 týždňov s dávkovaním trikrát denne (TID). Celkové profily bezpečnosti a účinnosti pri BID a TID dávkovacích režimoch boli podobné.
V klinických skúšaniach v trvaní až do 12 týždňov sa u periférnej ako aj centrálnej neuropatickej bolesti pozorovalo zníženie bolesti v 1. týždni a pretrvávalo počas celého obdobia liečby.
V kontrolovaných klinických skúšaniach u periférnej neuropatickej bolesti 35 % pregabalínom liečených pacientov a 18 % pacientov užívajúcich placebo dosiahlo 50 % zlepšenie v skóre bolesti. V prípade pacientov, u ktorých sa neprejavila ospalosť, sa takéto zlepšenie pozorovalo u 33 % pacientov liečených pregabalínom a u 18 % pacientov užívajúcich placebo. V prípade pacientov,
u ktorých sa prejavila ospalosť, bola miera odpovede na liečbu pregabalínom 48 % a na placebo 16 %.
V kontrolných klinických skúšaniach u centrálnej neuropatickej bolesti 22 % pacientov liečených pregabalínom a 7 % pacientov užívajúcich placebo dosiahlo 50 % zlepšenie v skóre bolesti.
Epilepsia
Prídavná liečba
Pregabalín sa študoval v 3 kontrolovaných klinických skúšaniach v trvaní 12 týždňov s dávkovaním BID alebo TID. Celkové profily bezpečnosti a účinnosti pri BID a TID dávkovacích režimoch boli podobné.
Zníženie frekvencie záchvatov sa pozorovalo v 1. týždni. Pediatrickápopulácia
Účinnosť a bezpečnosť pregabalínu ako doplnkovej liečby pri epilepsii u pediatrických pacientov
mladších ako 12 rokov a dospievajúcich nebola stanovená. Nežiaduce udalosti pozorované vo farmakokinetickej štúdii a štúdii znášanlivosti, do ktorých boli zaradení pacienti vo veku
od 3 mesiacov do 16 rokov (n = 65) s výskytom parciálnych záchvatov, boli podobné tým, ktoré sa pozorovali u dospelých. Výsledky z 12-týždňovej, placebom kontrolovanej štúdie s 295 pediatrickými pacientmi vo veku 4 až 16 rokov zameranej na zhodnotenie účinnosti a bezpečnosti pregabalínu ako podpornej terapie pri liečbe parciálnych záchvatov a z 1-ročnej otvorenej štúdie bezpečnosti u 54 pediatrických pacientov vo veku od 3 mesiacov do 16 rokov s epilepsiou naznačujú, že nežiaduce udalosti pyrexie a infekcií horných dýchacích ciest sa pozorovali častejšie ako v štúdiách u dospelých pacientov s epilepsiou (pozri časti 4.2, 4.8 a 5.2).
V 12-týždňovej, placebom kontrolovanej štúdii bol pediatrickým pacientom podaný pregabalín
v dávke 2,5 mg/kg/deň (maximálne 150 mg/deň), pregabalín v dávke 10 mg/kg/deň (maximálne 600 mg/deň) alebo placebo. Percentuálny podiel jedincov, u ktorých nastalo najmenej 50 % zníženie výskytu parciálnych záchvatov v porovnaní so začiatkom bol 40,6 % jedincov liečených pregabalínom v dávke 10 mg/kg/deň (p = 0,0068 oproti placebu), 29,1 % jedincov liečených pregabalínom v dávke
2,5 mg/kg/deň (p = 0,2600 oproti placebu) a 22,6 % jedincov, ktorí dostávali placebo.
Monoterapia(novodiagnostikovanípacienti)
Pregabalín sa študoval v 1 kontrolovanom klinickom skúšaní v trvaní 56 týždňov s dávkovaním BID. Pregabalín nebol horší oproti lamotrigínu, čo sa týka dosiahnutia 6-mesačného obdobia bez záchvatov na konci sledovania. Pregabalín a lamotrigín boli podobne bezpečné a dobre tolerované.
Generalizovanáúzkostnáporucha
Pregabalín sa študoval v 6 kontrolovaných klinických skúšaniach v trvaní 4 – 6 týždňov, v štúdii so staršími osobami v trvaní 8 týždňov a v dlhodobej štúdii zameranej na prevenciu relapsu s dvojito zaslepenou fázou zameranou na prevenciu relapsu v trvaní 6 mesiacov.
Ústup príznakov GAD vyjadrených Hamiltonovou škálou úzkosti (Hamilton Anxiety Rating
Scale = HAM-A) sa pozoroval v 1. týždni.
V kontrolovaných klinických skúšaniach (v trvaní 4 – 8 týždňnov) 52 % pacientov liečených pregabalínom a 38 % pacientov v skupine s placebom malo aspoň 50 % zlepšenie celkového HAM-A skóre od začiatku až po koniec sledovania.
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní v dávkovaní. Oftalmologické vyšetrenie (vrátane vyšetrenia zrakovej ostrosti, formálneho vyšetrenia zorného poľa a vyšetrenia očného pozadia pri rozšírených zreniciach) sa vykonalo u viac ako
3 600 pacientov v rámci kontrolovaných klinických skúšaní. U týchto pacientov bola zraková ostrosť znížená u 6,5 % pacientov liečených pregabalínom a 4,8 % pacientov liečených placebom. Zmeny zrakového poľa sa zistili u 12,4 % pacientov liečených pregabalínom a 11,7 % pacientov liečených placebom. Zmeny na očnom pozadí sa pozorovali u 1,7 % pacientov liečených pregabalínom a 2,1 % pacientov liečených placebom.
5.2 Farmakokinetické vlastnosti
Farmakokinetika pregabalínu v rovnovážnom stave je podobná u zdravých dobrovoľníkov, pacientov s epilepsiou užívajúcich antiepileptiká a pacientov s chronickou bolesťou.
Absorpcia
Pregabalín sa pri podaní nalačno rýchlo vstrebáva, maximálne plazmatické koncentrácie sa dosiahnu do 1 hodiny po podaní jednorazovej aj viacnásobnej dávky. Biologická dostupnosť pregabalínu po perorálnom podaní sa odhaduje na ³ 90 % a je nezávislá na dávke. Po opakovanom podaní sa rovnovážny stav dosiahne počas 24 až 48 hodín. Rýchlosť absorpcie pregabalínu sa zníži, keď sa podáva s jedlom, čo sa prejaví poklesom Cmax približne o 25 – 30 % a predĺžením tmax na približne
2,5 hodiny. Avšak podávanie pregabalínu s jedlom nemá klinicky signifikantný účinok na mieru
absorpcie pregabalínu.
Distribúcia
V predklinických štúdiách sa potvrdil prienik pregabalínu cez hematoencefalickú bariéru u myší, potkanov a opíc. Bolo dokázané, že pregabalín prechádza cez placentu u potkanov a nachádza sa
v mlieku laktujúcich potkanov. U človeka je zdanlivý distribučný objem pregabalínu po perorálnom podaní približne 0,56 l/kg. Pregabalín sa neviaže na plazmatické proteíny.
Biotransformácia
Pregabalín u človeka podlieha zanedbateľnému metabolizmu. Po podaní dávky rádionuklidom značeného pregabalínu približne 98 % rádioaktivity stanovenej v moči predstavoval nezmenený pregabalín. N-metylovaný derivát pregabalínu, hlavný metabolit pregabalínu v moči, predstavoval
0,9 %. V predklinických štúdiách sa nezistila racemizácia S-enancioméru pregabalínu na
R-enanciomér.
Eliminácia
Pregabalín sa eliminuje zo systémovej cirkulácie primárne renálnou exkréciou v nezmenenej forme. Priemerný eliminačný polčas je 6,3 hodiny. Plazmatický klírens a renálny klírens pregabalínu sú priamo úmerné klírensu kreatinínu (pozri časť 5.2 Poškodenie funkcie obličiek).
Je potrebné upraviť dávku u pacientov so zníženými renálnymi funkciami alebo u hemodialyzovaných pacientov (pozri časť 4.2 Tabuľka 1).
Linearita/ nelinearita
Farmakokinetika pregabalínu je lineárna v odporúčanom rozsahu denných dávok. Interindivuduálna farmakokinetická variabilita pregabalínu je nízka (< 20 %). Farmakokinetiku pri opakovaných dávkach možno predpovedať z údajov pri jednej dávke. Preto nie je potrebné bežné monitorovanie plazmatických koncentrácií pregabalínu.
Pohlavie
Klinické skúšania potvrdili, že pohlavie nemá klinicky signifikantný vplyv na plazmatické koncentrácie pregabalínu.
Poruchafunkcieobličiek
Klírens pregabalínu je priamo úmerný klírensu kreatinínu. Okrem toho sa pregabalín účinne odstraňuje z plazmy hemodialýzou (po 4-hodinovej hemodialýze klesnú plazmatické koncentrácie pregabalínu asi o 50 %). Vzhľadom na to, že eliminácia obličkami je hlavným spôsobom eliminácie, je potrebné zníženie dávky u pacientov s poruchou funkcie obličiek a doplnková dávka po hemodialýze (pozri časť 4.2 Tabuľka 1).
Poruchafunkciepečene
Neboli vykonané žiadne špecifické farmakokinetické štúdie u pacientov s poškodenými pečeňovými funkciami. Keďže pregabalín nepodlieha signifikantnému metabolizmu a vylučuje sa prednostne
v nezmenenej forme močom, neočakáva sa, že by poškodenie pečeňových funkcií signifikantne menilo plazmatické koncentrácie pregabalínu.
Pediatrickápopulácia
Farmakokinetika pregabalínu bola vyhodnocovaná u pediatrických pacientov s epilepsiou (vekové skupiny: 1 až 23 mesiacov, 2 až 6 rokov, 7 až 11 rokov a 12 až 16 rokov) pri hladinách dávky 2,5; 5;
10 a 15 mg/kg/deň vo farmakokinetickej štúdii a štúdii znášanlivosti.
Po perorálnom podaní pregabalínu u pediatrických pacientov nalačno, bol čas do dosiahnutia maximálnej plazmatickej koncentrácie vo všeobecnosti podobný v rámci všetkých vekových skupín a dosiahol sa 0,5 hodiny až 2 hodiny po podaní dávky.
Parametre Cmax a AUC pregabalínu sa zvyšovali priamo úmerne so zvyšujúcou sa dávkou v rámci každej vekovej skupiny. AUC bola nižšia o 30 % u pediatrických pacientov s telesnou hmotnosťou menej ako 30 kg z dôvodu klírensu upraveného na základe telesnej hmotnosti zvýšeného o 43 %
u týchto pacientov v porovnaní s pacientmi s telesnou hmotnosťou ≥ 30 kg.
Terminálny polčas pregabalínu sa pohyboval v priemere od 3 do 4 hodín u pediatrických pacientov vo veku do 6 rokov a od 4 do 6 hodín u tých, ktorí boli vo veku 7 rokov a starší.
Analýza populačnej farmakokinetiky preukázala, že klírens kreatinínu bol významným vedľajším parametrom klírensu pregabalínu po perorálnom podaní, telesná hmotnosť bola významným vedľajším parametrom zdanlivého distribučného objemu pregabalínu po perorálnom podaní a tieto vzťahy boli podobné u pediatrických a dospelých pacientov.
Farmakokinetika pregabalínu u pacientov mladších ako 3 mesiace nebola skúmaná (pozri časti 4.2,
4.8 a 5.1).
Staršieosoby
Klírens pregabalínu má tendenciu klesať so stúpajúcim vekom. Tento pokles klírensu pregabalínu je v súlade s poklesom klírensu kreatinínu, ktorý je podmienený stúpajúcim vekom. Zníženie dávky pregabalínu sa môže vyžadovať u pacientov pri vekom podmienenom poškodení renálnych funkcií (pozri časť 4.2 Tabuľka 1).
Dojčiacematky
Farmakokinetika 150 mg pregabalínu podávaných každých 12 hodín (300 mg denná dávka) bola vyhodnocovaná u 10 žien počas laktácie, ktoré boli aspoň 12 týždňov po pôrode. Laktácia mala malý až žiadny vplyv na farmakokinetiku pregabalínu. Pregabalín sa vylučoval do materského mlieka
s priemernými koncentráciami v ustálenom stave približne 76 % z plazmatických koncentrácií
u matiek. Odhadovaná dávka u dojčaťa z materského mlieka (za predpokladu priemernej konzumácie mlieka 150 ml/kg/deň) žien užívajúcich 300 mg/deň by bola 0,31 mg/kg/deň alebo 0,62 mg/kg/deň
u žien užívajúcich maximálnu dávku 600 mg/deň. Tieto odhadované dávky predstavujú približne 7 %
celkovej dennej dávky u matky v mg/kg.
5.3 Predklinické údaje o bezpečnosti
V obvyklých farmakologických štúdiách bezpečnosti u zvierat bol pregabalín dobre tolerovaný
v klinicky relevantných dávkach. V štúdiách toxicity po opakovanom podávaní u potkanov a opíc sa pozorovali účinky na CNS vrátane hypoaktivity, hyperaktivity a ataxie. Zvýšená incidencia atrofie retiny, bežne pozorovaná u starnúcich potkaních albínov, sa zistila po dlhodobej expozícii pregabalínu v dávkach ≥ 5-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke.
Pregabalín nebol teratogénny u myší, potkanov ani u králikov. Fetálna toxicita u potkanov a králikov sa vyskytla iba pri dávkach dostatočne prevyšujúcich dávku pre človeka.
V prenatálnych/postnatálnych štúdiách toxicity pregabalín vyvolával vývojovú toxicitu u potomkov potkanov v dávkach > 2-krát vyššších, než je odporúčaná maximálna dávka pre človeka.
Nežiaduce účinky na fertilitu u samčekov a samičiek potkanov sa pozorovali iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia. Nežiaduce účinky na samčie reprodukčné orgány a parametre spermií boli reverzibilné a vyskytli sa iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia, alebo boli spojené so spontánnymi degeneratívnymi procesmi na samčích reprodukčných orgánoch u potkana. Preto sa týmto účinkom pripisuje malý alebo žiadny klinický význam.
Na základe výsledkov mnohých in vitro a in vivo skúšok možno prehlásiť, že pregabalín nie je genotoxický.
Dvojročné štúdie karcinogenicity s pregabalínom boli vykonané na potkanoch a myšiach. Nepozorovali sa žiadne nádory u potkanov v dávkach až do 24-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke 600 mg/deň. U myší sa nezistil zvýšený výskyt nádorov v dávkach podobných priemernej dávke u človeka, ale zvýšený výskyt hemangiosarkómov sa pozoroval pri vyšších dávkach. Negenotoxický mechanizmus tvorby pregabalínom indukovaných nádorov u myší zahrňuje zmeny krvných doštičiek a súvisiacu proliferáciu endoteliálnych buniek. Tieto zmeny krvných doštičiek neboli prítomné u potkanov alebo u ľudí na základe krátkodobých
a limitovaných dlhodobých klinických údajov. Neexistuje dôkaz, ktorý by naznačoval súvisiace riziko u ľudí.
U mladých potkanov sa druhy toxicity kvantitatívne nelíšili od tých, ktoré sa pozorovali u dospelých potkanov. Avšak mladé potkany sú oveľa senzitívnejšie. Pri terapeutických dávkach sa dokázali klinické príznaky hyperaktivity CNS a bruxizmus a niektoré zmeny v raste (prechodné potlačenie prírastku telesnej hmotnosti). Účinky na pohlavný cyklus sa pozorovali pri 5-násobku terapeutickej dávky u človeka. Znížená odpoveď na akustický podnet sa pozorovala u mladých potkanov
1 - 2 týždne po expozícii pri > 2-násobku terapeutickej dávky u človeka. Deväť týždňov po expozícii sa už tento účinok viac nepozoroval.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Lyrica 25mg,50 mg,150 mgtvrdékapsuly
Obsah kapsuly:
monohydrát laktózy kukuričný škrob mastenec
Obalkapsuly:
želatína
oxid titaničitý (E171)
laurylsíran sodný
koloidný oxid kremičitý bezvodý čistená voda
Potlač:
šelak
čierny oxid železitý (E172)
propylénglykol hydroxid draselný
Lyrica 75mg,100 mg,200 mg,225 mg,300 mgtvrdékapsuly
Obsah kapsuly:
monohydrát laktózy kukuričný škrob mastenec
Obalkapsuly:
želatína
oxid titaničitý (E171)
laurylsíran sodný
koloidný oxid kremičitý bezvodý čistená voda
červený oxid železitý (E172)
Potlač:
šelak
čierny oxid železitý (E172)
propylénglykol hydroxid draselný
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Lyrica25mgtvrdékapsuly
PVC/Al blistre obsahujúce 14, 21, 56, 84, 100 alebo 112 (2 x 56) tvrdých kapsúl.
100 x 1 tvrdá kapsula v PVC/Alu perforovaný blister s jednotlivými dávkami. HDPE fľašky obsahujúce 200 tvrdých kapsúl.
Na trh nemusia byť uvedené všetky veľkosti balenia.
Lyrica50mgtvrdékapsuly
PVC/Al blistre obsahujúce 14, 21, 56, 84 alebo 100 tvrdých kapsúl.
100 x 1 tvrdá kapsula v PVC/Alu perforovaný blister s jednotlivými dávkami. Na trh nemusia byť uvedené všetky veľkosti balenia.
Lyrica75mgtvrdékapsuly
PVC/Al blistre obsahujúce 14, 56, 70, 100 alebo 112 (2 x 56) tvrdých kapsúl.
100 x 1 tvrdá kapsula v PVC/Alu perforovaný blister s jednotlivými dávkami. HDPE fľašky obsahujúce 200 tvrdých kapsúl.
Na trh nemusia byť uvedené všetky veľkosti balenia.
Lyrica100mgtvrdékapsuly
PVC/Al blistre obsahujúce 21, 84 alebo 100 tvrdých kapsúl.
100 x 1 tvrdá kapsula v PVC/Al bu perforovaný blister s jednotlivými dávkami. Na trh nemusia byť uvedené všetky veľkosti balenia.
Lyrica150
mg
tvrdé
kapsuly
PVC/Al blistre obsahujúce 14, 56, 100 alebo 112 (2 x 56) tvrdých kapsúl.
100 x 1 tvrdá kapsula v PVC/Alu perforovaný blister s jednotlivými dávkami. HDPE fľašky obsahujúce 200 tvrdých kapsúl.
Na trh nemusia byť uvedené všetky veľkosti balenia.
Lyrica200mgtvrdékapsuly
PVC/Al blistre obsahujúce 21, 84 alebo 100 tvrdých kapsúl.
100 x 1 tvrdá kapsula v PVC/Alu perforovaný blister s jednotlivými dávkami. Na trh nemusia byť uvedené všetky veľkosti balenia.
Lyrica225mgtvrdékapsuly
PVC/Al blistre obsahujúce 14, 56 alebo 100 tvrdých kapsúl.
100 x 1 tvrdá kapsula v PVC/Alu perforovaný blister s jednotlivými dávkami. Na trh nemusia byť uvedené všetky veľkosti balenia.
Lyrica300mgtvrdékapsuly
PVC/Al blistre obsahujúce 14, 56, 100 alebo 112 (2 x 56) tvrdých kapsúl.
100 x 1 tvrdá kapsula v PVC/Alu perforovaný blister s jednotlivými dávkami. HDPE fľašky obsahujúce 200 tvrdých kapsúl.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky na likvidáciu.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Pfizer Limited Ramsgate Road Sandwich
Kent
CT13 9NJ Veľká Británia
8. REGISTRAČNÉ ČÍSLA
Lyrica25mgtvrdékapsuly
EU/1/04/279/001 – 005
EU/1/04/279/026
EU/1/04/279/036
EU/1/04/279/046
Lyrica50mgtvrdékapsuly
EU/1/04/279/006-010
EU/1/04/279/037
Lyrica75mgtvrdékapsuly
EU/1/04/279/011-013
EU/1/04/279/027
EU/1/04/279/030
EU/1/04/279/038
EU/1/04/279/045
Lyrica100
mg
tvrdé
kapsuly
EU/1/04/279/014-016
EU/1/04/279/39
Lyrica150mgtvrdékapsulyEU/1/04/279/017-019
EU/1/04/279/028
EU/1/04/279/031
EU/1/04/279/040
Lyrica200mgtvrdékapsulyEU/1/04/279/020 – 022
EU/1/04/279/041
Lyrica225mgtvrdékapsulyEU/1/04/279/033 – 035
EU/1/04/279/042
Lyrica300mgtvrdékapsulyEU/1/04/279/023 – 025
EU/1/04/279/029
EU/1/04/279/032
EU/1/04/279/043
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 06. júl 2004
Dátum posledného predĺženia: 06. júl 2009
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Lyrica 20 mg/ml perorálny roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml obsahuje 20 mg pregabalínu. Pomocnélátkysoznámymúčinkom
Každý ml obsahuje 1,3 mg metylparabénu (E218), 0,163 mg propylparabénu (E216).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Perorálny roztok
Číra bezfarebná tekutina.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Neuropatickábolesť
Lyrica je indikovaná na liečbu periférnej a centrálnej neuropatickej bolesti u dospelých.
Epilepsia
Lyrica je indikovaná ako prídavná liečba u dospelých s parciálnymi záchvatmi s alebo bez sekundárnej generalizácie.
Generalizovanáúzkostnáporucha
Lyrica je indikovaná na liečbu generalizovanej úzkostnej poruchy (GAD = Generalised Anxiety
Disorder) u dospelých.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Rozsah dávkovania je 150 až 600 mg denne (7,5 až 30 ml), podáva sa rozdelene v dvoch alebo troch dávkach.
Neuropatická bolesť
Liečbu pregabalínom možno začať dávkou 150 mg (7,5 ml) denne, ktorá sa podáva rozdelená v dvoch alebo troch dávkach. Podľa individuálnej odpovede pacienta a tolerancie možno dávku po
3 až 7-dňovom intervale zvýšiť na 300 mg (15 ml) denne a ak je to potrebné, až na maximálnu dávku
600 mg (30 ml) denne po ďalšom 7-dňovom intervale.
Epilepsia
Liečbu pregabalínom možno začať dávkou 150 mg (7,5 ml) denne, ktorá sa podáva rozdelená v dvoch alebo troch dávkach. Podľa individuálnej odpovede pacienta a tolerancie možno dávku po 1 týždni zvýšiť na 300 mg (15 ml) denne. Maximálnu dennú dávku 600 mg (30 ml) možno dosiahnuť po ďalšom týždni.
Generalizovaná úzkostná porucha
Rozsah dávkovania je 150 až 600 mg (7,5 až 30 ml) denne, podáva sa rozdelene v dvoch alebo troch dávkach. Potreba liečby sa musí pravidelne opakovane posúdiť.
Liečbu pregabalínom možno začať dávkou 150 mg (7,5 ml) denne. Podľa individuálnej odpovede pacienta a tolerancie možno dávku po 1 týždni zvýšiť na 300 mg (15 ml) denne. Po ďalšom týždni možno dávku zvýšiť na 450 mg (22,5 ml) denne. Maximálnu dennú dávku 600 mg (30 ml) možno dosiahnuť po ďalšom týždni.
Prerušenie liečby pregabalínom
V súlade so súčasnou klinickou praxou, ak sa musí liečba pregabalínom prerušiť, odporúča sa, aby sa to urobilo postupne počas minimálne 1 týždňa bez ohľadu na indikáciu (pozri časť 4.4 a 4.8).
Poruchafunkcieobličiek
Pregabalín sa zo systémovej cirkulácie primárne eliminuje v nezmenenej forme renálnou exkréciou. Keďže klírens pregabalínu je priamo úmerný klírensu kreatinínu (pozri časť 5.2), dávka u pacientov
s poškodenými renálnymi funkciami sa musí znižovať individuálne podľa klírensu kreatinínu (CLcr), ako je uvedené v tabuľke 1 použitím nasledovného vzorca:
é1,23 ´ [140 - vek (roky)] x hmotnoť (kg) ù

CLcr (ml/min) = ê
êë
kreatinín v sére ( mmol/l)
ú ( x 0,85 u žien)
úû
Pregabalín možno efektívne odstrániť z plazmy hemodialýzou (50 % lieku počas 4 hodín).
U hemodialyzovaných pacientov sa denná dávka pregabalínu musí upraviť podľa renálnych funckcií. K dennej dávke treba pridať doplnkovú dávku okamžite po každej 4-hodinovej hemodialýze (pozri tabuľku 1).
Tabuľka 1 Úprava dávky pregabalínu podľa renálnych funkcií
Klírens kreatinínu
(CLcr) (ml/min)
Celková denná dávka pregabalínu* Dávkovací režim
Úvodná dávka
(mg/deň)
Maximálna dávka
(mg/deň)
≥ 60 150 (7,5 ml) 600 (30 ml) BID alebo TID
≥ 30 – < 60 75 (3,75 ml) 300 (15 ml) BID alebo TID
≥ 15 – < 30 25 – 50
(1,25 - 2,5 ml)
150 (7,5 ml) Jedenkrát denne alebo BID
< 15 25 (1,25 ml) 75 (3,75 ml) Jedenkrát denne
Doplnkové dávkovanie po hemodialýze (mg)
25 (1,25 ml) 100 (5 ml) Jedna dávka+
TID = tri rozdelené dávky
BID = dve rozdelené dávky
* Celková denná dávka (mg/deň) sa má rozdeliť podľa dávkovacieho režimu a vyjadriť v mg/dávka
+ Doplnková dávka je jedna dodatočná dávka
PoruchafunkciepečeneNevyžaduje sa žiadna úprava dávky u pacientov s poruchou funkcie pečene (pozri časť 5.2).
PediatrickápopuláciaBezpečnosť a účinnosť LYRICY u detí mladších ako 12 rokov a u dospievajúcich (vo veku
12 - 17 rokov) neboli stanovené. Údaje dostupné v súčasnosti sú uvedené v časti 4.8, 5.1 a 5.2, ale nie je možné vykonať odporúčanie týkajúce sa dávkovania.
Staršieosoby
Starší pacienti môžu vyžadovať zníženie dávky pregabalínu z dôvodu zníženej renálnej funkcie (pozri časť 5.2).
Spôsobpodávania
Lyrica sa môže užívať s jedlom aj bez jedla. Lyrica je určená iba na perorálne použitie.
Spolu s liekom sa dodáva kalibrovaná striekačka na perorálne podanie a stláčací nadstavec na fľašku (Press-In Bottle Adapter, PIBA). Informácie o podaní, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Diabetickípacienti
Podľa súčasnej klinickej praxe u niektorých diabetických pacientov s prírastkom hmotnosti počas liečby pregabalínom môže byť potrebné upraviť hypoglykemickú liečbu.
Reakciezprecitlivenosti
Po uvedení lieku na trh boli zaznamenané hlásenia o rekciách z precitlivenosti vrátane prípadov angioedému. Liečba pregabalínom sa musí okamžite ukončiť, ak sa vyskytnú príznaky angioedému, ako sú faciálny, periorálny opuch alebo opuch horných dýchacích ciest.
Závrat,somnolencia,stratavedomia,zmätenosťazhoršeniementálnych funkcií
Liečba pregabalínom sa dáva do súvisu so závratom a somnolenciou, ktoré mohli zvýšiť výskyt náhodných zranení (pádom) u staršej populácie. Existujú tiež hlásenia po uvedení lieku na trh o strate vedomia, zmätenosti a zhoršení mentálnych funkcií. Preto sa má pacientom poradiť, aby boli opatrní, pokým sa neoboznámia s možnými účinkami lieku.
Účinkyspojenés videním
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní dávkovania. V klinických štúdiách, v ktorých bolo zahrnuté aj oftalmologické vyšetrenie, bol výskyt zníženia zrakovej ostrosti a zmien zorného poľa väčší u pacientov liečených pregabalínom ako
u pacientov liečených placebom; výskyt zmien na očnom pozadí bol väčší u pacientov liečených placebom (pozri časť 5.1).
Po uvedení lieku na trh boli tiež hlásené nežiaduce reakcie na zrak, vrátane straty zraku, rozmazaného videnia alebo iných zmien zrakovej ostrosti, z ktorých mnohé boli prechodné. Prerušenie liečby pregabalínom môže viesť k vymiznutiu alebo zlepšeniu týchto zrakových príznakov.
Renálnezlyhávanie
Boli hlásené prípady renálneho zlyhávania a v niektorých prípadoch prerušenie liečby pregabalínom viedlo k reverzibilite tejto nežiaducej reakcie.
Vysadeniesúčasnepodávanýchantiepileptík
Nie sú dostatočné údaje týkajúce sa vysadenia súčasne podávaných antiepileptík, akonáhle sa po pridaní pregabalínu dosiahne kontrola záchvatu tak, aby bolo možné podávať pregabalín
v monoterapii.
Abstinenčnépríznaky
Po ukončení krátkodobej a dlhodobej liečby pregabalínom boli u niektorých pacientov pozorované abstinenčné príznaky. Uvádzajú sa nasledujúce účinky: insomnia, bolesť hlavy, nauzea, úzkosť,
hnačka, chrípkový syndróm, nervozita, depresia, bolesť, kŕče, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tom informovaný na začiatku liečby.
Počas užívania pregabalínu alebo krátko po ukončení liečby pregabalínom sa môžu vyskytnúť kŕče vrátane epileptických záchvatov a záchvatov typu grand mal.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť abstinenčných príznakov môžu byť závislé od dávky.
Kongestívnesrdcovézlyhávanie
Po uvedení lieku na trh boli hlásené prípady kongestívneho srdcového zlyhávania u niektorých pacientov dostávajúcich pregabalín. Tieto reakcie sú najčastejšie pozorované u starších pacientov
s kardiovaskulárnymi ochoreniami počas liečby pregabalínom na neuropatickú indikáciu. Pregabalín sa má u týchto pacientov podávať s opatrnosťou. Ukončenie podávania pregabalínu môže viesť
k odozneniu reakcie.
Liečbacentrálnejneuropatickejbolestivdôsledkupoškodeniamiechy
Pri liečbe centrálnej neuropatickej bolesti v dôsledku poškodenia miechy sa zaznamenal zvýšený výskyt nežiaducich reakcií všeobecne, nežiaducich reakcií centrálnej nervovej sústavy a zvlášť somnolencie. Môže sa to pripísať aditívnemu účinku sprievodnej liečby (napr. spazmolytikami) potrebnej pri tomto ochorení. Toto sa má zvážiť pri predpisovaní pregabalínu pri tomto ochorení.
Samovražednémyšlienkyasprávanie
Samovražedné myšlienky a správanie boli hlásené u pacientov liečených antiepileptikami pri niekoľkých indikáciách. Meta-analýza randomizovaných placebom kontrolovaných štúdií antiepileptík tiež ukázala málo zvýšené riziko samovražedných myšlienok a správania. Mechanizmus tohto rizika nie je známy a dostupné údaje nevylučujú možnosť zvýšeného rizika u pregabalínu.
Pacienti majú byť preto sledovaní kvôli znakom samovražedných myšlienok a správania a má sa u nich zvážiť vhodná liečba. Pacienti (a ich opatrovatelia) majú byť upozornení, aby vyhľadali lekársku pomoc, ak sa znaky samovražedných myšlienok alebo správania objavia.
Zhoršenáfunkciadolnéhotráviacehotraktu
Po uvedení lieku na trh boli hlásené prípady týkajúce sa zhoršenej funkcie dolného tráviaceho traktu (napr. intestinálna obštrukcia, paralytický ileus, obstipácia), keď sa pregabalín podával spolu s liekmi, ktoré môžu spôsobovať obstipáciu, ako sú napr. opioidné analgetiká. Keď sa bude pregabalín užívať
v kombinácii s opioidmi, môžu sa zvážiť opatrenia na predchádzanie obstipácii (zvlášť u žien a starších pacientov).
Zneužitie,sklonknadmernémuužívaniuliekovalebozávislosť
Boli hlásené prípady zneužitia, nadmerného užívania liekov a závislosti. Treba byť opatrný
u pacientov s anamnézou nadmerného užívania návykových látok a u takýchto pacientov majú byť sledované príznaky zneužitia pregabalínu, nadmerného užívania alebo závislosti (boli hlásené rozvoj tolerancie, zvýšovanie dávky, správanie vedúce k užitiu lieku).
Encefalopatia
Boli hlásené prípady encefalopatie, hlavne u pacientov s pridruženými stavmi, ktoré môžu vyvolať encefalopatiu.
Pomocnélátky,ktorémôžuvyvolaťalergickéreakcie
Lyrica perorálny roztok obsahuje metylparabén a propylparabén, ktoré môžu vyvolať alergickú reakciu (pravdepodobne oneskorenú).
4.5 Liekové a iné interakcie
Pretože pregabalín sa vylučuje prevažne v nezmenenej forme močom, podlieha zanedbateľnému metabolizmu u ľudí (< 2 % dávky zachytenej v moči vo forme metabolitov), neinhibuje liekový metabolizmus in vitro a neviaže sa na plazmatické proteíny, je nepravdepodobné, že by spôsobil alebo bol sám subjektom farmakokinetických interakcií.
In vivo štúdieapopulačnáfarmakokinetickáanalýza
Podobne, v in vivo štúdiách sa nepozorovali žiadne klinicky relevantné farmakokinetické interakcie medzi pregabalínom a fenytoínom, karbamazepínom, kyselinou valproovou, lamotrigínom, gabapentínom, lorazepamom, oxykodónom alebo etanolom. Populačná farmakokinetická analýza ukázala, že perorálne antidiabetiká, diuretiká, inzulín, fenobarbital, tiagabín a topiramát nemali klinicky významný účinok na klírens pregabalínu.
Perorálnekontraceptíva,noretisteróna/aleboetinylestradiol
Súbežné podávanie pregabalínu s perorálnymi kontraceptívami noretisterónom a/alebo etinylestradiolom nemá vplyv na farmakokinetiku v rovnovážnom stave žiadnej z týchto látok.
Liekyovplyvňujúcecentrálnynervovýsystém
Pregabalín môže zosilňovať účinky etanolu a lorazepamu. Opakované perorálne dávky pregabalínu podávané súbežne s oxykodónom, lorazepamom alebo etanolom v kontrolovaných klinických štúdiách neviedli ku klinicky významným účinkom na dýchanie. Po uvedení lieku na trh existujú hlásenia
o respiračnom zlyhaní a kóme u pacientov užívajúcich pregabalín a iné lieky utlmujúce centrálny nerovový systém (CNS). Ukazuje sa, že pregabalín má aditívny efekt pri poškodení kognitívnej
a hrubej motorickej funkcie spôsobenej oxykodónom.
Interakcieastaršieosoby
Žiadne špecifické štúdie farmakodynamických interakcií sa nevykonali u starších dobrovoľníkov. Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Ženyvreprodukčnomveku/Antikoncepciaumužovažien
Keďže potenciálne riziko pre ľudí nie je známe, ženy vo fertilnom veku musia používať účinnú antikoncepciu.
Gravidita
Nie sú k dispozícii dostatočné údaje o použití pregabalínu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko pre ľudí.
Lyrica sa má užívať počas gravidity iba v nevyhnutných prípadoch (ak prínos pre matku jednoznačne preváži potenciálne riziko pre plod).
Dojčenie
Pregabalín sa vylučuje do ľudského materského mlieka (pozri časť 5.2). Účinok pregabalínu na novorodencov/dojčatá nie je známy. Rozhodnutie, či ukončiť dojčenie alebo ukončiť liečbu pregabalínom, sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú k dispozícii klinické údaje o účinkoch pregabalínu na ženskú fertilitu.
V klinickom skúšaní hodnotiacom účinok pregabalínu na pohyblivosť spermií boli zdraví muži vystavení pregabalínu v dávke 600 mg/deň. Po 3 mesiacoch liečby sa nezistili žiadne účinky na pohyblivosť spermií.
Štúdia fertility na samičkách potkanov preukázala nežiaduce účinky na reprodukciu. Štúdie fertility na samčekoch potkanov preukázali nežiaduce účinky na reprodukciu a vývin. Klinický význam týchto zistení nie je známy (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeLyrica môže mať malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Lyrica môže vyvolať závraty a ospalosť, a preto môže ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje. Pacientom treba poradiť, aby neviedli vozidlá, neobsluhovali zložité stroje alebo sa nezapájali do iných potenciálne nebezpečných činností, pokiaľ nie je isté, či tento liek neovplyvňuje ich schopnosť vykonávať uvedené činnosti.
4.8 Nežiaduce účinkyKlinický program s pregabalínom zahrňoval viac ako 8 900 pacientov užívajúcich pregabalín,
z ktorých viac ako 5 600 bolo zaradených v dvojito-slepých placebom kontrolovaných štúdiách. Najčastejšie hlásenými nežiaducimi reakciami boli závraty a somnolencia. Nežiaduce reakcie boli zvyčajne ľahkej až strednej intenzity. Vo všetkých kontrolovaných štúdiách boli nežiaduce reakcie príčinou prerušenia liečby u 12 % pacientov užívajúcich pregabalín a u 5 % pacientov užívajúcich placebo. Najčastejšími nežiaducimi reakciami vedúcimi k prerušeniu liečby v skupinách
s pregabalínom boli závraty a somnolencia.
V tabuľke 2 nižšie sú všetky nežiaduce reakcie, ktoré sa vyskytli častejšie než pri placebe a viac než u jedného pacienta, zoradené podľa triedy a frekvencie (veľmi časté (³ 1/10); časté (³ 1/100 až
< 1/10); menej časté (³ 1/1 000 až < 1/100); zriedkavé (³1/10 000 až < 1/1 000); veľmi zriedkavé
(<1/10 000), neznáme (nedá sa odhadnúť z dostupných údajov)).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.'
Uvedené nežiaduce reakcie môžu tiež súvisieť so základným ochorením a/alebo sprievodnou liečbou. Pri liečbe centrálnej neuropatickej bolesti v dôsledku poškodenia miechy sa zaznamenal zvýšený
výskyt nežiaducich reakcií všeobecne, CNS nežiaducich reakcií a zvlášť somnolencie (pozri časť 4.4).
Ďalšie reakcie hlásené na základe skúseností po uvedení lieku na trh sú zaradené v zozname nižšie kurzívou ako Frekvencia nie je známa.
Ďalšie reakcie hlásené na základe skúseností po uvedení lieku na trh sú zaradené v zozname nižšie kurzívou.
Tabuľka 2 Nežiaduce liekové reakcie pregabalínuTrieda orgánovýchsystémov Nežiaduce reakcie liekuInfekcie a nákazyČasté nazofaryngitída
 Poruchy krvi a lymfatického systému
Poruchy krvi a lymfatického systému Menej časté neutropénia
Poruchy imunitného systémuMenej časté
hypersenzitivitaZriedkavé
angioedém, alergická reakciaPoruchy metabolizmu a výživyČasté zvýšená chuť do jedla
Menej časté anorexia, hypoglykémia
Trieda orgánových
systémov
Nežiaduce reakcie lieku
Psychické poruchy
Časté euforická nálada, zmätenosť, iritabilita, dezorientácia, insomnia, pokles libida
Menej časté halucinácie, panický atak, nepokoj, agitovanosť, depresia, depresívna nálada, povznášajúca nálada, agresivita, kolísanie nálady, depersonalizácia, ťažkosti s vyhľadávaním slov, abnormálne sny, vzostup libida, anorgazmia, apatia
Zriedkavé strata zábran
Poruchy nervového systému
Veľmi časté závraty, somnolencia, bolesť hlavy
Časté ataxia, porucha koordinácie, tremor, dyzartria, amnézia, poruchy pamäti, porucha koncentrácie, parestézia, hypestézia, sedácia, porucha rovnováhy, letargia
Menej časté synkopa, stupor, myoklonus, strata vedomia, psychomotorická hyperaktivita, dyskinéza, posturálne závraty, intenčný tremor, nystagmus, kognitívne poruchy, mentálne poškodenie, porucha reči, hyporeflexia, hyperestézia, pocit pálenia, strata chuti, nevoľnosť
Zriedkavé kŕče, parosmia, hypokinéza, dysgrafia
Poruchy oka
Časté zahmlené videnie, diplopia
Menej časté strata periférneho videnia, poruchy videnia, opuch očí, defekty
v zornom poli, zníženie zrakovej ostrosti, bolesti oka, astenopia, fotopsia, suché oči, zvýšená lakrimácia, podráždenie očí
Zriedkavé strata zraku, keratitída, oscilopsia, porušené hĺbkové videnie, mydriáza, strabizmus, porušená zraková ostrosť
Poruchy ucha a labyrintu
Časté vertigo Menej časté hyperakúzia Poruchy srdca a srdcovej činnosti
Menej časté tachykardia, AV blokáda 1. stupňa, sínusová bradykardia,
kongestívne srdcové zlyhávanie
Zriedkavé predĺženie QT, sínusová tachykardia, sínusová arytmia
Poruchy ciev
Menej časté hypotenzia, hypertenzia, návaly horúčavy, sčervenenie, periférny pocit chladu
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, epistaxa, kašeľ, upchatie nosa, rinitída, chrápanie, suchý nos
Zriedkavé pľúcny edém, zovreté hrdlo
Poruchy gastrointestinálneho traktu
Časté vracanie, nauzea, obstipácia, hnačka, flatulencia, abdominálna distenzia, sucho v ústach
Menej časté gastroezofageálna refluxová choroba, zvýšená salivácia, znížená citlivosť v ústach
Zriedkavé ascites, pankreatitída, opuchnutý jazyk, dysfágia
Poruchy pečene a žlčových ciest
Menej časté
Zriedkavé
Veľmi zriedkavé
zvýšené hladiny pečeňových enzýmov*
žltačka
zlyhanie pečene, hepatitída
 Poruchy kože a podkožného tkaniva
Poruchy kože a podkožného tkaniva
Menej časté papulózny exantém, žihľavka, hyperhidróza,
pruritusZriedkavé
Stevensov-Johnsonov syndróm, studený pot
,
Trieda orgánových
systémov
Nežiaduce reakcie lieku
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté svalové kŕče, artralgia, bolesti chrbta, bolesti v končatinách, cervikálny spazmus
Menej časté opuch kĺbov, myalgia, svalové zášklby, bolesť šije, svalová stuhnutosť
Zriedkavé rabdomyolýza
Poruchy obličiek a močových ciestMenej časté močová inkontinencia, dyzúria
Zriedkavé renálne zlyhanie, oligúria
, retencia močuPoruchy reprodukčného systému a prsníkov
Časté erektilná dysfunkcia
Menej časté sexuálna dysfunkcia, oneskorená ejakulácia, dysmenorea, bolesť prsníkov
Zriedkavé amenorea, výtok z prsníkov, zväčšenie prsníkov
, gynekomastiaCelkové poruchy a reakcie v mieste podaniaČasté periférny edém, edém, abnormálna chôdza, padanie, pocit opitosti, abnormálny pocit, únava
Menej časté generalizovaný edém,
edém tváre, pocit napätia na hrudníku, bolesť, pyrexia, smäd, triaška, asténia
Laboratórne a funkčné vyšetreniaČasté zvýšená hmotnosť
Menej časté zvýšená kreatínfosfokináza v krvi, zvýšená glukóza v krvi, znížený počet trombocytov, zvýšený kreatinín v krvi, znížený draslík v krvi, znížená hmotnosť
Zriedkavé znížený počet leukocytov v krvi
* Zvýšená hladina alanínaminotransferázy, zvýšená hladina aspartátaminotransferázy (AST).
Po ukončení krátkodobej a dlhodobej liečby pregabalínom sa u niektorých pacientov pozorovali abstinenčné príznaky. Uvádzajú sa nasledujúce reakcie: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, kŕče, nervozita, depresia, bolesť
, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tejto skutočnosti informovaný na začiatku liečby.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť abstinenčných príznakov môžu byť závislé od dávky.
PediatrickápopuláciaBezpečnostný profil pregabalínu pozorovaný v troch pediatrických štúdiách s pacientmi s parciálnymi záchvatmi s alebo bez sekundárnej generalizácie (12-týždňová štúdia účinnosti a bezpečnosti
u pacientov s výskytom parciálnych záchvatov, n = 295; štúdie farmakokinetiky a znášanlivosti, n =
65; a 1-ročná otvorená nadväzujúca štúdia bezpečnosti, n = 54) bol podobný bezpečnostnému profilu, ktorý sa pozoroval v štúdiách u dospelých pacientov s epilepsiou. Najčastejšie nežiaduce udalosti pozorované v 12-týždňovej štúdii s liečbou pregabalínom boli ospalosť, pyrexia, infekcia horných dýchacích ciest, zvýšená chuť do jedla, zvýšená telesná hmotnosť a nazofaryngitída (pozri časti 4.2,
5.1 a 5.2).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePo uvedení lieku na trh najčastejšie hlásené nežiaduce reakcie pozorované po predávkovaní
V zriedkavých prípadoch bola hlásená kóma.
Liečba predávkovania pregabalínom musí zahrňovať štandardné podporné opatrenia a môže zahrňovať podľa potreby aj hemodialýzu (pozri časť 4.2 Tabuľka 1).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiepileptikum, iné atiepileptiká, ATC kód: N03AX16
Liečivo pregabalín je analógom gamaaminomaslovej kyseliny ((S)-3-(aminometyl)-5-metylhexánová kyselina).
Mechanizmusúčinku
Pregabalín sa viaže na auxiliárne podjednotky (a2-d proteíny) napäťovo ovládaných kalciových
kanálov v centrálnom nervovom systéme.
Klinickáúčinnosťabezpečnosť
Neuropatická bolesť
Účinnosť bola dokázaná v klinických skúšaniach u diabetickej neuropatie, postherpetickej neuralgie a poškodenia miechy. Účinnosť sa neštudovala na ostatných modeloch neuropatickej bolesti.
Pregabalín sa študoval v 10 kontrolovaných klinických skúšaniach v trvaní až do 13 týždňov
s dávkovaním dvakrát denne (BID) a až do 8 týždňov s dávkovaním trikrát denne (TID). Celkové profily bezpečnosti a účinnosti pri BID a TID dávkovacích režimoch boli podobné.
V klinických skúšaniach v trvaní až do 12 týždňov sa u periférnej ako aj centrálnej neuropatickej bolesti pozorovalo zníženie bolesti v 1. týždni a pretrvávalo počas celého obdobia liečby.
V kontrolovaných klinických skúšaniach u periférnej neuropatickej bolesti 35 % pregabalínom liečených pacientov a 18 % pacientov užívajúcich placebo dosiahlo 50 % zlepšenie v skóre bolesti. V prípade pacientov, u ktorých sa neprejavila ospalosť, sa takéto zlepšenie pozorovalo u 33 % pacientov liečených pregabalínom a u 18 % pacientov užívajúcich placebo. V prípade pacientov,
u ktorých sa prejavila ospalosť, bola miera odpovede na liečbu pregabalínom 48 % a na placebo 16 %.
V kontrolných klinických skúšaniach u centrálnej neuropatickej bolesti 22 % pacientov liečených pregabalínom a 7 % pacientov užívajúcich placebo dosiahlo 50 % zlepšenie v skóre bolesti.
Epilepsia
Prídavná liečba
Pregabalín sa študoval v 3 kontrolovaných klinických skúšaniach v trvaní 12 týždňov s dávkovaním BID alebo dávkovaním TID. Celkové profily bezpečnosti a účinnosti pri BID a TID dávkovacích režimoch boli podobné.
Zníženie frekvencie záchvatov sa pozorovalo v 1. týždni. Pediatrickápopulácia
Účinnosť a bezpečnosť pregabalínu ako doplnkovej liečby pri epilepsii u pediatrických pacientov
mladších ako 12 rokov a dospievajúcich nebola stanovená. Nežiaduce udalosti pozorované vo farmakokinetickej štúdii a štúdii znášanlivosti, do ktorých boli zaradení pacienti vo veku
od 3 mesiacov do 16 rokov (n = 65) s výskytom parciálnych záchvatov, boli podobné tým, ktoré sa
pozorovali u dospelých. Výsledky z 12-týždňovej, placebom kontrolovanej štúdie s 295 pediatrickými pacientmi vo veku 4 až 16 rokov zameranej na zhodnotenie účinnosti a bezpečnosti pregabalínu ako podpornejterapie pri liečbe parciálnych záchvatov a z 1-ročnej otvorenej štúdie bezpečnosti u 54 pediatrických pacientov vo veku od 3 mesiacov do 16 rokov s epilepsiou naznačujú, že nežiaduce udalosti pyrexie a infekcií horných dýchacích ciest sa pozorovali častejšie ako v štúdiách u dospelých pacientov s epilepsiou (pozri časti 4.2, 4.8 a 5.2).
V 12-týždňovej placebom kontrolovanej štúdii bol pediatrickým pacientom podaný pregabalín
v dávke 2,5 mg/kg/deň (maximálne 150 mg/deň), pregabalín v dávke 10 mg/kg/deň (maximálne 600 mg/deň) alebo placebo. Percentuálny podiel jedincov, u ktorých nastalo najmenej 50 % zníženie výskytu parciálnych záchvatov v porovnaní so začiatkom bol 40,6 % jedincov liečených pregabalínom v dávke 10 mg/kg/deň (p = 0,0068 oproti placebu), 29,1 % jedincov liečených pregabalínom v dávke
2,5 mg/kg/deň (p = 0,2600 oproti placebu) a 22,6 % jedincov, ktorí dostávali placebo.
Monoterapia(novodiagnostikovanípacienti)
Pregabalín sa študoval v 1 kontrolovanom klinickom skúšaní v trvaní 56 týždňov s dávkovaním BID. Pregabalín nebol horší oproti lamotrigínu, čo sa týka dosiahnutia 6-mesačného obdobia bez záchvatov na konci sledovania. Pregabalín a lamotrigín boli podobne bezpečné a dobre tolerované.
Generalizovanáúzkostnáporucha
Pregabalín sa študoval v 6 kontrolovaných klinických skúšaniach v trvaní 4 – 6 týždňov, v štúdii so staršími osobami v trvaní 8 týždňov a v dlhodobej štúdii zameranej na prevenciu relapsu s dvojito zaslepenou fázou zameranou na prevenciu relapsu v trvaní 6 mesiacov.
Ústup príznakov GAD vyjadrených Hamiltonovou škálou úzkosti (Hamilton Anxiety Rating
Scale = HAM-A) sa pozoroval v 1. týždni.
V kontrolovaných klinických skúšaniach (v trvaní 4 – 8 týždňnov) 52 % pacientov liečených pregabalínom a 38 % pacientov v skupine s placebom malo aspoň 50 % zlepšenie celkového HAM-A skóre od začiatku až po koniec sledovania.
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní v dávkovaní. Oftalmologické vyšetrenie (vrátane vyšetrenia zrakovej ostrosti, formálneho vyšetrenia zorného poľa a vyšetrenia očného pozadia pri rozšírených zreniciach) sa vykonalo u viac ako
3 600 pacientov v rámci kontrolovaných klinických skúšaní. U týchto pacientov bola zraková ostrosť znížená u 6,5 % pacientov liečených pregabalínom a 4,8 % pacientov liečených placebom. Zmeny zrakového poľa sa zistili u 12,4 % pacientov liečených pregabalínom a 11,7 % pacientov liečených placebom. Zmeny na očnom pozadí sa pozorovali u 1,7 % pacientov liečených pregabalínom a 2,1 % pacientov liečených placebom.
5.2 Farmakokinetické vlastnosti
Farmakokinetika pregabalínu v rovnovážnom stave je podobná u zdravých dobrovoľníkov, pacientov s epilepsiou užívajúcich antiepileptiká a pacientov s chronickou bolesťou.
Absorpcia
Pregabalín sa pri podaní nalačno rýchlo vstrebáva, maximálne plazmatické koncentrácie sa dosiahnu do 1 hodiny po podaní jednorazovej aj viacnásobnej dávky. Biologická dostupnosť pregabalínu po perorálnom podaní sa odhaduje na ³ 90 % a je nezávislá na dávke. Po opakovanom podaní sa rovnovážny stav dosiahne počas 24 až 48 hodín. Rýchlosť absorpcie pregabalínu sa zníži, keď sa podáva s jedlom, čo sa prejaví poklesom Cmax približne o 25 – 30 % a predĺžením tmax na približne
2,5 hodiny. Avšak podávanie pregabalínu s jedlom nemá klinicky signifikantný účinok na mieru
absorpcie pregabalínu.
Distribúcia
V predklinických štúdiách sa potvrdil prienik pregabalínu cez hematoencefalickú bariéru u myší, potkanov a opíc. Bolo dokázané, že pregabalín prechádza cez placentu u potkanov a nachádza sa
v mlieku laktujúcich potkanov. U človeka je zdanlivý distribučný objem pregabalínu po perorálnom podaní približne 0,56 l/kg. Pregabalín sa neviaže na plazmatické proteíny.
Biotransformácia
Pregabalín u človeka podlieha zanedbateľnému metabolizmu. Po podaní dávky rádionuklidom značeného pregabalínu približne 98 % rádioaktivity stanovenej v moči predstavoval nezmenený pregabalín. N-metylovaný derivát pregabalínu, hlavný metabolit pregabalínu v moči, predstavoval
0,9 %. V predklinických štúdiách sa nezistila racemizácia S-enancioméru pregabalínu na
R-enanciomér.
Eliminácia
Pregabalín sa eliminuje zo systémovej cirkulácie primárne renálnou exkréciou v nezmenenej forme. Priemerný eliminačný polčas je 6,3 hodiny. Plazmatický klírens a renálny klírens pregabalínu sú priamo úmerné klírensu kreatinínu (pozri časť 5.2 Poškodenie funkcie obličiek).
Je potrebné upraviť dávku u pacientov so zníženými renálnymi funkciami alebo u hemodialyzovaných pacientov (pozri časť 4.2 Tabuľka 1).
Linearita/ nelinearita
Farmakokinetika pregabalínu je lineárna v odporúčanom rozsahu denných dávok. Interindivuduálna farmakokinetická variabilita pregabalínu je nízka (< 20 %). Farmakokinetiku pri opakovaných dávkach možno predpovedať z údajov pri jednej dávke. Preto nie je potrebné bežné monitorovanie plazmatických koncentrácií pregabalínu.
Pohlavie
Klinické skúšania potvrdili, že pohlavie nemá klinicky signifikantný vplyv na plazmatické koncentrácie pregabalínu.
Poruchafunkcieobličiek
Klírens pregabalínu je priamo úmerný klírensu kreatinínu. Okrem toho sa pregabalín účinne odstraňuje z plazmy hemodialýzou (po 4-hodinovej hemodialýze klesnú plazmatické koncentrácie pregabalínu asi o 50 %). Vzhľadom na to, že eliminácia obličkami je hlavným spôsobom eliminácie, je potrebné zníženie dávky u pacientov s poruchou funkcie obličiek a doplnková dávka po hemodialýze (pozri časť 4.2 Tabuľka 1).
Poruchafunkciepečene
Neboli vykonané žiadne špecifické farmakokinetické štúdie u pacientov s poškodenými pečeňovými funkciami. Keďže pregabalín nepodlieha signifikantnému metabolizmu a vylučuje sa prednostne
v nezmenenej forme močom, neočakáva sa, že by poškodenie pečeňových funkcií signifikantne menilo plazmatické koncentrácie pregabalínu.
Pediatrickápopulácia
Farmakokinetika pregabalínu bola vyhodnocovaná u pediatrických pacientov s epilepsiou (vekové skupiny: 1 až 23 mesiacov, 2 až 6 rokov, 7 až 11 rokov a 12 až 16 rokov) pri hladinách dávky 2,5; 5;
10 a 15 mg/kg/deň vo farmakokinetickej štúdii a štúdii znášanlivosti.
Po perorálnom podaní pregabalínu u pediatrických pacientov nalačno, bol čas do dosiahnutia maximálnej plazmatickej koncentrácie vo všeobecnosti podobný v rámci všetkých vekových skupín a dosiahol sa 0,5 hodiny až 2 hodiny po podaní dávky.
Parametre Cmax a AUC pregabalínu sa zvyšovali priamo úmerne so zvyšujúcou sa dávkou v rámci každej vekovej skupiny. AUC bola nižšia o 30 % u pediatrických pacientov s telesnou hmotnosťou menej ako 30 kg z dôvodu klírensu upraveného na základe telesnej hmotnosti zvýšeného o 43 %
u týchto pacientov v porovnaní s pacientmi s telesnou hmotnosťou ≥ 30 kg.
Terminálny polčas pregabalínu sa pohyboval v priemere od 3 do 4 hodín u pediatrických pacientov vo veku do 6 rokov a od 4 do 6 hodín u tých, ktorí boli vo veku 7 rokov a starší.
Analýza populačnej farmakokinetiky preukázala, že klírens kreatinínu bol významným vedľajším parametrom klírensu pregabalínu po perorálnom podaní, telesná hmotnosť bola významným vedľajším parametrom zdanlivého distribučného objemu pregabalínu po perorálnom podaní a tieto vzťahy boli podobné u pediatrických a dospelých pacientov.
Farmakokinetika pregabalínu u pacientov mladších ako 3 mesiace nebola skúmaná (pozri časti 4.2,
4.8 a 5.1).
Staršieosoby
Klírens pregabalínu má tendenciu klesať so stúpajúcim vekom. Tento pokles klírensu pregabalínu je v súlade s poklesom klírensu kreatinínu, ktorý je podmienený stúpajúcim vekom. Zníženie dávky pregabalínu sa môže vyžadovať u pacientov pri vekom podmienenom poškodení renálnych funkcií (pozri časť 4.2 Tabuľka 1).
Dojčiacematky
Farmakokinetika 150 mg pregabalínu podávaných každých 12 hodín (300 mg denná dávka) bola vyhodnocovaná u 10 žien počas laktácie, ktoré boli aspoň 12 týždňov po pôrode. Laktácia mala malý až žiadny vplyv na farmakokinetiku pregabalínu. Pregabalín sa vylučoval do materského mlieka
s priemernými koncentráciami v ustálenom stave približne 76 % z plazmatických koncentrácií
u matiek. Odhadovaná dávka u dojčaťa z materského mlieka (za predpokladu priemernej konzumácie mlieka 150 ml/kg/deň) žien užívajúcich 300 mg/deň by bola 0,31 mg/kg/deň alebo 0,62 mg/kg/deň
u žien užívajúcich maximálnu dávku 600 mg/deň. Tieto odhadované dávky predstavujú približne 7 %
celkovej dennej dávky u matky v mg/kg.
5.3 Predklinické údaje o bezpečnosti
V obvyklých farmakologických štúdiách bezpečnosti u zvierat bol pregabalín dobre tolerovaný
v klinicky relevantných dávkach. V štúdiách toxicity po opakovanom podávaní u potkanov a opíc sa pozorovali účinky na CNS vrátane hypoaktivity, hyperaktivity a ataxie. Zvýšená incidencia atrofie retiny, bežne pozorovaná u starnúcich potkaních albínov, sa zistila po dlhodobej expozícii pregabalínu v dávkach ≥ 5-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke.
Pregabalín nebol teratogénny u myší, potkanov ani u králikov. Fetálna toxicita u potkanov a králikov sa vyskytla iba pri dávkach dostatočne prevyšujúcich dávku pre človeka.
V prenatálnych/postnatálnych štúdiách toxicity pregabalín vyvolával vývojovú toxicitu u potomkov potkanov v dávkach > 2-krát vyššších, než je odporúčaná maximálna dávka pre človeka.
Nežiaduce účinky na fertilitu u samčekov a samičiek potkanov sa pozorovali iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia. Nežiaduce účinky na samčie reprodukčné orgány a parametre spermií boli reverzibilné a vyskytli sa iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia, alebo boli spojené so spontánnymi degeneratívnymi procesmi na samčích reprodukčných orgánoch u potkana. Preto sa týmto účinkom pripisuje malý alebo žiadny klinický význam.
Na základe výsledkov mnohých in vitro a in vivo skúšok možno prehlásiť, že pregabalín nie je genotoxický.
Dvojročné štúdie karcinogenicity s pregabalínom boli vykonané na potkanoch a myšiach. Nepozorovali sa žiadne nádory u potkanov v dávkach až do 24-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke 600 mg/deň. U myší sa nezistil zvýšený výskyt nádorov v dávkach podobných priemernej dávke u človeka, ale zvýšený výskyt hemangiosarkómov sa pozoroval pri vyšších dávkach. Negenotoxický mechanizmus tvorby pregabalínom indukovaných
nádorov u myší zahrňuje zmeny krvných doštičiek a súvisiacu proliferáciu endoteliálnych buniek. Tieto zmeny krvných doštičiek neboli prítomné u potkanov alebo u ľudí na základe krátkodobých
a limitovaných dlhodobých klinických údajov. Neexistuje dôkaz, ktorý by naznačoval súvisiace riziko u ľudí.
U mladých potkanov sa druhy toxicity kvantitatívne nelíšili od tých, ktoré sa pozorovali u dospelých potkanov. Avšak mladé potkany sú oveľa senzitívnejšie. Pri terapeutických dávkach sa dokázali klinické príznaky hyperaktivity CNS a bruxizmus a niektoré zmeny v raste (prechodné potlačenie prírastku telesnej hmotnosti). Účinky na pohlavný cyklus sa pozorovali pri 5-násobku terapeutickej dávky u človeka. Znížená odpoveď na akustický podnet sa pozorovala u mladých potkanov
1 - 2 týždne po expozícii pri > 2-násobku terapeutickej dávky u človeka. Deväť týždňov po expozícii sa už tento účinok viac nepozoroval.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
metylparabén (E218) propylparabén (E216) dihydrogénfosforečnan sodný, bezvodý
hydrogénfosforečnan disodný, bezvodý (E339)
sukralóza (E955)
umelá jahodová príchuť [obsahuje malé množstvo etanolu (alkoholu)]
čistená voda
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Biela fľaška z polyetylénu s vysokou hustotou (HDPE) s uzáverom s polyetylénovým tesnením obsahujúca 473 ml perorálneho roztoku, v papierovej škatuľke. Škatuľka tiež obsahuje,
v priehľadnom polyetylénovom obale, 5 ml kalibrovanú striekačku na perorálne podanie a stláčací nadstavec na fľašku (Press-In-Bottle-Adapter, PIBA).
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky na likvidáciu. Spôsob podania
1. Otvorte fľašku a pri prvom použití zasuňte stláčací nadstavec (Press-In Bottle Adapter, PIBA) (obrázky 1 a 2).
2. Vsuňte striekačku do nadstavca PIBA a natiahnite požadovaný objem z obrátenej fľašky
(obrázky 3 a 4).
3. Vytiahnite naplnenú striekačku z fľašky vo zvislej polohe (obrázky 5 a 6).
4. Vyprázdnite obsah striekačky do úst (obrázok 7). Opakujte kroky 2 až 4 podľa potreby, aby ste dosiahli požadovanú dávku. (Tabuľka 3).
5. Vypláchnite striekačku a znovu nasaďte viečko na fľašku (nadstavec PIBA ostáva na mieste) (obrázky 8 a 9).
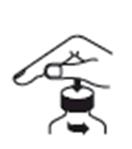
Obrázok 1 Obrázok 2 Obrázok 3

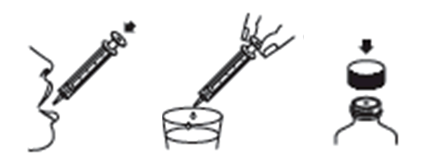
Obrázok 4 Obrázok 5 Obrázok 6
Obrázok 7 Obrázok 8 Obrázok 9
Tabuľka 3. Odbery striekačkou na perorálne podanie na dodanie predpísanej dávky LYRICY
Dávk
a LYRICY
(mg)
Celkový objem
roztoku (ml)
Prvý odber
striekačkou (ml)
Druhý odber
striekačkou (ml)
Tretí odber
striekačkou (ml)

25 1,25 1,25 Nie je potrebný Nie je potrebný
50 2,5 2,5 Nie je potrebný Nie je potrebný
75 3,75 3,75 Nie je potrebný Nie je potrebný
100 5 5 Nie je potrebný Nie je potrebný
150 7,5 5 2,5 Nie je potrebný
200 10 5 5 Nie je potrebný
225 11,25 5 5 1,25
Dávk
a LYRICY (mg)
Celkový objem roztoku (ml)
Prvý odber striekačkou (ml)
Druhý odber striekačkou (ml)
Tretí odber striekačkou (ml)

300 15 5 5 5
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIPfizer Limited Ramsgate Road Sandwich
Kent
CT13 9NJ Veľká Británia
8. REGISTRAČNÉ ČÍSLOEU/1/04/279/044
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 06. júl 2004
Dátum posledného predĺženia: 06. júl 2009
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu