
ia.
2. Čo potrebujete vedieť predtým, ako sa použije Lamzede
Lamzede sa nesmie použiť:
- ak ste alergický na velmanázu alfa alebo na ktorúkoľvek z ďalších zložiek tohto lieku
(uvedených v časti 6).
Upozornenia a opatrenia
Pred použitím lieku Lamzede sa obráťte na svojho lekára.
Ak vás liečia liekom Lamzede, počas infúzie použitej na podanie lieku alebo bezprostredne po infúzii sa môže u vás vyskytnúť vedľajší účinok (pozri časť 4). To sa nazýva reakcia súvisiaca s infúziou a niekedy môže byť závažná.
- Reakcie súvisiace s infúziou zahŕňajú závrat, bolesť hlavy, nevoľnosť, nízky krvný tlak, únavu a horúčku. Ak sa u vás vyskytne reakcia súvisiaca s infúziou, musíte to okamžite povedať svojmu lekárovi.
- Ak sa u vás vyskytne reakcia súvisiaca s infúziou, môžete dostať ďalšie lieky na liečbu alebo prevenciu budúcich reakcií. Tieto lieky môžu zahŕňať lieky používané na liečbu alergií (antihistaminiká), lieky používané na liečbu horúčky (antipyretiká) a lieky na kontrolu zápalu (kortikosteroidy).
- Ak je reakcia súvisiaca s infúziou závažná, lekár ihneď zastaví podávanie infúzie a začne vám podávať vhodnú liečbu.
- Ak sú reakcie súvisiace s infúziou závažné a/alebo dôjde k strate účinku tohto lieku, váš lekár vykoná krvný test na kontrolu prítomnosti protilátok, ktoré by mohli ovplyvniť výsledok vašej liečby.
- Lamzede vám väčšinou môžu podávať naďalej aj napriek tomu, že sa u vás vyskytne reakcia
súvisiaca s infúziou.
Iné lieky a Lamzede
Ak teraz užívate alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky, povedzte to
svojmu lekárovi.
Tehotenstvo a dojčenie
Ak ste tehotná alebo dojčíte, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom predtým, ako sa začne používať tento liek.
Lamzede sa má používať počas tehotenstva, len ak je to z lekárskeho hľadiska nevyhnutné. Nie je známe, či velmanáza alfa prechádza do materského mlieka. Lamzede sa môže používať počas dojčenia.
Vedenie vozidiel a obsluha strojov
Lamzede nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
Lamzede obsahuje sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednotke dávkovania, t. j. v podstate
zanedbateľné množstvo sodíka.
3. Ako sa Lamzede používa
Tento liek sa má používať výhradne pod dohľadom lekára, ktorý má skúsenosti s liečbou
alfa-manozidózy alebo iných podobných ochorení a má ho podávať výhradne zdravotnícky pracovník.
Dávkovanie
Odporúčaná dávka lieku Lamzede je 1 mg/kg telesnej hmotnosti podávaná raz týždenne.
Použitie u detí a dospievajúcich
Lamzede sa môže podávať deťom a dospievajúcim v rovnakej dávke a s rovnakou frekvenciou ako u dospelých. S pacientmi mladšími ako 6 rokov nie sú žiadne skúsenosti.
Podávanie
Lamzede sa dodáva v injekčnej liekovke ako prášok na infúziu, ktorý sa pred podaním pripraví s vodou na injekcie.
Po príprave sa tento liek podáva pomocou infúznej pumpy (kvapkaním) do žily, pričom toto
podávanie sa vykonáva po dobu najmenej 50 minút pod dohľadom lekára (intravenózne použitie).
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. Väčšina účinkov sa vyskytne počas infúzie alebo krátko po nej (tzv. reakcia súvisiaca s infúziou, pozri časť 2 „Upozornenia a opatrenia“).
Počas liečby liekom Lamzede sa môžu u vás vyskytnúť niektoré z nasledujúcich reakcií:
Závažné vedľajšie účinkyČasté vedľajšie účinky (môžu postihovať menej ako 1 z 10 osôb)
- strata vedomia (mdloby, ktorým môžu predchádzať závraty, točenie hlavy alebo zmätenosť),
- akútna obličková nedostatočnosť (problémy s obličkami, ktoré možno zistiť podľa zadržiavania
tekutín, opuchu nôh, členkov alebo chodidiel, ospalosti, dýchavičnosti alebo únavy),
- precitlivenosť a závažná alergická reakcia (príznaky zahŕňajúce lokalizované alebo rozptýlené svrbenie pokožky, závrat, ťažkosti s dýchaním, bolesť v hrudi, žalúdočno-črevné príznaky, ako napríklad nevoľnosť, vracanie, hnačka alebo bolesť čriev, opuch hrdla, tváre, pier alebo jazyka).
Ak sa u vás vyskytne akýkoľvek vedľajší účinok podobný týmto, povedzte to ihneď svojmulekárovi.Ďalšie vedľajšie účinkyVeľmi časté vedľajšie účinky (môžu postihovať viac ako 1 z 10 osôb)
- hnačka,
- zvýšenie telesnej hmotnosti,
- horúčka/zvýšená telesná teplota.
Časté vedľajšie účinky (môžu postihovať menej ako 1 z 10 osôb)
- spomalený srdcový rytmus (bradykardia),
- psychotické správanie (duševné ochorenie s halucináciami, problémy s jasným myslením a chápaním reality, úzkosť), počiatočné problémy so spánkom,
- stav zmätenosti, mdloby, trasenie, závrat, bolesť hlavy,
- bolesť čriev (brucha), podráždenie žalúdka spôsobené tráviacimi kyselinami (refluxná
gastritída), nevoľnosť, vracanie,
- bolesť v mieste podania infúzie, triaška, pocit horúčavy, malátnosť, únava,
- kožné vyrážky (žihľavka), zvýšené potenie (hyperhidróza),
- krvácanie z nosa,
- bolesť kĺbov, bolesť chrbta, stuhnutosť kĺbov, bolesť svalov, bolesť v končatinách (rukách,
nohách),
- podráždenie očí, opuch očných viečok (edém očných viečok), sčervenanie očí,
- zvýšená chuť do jedla.
Hlásenie vedľajších účinkovAk sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára. To sa týka aj

akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako sa Lamzede uchovávaTento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na štítku a škatuľke po „EXP“. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Uchovávajte a prepravujte v chlade (2 °C - 8 °C). Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Liek sa má po rekonštitúcii okamžite použiť. Ak sa nepoužije okamžite, rekonštituovaný roztok sa
môže uchovávať po dobu maximálne 24 hodín pri teplote 2 °C - 8 °C.
Tento liek sa nesmie používať, ak rekonštituovaný roztok obsahuje nepriehľadné častice alebo ak
zmenil farbu.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne.
Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácie
Čo Lamzede obsahuje
- Liečivo je velmanáza alfa.
Jedna injekčná liekovka obsahuje 10 mg velmanázy alfa.
Po rekonštitúcii jeden ml roztoku obsahuje 2 mg velmanázy alfa (10 mg/5 ml).
- Ďalšie zložky sú: dihydrát hydrogenfosforečnanu sodného, dihydrát dihydrogenfosforečnanu
sodného, manitol a glycín.
Ako vyzerá Lamzede a obsah balenia
Lamzede je biely až takmer biely prášok na infúzny roztok, ktorý sa dodáva v sklenenej injekčnej
liekovke.
Každá škatuľka obsahuje 1, 5 alebo 10 injekčných liekoviek. Na trh nemusia byť uvedené všetky veľkosti balenia.
Držiteľ rozhodnutia o registrácii
Chiesi Farmaceutici S.p.A.
Via Palermo 26/A
43122 Parma
Taliansko
Výrobca
Chiesi Farmaceutici S.p.A.
Via San Leonardo, 96
43122 Parma
Taliansko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa
rozhodnutia o registrácii:
B
e
l
gië/Belgique/Belgien
Chiesi sa/nv
Tél/Tel: + 32 (0)2 788 42 00
Lietuva
Chiesi Pharmaceuticals GmbH
Tel: + 43 1 4073919
Б
ълг
а
р
и
я
Chiesi Bulgaria EOOD
Teл.: + 359 29201205
Luxembourg/Luxemburg
Chiesi sa/nv
Tél/Tel: + 32 (0)2 788 42 00
Č
e
s
k
á republika
Chiesi CZ s.r.o.
Tel: + 420 261221745
Magyarország
Chiesi Hungary Kft. Tel.: + 36-1-429 1060
D
anmark
Chiesi Pharma AB Tlf: + 46 8 753 35 20
Malta
Chiesi Farmaceutici S.p.A. Tel: + 39 0521 2791
D
e
u
t
s
c
h
l
and
Chiesi GmbH
Tel: + 49 40 89724-0
Nederland
Chiesi Pharmaceuticals B.V.
Tel: + 31 88 501 64 00
E
e
s
t
i
Chiesi Pharmaceuticals GmbH Tel: + 43 1 4073919
Norge
Chiesi Pharma AB Tlf: + 46 8 753 35 20
Ελ
λ
ά
δ
α
Chiesi Hellas AEBE
Τηλ: + 30 210 6179763
Österreich
Chiesi Pharmaceuticals GmbH Tel: + 43 1 4073919
E
s
p
aña
Chiesi España, S.A.U.
Tel: + 34 93 494 8000
Polska
Chiesi Poland Sp. z.o.o.
Tel.: + 48 22 620 1421
F
r
ance
Chiesi S.A.S.
Tél: + 33 1 47688899
Portugal
Chiesi Farmaceutici S.p.A. Tel: + 39 0521 2791
H
r
vatska
Chiesi Pharmaceuticals GmbH
Tel: + 43 1 4073919
România
Chiesi Romania S.R.L.
Tel: + 40 212023642
I
re
l
and
Chiesi Ltd
Tel: + 44 (0)161 488 5555
Slovenija
Chiesi Slovenija d.o.o. Tel: + 386-1-43 00 901
Ísland
Chiesi Pharma AB Sími: +46 8 753 35 20
Slovenská republika
Chiesi Slovakia s.r.o. Tel: + 421 259300060
I
t
alia
Chiesi Farmaceutici S.p.A.
Tel: + 39 0521 2791
Suomi/Finland
Chiesi Pharma AB
Puh/Tel: +46 8 753 35 20
Κύ
π
ρ
ος
Chiesi Farmaceutici S.p.A.
Τηλ: + 39 0521 2791
Sverige
Chiesi Pharma AB Tel: +46 8 753 35 20
L
a
t
vija
Chiesi Pharmaceuticals GmbH Tel: + 43 1 4073919
United Kingdom
Chiesi Ltd
Tel: + 44 (0)161 488 5555
T
á
t
o písomná informácia bola naposledy aktualizovaná v {MM/RRRR}.
Tento liek bol registrovaný za tzv. mimoriadnych okolností. To znamená, že pre zriedkavosť výskytu
tohto ochorenia nebolo možné získať všetky informácie o tomto lieku.
Európska agentúra pre lieky každý rok posúdi nové informácie o tomto lieku a túto písomnú
informáciu bude podľa potreby aktualizovať.
Ď
alšie zdroje informácií
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu. Nájdete tam aj odkazy na ďalšie webové stránky o zriedkavých ochoreniach a ich liečbe.
---------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov.
Lamzede vyžaduje rekonštitúciu a je určený iba na intravenóznu infúziu.
Každá injekčná liekovka je určená iba na jednorazové použitie.
Pokyny na rekonštitúciu a podávanieLamzede má rekonštituovať a podávať zdravotnícky pracovník.
Počas prípravy sa má používať aseptická technika. Počas prípravy sa nesmú používať ihly s filtrom.
a) Počet injekčných liekoviek, ktoré sa majú použiť, sa má vypočítať na základe hmotnosti každého pacienta. Odporúčaná dávka pri 1 mg/kg sa stanoví pomocou nasledovného výpočtu:
- hmotnosť pacienta (kg) × dávka (mg/kg) = pacientova dávka (v mg),
- pacientova dávka (v mg) delená dávkou 10 mg/injekčnú liekovku (obsah jednej injekčnej liekovky) = počet injekčných liekoviek na rekonštitúciu; ak počet vypočítaných injekčných liekoviek obsahuje desatinné číslo, má sa zaokrúhliť na najbližšie celé číslo,
- Približne 30 minút pred rekonštitúciou sa má z chladničky vybrať potrebný počet injekčných liekoviek. Injekčné liekovky majú pred rekonštitúciou dosiahnuť teplotu okolia (15 °C - 25 °C).
Každá injekčná liekovka sa rekonštituuje pomalým vstreknutím 5 ml vody na injekcie po vnútornej stene každej injekčnej liekovky. Každý ml rekonštituovaného roztoku obsahuje 2 mg velmanázy alfa. Má sa podať iba množstvo zodpovedajúce odporúčanej dávke.
Príklad:
- hmotnosť pacienta (44 kg) × dávka (1 mg/kg) = pacientova dávka (44 mg),
- 44 mg delených dávkou 10 mg/injekčnú liekovku = 4,4 injekčnej liekovky, preto sa má
rekonštituovať 5 injekčných liekoviek.
- Z celkového rekonštituovaného objemu sa má podať len 22 ml (čo zodpovedá 44 mg).
b) Prášok sa má rekonštituovať v injekčnej liekovke pomalým pridávaním (po kvapkách) vody na injekciu po vnútornej stene injekčnej liekovky, a nie priamo na lyofilizovaný prášok. Aby sa minimalizovalo penenie, je potrebné sa vyhnúť silnému vytlačeniu vody na injekcie z injekčnej striekačky na prášok. Rekonštituované injekčné liekovky majú stáť na stole asi 5 – 10 minút. Potom sa má každá injekčná liekovka nakloniť a 15 – 20 sekúnd jemne otáčať, aby sa podporil proces rozpúšťania. Injekčná liekovka sa nemá prevracať, pretrepávať ani sa ňou nemá krúžiť.'
c) Po rekonštitúcii sa má roztok ihneď vizuálne skontrolovať, či neobsahuje častice a nezmenil farbu. Roztok má byť číry a
ak sa v ňom spozorujú nepriehľadné častice alebo ak zmenil farbu, nemá sa používať. Vzhľadom na charakter lieku môže rekonštituovaný roztok niekedy obsahovať určité proteínové častice vo forme tenkých bielych zhlukov alebo priesvitných vlákien, ktoré sa odstránia pomocou integrovaného filtra počas infúzie (pozri bod e).
d) Rekonštituovaný roztok sa má opatrne pomaly natiahnuť z jednotlivých injekčných liekoviek do injekčnej striekačky, aby sa zabránilo peneniu v nej. Ak objem roztoku prekročí kapacitu jednej injekčnej striekačky, má sa pripraviť požadovaný počet injekčných striekačiek, aby sa mohla počas infúzie vykonať rýchla výmena injekčnej striekačky.
e) Rekonštituovaný roztok sa má podávať použitím infúznej súpravy vybavenej pumpou
a zaradeným filtrom 0,22 µm s nízkym viazaním bielkovín
Celkový objem infúzie sa určuje podľa hmotnosti pacienta a má sa podávať minimálne po dobu
50 minút. V prípade pacientov s hmotnosťou nižšou ako 18 kg, ktorým sa podáva menej ako
9 ml rekonštituovaného roztoku, sa má rýchlosť infúzie vypočítať tak, aby sa infúzia podávala po dobu ≥ 50 minút. Maximálna rýchlosť infúzie je 25 ml/hodinu. Dobu podávania infúzie možno vypočítať podľa nasledujúcej tabuľky:
H
m
otnosť
p
acienta
(
k
g)
D
á
v
k
a
(
m
l
)
M
axi-
m
álna rýchlosť infúzie (ml/h)
M
i
n
i
-
m
álna doba podávania infúzie (min)
H
m
otnosť
p
acienta
(
k
g)
D
á
v
k
a
(
m
l
)
M
axi-
m
álna rýchlosť infúzie (ml/h)
M
i
n
i
-
m
álna doba podávania infúzie (min)
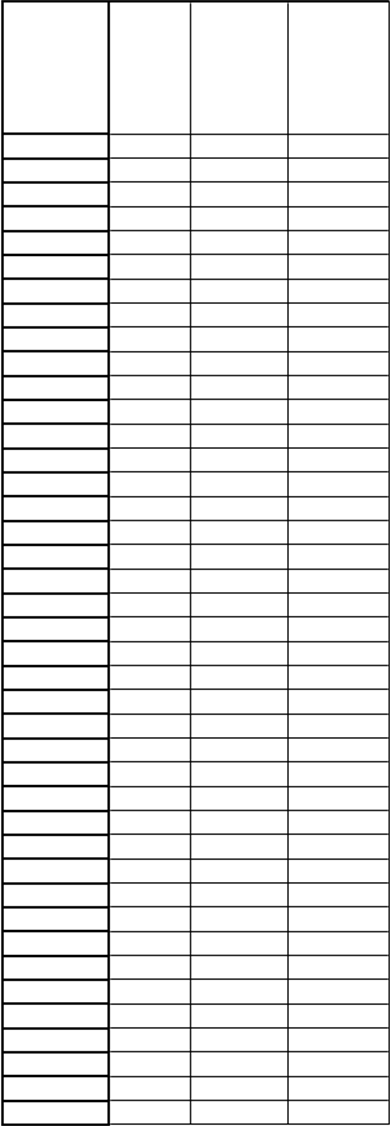
 5
5 2,5 3 50
53 26,5 25 64
6 3 3,6 50
54 27 25 65
7 3,5 4,2 50
55 27,5 25 67
8 4 4,8 50
56 28 25 67
9 4,5 5,4 50
57 28,5 25 68
10 5 6 50
58 29 25 70
11 5,5 6,6 50
59 29,5 25 71
12 6 7,2 50
60 30 25 72
13 6,5 7,8 50
61 30,5 25 73
14 7 8,4 50
62 31 25 74
15 7,5 9 50
63 31,5 25 76
16 8 9,6 50
64 32 25 77
17 8,5 10,2 50
65 32,5 25 78
18 9 10,8 50
66 33 25 79
19 9,5 11,4 50
67 33,5 25 80
20 10 12 50
68 34 25 82
21 10,5 12,6 50
69 34,5 25 83
22 11 13,2 50
70 35 25 84
23 11,5 13,8 50
71 35,5 25 85
24 12 14,4 50
72 36 25 86
25 12,5 15 50
73 36,5 25 88
26 13 15,6 50
74 37 25 89
27 13,5 16,2 50
75 37,5 25 90
28 14 16,8 50
76 38 25 91
29 14,5 17,4 50
77 38,5 25 92
30 15 18 50
78 39 25 94
31 15,5 18,6 50
79 39,5 25 95
32 16 19,2 50
80 40 25 96
33 16,5 19,8 50
81 40,5 25 97
34 17 20,4 50
82 41 25 98
35 17,5 21 50
83 41,5 25 100
36 18 21,6 50
84 42 25 101
37 18,5 22,2 50
85 42,5 25 102
38 19 22,8 50
86 43 25 103
39 19,5 23,4 50
87 43,5 25 104
40 20 24 50
88 44 25 106
41 20,5 24,6 50
89 44,5 25 107
42 21 25 50
90 45 25 108
43 21,5 25 52
91 45,5 25 109
44 22 25 53
92 46 25 110
45 22,5 25 54
93 46,5 25 112
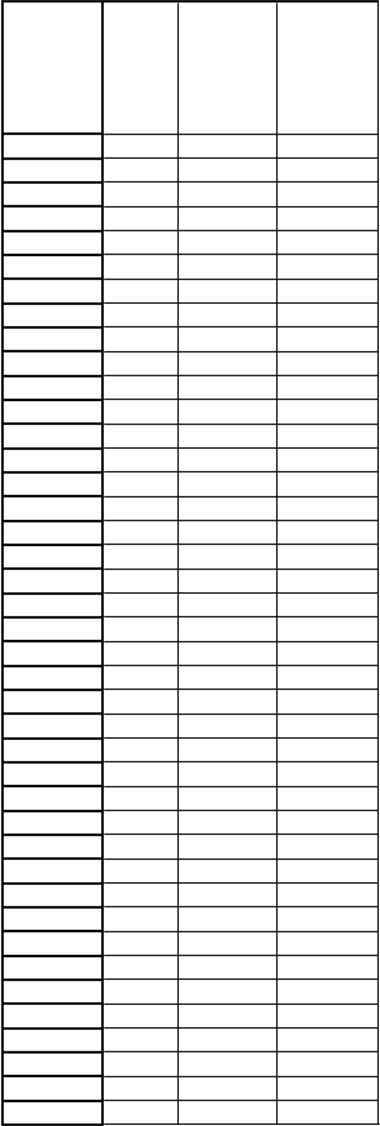
H
m
otnosť pacienta (kg)
D
á
v
k
a
(
m
l
)
M
axi- málna rýchlosť infúzie (ml/h)
M
i
n
i
- málna doba podávania infúzie (min)
H
m
otnosť pacienta (kg)
D
á
v
k
a
(
m
l
)
M
axi- málna rýchlosť infúzie (ml/h)
M
i
n
i
- málna doba podávania infúzie (min)
 46
46 23 25 55
94 47 25 113
47 23,5 25 56
95 47,5 25 114
48 24 25 58
96 48 25 115
49 24,5 25 59
97 48,5 25 116
50 25 25 60
98 49 25 118
51 25,5 25 61
99 49,5 25 119
52 26 25 62
f) Keď bude posledná injekčná striekačka prázdna, dávkovacia injekčná striekačka sa nahradí 20
ml injekčnou striekačkou naplnenou injekčným roztokom chloridu sodného s koncentráciou
9 mg/ml (0,9 %). Prostredníctvom infúzneho systému sa má podať 10 ml roztoku chloridu
sodného, aby sa pacientovi infúzne podala aj časť lieku Lamzede zostávajúca v katétri.
LikvidáciaVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
P
R
Í
L
OH
A IV
Z
ÁV
E
R
Y TÝKAJÚCE SA UDELENIA POVOLENIA NA UVEDENIE NA TRH ZA MIMORIADNYCH OKOLNOSTÍ, PREDLOŽENÉ EURÓPSKOU AGENTÚROU PRE LIEKY
Z
á
v
er
y predložené Európskou agentúrou pre lieky:
• Povolenie na uvedenie na trh za mimoriadnych okolností
Výbor CHMP po posúdení žiadosti zastáva názor, že pomer rizika a prínosu je priaznivý, a preto odporúča udeliť povolenie na uvedenie na trh za mimoriadnych okolností, ako je to podrobnejšie opísané v Európskej verejnej hodnotiacej správe.