
u pacienta znižovať potrebu inzulínu.
U pacientov s poruchou funkcie pečene sa musí dôsledne monitorovať glukóza a dávka inzulín- aspartátu sa má nastaviť na individuálnom základe.
Pediatrická populácia
Kixelle môžu používať deti a dospievajúci, od 1 roka a staršie, ak sa uprednostní pred rozpustným
ľudským inzulínom, keď môže byť prospešný rýchly nástup účinku, napríklad pri načasovaní podávania injekcie vzhľadom k jedlu (pozri časti 5.1 a 5.2).
Bezpečnosť a účinnosť lieku Kixelle u detí do 1 roka neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Prechod z iných inzulínových liekov
Prechod pacienta z iných inzulínových liekov si môže vyžadovať úpravu dávky lieku Kixelle a môže byť potrebná dávka bazálneho inzulínu. Kixelle má rýchlejší nástup účinku a kratšie trvanie účinku, ako rozpustný ľudský inzulín. Keď sa injekcia podáva podkožne do brušnej steny, účinok sa prejaví do
10-20 minút po podaní. Maximálny účinok sa dosiahne medzi 1. a 3. hodinou po podaní. Doba trvania
účinku je 3 až 5 hodín.
Počas prechodu a v prvých týždňoch po ňom sa odporúča dôsledné monitorovanie glukózy (pozri časť 4.4).
Spôsob podávania
Inzulín-aspartát je rýchlo pôsobiaci inzulínový analóg.
Kixelle sa podáva podkožne ako injekcia do brušnej steny, do stehna, do nadlaktia, do oblasti deltového alebo sedacieho svalu. Miesta podania injekcie sa majú v tej istej oblasti striedať, aby sa znížilo riziko lipodystrofie a kožnej amyloidózy (pozri časti 4.4 a 4.8). Podkožné podávanie do brušnej steny zaručuje rýchlejšiu absorpciu, ako z iných miest podávania. V porovnaní s rozpustným ľudským inzulínom je rýchlejší nástup účinku lieku Kixelle zachovaný bez ohľadu na miesto
podávania injekcie. Trvanie účinku sa môže meniť podľa dávky, miesta podávania, prietoku krvi, teploty a úrovne fyzickej aktivity.
Vzhľadom na rýchlejší nástup účinku sa má Kixelle vo všeobecnosti podávať tesne pred jedlom. Ak je to potrebné, môže sa Kixelle podať hneď po jedle.
Kixelle 100 jednotiek/ml injekčný roztok v injekčnej liekovke
Kontinuálna subkutánnainzulínováinfúzia(CSII)
Kixelle sa môže použiť na kontinuálnu podkožnú inzulínovú infúziu (CSII) v pumpe vhodnej pre
inzulínovú infúziu. CSII musí byť podaná do brušnej steny. Miesta podávania sa majú meniť.
Keď sa Kixelle používa v inzulínovej infúznej pumpe, nemá sa miešať so žiadnymi inými inzulínovými liekmi.
Pacienti používajúci CSII majú byť podrobne oboznámení s použitím inzulínovej pumpy a použitím správnej nádržky a cievky pumpy (pozri časť 6.6). Infúzna súprava (cievka a kanyla) sa musia meniť podľa pokynov uvedených v návode, ktoré sú súčasťou infúznej súpravy.
Pacienti, ktorí si podávajú Kixelle cez CSII musia mať vždy k dispozícii alternatívny spôsob podávania inzulínu pre prípad poruchy systému pumpy.
Intravenózne použitie
Ak je to potrebné, môžu Kixelle podať intravenózne lekári alebo zdravotnícki pracovníci.
Na intravenózne použitie, infúzne systémy s liekom Kixelle 100 jednotiek/ml s koncentráciami od
0,05 jednotky/ml do 1,0 jednotky/ml inzulín-aspartátu v infúznych roztokoch chloridu sodného
9 mg/ml (0,9%), 5% glukózy alebo 10% glukózy zahŕňajúcej 40 mmol/l chloridu draselného, ktoré sa používajú v polypropylénových infúznych vakoch sú pri izbovej teplote stabilné 24 hodín.
Aj keď sú stabilné po celý čas, bude sa spočiatku určité množstvo inzulínu absorbovať do materiálu infúzneho vaku. Počas inzulínovej infúzie je potrebné monitorovanie glukózy.
Podávanie injekčnou striekačkou
Kixelle injekčné liekovky sú určené na používanie s inzulínovými injekčnými striekačkami s vhodným
rozsahom jednotiek. Pozri tiež časť 6.6.
Kixelle 100 jednotiek/ml injekčný roztok v naplnenom pere
Kixelle v naplnenom pere je vhodný len na subkutánne použitie. Ak je nevyhnutné podanie injekčnou striekačkou alebo intravenóznou injekciou, má sa použiť injekčná liekovka. Ak je nevyhnutné podanie infúznou pumpou, má sa použiť injekčná liekovka.
Pomocou lieku Kixelle v naplnenom pere sa inzulín podáva v prírastkoch po 1 jednotke až do maximálnej jednorazovej dávky 80 jednotiek. Kixelle v naplnenom pere sa má používať s komerčne dostupnými ihlami na inzulínové perá. Pozri tiež časť 6.6.
Podrobné informácie o používaní, nájdete v písomnej informácii pre používateľa.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok (pozri časť 6.1).
4.4 Osobitné upozornenia a opatrenia pri používaní
Sledovateľnosť
Aby sa zlepšila (do)sledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov a číslo
šarže podaného lieku.
Cestovanie
Pred cestou medzi rôznymi časovými pásmami sa má pacient poradiť s lekárom, pretože môže nastať
zmena v čase podávania inzulínu a príjmu jedla.
Hyperglykémia
Neprimerané dávky alebo prerušenie liečby môžu viesť, najmä pri diabetes mellitus 1. typu, k
hyperglykémii a diabetickej ketoacidóze. Zvyčajne sa prvé príznaky hyperglykémie objavujú postupne počas hodín alebo dní. Patrí k nim smäd, časté močenie, nevoľnosť, vracanie, ospalosť, suchá začervenaná kožu, sucho v ústach, nechutenstvo, ako aj acetónový dych. Neliečené hyperglykemické stavy u pacientov s diabetes mellitus 1. typu v konečnom dôsledku vedú k vzniku diabetickej ketoacidózy, ktorá je potenciálne letálna.
Hypoglykémia
Vynechanie jedla alebo neplánované, namáhavé fyzické vypätie môže viesť k hypoglykémii.
Najmä u detí treba dbať na to, aby dávky inzulínu (zvlášť v režime bazál-bolus) zodpovedali príjmu potravy, fyzickým aktivitám a aktuálnej glykémii, aby sa minimalizovalo riziko hypoglykémie.
Hypoglykémia môže nastať, ak je dávka inzulínu veľmi vysoká v porovnaní s potrebou inzulínu. V prípade hypoglykémie alebo podozrenia na hypoglykémiu, sa Kixelle nesmie podávať. Po stabilizácii krvnej glukózy pacienta sa má uvažovať o úprave dávky (pozri časti 4.8 a 4.9).
Pacienti, u ktorých nastalo významné zlepšenie kontroly hladiny glukózy v krvi, napr. po intenzifikovanej inzulínovej liečbe, môžu pocítiť zmenu obvyklých varovných príznakov hypoglykémie a majú byť o nich primerane poučení. Obvyklé varovné príznaky sa môžu stratiť u pacientov dlhodobo chorých na diabetes.
Dôsledkom farmakodynamiky inzulínových analógov s rýchlym nástupom účinku je, že ak sa vyskytne hypoglykémia, tak jej nástup po podaní injekcie je rýchlejší, v porovnaní s rozpustným ľudským inzulínom.
Pretože Kixelle sa má podávať v bezprostrednom pred jedlom, rýchly nástup účinku lieku sa má brať do úvahy u pacientov so sprievodnými ochoreniami alebo u liečby, kde sa predpokladá spomalenie absorpcie jedla.
Sprievodné ochorenia, najmä infekcie a horúčkovité stavy si obvykle vyžadujú zvýšenie dávky inzulínu. Sprievodné ochorenia obličiek, pečene, alebo ochorenia ovplyvňujúce nadobličky, podmozgovú alebo štítnu žľazu môžu vyžadovať zmeny v dávke inzulínu.
Keď sú pacienti prevádzaní medzi rôznymi typmi inzulínových prípravkov, môžu sa včasné varovné príznaky hypoglykémie zmeniť alebo prichádzať oneskorene, v porovnaní s predchádzajúcim inzulínom.
Prechod zinýchinzulínovýchliekov
Prechod pacientov na iný typ alebo na inú značku inzulínu sa musí uskutočniť len za prísnej lekárskej
kontroly. Zmeny v sile, značke (výrobca), type, pôvode (zvierací, ľudský inzulín alebo analóg ľudského inzulínu) a/alebo v spôsobe jeho výroby (rekombinantná DNA oproti inzulínu zvieracieho pôvodu) môžu vyžadovať zmenu dávky. Pacienti prechádzajúci na Kixelle z iného typu inzulínu môžu vyžadovať zvýšenie počtu injekčných podaní za deň alebo zmenu dávky oproti pôvodne používaným inzulínovým liekom. Ak je potrebná úprava dávky, môže sa vykonať pri prvej dávke, alebo počas prvých niekoľkých týždňov alebo mesiacov.
Reakcie vmiestepodávaniainjekcie
Ako pri liečbe inými inzulínmi, môžu sa objaviť reakcie v mieste podávania injekcie, ktoré sa prejavia
bolesťou, začervenaním, žihľavkou, zápalom, podliatinou, opuchom a svrbením. Neustále striedanie miesta podávania v rámci danej oblasti znižuje riziko vzniku týchto reakcií. Reakcie zvyčajne vymiznú do niekoľkých dní až niekoľkých týždňov. V zriedkavých prípadoch si reakcie v mieste podávania môžu vyžiadať prerušenie liečby liekom Kixelle.
Poruchy kože a podkožnéhotkaniva
Pacienti musia byť poučení o tom, aby miesto podania injekcie neustále menili, čím sa zníži riziko
vzniku lipodystrofie a kožnej amyloidózy. Na miestach s týmito reakciami existuje potenciálne riziko oneskorenej absorpcie inzulínu a zhoršenej kontroly glykémie po podaní inzulínových injekcií. V prípade náhlej zmeny miesta podania injekcie na nepostihnutú oblasť bol hlásený vznik hypoglykémie. Po zmene miesta podania injekcie z postihnutej oblasti na nepostihnutú oblasť sa odporúča monitorovanie hladiny glukózy v krvi a je možné zvážiť úpravu dávky antidiabetík.
Kombinácia inzulín-aspartátu s pioglitazónom
Boli zaznamenané prípady kardiálneho zlyhania, keď sa užíval pioglitazón v kombinácii s inzulínom,
zvlášť u pacientov s rizikovými faktormi pre rozvoj kardiálneho zlyhania srdca. Na toto sa má pamätať, ak sa uvažuje o liečbe s kombináciou pioglitazónu a inzulín-aspartátu. Ak sa používa táto kombinácia, majú sa u pacientov sledovať príznaky a symptómy zlyhania srdca, zvýšenie telesnej hmotnosti a edémy. Užívanie pioglitazónu má byť ukončené, ak sa objaví akékoľvek zhoršenie kardiálnych symptómov.
Zamedzenie náhodnýmzámenám/medicínskymchybám
Pacient musí byť upozornený, aby vždy pred každým injekčným podaním skontroloval obal inzulínu,
aby sa zamedzilo náhodnej zámene inzulín-aspartátu za iné inzulíny.
Protilátky proti inzulínu
Podávanie inzulínu môže spôsobiť tvorbu protilátok proti inzulínu. V zriedkavých prípadoch
prítomnosť takých protilátok proti inzulínu môže vyžadovať úpravu dávky inzulínu, aby sa upravila náchylnosť k hyperglykémii alebo hypoglykémii.
Sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t.j. v podstate zanedbateľné
množstvo sodíka.
4.5 Liekové a iné interakcie
O mnohých druhoch liekov je známe, že ovplyvňujú glukózový metabolizmus.
Látky, ktoré môžu znižovať pacientovu potrebu inzulínu sú nasledovné:
Perorálne antidiabetiká, inhibítory monoaminooxidázy (IMAO), betablokátory, inhibítory angiotenzín konvertujúceho enzýmu (ACE), salicyláty, anabolické steroidy a sulfónamidy.
Látky, ktoré môžu zvyšovať pacientovu potrebu inzulínu sú nasledovné:
Perorálne antikoncepčné prípravky, tiazidy, glukokortikoidy, tyroidálne hormóny, sympatomimetiká, rastový hormón a danazol.
Betablokátory môžu maskovať príznaky hypoglykémie. Oktreotid/lanreotid môžu zvyšovať alebo znižovať potrebu inzulínu. Alkohol môže zosilňovať alebo redukovať hypoglykemický efekt inzulínu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Kixelle sa môže používať počas gravidity. Údaje z dvoch randomizovaných kontrolovaných
klinických štúdií (322 a 27 gravidných žien) nepreukázali žiadne nežiaduce účinky inzulín-aspartátu na graviditu alebo na zdravie plodu/novorodenca v porovnaní s ľudským inzulínom (pozri časť 5.1).
Intenzívna kontrola glukózy v krvi a sledovanie gravidných žien s diabetom mellitus (1. typu, 2. typu alebo gestačný diabetes mellitus) sa odporúča počas gravidity a pri plánovaní gravidity. Potreba inzulínu v prvom trimestri obvykle poklesne a následne sa zvyšuje počas druhého a tretieho trimestra. Po pôrode sa potreba inzulínu rýchlo vracia na hodnoty pred graviditou.
Dojčenie
Nie sú žiadne obmedzenia na liečbu liekom Kixelle počas dojčenia. Liečba dojčiacich matiek
inzulínom nepreukazuje žiadne riziko pre dojča. Predsa len, môže byť potrebné dávku lieku Kixelle upraviť.
Fertilita
Reprodukčné štúdie na zvieratách nepreukázali žiadne rozdiely medzi inzulín-aspartátom a ľudským
inzulínom, čo sa týka fertility.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Schopnosť koncentrácie, ako aj reakčná schopnosť u pacientov môže byť znížená v dôsledku hypoglykémie. Táto skutočnosť vytvára riziko v situáciách, ktoré si vyžadujú mimoriadnu pozornosť (napr. pri vedení vozidiel alebo pri obsluhe strojov).
Pacienti musia byť upozornení na vplyv hypoglykémie na vedenie vozidiel. Dôležité je to najmä
u tých pacientov, ktorí si znížene, alebo nedostatočne uvedomujú varovné signály hypoglykémie, alebo majú časté hypoglykémie. V týchto situáciách treba zvážiť vhodnosť vedenia vozidiel.
4.8 Nežiaduce účinky
Súhrn údajov obezpečnosti
Nežiaduce reakcie spozorované u pacientov používajúcich inzulín-aspartát sú spôsobené hlavne
farmakologickým účinkom inzulínu.
Hypoglykémia je najčastejšie pozorovaná nežiaduca reakcia. Frekvencia hypoglykémie sa mení s populáciou pacientov, dávkovacími schémami a úrovňou glykemickej kontroly (pozri časť 4.8 Opis vybraných nežiaducich reakcií).
Na začiatku liečby inzulínom sa môžu objaviť refrakčné poruchy, edém a reakcie v mieste podávania injekcie (bolesť, začervenanie, žihľavka, zápal, podliatina, opuch a svrbenie v mieste podávania). Tieto reakcie majú obvykle prechodný charakter. Náhle zlepšenie glykémie môže byť spojené s akútnou bolestivou neuropatiou, ktorá je zvyčajne reverzibilná. Stupňovanie liečby inzulínom s prudkým zlepšením glykemickej kontroly môže byť spojené s prechodným zhoršením diabetickej retinopatie, zatiaľ čo dlhodobé zlepšenie kontroly glykémie znižuje riziko progresie diabetickej retinopatie.
Tabuľkový zoznamnežiaducichreakciíNežiaduce reakcie uvedené nižšie na základe údajov z klinickej štúdie a sú klasifikované podľa
MedDRA frekvencie a triedy orgánových systémov. Kategórie frekvencií sú definované podľa nasledovnej konvencie: Veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až <
1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000); neznáme (nemôžu byť
stanovené z dostupných údajov).
Trieda orgánových systémov podľa databázy MedDRA
| veľmi časté
| menej časté
| zriedkavé
| veľmi zriedkavé
| neznáme
|
Poruchy imunitného systému
|
| Žihľavka, vyrážka, výsev
|
| Anafylaktické reakcie*
|
|
Poruchy metabolizmu a výživy
| Hypoglykémia*
|
|
|
|
|
Poruchy nervového systému
|
|
| Periférna neuropatia (bolestivá neuropatia)
|
|
|
Poruchy oka
|
| Refrakčné poruchy, diabetická retinopatia
|
|
|
|
Poruchy kože a podkožného tkaniva
|
| Lipodystrofia*
|
|
| Kožná amyloidóza*†
|
Celkové poruchy a reakcie v
mieste podania
|
| Reakcie v mieste podávania injekcie, edém
|
|
|
|
*pozri časť 4.8, Opis vybraných nežiaducich reakcií.
†nežiaduce reakcie z postmarketingových zdrojov.
Opis vybranýchnežiaducichreakciíAnafylaktické reakcieVýskyt generalizovaných hypersenzitívnych reakcií (zahŕňajúcich generalizovanú kožnú vyrážku, svrbenie, potenie, gastrointestinálne ťažkosti, angioneurotický edém, ťažkosti s dýchaním, palpitácie a pokles krvného tlaku) sú veľmi zriedkavé, ale môžu byť potenciálne život ohrozujúce.
H
ypoglykémia
Hypoglykémia je najčastejšie pozorovaná nežiaduca reakcia. Môže sa objaviť vtedy, keď je dávka inzulínu veľmi vysoká v porovnaní s potrebnou dávkou inzulínu. Závažná hypoglykémia môže viesť k bezvedomiu a/alebo kŕčom, čoho výsledkom môže byť prechodné alebo trvalé poškodenie funkcií mozgu alebo až smrť. Príznaky hypoglykémie sa objavujú zvyčajne náhle. Môžu zahŕňať studený pot, studenú bledú pokožku, vyčerpanosť, nervozitu alebo triašku, úzkosť, nezvyčajnú únavu alebo
slabosť, zmätenosť, problémy s koncentráciou, ospalosť, nadmerný hlad, zmeny videnia, bolesť hlavy, nauzeu a búšenie srdca.
V klinických štúdiách sa frekvencia hypoglykémie mení s populáciou pacientov, dávkovacími schémami a úrovňou glykemickej kontroly. Počas klinických štúdií celkové množstvo hypoglykémií nebolo rozdielne v porovnaní medzi pacientami liečenými inzulín-aspartátom a ľudským inzulínom.
Poruchy kože a podkožného tkanivaLipodystrofia (vrátane lipohypertrofie, lipoatrofie) a kožná amyloidóza sa môže vyskytnúť v mieste podávania injekcie, čím sa môže oneskoriť lokálna absorpcia inzulínu. Pravidelné striedanie miesta podania injekcie v danej oblasti môže pomôcť pri zmiernení týchto reakcií alebo môže týmto reakciám zabrániť (pozri časť 4.4).
Pediatrická populáciaNa základe postmarketingových zdrojov a klinických štúdií, frekvencia, typ a závažnosť nežiaducich
reakcií pozorovaných v pediatrickej populácii nenaznačujú žiadne rozdiely vo všeobecných skúsenostiach v porovnaní s bežnou populáciou.
Ďalšie osobitnéskupinypopulácieNa základe postmarketingových zdrojov a klinických štúdií nenaznačujú frekvencia, typ a závažnosť
nežiaducich reakcií pozorovaných u starších pacientov a pacientov s poškodením obličiek alebo pečene nenaznačujú žiadne rozdiely vo všeobecných skúsenostiach v porovnaní s bežnou populáciou.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 PredávkovanieŠpecifiká predávkovania inzulínom nie je možné definovať, hoci sa hypoglykémia môže vyvinúť cez nasledujúce štádiá, ak sú pacientovi podané veľmi vysoké dávky v porovnaní s potrebou:
• V prípade miernej hypoglykémie, je možné podať perorálne pacientovi glukózu alebo potravu obsahujúcu cukor. Preto sa odporúča, aby diabetik mal vždy pri sebe výrobky obsahujúce cukor.
• Pri závažnej hypoglykémii, ak je pacient v bezvedomí, môže mu byť podaný intramuskulárne alebo subkutánne glukagón (0,5 až 1 mg) osobou oboznámenou s podávaním injekcie, alebo glukóza, ktorú môžu podávať intravenózne lekári alebo iní zdravotnícki pracovníci. Ak pacient do 10 až 15 minút nezareagoval na glukagón, musí sa mu podať intravenózne glukóza. Po nadobudnutí vedomia sa odporúča podať pacientovi perorálne cukor, ako prevenciu proti recidíve.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Lieky používané na liečbu diabetu. Inzulíny a analógy na injekciu, rýchlo pôsobiace. ATC kód: A10AB05.
Kixelle je biologicky podobný liek. Podrobné informácie sú k dispozícii na webovej lokalite
Európskej liekovej agentúry
http://www.ema.europa.eu.MechanizmusúčinkuafarmakodynamickéúčinkyVplyv inzulín-aspartátu na znižovanie cukru v krvi je dôsledkom uľahčeného vychytávania glukózy
väzbou na inzulínové receptory vo svale a tukových bunkách a súčasne prebieha inhibícia produkcie glukózy v pečeni.

Pri sledovaní znižovania koncentrácie glukózy za prvé štyri hodiny po jedle má inzulín-aspartát rýchlejší nástup účinku v porovnaní s rozpustným ľudským inzulínom. Pri podkožnom podaní má inzulín-aspartát kratšiu dobu účinku ako rozpustný ľudský inzulín.
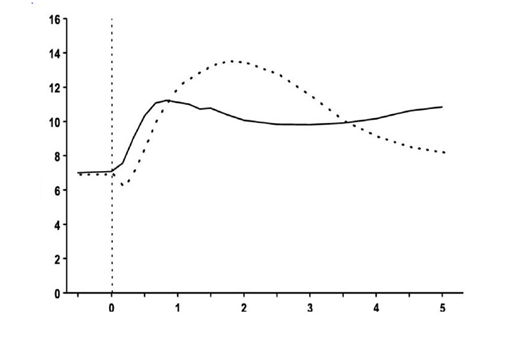 Čas (h)
Čas (h)Obr. 1. Koncentrácia glukózy v krvi po jednorazovej dávke inzulín-aspartátu podanom bezprostredne pred jedlom (plná krivka) alebo po podaní rozpustného ľudského inzulínu podaného 30 minút pred jedlom (čiarkovaná krivka) u pacienta s diabetes mellitus 1. typu.
Keď je inzulín-aspartát podaný podkožne, začiatok účinku je do 10 až 20 minút po podaní. Maximálny účinok sa dosiahne medzi 1. a 3. hodinou po podaní. Celkový čas trvania účinku je 3 až 5 hodín.'
Klinická účinnosť abezpečnosťKlinické skúšky u pacientov s diabetes mellitus 1. typu dokázali nižšie hodnoty postprandiálnej
glukózy v krvi po podaní inzulín-aspartátu v porovnaní s rozpustným ľudským inzulínom (obrázok 1). V dvoch dlhodobých otvorených štúdiách na pacientoch s diabetom 1. typu pozostávajúcich z 1 070 a
884 pacientov znižoval inzulín-aspartát glykovaný hemoglobín o 0,12 [95% C.I. 0,03; 0,22]
percentných bodov a o 0,15 [95% C.I. 0,05; 0,26] percentných bodov v porovnaní s ľudským inzulínom: rozdiel má obmedzený klinický význam.
Klinické štúdie u pacientov s diabetom 1. typu preukázali znížené riziko nočnej hypoglykémie pri inzulín-aspartáte v porovnaní s rozpustným ľudským inzulínom. Riziko dennej hypoglykémie sa výrazne nezvýšilo.
Inzulín-aspartát je ekvivalentný s rozpustným ľudským inzulínom v molárnom základe. Osobitnéskupinypacientov
Staršie osoby (≥ 65 rokov)
Randomizovaná, dvojito zaslepená skrížená PK/PD štúdia porovnávajúca inzulín-aspartát s rozpustným ľudským inzulínom, uskutočnená na starších pacientoch s diabetom 2. typu (19 pacientov vo veku 65-83 rokov, priemerný vek 70 rokov). Porovnateľné rozdiely vo farmakodynamických vlastnostiach (GIRmax, AUCGIR, 0-120 min) medzi inzulín-aspartátom a rozpustným ľudským inzulínom u starších pacientov boli podobné tými, ktoré sa pozorovali u zdravých subjektov a u mladších pacientov s diabetom.
Pediatrická populácia
Klinická štúdia porovnávajúca preprandiálny rozpustný ľudský inzulín s postprandiálnym inzulín- aspartátom bola vykonaná na malých deťoch (20 pacientov vo veku od 2 do menej ako 6 rokov, vykonávaná 12 týždňov, medzi ktorými boli štyria mladší ako 4 roky) a štúdia PK/PD jednotlivej dávky bola vykonaná u detí (6-12 rokov) a mladistvých (13-17 rokov). Farmakodynamický profil inzulín-aspartátu u detí bol podobný ako u dospelých.
Účinnosť a bezpečnosť inzulín-aspartátu, ktorý bol podávaný ako bolusový inzulín v kombinácii buď s inzulínom detemirom, alebo s inzulínom degludekom ako bazálnym inzulínom, bola sledovaná
v dvoch randomizovaných kontrolovaných klinických skúšaniach počas obdobia až do 12 mesiacov u dospievajúcich a detí vo veku od 1 do menej ako 18 rokov (n=712). Skúšania zahŕňali 167 detí vo veku 1-5 rokov, 260 vo veku 6-11 a 285 vo veku 12-17 rokov. Pozorované zlepšenie HbA1c
a bezpečnostné profily boli porovnateľné v rámci všetkých vekových skupín.
Gravidita
Klinická štúdia porovnávajúca bezpečnosť a účinnosť inzulín-aspartátu v porovnaní s ľudským inzulínom v liečbe gravidných žien s diabetom mellitus 1. typu (322 gravidných žien (inzulín-aspartát:
157; ľudský inzulín: 165)) nepreukázala žiadne nežiaduce účinky inzulín-aspartátu na graviditu alebo na zdravie plodu/novorodenca.
Na doplnenie, údaje z klinickej štúdie zahŕňajúcej 27 žien s gestačným diabetom randomizovaných na liečbu inzulín-aspartátom v porovnaní s ľudským inzulínom (inzulín-aspartát: 14; ľudský inzulín: 13) preukázali podobné bezpečnostné profily medzi liečbami.
5.2 Farmakokinetické vlastnosti
Absorpcia, distribúcia a eliminácia
V lieku Kixelle je aminokyselina prolín nahradená v polohe B 28 kyselinou asparágovou, čím sa
znižuje možnosť vytvárania hexamérov, ktoré boli pozorované u rozpustného ľudského inzulínu. Preto je Kixelle v porovnaní s rozpustným ľudským inzulínom rýchlejšie absorbovaný z podkožnej vrstvy.
Čas do získania maximálnej koncentrácie je v priemere polovičný ako pre rozpustný ľudský inzulín. Priemerná maximálna koncentrácia v plazme 492±256 pmol/l bola dosiahnutá za 40 (v rozmedzí
30-40) minút po podkožnom podaní dávky 0,15 jednotky/kg telesnej hmotnosti, u pacientov s diabetes mellitus 1. typu. Koncentrácie inzulínu sa vracajú k základnej línii za 4 až 6 hodín po podaní.
Rýchlosť absorpcie bola o niečo nižšia u pacientov s diabetes mellitus 2. typu, z čoho vyplýva nižšie
Cmax (352 ± 240 pmol/l) a neskorší tmax/60 (v rozmedzí 50-90) minút. Variabilita v čase dosiahnutia maximálnej koncentrácie u jednotlivých osôb je významne nižšia pri lieku Kixelle ako pri rozpustnom ľudskom inzulíne, aj keď naopak variabilita v Cmax je pri lieku Kixelle vyššia.
O
sobitné skupinypacientov
Staršie osoby (≥ 65 rokov)
Porovnateľné rozdiely vo farmakokinetických vlastnostiach medzi inzulín-aspartátom a rozpustným ľudským inzulínom u starších pacientov (65-83 rokov, priemerný vek 70 rokov) s diabetom 2. typu boli podobné ako tie ktoré sa pozorovali u zdravých subjektov a mladších pacientov s diabetom. Znížená absorpčná rýchlosť sa spozorovala u starších pacientov, vyplyvajúca z neskoršieho tmax (82 (medzikvartilový interval: 60-120) minút), zatiaľ čo Cmax bolo podobné ako to, ktoré sa pozorovalo
u mladších pacientov s diabetom 2. typu a nepatrne nižšie ako u pacientov s diabetom 1. typu.
Porucha funkcie pečene
Jednodávková farmakokinetická štúdia inzulín-aspartátu bola vykonaná u 24 subjektov s poruchou funkcie pečene v rozmedzí od normálnej po vážnu poruchu. U pacientov s poruchou funkcie pečene bola absorpčná rýchlosť znížená a variabilnejšia, vyplývajúca zo spomaleného tmax z asi 50 minút
u subjektov s normálnou funkciou pečene po asi 85 minút u pacientov s miernou a vážnou poruchou
funkcie pečene. AUC, Cmax a CL/F boli podobné u pacientov s poruchou funkcie pečene v porovnaní so subjektami s normálnou funkciou pečene.
Porucha funkcie obličiek
Jednodávková farmakokinetická štúdia inzulín-aspartátu bola vykonaná u 18 subjektov s poškodením funkcie obličiek v rozmedzí od normálnej po vážne poškodenú. Žiaden zdanlivý vplyv hodnôt kreatinín klírensu na AUC, Cmax, CL/F a tmax inzulín-aspartátu nebol zistený. Dáta boli obmedzené u pacientov so strednou a vážnou poruchou funkcie obličiek. Pacienti so zlyhávaním obličiek vyžadujúcim si liečbu dialýzou neboli skúmaní.
Pediatrická populácia
Farmakokinetické a farmakodynamické vlastnosti inzulín-aspartátu boli skúmané u detí (6-12 rokov) a dospievajúcich (13-17 rokov) s diabetom 1. typu. Inzulín-aspartát bol rýchlo absorbovaný u oboch vekových skupín s podobným tmax ako u dospelých. Avšak Cmax sa líšilo medzi vekovými skupinami s dôrazom na význam individuálnej titrácie inzulín-aspartátu.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podaní, genotoxicity a reprodukčnej toxicity a toxicity vývinu nedokázali žiadne osobitné riziko pre ľudí.
V in vitro testoch zahrňujúcich väzby na inzulínové a IGF-1 receptorové miesta a pri sledovaní vplyvu na rast buniek sa inzulín-aspartát správal podobne ako ľudský inzulín. Štúdie tiež dokázali, že disociácia väzieb medzi inzulínovými receptormi a inzulín-aspartátom je rovnaká ako u ľudského inzulínu.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
glycerol fenol metakrezol
chlorid zinočnatý
dihydrát hydrogenfosforečnanu sodného chlorid sodný
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
voda na injekcie
6.2 Inkompatibility
Tento liek sa nesmie riediť alebo miešať s inými liekmi.
6.3 Čas použiteľnosti
Pred otvorením:
30 mesiacov
Po prvomotvorení:
28 dní
Chemická a fyzikálna stabilita počas používania bola preukázaná počas 31 dní pri teplotách 30°C
a 5°C. Z mikrobiologického hľadiska možno liek po otvorení uchovávať najviac 28 dní pri teplote
30°C. Iná dĺžka skladovania je na zodpovednosti používateľa.
Kixelle 100 jednotiek/ml injekčný roztok v injekčnej liekovke
Uchovávajte pri teplote do 30°C. Neuchovávajte v chladničke. Neuchovávajte v mrazničke. Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Kixelle 100 jednotiek/ml injekčný roztok v naplnenom pere
Uchovávajte pri teplote do 30°C. Môže sa uchovávať v chladničke (2°C-8°C). Neuchovávajte v mrazničke.
Pero uchovávajte uzatvorené krytom na ochranu pred svetlom.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2°C-8°C). Neuchovávajte v mrazničke. Tento liek uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky uchovávania lieku po prvom otvorení, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Kixelle 100 jednotiek/mlinjekčnýroztokvinjekčnejliekovke
10 ml roztok v injekčnej liekovke (sklo typu 1), ktorá je uzavretá brómbutylovou gumenou zátkou
a hliníkovým odklopným tesnením.
Veľkosť balenia je 1 alebo 5 injekčných liekoviek alebo multibalenie obsahujúce 5 balení s 1 injekčnou liekovkou.
Kixelle 100 jednotiek/mlinjekčnýroztokvnaplnenompere
3 ml roztok v náplni (sklo typu 1) s piestom a zátkou (brómbutyl) a hliníkovým tesnením vo
viacdávkovom naplnenom pere.
Veľkosti balenia sú 1, 5, 10 naplnených pier alebo multibalenie obsahujúce 10 (2 balenia po 5)
naplnených pier.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom Nepoužívajte tento liek, ak spozorujete, že roztok nie je číry, bezfarebný a vodnatý. Liek Kixelle, ktorý bol zmrazený sa nesmie použiť.
Pacient má byť poučený o tom, že po každej injekcii má ihlu zlikvidovať.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s miestnymi požiadavkami.
Ihly, injekčné striekačky a naplnené perá nesmie používať nikto iný.
Kixelle100jednotiek/mlinjekčnýroztokvinjekčnejliekovkeKixelle môže byť použitý v infúznych pumpách (CSII) tak, ako je opísané v časti 4.2. Cievky, v
ktorých sú vnútorné povrchové materiály vyrobené z polyetylénu alebo polyolefínu, boli posúdené ako kompatibilné s použitím v pumpách.
Kixelle100 jednotiek/mlinjekčnýroztokvnaplnenompereVeľkosti ihiel kompatibilné s týmto perom:
- 31G, 5 mm,
- 32G, 4-6 mm,
- 34G, 4 mm.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMylan IRE Healthcare Limited
Unit 35/36 Grange Parade, Baldoyle Industrial Estate, Dublin 13, Írsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/20/1506/001
EU/1/20/1506/002
EU/1/20/1506/003
EU/1/20/1506/004
EU/1/20/1506/005
EU/1/20/1506/006
EU/1/20/1506/007
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na webovom sídle Európskej liekovej agentúry
http://www.ema.europa.eu.