
ypuknutie ložiskového záchvatu)
Odporúčaná začiatočná dávka je 40 mg/kg/deň.
Udržiavacie odporúčania vo vzťahu k telesnej hmotnosti sú: Telesná hmotnosť: 10 až 15 kg; 0,5 až 1 g/deň
15 až 30 kg; 1 až 1,5 g/deň
T
abuľka 2: Počet rozpustných tabliet podľa telesnej hmotnosti a počiatočnej dávky pri
rezistentnej parciálnej epilepsii
T
elesná
hmotnosť
(
kg)
P
očiatočná dávka 40 mg/kg/deň
3 0,5 x 100 mg tableta ráno
0,5 x 100 mg tableta večer
4 0,5 x 100 mg tableta ráno
1 x 100 mg tableta večer
5 1 x 100 mg tableta ráno
1 x 100 mg tableta večer
6 1 x 100 mg tableta ráno
1,5 x 100 mg tableta večer
7 1,5 x 100 mg tableta ráno
1,5 x 100 mg tableta večer
8 1,5 x 100 mg tableta ráno
2 x 100 mg tableta večer
10 2 x 100 mg tableta ráno
2 x 100 mg tableta večer
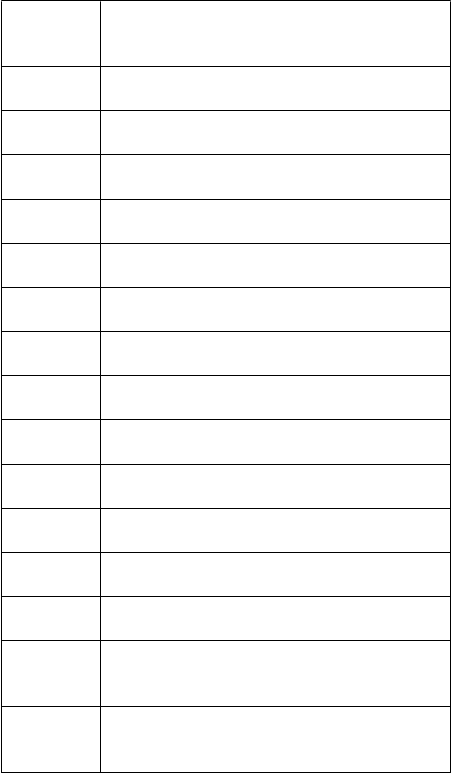
13 2,5 x 100 mg tableta ráno
2,5 x 100 mg tableta večer
15 3 x 100 mg tableta ráno
3 x 100 mg tableta večer
17 3,5 x 100 mg tableta ráno
3,5 x 100 mg tableta večer
19 3,5 x 100 mg tableta ráno
4 x 100 mg tableta večer
22 4,5 x 100 mg tableta ráno
4,5 x 100 mg tableta večer
25 1 x 500 mg tableta ráno
1 x 500 mg tableta večer
1 x 500 mg tableta ráno
28 1 x 500 mg tableta a 1 x 100 mg tableta
večer
1 x 500 mg tableta a 1 x 100 mg tableta ráno
30 1 x 500 mg tableta a 1 x 100 mg tableta
večer
Kigabeq je určený na perorálne podávanie alebo podávanie do žalúdka dvakrát denne a môže sa užívať
pred jedlom alebo po jedle.
Maximálna odporúčaná dávka sa nesmie prekročiť.
Ak sa kontrola epilepsie po adekvátnej liečbe klinicky významne nezlepší, liečba vigabatrínom sa má prerušiť. Vigabatrín sa má pod prísnym lekárskym dohľadom postupne vysadzovať.
Porucha funkcie obličiekKeďže vigabatrín sa vylučuje obličkami, pri podávaní lieku pacientom s klírensom kreatinínu pod 60
ml/min je potrebné dbať na opatrnosť. Je potrebné zvážiť úpravu dávky. Takíto pacienti môžu reagovať na nižšiu udržiavaciu dávku. Pacienti by sa mali sledovať kvôli nežiaducim reakciám, akými
sú sedácia alebo zmätenosť (pozri časti 4.4 a 4.8).
Porucha funkcie pečene

Vigabatrín nie je metabolizovaný pečeňovými enzýmami, preto nie je potrebné upravovať dávku ani
frekvenciu podávania.
Pediatrická populáciaU indikácie „detské kŕče“ a u detí a adolescentov vo veku nad 7 rokov u indikácie „rezistentná parciálna epilepsia“ (vypuknutie ložiskového záchvatu) nie je relevantné používanie Kigabequ u
novorodencov (mladších ako 27 dní).
Spôsob podávaniaKigabeq je určený na perorálne podávanie alebo podávanie do žalúdka a môže sa užívať pred jedlom
alebo po jedle.
Podávanie do žalúdka sa má používať u detí, ktoré nemôžu prehĺtať, ale môžu sa vyživovať cez črevá.
Spôsob podávania určí lekár špecializujúci sa na epileptológiu, neurológiu alebo pediatrickú neurológiu.
Pokyny na rozpustenie a zaobchádzanie s liekom pred podaním, pozri časť 6.6.
Perorálne podávanieKeďže neboli vykonané žiadne štúdie stability s inými rozpúšťadlami ako s vodou, na prípravu perorálneho roztoku by sa mala používať len voda. Keď sa tablety úplne rozpadnú, celý obsah roztoku
sa má ihneď podať dieťaťu priamo z pohára na pitie. Ak existuje riziko regurgitácie alebo ak dieťa nie je dosť staré na to, aby pilo z pohára, celý obsah roztoku by sa mal odobrať injekčnou striekačkou na
perorálne použitie, koniec striekačky by sa mal vložiť do úst dieťaťa a jemne stlačiť piest.
Keď dieťa úplne vypije roztok s liekom, pohár by sa mal vypláchnuť jednou alebo dvoma čajovými lyžičkami vody (približne 5 alebo 10 ml) a okamžite podať dieťaťu rovnakým spôsobom.
Podávanie do žalúdkaU pacientov, ktorí nemôžu prehĺtať, je možné podávať Kigabeq pomocou žalúdočnej trubice. Tablety sa rozpadajú v približne 5 alebo 10 ml vody a výsledný roztok sa zavedie do skúmavky pomocou prispôsobenej striekačky. Žalúdočná trubica sa má opláchnuť 10 ml vody.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníPoruchy zorného poľa (VFD) boli hlásené u pacientov užívajúcich vigabatrín s vysokou prevalenciou (približne 1/3 pacientov). Frekvencie zistené v otvorenej klinickej štúdii sú uvedené v časti 4.8. Vypuknutie nastáva zvyčajne po mesiacoch až rokoch liečby vigabatrínom. Stupeň zúženia zorného poľa môže byť závažný a môže mať pre pacienta praktické následky. Vigabatrín môže spôsobiť trvalú stratu zraku.
Väčšina pacientov s poškodeniami potvrdenými perimetriou bola asymptomatická. Preto môže byť tento nežiaduci účinok spoľahlivo zistený len systematickou perimetriou, ktorá je zvyčajne možná len u pacientov s vývojovým vekom nad 9 rokov. U mladších pacientov sa má použiť elektroretinografia (pozri Poruchy zorného poľa).
Z dostupných údajov vyplýva, že poruchy zorného poľa sú nezvratné aj po vysadení vigabatrínu. Zhoršenie poruchy zorného poľa po ukončení liečby nemožno vylúčiť.
Preto sa má vigabatrín používať len po starostlivom zhodnotení prínosu a rizika v porovnaní s
alternatívami.
Vigabatrín sa neodporúča používať u pacientov s akoukoľvek už existujúcou klinicky významnou poruchou zorného poľa.

Pacienti by mali podstúpiť systematické skríningové vyšetrenie na zistenie porúch zorného poľa a v pravidelných intervaloch ho opakovať. V testovaní zorného poľa sa má pokračovať v 6-mesačných intervaloch počas celej liečby. Posúdenie musí pokračovať 6 až 12 mesiacov po ukončení liečby (pozri Poruchy zorného poľa).
Poruchyzornéhopoľa(VFD)Na základe dostupných údajov je obvyklým vzorom sústredné zúženie zorného poľa oboch očí, ktoré
je vo všeobecnosti výraznejšie skôr nazálne než časovo. V strednom zornom poli (do 30 stupňov výstrednosti) je často pozorovaná prstencová nazálna porucha. Avšak poruchy zorného poľa hlásené u
pacientov užívajúcich vigabatrín sa pohybovali od miernej až po závažnú poruchu. Závažné prípady
potenciálne spôsobujú znemožnenie videnia.
Väčšina pacientov s poruchami potvrdenými perimetriou si predtým spontánne nevšimla žiadne príznaky, dokonca ani v prípadoch, keď bola v perimetrii pozorovaná závažná porucha. Z dostupných údajov vyplýva, že poruchy zorného poľa sú nezvratné aj po vysadení vigabatrínu. Zhoršenie poruchy zorného poľa po ukončení liečby nemožno vylúčiť.
Súhrnné údaje z prieskumov prevalencie naznačujú, že až 1/3 pacientov liečených vigabatrínom má poruchy zorného poľa. Muži môžu byť vo väčšej miere ohrození ako ženy. Frekvencie zistené v otvorenej klinickej štúdii sú uvedené v časti 4.8. V tejto štúdii bola preukázaná možná súvislosť medzi rizikom porúch zorného poľa a rozsahom vystavenia vigabatrínu, a to ako z dennej dávky (od 1 gramu do viac ako 3 gramov), tak z hľadiska trvania liečby (maximálne počas prvých troch rokov).
Pred začiatkom liečby vigabatrínom alebo tesne po ňom majú všetci pacienti ísť na oftalmologickú
konzultáciu.
U detí mladších ako 9 rokov vývojového veku je perimetria možná len zriedka. Riziká liečby sa musia starostlivo zvážiť v porovnaní s možným prínosom u detí. V súčasnosti neexistuje žiadna zavedená metóda na diagnostiku alebo vylúčenie porúch zorného poľa u detí, u ktorých nie je možné vykonať štandardnú perimetriu. Frekvencia a závažnosť boli u tejto populácie len nepriamo charakterizované
na základe prítomnosti elektroretinogramu alebo potenciálnych anomálií vyvolaných zrakom.
Elektroretinografia sa odporúča u dojčiat a u detí, ktoré nie sú schopné spolupracovať počas perimetrie. Na základe dostupných údajov sa zdá, že prvý oscilačný potenciál a 30 Hz blikanie odpovedí elektroretinogramu korelujú s poruchou zorného poľa spojenou s vigabatrínom. Tieto odpovede sa oneskorujú a znižujú nad rámec bežných limitov. Takéto zmeny neboli pozorované u pacientov bez poruchy zorného poľa liečených vigabatrínom.
Rodičia a/alebo opatrovatelia musia dostať dôkladný opis frekvencie a dôsledkov vývoja poruchy
zorného poľa počas liečby vigabatrínom.
Porucha zorného poľa nemusí byť zistená, až kým nie je závažná a nezistené stredne závažné poruchy môžu mať vplyv na integritu dieťaťa. Preto sa na začiatku liečby vyžaduje posúdenie zraku (nie neskôr ako 4 týždne po začiatku liečby), a potom najmenej každých 6 mesiacov počas liečby. Posúdenie musí pokračovať 6 až 12 mesiacov po ukončení liečby.
Z dostupných údajov vyplýva, že poruchy zorného poľa sú nezvratné.
Ak sa počas sledovania zistí zúženie zorného poľa, má sa zvážiť postupné prerušenie liečby vigabatrínom. Ak sa rozhodne o pokračovaní liečby, má sa zvážiť častejšie sledovanie (perimetria) s cieľom zistiť progresiu alebo zhoršenie poškodenia zraku.
Vigabatrín sa nemá používať súbežne s inými retinotoxickými liekmi.
Neurologické a psychiatrické stavy
Vzhľadom na výsledky štúdií bezpečnosti zvierat (pozri časť 5.3) sa odporúča, aby sa pacienti liečení
vigabatrínom pozorne sledovali na nežiaduce účinky v neurologických funkciách.
Krátko po začatí liečby vigabatrínom boli popisované zriedkavé hlásenia encefalopatických symptómov, akými sú výrazná sedácia, stupor a zmätenosť v súvislosti s nešpecifickou aktivitou pomalých vĺn na elektroencefalograme. Rizikové faktory pre vznik týchto reakcií zahŕňajú vyššiu než odporúčanú počiatočnú dávku, rýchlejšiu eskaláciu dávky vo vyšších krokoch, ako sa odporúča, a zlyhanie obličiek. Tieto príhody boli reverzibilné po znížení dávky alebo po vysadení vigabatrínu (pozri časť 4.8).
Abnormálne signály pri vyšetrení magnetickou rezonanciou
Abnormálne zmeny signálu magnetickej rezonancie (MRI), ktoré sa vyznačujú zvýšeným signálom T2
a obmedzenou difúziou v symetrickom vzore, zahŕňajúce talamus, bazálne gangliá, mozgový kmeň a mozoček boli pozorované u niektorých dojčiat s detskými kŕčmi liečených vigabatrínom. V retrospektívnej epidemiologickej štúdii u dojčiat s detskými kŕčmi (N = 205) bola prevalencia týchto zmien 22 % u pacientov liečených vigabatrínom oproti 4 % u pacientov liečených inými liekmi.
V uvedenej štúdii v postmarketingových skúsenostiach a v publikovaných vedeckých správach sa tieto zmeny vo všeobecnosti vyriešili prerušením liečby. U niekoľkých pacientov sa lézia vyriešila napriek pokračujúcemu užívaniu.
Poruchy pohybového systému vrátane dystónie, dyskinézy a hypertónie boli hlásené u pacientov s detskými kŕčmi liečených vigabatrínom. Pomer prínosu a rizika vigabatrínu sa má hodnotiť na základe jednotlivých pacientov. Ak sa počas liečby vigabatrínom vyskytnú nové poruchy pohybu, treba zvážiť zníženie dávky alebo postupné prerušenie liečby.
Niektorí pacienti môžu pri liečbe vigabatrínom zaznamenať zvýšenie frekvencie záchvatov alebo nástup nových typov záchvatov (pozri časť 4.8). Obzvlášť náchylní na tento účinok môžu byť pacienti s myoklonickými záchvatmi. V zriedkavých prípadoch sa môže objaviť nový myoklonus a exacerbácia existujúceho myoklonu. Tieto javy môžu byť tiež dôsledkom predávkovania, zníženia plazmatickej koncentrácie súbežnej antiepileptickej liečby alebo paradoxného účinku.
Náhle vysadenie môže spôsobiť návrat záchvatov. Ak sa u pacienta chystá vysadenie vigabatrínu,
odporúča sa to dosiahnuť postupným znižovaním dávky počas obdobia 2 až 4 týždňov.
Pacienti s anamnézou psychózy, depresie alebo poruchami správania majú vigabatrín užívať veľmi opatrne. V priebehu liečby vigabatrínom boli hlásené psychické príhody (napr. agitácia, depresia, abnormálne myslenie, paranoidné reakcie). Tieto prípady sa vyskytli u pacientov s psychiatrickou anamnézou aj bez nej a boli zvyčajne reverzibilné, keď sa dávky vigabatrínu znížili alebo sa postupne prerušili.
Samovražedné myšlienky a správanie
U pacientov liečených antiepileptickými liekmi boli u niekoľkých indikácií hlásené samovražedné
myšlienky a správanie. Metaanalýza antiepileptických liekov randomizovaných placebom kontrolovaných testov tiež preukázala malé zvýšenie rizika samovražedných myšlienok a správania. Mechanizmus tohto účinku nie je známy a dostupné údaje nevylučujú u vigabatrínu možnosť zvýšeného rizika.
Preto sa u pacientov majú sledovať príznaky samovražedných myšlienok a správania a má sa zvážiť vhodná liečba. Pacientom (a opatrovateľom pacientov) treba odporučiť, aby vyhľadali lekársku pomoc hneď, keď sa objavia známky samovražedných myšlienok alebo správania.
Poruchafunkcieobličiek
Keďže vigabatrín sa vylučuje obličkami, u pacientov s klírensom kreatinínu pod 60 ml/min by sa malo dbať na opatrnosť. U týchto pacientov sa majú starostlivo sledovať nežiaduce účinky, akými sú
sedácia a zmätenosť (pozri časť 4.2).
Zásah do sérologických testov
Užívanie vigabatrínu môže viesť k zníženiu meranej plazmatickej aktivity alanínaminotransferázy
(ALT) a v menšej miere aspartátaminotransferázy (AST). Hodnota potlačenia ALT sa pohybovala medzi 30 % a 100 %. Tieto pečeňové testy preto môžu byť u pacientov užívajúcich vigabatrín kvantitatívne nespoľahlivé (pozri časť 4.8).
Vigabatrín môže zvýšiť množstvo aminokyselín v moči, čo môže viesť k falošne pozitívnemu testu na niektoré zriedkavé genetické metabolické poruchy (napr. alfa aminoadipovú acidúriu).
Riziko omylov pri liečbe
Pretože sa môžu užívať tablety s oboma silami (100 mg a 500 mg), môže dôjsť k zámene medzi podávanými tabletami alebo polovicami tabliet s rizikom nesprávneho dávkovania. Aby sa správne určila sila, veľkosti tablety sa má venovať osobitná pozornosť.
4.5 Liekové a iné interakcie
Interakčné štúdie sa uskutočnili len u dospelých.
Keďže vigabatrín sa nemetabolizuje, ani nie je viazaný na proteíny a nie je induktorom metabolizujúcich enzýmov pečeňového cytochrómu P450, interakcie s inými liekmi sú nepravdepodobné. Počas kontrolovaných klinických štúdií však bolo pozorované postupné zníženie plazmatickej koncentrácie fenytoínu o 16 až 33 %. Presná povaha tejto interakcie v súčasnosti nie je známa, avšak vo väčšine prípadov je nepravdepodobné, že by mala terapeutický význam.
Počas kontrolovaných klinických skúšaní boli tiež sledované plazmatické koncentrácie karbamazepínu, fenobarbitalu a valproátu sodného, pričom neboli zistené žiadne klinicky významné interakcie.
4.6 Fertilita, gravidita a laktácia
Gravidita
Tento liek nie je určený na použitie u žien v plodnom veku.
Dojčenie
Tento liek nie je určený na použitie u žien, ktoré dojčia.
Fertilita
Štúdie plodnosti u potkanov nepreukázali žiadny vplyv na plodnosť samcov a samíc (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Kigabeq má veľký vplyv na schopnosť vykonávať rizikové činnosti.
Vzhľadom na skutočnosť, že v klinických testoch vigabatrínu bola pozorovaná ospalosť, pacienti majú byť na túto možnosť upozornení na začiatku liečby.
V súvislosti s vigabatrínom boli často hlásené poruchy zorného poľa, ktoré môžu významne ovplyvniť
schopnosť vykonávať rizikové činnosti. U pacientov sa má vyšetriť prítomnosť porúch zorného poľa
(pozri tiež časť 4.4). Osobitnú pozornosť je potrebné venovať mladým pacientom, ktorí chodia na bicykli, šplhajú sa po horách alebo vykonávajú akúkoľvek inú rizikovú činnosť.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie hláseným nežiaducim účinkom súvisiacim s vigabatrínom sú poruchy zorného poľa (od
miernej až po závažnú a vyskytujúce sa zvyčajne po mesiacoch až rokoch liečby vigabatrínom), psychické poruchy ako agitácia, excitácia, agresia, nervozita, depresia, paranoidná reakcia, poruchy nervového systému, akou je výrazná sedácia, stupor a zmätenosť. Medzi zriedka videné prípady patria pokusy o samovraždu, encefalopatia a poruchy sietnice.
U niektorých pacientov môže pri užívaní vigabatrínu nastať zvýšenie frekvencie záchvatov vrátane epileptického stavu. Obzvlášť náchylní na tento účinok môžu byť pacienti s myoklonickými záchvatmi. V zriedkavých prípadoch sa môže objaviť nový myoklonus a exacerbácia existujúceho myoklonu.
Tabuľkový zoznamnežiaducichreakcií
Po celom svete boli počas užívania vigabatrínu pred alebo po schválení hlásené nižšie uvedené
nežiaduce reakcie. Nie sú špecifické pre pediatrickú populáciu.
Nežiaduce účinky zoradené podľa frekvencie sú uvedené nižšie s použitím nasledujúcej konvencie:
Veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až <1/100), zriedkavé (≥
1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000), neznáme (nedá sa odhadnúť z dostupných údajov).
T
rieda orgánových systémov
P
oruchy krvi a lymfatického systému
V
eľmi časté
Č
asté Menej časté Zriedkav é
anémia
Veľmi
zriedkavé
Neznáme
P
sychické poruchy
P
oruchy nervového systému
agitácia, agresivita, nervozita, depresia, paranoidná reakcia
spavosť porucha reči, bolesť hlavy, závrat, parestézia, poruchy pozornosti
a poruchy
pamäti, duševná porucha (poruchy myslenia), triaška
hypománia, mánia, psychotická porucha
abnormálna koordinácia (ataxia)
pokus o samovraž du
encefalop atia
halucinácie
optická neuritída
abnormality MRI mozgu. pohybové poruchy vrátane dystónie, dyskinézy a hypertónie, buď samostatne, alebo v spojení s

abnormalitami
MRI
P
oruchy oka porucha zorného poľa
Poruchy gastrointesti nálneho traktu
Poruchy
pečene
a žlčových
ciest
Poruchy kože
a podkožnéh
o tkaniva
rozmazané videnie, dvojité videnie, nystagmus
nevoľnosť, vracanie, bolesť brucha
porucha sietnice (akou je periférna retinálna atrofia)
vyrážka angioedé m, žihľavka
optická atrofia
hepatitída
P
oruchy kostrovej
a svalovej
sústavy
a spojivovéh
artralgia
o tkaniva
C
elkové poruchy
a reakcie
v mieste podania
Laboratórne a funkčné vyšetrenia
únava edém,

podráždenosť
zvýšená telesná hmotnosť
Poruchy
z
orného
poľa
Epidemiológia poruchy zorného poľa u pacientov s refraktérnou parciálnou epilepsiou bola
pozorovaná v pozorovanej, otvorenej, multicentrickej, porovnávacej, paralelnej skupine štúdie fázy IV vrátane 734 pacientov vo veku najmenej 8 rokov, s refraktérnou parciálnou epilepsiou aspoň po dobu jedného roka.
Pacienti boli rozdelení do troch liečebných skupín: pacienti v súčasnosti liečení vigabatrínom (I. skupina), pacienti predtým liečení vigabatrínom (II. skupina) a pacienti, ktorí nikdy neboli liečení vigabatrínom (III. skupina).
V nasledujúcej tabuľke sú uvedené hlavné zistenia pri zaradení do skupiny a prvé a posledné preukazné hodnotenia v hodnotenej populácii (n = 524):
Deti (od 8 do 12 rokov) Adolescenti a dospelí (> 12 rokov)
I. skupina 1 II. skupina 2
III. skupina I. skupina 3 II. skupina 4
III. skupina
Porucha zorného poľa s neidentifikovanou etiológiou:
- Pozorované pri zaradení do skupiny
- Pozorované pri prvom preukaznom hodnotení
- Pozorované pri poslednom preukaznom hodnotení
N = 38 N = 47 N = 41 N = 150 N = 151 N = 97
1 (4,4 %) 3 (8,8 %) 2 (7,1%) 31 (34,1%) 20 (19,2%) 1 (1,4%)
4 (10,5%) 6 (12,8%) 2 (4,9%) 59 (39,3%) 39 (25,8%) 4 (4,1%)
10 (26,3%) 7 (14,9%) 3 (7,3%) 70 (46,7%) 47 (31,1%) 5 (5,2%)

1 Stredné trvanie liečby: 44,4 mesiacov, stredná denná dávka 1,48 g
2 Stredné trvanie liečby: 20,6 mesiacov, stredná denná dávka 1,39 g
3 Stredné trvanie liečby: 48,8 mesiacov, stredná denná dávka 2,10 g
4 Stredné trvanie liečby: 23,0 mesiacov, stredná denná dávka 2,18 g
O
pis vybraných nežiaducich reakcií
Počas liečby vigabatrínom boli hlásené psychiatrické reakcie. Tieto reakcie sa vyskytli u pacientov s
psychiatrickou anamnézou aj bez nej a boli zvyčajne reverzibilné, keď sa dávky vigabatrínu znížili alebo sa postupne prerušili (pozri časť 4.4.). V klinických štúdiách bola depresia bežnou psychiatrickou reakciou, ale zriedka si vyžadovala prerušenie liečby vigabatrínom.
Krátko po začatí liečby vigabatrínom boli popisované zriedkavé hlásenia encefalopatických
symptómov, akými sú výrazná sedácia, stupor a zmätenosť v súvislosti s nešpecifickou aktivitou pomalých vĺn na elektroencefalograme. Tieto reakcie boli po znížení dávky vigabatrínu alebo po jeho vysadení úplne reverzibilné (pozri časť 4.8).
Z laboratórnych údajov vyplýva, že liečba vigabatrínom nevedie k renálnej toxicite. Zaznamenali sa poklesy ALT a AST, ktoré sa považujú za dôsledok inhibície týchto aminotransferáz vigabatrínom. Chronické liečenie vigabatrínom môže byť spojené s miernym poklesom hemoglobínu, ktorý len zriedkavo dosahuje významné hodnoty.
Asymptomatické a prechodné abnormality vyšetrenia magnetickej rezonancie (MRI) v mozgu boli pozorované u niektorých dojčiat, u ktorých sa vigabatrínom liečili detské kŕče. Klinický význam týchto abnormalít magnetickej rezonancie nie je známy. Keďže rutinné sledovanie magnetickej rezonancie u tejto detskej populácie sa neodporúča, z dostupných údajov nie je možné frekvenciu abnormalít magnetickej rezonancie spoľahlivo odhadnúť. U pacientov, u ktorých sa vigabatrínom liečili detské kŕče, boli hlásené poruchy pohybu buď samostatné alebo v súvislosti s abnormalitami magnetickej rezonancie, ale ich frekvencia nie je známa.
Pediatrická populáciaPsychické poruchyVeľmi časté: excitácia, agitácia
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePríznakyBolo hlásené predávkovanie vigabatrínom. Pri podávaní boli dávky najčastejšie medzi 7,5 až 30 g; ale
boli hlásené prípady až do 90 g. Takmer polovica prípadov zahŕňala užívanie viacerých liekov. V hláseniach boli najčastejšími príznakmi ospalosť alebo kóma. Medzi ďalšie menej často hlásené príznaky patrí závrat, bolesť hlavy, psychóza, dychový útlm alebo apnoe, bradykardia, hypotenzia, agitácia, podráždenosť, zmätenosť, abnormálne správanie a porucha reči.
ZvládnutieNeexistuje žiadne špecifické antidotum. Majú sa využiť bežné podporné opatrenia. Majú sa zvážiť
opatrenia na odstránenie neabsorbovaného lieku. V
in vitro štúdii bolo preukázané, že aktívne uhlie významne neabsorbuje vigabatrín. Účinnosť hemodialýzy pri liečbe predávkovania vigabatrínom nie
je známa. V sporadických prípadoch hlásených u pacientov so zlyhaním obličiek, ktorí dostávali
terapeutické dávky vigabatrínu, hemodialýza znížila plazmatické koncentrácie vigabatrínu o 40 % až
60 %.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiepileptiká, deriváty mastných kyselín, ATC kód: N03AG04
Mechanizmus účinku
Vigabatrín je selektívny ireverzibilný inhibítor GABA transaminázy, enzýmu zodpovedného za
rozklad GABA (kyselina gama-aminomaslová). Vigabatrín zvyšuje koncentráciu kyseliny gama-
aminomaslovej, hlavného inhibičného neurotransmitera v mozgu.
Klinická účinnosť abezpečnosť
Kontrolované a dlhodobé klinické testy preukázali, že vigabatrín je účinnou antikonvulzívnou látkou,
ak sa podáva ako liek prvej línie u pacientov s detskými kŕčmi a ako prídavný liek u pacientov
s epilepsiou, ktorí neboli pomocou konvenčnej liečby uspokojivo kontrolovaní. Táto účinnosť je zvlášť výrazná u pacientov so záchvatmi čiastočného pôvodu.
5.2 Farmakokinetické vlastnosti
Dospelí
Absorpcia
Vigabatrín je vo vode rozpustná zlúčenina a rýchlo sa úplne absorbuje z gastrointestinálneho traktu. Podávanie potravy nemení rozsah absorpcie vigabatrínu. Čas dosiahnutia maximálnych plazmatických koncentrácií (tmax ) je približne 1 hodina.
Distribúcia
Vigabatrín sa široko distribuuje so zdanlivým distribučným objemom o niečo väčším ako celkový objem vody v tele. Väzba na plazmatické bielkoviny je zanedbateľná. Koncentrácie plazmy a mozgovomiechového moku sú lineárne spojené s dávkou presahujúcou odporúčané dávkovanie.
Biotransformácia
Vigabatrín nie je významne metabolizovaný. V plazme neboli zistené žiadne metabolity.
Eliminácia
Vigabatrín sa vylučuje renálnym vylučovaním s terminálnym polčasom 5-8 hodín. Perorálny klírens
(Cl/F) vigabatrínu je približne 7 l/h (t. j. 0,10 l/h/kg). Približne 70 % jednej perorálnej dávky sa počas
prvých 24 hodín po podaní dávky objavilo v moči ako nezmenený liek.
Farmakokinetický/farmakodynamický vzťah
Neexistuje žiadna priama korelácia medzi koncentráciou plazmy a účinnosťou. Trvanie účinku lieku
závisí od rýchlosti syntézy transaminázy gama-aminomaslovej kyseliny.
Pediatrická populácia
Farmakokinetické vlastnosti vigabatrínu sa skúmali u skupín po šiestich novorodencoch (vo veku 15-
26 dní), šiestich dojčiat (vo veku 5-22 mesiacov) a šiestich detí (vo veku 4,6 - 14,2 rokov) s refraktérnou epilepsiou.
Po podaní jednorazovej dávky perorálneho roztoku 37-50 mg/kg bol t max vigabatrínu približne 2,5 hodiny u novorodencov a dojčiat a 1 hodinu u detí. Priemerný terminálny polčas vigabatrínu bol u novorodencov približne 7,5 hodiny, u dojčiat 5,7 hodín a u detí 5,5 hodín. Priemerný Cl/F aktívneho S-enantioméru vigabatrínu u dojčiat a detí bol 0,591 l/h/kg a 0,446 l/h/kg.
5.3 Predklinické údaje o bezpečnosti
Bezpečnostné štúdie na zvieratách vykonané u potkanov, myší, psov a opíc ukázali, že vigabatrín
nemá významné nežiaduce účinky na pečeň, obličky, pľúca, srdce alebo gastrointestinálny trakt.
V mozgu sa v dávkach 30-50 mg/kg/deň pozorovala mikrovokulácia v dôsledku intramyelinického edému v traktoch bielej hmoty u potkanov, myší a psov. U opíc sú tieto lézie minimálne alebo nejednoznačné. U potkanov aj u psov boli reverzibilné pri zastavení liečby vigabatrínom a ustúpili dokonca aj pri pokračovaní liečby.
Retinotoxicita spojená s vigabatrínom bola pozorovaná u 80 – 100 % albínov potkanov v dávke 300 mg/kg/deň perorálne, ale nie u pigmentovaných potkanov, psov alebo opíc. Zmeny v sietnici u albínov potkanov boli charakterizované ako fokálna alebo multifokálna dezorganizácia vonkajšej jadrovej vrstvy, zatiaľ čo ostatné vrstvy sietnice neboli ovplyvnené.
Pokusy na zvieratách preukázali, že vigabatrín nemá žiadny negatívny vplyv na plodnosť alebo vývoj mláďat. Žiadna teratogenita nebola pozorovaná u potkanov pri dávkach do 150 mg/kg (3-násobok ľudskej dávky) ani u králikov pri dávkach do 100 mg/kg. Avšak u králikov bol pozorovaný mierny nárast výskytu rozštiepeného podnebia pri dávkach 150-200 mg/kg.
Štúdie s vigabatrínom neodhalili žiadne dôkazy o mutagénnych alebo karcinogénnych účinkoch.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
krospovidón (typ B) manitol stearylfumaran sodný
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
30 mesiacov
Použite ihneď po príprave perorálneho roztoku.
Po prvom otvorení: 100 dní
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Kigabeq 100 mg rozpustné tablety
HDPE fľaša uzatvorená odolným detským bezpečnostným uzáverom so závitom.
Veľkosť balenia: 100 rozpustných tabliet.
Kigabeq 500 mg rozpustné tablety
HDPE fľaša uzatvorená odolným detským bezpečnostným uzáverom so závitom.
Veľkosť balenia: 50 rozpustných tabliet.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
R
ozpustenie rozpustných tabliet
Naplňte pohár jedným alebo dvoma čajovými lyžičkami vody (približne 5 alebo 10 ml) podľa veku
dieťaťa. Do vody pridajte predpísaný počet tabliet alebo polovíc tabliet Kigabeq. Počkajte, kým sa
tablety úplne rozpadnú; tablety sa všeobecne rozpadávajú za menej ako jednu minútu, ale rozpad sa
môže urýchliť jemným miešaním perorálneho roztoku.
Výsledný roztok je belavý a zakalený. Je to normálne a kvôli prítomnosti vo vode nerozpustných pomocných látok.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIORPHELIA Pharma SAS
85 boulevard Saint-Michel
75005 Paríž
Francúzsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)Kigabeq 100 mg rozpustné tablety
EU/1/18/1302/001
Kigabeq 500 mg rozpustné tablety
EU/1/18/1302/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
P
ís
o
m
ná informácia pre používateľa
Ki
g
abeq 100 mg rozpustné tablety
Pre deti od 1 mesiaca do menej ako 7 rokov
Kigabeq 500 mg rozpustné tabletyPre deti od 1 mesiaca do menej ako 7 rokov
vigabatrín
Pozorne si prečítajte celú písomnú informáciu predtým, ako podáte tento liek svojmu dieťaťu,pretože obsahuje pre vás dôležité informácie.- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.'
- Tento liek bol predpísaný vášmu dieťaťu. Nedávajte ho nikomu inému. Môže mu uškodiť, dokonca aj vtedy, ak má rovnaké prejavy ochorenia ako vaše dieťa.
- Ak sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete:1. Čo je Kigabeq a na čo sa používa
2. Čo potrebujete vedieť predtým, ako vaše dieťa použijete Kigabeq
3. Ako podávať Kigabeq
4. Možné vedľajšie účinky
5. Ako uchovávať Kigabeq
6. Obsah balenia a ďalšie informácie
1. Čo je Kigabeq a na čo sa používaKigabeq obsahuje vigabatrín a používa sa na liečbu dojčiat a detí vo veku od 1 mesiaca do menej ako
7 rokov. Používa sa na liečbu detských kŕčov (Westov syndróm) alebo spolu s ďalšími liekmi na epilepsiu na liečbu čiastočnej epilepsie, ktorá nie je v súčasnej liečbe dostatočne kontrolovaná.
2. Čo potrebujete vedieť predtým, ako vaše dieťa použijete KigabeqNepodávajte Kigabeq:- ak je vaše dieťa alergické na vigabatrín alebo na ktorúkoľvek z ďalších zložiek tohto lieku
(uvedených v časti 6),
Upozornenia a opatreniaPredtým, ako podáte Kigabeq, obráťte sa na svojho detského lekára, ak vaše dieťa:
- má alebo malo v minulosti depresiu alebo iné psychické ochorenie
- malo problémy s obličkami, pretože by sa u neho mohli vyvinúť príznaky, akými sú sedácia alebo zmätenosť
- malo akékoľvek problémy s očami.

Pri liečbe vigabatrínom sa môže vyskytnúť strata zraku (strata zraku z okrajov zorného poľa vášho dieťaťa). Mali by ste túto možnosť prediskutovať s lekárom skôr, ako vaše dieťa začne liečbu a lekár vám povie, ako zistiť tento vedľajší účinok. Táto strata zorného poľa môže byť závažná a trvalá, preto musí byť zistená včas, aby sa zabránilo progresii. Po ukončení liečby môže zhoršovanie straty zorného

poľa pokračovať. Je dôležité, aby ste okamžite povedali svojmu lekárovi, keď nastane zmena zraku vášho dieťaťa. Lekár skontroluje zorné pole vášho dieťaťa skôr, ako vaše dieťa začne užívať vigabatrín a počas liečby pokračuje v pravidelných kontrolách.
Ak sa u vášho dieťa objavia príznaky, akými sú ospalosť, znížené vedomie a pohyby (stupor) alebo
zmätenosť, povedzte to vášmu detskému lekárovi, ktorý môže znížiť dávku alebo zastaviť liečbu
Kigabeqom.
U menšieho počtu ľudí, ktorí boli liečení liekmi na epilepsiu, akým je vigabatrín, sa vyskytli myšlienky na zraňovanie sa alebo samovraždu. Pozrite sa na príznaky naznačujúce takéto myšlienky: narušený spánok, strata chuti do jedla alebo úbytok telesnej hmotnosti, izolácia, strata záujmu o obľúbené aktivity.
Ak sa u vášho dieťaťa vyskytnú tieto príznaky, okamžite kontaktujte detského lekára.
Pohybové poruchy sa môžu vyskytnúť u malých detí liečených na detské kŕče (Westov syndróm). Ak spozorujete u vášho dieťaťa nezvyčajné pohyby, povedzte to svojmu detskému lekárovi, ktorý môže zmeniť liečbu.
Ak vášmu dieťaťu boli vykonané alebo budú vykonané laboratórne testy, povedzte to svojmu
detskému lekárovi, pretože tento liek môže spôsobiť abnormálne výsledky.
Ak sa stav vášho dieťaťa nezlepší v priebehu mesiaca po začatí užívania vigabatrínu, musíte sa porozprávať so svojím detským lekárom.
DetiNepodávajte tento liek deťom mladším ako jeden mesiac alebo starším ako 7 rokov.
Iné lieky a KigabeqAk vaše dieťa v súčasnosti užíva alebo v poslednom čase užívalo, či práve bude užívať ďalšie lieky,
povedzte to svojmu detskému lekárovi alebo lekárnikovi.
Kigabeq sa nemá používať v kombinácii s inými liekmi, ktoré môžu mať vedľajšie účinky súvisiace s očami.
Tehotenstvo a dojčenieTento liek nie je určený na použitie u žien v plodnom veku alebo u dojčiacich žien.
Vedenie vozidiel a obsluha strojovVaše dieťa nemá jazdiť na bicykli, šplhať sa, ani sa zúčastňovať na nebezpečných aktivitách, ak počas užívania Kigabequ má príznaky, akými sú ospalosť alebo závraty. Pri niektorých pacientoch, ktorí užívajú tento liek, sa vyskytli poruchy zraku, ktoré môžu ovplyvniť schopnosť jazdiť na bicykli, šplhania sa alebo účasti na nebezpečných aktivitách.
3. Ako podávať KigabeqVždy podávajte svojmu dieťaťu tento liek presne tak, ako vám povedal váš lekár. Ak si nie ste niečím
istí, overte si to u svojho lekára alebo lekárnika.
DávkaNikdy sami nemeňte dávku. Lekár pripraví dávku individuálne pre vaše dieťa, berúc do úvahy telesnú
hmotnosť dieťaťa.
Kigabeq je k dispozícii vo forme 100 mg alebo 500 mg tabliet, ktoré sa môžu podávať spoločne na vytvorenie správnej dávky pre vaše dieťa. Vždy skontrolujte štítok a veľkosť tabliet, aby ste sa uistili, že podávate správnu dávku.
Pri detských kŕčoch (Westov syndróm) je odporúčaná počiatočná dávka 50 miligramov na kilogram telesnej hmotnosti denne. Pri rezistentnej parciálnej epilepsii (ložiskové záchvaty) je odporúčaná počiatočná dávka 40 miligramov na kilogram denne. Počas liečby upraví lekár dávku podľa potreby. Ak má Vaše dieťa problémy s obličkami, lekár môže predpísať menšiu dávku.
V nasledujúcej tabuľke sa uvádza počet tabliet Kigabeq, ktoré sa majú podávať dieťaťu podľa dávky
predpísanej vašim detským lekárom.
Dávka
(
m
g za deň)
Po
čet tabliet (sila)
Ráno
Po
čet tabliet (sila)
Večer
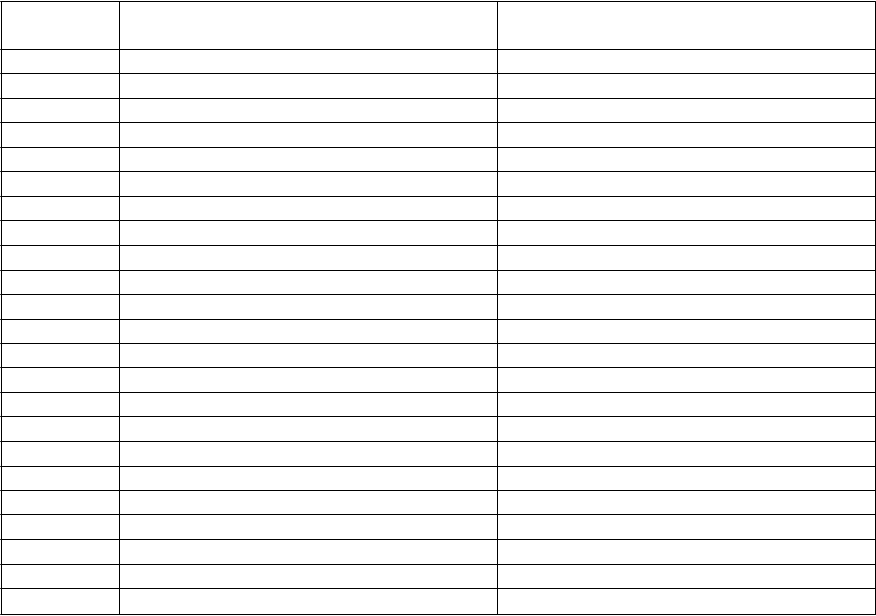
150 Pol tablety (100 mg) Jedna tableta (100 mg)
200 Jedna tableta (100 mg) Jedna tableta (100 mg)
250 Jedna tableta (100 mg) Jeden a pol tablety (100 mg)
300 Jeden a pol tablety (100 mg) Jeden a pol tablety (100 mg)
350 Jeden a pol tablety (100 mg) Dve tablety (100 mg)
400 Dve tablety (100 mg) Dve tablety (100 mg)
450 Dve tablety (100 mg) Dve a pol tablety (100 mg)
500 Pol tablety (500 mg) alebo dve a pol tablety (100 mg) Pol tablety (500 mg) alebo dve a pol tablety (100 mg)
550 Dve a pol tablety (100 mg) Tri tablety (100 mg)
600 Tri tablety (100 mg) Tri tablety (100 mg)
650 Tri tablety (100 mg) Tri a pol tablety (100 mg)
700 Tri a pol tablety (100 mg) Tri a pol tablety (100 mg)
750 Pol tablety (500 mg) Jedna tableta (500 mg)
800 Štyri tablety (100 mg) Štyri tablety (100 mg)
850 Štyri tablety (100 mg) Štyri a pol tablety (100 mg)
900 Štyri a pol tablety (100 mg) Štyri a pol tablety (100 mg)
950 Štyri a pol tablety (100 mg) Jedna tableta (500 mg)
1 000 Jedna tableta (500 mg) Jedna tableta (500 mg)
1 100 Jedna tableta (500 mg) Jedna tableta (500 mg) a jedna tableta (100 mg)
1 200 Jedna tableta (500 mg) a jedna tableta (100 mg) Jedna tableta (500 mg) a jedna tableta (100 mg)
1 300 Jedna tableta (500 mg) a jedna tableta (100 mg) Jedna tableta (500 mg) a dve tablety (100 mg)
1 400 Jedna tableta (500 mg) a dve tablety (100 mg) Jedna tableta (500 mg) a dve tablety (100 mg)
1 500 Jeden a pol tablety (500 mg) Jeden a pol tablety (500 mg)
AkopodávaťtentoliekOpýtajte sa svojho detského lekára, aby vám ukázal, ako tento liek podávať. Ak si nie ste niečím istí,
overte si to u svojho lekára alebo lekárnika.
Kigabeq je určený na perorálne podávanie a môže sa užívať pred jedlom alebo po jedle. Tableta sa môže rozdeliť na rovnaké polovice.
Na prípravu roztoku použite len vodu.
• Do pohára alebo pohárika nalejte jednu alebo dve čajové lyžičky (asi 5 až 10 ml) vody
• Do vody pridajte správnu dávku tabliet lieku Kigabeq (celé alebo polovice).
• Počkajte, až sa tableta úplne rozpadne. Trvá to menej ako minútu, ale môžete to zrýchliť jemným ručným miešaním zmesi
• Zmes bude belavá a zakalená. To je normálne a zakalená je preto, že tableta obsahuje niektoré
neúčinné zložky, ktoré sa úplne nerozpúšťajú
• Podajte zmes okamžite vášmu dieťaťu priamo z pohára alebo pohárika
• Ak vaše dieťa nemôže piť z pohára alebo pohárika, môžete použiť injekčnú striekačku na jemné vstreknutie zmesi do úst vášho dieťaťa, pričom dávajte pozor, aby ste ho neudusili: seďte priamo pred a pod ním, aby malo hlavu naklonenú dopredu a podávajte zmes proti jeho tvári
• Opláchnite pohár alebo pohárik jednou alebo dvoma čajovými lyžičkami (asi 5 až 10 ml) vody a
podajte to svojmu dieťaťu, aby ste sa ubezpečili, že dieťa dostane všetok liek
• Ak dieťa nemôže prehĺtať, zmes sa môže podať do žalúdka pomocou trubice a vhodnej striekačky.
Trubica sa má opláchnuť 10 ml vody.
Ak vaše dieťa užije príliš veľa lieku Kigabeq
Ak vaše dieťa náhodne užije príliš veľa tabliet Kigabeq, ihneď to oznámte lekárovi alebo choďte do najbližšej nemocnice alebo informačného strediska pre jedy. Možné príznaky predávkovania zahŕňajú ospalosť alebo zníženú úroveň vedomia.
Ak zabudnete podať svojmu dieťaťu Kigabeq
Ak zabudnete podať dávku Vášmu dieťaťu, podajte ju hneď, ako si na to spomeniete. Ak sa už blíži čas podania ďalšej dávky, podajte len jednu dávku. Nepodávajte dvojnásobnú dávku, aby ste nahradili vynechané tablety.
Ak prestanete vášmu dieťaťu podávať Kigabeq
Neprestávajte podávať tento liek bez toho, aby ste sa poradili so svojím detským lekárom. Ak sa lekár
rozhodne liečbu ukončiť, odporučí vám postupne znižovať dávku. Neprestávajte náhle, pretože to môže spôsobiť u dieťaťa záchvaty.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára alebo
lekárnika.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. Počas užívania lieku Kigabeq môžu mať niektorí pacienti viac záchvatov (kŕčov). Ak sa to stane, okamžite kontaktujte svojho detského lekára.
Závažné vedľajšie účinky
Okamžite vyhľadajte lekársku pomoc, ak má vaše dieťa tieto príznaky: Veľmi časté vedľajšie účinky (môžu postihovať viac ako 1 z 10 osôb):
- Zmeny zorného poľa - približne 33 zo 100 pacientov liečených vigabatrínom môže mať zmeny zorného poľa (zúžené zorné pole). Táto porucha zorného poľa sa môže pohybovať od miernej až po závažnú. Zvyčajne sa to zistí až po mesiacoch alebo rokoch liečby vigabatrínom. Zmeny
zorného poľa môžu byť trvalé, preto je dôležité ich skontrolovať včas, aby sa zabránilo
progresii. Ak má vaše dieťa poruchy videnia, okamžite kontaktujte svojho detského lekára alebo
nemocnicu.
Ďalšie vedľajšie účinky sú:
Veľmi časté vedľajšie účinky (môžu postihovať viac ako 1 z 10 osôb):
- excitácia alebo nepokoj
- únava a výrazná ospalosť
- bolesť kĺbov
Časté vedľajšie účinky (môžu postihnúť až 1 osobu z 10)
- bolesť hlavy.
- zvýšenie telesnej hmotnosti
- triaška (tremor)
- opuch (edém)
- závraty
- pocit necitlivosti alebo tŕpnutia (brnenie a mravčenie)
- znížená koncentrácia a pamäť
- psychické problémy vrátane nepokoja, agresie, nervozity, podráždenosti, depresie, poruchy myslenia a podozrievanie bez príčiny (paranoja). Tieto vedľajšie účinky sa zvyčajne zastavia, keď sa znížia dávky vigabatrínu alebo sa liek postupne vysadí. Dávku však nesmiete znižovať bez toho, aby ste sa najprv neporadili so svojím detským lekárom. Kontaktujte lekára, ak vaše dieťa má tieto psychologické účinky
- nevoľnosť (napínanie na vracanie), vracanie a bolesť brucha
- rozmazané videnie, dvojité videnie a nekontrolovaný pohyb oka, čo môže spôsobiť závrat
- porucha reči
- zníženie počtu červených krviniek (anémia)
Menej časté vedľajšie účinky (môžu postihovať menej ako 1 zo 100 osôb)
- nedostatočná koordinácia alebo tápanie
- závažnejšie psychologické problémy, akým je pocit vzrušenia alebo nadmerného vzrušenia,
ktoré spôsobuje nezvyčajné správanie a pocit oddelenia od reality
- kožná vyrážka
Zriedkavé vedľajšie účinky (môžu postihnúť až 1 osobu z 1 000)
- závažná alergická reakcia, ktorá spôsobuje opuch tváre alebo hrdla. Ak má vaše dieťa tieto
príznaky, okamžite to povedzte svojmu detskému lekárovi
- žihľavka alebo žihľavová vyrážka
- výrazná sedácia (ospalosť), stupor (meravosť) a zmätenosť (encefalopatia). Tieto vedľajšie účinky sa zvyčajne zastavia, keď sa znížia dávky alebo sa liek postupne vysadí. Dávku však
nesmiete znižovať bez toho, aby ste sa najprv neporadili so svojím detským lekárom.
Kontaktujte detského lekára, ak vaše dieťa má tieto psychologické účinky
- pokus o samovraždu
- iné problémy s očami, akou je porucha sietnice, spôsobujúca napríklad zlé videnie v noci a ťažkosti s nastavovaním z jasných do tmavých oblastí, náhla alebo nevysvetliteľná strata zraku,
citlivosť na svetlo
Veľmi časté vedľajšie účinky (môžu postihovať až 1 z 10 000 osôb):
- ďalšie problémy s očami, akým sú bolesť v očiach (optická neuritída) a strata zraku vrátane farebného videnia (optická atrofia)
- halucinácie (pocit, videnie alebo počúvanie vecí, ktoré neexistujú)
- problémy s pečeňou
neznáme (frekvenciu nemožno odhadnúť z dostupných údajov)
- pohybové poruchy a abnormality pri vyšetrení mozgu magnetickou rezonanciou (MRI) u
malých dojčiat liečených na detské kŕče
Hlásenie vedľajších účinkovAk sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej

informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené
v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti
tohto lieku.
5. Ako uchovávať KigabeqTento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na škatuli a fľaštičke. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci. Tento liek sa musí použiť do 100 dní po prvom otvorení fľaše.
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
Roztok sa má podávať okamžite po príprave.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo Kigabeq obsahuje- Liečivo je vigabatrín.
- Jedna rozpustná tableta lieku Kigabeq 100 mg obsahuje 100 mg vigabatrínu
- Jedna rozpustná tableta lieku Kigabeq 500 mg obsahuje 500 mg vigabatrínu
- Ďalšie zložky sú: krospovidón typu B, manitol, stearylfumaran sodný
Ako vyzerá liek Kigabeq a obsah baleniaKigabeq sú biele oválne rozpustné tablety.
Veľkosť 100 mg tabliet: 9,4 mm x 5,3 mm
Veľkosť 500 mg tabliet: 16,0 mm x 9,0 mm
Výsledný roztok je belavý a zakalený.
Veľkosti balenia:
Kigabeq 100 mg sa dodáva v baleniach so 100 rozpustnými tabletami. Kigabeq 500 mg sa dodáva v baleniach so 50 rozpustnými tabletami.
Držiteľ rozhodnutia o registráciiORPHELIA Pharma SAS
85 boulevard Saint-Michel
75005 Paríž
Francúzsko
VýrobcaFARMEA
10 rue Bouché-Thomas ZAC d'Orgemont
49000 Angers
Francúzsko
Táto písomná informácia bola naposledy aktualizovaná v {mesiac RRRR}.Ďalšie zdroje informáciíPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu