
cytopénie. Očkované osoby majú byť poučené, aby okamžite vyhľadali lekársku starostlivosť v prípade, že sa u nich po očkovaní vyvinú príznaky ako dýchavičnosť, bolesť na hrudi, opuch nohy alebo pretrvávajúca bolesť brucha. Navyše každý, u koho sa po očkovaní objavia neurologické
príznaky zahŕňajúce silné alebo pretrvávajúce bolesti hlavy alebo rozmazané videnie, alebo u koho sa po pár dňoch objaví kožná podliatina (petechie) mimo miesta podania očkovacej látky, má okamžite vyhľadať lekársku starostlivosť.
Trombóza v kombinácii s trombocytopéniou si vyžaduje odbornú klinickú liečbu. Zdravotnícki pracovníci sa majú riadiť príslušnými usmerneniami a/alebo sa majú poradiť s odborníkmi (napr. hematológmi, odborníkmi na hemokoaguláciu), aby diagnostikovali a liečili tento stav.
Riziko krvácania pri intramuskulárnom podaní
Tak ako pri iných intramuskulárnych injekciách, očkovacia látka sa má podávať opatrne osobám, ktoré dostávajú antikoagulačnú liečbu, alebo osobám s trombocytopéniou alebo akoukoľvek poruchou
koagulácie (ako je hemofília), pretože po intramuskulárnom podaní sa u týchto osôb môže vyskytnúť
krvácanie alebo tvorba modrín.
Imunokompromitované osoby
Účinnosť, bezpečnosť a imunogenita očkovacej látky sa nehodnotili u imunokompromitovaných osôb
vrátane osôb liečených imunosupresívami.
Účinnosť očkovacej látky COVID-19 Vaccine Janssen môže byť u osôb so zníženou imunitou nižšia.
Dĺžka trvaniaochrany
Dĺžka trvania ochrany, ktorú poskytuje očkovacia látka, nie je známa, pretože sa stále určuje
v prebiehajúcich klinických skúšaniach.
Obmedzenia účinnostiočkovacejlátky
Ochrana začína približne 14 dní po očkovaní. Tak ako pri všetkých očkovacích látkach, ani očkovanie
očkovacou látkou COVID-19 Vaccine Janssen nemusí chrániť všetkých, ktorí ju dostanú (pozri časť
5.1).
Pomocné látky
Sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v 0,5 ml dávke, t. j. v podstate zanedbateľné množstvo sodíka.
Etanol
Tento liek obsahuje 2 mg alkoholu (etanolu) v 0,5 ml dávke. Malé množstvo alkoholu v tomto lieku nemá žiadny pozorovateľný vplyv.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie. Súbežné podávanie očkovacej látky COVID-19 Vaccine
Janssen s inými očkovacími látkami sa neskúmalo.
4.6 Fertilita, gravidita a laktácia
Gravidita
Skúsenosti s použitím očkovacej látky COVID-19 Vaccine Janssen u gravidných žien sú obmedzené.
Štúdie na zvieratách s očkovacou látkou COVID-19 Vaccine Janssen nenaznačujú priame alebo nepriame škodlivé účinky na graviditu, embryonálny/fetálny vývin, pôrod alebo postnatálny vývin
(pozri časť 5.3).
Podanie očkovacej látky COVID-19 Vaccine Janssen v gravidite sa má zvážiť len v prípade, že potenciálny prínos preváži nad akýmikoľvek potenciálnymi rizikami pre matku a plod.
Dojčenie
Nie je známe, či sa očkovacia látka COVID-19 Vaccine Janssen vylučuje do ľudského mlieka.
Fertilita
Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej
toxicity (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Očkovacia látka COVID-19 Vaccine Janssen nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Niektoré z nežiaducich účinkov uvedených v časti 4.8 však môžu dočasne ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Bezpečnosť očkovacej látky COVID-19 Vaccine Janssen sa hodnotila v prebiehajúcej štúdii fázy 3
(COV3001). Očkovaciu látku COVID-19 Vaccine Janssen dostalo celkovo 21 895 dospelých vo veku
18 rokov a starších. Medián veku účastníkov štúdie bol 52 rokov (rozpätie 18 – 100 rokov). Analýza bezpečnosti sa uskutočnila po dosiahnutí mediánu trvania sledovania 2 mesiace po očkovaní. Dlhšie
sledovanie bezpečnosti trvajúce > 2 mesiace je k dispozícii u 11 948 dospelých, ktorí dostali
očkovaciu látku COVID-19 Vaccine Janssen.
V štúdii COV3001 bola ako najčastejšia lokálna nežiaduca reakcia hlásená bolesť v mieste podania injekcie (48,6 %). Najčastejšími systémovými nežiaducimi reakciami boli bolesť hlavy (38,9 %), únava (38,2 %), myalgia (33,2 %) a nauzea (14,2 %). Pyrexia (definovaná ako telesná teplota
≥ 38,0 °C) bola pozorovaná u 9 % účastníkov. Väčšina nežiaducich reakcií sa vyskytla do 1 – 2 dní po očkovaní a bola miernej až strednej závažnosti a trvala krátku dobu (1 – 2 dni).
Reaktogenita bola vo všeobecnosti miernejšia a menej často hlásená u starších dospelých
(763 dospelých vo veku ≥ 65 rokov).
Bezpečnostný profil bol vo všeobecnosti konzistentný medzi účastníkmi s dokázanou predchádzajúcou infekciou SARS-CoV-2 vo východiskovom stave alebo bez nej; očkovaciu látku COVID-19 Vaccine Janssen dostalo celkovo 2 151 dospelých, ktorí boli séropozitívni vo východiskovom stave (9,8 %).
Tabuľkový zoznamnežiaducichreakcií
Nežiaduce reakcie na liek pozorované počas štúdie COV3001 sú usporiadané podľa triedy orgánových
systémov databázy MedDRA. Kategórie frekvencie sú definované nasledovne:
veľmi časté (≥ 1/10);
časté (≥ 1/100 až < 1/10);
menej časté (≥ 1/1 000 až < 1/100);
zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000); neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
Tabuľka 1: Nežiaduce reakcie hlásené po očkovaní očkovacou látkou COVID-19
Vaccine Janssen
Trieda orgánových systémov
|
Veľmi časté
(
≥ 1/10)
|
Časté
(
≥ 1/100 až
< 1/10)
|
Menej časté
(
≥ 1/1 000 až
< 1/100)
|
Zriedkavé
(
≥ 1/10 000 až
< 1/1 000)
|
Veľmi zriedkavé
(
< 1/10 000)
|
Neznáme
(
z dostupných údajov)
|
Poruchy imunitného systému
|
|
|
|
Precitlivenosťa;
urtikária
|
|
Anafylaxiab
|
Poruchy nervového systému
|
Bolesť hlavy
|
|
Tremor
|
|
|
|
Poruchy ciev
|
|
|
|
|
Trombóza
v kombinácii
s trombocytopéniou*
|
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
|
Kašeľ
|
Kýchanie; orofaryngálna bolesť
|
|
|
|
Poruchy gastrointestinálneho traktu
|
Nauzea
|
|
|
|
|
|
Poruchy kože a podkožného tkaniva
|
|
|
Vyrážka;
hyperhidróza
|
|
|
|
Poruchy kostrovej a svalovej sústavy a spojivového
tkaniva
|
Myalgia
|
Artralgia
|
Svalová slabosť; bolesť končatín; bolesť chrbta
|
|
|
|
Celkové poruchy a reakcie v mieste podania
|
Únava;
bolesť
v mieste podania injekcie
|
Pyrexia; začervenanie v mieste
podania injekcie; opuch
v mieste podania injekcie; zimnica
|
Asténia;
malátnosť
|
|
|
|
a Precitlivenosť sa vzťahuje na alergické reakcie kože a podkožného tkaniva.
b Prípady získané z prebiehajúcej otvorenej štúdie v Južnej Afrike.
* Po uvedení očkovacej látky na trh boli hlásené závažné a veľmi zriedkavé prípady trombózy v kombinácii
s trombocytopéniou. Zahŕňali venóznu trombózu ako je trombóza cerebrálnych venóznych sínsov, trombóza splanchnických žíl rovnako ako aj arteriálnu trombózu (pozri časť 4.4).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v PríloheV; uveďte
číslo šarže, ak je k dispozícii.
4.9 PredávkovanieNeboli hlásené prípady predávkovania. V štúdiách fázy 1/2, v ktorých bola podaná vyššia dávka (až 2- násobná), bola očkovacia látka COVID-19 Vaccine Janssen dobre tolerovaná, avšak očkované osoby hlásili zvýšenie reaktogenity (zvýšená bolesť v mieste očkovania, únava, bolesť hlavy, myalgia,
nauzea a pyrexia).
V prípade predávkovania sa odporúča sledovanie vitálnych funkcií a možná symptomatická liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: očkovacie látky, iné vírusové očkovacie látky, ATC kód: J07BX03
Mechanizmus účinku
COVID-19 Vaccine Janssen je monovalentná očkovacia látka zložená z rekombinantného replikačne
nekompetentného vektora ľudského adenovírusu typu 26, ktorý kóduje spike (S) glykoproteín vírusu
SARS-CoV-2 v celej dĺžke v stabilizovanej konformácii. Po podaní sa prechodne exprimuje
S glykoproteín SARS-CoV-2, ktorý stimuluje neutralizačné aj ďalšie funkčné S-špecifické protilátky ako aj bunkové imunitné odpovede namierené proti S antigénu, čo môže prispievať k ochrane proti
COVID-19.
Klinická účinnosť
Prebiehajúca multicentrická, randomizovaná, dvojito zaslepená, placebom kontrolovaná štúdia fázy 3
(COV3001) sa vykonáva v Spojených štátoch amerických, Južnej Afrike a krajinách Latinskej Ameriky s cieľom posúdiť účinnosť, bezpečnosť a imunogenitu jednorazovej dávky očkovacej látky COVID-19 Vaccine Janssen na prevenciu ochorenia COVID-19 u dospelých vo veku 18 rokov a starších. Zo štúdie boli vylúčené osoby s abnormálnou funkciou imunitného systému, ktorá je dôsledkom klinického ochorenia, osoby, ktoré v priebehu 6 mesiacov podstúpili imunosupresívnu liečbu, ako aj tehotné ženy. Účastníci s liečenou stabilnou infekciou HIV neboli vylúčení. Registrované očkovacie látky, s výnimkou živých očkovacích látok, sa mohli podávať viac ako 14 dní pred alebo viac ako 14 dní po očkovaní v štúdii. Registrované živé oslabené očkovacie látky sa mohli podávať viac ako 28 dní pred alebo viac ako 28 dní po očkovaní v štúdii.
Celkovo bolo randomizovaných 44 325 osôb paralelne v pomere 1:1 a dostali buď intramuskulárnu injekciu očkovacej látky COVID-19 Vaccine Janssen alebo placebo. Celkovo 21 895 dospelým bola podaná očkovacia látka COVID-19 Vaccine Janssen a 21 888 dospelým bolo podané placebo. Účastníci boli sledovaní s mediánom 58 dní (rozpätie: 1 – 124 dní) po očkovaní.
Populácia na primárnu analýzu účinnosti pozostávajúca z 39 321 osôb zahŕňala 38 059 osôb séronegatívnych na SARS-CoV-2 na začiatku štúdie a 1 262 osôb s neznámym sérologickým stavom.
Demografické a východiskové charakteristiky boli u osôb, ktoré dostali očkovaciu látku COVID-19
Vaccine Janssen, a u tých, ktoré dostali placebo, podobné. V populácii na primárnu analýzu účinnosti bol medzi osobami, ktoré dostali očkovaciu látku COVID-19 Vaccine Janssen, medián veku 52,0 rokov (rozpätie: 18 až 100 rokov); 79,7 % (N = 15 646) osôb bolo vo veku 18 až 64 rokov [20,3 %
(N = 3 984) vo veku 65 rokov alebo starších a 3,8 % (N = 755) vo veku 75 rokov alebo starších];
44,3 % osôb boli ženy; 46,8 % pochádzalo zo Severnej Ameriky (Spojené štáty americké), 40,6 %
z Latinskej Ameriky a 12,6 % z južnej Afriky (Juhoafrická republika). Celkovo 7 830 (39,9 %) osôb malo vo východiskovom stave aspoň jednu už existujúcu komorbiditu spojenú so zvýšeným rizikom progresie do závažnej formy COVID-19 (medzi tieto komorbidity patrila: obezita definovaná ako BMI
≥ 30 kg/m2 (27,5 %), hypertenzia (10,3 %), diabetes mellitus 2. typu (7,2 %), stabilná/dobre kontrolovaná infekcia HIV (2,5 %), závažné srdcové ochorenia (2,4 %) a astma (1,3 %)). Ďalšie
komorbidity boli prítomné u ≤ 1 % osôb.
Prípady COVID-19 boli potvrdené centrálnym laboratóriom na základe pozitívneho výsledku pre vírusovú SARS-CoV-2 RNA s použitím testu polymerázovej reťazovej reakcie (polymerase chain reaction, PCR). Účinnosť očkovacej látky celkovo a podľa kľúčových vekových skupín je uvedená v tabuľke 2.
Tabuľka 2: Analýza účinnosti očkovacej látky proti ochoreniu COVID-19
b
u SARS-CoV-2
séronegatívnych dospelých – populácia na primárnu analýzu účinnosti
Podskupina
|
COVID-19 Vaccine
Janssen N = 19 630
|
Placebo
N = 19 691
|
% účinnosti očkovacej látky
(
95 % IS)
c
|
Prípady
COVID-19 (n)
|
Osoboroky
|
Prípady
COVID-
19 (n)
|
Osoboroky
|
14 dní po očkovaní
|
Všetci účastníci
a
|
116
|
3 116,57
|
348
|
3 096,12
|
66,9 (59,03; 73,40)
|
18 až 64 rokov
|
107
|
2 530,27
|
297
|
2 511,23
|
64,2 (55,26; 71,61)
|
65 rokov a starší
|
9
|
586,31
|
51
|
584,89
|
82,4 (63,90; 92,38)
|
75 rokov a starší
|
0
|
107,37
|
8
|
99,15
|
100 (45,90;
100,00)
|
28 dní po očkovaní
|
Všetci účastníci
a
|
66
|
3 102,00
|
193
|
3 070,65
|
66,1 (55,01; 74,80)
|
18 až 64 rokov
|
60
|
2 518,73
|
170
|
2 490,11
|
65,1 (52,91; 74,45)
|
65 rokov a starší
|
6
|
583,27
|
23
|
580,54
|
74,0 (34,40; 91,35)
|
75 rokov a starší
|
0
|
106,42
|
3
|
98,06
|
--
|
a Spoločný primárny cieľový ukazovateľ ako je definované v protokole.
b Symptomatické ochorenie COVID-19 vyžadujúce pozitívny výsledok RT-PCR a najmenej 1 respiračný prejav alebo príznak alebo 2 iné systémové prejavy alebo príznaky, ako je definované v protokole.
c Intervaly spoľahlivosti pre „všetkých účastníkov“ boli upravené tak, aby sa implementovala kontrola chýb typu I pre viacnásobné testovanie. Intervaly spoľahlivosti pre vekové skupiny sú prezentované bez úpravy.
Účinnosť očkovacej látky proti závažnému ochoreniu COVID-19 je uvedená v tabuľke 3 nižšie.
Tabuľka 3: Analýzy účinnosti očkovacej látky proti závažnému ochoreniu COVID-19
Podskupina
| COVID-19 Vaccine
Janssen
N = 19 630
|
Placebo
N = 19 691
|
% účinnosti očkovacej látky
(95 % IS)b
| Prípady
COVID-19 (n)
|
Osoboroky
| Prípady
COVID-19 (n)
|
Osoboroky
| 14 dní po očkovaní
| Závažnéa
|
14
|
3 125,05
|
60
|
3 122,03
| 76,7 (54,56; 89,09)
| 28 dní po očkovaní
| Závažnéa
|
5
|
3 106,15
|
34
|
3 082,58
| 85,4
(54,15; 96,90)
|
|
|
u SARS-CoV-2 séronegatívnych dospelých - populácia na primárnu analýzu účinnostia Konečné určenie závažných prípadov COVID-19 urobila nezávislá hodnotiaca komisia, ktorá tiež určila závažnosť ochorenia podľa definície v usmerneniach FDA.
b Intervaly spoľahlivosti boli upravené tak, aby sa implementovala kontrola chýb typu I pre viacnásobné testovanie.
Zo 14 oproti 60 závažným prípadom s nástupom najmenej 14 dní po očkovaní v skupine s očkovacou
látkou COVID-19 Vaccine Janssen oproti skupine s placebom boli 2 oproti 6 hospitalizovaní. Tri osoby zomreli (všetci zo skupiny s placebom). Väčšina zostávajúcich závažných prípadov spĺňala len
kritérium saturácie kyslíkom (SpO2) pre závažné ochorenie (≤ 93 % na vzduchu v miestnosti).
Pred odslepením uskutočnené dodatočné post-hoc analýzy pozitívnych prípadov pomocou testov založených na metóde PCR bez ohľadu na potvrdenie centrálnym laboratóriom vo všeobecnosti podporujú výsledky primárnej analýzy.
V čase od 14 dní po očkovaní boli hospitalizované 2 prípady molekulárne potvrdeného COVID-19 zo skupiny s očkovacou látkou COVID-19 Vaccine Janssen oproti 8 prípadom zo skupiny s placebom. Jeden prípad zo skupiny s placebom si vyžadoval prijatie na JIS a umelú pľúcnu ventiláciu. Toto zistenie bolo podporené post-hoc analýzou všetkých hospitalizácií súvisiacich s COVID-19 implementujúcich širšie vyhľadávanie na základe všetkých dostupných informácií z akéhokoľvek zdroja (2 oproti 29 prípadom v rozšírenom súbore údajov).
Analýzy podskupín primárneho cieľového ukazovateľa účinnosti preukázali podobné bodové odhady účinnosti pre účastníkov mužského a ženského pohlavia, ako aj pre účastníkov s komorbiditami a bez komorbidít, ktoré sú spojené s vysokým rizikom závažného ochorenia COVID-19.
Vykonali sa prieskumné podskupinové analýzy účinnosti očkovacej látky proti ochoreniu COVID-19 a závažnému ochoreniu COVID-19 pre Brazíliu, Južnú Afriku a Spojené štáty americké (pozri tabuľku 4). Do analýz podskupín boli zahrnuté všetky prípady COVID-19 akumulované do dátumu uzávierky analýzy údajov o primárnej účinnosti, vrátane prípadov potvrdených centrálnym laboratóriom a prípadov so zdokumentovaným pozitívnym SARS-CoV-2 PCR testom z miestneho laboratória, ktoré stále čakajú na potvrdenie centrálnym laboratóriom.

 Tabuľka 4: Súhrn účinnosti očkovacej látky proti ochoreniu COVID-19 a závažnému ochoreniu COVID-19 v krajinách s > 100 hlásenými prípadmiZávažnosť
Tabuľka 4: Súhrn účinnosti očkovacej látky proti ochoreniu COVID-19 a závažnému ochoreniu COVID-19 v krajinách s > 100 hlásenými prípadmiZávažnosť
Nástup

US najmenej
14 dníCOVID-19 bodový odhad (95 % IS)Závažné ochorenieCOVID-19bodový odhad (95 % IS)
po očkovaní 74,4 % (65,00; 81,57) 78,0 % (33,13; 94,58)
najmenej 28 dní
po očkovaní 72,0 % (58,19; 81,71) 85,9 % (-9,38; 99,69)
Brazília najmenej 14 dní
po očkovaní 66,2 % (51,01; 77,14) 81,9 % (17,01; 98,05)
najmenej 28 dní
po očkovaní 68,1 % (48,81; 80,74) 87,6 % (7,84; 99,72)
Južná
Afrika
najmenej 14 dní
po očkovaní 52,0 % (30,26; 67,44) 73,1 % (40,03; 89,36)
najmenej 28 dní
po očkovaní 64,0 % (41,19; 78,66) 81,7 % (46,18; 95,42)
Vzorky zo 71,7 % prípadov z primárnej analýzy potvrdených v centrálnom laboratóriu boli
sekvenované [Spojené štáty americké (73,5 %), Južná Afrika (66,9 %) a Brazília (69,3 %)]. Zo sekvenovaných vzoriek existuje nerovnováha v úplnosti súboru údajov medzi očkovacou látkou COVID-19 Vaccine Janssen a placebom. V Spojených štátoch amerických bolo 96,4 % kmeňov identifikovaných ako Wuhan-H1 variant D614G; v Južnej Afrike bolo 94,5 % kmeňov identifikovaných ako 20H/501Y.V2 variant (línia B.1.351); v Brazílii bolo 69,4 % kmeňov identifikovaných ako variant línie P.2 a 30,6 % kmeňov bolo identifikovaných ako Wuhan-H1 variant D614G.
Staršia populácia
Očkovacia látka COVID-19 Vaccine Janssen sa hodnotila u osôb vo veku 18 rokov a starších.
Účinnosť očkovacej látky COVID-19 Vaccine Janssen bola medzi staršími (≥ 65 rokov) a mladšími osobami (18 – 64 rokov) konzistentná.
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s očkovacou látkou
COVID-19 Vaccine Janssen v jednej alebo vo viacerých podskupinách pediatrickej populácie pri prevencii ochorenia COVID-19 (informácie o použití v pediatrickej populácii, pozri časť 4.2).
Registrácia spodmienkou
Tento liek bol registrovaný s tzv. podmienkou. To znamená, že sa očakávajú ďalšie údaje o tomto
lieku. Európska agentúra pre lieky najmenej raz ročne posúdi nové informácie o tomto lieku a tento súhrn charakteristických vlastností lieku bude podľa potreby aktualizovať.
5.2 Farmakokinetické vlastnosti
Neaplikovateľné.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe konvenčných štúdií toxicity po opakovanom podávaní a lokálnej tolerancie a reprodukčnej a vývinovej toxicity nepreukázali žiadne osobitné riziko pre ľudí.
Genotoxicita akarcinogenita
Očkovacia látka COVID-19 Vaccine Janssen nebola hodnotená z hľadiska jej genotoxického alebo
karcinogénneho potenciálu. Nepredpokladá sa, že zložky očkovacej látky budú mať genotoxický alebo karcinogénny potenciál.
Reprodukčná toxicita a fertilita
Reprodukčná toxicita a fertilita u samíc sa hodnotila v kombinovanej štúdii embryofetálneho
a prenatálneho a postnatálneho vývinu u králikov. V tejto štúdii sa prvé očkovanie očkovacou látkou COVID-19 Vaccine Janssen podávalo intramuskulárne samiciam králikov 7 dní pred párením v dávke zodpovedajúcej 2-násobku odporúčanej dávky u ľudí, po ktorej nasledovali dve očkovania v rovnakej dávke počas gestačného obdobia (t. j. v 6. a 20. gestačnom dni). Nezistili sa žiadne účinky súvisiace
s očkovacou látkou na fertilitu samíc, graviditu alebo embryofetálny vývin či vývin potomstva. Matky-samice, ako aj ich plody a potomkovia, vykazovali titre protilátok špecifických pre S proteín
SARS-CoV-2, čo naznačuje, že materské protilátky boli počas gestácie prenesené na plody. Nie sú
k dispozícii žiadne údaje o vylučovaní očkovacej látky COVID-19 Vaccine Janssen do mlieka.
Okrem toho konvenčná štúdia toxicity (po opakovanom podávaní) u králikov s očkovacou látkou COVID-19 Vaccine Janssen neodhalila žiadne účinky na pohlavné orgány samcov, ktoré by zhoršili plodnosť samcov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
balenie s10injekčnýmiliekovkami
2-hydroxypropyl-β-cyklodextrín (HBCD)
monohydrát kyseliny citrónovej etanol
kyselina chlorovodíková
polysorbát-80 chlorid sodný hydroxid sodný
dihydrát citrónanu trisodného voda na injekcie
balenie s20injekčnýmiliekovkami
2-hydroxypropyl-β-cyklodextrín (HBCD)
monohydrát kyseliny citrónovej etanol
kyselina chlorovodíková polysorbát-80
chlorid sodný hydroxid sodný voda na injekcie
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi ani riediť.
6.3 Čas použiteľnosti
Neotvorená injekčnáliekovka'
2 roky, ak sa uchováva pri teplote -25 °C až -15 °C.
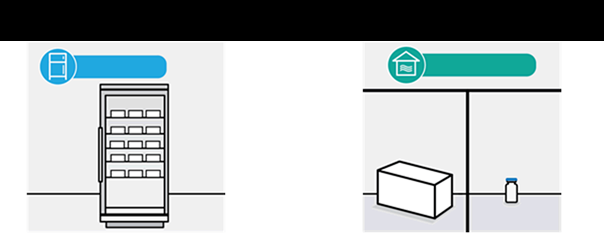
Po vybratí z mrazničky sa neotvorená očkovacia látka môže uchovávať v chlade pri teplote 2 °C až
8 °C, chránená pred svetlom, počas jedného maximálne 3-mesačného obdobia, ktoré nesmie prekročiť vytlačený dátum exspirácie (EXP).
Po rozmrazení sa očkovacia látka nemá znovu zmraziť. Špeciálne upozornenia na uchovávanie, pozri časť 6.4.
Otvorená injekčnáliekovka(poprvomprepichnutíinjekčnejliekovky)
Chemická a fyzikálna stabilita očkovacej látky pri používaní sa preukázala počas 6 hodín pri teplote
2 °C až 25 °C. Z mikrobiologického hľadiska sa má očkovacia látka použiť okamžite po prvom prepichnutí injekčnej liekovky, liek sa však môže uchovávať pri teplote 2 °C – 8 °C maximálne
6 hodín alebo môže zostať pri izbovej teplote (maximálne 25 °C) najviac 3 hodiny po prvom prepichnutí injekčnej liekovky. Nad rámec týchto časov je za uchovávanie počas používania zodpovedný používateľ.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v mraze pri teplote -25 °C až -15 °C. Dátum exspirácie pre uchovávanie pri teplote -25 °C až -15 °C je vytlačený na injekčnej liekovke a vonkajšej škatuli po „EXP“.
Ak sa očkovacia látka uchováva v mraze pri teplote -25 °C až -15 °C, možno ju rozmraziť buď pri teplote 2 °C až 8 °C, alebo pri izbovej teplote:
· pri teplote 2 °C až 8 °C: rozmrazenie škatule s 10 alebo 20 injekčnými liekovkami trvá približne
13 hodín a rozmrazenie jednotlivej injekčnej liekovky trvá približne 2 hodiny.
· pri izbovej teplote (maximálne 25 °C): rozmrazenie škatule s 10 alebo 20 injekčnými liekovkami trvá približne 4 hodiny a rozmrazenie jednotlivej injekčnej liekovky trvá približne
1 hodinu.
Očkovacia látka sa môže uchovávať aj v chladničke pri teplote 2 °C až 8 °C počas jedného maximálne
3-mesačného obdobia, ktoré nesmie prekročiť pôvodný dátum exspirácie (EXP). Po premiestnení lieku
na miesto s teplotou 2 °C až 8 °C sa musí na vonkajšiu škatuľu napísať aktualizovaný dátum exspirácie a očkovacia látka sa má použiť alebo zlikvidovať do aktualizovaného dátumu exspirácie. Pôvodný dátum exspirácie sa má stať nečitateľným. Očkovacia látka sa môže prepravovať aj pri teplote 2 °C – 8 °C, pokiaľ sa použijú vhodné podmienky na uchovávanie (teplota, čas).
Po rozmrazení sa očkovacia látka nesmie znovu zmraziť.
Injekčné liekovky uchovávajte v pôvodnej škatuli na ochranu pred svetlom.
Neotvorená očkovacia látka COVID-19 Vaccine Janssen je stabilná celkovo 12 hodín pri teplote 9 °C až 25 °C. Nie sú to odporúčané podmienky na uchovávanie a prepravu, môže to však slúžiť ako pomôcka pri rozhodovaní o použití v prípade dočasných teplotných odchýlok počas 3 mesiacov uchovávania pri teplote 2 °C – 8 °C.
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia2,5 ml suspenzie vo viacdávkovej injekčnej liekovke (sklo typu I) s gumovou zátkou (chlórbutylová
s povrchom potiahnutým fluórpolymérom), hliníkovým lemom a modrým plastovým uzáverom. Jedna injekčná liekovka obsahuje 5 dávok po 0,5 ml.
Veľkosti balenia: 10 alebo 20 viacdávkových injekčných liekoviek. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomPokyny nazaobchádzanieapodávanieS touto očkovacou látkou má zaobchádzať zdravotnícky pracovník aseptickým postupom, aby sa
zabezpečila sterilita každej dávky.
· Po rozmrazení je očkovacia látka pripravená na použitie.
· Očkovacia látka sa môže dodávať zmrazená pri teplote -25 °C až -15 °C alebo rozmrazená pri teplote 2 °C až 8 °C.
· Po rozmrazení očkovaciu látku znovu nezmrazujte.
· Injekčné liekovky uchovávajte v pôvodnej škatuli na ochranu pred svetlom a aby bolo možné vyznačiť dátum exspirácie pre odlišné podmienky uchovávania, ak je to relevantné.
 a. Uchovávanie po prevzatí očkovacej látkyAK DOSTANETE OČKOVACIU LÁTKU ZMRAZENÚ PRI TEPLOTE -25 °C až -15 °C, môžete ju:
a. Uchovávanie po prevzatí očkovacej látkyAK DOSTANETE OČKOVACIU LÁTKU ZMRAZENÚ PRI TEPLOTE -25 °C až -15 °C, môžete ju:-25 °C až -15 °C
|
ALEBO
|
2 °C až 8 °C
|
Uchovávať v mrazničke
|
|
Uchovávať v chladničke
|
· Očkovacia látka sa môže uchovávať
a prepravovať v mraze pri teplote -25 °C až -
15 °C.
· Dátum exspirácie pre uchovávanie je vytlačený na injekčnej liekovke a na vonkajšej škatuli po „EXP“ (pozri časť 6.4).
· Očkovacia látka sa môže uchovávať
a prepravovať aj pri teplote 2 °C až 8 °C
počas jedného maximálne 3-mesačného obdobia, ktoré nesmie prekročiť pôvodný dátum exspirácie (EXP).
· Po premiestnení lieku do chladničky
s teplotou 2 °C až 8 °C sa musí na vonkajšiu škatuľu napísať aktualizovaný dátum
exspirácie a očkovacia látka sa má použiť
alebo zlikvidovať do aktualizovaného dátumu exspirácie. Pôvodný dátum
exspirácie sa má stať nečitateľným (pozri
časť 6.4).
AK DOSTANETE OČKOVACIU LÁTKU ROZMRAZENÚ PRI TEPLOTE 2 °C až 8 °C,
uchovávajte ju v chladničke:
2 °C až 8 °C
Nezmrazujte znova tento liek, ak ste ho dostali už rozmrazený pri teplote 2 °C až 8 °C.
Poznámka: Ak sa dodaná očkovacia látka uchovávala v chladničke pri teplote 2 °C až 8 °C, pri
prevzatí skontrolujte, či miestny dodávateľ aktualizoval dátum exspirácie. Ak nedokážete nájsť nový dátum exspirácie, obráťte sa na miestneho dodávateľa pre potvrdenie dátumu exspirácie pre
uchovávanie v chladničke. Pred uložením očkovacej látky do chladničky napíšte
nový dátumexspirácie na vonkajšiu škatuľku.
Pôvodný dátum exspirácie sa má stať nečitateľný (pozri časť
6.4).
b. Ak je injekčná liekovka uchovávaná (sú injekčné liekovky uchovávané) v mraze, predpodaním ju (ich) rozmrazte buď v chladničke, alebo pri izbovej teplote
2 °C až 8 °C
M
a
xi
m
álne 25 °C
Roz
m
razujte
1
3 hodín
ALEBO
Roz
m
razujte
4 hodiny
Roz
m
razujte
1 hodinu
 Rozmrazte v chladničke
Rozmrazte v chladničke
· Ak sa očkovacia látka uchováva v mraze pri teplote -25 °C až -15 °C, škatuľa s 10 alebo
Rozmrazte pri izbovej teplote· Ak sa očkovacia látka uchováva v mraze pri teplote
-25 °C až -15 °C, škatuľa s 10 alebo
20 injekčnými liekovkami sa rozmrazí približne za 13 hodín alebo jednotlivé injekčné liekovky sa rozmrazia približne za 2 hodiny
pri teplote 2 °C až 8 °C.
· Ak sa očkovacia látka nepoužije okamžite, pozrite si pokyny v časti „Uchovávať
v chladničke“.
· Injekčná liekovka sa musí uchovávať
v pôvodnej škatuli na ochranu pred svetlom a aby bolo možné vyznačiť dátum exspirácie
pre odlišné podmienky uchovávania, ak je to relevantné.

Po rozmrazení opakovane nezmrazujte.
20 injekčnými liekovkami alebo jednotlivé injekčné liekovky sa majú rozmraziť pri izbovej teplote maximálne
25 °C.
· Škatuľa s 10 alebo 20 injekčnými liekovkami sa rozmrazí približne za
4 hodiny.
· Jednotlivé injekčné liekovky sa rozmrazia približne za
1 hodinu.
· Očkovacia látka je stabilná celkovo
12 hodín pri teplote 9 °C až 25 °C. Nie sú to odporúčané podmienky na uchovávanie a prepravu, môže to však slúžiť ako pomôcka pri rozhodovaní o použití v prípade dočasných teplotných odchýlok.
· Ak sa očkovacia látka nepoužije okamžite, pozrite si pokyny v časti „Uchovávať
v chladničke“.

Po rozmrazení opakovane
nezmrazujte.
c. Skontrolujte injekčnú liekovku a očkovaciu látku
· Očkovacia látka COVID-19 Vaccine Janssen je bezfarebná až svetložltá, číra až veľmi opalizujúca suspenzia (pH 6 – 6,4).
· Pred podaním sa má očkovacia látka vizuálne skontrolovať, či neobsahuje pevné častice a či nedošlo k zmene farby.
· Pred podaním sa má injekčná liekovka vizuálne skontrolovať, či neobsahuje praskliny alebo akékoľvek abnormality, napríklad dôkazy o manipulácii pred podaním.
Ak sa čokoľvek z toho vyskytne, očkovaciu látku nepodávajte.
d. Pripravte a podajte očkovaciu látku
10
SEK.
 Injekčnou liekovkou jemne
krúžte
Injekčnou liekovkou jemne
krúžte
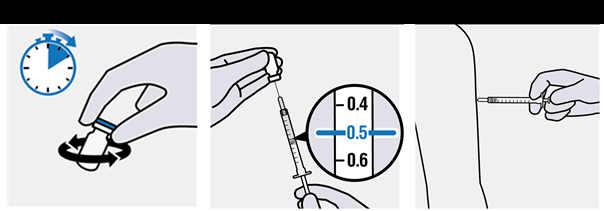
· Pred podaním dávky očkovacej látky injekčnou liekovkou jemne krúžte
vo zvislej polohe počas 10 sekúnd.
·
Netraste.
Odoberte 0,5 ml· Pomocou sterilnej ihly a sterilnej injekčnej striekačky odoberte z viacdávkovej injekčnej liekovky jednu dávku
0,5 ml (pozri časť
4.2).
 Z viacdávkovej injekčnejliekovky sa môže odobrať maximálne 5 dávok
Z viacdávkovej injekčnejliekovky sa môže odobrať maximálne 5 dávok. Po
extrahovaní 5 dávok zlikvidujte všetku zostávajúcu očkovaciu
látku v injekčnej liekovke.
Podajte injekčne 0,5 ml· Podávajte
výlučne intramuskulárnou injekciou do deltového svalu ramena (pozri časť
4.2).
e. Uchovávanie po prvom prepichnutí
2 °C až 8 °C
M
a
xi
m
álne 25 °C
 Uchovávajt
e maximálne
6 hodín
Uchovávajt
e maximálne
Uchovávajt
e maximálne
6 hodín
Uchovávajt
e maximálne
ALEBO
3 hodiny
Z
a
znamenajte dátum a čas,
keď sa má injekčná liekovka zlikvidovať
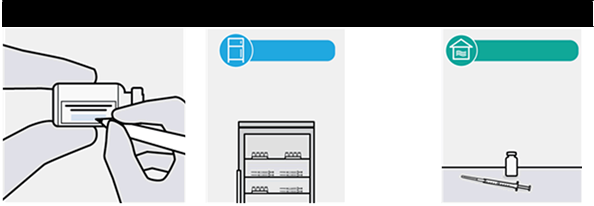
· Po prvom prepichnutí injekčnej liekovky zaznamenajte na každý štítok injekčnej liekovky dátum a čas, keď sa má injekčná liekovka zlikvidovať.
Najlepšie je použiť ihneď po prvom prepichnutí.
· Po prvom prepichnutí
injekčnej liekovky sa očkovacia látka môže uchovávať pri teplote
2 °C až 8 °Cmaximálne 6 hodín.
· Ak sa očkovacia látka v tomto čase nepoužije, zlikvidujte ju.
· Po prvom prepichnutí
injekčnej liekovky sa očkovacia látka môže uchovávať pri
izbovejteplote (maximálne25 °C) jednorazovo
najviac 3 hodiny. (pozri časť 6.3).
· Ak sa očkovacia látka
v tomto čase nepoužije, zlikvidujte ju.
 f
. Likvidácia
f
. Likvidácia
Všetka nepoužitá očkovacia látka alebo odpad vzniknutý z očkovacej látky sa má zlikvidovať v
súlade s národnými usmerneniami pre farmaceutický odpad. Prípadné rozliatie je potrebné dezinfikovať prostriedkami s viricídnym účinkom proti adenovírusu.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIJanssen-Cilag International NV Turnhoutseweg 30
B-2340 Beerse
Belgicko
8. REGISTRAČNÉ ČÍSLOEU/1/20/1525/001
EU/1/20/1525/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 11. marec 2021
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.