
mg dvakrát denne.
Liečba sa musí prerušiť, ak srdcová frekvencia je stále pod 50 úderov/min alebo príznaky bradykardie
pretrvávajú (pozri časť 4.4).
Osobitnéskupinypacientov
Staršie osoby
U pacientov vo veku 75 rokov a starších sa má zvážiť nižšia začiatočná dávka (2,5 mg dvakrát denne, t.j. jedna polovica 5 mg tablety dvakrát denne) pred titráciou dávky nahor, ak je to nevyhnutné.
Porucha funkcie obličiek
U pacientov s renálnou insuficienciou a s klírensom kreatinínu nad 15 ml/min nie je potrebná žiadna úprava dávky (pozri časť 5.2). O pacientoch s klírensom kreatinínu pod 15 ml/min nie sú k dispozícii
žiadne údaje. Ivabradín sa má preto používať v tejto populácii s opatrnosťou.
Porucha funkcie pečene
U pacientov s miernou poruchou funkcie pečene nie je potrebná žiadna úprava dávky. Pri použití ivabradínu u pacientov so stredne ťažkou poruchou funkcie pečene sa má postupovať opatrne. Použitie ivabradínu je kontraindikované u pacientov s ťažkou hepatálnou insuficienciou, keďže v tejto populácii nebol skúmaný a predpokladá sa značné zvýšenie systémovej expozície (pozri časti 4.3 a 5.2).
Pediatrická populácia
Bezpečnosť a účinnosť ivabradínu pre liečbu chronického srdcového zlyhania u detí vo veku do 18 rokov neboli stanovené.
V súčasnosti dostupné údaje sú opísané v častiach 5.1 a 5.2, ale neumožňujú uviesť odporúčania na dávkovanie.
Spôsobpodávania
Tablety sa musia užívať perorálne dvakrát denne, t.j. jedna tableta ráno a jedna tableta večer, počas jedla
(pozri časť 5.2).
4.3 Kontraindikácie
‒ Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
‒ Pokojová srdcová frekvencia pred liečbou menej ako 70 úderov/min.
‒ Kardiogénny šok.
‒ Akútny infarkt myokardu.
‒ Ťažká hypotenzia (< 90/50 mmHg).
‒ Ťažká hepatálna insuficiencia.
‒ Syndróm chorého sínusu.
‒ Sinoatriálna blokáda.
‒ Nestabilné alebo akútne srdcové zlyhanie.
‒ Závislosť od kardiostimulátora (srdcová frekvencia navodená výlučne kardiostimulátorom).
‒ Nestabilná angina pectoris.
‒ AV blokáda III. stupňa.
‒ Kombinácia so silnými inhibítormi cytochrómu P450 3A4, ako sú azolové antimykotiká (ketokonazol, itrakonazol), makrolidové antibiotiká (klaritromycín, erytromycín per os, josamycín, telitromycín), inhibítory HIV proteáz (nelfinavir, ritonavir) a nefazodon (pozri časti 4.5 a 5.2).
‒ Kombinácia s verapamilom alebo diltiazemom, ktoré sú stredne silné CYP3A4 inhibítory s vlastnosťami znižujúcimi srdcovú frekvenciu (pozri časť 4.5).
‒ Gravidita, laktácia a ženy v reprodukčnom veku, ktoré nepoužívajú účinnú antikoncepciu (pozri časť
4.6).
4.4 Osobitné upozornenia a opatrenia pri používaní
O
sobitné
upozornenia
N
edostatočný prínos v klinických výsledkoch u pacientov so symptomatickou chronickou stabilnou anginou pectoris
Ivabradín je indikovaný iba na symptomatickú liečbu chronickej stabilnej anginy pectoris, pretože ivabradín nemá prínos pri kardiovaskulárnych výsledkoch (napr. infarkt myokardu alebo kardiovaskulárna
smrť) (pozri časť 5.1).
Meranie srdcovej frekvencie
Vzhľadom na to, že srdcová frekvencia môže v priebehu času značne kolísať, majú sa zvážiť opakované merania srdcovej frekvencie, EKG alebo 24-hodinové ambulantné monitorovanie, pri stanovení pokojovej srdcovej frekvencie pred začatím liečby ivabradínom a u pacientov liečených ivabradínom, u ktorých sa zvažuje titrácia. To sa týka aj pacientov s nízkou srdcovou frekvenciou, najmä ak sa srdcová frekvencia znižuje pod 50 úderov/min, alebo po znížení dávky (pozri časť 4.2).
Srdcové arytmie
Ivabradín nie je účinný v liečbe alebo prevencii srdcových arytmií a pravdepodobne stráca svoju účinnosť, keď vznikne tachyarytmia (napr. komorová alebo supraventrikulárna tachykardia). Ivabradín sa preto neodporúča u pacientov s predsieňovou fibriláciou alebo inými srdcovými arytmiami, ktoré interferujú s funkciou sínusového uzla.
U pacientov liečených ivabradínom je zvýšené riziko vzniku predsieňovej fibrilácie (pozri časť 4.8). Predsieňová fibrilácia je častejšia u pacientov súbežne užívajúcich amiodarón alebo silné antiarytmiká
triedy I. Odporúča sa pravidelne klinicky monitorovať pacientov liečených ivabradínom pre výskyt
predsieňovej fibrilácie (trvalej alebo paroxyzmálnej), vrátane monitorovania EKG, ak je to klinicky indikované (napr. v prípade zhoršujúcej sa anginy pectoris, palpitácií, nepravidelného pulzu).
Pacienti majú byť informovaní o prejavoch a príznakoch predsieňovej fibrilácie a majú byť poučení, aby
kontaktovali lekára, ak sa tieto vyskytnú.
Ak sa predsieňová fibrilácia rozvinie počas liečby, má sa starostlivo prehodnotiť pomer prínosov a rizík pokračovania liečby ivabradínom.
Pacienti s chronickým srdcovým zlyhaním s poruchami intraventrikulárneho vedenia (blokáda ľavého ramienka, blokáda pravého ramienka) a ventrikulárnou dyssynchróniou sa majú dôkladne sledovať.
Použitie u pacientov s AV blokádou II. stupňa
Ivabradín sa u pacientov s AV blokádou II. stupňa neodporúča.
Použitie u pacientov s nízkou srdcovou frekvenciou
Liečba ivabradínom sa nesmie iniciovať u pacientov s pokojovou srdcovou frekvenciou pred liečbou pod
70 úderov/min (pozri časť 4.3).
Ak sa počas liečby pokojová srdcová frekvencia stále znižuje pod 50 úderov/min, alebo pacient má príznaky spojené s bradykardiou ako závraty, únava alebo hypotenzia, dávka sa musí titrovať nadol, alebo sa liečba musí prerušiť, ak pretrváva srdcová frekvencia pod 50 úderov/min alebo príznaky bradykardie (pozri časť 4.2).
Kombinácia s blokátormi vápnikových kanálov
Súbežné užívanie ivabradínu s blokátormi vápnikových kanálov znižujúcimi srdcovú frekvenciu, ako sú verapamil alebo diltiazem, je kontraindikované (pozri časti 4.3 a 4.5). Pri kombinácii ivabradínu s nitrátmi
a dihydropyridínovými blokátormi vápnikových kanálov, ako je amlodipín, sa nezistili problémy týkajúce
sa bezpečnosti. Aditívna účinnosť ivabradínu v kombinácii s dihydropyridínovými blokátormi
vápnikových kanálov nebola stanovená (pozri časť 5.1).
Chronické srdcové zlyhanie
Pred zvažovaním liečby ivabradínom musí byť srdcové zlyhanie stabilné. Ivabradín sa má používať s opatrnosťou u pacientov so srdcovým zlyhaním triedy IV podľa funkčnej klasifikácie NYHA vzhľadom na obmedzené množstvo údajov u tejto populácie.
Cievna mozgová príhoda
Použitie ivabradínu sa neodporúča ihneď po cievnej mozgovej príhode, pretože nie sú k dispozícii údaje pre takéto situácie.
Zrakové funkcie
Ivabradín ovplyvňuje funkciu sietnice. Nie sú žiadne dôkazy o toxickom účinku dlhodobej liečby ivabradínom na sietnicu (pozri časť 5.1). Ak sa vyskytne akékoľvek neočakávané zhoršenie zrakových
funkcií, má sa zvážiť prerušenie liečby. U pacientov s pigmentovou retinitídou sa má postupovať opatrne.
Opatreniapripoužívaní
Pacienti s hypotenziou
U pacientov s miernou až stredne ťažkou hypotenziou je dostupné obmedzené množstvo údajov, a preto sa má u týchto pacientov ivabradín používať s opatrnosťou. Ivabradín je kontraindikovaný u pacientov s ťažkou hypotenziou (krvný tlak < 90/50 mmHg) (pozri časť 4.3).
Fibrilácia predsiení – srdcové arytmie
Nie sú žiadne dôkazy o riziku (nadmernej) bradykardie pri návrate k sínusovému rytmu, keď sa iniciuje farmakologická kardioverzia u pacientov liečených ivabradínom. Keďže nie je k dispozícii dostatočné množstvo údajov, neurgentná DC-kardioverzia by sa mala zvážiť 24 hodín po poslednej dávke ivabradínu.
Použitie u pacientov s vrodeným syndrómom QT alebo liečených liekmi predlžujúcimi interval QT
Je potrebné vyhnúť sa použitiu ivabradínu u pacientov s vrodeným syndrómom QT alebo liečených liekmi predlžujúcimi interval QT (pozri časť 4.5). Ak je táto kombinácia nutná, je potrebné dôsledné kardiálne monitorovanie.
Zníženie srdcovej frekvencie, ktoré je spôsobené ivabradínom, môže vyvolať predĺženie intervalu QT, čo môže viesť k vzniku závažných arytmií, najmä Torsade de pointes.
Pacienti s hypertenziou vyžadujúci úpravu liečby krvného tlaku
V štúdii SHIFT viac pacientov zaznamenalo epizódy zvýšeného krvného tlaku počas liečby ivabradínom (7,1 %) v porovnaní s pacientmi, ktorí dostávali placebo (6,1 %). Tieto epizódy sa vyskytli najčastejšie krátko po zmene liečby krvného tlaku, boli prechodné a nemali vplyv na liečebný účinok ivabradínu. Ak dochádza k zmene liečby u pacientov s chronickým srdcovým zlyhaním, ktorí sú liečení ivabradínom, krvný tlak sa má sledovať vo vhodných intervaloch (pozri časť 4.8).
4.5 Liekové a iné interakcie
Farmakodynamickéinterakcie
Súbežné použitie sa neodporúča
S liekmi predlžujúcimi interval QT
‒ Kardiovaskulárne lieky predlžujúce interval QT (napr. chinidín, dizopyramid, bepridil, sotalol,
ibutilid, amiodarón).
‒ Nekardiovaskulárne lieky predlžujúce interval QT (napr. pimozid, ziprasidón, sertindol, meflochín, halofantrín, pentamidín, cisaprid, intravenózny erytromycín).
Súbežnému použitiu kardiovaskulárnych a nekardiovaskulárnych liekov predlžujúcich interval QT s
ivabradínom sa má vyhnúť, pretože predĺženie intervalu QT môže byť exacerbované znížením srdcovej frekvencie. Ak je táto kombinácia nevyhnutná, je potrebné dôsledné kardiálne monitorovanie (pozri časť
4.4).
Súbežné použitie so zvýšenou opatrnosťou
Diuretiká šetriace draslík (tiazidové diuretiká a slučkové diuretiká)
Hypokaliémia môže zvýšiť riziko vzniku arytmie. Keďže ivabradín môže spôsobiť bradykardiu, následná kombinácia hypokaliémie a bradykardie je predisponujúcim faktorom pre vznik závažných arytmií, najmä
u pacientov so syndrómom dlhého intervalu QT, či už vrodeným alebo vyvolaným liečivom.
Farmakokinetickéinterakcie
Cytochróm P450 3A4 (CYP3A4)
Ivabradín je metabolizovaný výhradne cez CYP3A4 a je veľmi slabým inhibítorom tohto cytochrómu. Ukázalo sa, že ivabradín neovplyvňuje metabolizmus a plazmatické koncentrácie iných substrátov CYP3A4 (mierne, stredne silné a silné inhibítory). CYP3A4 inhibítory a induktory sú náchylné vzájomne pôsobiť s ivabradínom a ovplyvňovať jeho metabolizmus a farmakokinetiku do klinicky významnej miery. Štúdie liekových interakcií preukázali, že inhibítory CYP3A4 zvyšujú plazmatické koncentrácie ivabradínu, zatiaľ čo induktory ich znižujú. Zvýšené plazmatické koncentrácie ivabradínu môžu byť spojené s rizikom nadmernej bradykardie (pozri časť 4.4).
Kontraindikácie súbežného použitia
Súbežné použitie silných inhibítorov CYP3A4, ako sú azolové antimykotiká (ketokonazol, itrakonazol), makrolidové antibiotiká (klaritromycín, erytromycín per os, josamycín, telitromycín), inhibítory HIV
proteáz (nelfinavir, ritonavir) a nefazodón, je kontraindikované (pozri časť 4.3). Silné inhibítory CYP3A4
ketokonazol (200 mg jedenkrát denne) a josamycín (1 g dvakrát denne) zvýšili strednú plazmatickú expozíciu ivabradínom 7- až 8-násobne.
Stredne silné inhibítory CYP3A4: špecifické štúdie zamerané na interakcie u zdravých dobrovoľníkov a pacientov ukázali, že kombinácia ivabradínu s látkami znižujúcimi srdcovú frekvenciu (diltiazem alebo verapamil) viedla k zvýšeniu expozície ivabradínom (2- až 3-násobné zvýšenie v AUC) a k ďalšiemu zníženiu srdcovej frekvencie o 5 úderov/min. Súbežné použitie ivabradínu s týmito liekmi je kontraindikované (pozri časť 4.3).
Súbežné použitie sa neodporúča
Grapefruitový džús: expozícia ivabradínu sa dvojnásobne zvýšila po súčasnom podaní grapefruitového džúsu. Preto je potrebné vyhnúť sa konzumácii grapefruitového džúsu.
Súbežné použitie so zvýšenou opatrnosťou
‒ Stredne silné inhibítory CYP3A4: súbežné použitie ivabradínu s inými stredne silnými inhibítormi CYP3A4 (napr. flukonazol) možno zvážiť pri začiatočnej dávke 2,5 mg dvakrát denne, a ak je pokojová srdcová frekvencia nad 70 úderov/min, s monitorovaním srdcovej frekvencie.
‒ Induktory CYP3A4: induktory CYP3A4 (napr. rifampicín, barbituráty, fenytoín, Hypericum perforatum [ľubovník bodkovaný]) môžu znížiť expozíciu a aktivitu ivabradínu. Súbežné použitie
liekov indukujúcich CYP3A4 si môže vyžiadať úpravu dávky ivabradínu. Ukázalo sa, že kombinácia
ivabradínu 10 mg dvakrát denne s ľubovníkom bodkovaným znižuje AUC ivabradínu o polovicu. Príjem ľubovníka bodkovaného sa má počas liečby ivabradínom obmedziť.
Iné súbežné použitie
Špecifické štúdie liekových interakcií nepreukázali klinicky významný účinok nasledujúcich liekov na farmakokinetiku a farmakodynamiku ivabradínu: inhibítory protónovej pumpy (omeprazol, lanzoprazol),
sildenafil, inhibítory HMG CoA reduktázy (simvastatín), dihydropyridínové blokátory kalciových kanálov
(amlodipín, lacidipín), digoxín a warfarín. Okrem toho sa nezistil žiadny klinicky významný účinok ivabradínu na farmakokinetiku simvastatínu, amlodipínu, lacidipínu, na farmakokinetiku a
farmakodynamiku digoxínu, warfarínu a na farmakodynamiku acylpyrínu.
V pilotných klinických štúdiách III. fázy boli nasledujúce lieky bežne kombinované s ivabradínom bez dôkazov týkajúcich sa bezpečnosti: inhibítory angiotenzín- konvertujúceho enzýmu, antagonisty angiotenzínu II, betablokátory, diuretiká, antagonisty aldosterónu, krátkodobo a dlhodobo pôsobiace nitráty, inhibítory HMG CoA reduktázy, fibráty, inhibítory protónovej pumpy, perorálne antidiabetiká, acylpyrín a ďalšie antiagregačné lieky.
Pediatrickápopulácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Ženyvreprodukčnomveku
Ženy v reprodukčnom veku majú počas liečby používať účinnú antikoncepciu (pozri časť 4.3).
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití ivabradínu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu. Tieto štúdie preukázali embryotoxické a teratogénne účinky (pozri časť 5.3). Potenciálne riziko pre ľudí nie je známe. Preto je ivabradín kontraindikovaný
počas gravidity (pozri časť 4.3).
Dojčenie
Sledovaním na zvieratách sa zistilo, že ivabradín sa vylučuje do mlieka. Preto je ivabradín kontraindikovaný počas dojčenia (pozri časť 4.3). Ženy, ktoré potrebujú liečbu ivabradínom musia
ukončiť dojčenie a vybrať iný spôsob výživy dieťaťa.
Fertilita
Štúdie u potkanov nepreukázali žiadny vplyv na fertilitu samcov ani samíc (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Bola uskutočnená špecifická štúdia na posúdenie možného vplyvu ivabradínu na schopnosť viesť vozidlá u zdravých dobrovoľníkov, kde nebola preukázaná zmena v schopnosti viesť vozidlá. Avšak po uvedení lieku na trh boli hlásené prípady zníženej schopnosti viesť vozidlá kvôli zrakovým príznakom. Ivabradín môže vyvolávať prechodné svetelné fenomény pozostávajúce hlavne z fosfénov (pozri časť 4.8).
Možný výskyt takýchto svetelných fenoménov sa má brať do úvahy pri vedení vozidla alebo obsluhovaní strojov v situáciách, kde sa môžu vyskytnúť náhle zmeny v intenzite svetla, obzvlášť počas vedenia
vozidla v noci.
Ivabradín nemá žiadny vplyv na schopnosť obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Ivabradín bol skúmaný v klinických štúdiách zahŕňajúcich takmer 45 000 účastníkov.
Najčastejšie nežiaduce reakcie ivabradínu, svetelné fenomény (fosfény) a bradykardia, sú závislé od dávky a súvisia s farmakologickým účinkom lieku.
Tabuľkovýzoznamnežiaducichreakcií
Počas klinických štúdií boli zaznamenané nasledujúce nežiaduce reakcie a sú usporiadané podľa nasledujúcej frekvencie: veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až
<1/100); zriedkavé (≥1/10 000 až <1/1 000); veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov).
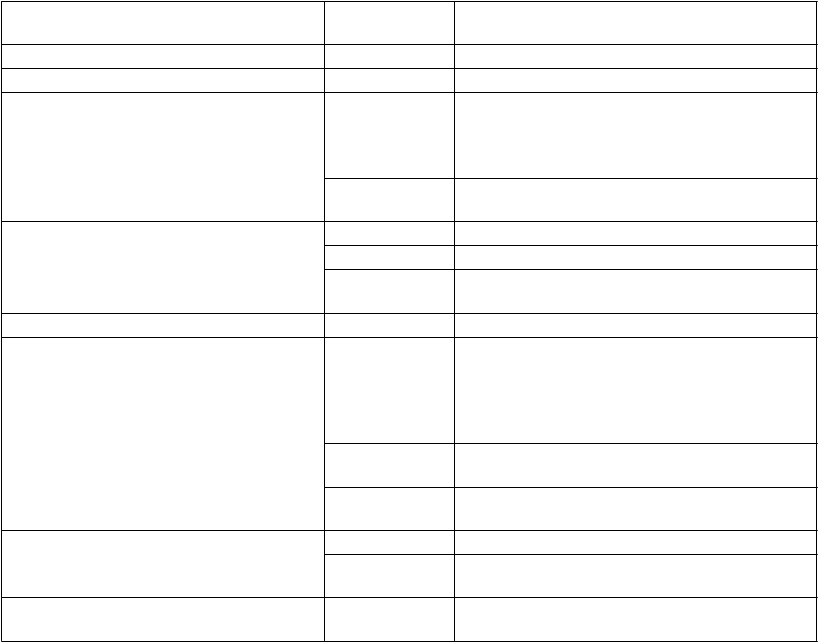
T
rieda orgánových systémov Frekvencia
výskytu
U
prednostňovaný výraz
P
oruchy krvi a lymfatického systému Menej časté Eozinofília
Poruchy metabolizmu a výživy Menej časté Hyperurikémia
Poruchy nervového systému Časté Bolesť hlavy, obyčajne počas prvého mesiaca liečby
Závraty, pravdepodobne súvisiace s bradykardiou
Menej časté* Synkopa, pravdepodobne súvisiaca s bradykardiou
Poruchy oka Veľmi časté Svetelné fenomény (fosfény) Časté Rozmazané videnie
Menej časté* Diplopia
Zhoršené videnie
Poruchy ucha a labyrintu Menej časté Vertigo
Poruchy srdca a srdcovej činnosti Časté Bradykardia
AV blokáda I. stupňa (na EKG predĺžený
interval PQ)
Komorové extrasystoly
Fibrilácia predsiení
Menej časté Palpitácie
Supraventrikulárne extrasystoly
Veľmi zriedkavé
AV blokáda 2. stupňa, AV blokáda 3. stupňa
Syndróm chorého sínusu
P
oruchy ciev Časté Nekontrolovaný krvný tlak
Menej časté* Hypotenzia, pravdepodobne súvisiaca s bradykardiou
 P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy dýchacej sústavy, hrudníka a mediastína
Menej časté Dýchavičnosť
P
oruchy gastrointestinálneho
t
raktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
C
elkové poruchy a reakcie v mieste podania
Menej časté Nauzea
Zápcha
Hnačka
Bolesť brucha*
Menej časté * Angioedém
Vyrážka
Zriedkavé * Erytém
Pruritus
Urtikária
Menej časté Svalové kŕče
Menej časté * Asténia, pravdepodobne súvisiaca s bradykardiou
Únava, pravdepodobne súvisiaca s bradykardiou
Zriedkavé * Celková nevoľnosť, pravdepodobne súvisiaca s bradykardiou
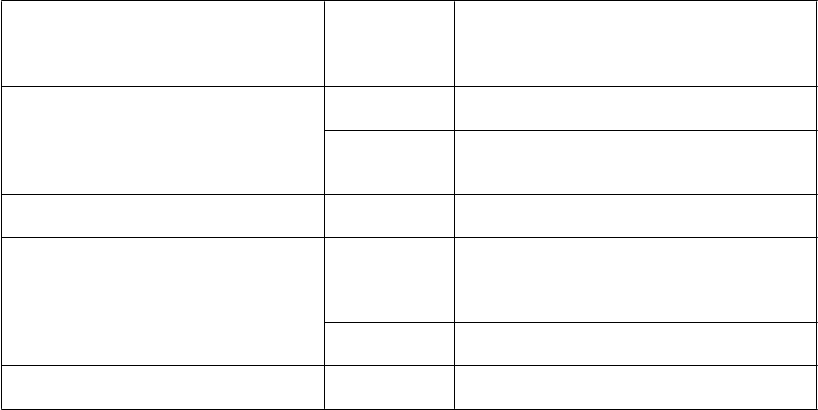 L
aboratórne a funkčné vyšetrenia
L
aboratórne a funkčné vyšetrenia Menej časté Zvýšená hladina kreatinínu v krvi
Predĺžený interval QT na EKG
* Frekvencia vypočítaná z klinických štúdií, v ktorých boli nežiaduce účinky zaznamenané zo spontánnych hlásení.
PopisvybranýchnežiaducichreakciíSvetelné fenomény (fosfény) boli hlásené u 14,5 % pacientov, popisované ako prechodné zvýšenie jasu v ohraničenej oblasti zrakového poľa. Zvyčajne sú vyvolávané náhlymi zmenami v intenzite svetla. Fosfény
môžu byť taktiež popisované ako prstenec svetla (halo), rozloženie obrazu (stroboskopické alebo
kaleidoskopické efekty), farebné jasné svetlá, alebo mnohopočetný obraz (retinálna perzistencia). Nástup fosfénov sa vyskytuje zvyčajne počas prvých dvoch mesiacov liečby, potom sa môžu objavovať
opakovane. Zvyčajne sa zaznamenali fosfény so slabou až miernou intenzitou. Všetky fosfény ustúpili
počas liečby alebo po nej, väčšina z nich (77,5 %) ustúpila počas liečby. V súvislosti s fosfénmi menej ako
1 % pacientov zmenilo svoj bežný denný režim alebo prerušilo liečbu.
Bradykardia bola hlásená u 3,3 % pacientov, najmä počas prvých 2 až 3 mesiacov po začatí liečby. 0,5 %
pacientov pocítilo ťažkú bradykardiu pod alebo rovnú 40 úderom/min.
V štúdii SIGNIFY bola pozorovaná predsieňová fibrilácia u 5,3 % pacientov užívajúcich ivabradín v porovnaní s 3,8 % v skupine s placebom. V združenej analýze všetkých dvojito zaslepených kontrolovaných klinických skúšaní fázy II/III trvajúcich najmenej 3 mesiace zahŕňajúcich viac ako 40 000 pacientov, bol výskyt predsieňovej fibrilácie 4,86 % u pacientov liečených ivabradínom v porovnaní s
4,08 % u kontrolnej skupiny, čo zodpovedá pomeru rizika 1,26, 95 % IS [1,15 – 1,39].
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 Predávkovanie
Príznaky
Predávkovanie môže viesť k ťažkej a prolongovanej bradykardii (pozri časť 4.8).
Liečba
Ťažká bradykardia sa má liečiť symptomaticky v špecializovanom zariadení. V prípade bradykardie s nedostačujúcou hemodynamickou toleranciou sa má zvážiť symptomatická liečba zahŕňajúca intravenózne podanie beta-sympatomimetika, ako je izoprenalín. Ak je to nutné, môže byť zavedená dočasná elektrická stimulácia srdca.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Kardiaká, iné kardiaká; ATC kód: C01EB17
Mechanizmusúčinku
Ivabradín je látka, ktorej účinok na srdce spočíva výlučne v znižovaní srdcovej frekvencie. Tento účinok je sprostredkovaný selektívnou a špecifickou inhibíciou srdcového pacemakerového If prúdu, ktorý riadi spontánnu diastolickú depolarizáciu, a tým srdcovú frekvenciu v bunkách sínusového uzla. Kardiálne účinky sú špecifické pre sínusový uzol, bez vplyvu na intraatriálne, atrioventrikulárne alebo bez vplyvu intraventrikulárne prevodové časy, alebo na kontraktilitu myokardu alebo repolarizáciu komôr.
Ivabradín môže tiež súčasne pôsobiť na Ih prúd v sietnici, ktorý sa veľmi podobá na srdcový If prúd. Podieľa sa na dočasnej zmene rozlišovacej schopnosti zrakového systému skrátením odpovede sietnice na jasné svetelné podnety. Pri určitých vyvolávajúcich okolnostiach (napr. náhle zmeny intenzity svetla) spôsobuje parciálna inhibícia Ih prúdu ivabradínom svetelné fenomény, ktoré môžu pacienti príležitostne vnímať. Svetelné fenomény (fosfény) sú popisované ako prechodné zvýšenie jasu v ohraničenej oblasti zrakového poľa (pozri časť 4.8).
Farmakodynamickýúčinok
Hlavnou farmakodynamickou vlastnosťou ivabradínu u ľudí je špecifické zníženie srdcovej frekvencie závislé od dávky. Analýza zníženia srdcovej frekvencie s dávkami do 20 mg dvakrát denne naznačuje
smer k plató efektu, ktorý je v zhode so zníženým rizikom ťažkej bradykardie pod 40 úderov/min (pozri
časť 4.8).
Pri bežných odporučených dávkach je zníženie srdcovej frekvencie v pokoji a počas záťaže približne 10 úderov/min. To vedie k zníženiu pracovnej záťaže srdca a spotreby kyslíka myokardom. Ivabradín neovplyvňuje intrakardiálne vedenie, kontraktilitu (nemá negatívny inotropný účinok) alebo komorovú repolarizáciu:
‒ V klinických elektrofyziologických štúdiách nemal ivabradín žiadny účinok na atrioventrikulárne alebo intraventrikulárne prevodové časy alebo korigované intervaly QT.
‒ U pacientov s dysfunkciou ľavej komory (ejekčná frakcia ľavej komory (EF ĽK) medzi 30 a 45 %)
nemal ivabradín žiadny škodlivý účinok na EF ĽK.
K
l
i
n
i
cká
účinnosť
a
bezpečnosť
Antianginózna a antiischemická účinnosť ivabradínu bola hodnotená v piatich dvojito zaslepených, randomizovaných štúdiách (tri verzus placebo, jedna verzus atenolol a jedna verzus amlodipín). Tieto
štúdie zahŕňali celkom 4111 pacientov s chronickou stabilnou anginou pectoris, z ktorých
2617 dostávalo ivabradín.
Ivabradín 5 mg dvakrát denne preukázal účinnosť na parametre záťažového testu v priebehu 3 až 4 týždňov liečby. Účinnosť bola potvrdená so 7,5 mg dvakrát denne. Obzvlášť, aditívny účinok dávky nad 5 mg dvakrát denne bol stanovený v referenčnej kontrolovanej štúdii verzus atenolol: celkové trvanie záťaže v dobe minimálneho účinku lieku sa predĺžilo o takmer 1 minútu po jednom mesiaci liečby s 5 mg dvakrát denne a ďalej sa zlepšilo o takmer 25 sekúnd po ďalšom 3-mesačnom období s cielenou titráciou na 7,5
mg dvakrát denne. V tejto štúdii boli potvrdené antianginózne a antiischemické účinky ivabradínu u pacientov vo veku 65 rokov alebo viac. Účinnosť dávky 5 a 7,5 mg dvakrát denne bola konzistentná medzi jednotlivými štúdiami na parametre záťažového testu (celkové trvanie záťaže, čas do limitujúcej anginy, čas do nástupu anginy a čas do vzniku depresie segmentu ST o 1 mm) a bola spojená so znížením výskytu frekvencie anginóznych záchvatov o približne 70 %. Dávkovací režim ivabradínu dvakrát denne priniesol rovnakú účinnosť počas 24 hodín.
V randomizovanej, placebom kontrolovanej štúdii, ktorej sa zúčastnilo 889 pacientov ivabradín pridávaný k atenololu 50 mg raz denne preukázal aditívnu účinnosť na všetky parametre záťažového testu v dobe minimálneho účinku lieku (12 hodín po perorálnom užití).
V randomizovanej, placebom kontrolovanej štúdii so 725 pacientmi ivabradín pridávaný k amlodipínu 10 mg raz denne nepreukázal aditívnu účinnosť v dobe minimálneho účinku lieku (12 hodín po perorálnom užití), zatiaľ čo aditívna účinnosť bola preukázaná v dobe maximálneho účinku lieku (3-4 hodiny po perorálnom užití).
V randomizovanej, placebom kontrolovanej štúdii s 1277 pacientmi preukázal ivabradín pridávaný k amlodipínu 5 mg raz denne alebo k nifedipínu GITS 30 mg raz denne štatisticky signifikantnú aditívnu účinnosť na odpoveď na liečbu (definovaná ako zníženie o najmenej 3 záchvaty anginy pectoris za týždeň a/alebo predĺženie času depresie segmentu ST o 1 mm o najmenej 60 s počas záťažového testu), v dobe najnižšieho účinku lieku (12 hodín po perorálnom užití ivabradínu) počas 6 týždňovej liečby (OR = 1,3,
95 % IS [1,0 – 1,7]; p = 0,012). Ivabradín nepreukázal aditívnu účinnosť na sekundárne cieľové parametre záťažového testu v dobe najnižšieho účinku lieku, zatiaľ čo aditívna účinnosť bola preukázaná v dobe
maximálneho účinku lieku (3 – 4 hodiny po perorálnom užití ivabradínu).
Účinnosť ivabradínu bola plne udržiavaná počas 3- alebo 4-mesačných období liečby v štúdiách zameraných na účinnosť. Neexistuje žiadny dôkaz farmakologickej tolerancie (straty účinnosti) vyvíjajúcej sa počas liečby, ani rebound fenoménu po náhlom vysadení liečby. Antianginózne a antiischemické účinky ivabradínu sa spájajú so znížením srdcovej frekvencie závislej od dávky a so signifikantným znížením hodnoty dvojproduktu (srdcová frekvencia x systolický krvný tlak) v pokoji a počas záťaže. Účinky na krvný tlak a periférnu cievnu rezistenciu boli nepatrné a klinicky nevýznamné.
Trvalé zníženie srdcovej frekvencie bolo preukázané u pacientov liečených ivabradínom najmenej počas 1
roka (n = 713). Nebol pozorovaný vplyv na glukózový alebo lipidový metabolizmus.
Antianginózna a antiischemická účinnosť ivabradínu bola zachovaná u diabetických pacientov (n = 457) s podobným bezpečnostným profilom ako v celkovej populácii.
Rozsiahla štúdia BEAUTIFUL (outcome study), zameraná na sledovanie 10917 pacientov s koronárnou
chorobou srdca a dysfunkciou ľavej komory (EF ĽK<40 %) sa uskutočnila pridaním k optimálnej štandardnej terapii pacientov, z ktorých 86,9 % užívalo betablokátory. Hlavným kritériom účinnosti bol
kombinovaný cieľ zahŕňajúci úmrtie z kardiovaskulárnych príčin, hospitalizáciu pre akútny IM alebo
hospitalizáciu pre nový výskyt srdcového zlyhania alebo jeho zhoršenie. Štúdia nepreukázala rozdiel v pomere výsledkov primárneho kombinovaného cieľa v skupine s ivabradínom v porovnaní so skupinou s placebom (relatívne riziko ivabradín: placebo 1,00, p = 0,945).
V post hoc podskupine pacientov so symptomatickou anginou pektoris sa pri randomizácii (n = 1507)
nezistil žiadny bezpečnostný signál týkajúci sa úmrtia z kardiovaskulárnych príčin, hospitalizácie pre akútny IM alebo srdcového zlyhania (ivabradín 12,0 % verzus placebo 15,5 %, p = 0,05).
Rozsiahla štúdia SIGNIFY sa uskutočnila u 19 102 pacientov s koronárnou chorobou srdca a bez klinického srdcového zlyhania (EF ĽK > 40 %) pridaním sledovanej liečby k optimálnej štandardnej terapii. Bola použitá terapeutická schéma s vyšším dávkovaním ako je schválené dávkovanie (začiatočná dávka 7,5 mg dvakrát denne (5 mg dvakrát denne, ak vek je ≥ 75 rokov) a titrácia až do 10 mg dvakrát denne). Hlavné kritérium účinnosti bolo zložené z kardiovaskulárnej mortality alebo nefatálneho IM. Štúdia nepreukázala rozdiel v hodnote primárneho zloženého ukazovateľa (PCE, Primary composite Endpoint) v skupine s ivabradínom v porovnaní so skupinou s placebom (relatívne riziko ivabradín/placebo 1,08, p = 0,197). Bradykardia bola hlásená u 17,9 % pacientov v skupine s ivabradínom (2,1 % v skupine s placebom). Verapamil, diltiazem alebo silné CYP 3A4 inhibítory užívalo počas štúdie
7,1 % pacientov.
Malý štatisticky významný nárast PCE bol pozorovaný vo vopred určenej podskupine pacientov s anginou pectoris CCS triedy II alebo vyššej na začiatku štúdie (n = 12 049) (ročný výskyt 3,4 % verzus 2,9 %, relatívne riziko ivabradín/placebo 1,18, p = 0,018), ale nie v podskupine celkovej populácie s anginou
CCS triedy ≥ I (n = 14 286) (relatívne riziko ivabradín/placebo 1,11, p = 0,110).
Dávka použitá v štúdii bola vyššia ako je schválená dávka, čo ale úplne nevysvetľuje tieto výsledky. Štúdia SHIFT (outcome trial) bola veľká multicentrická, medzinárodná, randomizovaná dvojito zaslepená
placebom kontrolovaná štúdia vykonaná u 6 505 dospelých pacientov so stabilným chronickým srdcovým zlyhaním (počas ≥ 4 týždňov), triedy II až IV podľa NYHA, so zníženou ejekčnou frakciou ľavej komory
(EF ĽK ≤ 35%) a pokojovou srdcovou frekvenciou ≥ 70 úderov/min.
Pacienti dostávali štandardnú liečbu vrátane betablokátorov (89 %), ACE inhibítorov a/alebo antagonistov angiotenzínu II (91 %), diuretík (83 %) a antagonistov aldosterónu (60 %). V skupine s ivabradínom bolo'
67 % pacientov liečených dávkou 7,5 mg dvakrát denne. Priemerná dĺžka sledovania bola 22,9 mesiacov.
Liečba ivabradínom bola spojená s priemerným znížením srdcovej frekvencie o 15 úderov/min zo vstupnej hodnoty 80 úderov/min. Rozdiel v srdcovej frekvencii medzi ivabradínovou a placebovou skupinou bol 10,8 úderov/min po 28 dňoch, 9,1 úderov za minútu po 12 mesiacoch a 8,3 úderov/min po
24 mesiacoch.
Štúdia preukázala klinicky a štatisticky signifikantné zníženie relatívneho rizika o 18 % v primárnom zloženom ukazovateli kardiovaskulárnej mortality a hospitalizácie z dôvodu zhoršenia srdcového zlyhania
(pomer rizika: 0,82, 95 % IS [0,75; 0,90], p < 0,0001), ktoré sa prejavilo v priebehu 3 mesiacov od začatia
liečby. Zníženie absolútneho rizika bolo 4,2 %. Na výsledky primárneho ukazovateľa mali vplyv hlavne ukazovatele srdcového zlyhania, hospitalizácia z dôvodu zhoršenia srdcového zlyhania (absolútne riziko znížené o 4,7 %) a úmrtia v dôsledku srdcového zlyhania (absolútne riziko znížené o 1,1 %).
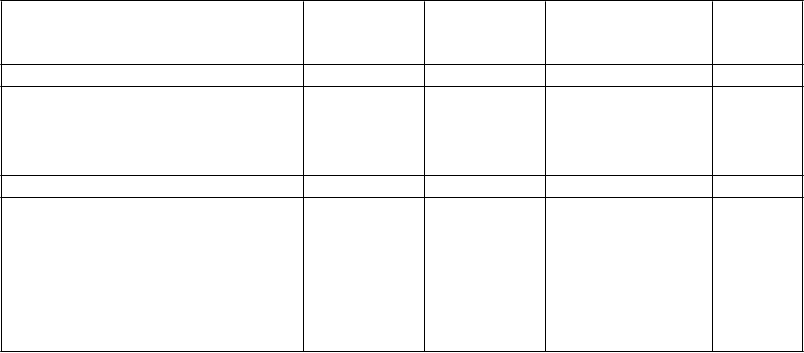
Účinok liečby na primárny zložený ukazovateľ, jeho zložky a sekundárne ukazovatele
Ivabradín
(
N = 3 241)
n (%)
Placebo
(
N = 3 264)
n (%)
P
o
m
er rizika
[
95 % CI]
p-
hodnota
Primárny zložený endpoint 793 (24,47) 937 (28,71) 0,82 [0,75; 0,90] < 0,0001
Zložky zloženého endpointu:
‒ Kardiovaskulárne úmrtie
‒ Hospitalizácia z dôvodu zhoršenia srdcového zlyhania
Iné sekundárne endpointy
‒ Úmrtia zo všetkých príčin
‒ Úmrtie z dôvodu srdcového zlyhania
‒ Hospitalizácia z akejkoľvek príčiny
‒ Hospitalizácia z kardiovaskulárnej príčiny
449 (13,85)
514 (15,86)
503 (15,52)
113 (3,49)
1,231 (37,98)
977 (30,15)
491 (15,04)
672 (20,59)
552 (16,91)
151 (4,63)
1,356 (41,54)
1,122 (34,38)
0.91 [0,80; 1,03]
0.74 [0,66; 0,83]
0,90 [0,80; 1,02]
0,74 [0,58; 0,94]
0,89 [0,82; 0,96]
0,85 [0,78; 0,92]
0,128
< 0,0001
0,092
0,014
0,003
0,0002
Zníženie primárného endpointu sa pozorovalo rovnomerne bez ohľadu na pohlavie, NYHA triedu,
ischemickú alebo neischemickú etiológiu srdcového zlyhania a pôvod anamnézy diabetu alebo hypertenzie.
V podskupine pacientov so srdcovou frekvenciou ≥ 75 úderov/min (n = 4 150) sa pozorovalo väčšie zníženie v primárnom zloženom endpointe o 24 % (pomer rizika: 0,76, 95 % IS [0,68; 0,85], p
< 0,0001)
a v iných sekundárnych endpointoch, vrátane celkovej mortality (pomer rizika: 0,83, 95 % IS [0,72; 0,96],
p
= 0,0109) a KV mortality (pomer rizika: 0,83, 95 % IS [0,71; 0,97], p
= 0,0166). V tejto podskupine pacientov je bezpečnostný profil ivabradínu v súlade s profilom v celkovej populácii.
Signifikantný účinok sa pozoroval v primárnom zloženom endpointe v celkovej skupine pacientov užívajúcich betablokátory (pomer rizika: 0,85, 95 % IS [0,76; 0,94]). V podskupine pacientov so srdcovou frekvenciou ≥ 75 úderov/min a liečených odporúčanou cieľovou dávkou betablokátora sa nepozoroval štatisticky signifikantný prínos v primárnom zloženom endpointe (pomer rizika: 0,97, 95 % IS [0,74;
1,28]) a v iných sekundárnych endpointoch, vrátane hospitalizácie z dôvodu zhoršenia srdcového zlyhania
(pomer rizika: 0,79, 95 % IS [0,56; 1,10]) alebo úmrtia kvôli srdcovému zlyhaniu (pomer rizika: 0,69, 95
% IS [0,31; 1,53]).
Pri poslednej zaznamenanej hodnote došlo k signifikantnému zlepšeniu v NYHA triede, u 887 (28 %) pacientov liečených ivabradínom došlo k zlepšeniu v porovnaní so 776 (24 %) pacientmi dostávajúcimi placebo (p = 0,001).
V randomizovanej placebom kontrolovanej štúdii u 97 pacientov liečených ivabradínom na chronickú stabilnú anginu pectoris viac ako 3 roky, nepreukázali údaje zozbierané počas špecifických oftalmologických vyšetrení s cieľom zdokumentovať funkciu sústav čapíkov a tyčiniek sietnice a vzostupnú zrakovú dráhu (t. j. elektroretinogram, statické a kinetické zrakové pole, farebné videnie, ostrosť videnia) žiadnu toxicitu na sietnicu.
PediatrickápopuláciaRandomizovaná, dvojito zaslepená, placebom kontrolovaná štúdia bola vykonaná u 116 pediatrických pacientov (17 vo veku [6 až 12] mesiacov, 36 vo veku [1 až 3] rokov a 63 vo veku [3 až 18] rokov) s
chronickým srdcovým zlyhaním a dilatačnou kardiomyopatiou (DCM) pridaním sledovanej liečby k
optimálnej štandardnej terapii. 74 dostávalo ivabradín (pomer 2:1). Úvodná dávka bola 0,02 mg/kg dvakrát denne vo vekovej podskupine [6 až 12] mesiacov; 0,05 mg/kg dvakrát denne u [1 až 3] ročných a
[3 až 18] ročných ˂ 40 kg; a 2,5 mg dvakrát denne u [3 až 18] ročných a ≥ 40 kg. Dávka bola jednotlivo
prispôsobená v závislosti na terapeutickej odpovedi s maximálnymi dávkami 0,2 mg/kg dvakrát denne; 0,3 mg/kg dvakrát denne a 15 mg dvakrát denne. V tejto štúdii bol ivabradín podávaný vo forme perorálnej tekutiny alebo tablety dvakrát denne. Neprítomnosť farmakokinetického rozdielu medzi dvomi formami
sa ukázala v otvorenej randomizovanej dvojito skríženej štúdii u 24 dospelých zdravých dobrovoľníkov.
20 % zníženie srdcovej frekvencie, bez bradykardie, bolo dosiahnuté u 69,9 % pacientov v skupine s ivabradínom verzus 12,2 % v skupine s placebom počas doby titrácie 2 až 8 týždňov (pomer šancí:
E=17,24; 95 % IS [5,91 ; 50,30]).
Priemerné dávky ivabradínu umožňujúce dosiahnuť 20 % zníženie srdcovej frekvencie boli 0,13 ± 0,04 mg/kg dvakrát denne; 0,10 ± 0,04 mg/kg dvakrát denne a 4,1 ± 2,2 mg dvakrát denne vo vekových podskupinách [1 až 3] rokov, [3 až 18] rokov a ˂ 40 kg a [3 až 18] rokov a ≥ 40 kg, v uvedenom poradí. Priemerná EF ĽK sa zvýšila z 31,8 % na 45,3 % v M012 skupine s ivabradínom verzus z 35,4 % na 42,3
% v skupine s placebom. Zlepšenie v NYHA triede bolo u 37,7 % pacientov v skupine s ivabradínom verzus 25,0 % v skupine s placebom. Tieto zlepšenia neboli štatisticky signifikantné.
Bezpečnostný profil, počas jedného roka, bol podobný tomu opísanému u dospelých pacientov s
chronickým srdcovým zlyhaním.
Dlhodobé účinky ivabradínu na rast, pubertu a celkový vývoj ako aj dlhodobá účinnosť terapie ivabradínom v detstve na zníženie kardiovaskulárnej morbidity a mortality neboli skúmané.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s ivabradínom vo všetkých podskupinách pediatrickej populácie pre liečbu anginy pectoris.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s ivabradínom u detí
vo veku od 0 do menej ako 6 mesiacov pre liečbu chronického srdcového zlyhania.
5.2 Farmakokinetické vlastnosti
Za fyziologických podmienok sa ivabradín rýchlo uvoľňuje z tabliet a je vysokorozpustný vo vode (>10 mg/ml). Ivabradín je S-enantiomér bez preukázanej biokonverzie in vivo. N-demetylovaný derivát ivabradínu bol identifikovaný ako hlavný aktívny metabolit u ľudí.
Absorpciaabiologickádostupnosť
Ivabradín sa rýchlo a takmer úplne absorbuje po perorálnom podaní nalačno s najvyššou plazmatickou hladinou dosiahnutou približne o 1 hodinu. Absolútna biologická dostupnosť filmom obalených tabliet je
okolo 40 %, čo je dôsledkom „first-pass“ efektu v čreve a pečeni.
Jedlom sa absorpcia oneskorila o približne 1 hodinu a plazmatická expozícia sa zvýšila o 20 až 30 %. Odporúča sa užívať tablety počas jedla, aby sa znížila intraindividuálna variabilita pri expozícii (pozri časť 4.2).
Distribúcia
Ivabradín je viazaný na plazmatické bielkoviny v približne 70 % a distribučný objem je v rovnovážnom stave u pacientov blízko k 100 l. Maximálna plazmatická koncentrácia po dlhodobom podávaní odporučenej dávky 5 mg dvakrát denne je 22 ng/ml (CV=29 %). Priemerná plazmatická koncentrácia je v rovnovážnom stave 10 ng/ml (CV=38 %).
B
i
otransformácia
Ivabradín sa extenzívne metabolizuje v pečeni a čreve výlučne oxidáciou cez cytochróm P4503A4 (CYP3A4). Hlavným aktívnym metabolitom je N-demetylovaný derivát (S 18982) s expozíciou okolo 40
% v porovnaní s materskou zlúčeninou. Metabolizmus tohto aktívneho metabolitu tiež zahŕňa CYP3A4.
Ivabradín má nízku afinitu k CYP3A4, nepreukazuje klinicky relevantnú indukciu alebo inhibíciu CYP3A4, a preto je nepravdepodobné, že by modifikoval metabolizmus alebo plazmatické koncentrácie substrátov CYP3A4. Naopak, silné inhibítory a induktory môžu podstatne ovplyvniť plazmatické koncentrácie ivabradínu (pozri časť 4.5).
Eliminácia
Ivabradín sa vylučuje s hlavným polčasom 2 hodiny (70-75 % AUC) v plazme a s efektívnym polčasom
11 hodín. Celkový klírens je približne 400 ml/min a renálny klírens približne 70 ml/min. Vylučovanie metabolitov nastáva v podobnom rozsahu stolicou a močom. Približne 4 % perorálnej dávky sa vylučujú močom nezmenené.
Linearita/nelinearita
Kinetika ivabradínu je lineárna po perorálnej dávke v rozsahu 0,5 – 24 mg.
Osobitnéskupinypacientov
Staršie osoby
Neboli pozorované žiadne farmakokinetické rozdiely (AUC a Cmax) medzi staršími (≥ 65 rokov) alebo veľmi starými pacientmi (≥ 75 rokov) a celkovou populáciou (pozri časť 4.2).
Porucha funkcie obličiek
Vplyv poruchy funkcie obličiek (klírens kreatinínu od 15 do 60 ml/min) na farmakokinetiku ivabradínu je minimálny, čo súvisí s nízkym podielom renálneho klírensu (okolo 20 %) na celkovú elimináciu oboch, ivabradínu a jeho hlavného metabolitu S 18982 (pozri časť 4.2).
Porucha funkcie pečene
U pacientov s miernou poruchou funkcie pečene (Childovo-Pughovo skóre do 7) boli neviazané AUC ivabradínu a hlavný aktívny metabolit približne o 20 % vyššie ako u osôb s normálnou funkciou pečene. Na vyvodenie záverov u pacientov so stredne ťažkou poruchou funkcie pečene sú limitované údaje. U pacientov s ťažkou poruchou funkcie pečene nie sú k dispozícii žiadne údaje (pozri časti 4.2 a 4.3).
Pediatrická populácia
Farmakokinetický profil ivabradínu u pediatrických pacientov s chronickým srdcovým zlyhaním vo veku od 6 mesiacov do menej ako 18 rokov je podobný farmakokinetike opísanej u dospelých, keď je aplikovaná titračná schéma na základe veku a váhy.
Farmakokinetický/farmakodynamický(FK/FD)pomer
Analýza FK/FD pomeru ukázala, že srdcová frekvencia sa znižuje takmer lineárne so zvyšujúcimi sa plazmatickými koncentráciami ivabradínu a S 18982 pre dávky do 15 – 20 mg dvakrát denne. Pri vyšších dávkach zníženie srdcovej frekvencie už nie je proporcionálne k plazmatickým koncentráciám ivabradínu a má tendenciu dosiahnuť plató. Vysoké expozície k ivabradínu, ktoré môžu nastať, keď je ivabradín podávaný v kombinácii so silnými inhibítormi CYP3A4, môžu viesť k nadmernému zníženiu srdcovej frekvencie, hoci toto riziko je menšie u stredne silných inhibítorov CYP3A4 (pozri časti 4.3, 4.4 a 4.5). FK/FD pomer ivabradínu u pediatrických pacientov s chronickým srdcovým zlyhaním vo veku od 6 mesiacov do menej ako 18 rokov je podobný FK/FD pomeru opísanému u dospelých.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí. Štúdie reprodukčnej toxicity nepreukázali žiadny vplyv ivabradínu na fertilitu samcov a samíc potkanov. Keď boli gravidné zvieratá liečené počas organogenézy pri vystavení účinkom dávok blízkych
terapeutickým, bola vyššia incidencia plodov so srdcovými defektmi pri potkanoch a nízky počet plodov s ektrodaktýliou pri králikoch.
U psov, ktorým bol podávaný ivabradín (dávky 2, 7 alebo 24 mg/kg/deň) počas jedného roka sa
pozorovali reverzibilné zmeny vo funkcii sietnice, ale neboli spojené so žiadnym poškodením vizuálnych štruktúr. Tieto údaje sú v súlade s farmakologickým účinkom ivabradínu, ktorý sa týka jeho interakcie s hyperpolarizáciou aktivovaných Ih prúdov v sietnici, ktoré sú veľmi podobné s If prúdmi sínusového uzla. Iné štúdie s dlhodobými opakovanými dávkami a štúdie zamerané na karcinogenitu neodhalili žiadne klinicky relevantné zmeny.
Hodnotenieenvironmentálnehorizika(ERA)
Hodnotenie environmentálneho rizika ivabradínu sa uskutočnilo podľa európskych smerníc týkajúcich sa
ERA.
Výsledky týchto hodnotení potvrdzujú, že neexistuje environmentálne riziko ivabradínu a že ivabradín nepredstavuje ohrozenie životného prostredia.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro: Manitol Krospovidón Stearan horečnatý
Filmotvorná vrstva: Hypromelóza
Oxid titaničitý
Makrogol 400
Glycerol
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
18 mesiacov.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 25 °C v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
OPA/Alu/PVC-Alu blistre, papierová škatuľka. Veľkosť balenia:
Ivabradine Zentiva 5 mg filmom obalené tablety: 14, 28, 56, 84, 98, 100, 112 filmom obalené tablety
Ivabradine Zentiva 7,5 mg: 14, 28, 56, 84, 98, 100, 112 filmom obalené tablety
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Zentiva, k.s.
U Kabelovny 130
102 37 Praha 10
Česká republika
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
Ivabradine Zentiva 5 mg filmom obalené tablety: EU/1/16/1144/001
EU/1/16/1144/002
EU/1/16/1144/003
EU/1/16/1144/004
EU/1/16/1144/005
EU/1/16/1144/006
EU/1/16/1144/007
Ivabradine Zentiva 7,5 mg filmom obalené tablety: EU/1/16/1144/008
EU/1/16/1144/009
EU/1/16/1144/010
EU/1/16/1144/011
EU/1/16/1144/012
EU/1/16/1144/013
EU/1/16/1144/014
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.