
zdvojnásobiť.
St arší ľudi a (65 rokov alebo viac)
Nie sú dôkazy, ktoré by naznačovali, že u pacientov vo veku 65 rokov a starších sa vyžaduje úprava dávky. Údaje o použití v tejto populácii sú však obmedzené, preto sa Isturisa má používať v tejto vekovej skupine s opatrnosťou.
Porucha f unkc ie obl i či ek
Úprava dávky nie je potrebná u pacientov s poruchou funkcie obličiek (pozri časť 5.2). Koncentrácie voľného kortizolu v moči (urinary free cortisol, UFC) sa majú interpretovať s opatrnosťou u pacientov so stredne ťažkou až ťažkou poruchou funkcie obličiek vzhľadom na znížené vylučovanie UFC.
U týchto pacientov sa majú zvážiť alternatívne metódy monitorovania kortizolu.
Porucha f unkc ie peče ne
Úprava dávky nie je potrebná u pacientov s ľahkou poruchou funkcie pečene (A podľa Childa-Pugha). U pacientov so stredne ťažkou poruchou funkcie pečene (B podľa Childa-Pugha) je odporúčaná
začiatočná dávka 1 mg dvakrát denne. U pacientov s ťažkou poruchou funkcie pečene (C podľa
Childa-Pugha) je odporúčaná začiatočná dávka 1 mg jedenkrát denne večer, so začiatočnou titráciou
nahor na 1 mg dvakrát denne (pozri časť 5.2).
Údaje o použití u pacientov s poruchou funkcie pečene sú obmedzené. U pacientov s poruchou funkcie
pečene môže byť počas titrovania dávky potrebná častejšia kontrola funkcie nadobličiek.
Pediatrická populácia
Bezpečnosť a účinnosť Isturisy u pacientov vo veku menej ako 18 rokov neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podávania
Perorálne použitie.
Isturisu možno užívať s jedlom alebo bez jedla.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Hypokortizolizmus
Inhibícia syntézy kortizolu osilodrostatom mala za následok udalosti súvisiace s hypokortizolizmom,
napr. syndróm z vysadenia kortizolu (symptomatický pokles koncentrácií kortizolu, ale ešte nad
dolnou hranicou normálneho rozmedzia) a insuficienciu nadobličiek (koncentrácie kortizolu
pod normálnym rozmedzím).
Koncentrácie kortizolu sa majú kontrolovať v pravidelných intervaloch (pozri časť 4.2), pretože udalosti súvisiace s hypokortizolizmom sa môžu vyskytnúť kedykoľvek počas liečby. Odporúča sa ďalšie sledovanie, najmä za podmienok zvýšenej potreby kortizolu, napr. pri fyzickom alebo psychickom strese, alebo počas zmien v súbežne podávaných liekoch, ktoré môžu ovplyvniť expozíciu osilodrostatu (pozri časť 4.5). Odporúča sa používať laboratórne metódy, ktoré nevykazujú významnú skríženú reaktivitu s prekurzormi kortizolu, napr. s 11-deoxykortizolom, ktoré sa môžu zvýšiť počas liečby osilodrostatom.
Pacienti majú byť poučení o prejavoch a príznakoch spojených s hypokortizolizmom (napr. nauzea,
vracanie, únava, bolesť brucha, strata chuti do jedenia a závraty).
Symptomatickí pacienti majú byť monitorovaní pre hypotenziu, hyponatriémiu, hyperkaliémiu a/alebo hypoglykémiu. Pri podozrení na hypokortizolizmus sa majú stanoviť koncentrácie kortizolu a zvážiť dočasné zníženie dávky alebo vysadenie osilodrostatu. Ak je to potrebné, má sa začať substitučná liečba kortikosteroidmi. Isturisu možno po vymiznutí symptómov znovu podať v nižšej dávke
za predpokladu, že koncentrácie kortizolu sú bez substitúcie glukokortikoidmi nad dolnou hranicou normálneho rozmedzia.
Predĺženie QTc
V podrobnej štúdii zameranej na QT sa osilodrostat spájal s predĺžením intervalu QT závislým
od dávky (priemerné maximálne odhadované zvýšenie QTcF o +5,3 ms pri najvyššej odporúčanej
dávke 30 mg), čo môže vyvolať srdcové arytmie (pozri časť 5.1). V klinických štúdiách boli hlásené nežiaduce reakcie predĺženia QT a klinicky významné EKG nálezy.
Má sa vykonať vyšetrenie EKG pred začiatkom liečby Isturisou, do jedného týždňa od začatia liečby a neskôr podľa klinickej potreby. Ak interval QTc prekročí 480 ms pred liečbou alebo počas nej, odporúča sa konzultácia s kardiológom. Môže byť potrebné dočasné zníženie dávky alebo prerušenie liečby.
Každá hypokaliémia, hypokalciémia alebo hypomagneziémia sa má korigovať pred podaním Isturisy a hladiny elektrolytov sa majú počas liečby pravidelne kontrolovať.
Isturisa sa má používať s opatrnosťou a pomer prínosu a rizika sa má starostlivo zvážiť u pacientov s rizikovými faktormi pre predĺženie QT, napr.:
- vrodený syndróm dlhého intervalu QT,
- významné kardiovaskulárne ochorenie (vrátane kongestívneho zlyhávania srdca, nedávneho infarktu myokardu, nestabilnej angíny, pretrvávajúcej ventrikulárnej tachykardie, pokročilej
srdcovej blokády a klinicky významnej bradyarytmie), a
- súbežne podávané lieky, o ktorých je známe, že predlžujú interval QT (pozri časť 4.5).
Ak sa Isturisa používa u pacientov s týmito rizikovými faktormi, odporúča sa častejšie monitorovanie
prostredníctvom EKG.
Rast kortikotropného nádoru
Ukončenie liečby osilodrostatom treba zvážiť u pacientov, u ktorých sa počas liečby rozvinie a na
MRI potvrdí invazívnosť kortikotropného nádoru.
Súbežné použitiesosilnýmiinhibítormia induktormi enzýmov
Opatrnosť a dôkladnejšie sledovanie sa odporúča, keď sa počas liečby osilodrostatom začína alebo
končí liečba súbežne podávanými liekmi, ktoré silne inhibujú alebo indukujú viaceré enzýmy (pozri
časť 4.5), pretože môžu ovplyvniť expozíciu osilodrostatu a môžu mať za následok riziko nežiaducich
udalostí (v dôsledku možného zvýšenia expozície) alebo zníženú účinnosť (v dôsledku možného zníženia expozície).
Ženy vo fertilnom veku
Isturisa môže spôsobiť poškodenie plodu. U žien vo fertilnom veku sa má pred začatím liečby
Isturisou vylúčiť gravidita a tieto pacientky je potrebné poučiť o možnom riziku pre plod a nutnosti
používať účinnú antikoncepciu počas liečby a najmenej jeden týždeň po skončení liečby (pozri časť 4.6).
4.5 Liekové a iné interakcie
Prípadné farmakodynamické interakcie
Súbežné podávanie osilodrostatu s inými liekmi, o ktorých je známe, že ovplyvňujú interval QT, môže
môže mať za následok predĺženie QT u pacientov so známymi poruchami srdcového rytmu (pozri
časti 4.4 a 5.1). Pri prechode z iných liekov, o ktorých je známe, že ovplyvňujú interval QT, ako je pasireotid alebo ketokonazol, sa má zvážiť obdobie pre elimináciu lieku.
Účinky iných liekovna farmakokinetiku osilodrostatu
Potenciál pre klinické liekové interakcie (drug-drug interactions, DDI) so súbežne podávanými
liekmi, ktoré inhibujú transportéry alebo len jeden CYP alebo UGT enzým, je nízky (pozri časť 5.2).
Silné inhibítory enzýmov
Opatrnosť sa odporúča, keď sa počas liečby osilodrostatom začína alebo končí liečba súbežne
podávanými liekmi, ktoré silne inhibujú viaceré enzýmy (pozri časť 4.4).
Silné induktory enzýmov
Opatrnosť sa odporúča, keď sa počas liečby osilodrostatom začína alebo končí liečba súbežne
podávanými liekmi, ktoré silne indukujú viaceré enzýmy (napr. rifampín) (pozri časť 4.4).
Účinky osilodrostatu na farmakokinetiku iných liekov
Pretože osilodrostat a jeho hlavný metabolit M34.5 môžu inhibovať a/alebo indukovať viac enzýmov a
transportérov, odporúča sa celková opatrnosť, keď sa osilodrostat podáva súbežne s citlivými
substrátmi enzýmov alebo transportérov s úzkym terapeutickým indexom. Dostupné údaje o interakciách sú zhrnuté ďalej (pozri tiež časť 5.2).
Kl i ni cké š túdie
V štúdii so zdravými dobrovoľníkmi (n=20), v ktorej sa použila jednorazová dávka 50 mg osilodrostatu a zmes skúmaných liečiv, sa zistilo, že osilodrostat je slabý inhibítor CYP2D6 a
CYP3A4/5, slabý až stredne silný inhibítor CYP2C19 a stredne silný inhibítor CYP1A2.
- CYP2D6 – pomery geometrických priemerov AUC boli 1,5 pre dextrometorfán (substrát
CYP2D6) keď sa podával s osilodrostatom v porovnaní so samostatným podaním
- CYP3A4 – pomery geometrických priemerov AUC boli 1,5 pre midazolam (substrát CYP3A4)
keď sa podával s osilodrostatom v porovnaní so samostatným podaním
- CYP2C19 – pomery geometrických priemerov AUC boli 1,9 pre omeprazol (substrát
CYP2C19) keď sa podával s osilodrostatom v porovnaní so samostatným podaním. In vitro bol však pozorovaný signál časovo závislej inhibície, dôsledok po opakovanom podaní nie je jasný. Osilodrostat sa má používať s opatrnosťou, keď sa podáva súbežne s citlivými substrátmi CYP2C19 s úzkym terapeutickým indexom
- CYP1A2 – pomery geometrických priemerov AUC boli 2,5 pre kofeín (substrát CYP1A2) keď
sa podával s osilodrostatom alebo samostatne. In vitro bol však pozorovaný signál CYP1A2
indukcie, dôsledok po opakovanom podaní nie je jasný. Osilodrostat sa má používať
s opatrnosťou, keď sa podáva súbežne s citlivými substrátmi CYP1A2 s úzkym terapeutickým indexom, napr. teofylínom a tizanidínom.
V štúdii so zdravými dobrovoľníčkami (n=24) nemal osilodrostat (30 mg dvakrát denne počas 7 dní pred súbežným podávaním kombinovanej perorálnej antikoncepcie obsahujúcej 0,03 mg etinylestradiolu a 0,15 mg levonorgestrelu a potom ďalších 5 dní) klinicky významný účinok na AUC a Cmax etinylestradiolu (pomer geometrických priemerov: 1,03 a 0,88 v uvedenom poradí) a AUC levonorgestrelu (pomer geometrického priemeru: 1,02). Cmax levonorgestrelu mierne klesla mimo prijateľného rozsahu bioekvivalencie (pomer geometrických priemerov: 0,86; 90% interval spoľahlivosti: 0,737-1,00). Účinky dlhšieho obdobia indukcie a interakcia s inými hormonálnymi kontraceptívami sa neskúmali (pozri tiež časti 4.4 a 4.6).
Údaje in vitro
Údaje in vitro pre osilodrostat a jeho hlavný metabolit M34.5 naznačujú inhibičný aj indukčný potenciál pre CYP1A2, CYP2B6 a CYP3A4/5, potenciál pre časovo závislú inhibíciu CYP2C19 a inhibičný potenciál pre CYP2E1 a UGT1A1. Nedá sa vylúčiť, že osilodrostat môže ovplyvniť expozíciu citlivých substrátov pre tieto enzýmy.
Údaje in vitro pre osilodrostat a jeho hlavný metabolit M34.5 naznačujú inhibičný potenciál pre OATP1B1, OCT1, OCT2, OAT1, OAT3 a MATE1. Nedá sa vylúčiť, že osilodrostat môže ovplyvniť expozíciu citlivých substrátov pre tieto transportéry.
4.6 Fertilita, gravidita a laktácia
Ž
eny vo fertilnom veku
Podľa predklinických údajov osilodrostat môže spôsobiť poškodenie plodu, keď sa podáva gravidnej
žene. U žien vo fertilnom veku sa pred začatím liečby odporúča vykonať test na graviditu. Ženy
vo fertilnom veku musia používať účinnú antikoncepciu počas liečby a najmenej jeden týždeň
po liečbe. Ak sa používajú iné hormonálne kontraceptíva ako perorálna kombinácia etinylestradiolu a levonorgestrelu, odporúča sa použiť ďalšiu bariérovú metódu antikoncepcie (pozri časť 4.5).
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití osilodrostatu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Isturisa sa nemá užívať počas
gravidity a u žien vo fertilnom veku nepoužívajúcich antikoncepciu.
Dojčenie
Nie je známe, či sa osilodrostat alebo jeho metabolity vylučujú do ľudského mlieka. Riziko
u novorodencov/dojčiat nemôže byť vylúčené. Dojčenie má byť počas liečby Isturisou a najmenej
jeden týždeň po liečbe ukončené.
Fertilita
Nie sú informácie o účinku osilodrostatu na fertilitu u ľudí. Štúdie na zvieratách ukázali účinky
na menštruačný cyklus a zníženie fertility u samíc potkana (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Isturisa môže mať malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacientov je potrebné upozorniť na možné závraty a únavu (pozri časť 4.8) a odporučiť im, aby neviedli vozidlá a neobsluhovali stroje, ak sa tieto symptómy vyskytnú.
4.8 Nežiaduce účinky
Zhrnutie profilu bezpečnosti
Najčastejšie nežiaduce reakcie hlásené v pivotnej štúdii fázy III s osilodrostatom boli insuficiencia
nadobličiek (51 %), únava (44 %), edém (21 %), vracanie (22 %), nauzea (42 %) a bolesť hlavy
(34 %).
Najzávažnejšou nežiaducou reakciou spojenou s použitím osilodrostatu je insuficiencia nadobličiek
(pozri aj časti 4.2 a 4.4).
T
abuľkový zoznamnežiaducichreakcií
Nežiaduce reakcie na liek (tabuľka 1) sú usporiadané podľa tried orgánových systémov MedDRA.
V rámci každej triedy orgánových systémov sú nežiaduce reakcie na liek zoradené podľa frekvencie, najčastejšie ako prvé. V rámci každej skupiny frekvencií sú nežiaduce reakcie na liek zoradené podľa klesajúcej závažnosti. Okrem toho sa zodpovedajúca kategória frekvencií každej nežiaducej reakcie na liek zakladá na nasledujúcej konvencii (CIOMS III): veľmi časté (≥ 1/10); časté (≥ 1/100 až
< 1/10); menej časté (≥ 1/1 000 až< 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé
(< 1/10 000).
Tabuľka 1 Nežiaduce reakcie na liek
T
rieda orgánových systémov Kategória
f
rekvencie
P
re
f
e
r
ovaný názov*
Poruchy endokrinného systému Veľmi časté Insuficiencia nadobličiek
Poruchy metabolizmu a výživy Veľmi časté Hypokaliémia, znížená chuť do jedenia
Poruchy nervového systému Veľmi časté Závraty, bolesť hlavy
Časté Synkopa Poruchy srdca a srdcovej činnosti Časté Tachykardia Poruchy ciev Veľmi časté Hypotenzia
Poruchy gastrointestinálneho traktu Veľmi časté Vracanie, nauzea, hnačka, bolesť brucha
Poruchy kože a podkožného tkaniva Veľmi časté Exantém
Časté Hirsutizmus**, akné**
Celkové poruchy a reakcie v mieste podania
Veľmi časté Únava, edém
Časté Celková nevoľnosť

Laboratórne a funkčné vyšetrenia Veľmi časté Zvýšenie testosterónu v krvi**, zvýšenie
kortikotropínu v krvi
Časté Predĺženie QT na elektrokardiograme,
zvýšenie aminotransferáz
* Niektoré názvy označujú skupinový názov dvoch alebo viacerých názvov preferovaných MedDRA, ktoré sa považovali za klinicky podobné. Označenie „insuficiencia nadobličiek“ zahŕňa deficit glukokortikoidov, akútnu insuficienciu kôry nadobličiek, syndróm z vysadenia steroidov, zníženie voľného kortizolu v moči, zníženie kortizolu.
** Frekvencia „veľmi časté“ u pacientov ženského pohlavia.
OpisvybranýchnežiaducichreakciíInhibícia CYP11B1 osilodrostatom sa spája s akumuláciou prekurzorov steroidov nadobličiek a
zvýšením testosterónu. V klinickej štúdii s osilodrostatom sa priemerné koncentrácie testosterónu
u pacientok zvýšili z východiskových vysokých normálnych hodnôt na hodnoty nad hornou hranicou
normálneho rozmedzia. Zvýšenie sa zvrátilo, keď sa liečba prerušila. Zvýšenie testosterónu sa
v podskupine pacientov spájalo s ľahkými až stredne závažnými prípadmi hirsutizmu alebo akné.
Hodnoty ACTH nad 10-násobkom hornej hranice normálu boli pozorované u niektorých pacientov
s Cushingovou chorobou liečených osilodrostatom v klinických štúdiách (pozri časť 5.1) a môžu byť
spojené s hodnotami kortizolu pod dolnou hranicou normálu.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 Predávkovanie
Predávkovanie môže spôsobiť závažný hypokortizolizmus. Prejavy a príznaky naznačujúce hypokortizolizmus môžu zahŕňať nauzeu, vracanie, únavu, nízky tlak krvi, bolesť brucha, stratu chuti do jedenia, závraty a synkopu.
V prípade podozrenia na predávkovanie sa má Isturisa vysadiť, majú sa skontrolovať koncentrácie kortizolu a ak je to potrebné, má sa začať suplementácia kortikosteroidov. Môže byť potrebné
dôsledné sledovanie vrátane monitorovania intervalu QT, krvného tlaku, glukózy, rovnováhy tekutín a
elektrolytov, až kým sa stav pacienta stabilizuje.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antikortikosteroidy, ATC kód: H02CA02
Mechanizmus účinku
Osilodrostat je inhibítor syntézy kortizolu. Účinne inhibuje 11β-hydroxylázu (CYP11B1), enzým
zodpovedný za posledný krok biosyntézy kortizolu v nadobličkovej žľaze.
Inhibícia CYP11B1 sa spája s akumuláciou prekurzorov, napr. 11-deoxykortizolu, a zrýchlením biosyntézy v nadobličkách, vrátane androgénov. Pri Cushingovej chorobe pokles koncentrácie kortizolu v plazme stimuluje aj sekréciu ACTH mechanizmom spätnej väzby, čo zrýchľuje biosyntézu steroidov (pozri časť 4.8).
Farmakodynamické účinky
V podrobnej štúdii QT (n=86 zdravých dobrovoľníkov a dobrovoľníčok) s osilodrostatom boli
maximálne rozdiely trvania intervalu QTcF oproti placebu 1,73 ms (90 % IS: 0,15; 3,31) pri dávke
10 mg a 25,38 ms (90 % IS: 23,53; 27,22) pri supraterapeutickej dávke 150 mg. Na základe interpolácie týchto výsledkov sa odhaduje, že priemerné maximálne predĺženie pri najvyššej odporúčanej dávke 30 mg je +5,3 ms.
Klinická účinnosťabezpečnosť
Účinnosť a bezpečnosť osilodrostatu u pacientov s Cushingovou chorobou sa vyhodnotili
v prospektívnej štúdii fázy III (štúdia C2301), v ktorej sa použilo usporiadanie randomizovaného vysadenia liečby. Štúdia pozostávala z 26-týždňového obdobia otvorenej liečby osilodrostatom
v jednej skupine, po ktorom nasledovalo 8-týždňové obdobie randomizovaného vysadenia liečby, keď
boli pacienti randomizovaní v pomere 1:1 buď na podávanie osilodrostatu, alebo placeba, a
následného obdobia otvorenej liečby osilodrostatom.
Kritériá pre zaradenie do štúdie zahŕňali Cushingovu chorobu (s potvrdením hypofýzy ako zdroja nadbytku adrenokortikotropného hormónu) a priemernú hodnotu voľného kortizolu v moči (mean urinary free cortisol, mUFC, odvodenú z troch hodnôt v moči zozbieranom za 24 hodín) väčšiu ako
1,5-násobok hornej hranice normálu (upper limit of normal, ULN) pri skríningu.
Celkovo bolo do štúdie zaradených 137 dospelých pacientov. Priemerný vek bol 41,2 rokov a väčšinu
tvorili pacientky (77 %). Sedem pacientov bolo vo veku 65 rokov alebo starších. Predchádzajúca
liečba zahŕňala operáciu hypofýzy u 88 % pacientov a predchádzajúcu medikamentóznu liečbu u 75 %
pacientov. Priemer a medián východiskových koncentrácií mUFC boli 1006,0 nmol/24 h a
476,4 nmol/24 h, v uvedenom poradí (ULN: 138 nmol/24 h). K sprievodným ochoreniam pri zaradení do štúdie patrili hypertenzia (67,9 % pacientov), obezita (29,9 %), diabetes mellitus (21,9 %) a osteoporóza (27,7 %).
Pacienti dostali začiatočnú dávku 2 mg osilodrostatu dvakrát denne a dávka sa mohla titrovať nahor
na základe individuálnej odpovede a znášanlivosti počas začiatočného 12-týždňového obdobia.
Pacienti bez ďalšieho zvyšovania dávky počas nasledujúcich 12 týždňov a s mUFC ≤ULN v 24. týždni boli randomizovaní v 26. týždni v pomere 1:1 na podávanie buď osilodrostatu, alebo zodpovedajúceho placeba počas 8 týždňov (obdobie dvojito zaslepeného randomizovaného vysadenia liečby),
po ktorých nasledovalo otvorené podávanie osilodrostatu počas zvyšku štúdie. V 26. týždni bolo
71 pacientov randomizovaných v pomere 1:1 na ďalšie podávanie osilodrostatu (n=36), alebo prechod na placebo (n=35). Pacienti, ktorí v 24. týždni nespĺňali kritériá pre randomizáciu (n=47), pokračovali
v otvorenej liečbe osilodrostatom.
Primárnym cieľom bolo porovnať podiel pacientov s kompletnou odpoveďou na liečbu v 34. týždni (koniec 8-týždňového obdobia randomizovaného vysadenia liečby) medzi pacientmi randomizovanými na pokračujúcu aktívnu liečbu a na placebo. Pre primárny cieľový ukazovateľ bola kompletná odpoveď definovaná ako hodnota mUFC ≤ULN v 34. týždni. Pacienti, ktorých dávka sa zvyšovala počas obdobia randomizovaného vysadenia liečby alebo ktorí prerušili randomizovanú liečbu, sa považovali za pacientov bez odpovede. Kľúčovým sekundárnym cieľovým ukazovateľom bol podiel kompletných odpovedí v 24. týždni. Pacienti, ktorých dávka sa zvyšovala medzi 12. a
24. týždňom a pacienti bez platného stanovenia mUFC v 24. týždni sa pre kľúčový sekundárny cieľový ukazovateľ rátali ako pacienti bez odpovede.
Štúdia splnila svoj primárny a kľúčový sekundárny cieľový ukazovateľ (tabuľka 2).
Medián koncentrácií mUFC sa znížil na 62,5 nmol/24 h (zmena oproti východiskovej hodnote -84,1 %, n=125) v 12. týždni, na 75,5 nmol/24 h (-82,3 %, n=125) v 24. týždni a na 63,3 nmol/24 h (-87,9 %, n=108) v 48. týždni.
Tabuľka 2 Kľúčové výsledky: štúdia fázy III s pacientmi s Cushingovou chorobou (štúdia
C2301)
P
r
i
m
árny cieľový ukazovateľ: Podiel pacientov s odpoveďou na liečbu na konci obdobia
randomizovaného vysadenia liečby
(34. týždeň) n (%) (95 % IS)
Osilodrostat
n=36
31 (86,1) (70,5; 95,3)
Placebo
n=34
10 (29,4) (15,1; 47,5)
R
ozdiel podielov s odpoveďou na liečbu (pomer pravdepodobnosti): osilodrostat oproti placebu
Sekundárne cieľové ukazovatele
13,7 (3,7; 53,4)
2-stranná hodnota p <0,001
Všetci pacienti
N=137
Kľúčový sekundárny cieľový ukazovateľ: Podiel pacientov s mUFC
≤ULN po 24. týždni a bez zvýšenia dávky po 12. týždni (95 % IS)
72 (52,6 %) (43,9; 61,1)

Podiel kompletných odpovedí mUFC (mUFC ≤ULN) v 48. týždni 91 (66,4 %) (57,9; 74,3)
Medián hodnoty mUFC a percentuálna zmena v 48. týždni 63,3 nmol/24 h (-87,9 %) mUFC: priemerná hodnota voľného kortizolu v moči; ULN: horná hranica normálu; IS: interval spoľahlivosti; odpoveď: mUFC ≤ULN.
Zlepšenie sa pozorovalo pri kardiovaskulárnych a metabolických parametroch (tabuľka 3) a 85,6 % pacientov, ktorých hodnotenie je k dispozícii, vykazovalo zlepšenie aspoň jedného fyzického znaku Cushingovej choroby v 48. týždni.
Tabuľka 3 Kardiovaskulárne a metabolické parametre
V
ýchodisková
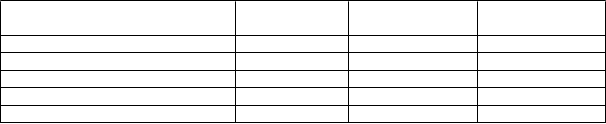 hodnota
24. týždeň 48. týždeň
hodnota
24. týždeň 48. týždeň
Systolický tlak krvi (mmHg) 132,2 124,9 (-4,1 %) 121,7 (-6,8 %) Diastolický tlak krvi (mmHg) 85,3 81,0 (-3,8 %) 78,9 (-6,6 %) Telesná hmotnosť (kg) 80,8 77,3 (-3,0 %) 75,5 (-4,6 %) Obvod pásu (cm) 103,4 99,1 (-2,6 %) 97,4 (-4,2 %) HbA1c (%) 6,0 5,6 (-4,6 %) 5,6 (-5,4 %)'
Liečba osilodrostatom mala za následok aj zlepšenie hodnotení hlásených pacientmi. Zlepšenia oproti
východiskovým hodnotám nad stanoveným minimálnym významným rozdielom (minimal important difference, MID) sa pozorovali pri kvalite života pri Cushingovej chorobe (celkové skóre, podstupnica Physical Problems a podstupnica Psychosocial Issues), skóre EQ-5D Utility index a BDI-II (depresia). Priemerné celkové skóre kvality života pri Cushingovej chorobe sa zlepšilo z východiskovej hodnoty
42,2 na 58,3 (+14,1; zmena oproti východiskovej hodnote +52,4 %) v 48. týždni.
Účinnosť osilodrostatu sa hodnotila aj v štúdii C1201 u deviatich dospelých japonských pacientov
s Cushingovým syndrómom, ktorého príčiny nesúviseli s hypofýzou. Štúdia, do ktorej boli zaradení pacienti s adenómom nadobličiek (n=5), syndrómom ektopického kortikotropného hormónu (n=3) a makronodulárnou hyperpláziou nadobličiek nezávislou od ACTH (n=1), pozostávala z 12-týždňového obdobia titrácie dávky (začiatočná dávka 2 mg dvakrát denne), 36-týždňového obdobia udržiavacej liečby a z voliteľnej dlhodobej extenzie. V 12. týždni (primárny cieľový ukazovateľ) sa kompletná odpoveď (mUFC ≤ULN) pozorovala u 6 pacientov (66,7 %) a čiastočná odpoveď (pokles mUFC
o najmenej 50 %) u jedného ďalšieho pacienta (11,1 %). Medián priemernej dávky použitej v štúdii
bol 2,6 mg/deň (rozmedzie 1,3-7,5 mg/deň). Priemerné trvanie liečby v tejto štúdii bolo 24 týždňov
a dlhodobá expozícia bola obmedzená.
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Isturisou v jednej
alebo vo viacerých podskupinách pediatrickej populácie s hyperfunkciou kôry nadobličiek (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Osilodrostat je látka s vysokou rozpustnosťou a vysokou permeabilitou (BCS trieda 1). Rýchlo sa
absorbuje (tmax ~1 h) a predpokladá sa, že absorpcia po perorálnom podaní je u ľudí takmer úplná. Rovnovážny stav sa dosiahne do 2. dňa.
Súčasné podanie s jedlom neovplyvnilo absorpciu v klinicky významnej miere. V štúdii so zdravými dobrovoľníkmi (n=20) malo podanie jednorazovej dávky 30 mg osilodrostatu s jedlom s vysokým obsahom tuku za následok mierny pokles AUC o 11 % a Cmax o 21 % a predĺženie mediánu tmax
z 1 hodiny na 2,5 hodiny.
V klinických štúdiách sa nepozorovala klinicky významná akumulácia. Pomer akumulácie 1,3 bol
stanovený pre rozmedzie dávok 2 až 30 mg.
D
i
stribúcia
Medián zdanlivého distribučného objemu (Vz/F) osilodrostatu je približne 100 litrov. Väzba osilodrostatu a jeho hlavného metabolitu M34.5 na bielkoviny je nízka (menej ako 40 %) a nezávisí
od koncentrácie. Pomer koncentrácií osilodrostatu v krvi a plazme je 0,85.
Osilodrostat nie je substrátom pre transportéry OATP1B1 alebo OATP1B3. Biotransformácia
V štúdii ADME u ľudí sa po podaní jednorazovej dávky 50 mg [14C]-osilodrostatu zdravým osobám
považoval metabolizmus za najdôležitejšiu dráhu klírensu osilodrostatu, keďže ~80 % dávky sa
vylúčilo ako metabolity. Tri hlavné metabolity v plazme (M34.5, M16.5 a M24.9) predstavovali 51 %,
9 % a 7 % dávky, v uvedenom poradí. Oba metabolity M34.5 a M24.9 majú dlhšie polčasy ako osilodrostat a pri dávkovaní dvakrát denne sa očakáva určitá akumulácia. Zistilo sa, že zníženie príspevku osilodrostatu k AUC rádioaktivity s časom po podaní dávky sa úzko zhoduje so zodpovedajúcim zvýšením príspevku M34.5.
V moči bolo charakterizovaných trinásť metabolitov, pričom tri hlavné metabolity boli M16.5, M22 (glukuronid M34.5) a M24.9 pri 17, 13 a 11 % dávky, v uvedenom poradí. Tvorba hlavného
metabolitu M16.5 v moči (priamy N-glukuronid) bola katalyzovaná UGT1A4, 2B7 a 2B10. Menej ako
1 % dávky sa vylúčilo močom ako M34.5 (dioxygenovaný osilodrostat), ale 13 % dávky sa identifikovalo ako M22 (glukuronid M34.5). Tvorba M34.5 nebola sprostredkovaná CYP.
Na metabolizme osilodrostatu sa podieľajú viaceré enzýmy CYP a UDP-glukuronozyltransferázy a podiel ani jedného enzýmu na celkovom klírense nepredstavuje viac ako 25 %. Hlavné enzýmy CYP, ktoré sa podieľajú na metabolizme osilodrostatu, sú CYP3A4, 2B6 a 2D6. Celkový podiel CYP je 26 %, celkový podiel UGT je 19 % a metabolizmus nesprostredkovaný CYP a UGT prispel
k celkovému klírensu ~50 %. Okrem toho osilodrostat vykazoval vysokú vnútornú permeabilitu, nízky výtokový pomer a mierny vplyv inhibítorov na výtokový pomer in vitro. To naznačuje, že potenciál
pre klinické liekové interakcie pri súbežne podávaných liekoch, ktoré inhibujú transportéry alebo len jeden enzým CYP alebo UGT, je nízky.
Údaje in vitro naznačujú, že metabolity neprispievajú k farmakologickému účinku osilodrostatu. Eliminácia
Polčas eliminácie osilodrostatu je približne 4 hodiny.
V štúdii ADME sa väčšina (91 %) rádioaktívnej dávky osilodrostatu vylúčila močom a len malé množstvo (1,6 % dávky) sa vylúčilo stolicou. Nízky percentuálny podiel dávky vylúčený močom ako nezmenený osilodrostat (5,2 %) naznačuje, že metabolizmus je hlavnou dráhou klírensu u ľudí.
Linearita/nelinearita
Expozícia (AUCinf a Cmax) sa pri dávkach nad terapeutickým rozmedzím zvyšovala viac, ako bolo
úmerné dávke.
Liekové interakcie(pozritiežčasť 4.5)
Údaje in vitro naznačujú, že osilodrostat ani jeho hlavný metabolit M34.5 v klinicky relevantných
koncentráciách neinhibujú nasledujúce enzýmy a transportéry: CYP2A6, CYP2C8, CYP2C9, UGT2B7, P-gp, BCRP, BSEP, MRP2, OATP1B3 a MATE2-K. Keďže expozícia M34.5 po
opakovanom dávkovaní ešte nebola stanovená, klinický význam výsledkov in vitro liekových
interakcií pre M34.5 nie je známy.
O
sobitné populácie
Porucha f unkc ie peče ne
V štúdii fázy I s 33 osobami s rôznym stupňom funkcie pečene, ktoré užili jednorazovú dávku 30 mg osilodrostatu, AUCinf bola 1,4-násobne väčšia v skupine stredne ťažkej poruchy funkcie pečene (B podľa Childa-Pugha) a 2,7-násobne väčšia v skupine ťažkej poruchy funkcie pečene (C podľa
Childa-Pugha). Cmax bola o 15 % nižšia v skupine stredne ťažkej poruchy a o 20 % nižšia v skupine
ťažkej poruchy. Konečný polčas sa predĺžil na 9,3 hodiny v skupine stredne ťažkej poruchy a
na 19,5 hodiny v skupine ťažkej poruchy. Ľahká porucha funkcie pečene (A podľa Childa-Pugha) neovplyvnila expozíciu vo významnej miere. Rýchlosť absorpcie nebola ovplyvnená stupňom poruchy funkcie pečene.
Porucha f unkc ie obl i či ek
V štúdii fázy I s 15 osobami s rôznym stupňom funkcie obličiek, ktoré užili jednorazovú dávku 30 mg osilodrostatu, bola pozorovaná porovnateľná systémová expozícia u osôb s ťažkou poruchou funkcie obličiek, s konečným štádiom ochorenia obličiek a normálnou funkciou obličiek.
Rasa/ et ni cká prí slušnosť a t eles ná hmot nosť
Relatívna biologická dostupnosť bola vyššia o približne 20 % u ázijských pacientov v porovnaní s inými etnikami. Telesná hmotnosť sa pri tomto rozdiele nepreukázala ako významný faktor.
Vek a pohlavie
Vek a pohlavie nemali významný vplyv na expozíciu osilodrostatu u dospelých. Počet starších
pacientov v klinických štúdiách bol obmedzený (pozri časť 4.2).
5.3 Predklinické údaje o bezpečnosti
Toxicita pri opakovanom podávaní
V štúdiách toxicity pri opakovanom podávaní vykonaných na myšiach, potkanoch a psoch boli
primárnymi cieľovými orgánmi centrálny nervový systém, pečeň, samičie reprodukčné orgány a nadobličková žľaza. NOAEL pre účinky na pečeň, reprodukčné orgány a nadobličky v dlhodobých (26- a 39-týždňových) štúdiách bola najmenej štvornásobkom klinickej expozície u ľudí založenej na AUC. Zaznamenali sa nálezy na CNS (agresia, precitlivenosť na dotyk a zvýšená alebo znížená
aktivita) u potkanov, myší a psov. NOAEL pre účinky na CNS na základe najcitlivejších druhov bola
približne 2-násobkom voľnej Cmax u ľudí.
Karcinogenita a mutagenita
Stanovenia genotoxicity vykonané in vitro na bakteriálnych systémoch a in vitro a in vivo na cicavčích
systémoch s metabolickou aktiváciou alebo bez nej nenaznačujú závažné riziko pre ľudí. V štúdiách karcinogenity na potkanoch a myšiach sa pozorovala zvýšená incidencia hepatocelulárneho adenómu/karcinómu (pri nižších dávkach u samcov ako u samíc) a neoplastické zmeny folikulárneho adenómu/karcinómu štítnej žľazy (len u samcov potkana). Nálezy sú pravdepodobne špecifické
pre hlodavce a nepovažujú sa za významné pre ľudí.
Fertilita areprodukčnátoxicita
Štúdie reprodukčnej toxcity na králikoch a potkanoch preukázali embryotoxicitu, fetotoxicitu (zvýšenú
resorpciu a zníženú životaschopnosť plodov, nižšiu hmotnosť plodov, vonkajšie malformácie a
odchýlky vnútorných orgánov a kostry) a teratogenitu pri dávkach toxických pre matky. NOAEL bola
10-násobkom expozície u ľudí (AUC) v štúdii pre- a postnatálneho vývinu a 8- až 73-násobkom expozície u ľudí (AUC) v štúdii fertility a počiatočného embryonálneho vývinu u potkanov. Materská
a fetálna NOAEL bola v štúdii embryofetálneho vývoja na králikoch 0,6-násobkom expozície u ľudí
(AUC).
T
oxicita u mláďat
Nálezy v štúdiách toxicity na mláďatách potkana sa vo veľkej miere zhodovali s tými, ktoré sa
pozorovali v štúdiách na dospelých potkanoch. Spomalené pohlavné dozrievanie sa zaznamenalo pri vysokých dávkach, bez účinkov na celkovú schopnosť alebo parametre reprodukcie po 6- týždňovom období zotavenia. Nevyskytli sa účinky na rast dlhých kostí alebo na charakteristiky správania.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
Mikrokryštalická celulóza
Manitol
Sodná soľ kroskarmelózy
Stearan horečnatý
Koloidný oxid kremičitý bezvodý
Filmový obal tablety
Hypromelóza
Oxid titaničitý (E171) Makrogol
Mastenec
1 mg tableta
Žltý oxid železitý (E172)
Červený oxid železitý (E172)
5 mg tableta
Žltý oxid železitý (E172)
10 mg tableta
Žltý oxid železitý (E172)
Červený oxid železitý (E172)
Čierny oxid železitý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 25 °C. Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
Al/Al blister s 10 tabletami.
Balenie obsahujúce 60 tabliet (6 blistrov po 10 tabliet).
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Írsko
8. REGISTRAČNÉ ČÍSLAIsturisa 1 mg filmom obalené tabletyEU/1/19/1407/001
Isturisa 5 mg filmom obalené tabletyEU/1/19/1407/002
Isturisa 10 mg filmom obalené tabletyEU/1/19/1407/003
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.