
ádory závislé od estrogénu (napr. karcinóm endometria).
• Neliečená hyperplázia endometria.
• Akútne ochorenie pečene alebo ochorenie pečene v anamnéze, pokiaľ sa pečeňové testy
nevrátili k normálnym hodnotám.
• Venózna trombembólia (hlboká žilová trombóza, pľúcna embólia) v anamnéze alebo súčasnosti.
• Známe trombofilné poruchy (napríklad proteín C, proteín S alebo nedostatok antitrombínu,
pozri časť 4.4).
• Arteriálne trombembolické ochorenie (napríklad angína, infarkt myokardu) – aktívne alebo
v nedávnej minulosti.
• Porfýria.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pri liečbe postmenopauzálnych príznakov sa má Intrarosa nasadiť len na príznaky, ktoré nepriaznivo ovplyvňujú kvalitu života. Vo všetkých prípadoch sa majú minimálne každých 6 mesiacov dôkladne posudzovať riziká a prínosy, a v liečbe Intrarosou sa má pokračovať len vtedy, ak na základe rozhovoru s lekárom prínos prevažuje nad rizikom.
Pred začatím liečby Intrarosou sa musí odobrať kompletná osobná a rodinná anamnéza. Fyzikálne
vyšetrenie (vrátane vyšetrenia panvy a prsníkov) sa má riadiť týmito ustanoveniami,
kontraindikáciami a osobitnými upozorneniami a opatreniami pri používaní podľa rozhodnutia lekára. Počas liečby sa odporúčajú pravidelné kontroly; frekvencia a typ kontroly sa má individuálne
prispôsobiť. Ženy treba upozorniť, aké zmeny v prsníkoch majú nahlásiť svojmu lekárovi alebo
zdravotnej sestre (pozri nižšie „Karcinóm prsníka“). Vyšetrenia, vrátane Pap-sterov a merania krvného tlaku, sa majú vykonávať v súlade s bežne akceptovanými skríningovými postupmi, ktoré sú
prispôsobené klinickým potrebám jednotlivca.
Stavy, ktoré si vyžadujú sledovanie
• Pacientku treba dôkladne sledovať, ak je ktorýkoľvek z nasledujúcich stavov prítomný alebo sa
vyskytol v minulosti a/alebo sa zhoršil počas tehotenstva alebo predchádzajúcej hormonálnej
liečby. Treba vziať do úvahy, že sa tieto stavy môžu počas liečby Intrarosou opakovať alebo zhoršiť, najmä:
– leiomyóm (fibroidy maternice) alebo endometrióza,
– rizikové faktory trombembolických porúch (pozri nižšie),
– rizikové faktory nádorov závislých od estrogénu, napr. 1. stupeň dedičnosti karcinómu prsníka,
– hypertenzia,
– poruchy pečene (napríklad adenóm pečene),
– diabetes mellitus s postihnutím ciev alebo bez neho,
– cholelitiáza,
– migréna alebo (závažná) bolesť hlavy,
– systémový lupus erythematosus,
– hyperplázia endometria v anamnéze (pozri nižšie),
– epilepsia,
– astma,
– otoskleróza,
Dôvodynaokamžitéukončenieliečby
Liečba sa má prerušiť v prípade vzniku kontraindikácie a v nasledujúcej situácii:
– žltačka alebo zhoršenie funkcie pečene,
– signifikantné zvýšenie krvného tlaku,
– novovzniknutá migrenózna bolesť hlavy,
– gravidita.
Hyperplázia a karcinóm endometria
• Estrogén je metabolit prasterónu. U žien s intaktnou maternicou sa riziko hyperplázie
a karcinómu endometria zvyšuje, keď sa exogénne estrogény podávajú dlhší čas. V klinických
štúdiách neboli u žien liečených počas 52 týždňov hlásené žiadne prípady hyperplázie
endometria. Intrarosa sa neskúmala u žien s hyperpláziou endometria.
• V prípade estrogénových liekov na vaginálnu aplikáciu, u ktorých systémová expozícia
estrogénu zostáva v normálnom postmenopauzálnom rozmedzí, sa neodporúča pridávať
gestagén.
• Bezpečnosť pre endometrium sa z hľadiska dlhodobého používania lokálneho, vaginálne
podávaného prasterónu nesledovala dlhšie ako jeden rok. Preto, ak sa liečba opakuje, má sa
prehodnotiť najmenej raz ročne.
• Ak sa kedykoľvek počas liečby objaví krvácanie alebo špinenie, treba zistiť príčinu – môže byť
potrebná biopsia endometria s cieľom vylúčiť malignitu.
• Neobmedzená stimulácia estrogénmi môže viesť k premalígnej alebo malígnej transformácii
vreziduálnych ložiskách endometriózy. Preto sa u žien, ktoré sa podrobili hysterektómii
z dôvodu endometriózy, odporúča opatrnosť pri používaní tohto lieku, najmä ak je známe, že majú reziduálnu endometriózu, pretože intravaginálny prasterón sa neskúmal u žien
s endometriózou.
Prasterón sa metabolizuje na estrogénové zlúčeniny. Nasledujúce riziká sa spájajú so systémovou hormonálnou substitučnou terapiou (hormone replacement therapy, HRT) a v menšom rozsahu sa vzťahujú na estrogénové produkty na vaginálnu aplikáciu, pri ktorých systémová expozícia estrogénu zostáva v normálnom postmenopauzálnom rozmedzí. Treba ich však vziať do úvahy v prípade dlhodobého alebo opakovaného používania tohto lieku.
Karcinóm prsníka
Celkové dôkazy poukazujú na zvýšené riziko karcinómu prsníka u žien používajúcich systémovú HRT s obsahom kombinácie estrogén-gestagén a pravdepodobne aj systémovú HRT, ktorá obsahuje len estrogény; riziko závisí od dĺžky používania HRT. Dodatočne zvýšené riziko sa prejaví v priebehu
niekoľkých rokov používania, ale vráti sa k východiskovým hodnotám v priebehu niekoľkých (najviac piatich) rokov po ukončení liečby.
Intrarosa sa neskúmala u žien s aktívnym karcinómom prsníka ani u žien s karcinómom prsníka
v anamnéze. U 1 196 žien, ktoré boli vystavené dávke 6,5 mg, bol v 52. týždni hlásený jeden prípad karcinómu prsníka, čo je menej ako incidencia pozorovaná u normálnej populácie rovnakého veku.
Karcinóm ovárií
Karcinóm ovárií je oveľa zriedkavejší ako karcinóm prsníka.
Epidemiologické dôkazy z rozsiahlej metaanalýzy naznačujú, že u žien, ktoré užívajú systémovú HRT
obsahujúcu iba estrogén, existuje mierne zvýšené riziko, ktoré sa prejaví do piatich rokov užívania a po vysadení liečby sa postupne znižuje.
Intrarosa sa neskúmala u žien s aktívnym karcinómom prsníka ani u žien s karcinómom vaječníkov v anamnéze. U 1 196 žien, ktoré boli vystavené dávke 6,5 mg, bol hlásený jeden prípad karcinómu ovárií, čo je viac ako je incidencia pozorovaná u normálnej populácie rovnakého veku. Pozoruhodné je, že tento prípad bol prítomný už pred začatím liečby a bol spojený s mutáciou BRCA1.
Abnormálne výsledky Pap-steru
Intrarosa sa neskúmala u žien s abnormálnymi alebo horšími výsledkami Pap-steru (atypické
skvamózne bunky neurčeného významu – atypical squamous cells of undetermined significance, ASCUS). U žien liečených dávkou 6,5 mg boli hlásené prípady abnormálnych výsledkov Pap-sterov, zodpovedajúcich ASCUS alebo skvamóznej intraepitelovej lézii nízkeho stupňa (low grade squamous intraepithelial lesion, LSIL).
Venózna trombembólia
Intrarosa sa neskúmala u žien s trombembolickou chorobou v súčasnosti alebo v anamnéze.
• Systémová HRT sa spája s 1,3 – 3-násobným rizikom vzniku venóznej trombembólie (VTE), t. j.
hlbokej žilovej trombózy alebo pľúcnej embólie. Výskyt takejto udalosti je pravdepodobnejší
v prvom roku HRT než neskôr (pozri časť 4.8).
• Pacientky so známymi trombofilnými stavmi majú zvýšené riziko VTE a HRT môže toto riziko
zvýšiť. Preto je HRT u týchto pacientok kontraindikovaná (pozri časť 4.3).
• Všeobecne známe rizikové faktory VTE sú používanie estrogénov, vyšší vek, veľké chirurgické
zákroky, dlhšia imobilizácia, obezita (BMI > 30 kg/m2), tehotenstvo/popôrodné obdobie,
systémový lupus erythematosus (SLE) a rakovina. Neexistuje konsenzus o možnej úlohe varixov v prípade VTE.
Tak ako u všetkých pooperačných pacientov, aj v tomto prípade je potrebné zvážiť profylaktické
opatrenia, aby sa zabránilo vzniku VTE po operácii. Ak má po elektívnej operácii nasledovať
dlhšia imobilizácia, odporúča sa dočasne vysadiť HRT 4 až 6 týždňov pred operáciou. Liečba sa môže opäť nasadiť len vtedy, keď je pacientka úplne mobilizovaná.
• Ženám, ktoré nemajú v osobnej anamnéze VTE, ale majú príbuzného 1. stupňa s anamnézou
trombózy v mladom veku, možno ponúknuť skríning, ale až po dôkladnom poradenstve týkajúcom
sa jeho obmedzení (skríning umožňuje identifikáciu len určitého podielu trombofilných defektov). Ak sa identifikuje trombofilná porucha, ktorá sa u rodinných príslušníkov prejavuje trombózou,
alebo ak je porucha závažná (napr. nedostatok antitrombínu, proteínu S alebo proteínu C alebo kombinácia porúch), HRT je kontraindikovaná.
• U žien s chronickou antikoagulačnou liečbou je nevyhnutné dôkladne zvážiť prínos a riziko
použitia HRT.
• Ak na začiatku liečby objaví VTE, liek sa má vysadiť. Pacientky treba poučiť, aby okamžite
kontaktovali svojho lekára, ak si všimnú možné symptómy trombembólie (napríklad bolestivý
opuch nohy, náhla bolesť v hrudníku, dyspnoe).
Počas klinických štúdií bol hlásený jeden prípad pľúcnej embólie v skupine s dávkou 6,5 mg a jeden v skupine s placebom.
K
oronárna choroba (coronary artery disease, CAD)/hypertenzia
Intrarosa sa neskúmala u žien s nekontrolovanou hypertenziou (krvný tlak nad 140/90 mmHg)
a kardiovaskulárnou chorobou. V klinických štúdiách boli hlásené prípady hypertenzie s frekvenciou
„menej časté“ a podobná frekvencia výskytu sa pozorovala v oboch skupinách (6,5 mg prasterónu a
placebo). Počas klinických štúdií nebol hlásený žiadny prípad koronárnej choroby.
Ischemická mozgová príhoda
Systémová terapia obsahujúca len estrogény sa spája až s 1,5-násobným zvýšením rizika ischemickej mozgovej príhody. Relatívne riziko sa nemení ani s vekom ani s časom od menopauzy. Ale keďže
základné riziko mozgovej príhody veľmi závisí od veku, celkové riziko mozgovej príhody u žien,
ktoré užívajú HRT, bude stúpať s vekom (pozri časť 4.8).
Intrarosa sa neskúmala u žien s trombembolickou chorobou v súčasnosti alebo v anamnéze. Počas
klinických štúdií neboli hlásené žiadne prípady arteriálnej tromboembolickej choroby.
Ďalšie stavy pozorované pri HRT
• Estrogény môžu spôsobiť retenciu tekutín, preto je potrebné pozorne sledovať pacientky
s poruchou funkcie srdca alebo obličiek.
• Ženy s hypertriacylglycerolémiou je potrebné počas estrogénovej alebo hormonálnej
substitučnej liečby dôkladne sledovať, pretože boli počas estrogénovej liečby v tomto stave
hlásené zriedkavé prípady výrazného zvýšenia plazmatických triacylglycerolov, čo viedlo
ku pankreatitíde.
• Estrogény zvyšujú hladinu globulínu viažuceho tyroxín (thyroxine binding globulin, TBG), čo
vedie k zvýšenej hladine celkového voľného hormónu štítnej žľazy, čo sa zistilo stanovením
jódu viazaného na bielkoviny (protein-bound inodine, PBI), hladiny T4 (chromatografiou alebo rádioimunoanalýzou) alebo hladiny T3 (rádioimunoanalýzou). Znižuje sa vychytávanie T3 živicou (T3 resin uptake), čo je odrazom zvýšenia TBG. Koncentrácie voľného T4 a voľného T3 sú nezmenené. V sére môžu byť zvýšené iné väzobné proteíny, napríklad globulín viažuci kortikosteroidy (corticoid binding globulin, CBG), globulín viažuci pohlavné hormóny (sex- hormone binding globulin, SHBG), čo vedie k zvýšeným hladinám cirkulujúcich kortikosteroidov resp. pohlavných hormoónov. Koncentrácie voľných alebo biologicky akítvnych hormónov zostávajú nezmenené. Môžu byť zvýšené aj hladiny iných plazmatických bielkovín (substrát angiotenzinogén/renín, alfa-I-antitrypsín, ceruloplazmín).
• HRT nezlepšuje kognitívne funkcie. Existujú určité dôkazy o zvýšenom riziku pravdepodobnej
demencie u žien, ktoré po dosiahnutí veku 65 rokov začínajú používať kontinuálnu HRT – buď
kombinovanú alebo obsahujúcu iba estrogén.
Počas klinických štúdií s Intrarosou sa nepozorovali žiadne z týchto príznakov.
Ženy s vaginálnou infekciou sa majú pred začatím používania Intrarosy liečiť vhodnou antimikrobiálnou liečbou.
Počas liečby sa môže vyskytnúť výtok spôsobený topením tuhého tukového základu lieku
a očakávaným zvýšením vaginálnej sekrécie v dôsledku liečby; nie je to však dôvod na ukončenie liečby (pozri časť 4.8).
Intrarosa sa nemá používať spolu s kondómom, vaginálnym pesarom alebo cervikálnym klobúčikom, pretože tento liek môže poškodzovať latex.
Intrarosa sa neskúmala u žien, ktoré sa liečia hormonálnou liečbou: HRT (samotnými estrogénmi alebo v kombinácii s gestagénmi) alebo liečbou androgénmi.
4.5 Liekové a iné interakcie
Súbežné používanie so systémovou HRT (samotnými estrogénmi, kombináciou estrogén-gestagén
alebo liečbou androgénmi) alebo vaginálnymi estrogénmi sa neskúmalo, a preto sa neodporúča.
4.6 Fertilita, gravidita a laktácia
G
r
avidita
Intrarosa nie je indikovaná u premenopauzálnych žien vo fertilnom veku vrátane tehotenstva.
Ak počas liečby Intrarosou dôjde ku gravidite, liečba sa musí okamžite vysadiť. Nie sú k dispozícii
žiadne údaje o použití Intrarosy u gravidných žien.
Čo sa týka reprodukčnej toxicity – nevykonali sa žiadne štúdie na zvieratách (pozri časť 5.3). Potenciálne riziko pre ľudí nie je známe.
Dojčenie
Intrarosa nie je indikovaná počas dojčenia.
Fertilita
Intrarosa nie je indikovaná u žien vo fertilnom veku.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Intrarosa nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Najčastejšie pozorovaným nežiaducim účinkom bol vaginálny výtok, ktorý je spôsobený roztopením tuhého tuku použitého vo funkcii vehikula a očakávaným zvýšením vaginálnej sekrécie v dôsledku liečby. Keď sa vaginálny výtok objaví, nie je nutné vysadiť liečbu Intrarosou (pozri časť 4.4).
Tabuľkovýzoznamnežiaducichúčinkov
Nežiaduce účinky pozorované v klinických štúdiách pri používaní vaginálnych čapíkov s obsahom
6,5 mg prasterónu sú uvedené nižšie.
T
rieda orgánových systémov podľa databázy MedDRA Celkové poruchy a reakcie
v mieste podania
Poruchy reprodukčného
systému a prsníkov
Laboratórne a funkčné
vyšetrenia
Časté
(≥ 1/100 až < 1/10)
výtok v mieste aplikácie
abnormálne výsledky Pap- steru (väčšinou ASCUS alebo LGSIL)
kolísanie hmotnosti
Menej časté
(> 1/1 000 až < 1/100)
polypy krčka/maternice, hrčky v prsníku (benígne)
 R
i
z
i
ko karcinómu prsníka
R
i
z
i
ko karcinómu prsníka
• U žien, ktoré užívajú kombinovanú estrogénovo-gestagénovú HRT viac ako 5 rokov sa udáva
až 2-násobné zvýšenie rizika diagnózy karcinómu prsníka.
• Akékoľvek zvýšené riziko u pacientok liečených samotnými estrogénmi je podstatne nižšie ako
u riziko u pacientok liečených kombináciou estrogén-gestagén.
• Veľkosť rizika závisí od dĺžky užívania (pozri časť 4.4).
• Uvádzame výsledky najväčšej randomizovanej placebom kontrolovanej štúdie (štúdie WHI)
a najväčšej epidemiologickej štúdie (MWS).
Million Women study – odhadované dodatočné riziko karcinómu prsníka po 5 rokoch užívania
Dodatočné
prípady na 1 000
Vek
(roky)
pacientok, ktoré nikdy neužívali HRT počas
5 rokov* 1
Risk ratio
a 95 % CI#
Dodatočné prípady na 1 000 pacientok liečených HRT počas 5 rokov
(95 % CI)
H
R
T obsahujúca iba estrogény
50 – 65 9 – 12 1,2 1 – 2 (0 – 3)
# Celkové risk ratio. Risk ratio nie je konštantné, ale sa bude zvyšovať s dĺžkou užívania.
Poznámka: Vzhľadom na to, že východisková incidencia karcinómu prsníka sa v jednotlivých krajinách EÚ líši, proporcionálne sa zmení aj počet dodatočných prípadov karcinómu prsníka.
US WHI štúdie – dodatočné riziko rakoviny prsníka po 5 rokoch užívania
Vek
(roky)
Incidencia na 1 000 žien
v skupine s placebom počas
5 rokov
Risk ratio a 95 % CI
Dodatočné prípady na 1 000 pacientok liečených HRT počas 5 rokov (95 % CI)
T
erapia obsahujúca iba CEE estrogény
50 – 79 21 0,8 (0,7 – 1,0) -4 (-6 – 0)* 2
Karcinóm ovárií
Užívanie HRT obsahujúcej iba estrogény alebo kombináciu estrogén-gestagén sa spája s mierne zvýšeným rizikom diagnózy karcinómu ovárií (pozri časť 4.4)
Metaanalýzou 52 epidemiologických štúdií sa zistilo zvýšené riziko karcinómu ovárií u žien, ktoré užívali HRT v porovnaní so ženami, ktoré HRT nikdy neužívali (RR 1,43; 95 % CI 1,31 – 1,56).
U žien vo veku 50 – 54 rokov, ktoré počas 5 rokov užívajú HRT, pripadá na 2 000 žien jeden prípad naviac. U približne 2 žien z 2 000 vo veku 50 – 54 rokov, ktoré neužívajú HRT, bude v priebehu 5 rokov diagnostikovaný karcinóm ovárií.
Riziko venóznej trombembólie
HRT sa spája s 1,3 – 3-násobným zvýšením relatívneho rizika vzniku venóznej trombembólie (VTE), t. j. hlbokej žilovej trombózy alebo pľúcnej embólie. Výskyt takejto udalosti je pravdepodobnejší
v prvom roku užívania HRT (pozri časť 4.4). Uvádzame výsledky štúdií WHI:
Štúdie WHI – dodatočné riziko VTE počas 5 rokov užívania
Vek
(roky)
Incidencia
na 1 000 žien v skupine
s placebom počas 5 rokov
Risk ratio a 95 % CI
Dodatočné prípady na 1 000 pacientok liečených HRT
R
i
z
i
ko koronárnej choroby
• Riziko koronárnej choroby je mierne zvýšené u žien starších ako 60 rokov liečených
kombinovanou estrogén-gestagénovu HRT (pozri časť 4.4).
Riziko ischemickej mozgovej príhody
• Užívanie HRT obsahujúcej iba estrogény alebo kombináciu estrogén-gestagén je spojené až
s 1,5-násobným zvýšením relatívneho rizika ischemickej mozgovej príhody. Riziko
hemoragickej mozgovej príhody sa počas užívania HRT nezvyšuje.
• Toto relatívne riziko nezávisí od veku ani od dĺžky užívania, ale keďže základné riziko veľmi
závisí od veku, celkové riziko mozgovej príhody u žien, ktoré užívajú HRT, bude stúpať
s vekom, pozri časť 4.4.
Kombinované WHI štúdie – dodatočné riziko ischemickej mozgovej príhody* 4 počas 5 rokov užívania
Vek
(roky)
Incidencia
na 1 000 žien v skupine
s placebom počas 5 rokov
Risk ratio a 95 % CI
Dodatočné prípady na 1 000 pacientok liečených HRT počas 5 rokov

50 – 59 8 1,3 (1,1 – 1,6) 3 (1 – 5)
V súvislosti s liečbou estrogénmi/gestagénmi boli hlásené ďalšie nežiaduce účinky:
–
Ochorenie žlčníka.–
Poruchy kože a podkožného tkaniva: chloasma, erythema multiforme, erythema nodosum, vaskulárna purpura.–
Pravdepodobná demencia vo veku nad 65 rokov (pozri časť 4.4).Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce účinky prostredníctvom národného systému hlásenia uvedeného
v
prílohe V.4.9 PredávkovanieV prípade predávkovania sa odporúča vaginálny výplach.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: {skupina}, ATC kód: {kód} <zatiaľ nepridelený>
MechanizmusúčinkuIntrarosa obsahuje liečivo prasterón, t. j. dehydroepiandrosterón (DHEA), ktorý je biochemicky
a biologicky identický s endogénnym humánnym DHEA, prekurzorovým steroidom, ktorý je sám o sebe inaktívny a transformuje sa na estrogény a androgény. Intrarosa sa teda odlišuje od

estrogénových liekov, pretože poskytuje aj androgénne metabolity.
*4 Nezistil sa žiadny rozdiel medzi ischemickou a hemoragickou mozgovou príhodou.'
Vo vaginálnej sliznici sa zaznamenal sa estrogénom sprostredkovaný nárast počtu superficiálnych
a intermediárnych buniek a zníženie počtu parabazálnych buniek. Okrem toho sa pH vagíny znížilo na normálny rozsah, čo uľahčilo rast normálnej bakteriálnej flóry.
KlinickáúčinnosťFyziologické odpovede (objektívne parametre)Údaje o účinnosti sa získali z dvoch (USA a Kanada) randomizovaných, dvojito zaslepených, placebom kontrolovaných multicentrických pivotných klinických štúdií fázy III (ERC-231/Trial 1
a ERC-238/Trial 2), ktoré sa vykonali u postmenopauzálnych žien vo veku 40 až 80 rokov (priemerný vek = 58,6 rokov v Trial 1 a 59,5 roka v Trial 2) s atrofiou vulvy a vagíny (vulvar and vaginal atrophy,
VVA). Na začiatku mali ženy vo vaginálnom stere ≤ 5,0 % superficiálnych buniek, vaginálne pH ≥ 5,0
a ako najviac obťažujúci symptóm (most bothersome symptom, MBS) VVA určili dyspareuniu
(stredne závažnú až závažnú). Po 12 týždňoch dennej liečby vaginálnym čapíkom s obsahom 6,5 mg prasterónu (n = 81 v Trial 1 a n = 325 v Trial 2) bola zmena oproti východiskovej hodnote v porovnaní
s placebom (n = 77 v Trial 1 a n = 157 v Trial 2) v obidvoch štúdiách signifikantne lepšia u 3 ko-
primárnych koncových ukazovateľov (co-primary endpoints) porovnaní s placebom, konkrétne v zvýšení percenta superficiálnych buniek (p < 0,0001), znížení percenta parabazálnych buniek (p < 0,0001) a znížení vaginálneho pH (p < 0,0001).
Symptómy (subjektívne parametre)Najviac obťažujúci príznak (MBS), dyspareunia (ko-primárny koncový ukazovateľ), sa hodnotil
na začiatku liečby a po 12 týždňoch; závažnosť sa hodnotila podľa nasledujúceho skóre: žiadna = 0, mierna = 1, stredne závažná = 2, závažná = 3. V tabuľke 1 sa uvádza priemerná zmena v skóre
závažnosti MBS dyspareunie po 12 týždňoch spolu so štatistickým testovaním z hľadiska rozdielu oproti placebu v štúdii Trial 1 (ERC-231) a Trial 2 (ERC-238).
Tabuľka 1: Analýza primárnej účinnosti – zmena najviac obťažujúceho príznaku, dispareunie, z východiskovej hodnoty na hodnotu po 12. týždňoch liečby (ITT-populácia; LOCF)Štúdia Dyspareunia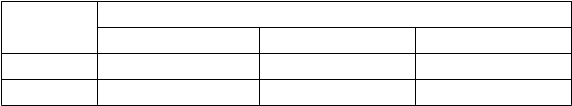 Intrarosa 6,5 mg Placebo hodnota pTrial 1
Intrarosa 6,5 mg Placebo hodnota pTrial 1 -1,27 -0,87 0,0132
Trial 2 -1,42 -1,06 0,0002
V tabuľke 2 je uvedené percento pacientok, ktoré z hľadiska MBS, dispareunie, oznámili v 12. týždni
zmenu oproti východiskovej hodnote. „Zlepšenie“ sa definovalo ako zníženie skóre závažnosti
o 1 alebo viac stupňov. „Úľava“ sa definovala ako žiadne alebo len mierne symptómy v 12. týždni.
„Podstatné zlepšenie“ sa týkalo len pacientok, ktoré mali na začiatku liečby stredne závažný alebo závažný MBS, ktorý sa zmenil zo závažného na mierny alebo zo závažného na stredne závažný alebo
žiadny.
T
abuľka 2: Percento pacientok, u ktorých sa z hľadiska MBS, dyspareunie, po 12 týždňoch liečby Intrarosou zaznamenalo zlepšenie, úľava alebo podstatné zlepšenie
oproti placebu (ITT, LOCF)
Z
l
epšenie Úľava Podstatné zlepšenie
Intrarosa Placebo Intrarosa Placebo Intrarosa Placebo
T
rial 1 (Intrarosa: n = 81) (placebo: n = 77)
Trial 2 (Intrarosa: n = 325) (placebo: n = 157)
72,8 %
(p = 0,0565)
80,3 %
(p = 0,0003)
58,4 % 58,0 %
(p = 0,0813)
65,0 % 68,6 %
(p = 0,0003)
44,2 % 43,2 %
(p = 0,0821)
51,6 % 47,1 %
(p = 0,0179)
29,9 %
35,7 %
 K
l
i
n
i
cká
bezpečnosť
K
l
i
n
i
cká
bezpečnosť
Okrem hlavných dvoch 12-týždňových klinických štúdií fázy III sa bezpečnostné údaje pre Intrarosu získali aj z jednej nekomparatívnej otvorenej bezpečnostnej štúdie trvajúcej jeden rok.
U žien liečených 6,5 mg prasterónu počas 52 týždňov boli hlásené prípady karcinómu prsníka a ovárií
(pozri časť 4.4).
U žien liečených Intrarosou počas 52 týždňov boli hlásené prípady abnormálnych výsledkov Pap- steru, buď s atypickými skvamóznymi bunkami neurčeného významu (ASCUS) alebo so skvamóznou intraepitelovou léziou nízkeho stupňa (LSIL) (pozri časť 4.4).
BezpečnosťpreendometriumZ 389 hodnotiteľných biopsií endometria realizovaných na konci štúdie, t. j. po 52 týždňoch liečby
Intrarosou, sa nezaznamenali žiadne histologické abnormality.
Pediatrická populáciaEurópska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Intrarosou vo všetkých podskupinách pediatrickej populácie.
5.2 Farmakokinetické vlastnostiAbsorpciaPrasterón podávaný vaginálne je neaktívny prekurzor, ktorý vstupuje do vaginálnych buniek
a intracelulárne sa transformuje na malé množstvo estrogénov a androgénov, ktoré je špecifické pre danú bunku, čo závisí od miery expresie enzýmov v každom type bunky. Priaznivé účinky
na prejavy a symptómy atrofie vulvy a vagíny sa prejavujú aktiváciou vaginálnych estrogénových a androgénových receptorov.
V štúdii, ktorej sa zúčastnili postmenopauzálne ženy, ktoré používali vaginálny čapík Intrarosa raz
denne počas 7 dní, bola na 7. deň liečby stredná hodnota Cmax prasterónu 4.4 ng/ml a plocha
pod krivkou od 0 do 24 hodín (AUC0-24 ) 56,2 ng.h/ml – tieto hodnoty boli významne vyššie ako
v skupine s placebom (tabuľka 3, obrázok 1). Cmax a AUC0-24 metabolitov – testosterónu a estradiolu –
boli tiež u žien liečených vaginálnym čapíkom Intrarosa mierne vyššie v porovnaní so ženami, ktoré
dostávali placebo, ale všetky zostali v rozmedzí normálnych hodnôt pre postmenopauzálne ženy (< 10
pg estradiolu/ml; < 0,26 ng testosterónu/ml), čo sa stanovilo validovanými testami založenými na hmotnostnej spektrometrii – pre skúmané vzorky aj pre referenčné hodnoty.
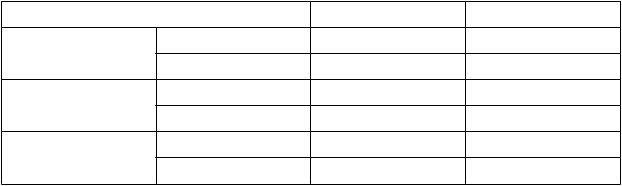
T
abuľka 3: C
m
a
x
a AUC
0
-
24
prasterónu, testosterónu a estradiolu na 7. deň po dennom
podávaní placeba alebo Intrarosy (priemer ±SD)
P
rasterón
T
estosterón
Placebo (n = 9) Intrarosa (n = 10)
Cmax (ng/ml) 1,60 (±0,95) 4,42 (±1,49) AUC0-24 (ng⋅h/ml) 24,82 (±14,31) 56,17 (±28,27) Cmax (ng/ml) 0,12 (±0,04)1 0,15 (±0,05)
1
AUC0-24 (ng⋅h/ml) 2,58 (±0,94)
2,79 (±0,94)
E
st
radiol
1 n = 8.
Cmax (pg/ml) 3,33 (±1,31) 5,04 (±2,68) AUC0-24 (pg⋅h/ml) 66,49 (±20,70) 96,93 (±52,06)
 A – prasterón B – testosterón C – estradiol (E
2
)
A – prasterón B – testosterón C – estradiol (E
2
)
Placebo

Intrarosa
Čas po podaní (v hodinách)Obrázok 1: Sérové koncentrácie prasterónu (A), testosterónu (B) a estradiolu (C) stanovenépočas 24 hodín na 7. deň po dennom podávaní placeba alebo Intrarosy(priemer ±SD)DistribúciaDistribúcia intravaginálneho (exogénneho) prasterónu je hlavne lokálna, ale pozoruje sa určitý nárast
systémovej expozície, najmä v prípade metabolitov, avšak v rozmedzí normálnych hodnôt.
BiotransformáciaExogénny prasterón sa metabolizuje rovnakým spôsobom ako endogénny prasterón. Systémový metabolizmus sa v súvislosti s týmto liekom neskúmal.
ElimináciaSystémová eliminácia sa v súvislosti s týmto liekom neskúmala.
5.3 Predklinické údaje o bezpečnostiPrasterón nevykazoval mutagénne ani klastogénne účinky v štandardnej sérii štúdií
in vitro a
in vivo.
Neuskutočnili sa štúdie karcinogenity, reprodukčnej a vývinovej toxicity.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Tuhý tuk (adeps solidus)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie Uchovávajte pri teplote neprevyšujúcej 30 °C. Nezmrazujte.
6.5 Druh obalu a obsah balenia
Blister pozostávajúci z vonkajšej PVC-vrstvy a vnútornej LDPE-vrstvy. Aplikátor vyrobený z LDPE a 1 % farbiva (oxid titaničitý).
28 vaginálnych čapíkov v škatuli so 6 aplikátormi.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Endoceutics Ltd.
Salisbury house, London Wall
EC2M 5PS Londýn
Spojené kráľovstvo
8. REGISTRAČNÉ ČÍSLO
EU/1/17/1255/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: {DD. mesiac RRRR}
10. DÁTUM REVÍZIE TEXTU
{MM/RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.