
a, gravidita a laktácia
Ženy vo fertilnom veku/ženská antikoncepcia
IKERVIS sa neodporúča používať u žien vo fertilnom veku nepoužívajúcich účinnú antikoncepciu.
Gravidita
Nie sú k dispozícii údaje o použití IKERVISU u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu po systémovom podaní cyklosporínu pri expozíciách považovaných za dostatočne vyššie, ako je maximálna expozícia u ľudí, čo poukazuje na malý význam týchto zistení pre klinické použitie IKERVISU.
IKERVIS sa neodporúča užívať počas gravidity, pokiaľ potenciálny prínos pre matku neprevyšuje potenciálne riziko pre plod.
Dojčenie
Cyklosporín sa po perorálnom podaní vylučuje do ľudského materského mlieka. Nie sú dostatočné
informácie o účinkoch cyklosporínu u novorodencov/dojčiat. Pri terapeutických dávkach cyklosporínu v očných kvapkách je však nepravdepodobné, že by sa do ľudského materského mlieka dostalo významné množstvo. Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu IKERVISOM sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú k dispozícii údaje o vplyve IKERVISU na fertilitu u človeka.
U zvierat, ktoré dostávali intravenózne cyklosporín, nebolo hlásené zhoršenie fertility (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
IKERVIS má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
Tento liek môže vyvolať dočasne rozmazané videnie alebo iné poruchy videnia, ktoré môžu ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje (pozri časť 4.8). Pacientov je potrebné upozorniť, aby neviedli vozidlá ani neobsluhovali stroje, kým sa im videnie nevyjasní.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Najčastejšie nežiaduce reakcie sú bolesť oka (19,0 %), podráždenie oka (17,5 %), zvýšené slzenie
(4,9 %), očná hyperémia (5,5 %) a erytém očného viečka (1,7 %), ktoré sú zvyčajne prechodné
a vyskytli sa počas podávania kvapiek. Tieto nežiaduce reakcie sú konzistentné s tými, ktoré boli hlásené po uvedení na trh.
Tabuľkový zoznam nežiaducich reakcií
V klinických štúdiách alebo po uvedení na trh sa pozorovali nežiaduce reakcie uvedené ďalej. Sú
zoradené podľa triedy orgánových systémov a rozdelené podľa nasledujúceho pravidla: veľmi časté
(³1/10), časté (³1/100 až <1/10), menej časté (³1/1 000 až <1/100), zriedkavé (³1/10 000 až
<1/1 000), veľmi zriedkavé (<1/10 000) alebo neznáme (z dostupných údajov).
Trieda orgánových systémov
| Frekvencia
| Nežiaduce reakcie
|
Infekcie a nákazy
| Menej časté
| Bakteriálna keratitída, Očný pásový opar.
|
Poruchy oka
| Veľmi časté
| Bolesť oka, Podráždenie oka.
|
Časté
| Erytém očného viečka, Zvýšené slzenie,
Očná hyperémia, Rozmazané videnie, Edém očného viečka, Hyperémia spojovky, Svrbenie oka.
|
Menej časté
| Edém spojovky, Porucha slzenia,
Výtok z oka, Podráždenie spojovky, Konjunktivitída,
Pocit cudzieho telesa v oku, Usadenina v oku,
Keratitída, Blefaritída, Chalazión,
Infiltráty v rohovke, Jazva na rohovke, Svrbenie očného viečka, Iridocyklitída, Nepríjemný pocit v oku.
|
Celkové poruchy a reakcie v mieste podania
| Menej časté
| Reakcia v mieste podania kvapiek
|
Poruchy nervového systému
| Menej časté
| Bolesť hlavy
|
OpisvybranýchnežiaducichreakciíBolesťokaČasto hlásená lokálna nežiaduca reakcia spojená s používaním IKERVISUpočas klinických skúšaní. Pravdepodobne je spôsobuje cyklosporín.
CelkovéalokálneinfekcieU pacientov užívajúcich imunosupresívne lieky vrátane cyklosporínu existuje zvýšené riziko infekcií. Môžu sa vyskytnúť celkové i lokálne infekcie. Môže dôjsť aj k zhoršeniu existujúcich infekcií (pozri časť 4.3). Menej často boli hlásené prípady infekcií v súvislosti s použitím IKERVISU.
Ako preventívne opatrenie treba urobiť krokyna zníženie systémovej absorpcie (pozri časť 4.2).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 Predávkovanie
Lokálne predávkovanie po podaní do oka nie je pravdepodobné. Ak dôjde k predávkovaniu
IKERVISOM, liečba má byť symptomatická a podporná.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: oftalmologiká, iné oftalmologiká, ATC kód: S01XA18. Mechanizmusúčinkuafarmakodynamickéúčinky
Cyklosporín (známy aj ako cyklosporín A) je cyklický polypeptidový imunomodulátor
s imunosupresívnymi vlastnosťami. Preukázalo sa, že predlžuje prežitie alogénnych transplantátov u zvierat a významne zvyšuje prežitie štepu pri všetkých druhoch transplantácie pevných orgánov
u človeka.
Takisto sa preukázalo, že cyklosporín má protizápalový účinok. Štúdie na zvieratách nasvedčujú tomu, že cyklosporín inhibuje rozvoj reakcií sprostredkovaných bunkami. Preukázalo sa, že cyklosporín inhibuje tvorbu a/alebo uvoľňovanie prozápalových cytokínov vrátane interleukínu 2 (IL-2) alebo rastového faktora T-buniek (TCGF). Je o ňom tiež známe, že zvyšuje uvoľňovanie protizápalových cytokínov. Zdá sa, že cyklosporín blokuje kľudové lymfocyty vo fáze G0 alebo G1 bunkového cyklu.
Všetky dostupné dôkazy nasvedčujú tomu, že cyklosporín pôsobí špecificky a reverzibilne na
lymfocyty a nepotláča krvotvorbu ani nemá žiadny vplyv na funkciu fagocytárnych buniek.
U pacientov so syndrómom suchého oka, čo je stav, ktorý možno považovať za zdroj zápalového imunitného mechanizmu, sa cyklosporín po podaní do oka pasívne absorbuje do T-lymfocytových infiltrátov v rohovke a spojovke a inaktivuje kalcineurínovú fosfatázu. Inaktivácia kalcineurínu vyvolaná cyklosporínom inhibuje defosforyláciu transkripčného faktora NF-AT a zabraňuje translokácii faktora NF-AT do jadra, čím blokuje uvoľňovanie prozápalových cytokínov, ako sú IL-2.
Klinická účinnosť a bezpečnosť
Účinnosť a bezpečnosť IKERVISU sa hodnotili v dvoch randomizovaných dvojito zaslepených
klinických štúdiách kontrolovaných vehikulom u dospelých pacientov so syndrómom suchého oka (suchou keratokonjunktivitídou), ktorí splnili kritériá Medzinárodného seminára o syndróme suchého oka (DEWS, International Dry Eye Workshop criteria).
V 12-mesačnom dvojito zaslepenomhlavnom klinickom skúšaní kontrolovanom vehikulom (štúdia SANSIKA) bolo 246pacientov so syndrómom suchého oka a závažnou keratitídou (definovanou ako skóre zafarbenia rohovky fluoresceínom (CFS, corneal fluorescein staining) 4 na upravenej oxfordskej stupnici) randomizovaných do skupín s jednou kvapkou IKERVISU alebo vehikula raz denne pred spaním počas 6 mesiacov. Pacienti randomizovaní do skupiny s vehikulom prešli po 6 mesiacoch na IKERVIS. Primárnym sledovaným parametrom bol podiel pacientov, ktorí do 6 mesiaca dosiahli zlepšenie keratitídy (CFS) aspoň o dva stupne a zlepšenie príznakov meraných ako index ochorenia povrchu oka (OSDI, Ocular Surface Disease Index) o 30 %. Podiel pacientov reagujúcich na liečbu
v skupine s IKERVISOM bol 28,6 %, v skupine s vehikulom 23,1 %. Rozdiel nebol štatisticky významný (p = 0,326).
Závažnosť keratitídy posudzovaná pomocou CFS sa v 6. mesiaci výrazne znížila oproti východiskovému stavu v skupine s IKERVISOM v porovnaní s vehikulom (priemerná zmena oproti východiskovému stavu bola –1,764 v prípade IKERVISU a –1,418 v prípade vehikula, p = 0,037). Podiel pacientov liečených IKERVISOM, ktorí po 6 mesiacoch dosiahli zlepšenie v skóre CFS o 3 stupne (zo 4 na 1), bol 28,8 % v porovnaní s 9,6 % pacientov liečených vehikulom, išlo však o analýzu post hoc, čím sa znižuje spoľahlivosť tohto výsledku. Priaznivý vplyv na keratitídu sa zachoval
v otvorenej fáze štúdie od 6. mesiaca až do 12. mesiaca.
Priemerná zmena v 100-bodovom skóre OSDI po 6 mesiacoch oproti východiskovému stavu bola –
13,6 v prípade IKERVISU a –14,1 v prípade vehikula (p = 0,858). Okrem toho sa po 6 mesiacoch nepozorovalo žiadne zlepšenie pri podávaní IKERVISU v porovnaní s vehikulom ani pri ostatných sekundárnych sledovaných parametroch, medzi ktoré patrili skóre nepohodlia oka, Schirmerov test, súbežné použitie umelých sĺz, celkové hodnotenie účinnosti skúšajúcim, čas roztrhnutia slzného filmu, farbenie lisamínovou zeleňou, skóre kvality života a osmolarita slzného filmu.
V 6. mesiaci sa dosiahlo zníženie povrchového zápalu oka posudzovaného pomocou expresie ľudského leukocytového antigénu-DR (HLA-DR) (informačný sledovaný parameter) v prospech
IKERVISU (p = 0,021).
V 6-mesačnom dvojito zaslepenompodpornom klinickom skúšaní kontrolovanom vehikulom (štúdia SICCANOVE) bolo 492 pacientov so syndrómom suchého oka a stredne závažnou až závažnou keratitídou (definovanou ako skóre CFS 2 až 4) takisto randomizovaných do skupín s IKERVISOM alebo vehikulom podávaným raz denne pred spaním počas 6 mesiacov. Spoločnými primárnymi sledovanými parametrami boli zmena v skóre CFS a zmena v celkovom skóre nepohodlia oka bez ohľadu na kvapky skúmaného lieku, oba merané v 6 mesiaci. V 6. mesiaci sa pozoroval malý, ale štatisticky významný rozdiel v zlepšení CFS medzi liečebnými skupinami v prospech IKERVISU (priemerná zmena v CFS oproti východiskovému stavu bola –1,05 v prípade IKERVISU a –0,82
v prípade vehikula, p = 0,009).
Priemerná zmena v skóre nepohodlia oka (hodnotenom pomocou vizuálnej analógovej stupnice) oproti východiskovému stavu bola –12,82 v prípade IKERVISU a –11,21 v prípade vehikula (p = 0,808).
Ani v jednej štúdii sa nepozorovalo výrazné zlepšenie príznakov pri použití IKERVISU v porovnaní s vehikulom po 6 mesiacoch liečbys použitím vizuálnej analógovej stupnice aleboOSDI.
V oboch štúdiách priemerne jedna tretina pacientov mala Sjögrenov syndróm. Pokiaľ ide o celkovú populáciu, pozorovalo sa štatisticky významné zlepšenie CFS v prospech IKERVISU v tejto podskupine pacientov.
Pri dokončení štúdie SANSIKA (12-mesačná štúdia) boli pacienti požiadaní, aby sa zúčastnili na následnej štúdii SANSIKA. Táto štúdia bola otvorené, nerandomizované, 24-mesačné rozšírenie štúdie Sansika vykonané na jednej skupine. V rámci následnej štúdie SANSIKA pacienti alternatívne dostávali alebo nedostávali liečbu IKERVISOM v závislosti od skóre CFS (pacientom bol podávaný IKERVIS, keď sa keratitída zhoršila).
Táto štúdia bola navrhnutá na monitorovanie dlhodobej účinnosti a miery recidívy u pacientov, ktorým bol predtým podávaný IKERVIS.
Primárnym cieľom štúdie bolo posúdiť trvanie zlepšenia po prerušení liečby IKERVISOM, akonáhle sa stav pacienta zlepšil z hľadiska východiskového stavu v rámci štúdie SANSIKA (t. j. zlepšenie minimálne o 2 stupne na upravenej oxfordskej stupnici).
Do štúdie sa zaregistrovalo 67 pacientov (37,9% zo 177 pacientov, ktorí ukončili štúdiu Sansika).
Po období 24 mesiacov 61,3 % zo 62 pacientov zaradených do populácie primárnej účinnosti nezaznamenalo recidívu na základe skóre CFS. Percentuálny podiel pacientov, ktorí zaznamenali závažnú recidívu keratitídy, bol 35 % u pacientov liečených IKERVISOM v rámci štúdie SANSIKA po dobu 12 mesiacov a 48 % u pacientov liečených IKERVISOM v rámci štúdie SANSIKA po dobu
6 mesiacov.
Na základe prvého kvartilu (nebolo možné vykonať odhad strednej hodnoty kvôli malému počtu recidív) bol čas do nástupu recidívy (návrat na stupeň 4 CFS) ≤224 dní u pacientov predtým liečených IKERVISOM 12 mesiacov a ≤175 dní u pacientov predtým liečených IKERVISOM 6 mesiacov. Pacienti strávili viac času na stupni 2 CFS (stredná hodnota 12,7 týždňa/rok) a na stupni 1 (stredná hodnota 6,6 týždňa/rok), po ktorých nasledoval stupeň 3 CFS (stredná hodnota 2,4 týždňa/rok)
a stupne 4 a 5 CFS (stredný čas 0 týždňov/rok).
Hodnotenie príznakov DED pomocou VAS ukázalo zhoršenie nepohodlia pacienta od času, kedy bola liečba prvýkrát prerušená, do času, kedy bola opäť začatá, s výnimkou bolesti, ktorá zostala relatívne nízka a stabilná. Stredné celkové skóre VAS sa zvýšilo od času, kedy bola liečba prvýkrát prerušená (23,3 %), do času, kedy bola opäť začatá (45,1 %).
V priebehu rozšírenej štúdie neboli u ostatných sekundárnych sledovaných parametrov (TBUT, farbenie lisamínovou zeleňou a Schirmerov test, NIE-VFQ a EQ-5D) pozorované žiadne významné zmeny.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s IKERVISOM vo
všetkých podskupinách pediatrickej populácie so syndrómom suchého oka (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Neuskutočnili sa žiadne oficiálne farmakokinetické štúdie s IKERVISOM u ľudí.
Koncentrácia IKERVISU v krvi sa merala s použitím špecifickej analýzy pomocou vysokotlakovej tekutej chromatografie a hmotnostnej spektrometrie. U 374 pacientov z dvoch štúdií účinnosti sa koncentrácia cyklosporínu v plazme merala pred podaním a po 6 mesiacoch (štúdie SICCANOVE
a SANSIKA) a 12 mesiacoch liečby (štúdia SANSIKA). Po 6 mesiacoch od podávania očných kvapiek IKERVISU raz denne sa u 327 pacientov zistili hodnoty pod spodnou hranicou detekcie (0,050 ng/ml) a u 35 pacientov hodnoty pod spodnou hranicou kvantifikácie (0,100 ng/ml). Merateľné hodnoty neprekračujúce 0,206 ng/ml sa namerali u ôsmich pacientov, pričom tieto hodnoty sa považovali za zanedbateľné. Traja pacienti mali hodnoty nad horným limitom kvantifikácie (5 ng/ml),
títo pacienti však už užívali perorálny cyklosporín v stabilnej dávke, čo protokol štúdie umožňoval. Po
12 mesiacoch liečby boli hodnoty pod spodnou hranicou detekcie u 56 pacientov a pod spodnou hranicou kvantifikácie u 19 pacientov. Sedem pacientov malo merateľné hodnoty (od 0,105 do
1,27 ng/ml), pričom všetky sa považovali za zanedbateľné. Dvaja pacienti mali hodnoty nad horným limitom kvantifikácie, títo pacienti však už v čase zaradenia do štúdie užívali aj perorálny cyklosporín v stabilnej dávke.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, fototoxicity a fotoalergie, genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
Účinky v predklinických štúdiách sa pozorovali iba pri systémovom podaní a expozíciách považovaných za dostatočne vyššie, ako je maximálna expozícia u ľudí, čo poukazuje na malý význam týchto zistení pre klinické použitie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
triglyceridy so stredne dlhým reťazcom cetalkóniumchlorid
glycerol tyloxapol poloxamér 188
hydroxid sodný (na úpravu pH)
voda na injekciu
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Neuchovávajte v mrazničke. Uchovávajte pri teplote do 25° C.
Po otvorení hliníkových vreciek sa jednodávkové obaly majú uchovávať vo vreckách na ochranu pred svetlom a zabránenie odparovaniu. Otvorený jednotlivý jednodávkový obal so zvyšnou emulziou sa má ihneď po použití zlikvidovať.
6.5 Druh obalu a obsah baleniaIKERVIS sa dodáva v 0,3 ml jednodávkových obaloch z polyetylénu s nízkou hustotou (LDPE)
vložených do uzavretého laminátového hliníkového vrecka. Jedno vrecko obsahuje päť jednodávkových obalov.
Veľkosti balenia: 30 a 90 jednodávkových obalov. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIISANTEN Oy
Niittyhaankatu 20
33720 Tampere
Fínsko
8. REGISTRAČNÉ ČÍSLAEU/1/15/990/001
EU/1/15/990/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 19. marca 2015
Dátum posledného predĺženia registrácie: 09. marca 2020
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1
. NÁZOV LIEKU
IKERVIS 1 mg/ml očné emulzné kvapky
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Jeden ml emulzie obsahuje 1 mg cyklosporínu (ciclosporin). Pomocnálátkasoznámymúčinkom
Jeden ml emulzie obsahuje 0,05 mg cetalkóniumchloridu (pozri časť 4.4).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Očné emulzné kvapky. Mliečna biela emulzia.
4. KLINICKÉ ÚDAJE
4.1 Terapeutická indikácia
Liečba závažnej keratitídy u dospelých pacientov so syndrómom suchého oka, ktorých stav sa nezlepšil napriek liečbe náhradou sĺz (pozri časť 5.1).
4.2 Dávkovanie a spôsob podávania
Liečbu musí začať oftalmológ alebo zdravotnícky pracovník kvalifikovaný v oblasti oftalmológie. Dávkovanie
Odporúčaná dávka je jedna kvapka raz denne pred spaním do postihnutého oka (očí).
Reakcia na liečbu sa má opakovane vyhodnocovať aspoň každých 6 mesiacov.
V prípade vynechania dávky má liečba normálne pokračovať nasledujúci deň. Pacientov je potrebné upozorniť, aby si do postihnutého oka (očí) nekvapkali viac než jednu kvapku.
Špeciálne populácie
Starší pacienti
Populácia starších pacientov sa skúmala v klinických štúdiách. Nevyžaduje sa úprava dávkovania.
Pacienti s poruchou funkcie obličiek alebo pečene
Účinok cyklosporínu sa neskúmal u pacientov s poruchou funkcie pečene alebo obličiek. V týchto populáciách však nie sú potrebné žiadne osobitné opatrenia.
Pediatrická populácia
Použitie cyklosporínu sa netýka detí a dospievajúcich vo veku do 18 rokov v indikácii liečby závažnej keratitídy u pacientov so syndrómom suchého oka, ktorých stav sa nezlepšil napriek liečbe náhradou sĺz.
Spôsob podávania
Podanie do oka.
Opatrenia pred podaním lieku
Pacienti majú byť poučení, aby si najprv umyli ruky. Pred podaním sa má obsah fľaše opatrne pretrepať.
Pacienti majú byť poučení, aby použili nazolakrimálnu oklúziu a aby nechali zatvorené očné viečka počas 2 minút po podaní kvapiek na zníženie systémovej absorpcie. To môže viesť k zníženiu systémových nežiaducich účinkov a zvýšeniu lokálneho pôsobenia.
Ak sa používa viac lokálnych oftalmologických liekov, musia sa podávať s odstupom aspoň 15 minút. IKERVIS sa má podať ako posledný (pozri časť 4.4).
Pacienti majú byť oboznámení so správnym zaobchádzaním s viacdávkovým obalom. Pokyny na použitie, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Očné alebo periokulárne malignity alebo premalígne stavy.
Aktívna očná alebo periokulárna infekcia alebo podozrenie na ňu.
4.4 Osobitné upozornenia a opatrenia pri používaní
IKERVIS sa neskúmal u pacientov s očným herpesom v anamnéze, preto sa má u týchto pacientov používať so zvýšenou opatrnosťou.
Kontaktnéšošovky
Pacienti používajúci kontaktné šošovky sa neskúmali. Odporúča sa dôsledné monitorovanie pacientov so závažnou keratitídou. Pred podaním očných kvapiek pred spaním sa majú kontaktné šošovky vybrať. Znova ich možno nasadiť po prebudení.
Súčasnáliečba
Skúsenosti s používaním cyklosporínu na liečbu pacientov s glaukómom sú obmedzené. Pri súčasnej liečbe týchto pacientov IKERVISOM, najmä v prípade liečby betablokátormi, o ktorých je známe, že znižujú sekréciu sĺz, sa má vykonávať pravidelné klinické monitorovanie.
Účinkynaimunitnýsystém
Oftalmologické lieky, ktoré ovplyvňujú imunitný systém, vrátane cyklosporínu, môžu ovplyvniť obranné mechanizmy hostiteľa voči lokálnym infekciám a malignitám. Preto keď sa IKERVIS používa veľa rokov, odporúča sa pravidelné vyšetrenie oka (očí), napr. aspoň raz za 6 mesiacov.
Obsahcetalkóniumchloridu
IKERVIS obsahuje cetalkóniumchlorid. Kontaktné šošovky sa majú pred podaním lieku vybrať
a znova ich možno nasadiť po prebudení.Cetalkóniumchlorid môže spôsobiť podráždenie oka. V
prípade dlhodobého používania musia byť pacienti monitorovaní.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s IKERVISOM.Kombináciasinýmiliekmi,ktoréovplyvňujúimunitnýsystém
Súčasné podávanie IKERVISU s očnými kvapkami s obsahom kortikosteroidov by mohlo posilniť účinky cyklosporínu na imunitný systém (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Ženy vo fertilnom veku/ženská antikoncepcia
IKERVIS sa neodporúča používať u žien vo fertilnom veku nepoužívajúcich účinnú antikoncepciu.
Gravidita
Nie sú k dispozícii údaje o použití IKERVISU u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu po systémovom podaní cyklosporínu pri expozíciách považovaných za dostatočne vyššie, ako je maximálna expozícia u ľudí, čo poukazuje na malý význam týchto zistení pre klinické použitie IKERVISU.
IKERVIS sa neodporúča užívať počas gravidity, pokiaľ potenciálny prínos pre matku neprevyšuje potenciálne riziko pre plod.
Dojčenie
Cyklosporín sa po perorálnom podaní vylučuje do ľudského materského mlieka. Nie sú dostatočné
informácie o účinkoch cyklosporínu u novorodencov/dojčiat. Pri terapeutických dávkach cyklosporínu v očných kvapkách je však nepravdepodobné, že by sa do ľudského materského mlieka dostalo významné množstvo. Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu IKERVISOM sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú k dispozícii údaje o vplyve IKERVISU na fertilitu u človeka.
U zvierat, ktoré dostávali intravenózne cyklosporín, nebolo hlásené zhoršenie fertility (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
IKERVIS má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
Tento liek môže vyvolať dočasne rozmazané videnie alebo iné poruchy videnia, ktoré môžu ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje (pozri časť 4.8). Pacientov je potrebné upozorniť, aby neviedli vozidlá ani neobsluhovali stroje, kým sa im videnie nevyjasní.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Najčastejšie nežiaduce reakcie sú bolesť oka (19,0 %), podráždenie oka (17,5 %), zvýšené slzenie
(4,9 %), očná hyperémia (5,5 %) a erytém očného viečka (1,7 %), ktoré sú zvyčajne prechodné
a vyskytli sa počas podávania kvapiek. Tieto nežiaduce reakcie sú konzistentné s tými, ktoré boli hlásené po uvedení na trh.
Tabuľkový zoznam nežiaducich reakcií
V klinických štúdiách alebo po uvedení na trh sa pozorovali nežiaduce reakcie uvedené ďalej. Sú
zoradené podľa triedy orgánových systémov a rozdelené podľa nasledujúceho pravidla: veľmi časté
(³1/10), časté (³1/100 až <1/10), menej časté (³1/1 000 až <1/100), zriedkavé (³1/10 000 až
<1/1 000), veľmi zriedkavé (<1/10 000) alebo neznáme (z dostupných údajov).
Trieda orgánových systémov
|
Frekvencia
|
Nežiaduce reakcie
|
Infekcie a nákazy
|
Menej časté
|
Bakteriálna keratitída, Očný pásový opar.
|
Poruchy oka
|
Veľmi časté
|
Bolesť oka, Podráždenie oka.
|
Časté
|
Erytém očného viečka, Zvýšené slzenie,
Očná hyperémia, Rozmazané videnie,
Edém očného viečka, Hyperémia spojovky, Svrbenie oka.
|
Menej časté
|
Edém spojovky, Porucha slzenia, Výtok z oka,
Podráždenie spojovky, Konjunktivitída,
Pocit cudzieho telesa v oku, Usadenina v oku,
Keratitída, Blefaritída,
Chalazión,
Infiltráty v rohovke, Jazva na rohovke, Svrbenie očného viečka, Iridocyklitída, Nepríjemný pocit v oku.
|
Celkové poruchy a reakcie v mieste podania
|
Menej časté
|
Reakcia v mieste podania kvapiek
|
Poruchy nervového systému
|
Menej časté
|
Bolesť hlavy
|
Opis
vybraných
nežiaducich
reakcií
Bolesť
oka
Často hlásená lokálna nežiaduca reakcia spojená s používaním IKERVISUpočas klinických skúšaní. Pravdepodobne je spôsobuje cyklosporín.
CelkovéalokálneinfekcieU pacientov užívajúcich imunosupresívne lieky vrátane cyklosporínu existuje zvýšené riziko infekcií. Môžu sa vyskytnúť celkové i lokálne infekcie. Môže dôjsť aj k zhoršeniu existujúcich infekcií (pozri časť 4.3). Menej často boli hlásené prípady infekcií v súvislosti s použitím IKERVISU.
Ako preventívne opatrenie treba urobiť krokyna zníženie systémovej absorpcie (pozri časť 4.2).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 PredávkovanieLokálne predávkovanie po podaní do oka nie je pravdepodobné. Ak dôjde k predávkovaniu
IKERVISOM, liečba má byť symptomatická a podporná.
5
. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: oftalmologiká, iné oftalmologiká, ATC kód: S01XA18. Mechanizmusúčinkuafarmakodynamickéúčinky
Cyklosporín (známy aj ako cyklosporín A) je cyklický polypeptidový imunomodulátor
s imunosupresívnymi vlastnosťami. Preukázalo sa, že predlžuje prežitie alogénnych transplantátov u zvierat a významne zvyšuje prežitie štepu pri všetkých druhoch transplantácie pevných orgánov'
u človeka.
Takisto sa preukázalo, že cyklosporín má protizápalový účinok. Štúdie na zvieratách nasvedčujú tomu, že cyklosporín inhibuje rozvoj reakcií sprostredkovaných bunkami. Preukázalo sa, že cyklosporín inhibuje tvorbu a/alebo uvoľňovanie prozápalových cytokínov vrátane interleukínu 2 (IL-2) alebo rastového faktora T-buniek (TCGF). Je o ňom tiež známe, že zvyšuje uvoľňovanie protizápalových cytokínov. Zdá sa, že cyklosporín blokuje kľudové lymfocyty vo fáze G0 alebo G1 bunkového cyklu. Všetky dostupné dôkazy nasvedčujú tomu, že cyklosporín pôsobí špecificky a reverzibilne na lymfocyty a nepotláča krvotvorbu ani nemá žiadny vplyv na funkciu fagocytárnych buniek.
U pacientov so syndrómom suchého oka, čo je stav, ktorý možno považovať za zdroj zápalového imunitného mechanizmu, sa cyklosporín po podaní do oka pasívne absorbuje do T-lymfocytových infiltrátov v rohovke a spojovke a inaktivuje kalcineurínovú fosfatázu. Inaktivácia kalcineurínu vyvolaná cyklosporínom inhibuje defosforyláciu transkripčného faktora NF-AT a zabraňuje translokácii faktora NF-AT do jadra, čím blokuje uvoľňovanie prozápalových cytokínov, ako sú IL-2.
Klinická účinnosť a bezpečnosť
Účinnosť a bezpečnosť IKERVISU sa hodnotili v dvoch randomizovaných dvojito zaslepených
klinických štúdiách kontrolovaných vehikulom u dospelých pacientov so syndrómom suchého oka (suchou keratokonjunktivitídou), ktorí splnili kritériá Medzinárodného seminára o syndróme suchého oka (DEWS, International Dry Eye Workshop criteria).
V 12-mesačnom dvojito zaslepenomhlavnom klinickom skúšaní kontrolovanom vehikulom (štúdia SANSIKA) bolo 246pacientov so syndrómom suchého oka a závažnou keratitídou (definovanou ako skóre zafarbenia rohovky fluoresceínom (CFS, corneal fluorescein staining) 4 na upravenej oxfordskej stupnici) randomizovaných do skupín s jednou kvapkou IKERVISU alebo vehikula raz denne pred spaním počas 6 mesiacov. Pacienti randomizovaní do skupiny s vehikulom prešli po 6 mesiacoch na IKERVIS. Primárnym sledovaným parametrom bol podiel pacientov, ktorí do 6 mesiaca dosiahli zlepšenie keratitídy (CFS) aspoň o dva stupne a zlepšenie príznakov meraných ako index ochorenia povrchu oka (OSDI, Ocular Surface Disease Index) o 30 %. Podiel pacientov reagujúcich na liečbu
v skupine s IKERVISOM bol 28,6 %, v skupine s vehikulom 23,1 %. Rozdiel nebol štatisticky významný (p = 0,326).
Závažnosť keratitídy posudzovaná pomocou CFS sa v 6. mesiaci výrazne znížila oproti východiskovému stavu v skupine s IKERVISOM v porovnaní s vehikulom (priemerná zmena oproti východiskovému stavu bola –1,764 v prípade IKERVISU a –1,418 v prípade vehikula, p = 0,037). Podiel pacientov liečených IKERVISOM, ktorí po 6 mesiacoch dosiahli zlepšenie v skóre CFS o 3 stupne (zo 4 na 1), bol 28,8 % v porovnaní s 9,6 % pacientov liečených vehikulom, išlo však o analýzu post hoc, čím sa znižuje spoľahlivosť tohto výsledku. Priaznivý vplyv na keratitídu sa zachoval
v otvorenej fáze štúdie od 6. mesiaca až do 12. mesiaca.
Priemerná zmena v 100-bodovom skóre OSDI po 6 mesiacoch oproti východiskovému stavu bola –
13,6 v prípade IKERVISU a –14,1 v prípade vehikula (p = 0,858). Okrem toho sa po 6 mesiacoch nepozorovalo žiadne zlepšenie pri podávaní IKERVISU v porovnaní s vehikulom ani pri ostatných sekundárnych sledovaných parametroch, medzi ktoré patrili skóre nepohodlia oka, Schirmerov test,
súbežné použitie umelých sĺz, celkové hodnotenie účinnosti skúšajúcim, čas roztrhnutia slzného filmu, farbenie lisamínovou zeleňou, skóre kvality života a osmolarita slzného filmu.
V 6. mesiaci sa dosiahlo zníženie povrchového zápalu oka posudzovaného pomocou expresie ľudského leukocytového antigénu-DR (HLA-DR) (informačný sledovaný parameter) v prospech IKERVISU (p = 0,021).
V 6-mesačnom dvojito zaslepenompodpornom klinickom skúšaní kontrolovanom vehikulom (štúdia SICCANOVE) bolo 492 pacientov so syndrómom suchého oka a stredne závažnou až závažnou keratitídou (definovanou ako skóre CFS 2 až 4) takisto randomizovaných do skupín s IKERVISOM alebo vehikulom podávaným raz denne pred spaním počas 6 mesiacov. Spoločnými primárnymi sledovanými parametrami boli zmena v skóre CFS a zmena v celkovom skóre nepohodlia oka bez ohľadu na kvapky skúmaného lieku, oba merané v 6 mesiaci. V 6. mesiaci sa pozoroval malý, ale štatisticky významný rozdiel v zlepšení CFS medzi liečebnými skupinami v prospech IKERVISU (priemerná zmena v CFS oproti východiskovému stavu bola –1,05 v prípade IKERVISU a –0,82
v prípade vehikula, p = 0,009).
Priemerná zmena v skóre nepohodlia oka (hodnotenom pomocou vizuálnej analógovej stupnice) oproti východiskovému stavu bola –12,82 v prípade IKERVISU a –11,21 v prípade vehikula (p = 0,808).
Ani v jednej štúdii sa nepozorovalo výrazné zlepšenie príznakov pri použití IKERVISU v porovnaní s vehikulom po 6 mesiacoch liečbys použitím vizuálnej analógovej stupnice aleboOSDI.
V oboch štúdiách priemerne jedna tretina pacientov mala Sjögrenov syndróm. Pokiaľ ide o celkovú populáciu, pozorovalo sa štatisticky významné zlepšenie CFS v prospech IKERVISU v tejto podskupine pacientov.
Pri dokončení štúdie SANSIKA (12-mesačná štúdia) boli pacienti požiadaní, aby sa zúčastnili na následnej štúdii SANSIKA. Táto štúdia bola otvorené, nerandomizované, 24-mesačné rozšírenie štúdie Sansika vykonané na jednej skupine. V rámci následnej štúdie SANSIKA pacienti alternatívne dostávali alebo nedostávali liečbu IKERVISOM v závislosti od skóre CFS (pacientom bol podávaný IKERVIS, keď sa keratitída zhoršila).
Táto štúdia bola navrhnutá na monitorovanie dlhodobej účinnosti a miery recidívy u pacientov, ktorým bol predtým podávaný IKERVIS.
Primárnym cieľom štúdie bolo posúdiť trvanie zlepšenia po prerušení liečby IKERVISOM, akonáhle sa stav pacienta zlepšil z hľadiska východiskového stavu v rámci štúdie SANSIKA (t. j. zlepšenie minimálne o 2 stupne na upravenej oxfordskej stupnici).
Do štúdie sa zaregistrovalo 67 pacientov (37,9% zo 177 pacientov, ktorí ukončili štúdiu Sansika). Po období 24 mesiacov 61,3 % zo 62 pacientov zaradených do populácie primárnej účinnosti nezaznamenalo recidívu na základe skóre CFS. Percentuálny podiel pacientov, ktorí zaznamenali závažnú recidívu keratitídy, bol 35 % u pacientov liečených IKERVISOM v rámci štúdie SANSIKA po dobu 12 mesiacov a 48 % u pacientov liečených IKERVISOM v rámci štúdie SANSIKA po dobu
6 mesiacov.
Na základe prvého kvartilu (nebolo možné vykonať odhad strednej hodnoty kvôli malému počtu recidív) bol čas do nástupu recidívy (návrat na stupeň 4 CFS) ≤224 dní u pacientov predtým liečených IKERVISOM 12 mesiacov a ≤175 dní u pacientov predtým liečených IKERVISOM 6 mesiacov. Pacienti strávili viac času na stupni 2 CFS (stredná hodnota 12,7 týždňa/rok) a na stupni 1 (stredná hodnota 6,6 týždňa/rok), po ktorých nasledoval stupeň 3 CFS (stredná hodnota 2,4 týždňa/rok)
a stupne 4 a 5 CFS (stredný čas 0 týždňov/rok).
Hodnotenie príznakov DED pomocou VAS ukázalo zhoršenie nepohodlia pacienta od času, kedy bola liečba prvýkrát prerušená, do času, kedy bola opäť začatá, s výnimkou bolesti, ktorá zostala relatívne nízka a stabilná. Stredné celkové skóre VAS sa zvýšilo od času, kedy bola liečba prvýkrát prerušená (23,3 %), do času, kedy bola opäť začatá (45,1 %).
V priebehu rozšírenej štúdie neboli u ostatných sekundárnych sledovaných parametrov (TBUT, farbenie lisamínovou zeleňou a Schirmerov test, NIE-VFQ a EQ-5D) pozorované žiadne významné zmeny.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s IKERVISOM vo
všetkých podskupinách pediatrickej populácie so syndrómom suchého oka (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Neuskutočnili sa žiadne oficiálne farmakokinetické štúdie s IKERVISOM u ľudí.
Koncentrácia IKERVISU v krvi sa merala s použitím špecifickej analýzy pomocou vysokotlakovej tekutej chromatografie a hmotnostnej spektrometrie. U 374 pacientov z dvoch štúdií účinnosti sa koncentrácia cyklosporínu v plazme merala pred podaním a po 6 mesiacoch (štúdie SICCANOVE
a SANSIKA) a 12 mesiacoch liečby (štúdia SANSIKA). Po 6 mesiacoch od podávania očných kvapiek IKERVISU raz denne sa u 327 pacientov zistili hodnoty pod spodnou hranicou detekcie (0,050 ng/ml) a u 35 pacientov hodnoty pod spodnou hranicou kvantifikácie (0,100 ng/ml). Merateľné hodnoty neprekračujúce 0,206 ng/ml sa namerali u ôsmich pacientov, pričom tieto hodnoty sa považovali za zanedbateľné. Traja pacienti mali hodnoty nad horným limitom kvantifikácie (5 ng/ml),
títo pacienti však už užívali perorálny cyklosporín v stabilnej dávke, čo protokol štúdie umožňoval. Po
12 mesiacoch liečby boli hodnoty pod spodnou hranicou detekcie u 56 pacientov a pod spodnou hranicou kvantifikácie u 19 pacientov. Sedem pacientov malo merateľné hodnoty (od 0,105 do
1,27 ng/ml), pričom všetky sa považovali za zanedbateľné. Dvaja pacienti mali hodnoty nad horným limitom kvantifikácie, títo pacienti však už v čase zaradenia do štúdie užívali aj perorálny cyklosporín v stabilnej dávke.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, fototoxicity a fotoalergie, genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
Účinky v predklinických štúdiách sa pozorovali iba pri systémovom podaní a expozíciách považovaných za dostatočne vyššie, ako je maximálna expozícia u ľudí, čo poukazuje na malý význam týchto zistení pre klinické použitie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
triglyceridy so stredne dlhým reťazcom cetalkóniumchlorid
glycerol tyloxapol poloxamér 188
hydroxid sodný (na úpravu pH)
voda na injekciu
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky.
Po prvom otvorení fľaše je čas použiteľnosti otvorenej fľaše 3 mesiace. Uchovávajte pri teplote neprevyšujúcej 25 °C.
6.4 Špeciálne upozornenia na uchovávanie
Neuchovávajte v mrazničke. Uchovávajte pri teplote do 25 °C.
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
IKERVIS sa dodáva sterilný v bielej fľaši z polyetylénu s nízkou hustotou s bielym kvapkadlom a bezpečnostným uzáverom.
Dodáva sa v týchto veľkostiach balenia: Škatuľa obsahujúca jednu 5 ml fľašu s obsahom 2,5 ml , škatuľa obsahujúca jednu 11 ml fľašu s náplňou 4,5 ml a škatuľa obsahujúca jednu 11 ml fľašu s náplňou 7 ml .
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Pokyny na použitie
Pred podaním očných kvapiek:
· Umyte si ruky a potom otvorte fľašu.
· Neužívajte tento liek, ak spozorujete, že poistné zapečatenie na hrdle fľaše je porušené pred prvým použitím.
· Pri prvom použití fľaše si pred podaním kvapky do oka nacvičte používanie fľaše pomalým stláčaním a podaním jednej kvapky mimo oka.
· Keď si už budete istý/á, že budete vedieť podávať po jednej kvapke, vyberte si pre vás
najvhodnejšiu polohu na podávanie kvapiek (môžete sedieť, ležať na chrbte alebo stáť pred zrkadlom).
· Po každom otvorením novej fľaše aktivujte fľašu kvapnutím jednej kvapky do odpadu.
Podanie:
1. Obsah fľaše opatrne pretrepte. Držte fľašu tesne pod vrchnákom a otvorte fľašu otočením vrchnáka. Aby nedošlo ku kontaminácii emulzie, špičkou fľaše sa ničoho nedotýkajte.

2. Zakloňte hlavu a držte fľašu nad okom.
3. Potiahnite si spodné očné viečko nadol a pozerajte sa nahor. Fľašu jemne stlačte v strede a počkajte, kým vám kvapne do oka kvapka. Upozorňujeme, že kvapka môže kvapnúť až niekoľko sekúnd po stlačení. Nestláčajte príliš silno.
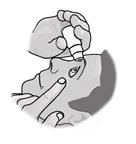
4. Zavrite oko a pritlačte prst do vnútorného očného kútika pri nose približne na dve minúty.
Zabránite tak tomu, aby sa liek dostal do ostatných častí tela.

5. Zopakujte 2. – 4. krok pokynov, aby ste si podali kvapku do druhého oka, ak vám to nariadil lekár. Niekedy je potrebné liečiť iba jedno oko a váš lekár vám povie, či to platí pre vás a ktoré oko potrebuje liečbu.
6. Po každom použití a pred opätovným nasadením vrchnáka sa má fľaša jedenkrát pretrepať smerom nadol bez toho, aby ste sa dotkli špičky kvapkadla, aby sa zo špičky odstránila zvyšková emulzia. Je to nevyhnutné na zabezpečenie podania ďalších kvapiek.
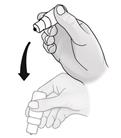
7. Utrite si prebytočnú emulziu na koži v okolí oka.
Na konci času použiteľnosti lieku môže vo fľaši zostať trochu emulzie. V žiadnom prípade nepoužívajte tento zvyšný liek, ktorý zostal vo fľaši po dokončení liečebného cyklu.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIISANTEN Oy
Niittyhaankatu 20
33720 Tampere
Fínsko
8. REGISTRAČNÉ ČÍSLAEU/1/15/990/003
EU/1/15/990/004
EU/1/15/990/005
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 19. marca 2015
Dátum posledného predĺženia registrácie: 09. marca 2020
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.